TWI832962B - 雜環化合物及其用途 - Google Patents
雜環化合物及其用途 Download PDFInfo
- Publication number
- TWI832962B TWI832962B TW109102825A TW109102825A TWI832962B TW I832962 B TWI832962 B TW I832962B TW 109102825 A TW109102825 A TW 109102825A TW 109102825 A TW109102825 A TW 109102825A TW I832962 B TWI832962 B TW I832962B
- Authority
- TW
- Taiwan
- Prior art keywords
- group
- methyl
- narcolepsy
- alkyl
- difluoro
- Prior art date
Links
- 150000002391 heterocyclic compounds Chemical class 0.000 title abstract description 5
- 150000001875 compounds Chemical class 0.000 claims abstract description 253
- 150000003839 salts Chemical class 0.000 claims abstract description 96
- 201000003631 narcolepsy Diseases 0.000 claims abstract description 60
- 108060005714 orexin Proteins 0.000 claims abstract description 40
- 102000002512 Orexin Human genes 0.000 claims abstract description 37
- 230000000694 effects Effects 0.000 claims abstract description 20
- 229940044601 receptor agonist Drugs 0.000 claims abstract description 17
- 239000000018 receptor agonist Substances 0.000 claims abstract description 17
- 238000011282 treatment Methods 0.000 claims abstract description 12
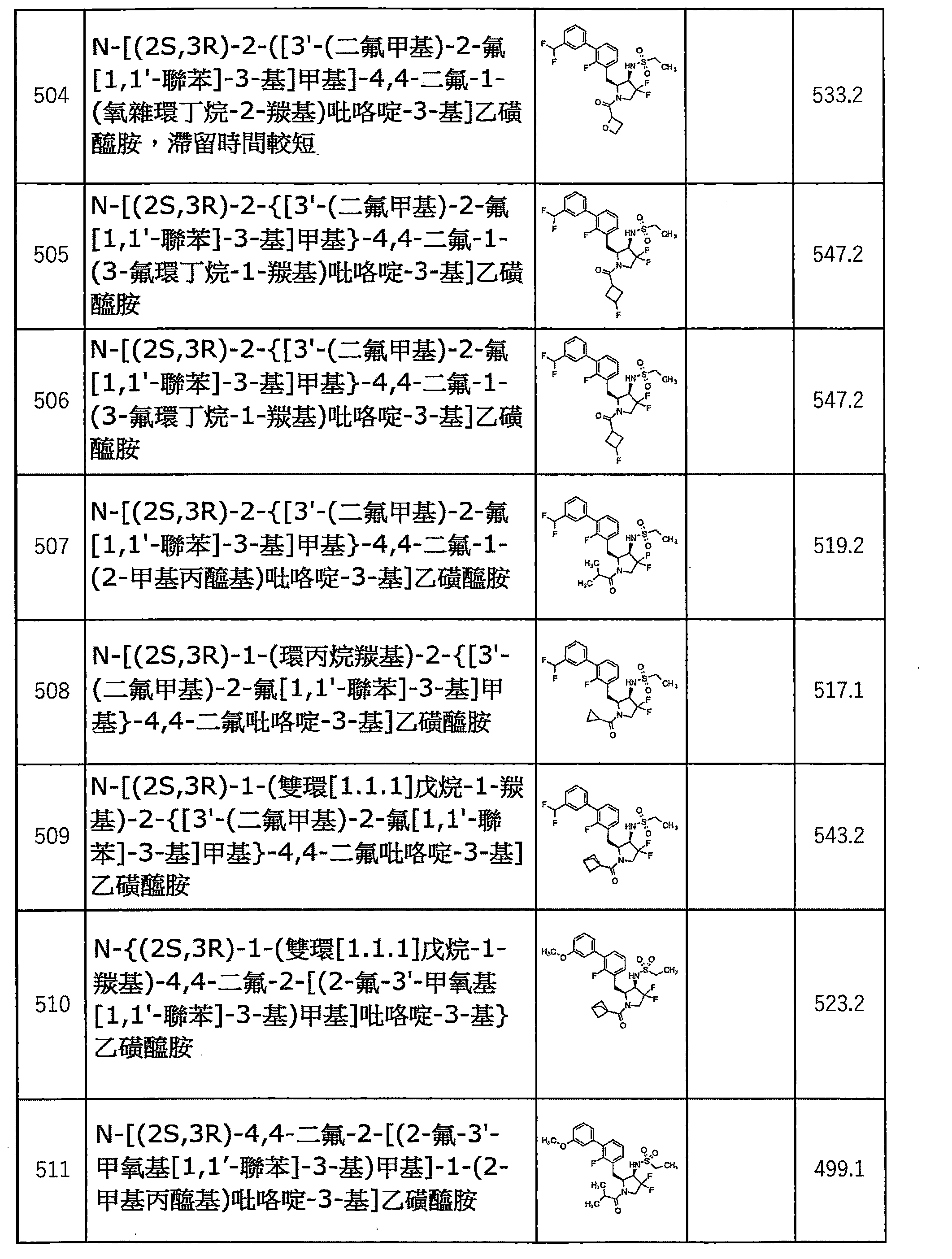
- -1 N'-{(2S,3R,4S)-1-(azetidine-1-carbonyl)-4-fluoro-2-[(2-fluoro-3'- Methyl[1,1'-biphenyl]-3-yl)methyl]pyrrolidin-3-yl}-N,N-dimethylthiodiamine Chemical compound 0.000 claims description 368
- 125000001424 substituent group Chemical group 0.000 claims description 124
- 239000003814 drug Substances 0.000 claims description 95
- 125000005843 halogen group Chemical group 0.000 claims description 65
- 238000002360 preparation method Methods 0.000 claims description 58
- 125000006615 aromatic heterocyclic group Chemical group 0.000 claims description 52
- 125000000217 alkyl group Chemical group 0.000 claims description 50
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 49
- 125000001153 fluoro group Chemical group F* 0.000 claims description 44
- 125000003118 aryl group Chemical group 0.000 claims description 34
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 31
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims description 29
- 125000004916 (C1-C6) alkylcarbonyl group Chemical group 0.000 claims description 29
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 28
- 125000006254 cycloalkyl carbonyl group Chemical group 0.000 claims description 25
- 229910052731 fluorine Inorganic materials 0.000 claims description 25
- 125000006376 (C3-C10) cycloalkyl group Chemical group 0.000 claims description 24
- 208000008589 Obesity Diseases 0.000 claims description 23
- 201000010099 disease Diseases 0.000 claims description 22
- 235000020824 obesity Nutrition 0.000 claims description 22
- 208000011580 syndromic disease Diseases 0.000 claims description 20
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 claims description 19
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 19
- 125000004454 (C1-C6) alkoxycarbonyl group Chemical group 0.000 claims description 18
- 125000005915 C6-C14 aryl group Chemical group 0.000 claims description 17
- 125000002950 monocyclic group Chemical group 0.000 claims description 17
- 239000005557 antagonist Substances 0.000 claims description 13
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 claims description 12
- 208000024891 symptom Diseases 0.000 claims description 12
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 11
- 201000002859 sleep apnea Diseases 0.000 claims description 10
- 206010019280 Heart failures Diseases 0.000 claims description 8
- 206010041349 Somnolence Diseases 0.000 claims description 8
- 125000006517 heterocyclyl carbonyl group Chemical group 0.000 claims description 8
- 208000024827 Alzheimer disease Diseases 0.000 claims description 7
- 206010065687 Bone loss Diseases 0.000 claims description 7
- 206010040047 Sepsis Diseases 0.000 claims description 7
- 150000001555 benzenes Chemical group 0.000 claims description 7
- 238000004519 manufacturing process Methods 0.000 claims description 7
- 208000007590 Disorders of Excessive Somnolence Diseases 0.000 claims description 6
- 208000031773 Insulin resistance syndrome Diseases 0.000 claims description 6
- 230000003444 anaesthetic effect Effects 0.000 claims description 6
- 208000035475 disorder Diseases 0.000 claims description 5
- 229940088597 hormone Drugs 0.000 claims description 5
- 239000005556 hormone Substances 0.000 claims description 5
- 206010002091 Anaesthesia Diseases 0.000 claims description 4
- RQOYODSBHDGQAL-PZJWPPBQSA-N N-[(2S,3R)-4,4-difluoro-2-[[2-fluoro-3-(3-fluorophenyl)phenyl]methyl]-1-(2-methylpropanoyl)pyrrolidin-3-yl]ethanesulfonamide Chemical compound FC1=C(C=CC=C1C[C@@H]1N(CC([C@@H]1NS(=O)(=O)CC)(F)F)C(C(C)C)=O)C1=CC(=CC=C1)F RQOYODSBHDGQAL-PZJWPPBQSA-N 0.000 claims description 4
- 230000037005 anaesthesia Effects 0.000 claims description 4
- 125000003545 alkoxy group Chemical group 0.000 claims description 3
- 150000003973 alkyl amines Chemical class 0.000 claims 2
- 230000036528 appetite Effects 0.000 claims 1
- 235000019789 appetite Nutrition 0.000 claims 1
- 206010020765 hypersomnia Diseases 0.000 claims 1
- 239000003887 narcotic antagonist Substances 0.000 claims 1
- 239000003795 chemical substances by application Substances 0.000 abstract description 27
- 238000011321 prophylaxis Methods 0.000 abstract 1
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 284
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 226
- 239000000203 mixture Substances 0.000 description 194
- 239000000243 solution Substances 0.000 description 147
- 235000019439 ethyl acetate Nutrition 0.000 description 141
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 117
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 107
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 102
- 230000002829 reductive effect Effects 0.000 description 83
- 229940079593 drug Drugs 0.000 description 80
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 77
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 77
- 238000004440 column chromatography Methods 0.000 description 65
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 59
- 239000012044 organic layer Substances 0.000 description 59
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 57
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical class O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 57
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 56
- 239000011541 reaction mixture Substances 0.000 description 51
- 238000000034 method Methods 0.000 description 49
- 239000002585 base Substances 0.000 description 48
- 238000006243 chemical reaction Methods 0.000 description 42
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 41
- 238000010828 elution Methods 0.000 description 39
- 239000000741 silica gel Substances 0.000 description 38
- 229910002027 silica gel Inorganic materials 0.000 description 38
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 37
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 35
- 125000004575 3-pyrrolidinyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 32
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 32
- 235000019341 magnesium sulphate Nutrition 0.000 description 32
- 239000003153 chemical reaction reagent Substances 0.000 description 31
- 239000000377 silicon dioxide Substances 0.000 description 31
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 30
- 235000017557 sodium bicarbonate Nutrition 0.000 description 28
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 28
- 238000005481 NMR spectroscopy Methods 0.000 description 26
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 26
- 125000006239 protecting group Chemical group 0.000 description 24
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 23
- 125000003277 amino group Chemical group 0.000 description 23
- 229920006395 saturated elastomer Polymers 0.000 description 22
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 21
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 21
- 238000003756 stirring Methods 0.000 description 21
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 20
- 239000002904 solvent Substances 0.000 description 20
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 18
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 18
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 18
- 125000000623 heterocyclic group Chemical group 0.000 description 17
- LPQZERIRKRYGGM-UHFFFAOYSA-N tert-butyl pyrrolidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCCC1 LPQZERIRKRYGGM-UHFFFAOYSA-N 0.000 description 17
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 16
- 229910052799 carbon Inorganic materials 0.000 description 16
- 150000002148 esters Chemical class 0.000 description 16
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 16
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 15
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 15
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 15
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 15
- ZCRZCMUDOWDGOB-UHFFFAOYSA-N ethanesulfonimidic acid Chemical group CCS(N)(=O)=O ZCRZCMUDOWDGOB-UHFFFAOYSA-N 0.000 description 15
- 235000019441 ethanol Nutrition 0.000 description 15
- 238000001914 filtration Methods 0.000 description 15
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 15
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 15
- 125000004172 4-methoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C([H])C([H])=C1* 0.000 description 14
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical group C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 14
- 238000005886 esterification reaction Methods 0.000 description 14
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 14
- 239000007821 HATU Substances 0.000 description 13
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 13
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 13
- SKTCDJAMAYNROS-UHFFFAOYSA-N methoxycyclopentane Chemical compound COC1CCCC1 SKTCDJAMAYNROS-UHFFFAOYSA-N 0.000 description 13
- 229910052757 nitrogen Inorganic materials 0.000 description 13
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 13
- 239000007787 solid Substances 0.000 description 13
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 12
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 12
- 239000007864 aqueous solution Substances 0.000 description 12
- 108090000623 proteins and genes Proteins 0.000 description 12
- 125000004179 3-chlorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C(Cl)=C1[H] 0.000 description 11
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 11
- 239000002253 acid Substances 0.000 description 11
- 239000013078 crystal Substances 0.000 description 11
- 230000032050 esterification Effects 0.000 description 11
- 239000003112 inhibitor Substances 0.000 description 11
- 229960005486 vaccine Drugs 0.000 description 11
- UGOMMVLRQDMAQQ-UHFFFAOYSA-N xphos Chemical compound CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 UGOMMVLRQDMAQQ-UHFFFAOYSA-N 0.000 description 11
- 125000005974 C6-C14 arylcarbonyl group Chemical group 0.000 description 10
- 102000004190 Enzymes Human genes 0.000 description 10
- 108090000790 Enzymes Proteins 0.000 description 10
- 125000003710 aryl alkyl group Chemical group 0.000 description 10
- WGQKYBSKWIADBV-UHFFFAOYSA-N benzylamine Chemical group NCC1=CC=CC=C1 WGQKYBSKWIADBV-UHFFFAOYSA-N 0.000 description 10
- HNQIVZYLYMDVSB-UHFFFAOYSA-N methanesulfonimidic acid Chemical group CS(N)(=O)=O HNQIVZYLYMDVSB-UHFFFAOYSA-N 0.000 description 10
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 10
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 10
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 9
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 9
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 9
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 9
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 9
- 150000002430 hydrocarbons Chemical group 0.000 description 9
- 229910000160 potassium phosphate Inorganic materials 0.000 description 9
- 235000011009 potassium phosphates Nutrition 0.000 description 9
- 239000000047 product Substances 0.000 description 9
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 9
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 8
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 8
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 8
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 8
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical group NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 8
- 125000004429 atom Chemical group 0.000 description 8
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 8
- IJOOHPMOJXWVHK-UHFFFAOYSA-N chlorotrimethylsilane Chemical compound C[Si](C)(C)Cl IJOOHPMOJXWVHK-UHFFFAOYSA-N 0.000 description 8
- 125000006637 cyclobutyl carbonyl group Chemical group 0.000 description 8
- 125000006255 cyclopropyl carbonyl group Chemical group [H]C1([H])C([H])([H])C1([H])C(*)=O 0.000 description 8
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 8
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 8
- 239000000706 filtrate Substances 0.000 description 8
- 239000005457 ice water Substances 0.000 description 8
- 150000007529 inorganic bases Chemical class 0.000 description 8
- 229910052751 metal Inorganic materials 0.000 description 8
- 239000002184 metal Substances 0.000 description 8
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 8
- PSHKMPUSSFXUIA-UHFFFAOYSA-N n,n-dimethylpyridin-2-amine Chemical compound CN(C)C1=CC=CC=N1 PSHKMPUSSFXUIA-UHFFFAOYSA-N 0.000 description 8
- 239000012299 nitrogen atmosphere Substances 0.000 description 8
- 125000004433 nitrogen atom Chemical group N* 0.000 description 8
- 150000007530 organic bases Chemical class 0.000 description 8
- 238000002953 preparative HPLC Methods 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- 239000000725 suspension Substances 0.000 description 8
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 8
- WJKHJLXJJJATHN-UHFFFAOYSA-N triflic anhydride Chemical compound FC(F)(F)S(=O)(=O)OS(=O)(=O)C(F)(F)F WJKHJLXJJJATHN-UHFFFAOYSA-N 0.000 description 8
- 125000004739 (C1-C6) alkylsulfonyl group Chemical group 0.000 description 7
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 7
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 7
- 125000005099 aryl alkyl carbonyl group Chemical group 0.000 description 7
- 125000003943 azolyl group Chemical group 0.000 description 7
- 235000010290 biphenyl Nutrition 0.000 description 7
- 239000000470 constituent Substances 0.000 description 7
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 description 7
- 230000008018 melting Effects 0.000 description 7
- 238000002844 melting Methods 0.000 description 7
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 7
- 210000002569 neuron Anatomy 0.000 description 7
- 239000003921 oil Substances 0.000 description 7
- 235000019198 oils Nutrition 0.000 description 7
- 230000003287 optical effect Effects 0.000 description 7
- 239000008194 pharmaceutical composition Substances 0.000 description 7
- 235000018102 proteins Nutrition 0.000 description 7
- 102000004169 proteins and genes Human genes 0.000 description 7
- 102000005962 receptors Human genes 0.000 description 7
- 108020003175 receptors Proteins 0.000 description 7
- 235000011121 sodium hydroxide Nutrition 0.000 description 7
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 6
- OZAIFHULBGXAKX-UHFFFAOYSA-N 2-(2-cyanopropan-2-yldiazenyl)-2-methylpropanenitrile Chemical compound N#CC(C)(C)N=NC(C)(C)C#N OZAIFHULBGXAKX-UHFFFAOYSA-N 0.000 description 6
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 6
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 6
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 6
- 241000124008 Mammalia Species 0.000 description 6
- 208000018737 Parkinson disease Diseases 0.000 description 6
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 6
- 150000001298 alcohols Chemical class 0.000 description 6
- 150000001350 alkyl halides Chemical class 0.000 description 6
- 125000004432 carbon atom Chemical group C* 0.000 description 6
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 6
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 6
- 229920002678 cellulose Polymers 0.000 description 6
- 239000001913 cellulose Substances 0.000 description 6
- 235000010980 cellulose Nutrition 0.000 description 6
- 125000001309 chloro group Chemical group Cl* 0.000 description 6
- 238000001704 evaporation Methods 0.000 description 6
- 230000008020 evaporation Effects 0.000 description 6
- 125000005842 heteroatom Chemical group 0.000 description 6
- 239000001257 hydrogen Substances 0.000 description 6
- 229910052739 hydrogen Inorganic materials 0.000 description 6
- 230000014759 maintenance of location Effects 0.000 description 6
- IZDROVVXIHRYMH-UHFFFAOYSA-N methanesulfonic anhydride Chemical compound CS(=O)(=O)OS(C)(=O)=O IZDROVVXIHRYMH-UHFFFAOYSA-N 0.000 description 6
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 6
- 150000007522 mineralic acids Chemical class 0.000 description 6
- 125000004430 oxygen atom Chemical group O* 0.000 description 6
- 239000000651 prodrug Substances 0.000 description 6
- 229940002612 prodrug Drugs 0.000 description 6
- 125000004076 pyridyl group Chemical group 0.000 description 6
- 208000019116 sleep disease Diseases 0.000 description 6
- 125000004646 sulfenyl group Chemical group S(*)* 0.000 description 6
- 125000004434 sulfur atom Chemical group 0.000 description 6
- CXWXQJXEFPUFDZ-UHFFFAOYSA-N tetralin Chemical compound C1=CC=C2CCCCC2=C1 CXWXQJXEFPUFDZ-UHFFFAOYSA-N 0.000 description 6
- 125000003396 thiol group Chemical group [H]S* 0.000 description 6
- RBTCRFLJLUNCLL-UHFFFAOYSA-N (1-chloro-2-methyl-1-oxopropan-2-yl) acetate Chemical compound CC(=O)OC(C)(C)C(Cl)=O RBTCRFLJLUNCLL-UHFFFAOYSA-N 0.000 description 5
- 125000006700 (C1-C6) alkylthio group Chemical group 0.000 description 5
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 5
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 5
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 5
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 5
- 239000002841 Lewis acid Substances 0.000 description 5
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 5
- 241000699670 Mus sp. Species 0.000 description 5
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 5
- 229920002472 Starch Polymers 0.000 description 5
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 5
- 229930006000 Sucrose Natural products 0.000 description 5
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 5
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 5
- 150000008065 acid anhydrides Chemical class 0.000 description 5
- 125000002252 acyl group Chemical group 0.000 description 5
- 238000005917 acylation reaction Methods 0.000 description 5
- 150000001335 aliphatic alkanes Chemical class 0.000 description 5
- 150000001412 amines Chemical class 0.000 description 5
- 150000004945 aromatic hydrocarbons Chemical group 0.000 description 5
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 description 5
- 239000007888 film coating Substances 0.000 description 5
- 238000009501 film coating Methods 0.000 description 5
- 235000019253 formic acid Nutrition 0.000 description 5
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 5
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 5
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 5
- 150000007517 lewis acids Chemical class 0.000 description 5
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Chemical compound C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 description 5
- 238000002156 mixing Methods 0.000 description 5
- 150000007524 organic acids Chemical class 0.000 description 5
- 239000003208 petroleum Substances 0.000 description 5
- 150000003254 radicals Chemical class 0.000 description 5
- 238000011069 regeneration method Methods 0.000 description 5
- 229910052938 sodium sulfate Inorganic materials 0.000 description 5
- 235000011152 sodium sulphate Nutrition 0.000 description 5
- 239000008107 starch Substances 0.000 description 5
- 235000019698 starch Nutrition 0.000 description 5
- 239000012258 stirred mixture Substances 0.000 description 5
- 239000005720 sucrose Substances 0.000 description 5
- 125000001544 thienyl group Chemical group 0.000 description 5
- 229910052725 zinc Inorganic materials 0.000 description 5
- 239000011701 zinc Substances 0.000 description 5
- 125000006717 (C3-C10) cycloalkenyl group Chemical group 0.000 description 4
- HZNVUJQVZSTENZ-UHFFFAOYSA-N 2,3-dichloro-5,6-dicyano-1,4-benzoquinone Chemical compound ClC1=C(Cl)C(=O)C(C#N)=C(C#N)C1=O HZNVUJQVZSTENZ-UHFFFAOYSA-N 0.000 description 4
- KVZVBGWCGLIGDJ-UHFFFAOYSA-N 4,4-difluoro-2-[(2-fluoro-3-phenylphenyl)methyl]pyrrolidin-3-ol Chemical compound FC1(C(C(NC1)CC=1C(=C(C=CC=1)C1=CC=CC=C1)F)O)F KVZVBGWCGLIGDJ-UHFFFAOYSA-N 0.000 description 4
- YYROPELSRYBVMQ-UHFFFAOYSA-N 4-toluenesulfonyl chloride Chemical compound CC1=CC=C(S(Cl)(=O)=O)C=C1 YYROPELSRYBVMQ-UHFFFAOYSA-N 0.000 description 4
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical group CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 description 4
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 4
- 102000013455 Amyloid beta-Peptides Human genes 0.000 description 4
- 108010090849 Amyloid beta-Peptides Proteins 0.000 description 4
- 208000020925 Bipolar disease Diseases 0.000 description 4
- 239000004215 Carbon black (E152) Substances 0.000 description 4
- 206010010071 Coma Diseases 0.000 description 4
- SFGRNMYQZNFHDD-UHFFFAOYSA-N FC=1C=C(C=CC1)B(OO)OO Chemical compound FC=1C=C(C=CC1)B(OO)OO SFGRNMYQZNFHDD-UHFFFAOYSA-N 0.000 description 4
- 241000699660 Mus musculus Species 0.000 description 4
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 4
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 4
- 239000004373 Pullulan Substances 0.000 description 4
- 229920001218 Pullulan Polymers 0.000 description 4
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 4
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 4
- 230000005856 abnormality Effects 0.000 description 4
- 150000001263 acyl chlorides Chemical class 0.000 description 4
- 230000010933 acylation Effects 0.000 description 4
- 239000000654 additive Substances 0.000 description 4
- 125000003282 alkyl amino group Chemical group 0.000 description 4
- 150000001408 amides Chemical class 0.000 description 4
- 125000004202 aminomethyl group Chemical group [H]N([H])C([H])([H])* 0.000 description 4
- 235000019270 ammonium chloride Nutrition 0.000 description 4
- 229910052786 argon Inorganic materials 0.000 description 4
- 125000004391 aryl sulfonyl group Chemical group 0.000 description 4
- 150000001540 azides Chemical class 0.000 description 4
- 125000002619 bicyclic group Chemical group 0.000 description 4
- UWTDFICHZKXYAC-UHFFFAOYSA-N boron;oxolane Chemical compound [B].C1CCOC1 UWTDFICHZKXYAC-UHFFFAOYSA-N 0.000 description 4
- 210000004556 brain Anatomy 0.000 description 4
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 4
- 229910052794 bromium Inorganic materials 0.000 description 4
- 150000001718 carbodiimides Chemical class 0.000 description 4
- 239000001768 carboxy methyl cellulose Substances 0.000 description 4
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 4
- 239000003054 catalyst Substances 0.000 description 4
- 210000004027 cell Anatomy 0.000 description 4
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 4
- 238000000576 coating method Methods 0.000 description 4
- 238000009833 condensation Methods 0.000 description 4
- 230000005494 condensation Effects 0.000 description 4
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 4
- MKRTXPORKIRPDG-UHFFFAOYSA-N diphenylphosphoryl azide Chemical compound C=1C=CC=CC=1P(=O)(N=[N+]=[N-])C1=CC=CC=C1 MKRTXPORKIRPDG-UHFFFAOYSA-N 0.000 description 4
- 125000006125 ethylsulfonyl group Chemical group 0.000 description 4
- 230000005496 eutectics Effects 0.000 description 4
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 description 4
- LNEPOXFFQSENCJ-UHFFFAOYSA-N haloperidol Chemical compound C1CC(O)(C=2C=CC(Cl)=CC=2)CCN1CCCC(=O)C1=CC=C(F)C=C1 LNEPOXFFQSENCJ-UHFFFAOYSA-N 0.000 description 4
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 4
- 229930195733 hydrocarbon Natural products 0.000 description 4
- 238000006460 hydrolysis reaction Methods 0.000 description 4
- CGIGDMFJXJATDK-UHFFFAOYSA-N indomethacin Chemical compound CC1=C(CC(O)=O)C2=CC(OC)=CC=C2N1C(=O)C1=CC=C(Cl)C=C1 CGIGDMFJXJATDK-UHFFFAOYSA-N 0.000 description 4
- 239000003999 initiator Substances 0.000 description 4
- 239000002198 insoluble material Substances 0.000 description 4
- 239000010410 layer Substances 0.000 description 4
- 239000012280 lithium aluminium hydride Substances 0.000 description 4
- 235000010355 mannitol Nutrition 0.000 description 4
- WGYKZJWCGVVSQN-UHFFFAOYSA-N mono-n-propyl amine Natural products CCCN WGYKZJWCGVVSQN-UHFFFAOYSA-N 0.000 description 4
- 235000005985 organic acids Nutrition 0.000 description 4
- ZKCXAZCRQJSFTQ-UHFFFAOYSA-N oxetane-2-carboxylic acid Chemical compound OC(=O)C1CCO1 ZKCXAZCRQJSFTQ-UHFFFAOYSA-N 0.000 description 4
- 125000001820 oxy group Chemical group [*:1]O[*:2] 0.000 description 4
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 4
- RDOWQLZANAYVLL-UHFFFAOYSA-N phenanthridine Chemical compound C1=CC=C2C3=CC=CC=C3C=NC2=C1 RDOWQLZANAYVLL-UHFFFAOYSA-N 0.000 description 4
- 239000000049 pigment Substances 0.000 description 4
- 125000003367 polycyclic group Chemical group 0.000 description 4
- AQHHHDLHHXJYJD-UHFFFAOYSA-N propranolol Chemical compound C1=CC=C2C(OCC(O)CNC(C)C)=CC=CC2=C1 AQHHHDLHHXJYJD-UHFFFAOYSA-N 0.000 description 4
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 4
- 235000019423 pullulan Nutrition 0.000 description 4
- LEHBURLTIWGHEM-UHFFFAOYSA-N pyridinium chlorochromate Chemical compound [O-][Cr](Cl)(=O)=O.C1=CC=[NH+]C=C1 LEHBURLTIWGHEM-UHFFFAOYSA-N 0.000 description 4
- HNJBEVLQSNELDL-UHFFFAOYSA-N pyrrolidin-2-one Chemical compound O=C1CCCN1 HNJBEVLQSNELDL-UHFFFAOYSA-N 0.000 description 4
- 238000006722 reduction reaction Methods 0.000 description 4
- 125000003808 silyl group Chemical group [H][Si]([H])([H])[*] 0.000 description 4
- 229910000104 sodium hydride Inorganic materials 0.000 description 4
- 239000000758 substrate Substances 0.000 description 4
- 238000003786 synthesis reaction Methods 0.000 description 4
- 239000003826 tablet Substances 0.000 description 4
- GMRIOAVKKGNMMV-UHFFFAOYSA-N tetrabutylazanium;azide Chemical compound [N-]=[N+]=[N-].CCCC[N+](CCCC)(CCCC)CCCC GMRIOAVKKGNMMV-UHFFFAOYSA-N 0.000 description 4
- VZGDMQKNWNREIO-UHFFFAOYSA-N tetrachloromethane Chemical compound ClC(Cl)(Cl)Cl VZGDMQKNWNREIO-UHFFFAOYSA-N 0.000 description 4
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 4
- 238000011830 transgenic mouse model Methods 0.000 description 4
- AQRLNPVMDITEJU-UHFFFAOYSA-N triethylsilane Chemical compound CC[SiH](CC)CC AQRLNPVMDITEJU-UHFFFAOYSA-N 0.000 description 4
- SEDZOYHHAIAQIW-UHFFFAOYSA-N trimethylsilyl azide Chemical compound C[Si](C)(C)N=[N+]=[N-] SEDZOYHHAIAQIW-UHFFFAOYSA-N 0.000 description 4
- VNDYJBBGRKZCSX-UHFFFAOYSA-L zinc bromide Chemical compound Br[Zn]Br VNDYJBBGRKZCSX-UHFFFAOYSA-L 0.000 description 4
- MOHYOXXOKFQHDC-UHFFFAOYSA-N 1-(chloromethyl)-4-methoxybenzene Chemical compound COC1=CC=C(CCl)C=C1 MOHYOXXOKFQHDC-UHFFFAOYSA-N 0.000 description 3
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 3
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 3
- ABFPKTQEQNICFT-UHFFFAOYSA-M 2-chloro-1-methylpyridin-1-ium;iodide Chemical compound [I-].C[N+]1=CC=CC=C1Cl ABFPKTQEQNICFT-UHFFFAOYSA-M 0.000 description 3
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 3
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 3
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 3
- 244000215068 Acacia senegal Species 0.000 description 3
- 208000006096 Attention Deficit Disorder with Hyperactivity Diseases 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- 125000005947 C1-C6 alkylsulfonyloxy group Chemical group 0.000 description 3
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 description 3
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 3
- 241000282472 Canis lupus familiaris Species 0.000 description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 3
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 3
- RGSFGYAAUTVSQA-UHFFFAOYSA-N Cyclopentane Chemical compound C1CCCC1 RGSFGYAAUTVSQA-UHFFFAOYSA-N 0.000 description 3
- 102000004127 Cytokines Human genes 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 208000035895 Guillain-Barré syndrome Diseases 0.000 description 3
- 229920000084 Gum arabic Polymers 0.000 description 3
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 3
- 206010022489 Insulin Resistance Diseases 0.000 description 3
- 206010049567 Miller Fisher syndrome Diseases 0.000 description 3
- JRNVZBWKYDBUCA-UHFFFAOYSA-N N-Chlorosuccinimide Substances ClN1C(=O)CCC1=O JRNVZBWKYDBUCA-UHFFFAOYSA-N 0.000 description 3
- AUITYSDSAARYAH-QKNQBKEWSA-N N-[(2S,3R)-4,4-difluoro-2-[[2-fluoro-3-(3-fluorophenyl)phenyl]methyl]-1-[(2R)-oxetane-2-carbonyl]pyrrolidin-3-yl]ethanesulfonamide Chemical compound FC1=C(C=CC=C1C[C@@H]1N(CC([C@@H]1NS(=O)(=O)CC)(F)F)C(=O)[C@@H]1OCC1)C1=CC(=CC=C1)F AUITYSDSAARYAH-QKNQBKEWSA-N 0.000 description 3
- 206010028980 Neoplasm Diseases 0.000 description 3
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 3
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- 241000700159 Rattus Species 0.000 description 3
- FTALBRSUTCGOEG-UHFFFAOYSA-N Riluzole Chemical compound C1=C(OC(F)(F)F)C=C2SC(N)=NC2=C1 FTALBRSUTCGOEG-UHFFFAOYSA-N 0.000 description 3
- 208000032140 Sleepiness Diseases 0.000 description 3
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 3
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 3
- 230000009102 absorption Effects 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 235000010489 acacia gum Nutrition 0.000 description 3
- 239000000205 acacia gum Substances 0.000 description 3
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 3
- 229910000102 alkali metal hydride Inorganic materials 0.000 description 3
- 150000008046 alkali metal hydrides Chemical class 0.000 description 3
- 150000004703 alkoxides Chemical class 0.000 description 3
- 238000005804 alkylation reaction Methods 0.000 description 3
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 3
- 235000001014 amino acid Nutrition 0.000 description 3
- 150000001413 amino acids Chemical class 0.000 description 3
- 125000005279 aryl sulfonyloxy group Chemical group 0.000 description 3
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 3
- ZSIQJIWKELUFRJ-UHFFFAOYSA-N azepane Chemical compound C1CCCNCC1 ZSIQJIWKELUFRJ-UHFFFAOYSA-N 0.000 description 3
- 230000003542 behavioural effect Effects 0.000 description 3
- 229940049706 benzodiazepine Drugs 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 230000037396 body weight Effects 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 125000004744 butyloxycarbonyl group Chemical group 0.000 description 3
- 239000006227 byproduct Substances 0.000 description 3
- 206010008118 cerebral infarction Diseases 0.000 description 3
- XMPZTFVPEKAKFH-UHFFFAOYSA-P ceric ammonium nitrate Chemical compound [NH4+].[NH4+].[Ce+4].[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O XMPZTFVPEKAKFH-UHFFFAOYSA-P 0.000 description 3
- OSUPRVCFDQWKQN-UHFFFAOYSA-N cerium;nitric acid Chemical compound [Ce].O[N+]([O-])=O.O[N+]([O-])=O.O[N+]([O-])=O.O[N+]([O-])=O.O[N+]([O-])=O.O[N+]([O-])=O OSUPRVCFDQWKQN-UHFFFAOYSA-N 0.000 description 3
- 239000011248 coating agent Substances 0.000 description 3
- 208000010877 cognitive disease Diseases 0.000 description 3
- 239000012141 concentrate Substances 0.000 description 3
- 235000008504 concentrate Nutrition 0.000 description 3
- 239000012043 crude product Substances 0.000 description 3
- 238000002425 crystallisation Methods 0.000 description 3
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 3
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 3
- 229960004132 diethyl ether Drugs 0.000 description 3
- 206010014599 encephalitis Diseases 0.000 description 3
- FRYHCSODNHYDPU-UHFFFAOYSA-N ethanesulfonyl chloride Chemical compound CCS(Cl)(=O)=O FRYHCSODNHYDPU-UHFFFAOYSA-N 0.000 description 3
- IRSJDVYTJUCXRV-UHFFFAOYSA-N ethyl 2-bromo-2,2-difluoroacetate Chemical compound CCOC(=O)C(F)(F)Br IRSJDVYTJUCXRV-UHFFFAOYSA-N 0.000 description 3
- 125000004494 ethyl ester group Chemical group 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 239000012065 filter cake Substances 0.000 description 3
- 239000000576 food coloring agent Substances 0.000 description 3
- 125000000524 functional group Chemical group 0.000 description 3
- DMEGYFMYUHOHGS-UHFFFAOYSA-N heptamethylene Natural products C1CCCCCC1 DMEGYFMYUHOHGS-UHFFFAOYSA-N 0.000 description 3
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 3
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 3
- 238000000185 intracerebroventricular administration Methods 0.000 description 3
- 150000002500 ions Chemical class 0.000 description 3
- SORXVYYPMXPIFD-UHFFFAOYSA-N iron palladium Chemical compound [Fe].[Pd] SORXVYYPMXPIFD-UHFFFAOYSA-N 0.000 description 3
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 3
- 150000002576 ketones Chemical class 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 150000002642 lithium compounds Chemical class 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 229960004640 memantine Drugs 0.000 description 3
- LDDHMLJTFXJGPI-UHFFFAOYSA-N memantine hydrochloride Chemical compound Cl.C1C(C2)CC3(C)CC1(C)CC2(N)C3 LDDHMLJTFXJGPI-UHFFFAOYSA-N 0.000 description 3
- 230000004060 metabolic process Effects 0.000 description 3
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 3
- 230000001956 orexigenic effect Effects 0.000 description 3
- OFNHNCAUVYOTPM-IIIOAANCSA-N orexin-a Chemical compound C([C@@H](C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)CNC(=O)[C@H](C)NC(=O)CNC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H]1NC(=O)[C@H](CO)NC(=O)[C@@H]2CSSC[C@@H](C(=O)N[C@H](C(N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(=O)N2)[C@@H](C)O)=O)CSSC1)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC(C)C)NC(=O)[C@H]1N(CCC1)C(=O)[C@H]1NC(=O)CC1)C1=CNC=N1 OFNHNCAUVYOTPM-IIIOAANCSA-N 0.000 description 3
- 238000007254 oxidation reaction Methods 0.000 description 3
- 239000001301 oxygen Substances 0.000 description 3
- 229910052760 oxygen Inorganic materials 0.000 description 3
- 229910052763 palladium Inorganic materials 0.000 description 3
- 229920000642 polymer Polymers 0.000 description 3
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 3
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 3
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 3
- 230000003449 preventive effect Effects 0.000 description 3
- 239000002994 raw material Substances 0.000 description 3
- 230000008929 regeneration Effects 0.000 description 3
- 229960004181 riluzole Drugs 0.000 description 3
- DCKVNWZUADLDEH-UHFFFAOYSA-N sec-butyl acetate Chemical group CCC(C)OC(C)=O DCKVNWZUADLDEH-UHFFFAOYSA-N 0.000 description 3
- 238000010898 silica gel chromatography Methods 0.000 description 3
- 230000007958 sleep Effects 0.000 description 3
- 229910000029 sodium carbonate Inorganic materials 0.000 description 3
- 235000017550 sodium carbonate Nutrition 0.000 description 3
- QDRKDTQENPPHOJ-UHFFFAOYSA-N sodium ethoxide Chemical compound [Na+].CC[O-] QDRKDTQENPPHOJ-UHFFFAOYSA-N 0.000 description 3
- 239000012312 sodium hydride Substances 0.000 description 3
- FVAUCKIRQBBSSJ-UHFFFAOYSA-M sodium iodide Chemical compound [Na+].[I-] FVAUCKIRQBBSSJ-UHFFFAOYSA-M 0.000 description 3
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 description 3
- 229940124530 sulfonamide Drugs 0.000 description 3
- 238000013268 sustained release Methods 0.000 description 3
- 239000012730 sustained-release form Substances 0.000 description 3
- LFKDJXLFVYVEFG-UHFFFAOYSA-N tert-butyl carbamate Chemical compound CC(C)(C)OC(N)=O LFKDJXLFVYVEFG-UHFFFAOYSA-N 0.000 description 3
- DPKBAXPHAYBPRL-UHFFFAOYSA-M tetrabutylazanium;iodide Chemical compound [I-].CCCC[N+](CCCC)(CCCC)CCCC DPKBAXPHAYBPRL-UHFFFAOYSA-M 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 125000000335 thiazolyl group Chemical group 0.000 description 3
- 238000004809 thin layer chromatography Methods 0.000 description 3
- 125000002827 triflate group Chemical group FC(S(=O)(=O)O*)(F)F 0.000 description 3
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 3
- 230000002792 vascular Effects 0.000 description 3
- AHOUBRCZNHFOSL-YOEHRIQHSA-N (+)-Casbol Chemical compound C1=CC(F)=CC=C1[C@H]1[C@H](COC=2C=C3OCOC3=CC=2)CNCC1 AHOUBRCZNHFOSL-YOEHRIQHSA-N 0.000 description 2
- CEMAWMOMDPGJMB-UHFFFAOYSA-N (+-)-Oxprenolol Chemical compound CC(C)NCC(O)COC1=CC=CC=C1OCC=C CEMAWMOMDPGJMB-UHFFFAOYSA-N 0.000 description 2
- FXLHWWQVAWRBSK-RGURZIINSA-N (2S)-2-[(3-chlorophenyl)methyl]-4,4-difluoropyrrolidin-3-ol Chemical compound ClC=1C=C(C=CC=1)C[C@@H]1NCC(C1O)(F)F FXLHWWQVAWRBSK-RGURZIINSA-N 0.000 description 2
- PDVFSPNIEOYOQL-UHFFFAOYSA-N (4-methylphenyl)sulfonyl 4-methylbenzenesulfonate Chemical compound C1=CC(C)=CC=C1S(=O)(=O)OS(=O)(=O)C1=CC=C(C)C=C1 PDVFSPNIEOYOQL-UHFFFAOYSA-N 0.000 description 2
- DEQANNDTNATYII-OULOTJBUSA-N (4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-19-[[(2r)-2-amino-3-phenylpropanoyl]amino]-16-benzyl-n-[(2r,3r)-1,3-dihydroxybutan-2-yl]-7-[(1r)-1-hydroxyethyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-1,2-dithia-5,8,11,14,17-pentazacycloicosane-4-carboxa Chemical compound C([C@@H](N)C(=O)N[C@H]1CSSC[C@H](NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](CC=2C3=CC=CC=C3NC=2)NC(=O)[C@H](CC=2C=CC=CC=2)NC1=O)C(=O)N[C@H](CO)[C@H](O)C)C1=CC=CC=C1 DEQANNDTNATYII-OULOTJBUSA-N 0.000 description 2
- XGHDGQZMTQJEMV-IENPIDJESA-N (5S)-5-[(3-chlorophenyl)methyl]-3,3-difluoro-4-hydroxypyrrolidin-2-one Chemical compound ClC=1C=C(C=CC=1)C[C@H]1C(C(C(N1)=O)(F)F)O XGHDGQZMTQJEMV-IENPIDJESA-N 0.000 description 2
- KWTSXDURSIMDCE-QMMMGPOBSA-N (S)-amphetamine Chemical compound C[C@H](N)CC1=CC=CC=C1 KWTSXDURSIMDCE-QMMMGPOBSA-N 0.000 description 2
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 2
- SPEUIVXLLWOEMJ-UHFFFAOYSA-N 1,1-dimethoxyethane Chemical compound COC(C)OC SPEUIVXLLWOEMJ-UHFFFAOYSA-N 0.000 description 2
- RXBYRTSOWREATF-UHFFFAOYSA-N 1,2,3,4-tetrahydroacridine Chemical compound C1=CC=C2C=C(CCCC3)C3=NC2=C1 RXBYRTSOWREATF-UHFFFAOYSA-N 0.000 description 2
- UWYZHKAOTLEWKK-UHFFFAOYSA-N 1,2,3,4-tetrahydroisoquinoline Chemical compound C1=CC=C2CNCCC2=C1 UWYZHKAOTLEWKK-UHFFFAOYSA-N 0.000 description 2
- JBHCHNYONQSXLP-UHFFFAOYSA-N 1,2,3,4-tetrahydrophenanthridine Chemical compound N1=CC2=CC=CC=C2C2=C1CCCC2 JBHCHNYONQSXLP-UHFFFAOYSA-N 0.000 description 2
- LBUJPTNKIBCYBY-UHFFFAOYSA-N 1,2,3,4-tetrahydroquinoline Chemical compound C1=CC=C2CCCNC2=C1 LBUJPTNKIBCYBY-UHFFFAOYSA-N 0.000 description 2
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical compound C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 2
- KLECYOQFQXJYBC-UHFFFAOYSA-N 1-fluoro-2-phenylbenzene Chemical group FC1=CC=CC=C1C1=CC=CC=C1 KLECYOQFQXJYBC-UHFFFAOYSA-N 0.000 description 2
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- XWIYUCRMWCHYJR-UHFFFAOYSA-N 1h-pyrrolo[3,2-b]pyridine Chemical compound C1=CC=C2NC=CC2=N1 XWIYUCRMWCHYJR-UHFFFAOYSA-N 0.000 description 2
- LCXSFEMSLWDBJG-UHFFFAOYSA-N 2,3,4,9-tetrahydro-1h-thioxanthene Chemical compound C1C2=CC=CC=C2SC2=C1CCCC2 LCXSFEMSLWDBJG-UHFFFAOYSA-N 0.000 description 2
- HBEDSQVIWPRPAY-UHFFFAOYSA-N 2,3-dihydrobenzofuran Chemical compound C1=CC=C2OCCC2=C1 HBEDSQVIWPRPAY-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- NPEOCBYLTPBLTJ-UHFFFAOYSA-N 2-amino-3-(3-bromo-2-fluorophenyl)propanoic acid hydrochloride Chemical compound C1=CC(=C(C(=C1)Br)F)CC(C(=O)O)N.Cl NPEOCBYLTPBLTJ-UHFFFAOYSA-N 0.000 description 2
- ICSNLGPSRYBMBD-UHFFFAOYSA-N 2-aminopyridine Chemical group NC1=CC=CC=N1 ICSNLGPSRYBMBD-UHFFFAOYSA-N 0.000 description 2
- WNZQDUSMALZDQF-UHFFFAOYSA-N 2-benzofuran-1(3H)-one Chemical compound C1=CC=C2C(=O)OCC2=C1 WNZQDUSMALZDQF-UHFFFAOYSA-N 0.000 description 2
- WRMNZCZEMHIOCP-UHFFFAOYSA-N 2-phenylethanol Chemical compound OCCC1=CC=CC=C1 WRMNZCZEMHIOCP-UHFFFAOYSA-N 0.000 description 2
- VSWICNJIUPRZIK-UHFFFAOYSA-N 2-piperideine Chemical compound C1CNC=CC1 VSWICNJIUPRZIK-UHFFFAOYSA-N 0.000 description 2
- HOQXQVSPKKOVGA-UHFFFAOYSA-N 3,3-difluoro-5-[(2-fluoro-3-phenylphenyl)methyl]-4-hydroxypyrrolidin-2-one Chemical compound FC1(C(NC(C1O)CC=1C(=C(C=CC=1)C1=CC=CC=C1)F)=O)F HOQXQVSPKKOVGA-UHFFFAOYSA-N 0.000 description 2
- PGVIVQHZILLOCN-UHFFFAOYSA-N 3-(3-bromo-2-fluorophenyl)-2-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)NC(Cc1cccc(Br)c1F)C(O)=O PGVIVQHZILLOCN-UHFFFAOYSA-N 0.000 description 2
- SNKZJIOFVMKAOJ-UHFFFAOYSA-N 3-Aminopropanesulfonate Chemical compound NCCCS(O)(=O)=O SNKZJIOFVMKAOJ-UHFFFAOYSA-N 0.000 description 2
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 2
- BMTZEAOGFDXDAD-UHFFFAOYSA-M 4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholin-4-ium;chloride Chemical compound [Cl-].COC1=NC(OC)=NC([N+]2(C)CCOCC2)=N1 BMTZEAOGFDXDAD-UHFFFAOYSA-M 0.000 description 2
- GAMYYCRTACQSBR-UHFFFAOYSA-N 4-azabenzimidazole Chemical compound C1=CC=C2NC=NC2=N1 GAMYYCRTACQSBR-UHFFFAOYSA-N 0.000 description 2
- KEWSCDNULKOKTG-UHFFFAOYSA-N 4-cyano-4-ethylsulfanylcarbothioylsulfanylpentanoic acid Chemical compound CCSC(=S)SC(C)(C#N)CCC(O)=O KEWSCDNULKOKTG-UHFFFAOYSA-N 0.000 description 2
- CVMSHFLTYLVYFI-UHFFFAOYSA-N 5-[(3-chloro-2-fluorophenyl)methyl]-3,3-difluoro-4-hydroxypyrrolidin-2-one Chemical compound ClC=1C(=C(C=CC=1)CC1C(C(C(N1)=O)(F)F)O)F CVMSHFLTYLVYFI-UHFFFAOYSA-N 0.000 description 2
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 2
- UJOBWOGCFQCDNV-UHFFFAOYSA-N 9H-carbazole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 2
- 206010001541 Akinesia Diseases 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- 208000019901 Anxiety disease Diseases 0.000 description 2
- 241000208340 Araliaceae Species 0.000 description 2
- 208000036864 Attention deficit/hyperactivity disease Diseases 0.000 description 2
- UKDYDSKIZZBCNO-UHFFFAOYSA-N B(C1=CC(=CC(=C1)F)F)(OO)OO Chemical compound B(C1=CC(=CC(=C1)F)F)(OO)OO UKDYDSKIZZBCNO-UHFFFAOYSA-N 0.000 description 2
- KHBQMWCZKVMBLN-UHFFFAOYSA-N Benzenesulfonamide Chemical compound NS(=O)(=O)C1=CC=CC=C1 KHBQMWCZKVMBLN-UHFFFAOYSA-N 0.000 description 2
- KZMGYPLQYOPHEL-UHFFFAOYSA-N Boron trifluoride etherate Chemical compound FB(F)F.CCOCC KZMGYPLQYOPHEL-UHFFFAOYSA-N 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- 125000005914 C6-C14 aryloxy group Chemical group 0.000 description 2
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 2
- 241000282693 Cercopithecidae Species 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 2
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- 102100037637 Cholesteryl ester transfer protein Human genes 0.000 description 2
- 206010008874 Chronic Fatigue Syndrome Diseases 0.000 description 2
- 208000028698 Cognitive impairment Diseases 0.000 description 2
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 2
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 2
- 206010012289 Dementia Diseases 0.000 description 2
- 229920001353 Dextrin Polymers 0.000 description 2
- 239000004375 Dextrin Substances 0.000 description 2
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 2
- ROSDSFDQCJNGOL-UHFFFAOYSA-N Dimethylamine Chemical compound CNC ROSDSFDQCJNGOL-UHFFFAOYSA-N 0.000 description 2
- 241000283086 Equidae Species 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- 208000001640 Fibromyalgia Diseases 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 108091006027 G proteins Proteins 0.000 description 2
- 102000030782 GTP binding Human genes 0.000 description 2
- 108091000058 GTP-Binding Proteins 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 102000018899 Glutamate Receptors Human genes 0.000 description 2
- 108010027915 Glutamate Receptors Proteins 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 206010019233 Headaches Diseases 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 101000880514 Homo sapiens Cholesteryl ester transfer protein Proteins 0.000 description 2
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 2
- 208000031226 Hyperlipidaemia Diseases 0.000 description 2
- 206010053712 Hypersomnia-bulimia syndrome Diseases 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 208000001456 Jet Lag Syndrome Diseases 0.000 description 2
- 201000008178 Kleine-Levin syndrome Diseases 0.000 description 2
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 239000012359 Methanesulfonyl chloride Substances 0.000 description 2
- 208000019695 Migraine disease Diseases 0.000 description 2
- 102000010909 Monoamine Oxidase Human genes 0.000 description 2
- 108010062431 Monoamine oxidase Proteins 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- 208000007101 Muscle Cramp Diseases 0.000 description 2
- 208000002033 Myoclonus Diseases 0.000 description 2
- HSHXDCVZWHOWCS-UHFFFAOYSA-N N'-hexadecylthiophene-2-carbohydrazide Chemical compound CCCCCCCCCCCCCCCCNNC(=O)c1cccs1 HSHXDCVZWHOWCS-UHFFFAOYSA-N 0.000 description 2
- JLTDJTHDQAWBAV-UHFFFAOYSA-N N,N-dimethylaniline Chemical compound CN(C)C1=CC=CC=C1 JLTDJTHDQAWBAV-UHFFFAOYSA-N 0.000 description 2
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 2
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 2
- HOKKHZGPKSLGJE-GSVOUGTGSA-N N-Methyl-D-aspartic acid Chemical compound CN[C@@H](C(O)=O)CC(O)=O HOKKHZGPKSLGJE-GSVOUGTGSA-N 0.000 description 2
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 2
- WMQJWHUDOYJUME-ZVWHLABXSA-N N-[(2S,3R)-2-[(3-chlorophenyl)methyl]-4,4-difluoropyrrolidin-3-yl]ethanesulfonamide hydrochloride Chemical compound Cl.ClC=1C=C(C=CC=1)C[C@@H]1NCC([C@@H]1NS(=O)(=O)CC)(F)F WMQJWHUDOYJUME-ZVWHLABXSA-N 0.000 description 2
- KILUEWPZIMWZGQ-SIGULFFNSA-N N-[(2S,3R)-4,4-difluoro-1-(oxetane-2-carbonyl)-2-[(3-phenylphenyl)methyl]pyrrolidin-3-yl]ethanesulfonamide Chemical compound C1(=CC(=CC=C1)C[C@@H]1N(CC([C@@H]1NS(=O)(=O)CC)(F)F)C(=O)C1OCC1)C1=CC=CC=C1 KILUEWPZIMWZGQ-SIGULFFNSA-N 0.000 description 2
- PEPXAIQSWYGLKQ-AZUAARDMSA-N N-[(2S,3R)-4,4-difluoro-2-[(2-fluoro-3-phenylphenyl)methyl]-1-(2-hydroxy-2-methylpropanoyl)pyrrolidin-3-yl]ethanesulfonamide Chemical compound FC1([C@@H]([C@@H](N(C1)C(C(C)(C)O)=O)CC=1C(=C(C=CC=1)C1=CC=CC=C1)F)NS(=O)(=O)CC)F PEPXAIQSWYGLKQ-AZUAARDMSA-N 0.000 description 2
- BDPOKPPEGVGAHX-OWJBEEKMSA-N N-[(2S,3R)-4,4-difluoro-2-[(2-fluoro-3-phenylphenyl)methyl]-1-(oxetane-2-carbonyl)pyrrolidin-3-yl]ethanesulfonamide Chemical compound FC1([C@@H]([C@@H](N(C1)C(=O)C1OCC1)CC=1C(=C(C=CC=1)C1=CC=CC=C1)F)NS(=O)(=O)CC)F BDPOKPPEGVGAHX-OWJBEEKMSA-N 0.000 description 2
- QNKXPKLUBLEAGY-FUDKSRODSA-N N-[(2S,3R,4S)-1-(azetidine-1-carbonyl)-4-fluoro-2-[[2-fluoro-3-(3-methylphenyl)phenyl]methyl]pyrrolidin-3-yl]ethanesulfonamide Chemical compound N1(CCC1)C(=O)N1[C@H]([C@H]([C@H](C1)F)NS(=O)(=O)CC)CC=1C(=C(C=CC=1)C1=CC(=CC=C1)C)F QNKXPKLUBLEAGY-FUDKSRODSA-N 0.000 description 2
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 2
- LQZMLBORDGWNPD-UHFFFAOYSA-N N-iodosuccinimide Chemical compound IN1C(=O)CCC1=O LQZMLBORDGWNPD-UHFFFAOYSA-N 0.000 description 2
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 2
- 208000028389 Nerve injury Diseases 0.000 description 2
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 2
- YSEXMKHXIOCEJA-FVFQAYNVSA-N Nicergoline Chemical compound C([C@@H]1C[C@]2([C@H](N(C)C1)CC=1C3=C2C=CC=C3N(C)C=1)OC)OC(=O)C1=CN=CC(Br)=C1 YSEXMKHXIOCEJA-FVFQAYNVSA-N 0.000 description 2
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 2
- OZSRBVWTNPCLNR-UHFFFAOYSA-N OOB(OO)C1=CC=CC=C1 Chemical compound OOB(OO)C1=CC=CC=C1 OZSRBVWTNPCLNR-UHFFFAOYSA-N 0.000 description 2
- 108010016076 Octreotide Proteins 0.000 description 2
- 108050000742 Orexin Receptor Proteins 0.000 description 2
- 102000008834 Orexin receptor Human genes 0.000 description 2
- 208000001132 Osteoporosis Diseases 0.000 description 2
- 208000002193 Pain Diseases 0.000 description 2
- 235000005035 Panax pseudoginseng ssp. pseudoginseng Nutrition 0.000 description 2
- 235000003140 Panax quinquefolius Nutrition 0.000 description 2
- 102000003982 Parathyroid hormone Human genes 0.000 description 2
- 108090000445 Parathyroid hormone Proteins 0.000 description 2
- AHOUBRCZNHFOSL-UHFFFAOYSA-N Paroxetine hydrochloride Natural products C1=CC(F)=CC=C1C1C(COC=2C=C3OCOC3=CC=2)CNCC1 AHOUBRCZNHFOSL-UHFFFAOYSA-N 0.000 description 2
- 101150003085 Pdcl gene Proteins 0.000 description 2
- MFOCDFTXLCYLKU-CMPLNLGQSA-N Phendimetrazine Chemical compound O1CCN(C)[C@@H](C)[C@@H]1C1=CC=CC=C1 MFOCDFTXLCYLKU-CMPLNLGQSA-N 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 206010062519 Poor quality sleep Diseases 0.000 description 2
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 2
- 208000028017 Psychotic disease Diseases 0.000 description 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 2
- 208000017442 Retinal disease Diseases 0.000 description 2
- 206010038923 Retinopathy Diseases 0.000 description 2
- 206010040070 Septic Shock Diseases 0.000 description 2
- 208000013738 Sleep Initiation and Maintenance disease Diseases 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 208000005392 Spasm Diseases 0.000 description 2
- JZRWCGZRTZMZEH-UHFFFAOYSA-N Thiamine Natural products CC1=C(CCO)SC=[N+]1CC1=CN=C(C)N=C1N JZRWCGZRTZMZEH-UHFFFAOYSA-N 0.000 description 2
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 2
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 2
- 206010046543 Urinary incontinence Diseases 0.000 description 2
- GXBMIBRIOWHPDT-UHFFFAOYSA-N Vasopressin Natural products N1C(=O)C(CC=2C=C(O)C=CC=2)NC(=O)C(N)CSSCC(C(=O)N2C(CCC2)C(=O)NC(CCCN=C(N)N)C(=O)NCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(CCC(N)=O)NC(=O)C1CC1=CC=CC=C1 GXBMIBRIOWHPDT-UHFFFAOYSA-N 0.000 description 2
- 108010004977 Vasopressins Proteins 0.000 description 2
- 102000002852 Vasopressins Human genes 0.000 description 2
- DHKHKXVYLBGOIT-UHFFFAOYSA-N acetaldehyde Diethyl Acetal Natural products CCOC(C)OCC DHKHKXVYLBGOIT-UHFFFAOYSA-N 0.000 description 2
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 2
- 239000003377 acid catalyst Substances 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical compound C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 2
- 239000012190 activator Substances 0.000 description 2
- 230000001154 acute effect Effects 0.000 description 2
- 150000001262 acyl bromides Chemical class 0.000 description 2
- 150000001266 acyl halides Chemical class 0.000 description 2
- 230000032683 aging Effects 0.000 description 2
- DCSBSVSZJRSITC-UHFFFAOYSA-M alendronate sodium trihydrate Chemical compound O.O.O.[Na+].NCCCC(O)(P(O)(O)=O)P(O)([O-])=O DCSBSVSZJRSITC-UHFFFAOYSA-M 0.000 description 2
- 229960004343 alendronic acid Drugs 0.000 description 2
- 125000005194 alkoxycarbonyloxy group Chemical group 0.000 description 2
- 125000005196 alkyl carbonyloxy group Chemical group 0.000 description 2
- 125000004422 alkyl sulphonamide group Chemical group 0.000 description 2
- 230000029936 alkylation Effects 0.000 description 2
- VWYANPOOORUCFJ-UHFFFAOYSA-N alpha-Fernenol Chemical compound CC1(C)C(O)CCC2(C)C3=CCC4(C)C5CCC(C(C)C)C5(C)CCC4(C)C3CCC21 VWYANPOOORUCFJ-UHFFFAOYSA-N 0.000 description 2
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 2
- VSCWAEJMTAWNJL-UHFFFAOYSA-K aluminium trichloride Chemical compound Cl[Al](Cl)Cl VSCWAEJMTAWNJL-UHFFFAOYSA-K 0.000 description 2
- 229920003144 amino alkyl methacrylate copolymer Polymers 0.000 description 2
- 229940025084 amphetamine Drugs 0.000 description 2
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 125000002490 anilino group Chemical group [H]N(*)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 2
- ZXNRTKGTQJPIJK-UHFFFAOYSA-N aniracetam Chemical compound C1=CC(OC)=CC=C1C(=O)N1C(=O)CCC1 ZXNRTKGTQJPIJK-UHFFFAOYSA-N 0.000 description 2
- 229960000793 aniracetam Drugs 0.000 description 2
- 230000003092 anti-cytokine Effects 0.000 description 2
- 229940125713 antianxiety drug Drugs 0.000 description 2
- 229940125644 antibody drug Drugs 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- 235000006708 antioxidants Nutrition 0.000 description 2
- 239000003435 antirheumatic agent Substances 0.000 description 2
- 239000002249 anxiolytic agent Substances 0.000 description 2
- 150000003974 aralkylamines Chemical group 0.000 description 2
- KBZOIRJILGZLEJ-LGYYRGKSSA-N argipressin Chemical compound C([C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CSSC[C@@H](C(N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N1)=O)N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCN=C(N)N)C(=O)NCC(N)=O)C1=CC=CC=C1 KBZOIRJILGZLEJ-LGYYRGKSSA-N 0.000 description 2
- 125000005098 aryl alkoxy carbonyl group Chemical group 0.000 description 2
- 125000002102 aryl alkyloxo group Chemical group 0.000 description 2
- 125000004658 aryl carbonyl amino group Chemical group 0.000 description 2
- 125000005199 aryl carbonyloxy group Chemical group 0.000 description 2
- 125000005161 aryl oxy carbonyl group Chemical group 0.000 description 2
- 125000003725 azepanyl group Chemical group 0.000 description 2
- 229960000686 benzalkonium chloride Drugs 0.000 description 2
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical compound C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 description 2
- SESFRYSPDFLNCH-UHFFFAOYSA-N benzyl benzoate Chemical compound C=1C=CC=CC=1C(=O)OCC1=CC=CC=C1 SESFRYSPDFLNCH-UHFFFAOYSA-N 0.000 description 2
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 2
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 2
- 125000000051 benzyloxy group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])O* 0.000 description 2
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 2
- KQNZLOUWXSAZGD-UHFFFAOYSA-N benzylperoxymethylbenzene Chemical compound C=1C=CC=CC=1COOCC1=CC=CC=C1 KQNZLOUWXSAZGD-UHFFFAOYSA-N 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 239000003124 biologic agent Substances 0.000 description 2
- SIPUZPBQZHNSDW-UHFFFAOYSA-N bis(2-methylpropyl)aluminum Chemical compound CC(C)C[Al]CC(C)C SIPUZPBQZHNSDW-UHFFFAOYSA-N 0.000 description 2
- YNHIGQDRGKUECZ-UHFFFAOYSA-L bis(triphenylphosphine)palladium(ii) dichloride Chemical compound [Cl-].[Cl-].[Pd+2].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 YNHIGQDRGKUECZ-UHFFFAOYSA-L 0.000 description 2
- 210000001185 bone marrow Anatomy 0.000 description 2
- UORVGPXVDQYIDP-UHFFFAOYSA-N borane Chemical compound B UORVGPXVDQYIDP-UHFFFAOYSA-N 0.000 description 2
- OZVBMTJYIDMWIL-AYFBDAFISA-N bromocriptine Chemical compound C1=CC(C=2[C@H](N(C)C[C@@H](C=2)C(=O)N[C@]2(C(=O)N3[C@H](C(N4CCC[C@H]4[C@]3(O)O2)=O)CC(C)C)C(C)C)C2)=C3C2=C(Br)NC3=C1 OZVBMTJYIDMWIL-AYFBDAFISA-N 0.000 description 2
- 229960002802 bromocriptine Drugs 0.000 description 2
- RYYVLZVUVIJVGH-UHFFFAOYSA-N caffeine Chemical compound CN1C(=O)N(C)C(=O)C2=C1N=CN2C RYYVLZVUVIJVGH-UHFFFAOYSA-N 0.000 description 2
- GMRQFYUYWCNGIN-NKMMMXOESA-N calcitriol Chemical compound C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@@H](CCCC(C)(C)O)C)=C\C=C1\C[C@@H](O)C[C@H](O)C1=C GMRQFYUYWCNGIN-NKMMMXOESA-N 0.000 description 2
- 229960005084 calcitriol Drugs 0.000 description 2
- 235000020964 calcitriol Nutrition 0.000 description 2
- 239000011612 calcitriol Substances 0.000 description 2
- 239000004202 carbamide Substances 0.000 description 2
- 150000001721 carbon Chemical group 0.000 description 2
- KXDHJXZQYSOELW-UHFFFAOYSA-N carbonic acid monoamide Natural products NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 description 2
- 150000001728 carbonyl compounds Chemical class 0.000 description 2
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 2
- 125000002057 carboxymethyl group Chemical group [H]OC(=O)C([H])([H])[*] 0.000 description 2
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 2
- 229940105329 carboxymethylcellulose Drugs 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 208000026106 cerebrovascular disease Diseases 0.000 description 2
- 150000001793 charged compounds Chemical class 0.000 description 2
- 230000009920 chelation Effects 0.000 description 2
- 239000003638 chemical reducing agent Substances 0.000 description 2
- 239000000460 chlorine Substances 0.000 description 2
- 229910052801 chlorine Inorganic materials 0.000 description 2
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 201000001883 cholelithiasis Diseases 0.000 description 2
- 235000012000 cholesterol Nutrition 0.000 description 2
- 239000011280 coal tar Substances 0.000 description 2
- 239000003086 colorant Substances 0.000 description 2
- 238000006482 condensation reaction Methods 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- 125000004122 cyclic group Chemical group 0.000 description 2
- 150000001924 cycloalkanes Chemical class 0.000 description 2
- 150000001925 cycloalkenes Chemical class 0.000 description 2
- 125000000000 cycloalkoxy group Chemical group 0.000 description 2
- 125000000753 cycloalkyl group Chemical group 0.000 description 2
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- JHIVVAPYMSGYDF-UHFFFAOYSA-N cyclohexanone Chemical compound O=C1CCCCC1 JHIVVAPYMSGYDF-UHFFFAOYSA-N 0.000 description 2
- HGCIXCUEYOPUTN-UHFFFAOYSA-N cyclohexene Chemical compound C1CCC=CC1 HGCIXCUEYOPUTN-UHFFFAOYSA-N 0.000 description 2
- PAFZNILMFXTMIY-UHFFFAOYSA-N cyclohexylamine Chemical compound NC1CCCCC1 PAFZNILMFXTMIY-UHFFFAOYSA-N 0.000 description 2
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 2
- LPIQUOYDBNQMRZ-UHFFFAOYSA-N cyclopentene Chemical compound C1CC=CC1 LPIQUOYDBNQMRZ-UHFFFAOYSA-N 0.000 description 2
- PGRHXDWITVMQBC-UHFFFAOYSA-N dehydroacetic acid Chemical compound CC(=O)C1C(=O)OC(C)=CC1=O PGRHXDWITVMQBC-UHFFFAOYSA-N 0.000 description 2
- 239000003405 delayed action preparation Substances 0.000 description 2
- 235000019425 dextrin Nutrition 0.000 description 2
- 206010012601 diabetes mellitus Diseases 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- FAMRKDQNMBBFBR-BQYQJAHWSA-N diethyl azodicarboxylate Substances CCOC(=O)\N=N\C(=O)OCC FAMRKDQNMBBFBR-BQYQJAHWSA-N 0.000 description 2
- 238000000113 differential scanning calorimetry Methods 0.000 description 2
- USIUVYZYUHIAEV-UHFFFAOYSA-N diphenyl ether Chemical compound C=1C=CC=CC=1OC1=CC=CC=C1 USIUVYZYUHIAEV-UHFFFAOYSA-N 0.000 description 2
- 239000002988 disease modifying antirheumatic drug Substances 0.000 description 2
- 239000007884 disintegrant Substances 0.000 description 2
- ADEBPBSSDYVVLD-UHFFFAOYSA-N donepezil Chemical compound O=C1C=2C=C(OC)C(OC)=CC=2CC1CC(CC1)CCN1CC1=CC=CC=C1 ADEBPBSSDYVVLD-UHFFFAOYSA-N 0.000 description 2
- 239000003136 dopamine receptor stimulating agent Substances 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- WSEQXVZVJXJVFP-FQEVSTJZSA-N escitalopram Chemical compound C1([C@]2(C3=CC=C(C=C3CO2)C#N)CCCN(C)C)=CC=C(F)C=C1 WSEQXVZVJXJVFP-FQEVSTJZSA-N 0.000 description 2
- 229960004341 escitalopram Drugs 0.000 description 2
- XLZLNCSZYWPDRJ-UHFFFAOYSA-N ethanesulfonamide;hydrochloride Chemical compound Cl.CCS(N)(=O)=O XLZLNCSZYWPDRJ-UHFFFAOYSA-N 0.000 description 2
- SUZFLJNYNVWABG-UHFFFAOYSA-N ethyl 4-amino-2,2-difluoro-5-(2-fluoro-3-phenylphenyl)-3-hydroxypentanoate hydrochloride Chemical compound Cl.NC(C(C(C(=O)OCC)(F)F)O)CC=1C(=C(C=CC=1)C1=CC=CC=C1)F SUZFLJNYNVWABG-UHFFFAOYSA-N 0.000 description 2
- RIFGWPKJUGCATF-UHFFFAOYSA-N ethyl chloroformate Chemical compound CCOC(Cl)=O RIFGWPKJUGCATF-UHFFFAOYSA-N 0.000 description 2
- FAMRKDQNMBBFBR-UHFFFAOYSA-N ethyl n-ethoxycarbonyliminocarbamate Chemical compound CCOC(=O)N=NC(=O)OCC FAMRKDQNMBBFBR-UHFFFAOYSA-N 0.000 description 2
- 125000004705 ethylthio group Chemical group C(C)S* 0.000 description 2
- 230000029142 excretion Effects 0.000 description 2
- 235000003599 food sweetener Nutrition 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 125000002541 furyl group Chemical group 0.000 description 2
- ASUTZQLVASHGKV-JDFRZJQESA-N galanthamine Chemical compound O1C(=C23)C(OC)=CC=C2CN(C)CC[C@]23[C@@H]1C[C@@H](O)C=C2 ASUTZQLVASHGKV-JDFRZJQESA-N 0.000 description 2
- 210000004211 gastric acid Anatomy 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 238000001415 gene therapy Methods 0.000 description 2
- 235000008434 ginseng Nutrition 0.000 description 2
- 230000004153 glucose metabolism Effects 0.000 description 2
- 150000004676 glycans Chemical class 0.000 description 2
- 150000004795 grignard reagents Chemical class 0.000 description 2
- 239000003102 growth factor Substances 0.000 description 2
- 230000002140 halogenating effect Effects 0.000 description 2
- 229960003878 haloperidol Drugs 0.000 description 2
- 231100000869 headache Toxicity 0.000 description 2
- 208000019622 heart disease Diseases 0.000 description 2
- 125000003707 hexyloxy group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])O* 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- 150000004677 hydrates Chemical class 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- USZLCYNVCCDPLQ-UHFFFAOYSA-N hydron;n-methoxymethanamine;chloride Chemical compound Cl.CNOC USZLCYNVCCDPLQ-UHFFFAOYSA-N 0.000 description 2
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 2
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 2
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 2
- CBFCDTFDPHXCNY-UHFFFAOYSA-N icosane Chemical compound CCCCCCCCCCCCCCCCCCCC CBFCDTFDPHXCNY-UHFFFAOYSA-N 0.000 description 2
- 125000005945 imidazopyridyl group Chemical group 0.000 description 2
- 229960000905 indomethacin Drugs 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 206010022437 insomnia Diseases 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- 239000011630 iodine Substances 0.000 description 2
- JEIPFZHSYJVQDO-UHFFFAOYSA-N iron(III) oxide Inorganic materials O=[Fe]O[Fe]=O JEIPFZHSYJVQDO-UHFFFAOYSA-N 0.000 description 2
- KQNPFQTWMSNSAP-UHFFFAOYSA-N isobutyric acid Chemical compound CC(C)C(O)=O KQNPFQTWMSNSAP-UHFFFAOYSA-N 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 2
- ZLTPDFXIESTBQG-UHFFFAOYSA-N isothiazole Chemical compound C=1C=NSC=1 ZLTPDFXIESTBQG-UHFFFAOYSA-N 0.000 description 2
- 239000007951 isotonicity adjuster Substances 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- PYZRQGJRPPTADH-UHFFFAOYSA-N lamotrigine Chemical compound NC1=NC(N)=NN=C1C1=CC=CC(Cl)=C1Cl PYZRQGJRPPTADH-UHFFFAOYSA-N 0.000 description 2
- 229960001848 lamotrigine Drugs 0.000 description 2
- 238000004811 liquid chromatography Methods 0.000 description 2
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 2
- AMXOYNBUYSYVKV-UHFFFAOYSA-M lithium bromide Chemical compound [Li+].[Br-] AMXOYNBUYSYVKV-UHFFFAOYSA-M 0.000 description 2
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 2
- ZCSHNCUQKCANBX-UHFFFAOYSA-N lithium diisopropylamide Chemical compound [Li+].CC(C)[N-]C(C)C ZCSHNCUQKCANBX-UHFFFAOYSA-N 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 208000024714 major depressive disease Diseases 0.000 description 2
- NUJOXMJBOLGQSY-UHFFFAOYSA-N manganese dioxide Chemical compound O=[Mn]=O NUJOXMJBOLGQSY-UHFFFAOYSA-N 0.000 description 2
- LULAYUGMBFYYEX-UHFFFAOYSA-N metachloroperbenzoic acid Natural products OC(=O)C1=CC=CC(Cl)=C1 LULAYUGMBFYYEX-UHFFFAOYSA-N 0.000 description 2
- 229940117841 methacrylic acid copolymer Drugs 0.000 description 2
- 229920003145 methacrylic acid copolymer Polymers 0.000 description 2
- 229960001252 methamphetamine Drugs 0.000 description 2
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 2
- USJUUYYGHABIBU-UHFFFAOYSA-N methanesulfonamide;hydrochloride Chemical compound Cl.CS(N)(=O)=O USJUUYYGHABIBU-UHFFFAOYSA-N 0.000 description 2
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 2
- 229920000609 methyl cellulose Polymers 0.000 description 2
- 239000001923 methylcellulose Substances 0.000 description 2
- 235000010981 methylcellulose Nutrition 0.000 description 2
- 229960002900 methylcellulose Drugs 0.000 description 2
- 125000002816 methylsulfanyl group Chemical group [H]C([H])([H])S[*] 0.000 description 2
- 239000003094 microcapsule Substances 0.000 description 2
- 238000010172 mouse model Methods 0.000 description 2
- 201000006417 multiple sclerosis Diseases 0.000 description 2
- 208000029766 myalgic encephalomeyelitis/chronic fatigue syndrome Diseases 0.000 description 2
- XBXCNNQPRYLIDE-UHFFFAOYSA-M n-tert-butylcarbamate Chemical compound CC(C)(C)NC([O-])=O XBXCNNQPRYLIDE-UHFFFAOYSA-M 0.000 description 2
- 238000005648 named reaction Methods 0.000 description 2
- 230000008764 nerve damage Effects 0.000 description 2
- 230000000926 neurological effect Effects 0.000 description 2
- 229960003642 nicergoline Drugs 0.000 description 2
- 229910017604 nitric acid Inorganic materials 0.000 description 2
- 108020004707 nucleic acids Proteins 0.000 description 2
- 150000007523 nucleic acids Chemical class 0.000 description 2
- 102000039446 nucleic acids Human genes 0.000 description 2
- 238000010534 nucleophilic substitution reaction Methods 0.000 description 2
- 229960002700 octreotide Drugs 0.000 description 2
- OHOWSYIKESXDMN-WMQZXSDYSA-N orexin-b Chemical compound C([C@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)CNC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@@H](N)CCSC)[C@@H](C)O)[C@@H](C)CC)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)NCC(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CCCN=C(N)N)C(N)=O)C1=CNC=N1 OHOWSYIKESXDMN-WMQZXSDYSA-N 0.000 description 2
- 229960004570 oxprenolol Drugs 0.000 description 2
- 230000036407 pain Effects 0.000 description 2
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 2
- 208000019906 panic disease Diseases 0.000 description 2
- 239000000199 parathyroid hormone Substances 0.000 description 2
- 229960001319 parathyroid hormone Drugs 0.000 description 2
- 229960002296 paroxetine Drugs 0.000 description 2
- 229960000436 phendimetrazine Drugs 0.000 description 2
- DHHVAGZRUROJKS-UHFFFAOYSA-N phentermine Chemical compound CC(C)(N)CC1=CC=CC=C1 DHHVAGZRUROJKS-UHFFFAOYSA-N 0.000 description 2
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 description 2
- 125000004344 phenylpropyl group Chemical group 0.000 description 2
- 239000002571 phosphodiesterase inhibitor Substances 0.000 description 2
- 125000005499 phosphonyl group Chemical group 0.000 description 2
- CYQAYERJWZKYML-UHFFFAOYSA-N phosphorus pentasulfide Chemical compound S1P(S2)(=S)SP3(=S)SP1(=S)SP2(=S)S3 CYQAYERJWZKYML-UHFFFAOYSA-N 0.000 description 2
- FAIAAWCVCHQXDN-UHFFFAOYSA-N phosphorus trichloride Chemical class ClP(Cl)Cl FAIAAWCVCHQXDN-UHFFFAOYSA-N 0.000 description 2
- 230000026731 phosphorylation Effects 0.000 description 2
- 238000006366 phosphorylation reaction Methods 0.000 description 2
- XNGIFLGASWRNHJ-UHFFFAOYSA-N phthalic acid Chemical compound OC(=O)C1=CC=CC=C1C(O)=O XNGIFLGASWRNHJ-UHFFFAOYSA-N 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- IUGYQRQAERSCNH-UHFFFAOYSA-N pivalic acid Chemical compound CC(C)(C)C(O)=O IUGYQRQAERSCNH-UHFFFAOYSA-N 0.000 description 2
- 229920000058 polyacrylate Polymers 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 229920001282 polysaccharide Polymers 0.000 description 2
- 239000005017 polysaccharide Substances 0.000 description 2
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 2
- CHKVPAROMQMJNQ-UHFFFAOYSA-M potassium bisulfate Chemical compound [K+].OS([O-])(=O)=O CHKVPAROMQMJNQ-UHFFFAOYSA-M 0.000 description 2
- 229910000343 potassium bisulfate Inorganic materials 0.000 description 2
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 2
- 235000010259 potassium hydrogen sulphite Nutrition 0.000 description 2
- 238000000634 powder X-ray diffraction Methods 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- VVWRJUBEIPHGQF-UHFFFAOYSA-N propan-2-yl n-propan-2-yloxycarbonyliminocarbamate Chemical compound CC(C)OC(=O)N=NC(=O)OC(C)C VVWRJUBEIPHGQF-UHFFFAOYSA-N 0.000 description 2
- QLNJFJADRCOGBJ-UHFFFAOYSA-N propionamide Chemical group CCC(N)=O QLNJFJADRCOGBJ-UHFFFAOYSA-N 0.000 description 2
- 229960003712 propranolol Drugs 0.000 description 2
- 208000020016 psychiatric disease Diseases 0.000 description 2
- 125000002755 pyrazolinyl group Chemical group 0.000 description 2
- 125000005554 pyridyloxy group Chemical group 0.000 description 2
- 125000000714 pyrimidinyl group Chemical group 0.000 description 2
- NYCVCXMSZNOGDH-UHFFFAOYSA-N pyrrolidine-1-carboxylic acid Chemical compound OC(=O)N1CCCC1 NYCVCXMSZNOGDH-UHFFFAOYSA-N 0.000 description 2
- XSCHRSMBECNVNS-UHFFFAOYSA-N quinoxaline Chemical compound N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 description 2
- 239000000700 radioactive tracer Substances 0.000 description 2
- 230000035484 reaction time Effects 0.000 description 2
- 238000001953 recrystallisation Methods 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 201000000980 schizophrenia Diseases 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- 229940125723 sedative agent Drugs 0.000 description 2
- 239000000932 sedative agent Substances 0.000 description 2
- MEZLKOACVSPNER-GFCCVEGCSA-N selegiline Chemical compound C#CCN(C)[C@H](C)CC1=CC=CC=C1 MEZLKOACVSPNER-GFCCVEGCSA-N 0.000 description 2
- JPJALAQPGMAKDF-UHFFFAOYSA-N selenium dioxide Chemical compound O=[Se]=O JPJALAQPGMAKDF-UHFFFAOYSA-N 0.000 description 2
- 230000036303 septic shock Effects 0.000 description 2
- QZAYGJVTTNCVMB-UHFFFAOYSA-N serotonin Chemical compound C1=C(O)C=C2C(CCN)=CNC2=C1 QZAYGJVTTNCVMB-UHFFFAOYSA-N 0.000 description 2
- 229960002073 sertraline Drugs 0.000 description 2
- VGKDLMBJGBXTGI-SJCJKPOMSA-N sertraline Chemical compound C1([C@@H]2CC[C@@H](C3=CC=CC=C32)NC)=CC=C(Cl)C(Cl)=C1 VGKDLMBJGBXTGI-SJCJKPOMSA-N 0.000 description 2
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 2
- 235000012239 silicon dioxide Nutrition 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 2
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 2
- BEOOHQFXGBMRKU-UHFFFAOYSA-N sodium cyanoborohydride Chemical compound [Na+].[B-]C#N BEOOHQFXGBMRKU-UHFFFAOYSA-N 0.000 description 2
- 229960003928 sodium oxybate Drugs 0.000 description 2
- JQWHASGSAFIOCM-UHFFFAOYSA-M sodium periodate Chemical compound [Na+].[O-]I(=O)(=O)=O JQWHASGSAFIOCM-UHFFFAOYSA-M 0.000 description 2
- 239000012453 solvate Substances 0.000 description 2
- 238000000638 solvent extraction Methods 0.000 description 2
- 229960002920 sorbitol Drugs 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 208000011117 substance-related disease Diseases 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 238000009495 sugar coating Methods 0.000 description 2
- IIACRCGMVDHOTQ-UHFFFAOYSA-N sulfamic acid group Chemical group S(N)(O)(=O)=O IIACRCGMVDHOTQ-UHFFFAOYSA-N 0.000 description 2
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 2
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 2
- 239000000375 suspending agent Substances 0.000 description 2
- 239000003765 sweetening agent Substances 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 235000012222 talc Nutrition 0.000 description 2
- DYHSDKLCOJIUFX-UHFFFAOYSA-N tert-butoxycarbonyl anhydride Chemical compound CC(C)(C)OC(=O)OC(=O)OC(C)(C)C DYHSDKLCOJIUFX-UHFFFAOYSA-N 0.000 description 2
- XKXIQBVKMABYQJ-UHFFFAOYSA-M tert-butyl carbonate Chemical compound CC(C)(C)OC([O-])=O XKXIQBVKMABYQJ-UHFFFAOYSA-M 0.000 description 2
- CIHOLLKRGTVIJN-UHFFFAOYSA-N tert‐butyl hydroperoxide Chemical compound CC(C)(C)OO CIHOLLKRGTVIJN-UHFFFAOYSA-N 0.000 description 2
- HJUGFYREWKUQJT-UHFFFAOYSA-N tetrabromomethane Chemical compound BrC(Br)(Br)Br HJUGFYREWKUQJT-UHFFFAOYSA-N 0.000 description 2
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 2
- 125000004853 tetrahydropyridinyl group Chemical group N1(CCCC=C1)* 0.000 description 2
- DLYUQMMRRRQYAE-UHFFFAOYSA-N tetraphosphorus decaoxide Chemical compound O1P(O2)(=O)OP3(=O)OP1(=O)OP2(=O)O3 DLYUQMMRRRQYAE-UHFFFAOYSA-N 0.000 description 2
- 235000019157 thiamine Nutrition 0.000 description 2
- 229960003495 thiamine Drugs 0.000 description 2
- 239000011721 thiamine Substances 0.000 description 2
- 238000005936 thiocarbonylation reaction Methods 0.000 description 2
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 2
- 229930192474 thiophene Natural products 0.000 description 2
- KJAMZCVTJDTESW-UHFFFAOYSA-N tiracizine Chemical compound C1CC2=CC=CC=C2N(C(=O)CN(C)C)C2=CC(NC(=O)OCC)=CC=C21 KJAMZCVTJDTESW-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 238000002054 transplantation Methods 0.000 description 2
- 150000003852 triazoles Chemical class 0.000 description 2
- 125000001425 triazolyl group Chemical group 0.000 description 2
- BDZBKCUKTQZUTL-UHFFFAOYSA-N triethyl phosphite Chemical compound CCOP(OCC)OCC BDZBKCUKTQZUTL-UHFFFAOYSA-N 0.000 description 2
- XQKBFQXWZCFNFF-UHFFFAOYSA-K triiodosamarium Chemical compound I[Sm](I)I XQKBFQXWZCFNFF-UHFFFAOYSA-K 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- CSRZQMIRAZTJOY-UHFFFAOYSA-N trimethylsilyl iodide Chemical compound C[Si](C)(C)I CSRZQMIRAZTJOY-UHFFFAOYSA-N 0.000 description 2
- 229960003726 vasopressin Drugs 0.000 description 2
- 229920002554 vinyl polymer Polymers 0.000 description 2
- JIAARYAFYJHUJI-UHFFFAOYSA-L zinc dichloride Chemical compound [Cl-].[Cl-].[Zn+2] JIAARYAFYJHUJI-UHFFFAOYSA-L 0.000 description 2
- UAYWVJHJZHQCIE-UHFFFAOYSA-L zinc iodide Chemical compound I[Zn]I UAYWVJHJZHQCIE-UHFFFAOYSA-L 0.000 description 2
- AIFRHYZBTHREPW-UHFFFAOYSA-N β-carboline Chemical compound N1=CC=C2C3=CC=CC=C3NC2=C1 AIFRHYZBTHREPW-UHFFFAOYSA-N 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- DBGIVFWFUFKIQN-UHFFFAOYSA-N (+-)-Fenfluramine Chemical compound CCNC(C)CC1=CC=CC(C(F)(F)F)=C1 DBGIVFWFUFKIQN-UHFFFAOYSA-N 0.000 description 1
- GRGNZYAYCNHDAH-UHFFFAOYSA-N (1-chloro-2-methylpropyl) acetate Chemical compound CC(C)C(Cl)OC(C)=O GRGNZYAYCNHDAH-UHFFFAOYSA-N 0.000 description 1
- PROQIPRRNZUXQM-UHFFFAOYSA-N (16alpha,17betaOH)-Estra-1,3,5(10)-triene-3,16,17-triol Natural products OC1=CC=C2C3CCC(C)(C(C(O)C4)O)C4C3CCC2=C1 PROQIPRRNZUXQM-UHFFFAOYSA-N 0.000 description 1
- BKPRVQDIOGQWTG-FKXFVUDVSA-N (1r,2s)-2-phenylcyclopropan-1-amine;sulfuric acid Chemical compound OS(O)(=O)=O.N[C@@H]1C[C@H]1C1=CC=CC=C1.N[C@@H]1C[C@H]1C1=CC=CC=C1 BKPRVQDIOGQWTG-FKXFVUDVSA-N 0.000 description 1
- KSDDQEGWVBODMD-OULINLAESA-N (2S)-2-[[(2S,3S)-2-[[(2S)-2-[[(2S)-6-amino-2-[[(2S)-2-[[(2S,3R)-2-[[(2S)-6-amino-2-[[(2S)-4-amino-2-[[(2S)-4-amino-2-[[(2S)-2-[[(2S,3S)-2-[[(2S)-2-[[(2S)-6-amino-2-[[(2S,3R)-2-[[(2S)-2-[[(2S)-2-[[(2S)-6-amino-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2R)-2-amino-3-sulfanylpropanoyl]amino]-4-carboxybutanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]-3-methylbutanoyl]amino]hexanoyl]amino]-4-carboxybutanoyl]amino]-3-methylbutanoyl]amino]-3-hydroxybutanoyl]amino]hexanoyl]amino]-4-methylpentanoyl]amino]-3-methylpentanoyl]amino]-3-carboxypropanoyl]amino]-4-oxobutanoyl]amino]-4-oxobutanoyl]amino]hexanoyl]amino]-3-hydroxybutanoyl]amino]-4-carboxybutanoyl]amino]hexanoyl]amino]-4-carboxybutanoyl]amino]-3-methylpentanoyl]amino]-4-methylpentanoic acid Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCCN)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CS)CC1=CC=CC=C1 KSDDQEGWVBODMD-OULINLAESA-N 0.000 description 1
- IGXZIDSYQVPGPG-JTQLQIEISA-N (2S)-3-(3-chloro-2-fluorophenyl)-2-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound C(C)(C)(C)OC(=O)N[C@@H](CC1=C(C(=CC=C1)Cl)F)C(=O)O IGXZIDSYQVPGPG-JTQLQIEISA-N 0.000 description 1
- VLPIATFUUWWMKC-SNVBAGLBSA-N (2r)-1-(2,6-dimethylphenoxy)propan-2-amine Chemical compound C[C@@H](N)COC1=C(C)C=CC=C1C VLPIATFUUWWMKC-SNVBAGLBSA-N 0.000 description 1
- CGTZMJIMMUNLQD-STYNFMPRSA-N (2r)-2-[(r)-(2-ethoxyphenoxy)-phenylmethyl]morpholine;methanesulfonic acid Chemical compound CS(O)(=O)=O.CCOC1=CC=CC=C1O[C@H](C=1C=CC=CC=1)[C@@H]1OCCNC1 CGTZMJIMMUNLQD-STYNFMPRSA-N 0.000 description 1
- RCZHBTHQISEPPP-NSHDSACASA-N (2s)-3-(3-chlorophenyl)-2-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](C(O)=O)CC1=CC=CC(Cl)=C1 RCZHBTHQISEPPP-NSHDSACASA-N 0.000 description 1
- MQSMWZHHUGSULF-QNGWXLTQSA-N (2s)-n-benzyl-3-(4-chlorophenyl)-n-(1,5-dipyridin-4-ylpentan-3-yl)-2-[methyl-[2-oxo-2-(3,4,5-trimethoxyphenyl)acetyl]amino]propanamide Chemical compound COC1=C(OC)C(OC)=CC(C(=O)C(=O)N(C)[C@@H](CC=2C=CC(Cl)=CC=2)C(=O)N(CC=2C=CC=CC=2)C(CCC=2C=CN=CC=2)CCC=2C=CN=CC=2)=C1 MQSMWZHHUGSULF-QNGWXLTQSA-N 0.000 description 1
- OOBHFESNSZDWIU-GXSJLCMTSA-N (2s,3s)-3-methyl-2-phenylmorpholine Chemical compound C[C@@H]1NCCO[C@H]1C1=CC=CC=C1 OOBHFESNSZDWIU-GXSJLCMTSA-N 0.000 description 1
- SCVHJVCATBPIHN-SJCJKPOMSA-N (3s)-3-[[(2s)-2-[[2-(2-tert-butylanilino)-2-oxoacetyl]amino]propanoyl]amino]-4-oxo-5-(2,3,5,6-tetrafluorophenoxy)pentanoic acid Chemical compound N([C@@H](C)C(=O)N[C@@H](CC(O)=O)C(=O)COC=1C(=C(F)C=C(F)C=1F)F)C(=O)C(=O)NC1=CC=CC=C1C(C)(C)C SCVHJVCATBPIHN-SJCJKPOMSA-N 0.000 description 1
- CUKWUWBLQQDQAC-VEQWQPCFSA-N (3s)-3-amino-4-[[(2s)-1-[[(2s)-1-[[(2s)-1-[[(2s,3s)-1-[[(2s)-1-[(2s)-2-[[(1s)-1-carboxyethyl]carbamoyl]pyrrolidin-1-yl]-3-(1h-imidazol-5-yl)-1-oxopropan-2-yl]amino]-3-methyl-1-oxopentan-2-yl]amino]-3-(4-hydroxyphenyl)-1-oxopropan-2-yl]amino]-3-methyl-1-ox Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C)C(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@@H](N)CC(O)=O)C(C)C)C1=CC=C(O)C=C1 CUKWUWBLQQDQAC-VEQWQPCFSA-N 0.000 description 1
- DIWRORZWFLOCLC-HNNXBMFYSA-N (3s)-7-chloro-5-(2-chlorophenyl)-3-hydroxy-1,3-dihydro-1,4-benzodiazepin-2-one Chemical compound N([C@H](C(NC1=CC=C(Cl)C=C11)=O)O)=C1C1=CC=CC=C1Cl DIWRORZWFLOCLC-HNNXBMFYSA-N 0.000 description 1
- NIOCOJFPGCXNKL-ZKZXETMPSA-N (4s)-4-amino-5-[[(2s)-1-[[(2s)-4-amino-1-[[(4s,5s,7r)-8-[[(2s)-1-[[(2s)-4-carboxy-1-[[(1s)-1-carboxy-2-phenylethyl]amino]-1-oxobutan-2-yl]amino]-1-oxopropan-2-yl]amino]-5-hydroxy-2,7-dimethyl-8-oxooctan-4-yl]amino]-1,4-dioxobutan-2-yl]amino]-3-methyl-1-ox Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)[C@@H](O)C[C@@H](C)C(=O)N[C@@H](C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 NIOCOJFPGCXNKL-ZKZXETMPSA-N 0.000 description 1
- 125000006624 (C1-C6) alkoxycarbonylamino group Chemical group 0.000 description 1
- 125000004738 (C1-C6) alkyl sulfinyl group Chemical group 0.000 description 1
- RJDJXOBGMMKPMH-GGWOSOGESA-N (E,E)-di-1-propenyl sulfide Chemical compound C\C=C\S\C=C\C RJDJXOBGMMKPMH-GGWOSOGESA-N 0.000 description 1
- MIOPJNTWMNEORI-GMSGAONNSA-N (S)-camphorsulfonic acid Chemical compound C1C[C@@]2(CS(O)(=O)=O)C(=O)C[C@@H]1C2(C)C MIOPJNTWMNEORI-GMSGAONNSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- YYVPSKOETWTUHH-UHFFFAOYSA-N (hydroxyamino)azanium chloride Chemical compound [Cl-].[NH3+]NO YYVPSKOETWTUHH-UHFFFAOYSA-N 0.000 description 1
- JPJGNZQDELRZGE-UHFFFAOYSA-N (phenyl-$l^{2}-phosphanyl)benzene Chemical compound C=1C=CC=CC=1[P]C1=CC=CC=C1 JPJGNZQDELRZGE-UHFFFAOYSA-N 0.000 description 1
- LRGZZEOWQURWFK-UHFFFAOYSA-N 1,2,3,4,4a,5,6,7-octahydroisoquinoline Chemical compound C1NCCC2CCCC=C21 LRGZZEOWQURWFK-UHFFFAOYSA-N 0.000 description 1
- ZCZVGQCBSJLDDS-UHFFFAOYSA-N 1,2,3,4-tetrahydro-1,8-naphthyridine Chemical compound C1=CC=C2CCCNC2=N1 ZCZVGQCBSJLDDS-UHFFFAOYSA-N 0.000 description 1
- WXRSSOIHEAVYLL-UHFFFAOYSA-N 1,2,3,4-tetrahydrocinnoline Chemical compound C1=CC=C2NNCCC2=C1 WXRSSOIHEAVYLL-UHFFFAOYSA-N 0.000 description 1
- PKORYTIUMAOPED-UHFFFAOYSA-N 1,2,3,4-tetrahydroquinazoline Chemical compound C1=CC=C2NCNCC2=C1 PKORYTIUMAOPED-UHFFFAOYSA-N 0.000 description 1
- HORKYAIEVBUXGM-UHFFFAOYSA-N 1,2,3,4-tetrahydroquinoxaline Chemical compound C1=CC=C2NCCNC2=C1 HORKYAIEVBUXGM-UHFFFAOYSA-N 0.000 description 1
- YGTAZGSLCXNBQL-UHFFFAOYSA-N 1,2,4-thiadiazole Chemical compound C=1N=CSN=1 YGTAZGSLCXNBQL-UHFFFAOYSA-N 0.000 description 1
- 125000004514 1,2,4-thiadiazolyl group Chemical group 0.000 description 1
- CSNIZNHTOVFARY-UHFFFAOYSA-N 1,2-benzothiazole Chemical compound C1=CC=C2C=NSC2=C1 CSNIZNHTOVFARY-UHFFFAOYSA-N 0.000 description 1
- CZSRXHJVZUBEGW-UHFFFAOYSA-N 1,2-thiazolidine Chemical compound C1CNSC1 CZSRXHJVZUBEGW-UHFFFAOYSA-N 0.000 description 1
- MJGPTHPXMVMHPS-UHFFFAOYSA-N 1,3,2-dioxathietan-4-one Chemical group O=C1OSO1 MJGPTHPXMVMHPS-UHFFFAOYSA-N 0.000 description 1
- MBIZXFATKUQOOA-UHFFFAOYSA-N 1,3,4-thiadiazole Chemical compound C1=NN=CS1 MBIZXFATKUQOOA-UHFFFAOYSA-N 0.000 description 1
- 125000004520 1,3,4-thiadiazolyl group Chemical group 0.000 description 1
- HFKNFDVVPTZQKR-UHFFFAOYSA-N 1,3-difluoro-5-(2-fluorophenyl)benzene Chemical compound FC1=CC(F)=CC(C=2C(=CC=CC=2)F)=C1 HFKNFDVVPTZQKR-UHFFFAOYSA-N 0.000 description 1
- OGYGFUAIIOPWQD-UHFFFAOYSA-N 1,3-thiazolidine Chemical compound C1CSCN1 OGYGFUAIIOPWQD-UHFFFAOYSA-N 0.000 description 1
- YNGDWRXWKFWCJY-UHFFFAOYSA-N 1,4-Dihydropyridine Chemical compound C1C=CNC=C1 YNGDWRXWKFWCJY-UHFFFAOYSA-N 0.000 description 1
- FLBAYUMRQUHISI-UHFFFAOYSA-N 1,8-naphthyridine Chemical compound N1=CC=CC2=CC=CN=C21 FLBAYUMRQUHISI-UHFFFAOYSA-N 0.000 description 1
- HYILLTADABKYHO-UHFFFAOYSA-N 1-(bromomethyl)-3-chloro-2-fluorobenzene Chemical compound FC1=C(Cl)C=CC=C1CBr HYILLTADABKYHO-UHFFFAOYSA-N 0.000 description 1
- YMMPTOIBWMCFAQ-UHFFFAOYSA-N 1-N'-butyl-2-[dimethylamino(ethyl)amino]-2-N'-ethyl-2-N-methyl-1-N"-propan-2-yl-1-N-propylethane-1,1,1,2,2-pentamine Chemical compound CNC(C(NCCCC)(NC(C)C)NCCC)(N(CC)N(C)C)NCC YMMPTOIBWMCFAQ-UHFFFAOYSA-N 0.000 description 1
- WIHMBLDNRMIGDW-UHFFFAOYSA-N 1-[3-(dimethylamino)propyl]-1-(4-fluorophenyl)-3h-2-benzofuran-5-carbonitrile;hydron;bromide Chemical compound [Br-].O1CC2=CC(C#N)=CC=C2C1(CCC[NH+](C)C)C1=CC=C(F)C=C1 WIHMBLDNRMIGDW-UHFFFAOYSA-N 0.000 description 1
- GNIFCOAVDWXENW-UHFFFAOYSA-N 1-[6-[[4-(4-methoxyphenyl)phenyl]methoxy]-1,2,3,4-tetrahydronaphthalen-2-yl]-n,n-dimethylmethanamine Chemical compound C1=CC(OC)=CC=C1C(C=C1)=CC=C1COC1=CC=C(CC(CN(C)C)CC2)C2=C1 GNIFCOAVDWXENW-UHFFFAOYSA-N 0.000 description 1
- MGVHFTWDCYIBDO-UHFFFAOYSA-N 1-bromo-3-(bromomethyl)-2-fluorobenzene Chemical compound FC1=C(Br)C=CC=C1CBr MGVHFTWDCYIBDO-UHFFFAOYSA-N 0.000 description 1
- 125000004973 1-butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000004972 1-butynyl group Chemical group [H]C([H])([H])C([H])([H])C#C* 0.000 description 1
- JMLWXCJXOYDXRN-UHFFFAOYSA-N 1-chloro-3-iodobenzene Chemical compound ClC1=CC=CC(I)=C1 JMLWXCJXOYDXRN-UHFFFAOYSA-N 0.000 description 1
- YHLKQHLUHLSVQW-UHFFFAOYSA-N 1-fluoro-2-(3-fluorophenyl)benzene Chemical compound FC1=CC=CC(C=2C(=CC=CC=2)F)=C1 YHLKQHLUHLSVQW-UHFFFAOYSA-N 0.000 description 1
- BMVXCPBXGZKUPN-UHFFFAOYSA-N 1-hexanamine Chemical compound CCCCCCN BMVXCPBXGZKUPN-UHFFFAOYSA-N 0.000 description 1
- 125000006039 1-hexenyl group Chemical group 0.000 description 1
- XCBNHDSVRQZWLH-UHFFFAOYSA-N 1-hydroxycyclobutane-1-carboxylic acid Chemical compound OC(=O)C1(O)CCC1 XCBNHDSVRQZWLH-UHFFFAOYSA-N 0.000 description 1
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- MPCDPVOFJRZVER-UHFFFAOYSA-N 1-pent-2-enylsulfanylpent-2-ene Chemical compound CCC=CCSCC=CCC MPCDPVOFJRZVER-UHFFFAOYSA-N 0.000 description 1
- 125000006023 1-pentenyl group Chemical group 0.000 description 1
- 125000006017 1-propenyl group Chemical group 0.000 description 1
- 125000000530 1-propynyl group Chemical group [H]C([H])([H])C#C* 0.000 description 1
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 description 1
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 1
- BAXOFTOLAUCFNW-UHFFFAOYSA-N 1H-indazole Chemical compound C1=CC=C2C=NNC2=C1 BAXOFTOLAUCFNW-UHFFFAOYSA-N 0.000 description 1
- 125000005955 1H-indazolyl group Chemical group 0.000 description 1
- SVUOLADPCWQTTE-UHFFFAOYSA-N 1h-1,2-benzodiazepine Chemical compound N1N=CC=CC2=CC=CC=C12 SVUOLADPCWQTTE-UHFFFAOYSA-N 0.000 description 1
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- MEKOFIRRDATTAG-UHFFFAOYSA-N 2,2,5,8-tetramethyl-3,4-dihydrochromen-6-ol Chemical compound C1CC(C)(C)OC2=C1C(C)=C(O)C=C2C MEKOFIRRDATTAG-UHFFFAOYSA-N 0.000 description 1
- LTMRRSWNXVJMBA-UHFFFAOYSA-L 2,2-diethylpropanedioate Chemical compound CCC(CC)(C([O-])=O)C([O-])=O LTMRRSWNXVJMBA-UHFFFAOYSA-L 0.000 description 1
- DKASUYIOUPPQSY-UHFFFAOYSA-N 2,3,3a,4-tetrahydrothieno[2,3-c]pyridine Chemical compound C1C=NC=C2SCCC21 DKASUYIOUPPQSY-UHFFFAOYSA-N 0.000 description 1
- MZBVNYACSSGXID-UHFFFAOYSA-N 2,3,4,5-tetrahydro-1h-1-benzazepine Chemical compound N1CCCCC2=CC=CC=C21 MZBVNYACSSGXID-UHFFFAOYSA-N 0.000 description 1
- CFTOTSJVQRFXOF-UHFFFAOYSA-N 2,3,4,9-tetrahydro-1H-pyrido[3,4-b]indole Chemical compound N1C2=CC=CC=C2C2=C1CNCC2 CFTOTSJVQRFXOF-UHFFFAOYSA-N 0.000 description 1
- XKLNOVWDVMWTOB-UHFFFAOYSA-N 2,3,4,9-tetrahydro-1h-carbazole Chemical compound N1C2=CC=CC=C2C2=C1CCCC2 XKLNOVWDVMWTOB-UHFFFAOYSA-N 0.000 description 1
- ZMJBHCIEMIVIFZ-UHFFFAOYSA-N 2,3-dimethylthiirane Chemical compound CC1SC1C ZMJBHCIEMIVIFZ-UHFFFAOYSA-N 0.000 description 1
- HFFXLYHRNRKAPM-UHFFFAOYSA-N 2,4,5-trichloro-n-(5-methyl-1,2-oxazol-3-yl)benzenesulfonamide Chemical compound O1C(C)=CC(NS(=O)(=O)C=2C(=CC(Cl)=C(Cl)C=2)Cl)=N1 HFFXLYHRNRKAPM-UHFFFAOYSA-N 0.000 description 1
- DUDRAKXAVJKRHA-UHFFFAOYSA-N 2,4-disulfido-1,3,2,4-dithiadiphosphetane-2,4-diium Chemical group S=P1SP(=S)S1 DUDRAKXAVJKRHA-UHFFFAOYSA-N 0.000 description 1
- YFTHTJAPODJVSL-UHFFFAOYSA-N 2-(1-benzothiophen-5-yl)-4,4,5,5-tetramethyl-1,3,2-dioxaborolane Chemical compound O1C(C)(C)C(C)(C)OB1C1=CC=C(SC=C2)C2=C1 YFTHTJAPODJVSL-UHFFFAOYSA-N 0.000 description 1
- XNWFRZJHXBZDAG-UHFFFAOYSA-N 2-METHOXYETHANOL Chemical compound COCCO XNWFRZJHXBZDAG-UHFFFAOYSA-N 0.000 description 1
- IMSODMZESSGVBE-UHFFFAOYSA-N 2-Oxazoline Chemical compound C1CN=CO1 IMSODMZESSGVBE-UHFFFAOYSA-N 0.000 description 1
- YFGHCGITMMYXAQ-UHFFFAOYSA-N 2-[(diphenylmethyl)sulfinyl]acetamide Chemical compound C=1C=CC=CC=1C(S(=O)CC(=O)N)C1=CC=CC=C1 YFGHCGITMMYXAQ-UHFFFAOYSA-N 0.000 description 1
- ZCXJRINSEWQWEZ-UHFFFAOYSA-N 2-[6-[[4-(1,3-benzodioxol-5-yl)phenyl]methoxy]-1,2,3,4-tetrahydronaphthalen-2-yl]-n,n-dimethylethanamine Chemical compound C1=C2OCOC2=CC(C2=CC=C(C=C2)COC=2C=C3CCC(CC3=CC=2)CCN(C)C)=C1 ZCXJRINSEWQWEZ-UHFFFAOYSA-N 0.000 description 1
- NLRUARYEZONILC-UHFFFAOYSA-N 2-[6-[[4-(2,4-dimethoxyphenyl)phenyl]methoxy]-1,2,3,4-tetrahydronaphthalen-2-yl]-n,n-dimethylethanamine Chemical compound COC1=CC(OC)=CC=C1C(C=C1)=CC=C1COC1=CC=C(CC(CCN(C)C)CC2)C2=C1 NLRUARYEZONILC-UHFFFAOYSA-N 0.000 description 1
- HMFTWQCNVNUOMF-UHFFFAOYSA-N 2-[6-[[4-(3,4-dimethoxyphenyl)phenyl]methoxy]-1,2,3,4-tetrahydronaphthalen-2-yl]-n,n-dimethylethanamine Chemical compound C1=C(OC)C(OC)=CC=C1C(C=C1)=CC=C1COC1=CC=C(CC(CCN(C)C)CC2)C2=C1 HMFTWQCNVNUOMF-UHFFFAOYSA-N 0.000 description 1
- OPKKNOGRCALYKB-UHFFFAOYSA-N 2-[6-[[4-(4-methoxyphenyl)phenyl]methoxy]-1,2,3,4-tetrahydronaphthalen-2-yl]-n,n-dimethylethanamine Chemical compound C1=CC(OC)=CC=C1C(C=C1)=CC=C1COC1=CC=C(CC(CCN(C)C)CC2)C2=C1 OPKKNOGRCALYKB-UHFFFAOYSA-N 0.000 description 1
- YGZFYDFBHIDIBH-UHFFFAOYSA-N 2-[bis(2-hydroxyethyl)amino]icosan-1-ol Chemical compound CCCCCCCCCCCCCCCCCCC(CO)N(CCO)CCO YGZFYDFBHIDIBH-UHFFFAOYSA-N 0.000 description 1
- YSGASDXSLKIKOD-UHFFFAOYSA-N 2-amino-N-(1,2-diphenylpropan-2-yl)acetamide Chemical compound C=1C=CC=CC=1C(C)(NC(=O)CN)CC1=CC=CC=C1 YSGASDXSLKIKOD-UHFFFAOYSA-N 0.000 description 1
- 125000005999 2-bromoethyl group Chemical group 0.000 description 1
- 125000004974 2-butenyl group Chemical group C(C=CC)* 0.000 description 1
- 125000000069 2-butynyl group Chemical group [H]C([H])([H])C#CC([H])([H])* 0.000 description 1
- 125000006176 2-ethylbutyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(C([H])([H])*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000006020 2-methyl-1-propenyl group Chemical group 0.000 description 1
- IKQSNVOJJISMJS-UHFFFAOYSA-N 2-methylpropane Chemical compound C[C+](C)C IKQSNVOJJISMJS-UHFFFAOYSA-N 0.000 description 1
- BSKHPKMHTQYZBB-UHFFFAOYSA-N 2-methylpyridine Chemical compound CC1=CC=CC=N1 BSKHPKMHTQYZBB-UHFFFAOYSA-N 0.000 description 1
- BZSXEZOLBIJVQK-UHFFFAOYSA-N 2-methylsulfonylbenzoic acid Chemical compound CS(=O)(=O)C1=CC=CC=C1C(O)=O BZSXEZOLBIJVQK-UHFFFAOYSA-N 0.000 description 1
- UBVSIAHUTXHQTD-UHFFFAOYSA-N 2-n-(4-bromophenyl)-1,3,5-triazine-2,4-diamine Chemical compound NC1=NC=NC(NC=2C=CC(Br)=CC=2)=N1 UBVSIAHUTXHQTD-UHFFFAOYSA-N 0.000 description 1
- 125000001622 2-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C(*)C([H])=C([H])C2=C1[H] 0.000 description 1
- 125000006024 2-pentenyl group Chemical group 0.000 description 1
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 1
- RSEBUVRVKCANEP-UHFFFAOYSA-N 2-pyrroline Chemical compound C1CC=CN1 RSEBUVRVKCANEP-UHFFFAOYSA-N 0.000 description 1
- VHMICKWLTGFITH-UHFFFAOYSA-N 2H-isoindole Chemical compound C1=CC=CC2=CNC=C21 VHMICKWLTGFITH-UHFFFAOYSA-N 0.000 description 1
- JZIBVTUXIVIFGC-UHFFFAOYSA-N 2H-pyrrole Chemical compound C1C=CC=N1 JZIBVTUXIVIFGC-UHFFFAOYSA-N 0.000 description 1
- YIKGFWOLUIFPKU-UHFFFAOYSA-N 3,3-difluoro-5-[[2-fluoro-3-(3-fluorophenyl)phenyl]methyl]-4-hydroxy-1-[(4-methoxyphenyl)methyl]pyrrolidin-2-one Chemical compound FC1=C(C=CC=C1CC1C(C(C(N1CC1=CC=C(C=C1)OC)=O)(F)F)O)C1=CC(=CC=C1)F YIKGFWOLUIFPKU-UHFFFAOYSA-N 0.000 description 1
- PCBJXSJPACOVBI-UHFFFAOYSA-N 3,3-difluoro-5-[[2-fluoro-3-(3-fluorophenyl)phenyl]methyl]-4-hydroxypyrrolidin-2-one Chemical compound FC1=C(C=CC=C1CC1C(C(C(N1)=O)(F)F)O)C1=CC(=CC=C1)F PCBJXSJPACOVBI-UHFFFAOYSA-N 0.000 description 1
- ATVJJNGVPSKBGO-UHFFFAOYSA-N 3,4-dihydro-2h-thiopyran Chemical compound C1CSC=CC1 ATVJJNGVPSKBGO-UHFFFAOYSA-N 0.000 description 1
- DNNVRTZJRKIUFK-UHFFFAOYSA-N 3,4-dihydroquinoline Chemical compound C1=CC=C2N=CCCC2=C1 DNNVRTZJRKIUFK-UHFFFAOYSA-N 0.000 description 1
- HPOIPOPJGBKXIR-UHFFFAOYSA-N 3,6-dimethoxy-10-methyl-galantham-1-ene Natural products O1C(C(=CC=2)OC)=C3C=2CN(C)CCC23C1CC(OC)C=C2 HPOIPOPJGBKXIR-UHFFFAOYSA-N 0.000 description 1
- GGNCUSDIUUCNKE-RSAXXLAASA-N 3-(1,3-benzodioxol-5-yloxy)-n-[[(3s)-2,3-dihydro-1,4-benzodioxin-3-yl]methyl]propan-1-amine;hydrochloride Chemical compound Cl.C1=C2OCOC2=CC(OCCCNC[C@@H]2OC3=CC=CC=C3OC2)=C1 GGNCUSDIUUCNKE-RSAXXLAASA-N 0.000 description 1
- OTHCIGKQBMKICB-UHFFFAOYSA-N 3-(3-silylpropoxy)propane-1,2-diol Chemical compound OCC(O)COCCC[SiH3] OTHCIGKQBMKICB-UHFFFAOYSA-N 0.000 description 1
- YGYGASJNJTYNOL-CQSZACIVSA-N 3-[(4r)-2,2-dimethyl-1,1-dioxothian-4-yl]-5-(4-fluorophenyl)-1h-indole-7-carboxamide Chemical compound C1CS(=O)(=O)C(C)(C)C[C@@H]1C1=CNC2=C(C(N)=O)C=C(C=3C=CC(F)=CC=3)C=C12 YGYGASJNJTYNOL-CQSZACIVSA-N 0.000 description 1
- ZPZDIFSPRVHGIF-UHFFFAOYSA-N 3-aminopropylsilicon Chemical compound NCCC[Si] ZPZDIFSPRVHGIF-UHFFFAOYSA-N 0.000 description 1
- 125000004975 3-butenyl group Chemical group C(CC=C)* 0.000 description 1
- 125000000474 3-butynyl group Chemical group [H]C#CC([H])([H])C([H])([H])* 0.000 description 1
- 125000006041 3-hexenyl group Chemical group 0.000 description 1
- PBBGSZCBWVPOOL-HDICACEKSA-N 4-[(1r,2s)-1-ethyl-2-(4-hydroxyphenyl)butyl]phenol Chemical compound C1([C@H](CC)[C@H](CC)C=2C=CC(O)=CC=2)=CC=C(O)C=C1 PBBGSZCBWVPOOL-HDICACEKSA-N 0.000 description 1
- IMWPSXHIEURNKZ-UHFFFAOYSA-N 4-[2-(dimethylamino)-1-(1-hydroxycyclohexyl)ethyl]phenol;hydrochloride Chemical compound Cl.C1CCCCC1(O)C(CN(C)C)C1=CC=C(O)C=C1 IMWPSXHIEURNKZ-UHFFFAOYSA-N 0.000 description 1
- DJKNRCWSXSZACF-UHFFFAOYSA-N 4-acetamido-n-tert-butylbenzamide Chemical compound CC(=O)NC1=CC=C(C(=O)NC(C)(C)C)C=C1 DJKNRCWSXSZACF-UHFFFAOYSA-N 0.000 description 1
- 125000004217 4-methoxybenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1OC([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000003119 4-methyl-3-pentenyl group Chemical group [H]\C(=C(/C([H])([H])[H])C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- QVIAMKXOQGCYCV-UHFFFAOYSA-N 4-methylpentan-1-amine Chemical compound CC(C)CCCN QVIAMKXOQGCYCV-UHFFFAOYSA-N 0.000 description 1
- YEGLBVMYDDOCKS-UHFFFAOYSA-N 5,6-dimethoxy-2-[2,2,4,6,7-pentamethyl-3-(4-methylphenyl)-3h-1-benzofuran-5-yl]-1,3-dihydroisoindole Chemical compound C1C=2C=C(OC)C(OC)=CC=2CN1C(C(=C(C)C=1OC2(C)C)C)=C(C)C=1C2C1=CC=C(C)C=C1 YEGLBVMYDDOCKS-UHFFFAOYSA-N 0.000 description 1
- KYKSMISRQZMWEV-UHFFFAOYSA-N 5,6-dimethoxy-2-[2,2,4,6,7-pentamethyl-3-(4-propan-2-ylphenyl)-3h-1-benzofuran-5-yl]-1,3-dihydroisoindole Chemical compound C1C=2C=C(OC)C(OC)=CC=2CN1C(C(=C(C)C=1OC2(C)C)C)=C(C)C=1C2C1=CC=C(C(C)C)C=C1 KYKSMISRQZMWEV-UHFFFAOYSA-N 0.000 description 1
- IKBZAUYPBWFMDI-UHFFFAOYSA-N 5-bromo-4-methoxy-7-methyl-2,3-dihydro-1h-indene Chemical compound C1=C(Br)C(OC)=C2CCCC2=C1C IKBZAUYPBWFMDI-UHFFFAOYSA-N 0.000 description 1
- 125000006043 5-hexenyl group Chemical group 0.000 description 1
- KDOPAZIWBAHVJB-UHFFFAOYSA-N 5h-pyrrolo[3,2-d]pyrimidine Chemical compound C1=NC=C2NC=CC2=N1 KDOPAZIWBAHVJB-UHFFFAOYSA-N 0.000 description 1
- FDOGEKGFFDGVRV-UHFFFAOYSA-N 6-[2,2,4,6,7-pentamethyl-3-(4-propan-2-ylphenyl)-3h-1-benzofuran-5-yl]-5,7-dihydro-[1,3]dioxolo[4,5-f]isoindole Chemical compound C1=CC(C(C)C)=CC=C1C1C(C)(C)OC2=C1C(C)=C(N1CC3=CC=4OCOC=4C=C3C1)C(C)=C2C FDOGEKGFFDGVRV-UHFFFAOYSA-N 0.000 description 1
- DHSSDEDRBUKTQY-UHFFFAOYSA-N 6-prop-2-enyl-4,5,7,8-tetrahydrothiazolo[4,5-d]azepin-2-amine Chemical compound C1CN(CC=C)CCC2=C1N=C(N)S2 DHSSDEDRBUKTQY-UHFFFAOYSA-N 0.000 description 1
- 208000004611 Abdominal Obesity Diseases 0.000 description 1
- 229940100578 Acetylcholinesterase inhibitor Drugs 0.000 description 1
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 1
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 1
- 208000006888 Agnosia Diseases 0.000 description 1
- 208000007848 Alcoholism Diseases 0.000 description 1
- WLDHEUZGFKACJH-ZRUFZDNISA-K Amaranth Chemical compound [Na+].[Na+].[Na+].C12=CC=C(S([O-])(=O)=O)C=C2C=C(S([O-])(=O)=O)C(O)=C1\N=N\C1=CC=C(S([O-])(=O)=O)C2=CC=CC=C12 WLDHEUZGFKACJH-ZRUFZDNISA-K 0.000 description 1
- KFYRPLNVJVHZGT-UHFFFAOYSA-N Amitriptyline hydrochloride Chemical compound Cl.C1CC2=CC=CC=C2C(=CCCN(C)C)C2=CC=CC=C21 KFYRPLNVJVHZGT-UHFFFAOYSA-N 0.000 description 1
- ATRRKUHOCOJYRX-UHFFFAOYSA-N Ammonium bicarbonate Chemical compound [NH4+].OC([O-])=O ATRRKUHOCOJYRX-UHFFFAOYSA-N 0.000 description 1
- 229910000013 Ammonium bicarbonate Inorganic materials 0.000 description 1
- 208000000044 Amnesia Diseases 0.000 description 1
- 208000031091 Amnestic disease Diseases 0.000 description 1
- 102400000345 Angiotensin-2 Human genes 0.000 description 1
- 101800000733 Angiotensin-2 Proteins 0.000 description 1
- 229940088872 Apoptosis inhibitor Drugs 0.000 description 1
- 206010003062 Apraxia Diseases 0.000 description 1
- 108091023037 Aptamer Proteins 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- CEUORZQYGODEFX-UHFFFAOYSA-N Aripirazole Chemical compound ClC1=CC=CC(N2CCN(CCCCOC=3C=C4NC(=O)CCC4=CC=3)CC2)=C1Cl CEUORZQYGODEFX-UHFFFAOYSA-N 0.000 description 1
- 206010003210 Arteriosclerosis Diseases 0.000 description 1
- 208000006820 Arthralgia Diseases 0.000 description 1
- 108010011485 Aspartame Proteins 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- XUKUURHRXDUEBC-KAYWLYCHSA-N Atorvastatin Chemical compound C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CC[C@@H](O)C[C@@H](O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-KAYWLYCHSA-N 0.000 description 1
- XUKUURHRXDUEBC-UHFFFAOYSA-N Atorvastatin Natural products C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CCC(O)CC(O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-UHFFFAOYSA-N 0.000 description 1
- 206010003805 Autism Diseases 0.000 description 1
- 208000020706 Autistic disease Diseases 0.000 description 1
- 208000012219 Autonomic Nervous System disease Diseases 0.000 description 1
- NOWKCMXCCJGMRR-UHFFFAOYSA-N Aziridine Chemical compound C1CN1 NOWKCMXCCJGMRR-UHFFFAOYSA-N 0.000 description 1
- UYIFTLBWAOGQBI-BZDYCCQFSA-N Benzhormovarine Chemical compound C([C@@H]1[C@@H](C2=CC=3)CC[C@]4([C@H]1CC[C@@H]4O)C)CC2=CC=3OC(=O)C1=CC=CC=C1 UYIFTLBWAOGQBI-BZDYCCQFSA-N 0.000 description 1
- 241001474374 Blennius Species 0.000 description 1
- 206010006002 Bone pain Diseases 0.000 description 1
- 201000006474 Brain Ischemia Diseases 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 206010052346 Brain contusion Diseases 0.000 description 1
- 206010048962 Brain oedema Diseases 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- SGHZXLIDFTYFHQ-UHFFFAOYSA-L Brilliant Blue Chemical compound [Na+].[Na+].C=1C=C(C(=C2C=CC(C=C2)=[N+](CC)CC=2C=C(C=CC=2)S([O-])(=O)=O)C=2C(=CC=CC=2)S([O-])(=O)=O)C=CC=1N(CC)CC1=CC=CC(S([O-])(=O)=O)=C1 SGHZXLIDFTYFHQ-UHFFFAOYSA-L 0.000 description 1
- 239000006171 Britton–Robinson buffer Substances 0.000 description 1
- REFHVJMPQWTEIV-UHFFFAOYSA-N C(CC=CCC)SCCC=CCC Chemical compound C(CC=CCC)SCCC=CCC REFHVJMPQWTEIV-UHFFFAOYSA-N 0.000 description 1
- JGZMSDQRWPOPQO-FJXQXJEOSA-N C1=CC(=C(C(=C1)Cl)F)C[C@@H](C(=O)O)N.Cl Chemical compound C1=CC(=C(C(=C1)Cl)F)C[C@@H](C(=O)O)N.Cl JGZMSDQRWPOPQO-FJXQXJEOSA-N 0.000 description 1
- 125000003320 C2-C6 alkenyloxy group Chemical group 0.000 description 1
- 229940124802 CB1 antagonist Drugs 0.000 description 1
- MQSGCPRDJUWFSI-UHFFFAOYSA-N CC(C)(C)OC(N(CC1(F)F)C(CC2=CC=CC(C3=CC(F)=CC=C3)=C2F)C1N=[N+]=[N-])=O Chemical compound CC(C)(C)OC(N(CC1(F)F)C(CC2=CC=CC(C3=CC(F)=CC=C3)=C2F)C1N=[N+]=[N-])=O MQSGCPRDJUWFSI-UHFFFAOYSA-N 0.000 description 1
- XISYCXBDTXYUCW-UHFFFAOYSA-N CC(C)(C)OC(N(CC1(F)F)C(CC2=CC=CC(C3=CC(F)=CC=C3)=C2F)C1OS(C(F)(F)F)(=O)=O)=O Chemical compound CC(C)(C)OC(N(CC1(F)F)C(CC2=CC=CC(C3=CC(F)=CC=C3)=C2F)C1OS(C(F)(F)F)(=O)=O)=O XISYCXBDTXYUCW-UHFFFAOYSA-N 0.000 description 1
- AQJMQEQSEHTFDK-UHFFFAOYSA-N CC(C)(C)OC(N(CC1(F)F)C(CC2=CC=CC(C3=CC=CC=C3)=C2F)C1N=[N+]=[N-])=O Chemical compound CC(C)(C)OC(N(CC1(F)F)C(CC2=CC=CC(C3=CC=CC=C3)=C2F)C1N=[N+]=[N-])=O AQJMQEQSEHTFDK-UHFFFAOYSA-N 0.000 description 1
- PWDLDBWXTVILPC-WGAVTJJLSA-N CC(C)(N)CC1=CC=CC=C1.C1O[C@@]2(COS(N)(=O)=O)OC(C)(C)O[C@H]2[C@@H]2OC(C)(C)O[C@@H]21 Chemical compound CC(C)(N)CC1=CC=CC=C1.C1O[C@@]2(COS(N)(=O)=O)OC(C)(C)O[C@H]2[C@@H]2OC(C)(C)O[C@@H]21 PWDLDBWXTVILPC-WGAVTJJLSA-N 0.000 description 1
- RHASDGMNOGKRJX-UHFFFAOYSA-N CC=1C=C(C=CC1)OOB(OO)O Chemical compound CC=1C=C(C=CC1)OOB(OO)O RHASDGMNOGKRJX-UHFFFAOYSA-N 0.000 description 1
- KORNTPPJEAJQIU-KJXAQDMKSA-N Cabaser Chemical compound C1=CC([C@H]2C[C@H](CN(CC=C)[C@@H]2C2)C(=O)N(CCCN(C)C)C(=O)NCC)=C3C2=CNC3=C1 KORNTPPJEAJQIU-KJXAQDMKSA-N 0.000 description 1
- 229940123613 Calcium receptor antagonist Drugs 0.000 description 1
- 102100024423 Carbonic anhydrase 9 Human genes 0.000 description 1
- 206010007269 Carcinogenicity Diseases 0.000 description 1
- 206010007559 Cardiac failure congestive Diseases 0.000 description 1
- 206010048610 Cardiotoxicity Diseases 0.000 description 1
- 208000001573 Cataplexy Diseases 0.000 description 1
- 229920000623 Cellulose acetate phthalate Polymers 0.000 description 1
- 206010065941 Central obesity Diseases 0.000 description 1
- 206010008120 Cerebral ischaemia Diseases 0.000 description 1
- LPCKPBWOSNVCEL-UHFFFAOYSA-N Chlidanthine Natural products O1C(C(=CC=2)O)=C3C=2CN(C)CCC23C1CC(OC)C=C2 LPCKPBWOSNVCEL-UHFFFAOYSA-N 0.000 description 1
- XTEGARKTQYYJKE-UHFFFAOYSA-M Chlorate Chemical class [O-]Cl(=O)=O XTEGARKTQYYJKE-UHFFFAOYSA-M 0.000 description 1
- 102000004859 Cholecystokinin Receptors Human genes 0.000 description 1
- 108090001085 Cholecystokinin Receptors Proteins 0.000 description 1
- 206010008748 Chorea Diseases 0.000 description 1
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 1
- 208000019888 Circadian rhythm sleep disease Diseases 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- GDLIGKIOYRNHDA-UHFFFAOYSA-N Clomipramine Chemical compound C1CC2=CC=C(Cl)C=C2N(CCCN(C)C)C2=CC=CC=C21 GDLIGKIOYRNHDA-UHFFFAOYSA-N 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 1
- 229940126062 Compound A Drugs 0.000 description 1
- 208000022540 Consciousness disease Diseases 0.000 description 1
- 239000005749 Copper compound Substances 0.000 description 1
- QPLDLSVMHZLSFG-UHFFFAOYSA-N Copper oxide Chemical compound [Cu]=O QPLDLSVMHZLSFG-UHFFFAOYSA-N 0.000 description 1
- 239000005751 Copper oxide Substances 0.000 description 1
- 229910021595 Copper(I) iodide Inorganic materials 0.000 description 1
- ITRJWOMZKQRYTA-RFZYENFJSA-N Cortisone acetate Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)COC(=O)C)(O)[C@@]1(C)CC2=O ITRJWOMZKQRYTA-RFZYENFJSA-N 0.000 description 1
- 208000009798 Craniopharyngioma Diseases 0.000 description 1
- 229920002785 Croscarmellose sodium Polymers 0.000 description 1
- PMPVIKIVABFJJI-UHFFFAOYSA-N Cyclobutane Chemical compound C1CCC1 PMPVIKIVABFJJI-UHFFFAOYSA-N 0.000 description 1
- LVZWSLJZHVFIQJ-UHFFFAOYSA-N Cyclopropane Chemical compound C1CC1 LVZWSLJZHVFIQJ-UHFFFAOYSA-N 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- 206010011878 Deafness Diseases 0.000 description 1
- 239000004287 Dehydroacetic acid Substances 0.000 description 1
- 206010012218 Delirium Diseases 0.000 description 1
- 208000024254 Delusional disease Diseases 0.000 description 1
- 102100021202 Desmocollin-1 Human genes 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 208000002249 Diabetes Complications Diseases 0.000 description 1
- 206010012655 Diabetic complications Diseases 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- RWSOTUBLDIXVET-UHFFFAOYSA-N Dihydrogen sulfide Chemical group S RWSOTUBLDIXVET-UHFFFAOYSA-N 0.000 description 1
- BUDQDWGNQVEFAC-UHFFFAOYSA-N Dihydropyran Chemical compound C1COC=CC1 BUDQDWGNQVEFAC-UHFFFAOYSA-N 0.000 description 1
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 1
- XIQVNETUBQGFHX-UHFFFAOYSA-N Ditropan Chemical compound C=1C=CC=CC=1C(O)(C(=O)OCC#CCN(CC)CC)C1CCCCC1 XIQVNETUBQGFHX-UHFFFAOYSA-N 0.000 description 1
- 208000000059 Dyspnea Diseases 0.000 description 1
- 206010013975 Dyspnoeas Diseases 0.000 description 1
- 206010013976 Dyspraxia Diseases 0.000 description 1
- 208000014094 Dystonic disease Diseases 0.000 description 1
- WQXNXVUDBPYKBA-UHFFFAOYSA-N Ectoine Natural products CC1=NCCC(C(O)=O)N1 WQXNXVUDBPYKBA-UHFFFAOYSA-N 0.000 description 1
- 206010014733 Endometrial cancer Diseases 0.000 description 1
- 206010014759 Endometrial neoplasm Diseases 0.000 description 1
- 208000008967 Enuresis Diseases 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 1
- 229920003148 Eudragit® E polymer Polymers 0.000 description 1
- 229920003138 Eudragit® L 30 D-55 Polymers 0.000 description 1
- 229920003136 Eudragit® L polymer Polymers 0.000 description 1
- 229920003153 Eudragit® NE polymer Polymers 0.000 description 1
- 229920003152 Eudragit® RS polymer Polymers 0.000 description 1
- 229920003137 Eudragit® S polymer Polymers 0.000 description 1
- HTQBXNHDCUEHJF-XWLPCZSASA-N Exenatide Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(=O)NCC(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CO)C(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCSC)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)CNC(=O)[C@@H](N)CC=1NC=NC=1)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=CC=C1 HTQBXNHDCUEHJF-XWLPCZSASA-N 0.000 description 1
- 108010011459 Exenatide Proteins 0.000 description 1
- 206010057671 Female sexual dysfunction Diseases 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- LFMYNZPAVPMEGP-PIDGMYBPSA-N Fluvoxamine maleate Chemical compound OC(=O)\C=C/C(O)=O.COCCCC\C(=N/OCCN)C1=CC=C(C(F)(F)F)C=C1 LFMYNZPAVPMEGP-PIDGMYBPSA-N 0.000 description 1
- 208000010235 Food Addiction Diseases 0.000 description 1
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical group NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 1
- 238000005727 Friedel-Crafts reaction Methods 0.000 description 1
- 201000001498 Froelich syndrome Diseases 0.000 description 1
- 102000003688 G-Protein-Coupled Receptors Human genes 0.000 description 1
- 108090000045 G-Protein-Coupled Receptors Proteins 0.000 description 1
- 102000004300 GABA-A Receptors Human genes 0.000 description 1
- 108090000839 GABA-A Receptors Proteins 0.000 description 1
- 208000011688 Generalised anxiety disease Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- BIVBRWYINDPWKA-VLQRKCJKSA-L Glycyrrhizinate dipotassium Chemical compound [K+].[K+].O([C@@H]1[C@@H](O)[C@H](O)[C@H](O[C@@H]1O[C@H]1CC[C@]2(C)[C@H]3C(=O)C=C4[C@@H]5C[C@](C)(CC[C@@]5(CC[C@@]4(C)[C@]3(C)CC[C@H]2C1(C)C)C)C(O)=O)C([O-])=O)[C@@H]1O[C@H](C([O-])=O)[C@@H](O)[C@H](O)[C@H]1O BIVBRWYINDPWKA-VLQRKCJKSA-L 0.000 description 1
- 201000005569 Gout Diseases 0.000 description 1
- 238000003747 Grignard reaction Methods 0.000 description 1
- 206010056438 Growth hormone deficiency Diseases 0.000 description 1
- 108010023302 HDL Cholesterol Proteins 0.000 description 1
- 229940033330 HIV vaccine Drugs 0.000 description 1
- 229940121710 HMGCoA reductase inhibitor Drugs 0.000 description 1
- 208000016905 Hashimoto encephalopathy Diseases 0.000 description 1
- 206010019196 Head injury Diseases 0.000 description 1
- 208000010496 Heart Arrest Diseases 0.000 description 1
- NLDMNSXOCDLTTB-UHFFFAOYSA-N Heterophylliin A Natural products O1C2COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC2C(OC(=O)C=2C=C(O)C(O)=C(O)C=2)C(O)C1OC(=O)C1=CC(O)=C(O)C(O)=C1 NLDMNSXOCDLTTB-UHFFFAOYSA-N 0.000 description 1
- 101000968043 Homo sapiens Desmocollin-1 Proteins 0.000 description 1
- 101000880960 Homo sapiens Desmocollin-3 Proteins 0.000 description 1
- 101001090860 Homo sapiens Myeloblastin Proteins 0.000 description 1
- 101000979342 Homo sapiens Nuclear factor NF-kappa-B p105 subunit Proteins 0.000 description 1
- 238000006546 Horner-Wadsworth-Emmons reaction Methods 0.000 description 1
- 208000023105 Huntington disease Diseases 0.000 description 1
- 102100030643 Hydroxycarboxylic acid receptor 2 Human genes 0.000 description 1
- 101710125793 Hydroxycarboxylic acid receptor 2 Proteins 0.000 description 1
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 1
- 229920001479 Hydroxyethyl methyl cellulose Polymers 0.000 description 1
- 208000035150 Hypercholesterolemia Diseases 0.000 description 1
- 206010020710 Hyperphagia Diseases 0.000 description 1
- 206010020772 Hypertension Diseases 0.000 description 1
- 201000001431 Hyperuricemia Diseases 0.000 description 1
- 208000013016 Hypoglycemia Diseases 0.000 description 1
- 206010058359 Hypogonadism Diseases 0.000 description 1
- 206010021067 Hypopituitarism Diseases 0.000 description 1
- 208000001953 Hypotension Diseases 0.000 description 1
- 206010021133 Hypoventilation Diseases 0.000 description 1
- 206010021143 Hypoxia Diseases 0.000 description 1
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- WRYCSMQKUKOKBP-UHFFFAOYSA-N Imidazolidine Chemical compound C1CNCN1 WRYCSMQKUKOKBP-UHFFFAOYSA-N 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- SFBODOKJTYAUCM-UHFFFAOYSA-N Ipriflavone Chemical compound C=1C(OC(C)C)=CC=C(C2=O)C=1OC=C2C1=CC=CC=C1 SFBODOKJTYAUCM-UHFFFAOYSA-N 0.000 description 1
- 229910021578 Iron(III) chloride Inorganic materials 0.000 description 1
- 208000032382 Ischaemic stroke Diseases 0.000 description 1
- LPHGQDQBBGAPDZ-UHFFFAOYSA-N Isocaffeine Natural products CN1C(=O)N(C)C(=O)C2=C1N(C)C=N2 LPHGQDQBBGAPDZ-UHFFFAOYSA-N 0.000 description 1
- 239000003810 Jones reagent Substances 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- 238000006000 Knoevenagel condensation reaction Methods 0.000 description 1
- WTDRDQBEARUVNC-LURJTMIESA-N L-DOPA Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-LURJTMIESA-N 0.000 description 1
- WTDRDQBEARUVNC-UHFFFAOYSA-N L-Dopa Natural products OC(=O)C(N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-UHFFFAOYSA-N 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- 102000004016 L-Type Calcium Channels Human genes 0.000 description 1
- 108090000420 L-Type Calcium Channels Proteins 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- 150000000994 L-ascorbates Chemical class 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- 208000007177 Left Ventricular Hypertrophy Diseases 0.000 description 1
- 208000009829 Lewy Body Disease Diseases 0.000 description 1
- 201000002832 Lewy body dementia Diseases 0.000 description 1
- YSDQQAXHVYUZIW-QCIJIYAXSA-N Liraglutide Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)NCC(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCNC(=O)CC[C@H](NC(=O)CCCCCCCCCCCCCCC)C(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC=1NC=NC=1)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=C(O)C=C1 YSDQQAXHVYUZIW-QCIJIYAXSA-N 0.000 description 1
- 108010019598 Liraglutide Proteins 0.000 description 1
- 208000008930 Low Back Pain Diseases 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 206010057672 Male sexual dysfunction Diseases 0.000 description 1
- PWHULOQIROXLJO-UHFFFAOYSA-N Manganese Chemical compound [Mn] PWHULOQIROXLJO-UHFFFAOYSA-N 0.000 description 1
- 206010026749 Mania Diseases 0.000 description 1
- ZPXSCAKFGYXMGA-UHFFFAOYSA-N Mazindol Chemical compound N12CCN=C2C2=CC=CC=C2C1(O)C1=CC=C(Cl)C=C1 ZPXSCAKFGYXMGA-UHFFFAOYSA-N 0.000 description 1
- YJPIGAIKUZMOQA-UHFFFAOYSA-N Melatonin Natural products COC1=CC=C2N(C(C)=O)C=C(CCN)C2=C1 YJPIGAIKUZMOQA-UHFFFAOYSA-N 0.000 description 1
- ZRVUJXDFFKFLMG-UHFFFAOYSA-N Meloxicam Chemical compound OC=1C2=CC=CC=C2S(=O)(=O)N(C)C=1C(=O)NC1=NC=C(C)S1 ZRVUJXDFFKFLMG-UHFFFAOYSA-N 0.000 description 1
- NPPQSCRMBWNHMW-UHFFFAOYSA-N Meprobamate Chemical compound NC(=O)OCC(C)(CCC)COC(N)=O NPPQSCRMBWNHMW-UHFFFAOYSA-N 0.000 description 1
- DUGOZIWVEXMGBE-UHFFFAOYSA-N Methylphenidate Chemical compound C=1C=CC=CC=1C(C(=O)OC)C1CCCCN1 DUGOZIWVEXMGBE-UHFFFAOYSA-N 0.000 description 1
- 238000006845 Michael addition reaction Methods 0.000 description 1
- 238000005654 Michaelis-Arbuzov synthesis reaction Methods 0.000 description 1
- 238000006751 Mitsunobu reaction Methods 0.000 description 1
- 206010027802 Moebius II syndrome Diseases 0.000 description 1
- 208000008238 Muscle Spasticity Diseases 0.000 description 1
- 102100034681 Myeloblastin Human genes 0.000 description 1
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 1
- 102000004129 N-Type Calcium Channels Human genes 0.000 description 1
- 108090000699 N-Type Calcium Channels Proteins 0.000 description 1
- LQUISSLSJYBCHN-ZHADSZHNSA-N N-[(2S,3R)-1-(bicyclo[1.1.1]pentane-1-carbonyl)-2-[[3-(3,5-difluorophenyl)-2-fluorophenyl]methyl]-4,4-difluoropyrrolidin-3-yl]methanesulfonamide Chemical compound C12(CC(C1)C2)C(=O)N1[C@H]([C@H](C(C1)(F)F)NS(=O)(=O)C)CC=1C(=C(C=CC=1)C1=CC(=CC(=C1)F)F)F LQUISSLSJYBCHN-ZHADSZHNSA-N 0.000 description 1
- FCOHUSRKTDPNIB-JKEGEWPTSA-N N-[(2S,3R)-1-(bicyclo[1.1.1]pentane-1-carbonyl)-4,4-difluoro-2-[[3-(3-fluorophenyl)phenyl]methyl]pyrrolidin-3-yl]methanesulfonamide Chemical compound C12(CC(C1)C2)C(=O)N1[C@H]([C@H](C(C1)(F)F)NS(=O)(=O)C)CC=1C=C(C=CC=1)C1=CC(=CC=C1)F FCOHUSRKTDPNIB-JKEGEWPTSA-N 0.000 description 1
- NABSLJQWDMASRQ-QLSWKGBWSA-N N-[(2S,3R)-2-[(3-chloro-2-fluorophenyl)methyl]-4,4-difluoropyrrolidin-3-yl]methanesulfonamide hydrochloride Chemical compound Cl.ClC=1C(=C(C[C@@H]2NCC([C@@H]2NS(=O)(=O)C)(F)F)C=CC=1)F NABSLJQWDMASRQ-QLSWKGBWSA-N 0.000 description 1
- HVEGGYRYKZWRNV-JHGRXFIBSA-N N-[(2S,3R)-2-[[3-(3,5-difluorophenyl)-2-fluorophenyl]methyl]-4,4-difluoro-1-(3-fluorocyclobutanecarbonyl)pyrrolidin-3-yl]methanesulfonamide Chemical compound FC1([C@@H]([C@@H](N(C1)C(=O)C1CC(C1)F)CC=1C(=C(C=CC=1)C1=CC(=CC(=C1)F)F)F)NS(=O)(=O)C)F HVEGGYRYKZWRNV-JHGRXFIBSA-N 0.000 description 1
- AIXZEPUKEPVSLT-QKNQBKEWSA-N N-[(2S,3R)-2-[[3-(3,5-difluorophenyl)-2-fluorophenyl]methyl]-4,4-difluoro-1-[(2R)-oxetane-2-carbonyl]pyrrolidin-3-yl]ethanesulfonamide Chemical compound FC1([C@@H]([C@@H](N(C1)C(=O)[C@@H]1OCC1)CC=1C(=C(C=CC=1)C1=CC(=CC(=C1)F)F)F)NS(=O)(=O)CC)F AIXZEPUKEPVSLT-QKNQBKEWSA-N 0.000 description 1
- WICZSNYESJEHAP-NLWGTHIKSA-N N-[(2S,3R)-2-[[3-(3,5-difluorophenyl)-2-fluorophenyl]methyl]-4,4-difluoro-1-[(2R)-oxetane-2-carbonyl]pyrrolidin-3-yl]methanesulfonamide Chemical compound FC1([C@@H]([C@@H](N(C1)C(=O)[C@@H]1OCC1)CC=1C(=C(C=CC=1)C1=CC(=CC(=C1)F)F)F)NS(=O)(=O)C)F WICZSNYESJEHAP-NLWGTHIKSA-N 0.000 description 1
- UAZZKAPUCDZRCN-KPVRICSOSA-N N-[(2S,3R)-2-[[3-(3,5-difluorophenyl)-2-fluorophenyl]methyl]-4,4-difluoropyrrolidin-3-yl]methanesulfonamide hydrochloride Chemical compound Cl.FC1([C@@H]([C@@H](NC1)CC=1C(=C(C=CC=1)C1=CC(=CC(=C1)F)F)F)NS(=O)(=O)C)F UAZZKAPUCDZRCN-KPVRICSOSA-N 0.000 description 1
- ATYHRVYDCRHLOS-VQTJNVASSA-N N-[(2S,3R)-2-[[3-(3,5-difluorophenyl)phenyl]methyl]-4,4-difluoro-1-(2-methylpropanoyl)pyrrolidin-3-yl]methanesulfonamide Chemical compound FC=1C=C(C=C(C=1)F)C1=CC(=CC=C1)C[C@@H]1N(CC([C@@H]1NS(=O)(=O)C)(F)F)C(C(C)C)=O ATYHRVYDCRHLOS-VQTJNVASSA-N 0.000 description 1
- CKIYYXZFZIVYIC-PKOBYXMFSA-N N-[(2S,3R)-4,4-difluoro-2-[(2-fluoro-3-phenylphenyl)methyl]-1-(2-hydroxy-2-methylpropanoyl)pyrrolidin-3-yl]methanesulfonamide Chemical compound FC1([C@@H]([C@@H](N(C1)C(C(C)(C)O)=O)CC=1C(=C(C=CC=1)C1=CC=CC=C1)F)NS(=O)(=O)C)F CKIYYXZFZIVYIC-PKOBYXMFSA-N 0.000 description 1
- USHWRCPXPVRPQD-AZUAARDMSA-N N-[(2S,3R)-4,4-difluoro-2-[[2-fluoro-3-(3-fluorophenyl)phenyl]methyl]-1-(1-hydroxycyclobutanecarbonyl)pyrrolidin-3-yl]methanesulfonamide Chemical compound FC1=C(C=CC=C1C[C@@H]1N(CC([C@@H]1NS(=O)(=O)C)(F)F)C(=O)C1(CCC1)O)C1=CC(=CC=C1)F USHWRCPXPVRPQD-AZUAARDMSA-N 0.000 description 1
- OLCUCFOIIQNVOZ-SIGULFFNSA-N N-[(2S,3R)-4,4-difluoro-2-[[3-(3-fluorophenyl)phenyl]methyl]-1-(oxetane-2-carbonyl)pyrrolidin-3-yl]ethanesulfonamide Chemical compound FC1([C@@H]([C@@H](N(C1)C(=O)C1OCC1)CC=1C=C(C=CC=1)C1=CC(=CC=C1)F)NS(=O)(=O)CC)F OLCUCFOIIQNVOZ-SIGULFFNSA-N 0.000 description 1
- VPTSDXFYJTUCKN-ONTIZHBOSA-N N-[(2S,3R,4S)-1-(cyclopropanecarbonyl)-2-[[3-(3,5-difluorophenyl)-2-fluorophenyl]methyl]-4-fluoropyrrolidin-3-yl]ethanesulfonamide Chemical compound C1(CC1)C(=O)N1[C@H]([C@H]([C@H](C1)F)NS(=O)(=O)CC)CC=1C(=C(C=CC=1)C1=CC(=CC(=C1)F)F)F VPTSDXFYJTUCKN-ONTIZHBOSA-N 0.000 description 1
- GIYXAJPCNFJEHY-UHFFFAOYSA-N N-methyl-3-phenyl-3-[4-(trifluoromethyl)phenoxy]-1-propanamine hydrochloride (1:1) Chemical compound Cl.C=1C=CC=CC=1C(CCNC)OC1=CC=C(C(F)(F)F)C=C1 GIYXAJPCNFJEHY-UHFFFAOYSA-N 0.000 description 1
- KCTZOTUQSGYWLV-UHFFFAOYSA-N N1C=NC=C2N=CC=C21 Chemical compound N1C=NC=C2N=CC=C21 KCTZOTUQSGYWLV-UHFFFAOYSA-N 0.000 description 1
- 229930182559 Natural dye Natural products 0.000 description 1
- 108010025020 Nerve Growth Factor Proteins 0.000 description 1
- 102000007072 Nerve Growth Factors Human genes 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- 102000003797 Neuropeptides Human genes 0.000 description 1
- 108090000189 Neuropeptides Proteins 0.000 description 1
- 101100030361 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) pph-3 gene Proteins 0.000 description 1
- 206010029350 Neurotoxicity Diseases 0.000 description 1
- 208000010577 Niemann-Pick disease type C Diseases 0.000 description 1
- 208000000224 Night Terrors Diseases 0.000 description 1
- 102100023050 Nuclear factor NF-kappa-B p105 subunit Human genes 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- AQLLBJAXUCIJSR-UHFFFAOYSA-N OC(=O)C[Na] Chemical compound OC(=O)C[Na] AQLLBJAXUCIJSR-UHFFFAOYSA-N 0.000 description 1
- 108010011140 OM99-2 Proteins 0.000 description 1
- 208000004166 Obesity Hypoventilation Syndrome Diseases 0.000 description 1
- 208000021384 Obsessive-Compulsive disease Diseases 0.000 description 1
- 229940127340 Orexin Receptor Agonists Drugs 0.000 description 1
- 229940123730 Orexin receptor antagonist Drugs 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- CBENFWSGALASAD-UHFFFAOYSA-N Ozone Chemical compound [O-][O+]=O CBENFWSGALASAD-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 108010066788 PPI 368 Proteins 0.000 description 1
- CZYWHNTUXNGDGR-UHFFFAOYSA-L Pamidronate disodium Chemical compound O.O.O.O.O.[Na+].[Na+].NCCC(O)(P(O)([O-])=O)P(O)([O-])=O CZYWHNTUXNGDGR-UHFFFAOYSA-L 0.000 description 1
- 206010033664 Panic attack Diseases 0.000 description 1
- 229930040373 Paraformaldehyde Natural products 0.000 description 1
- 206010033799 Paralysis Diseases 0.000 description 1
- 206010034010 Parkinsonism Diseases 0.000 description 1
- 229940122985 Peptide agonist Drugs 0.000 description 1
- RMUCZJUITONUFY-UHFFFAOYSA-N Phenelzine Chemical compound NNCCC1=CC=CC=C1 RMUCZJUITONUFY-UHFFFAOYSA-N 0.000 description 1
- RXBKMJIPNDOHFR-UHFFFAOYSA-N Phenelzine sulfate Chemical compound OS(O)(=O)=O.NNCCC1=CC=CC=C1 RXBKMJIPNDOHFR-UHFFFAOYSA-N 0.000 description 1
- BHHGXPLMPWCGHP-UHFFFAOYSA-N Phenethylamine Natural products NCCC1=CC=CC=C1 BHHGXPLMPWCGHP-UHFFFAOYSA-N 0.000 description 1
- 229940099471 Phosphodiesterase inhibitor Drugs 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 206010035004 Pickwickian syndrome Diseases 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 206010036049 Polycystic ovaries Diseases 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 201000010769 Prader-Willi syndrome Diseases 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-N Propionic acid Substances CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 101710126089 Putative inactive carbonic anhydrase 5B-like protein Proteins 0.000 description 1
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 239000007868 Raney catalyst Substances 0.000 description 1
- 229910000564 Raney nickel Inorganic materials 0.000 description 1
- 206010071141 Rasmussen encephalitis Diseases 0.000 description 1
- 208000004160 Rasmussen subacute encephalitis Diseases 0.000 description 1
- 238000006680 Reformatsky reaction Methods 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- 206010074268 Reproductive toxicity Diseases 0.000 description 1
- 208000005793 Restless legs syndrome Diseases 0.000 description 1
- 206010038743 Restlessness Diseases 0.000 description 1
- XSVMFMHYUFZWBK-NSHDSACASA-N Rivastigmine Chemical compound CCN(C)C(=O)OC1=CC=CC([C@H](C)N(C)C)=C1 XSVMFMHYUFZWBK-NSHDSACASA-N 0.000 description 1
- RYMZZMVNJRMUDD-UHFFFAOYSA-N SJ000286063 Natural products C12C(OC(=O)C(C)(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 RYMZZMVNJRMUDD-UHFFFAOYSA-N 0.000 description 1
- 208000000810 Separation Anxiety Diseases 0.000 description 1
- 229940121991 Serotonin and norepinephrine reuptake inhibitor Drugs 0.000 description 1
- 229920001800 Shellac Polymers 0.000 description 1
- 206010041010 Sleep terror Diseases 0.000 description 1
- 206010041250 Social phobia Diseases 0.000 description 1
- 108010052164 Sodium Channels Proteins 0.000 description 1
- 102000018674 Sodium Channels Human genes 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 1
- 239000005708 Sodium hypochlorite Substances 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- ABBQHOQBGMUPJH-UHFFFAOYSA-M Sodium salicylate Chemical compound [Na+].OC1=CC=CC=C1C([O-])=O ABBQHOQBGMUPJH-UHFFFAOYSA-M 0.000 description 1
- 102100033927 Sodium- and chloride-dependent GABA transporter 1 Human genes 0.000 description 1
- 101710104414 Sodium- and chloride-dependent GABA transporter 1 Proteins 0.000 description 1
- 206010041347 Somnambulism Diseases 0.000 description 1
- 244000228451 Stevia rebaudiana Species 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- 208000007271 Substance Withdrawal Syndrome Diseases 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 206010042434 Sudden death Diseases 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 201000008736 Systemic mastocytosis Diseases 0.000 description 1
- 102000003141 Tachykinin Human genes 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- DHXVGJBLRPWPCS-UHFFFAOYSA-N Tetrahydropyran Chemical compound C1CCOCC1 DHXVGJBLRPWPCS-UHFFFAOYSA-N 0.000 description 1
- YPWFISCTZQNZAU-UHFFFAOYSA-N Thiane Chemical compound C1CCSCC1 YPWFISCTZQNZAU-UHFFFAOYSA-N 0.000 description 1
- GNVMUORYQLCPJZ-UHFFFAOYSA-M Thiocarbamate Chemical group NC([S-])=O GNVMUORYQLCPJZ-UHFFFAOYSA-M 0.000 description 1
- AUYYCJSJGJYCDS-LBPRGKRZSA-N Thyrolar Chemical compound IC1=CC(C[C@H](N)C(O)=O)=CC(I)=C1OC1=CC=C(O)C(I)=C1 AUYYCJSJGJYCDS-LBPRGKRZSA-N 0.000 description 1
- 208000009205 Tinnitus Diseases 0.000 description 1
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 1
- KJADKKWYZYXHBB-XBWDGYHZSA-N Topiramic acid Chemical compound C1O[C@@]2(COS(N)(=O)=O)OC(C)(C)O[C@H]2[C@@H]2OC(C)(C)O[C@@H]21 KJADKKWYZYXHBB-XBWDGYHZSA-N 0.000 description 1
- 208000000323 Tourette Syndrome Diseases 0.000 description 1
- 208000016620 Tourette disease Diseases 0.000 description 1
- 206010044221 Toxic encephalopathy Diseases 0.000 description 1
- 208000031674 Traumatic Acute Stress disease Diseases 0.000 description 1
- 208000030886 Traumatic Brain injury Diseases 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- 206010044565 Tremor Diseases 0.000 description 1
- HWHLPVGTWGOCJO-UHFFFAOYSA-N Trihexyphenidyl Chemical group C1CCCCC1C(C=1C=CC=CC=1)(O)CCN1CCCCC1 HWHLPVGTWGOCJO-UHFFFAOYSA-N 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 240000000581 Triticum monococcum Species 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 208000026928 Turner syndrome Diseases 0.000 description 1
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 1
- 208000007930 Type C Niemann-Pick Disease Diseases 0.000 description 1
- 208000003443 Unconsciousness Diseases 0.000 description 1
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 1
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 1
- 229940116211 Vasopressin antagonist Drugs 0.000 description 1
- 238000005874 Vilsmeier-Haack formylation reaction Methods 0.000 description 1
- 206010047700 Vomiting Diseases 0.000 description 1
- 238000007239 Wittig reaction Methods 0.000 description 1
- 238000006734 Wohl-Ziegler bromination reaction Methods 0.000 description 1
- 206010048245 Yellow skin Diseases 0.000 description 1
- WFIHKLWVLPBMIQ-UHFFFAOYSA-N [1,3]thiazolo[5,4-b]pyridine Chemical compound C1=CN=C2SC=NC2=C1 WFIHKLWVLPBMIQ-UHFFFAOYSA-N 0.000 description 1
- HXRNADMHJBXZGO-UHFFFAOYSA-N [5-chloro-2-(4-methoxyphenyl)-1-benzofuran-3-yl]-[4-[3-(diethylamino)propoxy]phenyl]methanone Chemical compound C1=CC(OCCCN(CC)CC)=CC=C1C(=O)C1=C(C=2C=CC(OC)=CC=2)OC2=CC=C(Cl)C=C12 HXRNADMHJBXZGO-UHFFFAOYSA-N 0.000 description 1
- YKTSYUJCYHOUJP-UHFFFAOYSA-N [O--].[Al+3].[Al+3].[O-][Si]([O-])([O-])[O-] Chemical compound [O--].[Al+3].[Al+3].[O-][Si]([O-])([O-])[O-] YKTSYUJCYHOUJP-UHFFFAOYSA-N 0.000 description 1
- FWZRVGPLRDQRMD-UHFFFAOYSA-N [O]C1CCCCCCC1 Chemical group [O]C1CCCCCCC1 FWZRVGPLRDQRMD-UHFFFAOYSA-N 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 230000035508 accumulation Effects 0.000 description 1
- 150000001241 acetals Chemical class 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 229960001138 acetylsalicylic acid Drugs 0.000 description 1
- 238000005903 acid hydrolysis reaction Methods 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- 229920006243 acrylic copolymer Polymers 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 208000026345 acute stress disease Diseases 0.000 description 1
- 230000007059 acute toxicity Effects 0.000 description 1
- 231100000403 acute toxicity Toxicity 0.000 description 1
- 125000004423 acyloxy group Chemical group 0.000 description 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 1
- 238000007259 addition reaction Methods 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 210000001789 adipocyte Anatomy 0.000 description 1
- 239000000674 adrenergic antagonist Substances 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 201000007930 alcohol dependence Diseases 0.000 description 1
- OFHCOWSQAMBJIW-AVJTYSNKSA-N alfacalcidol Chemical compound C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)CCCC(C)C)=C\C=C1\C[C@@H](O)C[C@H](O)C1=C OFHCOWSQAMBJIW-AVJTYSNKSA-N 0.000 description 1
- 229960002535 alfacalcidol Drugs 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 125000005090 alkenylcarbonyl group Chemical group 0.000 description 1
- 125000005108 alkenylthio group Chemical group 0.000 description 1
- 125000003806 alkyl carbonyl amino group Chemical group 0.000 description 1
- 125000005130 alkyl carbonyl thio group Chemical group 0.000 description 1
- 125000005907 alkyl ester group Chemical group 0.000 description 1
- 150000004791 alkyl magnesium halides Chemical class 0.000 description 1
- 125000005103 alkyl silyl group Chemical group 0.000 description 1
- 125000004647 alkyl sulfenyl group Chemical group 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- OENHQHLEOONYIE-UKMVMLAPSA-N all-trans beta-carotene Natural products CC=1CCCC(C)(C)C=1/C=C/C(/C)=C/C=C/C(/C)=C/C=C/C=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C OENHQHLEOONYIE-UKMVMLAPSA-N 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- VREFGVBLTWBCJP-UHFFFAOYSA-N alprazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1 VREFGVBLTWBCJP-UHFFFAOYSA-N 0.000 description 1
- 229960004538 alprazolam Drugs 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- SNAAJJQQZSMGQD-UHFFFAOYSA-N aluminum magnesium Chemical compound [Mg].[Al] SNAAJJQQZSMGQD-UHFFFAOYSA-N 0.000 description 1
- 229960003805 amantadine Drugs 0.000 description 1
- DKNWSYNQZKUICI-UHFFFAOYSA-N amantadine Chemical compound C1C(C2)CC3CC2CC1(N)C3 DKNWSYNQZKUICI-UHFFFAOYSA-N 0.000 description 1
- 238000005576 amination reaction Methods 0.000 description 1
- 125000004397 aminosulfonyl group Chemical group NS(=O)(=O)* 0.000 description 1
- 229960005119 amitriptyline hydrochloride Drugs 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 235000012538 ammonium bicarbonate Nutrition 0.000 description 1
- 239000001099 ammonium carbonate Substances 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 230000006986 amnesia Effects 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 229950006323 angiotensin ii Drugs 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- RDOXTESZEPMUJZ-UHFFFAOYSA-N anisole Chemical compound COC1=CC=CC=C1 RDOXTESZEPMUJZ-UHFFFAOYSA-N 0.000 description 1
- 208000022531 anorexia Diseases 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000036436 anti-hiv Effects 0.000 description 1
- 239000000883 anti-obesity agent Substances 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 239000003416 antiarrhythmic agent Substances 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 229940065524 anticholinergics inhalants for obstructive airway diseases Drugs 0.000 description 1
- 239000003146 anticoagulant agent Substances 0.000 description 1
- 229940125682 antidementia agent Drugs 0.000 description 1
- 239000000935 antidepressant agent Substances 0.000 description 1
- 229940005513 antidepressants Drugs 0.000 description 1
- 229940082992 antihypertensives mao inhibitors Drugs 0.000 description 1
- 229940045985 antineoplastic platinum compound Drugs 0.000 description 1
- 239000000164 antipsychotic agent Substances 0.000 description 1
- 229940005529 antipsychotics Drugs 0.000 description 1
- 229960004676 antithrombotic agent Drugs 0.000 description 1
- 230000036506 anxiety Effects 0.000 description 1
- VMWNQDUVQKEIOC-CYBMUJFWSA-N apomorphine Chemical compound C([C@H]1N(C)CC2)C3=CC=C(O)C(O)=C3C3=C1C2=CC=C3 VMWNQDUVQKEIOC-CYBMUJFWSA-N 0.000 description 1
- 229960004046 apomorphine Drugs 0.000 description 1
- 239000000158 apoptosis inhibitor Substances 0.000 description 1
- GLGAUBPACOBAMV-DOFZRALJSA-N arachidonylcyclopropylamide Chemical compound CCCCC\C=C/C\C=C/C\C=C/C\C=C/CCCC(=O)NC1CC1 GLGAUBPACOBAMV-DOFZRALJSA-N 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 229960004372 aripiprazole Drugs 0.000 description 1
- 150000004982 aromatic amines Chemical class 0.000 description 1
- 230000006793 arrhythmia Effects 0.000 description 1
- 206010003119 arrhythmia Diseases 0.000 description 1
- 208000011775 arteriosclerosis disease Diseases 0.000 description 1
- 239000002473 artificial blood Substances 0.000 description 1
- 125000005126 aryl alkyl carbonyl amino group Chemical group 0.000 description 1
- 125000004659 aryl alkyl thio group Chemical group 0.000 description 1
- 125000005264 aryl amine group Chemical group 0.000 description 1
- 150000001502 aryl halides Chemical class 0.000 description 1
- 150000004792 aryl magnesium halides Chemical class 0.000 description 1
- 125000005135 aryl sulfinyl group Chemical group 0.000 description 1
- 125000005110 aryl thio group Chemical group 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000000605 aspartame Substances 0.000 description 1
- IAOZJIPTCAWIRG-QWRGUYRKSA-N aspartame Chemical compound OC(=O)C[C@H](N)C(=O)N[C@H](C(=O)OC)CC1=CC=CC=C1 IAOZJIPTCAWIRG-QWRGUYRKSA-N 0.000 description 1
- 235000010357 aspartame Nutrition 0.000 description 1
- 229960003438 aspartame Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 238000000065 atmospheric pressure chemical ionisation Methods 0.000 description 1
- 229960005370 atorvastatin Drugs 0.000 description 1
- 208000015802 attention deficit-hyperactivity disease Diseases 0.000 description 1
- 239000003693 atypical antipsychotic agent Substances 0.000 description 1
- 229940127236 atypical antipsychotics Drugs 0.000 description 1
- HONIICLYMWZJFZ-UHFFFAOYSA-N azetidine Chemical compound C1CNC1 HONIICLYMWZJFZ-UHFFFAOYSA-N 0.000 description 1
- 125000004069 aziridinyl group Chemical group 0.000 description 1
- RFRXIWQYSOIBDI-UHFFFAOYSA-N benzarone Chemical compound CCC=1OC2=CC=CC=C2C=1C(=O)C1=CC=C(O)C=C1 RFRXIWQYSOIBDI-UHFFFAOYSA-N 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- UREZNYTWGJKWBI-UHFFFAOYSA-M benzethonium chloride Chemical compound [Cl-].C1=CC(C(C)(C)CC(C)(C)C)=CC=C1OCCOCC[N+](C)(C)CC1=CC=CC=C1 UREZNYTWGJKWBI-UHFFFAOYSA-M 0.000 description 1
- 229960001950 benzethonium chloride Drugs 0.000 description 1
- 229950003745 benzfetamine Drugs 0.000 description 1
- MXMZCLLIUQEKSN-UHFFFAOYSA-N benzimidazoline Chemical compound C1=CC=C2NCNC2=C1 MXMZCLLIUQEKSN-UHFFFAOYSA-N 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000004604 benzisothiazolyl group Chemical group S1N=C(C2=C1C=CC=C2)* 0.000 description 1
- CYKIHIBNSFRKQP-UHFFFAOYSA-N benzo[f][1]benzothiole Chemical compound C1=CC=C2C=C(SC=C3)C3=CC2=C1 CYKIHIBNSFRKQP-UHFFFAOYSA-N 0.000 description 1
- 125000003310 benzodiazepinyl group Chemical class N1N=C(C=CC2=C1C=CC=C2)* 0.000 description 1
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- QRUDEWIWKLJBPS-UHFFFAOYSA-N benzotriazole Chemical compound C1=CC=C2N[N][N]C2=C1 QRUDEWIWKLJBPS-UHFFFAOYSA-N 0.000 description 1
- 239000012964 benzotriazole Substances 0.000 description 1
- 125000003354 benzotriazolyl group Chemical group N1N=NC2=C1C=CC=C2* 0.000 description 1
- YXKTVDFXDRQTKV-HNNXBMFYSA-N benzphetamine Chemical compound C([C@H](C)N(C)CC=1C=CC=CC=1)C1=CC=CC=C1 YXKTVDFXDRQTKV-HNNXBMFYSA-N 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- 229960002903 benzyl benzoate Drugs 0.000 description 1
- PUJDIJCNWFYVJX-UHFFFAOYSA-N benzyl carbamate Chemical compound NC(=O)OCC1=CC=CC=C1 PUJDIJCNWFYVJX-UHFFFAOYSA-N 0.000 description 1
- LUFPJJNWMYZRQE-UHFFFAOYSA-N benzylsulfanylmethylbenzene Chemical group C=1C=CC=CC=1CSCC1=CC=CC=C1 LUFPJJNWMYZRQE-UHFFFAOYSA-N 0.000 description 1
- 239000002439 beta secretase inhibitor Substances 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 239000011648 beta-carotene Substances 0.000 description 1
- 235000013734 beta-carotene Nutrition 0.000 description 1
- TUPZEYHYWIEDIH-WAIFQNFQSA-N beta-carotene Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CCCC1(C)C)C=CC=C(/C)C=CC2=CCCCC2(C)C TUPZEYHYWIEDIH-WAIFQNFQSA-N 0.000 description 1
- 229960002747 betacarotene Drugs 0.000 description 1
- ORCXPYPDHLVQFP-UHFFFAOYSA-N bicyclo[1.1.1]pentane-3-carboxylic acid Chemical compound C1C2CC1(C(=O)O)C2 ORCXPYPDHLVQFP-UHFFFAOYSA-N 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- YSXKPIUOCJLQIE-UHFFFAOYSA-N biperiden Chemical compound C1C(C=C2)CC2C1C(C=1C=CC=CC=1)(O)CCN1CCCCC1 YSXKPIUOCJLQIE-UHFFFAOYSA-N 0.000 description 1
- 229960003003 biperiden Drugs 0.000 description 1
- 230000023555 blood coagulation Effects 0.000 description 1
- 230000036772 blood pressure Effects 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 210000002798 bone marrow cell Anatomy 0.000 description 1
- 229910000085 borane Inorganic materials 0.000 description 1
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical class OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 1
- 230000009516 brain contusion Effects 0.000 description 1
- 208000006752 brain edema Diseases 0.000 description 1
- 230000003925 brain function Effects 0.000 description 1
- 238000005893 bromination reaction Methods 0.000 description 1
- IYYIVELXUANFED-UHFFFAOYSA-N bromo(trimethyl)silane Chemical compound C[Si](C)(C)Br IYYIVELXUANFED-UHFFFAOYSA-N 0.000 description 1
- 239000006189 buccal tablet Substances 0.000 description 1
- SNPPWIUOZRMYNY-UHFFFAOYSA-N bupropion Chemical compound CC(C)(C)NC(C)C(=O)C1=CC=CC(Cl)=C1 SNPPWIUOZRMYNY-UHFFFAOYSA-N 0.000 description 1
- 229960001058 bupropion Drugs 0.000 description 1
- 229960004367 bupropion hydrochloride Drugs 0.000 description 1
- QWCRAEMEVRGPNT-UHFFFAOYSA-N buspirone Chemical compound C1C(=O)N(CCCCN2CCN(CC2)C=2N=CC=CN=2)C(=O)CC21CCCC2 QWCRAEMEVRGPNT-UHFFFAOYSA-N 0.000 description 1
- 229960001768 buspirone hydrochloride Drugs 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 125000004106 butoxy group Chemical group [*]OC([H])([H])C([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- NEDGUIRITORSKL-UHFFFAOYSA-N butyl 2-methylprop-2-enoate;2-(dimethylamino)ethyl 2-methylprop-2-enoate;methyl 2-methylprop-2-enoate Chemical compound COC(=O)C(C)=C.CCCCOC(=O)C(C)=C.CN(C)CCOC(=O)C(C)=C NEDGUIRITORSKL-UHFFFAOYSA-N 0.000 description 1
- 125000006309 butyl amino group Chemical group 0.000 description 1
- 230000006208 butylation Effects 0.000 description 1
- MSZJEPVVQWJCIF-UHFFFAOYSA-N butylazanide Chemical group CCCC[NH-] MSZJEPVVQWJCIF-UHFFFAOYSA-N 0.000 description 1
- 229960004596 cabergoline Drugs 0.000 description 1
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 1
- 229910000024 caesium carbonate Inorganic materials 0.000 description 1
- 229960001948 caffeine Drugs 0.000 description 1
- VJEONQKOZGKCAK-UHFFFAOYSA-N caffeine Natural products CN1C(=O)N(C)C(=O)C2=C1C=CN2C VJEONQKOZGKCAK-UHFFFAOYSA-N 0.000 description 1
- BBBFJLBPOGFECG-VJVYQDLKSA-N calcitonin Chemical compound N([C@H](C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(N)=O)C(C)C)C(=O)[C@@H]1CSSC[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1 BBBFJLBPOGFECG-VJVYQDLKSA-N 0.000 description 1
- 229960003773 calcitonin (salmon synthetic) Drugs 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 229930003827 cannabinoid Natural products 0.000 description 1
- 239000003557 cannabinoid Substances 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 1
- 230000006315 carbonylation Effects 0.000 description 1
- 238000005810 carbonylation reaction Methods 0.000 description 1
- 125000002843 carboxylic acid group Chemical group 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 229940084030 carboxymethylcellulose calcium Drugs 0.000 description 1
- 230000007670 carcinogenicity Effects 0.000 description 1
- 231100000260 carcinogenicity Toxicity 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 210000004413 cardiac myocyte Anatomy 0.000 description 1
- 229940082638 cardiac stimulant phosphodiesterase inhibitors Drugs 0.000 description 1
- 231100000259 cardiotoxicity Toxicity 0.000 description 1
- 239000004203 carnauba wax Substances 0.000 description 1
- 235000013869 carnauba wax Nutrition 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 239000003543 catechol methyltransferase inhibitor Substances 0.000 description 1
- 229960000590 celecoxib Drugs 0.000 description 1
- RZEKVGVHFLEQIL-UHFFFAOYSA-N celecoxib Chemical compound C1=CC(C)=CC=C1C1=CC(C(F)(F)F)=NN1C1=CC=C(S(N)(=O)=O)C=C1 RZEKVGVHFLEQIL-UHFFFAOYSA-N 0.000 description 1
- 230000019522 cellular metabolic process Effects 0.000 description 1
- 229940081734 cellulose acetate phthalate Drugs 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- OGEBRHQLRGFBNV-RZDIXWSQSA-N chembl2036808 Chemical compound C12=NC(NCCCC)=NC=C2C(C=2C=CC(F)=CC=2)=NN1C[C@H]1CC[C@H](N)CC1 OGEBRHQLRGFBNV-RZDIXWSQSA-N 0.000 description 1
- DDPFHDCZUJFNAT-PZPWKVFESA-N chembl2104402 Chemical compound N([C@H](C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1N=CNC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(N)=O)C(C)C)C(=O)[C@@H]1CCCCCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1 DDPFHDCZUJFNAT-PZPWKVFESA-N 0.000 description 1
- 239000007810 chemical reaction solvent Substances 0.000 description 1
- ANTSCNMPPGJYLG-UHFFFAOYSA-N chlordiazepoxide Chemical compound O=N=1CC(NC)=NC2=CC=C(Cl)C=C2C=1C1=CC=CC=C1 ANTSCNMPPGJYLG-UHFFFAOYSA-N 0.000 description 1
- 229960004782 chlordiazepoxide Drugs 0.000 description 1
- 238000005660 chlorination reaction Methods 0.000 description 1
- 125000002668 chloroacetyl group Chemical group ClCC(=O)* 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- AOGYCOYQMAVAFD-UHFFFAOYSA-N chlorocarbonic acid Chemical compound OC(Cl)=O AOGYCOYQMAVAFD-UHFFFAOYSA-N 0.000 description 1
- 125000004218 chloromethyl group Chemical group [H]C([H])(Cl)* 0.000 description 1
- 229930002875 chlorophyll Natural products 0.000 description 1
- 235000019804 chlorophyll Nutrition 0.000 description 1
- ATNHDLDRLWWWCB-AENOIHSZSA-M chlorophyll a Chemical compound C1([C@@H](C(=O)OC)C(=O)C2=C3C)=C2N2C3=CC(C(CC)=C3C)=[N+]4C3=CC3=C(C=C)C(C)=C5N3[Mg-2]42[N+]2=C1[C@@H](CCC(=O)OC\C=C(/C)CCC[C@H](C)CCC[C@H](C)CCCC(C)C)[C@H](C)C2=C5 ATNHDLDRLWWWCB-AENOIHSZSA-M 0.000 description 1
- 239000000812 cholinergic antagonist Substances 0.000 description 1
- 208000012601 choreatic disease Diseases 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 229910052804 chromium Inorganic materials 0.000 description 1
- 239000011651 chromium Substances 0.000 description 1
- 230000007665 chronic toxicity Effects 0.000 description 1
- 231100000160 chronic toxicity Toxicity 0.000 description 1
- WCZVZNOTHYJIEI-UHFFFAOYSA-N cinnoline Chemical compound N1=NC=CC2=CC=CC=C21 WCZVZNOTHYJIEI-UHFFFAOYSA-N 0.000 description 1
- 125000000259 cinnolinyl group Chemical group N1=NC(=CC2=CC=CC=C12)* 0.000 description 1
- 230000008632 circadian clock Effects 0.000 description 1
- 229960000584 citalopram hydrobromide Drugs 0.000 description 1
- 229960001214 clofibrate Drugs 0.000 description 1
- KNHUKKLJHYUCFP-UHFFFAOYSA-N clofibrate Chemical compound CCOC(=O)C(C)(C)OC1=CC=C(Cl)C=C1 KNHUKKLJHYUCFP-UHFFFAOYSA-N 0.000 description 1
- 229960004606 clomipramine Drugs 0.000 description 1
- DGBIGWXXNGSACT-UHFFFAOYSA-N clonazepam Chemical compound C12=CC([N+](=O)[O-])=CC=C2NC(=O)CN=C1C1=CC=CC=C1Cl DGBIGWXXNGSACT-UHFFFAOYSA-N 0.000 description 1
- 229960003120 clonazepam Drugs 0.000 description 1
- ULEUKTXFAJZAAV-UHFFFAOYSA-M clorazepate monopotassium Chemical compound [K+].C12=CC(Cl)=CC=C2NC(=O)C(C(=O)[O-])N=C1C1=CC=CC=C1 ULEUKTXFAJZAAV-UHFFFAOYSA-M 0.000 description 1
- 229960004170 clozapine Drugs 0.000 description 1
- QZUDBNBUXVUHMW-UHFFFAOYSA-N clozapine Chemical compound C1CN(C)CCN1C1=NC2=CC(Cl)=CC=C2NC2=CC=CC=C12 QZUDBNBUXVUHMW-UHFFFAOYSA-N 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 1
- 150000001869 cobalt compounds Chemical class 0.000 description 1
- 238000002288 cocrystallisation Methods 0.000 description 1
- 238000009225 cognitive behavioral therapy Methods 0.000 description 1
- 230000006999 cognitive decline Effects 0.000 description 1
- 239000008119 colloidal silica Substances 0.000 description 1
- JNGZXGGOCLZBFB-IVCQMTBJSA-N compound E Chemical compound N([C@@H](C)C(=O)N[C@@H]1C(N(C)C2=CC=CC=C2C(C=2C=CC=CC=2)=N1)=O)C(=O)CC1=CC(F)=CC(F)=C1 JNGZXGGOCLZBFB-IVCQMTBJSA-N 0.000 description 1
- 238000002591 computed tomography Methods 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 150000001880 copper compounds Chemical class 0.000 description 1
- 229910000431 copper oxide Inorganic materials 0.000 description 1
- LSXDOTMGLUJQCM-UHFFFAOYSA-M copper(i) iodide Chemical compound I[Cu] LSXDOTMGLUJQCM-UHFFFAOYSA-M 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- 208000029078 coronary artery disease Diseases 0.000 description 1
- 229960003290 cortisone acetate Drugs 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- 229960001681 croscarmellose sodium Drugs 0.000 description 1
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 1
- SLFGIOIONGJGRT-UHFFFAOYSA-N cyamemazine Chemical compound C1=C(C#N)C=C2N(CC(CN(C)C)C)C3=CC=CC=C3SC2=C1 SLFGIOIONGJGRT-UHFFFAOYSA-N 0.000 description 1
- 229960004278 cyamemazine Drugs 0.000 description 1
- 125000006310 cycloalkyl amino group Chemical group 0.000 description 1
- 125000005366 cycloalkylthio group Chemical group 0.000 description 1
- CFBGXYDUODCMNS-UHFFFAOYSA-N cyclobutene Chemical compound C1CC=C1 CFBGXYDUODCMNS-UHFFFAOYSA-N 0.000 description 1
- 125000001047 cyclobutenyl group Chemical group C1(=CCC1)* 0.000 description 1
- ZXIJMRYMVAMXQP-UHFFFAOYSA-N cycloheptene Chemical compound C1CCC=CCC1 ZXIJMRYMVAMXQP-UHFFFAOYSA-N 0.000 description 1
- 125000001162 cycloheptenyl group Chemical group C1(=CCCCCC1)* 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- NKLCHDQGUHMCGL-UHFFFAOYSA-N cyclohexylidenemethanone Chemical group O=C=C1CCCCC1 NKLCHDQGUHMCGL-UHFFFAOYSA-N 0.000 description 1
- 125000002933 cyclohexyloxy group Chemical group C1(CCCCC1)O* 0.000 description 1
- WJTCGQSWYFHTAC-UHFFFAOYSA-N cyclooctane Chemical compound C1CCCCCCC1 WJTCGQSWYFHTAC-UHFFFAOYSA-N 0.000 description 1
- 239000004914 cyclooctane Substances 0.000 description 1
- URYYVOIYTNXXBN-UPHRSURJSA-N cyclooctene Chemical compound C1CCC\C=C/CC1 URYYVOIYTNXXBN-UPHRSURJSA-N 0.000 description 1
- 239000004913 cyclooctene Substances 0.000 description 1
- 125000000522 cyclooctenyl group Chemical group C1(=CCCCCCC1)* 0.000 description 1
- SNRCKKQHDUIRIY-UHFFFAOYSA-L cyclopenta-1,4-dien-1-yl(diphenyl)phosphane;dichloromethane;dichloropalladium;iron(2+) Chemical compound [Fe+2].ClCCl.Cl[Pd]Cl.C1=C[CH-]C(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1.C1=C[CH-]C(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 SNRCKKQHDUIRIY-UHFFFAOYSA-L 0.000 description 1
- NXQGGXCHGDYOHB-UHFFFAOYSA-L cyclopenta-1,4-dien-1-yl(diphenyl)phosphane;dichloropalladium;iron(2+) Chemical compound [Fe+2].Cl[Pd]Cl.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 NXQGGXCHGDYOHB-UHFFFAOYSA-L 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- OOXWYYGXTJLWHA-UHFFFAOYSA-N cyclopropene Chemical compound C1C=C1 OOXWYYGXTJLWHA-UHFFFAOYSA-N 0.000 description 1
- 125000000298 cyclopropenyl group Chemical group [H]C1=C([H])C1([H])* 0.000 description 1
- 208000026725 cyclothymic disease Diseases 0.000 description 1
- 229940127089 cytotoxic agent Drugs 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 206010061428 decreased appetite Diseases 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- 235000019258 dehydroacetic acid Nutrition 0.000 description 1
- 229940061632 dehydroacetic acid Drugs 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- XAEWZDYWZHIUCT-UHFFFAOYSA-N desipramine hydrochloride Chemical compound [H+].[Cl-].C1CC2=CC=CC=C2N(CCCNC)C2=CC=CC=C21 XAEWZDYWZHIUCT-UHFFFAOYSA-N 0.000 description 1
- 229960003829 desipramine hydrochloride Drugs 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- NIJJYAXOARWZEE-UHFFFAOYSA-N di-n-propyl-acetic acid Natural products CCCC(C(O)=O)CCC NIJJYAXOARWZEE-UHFFFAOYSA-N 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 239000000032 diagnostic agent Substances 0.000 description 1
- 229940039227 diagnostic agent Drugs 0.000 description 1
- 229960003529 diazepam Drugs 0.000 description 1
- AAOVKJBEBIDNHE-UHFFFAOYSA-N diazepam Chemical compound N=1CC(=O)N(C)C2=CC=C(Cl)C=C2C=1C1=CC=CC=C1 AAOVKJBEBIDNHE-UHFFFAOYSA-N 0.000 description 1
- QPMLSUSACCOBDK-UHFFFAOYSA-N diazepane Chemical compound C1CCNNCC1 QPMLSUSACCOBDK-UHFFFAOYSA-N 0.000 description 1
- 125000005959 diazepanyl group Chemical group 0.000 description 1
- KJGHYQZXEYTDSW-UHFFFAOYSA-N diazocane Chemical compound C1CCCNNCC1 KJGHYQZXEYTDSW-UHFFFAOYSA-N 0.000 description 1
- MHDVGSVTJDSBDK-UHFFFAOYSA-N dibenzyl ether Chemical compound C=1C=CC=CC=1COCC1=CC=CC=C1 MHDVGSVTJDSBDK-UHFFFAOYSA-N 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000000378 dietary effect Effects 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- ISOLMABRZPQKOV-UHFFFAOYSA-N diethyl 2-acetamidopropanedioate Chemical compound CCOC(=O)C(NC(C)=O)C(=O)OCC ISOLMABRZPQKOV-UHFFFAOYSA-N 0.000 description 1
- SQAUUQRBOCJRCW-UHFFFAOYSA-N diethyl 2-acetylpropanedioate Chemical compound CCOC(=O)C(C(C)=O)C(=O)OCC SQAUUQRBOCJRCW-UHFFFAOYSA-N 0.000 description 1
- 125000004177 diethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- XXEPPPIWZFICOJ-UHFFFAOYSA-N diethylpropion Chemical compound CCN(CC)C(C)C(=O)C1=CC=CC=C1 XXEPPPIWZFICOJ-UHFFFAOYSA-N 0.000 description 1
- 229960004890 diethylpropion Drugs 0.000 description 1
- 125000000723 dihydrobenzofuranyl group Chemical group O1C(CC2=C1C=CC=C2)* 0.000 description 1
- 125000005043 dihydropyranyl group Chemical group O1C(CCC=C1)* 0.000 description 1
- 125000004655 dihydropyridinyl group Chemical group N1(CC=CC=C1)* 0.000 description 1
- 125000005072 dihydrothiopyranyl group Chemical group S1C(CCC=C1)* 0.000 description 1
- 125000000118 dimethyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 125000006222 dimethylaminomethyl group Chemical group [H]C([H])([H])N(C([H])([H])[H])C([H])([H])* 0.000 description 1
- QKIUAMUSENSFQQ-UHFFFAOYSA-N dimethylazanide Chemical group C[N-]C QKIUAMUSENSFQQ-UHFFFAOYSA-N 0.000 description 1
- 150000002009 diols Chemical class 0.000 description 1
- GPAYUJZHTULNBE-UHFFFAOYSA-O diphenylphosphanium Chemical compound C=1C=CC=CC=1[PH2+]C1=CC=CC=C1 GPAYUJZHTULNBE-UHFFFAOYSA-O 0.000 description 1
- DXPIZCZNFUTPEI-UHFFFAOYSA-O diphenylphosphanium;azide Chemical compound [N-]=[N+]=[N-].C=1C=CC=CC=1[PH2+]C1=CC=CC=C1 DXPIZCZNFUTPEI-UHFFFAOYSA-O 0.000 description 1
- VDCSGNNYCFPWFK-UHFFFAOYSA-N diphenylsilane Chemical compound C=1C=CC=CC=1[SiH2]C1=CC=CC=C1 VDCSGNNYCFPWFK-UHFFFAOYSA-N 0.000 description 1
- BXLNWOAYQXBHCY-UHFFFAOYSA-N diphenylsilylidene(diphenyl)silane Chemical compound C1=CC=CC=C1[Si](C=1C=CC=CC=1)=[Si](C=1C=CC=CC=1)C1=CC=CC=C1 BXLNWOAYQXBHCY-UHFFFAOYSA-N 0.000 description 1
- 229940101029 dipotassium glycyrrhizinate Drugs 0.000 description 1
- 235000014632 disordered eating Nutrition 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 239000002934 diuretic Substances 0.000 description 1
- 229940030606 diuretics Drugs 0.000 description 1
- DLNKOYKMWOXYQA-UHFFFAOYSA-N dl-pseudophenylpropanolamine Natural products CC(N)C(O)C1=CC=CC=C1 DLNKOYKMWOXYQA-UHFFFAOYSA-N 0.000 description 1
- DWHHIPIOLSXJLV-UHFFFAOYSA-N dodecyl 2-aminopropanoate Chemical compound CCCCCCCCCCCCOC(=O)C(C)N DWHHIPIOLSXJLV-UHFFFAOYSA-N 0.000 description 1
- 229960003530 donepezil Drugs 0.000 description 1
- 229940052760 dopamine agonists Drugs 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 206010013663 drug dependence Diseases 0.000 description 1
- 229960002496 duloxetine hydrochloride Drugs 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 208000010118 dystonia Diseases 0.000 description 1
- WQXNXVUDBPYKBA-YFKPBYRVSA-N ectoine Chemical compound CC1=[NH+][C@H](C([O-])=O)CCN1 WQXNXVUDBPYKBA-YFKPBYRVSA-N 0.000 description 1
- 108700032313 elcatonin Proteins 0.000 description 1
- 229960000756 elcatonin Drugs 0.000 description 1
- 238000002635 electroconvulsive therapy Methods 0.000 description 1
- 125000006575 electron-withdrawing group Chemical group 0.000 description 1
- 238000000132 electrospray ionisation Methods 0.000 description 1
- 238000000921 elemental analysis Methods 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- 239000012156 elution solvent Substances 0.000 description 1
- 229950000234 emricasan Drugs 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 201000002491 encephalomyelitis Diseases 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- JRURYQJSLYLRLN-BJMVGYQFSA-N entacapone Chemical compound CCN(CC)C(=O)C(\C#N)=C\C1=CC(O)=C(O)C([N+]([O-])=O)=C1 JRURYQJSLYLRLN-BJMVGYQFSA-N 0.000 description 1
- 229960003337 entacapone Drugs 0.000 description 1
- 206010015037 epilepsy Diseases 0.000 description 1
- 229930182833 estradiol Natural products 0.000 description 1
- 229960005309 estradiol Drugs 0.000 description 1
- 229950002007 estradiol benzoate Drugs 0.000 description 1
- PROQIPRRNZUXQM-ZXXIGWHRSA-N estriol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H]([C@H](O)C4)O)[C@@H]4[C@@H]3CCC2=C1 PROQIPRRNZUXQM-ZXXIGWHRSA-N 0.000 description 1
- 229960001348 estriol Drugs 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- 125000001033 ether group Chemical group 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- 229940052303 ethers for general anesthesia Drugs 0.000 description 1
- BUOFMJVMDQQIQD-HMEPSURWSA-N ethyl (4S)-5-(3-chlorophenyl)-2,2-difluoro-3-hydroxy-4-[(4-methoxyphenyl)methylamino]pentanoate hydrochloride Chemical compound Cl.ClC=1C=C(C=CC=1)C[C@@H](C(C(C(=O)OCC)(F)F)O)NCC1=CC=C(C=C1)OC BUOFMJVMDQQIQD-HMEPSURWSA-N 0.000 description 1
- ZSYORKWIMLXNSC-UHFFFAOYSA-N ethyl 2,2-difluoro-3-hydroxypentanoate Chemical compound CCOC(=O)C(F)(F)C(O)CC ZSYORKWIMLXNSC-UHFFFAOYSA-N 0.000 description 1
- NQIZCDQCNYCVAS-RQBPZYBGSA-N ethyl 2-[[(7s)-7-[[(2r)-2-(3-chlorophenyl)-2-hydroxyethyl]amino]-5,6,7,8-tetrahydronaphthalen-2-yl]oxy]acetate;hydron;chloride Chemical compound Cl.C1([C@@H](O)CN[C@H]2CCC3=CC=C(C=C3C2)OCC(=O)OCC)=CC=CC(Cl)=C1 NQIZCDQCNYCVAS-RQBPZYBGSA-N 0.000 description 1
- VCYZVXRKYPKDQB-UHFFFAOYSA-N ethyl 2-fluoroacetate Chemical compound CCOC(=O)CF VCYZVXRKYPKDQB-UHFFFAOYSA-N 0.000 description 1
- PQJJJMRNHATNKG-UHFFFAOYSA-N ethyl bromoacetate Chemical compound CCOC(=O)CBr PQJJJMRNHATNKG-UHFFFAOYSA-N 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- GDCRSXZBSIRSFR-UHFFFAOYSA-N ethyl prop-2-enoate;2-methylprop-2-enoic acid Chemical compound CC(=C)C(O)=O.CCOC(=O)C=C GDCRSXZBSIRSFR-UHFFFAOYSA-N 0.000 description 1
- FSXVSUSRJXIJHB-UHFFFAOYSA-M ethyl prop-2-enoate;methyl 2-methylprop-2-enoate;trimethyl-[2-(2-methylprop-2-enoyloxy)ethyl]azanium;chloride Chemical compound [Cl-].CCOC(=O)C=C.COC(=O)C(C)=C.CC(=C)C(=O)OCC[N+](C)(C)C FSXVSUSRJXIJHB-UHFFFAOYSA-M 0.000 description 1
- SIVVHUQWDOGLJN-UHFFFAOYSA-N ethylsulfamic acid Chemical group CCNS(O)(=O)=O SIVVHUQWDOGLJN-UHFFFAOYSA-N 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 229960001519 exenatide Drugs 0.000 description 1
- 231100000040 eye damage Toxicity 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 206010016256 fatigue Diseases 0.000 description 1
- 239000003940 fatty acid amidase inhibitor Substances 0.000 description 1
- 230000004634 feeding behavior Effects 0.000 description 1
- WKGXYQFOCVYPAC-UHFFFAOYSA-N felbamate Chemical compound NC(=O)OCC(COC(N)=O)C1=CC=CC=C1 WKGXYQFOCVYPAC-UHFFFAOYSA-N 0.000 description 1
- 229960003472 felbamate Drugs 0.000 description 1
- 229960001582 fenfluramine Drugs 0.000 description 1
- 230000035558 fertility Effects 0.000 description 1
- 229940125753 fibrate Drugs 0.000 description 1
- 239000003527 fibrinolytic agent Substances 0.000 description 1
- 230000003480 fibrinolytic effect Effects 0.000 description 1
- 239000010408 film Substances 0.000 description 1
- 239000007941 film coated tablet Substances 0.000 description 1
- XOEVKNFZUQEERE-UHFFFAOYSA-N flavoxate hydrochloride Chemical compound Cl.C1=CC=C2C(=O)C(C)=C(C=3C=CC=CC=3)OC2=C1C(=O)OCCN1CCCCC1 XOEVKNFZUQEERE-UHFFFAOYSA-N 0.000 description 1
- 229960003064 flavoxate hydrochloride Drugs 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 125000004216 fluoromethyl group Chemical group [H]C([H])(F)* 0.000 description 1
- 229960000389 fluoxetine hydrochloride Drugs 0.000 description 1
- 238000011010 flushing procedure Methods 0.000 description 1
- 229960002107 fluvoxamine maleate Drugs 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 235000012631 food intake Nutrition 0.000 description 1
- VIFVPGVMYOCWTJ-UHFFFAOYSA-N formamide;phenylmethanamine Chemical group NC=O.NCC1=CC=CC=C1 VIFVPGVMYOCWTJ-UHFFFAOYSA-N 0.000 description 1
- 238000005755 formation reaction Methods 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 235000011087 fumaric acid Nutrition 0.000 description 1
- YRTCKZIKGWZNCU-UHFFFAOYSA-N furo[3,2-b]pyridine Chemical compound C1=CC=C2OC=CC2=N1 YRTCKZIKGWZNCU-UHFFFAOYSA-N 0.000 description 1
- JUQAECQBUNODQP-UHFFFAOYSA-N furo[3,2-d]pyrimidine Chemical compound C1=NC=C2OC=CC2=N1 JUQAECQBUNODQP-UHFFFAOYSA-N 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 229960003980 galantamine Drugs 0.000 description 1
- BGLNUNCBNALFOZ-WMLDXEAASA-N galanthamine Natural products COc1ccc2CCCC[C@@]34C=CCC[C@@H]3Oc1c24 BGLNUNCBNALFOZ-WMLDXEAASA-N 0.000 description 1
- ASUTZQLVASHGKV-UHFFFAOYSA-N galanthamine hydrochloride Natural products O1C(=C23)C(OC)=CC=C2CN(C)CCC23C1CC(O)C=C2 ASUTZQLVASHGKV-UHFFFAOYSA-N 0.000 description 1
- 208000020694 gallbladder disease Diseases 0.000 description 1
- 208000001130 gallstones Diseases 0.000 description 1
- 208000021302 gastroesophageal reflux disease Diseases 0.000 description 1
- 238000002695 general anesthesia Methods 0.000 description 1
- 229940052308 general anesthetics halogenated hydrocarbons Drugs 0.000 description 1
- 208000029364 generalized anxiety disease Diseases 0.000 description 1
- 231100000025 genetic toxicology Toxicity 0.000 description 1
- 230000001738 genotoxic effect Effects 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 229940075507 glyceryl monostearate Drugs 0.000 description 1
- 239000003163 gonadal steroid hormone Substances 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- SCMLRESZJCKCTC-KMYQRJGFSA-N gtpl8173 Chemical compound C12=CC=C(CSCC)C=C2C2=C(CNC3=O)C3=C3C4=CC(CSCC)=CC=C4N4C3=C2N1[C@]1(C)[C@@](O)(C(=O)OC)C[C@H]4O1 SCMLRESZJCKCTC-KMYQRJGFSA-N 0.000 description 1
- 150000008282 halocarbons Chemical class 0.000 description 1
- 150000002366 halogen compounds Chemical class 0.000 description 1
- 238000005658 halogenation reaction Methods 0.000 description 1
- 230000010370 hearing loss Effects 0.000 description 1
- 231100000888 hearing loss Toxicity 0.000 description 1
- 208000016354 hearing loss disease Diseases 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000005844 heterocyclyloxy group Chemical group 0.000 description 1
- 125000004468 heterocyclylthio group Chemical group 0.000 description 1
- 229950001996 hexestrol Drugs 0.000 description 1
- 125000005935 hexyloxycarbonyl group Chemical group 0.000 description 1
- 235000009200 high fat diet Nutrition 0.000 description 1
- 239000000938 histamine H1 antagonist Substances 0.000 description 1
- JUMYIBMBTDDLNG-OJERSXHUSA-N hydron;methyl (2r)-2-phenyl-2-[(2r)-piperidin-2-yl]acetate;chloride Chemical compound Cl.C([C@@H]1[C@H](C(=O)OC)C=2C=CC=CC=2)CCCN1 JUMYIBMBTDDLNG-OJERSXHUSA-N 0.000 description 1
- 229920001477 hydrophilic polymer Polymers 0.000 description 1
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 1
- 229920003063 hydroxymethyl cellulose Polymers 0.000 description 1
- 229940031574 hydroxymethyl cellulose Drugs 0.000 description 1
- 229940031704 hydroxypropyl methylcellulose phthalate Drugs 0.000 description 1
- 229920003132 hydroxypropyl methylcellulose phthalate Polymers 0.000 description 1
- 229920000639 hydroxypropylmethylcellulose acetate succinate Polymers 0.000 description 1
- WQYVRQLZKVEZGA-UHFFFAOYSA-N hypochlorite Chemical class Cl[O-] WQYVRQLZKVEZGA-UHFFFAOYSA-N 0.000 description 1
- 230000002218 hypoglycaemic effect Effects 0.000 description 1
- 230000001096 hypoplastic effect Effects 0.000 description 1
- 230000036543 hypotension Effects 0.000 description 1
- 230000002267 hypothalamic effect Effects 0.000 description 1
- 210000003016 hypothalamus Anatomy 0.000 description 1
- 230000007954 hypoxia Effects 0.000 description 1
- 229960001680 ibuprofen Drugs 0.000 description 1
- JGPMMRGNQUBGND-UHFFFAOYSA-N idebenone Chemical compound COC1=C(OC)C(=O)C(CCCCCCCCCCO)=C(C)C1=O JGPMMRGNQUBGND-UHFFFAOYSA-N 0.000 description 1
- 229960004135 idebenone Drugs 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- MTNDZQHUAFNZQY-UHFFFAOYSA-N imidazoline Chemical compound C1CN=CN1 MTNDZQHUAFNZQY-UHFFFAOYSA-N 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- XZZXIYZZBJDEEP-UHFFFAOYSA-N imipramine hydrochloride Chemical compound [Cl-].C1CC2=CC=CC=C2N(CCC[NH+](C)C)C2=CC=CC=C21 XZZXIYZZBJDEEP-UHFFFAOYSA-N 0.000 description 1
- 229960002102 imipramine hydrochloride Drugs 0.000 description 1
- 239000012729 immediate-release (IR) formulation Substances 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- LWRDQHOZTAOILO-UHFFFAOYSA-N incadronic acid Chemical compound OP(O)(=O)C(P(O)(O)=O)NC1CCCCCC1 LWRDQHOZTAOILO-UHFFFAOYSA-N 0.000 description 1
- 229950006971 incadronic acid Drugs 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 1
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 229940125425 inverse agonist Drugs 0.000 description 1
- 238000000752 ionisation method Methods 0.000 description 1
- 229960005431 ipriflavone Drugs 0.000 description 1
- RBTARNINKXHZNM-UHFFFAOYSA-K iron trichloride Chemical compound Cl[Fe](Cl)Cl RBTARNINKXHZNM-UHFFFAOYSA-K 0.000 description 1
- 208000002551 irritable bowel syndrome Diseases 0.000 description 1
- 125000005929 isobutyloxycarbonyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])OC(*)=O 0.000 description 1
- 125000004491 isohexyl group Chemical group C(CCC(C)C)* 0.000 description 1
- GWVMLCQWXVFZCN-UHFFFAOYSA-N isoindoline Chemical compound C1=CC=C2CNCC2=C1 GWVMLCQWXVFZCN-UHFFFAOYSA-N 0.000 description 1
- 125000004594 isoindolinyl group Chemical group C1(NCC2=CC=CC=C12)* 0.000 description 1
- 125000000904 isoindolyl group Chemical group C=1(NC=C2C=CC=CC12)* 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 125000005928 isopropyloxycarbonyl group Chemical group [H]C([H])([H])C([H])(OC(*)=O)C([H])([H])[H] 0.000 description 1
- 125000005956 isoquinolyl group Chemical group 0.000 description 1
- 208000033915 jet lag type circadian rhythm sleep disease Diseases 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 229960001375 lactose Drugs 0.000 description 1
- CFHGBZLNZZVTAY-UHFFFAOYSA-N lawesson's reagent Chemical compound C1=CC(OC)=CC=C1P1(=S)SP(=S)(C=2C=CC(OC)=CC=2)S1 CFHGBZLNZZVTAY-UHFFFAOYSA-N 0.000 description 1
- ACKFDYCQCBEDNU-UHFFFAOYSA-J lead(2+);tetraacetate Chemical compound [Pb+2].CC([O-])=O.CC([O-])=O.CC([O-])=O.CC([O-])=O ACKFDYCQCBEDNU-UHFFFAOYSA-J 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- JMPOIZCOJJMTHI-UHFFFAOYSA-N leteprinim Chemical compound C1=CC(C(=O)O)=CC=C1NC(=O)CCN1C(NC=NC2=O)=C2N=C1 JMPOIZCOJJMTHI-UHFFFAOYSA-N 0.000 description 1
- 229950011566 leteprinim Drugs 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 208000010325 limbic encephalitis Diseases 0.000 description 1
- 230000037356 lipid metabolism Effects 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 229960002701 liraglutide Drugs 0.000 description 1
- XGZVUEUWXADBQD-UHFFFAOYSA-L lithium carbonate Chemical compound [Li+].[Li+].[O-]C([O-])=O XGZVUEUWXADBQD-UHFFFAOYSA-L 0.000 description 1
- 229910052808 lithium carbonate Inorganic materials 0.000 description 1
- 229940008015 lithium carbonate Drugs 0.000 description 1
- 229960004391 lorazepam Drugs 0.000 description 1
- XTTZERNUQAFMOF-QMMMGPOBSA-N lorcaserin Chemical compound C[C@H]1CNCCC2=CC=C(Cl)C=C12 XTTZERNUQAFMOF-QMMMGPOBSA-N 0.000 description 1
- 229960005060 lorcaserin Drugs 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 231100000053 low toxicity Toxicity 0.000 description 1
- IYVSXSLYJLAZAT-NOLJZWGESA-N lycoramine Natural products CN1CC[C@@]23CC[C@H](O)C[C@@H]2Oc4cccc(C1)c34 IYVSXSLYJLAZAT-NOLJZWGESA-N 0.000 description 1
- 208000002780 macular degeneration Diseases 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- 235000012254 magnesium hydroxide Nutrition 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- NXPHGHWWQRMDIA-UHFFFAOYSA-M magnesium;carbanide;bromide Chemical compound [CH3-].[Mg+2].[Br-] NXPHGHWWQRMDIA-UHFFFAOYSA-M 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- CUONGYYJJVDODC-UHFFFAOYSA-N malononitrile Chemical compound N#CCC#N CUONGYYJJVDODC-UHFFFAOYSA-N 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- 239000011572 manganese Substances 0.000 description 1
- 230000000873 masking effect Effects 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 208000008585 mastocytosis Diseases 0.000 description 1
- 229960000299 mazindol Drugs 0.000 description 1
- 229960003987 melatonin Drugs 0.000 description 1
- DRLFMBDRBRZALE-UHFFFAOYSA-N melatonin Chemical compound COC1=CC=C2NC=C(CCNC(C)=O)C2=C1 DRLFMBDRBRZALE-UHFFFAOYSA-N 0.000 description 1
- 229960001929 meloxicam Drugs 0.000 description 1
- 229960004815 meprobamate Drugs 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 229910052987 metal hydride Inorganic materials 0.000 description 1
- 150000004681 metal hydrides Chemical class 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- AFCCDDWKHLHPDF-UHFFFAOYSA-M metam-sodium Chemical compound [Na+].CNC([S-])=S AFCCDDWKHLHPDF-UHFFFAOYSA-M 0.000 description 1
- XZWYZXLIPXDOLR-UHFFFAOYSA-N metformin Chemical compound CN(C)C(=N)NC(N)=N XZWYZXLIPXDOLR-UHFFFAOYSA-N 0.000 description 1
- 229960003105 metformin Drugs 0.000 description 1
- TWXDDNPPQUTEOV-FVGYRXGTSA-N methamphetamine hydrochloride Chemical compound Cl.CN[C@@H](C)CC1=CC=CC=C1 TWXDDNPPQUTEOV-FVGYRXGTSA-N 0.000 description 1
- 229960002532 methamphetamine hydrochloride Drugs 0.000 description 1
- UKVIEHSSVKSQBA-UHFFFAOYSA-N methane;palladium Chemical compound C.[Pd] UKVIEHSSVKSQBA-UHFFFAOYSA-N 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- NSPJNIDYTSSIIY-UHFFFAOYSA-N methoxy(methoxymethoxy)methane Chemical compound COCOCOC NSPJNIDYTSSIIY-UHFFFAOYSA-N 0.000 description 1
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 1
- 238000006063 methoxycarbonylation reaction Methods 0.000 description 1
- SIGOIUCRXKUEIG-UHFFFAOYSA-N methyl 2-dimethoxyphosphorylacetate Chemical compound COC(=O)CP(=O)(OC)OC SIGOIUCRXKUEIG-UHFFFAOYSA-N 0.000 description 1
- 150000004702 methyl esters Chemical group 0.000 description 1
- HBCAQUUDOCPMTB-UHFFFAOYSA-N methyl n-tert-butylcarbamate Chemical compound COC(=O)NC(C)(C)C HBCAQUUDOCPMTB-UHFFFAOYSA-N 0.000 description 1
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 1
- 230000011987 methylation Effects 0.000 description 1
- 238000007069 methylation reaction Methods 0.000 description 1
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 1
- 229960001344 methylphenidate Drugs 0.000 description 1
- 229960001033 methylphenidate hydrochloride Drugs 0.000 description 1
- MYMDOKBFMTVEGE-UHFFFAOYSA-N methylsulfamic acid Chemical group CNS(O)(=O)=O MYMDOKBFMTVEGE-UHFFFAOYSA-N 0.000 description 1
- 125000006216 methylsulfinyl group Chemical group [H]C([H])([H])S(*)=O 0.000 description 1
- 229960003404 mexiletine Drugs 0.000 description 1
- 230000027939 micturition Effects 0.000 description 1
- 229960001785 mirtazapine Drugs 0.000 description 1
- RONZAEMNMFQXRA-UHFFFAOYSA-N mirtazapine Chemical compound C1C2=CC=CN=C2N2CCN(C)CC2C2=CC=CC=C21 RONZAEMNMFQXRA-UHFFFAOYSA-N 0.000 description 1
- 239000002829 mitogen activated protein kinase inhibitor Substances 0.000 description 1
- YHXISWVBGDMDLQ-UHFFFAOYSA-N moclobemide Chemical compound C1=CC(Cl)=CC=C1C(=O)NCCN1CCOCC1 YHXISWVBGDMDLQ-UHFFFAOYSA-N 0.000 description 1
- 229960004644 moclobemide Drugs 0.000 description 1
- 229960001165 modafinil Drugs 0.000 description 1
- 239000001788 mono and diglycerides of fatty acids Substances 0.000 description 1
- 239000002899 monoamine oxidase inhibitor Substances 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- 230000003232 mucoadhesive effect Effects 0.000 description 1
- 201000006938 muscular dystrophy Diseases 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 206010028417 myasthenia gravis Diseases 0.000 description 1
- 208000010125 myocardial infarction Diseases 0.000 description 1
- ACTNHJDHMQSOGL-UHFFFAOYSA-N n',n'-dibenzylethane-1,2-diamine Chemical compound C=1C=CC=CC=1CN(CCN)CC1=CC=CC=C1 ACTNHJDHMQSOGL-UHFFFAOYSA-N 0.000 description 1
- JFTURWWGPMTABQ-UHFFFAOYSA-N n,n-dimethyl-3-naphthalen-1-yloxy-3-thiophen-2-ylpropan-1-amine Chemical compound C=1C=CC2=CC=CC=C2C=1OC(CCN(C)C)C1=CC=CS1 JFTURWWGPMTABQ-UHFFFAOYSA-N 0.000 description 1
- KRKPYFLIYNGWTE-UHFFFAOYSA-N n,o-dimethylhydroxylamine Chemical compound CNOC KRKPYFLIYNGWTE-UHFFFAOYSA-N 0.000 description 1
- HWMFFWCDLWDYGX-UHFFFAOYSA-N n-(4-aminophenyl)furan-2-carboxamide Chemical compound C1=CC(N)=CC=C1NC(=O)C1=CC=CO1 HWMFFWCDLWDYGX-UHFFFAOYSA-N 0.000 description 1
- 125000004923 naphthylmethyl group Chemical group C1(=CC=CC2=CC=CC=C12)C* 0.000 description 1
- 125000005186 naphthyloxy group Chemical group C1(=CC=CC2=CC=CC=C12)O* 0.000 description 1
- 125000005029 naphthylthio group Chemical group C1(=CC=CC2=CC=CC=C12)S* 0.000 description 1
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 1
- 229940037525 nasal preparations Drugs 0.000 description 1
- 239000000978 natural dye Substances 0.000 description 1
- 239000005445 natural material Substances 0.000 description 1
- DYCKFEBIOUQECE-UHFFFAOYSA-N nefazodone hydrochloride Chemical compound [H+].[Cl-].O=C1N(CCOC=2C=CC=CC=2)C(CC)=NN1CCCN(CC1)CCN1C1=CC=CC(Cl)=C1 DYCKFEBIOUQECE-UHFFFAOYSA-N 0.000 description 1
- 229960002441 nefazodone hydrochloride Drugs 0.000 description 1
- 230000001537 neural effect Effects 0.000 description 1
- 208000004296 neuralgia Diseases 0.000 description 1
- 208000021722 neuropathic pain Diseases 0.000 description 1
- 231100000228 neurotoxicity Toxicity 0.000 description 1
- 230000007135 neurotoxicity Effects 0.000 description 1
- 239000003900 neurotrophic factor Substances 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 150000002816 nickel compounds Chemical class 0.000 description 1
- 229960003512 nicotinic acid Drugs 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 206010029410 night sweats Diseases 0.000 description 1
- 230000036565 night sweats Effects 0.000 description 1
- 150000002825 nitriles Chemical class 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 208000005346 nocturnal enuresis Diseases 0.000 description 1
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 1
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 1
- 239000002664 nootropic agent Substances 0.000 description 1
- 239000002767 noradrenalin uptake inhibitor Substances 0.000 description 1
- 229940127221 norepinephrine reuptake inhibitor Drugs 0.000 description 1
- 239000012038 nucleophile Substances 0.000 description 1
- 238000005935 nucleophilic addition reaction Methods 0.000 description 1
- 230000000269 nucleophilic effect Effects 0.000 description 1
- 208000001797 obstructive sleep apnea Diseases 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- KVWDHTXUZHCGIO-UHFFFAOYSA-N olanzapine Chemical compound C1CN(C)CCN1C1=NC2=CC=CC=C2NC2=C1C=C(C)S2 KVWDHTXUZHCGIO-UHFFFAOYSA-N 0.000 description 1
- 229960005017 olanzapine Drugs 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 210000004273 ophthalmic nerve Anatomy 0.000 description 1
- 239000003402 opiate agonist Substances 0.000 description 1
- 239000003401 opiate antagonist Substances 0.000 description 1
- 239000006186 oral dosage form Substances 0.000 description 1
- 239000007935 oral tablet Substances 0.000 description 1
- 239000006191 orally-disintegrating tablet Substances 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 230000033667 organ regeneration Effects 0.000 description 1
- AHLBNYSZXLDEJQ-FWEHEUNISA-N orlistat Chemical compound CCCCCCCCCCC[C@H](OC(=O)[C@H](CC(C)C)NC=O)C[C@@H]1OC(=O)[C@H]1CCCCCC AHLBNYSZXLDEJQ-FWEHEUNISA-N 0.000 description 1
- 229960001243 orlistat Drugs 0.000 description 1
- 229960003104 ornithine Drugs 0.000 description 1
- 239000012285 osmium tetroxide Substances 0.000 description 1
- 229910000489 osmium tetroxide Inorganic materials 0.000 description 1
- 230000011164 ossification Effects 0.000 description 1
- 201000008482 osteoarthritis Diseases 0.000 description 1
- 235000020830 overeating Nutrition 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 125000005968 oxazolinyl group Chemical group 0.000 description 1
- UHHKSVZZTYJVEG-UHFFFAOYSA-N oxepane Chemical compound C1CCCOCC1 UHHKSVZZTYJVEG-UHFFFAOYSA-N 0.000 description 1
- 125000003551 oxepanyl group Chemical group 0.000 description 1
- AHHWIHXENZJRFG-UHFFFAOYSA-N oxetane Chemical compound C1COC1 AHHWIHXENZJRFG-UHFFFAOYSA-N 0.000 description 1
- 125000003566 oxetanyl group Chemical group 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 125000000466 oxiranyl group Chemical group 0.000 description 1
- 229960005434 oxybutynin Drugs 0.000 description 1
- 150000002941 palladium compounds Chemical class 0.000 description 1
- MUJIDPITZJWBSW-UHFFFAOYSA-N palladium(2+) Chemical compound [Pd+2] MUJIDPITZJWBSW-UHFFFAOYSA-N 0.000 description 1
- ULYNIEUXPCUIEL-UHFFFAOYSA-L palladium(2+);triethylphosphane;dichloride Chemical compound [Cl-].[Cl-].[Pd+2].CCP(CC)CC.CCP(CC)CC ULYNIEUXPCUIEL-UHFFFAOYSA-L 0.000 description 1
- LXNAVEXFUKBNMK-UHFFFAOYSA-N palladium(II) acetate Substances [Pd].CC(O)=O.CC(O)=O LXNAVEXFUKBNMK-UHFFFAOYSA-N 0.000 description 1
- UQPUONNXJVWHRM-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 UQPUONNXJVWHRM-UHFFFAOYSA-N 0.000 description 1
- 229960003978 pamidronic acid Drugs 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 229920002866 paraformaldehyde Polymers 0.000 description 1
- 208000002851 paranoid schizophrenia Diseases 0.000 description 1
- 239000004031 partial agonist Substances 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- NRNCYVBFPDDJNE-UHFFFAOYSA-N pemoline Chemical compound O1C(N)=NC(=O)C1C1=CC=CC=C1 NRNCYVBFPDDJNE-UHFFFAOYSA-N 0.000 description 1
- 229960000761 pemoline Drugs 0.000 description 1
- 125000006340 pentafluoro ethyl group Chemical group FC(F)(F)C(F)(F)* 0.000 description 1
- 125000003538 pentan-3-yl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004894 pentylamino group Chemical group C(CCCC)N* 0.000 description 1
- 125000001148 pentyloxycarbonyl group Chemical group 0.000 description 1
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical class OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 1
- 229960004851 pergolide Drugs 0.000 description 1
- YYPWGCZOLGTTER-MZMPZRCHSA-N pergolide Chemical compound C1=CC=C2[C@H]3C[C@@H](CSC)CN(CCC)[C@@H]3CC3=CN=C1[C]32 YYPWGCZOLGTTER-MZMPZRCHSA-N 0.000 description 1
- KHIWWQKSHDUIBK-UHFFFAOYSA-N periodic acid Chemical class OI(=O)(=O)=O KHIWWQKSHDUIBK-UHFFFAOYSA-N 0.000 description 1
- 208000023515 periodic limb movement disease Diseases 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 150000002978 peroxides Chemical class 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 229940127557 pharmaceutical product Drugs 0.000 description 1
- 125000004934 phenanthridinyl group Chemical group C1(=CC=CC2=NC=C3C=CC=CC3=C12)* 0.000 description 1
- 229960000964 phenelzine Drugs 0.000 description 1
- 229960004790 phenelzine sulfate Drugs 0.000 description 1
- 229940117803 phenethylamine Drugs 0.000 description 1
- 229960003209 phenmetrazine Drugs 0.000 description 1
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 1
- 229960003562 phentermine Drugs 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- 125000000843 phenylene group Chemical group C1(=C(C=CC=C1)*)* 0.000 description 1
- 125000000286 phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 1
- HKOOXMFOFWEVGF-UHFFFAOYSA-N phenylhydrazine Chemical compound NNC1=CC=CC=C1 HKOOXMFOFWEVGF-UHFFFAOYSA-N 0.000 description 1
- 229940067157 phenylhydrazine Drugs 0.000 description 1
- ANRQGKOBLBYXFM-UHFFFAOYSA-M phenylmagnesium bromide Chemical compound Br[Mg]C1=CC=CC=C1 ANRQGKOBLBYXFM-UHFFFAOYSA-M 0.000 description 1
- DLNKOYKMWOXYQA-APPZFPTMSA-N phenylpropanolamine Chemical compound C[C@@H](N)[C@H](O)C1=CC=CC=C1 DLNKOYKMWOXYQA-APPZFPTMSA-N 0.000 description 1
- 229960000395 phenylpropanolamine Drugs 0.000 description 1
- 125000003356 phenylsulfanyl group Chemical group [*]SC1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 125000003170 phenylsulfonyl group Chemical group C1(=CC=CC=C1)S(=O)(=O)* 0.000 description 1
- 208000019899 phobic disease Diseases 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- AQSJGOWTSHOLKH-UHFFFAOYSA-N phosphite(3-) Chemical class [O-]P([O-])[O-] AQSJGOWTSHOLKH-UHFFFAOYSA-N 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 150000004714 phosphonium salts Chemical class 0.000 description 1
- XUYJLQHKOGNDPB-UHFFFAOYSA-N phosphonoacetic acid Chemical compound OC(=O)CP(O)(O)=O XUYJLQHKOGNDPB-UHFFFAOYSA-N 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 230000000865 phosphorylative effect Effects 0.000 description 1
- XNGIFLGASWRNHJ-UHFFFAOYSA-L phthalate(2-) Chemical compound [O-]C(=O)C1=CC=CC=C1C([O-])=O XNGIFLGASWRNHJ-UHFFFAOYSA-L 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- 150000003058 platinum compounds Chemical class 0.000 description 1
- 201000010065 polycystic ovary syndrome Diseases 0.000 description 1
- 229920000137 polyphosphoric acid Polymers 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229950008882 polysorbate Drugs 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 235000019422 polyvinyl alcohol Nutrition 0.000 description 1
- 208000028173 post-traumatic stress disease Diseases 0.000 description 1
- 235000011056 potassium acetate Nutrition 0.000 description 1
- DJEHXEMURTVAOE-UHFFFAOYSA-M potassium bisulfite Chemical compound [K+].OS([O-])=O DJEHXEMURTVAOE-UHFFFAOYSA-M 0.000 description 1
- 229940099427 potassium bisulfite Drugs 0.000 description 1
- 229910000027 potassium carbonate Inorganic materials 0.000 description 1
- 229940028868 potassium clorazepate Drugs 0.000 description 1
- 239000012286 potassium permanganate Substances 0.000 description 1
- 159000000001 potassium salts Chemical class 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- FASDKYOPVNHBLU-ZETCQYMHSA-N pramipexole Chemical compound C1[C@@H](NCCC)CCC2=C1SC(N)=N2 FASDKYOPVNHBLU-ZETCQYMHSA-N 0.000 description 1
- 229960003089 pramipexole Drugs 0.000 description 1
- 229960003611 pramlintide Drugs 0.000 description 1
- 108010029667 pramlintide Proteins 0.000 description 1
- NRKVKVQDUCJPIZ-MKAGXXMWSA-N pramlintide acetate Chemical compound C([C@@H](C(=O)NCC(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CS)NC(=O)[C@@H](N)CCCCN)[C@@H](C)O)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=CC=C1 NRKVKVQDUCJPIZ-MKAGXXMWSA-N 0.000 description 1
- VWBQYTRBTXKKOG-IYNICTALSA-M pravastatin sodium Chemical compound [Na+].C1=C[C@H](C)[C@H](CC[C@@H](O)C[C@@H](O)CC([O-])=O)[C@H]2[C@@H](OC(=O)[C@@H](C)CC)C[C@H](O)C=C21 VWBQYTRBTXKKOG-IYNICTALSA-M 0.000 description 1
- 229960001495 pravastatin sodium Drugs 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 229940088417 precipitated calcium carbonate Drugs 0.000 description 1
- AYXYPKUFHZROOJ-ZETCQYMHSA-N pregabalin Chemical compound CC(C)C[C@H](CN)CC(O)=O AYXYPKUFHZROOJ-ZETCQYMHSA-N 0.000 description 1
- 229960001233 pregabalin Drugs 0.000 description 1
- 125000001844 prenyl group Chemical group [H]C([*])([H])C([H])=C(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 239000000186 progesterone Substances 0.000 description 1
- 229960003387 progesterone Drugs 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 230000006289 propionylation Effects 0.000 description 1
- 238000010515 propionylation reaction Methods 0.000 description 1
- 229960001187 propiverine hydrochloride Drugs 0.000 description 1
- JCRIVQIOJSSCQD-UHFFFAOYSA-N propylhexedrine Chemical compound CNC(C)CC1CCCCC1 JCRIVQIOJSSCQD-UHFFFAOYSA-N 0.000 description 1
- 229960000786 propylhexedrine Drugs 0.000 description 1
- 125000004742 propyloxycarbonyl group Chemical group 0.000 description 1
- 108010076038 prosaptide Proteins 0.000 description 1
- 230000004845 protein aggregation Effects 0.000 description 1
- LVTJOONKWUXEFR-FZRMHRINSA-N protoneodioscin Natural products O(C[C@@H](CC[C@]1(O)[C@H](C)[C@@H]2[C@]3(C)[C@H]([C@H]4[C@@H]([C@]5(C)C(=CC4)C[C@@H](O[C@@H]4[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@@H](O)[C@H](O[C@H]6[C@@H](O)[C@@H](O)[C@@H](O)[C@H](C)O6)[C@H](CO)O4)CC5)CC3)C[C@@H]2O1)C)[C@H]1[C@H](O)[C@H](O)[C@H](O)[C@@H](CO)O1 LVTJOONKWUXEFR-FZRMHRINSA-N 0.000 description 1
- BWPIARFWQZKAIA-UHFFFAOYSA-N protriptyline Chemical compound C1=CC2=CC=CC=C2C(CCCNC)C2=CC=CC=C21 BWPIARFWQZKAIA-UHFFFAOYSA-N 0.000 description 1
- 229960002601 protriptyline Drugs 0.000 description 1
- 238000001671 psychotherapy Methods 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 238000010926 purge Methods 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- USPWKWBDZOARPV-UHFFFAOYSA-N pyrazolidine Chemical compound C1CNNC1 USPWKWBDZOARPV-UHFFFAOYSA-N 0.000 description 1
- DNXIASIHZYFFRO-UHFFFAOYSA-N pyrazoline Chemical compound C1CN=NC1 DNXIASIHZYFFRO-UHFFFAOYSA-N 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- JUJWROOIHBZHMG-UHFFFAOYSA-O pyridinium Chemical compound C1=CC=[NH+]C=C1 JUJWROOIHBZHMG-UHFFFAOYSA-O 0.000 description 1
- 125000005030 pyridylthio group Chemical group N1=C(C=CC=C1)S* 0.000 description 1
- 150000003230 pyrimidines Chemical group 0.000 description 1
- 150000003233 pyrroles Chemical class 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- ZVJHJDDKYZXRJI-UHFFFAOYSA-N pyrroline Natural products C1CC=NC1 ZVJHJDDKYZXRJI-UHFFFAOYSA-N 0.000 description 1
- 125000001422 pyrrolinyl group Chemical group 0.000 description 1
- 125000006085 pyrrolopyridyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- JWVCLYRUEFBMGU-UHFFFAOYSA-N quinazoline Chemical compound N1=CN=CC2=CC=CC=C21 JWVCLYRUEFBMGU-UHFFFAOYSA-N 0.000 description 1
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- 125000005493 quinolyl group Chemical group 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 125000004621 quinuclidinyl group Chemical group N12C(CC(CC1)CC2)* 0.000 description 1
- 238000007154 radical cyclization reaction Methods 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 230000036385 rapid eye movement (rem) sleep Effects 0.000 description 1
- HELXLJCILKEWJH-NCGAPWICSA-N rebaudioside A Chemical compound O([C@H]1[C@H](O)[C@@H](CO)O[C@H]([C@@H]1O[C@H]1[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O1)O)O[C@]12C(=C)C[C@@]3(C1)CC[C@@H]1[C@@](C)(CCC[C@]1([C@@H]3CC2)C)C(=O)O[C@H]1[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O1)O)[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O HELXLJCILKEWJH-NCGAPWICSA-N 0.000 description 1
- 229960003269 reboxetine mesylate Drugs 0.000 description 1
- 239000006215 rectal suppository Substances 0.000 description 1
- 238000006268 reductive amination reaction Methods 0.000 description 1
- 229950000659 remacemide Drugs 0.000 description 1
- 238000013548 repetitive transcranial magnetic stimulation Methods 0.000 description 1
- 230000001850 reproductive effect Effects 0.000 description 1
- 208000017443 reproductive system disease Diseases 0.000 description 1
- 230000007696 reproductive toxicity Effects 0.000 description 1
- 231100000372 reproductive toxicity Toxicity 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000029058 respiratory gaseous exchange Effects 0.000 description 1
- 208000023504 respiratory system disease Diseases 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 150000003284 rhodium compounds Chemical class 0.000 description 1
- JZCPYUJPEARBJL-UHFFFAOYSA-N rimonabant Chemical compound CC=1C(C(=O)NN2CCCCC2)=NN(C=2C(=CC(Cl)=CC=2)Cl)C=1C1=CC=C(Cl)C=C1 JZCPYUJPEARBJL-UHFFFAOYSA-N 0.000 description 1
- 229960003015 rimonabant Drugs 0.000 description 1
- 229960001534 risperidone Drugs 0.000 description 1
- RAPZEAPATHNIPO-UHFFFAOYSA-N risperidone Chemical compound FC1=CC=C2C(C3CCN(CC3)CCC=3C(=O)N4CCCCC4=NC=3C)=NOC2=C1 RAPZEAPATHNIPO-UHFFFAOYSA-N 0.000 description 1
- 229960004136 rivastigmine Drugs 0.000 description 1
- RZJQGNCSTQAWON-UHFFFAOYSA-N rofecoxib Chemical compound C1=CC(S(=O)(=O)C)=CC=C1C1=C(C=2C=CC=CC=2)C(=O)OC1 RZJQGNCSTQAWON-UHFFFAOYSA-N 0.000 description 1
- 229960000371 rofecoxib Drugs 0.000 description 1
- BPRHUIZQVSMCRT-VEUZHWNKSA-N rosuvastatin Chemical compound CC(C)C1=NC(N(C)S(C)(=O)=O)=NC(C=2C=CC(F)=CC=2)=C1\C=C\[C@@H](O)C[C@@H](O)CC(O)=O BPRHUIZQVSMCRT-VEUZHWNKSA-N 0.000 description 1
- 229960000672 rosuvastatin Drugs 0.000 description 1
- 108010068072 salmon calcitonin Proteins 0.000 description 1
- PGKXDIMONUAMFR-AREMUKBSSA-N saredutant Chemical compound C([C@H](CN(C)C(=O)C=1C=CC=CC=1)C=1C=C(Cl)C(Cl)=CC=1)CN(CC1)CCC1(NC(C)=O)C1=CC=CC=C1 PGKXDIMONUAMFR-AREMUKBSSA-N 0.000 description 1
- 229950004387 saredutant Drugs 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 150000003335 secondary amines Chemical class 0.000 description 1
- 229940124834 selective serotonin reuptake inhibitor Drugs 0.000 description 1
- 239000012896 selective serotonin reuptake inhibitor Substances 0.000 description 1
- 229960003946 selegiline Drugs 0.000 description 1
- 208000025874 separation anxiety disease Diseases 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000003723 serotonin 1A agonist Substances 0.000 description 1
- 239000002400 serotonin 2A antagonist Substances 0.000 description 1
- 239000003369 serotonin 5-HT3 receptor antagonist Substances 0.000 description 1
- 239000003775 serotonin noradrenalin reuptake inhibitor Substances 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- GVPIXRLYKVFFMK-UHFFFAOYSA-N setiptiline Chemical compound C12=CC=CC=C2CC2=CC=CC=C2C2=C1CN(C)CC2 GVPIXRLYKVFFMK-UHFFFAOYSA-N 0.000 description 1
- 229950002275 setiptiline Drugs 0.000 description 1
- 230000036299 sexual function Effects 0.000 description 1
- 239000004208 shellac Substances 0.000 description 1
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 1
- 229940113147 shellac Drugs 0.000 description 1
- 235000013874 shellac Nutrition 0.000 description 1
- UNAANXDKBXWMLN-UHFFFAOYSA-N sibutramine Chemical compound C=1C=C(Cl)C=CC=1C1(C(N(C)C)CC(C)C)CCC1 UNAANXDKBXWMLN-UHFFFAOYSA-N 0.000 description 1
- 229960004425 sibutramine Drugs 0.000 description 1
- DEIYFTQMQPDXOT-UHFFFAOYSA-N sildenafil citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.CCCC1=NN(C)C(C(N2)=O)=C1N=C2C(C(=CC=1)OCC)=CC=1S(=O)(=O)N1CCN(C)CC1 DEIYFTQMQPDXOT-UHFFFAOYSA-N 0.000 description 1
- 229960002855 simvastatin Drugs 0.000 description 1
- RYMZZMVNJRMUDD-HGQWONQESA-N simvastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)C(C)(C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 RYMZZMVNJRMUDD-HGQWONQESA-N 0.000 description 1
- 230000003860 sleep quality Effects 0.000 description 1
- 230000037321 sleepiness Effects 0.000 description 1
- 230000005586 smoking cessation Effects 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 239000012279 sodium borohydride Substances 0.000 description 1
- 229910000033 sodium borohydride Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- SUKJFIGYRHOWBL-UHFFFAOYSA-N sodium hypochlorite Chemical compound [Na+].Cl[O-] SUKJFIGYRHOWBL-UHFFFAOYSA-N 0.000 description 1
- 235000009518 sodium iodide Nutrition 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 229960004025 sodium salicylate Drugs 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- AEQFSUDEHCCHBT-UHFFFAOYSA-M sodium valproate Chemical compound [Na+].CCCC(C([O-])=O)CCC AEQFSUDEHCCHBT-UHFFFAOYSA-M 0.000 description 1
- 229940084026 sodium valproate Drugs 0.000 description 1
- ILJOYZVVZZFIKA-UHFFFAOYSA-M sodium;1,1-dioxo-1,2-benzothiazol-3-olate;hydrate Chemical compound O.[Na+].C1=CC=C2C(=O)[N-]S(=O)(=O)C2=C1 ILJOYZVVZZFIKA-UHFFFAOYSA-M 0.000 description 1
- 239000007901 soft capsule Substances 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 208000018198 spasticity Diseases 0.000 description 1
- 239000004059 squalene synthase inhibitor Substances 0.000 description 1
- 229940032147 starch Drugs 0.000 description 1
- 125000004079 stearyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 239000006190 sub-lingual tablet Substances 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 230000035322 succinylation Effects 0.000 description 1
- 238000010613 succinylation reaction Methods 0.000 description 1
- 229960004793 sucrose Drugs 0.000 description 1
- 235000000346 sugar Nutrition 0.000 description 1
- 239000007940 sugar coated tablet Substances 0.000 description 1
- NVBFHJWHLNUMCV-UHFFFAOYSA-N sulfamide Chemical compound NS(N)(=O)=O NVBFHJWHLNUMCV-UHFFFAOYSA-N 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-L sulfite Chemical class [O-]S([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-L 0.000 description 1
- 150000003456 sulfonamides Chemical class 0.000 description 1
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 1
- UDYFLDICVHJSOY-UHFFFAOYSA-N sulfur trioxide-pyridine complex Substances O=S(=O)=O.C1=CC=NC=C1 UDYFLDICVHJSOY-UHFFFAOYSA-N 0.000 description 1
- 239000000516 sunscreening agent Substances 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 238000001308 synthesis method Methods 0.000 description 1
- 229920001059 synthetic polymer Polymers 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 108060008037 tachykinin Proteins 0.000 description 1
- 229960001685 tacrine Drugs 0.000 description 1
- YLJREFDVOIBQDA-UHFFFAOYSA-N tacrine Chemical compound C1=CC=C2C(N)=C(CCCC3)C3=NC2=C1 YLJREFDVOIBQDA-UHFFFAOYSA-N 0.000 description 1
- 229950008418 talipexole Drugs 0.000 description 1
- 229950000505 tandospirone Drugs 0.000 description 1
- DMLGUJHNIWGCKM-DPFKZJTMSA-N tandospirone citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.O=C([C@@H]1[C@H]2CC[C@H](C2)[C@@H]1C1=O)N1CCCCN(CC1)CCN1C1=NC=CC=N1 DMLGUJHNIWGCKM-DPFKZJTMSA-N 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- WZWYJBNHTWCXIM-UHFFFAOYSA-N tenoxicam Chemical compound O=C1C=2SC=CC=2S(=O)(=O)N(C)C1=C(O)NC1=CC=CC=N1 WZWYJBNHTWCXIM-UHFFFAOYSA-N 0.000 description 1
- 229960002871 tenoxicam Drugs 0.000 description 1
- 125000006633 tert-butoxycarbonylamino group Chemical group 0.000 description 1
- ITVZWHNMWINGRT-UEWDXFNNSA-N tert-butyl (2S)-2-[(3-chlorophenyl)methyl]-4,4-difluoro-3-hydroxypyrrolidine-1-carboxylate Chemical compound ClC=1C=C(C=CC=1)C[C@@H]1N(CC(C1O)(F)F)C(=O)OC(C)(C)C ITVZWHNMWINGRT-UEWDXFNNSA-N 0.000 description 1
- OPOIYZNXEBVGGO-LSDHHAIUSA-N tert-butyl (2S,3R)-2-[(3-chlorophenyl)methyl]-3-(ethylsulfonylamino)-4,4-difluoropyrrolidine-1-carboxylate Chemical compound ClC=1C=C(C=CC=1)C[C@@H]1N(CC([C@@H]1NS(=O)(=O)CC)(F)F)C(=O)OC(C)(C)C OPOIYZNXEBVGGO-LSDHHAIUSA-N 0.000 description 1
- ZRSADWXDLRAQRK-UHFFFAOYSA-N tert-butyl 2,2-difluoropyrrolidine-1-carboxylate Chemical compound C(C)(C)(C)OC(=O)N1C(CCC1)(F)F ZRSADWXDLRAQRK-UHFFFAOYSA-N 0.000 description 1
- SDNFLRRHUBWQLI-UHFFFAOYSA-N tert-butyl 2-[(3-chloro-2-fluorophenyl)methyl]-4,4-difluoro-3-hydroxypyrrolidine-1-carboxylate Chemical compound ClC=1C(=C(C=CC=1)CC1N(CC(C1O)(F)F)C(=O)OC(C)(C)C)F SDNFLRRHUBWQLI-UHFFFAOYSA-N 0.000 description 1
- XTDXZSGSIMLARD-UHFFFAOYSA-N tert-butyl 2h-pyridine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CC=CC=C1 XTDXZSGSIMLARD-UHFFFAOYSA-N 0.000 description 1
- NXWQSZKLDKEMFW-UHFFFAOYSA-N tert-butyl 4,4-difluoro-2-[[2-fluoro-3-(3-fluorophenyl)phenyl]methyl]-3-hydroxypyrrolidine-1-carboxylate Chemical compound FC1=C(C=CC=C1CC1N(CC(C1O)(F)F)C(=O)OC(C)(C)C)C1=CC(=CC=C1)F NXWQSZKLDKEMFW-UHFFFAOYSA-N 0.000 description 1
- 125000006318 tert-butyl amino group Chemical group [H]N(*)C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- FGTJJHCZWOVVNH-UHFFFAOYSA-N tert-butyl-[tert-butyl(dimethyl)silyl]oxy-dimethylsilane Chemical compound CC(C)(C)[Si](C)(C)O[Si](C)(C)C(C)(C)C FGTJJHCZWOVVNH-UHFFFAOYSA-N 0.000 description 1
- YBRBMKDOPFTVDT-UHFFFAOYSA-N tert-butylamine Chemical compound CC(C)(C)N YBRBMKDOPFTVDT-UHFFFAOYSA-N 0.000 description 1
- 125000001981 tert-butyldimethylsilyl group Chemical group [H]C([H])([H])[Si]([H])(C([H])([H])[H])[*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- KBLZDCFTQSIIOH-UHFFFAOYSA-M tetrabutylazanium;perchlorate Chemical compound [O-]Cl(=O)(=O)=O.CCCC[N+](CCCC)(CCCC)CCCC KBLZDCFTQSIIOH-UHFFFAOYSA-M 0.000 description 1
- 125000006337 tetrafluoro ethyl group Chemical group 0.000 description 1
- ZXLDQJLIBNPEFJ-UHFFFAOYSA-N tetrahydro-beta-carboline Natural products C1CNC(C)C2=C1C1=CC=C(OC)C=C1N2 ZXLDQJLIBNPEFJ-UHFFFAOYSA-N 0.000 description 1
- UJJLJRQIPMGXEZ-SCSAIBSYSA-N tetrahydrofuran-2-carboxylic acid Chemical compound OC(=O)[C@H]1CCCO1 UJJLJRQIPMGXEZ-SCSAIBSYSA-N 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 1
- 125000000147 tetrahydroquinolinyl group Chemical group N1(CCCC2=CC=CC=C12)* 0.000 description 1
- 125000005958 tetrahydrothienyl group Chemical group 0.000 description 1
- RAOIDOHSFRTOEL-UHFFFAOYSA-N tetrahydrothiophene Chemical compound C1CCSC1 RAOIDOHSFRTOEL-UHFFFAOYSA-N 0.000 description 1
- 125000004632 tetrahydrothiopyranyl group Chemical group S1C(CCCC1)* 0.000 description 1
- 125000005329 tetralinyl group Chemical group C1(CCCC2=CC=CC=C12)* 0.000 description 1
- 150000003536 tetrazoles Chemical class 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 229940126585 therapeutic drug Drugs 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 125000001984 thiazolidinyl group Chemical group 0.000 description 1
- CBDKQYKMCICBOF-UHFFFAOYSA-N thiazoline Chemical compound C1CN=CS1 CBDKQYKMCICBOF-UHFFFAOYSA-N 0.000 description 1
- 125000002769 thiazolinyl group Chemical group 0.000 description 1
- 150000008634 thiazolopyrimidines Chemical class 0.000 description 1
- DBDCNCCRPKTRSD-UHFFFAOYSA-N thieno[3,2-b]pyridine Chemical compound C1=CC=C2SC=CC2=N1 DBDCNCCRPKTRSD-UHFFFAOYSA-N 0.000 description 1
- RBNBDIMXFJYDLQ-UHFFFAOYSA-N thieno[3,2-d]pyrimidine Chemical compound C1=NC=C2SC=CC2=N1 RBNBDIMXFJYDLQ-UHFFFAOYSA-N 0.000 description 1
- 229940125670 thienopyridine Drugs 0.000 description 1
- 239000002175 thienopyridine Substances 0.000 description 1
- 125000004588 thienopyridyl group Chemical group S1C(=CC2=C1C=CC=N2)* 0.000 description 1
- XSROQCDVUIHRSI-UHFFFAOYSA-N thietane Chemical compound C1CSC1 XSROQCDVUIHRSI-UHFFFAOYSA-N 0.000 description 1
- 125000002053 thietanyl group Chemical group 0.000 description 1
- VOVUARRWDCVURC-UHFFFAOYSA-N thiirane Chemical compound C1CS1 VOVUARRWDCVURC-UHFFFAOYSA-N 0.000 description 1
- 125000001730 thiiranyl group Chemical group 0.000 description 1
- DUYAAUVXQSMXQP-UHFFFAOYSA-M thioacetate Chemical group CC([S-])=O DUYAAUVXQSMXQP-UHFFFAOYSA-M 0.000 description 1
- AWIJRPNMLHPLNC-UHFFFAOYSA-N thiocarboxylic acid group Chemical group C(=S)O AWIJRPNMLHPLNC-UHFFFAOYSA-N 0.000 description 1
- BRNULMACUQOKMR-UHFFFAOYSA-N thiomorpholine Chemical compound C1CSCCN1 BRNULMACUQOKMR-UHFFFAOYSA-N 0.000 description 1
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 1
- UMGDCJDMYOKAJW-UHFFFAOYSA-N thiourea Chemical group NC(N)=S UMGDCJDMYOKAJW-UHFFFAOYSA-N 0.000 description 1
- 210000001685 thyroid gland Anatomy 0.000 description 1
- 239000005495 thyroid hormone Substances 0.000 description 1
- 229940036555 thyroid hormone Drugs 0.000 description 1
- YUKARLAABCGMCN-PKLMIRHRSA-N tiagabine hydrochloride Chemical compound Cl.C1=CSC(C(=CCCN2C[C@@H](CCC2)C(O)=O)C2=C(C=CS2)C)=C1C YUKARLAABCGMCN-PKLMIRHRSA-N 0.000 description 1
- 229960002410 tiagabine hydrochloride Drugs 0.000 description 1
- 231100000886 tinnitus Toxicity 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- OGIDPMRJRNCKJF-UHFFFAOYSA-N titanium oxide Inorganic materials [Ti]=O OGIDPMRJRNCKJF-UHFFFAOYSA-N 0.000 description 1
- 208000004371 toothache Diseases 0.000 description 1
- 229960004394 topiramate Drugs 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 238000000844 transformation Methods 0.000 description 1
- 230000014616 translation Effects 0.000 description 1
- 229960003797 tranylcypromine sulfate Drugs 0.000 description 1
- 230000008733 trauma Effects 0.000 description 1
- OHHDIOKRWWOXMT-UHFFFAOYSA-N trazodone hydrochloride Chemical compound [H+].[Cl-].ClC1=CC=CC(N2CCN(CCCN3C(N4C=CC=CC4=N3)=O)CC2)=C1 OHHDIOKRWWOXMT-UHFFFAOYSA-N 0.000 description 1
- 229960002301 trazodone hydrochloride Drugs 0.000 description 1
- 150000003626 triacylglycerols Chemical class 0.000 description 1
- DBGVGMSCBYYSLD-UHFFFAOYSA-N tributylstannane Chemical compound CCCC[SnH](CCCC)CCCC DBGVGMSCBYYSLD-UHFFFAOYSA-N 0.000 description 1
- 125000003866 trichloromethyl group Chemical group ClC(Cl)(Cl)* 0.000 description 1
- FEQPHYCEZKWPNE-UHFFFAOYSA-K trichlororhodium;triphenylphosphane Chemical compound Cl[Rh](Cl)Cl.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 FEQPHYCEZKWPNE-UHFFFAOYSA-K 0.000 description 1
- LALRXNPLTWZJIJ-UHFFFAOYSA-N triethylborane Chemical compound CCB(CC)CC LALRXNPLTWZJIJ-UHFFFAOYSA-N 0.000 description 1
- IMNIMPAHZVJRPE-UHFFFAOYSA-N triethylenediamine Chemical compound C1CN2CCN1CC2 IMNIMPAHZVJRPE-UHFFFAOYSA-N 0.000 description 1
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 1
- 125000005034 trifluormethylthio group Chemical group FC(S*)(F)F 0.000 description 1
- WTVXIBRMWGUIMI-UHFFFAOYSA-N trifluoro($l^{1}-oxidanylsulfonyl)methane Chemical group [O]S(=O)(=O)C(F)(F)F WTVXIBRMWGUIMI-UHFFFAOYSA-N 0.000 description 1
- 125000004044 trifluoroacetyl group Chemical group FC(C(=O)*)(F)F 0.000 description 1
- MYMLGBAVNHFRJS-UHFFFAOYSA-N trifluoromethanamine Chemical group NC(F)(F)F MYMLGBAVNHFRJS-UHFFFAOYSA-N 0.000 description 1
- 125000005951 trifluoromethanesulfonyloxy group Chemical group 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- 125000001889 triflyl group Chemical group FC(F)(F)S(*)(=O)=O 0.000 description 1
- 206010044652 trigeminal neuralgia Diseases 0.000 description 1
- 229960001032 trihexyphenidyl Drugs 0.000 description 1
- 229940035722 triiodothyronine Drugs 0.000 description 1
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- HUYHHHVTBNJNFM-UHFFFAOYSA-N trimethylsilylsilicon Chemical compound C[Si](C)(C)[Si] HUYHHHVTBNJNFM-UHFFFAOYSA-N 0.000 description 1
- BZVJOYBTLHNRDW-UHFFFAOYSA-N triphenylmethanamine Chemical compound C=1C=CC=CC=1C(C=1C=CC=CC=1)(N)C1=CC=CC=C1 BZVJOYBTLHNRDW-UHFFFAOYSA-N 0.000 description 1
- OXFUXNFMHFCELM-UHFFFAOYSA-N tripropan-2-yl phosphate Chemical compound CC(C)OP(=O)(OC(C)C)OC(C)C OXFUXNFMHFCELM-UHFFFAOYSA-N 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 229960000281 trometamol Drugs 0.000 description 1
- 229940046728 tumor necrosis factor alpha inhibitor Drugs 0.000 description 1
- 239000002451 tumor necrosis factor inhibitor Substances 0.000 description 1
- 208000014001 urinary system disease Diseases 0.000 description 1
- 239000006216 vaginal suppository Substances 0.000 description 1
- 208000019553 vascular disease Diseases 0.000 description 1
- 239000003038 vasopressin antagonist Substances 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 229960004688 venlafaxine Drugs 0.000 description 1
- PNVNVHUZROJLTJ-UHFFFAOYSA-N venlafaxine Chemical compound C1=CC(OC)=CC=C1C(CN(C)C)C1(O)CCCCC1 PNVNVHUZROJLTJ-UHFFFAOYSA-N 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 230000008673 vomiting Effects 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
- WJJYZXPHLSLMGE-UHFFFAOYSA-N xaliproden Chemical compound FC(F)(F)C1=CC=CC(C=2CCN(CCC=3C=C4C=CC=CC4=CC=3)CC=2)=C1 WJJYZXPHLSLMGE-UHFFFAOYSA-N 0.000 description 1
- 229960004664 xaliproden Drugs 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
- PMBLXLOXUGVTGB-UHFFFAOYSA-N zanapezil Chemical compound C=1C=C2CCCCNC2=CC=1C(=O)CCC(CC1)CCN1CC1=CC=CC=C1 PMBLXLOXUGVTGB-UHFFFAOYSA-N 0.000 description 1
- 229950010696 zanapezil Drugs 0.000 description 1
- 229960002791 zimeldine Drugs 0.000 description 1
- OYPPVKRFBIWMSX-SXGWCWSVSA-N zimeldine Chemical compound C=1C=CN=CC=1C(=C/CN(C)C)\C1=CC=C(Br)C=C1 OYPPVKRFBIWMSX-SXGWCWSVSA-N 0.000 description 1
- 239000011592 zinc chloride Substances 0.000 description 1
- 235000005074 zinc chloride Nutrition 0.000 description 1
- UBQNRHZMVUUOMG-UHFFFAOYSA-N zonisamide Chemical compound C1=CC=C2C(CS(=O)(=O)N)=NOC2=C1 UBQNRHZMVUUOMG-UHFFFAOYSA-N 0.000 description 1
- 229960002911 zonisamide Drugs 0.000 description 1
- OENHQHLEOONYIE-JLTXGRSLSA-N β-Carotene Chemical compound CC=1CCCC(C)(C)C=1\C=C\C(\C)=C\C=C\C(\C)=C\C=C\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C OENHQHLEOONYIE-JLTXGRSLSA-N 0.000 description 1
- 125000004933 β-carbolinyl group Chemical group C1(=NC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/06—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/4025—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil not condensed and containing further heterocyclic rings, e.g. cromakalim
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/42—Oxazoles
- A61K31/422—Oxazoles not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
- A61K31/427—Thiazoles not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4439—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. omeprazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/04—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D207/10—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D207/14—Nitrogen atoms not forming part of a nitro radical
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/10—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/10—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D407/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00
- C07D407/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing two hetero rings
- C07D407/06—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D407/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00
- C07D407/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing two hetero rings
- C07D407/08—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing two hetero rings linked by a carbon chain containing alicyclic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/10—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/06—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/10—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a carbon chain containing aromatic rings
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Pyrrole Compounds (AREA)
Abstract
Description
本發明係有關一種雜環化合物,特定言之,具有食慾激素(orexin)第2型受體促效劑活性之雜環化合物。
食慾激素為特異性地由稀疏位在外側下視丘與其周圍區域的特定神經元產生,且由食慾激素A與食慾激素B兩種亞型組成。食慾激素A與食慾激素B二者均為食慾激素受體(其等係主要存在於腦部的G蛋白質偶聯受體)之內因性配體,且已知食慾激素受體有第1型與第2型之兩種亞型(非專利案文獻1)。
由於產生食慾激素的神經元(食慾激素神經元)位在攝食中樞附近,在腦室內投予食慾激素肽會增加食物攝取,食慾激素最早是具有作為調節攝食行為的神經肽而受到注意。然而,之後有報告指出狗的猝睡症原因為食慾激素第2型受體的遺傳變異(非專利案文獻2),亦才注意到食慾激素在控制睡眠與清醒上之角色。
在採用具有變性食慾激素神經元的轉殖基因小鼠及由此小鼠與過度表現食慾激素之轉殖基因小鼠雜交得到的雙重轉殖基因小鼠的試
驗中發現,因食慾激素神經元退化所產生之類似猝睡症的症狀可因食慾激素的持續表現而消失。同樣地,當經腦室內投予食慾激素肽至具有變性食慾激素神經元之轉殖基因小鼠中時,亦觀察到改善類似猝睡症的症狀(非專利案文獻3)。食慾激素第2型受體經剔除的小鼠已顯示食慾激素第2型受體對維持清醒之重要性(非專利案文獻4,非專利案文獻5)。此等背景顯示食慾激素第2型受體促效劑成為猝睡症的醫療藥物或其他出現過度嗜睡之睡眠疾病的醫療藥物(非專利案文獻6)。
此外,其顯示選擇性作用在食慾激素第2型受體之肽類促效劑可以為攝取高脂肪膳食的小鼠改善肥胖症(非專利案文獻7)。
此外,其顯示經腦室內投予食慾激素肽會縮短大鼠的全身麻醉時間(非專利案文獻8)。
此外,其顯示睡眠呼吸暫停症候群患者的血漿中食慾激素A濃度低(非專利案文獻9)。
此外,其顯示經腦室內投予食慾激素肽可改善具有認知力障礙的加速衰老模式小鼠(SAMP8)的記憶力(非專利案文獻10)。
此外,其顯示食慾激素第2型受體促效劑將成為心臟衰竭的醫療性藥物(專利案文獻1,非專利案文獻11)。
此外,其顯示帕金森氏症(Parkinson’s disease)患者的白天睡眠係由食慾激素神經餘毒所致(非專利案文獻12)。
此外,其顯示食慾激素調節骨質形成與骨質流失,及食慾激素第2型受體促效劑將成為與骨質流失相關之疾病(如:骨質疏鬆症、類風濕關節炎等)之醫療性藥物(專利案文獻2)。
此外,其顯示食慾激素受體促效劑適用於預防或治療敗血症、嚴重敗血症與敗血性休克,因為在敗血性休克模式小鼠中,僅需從末梢持續地投予食慾激素即可顯著地改善死亡率(專利案文獻3)。
因此,具有食慾激素第2型受體促效劑活性之化合物係被期待適用為猝睡症、特異性嗜睡症、嗜睡症、睡眠呼吸暫停症候群、如昏迷等意識障礙、伴隨出現類似猝睡症症狀之猝睡症症候群、伴隨白天嗜睡之嗜睡症候群(例如:帕金森氏症、格林-巴利症候群(Guillain-Barre syndrome)與克萊-李文症候群(Kleine Levin syndrome))、阿茲海默症(Alzheimer)、肥胖症、胰島素抗性症候群、心臟衰竭、與骨質流失相關之疾病、敗血症等之新穎醫療性藥物,再者,適用為麻醉藥拮抗劑、因麻醉引起的副作用與併發症之預防或醫療性藥物。
已報告一種磺醯胺衍生物,其係下式代表之化合物。
其中各代號係如文獻中之記載(專利案文獻4)。
此外,已報告下列化合物為具有食慾激素第2型受體促效劑活性之化合物。
一種下式代表之化合物,
其中各代號係如文獻中之記載(專利案文獻5)。
一種下式代表之化合物,
其中各代號係如文獻中之記載(專利案文獻6)。
一種下式代表之化合物,
其中各代號係如文獻中之記載(專利案文獻7)。
一種下式代表之化合物,
其中各代號係如文獻中之記載(專利案文獻8)。
一種下式代表之化合物,
其中各代號係如文獻中之記載(專利案文獻9)。
一種下式代表之化合物,
其中各代號係如文獻中之記載(專利案文獻10)。
一種下式代表之化合物,
其中各代號係如文獻中之記載(專利案文獻11)。
仍需要開發一種具有食慾激素第2型受體促效劑活性之新穎化合物。
[文獻列表]
[專利文獻]
[專利文獻1]WO 2015/073707 A1
[專利文獻2]WO 2015/048091 A1
[專利文獻3]WO 2015/147240 A1
[專利文獻4]WO 2012/137982 A9
[專利文獻5]WO 2017/135306 A1
[專利文獻6]WO 2018/164191 A1
[專利文獻7]WO 2018/164192 A1
[專利文獻8]WO 2019/027003 A1
[專利文獻9]WO 2019/027058 A1
[專利文獻10]WO 2020/004536 A1
[專利文獻11]WO 2020/004537 A1
[非專利文獻]
[非專利文獻1]Cell, Vol.92, 573-585, 1998
[非專利文獻2]Cell, Vol.98, 365-376, 1999
[非專利文獻3]Proc. Natl. Acad. Sci. USA, Vol.101, 4649-4654, 2004
[非專利文獻4]Cell, Vol.98, 437-451, 1999
[非專利文獻5]Neuron, Vol.38, 715-730, 2003
[非專利文獻6]CNS藥物s, Vol.27, 83-90, 2013
[非專利文獻7]Cell代謝,Vol.9, 64-76, 2009
[非專利文獻8]Neuroscience, Vol.121, 855-863, 2003
[非專利文獻9]Respiration, Vol.71, 575-579, 2004
[非專利文獻10]Peptides, Vol.23, 1683-1688, 2002
[非專利文獻11]Journal of the American College of Cardiology. Vol. 66, 2015, Pages 2522-2533
[非專利文獻12]Brain. Vol. 130, 2007, Pages 1586-1595
本發明之目的係提供一種具有食慾激素第2型受體促效劑活性之雜環化合物。
本發明者已發現一種下式(I)代表之化合物或其鹽(本說明書中有時候稱為化合物(I))具有食慾激素第2型受體促效劑活性。進一步研究進而完成本發明。
因此,本發明係關於下述。
[1]
一種式(I)代表之化合物或其鹽,
其中
R1為視需要經取代之C1-6烷基、視需要經取代之單-或二-C1-6烷基胺基、視需要經取代之C3-6環烷基、或視需要經取代之3-至14-員非芳香族雜環基;
R2為氫原子、氟原子、視需要經取代之C1-6烷基、或視需要經取代之C3-6環烷基;
R3為醯基、視需要經取代之C1-6烷基、視需要經取代之C3-6環烷基、視需要經取代之C6-14芳基、視需要經取代之3-至14-員非芳香族雜環基、或視需要經取代之5-至14-員芳香族雜環基;及
A環為視需要更經取代之C6-14芳香烴環、或視需要更經取代之5-至14-員芳香族雜環。
[2]
上述[1]之化合物或鹽,其中
R1為
(1)C1-6烷基、
(2)單-或二-C1-6烷基胺基、或
(3)C3-6環烷基;
R2為
(1)氫原子、
(2)氟原子、或
(3)C1-6烷基;
R3為
(1)視需要經1至3個選自下列取代基取代之C1-6烷基-羰基、
(a)鹵原子、
(b)羥基、及
(c)氰基,
(2)C1-6烷氧基-羰基,
(3)視需要經1至3個選自下列取代基取代之C3-10環烷基-羰基,其中,該C3-10環烷基-羰基之C3-10環烷基部分視需要經橋接,
(a)鹵原子、
(b)羥基、
(c)氰基、及
(d)C1-6烷基,
(4)視需要經1至3個選自下列取代基取代之3-至14-員非芳香族雜環基羰基
(a)鹵原子、
(b)羥基、及
(c)C1-6烷基,
(5)單-或二-C1-6烷基-胺甲醯基,
(6)N-C1-6烷基-N-C1-6烷氧基-胺甲醯基,或
(7)N-C1-6烷基-N’,N’-二-C1-6烷基肼-羰基;及
A環為
(1)更經1個選自下列取代基取代之苯環:
(a)視需要經1至3個選自下列取代基取代之C6-14芳基,
(i)鹵原子、
(ii)視需要經鹵化之C1-6烷基、及
(iii)視需要經鹵化之C1-6烷氧基,及
(b)視需要經1至3個選自下列取代基取代之5-至14-員芳香族雜環基,
(i)視需要經1至3個選自鹵原子與羥基之取代基取代之C1-6烷基、
(ii)C1-6烷氧基、
(iii)鹵原子、及
(iv)C1-6烷氧基-羰基,並且
該苯環視需要更經1至3個鹵原子取代,或
(2)更經1個視需要經1至3個鹵原子取代之C6-14芳基所取代之5-或6-員芳香族雜環。
[3]
上述[1]之化合物或鹽,其中
R1為
(1)C1-6烷基、
(2)單-或二-C1-6烷基胺基、或
(3)C3-6環烷基;
R2為
(1)氫原子、或
(2)氟原子;
R3為
(1)視需要經1至3個羥基取代之C1-6烷基-羰基,
(2)視需要經1至3個選自下列取代基取代之C3-10環烷基-羰基,其中,該C3-10環烷基-羰基之C3-10環烷基部分視需要經橋接,
(a)鹵原子、及
(b)羥基,
(3)3-至8-員單環非芳香族雜環基羰基,或
(4)單-或二-C1-6烷基-胺甲醯基;及
A環為更經視需要經1至3個選自下列取代基取代之1個C6-14芳基所取代的苯環,
(i)鹵原子、及
(ii)視需要經鹵化之C1-6烷基,並且
該苯環視需要更經1至3個鹵原子取代。
[4]
上述[1]之化合物或鹽,其中
R1為
(1)C1-6烷基、或
(2)單-或二-C1-6烷基胺基;
R2為
(1)氫原子、或
(2)氟原子;
R3為
(1)視需要經1至3個羥基取代之C1-6烷基-羰基、
(2)3-至8-員單環非芳香族雜環基羰基、或
(3)單-或二-C1-6烷基-胺甲醯基;及
A環為更經視需要經1至3個選自下列取代基取代之1個C6-14芳基所取代的苯環,
(i)鹵原子、及
(ii)C1-6烷基,並且
該苯環視需要更經1至3個鹵原子取代。
[5]
一種N'-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-4-氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}-N,N-二甲基硫醯二胺(SULFURIC DIAMIDE)或其鹽。
[6]
一種N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺或其鹽。
[7]
一種N-{(2S,3R)-4,4-二氟-1-(2-羥基-2-甲基丙醯基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺或其鹽。
[8]
一種醫藥,係包含上述[1]至[7]中任一項之化合物或鹽。
[9]
如上述[8]之醫藥,係食慾激素第2型受體促效劑。
[10]
如上述[8]之醫藥,係預防或治療猝睡症之製劑。
[11]
如上述[1]至[7]中任一項之化合物或鹽,係用於預防或治療猝睡症。
[12]
一種在哺乳動物中活化食慾激素第2型受體之方法,係包括對該哺乳動物投予有效量之上述[1]至[7]中任一項之化合物或鹽。
[13]
一種預防或治療哺乳動物之猝睡症之方法,係包括對該哺乳動物投予有效量之上述[1]至[7]中任一項之化合物或鹽。
[14]
一種上述[1]至[7]中任一項之化合物或鹽之用途,係用以製造預防或治療猝睡症之製劑。
本發明化合物具有食慾激素第2型受體促效劑活性,並且適用為預防或治療猝睡症之製劑。
於下文中詳細地說明本說明書所採用之各取代基之定義。除非另有說明,否則各取代基之定義如下述。
本說明書中,「鹵原子」實例包括:氟、氯、溴及碘。
本說明書中,「C1-6烷基」實例包括:甲基、乙基、丙基、異丙基、丁基、異丁基、第二丁基、第三丁基、戊基、異戊基、新戊基、1-乙基丙基、己基、異己基、1,1-二甲基丁基、2,2-二甲基丁基、3,3-二甲基丁基與2-乙基丁基。
本說明書中,「視需要經鹵化之C1-6烷基」實例包括:視需要具有1至7個,較佳係1至5個鹵原子之C1-6烷基。其具體例包括:甲基、氯甲基、二氟甲基、三氯甲基、三氟甲基、乙基、2-溴乙基、2,2,2-三氟乙基、四氟乙基、五氟乙基、丙基、2,2-二氟丙基、3,3,3-三氟丙基、異丙基、丁基、4,4,4-三氟丁基、異丁基、第二丁基、第三丁基、戊基、異戊基、新戊基、5,5,5-三氟戊基、己基及6,6,6-三氟己基。
本說明書中,「C2-6烯基」實例包括:乙烯基、1-丙烯基、2-丙烯基、2-甲基-1-丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、3-甲基-2-丁烯基、1-戊烯基、2-戊烯基、3-戊烯基、4-戊烯基、4-甲基-3-戊烯基、1-己烯基、3-己烯基及5-己烯基。
本說明書中,「C2-6炔基」實例包括:乙炔基、1-丙炔基、2-丙炔基、1-丁炔基、2-丁炔基、3-丁炔基、1-戊炔基、2-戊炔基、3-戊炔基、4-戊炔基、1-己炔基、2-己炔基、3-己炔基、4-己炔基、5-己炔基及4-甲基-2-戊炔基。
本說明書中,「C3-10環烷基」實例包括:環丙基、環丁基、環戊基、環己基、環庚基、環辛基、雙環[2.2.1]庚基、雙環[2.2.2]辛基、雙環[3.2.1]辛基及金剛烷基。
本說明書中,「視需要經鹵化之C3-10環烷基」實例包括:視需要具有1至7個,較佳係1至5個鹵原子之C3-10環烷基。其具體例包括:環丙基、2,2-二氟環丙基、2,3-二氟環丙基、環丁基、二氟環丁基、環戊基、環己基、環庚基及環辛基。
本說明書中,「C3-10環烯基」實例包括:環丙烯基、環丁烯基、環戊烯基、環己烯基、環庚烯基及環辛烯基。
本說明書中,「C6-14芳基」實例包括:苯基、1-萘基、2-萘基、1-蒽基、2-蒽基及9-蒽基。
本說明書中,「C7-16芳烷基」實例包括:苯甲基、苯乙基、萘基甲基及苯基丙基。
本說明書中,「C1-6烷氧基」實例包括:甲氧基、乙氧基、丙氧基、異丙氧基、丁氧基、異丁氧基、第二丁氧基、第三丁氧基、戊基氧及己基氧。
本說明書中,「視需要經鹵化之C1-6烷氧基」實例包括:視需要具有1至7個,較佳係1至5個鹵原子之C1-6烷氧基。其具體例包括:甲氧基、二氟甲氧基、三氟甲氧基、乙氧基、2,2,2-三氟乙氧基、丙氧基、異丙氧基、丁氧基、4,4,4-三氟丁氧基、異丁氧基、第二丁氧基、戊氧基及己氧基。
本說明書中,「C3-10環烷基氧基」實例包括:環丙基氧基、環丁基氧基、環戊基氧基、環己基氧基、環庚基氧基及環辛基氧基。
本說明書中,「C1-6烷基硫基」實例包括:甲基硫基、乙基硫基、丙基硫基、異丙基硫基、丁基硫基、第二丁基硫基、第三丁基硫基、戊基硫基及己基硫基。
本說明書中,「視需要經鹵化之C1-6烷基硫基」實例包括:視需要具有1至7個,較佳係1至5個鹵原子之C1-6烷基硫基。其具體例包括:甲基硫基、二氟甲基硫基、三氟甲基硫基、乙基硫基、丙基硫基、異丙基硫基、丁基硫基、4,4,4-三氟丁基硫基、戊基硫基及己基硫基。
本說明書中,「C1-6烷基-羰基」實例包括:乙醯基、丙醯基、丁醯基、2-甲基丙醯基、戊醯基、3-甲基丁醯基、2-甲基丁醯基、2,2-二甲基丙醯基、己醯基及庚醯基。
本說明書中,「視需要經鹵化之C1-6烷基-羰基」實例包括:視需要具有1至7個,較佳係1至5個鹵原子之C1-6烷基-羰基。其具體例包括:乙
醯基、氯乙醯基、三氟乙醯基、三氯乙醯基、丙醯基、丁醯基、戊醯基及己醯基。
本說明書中,「C1-6烷氧基-羰基」實例包括:甲氧基羰基、乙氧基羰基、丙氧基羰基、異丙氧基羰基、丁氧基羰基、異丁氧基羰基、第二丁氧基羰基、第三丁氧基羰基、戊基氧羰基及己基氧羰基。
本說明書中,「C6-14芳基-羰基」實例包括:苯甲醯基、1-萘甲醯基及2-萘甲醯基。
本說明書中,「C7-16芳烷基-羰基」實例包括:苯基乙醯基及苯基丙醯基。
本說明書中,「5-至14-員芳香族雜環基羰基」實例包括:菸鹼醯基、異菸鹼醯基、噻吩甲醯基及呋喃甲醯基。
本說明書中,「3-至14-員非芳香族雜環基羰基」實例包括:嗎啉基羰基、哌啶基羰基及吡咯啶基羰基。
本說明書中,「單-或二-C1-6烷基-胺甲醯基」實例包括:甲基胺甲醯基、乙基胺甲醯基、二甲基胺甲醯基、二乙基胺甲醯基及N-乙基-N-甲基胺甲醯基。
本說明書中,「單-或二-C7-16芳烷基-胺甲醯基」實例包括:苯甲基胺甲醯基及苯乙基胺甲醯基。
本說明書中,「C1-6烷基磺醯基」實例包括:甲基磺醯基、乙基磺醯基、丙基磺醯基、異丙基磺醯基、丁基磺醯基、第二丁基磺醯基及第三丁基磺醯基。
本說明書中,「視需要經鹵化之C1-6烷基磺醯基」實例包括:視需要具有1至7個,較佳係1至5個鹵原子之C1-6烷基磺醯基。其具體例包括:甲基磺醯基、二氟甲基磺醯基、三氟甲基磺醯基、乙基磺醯基、丙基磺醯基、異丙基磺醯基、丁基磺醯基、4,4,4-三氟丁基磺醯基、戊基磺醯基及己基磺醯基。
本說明書中,「C6-14芳基磺醯基」實例包括:苯基磺醯基、1-萘基磺醯基及2-萘基磺醯基。
本說明書中,「取代基」實例包括:鹵原子、氰基、硝基、視需要經取代之烴基、視需要經取代之雜環基、醯基、視需要經取代之胺基、視需要經取代之胺甲醯基、視需要經取代之硫代胺甲醯基、視需要經取代之胺磺醯基、視需要經取代之羥基、視需要經取代之氫硫基(SH)及視需要經取代之矽烷基。
本說明書中,「烴基」(包括「視需要經取代之烴基」之「烴基」)實例包括:C1-6烷基、C2-6烯基、C2-6炔基、C3-10環烷基、C3-10環烯基、C6-14芳基及C7-16芳烷基。
本說明書中,「視需要經取代之烴基」實例包括:視需要具有選自下列取代基群組A中之取代基(群)之烴基。
[取代基群組A]
(1)鹵原子,
(2)硝基,
(3)氰基,
(4)側氧基,
(5)羥基,
(6)視需要經鹵化之C1-6烷氧基,
(7)C6-14芳基氧基(例如:苯氧基、萘氧基),
(8)C7-16芳烷基氧基(例如:苯甲基氧基),
(9)5-至14-員芳香族雜環基氧基(例如:吡啶基氧基),
(10)3-至14-員非芳香族雜環基氧基(例如:嗎啉基氧基、哌啶基氧基),
(11)C1-6烷基-羰基氧基(例如:乙醯氧基、丙醯基氧基),
(12)C6-14芳基-羰基氧基(例如:苯甲醯基氧基、1-萘甲醯基氧基、2-萘甲醯基氧基),
(13)C1-6烷氧基-羰基氧基(例如:甲氧基羰基氧基、乙氧基羰基氧基、丙氧基羰基氧基、丁氧基羰基氧基),
(14)單-或二-C1-6烷基-胺甲醯基氧基(例如:甲基胺甲醯基氧基、乙基胺甲醯基氧基、二甲基胺甲醯基氧基、二乙基胺甲醯基氧基),
(15)C6-14芳基-胺甲醯基氧基(例如:苯基胺甲醯基氧基、萘基胺甲醯基氧基),
(16)5-至14-員芳香族雜環基羰基氧基(例如:菸鹼醯基氧基),
(17)3-至14-員非芳香族雜環基羰基氧基(例如:嗎啉基羰基氧基、哌啶基羰基氧基),
(18)視需要經鹵化之C1-6烷基磺醯基氧基(例如:甲基磺醯基氧基、三氟甲基磺醯基氧基),
(19)視需要經C1-6烷基取代之C6-14芳基磺醯基氧基(例如:苯基磺醯基氧基、甲苯基磺醯基氧基),
(20)視需要經鹵化之C1-6烷基硫基,
(21)5-至14-員芳香族雜環基,
(22)3-至14-員非芳香族雜環基,
(23)甲醯基,
(24)羧基,
(25)視需要經鹵化之C1-6烷基-羰基,
(26)C6-14芳基-羰基,
(27)5-至14-員芳香族雜環基羰基,
(28)3-至14-員非芳香族雜環基羰基,
(29)C1-6烷氧基-羰基,
(30)C6-14芳基氧基-羰基(例如:苯基氧基羰基、1-萘基氧基羰基、2-萘基氧基羰基),
(31)C7-16芳烷基氧基-羰基(例如:苯甲基氧基羰基、苯乙基氧基羰基),
(32)胺甲醯基,
(33)硫代胺甲醯基,
(34)單-或二-C1-6烷基-胺甲醯基,
(35)C6-14芳基-胺甲醯基(例如:苯基胺甲醯基),
(36)5-至14-員芳香族雜環基胺甲醯基(例如:吡啶基胺甲醯基、噻吩基胺甲醯基),
(37)3-至14-員非芳香族雜環基胺甲醯基(例如:嗎啉基胺甲醯基、哌啶基胺甲醯基),
(38)視需要經鹵化之C1-6烷基磺醯基,
(39)C6-14芳基磺醯基,
(40)5-至14-員芳香族雜環基磺醯基(例如:吡啶基磺醯基、噻吩基磺醯基),
(41)視需要經鹵化之C1-6烷基亞磺醯基,
(42)C6-14芳基亞磺醯基(例如:苯基亞磺醯基、1-萘基亞磺醯基、2-萘基亞磺醯基),
(43)5-至14-員芳香族雜環基亞磺醯基(例如:吡啶基亞磺醯基、噻吩基亞磺醯基),
(44)胺基,
(45)單-或二-C1-6烷基胺基(例如:甲基胺基、乙基胺基、丙基胺基、異丙基胺基、丁基胺基、二甲基胺基、二乙胺基、二丙基胺基、二丁基胺基、N-乙基-N-甲基胺基),
(46)單-或二-C6-14芳基胺基(例如:苯基胺基),
(47)5-至14-員芳香族雜環基胺基(例如:吡啶基胺基),
(48)C7-16芳烷基胺基(例如:苯甲基胺基),
(49)甲醯基胺基,
(50)C1-6烷基-羰基胺基(例如:乙醯基胺基、丙醯基胺基、丁醯基胺基),
(51)(C1-6烷基)(C1-6烷基-羰基)胺基(例如:N-乙醯基-N-甲基胺基),
(52)C6-14芳基-羰基胺基(例如:苯基羰基胺基、萘基羰基胺基),
(53)C1-6烷氧基-羰基胺基(例如:甲氧基羰基胺基、乙氧基羰基胺基、丙氧基羰基胺基、丁氧基羰基胺基、第三丁氧基羰基胺基),
(54)C7-16芳烷基氧基-羰基胺基(例如:苯甲基氧基羰基胺基),
(55)C1-6烷基磺醯基胺基(例如:甲基磺醯基胺基、乙基磺醯基胺基),
(56)視需要經C1-6烷基取代之C6-14芳基磺醯基胺基(例如:苯基磺醯基胺基、甲苯磺醯基胺基),
(57)視需要經鹵化之C1-6烷基,
(58)C2-6烯基,
(59)C2-6炔基,
(60)C3-10環烷基,
(61)C3-10環烯基,及
(62)C6-14芳基。
「視需要經取代之烴基」中之上述取代基數量為例如:1至5個,較佳係1至3個。當取代基數量為2個以上時,各取代基可相同或不同。
本說明書中,「雜環基」(包括「視需要經取代之雜環基」之「雜環基」)實例包括:(i)芳香族雜環基,(ii)非芳香族雜環基及(iii)7-至10-員橋接雜環基,其中除了碳原子以外,另分別包含1至4個選自氮原子、硫原子及氧原子之雜原子作為環組成原子。
本說明書中,「芳香族雜環基」(包括「5-至14-員芳香族雜環基」)實例包括:5-至14-員(較佳係5-至10-員)芳香族雜環基,其中除了碳原子以外,另包含1至4個選自氮原子、硫原子及氧原子之雜原子作為環組成原子
「芳香族雜環基」之較佳實例包括:5-或6-員單環芳香族雜環基,如:噻吩基、呋喃基、吡咯基、咪唑基、吡唑基、噻唑基、異噻唑基、唑基、異唑基、吡啶基、吡基、嘧啶基、嗒基、1,2,4-二唑基、1,3,4-二唑基、1,2,4-噻二唑基、1,3,4-噻二唑基、三唑基、四唑基、三基等;及
8-至14-員稠合多環(較佳係雙環或三環)芳香族雜環基,如:苯并噻吩基、苯并呋喃基、苯并咪唑基、苯并唑基、苯并異唑基、苯并噻唑基、苯并異噻唑基、苯并三唑基、咪唑并吡啶基、噻吩并吡啶基、呋喃并吡啶基、吡咯并吡啶基、吡唑并吡啶基、唑并吡啶基、噻唑并吡啶基、咪唑并吡基、咪唑并嘧啶基、噻吩并嘧啶基、呋喃并嘧啶基、吡咯并嘧啶基、吡唑并嘧啶基、唑并嘧啶基、噻唑并嘧啶基、吡唑并三基、萘并[2,3-b]噻吩基、吩氧硫雜環己烯基、吲哚基、異吲哚基、1H-吲唑基、嘌呤基、異喹啉基、喹啉基、酞基、萘啶基、喹喔啉基、喹唑啉基、噌啉基、咔唑基、β-咔啉基、菲啶基、吖啶基、吩基、吩噻基、吩基等。
本說明書中,「非芳香族雜環基」(包括「3-至14-員非芳香族雜環基」)實例包括:3-至14-員(較佳係4-至10-員)非芳香族雜環基,其中除了碳原子以外,另包含1至4個選自氮原子、硫原子及氧原子之雜原子作為環組成原子
「非芳香族雜環基」之較佳實例包括:3-至8-員單環非芳香族雜環基,如:氮雜環丙烷基、環氧乙烷基、硫雜環丙烷基、氮雜環丁烷基、氧雜環丁烷基、硫雜環丁烷基、四氫噻吩基、四氫呋喃基、吡咯啉基、吡咯啶基、咪唑啉基、咪唑啶基、唑啉基、唑啶基、吡唑啉基、吡唑啶基、噻唑
啉基、噻唑啶基、四氫異噻唑基、四氫唑基、四氫異唑基、哌啶基、哌基、四氫吡啶基、二氫吡啶基、二氫硫哌喃基、四氫嘧啶基、四氫嗒基、二氫哌喃基、四氫哌喃基、四氫硫哌喃基、嗎啉基、硫嗎啉基、氮雜環庚烷基、二氮雜環庚烷基、氮雜環庚三烯基、氧雜環庚烷基、氮雜環辛烷基、二氮雜環辛烷基等;及
9-至14-員稠合多環(較佳係雙環或三環)非芳香族雜環基,如:二氫苯并呋喃基、二氫苯并咪唑基、二氫苯并唑基、二氫苯并噻唑基、二氫苯并異噻唑基、二氫萘并[2,3-b]噻吩基、四氫異喹啉基、四氫喹啉基、4H-喹基、吲哚啉基、異吲哚啉基、四氫噻吩并[2,3-c]吡啶基、四氫苯并氮雜環庚三烯基、四氫喹喔啉基、四氫菲啶基、六氫吩噻基、六氫吩基、四氫酞基、四氫萘啶基、四氫喹唑啉基、四氫噌啉基、四氫咔唑基、四氫-β-咔啉基、四氫吖啶基、四氫吩基、四氫硫呫噸基、八氫異喹啉基等。
本說明書中,「7-至10-員橋接雜環基」之較佳實例包括:喹寧環基(quinuclidinyl)及7-氮雜雙環[2.2.1]庚烷基。
本說明書中,「含氮雜環基」實例包括:包含至少1個氮原子作為環組成原子之「雜環基」。
本說明書中,「視需要經取代之雜環基」實例包括:視需要具有選自上述取代基群組A之取代基(群)之雜環基。
「視需要經取代之雜環基」之取代基數量為例如:1至3個。當取代基數量為兩個以上時,各取代基可相同或不同。
本說明書中,「醯基」實例包括:甲醯基、羧基、胺甲醯基、硫代胺甲醯基、亞磺醯基、磺醯基、胺磺醯基及膦醯基,其分別視需要具
有「1或2個選自:C1-6烷基、C2-6烯基、C3-10環烷基、C3-10環烯基、C6-14芳基、C7-16芳烷基、5-至14-員芳香族雜環基、3-至14-員非芳香族雜環基、胺基及單-或二-C1-6烷基-胺基之取代基,此等分別視需要具有1至3個選自鹵原子、視需要經鹵化之C1-6烷氧基、羥基、硝基、氰基、胺基及胺甲醯基之取代基」。
「醯基」實例亦包括烴-磺醯基、雜環基磺醯基、烴-亞磺醯基及雜環基亞磺醯基。
此時,烴-磺醯基意指與烴基鍵結之磺醯基,雜環基磺醯基意指與雜環基鍵結之磺醯基、烴-亞磺醯基意指與烴基鍵結之亞磺醯基,及雜環基亞磺醯基意指與雜環基鍵結之亞磺醯基。
「醯基」之較佳實例包括:甲醯基、羧基、C1-6烷基-羰基、C2-6烯基-羰基(例如:巴豆醯基)、C3-10環烷基-羰基(例如:環丁烷羰基、環戊烷羰基、環己烷羰基、環庚烷羰基)、C3-10環烯基-羰基(例如:2-環己烯羰基)、C6-14芳基-羰基、C7-16芳烷基-羰基、5-至14-員芳香族雜環基羰基、3-至14-員非芳香族雜環基羰基、C1-6烷氧基-羰基、C6-14芳基氧基-羰基(例如:苯基氧基羰基、萘基氧基羰基)、C7-16芳烷基氧基-羰基(例如:苯甲基氧基羰基、苯乙基氧基羰基)、胺甲醯基、單-或二-C1-6烷基-胺甲醯基、單-或二-C2-6烯基-胺甲醯基(例如:二丙烯基胺甲醯基)、單-或二-C3-10環烷基-胺甲醯基(例如:環丙基胺甲醯基)、單-或二-C6-14芳基-胺甲醯基(例如:苯基胺甲醯基)、單-或二-C7-16芳烷基-胺甲醯基、5-至14-員芳香族雜環基胺甲醯基(例如:吡啶基胺甲醯基),N-C1-6烷基-N’,N’-二-C1-6烷基肼-羰基、硫代胺甲醯基、單-或二-C1-6烷基-硫代胺甲醯基(例如:甲基硫代胺甲醯基、N-乙基-N-甲
基硫代胺甲醯基)、單-或二-C2-6烯基-硫代胺甲醯基(例如:二丙烯基硫代胺甲醯基)、單-或二-C3-10環烷基-硫代胺甲醯基(例如:環丙基硫代胺甲醯基、環己基硫代胺甲醯基)、單-或二-C6-14芳基-硫代胺甲醯基(例如:苯基硫代胺甲醯基)、單-或二-C7-16芳烷基-硫代胺甲醯基(例如:苯甲基硫代胺甲醯基、苯乙基硫代胺甲醯基)、5-至14-員芳香族雜環基硫代胺甲醯基(例如:吡啶基硫代胺甲醯基)、亞磺醯基、C1-6烷基亞磺醯基(例如:甲基亞磺醯基、乙基亞磺醯基)、磺醯基、C1-6烷基磺醯基、C6-14芳基磺醯基、膦醯基及單-或二-C1-6烷基膦醯基(例如:二甲基膦醯基、二乙基膦醯基、二異丙基膦醯基、二丁基膦醯基)。
本說明書中,「視需要經取代之胺基」實例包括:視需要具有「1或2個選自:C1-6烷基、C2-6烯基、C3-10環烷基、C6-14芳基、C7-16芳烷基、C1-6烷基-羰基、C6-14芳基-羰基、C7-16芳烷基-羰基、5-至14-員芳香族雜環基羰基、3-至14-員非芳香族雜環基羰基、C1-6烷氧基-羰基、5-至14-員芳香族雜環基、胺甲醯基、單-或二-C1-6烷基-胺甲醯基、單-或二-C7-16芳烷基-胺甲醯基、C1-6烷基磺醯基及C6-14芳基磺醯基之取代基,此等分別視需要具有1至3個選自取代基群組A之取代基」之胺基。
視需要經取代之胺基之較佳實例包括:胺基、單-或二-(視需要經鹵化之C1-6烷基)胺基(例如:甲基胺基、三氟甲基胺基、二甲基胺基、乙基胺基、二乙胺基、丙基胺基、二丁基胺基)、單-或二-C2-6烯基胺基(例如:二丙烯基胺基)、單-或二-C3-10環烷基胺基(例如:環丙基胺基、環己基胺基)、單-或二-C6-14芳基胺基(例如:苯基胺基)、單-或二-C7-16芳烷基胺基(例如:苯甲基胺基、二苯甲基胺基)、單-或二-(視需要經鹵化之C1-6烷基)-羰基胺
基(例如:乙醯基胺基、丙醯基胺基)、單-或二-C6-14芳基-羰基胺基(例如:苯甲醯基胺基)、單-或二-C7-16芳烷基-羰基胺基(例如:苯甲基羰基胺基)、單-或二-5-至14-員芳香族雜環基羰基胺基(例如:菸鹼醯基胺基、異菸鹼醯基胺基)、單-或二-3-至14-員非芳香族雜環基羰基胺基(例如:哌啶基羰基胺基)、單-或二-C1-6烷氧基-羰基胺基(例如:第三丁氧基羰基胺基)、5-至14-員芳香族雜環基胺基(例如:吡啶基胺基)、胺甲醯基胺基、(單-或二-C1-6烷基-胺甲醯基)胺基(例如:甲基胺甲醯基胺基)、(單-或二-C7-16芳烷基-胺甲醯基)胺基(例如:苯甲基胺甲醯基胺基)、C1-6烷基磺醯基胺基(例如:甲基磺醯基胺基、乙基磺醯基胺基)、C6-14芳基磺醯基胺基(例如:苯基磺醯基胺基)、(C1-6烷基)(C1-6烷基-羰基)胺基(例如:N-乙醯基-N-甲基胺基)及(C1-6烷基)(C6-14芳基-羰基)胺基(例如:N-苯甲醯基-N-甲基胺基)。
本說明書中,「視需要經取代之胺甲醯基」實例包括:視需要具有「1或2個選自:C1-6烷基、C2-6烯基、C3-10環烷基、C6-14芳基、C7-16芳烷基、C1-6烷基-羰基、C6-14芳基-羰基、C7-16芳烷基-羰基、5-至14-員芳香族雜環基羰基、3-至14-員非芳香族雜環基羰基、C1-6烷氧基-羰基、5-至14-員芳香族雜環基、胺甲醯基、單-或二-C1-6烷基-胺甲醯基及單-或二-C7-16芳烷基-胺甲醯基之取代基,此等分別視需要具有1至3個選自取代基群組A之取代基」之胺甲醯基。
視需要經取代之胺甲醯基之較佳實例包括:胺甲醯基、單-或二-C1-6烷基-胺甲醯基、單-或二-C2-6烯基-胺甲醯基(例如:二丙烯基胺甲醯基)、單-或二-C3-10環烷基-胺甲醯基(例如:環丙基胺甲醯基、環己基胺甲醯基)、單-或二-C6-14芳基-胺甲醯基(例如:苯基胺甲醯基)、單-或二-C7-16芳烷基
-胺甲醯基、單-或二-C1-6烷基-羰基-胺甲醯基(例如:乙醯基胺甲醯基、丙醯基胺甲醯基)、單-或二-C6-14芳基-羰基-胺甲醯基(例如:苯甲醯基胺甲醯基)及5-至14-員芳香族雜環基胺甲醯基(例如:吡啶基胺甲醯基)。
本說明書中,「視需要經取代之硫代胺甲醯基」實例包括:視需要具有「1或2個選自:C1-6烷基、C2-6烯基、C3-10環烷基、C6-14芳基、C7-16芳烷基、C1-6烷基-羰基、C6-14芳基-羰基、C7-16芳烷基-羰基、5-至14-員芳香族雜環基羰基、3-至14-員非芳香族雜環基羰基、C1-6烷氧基-羰基、5-至14-員芳香族雜環基、胺甲醯基、單-或二-C1-6烷基-胺甲醯基及單-或二-C7-16芳烷基-胺甲醯基之取代基,此等分別視需要具有1至3個選自取代基群組A之取代基」之硫代胺甲醯基。
視需要經取代之硫代胺甲醯基之較佳實例包括:硫代胺甲醯基、單-或二-C1-6烷基-硫代胺甲醯基(例如:甲基硫代胺甲醯基、乙基硫代胺甲醯基、二甲基硫代胺甲醯基、二乙基硫代胺甲醯基、N-乙基-N-甲基硫代胺甲醯基)、單-或二-C2-6烯基-硫代胺甲醯基(例如:二丙烯基硫代胺甲醯基)、單-或二-C3-10環烷基-硫代胺甲醯基(例如:環丙基硫代胺甲醯基、環己基硫代胺甲醯基)、單-或二-C6-14芳基-硫代胺甲醯基(例如:苯基硫代胺甲醯基)、單-或二-C7-16芳烷基-硫代胺甲醯基(例如:苯甲基硫代胺甲醯基、苯乙基硫代胺甲醯基)、單-或二-C1-6烷基-羰基-硫代胺甲醯基(例如:乙醯基硫代胺甲醯基、丙醯基硫代胺甲醯基)、單-或二-C6-14芳基-羰基-硫代胺甲醯基(例如:苯甲醯基硫代胺甲醯基)及5-至14-員芳香族雜環基硫代胺甲醯基(例如:吡啶基硫代胺甲醯基)。
本說明書中,「視需要經取代之胺磺醯基」實例包括:視需要具有「1或2個選自:C1-6烷基、C2-6烯基、C3-10環烷基、C6-14芳基、C7-16芳烷基、C1-6烷基-羰基、C6-14芳基-羰基、C7-16芳烷基-羰基、5-至14-員芳香族雜環基羰基、3-至14-員非芳香族雜環基羰基、C1-6烷氧基-羰基、5-至14-員芳香族雜環基、胺甲醯基、單-或二-C1-6烷基-胺甲醯基及單-或二-C7-16芳烷基-胺甲醯基取代基,此該等分別視需要具有1至3個選自取代基群組A之取代基」之胺磺醯基。
視需要經取代之胺磺醯基之較佳實例包括:胺磺醯基、單-或二-C1-6烷基-胺磺醯基(例如:甲基胺磺醯基、乙基胺磺醯基、二甲基胺磺醯基、二乙胺磺醯基、N-乙基-N-甲基胺磺醯基)、單-或二-C2-6烯基-胺磺醯基(例如:二丙烯基胺磺醯基)、單-或二-C3-10環烷基-胺磺醯基(例如:環丙基胺磺醯基、環己基胺磺醯基)、單-或二-C6-14芳基-胺磺醯基(例如:苯基胺磺醯基)、單-或二-C7-16芳烷基-胺磺醯基(例如:苯甲基胺磺醯基、苯乙基胺磺醯基)、單-或二-C1-6烷基-羰基-胺磺醯基(例如:乙醯基胺磺醯基、丙醯基胺磺醯基)、單-或二-C6-14芳基-羰基-胺磺醯基(例如:苯甲醯基胺磺醯基)及5-至14-員芳香族雜環基胺磺醯基(例如:吡啶基胺磺醯基)。
本說明書中,「視需要經取代之羥基」實例包括:視需要具有「選自:C1-6烷基、C2-6烯基、C3-10環烷基、C6-14芳基、C7-16芳烷基、C1-6烷基-羰基、C6-14芳基-羰基、C7-16芳烷基-羰基、5-至14-員芳香族雜環基羰基、3-至14-員非芳香族雜環基羰基、C1-6烷氧基-羰基、5-至14-員芳香族雜環基、胺甲醯基、單-或二-C1-6烷基-胺甲醯基、單-或二-C7-16芳
烷基-胺甲醯基、C1-6烷基磺醯基及C6-14芳基磺醯基之取代基,此等分別視需要具有1至3個選自取代基群組A之取代基」之羥基。
視需要經取代之羥基之較佳實例包括:羥基、C1-6烷氧基、C2-6烯基氧基(例如:丙烯基氧基、2-丁烯基氧基、2-戊烯基氧基、3-己烯基氧基)、C3-10環烷基氧基(例如:環己基氧基)、C6-14芳基氧基(例如:苯氧基、萘基氧基)、C7-16芳烷基氧基(例如:苯甲基氧基、苯乙基氧基)、C1-6烷基-羰基氧基(例如:乙醯基氧基、丙醯基氧基、丁醯基氧基、異丁醯基氧基、三甲基乙醯基(pivaloyl)氧基)、C6-14芳基-羰基氧基(例如:苯甲醯基氧基)、C7-16芳烷基-羰基氧基(例如:苯甲基羰基氧基)、5-至14-員芳香族雜環基羰基氧基(例如:菸鹼醯基氧基)、3-至14-員非芳香族雜環基羰基氧基(例如:哌啶基羰基氧基)、C1-6烷氧基-羰基氧基(例如:第三丁氧基羰基氧基)、5-至14-員芳香族雜環基氧基(例如:吡啶基氧基)、胺甲醯基氧基、C1-6烷基-胺甲醯基氧基(例如:甲基胺甲醯基氧基)、C7-16芳烷基-胺甲醯基氧基(例如:苯甲基胺甲醯基氧基)、C1-6烷基磺醯基氧基(例如:甲基磺醯基氧基、乙基磺醯基氧基)及C6-14芳基磺醯基氧基(例如:苯基磺醯基氧基)。
本說明書中,「視需要經取代之氫硫基」實例包括:視需要具有「選自:C1-6烷基、C2-6烯基、C3-10環烷基、C6-14芳基、C7-16芳烷基、C1-6烷基-羰基、C6-14芳基-羰基及5-至14-員芳香族雜環基之取代基,此等分別視需要具有1至3個選自取代基群組A之取代基」之氫硫基、及鹵化氫硫基。
視需要經取代之氫硫基之較佳實例包括:氫硫基(-SH)、C1-6烷基硫基、C2-6烯基硫基(例如:丙烯基硫、2-丁烯基硫、2-戊烯基硫、3-己烯基硫)、
C3-10環烷基硫基(例如:環己基硫基)、C6-14芳基硫基(例如:苯基硫基、萘基硫基)、C7-16芳烷基硫基(例如:苯甲基硫基、苯乙基硫基)、C1-6烷基-羰基硫基(例如:乙醯基硫基、丙醯基硫基、丁醯基硫基、異丁醯基硫基、三甲基乙醯基硫基)、C6-14芳基-羰基硫基(例如:苯甲醯基硫基)、5-至14-員芳香族雜環基硫基(例如:吡啶基硫基)及鹵化硫基(例如:五氟硫基)。
本說明書中,「視需要經取代之矽烷基」實例包括:視需要具有「1至3個選自:C1-6烷基、C2-6烯基、C3-10環烷基、C6-14芳基及C7-16芳烷基之取代基,其分別視需要具有1至3個選自取代基群組A之取代基」之矽烷基。
視需要經取代之矽烷基之較佳實例包括:三-C1-6烷基矽烷基(例如:三甲基矽烷基、第三丁基(二甲基)矽烷基)。
本說明書中,「烴環」實例包括:C6-14芳香烴環、C3-10環烷及C3-10環烯。
本說明書中,「C6-14芳香烴環」實例包括:苯及萘。
本說明書中,「C3-10環烷」實例包括:環丙烷、環丁烷、環戊烷、環己烷、環庚烷及環辛烷。
本說明書中,「C3-10環烯」實例包括:環丙烯、環丁烯、環戊烯、環己烯、環庚烯、環辛烯。
本說明書中,「雜環」實例包括:芳香族雜環及非芳香族雜環,其中除了碳原子以外,另分別包含1至4個選自氮原子、硫原子及氧原子之雜原子作為環組成原子。
本說明書中,「芳香族雜環」實例包括:5-至14-員(較佳係5-至10-員)芳香族雜環其中除了碳原子以外,另包含1至4個選自氮原子、硫原子及氧原子之雜原子作為環組成原子。「芳香族雜環」之較佳實例包括:5-或6-員單環芳香族雜環,如:噻吩、呋喃、吡咯、咪唑、吡唑、噻唑、異噻唑、唑、異唑、吡啶、吡、嘧啶、嗒、1,2,4-二唑、1,3,4-二唑、1,2,4-噻二唑、1,3,4-噻二唑、三唑、四唑、三等;及
8-至14-員稠合多環(較佳係雙環或三環)芳香族雜環,如:苯并噻吩、苯并呋喃、苯并咪唑、苯并唑、苯并異唑、苯并噻唑、苯并異噻唑、苯并三唑、咪唑并吡啶、噻吩并吡啶、呋喃并吡啶、吡咯并吡啶、吡唑并吡啶、唑并吡啶、噻唑并吡啶、咪唑并吡、咪唑并嘧啶、噻吩并嘧啶、呋喃并嘧啶、吡咯并嘧啶、吡唑并嘧啶、唑并嘧啶、噻唑并嘧啶、吡唑并嘧啶、吡唑并三、萘并[2,3-b]噻吩、吩氧硫雜環己烯、吲哚、異吲哚、1H-吲唑、嘌呤、異喹啉、喹啉、酞、萘啶、喹喔啉、喹唑啉、噌啉、咔唑、β-咔啉、菲啶、吖啶、吩、吩噻、吩等。
本說明書中,「非芳香族雜環」實例包括:3-至14-員(較佳係4-至10-員)非芳香族雜環,其中除了碳原子以外,另包含1至4個選自氮原子、硫原子及氧原子之雜原子作為環組成原子。「非芳香族雜環」之較佳實例包括:3-至8-員單環非芳香族雜環,如:氮雜環丙烷、環氧乙烷、硫雜環丙烷、氮雜環丁烷、氧雜環丁烷、硫雜環丁烷、四氫噻吩、四氫呋喃、吡咯啉、吡咯啶、咪唑啉、咪唑啶、唑啉、唑啶、吡唑啉、吡唑啶、噻唑啉、噻唑啶、四氫異噻唑、四氫唑、四氫異唑、哌啶、哌、四氫吡啶、二氫吡啶、二氫硫哌喃、四氫嘧啶、四氫嗒、二氫哌喃、四
氫哌喃、四氫硫哌喃、嗎啉、硫嗎啉、氮雜環庚烷、二氮雜環庚烷、氮雜環庚三烯、氮雜環辛烷、二氮雜環辛烷、氧雜環庚烷等;及
9-至14-員稠合多環(較佳係雙環或三環)非芳香族雜環,如:二氫苯并呋喃、二氫苯并咪唑、二氫苯并唑、二氫苯并噻唑、二氫苯并異噻唑、二氫萘并[2,3-b]噻吩、四氫異喹啉、四氫喹啉、4H-喹、吲哚啉、異吲哚啉、四氫噻吩并[2,3-c]吡啶、四氫苯并氮雜環庚三烯、四氫喹喔啉、四氫菲啶、六氫吩噻、六氫吩、四氫酞、四氫萘啶、四氫喹唑啉、四氫噌啉、四氫咔唑、四氫-β-咔啉、四氫吖啶、四氫吩、四氫硫呫噸、八氫異喹啉等。
本說明書中,「含氮雜環」實例包括:「雜環」中包含至少1個氮原子作為環組成原子之雜環。
本說明書中,「C3-6環烷基」實例包括:環丙基、環丁基、環戊基及環己基。
本說明書中,「單-或二-C1-6烷基胺基」實例包括:甲基胺基、二甲基胺基、乙基胺基、二乙基胺基、丙基胺基、異丙基胺基、丁基胺基、異丁基胺基、第二丁基胺基、第三丁基胺基、戊基胺基、異戊基胺基、新戊基胺基、1-乙基丙基胺基、己基胺基、異己基胺基、1,1-二甲基丁基胺基、2,2-二甲基丁基胺基、3,3-二甲基丁基胺基、2-乙基丁基胺基等。
式(I)中各代號之定義詳細說明於下文中。
R1為視需要經取代之C1-6烷基、視需要經取代之單-或二-C1-6烷基胺基、視需要經取代之C3-6環烷基、或視需要經取代之3-至14-員非芳香族雜環基。
上述「視需要經取代之C1-6烷基」、「視需要經取代之單-或二-C1-6烷基胺基」、「視需要經取代之C3-6環烷基」及「視需要經取代之3-至14-員非芳香族雜環基」之取代基實例包括選自取代基群組A之取代基。取代基數量較佳係1至3個。當取代基數量為兩個以上時,各取代基可相同或不同。
R1較佳係
(1)視需要經取代之C1-6烷基(例如:甲基、乙基)、
(2)視需要經取代之單-或二-C1-6烷基胺基(例如:二甲基胺基)、或
(3)視需要經取代之C3-6環烷基(例如:環丙基)。
R1更佳係
(1)C1-6烷基(例如:甲基、乙基)、
(2)單-或二-C1-6烷基胺基(例如:二甲基胺基)、或
(3)C3-6環烷基(例如:環丙基)。
R1亦更佳係
(1)C1-6烷基(例如:甲基、乙基)、或
(2)單-或二-C1-6烷基胺基(例如:二甲基胺基)。
R2為氫原子、氟原子、視需要經取代之C1-6烷基、或視需要經取代之C3-6環烷基。
上述「視需要經取代之C1-6烷基」及「視需要經取代之C3-6環烷基」之取代基實例包括選自取代基群組A之取代基。取代基數量較佳係1至3個。當取代基數量為兩個以上時,各取代基可相同或不同。
R2較佳係
(1)氫原子、
(2)氟原子、或
(3)視需要經取代之C1-6烷基(例如:甲基)。
R2更佳係
(1)氫原子、
(2)氟原子、或
(3)C1-6烷基(例如:甲基)。
R2亦更佳係
(1)氫原子、或
(2)氟原子。
R3為醯基、視需要經取代之C1-6烷基、視需要經取代之C3-6環烷基、視需要經取代之C6-14芳基、視需要經取代之3-至14-員非芳香族雜環基、或視需要經取代之5-至14-員芳香族雜環基。
上述「視需要經取代之C1-6烷基」、「視需要經取代之C3-6環烷基」、「視需要經取代之C6-14芳基」、「視需要經取代之3-至14-員非芳香族雜環基」及「視需要經取代之5-至14-員芳香族雜環基」之取代基實例包括選自取代基群組A之取代基。取代基數量較佳係1至3個。當取代基數量為兩個以上時,各取代基可相同或不同。
R3較佳係醯基。
R3更佳係
(1)視需要經取代之C1-6烷基-羰基(例如:2-甲基丙醯基、2,2-二甲基丙醯基、丁醯基、2-甲基丁醯基)、
(2)視需要經取代之C1-6烷氧基-羰基(例如:乙氧基羰基、第三丁氧基羰基)、
(3)視需要經取代之C3-10環烷基-羰基(C3-10環烷基-羰基之C3-10環烷基部分視需要橋接(例如:環丙基羰基、環丁基羰基、雙環[1.1.1]戊烷-1-基羰基))、
(4)視需要經取代之3-至14-員非芳香族雜環基羰基(較佳係3-至8-員單環非芳香族雜環基羰基(例如:氧雜環丁烷基羰基、四氫呋喃基羰基、氮雜環丁烷基羰基))、
(5)視需要經取代之單-或二-C1-6烷基-胺甲醯基(例如:二甲基胺甲醯基)、
(6)視需要經取代之N-C1-6烷基-N-C1-6烷氧基-胺甲醯基(例如:N-甲基-N-甲氧基胺甲醯基)、或
(7)N-C1-6烷基-N’,N’-二-C1-6烷基肼-羰基(例如:N-甲基-N’,N’-二甲基肼羰基)。
R3亦更佳係
(1)視需要經1至3個選自下列取代基取代之C1-6烷基-羰基(例如:2-甲基丙醯基、2,2-二甲基丙醯基、丁醯基、2-甲基丁醯基),
(a)鹵原子(例如:氟原子)、
(b)羥基、及
(c)氰基,
(2)C1-6烷氧基-羰基(例如:乙氧基羰基、第三丁氧基羰基),
(3)視需要經1至3個選自下列取代基取代之C3-10環烷基-羰基(C3-10環烷基-羰基之C3-10環烷基部分視需要橋接(例如:環丙基羰基、環丁基羰基、雙環[1.1.1]戊烷-1-基羰基)),
(a)鹵原子(例如:氟原子)、
(b)羥基、
(c)氰基、及
(d)C1-6烷基(例如:甲基),
(4)視需要經1至3個選自下列取代基取代之3-至14-員非芳香族雜環基羰基(較佳係3-至8-員單環非芳香族雜環基羰基(例如:氧雜環丁烷基羰基、四氫呋喃基羰基、氮雜環丁烷基羰基)),
(a)鹵原子(例如:氟原子)、
(b)羥基、及
(c)C1-6烷基(例如:甲基),
(5)單-或二-C1-6烷基-胺甲醯基(例如:二甲基胺甲醯基),
(6)N-C1-6烷基-N-C1-6烷氧基-胺甲醯基(例如:N-甲基-N-甲氧基胺甲醯基),或
(7)N-C1-6烷基-N’,N’-二-C1-6烷基肼-羰基(例如:N-甲基-N’,N’-二甲基肼羰基)。
R3亦更佳係
(1)視需要經1至3個羥基取代之C1-6烷基-羰基(例如:2-甲基丙醯基、丁醯基),
(2)C3-10環烷基-羰基(C3-10環烷基-羰基之C3-10環烷基部分視需要橋接(例如:環丙基羰基、環丁基羰基、雙環[1.1.1]戊烷-1-基羰基)),其視需要經1至3個選自下列取代基取代
(a)鹵原子(例如:氟原子)、及
(b)羥基,
(3)3-至8-員單環非芳香族雜環基羰基(例如:氧雜環丁烷基羰基、四氫呋喃基羰基、氮雜環丁烷基羰基),或
(4)單-或二-C1-6烷基-胺甲醯基(例如:二甲基胺甲醯基)。
R3又再更佳係
(1)視需要經1至3個羥基取代之C1-6烷基-羰基(例如:2-甲基丙醯基),
(2)視需要經1至3個選自下列取代基取代之C3-10環烷基-羰基(C3-10環烷基-羰基之C3-10環烷基部分視需要橋接(例如:環丙基羰基、環丁基羰基、雙環[1.1.1]戊烷-1-基羰基)),
(a)鹵原子(例如:氟原子)、及
(b)羥基,
(3)3-至8-員單環非芳香族雜環基羰基(例如:氧雜環丁烷基羰基、氮雜環丁烷基羰基),或
(4)單-或二-C1-6烷基-胺甲醯基(例如:二甲基胺甲醯基)。
R3特別佳係
(1)視需要經1至3個羥基取代之C1-6烷基-羰基(例如:2-甲基丙醯基),
(2)3-至8-員單環非芳香族雜環基羰基(例如:氧雜環丁烷基羰基、氮雜環丁烷基羰基),或
(3)單-或二-C1-6烷基-胺甲醯基(例如:二甲基胺甲醯基)。
A環為視需要更經取代之C6-14芳香烴環、或視需要更經取代之5-至14-員芳香族雜環。
式(I)中除了-CH2-吡咯啶環外,A環可視需要具有取代基(群)。取代基實例包括上述「取代基」。取代基數量較佳係1至3個。當取代基數量為兩個以上時,各取代基可相同或不同。
A環較佳係
(1)視需要更經取代之苯環、或
(2)視需要更經取代之5-或6-員芳香族雜環(例如:噻唑、吡啶)。
A環更佳係
(1)更經1個選自下列取代基取代之苯環,
(a)其視需要經1至3個選自下列取代基取代之C6-14芳基(例如;苯基),
(i)鹵原子(例如:氟原子、氯原子、溴原子)、
(ii)視需要經鹵化之C1-6烷基(例如:甲基、二氟甲基)、及
(iii)視需要經鹵化之C1-6烷氧基(例如:甲氧基、二氟甲氧基),及
(i)視需要經1至3個選自:鹵原子(例如:氟原子)及羥基之取代基取代之C1-6烷基(例如:甲基、乙基)、
(ii)C1-6烷氧基(例如:甲氧基)、
(iii)鹵原子(例如:氟原子、氯原子)、及
(iv)C1-6烷氧基-羰基(例如:乙氧基羰基);並且
該苯環視需要更經1至3個鹵原子(例如:氟原子)取代,或
(2)更經1個視需要經1至3個鹵原子(例如:氟原子)取代之C6-14芳基(例如:苯基)所取代的5-或6-員芳香族雜環(例如:噻唑、吡啶)。
A環亦更佳係更經1個視需要經1至3個選自下列取代基取代之C6-14芳基(例如:苯基)所取代的苯環,
(i)鹵原子(例如:氟原子、氯原子)、及
(ii)視需要經鹵化之C1-6烷基(例如:甲基、二氟甲基);並且
該苯環視需要更經1至3個鹵原子(例如:氟原子)取代。
A環特別佳係更經1個視需要經1至3個選自下列取代基取代C6-14芳基(例如:苯基)所取代的苯環,
(i)鹵原子(例如:氟原子)、及
(ii)C1-6烷基(例如:甲基);並且
該苯環視需要更經1至3個鹵原子(例如:氟原子)取代。
針對化合物(I)之吡咯啶環,依據-NHSO2R1所鍵結之碳原子及-CH2-A環所鍵結之碳原子之組態較佳係順式型。亦即,化合物(I)較佳係由式(IA)或(IB)代表:
其中各代號係如上述定義,
更佳係由式(IA)代表:
其中各代號係如上述定義。
化合物(I)之較佳實例包括下列化合物。此等化合物較佳係由上述式(IA)或(IB)代表,更佳係由式(IA)代表。
[化合物A]
化合物(I),其中
R1為
(1)視需要經取代之C1-6烷基(例如:甲基、乙基)、
(2)視需要經取代之單-或二-C1-6烷基胺基(例如:二甲基胺基)、或
(3)視需要經取代之C3-6環烷基(例如:環丙基);
R2為
(1)氫原子、
(2)氟原子、或
(3)視需要經取代之C1-6烷基(例如:甲基);
R3為
(1)視需要經取代之C1-6烷基-羰基(例如:2-甲基丙醯基、2,2-二甲基丙醯基、丁醯基、2-甲基丁醯基)、
(2)視需要經取代之C1-6烷氧基-羰基(例如:乙氧基羰基、第三丁氧基羰基)、
(3)視需要經取代之C3-10環烷基-羰基(C3-10環烷基-羰基之C3-10環烷基部分視需要橋接(例如:環丙基羰基、環丁基羰基、雙環[1.1.1]戊烷-1-基羰基))、
(4)視需要經取代之3-至14-員非芳香族雜環基羰基(較佳係3-至8-員單環非芳香族雜環基羰基(例如:氧雜環丁烷基羰基、四氫呋喃基羰基、氮雜環丁烷基羰基))、
(5)視需要經取代之單-或二-C1-6烷基-胺甲醯基(例如:二甲基胺甲醯基)、
(6)視需要經取代之N-C1-6烷基-N-C1-6烷氧基-胺甲醯基(例如:N-甲基-N-甲氧基胺甲醯基)、或
(7)N-C1-6烷基-N’,N’-二-C1-6烷基肼-羰基(例如:N-甲基-N’,N’-二甲基肼羰基);及
A環為
(1)視需要更經取代之苯環、或
(2)視需要更經取代之5-或6-員芳香族雜環(例如:噻唑、吡啶)。
[化合物B]
化合物(I),其中
R1為
(1)C1-6烷基(例如:甲基、乙基)、
(2)單-或二-C1-6烷基胺基(例如:二甲基胺基)、或
(3)C3-6環烷基(例如:環丙基);
R2為
(1)氫原子、
(2)氟原子、或
(3)C1-6烷基(例如:甲基);
R3為
(1)視需要經1至3個選自下列取代基取代之C1-6烷基-羰基(例如:2-甲基丙醯基、2,2-二甲基丙醯基、丁醯基、2-甲基丁醯基),
(a)鹵原子(例如:氟原子)、
(b)羥基、及
(c)氰基,
(2)C1-6烷氧基-羰基(例如:乙氧基羰基、第三丁氧基羰基),
(3)視需要經1至3個選自下列取代基取代之C3-10環烷基-羰基(C3-10環烷基-羰基之C3-10環烷基部分視需要橋接(例如:環丙基羰基、環丁基羰基、雙環[1.1.1]戊烷-1-基羰基)),
(a)鹵原子(例如:氟原子)、
(b)羥基、
(c)氰基、及
(d)C1-6烷基(例如:甲基),
(4)視需要經1至3個選自下列取代基取代之3-至14-員非芳香族雜環基羰基(較佳係3-至8-員單環非芳香族雜環基羰基(例如:氧雜環丁烷基羰基、四氫呋喃基羰基、氮雜環丁烷基羰基)),
(a)鹵原子(例如:氟原子)、
(b)羥基、及
(c)C1-6烷基(例如:甲基),
(5)單-或二-C1-6烷基-胺甲醯基(例如:二甲基胺甲醯基),
(6)N-C1-6烷基-N-C1-6烷氧基-胺甲醯基(例如:N-甲基-N-甲氧基胺甲醯基),或
(7)N-C1-6烷基-N’,N’-二-C1-6烷基肼-羰基(例如:N-甲基-N’,N’-二甲基肼羰基);及
A環為
(1)更經1個選自下列取代基取代之苯環,
(a)視需要經1至3個選自下列取代基取代之C6-14芳基(例如:苯基),
(i)鹵原子(例如:氟原子、氯原子、溴原子)、
(ii)視需要經鹵化之C1-6烷基(例如:甲基、二氟甲基)、及
(iii)視需要經鹵化之C1-6烷氧基(例如:甲氧基、二氟甲氧基),及
(i)視需要經1至3個選自:鹵原子(例如:氟原子)及羥基之取代基取代之C1-6烷基(例如:甲基、乙基)、
(ii)C1-6烷氧基(例如:甲氧基)、
(iii)鹵原子(例如:氟原子、氯原子)、及
(iv)C1-6烷氧基-羰基(例如:乙氧基羰基),並且
該苯環視需要更經1至3個鹵原子(例如:氟原子)取代;或
(2)更經1個視需要經1至3個鹵原子(例如:氟原子)取代之C6-14芳基(例如:苯基)所取代的5-或6-員芳香族雜環(例如:噻唑、吡啶)。
[化合物C]
化合物(I),其中
R1為
(1)C1-6烷基(例如:甲基、乙基)、
(2)單-或二-C1-6烷基胺基(例如:二甲基胺基)、或
(3)C3-6環烷基(例如:環丙基);
R2為
(1)氫原子、或
(2)氟原子;
R3為
(1)視需要經1至3個羥基取代之C1-6烷基-羰基(例如:2-甲基丙醯基、丁醯基),
(2)視需要經1至3個選自下列取代基取代之C3-10環烷基-羰基(C3-10環烷基-羰基之C3-10環烷基部分視需要橋接(例如:環丙基羰基、環丁基羰基、雙環[1.1.1]戊烷-1-基羰基)),
(a)鹵原子(例如:氟原子)、及
(b)羥基,
(3)3-至8-員單環非芳香族雜環基羰基(例如:氧雜環丁烷基羰基、四氫呋喃基羰基、氮雜環丁烷基羰基),或
(4)單-或二-C1-6烷基-胺甲醯基(例如:二甲基胺甲醯基);及
A環為更經1個視需要經1至3個選自下列取代基取代之C6-14芳基(例如:苯基)所取代的苯環,
其
(i)鹵原子(例如:氟原子、氯原子)、及
(ii)視需要經鹵化之C1-6烷基(例如:甲基、二氟甲基),並且
該苯環視需要更經1至3個鹵原子(例如:氟原子)取代。
[化合物D]
化合物(I),其中
R1為
(1)C1-6烷基(例如:甲基、乙基)、或
(2)單-或二-C1-6烷基胺基(例如:二甲基胺基);
R2為
(1)氫原子、或
(2)氟原子;
R3為
(1)視需要經1至3個羥基取代之C1-6烷基-羰基(例如:2-甲基丙醯基),
(2)視需要經1至3個選自下列取代基取代之C3-10環烷基-羰基(C3-10環烷基-羰基之C3-10環烷基部分視需要橋接(例如:環丙基羰基、環丁基羰基、雙環[1.1.1]戊烷-1-基羰基)),
(a)鹵原子(例如:氟原子)、及
(b)羥基,
(3)3-至8-員單環非芳香族雜環基羰基(例如:氧雜環丁烷基羰基、氮雜環丁烷基羰基),或
(4)單-或二-C1-6烷基-胺甲醯基(例如:二甲基胺甲醯基);及
A環為更經1個視需要經1至3個選自下列取代基取代之C6-14芳基(例如:苯基)所取代的苯環,
(i)鹵原子(例如:氟原子)、及
(ii)C1-6烷基(例如:甲基);並且
該苯環視需要更經1至3個鹵原子(例如:氟原子)取代。
[化合物E]
化合物(I),其中
R1為
(1)C1-6烷基(例如:乙基)、或
(2)單-或二-C1-6烷基胺基(例如:二甲基胺基);
R2為
(1)氫原子、或
(2)氟原子;
R3為
(1)視需要經1至3個羥基取代之C1-6烷基-羰基(例如:2-甲基丙醯基)、
(2)3-至8-員單環非芳香族雜環基羰基(例如:氧雜環丁烷基羰基、氮雜環丁烷基羰基)、或
(3)單-或二-C1-6烷基-胺甲醯基(例如:二甲基胺甲醯基);及
A環為更經1個視需要經1至3個選自下列取代基取代之C6-14芳基(例如:苯基)所取代的苯環,
(i)鹵原子(例如:氟原子)、及
(ii)C1-6烷基(例如:甲基);並且
該苯環視需要更經1至3個鹵原子(例如:氟原子)取代。
化合物(I)之具體例包括:下述實例1至616之化合物。
明確言之,化合物(I)為較佳係
N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-((2R)-氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺或其鹽(實施例1);
N-{(2S,3R)-4,4-二氟-1-(2-羥基-2-甲基丙醯基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺或其鹽(實施例2);
N-{(2S,3R)-4,4-二氟-1-(2-羥基-2-甲基丙醯基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺或其鹽(實施例3);
N-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺或其鹽(實施例5);
N-{(2S,3R)-4,4-二氟-1-((2R)-氧雜環丁烷-2-羰基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺或其鹽(實施例56);
N-{(2S,3R)-4,4-二氟-1-(2-羥基-2-甲基丙醯基)-2-[(2,2',3'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺或其鹽(實施例66);
N-{(2S,3R)-4,4-二氟-1-(2-羥基-2-甲基丙醯基)-2-[(2,2',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺或其鹽(實施例67);
N-{(2S,3R)-1-(雙環[1.1.1]戊烷-1-羰基)-4,4-二氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺或其鹽(實施例87);
N-{(2S,3R)-4,4-二氟-1-((2R)-氧雜環丁烷-2-羰基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺或其鹽(實施例91);
N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺或其鹽(實施例94);
N-{(2S,3R)-1-(環丙烷羰基)-4,4-二氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺或其鹽(實施例144);
N-{(2S,3R)-4,4-二氟-1-(2-甲基丙醯基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺或其鹽(實施例146);
N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-((1r,3S)-3-氟環丁烷-1-羰基)吡咯啶-3-基]乙磺醯胺或其鹽(實施例225);
N-{(2S,3R,4S)-1-(環丙烷羰基)-4-氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺或其鹽(實施例236);
N-[(2S,3R,4S)-4-氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-((2R)-氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺或其鹽(實施例302);
N-{(2S,3R)-4,4-二氟-1-((1r,3S)-3-氟環丁烷-1-羰基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺或其鹽(實施例375);
N-{(2S,3R)-4,4-二氟-1-((1s,3R)-3-氟環丁烷-1-羰基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺或其鹽(實施例380);
N-{(2S,3R)-4,4-二氟-1-(3-氟環丁烷-1-羰基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺或其鹽(實施例433);
N'-{(2S,3R)-1-(氮雜環丁烷-1-羰基)-4,4-二氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}-N,N-二甲基硫醯二胺或其鹽(實施例443);
N-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-4-氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺或其鹽(實施例450);
N-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-4-氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺或其鹽(實施例451);
(2S,3R,4S)-3-[(二甲基胺磺醯基)胺基]-4-氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]-N,N-二甲基吡咯啶-1-甲醯胺或其鹽(實施例459);
N'-[(2S,3R,4S)-4-氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]-1-(1-羥基環丁烷-1-羰基)吡咯啶-3-基]-N,N-二甲基硫醯二胺或其鹽(實施例462);
N'-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-4-氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}-N,N-二甲基硫醯二胺或其鹽(實施例463);或
N'-{(2S,3R)-4,4-二氟-1-[(2R)-氧雜環丁烷-2-羰基]-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}-N,N-二甲基硫醯二胺或其鹽(實施例542)。
化合物(I)特別佳係
N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-((2R)-氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺或其鹽(實施例1);
N-{(2S,3R)-4,4-二氟-1-(2-羥基-2-甲基丙醯基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺或其鹽(實施例3);
N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺或其鹽(實施例94);
N'-{(2S,3R)-1-(氮雜環丁烷-1-羰基)-4,4-二氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}-N,N-二甲基硫醯二胺或其鹽(實施例443);
N-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-4-氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺或其鹽(實施例451);
(2S,3R,4S)-3-[(二甲基胺磺醯基)胺基]-4-氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]-N,N-二甲基吡咯啶-1-甲醯胺或其鹽(實施例459);
N'-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-4-氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}-N,N-二甲基硫醯二胺或其鹽(實施例463);或
N'-{(2S,3R)-4,4-二氟-1-[(2R)-氧雜環丁烷-2-羰基]-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}-N,N-二甲基硫醯二胺或其鹽(實施例542)。
式(I)所代表化合物之鹽為醫藥上可接受之鹽較佳,且此等鹽之實例包括:與無機鹼形成之鹽、與有機鹼形成之鹽類、與無機酸形成之鹽類、與有機酸形成之鹽類、與鹼性或酸性胺基酸形成之鹽類等。
與無機鹼形成之鹽之較佳實例包括:鹼金屬鹽類,如:鈉鹽、鉀鹽等;鹼土金屬鹽類,如:鈣鹽、鎂鹽等;鋁鹽;銨鹽等。
與有機鹼形成之鹽類之較佳實例包括:與三甲基胺、三乙基胺、吡啶、皮考啉、乙醇胺、二乙醇胺、三乙醇胺、三甲醇胺基甲烷(tromethamine)[參(羥基甲基)甲基胺]、第三丁基胺、環己基胺、苯甲基胺、二環己基胺、N,N-二苯甲基乙二胺等形成之鹽類。
與無機酸形成之鹽類之較佳實例包括:與鹽酸、氫溴酸、硝酸、硫酸、磷酸等形成之鹽類。
與有機酸形成之鹽類之較佳實例包括:與甲酸、乙酸、三氟乙酸、酞酸、富馬酸、草酸、酒石酸、馬來酸、檸檬酸、琥珀酸、蘋果酸、甲磺酸、苯磺酸、對甲苯磺酸等形成之鹽類。
與鹼性胺基酸形成之鹽類之較佳實例包括:與精胺酸、離胺酸、鳥胺酸等形成之鹽類。
與酸性胺基酸形成之鹽類之較佳實例包括:與天冬胺酸、麩胺酸等形成之鹽類。
本發明化合物之製造方法說明如下。
下列製法所使用之原料化合物、試劑及各步驟得到之化合物可能分別呈鹽型,且此等鹽類實例包括彼等類似式(I)所代表化合物之鹽類等。
當各步驟所得化合物為游離型時,其可藉由本身已知之方法轉化成所需鹽。當各步驟所得之化合物呈鹽型時,其可藉由本身已知之方法轉化成主要游離型或其他鹽類。
各步驟所得之化合物可呈反應混合物或呈粗產物直接用於下一個反應。或者,各步驟所得之化合物可依據本身已知方法,從反應混合物中單離及純化,例如:濃縮、結晶、再結晶、蒸餾、溶劑萃取、分餾、管柱層析等分離法。
當各步驟使用之原料化合物及試劑化合物可自商品取得時,亦可直接使用該等自商品取得之產品。
各步驟之反應中,雖然反應時間會隨所使用試劑及溶劑種類變化,但通常為1min至48hr,較佳係10min至8hr,除非另有說明。
各步驟之反應中,雖然反應溫度會隨所使用試劑及溶劑種類變化,但通常為-78℃至300℃,較佳係-78℃至150℃,除非另有說明。
各步驟之反應中,雖然壓力會隨所使用試劑及溶劑種類變化,但通常為1atm至20atm,較佳係1atm至3atm,除非另有說明。
各步驟之反應可使用微波合成儀(如:由Biotage製造之Initiator等)。雖然反應溫度會隨所使用試劑及溶劑種類變化,但通常為室溫至300℃,較佳係50℃至250℃,除非另有說明。雖然反應時間會隨所
使用試劑及溶劑種類變化,但通常為1min至48hr,較佳係1min至8hr,除非另有說明。
各步驟之反應中,試劑之用量為相對於受質之0.5當量至20當量,較佳係0.8當量至5當量,除非另有說明。當使用試劑作為觸媒,相對於受質之試劑用量為0.001當量至1當量,較佳係0.01當量至0.2當量。當使用試劑作為反應溶劑時,試劑係使用溶劑量。
除非另有其他說明,否則各步驟之反應不使用溶劑進行,或將原料化合物溶解或懸浮於合適溶劑中。溶劑實例包括:彼等說明於實施例中者及下列溶劑。
醇類:甲醇、乙醇、第三丁基醇、2-甲氧基乙醇等;
醚類:二乙醚、二苯基醚、四氫呋喃、1,2-二甲氧基乙烷等;
芳香族烴類:氯苯、甲苯、二甲苯等;
飽和烴類:環己烷、己烷等;
醯胺類:N,N-二甲基甲醯胺、N-甲基吡咯啶酮等;
鹵化烴類:二氯甲烷、四氯化碳等;
腈類:乙腈等;
亞碸類:二甲亞碸等;
芳香族有機鹼類:吡啶等;
酸酐類:乙酸酐等;
有機酸類:甲酸、乙酸、三氟乙酸等;
無機酸類:鹽酸、硫酸等;
酯類:乙酸乙酯等;
酮類:丙酮、甲基乙基酮等;
水。
上述溶劑可依適當比例使用其中兩種以上之混合物。
當各步驟之反應使用鹼時,其實例包括:彼等實施例中說明者及下列鹼類。
無機鹼類:氫氧化鈉、氫氧化鎂、碳酸鈉、碳酸鈣、碳酸氫鈉等;
有機鹼類:三乙基胺、二乙胺、吡啶、4-二甲基胺基吡啶、N,N-二甲基苯胺、1,4-重氮雙環[2.2.2]辛烷、1,8-重氮雙環[5.4.0]-7-十一碳烯、咪唑、哌啶等;
金屬醇鹽類:乙醇鈉、第三丁醇鉀等;
鹼金屬氫化物:氫化鈉等;
金屬胺化物:胺化鈉、二異丙基胺化鋰、六甲基二矽烷胺化物等;
有基鋰化物:正丁基鋰等。
當各步驟之反應使用酸或酸觸媒時,其實例包括:彼等實施例中說明者及下列酸類及酸觸媒。
無機酸類:鹽酸、硫酸、硝酸、氫溴酸、磷酸等;
有機酸類:乙酸、三氟乙酸、檸檬酸、對甲苯磺酸、10-樟腦磺酸等;
路易士酸:三氟化硼乙醚複合物、碘化鋅、無水氯化鋁、無水氯化鋅、無水氯化鐵等。
除非另有說明,否則各步驟之反應係依據本身已知方法進行,例如:Jikken Kagaku Kouza,第5版,vol.13-19(日本化學學會(Chemical Society of Japan)編輯);Shin Jikken Kagaku Kouza,vol.14-
15(日本化學學會編輯);Fine Organic Chemistry,第2修訂版(L.F.Tietze,Th.Eicher,Nankodo);Organic Name Reactions,the Reaction Mechanism and Essence,修訂版(Hideo Togo,Kodansha);ORGANIC SYNTHESES Collective Volume I-VII(John Wiley & Sons Inc.);Modern Organic Synthesis in the Laboratory A Collection of Standard Experimental Procedures(Jie Jack Li,OXFORD UNIVERSITY);Comprehensive Heterocyclic Chemistry III,Vol.1-Vol.14(Elsevier Japan);Strategic Applications of Named Reactions in Organic Synthesis(translated by Kiyoshi Tomioka,Kagakudojin);Comprehensive Organic Transformations (VCH Publishers Inc.),1989等中說明之方法,或實施例中說明之方法。
各步驟中,官能基之保護或脫除保護反應係依據本身已知之方法進行,例如:「Protective Groups in Organic Synthesis,第4版」,Wiley-Interscience,Inc.,2007(Theodora W.Greene,Peter G.M.Wuts);「Protecting Groups,第3版」Thieme,2004(P.J.Kocienski)等中說明之方法,或實施例中說明之方法。
醇及其類似物之羥基及酚系羥基之保護基實例包括:醚型保護基,如:甲氧基甲基醚、苯甲基醚、第三丁基二甲基矽烷基醚、四氫哌喃基醚等;羧酸酯型保護基,如:乙酸酯等;磺酸酯型保護基,如:甲磺酸酯等;碳酸酯型保護基,如:碳酸第三丁基酯等等。
羧基之保護基實例包括:酯型保護基,如:甲基酯等;醯胺型保護基,如:N,N-二甲基醯胺等等。
硫醇之保護基實例包括:醚型保護基,如:苯甲基硫醚等;酯型保護基,如:硫乙酸酯、硫碳酸酯、硫胺甲酸酯等等。
胺基及芳香族雜環,如:咪唑、吡咯、吲哚等)之保護基實例包括:胺甲酸酯型保護基,如:胺甲酸苯甲基酯等;醯胺型保護基,如:乙醯胺等;烷基胺型保護基,如:N-三苯基甲基胺等;磺醯胺型保護基,如:甲磺醯胺等等。
保護基可依據本身已知之方法脫除,例如:採用使用酸、鹼、紫外線、肼、苯基肼、N-甲基二硫代胺甲酸鈉、四丁基銨化氟、乙酸鈀、三烷基矽烷基鹵化物(例如:三甲基矽烷基碘化物、三甲基矽烷基溴化物)等之方法、還原法,及其類似方法。
當各步驟中進行還原反應時,所使用之還原劑實例包括:金屬氫化物,如:氫化鋰鋁、三乙醯氧基硼氫化鈉、氰基硼氫化鈉、二異丁基氫化鋁(DIBAL-H)、硼氫化鈉、四甲基銨三乙醯氧基硼氫化物等;甲硼烷類,如:甲硼烷四氫呋喃複合物等;阮來鎳(Raney nickel);阮來鈷(Raney cobalt);氫;甲酸;三乙基矽烷等。當要還原碳-碳雙鍵或參鍵時,可採用使用觸媒,如:鈀-碳、林德氏(Lindlar’s)觸媒等之方法。
當各步驟中進行氧化反應時,所使用之氧化劑實例包括:過氧化物,如:間氯過苯甲酸(mCPBA)、過氧化氫、第三丁基過氧化氫等;過氯酸鹽,如:四丁基過氯酸銨等;氯酸鹽,如:氯酸鈉等;次氯酸鹽,如:次氯酸鈉等;過碘酸鹽,如:過碘酸鈉等;高價碘試劑,如:氧碘苯等;含錳之試劑,如:二氧化錳、過錳酸鉀等;鉛,如:四乙酸鉛等;含鉻之試劑,如:氯鉻酸吡啶鎓鹽(PCC)、二鉻酸吡啶鎓鹽(PDC)、強氏試劑(Jones reagent)等;鹵素化合物,如:N-溴琥珀醯亞胺(NBS)等;氧;臭氧;三氧化硫-吡啶複合物;四氧化鋨;二氧化硒;2,3-二氯-5,6-二氰基-1,4-苯醌(DDQ)等。
當各步驟中進行游離基環化反應時,所使用之游離基引發劑實例包括:偶氮化合物,如:偶氮雙異丁腈(AIBN)等;水溶性游離基引發劑,如:4-4’-偶氮雙-4-氰基戊酸(ACPA)等;於空氣或氧氣存在下之三乙基硼;苯甲醯基過氧化物等。所使用之游離基試劑實例包括:三丁基甲錫烷、參-三甲基矽烷基矽烷、1,1,2,2-四苯基二矽烷、二苯基矽烷、碘化釤等。
當各步驟中進行威特(Wittig)反應時,所使用之威特試劑實例包括:亞烷基正膦類等。亞烷基正膦類可依據本身已知之方法製備,例如:由鏻鹽及強鹼反應。
當各步驟中進行霍納爾-埃蒙斯(Horner-Emmons)反應時,所使用之試劑實例包括:膦醯基乙酸酯,如:二甲基膦醯基乙酸甲基酯、二乙基膦醯基乙酸乙基酯等;及鹼類,如:鹼金屬氫化物、有機鋰化物等。
當各步驟中進行傅里德-克拉夫茨(Friedel-Crafts)反應時,係使用路易氏酸(Lewis acid)與醯基氯之組合或路易氏酸與烷基化劑(例
如:烷基鹵化物、醇、烯烴等)之組合作為試劑。或者,亦可改用有機酸或無機酸替代路易氏酸,亦可改用酸酐(如:乙酸酐等)替代醯基氯。
當進行芳香族親核性取代時,係使用親核物(例如:胺、咪唑等)及鹼(例如:有機鹼等)作為試劑。
當各步驟中利用碳陰離子進行親核性加成反應、利用碳陰離子進行親核性1,4-加成反應(米契爾(Michael)加成反應)或利用碳陰離子進行親核性取代反應時,用於產生碳陰離子之鹼實例包括:有機鋰化物、金屬醇鹽、無機鹼、有機鹼等。
當各步驟中進行格林納(Grignard)反應時,所使用之格林納試劑實例包括:芳基鎂鹵化物,如:苯基鎂溴化物等;及烷基鎂鹵化物,如:甲基鎂溴化物等。格林納試劑可依據本身已知之方法製備,例如:由烷基鹵化物或芳基鹵化物及金屬鎂於作為溶劑之醚或四氫呋喃中反應。
當各步驟中進行克萊文蓋爾縮合反應(Knoevenagel condensation)時,係使用具有帶有兩個拉電子基團之活化亞甲基之化合物(例如:丙二酸、丙二酸二乙基酯、丙二腈等)及鹼(例如:有機鹼、金屬醇鹽、無機鹼)作為試劑。
當各步驟中進行維爾斯邁爾-哈克(Vilsmeier-Haack)反應時,係使用磷醯氯及醯胺衍生物(例如:N,N-二甲基甲醯胺等)作為試劑。
當各步驟中進行醇、烷基鹵化物或磺酸酯之疊氮化反應時,所使用之疊氮化劑實例包括:二苯基磷醯基疊氮化物(DPPA)、三甲基矽烷基疊氮化物、疊氮化鈉等。例如:醇之疊氮化反應係採用使用二苯基磷醯
基疊氮化物及1,8-重氮雙環[5.4.0]十一碳-7-烯(DBU)之方法、使用三甲基矽烷基疊氮化物及路易士酸之方法,及其類似方法。
當各步驟中進行還原性胺化反應時,所使用之還原劑實例包括:三乙醯氧基硼氫化鈉、氰基硼氫化鈉、氫、甲酸等。當受質為胺化合物時,所使用之羰基化合物實例包括:多聚甲醛、醛類(如:縮醛等)及酮類(如:環己酮等)。當受質為羰基化合物時,所使用胺之實例包括:氨、一級胺(如:甲基胺等);二級胺(如:二甲基胺等)等。
當各步驟中進行光延(Mitsunobu)反應時,係使用之偶氮二羧酸酯(例如:偶氮二羧酸二乙基酯(DEAD)、偶氮二羧酸二異丙基酯(DIAD)等)及三苯基膦作為試劑。
當各步驟中進行酯化反應、醯胺化反應或脲形成反應時,所使用之試劑實例包括:醯基鹵化物,如:醯基氯、醯基溴等;活化羧酸,如:酸酐、活化酯類、硫酸酯類等。羧酸之活化劑實例包括:碳化二亞胺縮合劑,如:1-乙基-3-(3-二甲基胺基丙基)碳化二亞胺鹽酸鹽(WSCD)等;三縮合劑,如:4-(4,6-二甲氧基-1,3,5-三-2-基)-4-甲基嗎啉鎓氯化物n-水合物(DMT-MM)等;碳酸鹽縮合劑,如:1,1-羰基二咪唑(CDI)等;二苯基磷醯基疊氮化物(DPPA);苯并三唑-1-基氧-參-二甲基胺基鏻鹽(BOP試劑);2-氯-1-甲基-吡啶鎓碘化物(向山試劑(Mukaiyama reagent);亞硫醯氯;鹵甲酸之低碳數烷基酯,如:氯甲酸乙基酯等;O-(7-氮雜苯并三唑-1-基)-N,N,N’,N’-四甲基脲鎓六氟磷酸鹽(HATU);硫酸;其組合等。當使用碳化二亞胺縮合劑時,可在反應系統中添加添加劑,如:1-羥基苯并三唑(HOBt)、N-羥基琥珀醯亞胺(HOSu)、二甲基胺基吡啶(DMAP)等。
當各步驟中進行偶合反應時,所使用之金屬觸媒實例包括:鈀化合物,如:乙酸鈀(II)、肆(三苯基膦)鈀(0)、二氯雙(三苯基膦)鈀(II)、二氯雙(三乙基膦)鈀(II)、參(二亞苯甲基丙酮)二鈀(0)、1,1’-雙(二苯基膦基)二茂絡鐵氯化鈀(II)等;鎳化合物,如:肆(三苯基膦)鎳(0)等;銠化合物,如:參(三苯基膦)銠(III)氯化物等;鈷化合物;銅化合物,如:氧化銅、碘化亞銅(I)等;鉑化合物等。此外,可以在反應系統中添加鹼,其實例包括:無機鹼等。
當各步驟中進行硫羰基化時,通常使用五硫化磷作為硫羰基化劑。或者,亦可改用具有1,3,2,4-二硫雜磷雜環丁烷(dithiadiphosphetane)-2,4-二硫化物結構之試劑(例如:2,4-雙(4-甲氧基苯基)-1,3,2,4-二硫雜磷雜環丁烷-2,4-二硫化物(勞森試劑(Lawesson reagent))等)替代五硫化磷。
當各步驟中進行沃爾-齊格勒(Wohl-Ziegler)反應時,所使用之鹵化劑實例包括:N-碘琥珀醯亞胺、N-溴琥珀醯亞胺(NBS)、N-氯琥珀醯亞胺(NCS)、溴、硫醯氯等。此外,可以在反應系統中,利用游離基引發劑(如:熱、光、苯甲醯基過氧化物、偶氮雙異丁腈等)加速反應。
當各步驟中進行羥基之鹵化反應時,所使用之鹵化劑實例包括:氫鹵酸及無機酸之醯基鹵化物,明確言之,用於氯化反應之鹽酸、亞硫醯氯、磷醯氯等;用於溴化反應之48%氫溴酸等。此外,可採用由醇及三苯基膦及四氯化碳或四溴化碳或類似物之反應製造烷基鹵化物。或者,製造烷基鹵化物之方法亦可採用兩個步驟,包括轉化醇形成對應磺酸酯,然後由該磺酸酯及溴化鋰、氯化鋰或碘化鈉反應。
當各步驟中進行阿爾布佐夫(Arbuzov)反應時,所使用之試劑實例包括:烷基鹵化物,如:溴乙酸乙基酯等;及亞磷酸酯,如:亞磷酸三乙基酯、亞磷酸三(異丙基)酯等。
當各步驟中進行磺酸酯酯化反應時,所使用之磺酸化劑實例包括:甲磺醯氯、對甲苯磺醯氯化、甲烷磺酸酐、對甲苯磺酸酐等。
當各步驟中進行水解反應時,係使用酸或鹼作為試劑。進行第三丁基酯之酸水解反應時,可添加甲酸、三乙基矽烷等,以便進行還原性捕捉第三丁基陽離子副產物。
當各步驟中進行脫水反應時,所使用之脫水劑實例包括:硫酸、五氧化二磷、磷醯氯、N,N’-二環己基碳化二亞胺、礬土、聚磷酸等。
化合物(I)可以依據下列反應圖1所示方法,由化合物(1)製造。反應圖中,LG1及LG2分別獨立為脫離基,R4及R5分別獨立為視需要經取代之C1-6烷基或視需要經取代之C6-14芳基,P1及P2分別獨立為保護基,及其他代號係如上述定義。
由LG1或LG2代表之「脫離基」實例包括:鹵原子、視需要經鹵化之C1-6烷基磺醯基氧基(例如:甲磺醯基氧基、乙磺醯基氧基、三氟甲磺醯基氧基),及視需要經C1-6烷基(群)取代之C6-14芳基磺醯基氧基(例如:苯磺醯基氧基、甲苯磺醯基氧基)等。
由R4或R5代表之「視需要經取代之C1-6烷基」及「視需要經取代之C6-14芳基」之取代基實例包括選自取代基群組A之取代基。取代
基數量較佳係1至3個。當取代基數量為兩個以上時,各取代基可相同或不同。
由P1或P2代表之「保護基」實例包括:彼等由上述「胺基及芳香族雜環(如:咪唑、吡咯、吲哚等)之保護基」所例舉者。
化合物(1)可自商品取得,或可依據本身已知之方法或其類似方法製造。
化合物(4)可藉由化合物(2)在金屬之存在下、及化合物(3)進行雷福馬斯基(Reformatsky)反應而製造。所使用之金屬實例包括:鋅、碘化釤、銦等。化合物(3)可自商品取得,或可依據本身已知之方法或其類似方法製造。
化合物(6)法可藉由化合物(5)在鹼之存在下進行縮合反應而製造。所使用之鹼之實例包括:無機鹼、有機鹼、鹼金屬氫化物等。
化合物(9)可藉由化合物(8)進行磺酸酯之酯化反應而製造。所使用之磺酸化劑實例包括:甲磺醯氯、對甲苯磺醯氯、甲烷磺酸酐、對甲苯磺酸酐、三氟甲烷磺酸酐等。
化合物(10)可藉由化合物(9)進行疊氮化反應而製造。所使用之疊氮化劑實例包括:四-正丁基銨疊氮化物、三甲基矽烷基疊氮化物、疊氮化鈉等。
化合物(13)可藉由化合物(11)及化合物(12)進行磺醯胺化反應而製造。所使用之化合物(12)實例包括:磺醯氯、胺磺醯氯等。化合物(12)可自商品取得,或可依據本身已知之方法或其類似方法製造。
化合物(I)可藉由化合物(14)及化合物(15)進行縮合反應而製造。所使用之化合物(15)實例包括:醯基鹵化物,如:醯基氯、醯基溴、氯甲酸烷基酯、胺甲醯氯等;及活化羧酸,如:酸酐、活化酯類、硫酸酯等。羧酸之活化劑實例包括:碳化二亞胺縮合劑,如:1-乙基-3-(3-二甲基胺基丙基)碳化二亞胺鹽酸鹽(WSCD)等;三縮合劑,如:4-(4,6-二甲氧基-1,3,5-三-2-基)-4-甲基嗎啉鎓氯化物-n-水合物(DMT-MM)等;碳酸酯縮合劑,如:1,1-羰基二咪唑(CDI)等;二苯基磷醯基疊氮化物(DPPA);苯并三唑-1-基氧-參二甲基胺基鏻鹽(BOP試劑);2-氯-1-甲基-吡啶鎓碘化物(向山(Mukaiyama)試劑);亞硫醯氯;低碳數烷基鹵甲酸酯,如:氯甲酸乙基酯等;O-(7-氮雜苯并三唑-1-基)-N,N,N’,N’-四甲基脲鎓六氟磷酸鹽(HATU);硫酸;其組合等。此外,可以添加鹼至反應系統中。鹼實例包括:無機鹼、有機鹼等。當使用碳化二亞胺縮合劑時,可更在反應系統中添加添加劑,如:1-羥基苯并三唑(HOBt)、N-羥基琥珀醯亞胺(HOSu)、二甲基胺基吡啶(DMAP)等。
在所得之化合物(I)中,分子內官能基亦可經過本身已知之化學反應組合轉化成主要官能基。該化學反應實例包括:氧化反應、還原反應、烷基化反應、醯基化反應、脲化反應、水解反應、胺化反應、酯化反應、芳基偶合反應、脫除保護基反應等。
上述製法中,當起始化合物具有胺基、羧基、羥基、羰基或氫硫基作為取代基時,肽化學常用之保護基可被引進此等基團中,並可依需要在反應後脫除保護基後,得到所需之化合物。
由上述製法得到之化合物(I)可以採用已知方法單離及純化,如:溶劑萃取、液體轉化、移相、結晶、再結晶、層析,及其類似方法。
當化合物(I)包含光學異構物、立體異構物及旋轉異構物時,此等化合物亦包括在化合物(I)內,且分別可依本身已知合成方法或分離方法得到單一產物。例如:當化合物(I)出現光學異構物時,由該化合物解析之光學異構物亦包括在化合物(I)內。
此外,可依本身已知方法製造光學異構物。
化合物(I)可為晶體.。
化合物(I)之晶體(下文中有時候縮寫為本發明晶體)可由化合物(I)採用本身已知結晶方法進行結晶得到。
本說明書中,熔點意指利用例如:顯微熔點測定儀(Yanako,MP-500D或Buchi,B-545)、DSC(差示掃描量熱分析)裝置(METTLER TOLEDO,DSC1)等測定之熔點。
通常,熔點有時候會隨測定裝置、測定條件等變化。本說明書之晶體顯示之熔點可能與本說明書所說明數值不同,只要此差異在一般誤差範圍內即可。
本發明晶體具有優異物理化學性質(例如:熔點、溶解度、安定性)及生物性質(例如:藥物動力學(吸收性、分佈性、代謝性、排泄性)、效力表現),極適用為醫藥。
化合物(I)亦可作為前藥使用。化合物(I)之前藥係指一種可於活體內生理條件下,受到酵素、胃酸等反應轉化成本發明化合物(I)之化
合物,亦即可依據酵素之氧化、還原、水解等反應轉化成本發明化合物(I)之化合物;及可經胃酸等水解轉化成本發明化合物(I)之化合物。
化合物(I)之前藥可為由化合物(I)中之胺基經醯化、烷化或磷酸化得到之化合物(例如:由化合物(I)中之胺基經二十碳烷醯基化、丙胺醯基化、戊基胺基羰基化、(5-甲基-2-側氧基-1,3-二氧雜環戊烯-4-基)甲氧基羰基化、四氫呋喃基化、吡咯啶基甲基化、三甲基乙醯基氧甲基化及第三丁基化等製得之化合物);由化合物(I)中之羥基經醯基化、烷基化、磷酸化或硼酸化製得之化合物(例如:由化合物(I)中之羥基經乙醯基化、棕櫚醯基化、丙醯基化、三甲基乙醯基化、琥珀醯基化基、富馬醯基化、丙胺醯基化、二甲基胺基甲基羰基化等製得之化合物);由化合物(I)中之羧基經過酯化或醯胺化製得之化合物(例如:化合物(I)中之羧基經過乙基酯化、苯基酯化、羧基甲基酯化、二甲基胺基甲基酯化、三甲基乙醯基氧甲基酯化、乙氧基羰基氧乙基酯化、酞基酯化、(5-甲基-2-側氧基-1,3-二氧雜環戊烯-4-基)甲基酯化、環己基氧羰基乙基酯化及甲基醯胺化等製得之化合物)等。任何此等化合物均可由化合物(I)依本身已知之方法製得。
化合物(I)之前藥亦可為可於如:「IYAKUHIN no KAIHATSU(醫藥產品發展),Vol.7,Design of Molecules,p.163-198,HIROKAWA SHOTEN出版(1990)」中說明之彼等生理條件下轉化成化合物(I)之化合物。
本說明書中,前藥可形成鹽,且此等鹽可述及上述式(I)所代表化合物所例舉之彼等鹽。
化合物(I)可標記同位素(例如:3H、13C、14C、18F、35S、125I)等。
可採用經同位素標記或取代之化合物(I),例如:作為發射正子之電腦斷層攝影術(PET)之示蹤劑(PET示蹤劑),且適用於醫學診斷領域等。
此外,化合物(I)可為水合物或無水物,或非溶劑合物(例如:酸酐),或溶劑合物(例如:水合物)。
化合物(I)亦可包含氘轉化型,其中1H轉化成2H(D)。
此外,化合物(I)可為醫藥上可接受之共晶體或共晶體鹽。此時,該共晶體及共晶體鹽係指由兩種或更多種分別具有不同物理性質(例如:結構、熔點、熔解熱、吸濕性、及安定性)且在室溫下呈固體之特定物質組成之結晶物質。該共晶體及共晶體鹽可由本身已知之共結晶法製得。
化合物(I)或其前藥(下文中有時候簡稱為本發明化合物)可直接使用、或及醫藥上可接受之載劑等混合成醫藥組成物形式(亦稱為醫藥)後使用,作為預防或治療下述各種不同疾病之藥劑對哺乳動物(例如:人類、小鼠、大鼠、兔、狗、貓、牛、馬、豬、猴)投予。
可使用常用為製劑原料之各種不同有機或無機載劑物質作為醫藥上可接受之載劑。可在固體製劑中添加作為媒劑、潤滑劑、結合劑及崩解劑之載劑;或在液態製劑中添加作為溶劑、溶解劑、懸浮劑、等滲劑、緩衝劑及舒緩劑之載劑等;及若需要時,可使用如:防腐劑、抗氧化劑、著色劑、甜味劑等作為製劑添加劑。
賦形劑之較佳實例包括:乳糖、蔗糖、D-甘露糖醇、D-山梨糖醇、澱粉、糊化澱粉、糊精、結晶纖維素、低取代度羥丙基纖維素、羧甲基纖維素鈉、阿拉伯膠、普魯蘭多醣(pullulan)、輕質無水矽酸、合成性矽酸鋁及偏矽酸鋁鎂。
潤滑劑之較佳實例包括:硬脂酸鎂、硬脂酸鈣、滑石及膠體矽石。
結合劑之較佳實例包括:糊化澱粉、蔗糖、明膠、阿拉伯膠、甲基纖維素、羧甲基纖維素、羧甲基纖維素鈉、結晶纖維素、蔗糖、D-甘露糖醇、海藻糖、糊精、普魯蘭多醣、羥丙基纖維素、羥丙基甲基纖維素、及聚乙烯基吡咯啶酮。
崩解劑之較佳實例包括:乳糖、蔗糖、澱粉、羧甲基纖維素、羧甲基纖維素鈣、交聯羧甲基纖維素鈉、羧基甲基澱粉鈉、輕質無水矽酸、及低取代度羥丙基纖維素。
溶劑之較佳實例包括:注射用水、生理食鹽水、林格氏溶液(Ringer’s solution)、醇類、丙二醇、聚乙二醇、芝麻油、玉米油、橄欖油、及棉籽油。
溶解劑之較佳實例包括:聚乙二醇、丙二醇、D-甘露糖醇、海藻糖、苯甲酸苯甲基酯、乙醇、參-胺基甲烷、膽固醇、三乙醇胺、碳酸鈉、檸檬酸鈉、水楊酸鈉、及乙酸鈉。
懸浮劑之較佳實例包括:界面活性劑,如:硬脂基三乙醇胺、月桂基硫酸鈉、胺基丙酸月桂基酯、卵磷脂、氯苄烷胺(benzalkonium chloride)、氯苄乙氧銨(benzethonium chloride)、單硬脂酸甘油酯等;親水性聚合物,如:聚乙烯醇、聚乙烯基吡咯啶酮、羧甲基纖維素鈉、甲基纖維素、羥基甲基纖維素、羥基乙基纖維素、羥基丙基纖維素等;聚山梨酸酯、及聚氧伸乙基氫化蓖麻油。
等滲劑之較佳實例包括:氯化鈉、甘油、D-甘露糖醇、D-山梨糖醇及葡萄糖。
緩衝劑之較佳實例包括:磷酸鹽、乙酸鹽、碳酸鹽、檸檬酸鹽等之緩衝劑。
舒緩劑之較佳實例包括:苯甲基醇。
防腐劑之較佳實例包括:對氧苯甲酸酯、氯丁醇、苯甲基醇、苯乙基醇、脫氫乙酸及山梨酸。
抗氧化劑之較佳實例包括:亞硫酸鹽及抗壞血酸鹽。
著色劑之較佳實例包括:水性食用煤焦油色素(例如:食用色素,如:食用色素紅色2號及3號、食用色素黃色4號及5號、食用色素藍色1號及2號,及其類似色素);水不溶性色澱染劑(例如:上述水性食用煤焦油色素之鋁鹽)、天然染劑(例如:β-胡蘿蔔素、葉綠素、紅色氧化鐵)等。
甜味劑之較佳實例包括:糖精鈉、甘草酸二鉀、阿斯巴甜(aspartame)及甜菊。
上述醫藥組成物之劑型實例包括:口服製劑,如:錠劑(包括糖衣錠、膜衣錠、舌下錠、口腔崩解錠、頰含錠)、膠囊(包括軟膠囊、微膠囊)、丸劑、粒劑、粉劑、口含錠、糖漿、液體、乳液、懸浮液、氣霧劑、膜錠(例如:口腔崩解膜錠、口腔黏膜黏著性膜錠)等;及非經腸式製劑,如:注射(例如:皮下注射、靜脈內注射、肌內注射、腹膜內注射、點滴輸注)、外用製劑(例如:穿皮吸收型製劑、油膏、洗液、黏著性製劑)、栓劑(例如:直腸栓劑、陰道栓劑)、丸劑、鼻用製劑、肺部用製劑(吸入劑)、滴眼劑等。本發明化合物及醫藥分別可經口或非經腸式安全投藥(例如:經直腸內、靜脈內、動脈內、肌內、皮下、器官內、鼻內、皮內、滴注、腦內、陰道內、腹膜內、腫瘤、腫瘤附近投藥,及投藥至病灶處)。
此等製劑可為控制釋放製劑(例如:持續釋放性微膠囊),如:立即釋放性製劑、持續釋放性製劑等。
本發明醫藥組成物可依據醫藥調配物領域常用之方法製造,例如:列於「日本藥典(the Japanese Pharmacopoeia)」中說明之方法等。
雖然本發明醫藥組成物中之本發明化合物含量係隨劑型、本發明化合物劑量等變化,但其為例如:約0.1至100wt%。
當製造口服製劑時,若必要時可施加包衣,目的在於遮蔽味道、溶於腸道或持續性。
用於包覆之包衣基質實例包括:糖衣基質、水溶性膜衣基質、腸溶性膜衣基質及持續釋放性膜衣基質。
可使用蔗糖作為糖類包衣基質,且可更組合使用選自下列之一或多種:滑石及沉澱碳酸鈣、明膠、阿拉伯膠、普魯蘭多醣、巴西棕櫚蠟等。
水溶性膜衣基質實例包括:纖維素聚合物,如:羥丙基纖維素、羥丙基甲基纖維素、羥乙基纖維素、甲基羥乙基纖維素等;合成性聚合物,如:聚乙烯縮醛二乙胺基乙酸酯、胺基烷基甲基丙烯酸酯共聚物E[Eudragit E(商標名稱)]、聚乙烯基吡咯啶酮等;多醣類,如:普魯蘭多醣等。
腸溶性膜衣基質實例包括:纖維素聚合物,如:羥基丙基甲基纖維素酞酸酯、羥基丙基甲基纖維素乙酸酯琥珀酸酯、羧基甲基乙基纖維素、纖維素乙酸酯酞酸酯等;丙烯酸聚合物,如:甲基丙烯酸共聚物L[Eudragit L(商標名稱)]、甲基丙烯酸共聚物LD[Eudragit L-30D-55(商標名稱)]、甲基丙烯酸共聚物S[Eudragit S(商標名稱)]等;及天然物質(如:蟲膠等)。
持續釋放性膜衣基質實例包括:纖維素聚合物,如:乙基纖維素等;及丙烯酸聚合物,如:胺基烷基甲基丙烯酸酯共聚物RS[Eudragit RS(商標名稱)]、丙烯酸乙酯-甲基丙烯酸甲酯共聚物懸浮液[Eudragit NE(商標名稱)]等。
可依適當比例混合使用兩種或更多種如上述包衣基質。此外,例如:亦可使用遮光劑,如:氧化鈦、紅色氧化鐵等。
由於本發明化合物顯示低毒性(例如:急性毒性、慢性毒性、遺傳毒性、生殖毒性、心臟毒性、致癌性)及較低副作用,因此可作為哺乳動物(例如:人類、牛、馬、狗、貓、猴、小鼠、大鼠)之各種不同疾病之預防或治療劑或診斷藥劑。
此外,本發明化合物預期具有優異之中樞移動性。
本發明化合物具有優異之食慾激素第2型受體促效劑活性,可以治療、預防或緩解及食慾激素第2型受體相關之各種神經及心理疾病之風險。本發明化合物適用為預防或治療以下各種不同疾病之藥劑,如:猝睡症、特異性嗜睡症、嗜睡症、睡眠呼吸暫停症候群、伴隨類似猝睡症症狀之猝睡症候群、伴隨白天嗜睡之嗜睡症候群(例如:克萊-李文症候群(Kleine Levin syndrome)、出現嗜睡症之重度憂鬱症、路易體失智症(Lewy body dementia)、帕金森氏症(Parkinson’s disease)、進行性核上眼神經麻痺症、普瑞德-威利症候群(Prader-Willi syndrome)、牟比士症候群(Moebius syndrom)、換氣量不足症候群、C型尼曼匹克症(Niemann-Pick disease type C)、腦挫傷、腦梗塞、腦腫瘤、肌肉萎縮症、多發性硬化、急性瀰漫性腦脊髓炎、格林-巴利症候群(Guillain-Barre syndrome)、羅氏腦炎
(Rasmussen’s encephalitis)、韋尼克式氏腦病變(Wernicke’s encephalitis)、邊緣葉腦炎、橋本氏腦病變(Hashimoto’s encephalopathy))、昏迷、意識喪失、肥胖症(例如:惡性肥大細胞增多症、外因性肥胖症、胰島功能亢進性肥胖症、脂肪細胞增殖型肥胖症、垂體功能不全性肥胖症、發育不全性肥胖症、甲狀腺機能低下型肥胖症、下視丘性肥胖症、有症狀性肥胖症、嬰兒肥胖症、上半身肥胖症、飲食性肥胖症、性腺低能症肥胖症、全身性肥大細胞增生症、單純肥胖症、中央型肥胖)、胰島素抗性症候群、阿茲海默症(Alzheimer’s disease)、意識障礙(如:昏迷等)、因麻醉引起之副作用及併發症、睡眠紊亂、睡眠問題、失眠、間歇性睡眠、夜間肌陣攣、REM睡眠中斷、時差、時差症候群、輪班工作者之睡眠障礙、睡眠障礙、夜眠驚恐、憂鬱症、重度憂鬱症、夢遊症、夜間遺尿症、睡眠障礙、阿茲海默症黃昏症候群(Alzheimer’s dusk)及生理時鐘相關之疾病、纖維肌痛症、因睡眠品質下降造成之病症、暴食、強迫症性進食障礙、肥胖相關疾病、高血壓、糖尿病、血漿胰島素濃度升高及胰島素抗性、高血脂症、血脂過高、子宮內膜癌、乳癌、攝護腺癌、結腸直腸癌、癌症、骨關節炎、阻塞型睡眠呼吸中止、膽石病、膽結石、心臟疾病、心跳異常、心律不整、心肌梗塞、充血性心臟衰竭、心臟衰竭、冠狀心臟疾病、心血管病變、猝死、多囊性卵巢疾病、顱咽管瘤、弗利氏症候群(Froelich’s syndrome)、生長激素缺陷、正常突變體矮、透納氏症候群(Turner’s syndrome)、罹患急性淋巴母細胞性白血病的兒童、症候群X、生殖激素異常、生育率下降、不孕、男性生殖腺功能下降、性及生殖功能障礙(如:女性的雄性多毛症)及懷孕婦女肥胖相關之胎兒缺陷、胃腸蠕動病變(如:肥胖相關之胃食道逆流)、肥胖
症換氣不足症候群(皮氏症候群(Pickwick syndrome))、呼吸疾病(如:呼吸困難)、發炎(如:血管系統之全身性發炎)、動脈血管硬化、高膽固醇血症、高尿酸血症、下背疼痛、膽囊疾病、痛風、腎臟癌、肥胖症之後續風險(如:降低左心室肥大的風險)、偏頭痛、頭痛、神經病變性疼痛、帕金森氏症(Parkinson’s disease)、精神病、精神分裂、臉潮紅、夜盜汗、生殖/泌尿系統疾病及性功能或生育力相關之疾病、輕鬱症、躁鬱症、第I型躁鬱症、第II型躁鬱症、循環性情感疾病、急性壓力疾病、廣場恐懼症、廣泛性焦慮症、強迫症、恐慌發作、恐慌症、創傷後壓力疾病、分離焦慮症、社交恐懼症、焦慮症、急性神經及心理疾病(如:心臟繞道手術及移植後腦缺陷)、中風、缺血性中風、腦缺血、脊柱創傷、頭部創傷、周產期缺氧、心跳停止、低血糖神經損傷、亨丁頓氏症(Huntington’s disease)、肌萎縮性側索硬化症、多發性硬化、眼睛損傷、視網膜病變、認知力受損、肌肉痙攣、震顫、癲癇及肌肉痙攣相關之病變、譫妄、失憶症及老化相關之認知力下降、分裂情感疾病、妄想性疾病、藥物成隱、運動失能症、慢性疲勞症候群、疲勞、醫藥誘發之帕金森症候群、妥瑞氏症候群(Jill-do La Tourette’s syndrome)、舞蹈症、肌躍症、抽動、腿不寧症候群、肌張力不全症、運動失能症、注意力不足過動症(ADHD)、行為異常、尿失禁、戒斷症狀、三叉神經痛、聽力喪失、耳鳴、神經傷害、視網膜病變、黃斑部病變、嘔吐、腦水腫、疼痛、骨痛、關節痛、牙痛、猝倒症、及創傷後腦傷(TBI)。
特定言之,本發明化合物適用為預防或治療以下病症之製劑:猝睡症、特異性嗜睡症、嗜睡症、睡眠呼吸暫停症候群、伴隨類似猝睡症症狀之猝睡症候群、伴隨白天嗜睡之嗜睡症候群(例如:帕金森氏症、
格林-巴利症候群及克萊-李文症候群)、阿茲海默症、肥胖症、胰島素抗性症候群、心臟衰竭及骨質流失相關之疾病、敗血症、意識障礙(如:昏迷等)、因麻醉及其類似物、或麻醉藥拮抗劑造成之副作用及併發症。
雖然本發明化合物之劑量將隨接受投藥之個體、投藥途徑、目標疾病、症狀等變化,但例如:當本發明化合物供成人患者經口或非經腸式投藥時,其劑量為例如:每劑約0.01至100mg/kg體重,較佳係每劑0.1至50mg/kg體重,及更佳係每劑0.5至20mg/kg體重。需要時,此用量係分成一天三份投藥。
本發明化合物可及其他藥物(下文簡稱為併用藥物)組合使用。
組合本發明化合物與併用藥物時,可產生優越效果,例如:
(1)其劑量可比單獨投予本發明化合物或併用藥物時降低,
(2)可依據患者之病症(中度、嚴重等),選擇可與本發明化合物組合之藥物,
(3)藉由選擇具有與本發明化合物不同之作用及機轉之併用藥物,可以設計延長治療期;
(4)藉由選擇具有與本發明化合物不同之作用及機轉之併用藥物,可以得到持續之治療效果;及
(5)藉由組合使用本發明化合物與併用藥物等,可達到增效性效果。
本說明書中,本發明化合物及組合使用之併用藥物稱為「本發明之組合製劑」。
當使用本發明之組合製劑時,本發明化合物及併用藥物之投藥時間沒有限制,且本發明化合物或其醫藥組成物及併用藥物或其醫藥組成物可同時投予個體,或可在不同時間投予個體。併用藥物之劑量可依據臨床上之使用劑量決定,且可依據接受投藥之個體、投藥途徑、疾病、組合等適當選擇當。
本發明組合製劑及併用藥物之投藥模式沒有特別限制,只要本發明化合物可及併用藥物組合投藥即可。此等投藥模式實例包括:下列方法:
(1)由本發明化合物及併用藥物同時製成單一製劑後投藥,(2)由本發明化合物及併用藥物分開製造之兩種製劑依相同投藥途徑同時投藥,(3)由本發明化合物及併用藥物分開製造之兩種製劑依相同投藥途徑依序投藥,(4)由本發明化合物及併用藥物分開製造之兩種製劑依不同投藥途徑同時投藥,(5)由本發明化合物及併用藥物分開製造之兩種製劑依不同投藥途徑依序投藥(例如:先投予本發明化合物後再投予併用藥物,或依相反順序投藥)等。
併用藥物之劑量可依據臨床狀態所採用之劑量適當決定。本發明化合物及併用藥物之混合比例可依據接受投藥之個體、投藥途徑、目標疾病、症狀、組合等適當決定。
例如:本發明組合製劑中之本發明化合物含量可隨製劑形式變化,且通常佔總製劑之約0.01至約100wt%,較佳係約0.1至約50wt%,更較佳係約0.5至約20wt%。
本發明組合製劑中之併用藥物含量可隨製劑形式變化,且通常佔總製劑之約0.01至約100wt%,較佳係約0.1至約50wt%,更較佳係約0.5至約20wt%。
本發明組合製劑中之添加劑(如:載劑等)之含量可隨製劑形式變化,且通常佔製劑之約1至約99.99wt%,較佳係約10至約90wt%。
即使當本發明化合物及併用藥物分開調配成製劑時,其可採用上述之類似含量。
併用藥物實例包括下列。猝睡症之醫療性藥物(例如:甲基芬尼特(methyl phenidate)、安非他命(amphetamine)、佩莫林(pemoline)、苯乙肼(phenelzine)、普羅替林(protriptyline)、羥丁酸鈉(sodium oxybate)、莫達非尼(modafinil)、咖啡因)、抗肥胖症藥物(安非他命、甲苯異丙胺(Benzfetamine)、溴隱亭(bromocriptine)、安非他酮(bupropion)、雙乙氨丙醯苯酮(diethylpropion)、艾塞那肽(exenatide)、氟苯丙胺(fenfluramine)、三碘甲狀腺胺酸(liothyronine)、利拉魯肽(liraglutide)、氯苯咪吲哚(mazindol)、甲基安非他命(methamphetamine)、奧曲肽(octreotide)、奧曲肽(octreotide)、奧利司他(orlistat)、苯丙咪(phendimetrazine)、苯丙咪(phendimetrazine)、苯甲嗎啉(phenmetrazine)、芬他命(phentermine)、Qnexa(註冊商標)、苯基丙醇胺、普蘭林肽(pramlintide)、氫化去氧麻黃鹼(propylhexedrine)、重組瘦蛋白、西布曲明(sibutramine)、托吡酯(topiramate)、苯吡烯胺(zimelidine)、唑尼沙胺(zonisamide)、氯卡色林(Lorcaserin)、二甲雙胍(metformin))、乙醯基膽鹼酯酶抑制劑(例如:多奈哌齊(donepezil)、里曼提明(rivastigmine)、加蘭他敏(galanthamine)、蘭奈
哌齊(zanapezil)、艾地苯(idebenone)、他克林(tacrine))、抗失智劑(例如:美金剛胺(memantine))、β類澱粉蛋白質製造、分泌、累積、凝集及/或沉積之抑制劑、β分泌酶抑制劑(例如:6-(4-聯苯基)甲氧基-2-[2-(N,N-二甲基胺基)乙基]四氫萘、6-(4-聯苯基)甲氧基-2-(N,N-二甲基胺基)甲基四氫萘、6-(4-聯苯基)甲氧基-2-(N,N-二丙基胺基)甲基四氫萘、2-(N,N-二甲基胺基)甲基-6-(4’-甲氧基聯苯-4-基)甲氧基四氫萘、6-(4-聯苯基)甲氧基-2-[2-(N,N-二乙胺基)乙基]四氫萘、2-[2-(N,N-二甲基胺基)乙基]-6-(4’-甲基聯苯-4-基)甲氧基四氫萘、2-[2-(N,N-二甲基胺基)乙基]-6-(4’-甲氧基聯苯-4-基)甲氧基四氫萘、6-(2’,4’-二甲氧基聯苯-4-基)甲氧基-2-[2-(N,N-二甲基胺基)乙基]四氫萘、6-[4-(1,3-苯并間二氧雜環戊烯-5-基)苯基]甲氧基-2-[2-(N,N-二甲基胺基)乙基]四氫萘、6-(3’,4’-二甲氧基聯苯-4-基)甲氧基-2-[2-(N,N-二甲基胺基)乙基]四氫萘、其光學活性型、其鹽及其水合物、OM99-2(WO01/00663))、γ分泌抑制劑、β類澱粉蛋白質凝集抑制劑(例如:PTI-00703、ALZHEMED(NC-531)、PPI-368(國家公開之國際專利申請案(National Publication of International Patent Application)案號11-514333)、PPI-558(國家公開之國際專利申請案案號2001-500852)、SKF-74652(Biochem.J.(1999),340(1),283-289))、β類澱粉疫苗、β類澱粉-降解酵素及其類似物、腦功能加強劑(例如:阿尼西坦(aniracetam)、尼麥角林(nicergoline))、帕金森氏症之醫療性藥物[(例如:多巴胺受體促效劑(例如:L-DOPA、溴隱亭(bromocriptine)、培高利特(pergolide)、他利克索(talipexole)、普拉克索(pramipexole)、卡麥角林(cabergoline)、金剛烷胺(amantadine))、單胺氧化酶酵素(MAO)抑制劑(例如:丙炔苯并胺
(deprenyl)、希利治林(selegiline)、瑞馬西胺(remacemide)、利魯唑(riluzole))、抗膽鹼劑(例如:苯海索(trihexyphenidyl)、百比停(biperiden))、COMT抑制劑(例如:恩他卡朋(entacapone))]、肌萎縮性側索硬化症之醫療性藥物(例如:利魯唑(riluzole)等、神經營養因子)、行為異常伴隨失智、徘徊等演進之醫療性藥物(例如:鎮靜劑、抗焦慮藥物)、細胞凋亡抑制劑(例如:CPI-1189、IDN-6556、CEP-1347)、神經元分化-再生促進劑(例如:來普立寧(leteprinim)、沙利羅登(xaliproden);SR-57746-A)、SB-216763、Y-128、VX-853、普賽肽(prosaptide)、5,6-二甲氧基-2-[2,2,4,6,7-五甲基-3-(4-甲基苯基)-2,3-二氫-1-苯并呋喃-5-基]異吲哚啉、5,6-二甲氧基-2-[3-(4-異丙基苯基)-2,2,4,6,7-五甲基-2,3-二氫-1-苯并呋喃-5-基]異吲哚啉、6-[3-(4-異丙基苯基)-2,2,4,6,7-五甲基-2,3-二氫-1-苯并呋喃-5-基]-6,7-二氫-5H-[1,3]二氧雜環戊烯并[4,5-f]異吲哚及其光學活性型、鹽或水合物)、非類固醇消炎劑(美洛昔康(meloxicam)、替諾昔康(tenoxicam)、吲哚美辛(indomethacin)、布洛芬(ibuprofen)、塞來昔布(celecoxib)、羅非昔布(rofecoxib)、阿斯匹靈、吲哚美辛(indomethacin)等)、類固醇藥物(地塞米松(dexamethasone)、己烯雌酚(hexestrol)、乙酸可體松(cortisone acetate)等)、改善疾病之抗風濕藥(DMARD)、抗細胞激素藥物(例如:TNF抑制劑、MAP激酶抑制劑)、尿失禁、頻尿之醫療劑(例如:伏順(flavoxate)鹽酸鹽、奧昔布寧(oxybutynin)鹽酸鹽、丙哌維林(propiverine)鹽酸鹽)、磷酸二酯酶抑制劑(例如:西地那非(sildenafil)(檸檬酸鹽))、多巴胺促效劑(例如:阿撲嗎啡(apomorphine))、抗心律不整藥(例如:脈律循(mexiletine))、性激素或其衍生物(例如:孕酮(progesterone)、雌二醇、雌二醇苯甲酸酯)、骨質疏
鬆症之醫療劑(例如:α骨化醇(alfacalcidol)、骨化三醇(calcitriol)、依卡托寧(elcatonin)、鮭魚抑鈣素(calcitonin salmon)、雌三醇、依普黃酮(ipriflavone)、裴米卓耐特二鈉(pamidronate disodium)、阿侖膦酸鈉水合物(alendronate sodium hydrate)、因卡膦酸二鈉(incadronate disodium))、副甲狀腺激素(PTH)、鈣受體拮抗劑、失眠之醫療性藥物(例如:苯并二氮雜環庚三烯類醫藥、非苯并二氮雜環庚三烯類醫藥、褪黑素促效劑、食慾激素受體拮抗劑)、精神分裂症之醫療性藥物(例如:典型抗精神病劑,如:氟哌啶醇(haloperidol)等;非典型抗精神病劑,如:氯氮平(clozapine)、奧氮平(olanzapine)、理思必妥(risperidone)、阿立哌唑(aripiprazole)等;作用在代謝型麩胺酸受體或離子通道接合型麩胺酸受體之醫藥;磷酸二酯酶抑制劑)、苯并二氮雜環庚三烯類醫藥(氯二氮平(chlordiazepoxide)、地西泮(diazepam)、氯氮卓鉀(potassium clorazepate)、蘿拉西泮(lorazepam)、氯硝西泮(clonazepam)、阿普唑侖(alprazolam)等)、L型鈣通道抑制劑(普瑞巴林(pregabalin)等)、三環或四環抗抑鬱劑(伊米帕明(imipramine)鹽酸鹽、阿米替林(amitriptyline)鹽酸鹽、地昔帕明(desipramine)鹽酸鹽、氯米帕明(clomipramine)鹽酸鹽等)、選擇性羥色胺再吸收抑制劑(氟伏沙明(fluvoxamine)馬來酸鹽、氟西汀(fluoxetine)鹽酸鹽、西酞普蘭(citalopram)氫溴酸鹽、舍曲林(sertraline)鹽酸鹽、帕羅西汀(paroxetine)鹽酸鹽、艾司西酞普蘭(escitalopram)草酸鹽等)、羥色胺-去甲基腎上腺素再吸收抑制劑(文拉法辛(venlafaxine)鹽酸鹽、度洛西汀(duloxetine)鹽酸鹽、去甲文拉法辛(desvenlafaxine)鹽酸鹽等)、去甲基腎上腺素再吸收抑制劑(瑞波西汀(reboxetine)甲磺酸鹽等)、米氮平(mirtazapine)、曲唑酮(trazodone)鹽酸
鹽、奈法唑酮(nefazodone)鹽酸鹽、安非他酮(bupropion)鹽酸鹽、司普替林(setiptiline)馬來酸鹽、5-HT1A促效劑、(丁螺環酮(buspirone)鹽酸鹽、坦度螺酮(tandospirone)檸檬酸鹽、奧莫佐坦(osemozotan)鹽酸鹽等)、5-HT2A拮抗劑、5-HT2A反促效劑、5-HT3拮抗劑(氰甲丙(cyamemazine)等)、心臟非選擇性β抑制劑(普萘洛爾(propranolol)鹽酸鹽、氧烯洛爾(oxprenolol)鹽酸鹽等)、組織胺H1拮抗劑(羥基肼鹽酸鹽等)、CRF拮抗劑、其他抗焦慮藥物(甲丙巴酸酯(meprobamate)等)、速激肽拮抗劑(MK-869、沙瑞度坦(saredutant)等)、作用在代謝型麩胺酸受體上之醫藥、CCK拮抗劑、β3腎上腺素拮抗劑(安貝格龍((amibegron)鹽酸鹽等)、GAT-1抑制劑(噻加賓(tiagabine)鹽酸鹽等)、N型鈣通道抑制劑、碳酸脫水酶II抑制劑、NMDA甘胺酸部分促效劑、NMDA拮抗劑(美金剛胺(memantine)等)、末梢苯并二氮雜環庚三烯受體促效劑、血管加壓素拮抗劑、血管加壓素V1b拮抗劑、血管加壓素V1a拮抗劑、磷酸二酯酶抑制劑、類鴉片拮抗劑、類鴉片促效劑、脲苷、菸鹼酸受體促效劑、甲狀腺激素(T3、T4)、TSH、TRH、MAO抑制劑(苯乙肼(phenelzine)硫酸鹽、反苯環丙胺(tranylcypromine)硫酸鹽、嗎氯貝胺(moclobemide)等)、躁鬱症之醫療性藥物(碳酸鋰、丙戊酸鈉、拉莫三(lamotrigine)、利魯唑(riluzole)、非爾胺酯(felbamate)等)、大麻素CB1拮抗劑(利莫那班(rimonabant)等)、FAAH抑制劑、鈉通道抑制劑、抗-ADHD藥物(甲基芬尼特(methyl phenidate)鹽酸鹽、甲基安非他命鹽酸鹽等)、酗酒之醫療性藥物、自閉症之醫療性藥物、慢性疲勞症候群之醫療性藥物、痙攣之醫療性藥物、纖維肌痛症候群之醫療性藥物、頭痛之醫療性藥物、戒煙之醫療性藥物、重症肌無力之醫療性藥物、腦梗塞之醫療性藥
物、狂躁之醫療性藥物、嗜睡症之醫療性藥物、疼痛之醫療性藥物、輕鬱症之醫療性藥物、自主神經失調症之醫療性藥物、男性及女性性功能障礙之醫療性藥物、偏頭痛之醫療性藥物、病態賭徒之醫療性藥物、腿不寧症候群之醫療性藥物、物質成癮之醫療性藥物、酒精相關症候群之醫療性藥物、腸躁症之醫療性藥物、脂質異常之醫療性藥物(如:降膽固醇藥物(史丹汀(statin)系列(普伐他汀鈉(pravastatin sodium)、阿托伐他汀(atorvastatin)、辛伐他汀(simvastatin)、瑞舒伐他汀(rosuvastatin)等)、纖維酸類(fibrate)(氯貝丁酯(clofibrate))等)、鯊烯合成酶抑制劑))、行為異常之醫療性藥物或因失智造成之漫遊癖之壓制劑(鎮靜劑、抗焦慮藥等)、糖尿病之醫療性藥物、糖尿病併發症之醫療劑、高血壓之醫療性藥物、低血壓之醫療性藥物、利尿劑、化療劑、免疫醫療劑、抗血栓劑、抗癌劑等。
上述併用藥物可依適當比例組合使用其中兩種以上。
當本發明化合物應用在上述各疾病時,其亦可與生物製劑組合使用(例如:抗體藥物、核酸、或核酸衍生物、適體藥物、疫苗製劑),或可組合使用基因療法等,或亦可組合使用精神領域中不使用藥物之治療法。
抗體藥物及疫苗製劑實例包括:對抗血管收縮素II之疫苗製劑、對抗CETP之疫苗製劑、CETP抗體、對抗TNFα抗體及其他細胞素之抗體、類澱粉β疫苗製劑、針對第1型糖尿病之疫苗(例如:Peptor之DIAPEP-277)、抗-HIV抗體與HIV疫苗製劑,及對抗細胞素、腎素-血管收縮素型酵素及其產物之抗體或疫苗製劑、對抗涉及血液脂肪代謝之酵素或蛋白質之抗體或疫苗製劑及涉及血液凝結或纖維蛋白溶解系統之酵素及蛋白質相關之抗
體或疫苗、對抗涉及糖代謝及胰島素抗性之蛋白質之抗體或疫苗製劑等。此外,其可組合使用及生長因子(如:GH、IGF等)相關之生物製劑。
基因療法實例包括:使用與細胞素、腎素-血管收縮素型酵素及其產物、G蛋白質、G蛋白質接合受體及其磷酸化酵素相關之基因之治療方法;使用DNA誘餌(如:NFκB誘餌等)之治療方法;使用反義之治療方法;使用與涉及血液脂質代謝之酵素或蛋白質相關之基因(例如:與膽固醇或三酸甘油酯或HDL-膽固醇或血液磷脂之代謝、排泄及吸收相關之基因)之治療方法;使用涉及末梢血管阻塞之血管新生作用療法之酵素或蛋白質等(例如:生長因子,如:HGF、VEGF等)之基因相關之治療方法;使用與涉及葡萄糖代謝及胰島素抗性相關之蛋白質、對抗細胞素(如:TNF等)之反義之治療方法等。
不使用藥物之精神病領域之治療方法實例包括:經修飾之電痙攣療法、深層腦刺激療法、重複性透顱磁刺激療法、心理治療法(包括認知行為治療法)等。
本發明化合物可及各種不同器官再生方法組合,如:心臟再生、腎臟再生、胰臟再生、血管重建及其類似方法、利用骨髓細胞(源於骨髓之單核細胞、骨髓性幹細胞)之細胞移植療法,或利用組織工程改造之人造器官(例如:人造血管、心肌細胞補片)。
實施例
本發明係於下文中利用實施例、實驗實施例及調配物實施例詳細地說明。然而,該等實施例並未限制本發明,且該等實施例可在本發明範圍內進行修飾。
下列實施例中之「室溫」一般為約10℃至約35℃。除非另有明確說明,否則溶劑之混合比例為體積混合比例,及除非另有明確說明,否則%意指wt%。
除非另有明確說明,否則實施例中管柱層析法之溶離係在TLC(薄層層析法)之觀測下進行。利用TLC觀測時,使用Merck製造之60 F254作為TLC板,使用作為管柱層析法中溶離溶劑之溶劑作為溶離液,並使用UV檢測器進行檢測。在矽膠管柱層析法中,所指示之NH係指使用與胺基丙基矽烷鍵結之矽膠,且所指示之Diol係指使用與3-(2,3-二羥基丙氧基)丙基矽烷鍵結之矽膠。製備性HPLC(高效液相層析法)中,所指示之C18係指使用與十八碳烷基鍵結之矽膠。除非另有明確說明,否則溶離溶劑之比例為體積混合比例。
1H NMR之分析法係採用ACD/SpecManager(商標名稱)軟體等。有時候未說明具有極小質子峰之羥基、胺基等之波峰。
MS係採用LC/MS測定。採用ESI法或APCI法作為電離化法。數據係指示實際測定值(實測值)。雖然一般係觀測分子態離子峰,但有時候會觀測到片段離子。以鹽為例,一般觀測到游離型之分子態離子峰或片段離子峰。
旋光度([α]D)之樣本濃度單位(c)為g/100mL。
元素分析值(Anal.)係以計算值(Calcd)及實際測定值(實測值(Found))說明。
實施例中之滯留時間係採用液相層析法測定。除非另有說明,測定條件如下。
管柱:YMC PackPro C18 2.0mm i.d.x 75mm(3μm)
移動相:溶液係藉由添加0.04M伯瑞坦-羅賓森(Britton-Robinson)緩衝溶液(pH 6.5)至甲醇(5:2),均勻混合,使用0.2M氫氧化鈉溶液調整pH至7.4而準備。
實施例中粉末X-射線繞射法之波峰係指在室溫下利用Ultima IV(Rigaku Corporation,Japan),使用Cu Kα射線為放射源所測定之波峰。測定條件如下。
電壓/電流:40kV/50mA
掃瞄速度:6度/分鐘
2θ之掃瞄範圍:2-35度
實施例中以粉末X-射線繞射法測定之結晶度係採用赫曼方法(Hermans method)計算。
下列實施例中採用下列縮寫。
mp:熔點
MS:質譜
M:莫耳濃度
N:當量濃度
CDCl3:氘氯仿
DMSO-d6:氘二甲亞碸
1H NMR:質核磁共振
LC/MS:液相層析質譜儀
ESI:電噴灑電離化
APCI:常壓化學電離化
HATU:(二甲基胺基)-N,N-二甲基(3H-[1,2,3]三唑并[4,5-b]吡啶-3-基氧)甲烷鎓六氟磷酸鹽
PPh3:三苯基膦
TFA:三氟乙酸
DMAP:N,N-二甲基-4-胺基吡啶
CPME:環戊基甲基醚
WSC:N-(3-(二甲基胺基)丙基)-N'-乙基碳化二亞胺
IPE:2-異丙氧基丙烷
DIPEA:N-乙基-N-異丙基丙烷-2-胺
DMF:N,N-二甲基甲醯胺
HOBt:1H-苯并三唑-1-醇
THF:四氫呋喃
DME:1,2-二甲氧基乙烷
MeOH:甲醇
WSC.HCl:N-(3-(二甲基胺基)丙基)-N'-乙基碳化二亞胺鹽酸鹽(1:1)
EtOH:乙醇
Boc2O:二碳酸二-第三丁基酯
TEA:三乙基胺
Et2O:乙氧基乙烷
EtOAc:乙酸乙酯
CH3CN:乙腈
TMSCl:三甲基矽烷基氯化物
XPhos Pd G3:甲磺醯基(2-二環己基膦基-2’,4’,6’-三異丙基-1,1’-聯苯)(2’-胺基-1,1’-聯苯-2-基)鈀(II)
PdCl2(dppf):[1,1'-雙(二苯基膦基)二茂絡鐵]鈀(II)二氯化物
實施例1
N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-((2R)-氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺
A)3-氯-2-氟苯基丙胺酸鹽酸鹽
於0℃下,在含1-(溴甲基)-3-氯-2-氟苯(55.0g)、乙醯胺基丙二酸二乙基酯(56.1g)及EtOH(400mL)之混合物中添加20%乙醇鈉之乙醇溶液(88g)。使混合物回流2hr 30min並冷卻至室溫。過濾排除雜質,在減壓下濃縮濾液,使含殘質及6M鹽酸(500mL)之混合物回流15hr。在減壓下濃縮反應溶液,使用異丙醇/二異丙基醚洗滌所得殘質,產生標題化合物(67.1g)。
MS:[M+H]+ 217.8。
B)N-(第三丁氧基羰基)-3-氯-2-氟苯基丙胺酸
於室溫下,在含3-氯-2-氟苯基丙胺酸鹽酸鹽(67.1g)、1M氫氧化鈉水溶液(528mL)及DME(480mL)之混合物中添加Boc2O(63.4g)。混合物於室溫下攪拌2hr 30min並倒至冰水中。混合物使用1M氫氧化鈉水溶液鹼化,水層使用乙醚洗滌。水層使用1M鹽酸酸化,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。所得固體使用二異丙基醚/己烷洗滌,產生標題化合物(63.8g)。
MS:[M-H]- 316.0。
C){3-(3-氯-2-氟苯基)-1-[甲氧基(甲基)胺基]-1-側氧基丙烷-2-基}胺甲酸第三丁基酯
於0℃下,在含N-(第三丁氧基羰基)-3-氯-2-氟苯基丙胺酸(63.8g)、N-甲氧基甲烷胺鹽酸鹽(21.5g)、HOBt(29.8g)、TEA(44.7g)及DMF(425mL)之混合物中添加WSC.HCl(46.2g)。混合物於室溫下攪拌15hr,取反應混合物加至碳酸氫鈉水溶液中,使用EtOAc/THF萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。所得固體使用二異丙基醚/己烷洗滌,產生標題化合物(70.0g)。
MS,實測值:260.9。
D){3-(3-氯-2-氟苯基)-1-[甲氧基(甲基)胺基]-1-側氧基丙烷-2-基}(4-甲氧基苯甲基)胺甲酸第三丁基酯
於0℃下,在含{3-(3-氯-2-氟苯基)-1-[甲氧基(甲基)胺基]-1-側氧基丙烷-2-基}胺甲酸第三丁基酯(70.0g)及DMF(390mL)之混合物中添加60%氫化鈉(10.1g)。混合物於0℃下攪拌5min後,於室溫下10min,於0℃下,在反應混合物中添加1-(氯甲基)-4-甲氧基苯(60.7g)及四丁基銨化碘(7.16g)。混合物於室溫下攪拌2hr 30min,倒至冰水中,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(90.7g)。
MS:[M+H]+ 481.1。
E)[1-(3-氯-2-氟苯基)-3-側氧基丙烷-2-基][(4-甲氧基苯基)甲基]胺甲酸第三丁基酯
於-78℃下,在含{3-(3-氯-2-氟苯基)-1-[甲氧基(甲基)胺基]-1-側氧基丙烷-2-基}(4-甲氧基苯甲基)胺甲酸第三丁基酯(90.7g)及Et2O(500mL)之混合物中分少量添加氫化鋰鋁(9.30g)。混合物於-15℃下攪拌1hr 30min,於-78℃下在反應混合物中依序滴加EtOAc及10%亞硫酸氫鉀水溶液。混合物於室溫下攪拌15min,在混合物中添加水。通過寅氏鹽(Celite)過濾排除不可溶物質並使用EtOAc萃取濾液。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(74.7g)。
MS:[M-H]- 420.0。
F)4-{(第三丁氧基羰基)[(4-甲氧基苯基)甲基]胺基}-5-(3-氯-2-氟苯基)-2,4,5-三去氧-2,2-二氟戊酸乙基酯
於氬環境及室溫下,在含鋅(37.0g)及THF(500mL)之混合物中添加TMSCl(3.85g)。混合物於室溫下攪拌15min,於室溫下,滴加溴(二氟)乙酸乙酯(71.9g)至混合物中並激烈攪拌,同時保持內溫約50℃。混合物於室溫下攪拌15min,在混合物中滴加含[1-(3-氯-2-氟苯基)-3-側氧基丙烷-2-基][(4-甲氧基苯基)甲基]胺甲酸第三丁基酯(74.7g)及THF(100mL)之混合物,同時保持內溫約40℃。混合物於室溫下攪拌2hr,並添加至於冰冷卻下之5%亞硫酸氫鉀水溶液中,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(61.6g)。
MS,實測值:490.0。
G)5-[(3-氯-2-氟苯基)甲基]-3,3-二氟-4-羥基-1-[(4-甲氧基苯基)甲基]吡咯啶-2-酮
於室溫下,在含4-{(第三丁氧基羰基)[(4-甲氧基苯基)甲基]胺基}-5-(3-氯-2-氟苯基)-2,4,5-三去氧-2,2-二氟戊酸乙基酯(61.6g)及EtOH(160mL)之混合物中添加4M鹽酸CPME溶液(282mL)。混合物於室溫下攪拌2hr並取反應溶液濃縮。在所得殘質中添加EtOH(360mL)及DIPEA(43.8g)。混合物於70℃下攪拌1hr 30min,反應混合物倒至冰水中,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),所得固體使用二異丙基醚/己烷洗滌,產生標題化合物(36.1g)。
MS:[M+H]+ 399.9。
H)5-[(3-氯-2-氟苯基)甲基]-3,3-二氟-4-羥基吡咯啶-2-酮
於室溫下,在含5-[(3-氯-2-氟苯基)甲基]-3,3-二氟-4-羥基-1-[(4-甲氧基苯基)甲基]吡咯啶-2-酮(36.1g)、CH3CN(315mL)及水(105mL)之混合物中添加硝酸銨鈰(ammonium hexanitratocerate)(IV)(99g)。混合物於室溫下攪拌4hr,倒至冰水中,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),然後經過矽膠管柱層析法(NH,甲醇/EtOAc),產生標題化合物(22.7g)。
MS:[M-H]- 278.0。
I)2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-3-羥基吡咯啶-1-羧酸第三丁基酯
於室溫下,在含5-[(3-氯-2-氟苯基)甲基]-3,3-二氟-4-羥基吡咯啶-2-酮(22.7g)及THF(350mL)之混合物中滴加1M甲硼烷-THF複合物之THF溶液(284mL)。混合物慢慢回升至60℃並攪拌4hr。滴加水至0℃之混合物中,混合物於室溫下攪拌10min並在減壓下濃縮。在殘質中添加1M鹽酸(500mL),混合物於60℃下激烈攪拌1hr 30min。混合物慢慢添加至於冰冷卻下之1M氫氧化鈉水溶液中,使用碳酸鉀鹼化,使用鹽飽和,使用EtOAc/THF萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。於室溫下,在含所得殘質、碳酸氫鈉(6.83g)及THF(190mL)/水(210mL)之混合物中添加Boc2O(19.5g)之THF(20mL)溶液。混合物於室溫下激烈攪拌15hr,倒至水中,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(22.2g)。
MS,實測值:265.9。
J)消旋性-(2S,3S)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-3-[(三氟甲磺醯基)氧]吡咯啶-1-羧酸第三丁基酯
於氬環境及0℃下,在含2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-3-羥基吡咯啶-1-羧酸第三丁基酯(22.1g)、吡啶(96g)及Et2O(355mL)之混合物中滴加三氟甲烷磺酸酐(51.2g)。混合物於室溫下攪拌2hr 30min,倒至冰水中,使用EtOAc/己烷萃取。分離有機層,使用10%檸檬酸水溶液、碳酸氫鈉水溶液、水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(22.4g)。
MS,實測值:397.9。
K)消旋性-(2S,3R)-3-疊氮基-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯
於室溫下,在含消旋性-(2S,3S)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-3-[(三氟甲磺醯基)氧基]吡咯啶-1-羧酸第三丁基酯(22.4g)及CH3CN(265mL)之混合物中添加四-正丁基銨疊氮化物(38.3g)。混合物慢慢回升至80℃,攪拌1hr,倒至冰水中,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(16.2g)。
MS,實測值:290.9。
L)消旋性-(2S,3R)-3-胺基-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯
於氬環境及室溫下,在含消旋性-(2S,3R)-3-疊氮基-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(16.2g)及THF(200mL)/水(5mL)之混合物中添加PPh3(13.1g)。混合物於55℃下攪拌18hr,添加至於冰冷卻下之碳酸氫鈉水溶液中,使用EtOAc/THF萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(NH,EtOAc/己烷),分別產生標題化合物及副產物。在含所得副產物及THF(100mL)/水(10mL)之混合物中添加40%甲胺水溶液(3.22g)。混合物於70℃下攪拌15hr,倒至水中,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(NH,EtOAc/己烷),產生標題化合物(14.6g)、及上述得到之標題化合物合併。
MS,實測值:308.9。
M)(2S,3R)-3-胺基-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯
將消旋性-(2S,3R)-3-胺基-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(14.6g)藉由HPLC分離(管柱:CHIRALPAK IA,50mmID×500mmL,20μm,移動相:己烷/乙醇/二乙胺=800/200/1),產生滯留時間較短的標題化合物(6.84g)(管柱:CHIRALPAK IA,4.6mmID×250mmL,5μm,移動相:己烷/乙醇/二乙胺=800/200/1)。
MS,實測值:309.1。
N)(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-3-[(乙磺醯基)胺基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯
於0℃下,在含(2S,3R)-3-胺基-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(1.04g)、TEA(0.577g)、DMAP(0.174g)及THF(30mL)之混合物中添加乙磺醯氯(0.550g)。混合物於室溫下攪拌5hr,添加水至室溫下之混合物中,混合物使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鈉脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(NH,EtOAc/己烷),產生標題化合物(1.25g)。
MS:[M-H]- 455.1。
O)N-{(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟吡咯啶-3-基}乙磺醯胺鹽酸鹽
將含(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-3-[(乙磺醯基)胺基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(24.9mg)、(3-氟苯基)二羥硼酸(15.3mg)、
XPhos Pd G3(4.61mg)、1M磷酸鉀水溶液(0.163mL)及DME(0.6mL)之混合物於80℃下攪拌2hr。反應溶液濃縮,將殘質經矽膠管柱層析法純化(NH,EtOAc/己烷)。將含所得殘質(27mg)及4M鹽酸CPME溶液(2mL)之混合物於室溫下攪拌4hr。藉由過濾收集不可溶物質,產生標題化合物(17mg)。
MS:[M+H]+ 417.1。
P)N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-((2R)-氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺
於室溫下,在含N-{(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟吡咯啶-3-基}乙磺醯胺鹽酸鹽(250mg)、氧雜環丁烷-2-羧酸(67.6mg)及DMF(2mL)之混合物中添加HATU(315mg)及DIPEA(357mg)。混合物於室溫下攪拌一夜,在混合物中添加飽和氯化銨水溶液,混合物使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鈉脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(NH,EtOAc/己烷),所得固體自EtOAc/己烷中結晶,產生滯留時間較短之標題化合物(66mg)。
1H NMR(400MHz,CDCl3)δ 1.27-1.47(3H,m),2.68-5.20(14H,m),7.03-7.13(1H,m),7.16-7.45(6H,m)。
實施例2
N-{(2S,3R)-4,4-二氟-1-(2-羥基-2-甲基丙醯基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺
A)(2S,3R)-2-(3-氯-2-氟苯甲基)-4,4-二氟-3-(甲基磺醯胺基)吡咯啶-1-羧酸第三丁基酯
於室溫下,將甲烷磺酸酐(143mg)添加至含(2S,3R)-3-胺基-2-(3-氯-2-氟苯甲基)-4,4-二氟吡咯啶-1-羧酸第三丁基酯(200mg)、TEA(0.229mL)及THF(5mL)之混合物中。混合物於室溫下攪拌一夜。在減壓下濃縮混合物。殘質經管柱層析法純化(矽膠,EtOAc/己烷),產生標題化合物(244mg)。
MS:[M-H]- 441.1。
B)(2S,3R)-4,4-二氟-3-(甲基磺醯胺基)-2-((2,3',5'-三氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-1-羧酸第三丁基酯
將含(2S,3R)-2-(3-氯-2-氟苯甲基)-4,4-二氟-3-(甲基磺醯胺基)吡咯啶-1-羧酸第三丁基酯(4.52g)、(3,5-二氟苯基)二羥硼酸(3.22g)、XPhos Pd G3(0.432g)及1M磷酸鉀水溶液(30.6mL)之DME(100mL)混合物於80℃及氮環境下攪拌3h。混合物經管柱層析法純化(矽膠,EtOAc/己烷,然後NH矽膠,EtOAc/己烷),產生標題化合物(5.30g)。
MS:[M-H]- 519.1。
C)N-{(2S,3R)-4,4-二氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺鹽酸鹽
將含(2S,3R)-4,4-二氟-3-(甲基磺醯胺基)-2-((2,3',5'-三氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-1-羧酸第三丁基酯(73mg)及4M HCl/CPME溶液(1mL)之混合物於室溫下攪拌一夜。混合物使用EtOAc稀釋,藉由過濾收集沉澱,產生標題化合物(50.0mg)。
MS:[M+H]+ 421.0。
D)N-{(2S,3R)-4,4-二氟-1-(2-羥基-2-甲基丙醯基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺
於0℃下,在含N-{(2S,3R)-4,4-二氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺鹽酸鹽(4.3g)及DIPEA(8.14mL)之THF(60mL)混合物中添加α-乙醯氧基-異丁醯氯(1.64mL),混合物在相同溫度下攪拌10min。在混合物中添加水(20mL)及4M氫氧化鋰溶液(23.5mL),混合物於室溫下攪拌一夜。混合物使用飽和鹽水稀釋並使用EtOAc萃取。萃取液經硫酸鎂脫水及在減壓下濃縮。殘質經管柱層析法純化(矽膠,EtOAc/己烷),產生標題化合物(4.40g)。
1H NMR(400MHz,CDCl3)δ 1.31-1.47(6H,m),2.25-2.60(1H,m),2.88-3.02(4H,m),3.10(1H,dd,J=14.2,7.5Hz),4.01-4.49(3H,m),4.92-5.17(2H,m),6.75-6.87(1H,m),7.01-7.11(2H,m),7.16-7.23(1H,m),7.26-7.32(1H,m),7.36-7.46(1H,m)。
實施例3
N-{(2S,3R)-4,4-二氟-1-(2-羥基-2-甲基丙醯基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
A)(2S,3R)-3-(乙基磺醯胺基)-4,4-二氟-2-((2,3',5'-三氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-1-羧酸第三丁基酯
於室溫下,在含(2S,3R)-2-(3-氯-2-氟苯甲基)-3-(乙基磺醯胺基)-4,4-二氟吡咯啶-1-羧酸第三丁基酯(3.70g)、(3,5-二氟苯基)二羥硼酸(2.56g)及1M磷酸鉀水溶液(24.3mL)之DME(50mL)混合物中添加XPhos Pd G3(0.343g)。混合物於90℃及氮環境下攪拌15h。反應混合物倒至水中,使用EtOAc萃取。有機層使用飽和鹽水洗滌,經硫酸鎂脫水及在減壓下濃縮。殘質經管柱層析法純化(矽膠,EOAc/己烷),產生標題化合物(3.30g)。
MS:[M-H]- 533.2。
B)N-((2S,3R)-4,4-二氟-2-((2,3',5'-三氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-3-基)乙磺醯胺鹽酸鹽
將含(2S,3R)-3-(乙基磺醯胺)-4,4-二氟-2-((2,3',5'-三氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-1-羧酸第三丁基酯(3.30g)及4M HCl/CPME溶液(30mL)之混合物於室溫下攪拌一夜。經過過濾,得到標題化合物(2.86g)。
MS:[M+H]+ 435.1。
C)N-{(2S,3R)-4,4-二氟-1-(2-羥基-2-甲基丙醯基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
於0℃下,在含N-((2S,3R)-4,4-二氟-2-((2,3',5'-三氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-3-基)乙磺醯胺鹽酸鹽(200mg)及DIPEA(0.367mL)之THF(3mL)混合物中添加α-乙醯氧基-異丁醯氯(0.074mL),混合物在相同溫度下攪拌10min。在混合物中添加水(1mL)及4M氫氧化鋰溶液(1.06mL),混合物於室溫下攪拌一夜。混合物使用飽和鹽水稀釋並使用EtOAc萃取。萃取液經硫酸鎂脫水及在減壓下濃縮。殘質經管柱層析法純化(矽膠,EtOAc/己烷)並自EtOAc/己烷中再結晶,產生標題化合物(154mg)。
1H NMR(400MHz,CDCl3)δ 1.32-1.40(9H,m),2.27-2.54(1H,m),2.88-3.16(4H,m),4.02-4.49(3H,m),4.86-5.20(2H,m),6.78-6.86(1H,m),7.02-7.10(2H,m),7.16-7.22(1H,m),7.27-7.31(1H,m),7.35-7.43(1H,m)。
實施例4
N-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺
A)2-胺基-3-(3-溴-2-氟苯基)丙酸鹽酸鹽
於室溫下,將乙醇鈉(121g)添加至含1-溴-3-(溴甲基)-2-氟苯(91g)及2-乙醯胺基丙二酸二乙基酯(77g)之EtOH(566ml)溶液中。回流2h後,使反應混合物冷卻至室溫並濾除不可溶物。在減壓下濃縮濾液,使用8M鹽酸(849ml)稀釋殘質,使混合物回流17h。在減壓下濃縮反應混合物以產生晶體,其藉由過濾收集並使用2-丙醇/IPE洗滌,以產生標題化合物(100g)。
MS:[M+H]+ 261.9。
B)3-(3-溴-2-氟苯基)-2-((第三丁氧基羰基)胺基)丙酸
於0℃下,將Boc2O(92ml)添加至含2-胺基-3-(3-溴-2-氟苯基)丙酸鹽酸鹽(100g)及0.75M氫氧化鈉溶液(893ml)之DME(918ml)溶液中。於室溫下激烈攪拌16h後,反應混合物倒至冰水,使用1M NaOH水溶液鹼化並使用Et2O洗滌。水層使用1M鹽酸酸化至pH 3並使用EtOAc萃取。有機層經硫酸鎂脫水及在減壓下濃縮,產生標題化合物(105g)。
MS,實測值:261.8。
C)(3-(2-氟-[1,1'-聯苯]-3-基)-1-(甲氧基(甲基)胺基)-1-側氧基丙烷-2-基)胺甲酸第三丁基酯
於15℃及氮環境下,在含3-(3-溴-2-氟苯基)-2-((第三丁氧基羰基)胺基)丙酸(250g)之1,4-二烷(1.2L)混合物中添加苯基二羥硼酸(101g)及Pd(dppf)Cl2.CH2Cl2(28.2g)。攪拌15min後,添加K2CO3(191g)之
H2O(600mL)溶液。反應混合物於100℃下攪拌16h。反應混合物倒至水中,使用2M鹽酸調整至pH 2後,使用EtOAc萃取。合併之有機層使用飽和鹽水洗滌,經無水硫酸鈉脫水及在減壓下濃縮。於0℃下,在含所得殘質(250g)及N,O-二甲基羥基胺(71.3g)之DMF(2L)之攪拌溶液中添加HATU(250g)後,添加DIPEA(331g)。反應混合物於15℃及氮環境下攪拌16h。反應混合物倒至水中並分離有機層。水層使用EtOAc萃取。合併之有機層使用飽和鹽水洗滌,經無水硫酸鈉脫水及在減壓下濃縮。藉由過濾收集殘質,使用石油醚/EtOAc洗滌,產生標題化合物(180g)。
1H NMR(400MHz,CDCl3)δ 1.38(9H,s),3.00-3.18(2H,m),3.20(3H,s),3.77(3H,s),4.91-5.09(1H,m),5.17-5.30(1H,m),7.09-7.19(2H,m),7.28-7.48(4H,m),7.50-7.57(2H,m)。
D)4-((第三丁氧基羰基)胺基)-2,2-二氟-5-(2-氟-[1,1'-聯苯]-3-基)-3-羥基戊酸乙基酯
於-78℃下,在含(3-(2-氟-[1,1'-聯苯]-3-基)-1-(甲氧基(甲基)胺基)-1-側氧基丙烷-2-基)胺甲酸第三丁基酯(40.0g)之THF(1.2L)攪拌溶液中分批添加氫化鋰鋁(4.53g),反應混合物於-10℃及氮環境攪拌3h。反應混合物倒至冷卻之飽和氯化銨水溶液,混合物過濾。濾餅使用EtOAc洗滌,使用EtOAc萃取濾液。合併之有機層使用1M鹽酸、飽和碳酸氫鈉水溶液及飽和鹽水洗滌,經無水硫酸鈉脫水及在減壓下濃縮,產生(1-(2-氟-[1,1'-聯苯]-3-基)-3-側氧基丙烷-2-基)胺甲酸第三丁基酯(40.0g)。於20℃下,在含活性鋅(56.8g)之THF(300mL)混合物中添加TMSCl(4.43g),所得混合物於20℃及氮環境下攪拌15min。然後於40℃下,滴加含2-溴-2,2-二
氟乙酸乙基酯(82.8g)之THF(500mL)溶液至上述混合物中,再於40℃及氮環境下攪拌1.5h,產生0.51M(2-乙氧基-1,1-二氟-2-側氧基乙基)鋅(II)溴化物/THF溶液(800mL)。於15℃下,在含(1-(2-氟-[1,1'-聯苯]-3-基)-3-側氧基丙烷-2-基)胺甲酸第三丁基酯(27.0g)之THF(150mL)之攪拌溶液中添加0.51M(2-乙氧基-1,1-二氟-2-側氧基乙基)鋅(II)溴化物/THF溶液(385mL),反應混合物於15℃及氮環境下攪拌20min。然後再於55℃下攪拌20min。反應混合物倒至氯化銨水溶液中,使用EtOAc萃取。合併之有機層使用飽和鹽水洗滌,經無水硫酸鈉脫水及在減壓下濃縮。殘質經管柱層析法純化(矽膠,EtOAc/石油醚),產生標題化合物(12.0g)。
1H NMR(400MHz,CDCl3)δ 1.30-1.54(12H,m),3.00-3.35(2H,m),3.70-4.55(3H,m),4.74-5.19(1H,m),7.08-7.25(2H,m),7.35-7.57(7H,m)。
E)4-胺基-2,2-二氟-5-(2-氟-[1,1'-聯苯]-3-基)-3-羥基戊酸乙基酯鹽酸鹽
在含4-((第三丁氧基羰基)胺基)-2,2-二氟-5-(2-氟-[1,1'-聯苯]-3-基)-3-羥基戊酸乙基酯(39.0g)之1,4-二烷(80mL)攪拌溶液中添加4M HCl/1,4-二烷溶液(250mL),反應混合物於15℃下攪拌3h。在減壓下濃縮混合物,產生標題化合物(34.0g)。
MS:[M+H]+ 368.1。
F)3,3-二氟-5-((2-氟-[1,1'-聯苯]-3-基)甲基)-4-羥基吡咯啶-2-酮
在含4-胺基-2,2-二氟-5-(2-氟-[1,1'-聯苯]-3-基)-3-羥基戊酸乙基酯鹽酸鹽(66.0g)之EtOH(850mL)攪拌溶液中添加DIPEA(66.0g),反應混合物於80℃及氮環境下攪拌0.5h。在減壓下濃縮反應混合物。殘質經管柱層析法純化(矽膠,EtOAc/石油醚),產生標題化合物(35.0g)。
MS:[M+H]+ 322.0。
G)4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-3-醇
於15℃下,在含3,3-二氟-5-((2-氟-[1,1'-聯苯]-3-基)甲基)-4-羥基吡咯啶-2-酮(36.0g)之THF(400mL)攪拌溶液中添加1M BH3-THF複合物/THF溶液(336mL),反應混合物於70℃及氮環境下攪拌16h。然後於0℃下滴加水中止反應混合物之反應後,添加1M鹽酸,於66℃下攪拌2h。反應混合物使用飽和碳酸氫鈉水溶液調整至pH 8並使用EtOAc萃取。合併之有機層使用水洗滌,經無水硫酸鈉脫水及在減壓下濃縮,產生標題化合物(35.0g)。
MS:[M+H]+ 308.1。
H)消旋性-(2S,3S)-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)-3-羥基吡咯啶-1-羧酸第三丁基酯
在4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-3-醇(37.0g)中添加含碳酸第三丁氧基羰基第三丁基酯(26.3g)之THF(300mL),混合物使用飽和碳酸氫鈉水溶液鹼化至pH 8,反應混合物於15℃下攪拌2h。反應混合物倒至水中並使用EtOAc萃取。合併之有機層使用飽和鹽水洗滌,經無水硫酸鈉脫水及在減壓下濃縮。殘質經管柱層析法純化(矽膠,EtOAc/石
油醚),然後經製備性HPLC純化(管柱C18,移動相:CH3CN/水(包含10mM碳酸氫銨)),產生標題化合物(9g)。
1H NMR(400MHz,CDCl3)δ 1.48(9H,s),2.14-2.28(1H,m),2.78-3.00(1H,m),3.24-3.40(1H,m),3.69-4.00(2H,m),4.00-4.08(1H,m),4.14-4.20(1H,m),7.13-7.24(2H,m),7.32-7.50(4H,m),7.52-7.59(2H,m)。
I)消旋性-(2S,3S)-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)-3-(((三氟甲基)磺醯基)氧)吡咯啶-1-羧酸第三丁基酯
在含消旋性-(2S,3S)-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)-3-羥基吡咯啶-1-羧酸第三丁基酯(9.00g)之二氯甲烷(150mL)攪拌溶液中添加吡啶(8.74g)後,於-10℃下滴加含三氟甲烷磺酸酐(15.6g)之二氯甲烷(50mL)溶液,反應混合物於-10℃及氮環境下攪拌1h。反應混合物倒至水中,使用二氯甲烷萃取。合併之有機層使用5%檸檬酸水溶液及飽和鹽水洗滌,經無水硫酸鈉脫水及在減壓下濃縮,產生標題化合物(11.0g)。
1H NMR(400MHz,CDCl3)δ 1.51(9H,s),2.76-2.97(1H,m),3.34-3.52(1H,m),3.84-3.99(2H,m),4.32-4.51(1H,m),4.89-5.05(1H,m),7.10-7.25(2H,m),7.34-7.56(6H,m)。
J)消旋性-(2S,3R)-3-胺基-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-1-羧酸第三丁基酯
在含消旋性-(2S,3S)-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)-3-(((三氟甲基)磺醯基)氧基)吡咯啶-1-羧酸第三丁基酯(11.0g)之N,N-二甲基乙醯胺(450mL)之攪拌溶液中添加疊氮化鈉(5.30g),反應混合物於130
℃下攪拌3h。混合物加水稀釋,使用碳酸氫鈉水溶液調整至pH 9-10,使用EtOAc萃取。合併之有機層使用水洗滌,經無水硫酸鈉脫水及在減壓下濃縮,產生消旋性-(2S,3R)-3-疊氮基-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-1-羧酸第三丁基酯(9.00g)。在含消旋性-(2S,3R)-3-疊氮基-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-1-羧酸第三丁基酯(1.00g)之MeOH(30mL)攪拌溶液中添加10% Pd/碳(100mg),混合物於減壓下脫氣,使用氫氣吹掃數次後,於25℃及氫環境(15psi)下攪拌16h。反應混合物通過寅氏鹽墊過濾,濾餅使用MeOH洗滌,在減壓下濃縮合併之濾液,產生第一批粗產物。在含消旋性-(2S,3S)-4,4-二氟-2-((2-氟-1,1'-聯苯]-3-基)甲基)-3-(((三氟甲基)磺醯基)氧基)吡咯啶-1-羧酸第三丁基酯(8.00g)之MeOH(200mL)攪拌溶液中添加10% Pd/碳(800mg),混合物於減壓下脫氣,使用氫氣吹掃數次後,於25℃及氫環境(15psi)下攪拌3h。反應混合物通過寅氏鹽墊過濾,濾餅使用MeOH洗滌,在減壓下濃縮合併之濾液。殘質及第一批粗產物經管柱層析法純化(矽膠,EtOAc/石油醚),產生標題化合物(6.04g)。
1H NMR(400MHz,DMSO-d6)δ 0.89-1.32(9H,m),1.86-2.01(2H,m),2.53-2.78(1H,m),2.94-3.13(1H,m),3.63-3.95(3H,m),4.11-4.36(1H,m),7.13-7.55(8H,m)。
K)(2S,3R)-3-胺基-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-1-羧酸第三丁基酯
採用製備性HPLC(管柱:CHIRALPAK AD,移動相:己烷/EtOH=900/100(v/v))進行消旋性-(2S,3R)-3-胺基-4,4-二氟-2-((2-氟-
[1,1'-聯苯]-3-基)甲基)吡咯啶-1-羧酸第三丁基酯(6.03g)之光學解析,產生滯留時間較短之標題化合物(3.09g)(管柱:CHIRALPAK AD-H,使用己烷/EtOH=900/100(v/v)溶離)。
MS,實測值:351.1。
L)(2S,3R)-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)-3-(甲基磺醯胺基)吡咯啶-1-羧酸第三丁基酯
於室溫下,將甲烷磺酸酐(292mg)添加至含(2S,3R)-3-胺基-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-1-羧酸第三丁基酯(355mg)及TEA(0.365mL)之THF(8mL)攪拌溶液中。0.5h後,在減壓下濃縮反應混合物,殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(427mg)。
MS,實測值:385.0。
M)N-((2S,3R)-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-3-基)甲磺醯胺鹽酸鹽
將含(2S,3R)-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)-3-(甲基磺醯胺基)吡咯啶-1-羧酸第三丁基酯(427mg)之4M HCl/CPME溶液(12mL)混合物於室溫下攪拌2h。藉由過濾收集固體,產生標題化合物(340mg)。
MS:[M+H]+ 385.0。
N)N-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺
將含N-((2S,3R)-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-3-基)甲磺醯胺鹽酸鹽(45mg)及DIPEA(0.092mL)之THF(1.28mL)混合物
於室溫下攪拌30min。於0℃下,在懸浮液中滴加α-乙醯氧基-異丁醯氯(0.0186mL),混合物於相同溫度下攪拌一夜。在混合物中添加水(0.855mL)及4M氫氧化鋰溶液(0.267mL),混合物於室溫下攪拌一夜。混合物使用飽和碳酸氫鈉水溶液中止反應並使用EtOAc萃取。萃取液使用飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(矽膠,EtOAc/己烷),產生標題化合物(45mg)。
1H NMR(400MHz,DMSO-d6)δ 0.91-1.26(6H,m),2.62-2.72(1H,m),2.97-3.07(4H,m),4.09-4.44(2H,m),4.59-4.81(1H,m),4.82-5.02(1H,m),5.27(1H,s),7.07-7.17(1H,m),7.25-7.34(2H,m),7.34-7.41(1H,m),7.42-7.49(2H,m),7.49-7.56(2H,m),8.09-8.19(1H,m)。
實施例5
N-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺
A)(2S,3R)-3-(乙基磺醯胺)-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-1-羧酸第三丁基酯
於室溫下,將乙磺醯氯(0.233mL)添加至含(2S,3R)-3-胺基-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-1-羧酸第三丁基酯(500mg)、TEA(0.514mL)及DMAP(75mg)之THF(5mL)溶液中。於室溫下攪拌2h後,反應混合物倒至水中並使用EtOAc萃取。有機層使用飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘留之油狀物經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(441mg)。
MS,實測值:399.1。
B)N-((2S,3R)-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-3-基)乙磺醯胺鹽酸鹽
將含(2S,3R)-3-(乙基磺醯胺)-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-1-羧酸第三丁基酯(441mg)及4M HCl/CPME(5mL)之混合物於室溫下攪拌2h。在減壓下濃縮混合物,產生標題化合物(360mg)。
MS:[M+H]+ 399.1。
C)N-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺
將含N-((2S,3R)-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-3-基)乙磺醯胺鹽酸鹽(60mg)及DIPEA(0.119mL)之THF(1.66mL)混合物於室溫下攪拌30min.。於0℃下,在懸浮液中滴加α-乙醯氧基-異丁醯氯(0.024mL),混合物於相同溫度下攪拌一夜。在混合物中添加水(1.10mL)及4M氫氧化鋰溶液(0.345mL),混合物於室溫下攪拌一夜。混合物使用飽和碳酸氫鈉水溶液中止反應並使用EtOAc萃取。萃取液使用飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(42.0mg)。
1H NMR(400MHz,DMSO-d6)δ 0.95-1.36(9H,m),2.60-2.73(1H,m),2.99-3.15(3H,m),4.09-4.51(2H,m),4.58-4.98(2H,m),5.26(1H,s),7.07-7.18(1H,m),7.24-7.33(2H,m),7.34-7.42(1H,m),7.42-7.56(4H,m),8.13(1H,brs)。
實施例7
N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺
A)(3-(2,3'-二氟-[1,1'-聯苯]-3-基)-1-(甲氧基(甲基)胺基)-1-側氧基丙烷-2-基)胺甲酸第三丁基酯
於0℃下,將WSC(63.7mL)添加至含3-(3-溴-2-氟苯基)-2-((第三丁氧基羰基)胺基)丙酸(105g)、N,O-二甲基羥基胺鹽酸鹽(31.1g)、HOBt(43.1g)、TEA(48.5mL)及DMF(580mL)之混合物中。於室溫下攪拌15h後,反應混合物倒至半飽和碳酸氫鈉水溶液中,於室溫下攪拌20min以產生晶體,其藉由過濾收集,並依序使用水、2-丙醇及IPE洗滌。將含所得固體、(3-氟苯基)二羥硼酸(48.7g)、XPhos Pd G3(2.45g)、2M磷酸鉀水溶液(435mL)及THF(537mL)之混合物於70℃及氬環境下攪拌1h。反應混合物倒至半飽和碳酸氫鈉水溶液中,使用EtOAc萃取。有機層使用水及飽和鹽水洗滌,經硫酸鎂脫水,通過NH矽膠墊(使用EtOAc溶離)及在減壓下濃縮以產生晶體,其藉由過濾收集並使用IPE洗滌,產生標題化合物(92.8g)。
MS,實測值:321.0。
B){3-(2,3'-二氟[1,1'-聯苯]-3-基)-1-[甲氧基(甲基)胺基]-1-側氧基丙烷-2-基}[(4-甲氧基苯基)甲基]胺甲酸第三丁基酯
於0℃下,在含(3-(2,3'-二氟-[1,1'-聯苯]-3-基)-1-(甲氧基(甲基)胺基)-1-側氧基丙烷-2-基)胺甲酸第三丁基酯(77.0g)之DMF(366mL)攪拌懸浮液中添加NaH(油中60%)(9.52g)。於室溫下攪拌10分鐘後,於0℃下添加之α-氯-4-甲氧基甲苯(49.7mL)及四丁基銨化碘(6.76g)。於室溫下1.5
h後,反應混合物倒至0℃之含EtOAc及5% KHSO4水溶液之攪拌混合物中並分離有機層。有機層使用飽和鹽水洗滌,經硫酸鈉脫水、過濾並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(83g)。
MS,實測值:441.2。
C)[1-(2,3'-二氟[1,1'-聯苯]-3-基)-3-側氧基丙烷-2-基][(4-甲氧基苯基)甲基]胺甲酸第三丁基酯
將氫化鋰鋁(0.983g)添加至-78℃下之含{3-(2,3'-二氟[1,1'-聯苯]-3-基)-1-[甲氧基(甲基)胺基]-1-側氧基丙烷-2-基}[(4-甲氧基苯基)甲基]胺甲酸第三丁基酯(10g)之Et2O(83mL)攪拌溶液中。混合物回升至0℃。0.5h後,反應混合物使用EtOAc(3.61mL)中止反應,同時保持反應混合物之溫度在10℃以下,添加硫酸氫鉀(6.30g)之水(83mL)溶液至混合物中。混合物使用Et2O萃取。分離有機層,使用水、飽和鹽水及碳酸氫鈉水溶液之混合物洗滌,通過矽膠墊(使用EtOAc/己烷溶離),產生標題化合物(8.43g)。
MS,實測值:426.0。
D)4-{(第三丁氧基羰基)[(4-甲氧基苯基)甲基]胺基}-2,4,5-三去氧-5-(2,3'-二氟[1,1'-聯苯]-3-基)-2,2-二氟戊酸乙基酯
將氯三甲基矽烷(0.305mL)添加至室溫之含鋅(2.75g)之THF(24mL)攪拌懸浮液中。10min後,添加2-溴-2,2-二氟乙酸乙基酯(3.08mL)至於水浴中冷卻之混合物中,同時保持反應混合物溫度在40℃以下。10min後,添加含[1-(2,3'-二氟[1,1'-聯苯]-3-基)-3-側氧基丙烷-2-基][(4-甲氧基苯基)甲基]胺甲酸第三丁基酯(5.78g)之THF(6mL)溶液至室溫下之混合物中。
1.5h後,反應混合物倒至含10% KHSO4水溶液(60mL)及EtOAc(120mL)之攪拌混合物中。分離有機層,使用飽和鹽水洗滌,經硫酸鈉脫水、過濾並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(6.71g)。
MS,實測值:550.1。
E)5-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-3,3-二氟-4-羥基-1-[(4-甲氧基苯基)甲基]吡咯啶-2-酮
將4M HCl/CPME(30.1mL)添加至室溫之含4-{(第三丁氧基羰基)[(4-甲氧基苯基)甲基]胺基}-2,4,5-三去氧-5-(2,3'-二氟[1,1'-聯苯]-3-基)-2,2-二氟戊酸乙基酯(7.28g)之EtOH(3.8mL)溶液中。於室溫下攪拌1h後,在減壓下濃縮反應混合物。殘留之油狀物溶於EtOH(38mL)中,於室溫下添加DIPEA(6.28mL)。於80℃下攪拌0.5h後,在減壓下濃縮反應混合物。殘質倒至水中,混合物使用EtOAc萃取。在減壓下濃縮有機層,殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(5.00g)。
MS:[M+H]+ 460.2。
F)5-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-3,3-二氟-4-羥基吡咯啶-2-酮
將含硝酸鈰銨(14.0g)之水(15.9mL)添加至室溫之含5-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-3,3-二氟-4-羥基-1-[(4-甲氧基苯基)甲基]吡咯啶-2-酮(5.85g)之CH3CN(47.7mL)溶液中。混合物於室溫下攪拌2h。混合物使用飽和碳酸氫鈉水溶液中和並使用EtOAc稀釋。過濾排除不可溶物並
使用EtOAc萃取濾液。分離有機層,使用飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(3.80g)。
MS:[M-H]- 338.2。
G)2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-3-羥基吡咯啶-1-羧酸第三丁基酯
滴加0.9M甲硼烷-THF複合物(37.3mL)至室溫之含5-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-3,3-二氟-4-羥基吡咯啶-2-酮(3.80g)之THF(37.3mL)溶液中。於60℃下攪拌3h後,在反應混合物中滴加0℃之水中止反應。混合物於室溫下攪拌10min並在減壓下濃縮。使用EtOH(25mL)及1M鹽酸(125mL)稀釋殘質,混合物於60℃下攪拌1h。反應混合物小心倒至冰冷之飽和碳酸氫鈉水溶液(250mL)中並使用EtOAc萃取。有機層使用水及飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質及碳酸氫鈉(0.941g)、THF(28.0mL)及水(28.0mL)混合,添加Boc2O(2.83mL)至室溫下之混合物中。混合物於室溫及氮環境下攪拌3h。混合物倒至室溫下之水中,使用EtOAc萃取。分離有機層,使用飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘留之油狀物經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(4.00g)。
MS,實測值:326.2。
H)消旋性-(2S,3S)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-3-[(三氟甲磺醯基)氧]吡咯啶-1-羧酸第三丁基酯
於0℃下,將三氟甲烷磺酸酐(3.16mL)添加至含2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-3-羥基吡咯啶-1-羧酸第三丁基酯(4.0g)及吡啶(3.80mL)之Et2O(47.0mL)溶液中。於室溫下攪拌20h後,於室溫下使用水中止混合物反應,使用EtOAc萃取。分離有機層,使用飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。有機層經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(3.22g)。
1H NMR(400MHz,CDCl3)δ 1.50(9H,s),2.74-2.99(1H,m),3.33-3.51(1H,m),3.72-4.02(2H,m),4.33-4.49(1H,m),4.86-5.02(1H,m),7.03-7.13(1H,m),7.17-7.32(4H,m),7.33-7.47(2H,m)。
I)消旋性-(2S,3R)-3-疊氮基-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯
將四-正丁基銨疊氮化物(24.9g)添加至室溫下含消旋性-(2S,3S)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-3-[(三氟甲磺醯基)氧基]吡咯啶-1-羧酸第三丁基酯(24.4g)之CH3CN(292mL)溶液中。於80℃下攪拌1h後,反應混合物倒至冰水中並使用EtOAc萃取。有機層使用水及飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘留之油狀物經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(19.5g)。
MS,實測值:351.0。
J)消旋性-(2S,3R)-3-胺基-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯
將含消旋性-(2S,3R)-3-疊氮基-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(19.5g)之MeOH(433mL)溶液於20%
Pd(OH)2/碳(50%濕重)(1.95g)之存在下,於室溫及常壓下氫化1h。過濾排除晶體後,在減壓下濃縮濾液。殘留之油狀物經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(16.5g)。
MS,實測值:369.0。
K)(2S,3R)-3-胺基-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯
採用製備性HPLC(管柱:CHIRALPAK AD,移動相:己烷/EtOH/二乙胺=900/100/1(v/v/v))進行消旋性-(2S,3R)-3-胺基-2-[(2,3'-二氟[1,1'-聯苯1-3-基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(16.5g)之光學解析,產生滯留時間較短的標題化合物(7.32g)(管柱:CHIRALPAK AD-H,移動相:己烷/EtOH/二乙胺=900/100/1(v/v/v))。
MS,實測值:369.1。
L)(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-3-[(甲磺醯基)胺基]吡咯啶-1-羧酸第三丁基酯
將甲烷磺酸酐(185mg)添加至室溫之含(2S,3R)-3-胺基-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(300mg)及TEA(0.296mL)之THF(5mL)攪拌混合物中,混合物攪拌一夜。反應混合物直接經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(309mg)。
MS:[M-H]- 501.1。
M)N-{(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟吡咯啶-3-基}甲磺醯胺鹽酸鹽
將含(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-3-[(甲磺醯基)胺基]吡咯啶-1-羧酸第三丁基酯(309mg)及4M HCl/EtOAc(3mL)之混合物於室溫下攪拌1h。混合物使用EtOAc稀釋。藉由過濾收集所得固體,產生標題化合物(230mg)。
MS:[M-H]- 401.0。
N)N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺
將含N-{(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟吡咯啶-3-基}甲磺醯胺鹽酸鹽(40mg)及DIPEA(0.079mL)之THF(1.09mL)混合物於室溫下攪拌30min.。於0℃下,在懸浮液中滴加α-乙醯氧基-異丁醯氯(0.159mL),混合物於相同溫度下攪拌一夜。在混合物中添加水(0.729mL)及4M氫氧化鋰水溶液(0.228mL),混合物於室溫下攪拌一夜。混合物使用飽和碳酸氫鈉水溶液中止反應並使用EtOAc萃取。萃取液使用飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(41mg)。
1H NMR(400MHz,DMSO-d6)δ 0.95-1.34(6H,m),2.61-2.75(1H,m),2.96-3.10(4H,m),4.10-4.47(2H,m),4.60-4.81(1H,m),4.84-5.01(1H,m),5.28(1H,s),7.08-7.18(1H,m),7.20-7.28(1H,m),7.31-7.41(4H,m),7.47-7.56(1H,m),8.14(1H,brs)。
實施例8
N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺
於室溫下,在含N-((2S,3R)-2-((2,3'-二氟-[1,1'-聯苯]-3-基)甲基)-4,4-二氟吡咯啶-3-基)乙磺醯胺鹽酸鹽(57mg)及DIPEA(81mg)之THF(2mL)混合物中添加乙酸1-氯-2-甲基-1-側氧基丙烷-2-基酯(31.1mg)。混合物於室溫下攪拌1h。於室溫下,在混合物中添加水(1mL)及4M氫氧化鋰水溶液(0.314mL)。混合物於室溫下攪拌1h。及甲苯共沸蒸發後,殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(17.0mg)。
1H NMR(300MHz,DMSO-d6)δ 0.87-1.43(9H,m),2.60-2.77(1H,m),2.97-3.17(3H,m),4.07-5.01(3H,m),5.27(1H,s),7.03-7.62(8H,m),8.14(1H,brs)。
實施例13
N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(1-羥基環丁烷-1-羰基)吡咯啶-3-基]甲磺醯胺
於室溫下,在含N-{(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟吡咯啶-3-基}甲磺醯胺鹽酸鹽(29mg)、DIPEA(42.7mg)及1-羥基環丁烷-1-羧酸(9.21mg)之THF(4mL)溶液中添加HATU(37.7mg),混合物於室溫下攪拌15h。混合物使用飽和碳酸氫鈉水溶液中止反應,使用EtOAc萃取。分離有機層,使用飽和鹽水(5mL)洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(29.0mg)。
1H NMR(300MHz,DMSO-d6)δ 1.02-1.17(1H,m),1.44-1.66(1H,m),1.79-2.04(2H,m),2.16-2.42(2H,m),2.65-2.84(1H,m),2.95-3.10
(4H,m),3.91-4.11(1H,m),4.25-4.53(2H,m),4.82-4.96(1H,m),5.95(1H,s),7.09-7.42(6H,m),7.45-7.59(1H,m),8.19(1H,brs)。
實施例21
N-{(2S,3R)-1-(雙環[1.1.1]戊烷-1-羰基)-4,4-二氟-2-[(3'-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺
A)(S)-(3-(3-氯苯基)-1-(甲氧基(甲基)胺基)-1-側氧基丙烷-2-基)胺甲酸第三丁基酯
於室溫下,在含(S)-2-((第三丁氧基羰基)胺基)-3-(3-氯苯基)丙酸(25.3g)、DIPEA(27.3g)及HATU(35.3g)之THF(250mL)混合物中添加N,O-二甲基羥基胺鹽酸鹽(12.4g)。混合物於室溫下攪拌15h。混合物使用EtOAc(250mL)稀釋。於室溫下,混合物使用飽和碳酸氫鈉水溶液(200mL)中止反應。分離有機層,使用飽和鹽水(100mL)洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(28.5g)。
MS,實測值:243.0。
B)(S)-(3-(3-氯苯基)-1-(甲氧基(甲基)胺基)-1-側氧基丙烷-2-基)(4-甲氧基苯甲基)胺甲酸第三丁基酯
於0℃下,在含(S)-(3-(3-氯苯基)-1-(甲氧基(甲基)胺基)-1-側氧基丙烷-2-基)胺甲酸第三丁基酯(13.7g)之DMF(80mL)混合物中添加氫化鈉(2.08g)。於室溫下攪拌10分鐘後,於0℃下添加1-(氯甲基)-4-甲氧基苯(12.5g)及四丁基銨化碘(1.48g)。於室溫下攪拌1.5h,反應混合物倒至0℃之含EtOAc(200mL)及5% KHSO4水溶液(100mL)之攪拌混合物中並
分離有機層。有機層使用水及飽和鹽水洗滌,經硫酸鎂脫水、過濾並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(18.3g)。
MS:[M+H]+ 463.1。
C)[(2S)-1-(3-氯苯基)-3-側氧基丙烷-2-基][(4-甲氧基苯基)甲基]胺甲酸第三丁基酯
於-78℃下,將氫化鋁(III)鋰(2.10g)添加至含(S)-(3-(3-氯苯基)-1-(甲氧基(甲基)胺基)-1-側氧基丙烷-2-基)(4-甲氧基苯甲基)胺甲酸第三丁基酯(18.3g)之Et2O(150mL)攪拌溶液中。混合物回溫至0℃。0.5h後,反應混合物使用EtOAc(6.97g)及硫酸氫鉀(13.5g)之水溶液(150mL)中止反應,然後添加EtOAc及水。分離有機層,使用水及飽和鹽水及碳酸氫鈉水溶液混合物洗滌,經硫酸鎂脫水、過濾並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(12.8g)。
MS:[M-H]- 402.1。
D)(4S)-4-((第三丁氧基羰基)(4-甲氧基苯甲基)胺基)-5-(3-氯苯基)-2,2-二氟-3-羥基戊酸乙基酯
於室溫下,在含鋅(0.456g)之THF(6mL)攪拌混合物中添加氯三甲基矽烷(0.051g)。5min後,添加2-溴-2,2-二氟乙酸乙基酯(0.945g)至於冰浴中冷卻之混合物中。10min後,添加含[(2S)-1-(3-氯苯基)-3-側氧基丙烷-2-基][(4-甲氧基苯基)甲基]胺甲酸第三丁基酯(0.94g)之THF(2mL)至室溫下之混合物中。混合物於室溫及氮環境下攪拌2h。反應混合物倒至10%檸檬酸水溶液及EtOAc之攪拌混合物中。分離有機層,使用飽和鹽水洗滌,
經硫酸鎂脫水、過濾並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(1.11g)。
MS,實測值:472.1。
E)(4S)-5-(3-氯苯基)-2,2-二氟-3-羥基-4-((4-甲氧基苯甲基)胺基)戊酸乙基酯鹽酸鹽
於室溫下,在含(4S)-4-((第三丁氧基羰基)(4-甲氧基苯甲基)胺基)-5-(3-氯苯基)-2,2-二氟-3-羥基戊酸乙酯(1.11g)之EtOH(3mL)混合物中添加4M HCl/CPME溶液(5.26mL)。混合物於室溫下攪拌2h。蒸發後,產生標題化合物(0.976g)。
MS:[M+H]+ 428.0。
F)(5S)-5-[(3-氯苯基)甲基]-3,3-二氟-4-羥基-1-[(4-甲氧基苯基)甲基]吡咯啶-2-酮
於室溫下,在含(4S)-5-(3-氯苯基)-2,2-二氟-3-羥基-4-((4-甲氧基苯甲基)胺基)戊酸乙基酯鹽酸鹽(0.976g)之EtOH(5mL)混合物中添加DIPEA(2.72g)。混合物於室溫下攪拌2h。蒸發溶劑後,殘質倒至水中,混合物使用EtOAc萃取。分離有機層,使用飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(0.770g)。
MS:[M-H]- 380.1。
G)(5S)-5-[(3-氯苯基)甲基]-3,3-二氟-4-羥基吡咯啶-2-酮
於室溫下,在含(5S)-5-[(3-氯苯基)甲基]-3,3-二氟-4-羥基-1-[(4-甲氧基苯基)甲基]吡咯啶-2-酮(0.77g)之CH3CN(7mL)及水(2.33mL)之混合物
中添加硝酸銨鈰(IV)(2.21g)。混合物於室溫下攪拌2h。混合物使用飽和碳酸鈉水溶液中止反應,使用EtOAc萃取。分離有機層,使用飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(0.460g)。
MS:[M-H]- 260.0。
H)(2S)-2-[(3-氯苯基)甲基]-4,4-二氟吡咯啶-3-醇
於室溫下,在含(5S)-5-[(3-氯苯基)甲基]-3,3-二氟-4-羥基吡咯啶-2-酮(3.45g)之THF(40mL)混合物中添加0.9M甲硼烷-THF複合物/THF溶液(44.0mL)。混合物於60℃及氮環境下攪拌3h。混合物使用0℃之水中止反應。混合物於室溫下攪拌10min並在減壓下濃縮。使用EtOH(10mL)及1M鹽酸(50mL)稀釋殘質,混合物於60℃下攪拌1h。小心添加碳酸氫鈉至冰浴中之反應混合物中,提高溶液之pH至8。蒸發後,產生標題化合物(3.27g)。
MS,實測值:247.9。
I)(2S)-2-[(3-氯苯基)甲基]-4,4-二氟-3-羥基吡咯啶-1-羧酸第三丁基酯
於室溫下,在含(2S)-2-[(3-氯苯基)甲基]-4,4-二氟吡咯啶-3-醇(2.27g)及TEA(1.86g)之THF(30mL)粗製混合物中添加Boc2O(3.00g)。混合物於室溫及氮環境下攪拌3h。蒸發後,混合物加水稀釋,使用EtOAc萃取。分離有機層,使用飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(2.84g)。
MS,實測值:247.9。
J)(2S,3S)-2-[(3-氯苯基)甲基]-4,4-二氟-3-[(三氟甲磺醯基)氧]吡咯啶-1-羧酸第三丁基酯
於0℃下,將三氟甲烷磺酸酐(406μL)添加至含(2S)-2-[(3-氯苯基)甲基]-4,4-二氟-3-羥基吡咯啶-1-羧酸第三丁基酯(420mg)及吡啶(488μL)之Et2O(6.04mL)溶液中。於室溫下攪拌2h後,再於40℃下2h,於室溫下使用水中止混合物反應,使用EtOAc萃取。分離有機層,使用飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。有機層經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(410mg)。
MS,實測值:379.9。
K)(2S,3R)-3-疊氮基-2-[(3-氯苯基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯
於室溫下,在含(2S,3S)-2-[(3-氯苯基)甲基]-4,4-二氟-3-[(三氟甲磺醯基)氧基]吡咯啶-1-羧酸第三丁基酯(2.43g)之CH3CN(20mL)混合物中添加四丁基銨疊氮化物(2.16g)。混合物於80℃下攪拌1h。混合物使用0℃之水中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(1.85g)。
MS,實測值:272.9。
L)(2S,3R)-3-胺基-2-[(3-氯苯基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯
於室溫下,在含(2S,3R)-3-疊氮基-2-[(3-氯苯基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(1.57g)之THF(20mL)混合物中添加PPh3(1.33g)。混
合物於50℃下攪拌15h。蒸發後,殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離)。殘質經製備性HPLC純化(管柱:CHIRALPAK IA,移動相:己烷/EtOH/二乙胺=650/350/1(v/v/v)),產生滯留時間較短之標題化合物(1.13g)(管柱:CHIRALPAK IA,移動相:己烷/EtOH/二乙胺=650/350/1(v/v/v))。
MS,實測值:291.1。
M)(2S,3R)-2-[(3-氯苯基)甲基]-4,4-二氟-3-[(甲磺醯基)胺基]吡咯啶-1-羧酸第三丁基酯
於室溫下,將甲烷磺酸酐(166mg)添加至含(2S,3R)-3-胺基-2-[(3-氯苯基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(165mg)及TEA(0.199mL)之THF(3mL)攪拌溶液中。0.5h後,在減壓下濃縮反應混合物,殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(186mg)。
MS:[M-H]- 423.1。
N)(2S,3R)-4,4-二氟-2-[(3'-氟[1,1'-聯苯]-3-基)甲基]-3-[(甲磺醯基)胺基]吡咯啶-1-羧酸第三丁基酯
將含(2S,3R)-2-[(3-氯苯基)甲基]-4,4-二氟-3-[(甲磺醯基)胺基]吡咯啶-1-羧酸第三丁基酯(186mg)、(3-氟苯基)二羥硼酸(92mg)、XPhos Pd G3(37.1mg)及1M磷酸鉀水溶液(1.31mL)之DME(1.46mL)混合物於90℃下攪拌一夜。混合物經管柱層析法純化(NH矽膠,EtOAc/己烷),產生標題化合物(205mg)。
MS:[M-H]- 483.2。
O)N-{(2S,3R)-4,4-二氟-2-[(3'-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺鹽酸鹽
將含(2S,3R)-4,4-二氟-2-[(3'-氟[1,1'-聯苯]-3-基)甲基]-3-[(甲磺醯基)胺基]吡咯啶-1-羧酸第三丁基酯(205mg)及4M HCl/CPME溶液(5mL)之混合物於室溫下攪拌2h。藉由過濾收集固體,產生標題化合物(175mg)。
MS:[M+H]+ 385.0。
P)N-{(2S,3R)-1-(雙環[1.1.1]戊烷-1-羰基)-4,4-二氟-2-[(3'-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺
於室溫下,將HATU(43.4mg)添加至含N-{(2S,3R)-4,4-二氟-2-[(3'-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺鹽酸鹽(40mg)、雙環[1.1.1]戊烷-1-羧酸(12.8mg)及TEA(0.066mL)之DMF(1mL)溶液中。混合物於室溫及乾燥環境下攪拌30min。混合物使用室溫之飽和碳酸氫鈉水溶液中止反應,使用EtOAc萃取。分離有機層,使用飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(32.0mg)。
1H NMR(400MHz,CDCl3)δ 1.21-1.76(3H,m),1.98-3.18(9H,m),3.70-5.01(5H,m),6.97-7.53(8H,m)。
實施例25
N-[(2S,3R)-4,4-二氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺(35mg)、間甲苯基二羥硼酸(16.6mg)、
XPhos Pd G3(6.91mg)及1M磷酸鉀水溶液(245μL)之THF(408μL)混合物於90℃下攪拌1h。混合物經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(33.0mg)。
1H NMR(400MHz,DMSO-d6)δ 0.97-1.23(6H,m),2.36(3H,s),2.61-2.71(1H,m),2.99(3H,s),3.00-3.08(1H,m),4.08-4.45(2H,m),4.58-5.02(2H,m),5.28(1H,s),7.05-7.15(1H,m),7.17-7.22(1H,m),7.24-7.39(5H,m),8.05-8.23(1H,m)。
實施例26
N-{(2S,3R)-4,4-二氟-2-[(3'-氟[1,1'-聯苯]-3-基)甲基]-1-[(2R)-氧雜環戊烷-2-羰基]吡咯啶-3-基}甲磺醯胺
於室溫下,將HATU(43.4mg)添加至含N-{(2S,3R)-4,4-二氟-2-[(3'-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺鹽酸鹽(40mg)、(R)-四氫呋喃-2-羧酸(13.2mg)及TEA(0.066mL)之DMF(0.5mL)溶液中。混合物於室溫及乾燥環境下攪拌30min。混合物使用室溫之飽和碳酸氫鈉水溶液中止反應,使用EtOAc萃取。分離有機層,使用飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc溶離,然後NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(39.0mg)。
1H NMR(400MHz,DMSO-d6)δ 1.54-1.81(3H,m),1.88-2.06(1H,m),2.62-3.14(5H,m),3.41-4.76(7H,m),7.12-7.23(1H,m),7.29-7.44(2H,m),7.45-7.57(4H,m),7.59-7.76(1H,m),8.14-8.30(1H,m)。
實施例35
N-[(2S,3R)-2-[(3',5'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺
A)(2S,3R)-2-[(3',5'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-3-[(甲磺醯基)胺基]吡咯啶-1-羧酸第三丁基酯
將含(2S,3R)-2-[(3-氯苯基)甲基]-4,4-二氟-3-[(甲磺醯基)胺基]吡咯啶-1-羧酸第三丁基酯(90mg)、(3,5-二氟苯基)二羥硼酸(50.2mg)、XPhos Pd G3(17.9mg)及1M磷酸鉀水溶液(635μL)之DME(1.06mL)混合物於90℃下攪拌一夜。混合物使用飽和碳酸氫鈉水溶液中止反應,使用EtOAc萃取。分離有機層,使用飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(104mg)。
MS,實測值:403.0。
B)N-{(2S,3R)-2-[(3',5'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟吡咯啶-3-基}甲磺醯胺鹽酸鹽
將含(2S,3R)-2-[(3',5'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-3-[(甲磺醯基)胺基]吡咯啶-1-羧酸第三丁基酯(104mg)及4M HCl/CPME溶液(2mL)之混合物於室溫下攪拌2h。藉由過濾收集固體,產生標題化合物(85mg)。
MS:[M+H]+ 403.0。
C)N-[(2S,3R)-2-[(3',5'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺
於室溫下,在含N-{(2S,3R)-2-[(3',5'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟吡咯啶-3-基}甲磺醯胺鹽酸鹽(20.0mg)及異丁酸(5.09μL)之DMF(1.5mL)溶液中添加HATU(26.0mg)及DIPEA(0.032mL)。混合物於室溫下攪拌一夜。混合物使用飽和碳酸氫鈉水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(19.7mg)。
1H NMR(400MHz,DMSO-d6)δ 0.11-0.98(6H,m),1.82-1.91(1H,m),2.54-3.15(5H,m),3.81-4.25(2H,m),4.37-4.70(2H,m),7.16-7.84(7H,m),8.23(1H,brs)。
實施例44
N-[(2S,3R)-2-[(3'-氯-2-氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺
A)N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺
將含N-((2S,3R)-2-(3-氯-2-氟苯甲基)-4,4-二氟吡咯啶-3-基)甲磺醯胺鹽酸鹽(200mg)及DIPEA(456μL)之THF(3.16mL)混合物於室溫下攪拌30min。在0℃下,在懸浮液中滴加α-乙醯氧基-異丁醯氯(92μL),混合物於相同溫度下攪拌一夜。在混合物中添加水(2.11mL)及4M氫氧化鋰水溶液(1.32mL),混合物於室溫下攪拌一夜。混合物使用飽和碳酸氫鈉水溶液中止反應並使用EtOAc萃取。萃取液使用飽和鹽水洗滌,經硫酸鎂脫水並
在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(184mg)。
MS:[M+H]+ 429.0。
B)N-[(2S,3R)-2-[(3'-氯-2-氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺(24mg)、4,4,4',4',5,5,5',5'-八甲基-2,2'-雙(1,3,2-二氧雜硼雜環戊烷)(17.1mg)、XPhos Pd G3(9.47mg)、乙酸鉀(11.0mg)及甲苯(1mL)之混合物於80℃及氮環境下攪拌4h。混合物使用室溫之水中止反應,使用EtOAc萃取。分離有機層,使用飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。將含所得殘質、碳酸銫(58.6mg)、1-氯-3-碘苯(0.011mL)、PdCl2(dppf)(8.78mg)及DME(1mL)/水(0.300mL)之混合物於80℃及氮環境下攪拌1h。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離)。所得固體經製備性HPLC純化,產生標題化合物(7.50mg)。
1H NMR(300MHz,DMSO-d6)δ 0.93-1.28(6H,m),2.61-2.74(1H,m),2.93-3.12(4H,m),4.10-4.48(2H,m),4.57-4.81(1H,m),4.84-5.02(1H,m),5.29(1H,s),7.10-7.18(1H,m),7.29-7.39(2H,m),7.42-7.53(3H,m),7.57(1H,s),8.16(1H,brs)。
實施例45
N-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺,滯留時間較短
於室溫下,在含N-((2S,3R)-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-3-基)乙磺醯胺鹽酸鹽(40.4mg)及氧雜環丁烷-2-羧酸(9.33μL)之DMF(3mL)溶液中添加HATU(53.0mg)及DIPEA(0.065mL)。混合物於室溫下攪拌一夜。混合物使用飽和碳酸氫鈉水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(12.1mg)。
1H NMR(300MHz,DMSO-d6)δ 1.19-1.33(3H,m),2.20-2.44(1H,m),2.60-3.15(5H,m),3.80-5.22(7H,m),7.11-7.57(8H,m),8.09-8.29(1H,m)。
實施例46
N-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺,滯留時間較長
於室溫下,在含N-((2S,3R)-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-3-基)乙磺醯胺鹽酸鹽(40.4mg)及氧雜環丁烷-2-羧酸(9.33μL)之DMF(3mL)溶液中添加HATU(53.0mg)及DIPEA(0.065mL)。混合物於室溫下攪拌一夜。混合物使用飽和碳酸氫鈉水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(13.3mg)。
1H NMR(300MHz,DMSO-d6)δ 1.15-1.43(3H,m),1.95-2.41(1H,m),2.61-3.22(5H,m),3.76-5.13(7H,m),7.11-7.61(8H,m),8.13-8.38(1H,m)。
實施例50
N-[(2S,3R)-2-[([1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺,滯留時間較短
A)(2S,3R)-2-[(3-氯苯基)甲基]-3-[(乙磺醯基)胺基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯
於室溫下,將乙磺醯氯(0.065mL)添加至含(2S,3R)-3-胺基-2-[(3-氯苯基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(158mg)、TEA(0.127mL)、DMAP(11.2mg)及THF(5mL)之混合物中。於室溫下攪拌2h後,反應混合物使用飽和鹽水中止反應並在減壓下濃縮。殘留之油狀物經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(198mg)。
MS,實測值:338.9。
B)N-{(2S,3R)-2-[(3-氯苯基)甲基]-4,4-二氟吡咯啶-3-基}乙磺醯胺鹽酸鹽
將(2S,3R)-2-[(3-氯苯基)甲基]-3-[(乙磺醯基)胺基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(191mg)及4M HCl/CPME溶液(4mL)之混合物於室溫下攪拌2h。藉由過濾收集固體,產生標題化合物(149mg)。
MS:[M+H]+ 338.9。
C)N-[(2S,3R)-2-[(3-氯苯基)甲基]-4,4-二氟-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺
於室溫下,在含N-{(2S,3R)-2-[(3-氯苯基)甲基]-4,4-二氟吡咯啶-3-基}乙磺醯胺鹽酸鹽(145mg)及氧雜環丁烷-2-羧酸(0.049mL)之DMF(5mL)溶液中添加HATU(220mg)及DIPEA(0.270mL)。混合物於室溫下攪拌一夜。混合物使用飽和氯化銨水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鈉脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(125mg)。
MS:[M+H]+ 423.0.
D)N-[(2S,3R)-2-[([1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺,滯留時間較短
將含N-[(2S,3R)-2-[(3-氯苯基)甲基]-4,4-二氟-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺(52.7mg)、苯基二羥硼酸(30.4mg)、XPhos Pd G3(10.6mg)及1M磷酸鉀水溶液(0.374mL)之DME(1mL)混合物於90℃下攪拌一夜。冷卻回到室溫後,溶液使用EtOAc稀釋並經硫酸鈉脫水。在減壓下排除溶劑後,殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),然後經過製備性HPLC,產生標題化合物(8.7mg)。
1H NMR(300MHz,DMSO-d6)δ 1.01-1.29(3H,m),2.53-3.18(6H,m),3.75-5.29(7H,m),7.20-7.76(9H,m),8.18(1H,d,J=9.8Hz)。
實施例51
N-[(2S,3R)-2-[([1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺,滯留時間較長
將含N-[(2S,3R)-2-[(3-氯苯基)甲基]-4,4-二氟-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺(52.7mg)、苯基二羥硼酸(30.4mg)、XPhos Pd G3(10.6mg)及1M磷酸鉀水溶液(0.374mL)之DME(1mL)混合物於90℃下攪拌一夜。冷卻回到室溫後,使用EtOAc稀釋溶液,經硫酸鈉脫水。在減壓下排除溶劑後,殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),然後經過製備性HPLC,產生標題化合物(11.4mg)。
1H NMR(300MHz,DMSO-d6)δ 1.01-1.32(3H,m),1.75-2.28(1H,m),2.52-3.23(5H,m),3.73-5.22(7H,m),7.18-7.71(9H,m),8.07-8.36(1H,m)。
實施例52
N-[(2S,3R)-4,4-二氟-2-[(3'-氟[1,1'-聯苯]-3-基)甲基]-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺,滯留時間較短
將含N-[(2S,3R)-2-[(3-氯苯基)甲基]-4,4-二氟-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺(50.9mg)、(3-氟苯基)二羥硼酸(33.7mg)、XPhos Pd G3(10.2mg)及1M磷酸鉀水溶液(0.361mL)之DME(1mL)混合物於90℃下攪拌一夜。冷卻回到室溫後,使用EtOAc稀釋溶液並經硫酸鈉脫水。在減壓下排除溶劑後,殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),然後經過製備性HPLC,產生標題化合物(9.6mg)。
1H NMR(300MHz,DMSO-d6)δ 1.03-1.25(3H,m),2.52-3.19(6H,m),3.84-5.25(7H,m),7.11-7.82(8H,m),8.07-8.30(1H,m)。
實施例56
N-{(2S,3R)-4,4-二氟-1-((2R)-氧雜環丁烷-2-羰基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
A)N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-3-基}乙磺醯胺鹽酸鹽
將含(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-3-[(乙磺醯基)胺基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(580mg)及4M鹽酸CPME溶液(10mL)之混合物於室溫下攪拌一夜。藉由過濾收集不可溶物質,產生標題化合物(464mg)。
MS,實測值:356.9。
B)N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺
於室溫下,在含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-3-基}乙磺醯胺鹽酸鹽(200mg)、氧雜環丁烷-2-羧酸(78mg)及DMF(3mL)之混合物中添加HATU(290mg)及DIPEA(263mg)。混合物於室溫下攪拌一夜,在混合物中添加飽和氯化銨水溶液,混合物使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鈉脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(NH,EtOAc/己烷),產生標題化合物(147mg)。
MS:[M+H]+ 441.0。
C)N-{(2S,3R)-4,4-二氟-1-((2R)-氧雜環丁烷-2-羰基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺(147mg)、(3,5-二氟苯基)二羥硼酸(105mg)、
XPhos Pd G3(28.2mg)、1M磷酸鉀水溶液(1.00mL)及DME(2mL)之混合物於70℃下攪拌1hr。混合物冷卻至室溫並經矽膠管柱層析法純化(EtOAc/已烷)。所得固體自EtOAc/己烷中結晶,產生滯留時間較短之標題化合物(101mg)。
1H NMR(400MHz,DMSO-d6)δ1.18-1.33(3H,m),2.26-2.45(1H,m),2.58-2.83(2H,m),2.95-3.22(3H,m),3.74-5.20(7H,m),7.14-7.52(6H,m),8.21(1H,brs)。
實施例66
N-{(2S,3R)-4,4-二氟-1-(2-羥基-2-甲基丙醯基)-2-[(2,2',3'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
A)N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺
於0℃下,在含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-3-基}乙磺醯胺鹽酸鹽(160mg)及DIPEA(0.352mL)之THF(2mL)混合物中添加α-乙醯氧基-異丁醯氯(0.071mL),混合物在相同溫度下攪拌10min。在混合物中添加水(1mL)及4M氫氧化鋰水溶液(1.02mL)並於室溫下攪拌混合物一夜。混合物使用飽和碳酸氫鈉水溶液中止反應並使用EtOAc萃取。萃取液使用飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(172mg)。
MS:[M+H]+ 443.0。
B)N-{(2S,3R)-4,4-二氟-1-(2-羥基-2-甲基丙醯基)-2-[(2,2',3'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺(20mg)、(2,3-二氟苯基)二羥硼酸(14.3mg)、XPhos Pd G3(7.64mg)及1M磷酸鉀水溶液(0.135mL)之THF(0.5mL)混合物於90℃之密封管中攪拌6h。混合物經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(19.2mg)。
1H NMR(300MHz,CDCl3)δ 1.30-1.43(9H,m),2.05-3.25(5H,m),3.99-4.53(3H,m),4.87(1H,d,J=9.1Hz),4.99-5.33(1H,m),7.07-7.30(5H,m),7.35-7.48(1H,m)。
實施例67
N-{(2S,3R)-4,4-二氟-1-(2-羥基-2-甲基丙醯基)-2-[(2,2',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺(20mg)、(2,5-二氟苯基)二羥硼酸(14.3mg)、XPhos Pd G3(7.64mg)及1M磷酸鉀水溶液(0.135mL)之THF(0.5mL)混合物於90℃之密封管中攪拌6h。混合物經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(17.4mg)。
1H NMR(300MHz,CDCl3)δ 1.28-2.66(10H,m),2.87-3.22(4H,m),3.94-4.57(3H,m),4.86(1H,d,J=10.6Hz),4.99-5.30(1H,m),6.99-7.24(5H,m),7.35-7.48(1H,m)。
實施例68
N-[(2S,3R)-2-[(3'-氯-2-氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺
A)N-[(2S,3R)-4,4-二氟-2-{[2-氟-3-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基]甲基}-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺(75mg)、4,4,4',4',5,5,5',5'-八甲基-2,2'-雙(1,3,2-二氧雜硼雜環戊烷)(51.6mg)、XPhos Pd G3(28.7mg)及乙酸鉀(33.2mg)之甲苯(1mL)混合物於80℃及氮環境下攪拌5h。反應混合物加水稀釋,使用EtOAc萃取。萃取液使用飽和鹽水洗滌,經硫酸鎂脫水、過濾並在減壓下濃縮,產生標題化合物(151mg)。
MS:[M+H]+ 535.2。
B)N-[(2S,3R)-2-[(3'-氯-2-氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺
將含N-[(2S,3R)-4,4-二氟-2-{[2-氟-3-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜環戊烷-2-基)苯基]甲基}-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺(0.022g)、碳酸銫(0.040g)、1-氯-3-碘苯(7.65μL)、PdCl2(dppf)(6.02mg)及DME(0.5mL)/水(0.150mL)之混合物於80℃及氮環境下攪拌一夜。混合物經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(0.017g)。
1H NMR(300MHz,CDCl3)δ 1.31-1.42(9H,m),2.21-2.58(1H,m),2.86-3.18(4H,m),3.99-4.53(3H,m),4.90(1H,d,J=8.3Hz),5.01-5.29(1H,m),7.14-7.22(1H,m),7.27-7.44(5H,m),7.47-7.56(1H,m)。
實施例73
N-{(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-[(2R)-氧雜環戊烷-2-羰基]吡咯啶-3-基}甲磺醯胺
A)(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-3-[(甲磺醯基)胺基]吡咯啶-1-羧酸第三丁基酯
於室溫下,在含(2S,3R)-3-胺基-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(200mg)、TEA(166mg)及THF(5mL)之混合物中添加甲烷磺酸酐(143mg)。反應混合物於室溫下攪拌一夜並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(244mg)。
MS:[M-H]- 441.1。
B)N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-3-基}甲磺醯胺鹽酸鹽
將含(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-3-[(甲磺醯基)胺基]吡咯啶-1-羧酸第三丁基酯(360mg)及4M鹽酸CPME溶液(5mL)之混合物於室溫下攪拌2hr。反應溶液濃縮,產生標題化合物(300mg)。
MS,實測值:342.9。
C)N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-[(2R)-氧雜環戊烷-2-羰基]吡咯啶-3-基}甲磺醯胺
於室溫下,在含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-3-基}甲磺醯胺鹽酸鹽(300mg)、TEA(400mg)、(2R)-四氫呋喃-2-羧酸(110mg)及DMF(5mL)之混合物中添加HATU(361mg)。混合物於室溫下攪拌30min,於室溫下,在混合物中添加飽和碳酸氫鈉水溶液,混合物使用EtOAc萃取。分離有機層,使用飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷)。所得固體使用IPE洗滌,產生標題化合物(350mg)。
MS:[M+H]+ 441.0。
D)N-{(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-[(2R)-氧雜環戊烷-2-羰基]吡咯啶-3-基}甲磺醯胺
將含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-[(2R)-氧雜環戊烷-2-羰基]吡咯啶-3-基}甲磺醯胺(30mg)、苯基二羥硼酸(12.5mg)、1M磷酸鉀水溶液(0.204mL)、XPhos Pd G3(5.76mg)及THF(0.340mL)之混合物於90℃下攪拌1hr。殘質經矽膠管柱層析法純化(NH,EtOAc/己烷),產生標題化合物(22mg)。
1H NMR(400MHz,DMSO-d6)δ 1.37-2.08(4H,m),2.60-3.12(5H,m),3.31-4.95(7H,m),7.08-7.55(8H,m),8.14-8.29(1H,m)。
實施例76
N-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-(1-羥基環丁烷-1-羰基)吡咯啶-3-基]甲磺醯胺
於室溫下,在含N-((2S,3R)-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-3-基)甲磺醯胺鹽酸鹽(35.0mg)及1-羥基環丁烷-1-羧酸(9.50μL)
之DMF(1.5mL)溶液中添加HATU(47.4mg)及DIPEA(0.058mL)。混合物於室溫下攪拌一夜。混合物使用飽和碳酸氫鈉水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(23.5mg)。
1H NMR(400MHz,CDCl3)δ 1.79-2.12(4H,m),2.51-2.62(2H,m),2.87(3H,s),2.92-3.14(2H,m),3.93-4.13(1H,m),4.19-4.41(2H,m),4.97-5.13(2H,m),7.16-7.21(1H,m),7.27-7.54(8H,m)。
實施例77
N-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-(2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺
於室溫下,在含N-((2S,3R)-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-3-基)甲磺醯胺鹽酸鹽(35.0mg)及異丁酸(0.012mL)之DMF(1.5mL)溶液中添加HATU(47.4mg)及DIPEA(0.058mL)。混合物於室溫下攪拌一夜。混合物使用飽和氯化銨水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(33.0mg)。
1H NMR(400MHz,CDCl3)δ 0.45-1.15(6H,m),1.94-2.49(1H,m),2.74-3.17(5H,m),3.72-4.02(1H,m),4.28-4.60(2H,m),4.87-5.19(1H,m),7.09-7.24(2H,m),7.29-7.54(6H,m)。
實施例78
N-{(2S,3R)-1-(雙環[1.1.1]戊烷-1-羰基)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺
於室溫下,在含N-((2S,3R)-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-3-基)甲磺醯胺鹽酸鹽(35.0mg)及雙環[1.1.1]戊烷-1-羧酸(9,17μL)之DMF(1.5mL)溶液中添加HATU(47.4mg)及DIPEA(0.058mL)。混合物於室溫下攪拌一夜。混合物使用飽和氯化銨水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(33.2mg)。
1H NMR(400MHz,CDCl3)δ 1.78-1.91(2H,m),2.10(4H,s),2.26-2.51(1H,m),2.77-3.12(5H,m),3.92-4.08(1H,m),4.17-4.44(1H,m),4.71-5.20(2H,m),7.11-7.24(2H,m),7.27-7.55(7H,m)。
實施例79
N-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]甲磺醯胺,滯留時間較短
於室溫下,在含N-((2S,3R)-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-3-基)甲磺醯胺鹽酸鹽(110mg)及氧雜環丁烷-2-羧酸(0.026mL)之DMF(5mL)溶液中添加HATU(149mg)及DIPEA(0.183mL)。混合物於室溫下攪拌一夜。混合物使用飽和碳酸氫鈉水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),然後經過製備性HPLC,產生標題化合物(33.2mg)。
1H NMR(300MHz,DMSO-d6)δ 2.23-2.47(1H,m),2.61-3.09(6H,m),3.72-5.19(7H,m),7.11-7.56(8H,m),8.23(1H,brs)。
實施例81
N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-((2R)-氧雜環丁烷-2-羰基)吡咯啶-3-基]甲磺醯胺
於室溫下,在含N-{(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟吡咯啶-3-基}甲磺醯胺鹽酸鹽(100mg)及氧雜環丁烷-2-羧酸(0.023mL)之DMF(2mL)溶液中添加HATU(130mg)及DIPEA(0.159mL)。混合物於室溫下攪拌1h。混合物使用飽和碳酸氫鈉水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(41mg)。
1H NMR(400MHz,DMSO-d6)δ 2.30-2.47(1H,m),2.64-2.78(2H,m),2.96-3.10(4H,m),3.75-5.19(7H,m),7.11-7.57(7H,m),8.14-8.32(1H,m)。
實施例87
N-{(2S,3R)-1-(雙環[1.1,1]戊烷-1-羰基)-4,4-二氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺
A)N-{(2S,3R)-1-(雙環[1.1.1]戊烷-1-羰基)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-3-基}甲磺醯胺
於室溫下,在含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-3-基}甲磺醯胺鹽酸鹽(157mg)、雙環[1.1.1]戊烷-1-羧酸(55.7mg)、
TEA(209mg)及DMF(4mL)之混合物中添加HATU(236mg)。混合物於室溫下攪拌1hr,在混合物中添加水,藉由過濾收集不可溶物質,產生標題化合物(180mg)。
MS:[M+H]+ 437.0。
B)N-{(2S,3R)-1-(雙環[1.1.1]戊烷-1-羰基)-4,4-二氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺
將含N-{(2S,3R)-1-(雙環[1.1.1]戊烷-1-羰基)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-3-基}甲磺醯胺(180mg)、(3,5-二氟苯基)二羥硼酸(130mg)、XPhos Pd G3(69.8mg)、1M磷酸鉀水溶液(1.24mL)及DME(3mL)之混合物於90℃下攪拌2hr。殘質經矽膠管柱層析法純化(NH,EtOAc/己烷),然後經過矽膠管柱層析法(EtOAc/己烷)。所得殘質自乙醇/水中結晶,產生標題化合物(121mg)。
1H NMR(400MHz,DMSO-d6)δ 1.20-1.68(2H,m),1.90(4H,s),2.08-2.40(1H,m),2.61-2.77(1H,m),2.90-3.16(4H,m),3.70-4.31(2H,m),4.37-4.86(2H,m),7.08-7.57(6H,m),8.02-8.30(1H,m)。
實施例88
N-{(2S,3R)-4,4-二氟-2-[(3'-氟[1,1'-聯苯]-3-基)甲基]-1-[(2R)-氧雜環戊烷-2-羰基]吡咯啶-3-基}乙磺醯胺
A)(2S,3R)-3-[(乙磺醯基)胺基]-4,4-二氟-2-[(3'-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-1-羧酸第三丁基酯
將含(2S,3R)-2-[(3-氯苯基)甲基]-3-[(乙磺醯基)胺基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(97mg)、(3-氟苯基)二羥硼酸(46.4mg)、XPhos Pd
G3(18.7mg)及1M磷酸鉀水溶液(0.663mL)之THF(1mL)混合物於80℃及氮環境下加熱3h。混合物經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(100mg)。
MS:[M-H]- 497.2。
B)N-{(2S,3R)-4,4-二氟-2-[(3'-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺鹽酸鹽
將含(2S,3R)-3-[(乙磺醯基)胺基]-4,4-二氟-2-[(3'-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-1-羧酸第三丁基酯(100mg)及4M HCl/CPME溶液(5mL)之混合物於室溫下攪拌一夜。在減壓下濃縮混合物,產生標題化合物(86mg)。
MS:[M+H]+ 399.0。
C)N-{(2S,3R)-4,4-二氟-2-[(3'-氟[1,1'-聯苯]-3-基)甲基]-1-[(2R)-氧雜環戊烷-2-羰基]吡咯啶-3-基}乙磺醯胺
於室溫下,將HATU(22.7mg)添加至含N-{(2S,3R)-4,4-二氟-2-[(3'-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺鹽酸鹽(20mg)、(R)-四氫呋喃-2-羧酸(6.94mg)及TEA(0.032mL)之DMF(1mL)溶液中。混合物於室溫下,在乾燥環境下攪拌30min。混合物使用室溫之飽和碳酸氫鈉水溶液中止反應,使用EtOAc萃取。分離有機層,使用飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(18.0mg)。
1H NMR(400MHz,DMSO-d6)δ 1.03-2.06(7H,m),2.66-3.14(4H,m),3.41-4.74(7H,m),7.10-7.74(8H,m),8.07-8.31(1H,m)。
實施例91
N-{(2S,3R)-4,4-二氟-1-((2R)-氧雜環丁烷-2-羰基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺
A)N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-((2R)-氧雜環丁烷-2-羰基)吡咯啶-3-基]甲磺醯胺
於室溫下,在含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-3-基}甲磺醯胺鹽酸鹽(188mg)、氧雜環丁烷-2-羧酸(60.7mg)、TEA(251mg)及DMF(4mL)之混合物中添加HATU(283mg)。混合物於室溫下攪拌6hr,在混合物中添加水,混合物使用EtOAc萃取。分離有機層,使用飽和碳酸氫鈉水溶液、水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),然後經過矽膠管柱層析法(NH,EtOAc/己烷),然後經過HPLC(管柱:L-Column2 ODS(3.0mmI.D.×50mm,3μm),移動相:水/CH3CN(包含5mM乙酸銨)),產生滯留時間較短之標題化合物(65.2mg)。
MS:[M+H]+ 426.9。
B)N-{(2S,3R)-4,4-二氟-1-((2R)-氧雜環丁烷-2-羰基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-((2R)-氧雜環丁烷-2-羰基)吡咯啶-3-基]甲磺醯胺(30mg)、(3,5-二氟苯基)二羥硼酸(22.2mg)、XPhos Pd G3(11.9mg)、1M磷酸鉀水溶液(0.211mL)及THF(0.5mL)之混合物於90℃下攪拌4hr。混合物經矽膠管柱層析法純化(NH,EtOAc/己烷),並自EtOAc/己烷中再結晶,產生標題化合物(27.6mg)。
1H NMR(400MHz,CDCl3)δ 2.77-3.25(7H,m),3.68-3.92(1H,m),4.16-4.98(5H,m),5.01-5.21(2H,m),6.76-6.87(1H,m),7.01-7.10(2H,m),7.16-7.50(3H,m)。
實施例92
N-{(2S,3R)-4,4-二氟-1-((2S)-氧雜環丁烷-2-羰基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺
於室溫下,將HATU(43.7mg)添加至含N-{(2S,3R)-4,4-二氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺鹽酸鹽(35mg)、氧雜環丁烷-2-羧酸(9.39mg)及TEA(0.053mL)之DMF(0.5mL)溶液中。混合物於室溫下攪拌30min後,添加氧雜環丁烷-2-羧酸(9.39mg)至混合物中。混合物於室溫下攪拌30min。混合物加水稀釋,使用EtOAc萃取。萃取液使用飽和碳酸氫鈉水溶液、水及飽和鹽水洗滌,經硫酸鎂脫水、過濾及在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(10.4mg)。
1H NMR(300MHz,CDCl3)δ 2.31-3.21(7H,m),3.77-4.66(6H,m),4.96-5.11(2H,m),6.75-6.89(1H,m),6.99-7.15(2H,m),7.17-7.47(3H,m)。
實施例94
N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺
於室溫下,在含N-{(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟吡咯啶-3-基}乙磺醯胺鹽酸鹽(15.2mg)、DIPEA(21.7mg)及THF(0.5
mL)之混合物中添加2-甲基丙醯氯(5.36mg)。混合物於室溫下攪拌一夜,在混合物中添加飽和碳酸氫鈉水溶液,混合物使用EtOAc萃取。分離有機層,使用飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(13.6mg)。
1H NMR(400MHz,DMSO-d6)δ 0.17-0.92(6H,m),1.22-1.35(3H,m),1.79-2.48(1H,m),2.60-2.77(1H,m),2.97-3.24(3H,m),3.70-4.22(2H,m),4.35-4.93(2H,m),7.03-7.65(7H,m),8.01-8.45(1H,m)。
實施例97
N-[(2S,3R)-4,4-二氟-2-[(3'-氟[1,1'-聯苯]-3-基)甲基]-1-(2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺
於室溫下,將HATU(20.46mg)添加至含N-{(2S,3R)-4,4-二氟-2-[(3'-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺鹽酸鹽(18mg)、異丁酸(5.47mg)及TEA(0.029mL)之DMF(0.5mL)溶液中。混合物於室溫及乾燥環境下攪拌30min。混合物使用室溫之飽和碳酸氫鈉水溶液中止反應,使用EtOAc萃取。分離有機層,使用飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(12.0mg)。
1H NMR(400MHz,DMSO-d6)δ 0.11-1.38(9H,m),1.75-2.04(1H,m),2.52-2.92(2H,m),2.96-3.12(1H,m),3.15-3.24(1H,m),3.81-4.22(2H,m),4.35-4.65(2H,m),7.12-7.79(8H,m),8.10-8.30(1H,m)。
實施例98
N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺
於室溫下,在含N-{(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟吡咯啶-3-基}甲磺醯胺鹽酸鹽(20mg)及異丁酸(3.95μL)之DMF(0.5mL)溶液中添加HATU(26.0mg)及DIPEA(0.032mL)。混合物於室溫下攪拌1h。混合物使用飽和碳酸氫鈉水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(16mg)。
1H NMR(400MHz,DMSO-d6)δ 0.17-0.92(6H,m),1.11-1.94(1H,m),2.58-3.22(5H,m),3.65-4.26(2H,m),4.36-4.89(2H,m),7.06-7.57(7H,m),8.13-8.34(1H,m)。
實施例106
N-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-(2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺
於室溫下,在含N-((2S,3R)-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-3-基)乙磺醯胺鹽酸鹽(30mg)及異丁酸(7.29mg)之DMF(0.5mL)溶液中添加HATU(39.3mg)及DIPEA(0.048mL)。混合物於室溫下攪拌1h。混合物使用飽和碳酸氫鈉水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(29.0mg)。
1H NMR(400MHz,DMSO-d6)δ 0.16-0.94(6H,m),1.19-1.95(4H,m),2.59-2.80(1H,m),2.97-3.25(3H,m),3.65-4.21(2H,m),4.33-4.89(2H,m),7.05-7.55(8H,m),8.03-8.43(1H,m)。
實施例116
N-[(2S,3R)-2-[(3',5'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺
A)N-[(2S,3R)-2-[(3-氯苯基)甲基]-4,4-二氟-1-(2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺
於室溫下,在含N-{(2S,3R)-2-[(3-氯苯基)甲基]-4,4-二氟吡咯啶-3-基}乙磺醯胺鹽酸鹽(128mg)及異丁酸(0.038mL)之DMF(5mL)溶液中添加HATU(195mg)及DIPEA(0.238mL)。混合物於室溫下攪拌一夜。混合物使用飽和氯化銨水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鈉脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(108mg)。
MS:[M+H]+ 409.0。
B)N-[(2S,3R)-2-[(3',5'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺
將含N-[(2S,3R)-2-[(3-氯苯基)甲基]-4,4-二氟-1-(2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺(17mg)、(3,5-二氟苯基)二羥硼酸(13.1mg)、XPhos Pd G3(3.52mg)及1M磷酸鉀水溶液(0.125mL)之DME(1mL)混合物於80℃下攪拌一夜。冷卻回到室溫後,使用EtOAc稀釋溶液並經硫酸鈉脫水。
在減壓下排除溶劑後,殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(18.2mg)。
1H NMR(400MHz,DMSO-d6)δ 0.12-0.98(6H,m),1.03-1.88(4H,m),2.53-3.24(4H,m),3.81-4.23(2H,m),4.36-4.63(2H,m),7.16-7.78(7H,m),8.12-8.32(1H,m)。
實施例121
N-{(2S,3R)-4,4-二氟-1-((2R)-氧雜環丁烷-2-羰基)-2-[(2,2',3'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-((2R)-氧雜環丁烷-2-羰基)吡咯啶-3-基]甲磺醯胺(17mg)、(2,3-二氟苯基)二羥硼酸(12.6mg)、XPhos Pd G3(6.74mg)及1M磷酸鉀水溶液(0.119mL)之THF(0.5mL)混合物於90℃之密封管中攪拌1h。混合物經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(15.3mg)。
1H NMR(400MHz,CDCl3)δ 2.67-3.30(7H,m),3.67-3.93(1H,m),4.18-5.20(7H,m),7.06-7.49(6H,m)。
實施例122
N-{(2S,3R)-4,4-二氟-1-((2R)-氧雜環丁烷-2-羰基)-2-[(2,2',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-((2R)-氧雜環丁烷-2-羰基)吡咯啶-3-基]甲磺醯胺(17mg)、(2,5-二氟苯基)二羥硼酸(12.6mg)、XPhos Pd G3(6.74mg)及1M磷酸鉀水溶液(0.119mL)之
THF(0.5mL)混合物於90℃之密封管中攪拌1h。混合物直接經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(10.9mg)。
1H NMR(400MHz,CDCl3)δ 2.66-3.32(7H,m),3.64-3.91(1H,m),4.17-5.21(7H,m),6.99-7.17(3H,m),7.17-7.30(2H,m),7.32-7.49(1H,m)。
實施例124
N-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]環丙烷磺醯胺,滯留時間較短
A)(2S,3R)-3-[(環丙烷磺醯基)胺基]-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-1-羧酸第三丁基酯
於室溫下,將環丙烷磺醯氯(0.081mL)添加至含(2S,3R)-3-胺基-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-1-羧酸第三丁基酯(130mg)及TEA(0.178mL)之THF(2mL)攪拌溶液中。混合物於相同溫度下攪拌一夜,加熱至70℃及攪拌1h。再添加環丙烷磺醯氯(0.081mL)及TEA(0.178mL)至混合物中,混合物於70℃下攪拌一夜。反應混合物經矽膠管柱層析法純化(使用EtOAc/己烷溶離),產生標題化合物(130mg)。
MS,實測值:411.1。
B)N-{(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}環丙烷磺醯胺鹽酸鹽
將含(2S,3R)-3-[(環丙烷磺醯基)胺基]-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-1-羧酸第三丁基酯(186mg)及4M HCl/CPME溶液(4.0
mL)之混合物於室溫下攪拌一夜並在減壓下濃縮,產生標題化合物(150mg)。
MS:[M+H]+ 411.1。
C)N-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]環丙烷磺醯胺,滯留時間較短
於室溫下,在含N-{(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}環丙烷磺醯胺鹽酸鹽(80.0mg)、氧雜環丁烷-2-羧酸(29.3mg)、HATU(117mg)及DMF(2.0mL)之混合物中添加DIPEA(0.200mL)。
混合物於室溫下攪拌1h。在混合物中添加飽和碳酸氫鈉水溶液,混合物使用EtOAc/己烷萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鈉脫水並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離,然後NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(21.2mg)。
1H NMR(400MHz,DMSO-d6)δ 0.90-1.08(3H,m),1.21-1.33(1H,m),2.24-2.38(1H,m),2.54-2.81(3H,m),3.01-3.15(1H,m),3.70-5.22(7H,m),7.07-7.58(8H,m),8.05-8.42(1H,m)。
實施例129
N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]環丙烷磺醯胺,滯留時間較短
A)(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-3-[(環丙烷磺醯基)胺基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯
於室溫下,在含(2S,3R)-3-胺基-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(100mg)、TEA(83mg)及THF(3mL)之混合物中
添加環丙烷磺醯氯(96mg)。混合物於70℃下攪拌一夜並經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(75mg)。
MS:[M-H]- 467.0。
B)N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-3-基}環丙烷磺醯胺鹽酸鹽
將含(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-3-[(環丙烷磺醯基)胺基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(328mg)及4M鹽酸CPME溶液(6mL)之混合物於室溫下攪拌4hr。藉由過濾收集不可溶物質,產生標題化合物(240mg)。
MS,實測值:369.0。
C)N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]環丙烷磺醯胺,滯留時間較短(得自HPLC(管柱:L-Column2 ODS(3.0mmI.D.×50mm,3μm),移動相:水/CH3CN(包含5mM乙酸銨)))
於室溫下,在含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-3-基}環丙烷磺醯胺鹽酸鹽(35mg)、氧雜環丁烷-2-羧酸(13.2mg)及DMF(1.5mL)之混合物中添加HATU(49.3mg)及DIPEA(44.6mg)。混合物於室溫下攪拌一夜,在混合物中添加飽和氯化銨水溶液,混合物使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鈉脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(11mg)。
MS:[M+H]+ 453.1。
D)N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]環丙烷磺醯胺,滯留時間較短
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]環丙烷磺醯胺(10mg),滯留時間較短(得自HPLC(管柱:L-Column2 ODS(3.0mmI.D.×50mm,3μm),移動相:水/CH3CN(包含5mM乙酸銨)))、(3-氟苯基)二羥硼酸(6.18mg)、Xphos Pd G3(1.87mg)、1M磷酸鉀水溶液(0.066mL)及DME(0.5mL)之混合物於80℃下攪拌一夜。混合物冷卻至室溫,添加EtOAc。混合物經無水硫酸鈉脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(NH,EtOAc/己烷),產生標題化合物(3.6mg)。
1H NMR(400MHz,CDCl3)δ 0.91-1.21(4H,m),2.15-2.43(1H,m),2.71-3.04(3H,m),3.08-3.26(1H,m),3.68-3.88(1H,m),4.16-5.18(7H,m),7.03-7.25(3H,m),7.27-7.44(4H,m)。
實施例131
N-[(2S,3R)-2-[(2',3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺
A)N-{(2S,3R)-2-[(3-氯苯基)甲基]-4,4-二氟吡咯啶-3-基}甲磺醯胺鹽酸鹽
將含(2S,3R)-2-[(3-氯苯基)甲基]-4,4-二氟-3-[(甲磺醯基)胺基]吡咯啶-1-羧酸第三丁基酯(187mg)及4M HCl/CPME溶液(5mL)之混合物於室溫下攪拌2h。藉由過濾收集固體,產生標題化合物(145mg)。
MS:[M+H]+ 325.0。
B)N-[(2S,3R)-2-[(3-氯苯基)甲基]-4,4-二氟-1-(2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺
於室溫下,在含N-{(2S,3R)-2-[(3-氯苯基)甲基]-4,4-二氟吡咯啶-3-基}甲磺醯胺鹽酸鹽(51.1mg)及異丁酸(0.020mL)之DMF(2mL)溶液中添加HATU(81mg)及DIPEA(0.099mL)。混合物於室溫下攪拌一夜。混合物使用飽和氯化銨水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鈉脫水並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(53.0mg)。
MS:[M+H]+ 395.0。
C)N-[(2S,3R)-2-[(2',3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺
將含N-[(2S,3R)-2-[(3-氯苯基)甲基]-4,4-二氟-1-(2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺(14.5mg)、(2,3-二氟苯基)二羥硼酸(11.6mg)、XPhos Pd G3(3.11mg)及1M磷酸鉀水溶液(0.110mL)之DME(0.5mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(17.1mg)。
1H NMR(400MHz,DMSO-d6)δ 0.16-0.98(6H,m),1.78-2.36(1H,m),2.54-3.13(5H,m),3.75-4.72(4H,m),7.26-7.64(7H,m),8.10-8.36(1H,m)。
實施例133
N-{(2S,3R)-4,4-二氟-1-((2S)-氧雜環丁烷-2-羰基)-2-[(2,2',3'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺
A)N-((2S,3R)-2-(3-氯-2-氟苯甲基)-4,4-二氟-1-((2S)-氧雜環丁烷-2-羰基)吡咯啶-3-基)甲磺醯胺
於室溫下,將HATU(283mg)添加至含N-((2S,3R)-2-(3-氯-2-氟苯甲基)-4,4-二氟吡咯啶-3-基)甲磺醯胺鹽酸鹽(188mg)、氧雜環丁烷-2-羧酸(60.7mg)及TEA(0.345mL)之DMF(4mL)溶液中。混合物於室溫下攪拌6h。混合物加水稀釋,使用EtOAc萃取。萃取液使用飽和碳酸氫鈉水溶液、水及飽和鹽水洗滌,經硫酸鎂脫水、過濾及在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離,然後NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(84.5mg)。
MS:[M+H]+ 426.9。
B)N-{(2S,3R)-4,4-二氟-1-((2S)-氧雜環丁烷-2-羰基)-2-[(2,2',3'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺
將含N-((2S,3R)-2-(3-氯-2-氟苯甲基)-4,4-二氟-1-((2S)-氧雜環丁烷-2-羰基)吡咯啶-3-基)甲磺醯胺(20mg)、(2,3-二氟苯基)二羥硼酸(14.8mg)、XPhos Pd G3(7.93mg)及1M磷酸鉀水溶液(0.141mL)之THF(0.5mL)混合物於90℃之密封管中攪拌1h。混合物經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(10.1mg)。
1H NMR(400MHz,CDCl3)δ 2.31-3.22(7H,m),3.77-3.94(1H,m),4.01-4.20(1H,m),4.24-5.17(6H,m),7.06-7.48(6H,m)。
實施例144
N-{(2S,3R)-1-(環丙烷羰基)-4,4-二氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
A)N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-1-(環丙烷羰基)-4,4-二氟吡咯啶-3-基]乙磺醯胺
於室溫下,在含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-3-基}乙磺醯胺鹽酸鹽(146mg)、環丙烷羧酸(47.8mg)及DMF(4mL)之混合物中添加HATU(211mg)及DIPEA(191mg)。混合物於室溫下攪拌一夜,在混合物中添加飽和氯化銨水溶液,混合物使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鈉脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(NH,EtOAc/己烷),產生標題化合物(144mg)。
MS:[M-H]- 423.0。
B)N-{(2S,3R)-1-(環丙烷羰基)-4,4-二氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
於室溫下,在含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-1-(環丙烷羰基)-4,4-二氟吡咯啶-3-基]乙磺醯胺(16.0mg)、(3,5-二氟苯基)二羥硼酸(12.0mg)、1M磷酸鉀水溶液(0.116mL)及DME(0.500mL)混合物中添加XPhos Pd G3(3.2mg)。混合物於氮環境及90℃下攪拌一夜並經矽膠管柱層析法純化(NH,EtOAc/己烷),產生標題化合物(15.0mg)。
1H NMR(400MHz,CDCl3)δ 0.43-1.49(8H,m),2.85-5.03(9H,m),6.72-7.61(6H,m)。
實施例145
N'-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-(1-羥基環丁烷-1-羰基)吡咯啶-3-基]-N,N-二甲基硫醯二胺
A)(2S,3R)-3-[(二甲基胺磺醯基)胺基]-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-1-羧酸第三丁基酯
將含二甲基胺磺醯氯(3mL)、(2S,3R)-3-胺基-4,4-二氟-2-((2-氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-1-羧酸第三丁基酯(400mg)及DMAP(240mg)之混合物於50℃及氮環境下攪拌一夜。反應混合物經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(500mg)。
MS:[M-H]- 512.1。
B)N'-{(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}-N,N-二甲基硫醯二胺鹽酸鹽
將含4M HCl/CPME溶液(12.2mL)及(2S,3R)-3-[(二甲基胺磺醯基)胺基]-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-1-羧酸第三丁基酯(500mg)之混合物於45℃及氮環境下攪拌一夜。反應混合物濃縮,固體使用EtOAc洗滌並過濾,產生標題化合物(435mg)。
MS:[M+H]+ 414.0。
C)N'-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-(1-羥基環丁烷-1-羰基)吡咯啶-3-基]-N,N-二甲基硫醯二胺
於室溫下,在含N'-{(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}-N,N-二甲基硫醯二胺鹽酸鹽(20mg)、1-羥基-環丁烷羧酸(5.16mg)及DIPEA(7.76μL)之DMF(1mL)溶液中添加HATU(16.9mg)。混合物於室溫下攪拌一夜。混合物使用飽和碳酸氫鈉水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鎂脫水並在
減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(12.7mg)。
1H NMR(400MHz,CDCl3)δ 1.40-1.59(1H,m),1.74-1.91(1H,m),1.92-2.08(2H,m),2.47-2.60(2H,m),2.69-2.75(6H,m),2.89-3.02(2H,m),3.06-3.22(1H,m),3.90-4.07(1H,m),4.08-4.22(1H,m),4.22-4.43(1H,m),5.04(2H,brs),7.10-7.19(1H,m),7.24-7.38(3H,m),7.39-7.45(2H,m),7.48-7.53(2H,m)。
實施例146
N-{(2S,3R)-4,4-二氟-1-(2-甲基丙醯基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
A)N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺
於室溫下,在含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-3-基}乙磺醯胺鹽酸鹽(47.9mg)、異丁酸(20.2mg)、DIPEA(0.080mL)及DMF(0.80mL)之混合物中添加HATU(96.2mg)。混合物於室溫下攪拌一夜。混合物使用飽和碳酸氫鈉水溶液稀釋,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鈉脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(44.6mg)。
MS:[M+H]+ 427.0。
B)N-{(2S,3R)-4,4-二氟-1-(2-甲基丙醯基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
於室溫下,在含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺(15.9mg)、(3,5-二氟苯基)二羥硼酸(12.0mg)、1M磷酸鉀水溶液(0.100mL)及DME(0.300mL)之混合物中添加XPhos Pd G3(3.0mg)。混合物於90℃及氮環境下攪拌一夜。混合物經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(13.4mg)。
1H NMR(400MHz,CDCl3)δ 0.52(1H,d,J=6.4Hz),0.85-1.49(8H,m),1.82-5.09(10H,m),6.75-7.55(6H,m)。
實施例147
N-{(2S,3R)-4,4-二氟-1-(2-甲基丙醯基)-2-[(2,2',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
於室溫下,在含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺(14.5mg)、(2,5-二氟苯基)二羥硼酸(10.0mg)、1M磷酸鉀水溶液(0.100mL)及DME(0.300mL)之混合物中添加XPhos Pd G3(3.0mg)。混合物於氮環境及90℃下攪拌一夜。此外,於室溫下,在混合物中添加(2,5-二氟苯基)二羥硼酸(10.0mg)及XPhos Pd G3(3.0mg)。混合物於微波照射下,在120℃下攪拌20min。混合物經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(9.70mg)。
1H NMR(400MHz,CDCl3)δ 0.53(1H,d,J=6.5Hz),0.83-1.48(8H,m),1.90-5.01(10H,m),6.98-7.55(6H,m)。
實施例171
N-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-(2-甲基丙醯基)吡咯啶-3-基]環丙烷磺醯胺
於室溫下,在含N-{(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}環丙烷磺醯胺鹽酸鹽(44.3mg)、異丁酸(15μL)、DIPEA(50μL)及DMF(0.80mL)之混合物中添加HATU(60.0mg)。混合物於室溫下攪拌3天。在混合物中添加飽和碳酸氫鈉水溶液,混合物使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鈉脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(30.6mg)。
1H NMR(400MHz,CDCl3)δ 0.52(1H,d,J=6.5Hz),0.76-1.39(9H,m),1.84-5.16(9H,m),6.98-7.54(8H,m)。
實施例202
N-{(2S,3R)-1-(環丙烷羰基)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟吡咯啶-3-基}乙磺醯胺
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-1-(環丙烷羰基)-4,4-二氟吡咯啶-3-基]乙磺醯胺(15mg)、(3-氟苯基)二羥硼酸(9.88mg)、XPhos Pd G3(2.99mg)及1M磷酸鉀水溶液(0.106mL)之DME(1mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(17.1mg)。
1H NMR(400MHz,CDCl3)δ 0.05-1.49(8H,m),2.86-5.01(9H,m),7.04-7.44(7H,m)。
實施例205
N-{(2S,3R)-1-(環丙烷羰基)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-1-(環丙烷羰基)-4,4-二氟吡咯啶-3-基]乙磺醯胺(13mg)、苯基二羥硼酸(7.46mg)、XPhos Pd G3(2.59mg)及1M磷酸鉀水溶液(0.092mL)之DME(1mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(4.90mg)。
1H NMR(400MHz,CDCl3)δ -0.13-0.18(2H,m),0.49-1.48(6H,m),2.83-4.97(9H,m),7.15-7.54(8H,m)。
實施例210
(2S,3R,4S)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-3-[(乙磺醯基)胺基]-4-氟-N,N-二甲基吡咯啶-1-甲醯胺
A)2-[(3-氯-2-氟苯基)甲基]-1H-吡咯-1-羧酸第三丁基酯
於氬環境及室溫下,在含1-(溴甲基)-3-氯-2-氟苯(40.0g)、(1-(第三丁氧基羰基)-1H-吡咯-2-基)二羥硼酸(49.1g)、1M磷酸鉀水溶液(537mL)及THF(900mL)之混合物中添加PdCl2(dppf)(2.62g)。使混合物回流16hr,倒至冰水中,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(54.7g)。
MS:[M-H]- 308.0。
B)2-[(3-氯-2-氟苯基)甲基]-1H-吡咯
於氬環境及室溫下,在含2-[(3-氯-2-氟苯基)甲基]-1H-吡咯-1-羧酸第三丁基酯(54.7g)及MeOH(250mL)之混合物中添加28%甲醇鈉之甲醇溶液(170g)。混合物於室溫下攪拌5hr,添加反應混合物至於冰冷卻下之氯化銨水溶液中,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮,產生標題化合物(35.9g)。
MS:[M+H]+ 209.9。
C)2-[(3-氯-2-氟苯基)甲基]-2,5-二氫-1H-吡咯-1-羧酸苯甲基酯
於85℃下,在含2-[(3-氯-2-氟苯基)甲基]-1H-吡咯(35.9g)、鋅(112g)及EtOH(500mL)之混合物中滴加濃鹽酸(171mL)。混合物於85℃下攪拌30min,反應混合物倒至冰水中,使用8M氫氧化鈉水溶液鹼化(pH=8)。過濾排除不可溶物質,濾液使用EtOAc/THF萃取。分離有機層,使用飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。於室溫下,在含所得殘質、THF(400mL)及水(400mL)之混合物中添加碳酸氫鈉(21.6g)及1-(((苯甲基氧基)羰基)氧基)吡咯啶-2,5-二酮(44.8g)。混合物於室溫下攪拌15hr、及反應混合物倒至水中,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),然後經過矽膠管柱層析法(NH,EtOAc/己烷),產生標題化合物(25.7g)。
MS:[M+H]+ 346.0。
D)消旋性-(1S,2S,5R)-2-[(3-氯-2-氟苯基)甲基]-6-氧雜-3-氮雜雙環[3.1.0]己烷-3-羧酸苯甲基酯
於0℃下,以35分鐘時間,在含2-[(3-氯-2-氟苯基)甲基]-2,5-二氫-1H-吡咯-1-羧酸苯甲基酯(25.7g)、1,1,1-三氟丙酮(70.3g)、2,2'-((2-(雙(羧基甲基)胺基)乙基)亞胺基)二乙酸鈉二水合物(0.055g)及CH3CN(180mL)/水(120mL)之混合物中添加過氧單硫酸鉀(137g)及碳酸氫鈉(94g)。混合物於0℃下激烈攪拌2hr 30min,倒至冰水中,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),然後經過矽膠管柱層析法(NH,EtOAc/己烷),產生標題化合物(24.6g)。
MS:[M+H]+ 362.0。
E)消旋性-(2S,3S,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟-3-羥基吡咯啶-1-羧酸苯甲基酯
將含消旋性-(1S,2S,5R)-2-[(3-氯-2-氟苯基)甲基]-6-氧雜-3-氮雜雙環[3.1.0]己烷-3-羧酸苯甲基酯(24.0g)及N,N-二乙基乙胺三氫氟酸鹽(64.1g)之混合物於120℃下攪拌17hr。混合物倒至冰水,使用EtOAc萃取。分離有機層,使用碳酸氫鈉水溶液及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(24.2g)。
MS:[M+H]+ 382.0。
F)消旋性-(2S,3S,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟-3-[(三氟甲磺醯基)氧基]吡咯啶-1-羧酸苯甲基酯
於氬環境及0℃下,在含消旋性-(2S,3S,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟-3-羥基吡咯啶-1-羧酸苯甲基酯(24.2g)、吡啶(100g)及Et2O(370mL)
之混合物中滴加三氟甲烷磺酸酐(53.6g)。混合物於室溫下攪拌2hr 30min,倒至冰水中,使用EtOAc萃取。分離有機層,依序使用10%檸檬酸水溶液、碳酸氫鈉水溶液及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(29.0g)。
MS:[M+H]+ 514.0。
G)消旋性-(2S,3R,4S)-3-疊氮基-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-1-羧酸苯甲基酯
於室溫下,在含消旋性-(2S,3S,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟-3-[(三氟甲磺醯基)氧基]吡咯啶-1-羧酸苯甲基酯(29.0g)及CH3CN(335mL)之混合物中添加四-正丁基銨疊氮化物(48.2g)。混合物於80℃下攪拌1hr,倒至冰水中,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(22.2g)。
MS:[M+H]+ 407.0。
H)消旋性-(2S,3R,4S)-3-胺基-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-1-羧酸苯甲基酯
於室溫下,在含消旋性-(2S,3R,4S)-3-疊氮基-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-1-羧酸苯甲基酯(2.17g)及THF(42.7mL)/水(10.7mL)之混合物中添加三苯基磷(1.68g)。混合物於50℃下攪拌15hr,在混合物中添加室溫之飽和鹽水,混合物使用EtOAc萃取。分離有機層,使用飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(甲醇/EtOAc),產生標題化合物(1.74g)。
MS:[M+H]+ 381.0。
I)(2S,3R,4S)-3-胺基-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-1-羧酸苯甲基酯
由消旋性-(2S,3R,4S)-3-胺基-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-1-羧酸苯甲基酯(668mg)經過HPLC解析(管柱:CHIRALPAK ID,50mmID×500mmL,20μm,移動相:己烷/2-丙醇/二乙胺=600/400/1),產生滯留時間較長之標題化合物(251mg)。
MS:[M+H]+ 381.1。
J)(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-3-[(乙磺醯基)胺基]-4-氟吡咯啶-1-羧酸苯甲基酯
於0℃下,在含(2S,3R,4S)-3-胺基-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-1-羧酸苯甲基酯(289mg)、TEA(189mg)及THF(4.0mL)之混合物中添加乙磺醯氯(190mg)。混合物於室溫下攪拌2hr,在混合物中添加水,混合物使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鈉脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(295mg)。
MS:[M+H]+ 473.0。
K)(2S,3R,4S)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-3-[(乙磺醯基)胺基]-4-氟吡咯啶-1-羧酸苯甲基酯
於室溫下,在含(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-3-[(乙磺醯基)胺基]-4-氟吡咯啶-1-羧酸苯甲基酯(340mg)、(3-氟苯基)二羥硼酸(150mg)、XPhos Pd G3(30.9mg)及DME(4.0ml)之混合物中添加1M磷酸鉀水溶液
(1.2mL),混合物於氮環境及90℃下攪拌2hr。於90℃下,在反應混合物中添加1M磷酸鉀水溶液(0.4mL)、(3-氟苯基)二羥硼酸(50.5mg)及XPhos Pd G3(15.2mg)。混合物於氮環境及90℃下攪拌1hr,在反應混合物中添加水,混合物使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鈉脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(250mg)。
MS:[M+H]+ 533.2。
L)N-{(2S,3R,4S)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4-氟吡咯啶-3-基}乙磺醯胺
將含(2S,3R,4S)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-3-[(乙磺醯基)胺基]-4-氟吡咯啶-1-羧酸苯甲基酯(240mg)、10%碳載鈀(24.0mg)及MeOH(5.0mL)/THF(3.0mL)之混合物於常壓氫環境及室溫下攪拌一夜。過濾排除觸媒並在減壓下濃縮濾液,產生標題化合物(178mg)。
MS:[M+H]+ 399.0。
M)(2S,3R,4S)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-3-[(乙磺醯基)胺基]-4-氟-N,N-二甲基吡咯啶-1-甲醯胺
於0℃下,在含N-{(2S,3R,4S)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4-氟吡咯啶-3-基}乙磺醯胺(10.0mg)、DIPEA(22.2mg)及THF(0.200mL)之混合物中添加二甲基胺甲醯氯(11.7mg)。混合物於室溫下攪拌3hr並將反應溶液經過氮氣吹掃乾燥。殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(6.7mg)。
1H NMR(400MHz,CDCl3)δ 0.81-1.44(3H,m),2.59-4.17(13H,m),4.73-4.90(2H,m),5.06-5.27(1H,m),6.98-7.53(7H,m)。
實施例211
N-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4-氟吡咯啶-3-基}乙磺醯胺
於0℃下,在含N-{(2S,3R,4S)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4-氟吡咯啶-3-基}乙磺醯胺(8.9mg)、雙(三氯甲基)碳酸酯(4.0mg)及THF(0.200mL)之混合物中添加DIPEA(7.40mg)。混合物於0℃下攪拌30min並在減壓下濃縮反應溶液。使用THF(0.200mL)稀釋所得殘質,於室溫下添加氮雜環丁烷(3.83mg),混合物於室溫下攪拌1hr。混合物經過氮氣吹掃乾燥並殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(4.8mg)。
1H NMR(400MHz,CDCl3)δ 0.81-1.35(3H,m),2.06-2.16(2H,m),2.85-4.23(11H,m),4.64-5.29(3H,m),6.98-7.54(7H,m)。
實施例212
N-{(2S,3R,4S)-1-(環丙烷羰基)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4-氟吡咯啶-3-基}乙磺醯胺
於室溫下,在含N-{(2S,3R,4S)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4-氟吡咯啶-3-基}乙磺醯胺(11.6mg)、環丙烷羧酸(4.6mg)、DIPEA(11.8mg)及DMF(0.200mL)之混合物中添加HATU(20.5mg)。混合物於室溫下攪拌一夜,在混合物中添加水,混合物使用EtOAc萃取。有機層經過氮氣
吹掃乾燥。殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(8.4mg)。
1H NMR(400MHz,CDCl3)δ 0.05-1.47(7H,m),2.64-5.43(11H,m),6.98-7.54(7H,m)。
實施例220
N-{(2S,3R,4S)-4-氟-1-(2-羥基-2-甲基丙醯基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
A)N-{(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-3-基}乙磺醯胺氫溴酸鹽
於室溫下,在(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-3-[(乙磺醯基)胺基]-4-氟吡咯啶-1-羧酸苯甲基酯(78mg)中添加30%溴化氫-乙酸溶液(0.8mL)。混合物於室溫下攪拌1hr並在減壓下濃縮反應溶液。所得殘質及甲苯共沸,懸浮於IPE中,藉由過濾收集不可溶物質,產生標題化合物(65mg)。
MS,實測值:338.9。
B)N-[(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺
於0℃下,在含N-{(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-3-基}乙磺醯胺氫溴酸鹽(65mg)、DIPEA(60.0mg)及THF(0.8mL)之混合物中添加1-氯-2-甲基-1-側氧基丙烷-2-基乙酸酯(30.6mg)。混合物於相同溫度下攪拌1hr,於0℃下添加水(0.4mL)及4M氫氧化鋰水溶液(0.387mL)。混合物於室溫下攪拌1hr,在混合物中添加水,混合物使用EtOAc
萃取。分離有機層,使用飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮,產生標題化合物(66mg)。
MS:[M+H]+ 425.0。
C)N-{(2S,3R,4S)-4-氟-1-(2-羥基-2-甲基丙醯基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]咯啶-3-基}乙磺醯胺
將含N-[(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺(22mg)、(3,5-二氟苯基)二羥硼酸(16.4mg)、XPhos Pd G3(4.38mg)、1M磷酸鉀水溶液(0.155mL)及DME(0.8mL)之混合物於氮環境及80℃下攪拌1hr。混合物經矽膠管柱層析法純化(EtOAc/己烷),然後經過矽膠管柱層析法(NH,EtOAc/己烷),產生標題化合物(20.2mg)。
1H NMR(400MHz,CDCl3)δ 1.20(3H,t,J=7.0Hz),1.40(6H,s),2.85(2H,q,J=6.9Hz),3.02(2H,dd,J=13.4,6.1Hz),3.22(1H,dd,J=13.9,7.8Hz),3.96-4.30(3H,m),4.75-5.02(2H,m),5.10-5.32(1H,m),6.82(1H,t,J=8.9Hz),7.02-7.13(2H,m),7.16-7.23(1H,m),7.27-7.50(2H,m)。
實施例225
N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-((1r,3S)-3-氟環丁烷-1-羰基)吡咯啶-3-基]乙磺醯胺
A)N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-[(1r,3S)-3-氟環丁烷-1-羰基]吡咯啶-3-基}乙磺醯胺
於室溫下,在含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-3-基}乙磺醯胺鹽酸鹽(0.310g)及3-氟環丁烷-1-羧酸(0.128mL)之DMF(10mL)溶液中添加HATU(0.450g)及DIPEA(0.551mL)。混合物於室溫下攪拌一夜。混合物使用飽和氯化銨水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鈉脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),然後經製備性HPLC純化(管柱:CHIRALCEL OD-H,移動相:二氧化碳/(MeOH/二乙胺=1000/3)=850/150(v/v)),產生HPLC(管柱:CHIRALCEL OD-H,移動相:二氧化碳/(MeOH/二乙胺=1000/3)=850/150(v/v))滯留時間較短之標題化合物(177mg)。
MS:[M+H]+ 457.1。
B)N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-((1r,3S)-3-氟環丁烷-1-羰基)吡咯啶-3-基]乙磺醯胺
於室溫下,在含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-[(1r,3S)-3-氟環丁烷-1-羰基]吡咯啶-3-基}乙磺醯胺(50mg)、(3-氟苯基)二羥硼酸(30.6mg)及XPhos Pd G3(9.26mg)之混合物中添加DME(2mL)及1M磷酸鉀水溶液(0.328mL)。混合物於80℃及氮環境下攪拌1h。冷卻回到室溫後,在減壓下排除溶劑,殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(54.1mg)。
1H NMR(400MHz,CDCl3)δ 1.29-1.48(3H,m),1.55-2.03(2H,m),2.25-3.26(7H,m),3.33-4.55(4H,m),4.88-5.24(2H,m),7.03-7.48(7H,m)。
實施例226
N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-((1s,3R)-3-氟環丁烷-1-羰基)吡咯啶-3-基]乙磺醯胺
A)N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-[(1s,3R)-3-氟環丁烷-1-羰基]吡咯啶-3-基}乙磺醯胺
於室溫下,在含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-3-基}乙磺醯胺鹽酸鹽(0.310g)及3-氟環丁烷-1-羧酸(0.128mL)之DMF(10mL)溶液中添加HATU(0.450g)及DIPEA(0.551mL)。混合物於室溫下攪拌一夜。混合物使用飽和氯化銨水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鈉脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),然後經製備性HPLC純化(管柱:CHIRALCEL OD-H,移動相:二氧化碳/(MeOH/二乙胺=1000/3)=850/150(v/v)),產生HPLC(管柱:CHIRALCEL OD-H,移動相:二氧化碳/(MeOH/二乙胺=1000/3)=850/150(v/v))滯留時間較長之標題化合物(134mg)。
MS:[M+H]+ 457.1。
B)N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-((1s,3R)-3-氟環丁烷-1-羰基)吡咯啶-3-基]乙磺醯胺
將含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-[(1s,3R)-3-氟環丁烷-1-羰基]吡咯啶-3-基}乙磺醯胺(45mg)、(3-氟苯基)二羥硼酸(17.9mg)、XPhos Pd G3(8.34mg)及1M磷酸鉀水溶液(0.295mL)之DME(2mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質
經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離)。殘質自EtOAc/己烷中結晶,產生標題化合物(19.5mg)。
1H NMR(400MHz,CDCl3)δ 1.29-1.47(3H,m),1.80-3.92(11H,m),4.19-5.01(4H,m),7.02-7.46(7H,m)。
實施例236
N-{(2S,3R,4S)-1-(環丙烷羰基)-4-氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
A)N-[(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-1-(環丙烷羰基)-4-氟吡咯啶-3-基]乙磺醯胺
將含(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-3-[(乙磺醯基)胺基]-4-氟吡咯啶-1-羧酸苯甲基酯(179mg)及30%溴化氫/乙酸溶液(2.0mL)之混合物於室溫下攪拌一夜。添加甲苯(20mL),在減壓下濃縮混合物。使用EtOAc稀釋殘質,藉由過濾收集不可溶物質,使用EtOAc洗滌,產生固體。於室溫下,在含所得固體、THF(2.0ml)及2M氫氧化鈉水溶液(0.50ml)之混合物中添加環丙烷羰基氯(81mg)。混合物於室溫下攪拌30min。在混合物中添加水,混合物使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鈉脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(88.2mg)。
MS:[M+H]+ 407.0。
B)N-{(2S,3R,4S)-1-(環丙烷羰基)-4-氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
於室溫下,在含N-[(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-1-(環丙烷羰基)-4-氟吡咯啶-3-基]乙磺醯胺(22.0mg)、(3,5-二氟苯基)二羥硼酸(17.3mg)、1M磷酸鉀水溶液(0.130mL)及DME(0.500mL)之混合物中添加XPhos Pd G3(5.0mg)。混合物於氮環境及90℃下攪拌一夜。混合物經矽膠管柱層析法純化(NH,EtOAc/己烷)並自EtOAc/己烷中再結晶,產生標題化合物(13.5mg)。
1H NMR(400MHz,CDCl3)δ 0.05-1.48(7H,m),2.68-4.30(8H,m),4.60-5.41(3H,m),6.76-7.54(6H,m)。
實施例239
N-{(2S,3R,4S)-1-(環丙烷羰基)-4-氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
於室溫下,在含N-[(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-1-(環丙烷羰基)-4-氟吡咯啶-3-基]乙磺醯胺(22.0mg)、苯基二羥硼酸(17.0mg)、1M磷酸鉀水溶液(0.130mL)及DME(0.500mL)之混合物中添加XPhos Pd G3(6.0mg)。混合物於氮環境及90℃下攪拌一夜。混合物經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),然後再結晶(EtOAc/庚烷),產生標題化合物(13.2mg)。
1H NMR(400MHz,CDCl3)δ 0.09-1.47(7H,m),2.60-4.31(8H,m),4.60-5.38(3H,m),6.98-7.57(8H,m)。
實施例245
N-[(2S,3R)-2-[(3'-氯-2,5'-二氟[1,1'-聯苯]-3-基)甲基]-1-(環丙烷羰基)-4,4-二氟吡咯啶-3-基]甲磺醯胺
A)N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-1-(環丙烷羰基)-4,4-二氟吡咯啶-3-基]甲磺醯胺
於室溫下,在含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-3-基}甲磺醯胺鹽酸鹽(141mg)及環丙烷羧酸(0.044mL)之DMF(4mL)溶液中添加HATU(212mg)及DIPEA(0.260mL)。混合物於室溫下攪拌一夜。混合物使用飽和氯化銨水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鈉脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(134mg)。
MS:[M+H]+ 411.0。
B)N-[(2S,3R)-2-[(3'-氯-2,5'-二氟[1,1'-聯苯]-3-基)甲基]-1-(環丙烷羰基)-4,4-二氟吡咯啶-3-基]甲磺醯胺
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-1-(環丙烷羰基)-4,4-二氟吡咯啶-3-基]甲磺醯胺(134mg)、4,4,4’,4’,5,5,5’,5’-八甲基-2,2’-雙(1,3,2-二氧雜硼雜環戊烷)(124mg)、XPhos Pd G3(55.2mg)及乙酸鉀(64.0mg)之甲苯(4mL)混合物於80℃及氮環境下攪拌8h。反應混合物加水稀釋,使用EtOAc萃取。萃取液使用飽和鹽水洗滌,經硫酸鎂脫水、過濾及在減壓下濃縮。將含所得殘質(0.041g)、碳酸銫(0.080g)、1-溴-3-氯-5-氟苯(0.051g)、PdCl2(dppf)(0.012g)及DME(1mL)/水(0.300mL)之混合物於密封燒瓶中,在80℃及氮環境下攪拌1h。在減壓下排除溶劑,殘質經製備性HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O 10mM NH4HCO3/CH3CN),產生標題化合物(13.8mg)。
1H NMR(400MHz,CDCl3)δ 0.05-1.47(5H,m),2.83-5.42(10H,m),7.07-7.47(6H,m)。
實施例248
N-[(2S,3R)-2-[(3'-氯-2,5'-二氟[1,1'-聯苯]-3-基)甲基]-1-(環丙烷羰基)-4,4-二氟吡咯啶-3-基]乙磺醯胺
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-1-(環丙烷羰基)-4,4-二氟吡咯啶-3-基]乙磺醯胺(144mg)、4,4,4’,4’,5,5,5’,5’-八甲基-2,2’-雙(1,3,2-二氧雜硼雜環戊烷)(129mg)、XPhos Pd G3(57.4mg)及乙酸鉀(66.5mg)之甲苯(4mL)混合物於80℃及氮環境下攪拌36h。反應混合物加水稀釋,使用EtOAc萃取。萃取液使用飽和鹽水洗滌,經硫酸鎂脫水、過濾及在減壓下濃縮。將含所得殘質(0.043g)、碳酸銫(0.081g)、1-溴-3-氯-5-氟苯(0.052g)、PdCl2(dppf)(0.012g)及DME(1mL)/水(0.300mL)之混合物於密封燒瓶中,在80℃及氮環境下攪拌1h。在減壓下排除溶劑,殘質經製備性HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O 10mM NH4HCO3/CH3CN),產生標題化合物(6.00mg)。
1H NMR(400MHz,CDCl3)δ 0.06-1.51(8H,m),2.84-5.44(9H,m),7.05-7.48(6H,m)。
實施例249
N-[(2S,3R)-2-[(3'-氯-2,2'-二氟[1,1'-聯苯]-3-基)甲基]-1-(環丙烷羰基)-4,4-二氟吡咯啶-3-基]乙磺醯胺
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-1-(環丙烷羰基)-4,4-二氟吡咯啶-3-基]乙磺醯胺(144mg)、4,4,4’,4’,5,5,5’,5’-八甲基-2,2’-雙(1,3,2-
二氧雜硼雜環戊烷)(129mg)、XPhos Pd G3(57.4mg)及乙酸鉀(66.5mg)之甲苯(4mL)混合物於80℃及氮環境下攪拌36h。反應混合物加水稀釋,使用EtOAc萃取。萃取液使用飽和鹽水洗滌,經硫酸鎂脫水、過濾及在減壓下濃縮。將含所得殘質(0.043g)、碳酸銫(0.081g)、1-溴-3-氯-2-氟苯(0.052g)及PdCl2(dppf)(0.012g)之DME(1mL)/水(0.300mL)混合物於密封燒瓶中,在80℃及氮環境下攪拌1h。在減壓下排除溶劑,殘質經製備性HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O 10mM NH4HCO3/CH3CN),產生標題化合物(9.30mg)。
1H NMR(400MHz,CDCl3)δ -0.11-0.22(1H,m),0.47-1.48(7H,m),2.79-4.98(9H,m),6.95-7.61(6H,m)。
實施例250
N-[(2S,3R)-2-[(3'-氯-2-氟[1,1'-聯苯]-3-基)甲基]-1-(環丙烷羰基)-4,4-二氟吡咯啶-3-基]甲磺醯胺
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-1-(環丙烷羰基)-4,4-二氟吡咯啶-3-基]甲磺醯胺(134mg)、4,4,4',4',5,5,5',5'-八甲基-2,2'-雙(1,3,2-二氧雜硼雜環戊烷)(124mg)、XPhos Pd G3(55.2mg)及乙酸鉀(64.0mg)之甲苯(4mL)混合物於80℃及氮環境下攪拌8h。反應混合物加水稀釋,使用EtOAc萃取。萃取液使用飽和鹽水洗滌,經硫酸鎂脫水、過濾及在減壓下濃縮。將含所得殘質(0.041g)、碳酸銫(0.080g)、1-氯-3-碘苯(0.058g)及PdCl2(dppf)(0.012g)之DME(1mL)/水(0.300mL)混合物於密封燒瓶中,在80℃及氮環境下攪拌1h。在減壓下排除溶劑,殘質經製備性HPLC
純化(管柱:YMC-Actus Triant C18,移動相:H2O 10mM NH4HCO3/CH3CN),產生標題化合物(0.013g)。
1H NMR(400MHz,CDCl3)δ 0.07-1.48(5H,m),2.76-5.27(10H,m),7.12-7.51(7H,m)。
實施例251
N-[(2S,3R)-2-[(5'-氯-2,2'-二氟[1,1'-聯苯]-3-基)甲基]-1-(環丙烷羰基)-4,4-二氟吡咯啶-3-基]乙磺醯胺
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-1-(環丙烷羰基)-4,4-二氟吡咯啶-3-基]乙磺醯胺(144mg)、4,4,4',4',5,5,5',5'-八甲基-2,2'-雙(1,3,2-二氧雜硼雜環戊烷)(129mg)、XPhos Pd G3(57.4mg)及乙酸鉀(66.5mg)之甲苯(4mL)混合物於80℃及氮環境下攪拌36h。反應混合物加水稀釋,使用EtOAc萃取。萃取液使用飽和鹽水洗滌,經硫酸鎂脫水、過濾及在減壓下濃縮。將含所得殘質(0.043g)、碳酸銫(0.081g)、2-溴-4-氯-1-氟苯(0.052g)、PdCl2(dppf)(0.012g)及DME(1mL)/水(0.300mL)之混合物於密封燒瓶中,在80℃及氮環境下攪拌1h。在減壓下排除溶劑,殘質經製備性HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O10mM NH4HCO3/CH3CN),產生標題化合物(10.6mg)。
1H NMR(400MHz,CDCl3)δ 0.11-1.47(8H,m),2.77-5.39(9H,m),6.97-7.61(6H,m)。
實施例257
N-{(2S,3R)-1-丁醯基-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟吡咯啶-3-基}乙磺醯胺
於室溫下,在含N-((2S,3R)-2-((2,3'-二氟-[1,1'-聯苯]-3-基)甲基)-4,4-二氟吡咯啶-3-基)乙磺醯胺鹽酸鹽(0.020g)及丁酸(6.08μL)之DMF(1mL)溶液中添加HATU(0.025g)及DIPEA(0.031mL)。混合物於室溫下攪拌一夜。混合物使用飽和氯化銨水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鈉脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),然後經製備性HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O 10mM NH4HCO3/CH3CN),產生標題化合物(9.90mg)。
1H NMR(300MHz,DMSO-d6)δ 0.44-0.69(3H,m),0.70-1.33(6H,m),1.81-2.31(1H,m),2.56-3.24(4H,m),3.64-4.82(4H,m),7.08-7.58(7H,m),8.11-8.41(1H,m)。
實施例267
N-[(2S,3R)-2-[(3'-氯-2-氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺,滯留時間較短
A)(2S,3R)-2-[(3'-氯-2-氟[1,1'-聯苯]-3-基)甲基]-3-[(乙磺醯基)胺基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯
將含(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-3-[(乙磺醯基)胺基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(51mg)、4,4,4’,4’,5,5,5’,5’-八甲基-2,2’-雙-1,3,2-二氧雜硼雜環戊烷(42.5mg)、XPhos Pd G3(18.9mg)、乙酸鉀(21.9mg)及甲苯(2ml)之混合物於氮環境及80℃下攪拌36hr。反應混合物使用水稀釋,使用EtOAc萃取。分離有機層,使用飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。將含所得殘質、碳酸銫(108mg)、1-氯-3-碘苯(39.3
mg)、PdCl2(dppf)(16.1mg)及DME(1ml)/水(0.3mL)之混合物於密閉條件下,於氮環境及80℃下攪拌1hr。減壓蒸發溶劑,殘質經矽膠管柱層析法純化(NH,EtOAc/己烷),產生標題化合物(22mg)。
MS:[M-H]- 531.1。
B)N-{(2S,3R)-2-[(3'-氯-2-氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟吡咯啶-3-基}乙磺醯胺鹽酸鹽
將含(2S,3R)-2-[(3'-氯-2-氟[1,1'-聯苯]-3-基)甲基]-3-[(乙磺醯基)胺基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(22mg)及4M鹽酸/CPME溶液(15mL)之混合物於室溫下攪拌一夜。藉由過濾收集不可溶物質,產生標題化合物(4.5mg)。
MS:[M-H]- 431.0。
C)N-[(2S,3R)-2-[(3'-氯-2-氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺,滯留時間較短
於室溫下,在含N-{(2S,3R)-2-[(3'-氯-2-氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟吡咯啶-3-基}乙磺醯胺鹽酸鹽(4.5mg)、氧雜環丁烷-2-羧酸(1.47mg)及DMF(1ml)之混合物中添加HATU(5.47mg)及DIPEA(4.96mg)。混合物於室溫下攪拌一夜並在減壓下濃縮。殘質經HPLC純化(YMC-Actus Triant C18,移動相:水/CH3CN(包含10mM碳酸氫銨)),產生標題化合物(0.4mg)。
1H NMR(300MHz,DMSO-d6)δ 1.18-1.32(3H,m),2.23-2.40(1H,m),2.61-3.16(5H,m),3.78-5.11(7H,m),7.12-7.61(7H,m),8.12-8.42(1H,m)。
實施例272
N-{(2S,3R)-4,4-二氟-1-(1-羥基環丁烷-1-羰基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
於室溫下,在含N-((2S,3R)-4,4-二氟-2-((2,3',5'-三氟-[1,1'-聯苯]-3-基)甲基)吡咯啶-3-基)乙磺醯胺鹽酸鹽(0.030g)及1-羥基環丁烷-1-羧酸(10.2μL)之DMF(1mL)溶液中添加HATU(0.036g)及DIPEA(0.045mL)。混合物於室溫下攪拌一夜。混合物使用飽和氯化銨水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鈉脫水並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(0.016g)。
1H NMR(400MHz,CDCl3)δ 1.36(3H,t,J=7.3Hz),1.77-1.92(1H,m),1.96-2.11(3H,m),2.45-2.62(2H,m),2.90-3.19(4H,m),3.35-3.67(1H,m),3.98-4.39(3H,m),4.86-5.08(2H,m),6.78-6.86(1H,m),7.02-7.12(2H,m),7.15-7.23(1H,m),7.24-7.30(1H,m),7.35-7.45(1H,m)。
實施例302
N-[(2S,3R,4S)-4-氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-((2R)-氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺
A)(2S,3R,4S)-3-[(乙磺醯基)胺基]-4-氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-1-羧酸苯甲基酯
將(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-3-[(乙磺醯基)胺基]-4-氟吡咯啶-1-羧酸苯甲基酯(129mg)、苯基二羥硼酸(66.5mg)、XPhos Pd G3(23.1mg)及1M磷酸鉀水溶液(0.818mL)之DME(4mL)混合物於80℃及氮環
境下攪拌1h。混合物加水稀釋,使用EtOAc萃取。合併之有機層經硫酸鎂脫水、過濾及在減壓下濃縮。所得殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(92mg)。
MS:[M+H]+ 515.1。
B)N-{(2S,3R,4S)-4-氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺氫溴酸鹽
於室溫下,在(2S,3R,4S)-3-[(乙磺醯基)胺基]-4-氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-1-羧酸苯甲基酯(90mg)中添加30% HBr/乙酸溶液(1mL)。混合物於室溫下攪拌1.5h,使用甲苯蒸發溶劑。所得固體懸浮於IPE並藉由過濾收集,產生標題化合物(80.9mg)。
MS:[M+H]+ 381.0。
C)N-[(2S,3R,4S)-4-氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-((2R)-氧雜環丁烷-2-羰基)吡咯啶-3-基]乙磺醯胺
於0℃下,在含N-{(2S,3R,4S)-4-氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺氫溴酸鹽(35mg)及氧雜環丁烷-2-羧酸(23.2mg)之DMF(2mL)溶液中添加HATU(43.3mg)及DIPEA(0.053mL)。混合物於室溫下攪拌1.5h。使用水中止混合物反應並使用EtOAc萃取。有機層經硫酸鎂脫水、過濾及在減壓下濃縮。殘質經製備性HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O 10mM NH4HCO3/CH3CN),產生標題化合物(11.5mg)。
1H NMR(300MHz,DMSO-d6)δ 1.19-1.31(3H,m,),2.30-2.46(1H,m),2.60-2.86(2H,m),3.02-3.20(3H,m),3.46-3.68(1H,m),3.77-4.28(4H,m),4.39-5.40(3H,m),7.09-7.61(8H,m),7.81(1H,br s)。
實施例304
N-{(2S,3R,4S)-4-氟-1-(氧雜環丁烷-2-羰基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺,滯留時間較短
A)(2S,3R,4S)-3-[(乙磺醯基)胺基]-4-氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-1-羧酸苯甲基酯
於室溫下,在含(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-3-[(乙磺醯基)胺基]-4-氟吡咯啶-1-羧酸苯甲基酯(129mg)、(3,5-二氟苯基)二羥硼酸(94.6mg)、XPhos Pd G3(21.9mg)及DME(2.0mL)之混合物中添加1M磷酸鉀水溶液(0.60mL)。混合物於90℃及氮環境下攪拌4h。在混合物中添加水,混合物使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鈉脫水並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(30.4mg)。
MS:[M+H]+ 551.2。
B)N-{(2S,3R,4S)-4-氟-1-(氧雜環丁烷-2-羰基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺,滯留時間較短
將含(2S,3R,4S)-3-[(乙磺醯基)胺基]-4-氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-1-羧酸苯甲基酯(30.4mg)及10% Pd-C(3.0mg)之MeOH(1.0mL)混合物在汽球壓力下,於室溫下氫化一夜。過濾排除觸媒並在減壓下濃縮濾液。於室溫下,在含所得殘質、2-氧雜環丁烷羧酸(10.2mg)、
DIPEA(0.030mL)及DMF(1.0mL)之混合物中添加HATU(36.1mg)。混合物於室溫下攪拌1h。在混合物中添加飽和碳酸氫鈉水溶液,混合物使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鈉脫水並在減壓下濃縮。殘質經製備性HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O 10mM NH4HCO3/CH3CN),產生標題化合物(5.2mg)。
1H NMR(300MHz,DMSO-d6)δ 1.17-1.33(3H,m),2.22-2.45(1H,m),2.58-3.20(5H,m),3.48-5.42(8H,m),7.13-7.51(6H,m),7.73-7.91(1H,m)。
實施例305
N-{(2S,3R,4S)-4-氟-1-(氧雜環丁烷-2-羰基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺,滯留時間較長
將含(2S,3R,4S)-3-[(乙磺醯基)胺基]-4-氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-1-羧酸苯甲基酯(30.4mg)及10% Pd-C(3.0mg)之MeOH(1.0mL)混合物在汽球壓力下,於室溫下氫化一夜。過濾排除觸媒並在減壓下濃縮濾液。於室溫下,在含所得殘質、2-氧雜環丁烷羧酸(10.2mg)、DIPEA(0.030mL)及DMF(1.0mL)之混合物中添加HATU(36.1mg)。混合物於室溫下攪拌1h。在混合物中添加飽和碳酸氫鈉水溶液,混合物使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鈉脫水並在減壓下濃縮。殘質經製備性HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O 10mM NH4HCO3/CH3CN),產生標題化合物(4.1mg)。
1H NMR(300MHz,DMSO-d6)δ 1.19-1.33(3H,m),2.22-2.44(1H,m),2.61-3.22(4H,m),3.42-5.41(9H,m),7.12-7.56(6H,m),7.73-8.00(1H,m)。
實施例307
N-{(2S,3R,4S)-4-氟-1-(氧雜環丁烷-2-羰基)-2-[(2,2',3'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺,滯留時間較短
A)(2S,3R,4S)-3-[(乙磺醯基)胺基]-4-氟-2-[(2,2',3'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-1-羧酸苯甲基酯
於室溫下,在含(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-3-[(乙磺醯基)胺基]-4-氟吡咯啶-1-羧酸苯甲基酯(129mg)、(2,3-二氟苯基)二羥硼酸(91.9mg)、XPhos Pd G3(21.9mg)及DME(2.0mL)之混合物中添加1M磷酸鉀水溶液(0.60mL)。於90℃及氮環境下攪拌4h後,在減壓下濃縮混合物。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(32.7mg)。
MS:[M+H]+ 551.2。
B)N-{(2S,3R,4S)-4-氟-2-[(2,2',3'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
將含(2S,3R,4S)-3-[(乙磺醯基)胺基]-4-氟-2-[(2,2',3'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-1-羧酸苯甲基酯(32.7mg)及10% Pd-C(3.0mg)之MeOH(1.0mL)混合物在汽球壓力下,於室溫下氫化一夜。過濾排除觸媒並在減壓下濃縮濾液,產生標題化合物(23.6mg)。
MS:[M+H]+ 417.1。
C)N-{(2S,3R,4S)-4-氟-1-(氧雜環丁烷-2-羰基)-2-[(2,2',3'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺,滯留時間較短
於室溫下,在含N-{(2S,3R,4S)-4-氟-2-[(2,2',3'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺(23.6mg)、2-氧雜環丁烷羧酸(16.1mg)、DIPEA(0.050mL)及DMF(1.0mL)之混合物中添加HATU(26.0mg)。於室溫下攪拌1h後,在減壓下濃縮混合物。殘質經製備性HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O 10mM NH4HCO3/CH3CN),產生標題化合物(8.7mg)。
1H NMR(300MHz,DMSO-d6)δ 1.24(3H,t,J=7.3Hz),2.23-2.45(1H,m),2.58-2.89(2H,m),3.00-3.18(3H,m),3.41-5.39(8H,m),7.07-7.59(6H,m),7.82(1H,br s)。
實施例346
N-[(2S,3R,4S)-2-[(3'-氯-2-氟[1,1'-聯苯]-3-基)甲基]-4-氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺
A)N-{(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-3-基}乙磺醯胺氫溴酸鹽
於0℃下,在(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-3-[(乙磺醯基)胺基]-4-氟吡咯啶-1-羧酸苯甲基酯(2.18g)中添加30% HBr/乙酸溶液(20mL)。於室溫下攪拌30min後,使用庚烷在減壓下濃縮混合物,使用IPE稀釋殘質。藉由過濾收集不可溶物並使用IPE洗滌,產生標題化合物(1.83g)。
MS:[M+H]+ 339.0。
B)N-[(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺
於0℃下,在含N-{(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-3-基}乙磺醯胺氫溴酸鹽(195mg)及DIPEA(0.402mL)之THF(4mL)混合物中添加α-乙醯氧基-異丁醯氯(0.081mL),混合物在相同溫度下攪拌10min。在混合物中添加水(1mL)及4M氫氧化鋰水溶液(1.16mL),混合物於室溫下攪拌一夜。混合物使用飽和碳酸氫鈉水溶液中止反應並使用EtOAc萃取。萃取液使用飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(180mg)。
MS:[M+H]+ 425.0。
C)N-[(2S,3R,4S)-2-[(3'-氯-2-氟[1,1'-聯苯]-3-基)甲基]-4-氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺
將含N-[(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺(45mg)、(3-氯苯基)二羥硼酸(21.5mg)、XPhos Pd G3(8.96mg)及1M磷酸鉀水溶液(0.318mL)之DME(2mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經製備性HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O 10mM NH4HCO3/CH3CN),然後經過管柱層析(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(11.4mg)。
1H NMR(400MHz,CDCl3)δ 1.10-1.22(3H,m),1.40(6H,s),2.73-3.27(5H,m),3.94-4.31(3H,m),4.76-5.33(3H,m),7.13-7.55(7H,m)。
實施例374
N-{(2S,3R,4S)-1-(雙環[1.1.1]戊烷-1-羰基)-4-氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺
A)N-((2S,3R,4S)-1-(雙環[1.1.1]戊烷-1-羰基)-2-(3-氯-2-氟苯甲基)-4-氟吡咯啶-3-基)甲磺醯胺
於0℃下,在含N-{(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-3-基}甲磺醯胺氫溴酸鹽(100mg)及雙環[1.1.1]戊烷-1-羧酸(0.044mL)之DMF(3mL)溶液中添加HATU(141mg)及DIPEA(0.129mL)。混合物於室溫下攪拌1.5h,然後使用飽和碳酸氫鈉水溶液中止反應,使用EtOAc萃取。合併之有機層使用飽和鹽水洗滌,經硫酸鎂脫水、過濾並濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(102mg)。
MS:[M+H]+ 419.0。
B)N-{(2S,3R,4S)-1-(雙環[1.1.1]戊烷-1-羰基)-4-氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺
將含N-((2S,3R,4S)-1-(雙環[1.1.1]戊烷-1-羰基)-2-(3-氯-2-氟苯甲基)-4-氟吡咯啶-3-基)甲磺醯胺(20mg)、(3,5-二氟苯基)二羥硼酸(15.1mg)、XPhos Pd G3(4.04mg)及1M磷酸鉀水溶液(0.143mL)之DME(0.8mL)混合物於80℃及氮環境下攪拌2h。混合物經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),接著進行製備性HPLC((管柱:L-Column 2 ODS,移動相:H2O 5mM NH4HCO3/CH3CN),產生標題化合物(15.5mg)。
1H NMR(400MHz,CDCl3)δ 1.75-1.94(1H,m),2.07-2.38(5H,m),2.53(3H,d,J=26.2Hz),2.88-3.31(3H,m),3.62-4.47(3H,m),4.65-5.35(3H,m),6.78-6.88(1H,m),7.02-7.12(2H,m),7.16-7.26(2H,m),7.46-7.55(1H,m)。
實施例375
N-{(2S,3R)-4,4-二氟-1-((1r,3S)-3-氟環丁烷-1-羰基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
將含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-[(1r,3S)-3-氟環丁烷-1-羰基]吡咯啶-3-基}乙磺醯胺(28mg)、(3,5-二氟苯基)二羥硼酸(19.4mg)、XPhos Pd G3(5.19mg)及1M磷酸鉀水溶液(0.184mL)之DME(2mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經管柱層析法(NH矽膠,使用EtOAc/己烷溶離)及製備性HPLC(管柱:YMC-Actus Triant C18,移動相:H2O 10mM NH4HCO3/CH3CN)純化,產生標題化合物(28.3mg)。
1H NMR(300MHz,DMSO-d6)δ 1.21-1.73(4H,m),2.00-2.42(3H,m),2.60-3.26(5H,m),3.68-5.13(5H,m),7.11-7.55(6H,m),8.09-8.40(1H,m).
實施例376
N-{(2S,3R)-4,4-二氟-1-((1r,3S)-3-氟環丁烷-1-羰基)-2-[(2,2',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
將含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-[(1r,3S)-3-氟環丁烷-1-羰基]吡咯啶-3-基}乙磺醯胺(28mg)、(2,5-二氟苯基)二羥硼酸
(19.4mg)、XPhos Pd G3(5.19mg)及1M磷酸鉀水溶液(0.184mL)之DME(2mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經管柱層析法(NH矽膠,使用Et0Ac/己烷溶離)及製備性HPLC(管柱:YMC-Actus Triant C18,移動相:H2O 10mM NH4HCO3/CH3CN)純化,產生標題化合物(18.2mg)。
1H NMR(300MHz,DMSO-d6)δ 1.19-1.74(4H,m),2.01-2.42(3H,m),2.57-3.22(5H,m),3.66-5.17(5H,m),7.13-7.48(6H,m),8.11-8.37(1H,m).
實施例378
N-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-((1r,3S)-3-氟環丁烷-1-羰基)吡咯啶-3-基]乙磺醯胺
將含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-[(1r,3S)-3-氟環丁烷-1-羰基]吡咯啶-3-基}乙磺醯胺(28mg)、苯基二羥硼酸(14.9mg)、XPhos Pd G3(5.19mg)及1M磷酸鉀水溶液(0.184mL)之DME(2mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經管柱層析法(NH矽膠,使用EtOAc/己烷溶離)及製備性HPLC(管柱:YMC-Actus Triant C18,移動相:H2O 10mM NH4HCO3/CH3CN)純化,產生標題化合物(26.9mg)。
1H NMR(300MHz,DMSO-d6)δ 1.20-1.71(4H,m),1.99-2.43(3H,m),2.60-3.23(5H,m),3.68-5.14(5H,m),7.09-7.56(8H,m),8.11-8.38(1H,m).
實施例380
N-{(2S,3R)-4,4-二氟-1-((1s,3R)-3-氟環丁烷-1-羰基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
將含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-[(1s,3R)-3-氟環丁烷-1-羰基]吡咯啶-3-基}乙磺醯胺(17mg)、(3,5-二氟苯基)二羥硼酸(11.8mg)、XPhos Pd G3(3.15mg)及1M磷酸鉀水溶液(0.112mL)之DME(1mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經管柱層析法(NH矽膠,使用EtOAc/己烷溶離)及製備性HPLC(管柱:YMC-Actus Triant C18,移動相:H2O 10mM NH4HCO3/CH3CN)純化,產生標題化合物(15.8mg)。
1H NMR(300MHz,DMSO-d6)δ 1.11-3.20(12H,m),3.73-5.00(5H,m),7.11-7.52(6H,m),8.14-8.35(1H,m)。
實施例381
N-{(2S,3R)-4,4-二氟-1-((1s,3R)-3-氟環丁烷-1-羰基)-2-[(2,2',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
將含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-[(1s,3R)-3-氟環丁烷-1-羰基]吡咯啶-3-基}乙磺醯胺(17mg)、(2,5-二氟苯基)二羥硼酸(7.64mg)、XPhos Pd G3(3.15mg)及1M磷酸鉀水溶液(0.112mL)之DME(1mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經管柱層析法(NH矽膠,使用EtOAc/己烷溶離)及製備性HPLC(管柱:YMC-Actus Triant C18,移動相:H2O 10mM NH4HCO3/CH3CN)純化,產生標題化合物(12.0mg)。
1H NMR(300MHz,DMSO-d6)δ 1.19-1.30(3H,m),1.70-2.44(5H,m),2.54-3.22(4H,m),3.70-5.12(5H,m),7.10-7.49(6H,m),8.10-8.38(1H,m)。
實施例383
N-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-((1s,3R)-3-氟環丁烷-1-羰基)吡咯啶-3-基]乙磺醯胺
將含N-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-[(1s,3R)-3-氟環丁烷-1-羰基]吡咯啶-3-基}乙磺醯胺(17mg)、苯基二羥硼酸(9.07mg)、XPhos Pd G3(3.15mg)及1M磷酸鉀水溶液(0.112mL)之DME(1mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經管柱層析法(NH矽膠,使用EtOAc/己烷溶離)及製備性HPLC(管柱:YMC-Actus Triant C18,移動相:H2O10mM NH4HCO3/CH3CN)純化,產生標題化合物(8.00mg)。
1H NMR(300MHz,DMSO-d6)δ 1.12-3.24(12H,m),3.68-5.03(5H,m),7.06-7.59(8H,m),8.10-8.40(1H,m)。
實施例388
N-[(2S,3R,4S)-2-[(3'-氯-2-氟[1,1'-聯苯]-3-基)甲基]-4-氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺
A)(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟-3-[(甲磺醯基)胺基]吡咯啶-1-羧酸苯甲基酯
於室溫下,將甲烷磺酸酐(225mg)添加至含(2S,3R,4S)-3-胺基-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-1-羧酸苯甲基酯(328mg)及TEA(0.360
mL)之THF(10mL)攪拌溶液中。0.5h後,在減壓下濃縮反應混合物,殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(336mg)。
MS:[M+H]+ 459.0。
B)N-{(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-3-基}甲磺醯胺氫溴酸鹽
於室溫下,在(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟-3-[(甲磺醯基)胺基]吡咯啶-1-羧酸苯甲基酯(1.17g)中添加30%HBr/乙酸溶液(10mL)。混合物於室溫下攪拌30min。混合物使用甲苯蒸發,殘質懸浮於IPE中,藉由過濾收集不可溶物並使用IPE洗滌,產生標題化合物(0.974g)。
MS,實測值:325.1。
C)N-[(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺
於0℃下,在含N-{(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-3-基}甲磺醯胺氫溴酸鹽(100mg)及DIPEA(0.299mL)之THF(3mL)混合物中添加α-乙醯氧基-異丁醯氯(0.071mL),混合物於相同溫度下攪拌10min。在混合物中添加水(1mL)及4M氫氧化鋰水溶液(1mL),混合物於室溫下攪拌4h。混合物使用飽和碳酸氫鈉水溶液中止反應並使用EtOAc萃取。萃取液使用飽和鹽水洗滌,經硫酸鈉脫水並在減壓下濃縮。殘質經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(96mg)。
MS:[M+H]+ 411.1。
D)N-[(2S,3R,4S)-2-[(3'-氯-2-氟[1,1'-聯苯]-3-基)甲基]-4-氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺
將含N-[(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟-1-(2-羥基-2-甲基丙醯基)吡咯啶-3-基]甲磺醯胺(23mg)、(3-氯苯基)二羥硼酸(17.5mg)、XPhos Pd G3(4.74mg)及1M磷酸鉀水溶液(0.168mL)之DME(2mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經製備性HPLC(管柱:YMC-Actus Triant C18,移動相:H2O 0.1% TFA/CH3CN 0.1% TFA)及管柱層析法(NH矽膠,使用EtOAc/己烷溶離)純化,產生標題化合物(5.40mg)。
1H NMR(400MHz,CDCl3)δ 1.42(6H,s),2.60(6H,brs),4.01-4.30(3H,m),4.77-5.34(3H,m),7.16-7.23(1H,m),7.27-7.55(6H,m)。
實施例392
N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(3-氟環丁烷-1-羰基)吡咯啶-3-基]甲磺醯胺,滯留時間較長
A)N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(3-氟環丁烷-1-羰基)吡咯啶-3-基]甲磺醯胺
於室溫下,在含N-((2S,3R)-2-(3-氯-2-氟苯甲基)-4,4-二氟吡咯啶-3-基)甲磺醯胺鹽酸鹽(0.310g)及3-氟環丁烷-1-羧酸(0.133mL)之DMF(10mL)溶液中添加HATU(0.466g)及DIPEA(0.571mL)。混合物於室溫下攪拌一夜。混合物使用飽和氯化銨水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鈉脫水並在減壓下濃縮。殘質經
管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離,然後矽膠,使用EtOAc/己烷溶離),產生標題化合物(0.196g)。
MS:[M+H]+ 443.0。
B)N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(3-氟環丁烷-1-羰基)吡咯啶-3-基]甲磺醯胺,滯留時間較長
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(3-氟環丁烷-1-羰基)吡咯啶-3-基]甲磺醯胺(29mg)、(3-氟苯基)二羥硼酸(18.3mg)、XPhos Pd G3(5.54mg)及1M磷酸鉀水溶液(0.196mL)之DME(2mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經製備性HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O 0.1% TFA/CH3CN 0.1% TFA,然後管柱:CHIRALPAK IB,移動相:二氧化碳/(MeOH/二乙胺=1000/3)=900/100(v/v)),產生標題化合物(11.3mg)。
1H NMR(400MHz,CDCl3)δ 1.56-1.72(1H,m),1.95-3.14(9H,m),3.36-3.92(2H,m),4.26-4.53(2H,m),4.88-5.24(2H,m),7.26(7H,s)。
實施例393
N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(3-氟環丁烷-1-羰基)吡咯啶-3-基]甲磺醯胺,滯留時間較短
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(3-氟環丁烷-1-羰基)吡咯啶-3-基]甲磺醯胺(29mg)、(3-氟苯基)二羥硼酸(18.3mg)、XPhos Pd G3(5.54mg)及1M磷酸鉀水溶液(0.196mL)之DME(2mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經製備性HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O 0.1%
TFA/CH3CN 0.1% TFA,然後管柱:CHIRALPAK IB,移動相:二氧化碳/(MeOH/二乙胺=1000/3)=900/100(v/v)),產生標題化合物(10.2mg)。
1H NMR(400MHz,CDCl3)δ 1.84-3.14(10H,m),3.32-3.94(2H,m),4.27-5.13(4H,m),7.03-7.46(7H,m)。
實施例431
N-{(2S,3R)-4,4-二氟-1-((1r,3S)-3-氟環丁烷-1-羰基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(3-氟環丁烷-1-羰基)吡咯啶-3-基]甲磺醯胺(29mg)、(3,5-二氟苯基)二羥硼酸(20.7mg)、XPhos Pd G3(5.54mg)及1M磷酸鉀水溶液(0.196mL)之DME(2mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經製備性HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O 0.1% TFA/CH3CN 0.1% TFA,然後管柱:CHIRALPAK IB,移動相:二氧化碳/(MeOH/二乙胺=1000/3)=900/100(v/v)),產生標題化合物(9.90mg)。
1H NMR(400MHz,CDCl3)δ 1.56-1.70(1H,m),1.98-3.14(9H,m),3.27-3.98(2H,m),4.25-4.52(2H,m),4.88-5.23(2H,m),6.78-6.88(1H,m),6.99-7.09(2H,m),7.16-7.45(3H,m)。
實施例433
N-{(2S,3R)-4,4-二氟-1-((1s,3R)-3-氟環丁烷-1-羰基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(3-氟環丁烷-1-羰基)吡咯啶-3-基]甲磺醯胺(29mg)、(3,5-二氟苯基)二羥硼酸(20.7mg)、
XPhos Pd G3(5.54mg)及1M磷酸鉀水溶液(0.196mL)之DME(2mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經製備性HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O 0.1% TFA/CH3CN 0.1% TFA,然後管柱:CHIRALPAK IB,移動相:二氧化碳/(MeOH/二乙胺=1000/3)=900/100(v/v)),產生標題化合物(12.3mg)。
1H NMR(400MHz,CDCl3)δ 1.29-3.22(10H,m),3.30-5.24(6H,m),6.77-7.47(6H,m)。
實施例435
N-{(2S,3R)-4,4-二氟-1-(3-氟環丁烷-1-羰基)-2-[(2,2',3'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺,滯留時間較長
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(3-氟環丁烷-1-羰基)吡咯啶-3-基]甲磺醯胺(29mg)、(3,5-二氟苯基)二羥硼酸(20.7mg)、XPhos Pd G3(5.54mg)及1M磷酸鉀水溶液(0.196mL)之DME(2mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經製備性HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O 0.1% TFA/CH3CN 0.1% TFA,然後管柱:CHIRALPAK IB,移動相:二氧化碳/(MeOH/二乙胺=1000/3)=900/100(v/v)),產生標題化合物(9mg)。
1H NMR(400MHz,CDCl3)δ 1.60-3.18(10H,m),3.36-3.94(2H,m),4.28-4.53(2H,m),4.92-5.24(2H,m),7.05-7.46(6H,m)。
實施例436
N-{(2S,3R)-4,4-二氟-1-(3-氟環丁烷-1-羰基)-2-[(2,2',3'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺,滯留時間較短
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(3-氟環丁烷-1-羰基)吡咯啶-3-基]甲磺醯胺(29mg)、(3,5-二氟苯基)二羥硼酸(20.7mg)、XPhos Pd G3(5.54mg)及1M磷酸鉀水溶液(0.196mL)之DME(2mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經製備性HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O 0.1% TFA/CH3CN 0.1% TFA,然後管柱:CHIRALPAK IB,移動相:二氧化碳/(MeOH/二乙胺=1000/3)=900/100(v/v)),產生標題化合物(7.6mg)。
1H NMR(400MHz,CDCl3)δ 1.54-3.23(10H,m),3.27-5.08(6H,m),7.04-7.47(6H,m)。
實施例437
N-{(2S,3R)-4,4-二氟-1-(3-氟環丁烷-1-羰基)-2-[(2,2',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺,滯留時間較長
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(3-氟環丁烷-1-羰基)吡咯啶-3-基]甲磺醯胺(29mg)、(2,5-二氟苯基)二羥硼酸(20.7mg)、XPhos Pd G3(5.54mg)及1M磷酸鉀水溶液(0.196mL)之DME(2mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經製備性HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O 0.1% TFA/CH3CN 0.1% TFA,然後管柱:CHIRALPAK IA,移動相:二氧化碳/(MeOH/二乙胺=1000/3)=900/100(v/v)),產生標題化合物(6.1mg)。
1H NMR(400MHz,CDCl3)δ 1.54-3.36(10H,m),3.33-3.94(2H,m),4.27-4.53(2H,m),4.91-5.24(2H,m),7.02-7.46(6H,m)。
實施例439
N-{(2S,3R)-4,4-二氟-1-(3-氟環丁烷-1-羰基)-2-[(2,2',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}甲磺醯胺,滯留時間較短
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(3-氟環丁烷-1-羰基)吡咯啶-3-基]甲磺醯胺(29mg)、(2,5-二氟苯基)二羥硼酸(20.7mg)、XPhos Pd G3(5.54mg)及1M磷酸鉀水溶液(0.196mL)之DME(2mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經製備性HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O 0.1% TFA/CH3CN 0.1% TFA,然後管柱:CHIRALPAK IA,移動相:二氧化碳/(MeOH/二乙胺=1000/3)=900/100(v/v)),產生標題化合物(8.4mg)。
1H NMR(400MHz,CDCl3)δ 1.30-3.21(10H,m),3.25-5.07(6H,m),6.97-7.47(6H,m)。
實施例440
N-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-(3-氟環丁烷-1-羰基)吡咯啶-3-基]甲磺醯胺,滯留時間較長
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(3-氟環丁烷-1-羰基)吡咯啶-3-基]甲磺醯胺(29mg)、苯基二羥硼酸(16.0mg)、XPhos Pd G3(5.54mg)及1M磷酸鉀水溶液(0.196mL)之DME(2mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經製備性HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O 0.1% TFA/CH3CN 0.1% TFA,然後管柱:CHIRALPAK OJ-H,移動相:二氧化碳/(MeOH/二乙胺=1000/3)=900/100(v/v)),產生標題化合物(11.8mg)。
1H NMR(400MHz,CDCl3)δ 1.54-3.15(10H,m),3.32-3.93(2H,m),4.27-4.52(2H,m),4.91-5.23(2H,m),7.09-7.53(8H,m)。
實施例441
N-[(2S,3R)-4,4-二氟-2-[(2-氟[1,1'-聯苯]-3-基)甲基]-1-(3-氟環丁烷-1-羰基)吡咯啶-3-基]甲磺醯胺,滯留時間較短
將含N-[(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-(3-氟環丁烷-1-羰基)吡咯啶-3-基]甲磺醯胺(29mg)、苯基二羥硼酸(16.0mg)、XPhos Pd G3(5.54mg)及1M磷酸鉀水溶液(0.196mL)之DME(2mL)混合物於80℃下攪拌2h。冷卻回到室溫後,在減壓下排除溶劑,殘質經HPLC純化(管柱:YMC-Actus Triant C18,移動相:H2O 0.1% TFA/CH3CN 0.1% TFA,然後管柱:CHIRALPAK OJ-H,移動相:二氧化碳/(MeOH/二乙胺=1000/3)=900/100(v/v)),產生標題化合物(8mg)。
1H NMR(400MHz,CDCl3)δ 1.29-3.20(10H,m),3.35-5.19(6H,m),7.10-7.53(8H,m)。
實施例442
(2S,3R)-3-[(二甲基胺磺醯基)胺基]-4,4-二氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]-N,N-二甲基吡咯啶-1-甲醯胺
A)(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-3-[(二甲基胺磺醯基)胺基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯
將含(2S,3R)-3-胺基-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(300mg)、二甲基胺磺醯氯(800mg)及DMAP(201mg)混合物於氮環境及50℃下攪拌一夜。反應混合物使用飽和碳酸氫鈉水溶液稀釋,
使用EtOAc萃取。分離有機層,使用飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(225mg)。
MS:[M-H]- 470.1。
B)(2S,3R)-3-[(二甲基胺磺醯基)胺基]-4,4-二氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]吡咯啶-1-羧酸第三丁基酯
將含(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-3-[(二甲基胺磺醯基)胺基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(200mg)、(3-甲基苯基)二羥硼酸(86mg)、XPhos Pd G3(35.9mg)、1M磷酸鉀水溶液(0.636mL)及THF(3ml)之混合物使用微波,於80℃下照射1hr。混合物使用0℃之飽和碳酸氫鈉水溶液中和,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮。殘質經矽膠管柱層析法純化(NH,EtOAc/己烷),產生標題化合物(150mg)。
MS:[M-H]- 526.2。
C)N'-{(2S,3R)-4,4-二氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}-N,N-二甲基硫醯二胺鹽酸鹽
將含(2S,3R)-3-[(二甲基胺磺醯基)胺基]-4,4-二氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]吡咯啶-1-羧酸第三丁基酯(145mg)及4M鹽酸/CPME溶液(5mL)之混合物於60℃下攪拌4hr。在減壓下濃縮反應混合物,產生標題化合物(125mg)。
MS,實測值:428.1。
D)(2S,3R)-3-[(二甲基胺磺醯基)胺基]-4,4-二氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]吡咯啶-1-羰基氯
於0℃下,在含N'-{(2S,3R)-4,4-二氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}-N,N-二甲基硫醯二胺鹽酸鹽(50mg)、DIPEA(27.9mg)及THF(4.7ml)之混合物中添加雙(三氯甲基)碳酸酯(25.6mg)。反應混合物於0℃下攪拌10min後,於室溫下攪拌10min。混合物使用0℃之飽和碳酸氫鈉水溶液中和,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經無水硫酸鎂脫水並在減壓下濃縮,產生標題化合物(48mg)。
MS:[M+H]+ 490.1。
E)(2S,3R)-3-[(二甲基胺磺醯基)胺基]-4,4-二氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]-N,N-二甲基吡咯啶-1-甲醯胺
於0℃下,在含(2S,3R)-3-[(二甲基胺磺醯基)胺基]-4,4-二氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]吡咯啶-1-羰基氯(48mg)及THF(0.5ml)之混合物中添加2M N-甲基甲胺/THF溶液(0.5mL)。混合物於室溫下攪拌2hr並經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(35mg)。
1H NMR(400MHz,CDCl3)δ 2.40(3H,s),2.60(6H,s),2.76-2.88(7H,m),2.98-3.05(1H,m),3.66-3.78(1H,m),3.88-4.00(1H,m),4.14-4.27(1H,m),4.82-4.90(1H,m),5.05(1H,d,J=9.7Hz),7.09-7.34(7H,m)。
實施例443
N'-{(2S,3R)-1-(氮雜環丁烷-1-羰基)-4,4-二氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}-N,N-二甲基硫醯二胺
於0℃下,在含(2S,3R)-3-[(二甲基胺磺醯基)胺基]-4,4-二氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]吡咯啶-1-羰基氯(50mg)及THF(0.5ml)之混合物中添加氮雜環丁烷(17.5mg)。混合物於室溫下攪拌2hr並經矽膠管柱層析法純化(EtOAc/己烷),產生標題化合物(20mg)。
1H NMR(400MHz,CDCl3)δ 1.99-2.11(2H,m),2.41(3H,s),2.78(6H,s),2.83-2.93(1H,m),2.96-3.09(1H,m),3.58-3.91(6H,m),4.10-4.26(1H,m),4.69-4.87(1H,m),4.87-5.01(1H,m),7.12-7.23(2H,m),7.24-7.36(5H,m)。
實施例450
N-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-4-氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
A)N-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-3-基}乙磺醯胺
於0℃下,在含N-{(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-3-基}乙磺醯胺氫溴酸鹽(60mg)、雙(三氯甲基)碳酸酯(25.5mg)及THF(1.4mL)之混合物中添加DIPEA(0.075mL)。於0℃下攪拌30min後,混合物倒至水中,使用EtOAc萃取。合併之有機層經硫酸鈉脫水、過濾及在減壓下濃縮。使用THF(1.4mL)稀釋殘質,於室溫下添加氮雜環丁烷(0.029mL)。於室溫下攪拌2h後,混合物倒至飽和氯化銨水溶液中,使用EtOAc萃取。合併之有機層經硫酸鈉脫水、過濾及在減壓下濃縮。殘質經製備性HPLC純化(管柱:L-Column 2 ODS,移動相:H2O 10mM NH4HCO3/CH3CN),產生標題化合物(49.0mg)。
MS:[M+H]+ 422.1。
B)N-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-4-氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
將含N-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-3-基}乙磺醯胺(23mg)、(3,5-二氟苯基)二羥硼酸(17.2mg)、XPhos Pd G3(4.61mg)及1M磷酸鉀水溶液(0.164mL)之DME(0.8mL)混合物於80℃及氮環境下攪拌2h。混合物直接經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(24.5mg)。
1H NMR(400MHz,CDCl3)δ 1.28(3H,t,J=7.4Hz),2.13(2H,quin,J=8.0Hz),2.95(3H,q,J=7.3Hz),3.04-3.14(1H,m),3.61-3.79(4H,m),3.89-4.08(3H,m),4.66-4.75(1H,m),4.86(1H,d,J=10.3Hz),5.06-5.27(1H,m),6.82(1H,t,J=8.9Hz),7.08(2H,d,J=7.0Hz),7.15-7.22(1H,m),7.27-7.31(1H,m),7.36(1H,t,J=7.1Hz)。
實施例451
N-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-4-氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺
將含N-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-3-基}乙磺醯胺(23mg)、間甲苯基二羥硼酸(14.8mg)、XPhos Pd G3(4.61mg)及1M磷酸鉀水溶液(0.164mL)之DME(0.8mL)混合物於80℃及氮環境下攪拌2h。混合物直接經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(23.5mg)。
1H NMR(400MHz,CDCl3)δ 1.22(3H,t,J=7.3Hz),2.06-2.18(2H,m),2.38-2.45(3H,m),2.87(2H,q,J=7.2Hz),2.92-3.01(1H,m),3.05-3.14(1H,m),3.60-3.82(4H,m),3.88-4.09(3H,m),4.68(1H,q,J=7.3Hz),4.88(1H,d,J=10.3Hz),5.04-5.27(1H,m),7.13-7.21(2H,m),7.27-7.37(5H,m)。
實施例458
N'-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-4-氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}-N,N-二甲基硫醯二胺
A)(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-3-[(二甲基胺磺醯基)胺基]-4-氟吡咯啶-1-羧酸苯甲基酯
將含(2S,3R,4S)-3-胺基-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-1-羧酸苯甲基酯(100mg)、DMAP(64.2mg)及二甲基胺磺醯氯(3mL)之混合物於氮環境及50℃下攪拌一夜。反應混合物經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(114mg)。
MS:[M+H]+ 488.1。
B)N'-{(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-3-基}-N,N-二甲基硫醯二胺氫溴酸鹽
於室溫下,在(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-3-[(二甲基胺磺醯基)胺基]-4-氟吡咯啶-1-羧酸苯甲基酯(225mg)中添加30%HBr/乙酸溶液(10mL)。混合物於室溫下攪拌16h後,使用甲苯蒸發溶劑。所得固體懸浮於IPE並藉由過濾收集,產生標題化合物(180mg)。
MS:[M+H]+ 354.0。
C)(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-3-[(二甲基胺磺醯基)胺基]-4-氟吡咯啶-1-羰基氯
於0℃下,將雙(三氯甲基)碳酸酯(76mg)添加至含N'-{(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-3-基}-N,N-二甲基硫醯二胺氫溴酸鹽(140mg)及DIPEA(0.112mL)之THF(4.7mL)溶液中。於0℃下攪拌10min及於室溫下10min後,混合物使用0℃之飽和碳酸氫鈉水溶液中和,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鎂脫水及在減壓下濃縮,產生標題化合物(120mg)。
MS:[M-H]-414.0。
D)N'-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-3-基}-N,N-二甲基硫醯二胺
於0℃下,將氮雜環丁烷(300μL)添加至含(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-3-[(二甲基胺磺醯基)胺基]-4-氟吡咯啶-1-羰基氯(80mg)之THF(3mL)溶液中。混合物於室溫及乾燥環境下攪拌2h。混合物使用0℃之0.05M鹽酸中和,使用EtOAc萃取。分離有機層,使用飽和碳酸氫鈉水溶液、水及飽和鹽水洗滌,經硫酸鎂脫水及在減壓下濃縮,產生標題化合物(70.0mg)。
MS:[M+H]+ 437.1。
E)N'-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-4-氟-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}-N,N-二甲基硫醯二胺
將含N'-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-3-基}-N,N-二甲基硫醯二胺(35mg)、(3,5-二氟苯基)二羥
硼酸(19.0mg)、XPhos Pd G3(6.78mg)及1M磷酸鉀水溶液(0.120mL)之THF(3mL)混合物於微波照射下,在80℃下加熱1h。混合物使用0℃之飽和氯化銨水溶液中和,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。粗產物經過製備性TLC純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(20.0mg)。
1H NMR(400MHz,CDCl3)δ 1.99-2.21(2H,m),2.71(6H,s),2.84-3.00(1H,m),3.00-3.18(1H,m),3.63-3.80(4H,m),3.80-4.01(3H,m),4.58-4.81(1H,m),4.77-4.97(1H,m),5.05-5.37(1H,m),6.70-6.90(1H,m),7.02-7.21(3H,m),7.25-7.30(1H,m),7.32-7.45(1H,m)。
實施例459
(2S,3R,4S)-3-[(二甲基胺磺醯基)胺基]-4-氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]-N,N-二甲基吡咯啶-1-甲醯胺
A)(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-3-[(二甲基胺磺醯基)胺基]-4-氟-N,N-二甲基吡咯啶-1-甲醯胺
於0℃下,將二甲基胺(366μL)添加至含(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-3-[(二甲基胺磺醯基)胺基]-4-氟吡咯啶-1-羰基氯(40mg)之THF(2mL)溶液中。混合物於室溫及乾燥環境下攪拌2h。混合物使用0℃之0.05M鹽酸中和,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鎂脫水及在減壓下濃縮,產生標題化合物(35.0mg)。
MS:[M+H]+ 425.0。
B)(2S,3R,4S)-3-[(二甲基胺磺醯基)胺基]-4-氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]-N,N-二甲基吡咯啶-1-甲醯胺
將含(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-3-[(二甲基胺磺醯基)胺基]-4-氟-N,N-二甲基吡咯啶-1-甲醯胺(35mg)、間甲苯基二羥硼酸(16.8mg)、XPhos Pd G3(6.97mg)及1M磷酸鉀水溶液(0.247mL)之THF(3mL)之混合物於微波照射下,在85℃下加熱3h。混合物使用0℃之飽和碳酸氫鈉水溶液中和,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。粗產物經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(13.0mg)。
1H NMR(400MHz,CDCl3)δ 2.41(3H,s),2.65(6H,s),2.80(6H,s),2.82-2.90(1H,m),3.00-3.08(1H,m),3.58-3.76(1H,m),3.78-4.04(2H,m),4.75-4.89(2H,m),5.01-5.39(1H,m),7.07-7.15(1H,m),7.15-7.23(2H,m),7.24-7.27(1H,m),7.28-7.36(3H,m)。
實施例462
N'-[(2S,3R,4S)-4-氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]-1-(1-羥基環丁烷-1-羰基)吡咯啶-3-基]-N,N-二甲基硫醯二胺
A)N'-[(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟-1-(1-羥基環丁烷-1-羰基)吡咯啶-3-基]-N,N-二甲基硫醯二胺
於室溫下,在含N'-{(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-3-基}-N,N-二甲基硫醯二胺氫溴酸鹽(40mg)及1-羥基環丁烷-1-羧酸(12.8mg)之DMF(1mL)溶液中添加HATU(52.5mg)及DIPEA(0.048mL)。混合物於室溫下攪拌一夜。混合物使用飽和碳酸氫鈉水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鎂脫
水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(40.0mg)。
MS:[M+H]+ 452.0。
B)N'-[(2S,3R,4S)-4-氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]-1-(1-羥基環丁烷-1-羰基)吡咯啶-3-基]-N,N-二甲基硫醯二胺
將含N'-[(2S,3R,4S)-2-[(3-氯-2-氟苯基)甲基]-4-氟-1-(1-羥基環丁烷-1-羰基)吡咯啶-3-基]-N,N-二甲基硫醯二胺(40mg)、間甲苯基二羥硼酸(18.1mg)、XPhos Pd G3(7.49mg)及1M磷酸鉀水溶液(0.266mL)之THF(3mL)混合物於微波照射下,在85℃下加熱3h。混合物使用0℃之飽和氯化銨水溶液中和,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(32.0mg)。
1H NMR(400MHz,CDCl3)δ 1.59-1.70(1H,m),1.82-1.97(1H,m),1.97-2.14(2H,m),2.15-2.20(1H,m),2.41(3H,s),2.57(8H,s),2.98-3.11(1H,m),3.11-3.27(1H,m),3.74-4.30(3H,m),4.72-4.84(1H,m),4.85-5.01(1H,m),5.09-5.34(1H,m),7.10-7.23(2H,m),7.26-7.30(1H,m),7.31(3H,s),7.36-7.47(1H,m)。
實施例463
N'-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-4-氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}-N,N-二甲基硫醯二胺
將含N'-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-2-[(3-氯-2-氟苯基)甲基]-4-氟吡咯啶-3-基}-N,N-二甲基硫醯二胺(35mg)、間甲苯基二羥硼酸
(16.3mg)、XPhos Pd G3(6.78mg)及1M磷酸鉀水溶液(0.240m)之THF(3mL)混合物於微波照射下,在85℃下加熱3h。混合物使用0℃之飽和氯化銨水溶液中和,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鎂脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(13.0mg)。
1H NMR(400MHz,CDCl3)δ 2.03-2.16(2H,m),2.41(3H,s),2.63-2.69(6H,m),2.90-2.99(1H,m),3.03-3.15(1H,m),3.59-4.01(7H,m),4.63-4.76(1H,m),4.76-4.91(1H,m),5.03-5.41(1H,m),7.10-7.21(2H,m),7.26-7.37(5H,m)。
實施例505
N-[(2S,3R)-2-{[3'-(二氟甲基)-2-氟[1,1'-聯苯]-3-基]甲基}-4,4-二氟-1-(3-氟環丁烷-1-羰基)吡咯啶-3-基]乙磺醯胺,滯留時間較長
A)(2S,3R)-2-{[3'-(二氟甲基)-2-氟[1,1'-聯苯]-3-基]甲基}-3-[(乙磺醯基)胺基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯
將含(2S,3R)-2-(3-氯-2-氟苯甲基)-3-(乙基磺醯胺)-4,4-二氟吡咯啶-1-羧酸第三丁基酯(270mg)、(3-(二氟甲基)苯基)二羥硼酸(203mg)、XPhos Pd G3(50.0mg)及1M磷酸鉀水溶液(1.77mL)之THF(7mL)混合物於90℃之密封管中攪拌一夜。混合物使用飽和碳酸氫鈉水溶液中止反應,使用EtOAc萃取。分離有機層,使用飽和鹽水洗滌,經硫酸鈉脫水並在減壓下濃縮。混合物經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(231mg)。
MS:[M-H]- 547.2。
B)N-[(2S,3R)-2-{[3'-(二氟甲基)-2-氟[1,1'-聯苯]-3-基]甲基}-4,4-二氟吡咯啶-3-基]乙磺醯胺鹽酸鹽
將含(2S,3R)-2-{[3'-(二氟甲基)-2-氟[1,1'-聯苯]-3-基]甲基}-3-[(乙磺醯基)胺基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(231mg)及4M HCl/CPME溶液(5mL)之混合物於室溫下攪拌2h。藉由過濾收集白色固體,產生標題化合物(195mg)。
MS:[M+H]+ 449.1。
C)N-[(2S,3R)-2-{[3'-(二氟甲基)-2-氟[1,1'-聯苯]-3-基]甲基}-4,4-二氟-1-(3-氟環丁烷-1-羰基)吡咯啶-3-基]乙磺醯胺,滯留時間較長
於室溫下,在含3-氟環丁烷羧酸(29.2mg)、N-[(2S,3R)-2-{[3'-(二氟甲基)-2-氟[1,1'-聯苯]-3-基]甲基}-4,4-二氟吡咯啶-3-基]乙磺醯胺鹽酸鹽(60mg)、DIPEA(0.130mL)及DMF(1mL)之混合物中添加HATU(75mg)。混合物於室溫下攪拌3h。混合物使用室溫之飽和氯化銨水溶液中止反應,使用EtOAc萃取。分離有機層,使用飽和碳酸氫鈉水溶液及飽和鹽水洗滌,經硫酸鈉脫水並在減壓下濃縮。殘質經管柱層析法(矽膠,使用EtOAc/己烷溶離),然後經過製備性HPLC(管柱:CHIRALCEL OJ-H,移動相:二氧化碳/MeOH=900/100(v/v))純化,產生標題化合物(25.6mg)。
1H NMR(400MHz,CDCl3)δ 1.25-1.48(3H,m),1.63-3.30(9H,m),3.70-5.30(6H,m),6.53-6.88(1H,m),7.14-7.71(7H,m)。
實施例542
N'-{(2S,3R)-4,4-二氟-1-[(2R)-氧雜環丁烷-2-羰基]-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}-N,N-二甲基硫醯二胺
A)(2R)-氧雜環丁烷-2-羧酸
將碘苯二乙酸鹽(8.04g)、(2,2,6,6-四甲基哌啶-1-基)氧(0.532g)及(R)-氧雜環丁烷-2-基甲醇(1.00g)合併,在此混合物中添加CH3CN(50mL)及水(50.0mL),然後於室溫下攪拌混合物3h。混合物使用0℃之1M NaOH水溶液中和,水層使用IPE洗滌。水層使用0℃之2M鹽酸酸化。在混合物中添加NaCl,使用THF/EtOAc萃取混合物。分離有機層,經硫酸鎂脫水及在減壓下濃縮。在殘質中添加甲苯,在減壓下濃縮混合物,產生標題化合物(0.510g)。
1H NMR(400MHz,CDCl3)δ 2.69-2.90(1H,m),3.00-3.22(1H,m),4.68-4.88(2H,m),5.07-5.33(1H,m)。
B)(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-3-[(二甲基胺磺醯基)胺基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯
將含(2S,3R)-3-胺基-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(500mg)及DMAP(335mg)之二甲基胺磺醯氯(4mL)之混合物於65℃及氮環境下攪拌5h。使反應混合物冷卻至室溫並經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(541mg)。
MS,實測值:416.0。
C)N'-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-3-基}-N,N-二甲基硫醯二胺鹽酸鹽
將(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-3-[(二甲基胺磺醯基)胺基]-4,4-二氟吡咯啶-1-羧酸第三丁基酯(541mg)於4M HCl/CPME溶液(10mL)
中,於60℃下攪拌1h。在減壓下濃縮混合物,使用IPE磨製並藉由過濾收集,產生標題化合物(439mg)。
MS:[M+H]+ 372.0。
D)N'-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-[(2R)-氧雜環丁烷-2-羰基]吡咯啶-3-基}-N,N-二甲基硫醯二胺
於室溫下,在含N'-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟吡咯啶-3-基}-N,N-二甲基硫醯二胺鹽酸鹽(100mg)及(2R)-氧雜環丁烷-2-羧酸(0.034mL)之DMF(5mL)溶液中添加HATU(140mg)及DIPEA(0.171mL)。混合物於室溫下攪拌一夜。混合物使用飽和氯化銨水溶液中止反應,使用EtOAc萃取。分離有機層,使用水及飽和鹽水洗滌,經硫酸鈉脫水並在減壓下濃縮。殘質經管柱層析法純化(NH矽膠,使用EtOAc/己烷溶離),產生標題化合物(109mg)。
MS:[M+H]+ 456.0。
E)N'-{(2S,3R)-4,4-二氟-1-[(2R)-氧雜環丁烷-2-羰基]-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}-N,N-二甲基硫醯二胺
將含N'-{(2S,3R)-2-[(3-氯-2-氟苯基)甲基]-4,4-二氟-1-[(2R)-氧雜環丁烷-2-羰基]吡咯啶-3-基}-N,N-二甲基硫醯二胺(22mg)、(3,5-二氟苯基)二羥硼酸(15.2mg)、XPhos Pd G3(4.08mg)及1M磷酸鉀水溶液(0.145mL)之DME(0.8mL)之混合物於80℃及氮環境下攪拌2h。混合物經管柱層析法純化(矽膠,使用EtOAc/己烷溶離),產生標題化合物(16.4mg)。
1H NMR(400MHz,CDCl3)δ 2.71-3.06(9H,m),3.06-3.25(1H,m),3.69-3.90(1H,m),4.05-5.17(7H,m),6.77-6.87(1H,m),7.06(2H,d,J=7.0Hz),7.21(1H,q,J=7.3Hz),7.27-7.48(2H,m)。
下表顯示實施例化合物。表中MS意指實際測定值。下表中實施例6、9至12、14至20、22至24、27至34、36至43、47至49、53至55、57至65、69至72、74、75、80、82至86、89、90、93、95、96、99至105、107至115、117至120、123、125至128、130、132、134至143、148至170、172至201、203、204、206至209、213至219、221至224、227至235、237、238、240至244、246、247、252至256、258至266、268至271、273至301、303、306、308至345、347至373、377、379、382、384至387、389至391、394至430、432、434、438、444至449、452至457、460、461、464至504、506至541及543至616化合物係依據上述實施例說明之方法或其類似方法製造。
實驗實施例1:取得穩定表現人類食慾激素第2型受體(hOX2R)之細胞
為了取得穩定表現人類食慾激素第2型受體之細胞純系,將人類食慾激素第2型受體cDNA嵌入pcDNA3.1(+)質體載體(Invitrogen)中,選殖表現人類食慾激素第2型受體(pcDNA3.1(+)/hOX2R)之質體DNA。採用電穿孔法,將質體DNA引入CHO-dhfr細胞中,使用G418藥物抗性作為選拔標記,使用限制稀釋法得到表現人類食慾激素第2型受體之純系細胞。
實驗實施例2:食慾激素第2型受體促效劑活性之測定
將強制表現人類OX2受體之CHO細胞接種在384孔黑色透明底板(BD Falcon)之各孔中,7,500個胞/孔,於37℃之5% CO2培養箱中培養一天。排除細胞板中之培養基後,添加分析緩衝液A,其包含鈣指示劑(HBSS(Thermo Fisher Scientific)、20mM HEPES(Thermo Fisher Scientific)、0.1% BSA(Sigma-Aldrich)、2.5μg/mL Fluo-4 AM(DOJINDO Chemical)、0.08% Pluronic F127(DOJINDO Chemical)、1.25mM丙磺舒(probenecid)(DOJINDO Chemical)),30μL/孔。細胞板係於37℃之5% CO2培養箱中靜置30min,再於室溫下靜置30min。添加經過分析緩衝液B(HBSS、20mM HEPES、0.1% BSA)稀釋製成之試驗化合物,10μL/孔,採用FDSSμCELL(Hamamatsu Photonics K.K.)測定螢光值,每秒一次共1min,然後每2秒一次共1分40秒。試驗化合物之活性(%)之計算法係假設改添加DMSO替代試驗化合物時之螢光值變化為0%並當添加最終濃度10nM之食慾激素A(人類)(PEPTIDE INSTITUTE,INC.)時之螢光值變化為100%。各化合物在濃度3μM時之活性示於表2。如結果所示,本發明化合物顯示對人類食慾激素第2型受體具有促效劑活性。
實驗實施例3:分析微粒體於人類中之穩定性
人類肝微粒體係購自Xenotech,LLC(Lenexa,KS)。培養混合物係由含在50mmol/L KH2PO4-K2HPO4磷酸鹽緩衝液(pH 7.4)中之微粒體及1μmol/L試驗化合物組成。微粒體蛋白質濃度為0.2mg/mL。在培養混合物中添加NADPH-生成系統(5mmol/L MgCl2、5mmol/L葡萄糖-6-磷酸、0.5mmol/L β-NADP+及1.5單位/mL葡萄糖-6-磷酸脫氫酶),使用一半體
積之反應混合物啟動酵素反應。在啟動反應15分鐘及30分鐘後,由反應混合物及乙腈混合來終止反應,然後於2500rpm下離心10min。將上清液進行LC/MS/MS分析。以殘留速率-時間圖之斜率計算代謝速率常數。由初始代謝速率常數除以培養混合物中之微粒體蛋白質,計算活體外內因性代謝清除率。結果示於表3。
實驗實施例4:在食蟹獼猴中分析促進清醒效果
測定食蟹獼猴之心電圖(EEG)及心肌圖(EMG),分析促進清醒效果。雄性食蟹獼猴(3-5歲,Hamri Co.,Ltd.,Ibaraki,Japan)在異氟醚(isoflurane)麻醉下(1-5%,Pfizer Japan Inc.,Tokyo,Japan),經過手術植入無線電遙測發射器(TL10M3-D70-EEE,Data Sciences International Inc.,MN,USA)。將EEG電極釘入頭骨頂部區。EMG電極係植入頸部肌肉。手術後,每隻猴子每天接受青黴素(100,000單位/隻,肌內,Meiji Seika Pharma Co.,Ltd.,Tokyo,Japan)、丁基原啡因(buprenorphine)(0.02mg/kg,肌內,Otsuka Pharmaceutical Co.,Ltd.,Tokyo,Japan)及培尼皮質醇(prednisolone)(1mg/kg,皮下,Kyoritsu Seiyaku Co.,Ltd.,Tokyo,Japan)歷時一週。送回籠內至少經過1個月恢復期後,猴子習慣置於隔音室中之記錄箱。EEG及EMG訊號係採用遙測系統記錄(Dataquest ART軟體,Data Sciences International Inc.,MN,USA)並使用睡眠徵兆軟體(Sleep Sign software)(Kissei Comtec Co.,Ltd.,Nagano,Japan)分析訊號。在實驗室中證實在黑暗期的長睡眠後,申請者等利用動物檢測化合物促進清醒之效果。
在交叉試驗設計或前後測試設計(pre-post design)(n=1-4)中,將懸浮於0.5%甲基纖維素水溶液之口服用試驗化合物(3或10mg/kg)或媒劑(亦即,0.5%甲基纖維素水溶液)在定時器時間(zeitgeber time)12(ZT12)經口投予(p.o.)猴子,體積為5mL/kg體重。在投予化合物4h後,記錄EEG及EMG。利用睡眠徵兆(SleepSign),計算投藥後之清醒時間歷時4小時(媒劑處理組之%)。結果示於表4。
前後測試設計(pre-post design)(n=1-2)中,將溶於包含5% DMSO、5% Cremophor EL、20% PEG400及70% soluplus(1%(w/v))之混合溶液
中之非經腸式試驗化合物(0.1或0.3mg/kg)或媒劑(亦即,包含5% DMSO、5% Cremophor EL、20% PEG400及70% soluplus(1%(w/v)之混合溶液)經皮下(s.c.)在ZT12投予猴子,體積為0.5mL/kg體重。在投予化合物後記錄EEG及EMG歷時4h。利用睡眠癥兆(SleepSign),計算投藥後之清醒時間歷時4h(媒劑處理組之%)。結果示於表5。
由表4及表5可見,本發明試驗化合物可在食蟹獼猴中,比媒劑處理組延長清醒時間。換言之,此等化合物被認為是猝睡症之潛在醫療劑。
調配物實施例1(膠囊製法)
將1)、2)、3)及4)混合,填入明膠膠囊中。
調配物實施例2(錠劑製法)
將1)、2)及3)之總量及30g 4)加水捏拌,真空乾燥及過篩。過篩後之粉末與14g 4)及1g 5)混合,混合物經過打錠劑壓錠。依此方式,得到1000錠,每錠包含30mg實施例1化合物。
工業應用
本發明化合物具有食慾激素第2型受體促效劑活性,適用為預防或治療猝睡症之製劑。
本申請係依據2019年1月31日在日本申請之專利申請案案號2019-015488,並且其完整揭示內容以引用之方式併入本文中。
Claims (20)
- 一種式(I)代表之化合物或其鹽,
- 如申請專利範圍第1項所述之化合物或其鹽,其中,R1為(1)C1-6烷基、(2)單-或二-C1-6烷基胺基、或(3)C3-6環烷基;R2為(1)氫原子、或(2)氟原子;R3為(1)視需要經1至3個羥基取代之C1-6烷基-羰基,(2)視需要經1至3個選自下列取代基取代之C3-10環烷基-羰基,其中,該C3-10環烷基-羰基之C3-10環烷基部分視需要經橋接,(a)鹵原子、及(b)羥基, (3)3-至8-員單環非芳香族雜環基羰基,或(4)單-或二-C1-6烷基-胺甲醯基;及A環為更經1個視需要經1至3個選自下列取代基取代之C6-14芳基所取代的苯環,(i)鹵原子、及(ii)視需要經鹵化之C1-6烷基,並且該苯環視需要更經1至3個鹵原子取代。
- 如申請專利範圍第1項所述之化合物或其鹽,其中R1為(1)C1-6烷基、或(2)單-或二-C1-6烷基胺基;R2為(1)氫原子、或(2)氟原子;R3為(1)視需要經1至3個羥基取代之C1-6烷基-羰基、(2)3-至8-員單環非芳香族雜環基羰基、或(3)單-或二-C1-6烷基-胺甲醯基;及A環為更經1個視需要經1至3個選自下列取代基取代之C6-14芳基所取代的苯環,(i)鹵原子、及(ii)C1-6烷基,並且 該苯環視需要更經1至3個鹵原子取代。
- 一種化合物或其鹽,該化合物係N'-{(2S,3R,4S)-1-(氮雜環丁烷-1-羰基)-4-氟-2-[(2-氟-3'-甲基[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}-N,N-二甲基硫醯二胺。
- 一種化合物或其鹽,該化合物係N-[(2S,3R)-2-[(2,3'-二氟[1,1'-聯苯]-3-基)甲基]-4,4-二氟-1-(2-甲基丙醯基)吡咯啶-3-基]乙磺醯胺。
- 一種化合物或其鹽,該化合物係N-{(2S,3R)-4,4-二氟-1-(2-羥基-2-甲基丙醯基)-2-[(2,3',5'-三氟[1,1'-聯苯]-3-基)甲基]吡咯啶-3-基}乙磺醯胺。
- 一種醫藥,係包含申請專利範圍第1至6項中任一項所述之化合物或其鹽。
- 如申請專利範圍第7項所述之醫藥,係食慾激素(orexin)第2型受體促效劑。
- 如申請專利範圍第7項所述之醫藥,係用作為治療猝睡症、特異性嗜睡症、嗜睡症、睡眠呼吸暫停症候群、伴隨類似猝睡症症狀之猝睡症候群、伴隨白天嗜睡之嗜睡症候群、阿茲海默症、肥胖症、胰島素抗性症候群、心臟衰竭、骨質流失相關之疾病、敗血症、意識障礙、以及麻醉藥拮抗劑造成之副作用及併發症之製劑,或者該醫藥是用作為麻醉拮抗劑的製劑。
- 如申請專利範圍第7項所述之醫藥,係用作為治療猝睡症、特異性嗜睡症、嗜睡症或睡眠呼吸暫停症候群之製劑。
- 如申請專利範圍第7項所述之醫藥,係用作為治療猝睡症之製劑。
- 一種申請專利範圍第7項所述之醫藥的用途,該醫藥係用以製造用於治療與食慾激素第2型受體相關的疾病或病症之製劑。
- 一種申請專利範圍第7項所述之醫藥的用途,其係用以製造用於治療猝睡症、特異性嗜睡症、嗜睡症、睡眠呼吸暫停症候群、伴隨類似猝睡症症狀之猝睡症候群、伴隨白天嗜睡之嗜睡症候群、阿茲海默症、肥胖症、胰島素抗性症候群、心臟衰竭、骨質流失相關之疾病、敗血症、意識障礙、以及麻醉藥拮抗劑造成之副作用及併發症之製劑,或者是用作為麻醉拮抗劑之製劑。
- 如申請專利範圍第13項所述之用途,其中該製劑係用於治療猝睡症、特異性嗜睡症、嗜睡症或睡眠呼吸暫停症候群。
- 如申請專利範圍第14項所述之用途,其中該製劑係用於治療猝睡症。
- 如申請專利範圍第1至6項中任一項所述之化合物或其鹽,其係用以製造用於治療猝睡症之醫藥。
- 一種申請專利範圍第1至6項中任一項所述之化合物或其鹽的用途,其係用以製造用於治療猝睡症之製劑。
- 一種申請專利範圍第1至6項中任一項所述之化合物或其鹽的用途,其係用以製造用於治療與食慾激素第2型受體相關的疾病或病症的製劑。
- 如申請專利範圍第18項所述之用途,其中該疾病或病症係選自猝睡症、特異性嗜睡症、嗜睡症、睡眠呼吸暫停症候群、伴隨類似猝睡症症狀之猝睡症候群、伴隨白天嗜睡之嗜睡症候群、阿茲海默症、肥胖症、胰島素抗性症候群、心臟衰竭、骨質流失相關之疾病、敗血症、意識障礙、以及麻醉藥拮抗劑造成之副作用及併發症,或者該醫藥是用作為麻醉拮抗劑的製劑。
- 如申請專利範圍第18項所述之用途,其中該疾病或病症係選自猝睡症、特異性嗜睡症、嗜睡症及睡眠呼吸暫停症候群。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2019015488 | 2019-01-31 | ||
| JP2019-015488 | 2019-01-31 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| TW202043196A TW202043196A (zh) | 2020-12-01 |
| TWI832962B true TWI832962B (zh) | 2024-02-21 |
Family
ID=69770989
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| TW109102825A TWI832962B (zh) | 2019-01-31 | 2020-01-30 | 雜環化合物及其用途 |
Country Status (21)
| Country | Link |
|---|---|
| US (4) | US11028048B2 (zh) |
| EP (1) | EP3917616A1 (zh) |
| JP (2) | JP7253640B2 (zh) |
| KR (1) | KR20210121080A (zh) |
| CN (6) | CN118271297A (zh) |
| AR (1) | AR117916A1 (zh) |
| AU (1) | AU2020215380A1 (zh) |
| BR (1) | BR112021014180A2 (zh) |
| CA (1) | CA3124536A1 (zh) |
| CL (1) | CL2021001973A1 (zh) |
| CO (1) | CO2021011188A2 (zh) |
| EA (1) | EA202192138A1 (zh) |
| EC (1) | ECSP21056325A (zh) |
| IL (1) | IL284073A (zh) |
| MX (1) | MX2021008241A (zh) |
| PE (1) | PE20211700A1 (zh) |
| PH (1) | PH12021551846A1 (zh) |
| SG (1) | SG11202106791XA (zh) |
| TW (1) | TWI832962B (zh) |
| WO (1) | WO2020158958A1 (zh) |
| ZA (1) | ZA202106304B (zh) |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BR112022009938A2 (pt) | 2019-11-25 | 2022-09-13 | Alkermes Inc | Compostos macrocíclicos substituídos e métodos de tratamento relacionados |
| JPWO2021106975A1 (zh) | 2019-11-27 | 2021-06-03 | ||
| CA3189908A1 (en) | 2020-08-18 | 2022-02-24 | Stephane L. Bogen | Bicycloheptane pyrrolidine orexin receptor agonists |
| US20230271973A1 (en) * | 2020-09-03 | 2023-08-31 | Orexia Therapeutics Limited | Bicyclic-heterocycle derivatives and their uses as orexin-2 receptor agonists |
| US20230331720A1 (en) * | 2020-09-03 | 2023-10-19 | Orexia Therapeutics Limited | Medium- or macro-cyclic benzyl-substituted heterocycle derivatives and their uses as orexin-2 receptor agonists |
| CA3196901A1 (en) * | 2020-11-02 | 2022-05-05 | Kira A. Armacost | Macrocyclic urea orexin receptor agonists |
| US11760747B2 (en) | 2020-12-21 | 2023-09-19 | Alkermes, Inc. | Substituted piperidino compounds and related methods of treatment |
| US12006330B2 (en) | 2020-12-21 | 2024-06-11 | Alkermes, Inc. | Substituted macrocyclic compounds and related methods of treatment |
| WO2022207935A1 (en) * | 2021-04-02 | 2022-10-06 | Orexia Therapeutics Limited | 2-(3-ethynylbenzyl)-substituted heterocycle derivatives as orexin-2 agonists |
| JP2024511676A (ja) | 2021-04-02 | 2024-03-14 | 武田薬品工業株式会社 | 術後回復のためのオレキシン2受容体アゴニストの使用 |
| KR20240157067A (ko) | 2022-03-01 | 2024-10-31 | 센테사 파마슈티칼스 (유케이) 리미티드 | 미디엄- 또는 마크로-시클릭 벤질-치환된 헤테로사이클 유도체 및 관련 용도 |
| WO2023199091A1 (en) | 2022-04-12 | 2023-10-19 | Takeda Pharmaceutical Company Limited | Heterocyclic compound |
| TW202428580A (zh) | 2022-10-31 | 2024-07-16 | 日商武田藥品工業股份有限公司 | 雜環化合物 |
| WO2024095158A1 (en) | 2022-10-31 | 2024-05-10 | Takeda Pharmaceutical Company Limited | Dosing of orexin type 2 receptor agonists |
| WO2024116086A1 (en) | 2022-11-30 | 2024-06-06 | Takeda Pharmaceutical Company Limited | Heterocyclic compound and use thereof |
| TW202430169A (zh) * | 2022-12-16 | 2024-08-01 | 日商第一三共股份有限公司 | 2-氮雜雙環[3.1.1]庚烷化合物 |
| WO2024189597A1 (en) | 2023-03-16 | 2024-09-19 | Takeda Pharmaceutical Company Limited | Macrocyclic heterocycle compounds and use thereof |
| WO2024246867A1 (en) | 2023-06-02 | 2024-12-05 | Takeda Pharmaceutical Company Limited | Use of an orexin 2 receptor agonist for improving respiratory function during sleep |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012137982A2 (en) * | 2011-04-05 | 2012-10-11 | Takeda Pharmaceutical Company Limited | Sulfonamide derivative and use thereof |
| WO2017135306A1 (en) * | 2016-02-04 | 2017-08-10 | Takeda Pharmaceutical Company Limited | Substituted piperidine compound and use thereof |
| WO2019027058A1 (en) * | 2017-08-03 | 2019-02-07 | Takeda Pharmaceutical Company Limited | HETEROCYCLIC COMPOUND AND USE THEREOF |
Family Cites Families (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6166193A (en) | 1997-07-25 | 2000-12-26 | Board Of Regents, University Of Texas System | Polynucleotides encoding MY1 receptor |
| EP1194449B1 (en) | 1999-06-28 | 2010-09-22 | Oklahoma Medical Research Foundation | Inhibitors of memapsin 2 and use thereof |
| WO2001008720A2 (en) | 1999-07-30 | 2001-02-08 | The Board Of Trustees Of The Leland Stanford Junior University | Hypocretin and hypocretin receptors in regulation of sleep and related disorders |
| US7112566B1 (en) | 1999-09-17 | 2006-09-26 | The Regents Of The University Of California | Systemic administration of Hypocretin-1 |
| US6204245B1 (en) | 1999-09-17 | 2001-03-20 | The Regents Of The University Of California | Treatment of narcolepsy with immunosuppressants |
| WO2001074162A1 (en) | 2000-04-04 | 2001-10-11 | The Regents Of The University Of California | Treatment of sleep disorders with hypocretin-1 |
| AU2003300776A1 (en) | 2002-09-09 | 2004-05-25 | Omeros Corporation | G protein coupled receptors and uses thereof |
| US20080260744A1 (en) | 2002-09-09 | 2008-10-23 | Omeros Corporation | G protein coupled receptors and uses thereof |
| WO2004054510A2 (en) | 2002-12-13 | 2004-07-01 | Janssen Pharmaceutica N.V. | Method for identifying modulators of human orexin-2 receptor |
| HUP0304101A3 (en) * | 2003-12-22 | 2008-10-28 | Sanofi Aventis | Pyrazole derivatives, process for producing them, their use, pharmaceutical compositions containing them and their intermediates |
| UY30284A1 (es) | 2006-04-14 | 2007-11-30 | Abbott Gmbh & Amp | Compuestos de ariloxietilamina apropiados para tratar trastornos que responden a la modulacion del receptor de dopamina d3 |
| AU2012200270A1 (en) * | 2007-05-23 | 2012-02-09 | Merck Sharp & Dohme Corp. | Pyridyl piperidine orexin receptor antagonists |
| WO2009049215A1 (en) | 2007-10-10 | 2009-04-16 | Wake Forest University Health Sciences | Methods to reduce the effects of sleep deprivation |
| US8258163B2 (en) | 2008-06-04 | 2012-09-04 | Board Of Regents, The University Of Texas System | Small-molecule agonists for type-2 orexin receptor |
| TW201341380A (zh) * | 2012-04-05 | 2013-10-16 | Takeda Pharmaceutical | 磺醯胺衍生物及其用途 |
| WO2014057435A1 (en) | 2012-10-10 | 2014-04-17 | Actelion Pharmaceuticals Ltd | Orexin receptor antagonists which are [ortho bi (hetero )aryl]-[2-(meta bi (hetero )aryl)-pyrrolidin-1-yl]-methanone derivatives |
| WO2014170343A1 (en) | 2013-04-15 | 2014-10-23 | Icm (Institut Du Cerveau Et De La Moelle Épinière) | Depolarizing agents and nicotinic acetylcholine receptor modulators for treating dopaminergic-related disorders |
| WO2014198880A1 (en) | 2013-06-14 | 2014-12-18 | Ferrer Internacional, S.A. | 2-(2-aminophenoxy)-3-chloronaphthalene-1,4-dione compounds having orexin 2 receptor agonist activity |
| US20160250224A1 (en) | 2013-09-24 | 2016-09-01 | The Board Of Regents Of The University Of Texas System | Orexin-control of bone formation and loss |
| EP3068783B1 (en) | 2013-11-15 | 2020-09-23 | The Board of Trustees of the Leland Stanford Junior University | Agonists of hypocretin receptor 2 for use for treating heart failure |
| MX2016007661A (es) | 2013-12-12 | 2017-01-06 | Univ Tsukuba | Derivado de sulfonamida o sales de adicion de acido farmaceuticamente aceptables del mismo. |
| WO2015147240A1 (ja) | 2014-03-28 | 2015-10-01 | 国立大学法人筑波大学 | 敗血症の予防治療剤 |
| TW201613902A (en) * | 2014-08-13 | 2016-04-16 | Eolas Therapeutics Inc | Difluoropyrrolidines as orexin receptor modulators |
| EP3029024A1 (en) | 2014-12-02 | 2016-06-08 | Ferrer Internacional, S.A. | 2-(2-aminophenoxy)-3-chloronaphthalene-1,4-dione compounds having orexin 2 receptor agonist activity |
| JP6746107B2 (ja) | 2015-02-19 | 2020-08-26 | 国立大学法人 筑波大学 | スルホンアミド誘導体またはその薬学的に許容される酸付加塩 |
| WO2016199906A1 (ja) | 2015-06-12 | 2016-12-15 | 国立大学法人筑波大学 | スルホンアミド誘導体またはその薬学的に許容される酸付加塩 |
| WO2017044889A1 (en) | 2015-09-10 | 2017-03-16 | The Regents Of The University Of California | Lrh-1 modulators |
| WO2018164191A1 (ja) | 2017-03-08 | 2018-09-13 | 武田薬品工業株式会社 | 置換ピロリジン化合物およびその用途 |
| EP3594202B1 (en) | 2017-03-08 | 2021-08-11 | Takeda Pharmaceutical Company Limited | Substituted pyrrolidine compound and use thereof |
| WO2019027003A1 (ja) | 2017-08-03 | 2019-02-07 | 武田薬品工業株式会社 | 複素環化合物およびその用途 |
| WO2019112007A1 (ja) | 2017-12-07 | 2019-06-13 | 国立大学法人 筑波大学 | 鎮痛薬による眠気の予防または治療薬 |
| EP3816154A4 (en) | 2018-06-29 | 2022-03-30 | Takeda Pharmaceutical Company Limited | HETEROCYCLIC COMPOUND AND APPLICATION THEREOF |
| WO2020004537A1 (ja) | 2018-06-29 | 2020-01-02 | 武田薬品工業株式会社 | 複素環化合物およびその用途 |
| WO2020122092A1 (ja) | 2018-12-12 | 2020-06-18 | 武田薬品工業株式会社 | 複素環化合物 |
| JP7408569B2 (ja) | 2018-12-12 | 2024-01-05 | 武田薬品工業株式会社 | 複素環化合物 |
| TW202045476A (zh) | 2019-02-13 | 2020-12-16 | 美商默沙東藥廠 | 5-烷基吡咯啶食慾素受體促效劑 |
| WO2020167701A1 (en) | 2019-02-13 | 2020-08-20 | Merck Sharp & Dohme Corp. | Pyrrolidine orexin receptor agonists |
-
2020
- 2020-01-30 TW TW109102825A patent/TWI832962B/zh active
- 2020-01-30 US US16/777,273 patent/US11028048B2/en active Active
- 2020-01-30 BR BR112021014180-4A patent/BR112021014180A2/pt unknown
- 2020-01-30 EP EP20709748.6A patent/EP3917616A1/en active Pending
- 2020-01-30 CN CN202410118961.6A patent/CN118271297A/zh active Pending
- 2020-01-30 PH PH1/2021/551846A patent/PH12021551846A1/en unknown
- 2020-01-30 CN CN202410149044.4A patent/CN118271298A/zh active Pending
- 2020-01-30 CN CN202410143991.2A patent/CN118420600A/zh active Pending
- 2020-01-30 CN CN202410125823.0A patent/CN118344346A/zh active Pending
- 2020-01-30 CA CA3124536A patent/CA3124536A1/en active Pending
- 2020-01-30 WO PCT/JP2020/004444 patent/WO2020158958A1/en active Application Filing
- 2020-01-30 JP JP2021568451A patent/JP7253640B2/ja active Active
- 2020-01-30 CN CN202080011417.1A patent/CN113395993B/zh active Active
- 2020-01-30 US US17/427,490 patent/US20230040770A1/en not_active Abandoned
- 2020-01-30 AR ARP200100236A patent/AR117916A1/es unknown
- 2020-01-30 PE PE2021001139A patent/PE20211700A1/es unknown
- 2020-01-30 KR KR1020217024931A patent/KR20210121080A/ko not_active Application Discontinuation
- 2020-01-30 MX MX2021008241A patent/MX2021008241A/es unknown
- 2020-01-30 EA EA202192138A patent/EA202192138A1/ru unknown
- 2020-01-30 CN CN202410132356.4A patent/CN118290408A/zh active Pending
- 2020-01-30 SG SG11202106791XA patent/SG11202106791XA/en unknown
- 2020-01-30 AU AU2020215380A patent/AU2020215380A1/en active Pending
-
2021
- 2021-04-23 US US17/239,191 patent/US20210276949A1/en not_active Abandoned
- 2021-06-16 IL IL284073A patent/IL284073A/en unknown
- 2021-07-27 CL CL2021001973A patent/CL2021001973A1/es unknown
- 2021-07-30 EC ECSENADI202156325A patent/ECSP21056325A/es unknown
- 2021-08-25 CO CONC2021/0011188A patent/CO2021011188A2/es unknown
- 2021-08-30 ZA ZA2021/06304A patent/ZA202106304B/en unknown
-
2023
- 2023-03-27 JP JP2023050325A patent/JP7502512B2/ja active Active
- 2023-11-27 US US18/520,037 patent/US20240360080A1/en active Pending
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012137982A2 (en) * | 2011-04-05 | 2012-10-11 | Takeda Pharmaceutical Company Limited | Sulfonamide derivative and use thereof |
| WO2017135306A1 (en) * | 2016-02-04 | 2017-08-10 | Takeda Pharmaceutical Company Limited | Substituted piperidine compound and use thereof |
| TW201731817A (zh) * | 2016-02-04 | 2017-09-16 | 武田藥品工業股份有限公司 | 經取代哌啶化合物及其用途 |
| WO2019027058A1 (en) * | 2017-08-03 | 2019-02-07 | Takeda Pharmaceutical Company Limited | HETEROCYCLIC COMPOUND AND USE THEREOF |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TWI832962B (zh) | 雜環化合物及其用途 | |
| TWI790264B (zh) | 雜環化合物及其用途 | |
| EP3816153B1 (en) | Heterocyclic compound and use thereof | |
| TWI755374B (zh) | 經取代哌啶化合物及其用途 | |
| CN115003670A (zh) | 杂环化合物 | |
| JP7592226B1 (ja) | 複素環化合物 | |
| TW202444345A (zh) | 大環雜環化合物及其用途 | |
| TW202440562A (zh) | 雜環化合物及其用途 | |
| EA048585B1 (ru) | Гетероциклическое соединение и его применение | |
| EA039459B1 (ru) | Гетероциклическое соединение и его применение в качестве средства для лечения заболеваний, связанных с рецептором орексина 2 типа |