TWI748194B - 含有雙環核心部分之新穎lxr調節劑 - Google Patents
含有雙環核心部分之新穎lxr調節劑 Download PDFInfo
- Publication number
- TWI748194B TWI748194B TW108121075A TW108121075A TWI748194B TW I748194 B TWI748194 B TW I748194B TW 108121075 A TW108121075 A TW 108121075A TW 108121075 A TW108121075 A TW 108121075A TW I748194 B TWI748194 B TW I748194B
- Authority
- TW
- Taiwan
- Prior art keywords
- alkyl
- mmol
- alkylene
- compound
- group
- Prior art date
Links
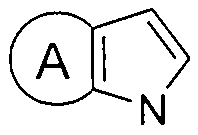
- 125000002619 bicyclic group Chemical group 0.000 title abstract description 8
- 125000000217 alkyl group Chemical group 0.000 claims description 271
- 150000001875 compounds Chemical class 0.000 claims description 264
- -1 bicyclo[1.1.1]pentyl Chemical group 0.000 claims description 124
- 125000001424 substituent group Chemical group 0.000 claims description 114
- 229910052739 hydrogen Inorganic materials 0.000 claims description 82
- 150000003839 salts Chemical class 0.000 claims description 47
- 229910052799 carbon Inorganic materials 0.000 claims description 45
- XOAAWQZATWQOTB-UHFFFAOYSA-N taurine Chemical compound NCCS(O)(=O)=O XOAAWQZATWQOTB-UHFFFAOYSA-N 0.000 claims description 43
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 claims description 42
- 229910002091 carbon monoxide Inorganic materials 0.000 claims description 42
- 125000006297 carbonyl amino group Chemical group [H]N([*:2])C([*:1])=O 0.000 claims description 40
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 38
- 201000010099 disease Diseases 0.000 claims description 36
- 238000011282 treatment Methods 0.000 claims description 34
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 31
- 230000000694 effects Effects 0.000 claims description 25
- 208000008338 non-alcoholic fatty liver disease Diseases 0.000 claims description 25
- 239000004471 Glycine Substances 0.000 claims description 21
- 229910052731 fluorine Inorganic materials 0.000 claims description 21
- 229960003080 taurine Drugs 0.000 claims description 21
- 206010028980 Neoplasm Diseases 0.000 claims description 20
- 229910052801 chlorine Inorganic materials 0.000 claims description 19
- 125000004076 pyridyl group Chemical group 0.000 claims description 19
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 claims description 18
- 201000011510 cancer Diseases 0.000 claims description 16
- 231100000240 steatosis hepatitis Toxicity 0.000 claims description 15
- 208000001072 type 2 diabetes mellitus Diseases 0.000 claims description 15
- 125000001544 thienyl group Chemical group 0.000 claims description 14
- 239000003814 drug Substances 0.000 claims description 13
- 206010053219 non-alcoholic steatohepatitis Diseases 0.000 claims description 12
- 208000019425 cirrhosis of liver Diseases 0.000 claims description 11
- 239000003862 glucocorticoid Substances 0.000 claims description 11
- 230000007863 steatosis Effects 0.000 claims description 11
- 238000006467 substitution reaction Methods 0.000 claims description 11
- 229910052794 bromium Inorganic materials 0.000 claims description 10
- 206010022489 Insulin Resistance Diseases 0.000 claims description 9
- 208000001145 Metabolic Syndrome Diseases 0.000 claims description 9
- 201000000690 abdominal obesity-metabolic syndrome Diseases 0.000 claims description 9
- 208000006454 hepatitis Diseases 0.000 claims description 9
- 230000007774 longterm Effects 0.000 claims description 9
- 239000008194 pharmaceutical composition Substances 0.000 claims description 9
- 208000035150 Hypercholesterolemia Diseases 0.000 claims description 8
- 208000008589 Obesity Diseases 0.000 claims description 8
- 231100000283 hepatitis Toxicity 0.000 claims description 8
- 208000010710 hepatitis C virus infection Diseases 0.000 claims description 8
- 235000020824 obesity Nutrition 0.000 claims description 8
- 208000011580 syndromic disease Diseases 0.000 claims description 8
- 206010047470 viral myocarditis Diseases 0.000 claims description 8
- 208000000563 Hyperlipoproteinemia Type II Diseases 0.000 claims description 7
- 102100024640 Low-density lipoprotein receptor Human genes 0.000 claims description 7
- 206010045261 Type IIa hyperlipidaemia Diseases 0.000 claims description 7
- 201000001386 familial hypercholesterolemia Diseases 0.000 claims description 7
- 208000017169 kidney disease Diseases 0.000 claims description 7
- 206010039073 rheumatoid arthritis Diseases 0.000 claims description 7
- 208000022559 Inflammatory bowel disease Diseases 0.000 claims description 6
- 208000006673 asthma Diseases 0.000 claims description 6
- 229940079593 drug Drugs 0.000 claims description 6
- 125000001475 halogen functional group Chemical group 0.000 claims description 6
- 230000002265 prevention Effects 0.000 claims description 6
- 230000001476 alcoholic effect Effects 0.000 claims description 5
- 230000000747 cardiac effect Effects 0.000 claims description 5
- 238000004519 manufacturing process Methods 0.000 claims description 5
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims description 4
- 125000001624 naphthyl group Chemical group 0.000 claims description 4
- 125000000714 pyrimidinyl group Chemical group 0.000 claims description 4
- 150000003536 tetrazoles Chemical class 0.000 claims description 4
- 238000002560 therapeutic procedure Methods 0.000 claims description 4
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 claims description 3
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 3
- 125000003386 piperidinyl group Chemical group 0.000 claims description 3
- 125000000335 thiazolyl group Chemical group 0.000 claims description 3
- 239000003607 modifier Substances 0.000 claims description 2
- 230000003412 degenerative effect Effects 0.000 claims 1
- 102000004311 liver X receptors Human genes 0.000 abstract description 141
- 108090000865 liver X receptors Proteins 0.000 abstract description 141
- 239000000556 agonist Substances 0.000 abstract description 54
- 150000002475 indoles Chemical class 0.000 abstract description 6
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 abstract description 3
- 239000000203 mixture Substances 0.000 description 201
- 239000000243 solution Substances 0.000 description 127
- 239000007787 solid Substances 0.000 description 108
- 239000012044 organic layer Substances 0.000 description 97
- 239000011734 sodium Substances 0.000 description 93
- 239000012267 brine Substances 0.000 description 80
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 80
- 125000000753 cycloalkyl group Chemical group 0.000 description 72
- 125000003118 aryl group Chemical group 0.000 description 69
- 238000002360 preparation method Methods 0.000 description 66
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 65
- 125000001820 oxy group Chemical group [*:1]O[*:2] 0.000 description 65
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 62
- 229910052736 halogen Inorganic materials 0.000 description 59
- 150000002367 halogens Chemical group 0.000 description 59
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 57
- 125000001072 heteroaryl group Chemical group 0.000 description 50
- 239000000460 chlorine Substances 0.000 description 46
- 125000005842 heteroatom Chemical group 0.000 description 46
- 125000002947 alkylene group Chemical group 0.000 description 44
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 43
- 229910052760 oxygen Inorganic materials 0.000 description 42
- 229910052717 sulfur Inorganic materials 0.000 description 42
- WYURNTSHIVDZCO-UHFFFAOYSA-N tetrahydrofuran Substances C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 36
- 238000005160 1H NMR spectroscopy Methods 0.000 description 33
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 31
- 210000004185 liver Anatomy 0.000 description 29
- 238000002953 preparative HPLC Methods 0.000 description 27
- ZOGILNJYZCGBQL-UHFFFAOYSA-N 2-(4-bromophenyl)-2-trimethylsilyloxypropanenitrile Chemical compound C[Si](C)(C)OC(C)(C#N)C1=CC=C(Br)C=C1 ZOGILNJYZCGBQL-UHFFFAOYSA-N 0.000 description 26
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 26
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 26
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 26
- 229910052757 nitrogen Inorganic materials 0.000 description 26
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 25
- SIKJAQJRHWYJAI-UHFFFAOYSA-N benzopyrrole Natural products C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 25
- 239000002904 solvent Substances 0.000 description 25
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-dimethylformamide Substances CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 23
- 210000004027 cell Anatomy 0.000 description 23
- 239000003921 oil Substances 0.000 description 23
- 239000007858 starting material Substances 0.000 description 23
- 229920006395 saturated elastomer Polymers 0.000 description 22
- 238000003756 stirring Methods 0.000 description 22
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 20
- 239000005557 antagonist Substances 0.000 description 19
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 18
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 18
- 108090000623 proteins and genes Proteins 0.000 description 18
- 238000004809 thin layer chromatography Methods 0.000 description 18
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 17
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 17
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 17
- 239000000651 prodrug Substances 0.000 description 17
- 229940002612 prodrug Drugs 0.000 description 17
- 230000002829 reductive effect Effects 0.000 description 17
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 16
- 125000004122 cyclic group Chemical group 0.000 description 16
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 15
- 238000004458 analytical method Methods 0.000 description 15
- 229940125904 compound 1 Drugs 0.000 description 15
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 14
- 239000002253 acid Substances 0.000 description 14
- 239000000543 intermediate Substances 0.000 description 14
- 239000002585 base Substances 0.000 description 13
- 238000000034 method Methods 0.000 description 13
- 238000000746 purification Methods 0.000 description 13
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 12
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 12
- 125000002252 acyl group Chemical group 0.000 description 12
- 239000012230 colorless oil Substances 0.000 description 12
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical group C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 12
- 239000003112 inhibitor Substances 0.000 description 12
- QAEDZJGFFMLHHQ-UHFFFAOYSA-N trifluoroacetic anhydride Chemical compound FC(F)(F)C(=O)OC(=O)C(F)(F)F QAEDZJGFFMLHHQ-UHFFFAOYSA-N 0.000 description 12
- 241001465754 Metazoa Species 0.000 description 11
- 238000006069 Suzuki reaction reaction Methods 0.000 description 11
- 239000012190 activator Substances 0.000 description 11
- 238000006243 chemical reaction Methods 0.000 description 11
- 239000000706 filtrate Substances 0.000 description 11
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 11
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 10
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 10
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 10
- 238000007363 ring formation reaction Methods 0.000 description 10
- QZAYGJVTTNCVMB-UHFFFAOYSA-N serotonin Chemical compound C1=C(O)C=C2C(CCN)=CNC2=C1 QZAYGJVTTNCVMB-UHFFFAOYSA-N 0.000 description 10
- 239000012453 solvate Substances 0.000 description 10
- 210000001519 tissue Anatomy 0.000 description 10
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 9
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- 239000003054 catalyst Substances 0.000 description 9
- 238000001816 cooling Methods 0.000 description 9
- 125000001041 indolyl group Chemical group 0.000 description 9
- 239000003446 ligand Substances 0.000 description 9
- 230000002441 reversible effect Effects 0.000 description 9
- GQHTUMJGOHRCHB-UHFFFAOYSA-N 2,3,4,6,7,8,9,10-octahydropyrimido[1,2-a]azepine Chemical compound C1CCCCN2CCCN=C21 GQHTUMJGOHRCHB-UHFFFAOYSA-N 0.000 description 8
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 8
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 8
- 229910004809 Na2 SO4 Inorganic materials 0.000 description 8
- 229940024606 amino acid Drugs 0.000 description 8
- 235000001014 amino acid Nutrition 0.000 description 8
- 125000004429 atom Chemical group 0.000 description 8
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 8
- 229910052805 deuterium Inorganic materials 0.000 description 8
- CSJLBAMHHLJAAS-UHFFFAOYSA-N diethylaminosulfur trifluoride Chemical compound CCN(CC)S(F)(F)F CSJLBAMHHLJAAS-UHFFFAOYSA-N 0.000 description 8
- 230000001404 mediated effect Effects 0.000 description 8
- AQRLNPVMDITEJU-UHFFFAOYSA-N triethylsilane Chemical compound CC[SiH](CC)CC AQRLNPVMDITEJU-UHFFFAOYSA-N 0.000 description 8
- DTQVDTLACAAQTR-UHFFFAOYSA-N trifluoroacetic acid Substances OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 8
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 8
- 125000006584 (C3-C10) heterocycloalkyl group Chemical group 0.000 description 7
- 206010019708 Hepatic steatosis Diseases 0.000 description 7
- 150000001413 amino acids Chemical class 0.000 description 7
- 235000010290 biphenyl Nutrition 0.000 description 7
- 125000004432 carbon atom Chemical group C* 0.000 description 7
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 7
- 239000012141 concentrate Substances 0.000 description 7
- 125000000623 heterocyclic group Chemical group 0.000 description 7
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 6
- PSOXOVKYGWBTPB-UHFFFAOYSA-N 2,4,6-trimethyl-n-[[4-(3-methylsulfonylphenyl)phenyl]methyl]-n-[[5-(trifluoromethyl)furan-2-yl]methyl]benzenesulfonamide Chemical compound CC1=CC(C)=CC(C)=C1S(=O)(=O)N(CC=1C=CC(=CC=1)C=1C=C(C=CC=1)S(C)(=O)=O)CC1=CC=C(C(F)(F)F)O1 PSOXOVKYGWBTPB-UHFFFAOYSA-N 0.000 description 6
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 6
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Substances BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 6
- YHIPILPTUVMWQT-UHFFFAOYSA-N Oplophorus luciferin Chemical compound C1=CC(O)=CC=C1CC(C(N1C=C(N2)C=3C=CC(O)=CC=3)=O)=NC1=C2CC1=CC=CC=C1 YHIPILPTUVMWQT-UHFFFAOYSA-N 0.000 description 6
- 150000007513 acids Chemical class 0.000 description 6
- 150000001335 aliphatic alkanes Chemical group 0.000 description 6
- 239000000872 buffer Substances 0.000 description 6
- 150000002148 esters Chemical class 0.000 description 6
- 230000014509 gene expression Effects 0.000 description 6
- 238000001727 in vivo Methods 0.000 description 6
- 235000018102 proteins Nutrition 0.000 description 6
- 102000004169 proteins and genes Human genes 0.000 description 6
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 6
- FVAUCKIRQBBSSJ-UHFFFAOYSA-M sodium iodide Chemical compound [Na+].[I-] FVAUCKIRQBBSSJ-UHFFFAOYSA-M 0.000 description 6
- 230000002103 transcriptional effect Effects 0.000 description 6
- CTPUUDQIXKUAMO-UHFFFAOYSA-N 1-bromo-3-iodobenzene Chemical compound BrC1=CC=CC(I)=C1 CTPUUDQIXKUAMO-UHFFFAOYSA-N 0.000 description 5
- BAXOFTOLAUCFNW-UHFFFAOYSA-N 1H-indazole Chemical compound C1=CC=C2C=NNC2=C1 BAXOFTOLAUCFNW-UHFFFAOYSA-N 0.000 description 5
- 125000001313 C5-C10 heteroaryl group Chemical group 0.000 description 5
- 239000007821 HATU Substances 0.000 description 5
- 241000699670 Mus sp. Species 0.000 description 5
- LQZMLBORDGWNPD-UHFFFAOYSA-N N-iodosuccinimide Substances IN1C(=O)CCC1=O LQZMLBORDGWNPD-UHFFFAOYSA-N 0.000 description 5
- 150000001204 N-oxides Chemical class 0.000 description 5
- 108020005497 Nuclear hormone receptor Proteins 0.000 description 5
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 5
- 229940125782 compound 2 Drugs 0.000 description 5
- 229940126214 compound 3 Drugs 0.000 description 5
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 5
- HDZWHJYZJWLTAG-UHFFFAOYSA-N ethyl 5-[[[4-(3-methylsulfonylphenyl)phenyl]methyl-(2,4,6-trimethylphenyl)sulfonylamino]methyl]furan-2-carboxylate Chemical compound O1C(C(=O)OCC)=CC=C1CN(S(=O)(=O)C=1C(=CC(C)=CC=1C)C)CC1=CC=C(C=2C=C(C=CC=2)S(C)(=O)=O)C=C1 HDZWHJYZJWLTAG-UHFFFAOYSA-N 0.000 description 5
- 239000011737 fluorine Substances 0.000 description 5
- 108020001756 ligand binding domains Proteins 0.000 description 5
- 239000002609 medium Substances 0.000 description 5
- 102000006255 nuclear receptors Human genes 0.000 description 5
- 108020004017 nuclear receptors Proteins 0.000 description 5
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 5
- 102000005962 receptors Human genes 0.000 description 5
- 108020003175 receptors Proteins 0.000 description 5
- 239000000758 substrate Substances 0.000 description 5
- 229940124530 sulfonamide Drugs 0.000 description 5
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 5
- 125000006570 (C5-C6) heteroaryl group Chemical group 0.000 description 4
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 4
- RNIRKEQGYHHNSE-UHFFFAOYSA-N 3-bromothiophene-2-carbonitrile Chemical compound BrC=1C=CSC=1C#N RNIRKEQGYHHNSE-UHFFFAOYSA-N 0.000 description 4
- ZLYBFBAHAQEEQQ-UHFFFAOYSA-N 4-chlorobenzenesulfonyl chloride Chemical compound ClC1=CC=C(S(Cl)(=O)=O)C=C1 ZLYBFBAHAQEEQQ-UHFFFAOYSA-N 0.000 description 4
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 4
- JGLMVXWAHNTPRF-CMDGGOBGSA-N CCN1N=C(C)C=C1C(=O)NC1=NC2=CC(=CC(OC)=C2N1C\C=C\CN1C(NC(=O)C2=CC(C)=NN2CC)=NC2=CC(=CC(OCCCN3CCOCC3)=C12)C(N)=O)C(N)=O Chemical compound CCN1N=C(C)C=C1C(=O)NC1=NC2=CC(=CC(OC)=C2N1C\C=C\CN1C(NC(=O)C2=CC(C)=NN2CC)=NC2=CC(=CC(OCCCN3CCOCC3)=C12)C(N)=O)C(N)=O JGLMVXWAHNTPRF-CMDGGOBGSA-N 0.000 description 4
- YYNVYPKEZRSBDZ-UHFFFAOYSA-N CN(C)CC(C=C1)=CC(Cl)=C1C1=CC(C2=C(C3=C(C#N)SC=C3)C3=CC(F)=CC=C3N2S(CC2=CC=CC=C2)(=O)=O)=CC=C1 Chemical compound CN(C)CC(C=C1)=CC(Cl)=C1C1=CC(C2=C(C3=C(C#N)SC=C3)C3=CC(F)=CC=C3N2S(CC2=CC=CC=C2)(=O)=O)=CC=C1 YYNVYPKEZRSBDZ-UHFFFAOYSA-N 0.000 description 4
- RWZXAYQIFRDRAL-UHFFFAOYSA-N COC(=O)C1=CC(Cl)=C(C=C1)C1=CC(=CC=C1)C#CC1=CC(F)=CC=C1N Chemical compound COC(=O)C1=CC(Cl)=C(C=C1)C1=CC(=CC=C1)C#CC1=CC(F)=CC=C1N RWZXAYQIFRDRAL-UHFFFAOYSA-N 0.000 description 4
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 4
- YCKRFDGAMUMZLT-UHFFFAOYSA-N Fluorine atom Chemical compound [F] YCKRFDGAMUMZLT-UHFFFAOYSA-N 0.000 description 4
- 102100039556 Galectin-4 Human genes 0.000 description 4
- JGFBQFKZKSSODQ-UHFFFAOYSA-N Isothiocyanatocyclopropane Chemical compound S=C=NC1CC1 JGFBQFKZKSSODQ-UHFFFAOYSA-N 0.000 description 4
- BAPJBEWLBFYGME-UHFFFAOYSA-N Methyl acrylate Chemical compound COC(=O)C=C BAPJBEWLBFYGME-UHFFFAOYSA-N 0.000 description 4
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 4
- 229930182558 Sterol Natural products 0.000 description 4
- 235000011054 acetic acid Nutrition 0.000 description 4
- 239000004480 active ingredient Substances 0.000 description 4
- 229910052786 argon Inorganic materials 0.000 description 4
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 4
- MUALRAIOVNYAIW-UHFFFAOYSA-N binap Chemical compound C1=CC=CC=C1P(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 MUALRAIOVNYAIW-UHFFFAOYSA-N 0.000 description 4
- 210000004369 blood Anatomy 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- 235000012000 cholesterol Nutrition 0.000 description 4
- 230000000052 comparative effect Effects 0.000 description 4
- YMGUBTXCNDTFJI-UHFFFAOYSA-N cyclopropanecarboxylic acid Chemical compound OC(=O)C1CC1 YMGUBTXCNDTFJI-UHFFFAOYSA-N 0.000 description 4
- 239000003937 drug carrier Substances 0.000 description 4
- 238000005516 engineering process Methods 0.000 description 4
- 238000001914 filtration Methods 0.000 description 4
- 239000001257 hydrogen Substances 0.000 description 4
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 4
- 230000003993 interaction Effects 0.000 description 4
- 150000002632 lipids Chemical class 0.000 description 4
- YXGUITPHPCSPCF-UHFFFAOYSA-N methyl 3-(3-bromophenyl)-3-hydroxycyclobutane-1-carboxylate Chemical compound BrC=1C=C(C=CC=1)C1(CC(C1)C(=O)OC)O YXGUITPHPCSPCF-UHFFFAOYSA-N 0.000 description 4
- 108090000765 processed proteins & peptides Proteins 0.000 description 4
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 4
- 238000011160 research Methods 0.000 description 4
- 239000000523 sample Substances 0.000 description 4
- 150000003384 small molecules Chemical class 0.000 description 4
- DAEPDZWVDSPTHF-UHFFFAOYSA-M sodium pyruvate Chemical compound [Na+].CC(=O)C([O-])=O DAEPDZWVDSPTHF-UHFFFAOYSA-M 0.000 description 4
- 150000003432 sterols Chemical class 0.000 description 4
- 235000003702 sterols Nutrition 0.000 description 4
- 239000011550 stock solution Substances 0.000 description 4
- 150000003456 sulfonamides Chemical class 0.000 description 4
- 238000003786 synthesis reaction Methods 0.000 description 4
- 238000003419 tautomerization reaction Methods 0.000 description 4
- BYLLEXWBLRQXMO-UHFFFAOYSA-N tert-butyl 2-(3-bromo-4-cyanophenoxy)acetate Chemical compound BrC=1C=C(OCC(=O)OC(C)(C)C)C=CC=1C#N BYLLEXWBLRQXMO-UHFFFAOYSA-N 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- 238000001890 transfection Methods 0.000 description 4
- ITOFPJRDSCGOSA-KZLRUDJFSA-N (2s)-2-[[(4r)-4-[(3r,5r,8r,9s,10s,13r,14s,17r)-3-hydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-17-yl]pentanoyl]amino]-3-(1h-indol-3-yl)propanoic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H](CC[C@]13C)[C@@H]2[C@@H]3CC[C@@H]1[C@H](C)CCC(=O)N[C@H](C(O)=O)CC1=CNC2=CC=CC=C12 ITOFPJRDSCGOSA-KZLRUDJFSA-N 0.000 description 3
- 125000006590 (C2-C6) alkenylene group Chemical group 0.000 description 3
- 125000006591 (C2-C6) alkynylene group Chemical group 0.000 description 3
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 3
- OZAIFHULBGXAKX-UHFFFAOYSA-N 2-(2-cyanopropan-2-yldiazenyl)-2-methylpropanenitrile Chemical compound N#CC(C)(C)N=NC(C)(C)C#N OZAIFHULBGXAKX-UHFFFAOYSA-N 0.000 description 3
- LWISLHRIEATKTM-UHFFFAOYSA-N 2-Ethynylthiophene Chemical compound C#CC1=CC=CS1 LWISLHRIEATKTM-UHFFFAOYSA-N 0.000 description 3
- RISFCKAVNAIMIG-UHFFFAOYSA-N 3-[1-(4-chlorophenyl)sulfonyl-2-phenylindol-3-yl]thiophene-2-carbonitrile Chemical compound ClC1=CC=C(C=C1)S(=O)(=O)N1C(=C(C2=CC=CC=C12)C1=C(SC=C1)C#N)C1=CC=CC=C1 RISFCKAVNAIMIG-UHFFFAOYSA-N 0.000 description 3
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 3
- CXNIUSPIQKWYAI-UHFFFAOYSA-N 4,5-bis(diphenylphosphino)-9,9-dimethyl-xanthene Substances C=12OC3=C(P(C=4C=CC=CC=4)C=4C=CC=CC=4)C=CC=C3C(C)(C)C2=CC=CC=1P(C=1C=CC=CC=1)C1=CC=CC=C1 CXNIUSPIQKWYAI-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 3
- GAIQLRVJJWRRQS-UHFFFAOYSA-N C1CCCC(C1)S(=O)(=O)N1C(=C(C2=CC=CC=C12)C1=C(C#N)SC=C1)C=1SC=CC=1 Chemical compound C1CCCC(C1)S(=O)(=O)N1C(=C(C2=CC=CC=C12)C1=C(C#N)SC=C1)C=1SC=CC=1 GAIQLRVJJWRRQS-UHFFFAOYSA-N 0.000 description 3
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 3
- FYJDXUOZTOGMEL-UHFFFAOYSA-N ClC1=C(C=CC(=C1)C(=O)O)C1=CC(=CC=C1)C=1N(C2=CC=C(C=C2C=1C1=C(C=CC=C1)C#N)F)S(=O)(=O)C1=CC=C(C)C=C1 Chemical compound ClC1=C(C=CC(=C1)C(=O)O)C1=CC(=CC=C1)C=1N(C2=CC=C(C=C2C=1C1=C(C=CC=C1)C#N)F)S(=O)(=O)C1=CC=C(C)C=C1 FYJDXUOZTOGMEL-UHFFFAOYSA-N 0.000 description 3
- DVUWOHHRGGEKNE-UHFFFAOYSA-N ClC1=C(C=CC(=C1)C(=O)OC)C1=CC(=CC=C1)C=1N(C2=CC=C(C=C2C=1C1=C(C=CC=C1C)C)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F Chemical compound ClC1=C(C=CC(=C1)C(=O)OC)C1=CC(=CC=C1)C=1N(C2=CC=C(C=C2C=1C1=C(C=CC=C1C)C)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F DVUWOHHRGGEKNE-UHFFFAOYSA-N 0.000 description 3
- FDLLRENJGKXNNP-UHFFFAOYSA-N ClC1=C(C=CC(=C1)C(=O)OC)C1=CC(=CC=C1)C=1N(C2=CC=C(C=C2C=1C1=C(SC=C1)C#N)F)S(=O)(=O)C=1C=NC(=CC=1)C(F)(F)F Chemical compound ClC1=C(C=CC(=C1)C(=O)OC)C1=CC(=CC=C1)C=1N(C2=CC=C(C=C2C=1C1=C(SC=C1)C#N)F)S(=O)(=O)C=1C=NC(=CC=1)C(F)(F)F FDLLRENJGKXNNP-UHFFFAOYSA-N 0.000 description 3
- 229940127007 Compound 39 Drugs 0.000 description 3
- 239000004593 Epoxy Substances 0.000 description 3
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 3
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- 101100280820 Mus musculus Gfus gene Proteins 0.000 description 3
- PVBIMDQFSKZCLO-UHFFFAOYSA-N N#CC(SC=C1)=C1C(C1=CC(F)=CC=C11)=C(C2=CC=CC(C(C=CC(C3=NN=NN3)=C3)=C3Cl)=C2)N1S(CC1=CC=CC=C1)(=O)=O Chemical compound N#CC(SC=C1)=C1C(C1=CC(F)=CC=C11)=C(C2=CC=CC(C(C=CC(C3=NN=NN3)=C3)=C3Cl)=C2)N1S(CC1=CC=CC=C1)(=O)=O PVBIMDQFSKZCLO-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 108091027981 Response element Proteins 0.000 description 3
- 230000006682 Warburg effect Effects 0.000 description 3
- YLEIFZAVNWDOBM-ZTNXSLBXSA-N ac1l9hc7 Chemical compound C([C@H]12)C[C@@H](C([C@@H](O)CC3)(C)C)[C@@]43C[C@@]14CC[C@@]1(C)[C@@]2(C)C[C@@H]2O[C@]3(O)[C@H](O)C(C)(C)O[C@@H]3[C@@H](C)[C@H]12 YLEIFZAVNWDOBM-ZTNXSLBXSA-N 0.000 description 3
- 230000000879 anti-atherosclerotic effect Effects 0.000 description 3
- 229940054051 antipsychotic indole derivative Drugs 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 3
- 150000001721 carbon Chemical group 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 229940125810 compound 20 Drugs 0.000 description 3
- 125000002993 cycloalkylene group Chemical group 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- 235000005911 diet Nutrition 0.000 description 3
- FAMRKDQNMBBFBR-BQYQJAHWSA-N diethyl azodicarboxylate Substances CCOC(=O)\N=N\C(=O)OCC FAMRKDQNMBBFBR-BQYQJAHWSA-N 0.000 description 3
- 238000009826 distribution Methods 0.000 description 3
- CCIVGXIOQKPBKL-UHFFFAOYSA-N ethanesulfonic acid Chemical compound CCS(O)(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-N 0.000 description 3
- 230000004761 fibrosis Effects 0.000 description 3
- 235000009200 high fat diet Nutrition 0.000 description 3
- 229940125425 inverse agonist Drugs 0.000 description 3
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 3
- YNESATAKKCNGOF-UHFFFAOYSA-N lithium bis(trimethylsilyl)amide Chemical compound [Li+].C[Si](C)(C)[N-][Si](C)(C)C YNESATAKKCNGOF-UHFFFAOYSA-N 0.000 description 3
- 210000002540 macrophage Anatomy 0.000 description 3
- 108020004999 messenger RNA Proteins 0.000 description 3
- 230000004060 metabolic process Effects 0.000 description 3
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 3
- DUWWHGPELOTTOE-UHFFFAOYSA-N n-(5-chloro-2,4-dimethoxyphenyl)-3-oxobutanamide Chemical compound COC1=CC(OC)=C(NC(=O)CC(C)=O)C=C1Cl DUWWHGPELOTTOE-UHFFFAOYSA-N 0.000 description 3
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 3
- 125000004433 nitrogen atom Chemical group N* 0.000 description 3
- 230000037361 pathway Effects 0.000 description 3
- 230000002093 peripheral effect Effects 0.000 description 3
- 239000012071 phase Substances 0.000 description 3
- 210000002706 plastid Anatomy 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- QLNJFJADRCOGBJ-UHFFFAOYSA-N propionamide Chemical compound CCC(N)=O QLNJFJADRCOGBJ-UHFFFAOYSA-N 0.000 description 3
- 235000019260 propionic acid Nutrition 0.000 description 3
- 239000000376 reactant Substances 0.000 description 3
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 3
- 230000004141 reverse cholesterol transport Effects 0.000 description 3
- 125000003003 spiro group Chemical group 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 125000003107 substituted aryl group Chemical group 0.000 description 3
- 125000005346 substituted cycloalkyl group Chemical group 0.000 description 3
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 3
- JAELLLITIZHOGQ-UHFFFAOYSA-N tert-butyl propanoate Chemical compound CCC(=O)OC(C)(C)C JAELLLITIZHOGQ-UHFFFAOYSA-N 0.000 description 3
- CUPOOAWTRIURFT-UHFFFAOYSA-N thiophene-2-carbonitrile Chemical compound N#CC1=CC=CS1 CUPOOAWTRIURFT-UHFFFAOYSA-N 0.000 description 3
- 238000013518 transcription Methods 0.000 description 3
- 230000035897 transcription Effects 0.000 description 3
- CWMFRHBXRUITQE-UHFFFAOYSA-N trimethylsilylacetylene Chemical compound C[Si](C)(C)C#C CWMFRHBXRUITQE-UHFFFAOYSA-N 0.000 description 3
- 239000003981 vehicle Substances 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical group N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- ASGMFNBUXDJWJJ-JLCFBVMHSA-N (1R,3R)-3-[[3-bromo-1-[4-(5-methyl-1,3,4-thiadiazol-2-yl)phenyl]pyrazolo[3,4-d]pyrimidin-6-yl]amino]-N,1-dimethylcyclopentane-1-carboxamide Chemical compound BrC1=NN(C2=NC(=NC=C21)N[C@H]1C[C@@](CC1)(C(=O)NC)C)C1=CC=C(C=C1)C=1SC(=NN=1)C ASGMFNBUXDJWJJ-JLCFBVMHSA-N 0.000 description 2
- HBENZIXOGRCSQN-VQWWACLZSA-N (1S,2S,6R,14R,15R,16R)-5-(cyclopropylmethyl)-16-[(2S)-2-hydroxy-3,3-dimethylpentan-2-yl]-15-methoxy-13-oxa-5-azahexacyclo[13.2.2.12,8.01,6.02,14.012,20]icosa-8(20),9,11-trien-11-ol Chemical compound N1([C@@H]2CC=3C4=C(C(=CC=3)O)O[C@H]3[C@@]5(OC)CC[C@@]2([C@@]43CC1)C[C@@H]5[C@](C)(O)C(C)(C)CC)CC1CC1 HBENZIXOGRCSQN-VQWWACLZSA-N 0.000 description 2
- GLGNXYJARSMNGJ-VKTIVEEGSA-N (1s,2s,3r,4r)-3-[[5-chloro-2-[(1-ethyl-6-methoxy-2-oxo-4,5-dihydro-3h-1-benzazepin-7-yl)amino]pyrimidin-4-yl]amino]bicyclo[2.2.1]hept-5-ene-2-carboxamide Chemical compound CCN1C(=O)CCCC2=C(OC)C(NC=3N=C(C(=CN=3)Cl)N[C@H]3[C@H]([C@@]4([H])C[C@@]3(C=C4)[H])C(N)=O)=CC=C21 GLGNXYJARSMNGJ-VKTIVEEGSA-N 0.000 description 2
- LAJAFFLJAJMYLK-CVOKMOJFSA-N (1s,2s,3r,4r)-3-[[5-chloro-2-[[(7s)-4-methoxy-7-morpholin-4-yl-6,7,8,9-tetrahydro-5h-benzo[7]annulen-3-yl]amino]pyrimidin-4-yl]amino]bicyclo[2.2.1]hept-5-ene-2-carboxamide Chemical compound N1([C@H]2CCC3=CC=C(C(=C3CC2)OC)NC=2N=C(C(=CN=2)Cl)N[C@H]2[C@H]([C@@]3([H])C[C@@]2(C=C3)[H])C(N)=O)CCOCC1 LAJAFFLJAJMYLK-CVOKMOJFSA-N 0.000 description 2
- STBLNCCBQMHSRC-BATDWUPUSA-N (2s)-n-[(3s,4s)-5-acetyl-7-cyano-4-methyl-1-[(2-methylnaphthalen-1-yl)methyl]-2-oxo-3,4-dihydro-1,5-benzodiazepin-3-yl]-2-(methylamino)propanamide Chemical compound O=C1[C@@H](NC(=O)[C@H](C)NC)[C@H](C)N(C(C)=O)C2=CC(C#N)=CC=C2N1CC1=C(C)C=CC2=CC=CC=C12 STBLNCCBQMHSRC-BATDWUPUSA-N 0.000 description 2
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 2
- WMMVLULSTWDXKF-UHFFFAOYSA-N (4-bromo-2-methylsulfonylphenyl)methanol Chemical compound CS(=O)(=O)C1=CC(Br)=CC=C1CO WMMVLULSTWDXKF-UHFFFAOYSA-N 0.000 description 2
- 125000003161 (C1-C6) alkylene group Chemical group 0.000 description 2
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 description 2
- VICOOSNNZUPVHM-IGPZRPDBSA-M (e,3r,5s)-7-[2-(4-fluorophenyl)-4-(3-phenylpentan-3-yl)phenyl]-3,5-dihydroxyhept-6-enoate Chemical compound C=1C=C(\C=C\[C@@H](O)C[C@@H](O)CC([O-])=O)C(C=2C=CC(F)=CC=2)=CC=1C(CC)(CC)C1=CC=CC=C1 VICOOSNNZUPVHM-IGPZRPDBSA-M 0.000 description 2
- YCGQPIRMLGEWMW-UHFFFAOYSA-N 1-[1-butyl-4-(3-methoxyphenyl)-2-oxo-1,8-naphthyridin-3-yl]-3-[4-[(dimethylamino)methyl]-2,6-di(propan-2-yl)phenyl]urea;hydrochloride Chemical compound Cl.CC(C)C=1C=C(CN(C)C)C=C(C(C)C)C=1NC(=O)NC=1C(=O)N(CCCC)C2=NC=CC=C2C=1C1=CC=CC(OC)=C1 YCGQPIRMLGEWMW-UHFFFAOYSA-N 0.000 description 2
- ONBQEOIKXPHGMB-VBSBHUPXSA-N 1-[2-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]oxy-4,6-dihydroxyphenyl]-3-(4-hydroxyphenyl)propan-1-one Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1OC1=CC(O)=CC(O)=C1C(=O)CCC1=CC=C(O)C=C1 ONBQEOIKXPHGMB-VBSBHUPXSA-N 0.000 description 2
- SZCBDIVMCGFVPW-UHFFFAOYSA-N 1-[4-(aminomethyl)-2,6-di(propan-2-yl)phenyl]-3-[1-butyl-4-(3-methoxyphenyl)-2-oxo-1,8-naphthyridin-3-yl]urea;hydrochloride Chemical compound Cl.CC(C)C=1C=C(CN)C=C(C(C)C)C=1NC(=O)NC=1C(=O)N(CCCC)C2=NC=CC=C2C=1C1=CC=CC(OC)=C1 SZCBDIVMCGFVPW-UHFFFAOYSA-N 0.000 description 2
- YRTFLDFDKPFNCJ-UHFFFAOYSA-N 1-[4-amino-2,6-di(propan-2-yl)phenyl]-3-[1-butyl-2-oxo-4-[3-(3-pyrrolidin-1-ylpropoxy)phenyl]-1,8-naphthyridin-3-yl]urea;dihydrochloride Chemical compound Cl.Cl.CC(C)C=1C=C(N)C=C(C(C)C)C=1NC(=O)NC=1C(=O)N(CCCC)C2=NC=CC=C2C=1C(C=1)=CC=CC=1OCCCN1CCCC1 YRTFLDFDKPFNCJ-UHFFFAOYSA-N 0.000 description 2
- ZFNNBIMQDHBELV-UHFFFAOYSA-N 1-[4-amino-2,6-di(propan-2-yl)phenyl]-3-[1-butyl-4-[3-(3-cyclohexylpropoxy)phenyl]-2-oxo-1,8-naphthyridin-3-yl]urea;dihydrochloride Chemical compound Cl.Cl.CC(C)C=1C=C(N)C=C(C(C)C)C=1NC(=O)NC=1C(=O)N(CCCC)C2=NC=CC=C2C=1C(C=1)=CC=CC=1OCCCC1CCCCC1 ZFNNBIMQDHBELV-UHFFFAOYSA-N 0.000 description 2
- NRKYWOKHZRQRJR-UHFFFAOYSA-N 2,2,2-trifluoroacetamide Chemical compound NC(=O)C(F)(F)F NRKYWOKHZRQRJR-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- PYMOBOZQTNLAHX-UHFFFAOYSA-N 2-ethynyl-4-fluoroaniline Chemical compound NC1=CC=C(F)C=C1C#C PYMOBOZQTNLAHX-UHFFFAOYSA-N 0.000 description 2
- UBPDKIDWEADHPP-UHFFFAOYSA-N 2-iodoaniline Chemical compound NC1=CC=CC=C1I UBPDKIDWEADHPP-UHFFFAOYSA-N 0.000 description 2
- HCLQARMRCPEALF-DNQXCXABSA-N 3-[[(2r)-2-[(1r)-2-[[1-(1-benzothiophen-2-yl)-2-methylpropan-2-yl]amino]-1-hydroxyethyl]pyrrolidin-1-yl]methyl]benzonitrile Chemical compound C([C@@H]1[C@H](O)CNC(C)(CC=2SC3=CC=CC=C3C=2)C)CCN1CC1=CC=CC(C#N)=C1 HCLQARMRCPEALF-DNQXCXABSA-N 0.000 description 2
- SQTOHXZTIZQQDI-UHFFFAOYSA-N 3-bromofuran-2-carboxamide Chemical compound NC(=O)C=1OC=CC=1Br SQTOHXZTIZQQDI-UHFFFAOYSA-N 0.000 description 2
- 125000006275 3-bromophenyl group Chemical group [H]C1=C([H])C(Br)=C([H])C(*)=C1[H] 0.000 description 2
- YYROPELSRYBVMQ-UHFFFAOYSA-N 4-toluenesulfonyl chloride Chemical compound CC1=CC=C(S(Cl)(=O)=O)C=C1 YYROPELSRYBVMQ-UHFFFAOYSA-N 0.000 description 2
- MVXAKOGJWVQPKC-UHFFFAOYSA-N 5-(3-ethynyl-5-fluorophenyl)-2-pyridin-2-yl-4,6,7,8-tetrahydro-[1,3]oxazolo[4,5-c]azepine Chemical compound FC1=CC(C#C)=CC(N2CC=3N=C(OC=3CCC2)C=2N=CC=CC=2)=C1 MVXAKOGJWVQPKC-UHFFFAOYSA-N 0.000 description 2
- FCBOUJYKAGWYQM-DEOSSOPVSA-N 6-[[(2s)-1-hydroxy-3-phenylpropan-2-yl]amino]-n-(2-phenoxyethyl)-2-(3,4,5-trimethoxyphenyl)pyridine-3-carboxamide Chemical compound COC1=C(OC)C(OC)=CC(C=2C(=CC=C(N[C@H](CO)CC=3C=CC=CC=3)N=2)C(=O)NCCOC=2C=CC=CC=2)=C1 FCBOUJYKAGWYQM-DEOSSOPVSA-N 0.000 description 2
- MITGKKFYIJJQGL-UHFFFAOYSA-N 9-(4-chlorobenzoyl)-6-methylsulfonyl-2,3-dihydro-1H-carbazol-4-one Chemical compound ClC1=CC=C(C(=O)N2C3=CC=C(C=C3C=3C(CCCC2=3)=O)S(=O)(=O)C)C=C1 MITGKKFYIJJQGL-UHFFFAOYSA-N 0.000 description 2
- OZAIFHULBGXAKX-VAWYXSNFSA-N AIBN Substances N#CC(C)(C)\N=N\C(C)(C)C#N OZAIFHULBGXAKX-VAWYXSNFSA-N 0.000 description 2
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- KFNHTIDWZCYYMY-UHFFFAOYSA-N BrC1=C(C=C(C=C1)S(=O)(=O)NC(C)=O)Cl Chemical compound BrC1=C(C=C(C=C1)S(=O)(=O)NC(C)=O)Cl KFNHTIDWZCYYMY-UHFFFAOYSA-N 0.000 description 2
- YEZJJOVUNYQUFM-UHFFFAOYSA-N BrC=1C=C(C=CC=1)C#CC1=C(C=CC(=C1)F)NS(=O)(=O)C1=CC=C(C=C1)C Chemical compound BrC=1C=C(C=CC=1)C#CC1=C(C=CC(=C1)F)NS(=O)(=O)C1=CC=C(C=C1)C YEZJJOVUNYQUFM-UHFFFAOYSA-N 0.000 description 2
- YWLRNFIHHVUFAO-UHFFFAOYSA-N BrC=1C=C(C=CC=1)C#CC1=C(N)C=CC(=C1)F Chemical compound BrC=1C=C(C=CC=1)C#CC1=C(N)C=CC(=C1)F YWLRNFIHHVUFAO-UHFFFAOYSA-N 0.000 description 2
- XEOZFQBHUYJNSJ-UHFFFAOYSA-N C(#N)C1=C(C(=CC=C1)C#N)C1=C(N(C2=CC=C(C=C12)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F)C=1C=C(C=CC=1)C1=C(C=C(C=C1F)C(=O)O)F Chemical compound C(#N)C1=C(C(=CC=C1)C#N)C1=C(N(C2=CC=C(C=C12)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F)C=1C=C(C=CC=1)C1=C(C=C(C=C1F)C(=O)O)F XEOZFQBHUYJNSJ-UHFFFAOYSA-N 0.000 description 2
- BQJAQWIVMKQGSM-UHFFFAOYSA-N ClC1=C(C=CC(=C1)C(=O)O)C1=CC(=CC=C1)C=1N(C2=CC=C(C=C2C=1C1=NC=CN=C1C#N)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F Chemical compound ClC1=C(C=CC(=C1)C(=O)O)C1=CC(=CC=C1)C=1N(C2=CC=C(C=C2C=1C1=NC=CN=C1C#N)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F BQJAQWIVMKQGSM-UHFFFAOYSA-N 0.000 description 2
- CVQXNPACXDUWQR-UHFFFAOYSA-N ClC1=CC=C(C=C1)S(=O)(=O)N1C(=C(C2=CC(=CC=C12)O)C1=C(SC=C1)C#N)C=1SC=CC1 Chemical compound ClC1=CC=C(C=C1)S(=O)(=O)N1C(=C(C2=CC(=CC=C12)O)C1=C(SC=C1)C#N)C=1SC=CC1 CVQXNPACXDUWQR-UHFFFAOYSA-N 0.000 description 2
- RGHNJXZEOKUKBD-SQOUGZDYSA-N D-gluconic acid Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O RGHNJXZEOKUKBD-SQOUGZDYSA-N 0.000 description 2
- 230000004568 DNA-binding Effects 0.000 description 2
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 2
- 241000588724 Escherichia coli Species 0.000 description 2
- QUSNBJAOOMFDIB-UHFFFAOYSA-N Ethylamine Chemical compound CCN QUSNBJAOOMFDIB-UHFFFAOYSA-N 0.000 description 2
- 208000004930 Fatty Liver Diseases 0.000 description 2
- 206010016654 Fibrosis Diseases 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 108010001515 Galectin 4 Proteins 0.000 description 2
- 241000711549 Hepacivirus C Species 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 101000608765 Homo sapiens Galectin-4 Proteins 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 2
- WTDHULULXKLSOZ-UHFFFAOYSA-N Hydroxylamine hydrochloride Chemical compound Cl.ON WTDHULULXKLSOZ-UHFFFAOYSA-N 0.000 description 2
- 239000005909 Kieselgur Substances 0.000 description 2
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 2
- 241000254158 Lampyridae Species 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- HSHXDCVZWHOWCS-UHFFFAOYSA-N N'-hexadecylthiophene-2-carbohydrazide Chemical compound CCCCCCCCCCCCCCCCNNC(=O)c1cccs1 HSHXDCVZWHOWCS-UHFFFAOYSA-N 0.000 description 2
- OPFJDXRVMFKJJO-ZHHKINOHSA-N N-{[3-(2-benzamido-4-methyl-1,3-thiazol-5-yl)-pyrazol-5-yl]carbonyl}-G-dR-G-dD-dD-dD-NH2 Chemical compound S1C(C=2NN=C(C=2)C(=O)NCC(=O)N[C@H](CCCN=C(N)N)C(=O)NCC(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC(O)=O)C(N)=O)=C(C)N=C1NC(=O)C1=CC=CC=C1 OPFJDXRVMFKJJO-ZHHKINOHSA-N 0.000 description 2
- MSZHRBSWCLGMRJ-UHFFFAOYSA-N NC(NS(C1=CC=C(C(F)F)C=C1)(=O)=O)=O Chemical compound NC(NS(C1=CC=C(C(F)F)C=C1)(=O)=O)=O MSZHRBSWCLGMRJ-UHFFFAOYSA-N 0.000 description 2
- 101150003085 Pdcl gene Proteins 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 2
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 2
- 241000283984 Rodentia Species 0.000 description 2
- 101150097713 SCD1 gene Proteins 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- KZVWEOXAPZXAFB-BQFCYCMXSA-N Temocaprilat Chemical compound C([C@H](N[C@H]1CS[C@@H](CN(C1=O)CC(=O)O)C=1SC=CC=1)C(O)=O)CC1=CC=CC=C1 KZVWEOXAPZXAFB-BQFCYCMXSA-N 0.000 description 2
- 102000040945 Transcription factor Human genes 0.000 description 2
- 108091023040 Transcription factor Proteins 0.000 description 2
- 239000007983 Tris buffer Substances 0.000 description 2
- 229920004890 Triton X-100 Polymers 0.000 description 2
- 239000013504 Triton X-100 Substances 0.000 description 2
- 102000004142 Trypsin Human genes 0.000 description 2
- 108090000631 Trypsin Proteins 0.000 description 2
- LJOOWESTVASNOG-UFJKPHDISA-N [(1s,3r,4ar,7s,8s,8as)-3-hydroxy-8-[2-[(4r)-4-hydroxy-6-oxooxan-2-yl]ethyl]-7-methyl-1,2,3,4,4a,7,8,8a-octahydronaphthalen-1-yl] (2s)-2-methylbutanoate Chemical compound C([C@H]1[C@@H](C)C=C[C@H]2C[C@@H](O)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)CC1C[C@@H](O)CC(=O)O1 LJOOWESTVASNOG-UFJKPHDISA-N 0.000 description 2
- LNUFLCYMSVYYNW-ZPJMAFJPSA-N [(2r,3r,4s,5r,6r)-2-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[[(3s,5s,8r,9s,10s,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-3-yl]oxy]-4,5-disulfo Chemical compound O([C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1C[C@@H]2CC[C@H]3[C@@H]4CC[C@@H]([C@]4(CC[C@@H]3[C@@]2(C)CC1)C)[C@H](C)CCCC(C)C)[C@H]1O[C@H](COS(O)(=O)=O)[C@@H](OS(O)(=O)=O)[C@H](OS(O)(=O)=O)[C@H]1OS(O)(=O)=O LNUFLCYMSVYYNW-ZPJMAFJPSA-N 0.000 description 2
- CWGJBBRZFIPXNZ-UHFFFAOYSA-N [C-]#N.Br Chemical compound [C-]#N.Br CWGJBBRZFIPXNZ-UHFFFAOYSA-N 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- WNLRTRBMVRJNCN-UHFFFAOYSA-N adipic acid Chemical compound OC(=O)CCCCC(O)=O WNLRTRBMVRJNCN-UHFFFAOYSA-N 0.000 description 2
- 230000011759 adipose tissue development Effects 0.000 description 2
- 125000004450 alkenylene group Chemical group 0.000 description 2
- 150000001345 alkine derivatives Chemical class 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 125000003277 amino group Chemical group 0.000 description 2
- 230000008485 antagonism Effects 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- AJRQIXBBIDPNGK-BVSLBCMMSA-N benzyl n-[(2s)-1-[[(2s)-1-(1,3-benzothiazol-2-yl)-1-oxo-3-[(3s)-2-oxopyrrolidin-3-yl]propan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]carbamate Chemical compound N([C@@H](CC(C)C)C(=O)N[C@@H](C[C@H]1C(NCC1)=O)C(=O)C=1SC2=CC=CC=C2N=1)C(=O)OCC1=CC=CC=C1 AJRQIXBBIDPNGK-BVSLBCMMSA-N 0.000 description 2
- 125000002618 bicyclic heterocycle group Chemical group 0.000 description 2
- 230000027455 binding Effects 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 230000000903 blocking effect Effects 0.000 description 2
- 230000031709 bromination Effects 0.000 description 2
- 238000005893 bromination reaction Methods 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- IJOOHPMOJXWVHK-UHFFFAOYSA-N chlorotrimethylsilane Chemical compound C[Si](C)(C)Cl IJOOHPMOJXWVHK-UHFFFAOYSA-N 0.000 description 2
- 229940125773 compound 10 Drugs 0.000 description 2
- 229940125758 compound 15 Drugs 0.000 description 2
- 229940126142 compound 16 Drugs 0.000 description 2
- 229940126086 compound 21 Drugs 0.000 description 2
- 229940127204 compound 29 Drugs 0.000 description 2
- 229940126540 compound 41 Drugs 0.000 description 2
- 229940125898 compound 5 Drugs 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 239000012043 crude product Substances 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 206010012601 diabetes mellitus Diseases 0.000 description 2
- 230000037213 diet Effects 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 239000003797 essential amino acid Substances 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 230000002349 favourable effect Effects 0.000 description 2
- 239000012091 fetal bovine serum Substances 0.000 description 2
- 235000013305 food Nutrition 0.000 description 2
- 235000019253 formic acid Nutrition 0.000 description 2
- 230000000855 fungicidal effect Effects 0.000 description 2
- 239000000417 fungicide Substances 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 2
- KWIUHFFTVRNATP-UHFFFAOYSA-N glycine betaine Chemical compound C[N+](C)(C)CC([O-])=O KWIUHFFTVRNATP-UHFFFAOYSA-N 0.000 description 2
- 150000004820 halides Chemical class 0.000 description 2
- 125000005843 halogen group Chemical group 0.000 description 2
- 230000002440 hepatic effect Effects 0.000 description 2
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 2
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 2
- 125000006588 heterocycloalkylene group Chemical group 0.000 description 2
- 238000009396 hybridization Methods 0.000 description 2
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 2
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 2
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 2
- 210000000987 immune system Anatomy 0.000 description 2
- 230000001976 improved effect Effects 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 210000000936 intestine Anatomy 0.000 description 2
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 2
- TWBYWOBDOCUKOW-UHFFFAOYSA-N isonicotinic acid Chemical compound OC(=O)C1=CC=NC=C1 TWBYWOBDOCUKOW-UHFFFAOYSA-N 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- ZLVXBBHTMQJRSX-VMGNSXQWSA-N jdtic Chemical compound C1([C@]2(C)CCN(C[C@@H]2C)C[C@H](C(C)C)NC(=O)[C@@H]2NCC3=CC(O)=CC=C3C2)=CC=CC(O)=C1 ZLVXBBHTMQJRSX-VMGNSXQWSA-N 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 239000010410 layer Substances 0.000 description 2
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 2
- RENRQMCACQEWFC-UGKGYDQZSA-N lnp023 Chemical compound C1([C@H]2N(CC=3C=4C=CNC=4C(C)=CC=3OC)CC[C@@H](C2)OCC)=CC=C(C(O)=O)C=C1 RENRQMCACQEWFC-UGKGYDQZSA-N 0.000 description 2
- 239000012139 lysis buffer Substances 0.000 description 2
- NXPHGHWWQRMDIA-UHFFFAOYSA-M magnesium;carbanide;bromide Chemical compound [CH3-].[Mg+2].[Br-] NXPHGHWWQRMDIA-UHFFFAOYSA-M 0.000 description 2
- 230000014759 maintenance of location Effects 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- UOCWTLBPYROHEF-UHFFFAOYSA-N methyl azetidine-3-carboxylate;hydrochloride Chemical compound Cl.COC(=O)C1CNC1 UOCWTLBPYROHEF-UHFFFAOYSA-N 0.000 description 2
- QPJVMBTYPHYUOC-UHFFFAOYSA-N methyl benzoate Chemical compound COC(=O)C1=CC=CC=C1 QPJVMBTYPHYUOC-UHFFFAOYSA-N 0.000 description 2
- 239000002480 mineral oil Substances 0.000 description 2
- 235000010446 mineral oil Nutrition 0.000 description 2
- 150000007522 mineralic acids Chemical class 0.000 description 2
- UHOVQNZJYSORNB-UHFFFAOYSA-N monobenzene Natural products C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 2
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 2
- GVOISEJVFFIGQE-YCZSINBZSA-N n-[(1r,2s,5r)-5-[methyl(propan-2-yl)amino]-2-[(3s)-2-oxo-3-[[6-(trifluoromethyl)quinazolin-4-yl]amino]pyrrolidin-1-yl]cyclohexyl]acetamide Chemical compound CC(=O)N[C@@H]1C[C@H](N(C)C(C)C)CC[C@@H]1N1C(=O)[C@@H](NC=2C3=CC(=CC=C3N=CN=2)C(F)(F)F)CC1 GVOISEJVFFIGQE-YCZSINBZSA-N 0.000 description 2
- NFPUARSXIMWASK-GOEBONIOSA-N n-[(5r,7s)-2-(3-chlorophenyl)-1-oxa-3-azaspiro[4.5]dec-2-en-7-yl]acetamide Chemical compound C1[C@@H](NC(=O)C)CCC[C@@]11OC(C=2C=C(Cl)C=CC=2)=NC1 NFPUARSXIMWASK-GOEBONIOSA-N 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- WLJVNTCWHIRURA-UHFFFAOYSA-N pimelic acid Chemical compound OC(=O)CCCCCC(O)=O WLJVNTCWHIRURA-UHFFFAOYSA-N 0.000 description 2
- 230000029279 positive regulation of transcription, DNA-dependent Effects 0.000 description 2
- 238000002600 positron emission tomography Methods 0.000 description 2
- 230000003389 potentiating effect Effects 0.000 description 2
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000006239 protecting group Chemical group 0.000 description 2
- 125000003373 pyrazinyl group Chemical group 0.000 description 2
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 2
- 230000007115 recruitment Effects 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 238000002603 single-photon emission computed tomography Methods 0.000 description 2
- 235000009518 sodium iodide Nutrition 0.000 description 2
- 229940054269 sodium pyruvate Drugs 0.000 description 2
- 241000894007 species Species 0.000 description 2
- VNFWTIYUKDMAOP-UHFFFAOYSA-N sphos Chemical compound COC1=CC=CC(OC)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 VNFWTIYUKDMAOP-UHFFFAOYSA-N 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 125000005750 substituted cyclic group Chemical group 0.000 description 2
- AGGIJOLULBJGTQ-UHFFFAOYSA-N sulfoacetic acid Chemical class OC(=O)CS(O)(=O)=O AGGIJOLULBJGTQ-UHFFFAOYSA-N 0.000 description 2
- 125000004434 sulfur atom Chemical group 0.000 description 2
- 230000001629 suppression Effects 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 229940037128 systemic glucocorticoids Drugs 0.000 description 2
- JYRWUSXRTGACLY-UHFFFAOYSA-N tert-butyl 4-[[3-(4-methylsulfonylphenyl)-[1,2]oxazolo[4,5-d]pyrimidin-7-yl]oxy]piperidine-1-carboxylate Chemical compound C1CN(C(=O)OC(C)(C)C)CCC1OC1=NC=NC2=C1ON=C2C1=CC=C(S(C)(=O)=O)C=C1 JYRWUSXRTGACLY-UHFFFAOYSA-N 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 238000003146 transient transfection Methods 0.000 description 2
- 150000003626 triacylglycerols Chemical class 0.000 description 2
- CSRZQMIRAZTJOY-UHFFFAOYSA-N trimethylsilyl iodide Chemical compound C[Si](C)(C)I CSRZQMIRAZTJOY-UHFFFAOYSA-N 0.000 description 2
- JBWKIWSBJXDJDT-UHFFFAOYSA-N triphenylmethyl chloride Chemical compound C=1C=CC=CC=1C(C=1C=CC=CC=1)(Cl)C1=CC=CC=C1 JBWKIWSBJXDJDT-UHFFFAOYSA-N 0.000 description 2
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 2
- 239000012588 trypsin Substances 0.000 description 2
- 210000004881 tumor cell Anatomy 0.000 description 2
- NQPDZGIKBAWPEJ-UHFFFAOYSA-N valeric acid Chemical compound CCCCC(O)=O NQPDZGIKBAWPEJ-UHFFFAOYSA-N 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- UAYWVJHJZHQCIE-UHFFFAOYSA-L zinc iodide Chemical compound I[Zn]I UAYWVJHJZHQCIE-UHFFFAOYSA-L 0.000 description 2
- UAOUIVVJBYDFKD-XKCDOFEDSA-N (1R,9R,10S,11R,12R,15S,18S,21R)-10,11,21-trihydroxy-8,8-dimethyl-14-methylidene-4-(prop-2-enylamino)-20-oxa-5-thia-3-azahexacyclo[9.7.2.112,15.01,9.02,6.012,18]henicosa-2(6),3-dien-13-one Chemical compound C([C@@H]1[C@@H](O)[C@@]23C(C1=C)=O)C[C@H]2[C@]12C(N=C(NCC=C)S4)=C4CC(C)(C)[C@H]1[C@H](O)[C@]3(O)OC2 UAOUIVVJBYDFKD-XKCDOFEDSA-N 0.000 description 1
- AOSZTAHDEDLTLQ-AZKQZHLXSA-N (1S,2S,4R,8S,9S,11S,12R,13S,19S)-6-[(3-chlorophenyl)methyl]-12,19-difluoro-11-hydroxy-8-(2-hydroxyacetyl)-9,13-dimethyl-6-azapentacyclo[10.8.0.02,9.04,8.013,18]icosa-14,17-dien-16-one Chemical compound C([C@@H]1C[C@H]2[C@H]3[C@]([C@]4(C=CC(=O)C=C4[C@@H](F)C3)C)(F)[C@@H](O)C[C@@]2([C@@]1(C1)C(=O)CO)C)N1CC1=CC=CC(Cl)=C1 AOSZTAHDEDLTLQ-AZKQZHLXSA-N 0.000 description 1
- ABJSOROVZZKJGI-OCYUSGCXSA-N (1r,2r,4r)-2-(4-bromophenyl)-n-[(4-chlorophenyl)-(2-fluoropyridin-4-yl)methyl]-4-morpholin-4-ylcyclohexane-1-carboxamide Chemical compound C1=NC(F)=CC(C(NC(=O)[C@H]2[C@@H](C[C@@H](CC2)N2CCOCC2)C=2C=CC(Br)=CC=2)C=2C=CC(Cl)=CC=2)=C1 ABJSOROVZZKJGI-OCYUSGCXSA-N 0.000 description 1
- SZUVGFMDDVSKSI-WIFOCOSTSA-N (1s,2s,3s,5r)-1-(carboxymethyl)-3,5-bis[(4-phenoxyphenyl)methyl-propylcarbamoyl]cyclopentane-1,2-dicarboxylic acid Chemical compound O=C([C@@H]1[C@@H]([C@](CC(O)=O)([C@H](C(=O)N(CCC)CC=2C=CC(OC=3C=CC=CC=3)=CC=2)C1)C(O)=O)C(O)=O)N(CCC)CC(C=C1)=CC=C1OC1=CC=CC=C1 SZUVGFMDDVSKSI-WIFOCOSTSA-N 0.000 description 1
- UFDULEKOJAEIRI-UHFFFAOYSA-N (2-acetyloxy-3-iodophenyl) acetate Chemical compound CC(=O)OC1=CC=CC(I)=C1OC(C)=O UFDULEKOJAEIRI-UHFFFAOYSA-N 0.000 description 1
- NPLZNDDFVCGRAG-UHFFFAOYSA-N (2-cyanophenyl)boronic acid Chemical compound OB(O)C1=CC=CC=C1C#N NPLZNDDFVCGRAG-UHFFFAOYSA-N 0.000 description 1
- GHYOCDFICYLMRF-UTIIJYGPSA-N (2S,3R)-N-[(2S)-3-(cyclopenten-1-yl)-1-[(2R)-2-methyloxiran-2-yl]-1-oxopropan-2-yl]-3-hydroxy-3-(4-methoxyphenyl)-2-[[(2S)-2-[(2-morpholin-4-ylacetyl)amino]propanoyl]amino]propanamide Chemical compound C1(=CCCC1)C[C@@H](C(=O)[C@@]1(OC1)C)NC([C@H]([C@@H](C1=CC=C(C=C1)OC)O)NC([C@H](C)NC(CN1CCOCC1)=O)=O)=O GHYOCDFICYLMRF-UTIIJYGPSA-N 0.000 description 1
- IUSARDYWEPUTPN-OZBXUNDUSA-N (2r)-n-[(2s,3r)-4-[[(4s)-6-(2,2-dimethylpropyl)spiro[3,4-dihydropyrano[2,3-b]pyridine-2,1'-cyclobutane]-4-yl]amino]-3-hydroxy-1-[3-(1,3-thiazol-2-yl)phenyl]butan-2-yl]-2-methoxypropanamide Chemical compound C([C@H](NC(=O)[C@@H](C)OC)[C@H](O)CN[C@@H]1C2=CC(CC(C)(C)C)=CN=C2OC2(CCC2)C1)C(C=1)=CC=CC=1C1=NC=CS1 IUSARDYWEPUTPN-OZBXUNDUSA-N 0.000 description 1
- WWTBZEKOSBFBEM-SPWPXUSOSA-N (2s)-2-[[2-benzyl-3-[hydroxy-[(1r)-2-phenyl-1-(phenylmethoxycarbonylamino)ethyl]phosphoryl]propanoyl]amino]-3-(1h-indol-3-yl)propanoic acid Chemical compound N([C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)O)C(=O)C(CP(O)(=O)[C@H](CC=1C=CC=CC=1)NC(=O)OCC=1C=CC=CC=1)CC1=CC=CC=C1 WWTBZEKOSBFBEM-SPWPXUSOSA-N 0.000 description 1
- AEVBPXDFDKBGLT-YOUFYPILSA-N (2s,3s,4r,5r)-n-[2-[4-(diethoxyphosphorylmethyl)anilino]-2-oxoethyl]-5-(2,4-dioxopyrimidin-1-yl)-3,4-dihydroxyoxolane-2-carboxamide Chemical compound C1=CC(CP(=O)(OCC)OCC)=CC=C1NC(=O)CNC(=O)[C@@H]1[C@@H](O)[C@@H](O)[C@H](N2C(NC(=O)C=C2)=O)O1 AEVBPXDFDKBGLT-YOUFYPILSA-N 0.000 description 1
- AFSSVCNPDKKSRR-UHFFFAOYSA-N (3-bromophenyl)boronic acid Chemical compound OB(O)C1=CC=CC(Br)=C1 AFSSVCNPDKKSRR-UHFFFAOYSA-N 0.000 description 1
- IWZSHWBGHQBIML-ZGGLMWTQSA-N (3S,8S,10R,13S,14S,17S)-17-isoquinolin-7-yl-N,N,10,13-tetramethyl-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1H-cyclopenta[a]phenanthren-3-amine Chemical compound CN(C)[C@H]1CC[C@]2(C)C3CC[C@@]4(C)[C@@H](CC[C@@H]4c4ccc5ccncc5c4)[C@@H]3CC=C2C1 IWZSHWBGHQBIML-ZGGLMWTQSA-N 0.000 description 1
- UDQTXCHQKHIQMH-KYGLGHNPSA-N (3ar,5s,6s,7r,7ar)-5-(difluoromethyl)-2-(ethylamino)-5,6,7,7a-tetrahydro-3ah-pyrano[3,2-d][1,3]thiazole-6,7-diol Chemical compound S1C(NCC)=N[C@H]2[C@@H]1O[C@H](C(F)F)[C@@H](O)[C@@H]2O UDQTXCHQKHIQMH-KYGLGHNPSA-N 0.000 description 1
- HUWSZNZAROKDRZ-RRLWZMAJSA-N (3r,4r)-3-azaniumyl-5-[[(2s,3r)-1-[(2s)-2,3-dicarboxypyrrolidin-1-yl]-3-methyl-1-oxopentan-2-yl]amino]-5-oxo-4-sulfanylpentane-1-sulfonate Chemical compound OS(=O)(=O)CC[C@@H](N)[C@@H](S)C(=O)N[C@@H]([C@H](C)CC)C(=O)N1CCC(C(O)=O)[C@H]1C(O)=O HUWSZNZAROKDRZ-RRLWZMAJSA-N 0.000 description 1
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 1
- YUCNQIKLRVURHK-UHFFFAOYSA-N (4-bromo-2-sulfanylphenyl)methanol Chemical compound OCC1=CC=C(Br)C=C1S YUCNQIKLRVURHK-UHFFFAOYSA-N 0.000 description 1
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- YEMUSDCFQUBPAL-SNAWJCMRSA-N (e)-3-(3-bromophenyl)prop-2-enoic acid Chemical compound OC(=O)\C=C\C1=CC=CC(Br)=C1 YEMUSDCFQUBPAL-SNAWJCMRSA-N 0.000 description 1
- 0 *N(C1)CC1O Chemical compound *N(C1)CC1O 0.000 description 1
- 125000005940 1,4-dioxanyl group Chemical group 0.000 description 1
- NFBYMQBZRWBFDH-UHFFFAOYSA-N 1-(2-chloropyridin-3-yl)azetidin-3-ol Chemical compound ClC1=NC=CC=C1N1CC(C1)O NFBYMQBZRWBFDH-UHFFFAOYSA-N 0.000 description 1
- MBZYFQGJMCBYTQ-UHFFFAOYSA-N 1-(4-bromo-3-chlorophenyl)-n,n-dimethylmethanamine Chemical compound CN(C)CC1=CC=C(Br)C(Cl)=C1 MBZYFQGJMCBYTQ-UHFFFAOYSA-N 0.000 description 1
- WYECURVXVYPVAT-UHFFFAOYSA-N 1-(4-bromophenyl)ethanone Chemical compound CC(=O)C1=CC=C(Br)C=C1 WYECURVXVYPVAT-UHFFFAOYSA-N 0.000 description 1
- NPJWRCYRRMEJSV-UHFFFAOYSA-N 1-(4-chlorophenyl)sulfonyl-3-(2-chlorothiophen-3-yl)-2-thiophen-2-ylindole Chemical compound ClC1=CC=C(C=C1)S(=O)(=O)N1C(=C(C2=CC=CC=C12)C1=C(SC=C1)Cl)C=1SC=CC=1 NPJWRCYRRMEJSV-UHFFFAOYSA-N 0.000 description 1
- KQZLRWGGWXJPOS-NLFPWZOASA-N 1-[(1R)-1-(2,4-dichlorophenyl)ethyl]-6-[(4S,5R)-4-[(2S)-2-(hydroxymethyl)pyrrolidin-1-yl]-5-methylcyclohexen-1-yl]pyrazolo[3,4-b]pyrazine-3-carbonitrile Chemical compound ClC1=C(C=CC(=C1)Cl)[C@@H](C)N1N=C(C=2C1=NC(=CN=2)C1=CC[C@@H]([C@@H](C1)C)N1[C@@H](CCC1)CO)C#N KQZLRWGGWXJPOS-NLFPWZOASA-N 0.000 description 1
- UNILWMWFPHPYOR-KXEYIPSPSA-M 1-[6-[2-[3-[3-[3-[2-[2-[3-[[2-[2-[[(2r)-1-[[2-[[(2r)-1-[3-[2-[2-[3-[[2-(2-amino-2-oxoethoxy)acetyl]amino]propoxy]ethoxy]ethoxy]propylamino]-3-hydroxy-1-oxopropan-2-yl]amino]-2-oxoethyl]amino]-3-[(2r)-2,3-di(hexadecanoyloxy)propyl]sulfanyl-1-oxopropan-2-yl Chemical compound O=C1C(SCCC(=O)NCCCOCCOCCOCCCNC(=O)COCC(=O)N[C@@H](CSC[C@@H](COC(=O)CCCCCCCCCCCCCCC)OC(=O)CCCCCCCCCCCCCCC)C(=O)NCC(=O)N[C@H](CO)C(=O)NCCCOCCOCCOCCCNC(=O)COCC(N)=O)CC(=O)N1CCNC(=O)CCCCCN\1C2=CC=C(S([O-])(=O)=O)C=C2CC/1=C/C=C/C=C/C1=[N+](CC)C2=CC=C(S([O-])(=O)=O)C=C2C1 UNILWMWFPHPYOR-KXEYIPSPSA-M 0.000 description 1
- OIRHKGBNGGSCGS-UHFFFAOYSA-N 1-bromo-2-iodobenzene Chemical compound BrC1=CC=CC=C1I OIRHKGBNGGSCGS-UHFFFAOYSA-N 0.000 description 1
- FAGYVSVOUYMGTM-UHFFFAOYSA-N 1-bromo-3-methylsulfinylbenzene Chemical compound CS(=O)C1=CC=CC(Br)=C1 FAGYVSVOUYMGTM-UHFFFAOYSA-N 0.000 description 1
- SPEAAANSIDPCQV-UHFFFAOYSA-N 1-bromopyridin-2-one Chemical compound BrN1C=CC=CC1=O SPEAAANSIDPCQV-UHFFFAOYSA-N 0.000 description 1
- MICMHFIQSAMEJG-UHFFFAOYSA-N 1-bromopyrrolidine-2,5-dione Chemical compound BrN1C(=O)CCC1=O.BrN1C(=O)CCC1=O MICMHFIQSAMEJG-UHFFFAOYSA-N 0.000 description 1
- 102100037426 17-beta-hydroxysteroid dehydrogenase type 1 Human genes 0.000 description 1
- 101710147298 17-beta-hydroxysteroid dehydrogenase type 1 Proteins 0.000 description 1
- FEYDZHNIIMENOB-UHFFFAOYSA-N 2,6-dibromopyridine Chemical compound BrC1=CC=CC(Br)=N1 FEYDZHNIIMENOB-UHFFFAOYSA-N 0.000 description 1
- OUVCGGQBMJGLDX-UHFFFAOYSA-N 2-(2-trimethylsilylethynyl)pyridin-3-amine Chemical compound C[Si](C)(C)C#CC1=NC=CC=C1N OUVCGGQBMJGLDX-UHFFFAOYSA-N 0.000 description 1
- HIXDQWDOVZUNNA-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-hydroxy-7-methoxychromen-4-one Chemical compound C=1C(OC)=CC(O)=C(C(C=2)=O)C=1OC=2C1=CC=C(OC)C(OC)=C1 HIXDQWDOVZUNNA-UHFFFAOYSA-N 0.000 description 1
- QACUVBBPVMJMTG-UHFFFAOYSA-N 2-(3-bromo-4-cyanophenoxy)acetic acid Chemical compound OC(=O)COc1ccc(C#N)c(Br)c1 QACUVBBPVMJMTG-UHFFFAOYSA-N 0.000 description 1
- DVRFSZZTGXBIIR-UHFFFAOYSA-N 2-(4-bromo-2-methylsulfonylphenyl)-2-methylpropanenitrile Chemical compound BrC1=CC(=C(C=C1)C(C#N)(C)C)S(=O)(=O)C DVRFSZZTGXBIIR-UHFFFAOYSA-N 0.000 description 1
- VGHPEBUPPDHJIU-UHFFFAOYSA-N 2-(4-bromo-2-methylsulfonylphenyl)-2-methylpropanoic acid Chemical compound BrC1=CC(=C(C=C1)C(C(=O)O)(C)C)S(=O)(=O)C VGHPEBUPPDHJIU-UHFFFAOYSA-N 0.000 description 1
- GLDINUXZOQEDLH-UHFFFAOYSA-N 2-(4-bromo-2-methylsulfonylphenyl)acetonitrile Chemical compound CS(=O)(=O)C1=CC(Br)=CC=C1CC#N GLDINUXZOQEDLH-UHFFFAOYSA-N 0.000 description 1
- HGBGWLCEGRKHHJ-UHFFFAOYSA-N 2-(4-bromophenyl)-2-hydroxypropanoic acid Chemical compound OC(=O)C(O)(C)C1=CC=C(Br)C=C1 HGBGWLCEGRKHHJ-UHFFFAOYSA-N 0.000 description 1
- OXQGTIUCKGYOAA-UHFFFAOYSA-N 2-Ethylbutanoic acid Chemical compound CCC(CC)C(O)=O OXQGTIUCKGYOAA-UHFFFAOYSA-N 0.000 description 1
- RVGLEPQPVDUSOJ-UHFFFAOYSA-N 2-Methyl-3-hydroxypropanoate Chemical compound COC(=O)CCO RVGLEPQPVDUSOJ-UHFFFAOYSA-N 0.000 description 1
- ZLJZDYOBXVOTSA-XMMPIXPASA-N 2-[3-[(3r)-3-[[2-chloro-3-(trifluoromethyl)phenyl]methyl-(2,2-diphenylethyl)amino]butoxy]phenyl]acetic acid Chemical compound C([C@@H](C)N(CC(C=1C=CC=CC=1)C=1C=CC=CC=1)CC=1C(=C(C=CC=1)C(F)(F)F)Cl)COC1=CC=CC(CC(O)=O)=C1 ZLJZDYOBXVOTSA-XMMPIXPASA-N 0.000 description 1
- PYRKKGOKRMZEIT-UHFFFAOYSA-N 2-[6-(2-cyclopropylethoxy)-9-(2-hydroxy-2-methylpropyl)-1h-phenanthro[9,10-d]imidazol-2-yl]-5-fluorobenzene-1,3-dicarbonitrile Chemical compound C1=C2C3=CC(CC(C)(O)C)=CC=C3C=3NC(C=4C(=CC(F)=CC=4C#N)C#N)=NC=3C2=CC=C1OCCC1CC1 PYRKKGOKRMZEIT-UHFFFAOYSA-N 0.000 description 1
- MTVBBLNLYSYKCQ-UHFFFAOYSA-N 2-[[cyclohexyl(methyl)amino]methyl]aniline Chemical compound C1CCCCC1N(C)CC1=CC=CC=C1N MTVBBLNLYSYKCQ-UHFFFAOYSA-N 0.000 description 1
- YSUIQYOGTINQIN-UZFYAQMZSA-N 2-amino-9-[(1S,6R,8R,9S,10R,15R,17R,18R)-8-(6-aminopurin-9-yl)-9,18-difluoro-3,12-dihydroxy-3,12-bis(sulfanylidene)-2,4,7,11,13,16-hexaoxa-3lambda5,12lambda5-diphosphatricyclo[13.2.1.06,10]octadecan-17-yl]-1H-purin-6-one Chemical compound NC1=NC2=C(N=CN2[C@@H]2O[C@@H]3COP(S)(=O)O[C@@H]4[C@@H](COP(S)(=O)O[C@@H]2[C@@H]3F)O[C@H]([C@H]4F)N2C=NC3=C2N=CN=C3N)C(=O)N1 YSUIQYOGTINQIN-UZFYAQMZSA-N 0.000 description 1
- TVTJUIAKQFIXCE-HUKYDQBMSA-N 2-amino-9-[(2R,3S,4S,5R)-4-fluoro-3-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-7-prop-2-ynyl-1H-purine-6,8-dione Chemical compound NC=1NC(C=2N(C(N(C=2N=1)[C@@H]1O[C@@H]([C@H]([C@H]1O)F)CO)=O)CC#C)=O TVTJUIAKQFIXCE-HUKYDQBMSA-N 0.000 description 1
- SVYWEZZHXINQHC-UHFFFAOYSA-N 2-bromo-5-fluoro-4-methoxyaniline Chemical compound COC1=CC(Br)=C(N)C=C1F SVYWEZZHXINQHC-UHFFFAOYSA-N 0.000 description 1
- PCTWWYKFRYQMOH-UHFFFAOYSA-N 2-bromobenzene-1,3-dicarbonitrile Chemical compound BrC1=C(C#N)C=CC=C1C#N PCTWWYKFRYQMOH-UHFFFAOYSA-N 0.000 description 1
- PIALZEVQBULFAZ-UHFFFAOYSA-N 2-bromocyclohexene-1-carbonitrile Chemical compound BrC1=C(CCCC1)C#N PIALZEVQBULFAZ-UHFFFAOYSA-N 0.000 description 1
- DCCMDYNPNCJVGS-UHFFFAOYSA-N 2-bromocyclohexene-1-carboxamide Chemical compound BrC1=C(CCCC1)C(=O)N DCCMDYNPNCJVGS-UHFFFAOYSA-N 0.000 description 1
- ZLXLAGQLWBJSSF-UHFFFAOYSA-N 2-bromocyclohexene-1-carboxylic acid Chemical compound OC(=O)C1=C(Br)CCCC1 ZLXLAGQLWBJSSF-UHFFFAOYSA-N 0.000 description 1
- HKDVVTLISGIPFE-UHFFFAOYSA-N 2-bromopyridin-3-amine Chemical compound NC1=CC=CN=C1Br HKDVVTLISGIPFE-UHFFFAOYSA-N 0.000 description 1
- OHWSWGXNZDSHLM-UHFFFAOYSA-N 2-chloro-3-iodopyridine Chemical compound ClC1=NC=CC=C1I OHWSWGXNZDSHLM-UHFFFAOYSA-N 0.000 description 1
- SFZCMKJLVRSWTN-UHFFFAOYSA-N 2-ethynylpyridin-3-amine Chemical compound NC1=CC=CN=C1C#C SFZCMKJLVRSWTN-UHFFFAOYSA-N 0.000 description 1
- ORVCATCRRUXRCE-UHFFFAOYSA-N 2-iodooxybenzoic acid Chemical compound OC(=O)C1=CC=CC=C1OI ORVCATCRRUXRCE-UHFFFAOYSA-N 0.000 description 1
- XYSJPUFCXCNEJO-UHFFFAOYSA-N 2-methylbut-3-ynoic acid Chemical compound C#CC(C)C(O)=O XYSJPUFCXCNEJO-UHFFFAOYSA-N 0.000 description 1
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- LGCYVLDNGBSOOW-UHFFFAOYSA-N 2H-benzotriazol-4-ol 1-hydroxybenzotriazole Chemical compound OC1=CC=CC2=C1N=NN2.C1=CC=C2N(O)N=NC2=C1 LGCYVLDNGBSOOW-UHFFFAOYSA-N 0.000 description 1
- MKAANEUBJPJXKA-UHFFFAOYSA-N 3-(2-phenyl-1H-indol-3-yl)thiophene-2-carbonitrile Chemical compound C1(=CC=CC=C1)C=1NC2=CC=CC=C2C=1C1=C(SC=C1)C#N MKAANEUBJPJXKA-UHFFFAOYSA-N 0.000 description 1
- WAURFUIGZFRYFP-UHFFFAOYSA-N 3-(2-thiophen-2-yl-1H-indol-3-yl)thiophene-2-carbonitrile Chemical compound S1C(=CC=C1)C=1NC2=CC=CC=C2C=1C1=C(SC=C1)C#N WAURFUIGZFRYFP-UHFFFAOYSA-N 0.000 description 1
- MQZOPNCSVBKENV-UHFFFAOYSA-N 3-(3-bromothiophen-2-yl)oxetan-3-ol Chemical compound BrC1=C(SC=C1)C1(COC1)O MQZOPNCSVBKENV-UHFFFAOYSA-N 0.000 description 1
- QBWKPGNFQQJGFY-QLFBSQMISA-N 3-[(1r)-1-[(2r,6s)-2,6-dimethylmorpholin-4-yl]ethyl]-n-[6-methyl-3-(1h-pyrazol-4-yl)imidazo[1,2-a]pyrazin-8-yl]-1,2-thiazol-5-amine Chemical compound N1([C@H](C)C2=NSC(NC=3C4=NC=C(N4C=C(C)N=3)C3=CNN=C3)=C2)C[C@H](C)O[C@H](C)C1 QBWKPGNFQQJGFY-QLFBSQMISA-N 0.000 description 1
- KSHOQKKCPJELBV-UHFFFAOYSA-N 3-bromo-2-chlorothiophene Chemical compound ClC=1SC=CC=1Br KSHOQKKCPJELBV-UHFFFAOYSA-N 0.000 description 1
- PKBHDRWOPSSOIV-UHFFFAOYSA-N 3-bromofuran-2-carbonitrile Chemical compound Brc1ccoc1C#N PKBHDRWOPSSOIV-UHFFFAOYSA-N 0.000 description 1
- UZBGSJZFBUOJNE-UHFFFAOYSA-N 3-bromofuran-2-carboxylic acid Chemical compound OC(=O)C=1OC=CC=1Br UZBGSJZFBUOJNE-UHFFFAOYSA-N 0.000 description 1
- MNOJRWOWILAHAV-UHFFFAOYSA-N 3-bromophenol Chemical compound OC1=CC=CC(Br)=C1 MNOJRWOWILAHAV-UHFFFAOYSA-N 0.000 description 1
- XCMISAPCWHTVNG-UHFFFAOYSA-N 3-bromothiophene Chemical compound BrC=1C=CSC=1 XCMISAPCWHTVNG-UHFFFAOYSA-N 0.000 description 1
- FMSBZHYUFYHPMK-UHFFFAOYSA-N 3-chloro-4-[3-[3-(2-cyanothiophen-3-yl)-1-[4-(difluoromethyl)phenyl]sulfonyl-5-fluoroindol-2-yl]phenyl]benzoic acid Chemical compound ClC1=C(C=CC(=C1)C(=O)O)C1=CC(=CC=C1)C=1N(C2=CC=C(C=C2C=1C1=C(SC=C1)C#N)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F FMSBZHYUFYHPMK-UHFFFAOYSA-N 0.000 description 1
- ROADCYAOHVSOLQ-UHFFFAOYSA-N 3-oxetanone Chemical compound O=C1COC1 ROADCYAOHVSOLQ-UHFFFAOYSA-N 0.000 description 1
- IENOFRJPUPTEMI-UHFFFAOYSA-N 3-oxocyclobutane-1-carboxylic acid Chemical compound OC(=O)C1CC(=O)C1 IENOFRJPUPTEMI-UHFFFAOYSA-N 0.000 description 1
- XMIIGOLPHOKFCH-UHFFFAOYSA-N 3-phenylpropionic acid Chemical compound OC(=O)CCC1=CC=CC=C1 XMIIGOLPHOKFCH-UHFFFAOYSA-N 0.000 description 1
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 description 1
- MJSLVHKDBWJPCL-UHFFFAOYSA-N 4-(3-bromophenyl)butanoic acid Chemical compound OC(=O)CCCC1=CC=CC(Br)=C1 MJSLVHKDBWJPCL-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- MRZWOBNQYQXAIR-UHFFFAOYSA-N 4-(difluoromethyl)benzenesulfonyl chloride Chemical compound FC(F)C1=CC=C(S(Cl)(=O)=O)C=C1 MRZWOBNQYQXAIR-UHFFFAOYSA-N 0.000 description 1
- YYROPELSRYBVMQ-FIBGUPNXSA-N 4-(trideuteriomethyl)benzenesulfonyl chloride Chemical compound [2H]C([2H])([2H])c1ccc(cc1)S(Cl)(=O)=O YYROPELSRYBVMQ-FIBGUPNXSA-N 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- IRHPJGPQWZEZRX-UHFFFAOYSA-N 4-bromo-2,6-difluorobenzoic acid Chemical compound OC(=O)C1=C(F)C=C(Br)C=C1F IRHPJGPQWZEZRX-UHFFFAOYSA-N 0.000 description 1
- XKSQVHUEXCODBR-UHFFFAOYSA-N 4-bromo-2-(2-ethoxy-2-oxoethyl)sulfanyl-6-fluorobenzoic acid Chemical compound C1(=CC(F)=C(C(=O)O)C(SCC(=O)OCC)=C1)Br XKSQVHUEXCODBR-UHFFFAOYSA-N 0.000 description 1
- HYZVAVYBDNKXDG-UHFFFAOYSA-N 4-bromo-3,5-dimethylpyridine Chemical compound CC1=CN=CC(C)=C1Br HYZVAVYBDNKXDG-UHFFFAOYSA-N 0.000 description 1
- DOZQVNCMJSDAPP-UHFFFAOYSA-N 4-bromo-3-(trifluoromethyl)-1-tritylpyrazole Chemical compound C1=C(Br)C(C(F)(F)F)=NN1C(C=1C=CC=CC=1)(C=1C=CC=CC=1)C1=CC=CC=C1 DOZQVNCMJSDAPP-UHFFFAOYSA-N 0.000 description 1
- KQFLTKBUSDMAKA-UHFFFAOYSA-N 4-bromo-3-chlorobenzenesulfonamide Chemical compound NS(=O)(=O)C1=CC=C(Br)C(Cl)=C1 KQFLTKBUSDMAKA-UHFFFAOYSA-N 0.000 description 1
- KJPDIIYBGFLXQC-UHFFFAOYSA-N 4-bromo-3-chlorobenzenesulfonic acid Chemical compound BrC1=C(C=C(C=C1)S(=O)(=O)O)Cl KJPDIIYBGFLXQC-UHFFFAOYSA-N 0.000 description 1
- FSNCFUWFJZQPTR-UHFFFAOYSA-N 4-bromo-3-chlorobenzenesulfonyl chloride Chemical compound ClC1=CC(S(Cl)(=O)=O)=CC=C1Br FSNCFUWFJZQPTR-UHFFFAOYSA-N 0.000 description 1
- YWTKUWXYQQZSIL-UHFFFAOYSA-N 4-bromo-3-chlorobenzonitrile Chemical compound ClC1=CC(C#N)=CC=C1Br YWTKUWXYQQZSIL-UHFFFAOYSA-N 0.000 description 1
- JTHNMRUVJDWVMJ-UHFFFAOYSA-N 4-bromo-5-(trifluoromethyl)-1h-pyrazole Chemical compound FC(F)(F)C=1NN=CC=1Br JTHNMRUVJDWVMJ-UHFFFAOYSA-N 0.000 description 1
- JKTKLPOLMMRHRB-UHFFFAOYSA-N 4-bromopyridine-3,5-dicarboxylic acid Chemical compound BrC1=C(C=NC=C1C(=O)O)C(=O)O JKTKLPOLMMRHRB-UHFFFAOYSA-N 0.000 description 1
- MOOVTTIXDNQDEL-UHFFFAOYSA-N 4-chloropyridine-3,5-dicarbonitrile Chemical compound ClC1=C(C=NC=C1C#N)C#N MOOVTTIXDNQDEL-UHFFFAOYSA-N 0.000 description 1
- SETOTRGVPANENO-UHFFFAOYSA-N 4-fluoro-2-iodoaniline Chemical compound NC1=CC=C(F)C=C1I SETOTRGVPANENO-UHFFFAOYSA-N 0.000 description 1
- BNRRMRUVYDETQC-UHFFFAOYSA-N 4-fluoro-2-methoxyaniline Chemical compound COC1=CC(F)=CC=C1N BNRRMRUVYDETQC-UHFFFAOYSA-N 0.000 description 1
- IDHJHDGEXQRVJA-UHFFFAOYSA-N 5-(4-bromo-3-chlorophenyl)-2H-tetrazole Chemical compound BrC1=C(C=C(C=C1)C1=NN=NN1)Cl IDHJHDGEXQRVJA-UHFFFAOYSA-N 0.000 description 1
- DWUPYMSVAPQXMS-UHFFFAOYSA-N 5-bromo-1,3-thiazole Chemical compound BrC1=CN=CS1 DWUPYMSVAPQXMS-UHFFFAOYSA-N 0.000 description 1
- WKSFPOZLVDSBAF-UHFFFAOYSA-N 5-chloro-4-[3-[3-(2,6-dicyanophenyl)-1-[4-(difluoromethyl)phenyl]sulfonyl-5-fluoroindol-2-yl]phenyl]-2-fluorobenzoic acid Chemical compound FC(C1=CC=C(S(=O)(=O)N2C(C(C3=CC(=CC=C23)F)=C2C(C#N)=CC=C[C]2C#N)=C2C=C(C3=CC(F)=C(C(=O)O)C=C3Cl)C=C[CH]2)C=C1)F WKSFPOZLVDSBAF-UHFFFAOYSA-N 0.000 description 1
- NSGLNIQAWVNZFB-UHFFFAOYSA-N 6-(trifluoromethyl)pyridine-3-sulfonyl chloride Chemical compound FC(F)(F)C1=CC=C(S(Cl)(=O)=O)C=N1 NSGLNIQAWVNZFB-UHFFFAOYSA-N 0.000 description 1
- VAZNJOLLULMJGT-UHFFFAOYSA-N 6-bromopyridine Chemical compound BrC1=C=CC=C[N]1 VAZNJOLLULMJGT-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- JYSLFQTWNRYWJT-UHFFFAOYSA-N 8-(3,5-dichlorophenyl)sulfanyl-9-[3-(propan-2-ylamino)propyl]purin-6-amine Chemical compound N=1C2=C(N)N=CN=C2N(CCCNC(C)C)C=1SC1=CC(Cl)=CC(Cl)=C1 JYSLFQTWNRYWJT-UHFFFAOYSA-N 0.000 description 1
- 101150092476 ABCA1 gene Proteins 0.000 description 1
- 108700005241 ATP Binding Cassette Transporter 1 Proteins 0.000 description 1
- 102100022594 ATP-binding cassette sub-family G member 1 Human genes 0.000 description 1
- 102100033106 ATP-binding cassette sub-family G member 5 Human genes 0.000 description 1
- 102100033092 ATP-binding cassette sub-family G member 8 Human genes 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 102100022089 Acyl-[acyl-carrier-protein] hydrolase Human genes 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- HJCMDXDYPOUFDY-WHFBIAKZSA-N Ala-Gln Chemical compound C[C@H](N)C(=O)N[C@H](C(O)=O)CCC(N)=O HJCMDXDYPOUFDY-WHFBIAKZSA-N 0.000 description 1
- 102100036475 Alanine aminotransferase 1 Human genes 0.000 description 1
- 108010082126 Alanine transaminase Proteins 0.000 description 1
- 240000006108 Allium ampeloprasum Species 0.000 description 1
- 201000001320 Atherosclerosis Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 1
- SUVBGXFZQXRJHK-UHFFFAOYSA-N BrC1=C(C=C(C=C1)C1=NN=NN1C(C1=CC=CC=C1)(C1=CC=CC=C1)C1=CC=CC=C1)Cl Chemical compound BrC1=C(C=C(C=C1)C1=NN=NN1C(C1=CC=CC=C1)(C1=CC=CC=C1)C1=CC=CC=C1)Cl SUVBGXFZQXRJHK-UHFFFAOYSA-N 0.000 description 1
- LWENDOFLGORDON-UHFFFAOYSA-N BrC1=C(C=CC=C1)C1(CN(C1)C(=O)OC(C)(C)C)F Chemical compound BrC1=C(C=CC=C1)C1(CN(C1)C(=O)OC(C)(C)C)F LWENDOFLGORDON-UHFFFAOYSA-N 0.000 description 1
- AKMFRQDSDONGFA-UHFFFAOYSA-N BrC1=C(N(C2=CC=C(C=C12)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F)C=1C=C(C=CC=1)C1=C(C=C(C=C1)C(=O)OC)Cl Chemical compound BrC1=C(N(C2=CC=C(C=C12)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F)C=1C=C(C=CC=1)C1=C(C=C(C=C1)C(=O)OC)Cl AKMFRQDSDONGFA-UHFFFAOYSA-N 0.000 description 1
- DHTLZEJRTORWIR-UHFFFAOYSA-N BrC=1C=C(C=CC=1)C1(CC(C1)C(=O)O)O Chemical compound BrC=1C=C(C=CC=1)C1(CC(C1)C(=O)O)O DHTLZEJRTORWIR-UHFFFAOYSA-N 0.000 description 1
- JDDIWHBDQOGCFW-UHFFFAOYSA-N BrC=1N(C2=CC=CC=C2C=1C1=C(SC=C1)C#N)C(=O)OC(C)(C)C Chemical compound BrC=1N(C2=CC=CC=C2C=1C1=C(SC=C1)C#N)C(=O)OC(C)(C)C JDDIWHBDQOGCFW-UHFFFAOYSA-N 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- FAKIPUNHUNCSKF-UHFFFAOYSA-N C(#N)C=1SC=CC=1C1=C(N(C2=CC=CC=C12)C(=O)OC(C)(C)C)C1=CC=CC=C1 Chemical compound C(#N)C=1SC=CC=1C1=C(N(C2=CC=CC=C12)C(=O)OC(C)(C)C)C1=CC=CC=C1 FAKIPUNHUNCSKF-UHFFFAOYSA-N 0.000 description 1
- GENFTVYQNQQZNP-UHFFFAOYSA-N C(#N)C=1SC=CC=1C1=C(N(C2=CC=CC=C12)C(=O)OC(C)(C)C)C1=CN=CS1 Chemical compound C(#N)C=1SC=CC=1C1=C(N(C2=CC=CC=C12)C(=O)OC(C)(C)C)C1=CN=CS1 GENFTVYQNQQZNP-UHFFFAOYSA-N 0.000 description 1
- JIARNDAJWJDAKQ-UHFFFAOYSA-N C(#N)C=1SC=CC=1C1=C(N(C2=CC=CC=C12)CCC(=O)OC)C=1SC=CC=1 Chemical compound C(#N)C=1SC=CC=1C1=C(N(C2=CC=CC=C12)CCC(=O)OC)C=1SC=CC=1 JIARNDAJWJDAKQ-UHFFFAOYSA-N 0.000 description 1
- HGYPYWSHEVDCFJ-UHFFFAOYSA-N C(=O)(OC)C1=CC=C2C(C3=C(C#N)SC=C3)=C(C=3SC=CC=3)NC2=C1 Chemical compound C(=O)(OC)C1=CC=C2C(C3=C(C#N)SC=C3)=C(C=3SC=CC=3)NC2=C1 HGYPYWSHEVDCFJ-UHFFFAOYSA-N 0.000 description 1
- DIXSSYKFHWFXRR-UHFFFAOYSA-N C1(=C(C=CS1)Br)C1COC1 Chemical compound C1(=C(C=CS1)Br)C1COC1 DIXSSYKFHWFXRR-UHFFFAOYSA-N 0.000 description 1
- QFVTXHUBSHTWBU-UHFFFAOYSA-N CC(C1=CC=C(C=C1)S(=O)(=O)N1C(C(=C2C1=CC=C(F)[CH]2)I)=C1C=C(C2=CC=C(C(=O)OC)C=C2Cl)C=C[CH]1)(O)C Chemical compound CC(C1=CC=C(C=C1)S(=O)(=O)N1C(C(=C2C1=CC=C(F)[CH]2)I)=C1C=C(C2=CC=C(C(=O)OC)C=C2Cl)C=C[CH]1)(O)C QFVTXHUBSHTWBU-UHFFFAOYSA-N 0.000 description 1
- LPVNSIWQDZLLLQ-UHFFFAOYSA-N CC(OCCS(C1=C(CO)C=CC(Br)=C1)(=O)=O)=O Chemical compound CC(OCCS(C1=C(CO)C=CC(Br)=C1)(=O)=O)=O LPVNSIWQDZLLLQ-UHFFFAOYSA-N 0.000 description 1
- RUKNEMCYSXPINJ-UHFFFAOYSA-N CC(OCCSC1=C(CO)C=CC(Br)=C1)=O Chemical compound CC(OCCSC1=C(CO)C=CC(Br)=C1)=O RUKNEMCYSXPINJ-UHFFFAOYSA-N 0.000 description 1
- KCBAMQOKOLXLOX-BSZYMOERSA-N CC1=C(SC=N1)C2=CC=C(C=C2)[C@H](C)NC(=O)[C@@H]3C[C@H](CN3C(=O)[C@H](C(C)(C)C)NC(=O)CCCCCCCCCCNCCCONC(=O)C4=C(C(=C(C=C4)F)F)NC5=C(C=C(C=C5)I)F)O Chemical compound CC1=C(SC=N1)C2=CC=C(C=C2)[C@H](C)NC(=O)[C@@H]3C[C@H](CN3C(=O)[C@H](C(C)(C)C)NC(=O)CCCCCCCCCCNCCCONC(=O)C4=C(C(=C(C=C4)F)F)NC5=C(C=C(C=C5)I)F)O KCBAMQOKOLXLOX-BSZYMOERSA-N 0.000 description 1
- BQXUPNKLZNSUMC-YUQWMIPFSA-N CCN(CCCCCOCC(=O)N[C@H](C(=O)N1C[C@H](O)C[C@H]1C(=O)N[C@@H](C)c1ccc(cc1)-c1scnc1C)C(C)(C)C)CCOc1ccc(cc1)C(=O)c1c(sc2cc(O)ccc12)-c1ccc(O)cc1 Chemical compound CCN(CCCCCOCC(=O)N[C@H](C(=O)N1C[C@H](O)C[C@H]1C(=O)N[C@@H](C)c1ccc(cc1)-c1scnc1C)C(C)(C)C)CCOc1ccc(cc1)C(=O)c1c(sc2cc(O)ccc12)-c1ccc(O)cc1 BQXUPNKLZNSUMC-YUQWMIPFSA-N 0.000 description 1
- CYAPXHAZILZDKW-UHFFFAOYSA-N CCOC(=O)CS(=O)(=O)c1cc(Br)cc(F)c1CO Chemical compound CCOC(=O)CS(=O)(=O)c1cc(Br)cc(F)c1CO CYAPXHAZILZDKW-UHFFFAOYSA-N 0.000 description 1
- FZEKCBHQDITGOI-UHFFFAOYSA-N CN1CC(C1)(C2=CC=CC=C2C3=C(N(C4=C3C=C(C=C4)F)S(=O)(=O)C5=CC=C(C=C5)C(F)F)C6=CC=CC(=C6)C7=C(C=C(C=C7)C(=O)OC)Cl)F Chemical compound CN1CC(C1)(C2=CC=CC=C2C3=C(N(C4=C3C=C(C=C4)F)S(=O)(=O)C5=CC=C(C=C5)C(F)F)C6=CC=CC(=C6)C7=C(C=C(C=C7)C(=O)OC)Cl)F FZEKCBHQDITGOI-UHFFFAOYSA-N 0.000 description 1
- JSRZDSLUZDKSEC-UHFFFAOYSA-N COC(=O)C1=CC=C(C(Cl)=C1)C1=CC=CC(=C1)C#CC1=CC(OC)=C(F)C=C1NS(=O)(=O)C1=CC=C(C=C1)C(F)F Chemical compound COC(=O)C1=CC=C(C(Cl)=C1)C1=CC=CC(=C1)C#CC1=CC(OC)=C(F)C=C1NS(=O)(=O)C1=CC=C(C=C1)C(F)F JSRZDSLUZDKSEC-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- SANKOTCDZLGVSR-UHFFFAOYSA-N ClC1=C(C=CC(=C1)C(=O)O)C1=CC(=CC=C1)C1=C(C=2C(=CN=C(C=2)O)N1S(=O)(=O)C1=CC=C(C=C1)C(F)F)C1=C(C=CC=C1C#N)C#N Chemical compound ClC1=C(C=CC(=C1)C(=O)O)C1=CC(=CC=C1)C1=C(C=2C(=CN=C(C=2)O)N1S(=O)(=O)C1=CC=C(C=C1)C(F)F)C1=C(C=CC=C1C#N)C#N SANKOTCDZLGVSR-UHFFFAOYSA-N 0.000 description 1
- QZWRMBDUEWTVRI-UHFFFAOYSA-N ClC1=C(C=CC(=C1)C(=O)O)C1=CC(=CC=C1)C=1N(C2=CC(=C(C=C2C=1C1=C(C=CC=C1C#N)C#N)O)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F Chemical compound ClC1=C(C=CC(=C1)C(=O)O)C1=CC(=CC=C1)C=1N(C2=CC(=C(C=C2C=1C1=C(C=CC=C1C#N)C#N)O)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F QZWRMBDUEWTVRI-UHFFFAOYSA-N 0.000 description 1
- ZVAXSEVCJDWIJA-UHFFFAOYSA-N ClC1=C(C=CC(=C1)C(=O)O)C1=CC(=CC=C1)C=1N(C2=CC=C(C=C2C=1C1=C(C=CC=C1)C#N)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F Chemical compound ClC1=C(C=CC(=C1)C(=O)O)C1=CC(=CC=C1)C=1N(C2=CC=C(C=C2C=1C1=C(C=CC=C1)C#N)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F ZVAXSEVCJDWIJA-UHFFFAOYSA-N 0.000 description 1
- FXHAGTDQYKAIJY-UHFFFAOYSA-N ClC1=C(C=CC(=C1)C(=O)O)C1=CC(=CC=C1)C=1N(C2=CC=C(C=C2C=1C1=C(C=CC=C1C#N)C#N)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F Chemical compound ClC1=C(C=CC(=C1)C(=O)O)C1=CC(=CC=C1)C=1N(C2=CC=C(C=C2C=1C1=C(C=CC=C1C#N)C#N)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F FXHAGTDQYKAIJY-UHFFFAOYSA-N 0.000 description 1
- SOMTUWIJHLTNSW-UHFFFAOYSA-N ClC1=C(C=CC(=C1)C(=O)O)C1=CC(=CC=C1)C=1N(C2=CC=C(C=C2C=1C1=C(C=CC=C1C)C#N)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F Chemical compound ClC1=C(C=CC(=C1)C(=O)O)C1=CC(=CC=C1)C=1N(C2=CC=C(C=C2C=1C1=C(C=CC=C1C)C#N)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F SOMTUWIJHLTNSW-UHFFFAOYSA-N 0.000 description 1
- PVAFVCQLODGXAU-UHFFFAOYSA-N ClC1=C(C=CC(=C1)C(=O)OC)C1=CC(=CC=C1)C#C Chemical compound ClC1=C(C=CC(=C1)C(=O)OC)C1=CC(=CC=C1)C#C PVAFVCQLODGXAU-UHFFFAOYSA-N 0.000 description 1
- JFIRCTYRQHEUSU-UHFFFAOYSA-N ClC1=C(C=CC(=C1)C(=O)OC)C1=CC(=CC=C1)C#CC1=C(C=CC(=C1)F)NS(=O)(=O)C1=CC=C(C=C1)C(C)(C)O Chemical compound ClC1=C(C=CC(=C1)C(=O)OC)C1=CC(=CC=C1)C#CC1=C(C=CC(=C1)F)NS(=O)(=O)C1=CC=C(C=C1)C(C)(C)O JFIRCTYRQHEUSU-UHFFFAOYSA-N 0.000 description 1
- QLIGHLSCPPHGHP-UHFFFAOYSA-N ClC1=C(C=CC(=C1)C(=O)OC)C1=CC(=CC=C1)C#C[Si](C)(C)C Chemical compound ClC1=C(C=CC(=C1)C(=O)OC)C1=CC(=CC=C1)C#C[Si](C)(C)C QLIGHLSCPPHGHP-UHFFFAOYSA-N 0.000 description 1
- XOWJMJOFAZMJIT-UHFFFAOYSA-N ClC1=C(C=CC(=C1)C(=O)OC)C1=CC(=CC=C1)C=1N(C2=CC(=C(C=C2C=1C1=C(C=CC=C1C#N)C#N)OC)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F Chemical compound ClC1=C(C=CC(=C1)C(=O)OC)C1=CC(=CC=C1)C=1N(C2=CC(=C(C=C2C=1C1=C(C=CC=C1C#N)C#N)OC)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F XOWJMJOFAZMJIT-UHFFFAOYSA-N 0.000 description 1
- XWVSUOFADAAIMA-UHFFFAOYSA-N ClC1=C(C=CC(=C1)C(=O)OC)C1=CC(=CC=C1)C=1N(C2=CC=C(C=C2C=1)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F Chemical compound ClC1=C(C=CC(=C1)C(=O)OC)C1=CC(=CC=C1)C=1N(C2=CC=C(C=C2C=1)F)S(=O)(=O)C1=CC=C(C=C1)C(F)F XWVSUOFADAAIMA-UHFFFAOYSA-N 0.000 description 1
- NJZJSEOUVATZIS-UHFFFAOYSA-N ClC1=CC=C(C=C1)S(=O)(=O)N1C(=C(C2=CC=CC=C12)B1OC(C(O1)(C)C)(C)C)C=1SC=CC=1 Chemical compound ClC1=CC=C(C=C1)S(=O)(=O)N1C(=C(C2=CC=CC=C12)B1OC(C(O1)(C)C)(C)C)C=1SC=CC=1 NJZJSEOUVATZIS-UHFFFAOYSA-N 0.000 description 1
- OLHXYOMDGSEGBQ-UHFFFAOYSA-N ClC1=CC=C(C=C1)S(=O)(=O)N1C(=C(C2=CC=CC=C12)C1=C(SC=C1)C#N)C1=CN=CS1 Chemical compound ClC1=CC=C(C=C1)S(=O)(=O)N1C(=C(C2=CC=CC=C12)C1=C(SC=C1)C#N)C1=CN=CS1 OLHXYOMDGSEGBQ-UHFFFAOYSA-N 0.000 description 1
- JQYCJILDDTWWOC-UHFFFAOYSA-N ClC1=CC=C(C=C1)S(=O)(=O)N1C(=C(C2=CC=CC=C12)C1=C(SC=C1)C(=O)O)C=1SC=CC=1 Chemical compound ClC1=CC=C(C=C1)S(=O)(=O)N1C(=C(C2=CC=CC=C12)C1=C(SC=C1)C(=O)O)C=1SC=CC=1 JQYCJILDDTWWOC-UHFFFAOYSA-N 0.000 description 1
- NYLLTBHEDUISPY-UHFFFAOYSA-N ClC1=CC=C(C=C1)S(=O)(=O)NC1=C(C=CC=C1)C#CC=1SC=CC=1 Chemical compound ClC1=CC=C(C=C1)S(=O)(=O)NC1=C(C=CC=C1)C#CC=1SC=CC=1 NYLLTBHEDUISPY-UHFFFAOYSA-N 0.000 description 1
- FQLFSGQTIYEJMJ-UHFFFAOYSA-N ClC=1C=C(C=CC=1B1OC(C(O1)(C)C)(C)C)S(=O)(=O)NC(C)=O Chemical compound ClC=1C=C(C=CC=1B1OC(C(O1)(C)C)(C)C)S(=O)(=O)NC(C)=O FQLFSGQTIYEJMJ-UHFFFAOYSA-N 0.000 description 1
- 229940126657 Compound 17 Drugs 0.000 description 1
- 229940126639 Compound 33 Drugs 0.000 description 1
- XZMCDFZZKTWFGF-UHFFFAOYSA-N Cyanamide Chemical compound NC#N XZMCDFZZKTWFGF-UHFFFAOYSA-N 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- RGHNJXZEOKUKBD-UHFFFAOYSA-N D-gluconic acid Natural products OCC(O)C(O)C(O)C(O)C(O)=O RGHNJXZEOKUKBD-UHFFFAOYSA-N 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 239000012594 Earle’s Balanced Salt Solution Substances 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 108700039887 Essential Genes Proteins 0.000 description 1
- 101710174215 Estradiol 17-beta-dehydrogenase 1 Proteins 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- 101150003888 FASN gene Proteins 0.000 description 1
- FWAWZAMJQMHKLF-UHFFFAOYSA-N FC1=CC(=C(C=C1)NS(=O)(=O)C1=CC=C(C=C1)C(C)(C)O)I Chemical compound FC1=CC(=C(C=C1)NS(=O)(=O)C1=CC=C(C=C1)C(C)(C)O)I FWAWZAMJQMHKLF-UHFFFAOYSA-N 0.000 description 1
- 108010039731 Fatty Acid Synthases Proteins 0.000 description 1
- 108010087894 Fatty acid desaturases Proteins 0.000 description 1
- 108090000331 Firefly luciferases Proteins 0.000 description 1
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- 238000013218 HFD mouse model Methods 0.000 description 1
- 101000974340 Homo sapiens Nuclear receptor corepressor 1 Proteins 0.000 description 1
- 101001093899 Homo sapiens Retinoic acid receptor RXR-alpha Proteins 0.000 description 1
- 206010020772 Hypertension Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 102100034343 Integrase Human genes 0.000 description 1
- 229930194542 Keto Natural products 0.000 description 1
- 206010067125 Liver injury Diseases 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 108010090314 Member 1 Subfamily G ATP Binding Cassette Transporter Proteins 0.000 description 1
- 108010090837 Member 5 Subfamily G ATP Binding Cassette Transporter Proteins 0.000 description 1
- 108010090822 Member 8 Subfamily G ATP Binding Cassette Transporter Proteins 0.000 description 1
- RJUFJBKOKNCXHH-UHFFFAOYSA-N Methyl propionate Chemical compound CCC(=O)OC RJUFJBKOKNCXHH-UHFFFAOYSA-N 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- ADLMVBSBYMRPGJ-UHFFFAOYSA-N N(C(=O)C(F)(F)F)C1=CC(C(=O)OC)=CC=C1C#CC=1SC=CC=1 Chemical compound N(C(=O)C(F)(F)F)C1=CC(C(=O)OC)=CC=C1C#CC=1SC=CC=1 ADLMVBSBYMRPGJ-UHFFFAOYSA-N 0.000 description 1
- 238000013231 NASH rodent model Methods 0.000 description 1
- MAHMEQIZIMEUOK-UHFFFAOYSA-N NC1=C(C=C(C(=C1)F)OC)C#CC=1C=C(C=CC=1)C1=C(C=C(C=C1)C(=O)OC)Cl Chemical compound NC1=C(C=C(C(=C1)F)OC)C#CC=1C=C(C=CC=1)C1=C(C=C(C=C1)C(=O)OC)Cl MAHMEQIZIMEUOK-UHFFFAOYSA-N 0.000 description 1
- 229910017917 NH4 Cl Inorganic materials 0.000 description 1
- 238000005481 NMR spectroscopy Methods 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 102100022935 Nuclear receptor corepressor 1 Human genes 0.000 description 1
- WJTSADMUMMJWRG-UHFFFAOYSA-N OC(C(=O)OC)(C)C1=CC=C(C=C1)B1OC(C(O1)(C)C)(C)C Chemical compound OC(C(=O)OC)(C)C1=CC=C(C=C1)B1OC(C(O1)(C)C)(C)C WJTSADMUMMJWRG-UHFFFAOYSA-N 0.000 description 1
- 102100033616 Phospholipid-transporting ATPase ABCA1 Human genes 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 238000002123 RNA extraction Methods 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- 238000011529 RT qPCR Methods 0.000 description 1
- 108010052090 Renilla Luciferases Proteins 0.000 description 1
- 241000242743 Renilla reniformis Species 0.000 description 1
- 108700008625 Reporter Genes Proteins 0.000 description 1
- 102100035178 Retinoic acid receptor RXR-alpha Human genes 0.000 description 1
- 108010038912 Retinoid X Receptors Proteins 0.000 description 1
- 102000034527 Retinoid X Receptors Human genes 0.000 description 1
- GOGRTCNBXQXDOI-UHFFFAOYSA-N S1C=NC=C1C=1NC2=CC=CC=C2C=1C1=C(SC=C1)C#N Chemical compound S1C=NC=C1C=1NC2=CC=CC=C2C=1C1=C(SC=C1)C#N GOGRTCNBXQXDOI-UHFFFAOYSA-N 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- PNUZDKCDAWUEGK-CYZMBNFOSA-N Sitafloxacin Chemical compound C([C@H]1N)N(C=2C(=C3C(C(C(C(O)=O)=CN3[C@H]3[C@H](C3)F)=O)=CC=2F)Cl)CC11CC1 PNUZDKCDAWUEGK-CYZMBNFOSA-N 0.000 description 1
- 238000003477 Sonogashira cross-coupling reaction Methods 0.000 description 1
- 101150044214 Srebf1 gene Proteins 0.000 description 1
- 102000016553 Stearoyl-CoA Desaturase Human genes 0.000 description 1
- 108010085012 Steroid Receptors Proteins 0.000 description 1
- 102000007451 Steroid Receptors Human genes 0.000 description 1
- 108010074436 Sterol Regulatory Element Binding Protein 1 Proteins 0.000 description 1
- 102100026839 Sterol regulatory element-binding protein 1 Human genes 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 101710112766 Syntaxin-1A Proteins 0.000 description 1
- 102000006467 TATA-Box Binding Protein Human genes 0.000 description 1
- 108010044281 TATA-Box Binding Protein Proteins 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- PSLUFJFHTBIXMW-WYEYVKMPSA-N [(3r,4ar,5s,6s,6as,10s,10ar,10bs)-3-ethenyl-10,10b-dihydroxy-3,4a,7,7,10a-pentamethyl-1-oxo-6-(2-pyridin-2-ylethylcarbamoyloxy)-5,6,6a,8,9,10-hexahydro-2h-benzo[f]chromen-5-yl] acetate Chemical compound O([C@@H]1[C@@H]([C@]2(O[C@](C)(CC(=O)[C@]2(O)[C@@]2(C)[C@@H](O)CCC(C)(C)[C@@H]21)C=C)C)OC(=O)C)C(=O)NCCC1=CC=CC=N1 PSLUFJFHTBIXMW-WYEYVKMPSA-N 0.000 description 1
- LXGQHDUCNDGTDB-PAMNCVQHSA-N [2-[(8s,9r,10s,13s,14s,16s,17r)-9-fluoro-11,17-dihydroxy-10,13,16-trimethyl-3-oxo-6,7,8,11,12,14,15,16-octahydrocyclopenta[a]phenanthren-17-yl]-2-oxoethyl] acetate;[2-[(8s,9r,10s,13s,14s,16s,17r)-9-fluoro-11,17-dihydroxy-10,13,16-trimethyl-3-oxo-6,7,8,11, Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@H](C)[C@@](C(=O)COC(C)=O)(O)[C@@]1(C)CC2O.C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@H](C)[C@@](C(=O)COP(O)(O)=O)(O)[C@@]1(C)CC2O LXGQHDUCNDGTDB-PAMNCVQHSA-N 0.000 description 1
- NGSHSQFNJGUKCF-UHFFFAOYSA-N [3-[(4-methylpiperazin-1-yl)methyl]phenyl]boronic acid Chemical compound C1CN(C)CCN1CC1=CC=CC(B(O)O)=C1 NGSHSQFNJGUKCF-UHFFFAOYSA-N 0.000 description 1
- SMNRFWMNPDABKZ-WVALLCKVSA-N [[(2R,3S,4R,5S)-5-(2,6-dioxo-3H-pyridin-3-yl)-3,4-dihydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl] [[[(2R,3S,4S,5R,6R)-4-fluoro-3,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-hydroxyphosphoryl]oxy-hydroxyphosphoryl] hydrogen phosphate Chemical compound OC[C@H]1O[C@H](OP(O)(=O)OP(O)(=O)OP(O)(=O)OP(O)(=O)OC[C@H]2O[C@H]([C@H](O)[C@@H]2O)C2C=CC(=O)NC2=O)[C@H](O)[C@@H](F)[C@@H]1O SMNRFWMNPDABKZ-WVALLCKVSA-N 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- KXKVLQRXCPHEJC-UHFFFAOYSA-N acetic acid trimethyl ester Natural products COC(C)=O KXKVLQRXCPHEJC-UHFFFAOYSA-N 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 108091006088 activator proteins Proteins 0.000 description 1
- ORILYTVJVMAKLC-UHFFFAOYSA-N adamantane Chemical class C1C(C2)CC3CC1CC2C3 ORILYTVJVMAKLC-UHFFFAOYSA-N 0.000 description 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 1
- 230000006978 adaptation Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000001361 adipic acid Substances 0.000 description 1
- 235000011037 adipic acid Nutrition 0.000 description 1
- 210000002171 adipose macrophage Anatomy 0.000 description 1
- 210000000577 adipose tissue Anatomy 0.000 description 1
- 230000006536 aerobic glycolysis Effects 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 125000003342 alkenyl group Chemical group 0.000 description 1
- 125000002355 alkine group Chemical group 0.000 description 1
- 125000003545 alkoxy group Chemical group 0.000 description 1
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 1
- 125000005907 alkyl ester group Chemical group 0.000 description 1
- 125000000304 alkynyl group Chemical group 0.000 description 1
- 125000004419 alkynylene group Chemical group 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 238000010976 amide bond formation reaction Methods 0.000 description 1
- 125000004397 aminosulfonyl group Chemical group NS(=O)(=O)* 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 238000005349 anion exchange Methods 0.000 description 1
- 230000003042 antagnostic effect Effects 0.000 description 1
- 125000005428 anthryl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C(*)=C([H])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 229940121363 anti-inflammatory agent Drugs 0.000 description 1
- 239000002260 anti-inflammatory agent Substances 0.000 description 1
- 230000003110 anti-inflammatory effect Effects 0.000 description 1
- 210000000612 antigen-presenting cell Anatomy 0.000 description 1
- 230000005975 antitumor immune response Effects 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 125000004391 aryl sulfonyl group Chemical group 0.000 description 1
- 125000000732 arylene group Chemical group 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- XRWSZZJLZRKHHD-WVWIJVSJSA-N asunaprevir Chemical compound O=C([C@@H]1C[C@H](CN1C(=O)[C@@H](NC(=O)OC(C)(C)C)C(C)(C)C)OC1=NC=C(C2=CC=C(Cl)C=C21)OC)N[C@]1(C(=O)NS(=O)(=O)C2CC2)C[C@H]1C=C XRWSZZJLZRKHHD-WVWIJVSJSA-N 0.000 description 1
- 125000005334 azaindolyl group Chemical group N1N=C(C2=CC=CC=C12)* 0.000 description 1
- UQUPQEUNHVVNKW-UHFFFAOYSA-N azetidin-1-ium-3-ol;chloride Chemical compound Cl.OC1CNC1 UQUPQEUNHVVNKW-UHFFFAOYSA-N 0.000 description 1
- 125000002393 azetidinyl group Chemical group 0.000 description 1
- 125000003943 azolyl group Chemical group 0.000 description 1
- 239000003855 balanced salt solution Substances 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000004603 benzisoxazolyl group Chemical group O1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000005605 benzo group Chemical group 0.000 description 1
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- KQNZLOUWXSAZGD-UHFFFAOYSA-N benzylperoxymethylbenzene Chemical compound C=1C=CC=CC=1COOCC1=CC=CC=C1 KQNZLOUWXSAZGD-UHFFFAOYSA-N 0.000 description 1
- 229960003237 betaine Drugs 0.000 description 1
- 210000000941 bile Anatomy 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 238000011953 bioanalysis Methods 0.000 description 1
- 230000006696 biosynthetic metabolic pathway Effects 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- 230000005587 bubbling Effects 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- PWLNAUNEAKQYLH-UHFFFAOYSA-N butyric acid octyl ester Natural products CCCCCCCCOC(=O)CCC PWLNAUNEAKQYLH-UHFFFAOYSA-N 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 150000001733 carboxylic acid esters Chemical class 0.000 description 1
- 238000005341 cation exchange Methods 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 208000015114 central nervous system disease Diseases 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 229940125797 compound 12 Drugs 0.000 description 1
- 229940126543 compound 14 Drugs 0.000 description 1
- 229940126208 compound 22 Drugs 0.000 description 1
- 229940125833 compound 23 Drugs 0.000 description 1
- 229940125961 compound 24 Drugs 0.000 description 1
- 229940125846 compound 25 Drugs 0.000 description 1
- 229940125851 compound 27 Drugs 0.000 description 1
- 229940125877 compound 31 Drugs 0.000 description 1
- 229940125878 compound 36 Drugs 0.000 description 1
- 229940125807 compound 37 Drugs 0.000 description 1
- 229940127573 compound 38 Drugs 0.000 description 1
- 229940125936 compound 42 Drugs 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 125000000392 cycloalkenyl group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- MJWVCJUSRGLHFO-UHFFFAOYSA-N cyclohexanesulfonyl chloride Chemical compound ClS(=O)(=O)C1CCCCC1 MJWVCJUSRGLHFO-UHFFFAOYSA-N 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- WMKGGPCROCCUDY-PHEQNACWSA-N dibenzylideneacetone Chemical compound C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 WMKGGPCROCCUDY-PHEQNACWSA-N 0.000 description 1
- 230000000378 dietary effect Effects 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- UXGNZZKBCMGWAZ-UHFFFAOYSA-N dimethylformamide dmf Chemical compound CN(C)C=O.CN(C)C=O UXGNZZKBCMGWAZ-UHFFFAOYSA-N 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 230000036267 drug metabolism Effects 0.000 description 1
- 239000006274 endogenous ligand Substances 0.000 description 1
- 125000002587 enol group Chemical group 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 235000020776 essential amino acid Nutrition 0.000 description 1
- 238000010931 ester hydrolysis Methods 0.000 description 1
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 1
- GQRZOSBPOLYDAA-UHFFFAOYSA-N ethyl 2-(4-bromophenyl)-2-hydroxypropanoate Chemical compound CCOC(=O)C(C)(O)C1=CC=C(Br)C=C1 GQRZOSBPOLYDAA-UHFFFAOYSA-N 0.000 description 1
- SFOMTBBEDGCTHQ-UHFFFAOYSA-N ethyl 2-(4-bromophenyl)-2-oxoacetate Chemical compound CCOC(=O)C(=O)C1=CC=C(Br)C=C1 SFOMTBBEDGCTHQ-UHFFFAOYSA-N 0.000 description 1
- PVBRSNZAOAJRKO-UHFFFAOYSA-N ethyl 2-sulfanylacetate Chemical compound CCOC(=O)CS PVBRSNZAOAJRKO-UHFFFAOYSA-N 0.000 description 1
- PQJJJMRNHATNKG-UHFFFAOYSA-N ethyl bromoacetate Chemical compound CCOC(=O)CBr PQJJJMRNHATNKG-UHFFFAOYSA-N 0.000 description 1
- FAMRKDQNMBBFBR-UHFFFAOYSA-N ethyl n-ethoxycarbonyliminocarbamate Chemical compound CCOC(=O)N=NC(=O)OCC FAMRKDQNMBBFBR-UHFFFAOYSA-N 0.000 description 1
- 125000000816 ethylene group Chemical group [H]C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 208000010706 fatty liver disease Diseases 0.000 description 1
- 210000003608 fece Anatomy 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 210000004211 gastric acid Anatomy 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 239000000174 gluconic acid Substances 0.000 description 1
- 235000012208 gluconic acid Nutrition 0.000 description 1
- 229960002989 glutamic acid Drugs 0.000 description 1
- 229960003180 glutathione Drugs 0.000 description 1
- 230000034659 glycolysis Effects 0.000 description 1
- ZJYYHGLJYGJLLN-UHFFFAOYSA-N guanidinium thiocyanate Chemical compound SC#N.NC(N)=N ZJYYHGLJYGJLLN-UHFFFAOYSA-N 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 231100000234 hepatic damage Toxicity 0.000 description 1
- 230000010224 hepatic metabolism Effects 0.000 description 1
- 125000004366 heterocycloalkenyl group Chemical group 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 239000003395 histamine H3 receptor antagonist Substances 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- 229910000042 hydrogen bromide Inorganic materials 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- RCCPEORTSYDPMB-UHFFFAOYSA-N hydroxy benzenecarboximidothioate Chemical compound OSC(=N)C1=CC=CC=C1 RCCPEORTSYDPMB-UHFFFAOYSA-N 0.000 description 1
- 239000005457 ice water Substances 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 150000008624 imidazolidinones Chemical class 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 230000001506 immunosuppresive effect Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 229940060367 inert ingredients Drugs 0.000 description 1
- 239000012442 inert solvent Substances 0.000 description 1
- 230000006749 inflammatory damage Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 108091006086 inhibitor proteins Proteins 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 239000013067 intermediate product Substances 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 125000004491 isohexyl group Chemical group C(CCC(C)C)* 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 230000000155 isotopic effect Effects 0.000 description 1
- 125000000468 ketone group Chemical group 0.000 description 1
- 229940043355 kinase inhibitor Drugs 0.000 description 1
- 238000010983 kinetics study Methods 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 150000002596 lactones Chemical class 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 125000005647 linker group Chemical group 0.000 description 1
- 230000037356 lipid metabolism Effects 0.000 description 1
- 230000004132 lipogenesis Effects 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- CNOXNGAZMFFQSR-UHFFFAOYSA-N lithium;propylazanide Chemical compound [Li+].CCC[NH-] CNOXNGAZMFFQSR-UHFFFAOYSA-N 0.000 description 1
- 230000008818 liver damage Effects 0.000 description 1
- 208000019423 liver disease Diseases 0.000 description 1
- 208000018191 liver inflammation Diseases 0.000 description 1
- 210000001853 liver microsome Anatomy 0.000 description 1
- 210000005228 liver tissue Anatomy 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- WBGPNPZUWVTYAA-UHFFFAOYSA-N methane;dihydrochloride Chemical compound C.Cl.Cl WBGPNPZUWVTYAA-UHFFFAOYSA-N 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- HNQIVZYLYMDVSB-UHFFFAOYSA-N methanesulfonimidic acid Chemical compound CS(N)(=O)=O HNQIVZYLYMDVSB-UHFFFAOYSA-N 0.000 description 1
- YARHWRVGFILLHG-UHFFFAOYSA-N methyl 1-(3-bromophenyl)-3-methylazetidine-3-carboxylate Chemical compound BrC=1C=C(C=CC=1)N1CC(C1)(C(=O)OC)C YARHWRVGFILLHG-UHFFFAOYSA-N 0.000 description 1
- AJAZAOHWCRDHJZ-UHFFFAOYSA-N methyl 1-(3-bromophenyl)azetidine-3-carboxylate Chemical compound BrC=1C=C(C=CC=1)N1CC(C1)C(=O)OC AJAZAOHWCRDHJZ-UHFFFAOYSA-N 0.000 description 1
- CBBXJYWREWQWCA-UHFFFAOYSA-N methyl 1-(6-bromopyridin-2-yl)azetidine-3-carboxylate Chemical compound BrC1=CC=CC(=N1)N1CC(C1)C(=O)OC CBBXJYWREWQWCA-UHFFFAOYSA-N 0.000 description 1
- JALDGRUZXZRJGJ-UHFFFAOYSA-N methyl 2,2-dimethylbut-3-ynoate Chemical compound COC(=O)C(C)(C)C#C JALDGRUZXZRJGJ-UHFFFAOYSA-N 0.000 description 1
- SUPJZQCSWWGEGR-UHFFFAOYSA-N methyl 2-(3-bromophenyl)-2-methylcyclopropane-1-carboxylate Chemical compound BrC1=CC(C2(C)C(C(=O)OC)C2)=CC=C1 SUPJZQCSWWGEGR-UHFFFAOYSA-N 0.000 description 1
- ZRIXZNKEUIGHOM-UHFFFAOYSA-N methyl 2-(4-bromophenyl)-2-hydroxypropanoate Chemical compound COC(=O)C(C)(O)C1=CC=C(Br)C=C1 ZRIXZNKEUIGHOM-UHFFFAOYSA-N 0.000 description 1
- HLZFFIBXQLALKF-UHFFFAOYSA-N methyl 2-amino-2-(4-bromo-3-chlorophenyl)acetate Chemical compound COC(=O)C(N)c1ccc(Br)c(Cl)c1 HLZFFIBXQLALKF-UHFFFAOYSA-N 0.000 description 1
- YDCHPLOFQATIDS-UHFFFAOYSA-N methyl 2-bromoacetate Chemical compound COC(=O)CBr YDCHPLOFQATIDS-UHFFFAOYSA-N 0.000 description 1
- HBVOFTIXVMRJGG-UHFFFAOYSA-N methyl 3-(2-iodo-N-methylanilino)propanoate Chemical compound COC(=O)CCN(C)c1ccccc1I HBVOFTIXVMRJGG-UHFFFAOYSA-N 0.000 description 1
- ITKPRGJMSMXCMG-UHFFFAOYSA-N methyl 3-(3-bromophenyl)cyclobutane-1-carboxylate Chemical compound BrC=1C=C(C=CC=1)C1CC(C1)C(=O)OC ITKPRGJMSMXCMG-UHFFFAOYSA-N 0.000 description 1
- FIOAPZKXRAPYJN-UHFFFAOYSA-N methyl 3-[N-methyl-2-(2-thiophen-2-ylethynyl)anilino]propanoate Chemical compound N(CCC(=O)OC)(C1=C(C#CC=2SC=CC=2)C=CC=C1)C FIOAPZKXRAPYJN-UHFFFAOYSA-N 0.000 description 1
- WJEBNIVVLJEIKE-UHFFFAOYSA-N methyl 3-amino-4-iodobenzoate Chemical compound COC(=O)C1=CC=C(I)C(N)=C1 WJEBNIVVLJEIKE-UHFFFAOYSA-N 0.000 description 1
- KMFJVYMFCAIRAN-UHFFFAOYSA-N methyl 3-bromobenzoate Chemical compound COC(=O)C1=CC=CC(Br)=C1 KMFJVYMFCAIRAN-UHFFFAOYSA-N 0.000 description 1
- LVNACXVGLUFTBL-UHFFFAOYSA-N methyl 3-methylazetidine-3-carboxylate;hydrochloride Chemical compound Cl.COC(=O)C1(C)CNC1 LVNACXVGLUFTBL-UHFFFAOYSA-N 0.000 description 1
- GTZWFAKNQXXWHV-UHFFFAOYSA-N methyl 4-(3-bromophenyl)benzoate Chemical compound C1=CC(C(=O)OC)=CC=C1C1=CC=CC(Br)=C1 GTZWFAKNQXXWHV-UHFFFAOYSA-N 0.000 description 1
- XITMDVGEJXIJRO-UHFFFAOYSA-N methyl 4-(3-ethynylphenyl)benzoate Chemical compound COC(=O)C1=CC=C(C=C1)C1=CC(=CC=C1)C#C XITMDVGEJXIJRO-UHFFFAOYSA-N 0.000 description 1
- OMTWUICAKUOXOV-UHFFFAOYSA-N methyl 4-bromo-2-methylsulfonylbenzoate Chemical compound COC(=O)C1=CC=C(Br)C=C1S(C)(=O)=O OMTWUICAKUOXOV-UHFFFAOYSA-N 0.000 description 1
- QOAMJQQYVZEHHS-UHFFFAOYSA-N methyl 4-bromo-5-chloro-2-fluorobenzoate Chemical compound COC(=O)C1=CC(Cl)=C(Br)C=C1F QOAMJQQYVZEHHS-UHFFFAOYSA-N 0.000 description 1
- ONVFLPULKYBQAO-UHFFFAOYSA-N methyl 4-bromo-5-chloro-2-methylbenzoate Chemical compound COC(=O)C1=CC(Cl)=C(Br)C=C1C ONVFLPULKYBQAO-UHFFFAOYSA-N 0.000 description 1
- MOFQDKOKODUZPK-UHFFFAOYSA-N methyl 4-chlorosulfonylbenzoate Chemical compound COC(=O)C1=CC=C(S(Cl)(=O)=O)C=C1 MOFQDKOKODUZPK-UHFFFAOYSA-N 0.000 description 1
- HLCCMFLYYDIXDA-UHFFFAOYSA-N methyl 5-chloro-2-fluoro-4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)benzoate Chemical compound ClC=1C(=CC(=C(C(=O)OC)C=1)F)B1OC(C(O1)(C)C)(C)C HLCCMFLYYDIXDA-UHFFFAOYSA-N 0.000 description 1
- 229940095102 methyl benzoate Drugs 0.000 description 1
- ZQWPRMPSCMSAJU-UHFFFAOYSA-N methyl cyclohexanecarboxylate Chemical compound COC(=O)C1CCCCC1 ZQWPRMPSCMSAJU-UHFFFAOYSA-N 0.000 description 1
- 229940017219 methyl propionate Drugs 0.000 description 1
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 1
- 230000003228 microsomal effect Effects 0.000 description 1
- 239000007758 minimum essential medium Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 125000002950 monocyclic group Chemical group 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- SYSQUGFVNFXIIT-UHFFFAOYSA-N n-[4-(1,3-benzoxazol-2-yl)phenyl]-4-nitrobenzenesulfonamide Chemical class C1=CC([N+](=O)[O-])=CC=C1S(=O)(=O)NC1=CC=C(C=2OC3=CC=CC=C3N=2)C=C1 SYSQUGFVNFXIIT-UHFFFAOYSA-N 0.000 description 1
- UUIQMZJEGPQKFD-UHFFFAOYSA-N n-butyric acid methyl ester Natural products CCCC(=O)OC UUIQMZJEGPQKFD-UHFFFAOYSA-N 0.000 description 1
- WOOWBQQQJXZGIE-UHFFFAOYSA-N n-ethyl-n-propan-2-ylpropan-2-amine Chemical compound CCN(C(C)C)C(C)C.CCN(C(C)C)C(C)C WOOWBQQQJXZGIE-UHFFFAOYSA-N 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- PIDFDZJZLOTZTM-KHVQSSSXSA-N ombitasvir Chemical compound COC(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@H]1C(=O)NC1=CC=C([C@H]2N([C@@H](CC2)C=2C=CC(NC(=O)[C@H]3N(CCC3)C(=O)[C@@H](NC(=O)OC)C(C)C)=CC=2)C=2C=CC(=CC=2)C(C)(C)C)C=C1 PIDFDZJZLOTZTM-KHVQSSSXSA-N 0.000 description 1
- 238000003305 oral gavage Methods 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 150000004965 peroxy acids Chemical class 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 125000005561 phenanthryl group Chemical group 0.000 description 1
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 1
- RLOWWWKZYUNIDI-UHFFFAOYSA-N phosphinic chloride Chemical compound ClP=O RLOWWWKZYUNIDI-UHFFFAOYSA-N 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000003367 polycyclic group Chemical group 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 238000010926 purge Methods 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 238000003753 real-time PCR Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000006722 reduction reaction Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 102200123609 rs28937580 Human genes 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 239000012488 sample solution Substances 0.000 description 1
- 238000007127 saponification reaction Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 229940076279 serotonin Drugs 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 238000010898 silica gel chromatography Methods 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- LMUMMJCCZMWLEN-UHFFFAOYSA-N spiro[3.3]heptyl Chemical group [CH]1CCC11CCC1 LMUMMJCCZMWLEN-UHFFFAOYSA-N 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 230000000707 stereoselective effect Effects 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- IIACRCGMVDHOTQ-UHFFFAOYSA-N sulfamic acid Chemical compound NS(O)(=O)=O IIACRCGMVDHOTQ-UHFFFAOYSA-N 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- RQSHFNCPWDVTPK-UHFFFAOYSA-N tert-butyl 3-(2-bromophenyl)-3-hydroxyazetidine-1-carboxylate Chemical compound C1N(C(=O)OC(C)(C)C)CC1(O)C1=CC=CC=C1Br RQSHFNCPWDVTPK-UHFFFAOYSA-N 0.000 description 1
- WWMZOMHUEMTTQO-UHFFFAOYSA-N tert-butyl 3-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)indole-1-carboxylate Chemical compound C12=CC=CC=C2N(C(=O)OC(C)(C)C)C=C1B1OC(C)(C)C(C)(C)O1 WWMZOMHUEMTTQO-UHFFFAOYSA-N 0.000 description 1
- QPVJCAHZBTXUQF-UHFFFAOYSA-N tert-butyl 3-bromo-2-(1,3-thiazol-5-yl)indole-1-carboxylate Chemical compound C1=CC=C2C(Br)=C(C=3SC=NC=3)N(C2=C1)C(=O)OC(C)(C)C QPVJCAHZBTXUQF-UHFFFAOYSA-N 0.000 description 1
- VMKIXWAFFVLJCK-UHFFFAOYSA-N tert-butyl 3-oxoazetidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CC(=O)C1 VMKIXWAFFVLJCK-UHFFFAOYSA-N 0.000 description 1
- RUPAXCPQAAOIPB-UHFFFAOYSA-N tert-butyl formate Chemical group CC(C)(C)OC=O RUPAXCPQAAOIPB-UHFFFAOYSA-N 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- WHRNULOCNSKMGB-UHFFFAOYSA-N tetrahydrofuran thf Chemical compound C1CCOC1.C1CCOC1 WHRNULOCNSKMGB-UHFFFAOYSA-N 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- WROMPOXWARCANT-UHFFFAOYSA-N tfa trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F.OC(=O)C(F)(F)F WROMPOXWARCANT-UHFFFAOYSA-N 0.000 description 1
- 231100001274 therapeutic index Toxicity 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000004496 thiazol-5-yl group Chemical group S1C=NC=C1* 0.000 description 1
- YXFVVABEGXRONW-JGUCLWPXSA-N toluene-d8 Chemical compound [2H]C1=C([2H])C([2H])=C(C([2H])([2H])[2H])C([2H])=C1[2H] YXFVVABEGXRONW-JGUCLWPXSA-N 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- LEIMLDGFXIOXMT-UHFFFAOYSA-N trimethylsilyl cyanide Chemical compound C[Si](C)(C)C#N LEIMLDGFXIOXMT-UHFFFAOYSA-N 0.000 description 1
- BPLKQGGAXWRFOE-UHFFFAOYSA-M trimethylsulfoxonium iodide Chemical compound [I-].C[S+](C)(C)=O BPLKQGGAXWRFOE-UHFFFAOYSA-M 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- 238000010396 two-hybrid screening Methods 0.000 description 1
- 229940005605 valeric acid Drugs 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- UGOMMVLRQDMAQQ-UHFFFAOYSA-N xphos Chemical compound CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 UGOMMVLRQDMAQQ-UHFFFAOYSA-N 0.000 description 1
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/403—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with carbocyclic rings, e.g. carbazole
- A61K31/404—Indoles, e.g. pindolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4439—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. omeprazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/02—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring
- C07D209/04—Indoles; Hydrogenated indoles
- C07D209/10—Indoles; Hydrogenated indoles with substituted hydrocarbon radicals attached to carbon atoms of the hetero ring
- C07D209/18—Radicals substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/10—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/04—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/10—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D451/00—Heterocyclic compounds containing 8-azabicyclo [3.2.1] octane, 9-azabicyclo [3.3.1] nonane, or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane or granatane alkaloids, scopolamine; Cyclic acetals thereof
- C07D451/02—Heterocyclic compounds containing 8-azabicyclo [3.2.1] octane, 9-azabicyclo [3.3.1] nonane, or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane or granatane alkaloids, scopolamine; Cyclic acetals thereof containing not further condensed 8-azabicyclo [3.2.1] octane or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane; Cyclic acetals thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D495/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/05—Isotopically modified compounds, e.g. labelled
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Gastroenterology & Hepatology (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Indole Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Optical Modulation, Optical Deflection, Nonlinear Optics, Optical Demodulation, Optical Logic Elements (AREA)
Abstract
本發明係關於含有磺醯基部分之雙環化合物(例如,吲哚),其結合至肝X受體(LXRα及/或LXRβ)且較佳地充當LXR之反向促效劑。
Description
本發明係關於作為肝X受體(LXR)調節劑之新穎化合物且關於含有該等新穎化合物之醫藥組合物。本發明進一步係關於該等化合物在預防及/或治療與肝X受體之調節相關聯之疾病中的用途。
肝X受體LXRα (NR1H3)及LXRβ (NR1H2)為核受體蛋白超家族之成員。兩種受體與類視黃素X受體(RXRα、β或γ)一起形成異二聚複合物,且結合至位於LXR反應基因之啟動子區域中之LXR反應元素(例如,DR4型元素)。兩種受體均為藉由結合配位體(諸如環氧甾醇或膽固醇生物合成途徑之中間物(諸如鏈甾醇))生理學上調節之轉錄因子。在不存在配位體之情況下,咸信LXR-RXR異質二聚體藉由輔助抑制劑(諸如NCOR1)保持結合至含DR4型元素之複合物,導致抑制對應標靶基因。在結合促效劑配位體(一種諸如先前提及之環氧甾醇或甾類中間物的內源性配位體抑或一種合成的藥理學配位體)之後,改變異二聚複合物之構形,使得釋放輔助抑制蛋白且募集輔助活化蛋白(諸如NCOA1 (SRC1)),導致轉錄刺激相應標靶基因。當LXRβ表現於大部分組織中時,LXRα選擇性地更多表現於肝臟、腸道、脂肪組織及巨噬細胞之細胞中。LXRα及LXRβ在mRNA或蛋白質含量下之相對表現可在相同物種之不同組織之間或在不同物種的給定組織之間不同。LXR經由轉錄控制諸如巨噬細胞中之ABCA1及ABCG1以及肝臟及腸道中之ABCG5及ABCG8的標靶基因來控制反向膽固醇運輸,亦即組織結合之外周膽固醇至HDL中及自此處至膽液及糞便中之移動。此解釋LXR促效劑在膳食LDLR-KO小鼠模型中之抗動脈粥樣硬化活性。然而,LXR確實亦控制涉及脂肪生成之基因(例如,Srebp1c、Scd1、Fasn)之轉錄,其造成在用LXR促效劑進行延長治療後觀測到的肝脂肪變性。
肝脂肪變性傾向被視為對研發用於動脈粥樣硬化治療之非選擇性LXR促效劑之主要阻障。
非酒精性脂肪肝病(NAFLD)被視為代謝症候群在肝中之表現且NAFLD已在世界範圍內流行(Estes等人,Hepatology 2018;67:123;Estes等人,J. Hepatol. 2018;69:896)。NAFLD之病變範圍在良性及可逆脂肪變性至脂肪變性肝炎(非酒精性脂肪變性肝炎,NASH)內,其可向纖維化、肝硬化且潛在地進一步向肝細胞癌發生發展。經典地,二步驟模型已用於描述NAFLD至NASH之進展,其中肝脂肪變性作為引發第一步驟,其對引起發炎及肝損傷的二級信號(外源性或內源性)敏感(Day等人,Gastroenterology 1998;114:842)。當今,自良性NAFLD向更具攻擊性狀態的NASH之轉化被視為係多因素的,,其中遺傳、環境、生活方式及營養影響在不同個別設定中起不同作用。獨立於疾病之病因,由於不利的後遺症,諸如肝硬化、肝細胞癌或其他形式之肝相關模態,存在阻止NAFLD進展之極強未滿足之醫學需要。
LXR表現量與NAFLD狀態緊密相關。值得注意地,LXR表現經展示與NAFLD患者體內之脂肪沈積程度以及肝發炎及纖維化相關(Ahn等人,Dig. Dis. Sci. 2014;59:2975)。另外,血清及肝鏈甾醇含量在患有NASH之患者體內增加但在患有單純肝脂肪變性之人體內不增加。鏈甾醇已表徵為強效內源性LXR促效劑(Yang等人,J. Biol. Chem. 2006;281:27816)。鑒於大體而言LXR作為肝脂質生成及脂質代謝之主調節子及LXR表現量與脂肪肝病階段的前述關聯之已知涉及,因此NAFLD/NASH患者可受益於經由阻斷LXR之活性之小分子拮抗劑或反向促效劑來阻斷此等患者之肝中的增加之LXR活性。在進行此治療時,需要注意,此類LXR拮抗劑或反向促效劑並不干擾外周組織或巨噬細胞中之LXR以避免擾亂由此等組織或細胞中之LXR管理之抗動脈粥樣硬化的反向膽固醇運輸。
某些公開案(例如,Peet等人,Cell 1998;93:693及Schultz等人,Genes Dev. 2000;14:2831)已強調LXRα特定言之對於刺激脂質生成且因此在肝中建立NAFLD之作用。其指示主要係LXRα負責肝脂肪變性,因此LXRα特異性拮抗劑或反向促效劑可滿足或期望用於僅治療肝脂肪變性。然而,此等資料係僅藉由將LXRα、LXRβ或雙敲除之野生型小鼠關於其對於高脂膳食產生脂肪變性之敏感性進行比較而產生的。其並不解釋人類體內之LXRα及LXRβ相較於鼠類肝之相對表現量中之主要差異。然而,LXRα為嚙齒動物肝中之主要LXR亞型,相較於LXRα,若LXRβ在人類肝中並無更高含量,則其表現為約相同(來自Unigene或其他表現資料庫之資料)。此係藉由在人類階段I臨床研究中測試LXRβ選擇性促效劑例示(Kirchgessner等人,Cell Metab. 2016;24:223),其導致誘導較強肝脂肪變性,儘管其經展示並未活化人類LXRα。
因此可假定,應需要不具有經設計以治療針對特定LXR亞型之NAFLD或NASH之LXR調節劑的較強偏好。若此化合物之藥物動力學曲線明確確保足夠肝暴露及駐存時間以覆蓋兩種LXR之臨床使用,則可允許某一程度之LXR亞型選擇性。
總體而言,治療諸如NAFLD或NASH之疾病將需要以肝選擇性方式阻斷LXR之LXR調節劑且此可經由必須經建置至此類LXR調節劑中之親肝性藥代動力學及組織分佈特性實現。
藉由目前為止研究之所有主要細胞類型中之LXR施加對於脂質生成之主要控制。癌細胞亦高度取決於重新脂質生成且因此Flaveny等人在癌細胞中且在動物癌症模型中測試LXR反向促效劑工具化合物SR9243
(Cancer Cell 2015;28:42)。大體而言,其可展示SR9243
抑制脂質生成連同瓦爾堡糖酵解效應(Warburg glycolysis effect)且此分子效應引起活體內細胞凋亡且降低腫瘤生長。
先前技術
Zuercher等人描述結構上不相關三元磺醯胺GSK2033
為第一強效細胞活性LXR拮抗劑(J. Med. Chem. 2010;53:3412)。隨後,此化合物經報導針對多個其他核受體展示明顯程度之雜交(Griffett & Burris, Biochem. Biophys. Res. Commun. 2016;479:424)。據稱,GSK2033
在大鼠及人類肝微粒體分析中展示快速清除率(Clint
> 1.0毫升/分鐘/毫克蛋白質)且GSK2033
之此快速肝代謝妨礙其活體內用途。因而,GSK2033
僅在細胞研究中為對LXR適用之化學品探針。
特定言之,來自此申請案之以下化合物進一步描述於主要來自相同發明人/作者群之一些公開案中:SR9238
經描述為在非經腸投與
之後抑制肝脂肪變性之肝選擇性LXR反向促效劑(Griffett等人,ACS Chem. Biol. 2013;8:559)。
在SR9238
之酯皂化後,形成LXR非活性酸衍生物SR10389
。隨後,此化合物具有全身性暴露。此外,其描述SR9238
在非經腸投與後再次在NASH模型中抑制纖維化(Griffett等人,Mol. Metab. 2015;4:35)。藉由相關SR9243 ,
描述對於好氧的糖酵解(瓦爾堡效應)及脂肪生成之效應(Flaveny等人,Cancer Cell 2015;28:42)且藉由Huang等人(BioMed Res. Int. 2018;8071093)使用SR9243
證實藉由SR9238
獲得之NASH抑制資料。
在所有實例中,含有(雜)芳基部分之酸係經由氧原子連接至分子之其餘部分。大部分所關注實例為GW3965
(Collins等人. J. Med. Chem. 2002;45:1963)及來自Rgenix之臨床候選者RGX-104
。
WO2016/207217揭示式(D)之雙環衍生物,其並不屬於本發明之範疇,此係由於-SO2
-連接之殘基對於A而言係不可能的,其可表示包括吲哚之雙環結構。然而,揭示中間物D1
(實例69,步驟E),其為吲哚之3位置中經鄰取代之芳基之唯一實例。
WO2016/106266揭示式(E)之氮雜吲哚為TGFβ拮抗劑
其中R為視情況經取代之雜環或雜雙環基團,R8
選自大範圍取代基,包括-SO2
R9
。殘基R9
可選自大範圍取代基,包括C3
-C8
環烷基及雜環烷基。氮雜吲哚之2及3位置兩者經環狀部分取代之唯一實例為結構E1
及E2
。
WO2013/111150揭示式(F)之金剛烷衍生物為17β羥基類固醇去氫酶1型抑制劑
其中Ar為視情況經取代之C1-
C18
雜芳基,A可為-SO2
-及B可不存在。未展示實例,其在本發明之範疇內。
WO2013/028999揭示式(G)之結構為神經精神病症之潛在療法
其中Z可不存在且A表示環結構,例如式(G1
)之3-取代吲哚。此處R15
及R17
可選自視情況經取代之芳基及雜芳基部分。然而,關於此情況,未展示實例。
WO2013/012649揭示用於治療HIV之式(H)之氮雜吲哚
其中連接子元素L可為-SO2
-,R5
及R6
可獨立地選自大範圍取代基,包括視情況經取代之環烷基、雜環烷基、芳基及雜芳基。在大多數情況下,R2
為羧酸或其生物電子等排物體。未展示實例,其在本發明之範疇內。
WO2010/124793及WO2008/132434揭示式(J)之氮雜吲哚為殺真菌劑
其中R4
可選自大範圍取代基,包括視情況經取代之環基、雜環基、芳基及雜芳基。R3
可選自大範圍取代基,包括-SO2
R12 ,
其中同樣R12
可選自大範圍取代基,包括視情況經取代之環基、雜環基、芳基及雜芳基。氮雜吲哚之2及3位置兩者經環狀部分取代之唯一實例為結構J1
。
WO2010/010186揭示式(K)之JAK激酶抑制劑
其中環Cy選自芳基及雜芳基。可建構在本發明之範疇內之其中L1
等於SO2
,n等於0,R3a
例如未經取代之環烷基、雜環烷基、芳基或雜芳基且R3b
選自視情況經取代之環烷基、雜環烷基、芳基或雜芳基衍生物,然而,未展示實例。
WO2009/032116揭示用於治療病毒感染之式(L)之吲哚
其中R1
可選自大範圍取代基,包括-SO2
-。對於R2
而言環狀部分(L1
至L3
)及對於R3
而言環狀部分(L4
及L5
)係可能的。在相關申請案WO2009/032125及WO2009/064848中,對於R3
而言甚至更多環狀部分係可能的。R10
可選自視情況經取代之環烷基、環烯基、雜環烷基、雜環烯基、芳基及雜芳基。在WO2009/064852中,結構L6
之環狀部分對於R3
而言係可能的。在所有申請案中,未展示實例,其在本發明之範疇內。
WO2008/116833揭示式(M)之氮雜環丁烷化合物,其用於治療對調節血清素5-羥基色胺-6(5-HT6
)受體起反應之病症
其中X1
及X2
獨立地為N或CRx
。殘基Rx
可選自大範圍取代基,包括視情況經取代之苯基或C3-6
環烷基。殘基A可選自視情況經取代之C3-6
環烷基、芳基或雜芳基。未揭示其中吲哚之2位及3位兩者直接地經環狀部分取代的實例。
WO2008/003736揭示式(N)之氮雜吲哚
其中R2
及R3
可獨立地包含飽和含氮雜環部分(例如,哌啶)同時m可為0。根據技術方案8,Q可表示保護基-SO2
-Ph。未揭示其中吲哚之2位及3位兩者直接地經環狀部分取代的實例。
WO2007/075555揭示式(P)之CB1
拮抗劑
其中R1
可選自大範圍取代基,包括經取代之吲哚,同時X可表示一鍵。環狀部分連接至吲哚之3位之唯一實例為結構P1。更特定言之,式(P)之吲哚衍生物作為組胺H3拮抗劑描述於WO2004/000831中,同樣藉由結構P1
作為實例。
WO2007/134169及WO2006/050236揭示式(Q)之吲哚衍生物為TNF-α產物之抑制劑
其中X可為SO2
,Y可選自大範圍取代基,包括環烷基、雜環烷基、芳基及雜環,同時Z必須選自-B(OR)2
、-CONROR及-N(OR)COR (其中R = H或烷基)。R3
及R8
可獨立地選自大範圍取代基,包括環烷基及5員或6員有機環。未揭示其中吲哚之2位及3位兩者經環狀部分取代的實例。
WO2005/034941揭示式(R)之雙環結構為C型肝炎病毒聚合酶之抑制劑
其中Ar1
及Ar為5至10員芳環,A1
可為環烷基(視情況經烷氧基取代)且n可為0。本發明之最接近實例為結構R1
及R2
。
WO2005/14000揭示式(S)之吲哚以治療5-HT6
-受體相關疾病,諸如肥胖及CNS病症
其中R1
表示氮連接飽和或不飽和雜環系統,R2
可選自大範圍取代基,包括飽和或不飽和環烷基,n選自0至4且殘基A及B形成飽和或不飽和環烷基環。未揭示其中吲哚之2位及3位兩者直接地經環狀部分取代(亦即n = 0)的實例。
WO2002/51837及WO2002/36562分別揭示式(T)及(T1)之雙環結構,用於治療5-HT6
-受體相關疾病
其中X及Y可獨立地表示碳原子,其視情況經芳基或雜芳基部分取代,R8
亦可表示視情況經取代之芳基或雜芳基部分。式(T1)之左側上之環狀部分通常為哌嗪。未揭示其中(氮雜)吲哚之2及3位置兩者經環狀部分(例如,芳基或雜芳基)取代之實例。最接近實例為結構T1
。
WO2002/32863揭示式(U)之吲哚以治療5-HT6
受體相關疾病
其中Ar可選自視情況經取代之苯基、萘基或5至10員單環或雙環雜環部分,R2
可為未經取代之苯基且R3
選自氫或3-(1-氮雜雙環[2.2.2]辛-2-烯)基。然而,未展示吲哚之2位及3位處之適合之取代基的實例-最接近實例為結構U1
及U2
。
WO9857931及WO9822452分別揭示式(W)及(W1
)之雙環結構為抗菌劑
其中R2
可選自極寬廣範圍之殘基,包括芳基及雜芳基;及Y可表示NR,以及R選自極廣範圍之殘基,包括芳磺醯基部分。未展示吲哚之2位及3位處之取代基的實例-最接近實例為結構W1
。
WO9822457揭示式(X)之雙環結構為抗炎劑
其中R10
可選自極寬廣範圍之取代基,包括SO2
R30
;且其中R11
、R12
、R30
可選自視情況經取代之芳基及雜芳基。然而,未展示實例,其中R10
實際上具有經SO2
-連接之部分。
WO2001/30343、WO2000/46199、WO2000/46197、WO2000/46195、JP06145150、EP0535926、EP0535925描述吲哚衍生物,其中可在吲哚部分之2位置中連接1H
-或2H
-四唑-5-基部分作為唯一可能環狀部分,其充當羧酸生物電子等排物體。此直接連接之四唑部分之唯一實例揭示於JP06145150中(結構Y1
)。
本發明係關於式(I
)化合物
其甘胺酸結合物、牛磺酸結合物、對映異構體、非對映異構體、互變異構體、N-氧化物、溶劑合物、前藥及醫藥學上可接受之鹽,
其中環A、B、C、D及殘基L及R1
如技術方案1中所定義。
相較於已知LXR反向促效劑,本發明化合物具有類似或更佳LXR反向促效活性。另外,本發明化合物在經口投與後展現有利的肝/血液比使得可避免擾亂藉由外周巨噬細胞中之LXR管理的抗動脈粥樣硬化的反向膽固醇運輸。併入酸性部分(或其生物電子等排體)可改良額外參數,例如微粒體穩定性、可溶性及親脂性。
因此,本發明進一步係關於一種醫藥組合物,其包含式(I
)化合物及至少一種醫藥學上可接受之載劑或賦形劑。
本發明進一步涉及式(I
)之化合物用於預防及/或治療由LXR介導之疾病。
因此,本發明係關於預防及/或治療非酒精性脂肪肝病、非酒精性脂肪變性肝炎、肝炎、肝纖維化、肥胖、胰島素抗性、II型糖尿病、家族性高膽固醇血症、腎病症候群之高膽固醇血症、代謝症候群、心臟脂肪變性、癌症、病毒心肌炎及C型肝炎病毒感染。
LXR調節劑之所需特性連同肝選擇性可由化合物產生,該等化合物遵循由式(I
)表示之結構性圖案
其甘胺酸結合物、牛磺酸結合物、對映異構體、非對映異構體、互變異構體、N-氧化物、溶劑合物、前藥及醫藥學上可接受之鹽,其中為環化5至6員環,其形成6員芳基或含有1至3個獨立地選自N、O及S之雜原子之5至6員雜芳基,其中此環未經取代或經1至4個獨立地選自由以下組成之群的取代基取代:鹵素、CN、SF5
、NO2
、C1-6
烷基、側氧基、C0-6
伸烷基-OR11
、C0-6
伸烷基-(3至6員環烷基)、C0-6
伸烷基-(3至6員雜環烷基)、C0-6
伸烷基-S(O)n
R11
、C0-6
伸烷基-NR11
S(O)2
R11
、C0-6
伸烷基-S(O)2
NR11
R12
、C0-6
伸烷基-NR11
S(O)2
NR11
R12
、C0-6
伸烷基-CO2
R11
、O-C1-6
伸烷基-CO2
R11
、C0-6
伸烷基-O-COR11
、C0-6
伸烷基-CONR11
R12
、C0-6
伸烷基-NR11
-COR11
、C0-6
伸烷基-NR11
-CONR11
R12
、C0-6
伸烷基-O-CONR11
R12
、C0-6
伸烷基-NR11
-CO2
R11
及C0-6
伸烷基-NR11
R12
,
其中烷基、伸烷基、環烷基及雜環烷基未經取代或經1至6個獨立地選自以下之取代基取代:鹵素、CN、側氧基、羥基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;且
其中視情況,芳基或雜芳基部分上之兩個鄰接取代基形成5至8員部分不飽和環,該環視情況含有1至3個獨立地選自O、S或N之雜原子,且
其中新形成之環未經取代或經1至3個獨立地選自以下之取代基取代:鹵素、CN、C1-4
烷基、鹵基-C1-4
烷基、3至6員環烷基、鹵基-(3至6員環烷基)、3至6員雜環烷基、鹵基-(3至6員雜環烷基)、OH、側氧基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、O-C1-4
烷基及O-鹵基-C1-4
烷基;選自由以下組成之群:3至10員環烷基、含有1至3個獨立地選自N、O及S之雜原子之3至10員雜環烷基、6至14員芳基及含有1至4個獨立地選自N、O及S之雜原子之5至14員雜芳基,
其中環烷基、雜環烷基、芳基及雜芳基未經取代或經1至6個獨立地選自由以下組成之群的取代基取代:鹵素、CN、SF5
、NO2
、側氧基、C1-4
烷基、C0-6
伸烷基-OR21
、C0-6
伸烷基-(3至6員環烷基)、C0-6
伸烷基-(3至6員雜環烷基)、C0-6
伸烷基-S(O)n
R21
、C0-6
伸烷基-NR21
S(O)2
R21
、C0-6
伸烷基-S(O)2
NR21
R22
、C0-6
伸烷基-NR21
S(O)2
NR21
R22
、C0-6
伸烷基-CO2
R21
、O-C1-6
伸烷基-CO2
R21
、C0-6
伸烷基-O-COR21
、C0-6
伸烷基-CONR21
R22
、C0-6
伸烷基-NR21
-COR21
、C0-6
伸烷基-NR21
-CONR21
R22
、C0-6
伸烷基-O-CONR21
R22
、C0-6
伸烷基-NR21
-CO2
R21
及C0-6
伸烷基-NR21
R22
,
其中烷基、伸烷基、環烷基及雜環烷基未經取代或經1至6個獨立地選自以下之取代基取代:鹵素、CN、側氧基、羥基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
且其中視情況,芳基或雜芳基部分上之兩個鄰接取代基形成5至8員部分不飽和環,該環視情況含有1至3個獨立地選自O、S或N之雜原子,且
其中此額外環未經取代或經1至4個獨立地選自以下的取代基取代:鹵素、CN、側氧基、OH、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
且其中視情況,環烷基或雜環烷基部分上之兩個鄰接取代基形成5至6員不飽和環,該環視情況含有1至3個獨立地選自O、S或N之雜原子,
其中此額外環未經取代或經1至4個獨立地選自以下的取代基取代:鹵素、CN、側氧基、OH、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;選自由以下組成之群:6員或10員芳基及含有1至3個獨立地選自N、O及S之雜原子之5至10員雜芳基,
其中環烷基、雜環烷基、芳基及雜芳基未經取代或經1至4個獨立地選自由以下組成之群的取代基取代:鹵素、CN、SF5
、NO2
、側氧基、C1-4
烷基、C0-6
伸烷基-OR31
、C0-6
伸烷基-(3至6員環烷基)、C0-6
伸烷基-(3至6員雜環烷基)、C0-6
伸烷基-(6員芳基)、C0-6
伸烷基-(5至6員雜芳基)、C0-6
伸烷基-S(O)n
R31
、C0-6
伸烷基-NR31
S(O)2
R31
、C0-6
伸烷基-S(O)2
NR31
R32
、C0-6
伸烷基-NR31
S(O)2
NR31
R32
、C0-6
伸烷基-CO2
R31
、O-C1-6
伸烷基-CO2
R31
、C0-6
伸烷基-O-COR31
、C0-6
伸烷基-CONR31
R32
、C0-6
伸烷基-NR31
-COR31
、C0-6
伸烷基-NR31
-CONR31
R32
、C0-6
伸烷基-O-CONR31
R32
、C0-6
伸烷基-NR31
-CO2
R31
及C0-6
伸烷基-NR31
R32
,
其中烷基、伸烷基、環烷基、雜環烷基、芳基及雜芳基未經取代或經1至6個獨立地選自以下之取代基取代:鹵素、CN、側氧基、羥基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
且其中視情況,芳基或雜芳基部分上之兩個鄰接取代基形成5至8員部分不飽和環,該環視情況含有1至3個獨立地選自O、S或N之雜原子,且
其中此額外環未經取代或經1至4個獨立地選自以下的取代基取代:鹵素、CN、側氧基、OH、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;選自由以下組成之群:3至10員環烷基、含有1至3個獨立地選自N、O及S之雜原子之3至10員雜環烷基、6至14員芳基及含有1至4個獨立地選自N、O及S之雜原子之5至14員雜芳基,
其中環烷基、雜環烷基、芳基及雜芳基未經取代或經1至6個獨立地選自由以下組成之群的取代基取代:鹵素、CN、SF5
、NO2
、側氧基、C1-4
烷基、C0-6
伸烷基-OR21
、C0-6
伸烷基-(3至6員環烷基)、C0-6
伸烷基-(3至6員雜環烷基)、C0-6
伸烷基-S(O)n
R21
、C0-6
伸烷基-NR21
S(O)2
R21
、C0-6
伸烷基-S(O)2
NR21
R22
、C0-6
伸烷基-NR21
S(O)2
NR21
R22
、C0-6
伸烷基-CR41
(=N-OR41
)、C0-6
伸烷基-CO2
R21
、O-C1-6
伸烷基-CO2
R21
、C0-6
伸烷基-O-COR21
、C0-6
伸烷基-CONR21
R22
、C0-6
伸烷基-NR21
-COR21
、C0-6
伸烷基-NR21
-CONR21
R22
、C0-6
伸烷基-O-CONR21
R22
、C0-6
伸烷基-NR21
-CO2
R21
及C0-6
伸烷基-NR21
R22
,
其中烷基、伸烷基、環烷基及雜環烷基未經取代或經1至6個獨立地選自以下之取代基取代:鹵素、CN、側氧基、羥基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、CO-OC1-4
烷基、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
且其中視情況,芳基或雜芳基部分上之兩個鄰接取代基形成5至8員部分不飽和環,該環視情況含有1至3個獨立地選自O、S或N之雜原子,且
其中此額外環未經取代或經1至4個獨立地選自以下的取代基取代:鹵素、CN、側氧基、OH、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
且其中視情況,環烷基或雜環烷基部分上之兩個鄰接取代基形成5至6員不飽和環,該環視情況含有1至3個獨立地選自O、S或N之雜原子,
其中此額外環未經取代或經1至4個獨立地選自以下的取代基取代:鹵素、CN、側氧基、OH、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
其中在關於朝向之連接之1,2-定向上具有來自上文之取代基或在1,2-定向上具有環化之額外環;
L選自由以下組成之群:一鍵、C1-6
伸烷基、C2-6
伸烯基、C2-6
伸炔基、3至10員伸環烷基、含有1至4個獨立地選自N、O及S之雜原子之3至10員伸雜環烷基、6員或10員伸芳基及含有1至4個獨立地選自N、O及S之雜原子之5至10員伸雜芳基,
其中伸烷基、伸烯基、伸炔基、伸環烷基、伸雜環烷基、伸芳基及伸雜芳基未經取代或經1至6個獨立地選自由以下組成之群的取代基取代:鹵素、CN、SF5
、NO2
、側氧基、C1-4
烷基、C0-6
伸烷基-OR41
、C0-6
伸烷基-(3至6員環烷基)、C0-6
伸烷基-(3至6員雜環烷基)、C0-6
伸烷基-S(O)n
R41
、C0-6
伸烷基-NR41
S(O)2
R41
、C0-6
伸烷基-S(O)2
NR41
R42
、C0-6
伸烷基-NR41
S(O)2
NR41
R42
、C0-6
伸烷基-CO2
R41
、O-C1-6
伸烷基-CO2
R41
、C0-6
伸烷基-O-COR41
、C0-6
伸烷基-CONR41
R42
、C0-6
伸烷基-NR41
-COR41
、C0-6
伸烷基-NR41
-CONR41
R42
、C0-6
伸烷基-O-CONR41
R42
、C0-6
伸烷基-NR41
-CO2
R41
及C0-6
伸烷基-NR41
R42
,
其中烷基、伸烷基、環烷基及雜環烷基未經取代或經1至6個獨立地選自以下之取代基取代:鹵素、CN、側氧基、羥基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
且其中視情況,伸芳基及伸雜芳基部分上之兩個鄰接取代基形成5至8員部分不飽和環,該環視情況含有1至3個獨立地選自O、S或N之雜原子,且
其中此額外環未經取代或經1至4個獨立地選自以下的取代基取代:鹵素、CN、側氧基、OH、CO2
H、CO2
-C1-4
烷基、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
R1
選自由以下組成之群:H、鹵素、CN、SF5
、NO2
、側氧基、C1-4
烷基、C0-6
伸烷基-OR41
、Y-C0-6
伸烷基-(3至6員環烷基)、Y-C0-6
伸烷基-(3至6員雜環烷基)、Y-C0-6
伸烷基-(6員芳基)、Y-C0-6
伸烷基-(5至6員雜芳基)、C0-6
伸烷基-S(=O)(-R41
)=N-R75
、X-C1-6
伸烷基-S(=O)(-R41
)=N-R75
、C0-6
伸烷基-S(O)n
R41
、X-C1-6
伸烷基-S(O)n
R41
、C0-6
伸烷基-S(=NR71
)R41
、X-C1-6
伸烷基-S(=NR71
)R41
、C0-6
伸烷基-S(O)(=NR71
)R41
、X-C1-6
伸烷基-S(O)(=NR71
)R41
、C0-6
伸烷基-S(=NR71
)2
R41
、X-C1-6
伸烷基-S(=NR71
)2
R41
、C0-6
伸烷基-NR41
S(O)2
R41
、X-C1-6
伸烷基-NR41
S(O)2
R41
、C0-6
伸烷基-S(O)2
NR41
R42
、X-C1-6
伸烷基-S(O)2
NR41
R42
、C0-6
伸烷基-NR41
S(O)2
NR41
R42
、X-C1-6
伸烷基-NR41
S(O)2
NR41
R42
、C0-6
伸烷基-SO3
R41
、X-C1-6
伸烷基-SO3
R41
、C0-6
伸烷基-CO2
R41
、X-C1-6
伸烷基-CO2
R41
、C0-6
伸烷基-O-COR41
、X-C1-6
伸烷基-O-COR41
、C0-6
伸烷基-CONR41
R42
、X-C1-6
伸烷基-CONR41
R42
、C0-6
伸烷基-CONR41
OR41
、X-C1-6
伸烷基-CONR41
OR41
、C0-6
伸烷基-CONR41
SO2
R41
、X-C1-6
伸烷基-CONR41
SO2
R41
、C0-6
伸烷基-NR41
-COR41
、X-C1-6
-C0-6
伸烷基-NR41
-COR41
、C0-6
伸烷基-NR41
-CONR41
R42
、X-C1-6
伸烷基-NR41
-CONR41
R42
、C0-6
伸烷基-O-CONR41
R42
、X-C1-6
伸烷基-O-CONR41
R42
、C0-6
伸烷基-NR41
-CO2
R41
、X-C1-6
伸烷基-NR41
-CO2
R41
、C0-6
伸烷基-NR41
R42
、X-C1-6
伸烷基-NR41
R42
,
其中烷基、伸烷基、環烷基、雜環烷基、芳基及雜芳基未經取代或經1至6個獨立地選自以下之取代基取代:鹵素、CN、側氧基、羥基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
且其中視情況,芳基及雜芳基部分上之兩個鄰接取代基形成5至8員部分不飽和環,該環視情況含有1至3個獨立地選自O、S或N之雜原子,且
其中此額外環未經取代或經1至4個獨立地選自以下的取代基取代:鹵素、CN、側氧基、OH、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
R11
、R12
、R21
、R22
、R31
、R32
、R41
、R42
、R51
獨立地選自H及C1-4
烷基,
其中烷基未經取代或經1至3個獨立地選自以下之取代基取代:鹵素、CN、C1-4
烷基、鹵基-C1-4
烷基、3至6員環烷基、鹵基-(3至6員環烷基)、3至6員雜環烷基、鹵基-(3至6員雜環烷基)、OH、側氧基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、SO3
H、O-C1-4
烷基及O-鹵基-C1-4
烷基;
或R11
及R12
、R21
及R22
、R31
及R32
、R41
及R42
在與其所連接之氮一起時分別完成含有碳原子且視情況含有1或2個獨立地選自O、S或N之雜原子的3至6員環;且
其中新形成之環未經取代或經1至3個獨立地選自以下之取代基取代:鹵素、CN、C1-4
烷基、鹵基-C1-4
烷基、3至6員環烷基、鹵基-(3至6員環烷基)、3至6員雜環烷基、鹵基-(3至6員雜環烷基)、OH、側氧基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、SO3
H、O-C1-4
烷基及O-鹵基-C1-4
烷基;
R71
獨立地選自H、CN;NO2
、C1-4
烷基及C(O)-OC1-4
烷基,
其中烷基未經取代或經1至3個獨立地選自以下之取代基取代:鹵素、CN、C1-4
烷基、鹵基-C1-4
烷基、3至6員環烷基、鹵基-(3至6員環烷基)、3至6員雜環烷基、鹵基-(3至6員雜環烷基)、OH、側氧基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、SO3
H、O-C1-4
烷基及O-鹵基-C1-4
烷基;
R75
獨立地選自C1-4
烷基、3至6員環烷基、3至6員雜環烷基、6員芳基及5至6員雜芳基,
其中烷基、環烷基、雜環烷基、芳基及雜芳基未經取代或經1至3個獨立地選自以下之取代基取代:鹵素、CN、Me、Et、CHF2
、CF3
、OH、側氧基、CO2
H、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、SO3
H、OMe、OEt、OCHF2
及OCF3
;
X獨立地選自O、NR51
、S(O)n
、S(=NR71
)、S(O)(=NR71
)及S(=NR71
)2
;
Y獨立地選自一鍵、O、NR51
、S(O)n
、S(=NR71
)、S(O)(=NR71
)及S(=NR71
)2
;
n獨立地選自0至2;
且其限制條件為排除以下結構:。
在一較佳實施例以及以上或以下實施例中之任一者中,為環化5至6員環,其形成6員芳基或含有1至3個獨立地選自N、O及S之雜原子之5至6員雜芳基,其中此環未經取代或經1至4個獨立地選自由以下組成之群的取代基取代:鹵素、CN、SF5
、NO2
、C1-6
烷基、側氧基、C0-6
伸烷基-OR11
、C0-6
伸烷基-(3至6員環烷基)、C0-6
伸烷基-(3至6員雜環烷基)、C0-6
伸烷基-S(O)n
R11
、C0-6
伸烷基-NR11
S(O)2
R11
、C0-6
伸烷基-S(O)2
NR11
R12
、C0-6
伸烷基-NR11
S(O)2
NR11
R12
、C0-6
伸烷基-CO2
R11
、O-C1-6
伸烷基-CO2
R11
、C0-6
伸烷基-O-COR11
、C0-6
伸烷基-CONR11
R12
、C0-6
伸烷基-NR11
-COR11
、C0-6
伸烷基-NR11
-CONR11
R12
、C0-6
伸烷基-O-CONR11
R12
、C0-6
伸烷基-NR11
-CO2
R11
及C0-6
伸烷基-NR11
R12
,
其中烷基、伸烷基、環烷基及雜環烷基未經取代或經1至6個獨立地選自以下之取代基取代:鹵素、CN、側氧基、羥基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;且
其中視情況,芳基或雜芳基部分上之兩個鄰接取代基形成5至8員部分不飽和環,該環視情況含有1至3個獨立地選自O、S或N之雜原子,且
其中新形成之環未經取代或經1至3個獨立地選自以下之取代基取代:鹵素、CN、C1-4
烷基、鹵基-C1-4
烷基、3至6員環烷基、鹵基-(3至6員環烷基)、3至6員雜環烷基、鹵基-(3至6員雜環烷基)、OH、側氧基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、O-C1-4
烷基及O-鹵基-C1-4
烷基。
在一更佳實施例以及以上或以下實施例中之任一者中,為環化苯基、噻吩基、噻唑基、吡啶基、嘧啶基、噠嗪基及吡嗪基,其中此環未經取代或經1至4個獨立地選自由以下組成之群的取代基取代:鹵素、CN、SF5
、NO2
、C1-6
烷基、側氧基、C0-6
伸烷基-OR11
、C0-6
伸烷基-(3至6員環烷基)、C0-6
伸烷基-(3至6員雜環烷基)、C0-6
伸烷基-S(O)n
R11
、C0-6
伸烷基-NR11
S(O)2
R11
、C0-6
伸烷基-S(O)2
NR11
R12
、C0-6
伸烷基-NR11
S(O)2
NR11
R12
、C0-6
伸烷基-CO2
R11
、O-C1-6
伸烷基-CO2
R11
、C0-6
伸烷基-O-COR11
、C0-6
伸烷基-CONR11
R12
、C0-6
伸烷基-NR11
-COR11
、C0-6
伸烷基-NR11
-CONR11
R12
、C0-6
伸烷基-O-CONR11
R12
、C0-6
伸烷基-NR11
-CO2
R11
及C0-6
伸烷基-NR11
R12
,
其中烷基、伸烷基、環烷基及雜環烷基未經取代或經1至6個獨立地選自以下之取代基取代:鹵素、CN、側氧基、羥基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基。
在一甚至更佳實施例以及以上或以下實施例中之任一者中,選自,
其中未經取代或經1至3個獨立地選自由以下組成之群的取代基取代:F、Cl、Br、CN、OH、側氧基、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基、O-鹵基-C1-4
烷基、NH2
、NHC1-4
烷基、N(C1-4
烷基)2
、SO2
-C1-4
烷基及SO2
-鹵基-C1-4
烷基。
在一最佳實施例以及以上或以下實施例中之任一者中,為,
其中未經取代或經1至3個獨立地選自由以下組成之群的取代基取代:F、Cl、Br、CN、Me、Et、CF3
、CHF2
、OH、OMe、OCF3
及OCHF3
。
在一較佳實施例以及以上或以下實施例中之任一者中,選自由以下組成之群:3至10員環烷基、含有1至3個獨立地選自N、O及S之雜原子之3至10員雜環烷基、6至14員芳基及含有1至4個獨立地選自N、O及S之雜原子之5至14員雜芳基,
其中環烷基、雜環烷基、芳基及雜芳基未經取代或經1至6個獨立地選自由以下組成之群的取代基取代:鹵素、CN、SF5
、NO2
、側氧基、C1-4
烷基、C0-6
伸烷基-OR21
、C0-6
伸烷基-(3至6員環烷基)、C0-6
伸烷基-(3至6員雜環烷基)、C0-6
伸烷基-S(O)n
R21
、C0-6
伸烷基-NR21
S(O)2
R21
、C0-6
伸烷基-S(O)2
NR21
R22
、C0-6
伸烷基-NR21
S(O)2
NR21
R22
、C0-6
伸烷基-CO2
R21
、O-C1-6
伸烷基-CO2
R21
、C0-6
伸烷基-O-COR21
、C0-6
伸烷基-CONR21
R22
、C0-6
伸烷基-NR21
-COR21
、C0-6
伸烷基-NR21
-CONR21
R22
、C0-6
伸烷基-O-CONR21
R22
、C0-6
伸烷基-NR21
-CO2
R21
及C0-6
伸烷基-NR21
R22
,
其中烷基、伸烷基、環烷基及雜環烷基未經取代或經1至6個獨立地選自以下之取代基取代:鹵素、CN、側氧基、羥基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
且其中視情況,芳基或雜芳基部分上之兩個鄰接取代基形成5至8員部分不飽和環,該環視情況含有1至3個獨立地選自O、S或N之雜原子,且
其中此額外環未經取代或經1至4個獨立地選自以下的取代基取代:鹵素、CN、側氧基、OH、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
且其中視情況,環烷基或雜環烷基部分上之兩個鄰接取代基形成5至6員不飽和環,該環視情況含有1至3個獨立地選自O、S或N之雜原子,
其中此額外環未經取代或經1至4個獨立地選自以下的取代基取代:鹵素、CN、側氧基、OH、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基。
在一更佳實施例以及以上或以下實施例中之任一者中,選自由以下組成之群:苯基、吡啶基及噻吩基,
其中苯基、吡啶基及噻吩基經1至4個獨立地選自由以下組成之群的取代基取代:鹵素、CN、SF5
、NO2
、側氧基、C1-4
烷基、C0-6
伸烷基-OR21
、C0-6
伸烷基-(3至6員環烷基)、C0-6
伸烷基-(3至6員雜環烷基)、C0-6
伸烷基-S(O)n
R21
、C0-6
伸烷基-NR21
S(O)2
R21
、C0-6
伸烷基-S(O)2
NR21
R22
、C0-6
伸烷基-NR21
S(O)2
NR21
R22
、C0-6
伸烷基-CO2
R21
、O-C1-6
伸烷基-CO2
R21
、C0-6
伸烷基-O-COR21
、C0-6
伸烷基-CONR21
R22
、C0-6
伸烷基-NR21
-COR21
、C0-6
伸烷基-NR21
-CONR21
R22
、C0-6
伸烷基-O-CONR21
R22
、C0-6
伸烷基-NR21
-CO2
R21
及C0-6
伸烷基-NR21
R22
,
其中烷基、伸烷基、環烷基及雜環烷基未經取代或經1至6個獨立地選自以下之取代基取代:鹵素、CN、側氧基、羥基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
且其中視情況,苯基及吡啶基部分上之兩個鄰接取代基形成5至8員部分不飽和環,該環視情況含有1至3個獨立地選自O、S或N之雜原子,且
其中此額外環未經取代或經1至4個獨立地選自以下的取代基取代:鹵素、CN、側氧基、OH、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基。
在一類似更佳實施例以及以上或以下實施例中之任一者中,選自由以下組成之群:苯基、萘基、吡啶基、嘧啶基、噻吩基、噻唑基、環戊基、環己基、雙環[1.1.1]戊基、雙環[2.2.2]辛基、雙環[2.2.1]庚基、五環[4.2.0.02,5
.03,8
.04,7
]辛基及哌啶基,
其中該環未經取代或經1至3個獨立地選自由以下組成之群的取代基取代:F、Cl、Br、CN、OH、側氧基、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基、O-鹵基-C1-4
烷基、C1-4
烷基-OH及鹵基-C1-4
烷基-OH;且其中視情況,苯環上之兩個鄰接取代基一起形成-(CH2
)3
-、-(CH2
)4
-、-OCF2
O-及-OCH2
O-基團。
在一甚至更佳實施例以及以上或以下實施例中之任一者中,選自由以下組成之群:苯基及吡啶基,
其中苯基及吡啶基經1至2個獨立地選自由以下組成之群的取代基取代:F、Cl、CN、CF3
、CH2
F及CHF2
。
在一較佳實施例以及以上或以下實施例中之任一者中,選自由以下組成之群:6員或10員芳基及含有1至3個獨立地選自N、O及S之雜原子之5至10員雜芳基,
其中環烷基、雜環烷基、芳基及雜芳基未經取代或經1至4個獨立地選自由以下組成之群的取代基取代:鹵素、CN、SF5
、NO2
、側氧基、C1-4
烷基、C0-6
伸烷基-OR31
、C0-6
伸烷基-(3至6員環烷基)、C0-6
伸烷基-(3至6員雜環烷基)、C0-6
伸烷基-(6員芳基)、C0-6
伸烷基-(5至6員雜芳基)、C0-6
伸烷基-S(O)n
R31
、C0-6
伸烷基-NR31
S(O)2
R31
、C0-6
伸烷基-S(O)2
NR31
R32
、C0-6
伸烷基-NR31
S(O)2
NR31
R32
、C0-6
伸烷基-CO2
R31
、O-C1-6
伸烷基-CO2
R31
、C0-6
伸烷基-O-COR31
、C0-6
伸烷基-CONR31
R32
、C0-6
伸烷基-NR31
-COR31
、C0-6
伸烷基-NR31
-CONR31
R32
、C0-6
伸烷基-O-CONR31
R32
、C0-6
伸烷基-NR31
-CO2
R31
及C0-6
伸烷基-NR31
R32
,
其中烷基、伸烷基、環烷基、雜環烷基、芳基及雜芳基未經取代或經1至6個獨立地選自以下之取代基取代:鹵素、CN、側氧基、羥基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
且其中視情況,芳基或雜芳基部分上之兩個鄰接取代基形成5至8員部分不飽和環,該環視情況含有1至3個獨立地選自O、S或N之雜原子,且
其中此額外環未經取代或經1至4個獨立地選自以下的取代基取代:鹵素、CN、側氧基、OH、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基。
在一更佳實施例以及以上或以下實施例中之任一者中,選自由以下組成之群:苯基、吡啶基及噻吩基,
其中苯基、吡啶基及噻吩基未經取代或經1至4個獨立地選自由以下組成之群的取代基取代:鹵素、CN、SF5
、NO2
、側氧基、C1-4
烷基、C0-6
伸烷基-OR31
、C0-6
伸烷基-(3至6員環烷基)、C0-6
伸烷基-(3至6員雜環烷基)、C0-6
伸烷基-(6員芳基)、C0-6
伸烷基-(5至6員雜芳基)、C0-6
伸烷基-S(O)n
R31
、C0-6
伸烷基-NR31
S(O)2
R31
、C0-6
伸烷基-S(O)2
NR31
R32
、C0-6
伸烷基-NR31
S(O)2
NR31
R32
、C0-6
伸烷基-CO2
R31
、O-C1-6
伸烷基-CO2
R31
、C0-6
伸烷基-O-COR31
、C0-6
伸烷基-CONR31
R32
、C0-6
伸烷基-NR31
-COR31
、C0-6
伸烷基-NR31
-CONR31
R32
、C0-6
伸烷基-O-CONR31
R32
、C0-6
伸烷基-NR31
-CO2
R31
及C0-6
伸烷基-NR31
R32
,
其中烷基、伸烷基、環烷基、雜環烷基、芳基及雜芳基未經取代或經1至6個獨立地選自以下之取代基取代:鹵素、CN、側氧基、羥基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
且其中殘基-L-R1
在關於朝向之連接之1,3-定向上連接且L不為鍵。
在一甚至更佳實施例以及以上或以下實施例中之任一者中,選自苯基、吡啶基及噻吩基;其中苯基、吡啶基及噻吩基未經取代或經1至3個獨立地選自由以下組成之群的取代基取代:F、Cl、CN、OH、側氧基、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;且其中殘基-L-R1
在關於朝向之連接之1,3-定向上連接且L不為鍵。
在一較佳實施例以及以上或以下實施例中之任一者中,
L選自由以下組成之群:一鍵、C1-6
伸烷基、C2-6
伸烯基、C2-6
伸炔基、3至10員伸環烷基、含有1至4個獨立地選自N、O及S之雜原子之3至10員伸雜環烷基、6員或10員伸芳基及含有1至4個獨立地選自N、O及S之雜原子之5至10員伸雜芳基,
其中伸烷基、伸烯基、伸炔基、伸環烷基、伸雜環烷基、伸芳基及伸雜芳基未經取代或經1至6個獨立地選自由以下組成之群的取代基取代:鹵素、CN、SF5
、NO2
、側氧基、C1-4
烷基、C0-6
伸烷基-OR41
、C0-6
伸烷基-(3至6員環烷基)、C0-6
伸烷基-(3至6員雜環烷基)、C0-6
伸烷基-S(O)n
R41
、C0-6
伸烷基-NR41
S(O)2
R41
、C0-6
伸烷基-S(O)2
NR41
R42
、C0-6
伸烷基-NR41
S(O)2
NR41
R42
、C0-6
伸烷基-CO2
R41
、O-C1-6
伸烷基-CO2
R41
、C0-6
伸烷基-O-COR41
、C0-6
伸烷基-CONR41
R42
、C0-6
伸烷基-NR41
-COR41
、C0-6
伸烷基-NR41
-CONR41
R42
、C0-6
伸烷基-O-CONR41
R42
、C0-6
伸烷基-NR41
-CO2
R41
及C0-6
伸烷基-NR41
R42
,
其中烷基、伸烷基、環烷基及雜環烷基未經取代或經1至6個獨立地選自以下之取代基取代:鹵素、CN、側氧基、羥基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
且其中視情況,伸芳基及伸雜芳基部分上之兩個鄰接取代基形成5至8員部分不飽和環,該環視情況含有1至3個獨立地選自O、S或N之雜原子,且
其中此額外環未經取代或經1至4個獨立地選自以下的取代基取代:鹵素、CN、側氧基、OH、CO2
H、CO2
-C1-4
烷基、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基。
在一更佳實施例以及以上或以下實施例中之任一者中,
L選自由以下組成之群:3至10員伸環烷基、含有1至4個獨立地選自N、O及S之雜原子之3至10員伸雜環烷基、6員伸芳基及含有1至2個獨立地選自N、O及S之雜原子之5至6員伸雜芳基,
其中伸環烷基、伸雜環烷基、伸芳基及伸雜芳基未經取代或經1至6個獨立地選自由以下組成之群的取代基取代:鹵素、CN、SF5
、NO2
、側氧基、C1-4
烷基、C0-6
伸烷基-OR41
、C0-6
伸烷基-(3至6員環烷基)、C0-6
伸烷基-(3至6員雜環烷基)、C0-6
伸烷基-S(O)n
R41
、C0-6
伸烷基-NR41
S(O)2
R41
、C0-6
伸烷基-S(O)2
NR41
R42
、C0-6
伸烷基-NR41
S(O)2
NR41
R42
、C0-6
伸烷基-CO2
R41
、O-C1-6
伸烷基-CO2
R41
、C0-6
伸烷基-O-COR41
、C0-6
伸烷基-CONR41
R42
、C0-6
伸烷基-NR41
-COR41
、C0-6
伸烷基-NR41
-CONR41
R42
、C0-6
伸烷基-O-CONR41
R42
、C0-6
伸烷基-NR41
-CO2
R41
及C0-6
伸烷基-NR41
R42
,
其中烷基、伸烷基、環烷基及雜環烷基未經取代或經1至6個獨立地選自以下之取代基取代:鹵素、CN、側氧基、羥基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
且其中視情況,伸芳基及伸雜芳基部分上之兩個鄰接取代基形成5至8員部分不飽和環,該環視情況含有1至3個獨立地選自O、S或N之雜原子,且
其中此額外環未經取代或經1至4個獨立地選自以下的取代基取代:鹵素、CN、側氧基、OH、CO2
H、CO2
-C1-4
烷基、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基。
在一甚至更佳實施例以及以上或以下實施例中之任一者中,
-L-R1
選自 ,
其中該環未經取代或經1至4個獨立地選自由以下組成之群的取代基取代:F、Cl、Br、CN、OH、側氧基、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基、O-鹵基-C1-4
烷基、C1-4
烷基-OH、鹵基-C1-4
烷基-OH、SO2
-C1-4
烷基及SO2
-鹵基-C1-4
烷基;且其中視情況,苯環上之兩個鄰接取代基一起形成-(CH2
)3
-、-(CH2
)4
-、-OCF2
O-及-OCH2
O-基團。
在一較佳實施例以及以上或以下實施例中之任一者中,
R1
選自由以下組成之群:H、鹵素、CN、SF5
、NO2
、側氧基、C1-4
烷基、C0-6
伸烷基-OR41
、Y-C0-6
伸烷基-(3至6員環烷基)、Y-C0-6
伸烷基-(3至6員雜環烷基)、Y-C0-6
伸烷基-(6員芳基)、Y-C0-6
伸烷基-(5至6員雜芳基)、C0-6
伸烷基-S(=O)(-R41
)=N-R75
、X-C1-6
伸烷基-S(=O)(-R41
)=N-R75
、C0-6
伸烷基-S(O)n
R41
、X-C1-6
伸烷基-S(O)n
R41
、C0-6
伸烷基-S(=NR71
)R41
、X-C1-6
伸烷基-S(=NR71
)R41
、C0-6
伸烷基-S(O)(=NR71
)R41
、X-C1-6
伸烷基-S(O)(=NR71
)R41
、C0-6
伸烷基-S(=NR71
)2
R41
、X-C1-6
伸烷基-S(=NR71
)2
R41
、C0-6
伸烷基-NR41
S(O)2
R41
、X-C1-6
伸烷基-NR41
S(O)2
R41
、C0-6
伸烷基-S(O)2
NR41
R42
、X-C1-6
伸烷基-S(O)2
NR41
R42
、C0-6
伸烷基-NR41
S(O)2
NR41
R42
、X-C1-6
伸烷基-NR41
S(O)2
NR41
R42
、C0-6
伸烷基-SO3
R41
、X-C1-6
伸烷基-SO3
R41
、C0-6
伸烷基-CO2
R41
、X-C1-6
伸烷基-CO2
R41
、C0-6
伸烷基-O-COR41
、X-C1-6
伸烷基-O-COR41
、C0-6
伸烷基-CONR41
R42
、X-C1-6
伸烷基-CONR41
R42
、C0-6
伸烷基-CONR41
OR41
、X-C1-6
伸烷基-CONR41
OR41
、C0-6
伸烷基-CONR41
SO2
R41
、X-C1-6
伸烷基-CONR41
SO2
R41
、C0-6
伸烷基-NR41
-COR41
、X-C1-6
-C0-6
伸烷基-NR41
-COR41
、C0-6
伸烷基-NR41
-CONR41
R42
、X-C1-6
伸烷基-NR41
-CONR41
R42
、C0-6
伸烷基-O-CONR41
R42
、X-C1-6
伸烷基-O-CONR41
R42
、C0-6
伸烷基-NR41
-CO2
R41
、X-C1-6
伸烷基-NR41
-CO2
R41
、C0-6
伸烷基-NR41
R42
、X-C1-6
伸烷基-NR41
R42
,
其中烷基、伸烷基、環烷基、雜環烷基、芳基及雜芳基未經取代或經1至6個獨立地選自以下之取代基取代:鹵素、CN、側氧基、羥基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
且其中視情況,芳基及雜芳基部分上之兩個鄰接取代基形成5至8員部分不飽和環,該環視情況含有1至3個獨立地選自O、S或N之雜原子,且
其中此額外環未經取代或經1至4個獨立地選自以下的取代基取代:鹵素、CN、側氧基、OH、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基。
在一更佳實施例以及以上或以下實施例中之任一者中,
R1
選自CO2
H、四唑、CH2
CO2
H、OCH2
CO2
H、SO2
CH2
CO2
H、CHMeCO2
H、CMe2
CO2
H、C(OH)MeCO2
H、CONHSO2
Me及CONH(OH);及視情況其甘胺酸及牛磺酸結合物。
在一最佳實施例以及以上或以下實施例中之任一者中,
R1
選自CO2
H及C(OH)MeCO2
H;及視情況其甘胺酸及牛磺酸結合物。
在一較佳實施例以及以上或以下實施例中之任一者中,選自由以下組成之群:3至10員環烷基、含有1至3個獨立地選自N、O及S之雜原子之3至10員雜環烷基、6至14員芳基及含有1至4個獨立地選自N、O及S之雜原子之5至14員雜芳基,
其中環烷基、雜環烷基、芳基及雜芳基未經取代或經1至6個獨立地選自由以下組成之群的取代基取代:鹵素、CN、SF5
、NO2
、側氧基、C1-4
烷基、C0-6
伸烷基-OR21
、C0-6
伸烷基-(3至6員環烷基)、C0-6
伸烷基-(3至6員雜環烷基)、C0-6
伸烷基-S(O)n
R21
、C0-6
伸烷基-NR21
S(O)2
R21
、C0-6
伸烷基-S(O)2
NR21
R22
、C0-6
伸烷基-NR21
S(O)2
NR21
R22
、C0-6
伸烷基-CR41
(=N-OR41
)、C0-6
伸烷基-CO2
R21
、O-C1-6
伸烷基-CO2
R21
、C0-6
伸烷基-O-COR21
、C0-6
伸烷基-CONR21
R22
、C0-6
伸烷基-NR21
-COR21
、C0-6
伸烷基-NR21
-CONR21
R22
、C0-6
伸烷基-O-CONR21
R22
、C0-6
伸烷基-NR21
-CO2
R21
及C0-6
伸烷基-NR21
R22
,
其中烷基、伸烷基、環烷基及雜環烷基未經取代或經1至6個獨立地選自以下之取代基取代:鹵素、CN、側氧基、羥基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、CO-OC1-4
烷基、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
且其中視情況,芳基或雜芳基部分上之兩個鄰接取代基形成5至8員部分不飽和環,該環視情況含有1至3個獨立地選自O、S或N之雜原子,且
其中此額外環未經取代或經1至4個獨立地選自以下的取代基取代:鹵素、CN、側氧基、OH、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
且其中視情況,環烷基或雜環烷基部分上之兩個鄰接取代基形成5至6員不飽和環,該環視情況含有1至3個獨立地選自O、S或N之雜原子,
其中此額外環未經取代或經1至4個獨立地選自以下的取代基取代:鹵素、CN、側氧基、OH、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
其中在關於朝向之連接之1,2-定向上具有來自上文之取代基或在1,2-定向上具有環化之額外環。
在一更佳實施例以及以上或以下實施例中之任一者中,選自由以下組成之群:6員或10員芳基及含有1至4個獨立地選自N、O及S之雜原子之5至10員雜芳基,
其中芳基及雜芳基未經取代或經1至6個獨立地選自由以下組成之群的取代基取代:鹵素、CN、SF5
、NO2
、側氧基、C1-4
烷基、C0-6
伸烷基-OR21
、C0-6
伸烷基-(3至6員環烷基)、C0-6
伸烷基-(3至6員雜環烷基)、C0-6
伸烷基-S(O)n
R21
、C0-6
伸烷基-NR21
S(O)2
R21
、C0-6
伸烷基-S(O)2
NR21
R22
、C0-6
伸烷基-NR21
S(O)2
NR21
R22
、C0-6
伸烷基-CR41
(=N-OR41
)、C0-6
伸烷基-CO2
R21
、O-C1-6
伸烷基-CO2
R21
、C0-6
伸烷基-O-COR21
、C0-6
伸烷基-CONR21
R22
、C0-6
伸烷基-NR21
-COR21
、C0-6
伸烷基-NR21
-CONR21
R22
、C0-6
伸烷基-O-CONR21
R22
、C0-6
伸烷基-NR21
-CO2
R21
及C0-6
伸烷基-NR21
R22
,
其中烷基、伸烷基、環烷基及雜環烷基未經取代或經1至6個獨立地選自以下之取代基取代:鹵素、CN、側氧基、羥基、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、CO-OC1-4
烷基、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
且其中視情況,芳基或雜芳基部分上之兩個鄰接取代基形成5至8員部分不飽和環,該環視情況含有1至3個獨立地選自O、S或N之雜原子,且
其中此額外環未經取代或經1至4個獨立地選自以下的取代基取代:鹵素、CN、側氧基、OH、CO2
H、CO2
-C1-4
烷基、CONHCH2
CO2
H、CONH(CH2
)2
SO3
H、C1-4
烷基、鹵基-C1-4
烷基、O-C1-4
烷基及O-鹵基-C1-4
烷基;
其中在關於朝向之連接之1,2-定向上具有來自上文之取代基或在1,2-定向上具有環化之額外環。
在一甚至更佳實施例以及以上或以下實施例中之任一者中,選自由以下組成之群:,其中
R2
選自Me、F、Cl、CN、Me、CHO、CHF2
、CF3
、SO2
Me、 ;且
其中未進一步經取代或進一步經1至2個選自由以下組成之群的取代基取代:F、Cl、CN、Me、OMe、CHO、CHF2
及CF3
。
在一較佳實施例以及以上或以下實施例中之任一者中,
式(I
)含有選自由以下組成之群的取代基:CO2
H、四唑、CONHSO2
Me及CONH(OH);及視情況其甘胺酸及牛磺酸結合物。
在一更佳實施例以及以上或以下實施例中之任一者中,
式(I
)含有羧酸部分及視情況其甘胺酸及牛磺酸結合物。
在一最佳實施例中,該化合物為2-氯-3'-(3-(2-氰基噻吩-3-基)-1-((4-(二氟甲基)苯基)磺醯基)-5-氟-1H-吲哚-2-基)-[1,1'-聯苯]-4-羧酸或其甘胺酸結合物或牛磺酸結合物及視情況其醫藥學上可接受之鹽。甚至更佳為2-氯-3'-(3-(2-氰基噻吩-3-基)-1-((4-(二氟甲基)苯基)磺醯基)-5-氟-1H-吲哚-2-基)-[1,1'-聯苯]-4-羧酸及視情況其醫藥學上可接受之鹽。
在一類似最佳實施例中,該化合物為2-氯-3'-(3-(3-氰基吡嗪-2-基)-1-((4-(二氟甲基)苯基)磺醯基)-5-氟-1H-吲哚-2-基)-[1,1'-聯苯]-4-羧酸或其甘胺酸結合物或牛磺酸結合物及視情況其醫藥學上可接受之鹽。甚至更佳為2-氯-3'-(3-(3-氰基吡嗪-2-基)-1-((4-(二氟甲基)苯基)磺醯基)-5-氟-1H-吲哚-2-基)-[1,1'-聯苯]-4-羧酸及視情況其醫藥學上可接受之鹽。
在一類似最佳實施例中,該化合物為2-氯-3'-(3-(2-氰基苯基)-1-((4-(二氟甲基)苯基)磺醯基)-5-氟-1H-吲哚-2-基)-[1,1'-聯苯]-4-羧酸或其甘胺酸結合物或牛磺酸結合物及視情況其醫藥學上可接受之鹽。甚至更佳為2-氯-3'-(3-(2-氰基苯基)-1-((4-(二氟甲基)苯基)磺醯基)-5-氟-1H-吲哚-2-基)-[1,1'-聯苯]-4-羧酸及視情況其醫藥學上可接受之鹽。
在一類似最佳實施例中,該化合物為2-氯-3'-(3-(2,6-二氰基苯基)-1-((4-(二氟甲基)苯基)磺醯基)-5-氟-1H-吲哚-2-基)-[1,1'-聯苯]-4-羧酸或其甘胺酸結合物或牛磺酸結合物及視情況其醫藥學上可接受之鹽。甚至更佳為2-氯-3'-(3-(2,6-二氰基苯基)-1-((4-(二氟甲基)苯基)磺醯基)-5-氟-1H-吲哚-2-基)-[1,1'-聯苯]-4-羧酸及視情況其醫藥學上可接受之鹽。
在一類似最佳實施例中,該化合物為3'-(3-(2,6-二氰基苯基)-1-((4-(二氟甲基)苯基)磺醯基)-5-氟-1H-吲哚-2-基)-2,6-二氟-[1,1'-聯苯]-4-羧酸或其甘胺酸結合物或牛磺酸結合物及視情況其醫藥學上可接受之鹽。甚至更佳為3'-(3-(2,6-二氰基苯基)-1-((4-(二氟甲基)苯基)磺醯基)-5-氟-1H-吲哚-2-基)-2,6-二氟-[1,1'-聯苯]-4-羧酸及視情況其醫藥學上可接受之鹽。
在一類似最佳實施例中,該化合物為2-氯-3'-(3-(2,6-二氰基苯基)-1-((4-(二氟甲基)苯基)磺醯基)-5-氟-1H-吲哚-2-基)-5-氟-[1,1'-聯苯]-4-羧酸或其甘胺酸結合物或牛磺酸結合物及視情況其醫藥學上可接受之鹽。甚至更佳為2-氯-3'-(3-(2,6-二氰基苯基)-1-((4-(二氟甲基)苯基)磺醯基)-5-氟-1H-吲哚-2-基)-5-氟-[1,1'-聯苯]-4-羧酸及視情況其醫藥學上可接受之鹽。
本發明亦提供本發明化合物以用作藥劑。
亦提供用於預防及/或治療適於用LXR調節劑治療之疾病之本發明化合物。
亦提供本發明化合物用於治療選自以下之LXR介導的疾病:非酒精性脂肪肝病、非酒精性脂肪變性肝炎、肝炎、肝纖維化、肥胖、胰島素抗性、II型糖尿病、家族性高膽固醇血症、腎病症候群之高膽固醇血症、代謝症候群、心臟脂肪變性、癌症、病毒心肌炎、C型肝炎病毒感染或其併發症及長期糖皮質激素治療在諸如類風濕性關節炎之疾病中之非所需副作用。
在一較佳實施例中,疾病選自非酒精性脂肪肝病、非酒精性脂肪變性肝炎、肝炎、肝纖維化、肥胖、胰島素抗性、II型糖尿病、家族性高膽固醇血症、腎病症候群之高膽固醇血症、代謝症候群或心臟脂肪變性。
在一類似較佳實施例中,該疾病為癌症。
在一類似較佳實施例中,疾病選自病毒心肌炎、C型肝炎病毒感染或其併發症。
本發明進一步係關於一種用於預防及/或治療由介導LXR之疾病之方法,該方法包含向需要其之個體投與有效量之本發明化合物。
更特定言之,本發明係關於一種用於預防且治療疾病之方法,該等疾病選自非酒精性脂肪肝病、非酒精性脂肪變性肝炎、肝炎、肝纖維化、肥胖、胰島素抗性、II型糖尿病、家族性高膽固醇血症、腎病症候群之高膽固醇血症、代謝症候群、心臟脂肪變性、癌症、病毒心肌炎、C型肝炎病毒感染或其併發症及長期糖皮質激素治療在疾病(諸如類風濕性關節炎、發炎性腸病及哮喘)中之非所需副作用。
此外,本發明亦關於本發明之化合物在製備用於預防及/或治療LXR介導的疾病之藥劑中之用途。
更特定言之,本發明係關於本發明之化合物在製備用於預防及/或治療LXR介導的疾病之藥劑中之用途,其中該疾病選自非酒精性脂肪肝病、非酒精性脂肪變性肝炎、肝炎、肝纖維化、肥胖、胰島素抗性、II型糖尿病、家族性高膽固醇血症、腎病症候群之高膽固醇血症、代謝症候群、心臟脂肪變性、癌症、病毒心肌炎、C型肝炎病毒感染或其併發症及長期糖皮質激素治療在疾病(諸如類風濕性關節炎、發炎性腸病及哮喘)中之非所需副作用。
亦提供一種醫藥組合物,其包含本發明化合物及醫藥學上可接受之載劑或賦形劑。
在本發明之情形下,「C1-6
烷基」意謂具有1至6個碳原子之飽和烷基鏈,其可為直鏈或分支鏈。其實例包括甲基、乙基、丙基、異丙基、正丁基、異丁基、第三丁基、正戊基、異戊基、正己基及異己基。類似地,「C1-4
烷基」意謂具有1至4個碳原子之飽和烷基鏈,其可為直鏈或分支鏈。其實例包括甲基、乙基、丙基、異丙基、正丁基、異丁基及第三丁基。
術語「鹵基-C1-4
烷基」意謂烷基鏈中之一或多個氫原子經鹵素置換。其較佳實例為CH2
F、CHF2
及CF3
。
「C0-6
伸烷基」意謂各別基團為二價且且將所連接殘基與分子之剩餘部分連接。此外,在本發明之情形下,「C0
-伸烷基」意謂表示一鍵,然而C1-
伸烷基意謂亞甲基連接子,C2
-伸烷基意謂伸乙基連接子或經甲基取代之亞甲基連接子等。在本發明之情形下,C0-6
伸烷基較佳地表示一鍵、亞甲基、伸乙基或伸丙基。
類似地,「C2-6
伸烯基」及「C2-6
伸炔基」意謂連接分子之兩個部分的二價烯基或炔基。
3至10員環烷基意謂包含3至10個碳原子之飽和或部分不飽和單、雙、螺或多環環系統。實例包括環丙基、環丁基、環戊基、環己基、環己烯基、雙環[2.2.2]辛基、雙環[3.2.1]辛基、螺[3.3]庚基、雙環[2.2.1]庚基、金剛烷基及五環[4.2.0.02,5
.03,8
.04,7
]辛基。因此,3至6員環烷基意謂包含3至6個碳原子之飽和或部分不飽和單、雙或螺環環系統,然而5至8員環烷基意謂包含5至8個碳原子之飽和或部分不飽和單、雙或螺環環系統。
3至10員雜環烷基意謂飽和或部分不飽和3至10員碳單、雙、螺或多環環,其中1、2、3或4個碳原子分別地經1、2、3或4個雜原子置換,其中該等雜原子獨立地選自N、O、S、SO及SO2
。其實例包括環氧基、氮雜環丁基、吡咯啶基、四氫呋喃基、哌啶基、哌嗪基、四氫哌喃基、1,4-二氧雜環己烷基、嗎啉基、4-奎寧環基、1,4-二氫吡啶基及6-氮雜雙環[3.2.1]辛基。可經由碳、氮(例如,在嗎啉或哌啶中)或硫原子將雜環烷基與分子之剩餘部分連接。S
連接之雜環烷基之實例為環狀磺醯亞胺醯胺。
5至14員單、雙或三環雜芳環系統(在本申請案內亦被稱作雜芳基)意謂芳環系統,其含有至多6個獨立地選自N、O、S、SO及SO2
之雜原子。單環雜芳環之實例包括吡咯基、咪唑基、呋喃基、噻吩基(thiophenyl) (噻吩基(thienyl))、吡啶基、嘧啶基、吡嗪基、吡唑基、噁唑基、異噁唑基、三唑基、噁二唑基及噻二唑基。其進一步意謂雙環系統,其中雜原子可存在於包括橋頭原子之一個或兩個環中。其實例包括喹啉基、異喹啉基、喹喏啉基、苯并咪唑基、苯并異噁唑基、苯并呋喃基、苯并噁唑基、吲哚基、吲哚嗪基1,5-㖠啶基、1,7-㖠啶基及吡唑并[1,5-a]嘧啶基。三環雜芳環之實例包括吖啶基、苯并[b][1,5]㖠啶基及吡啶并[3,2-b][1,5]㖠啶基。
雜芳基系統之氮或硫原子亦可視情況經氧化為對應N-氧化物、S-氧化物或S,S-二氧化物。
6至14員單、雙或三環芳環系統(在本申請案內亦被稱作芳基)意謂芳族碳環,諸如苯基、萘基、蒽基或菲基。
術語「N-氧化物」表示雜芳族系統(較佳地吡啶基)中之氮經氧化之化合物。可以已知方式藉由使本發明化合物(諸如呈吡啶基形式)與H2
O2
或過酸在惰性溶劑中反應來獲得此類化合物。
鹵素選自氟、氯、溴及碘;更佳地氟或氯;且最佳氟。
本文所給定之任何式或結構亦意欲表示化合物之未標記形式以及同位素標記形式。同位素標記之化合物具有由本文中給定之式所描繪之結構,其例外之處在於一或多個原子經具有選定原子質量或質量數之原子置換。可併入本發明化合物中之同位素之實例包括氫、碳、氮、氧、磷、氟及氯之同位素,諸如(但不限於)2
H (氘, D)、3
H (氚)、11
C、13
C、14
C、15
N、18
F、31
P、32
P、35
S、36
Cl及125
I。經各種同位素標記之本發明化合物係例如其中併入諸如3
H、13
C及14
C之放射性同位素的彼等化合物。此等經同位素標記之化合物適用於代謝研究;反應動力學研究;偵測或成像技術,諸如正電子發射斷層攝影法(PET)或單光子放射電腦斷層攝影法(SPECT),包括藥物或受質組織分佈分析;或適用於患者之放射性治療。本發明的經同位素標記之化合物及其前藥一般可藉由進行流程中或下文所描述之實例及製備中所揭示之程序,藉由用易於獲得的經同位素標記之試劑取代非同位素標記之試劑來製備。
本發明亦包括式(I
)化合物之「氘化類似物」,其中連接至碳原子之1至n個氫經氘置換,其中n為分子中氫之數目。此類化合物呈現增加之代謝抗性,且因此適用於在向哺乳動物(尤其人類)投與時增加任何式(I
)化合物之半衰期。參見例如Foster in Trends Pharmacol. Sci. 1984:5;524。此類化合物藉由此項技術中熟知之方式來合成,例如藉由使用其中一或多個氫已經氘置換之起始物質。
本發明的經氘標記或取代之治療性化合物可具有經改良之DMPK (藥物代謝及藥物動力學)特性,該等特性與分佈、代謝及排泄(ADME)相關。經較重同位素(諸如氘)取代可得到由更大代謝穩定性產生之某些治療性優點,例如增加之活體內半衰期、減少之劑量需求及/或治療指數改良。經18
F標記之化合物可適用於PET或SPECT研究。
可藉由同位素增濃因子來界定此類較重同位素(尤其氘)之濃度。在本發明之化合物中,未具體指定為特定同位素之任何原子意欲表示該原子之任何穩定同位素。除非另外陳述,否則當位置經特定指定為「H」或「氫」時,應理解該位置在其天然豐度同位素組成中具有氫。因此,在本發明之化合物中,特定指定為氘(D)之任何原子意欲表示氘。
熟習此項技術者應瞭解,當可替代取代基之清單包括其成員(由於其價數需求或其他原因,該等成員不能用於替代特定基團)時,該清單意欲由熟習此項技術者之知識理解以僅包括適用於替代特定基團之該清單之彼等成員。
本發明化合物可呈前藥化合物形式。「前藥化合物」意謂藉由在活體中之生理條件下與酶、胃酸或其類似物反應而轉化為本發明之化合物之衍生物,例如藉由氧化、還原、水解或其類似物,其中之每一者以酶方式進行。前藥之實例為化合物,其中本發明化合物中之胺基經醯基化、烷基化或磷酸化以形成例如二十烷基胺基(eicosanoylamino)、丙胺醯基胺基、特戊醯氧基甲基胺基,或其中羥基經醯基化、烷基化、磷酸化或轉化為硼酸鹽,例如乙醯氧基、棕櫚醯氧基、特戊醯氧基、丁二醯基氧基、反丁烯二醯基氧基、丙胺醯基氧基,或其中羧基經酯化或醯胺化。此等化合物可根據熟知方法由本發明化合物產生。前藥之其他實例為在本申請案中被稱為「酯前藥」之化合物,其中本發明化合物中之羧酸酯例如經轉化為烷基、至、芳基伸烷基、胺基、膽鹼、醯氧基烷基、1-((烷氧羰基)氧基)-2-烷基或亞麻醯基酯。羧酸之前藥之例示性結構為前藥:。
本發明之化合物可以鹽形式存在,其亦在本發明之範疇內。
可出現本發明化合物或其前藥之互變異構,類似於例如酮烯醇互變異構,個別形式,類似於例如酮基及烯醇形式以及其混合物以任何比率各自在本發明之範疇內。同樣適用於立體異構體,類似於例如對映異構體、順/
反異構體、滯轉異構體、構象異構體以及類似物。
視需要,可藉由此項技術中熟知之方法,例如藉由液相層析將異構體分離。藉由使用例如對掌性固定相位同樣適用於對映異構體。另外,可藉由將對映異構體轉化為非對映異構體,亦即與對映異構性純輔助化合物偶合,後續將所得非對映異構體分隔且裂解輔助殘基來將該等對映異構體分離。替代地,本發明化合物之任一對映異構體可獲自使用光學純起始物質之立體選擇性合成。自外消旋混合物獲得純對映異構體之另一方式將使用利用對掌性相反離子之對映選擇性結晶。
本發明之化合物可呈醫藥學上可接受之鹽或溶劑合物形式。術語「醫藥學上可接受之鹽」係指由醫藥學上可接受之無毒鹼或酸製備之鹽,該等鹼或酸包括無機鹼或酸及有機鹼或酸。倘若本發明之化合物含有一或多種酸基或鹼基,則本發明亦包含其對應醫藥學上或毒理學可接受之鹽,尤其其醫藥學上可利用之鹽。因此,含有酸基之本發明化合物可存在於此等基團上且可根據本發明用作例如鹼金屬鹽、鹼土金屬鹽或銨鹽。此類鹽之更確切實例包括鈉鹽、鉀鹽、鈣鹽、鎂鹽或與氨或有機胺(諸如乙胺、乙醇胺、三乙醇胺或胺基酸)之鹽。含有一或多個鹼性基團(例如可質子化之基團)之本發明化合物可存在且可根據本發明以其與無機或有機酸之加成鹽形式使用。適合酸之實例包括氯化氫、溴化氫、磷酸、硫酸、硝酸、甲磺酸、對甲苯磺酸、萘二硫酸、草酸、乙酸、酒石酸、乳酸、柳酸、苯甲酸、甲酸、丙酸、特戊酸、二乙基乙酸、丙二酸、丁二酸、庚二酸、反丁烯二酸、順丁烯二酸、蘋果酸、胺基硫酸酸、苯基丙酸、葡萄糖酸、抗壞血酸、異菸酸、檸檬酸、己二酸及熟習此項技術者已知之其他酸。若本發明之化合物在分子中同時含有酸基及鹼基,則除所提及之鹽形式以外,本發明亦包括內鹽或甜菜鹼(兩性離子)。各別鹽可藉由熟習此項技術者已知之習用方法獲得,例如藉由使其在溶劑或分散劑中與有機或無機酸或鹼接觸,或藉由與其他鹽陰離子交換或陽離子交換。本發明亦包括本發明之化合物之所有鹽,其由於低生理學相容性而不適合直接用於醫藥中,但其可例如用作化學反應之中間產物或用於製備醫藥學上可接受之鹽。
此外,本發明之化合物可呈溶劑合物形式存在,諸如包括作為溶劑合物水之溶劑合物,或醫藥學上可接受之溶劑合物,諸如醇、尤其乙醇。
另外,本發明提供醫藥組合物,其包含至少一種本發明化合物、或其前藥化合物、或作為活性成份之其醫藥學上可接受之鹽或溶劑合物連同醫藥學上可接受之載劑。
「醫藥組合物」意謂一或多種活性成分及構成載劑之一或多種惰性成分,以及由任何兩種或超過兩種成分組合、複合或聚集,或由一或多種成分解離,或由一或多種成分之其他類型之反應或相互作用直接或間接產生的任何產物。因此,本發明之醫藥組合物涵蓋藉由混合至少一種本發明化合物及醫藥學上可接受之載劑而製得的任何組合物。
本發明之醫藥組合物可另外包含一或多種其他化合物作為活性成分,類似於前藥化合物或其他核受體調節劑。
組合物適合於經口、經直腸、局部、非經腸(包括皮下、肌肉內及靜脈內)、眼(經眼)、經肺(經鼻或頰內吸入)或經鼻投與,儘管在任何給定情況之大多數合適途徑將視所治療之病狀之性質及嚴重程度以及活性成分之性質而定。其可方便地以單位劑型呈現且藉由藥劑學技術中熟知之任何方法來製備。
本發明化合物充當LXR調節劑。
核受體之包括LXR配位體之配位體可充當促效劑、拮抗劑或反向促效劑。在此背景下之促效劑意謂結合至受體且刺激其轉錄活性之小分子配位體,如藉由例如在LXR反應元素控制下經轉錄之mRNA或蛋白質之增加所測定。亦可在僅採用LXRα或LXRβ配體結合結構域但使用與輔因子(亦即輔助抑制劑或輔助活化劑)之相互作用,潛在地結合通用DNA結合元素(諸如Gal4結構域)之生物化學或細胞活體外分析中測定轉錄活性以監視促效、拮抗性或反向促效活性。
儘管此定義之促效劑刺激LXR-或LXR-Gal4驅動之轉錄活性,但拮抗劑經定義為結合至LXR且因此抑制將經由內源性LXR配位體另外出現之轉錄活化之小分子。
反向促效劑與拮抗劑之不同在於其不僅結合至LXR且抑制轉錄活性,且其亦有效地關閉由LXR導引之轉錄,甚至在不存在內源性促效劑之情況下。然而難以活體內區分LXR拮抗性與反向促效活性,鑒於始終存在一些含量之內源性LXR促效劑,生物化學或細胞報導子分析可更明確區分該兩種活性。在分子含量下,反向促效劑並不允許募集輔助活化蛋白或其活性部分,儘管其應引起活性募集輔助抑制蛋白,該等輔助抑制蛋白為其活性部分。此背景下之LXR拮抗劑將定義為既不產生輔助活化劑亦不產生輔助抑制劑募集而僅經由置換LXR促效劑起作用之LXR配位體。因此,使用諸如Gal4-哺乳動物-兩種雜交分析之分析為必選的以區分輔助活化劑或輔助抑制劑募集LXR化合物(Kremoser等人,Drug Discov. Today 2007;12:860; Gronemeyer 等人,Nat. Rev. Drug Discov. 2004; 3:950)。
由於LXR促效劑、LXR拮抗劑及LXR反向促效劑之間的邊界並不清晰且為流暢的,因此術語「LXR調節劑」經創造以涵蓋所有化合物,其並不清除LXR促效劑而為展示某種程度之輔助抑制劑募集以及降低的LXR轉錄活性。因此,LXR調節劑涵蓋LXR拮抗劑及LXR反向促效劑,且應注意甚至較弱LXR促效劑可充當LXR拮抗劑,在其阻止完全促效劑完全轉錄活化的情況下。
圖1說明由LXR促效劑、拮抗劑及反向促效劑募集輔助活化劑或輔助抑制劑之不同能力例示之LXR促效劑、拮抗劑及反向促效劑之間的差異。
化合物適用於預防及/或治療由LXR介導之疾病。較佳疾病為與脂肪變性,亦即組織脂肪累積相關聯之所有病症。此類疾病涵蓋包括非酒精性脂肪變性肝炎、肝炎及肝纖維化,另外胰島素抗性、代謝症候群及心臟脂肪變性之非酒精性脂肪肝病之完整範圍。基於LXR調節劑之藥物亦可適用於治療C型肝炎病毒感染或其併發症且適用於預防長期糖皮質激素治療在諸如類風濕性關節炎、發炎性腸病及哮喘之疾病中之非所需副作用。
LXR調節劑之不同應用集合可在治療癌症中。LXR拮抗劑或反向促效劑可適用於抵消所謂的瓦爾堡效應,該瓦爾堡效應與自普通經分化細胞向癌細胞轉化相關聯(參見Liberti等人,Trends Biochem. Sci. 2016;41:211; Ward & Thompson, Cancer Cell 2012;21:297-308)。另外,已知LXR調節固有及後天免疫系統之各種組分。被稱為內源性LXR促效劑之環氧甾醇經識別為腫瘤微環境中發現之LXR依賴性免疫抑止效應之介體(Traversari等人,Eur. J. Immunol. 2014;44:1896)。因此,合理假定LXR拮抗劑或反向促效劑可能夠刺激免疫系統及抗原呈遞細胞,特定言之以引發抗腫瘤免疫反應。大體而言,LXR拮抗劑或反向促效劑之後期效應可用於治療晚期癌症,且特定言之用於展示較差免疫反應及高度升高之瓦爾堡代謝跡象之彼等類型之癌實體腫瘤。
更詳言之,LXR反向促效劑SR9243
之抗癌活性經展示為由干擾活體外不同腫瘤細胞中瓦爾堡效應及脂肪生成及活體內無胸腺小鼠中之SW620結腸腫瘤細胞來介導(參見Flaveny等人. Cancer Cell. 2015;28:42; Steffensen, Cancer Cell 2015;28:3)。
因此,LXR調節劑(較佳地LXR反向促效劑)可適用於治療瓦爾堡依賴性癌症。
LXR調節劑(較佳地LXR反向促效劑)可抵消糖皮質激素之致糖尿病效應且不損害糖皮質激素之消炎效應且可因此用於防止長期糖皮質激素治療在諸如類風濕性關節炎、發炎性腸病及哮喘之疾病中之非所需副作用(Patel等人. Endocrinology 2017:158:1034)。
LXR調節劑(較佳地LXR反向促效劑)可能適用於治療由C型肝炎病毒介導之肝脂肪變性(參見García-Mediavilla等人. Lab. Invest. 2012;92:1191)。
LXR調節劑(較佳地LXR反向促效劑)可適用於治療病毒心肌炎(參見Papageorgiou等人. Cardiovasc. Res. 2015;107:78)。
LXR調節劑(較佳地LXR反向促效劑)可適用於治療胰島素抗性(參見Zheng等人. PLoS One 2014;9:e101269)。
LXR調節劑(較佳地LXR反向促效劑)可適用於治療家族性高膽固醇血症(參見Zhou等人. J. Biol. Chem. 2008;283:2129)。
LXR調節劑(較佳地LXR反向促效劑)可適用於治療腎病症候群之高膽固醇血症(參見Liu & Vazizi in Nephrol. Dial. Transplant. 2014;29:538)。
實驗部分
本發明之化合物可藉由包括以下流程I
至V
中所描述之程序的此項技術中已知之方法之組合製備。
流程I
中所描繪之合成途徑開始於藉由薗頭偶合(Sonogashira couplings)製備炔烴I-c
。隨後,在存在合適鹼及合適溶劑的情況下,I-c
之游離胺基與磺醯基氯化物I-d反應,以獲得炔磺醯胺I-e
。在存在合適催化劑(例如,Pd催化劑)、合適溶劑及溫度的情況下,I-e
經歷環化且伴隨與芳族鹵化物I-f
反應,以獲得本發明化合物(I
)。藉由熟習此項技術者已知之標準方法(例如,酯水解、醯胺鍵形成)進一步操作R1
中存在的官能基可產生其他本發明化合物。替代地,炔醯胺I-c
可轉化為炔三氟乙醯胺I-g
,其亦可經受前述環化且伴隨與芳族鹵化物I-f
反應,以獲得具有未經取代之NH之中間物I-h
。在存在合適鹼及合適溶劑的情況下與磺醯基氯化物I-d
之反應亦獲得式(I
)化合物。
流程 I
:合成本發明化合物
展示於流程I
中之途徑之變化形式展示於流程II
中。炔磺醯胺I-e
在存在NIS的情況下反應,以獲得碘化中間物II-b
,其可為用於鈴木偶合(Suzuki couplings)之底物以獲得化合物(I
)。替代地,在存在合適催化劑(例如,Pd催化劑)、合適溶劑及溫度的情況下但在不存在鹵化物I-f
之情況下,環化炔磺醯胺I-e
,以獲得未經3取代之中間物II-d
。與NBS反應獲得溴化中間物II-e
,其同樣為鈴木偶合反應之底物,以獲得式(I
)化合物。
流程 II
:用於本發明化合物之合成途徑,經由鈴木偶合藉由引入部分D。
流程I
及II
中所描繪之合成途徑之另一變化形式展示於流程III
中。在存在B2
Pin2
、合適催化劑(例如,Pd催化劑)、合適溶劑、添加劑及溫度的情況下,中間物I-e
可經受環化且伴隨形成3-頻哪醇基硼酸酯III-b
。此等可為用於鈴木偶合反應之底物,以獲得式(I
)之本發明化合物。
流程 III
:用於本發明化合物之可替代合成途徑,經由鈴木偶合藉由引入D。
在流程IV
中,描繪用於將右側部分-L-R1
後期引入至本發明化合物之合成途徑。將I-a
與溴-碘-芳族物IV-a
薗頭偶合,獲得溴-炔醯胺IV-b ,
其可轉化成磺醯胺IV-c
。此等可經受環化且伴隨在存在合適催化劑(例如,Pd催化劑)、合適溶劑及溫度的情況下與芳族溴化物IV-d
反應,以獲得具有環C上之溴取代基之高級中間物IV-e
。最後,中間物IV-e
可用作用於鈴木偶合之底物,以獲得式(I
)化合物。
流程 IV
:用於本發明化合物之合成途徑,經由鈴木偶合藉由最終引入-L-R1
。
在流程V
中,概括用於製備本發明化合物之合成途徑,該等合成途徑以預成中心吡咯環化雙環芳族為起始物質。N-保護2-頻哪醇基硼酸酯V-a
可經受與鹵化物V-b 之
鈴木偶合,以獲得中間物V-c
。在藉由NBS溴化後,獲得3-溴中間物V-d ,
在第二此鈴木偶合後其轉化為N- 保護之
高級中間物V-e
。當以開始N- 保護之
3-頻哪醇基硼酸酯V-a
時,第一次鈴木偶合且隨後溴化2位置且後續第二次鈴木偶合,同樣獲得中間物V-e
。在去保護且在存在合適鹼及溶劑的情況下,使游離NH與磺醯基氯化物I-d
反應後,獲得化合物(I
)。
流程 V
:合成本發明化合物,以預成核心芳族為起始物質。
縮寫 Ac 乙醯基
ACN 乙腈
AIBN 偶氮二異丁腈
aq. 水溶液
BINAP (2,2'-雙(二苯基膦基)-1,1'-聯萘)
B2
Pin2
4,4,4',4',5,5,5',5'-八甲基-2,2'-雙-1,3,2-二氧硼㖦
Boc 第三丁氧羰基
BPO 過氧化二苯甲醯m
-CPBA 間氯過氧苯甲酸
Cy 環己基
DAST 三氟化二乙基胺基硫
dba 二亞苄基丙酮
DBU 1,8-二氮雜雙環[5.4.0]十一-7-烯
DCM 二氯甲烷
DEA 二乙醇胺
DEAD 偶氮二羧酸二乙酯
DIEA或DIPEA 二異丙基乙胺
DMAP 4-N,N-二甲基胺基吡啶
DMF N,N-二甲基甲醯胺
dppf 1,1´-雙(二苯基膦基)二茂鐵
EA 乙酸乙酯
EDCI 1-乙基-3-(3-二甲胺基丙基)碳化二亞胺
FCC 矽膠管柱層析
h 小時
HATUO-(7-
氮雜苯并三唑-1-基)-N,N,N ' ,N '
-四甲基脲
六氟磷酸鹽
HOBt 羥基苯并三唑
IBX 2-碘氧基苯甲酸
LDA 二異丙基胺基鋰
LiHMDS 雙(三甲基矽烷基)醯胺鋰
NBS N-溴丁二醯亞胺
NIS N-碘丁二醯亞胺
Pin 頻哪醇根基(OCMe2
CMe2
O)
PE 石油醚
prep 製備型
sat. 飽和(水溶液)
Sphos 2-二環己基膦基-2',6'-二甲氧基二苯基
TBAF 氟化四正丁基銨
TEA 三乙胺
TFA 三氟乙酸
TFAA 三氟乙酸酐
THF 四氫呋喃
TLC 薄層層析
Tr 三苯甲基
Xantphos 4,5-雙(二苯基膦基)-9,9-二甲基二苯并哌喃
XPhos 2-二環己基膦基-2',4',6'-三異丙基聯苯
製備實例 P1 2-( 4- 溴 -3- 氯苯基 )-2- ( 二甲胺基 ) 乙酸甲酯 (P1)
向2-胺基-2-(4-溴-3-氯苯基)乙酸甲酯(300 mg,1.08 mmol)於MeOH (6 mL)中之溶液中添加CH2
O (37重量% H2
O;0.5 mL)及HCOOH (2.0 mL)。在rt下攪拌混合物30 min,隨後添加NaBH(OAc)3
(572 mg,2.7 mmol)。在rt下攪拌混合物2 h,用EA (150 mL)稀釋並用水(15 mL)、飽和NaHCO3
(15 mL)及鹽水(10 mL)洗滌。將有機層經Na2
SO4
乾燥,過濾,濃縮且藉由prep-TLC (EA:PE = 1:4)純化,以獲得呈無色油狀物的化合物P1
。
製備實例 P2 步驟 1 : 2-(( 三甲基矽烷基 ) 乙炔基 ) 吡啶 -3- 胺 (P2a)
將Pd(PPh3
)4
(993 mg,0.86 mmol)、CuI (164 mg,0.86 mmol)及PPh3
(225 mg,0.86 mmol)合併在圓底燒瓶中,隨後脫氣且再填充N2
三次。向混合物中添加TEA (43 mL)、2-溴吡啶-3-胺(1.49 g,8.59 mmol)及乙炔基三甲基矽烷(2.43 mL,18.0 mmol)。將混合物在60℃下攪拌6 h,冷卻至rt,經由矽藻土過濾並用EA (40 mL)洗滌。濃縮濾液,得到不經進一步純化即用於下一步驟中之呈黑色固體狀之化合物P2a
。
步驟2:2-乙炔基吡啶-3-胺(P2
)
向化合物P2a
(2.16 g, 8.59 mmol)於THF (26 mL)中之溶液中添加TBAF (26 mL,1MTHF,26 mmol)且將混合物在rt下攪拌3 h,濃縮且藉由FCC (EA/PE = 1:19至1:0)純化,以得到呈白色固體狀之化合物P2
。
製備實例 P3 步驟 1 : (4- 溴 -2- 巰基苯基 ) 甲醇 (P3a)
向4-溴-2-巰基苯甲酸(1.5 g,6.5 mmol)於THF (30 mL)中之溶液中添加BH3
(13 mL,1M THF)。將此混合物攪拌隔夜且用水(30 mL)淬滅且用EA (20 mL)稀釋。分離有機層,用EA (3 × 20 mL)洗滌水層。合併之有機層用鹽水(30 mL)洗滌,經Na2
SO4
乾燥,過濾且濃縮。黃色固體不經純化即用於下一步驟中。
步驟2:2-((5-溴-2-(羥基甲基)苯基)硫基)乙酸乙酯(P3b
)
向化合物P3a
(436 mg,2.0 mmol)及2-溴乙酸乙酯(306 mg, 2.0 mmol)於DMF (10 mL)中之混合物中添加Cs2
CO3
(2.0 g,6.0 mmol)。在rt下攪拌混合物隔夜,用水(100 mL)稀釋且用EA (3 × 30 mL)萃取。合併之有機層用鹽水(30 mL)洗滌,經Na2
SO4
乾燥,過濾,濃縮且藉由FCC (PE:EA = 5:1)純化,以獲得呈白色固體狀之化合物P3b。
步驟3:2-((5-溴-2-(羥基甲基)苯基)磺醯基)乙酸乙酯(P3
)
在0℃下向化合物P3b
(290 mg, 1.0 mmol)於DCM (5 mL)中之經攪拌溶液中添加m-CPBA (610 mg,3.0 mmol,85%)且在rt下攪拌所得混合物16 h,用飽和NaHCO3
水溶液稀釋且用EA (3 × 20 mL)萃取。合併之有機層經Na2
SO4
乾燥,過濾,濃縮且藉由FCC (PE:EA =5:1)純化,以獲得呈白色固體狀之化合物P3
。
製備實例 P3-1 步驟 1 : 4- 溴 -2-((2- 乙氧基 -2- 側氧基乙基 ) 硫基 )-6- 氟苯甲酸 (P3-1a)
向4-溴-2,6-二氟苯甲酸(10.0 g,42.4 mmol)及2-巰基乙酸乙酯(5.10 g, 42.4 mmol)於DMF (100 mL)中之混合物中添加Cs2
CO3
(41.5 g, 127 mmol)且在80℃下攪拌混合物隔夜,用水(1 L)稀釋且藉由2 M HCl調節至pH =3且用EA (3 × 300 mL)萃取。合併之有機層用鹽水(300 mL)洗滌,經Na2
SO4
乾燥,過濾,濃縮且藉由FCC (PE:EA = 1:1)純化,以得到呈黃色油狀物的化合物P3-1a
。
步驟2:2-((5-溴-3-氟-2-(羥基甲基)苯基)硫基)乙酸乙酯(P3-1b
)
向化合物P3-1a
(4.10 g,12.2 mmol)於THF (40 mL)中之溶液中添加B2
H6
(24.4 mL,1M之THF)。在70℃下攪拌此混合物隔夜,用水(100 mL)淬滅且用EA (4 × 40 mL)萃取。合併之有機層用鹽水(50 mL)洗滌,經Na2
SO4
乾燥,過濾,濃縮且藉由FCC (PE:EA = 5:1)純化,以得到呈白色固體狀之化合物P3-1b
。
步驟3:2-((5-溴-3-氟-2-(羥基甲基)苯基)磺醯基)乙酸乙酯(P3-1
)
在0℃下向化合物P3-1b
(1.00 g,3.40 mmol)於DCM (30 mL)中之經攪拌溶液中添加m-CPBA (1.80 g,10.2 mmol,85%)且在rt下攪拌混合物16 h,用飽和NaHCO3
水溶液稀釋且用EA (3 × 20 mL)萃取。合併之有機層經Na2
SO4
乾燥,濃縮且藉由FCC (PE:EA = 5:1)來純化,以得到呈白色固體狀之化合物P3-1
。
製備實例 P4 2-(3- 溴苯基 )- 2- 甲基環丙烷 -1- 羧酸甲酯 ( P4 )
向化合物P16
(1.00 g,3.92 mmol)於DMF (15 mL)中之溶液中添加MeI (1.11 g,7.84 mmol)及K2
CO3
(1.35 g,9.80 mmol)。在50℃下攪拌混合物2 h,冷卻,用EA (100 mL)稀釋並用水(3 × 20 mL)及鹽水(20 mL)洗滌,經Na2
SO4
乾燥,過濾,濃縮且藉由prep-TLC (EA:PE = 1:6)純化,以得到呈黃色油狀物的化合物P4
。
製備實例 P5 3'- 溴 -2- 氯 - [1,1'- 聯苯 ]-4- 羧酸甲酯 (P5)
在N2
下,向3-氯-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼戊環-2-基)苯甲酸甲酯(47.7 g,161 mmol)於二噁烷(300 mL)中之溶液中添加1-溴-3-碘苯(50.0 g,177 mmol)、Na2
CO3
(35.7 g,337 mmol)及Pd(PPh3
)4
(11.7 g,10.1 mmol)。在N2
下在90℃下攪拌混合物隔夜,冷卻,過濾,濃縮且藉由FCC (EA:PE = 1:50)純化,以得到呈白色固體狀之化合物P5
。
製備實例 P6 4-( 甲基 - d3 ) 苯磺醯氯 -2,3,5,6-d4
( P6 )
向甲苯-d8 (1.00 g,10.0 mmol)於DCM (10 mL)中之溶液中添加ClSO3
H (5 mL)且在rt下攪拌混合物2 h,倒入水(100 mL)中並用DCM (100 mL)萃取。有機層經濃縮,以得到呈白色固體狀之化合物P6
。
製備實例 P7 2-(3- 溴 -4- 氰基苯氧基 ) 乙酸第三丁酯 (P7)
在rt下攪拌2-(3-溴-4-氰基苯氧基)乙酸(200 mg,0.78 mmol)、Boc2
O (204 mg,0.94 mmol)、DMAP (10 mg,80 µmol)及吡啶(0.4 mL)於tert-BuOH (10 mL)中之混合物隔夜,濃縮並藉由FCC (PE:EA = 50:1)純化,以得到呈黃色油狀物的化合物P7
。
製備實例 P8 5- 氯 -2- 氟 -4-(4,4,5,5- 四甲基 -1,3,2- 二氧雜硼戊環 -2- 基 ) 苯甲酸甲酯 (P8)
在N2
下,向4-溴-5-氯-2-氟苯甲酸甲酯(2.66 g,10.0 mmol)於二噁烷(30 mL)中之溶液中添加 B2
Pin2
(2.79 g,11.0 mmol)、KOAc (2.45 g,25.0 mmol)及Pd(dppf)Cl2
(260 mg)。在N2
下在80℃下攪拌混合物隔夜,用水(50 mL)稀釋並用EA (3 × 50 mL)萃取。合併之有機層用鹽水洗滌,經Na2
SO4
乾燥,過濾,濃縮且藉由FCC (EA:PE = 1:40)純化,以得到呈白色固體狀之化合物P8
。
製備實例 P9 4-(3- 溴苯基 ) 丁酸甲酯 (P9)
向4-(3-溴苯基)丁酸(500 mg,2.06 mmol)於DMF (50 mL)中之溶液中添加K2
CO3
(569 mg,4.11 mmol)及CH3
I (438 mg,3.09 mmol)。在rt下攪拌混合物2 h。過濾出不可溶鹽並用EA洗滌。合併之有機層用水(3 × 50 mL)、鹽水(2 × 50 mL)洗滌,經Na2
SO4
乾燥且過濾。在減壓下移除溶劑,獲得不經進一步純化即用於下一步驟中之呈黃色固體狀之化合物P9
。
製備實例P10 2-(3- 溴苯氧基 ) 乙酸甲酯 ( P10 )
向3-溴苯酚(1.72 g,10.0 mmol)及溴乙酸甲酯(1.01 mL,11.0 mmol)於ACN (60 mL)中之溶液中添加K2
CO3
(2.07 g, 15.0 mmol)且在50℃下攪拌混合物隔夜。在過濾出不可溶鹽並用ACN洗滌後,在減壓下移除溶劑且將剩餘部分溶解於EA中且隨後用水及鹽水洗滌。有機層經Na2
SO4
乾燥,過濾且濃縮,以得到呈無色半固體狀之化合物P10
。
製備實例P11 3-((6- 溴吡啶 -2- 基 ) 氧基 ) 丙酸甲酯 ( P11 )
在N2
下,向6溴吡啶-2(1H)-酮(800 mg,4.59 mmol)及PPh3
(2.39 g,9.19 mmol)於無水THF(30 mL)中之溶液中添加DEAD (1.20 g,6.89 mmol)及3-羥基丙酸甲酯(479 mg,4.59 mmol)。在rt下攪拌混合物隔夜,用飽和NH4
Cl (60 mL)淬滅且用EA (2 × 30 mL)萃取。合併之有機層用鹽水(2 × 30 mL)洗滌,經Na2
SO4
乾燥,濃縮且藉由prep-TLC (EA:PE = 1:4)純化,以得到呈白色固體狀之化合物P11
。
製備實例P12 1-(3- 溴苯基 ) 氮雜環丁烷 -3- 羧酸甲酯 (P12)
向1-溴-3-碘苯(500 mg,1.77 mmol)於二噁烷(8 mL)中之溶液中添加氮雜環丁烷-3-羧酸甲酯鹽酸鹽(295 mg,1.94 mol)、Pd2
(dba)3
(35 mg,40 µmol)、XPhos (17 mg,40 µmol)及Na2
CO3
(375 mg,3.53 mmol)。在100℃下攪拌混合物隔夜,冷卻至rt,過濾,濃縮且藉由prep-TLC (PE:EA = 2:1)純化,以得到呈黃色油狀物的化合物P12
。
製備實例P13 1-(3- 溴苯基 )- 3- 甲基氮雜環丁烷 -3- 羧酸甲酯 ( P13 )
向1-溴-3-碘苯(500 mg, 1.77 mmol)於二噁烷(15 mL)中之溶液中添加3-甲基氮雜環丁烷-3-羧酸甲酯鹽酸鹽(293 mg,1.77 mmol)、Pd2
(dba)3
(32 mg,35 µmol)、Xantphos (20 mg,35 µmol)及Cs2
CO3
(1.35 g,3.54 mmol)。在N2
下在100℃下攪拌混合物隔夜,冷卻至rt,用水(150 mL)稀釋且用EA (3 × 200 mL)萃取。合併之有機層用鹽水(2 × 50 mL)洗滌,經Na2
SO4
乾燥,濃縮且藉由FCC (EA:PE = 1:5)純化,以獲得呈黃色油狀物的化合物P13
。
製備實例P14 1-(6- 溴吡啶 -2- 基 ) 氮雜環丁烷 -3- 羧酸甲酯 ( P14 )
向2,6-二溴吡啶(500 mg,2.11 mmol)於DMF (20 mL)中之溶液中添加氮雜環丁烷-3-羧酸甲酯鹽酸鹽(384 mg,2.53 mmol)及K2
CO3
(729 mg,5.28 mmol)且在80℃下攪拌混合物隔夜。在冷卻至rt之後,過濾出不可溶鹽並用EA洗滌。合併之有機物溶劑用水(3 × 50 mL)、鹽水(2 × 50 mL)洗滌,經Na2
SO4
乾燥,過濾並濃縮。藉由prep-TLC (PE:EA = 4:1)純化殘餘物,以獲得呈黃色油狀物的化合物P14
。
製備實例P15 步驟 1 : 3-(3- 溴苯基 )- 3- 羥基環丁烷 -1- 羧酸 (P15a)
在-78℃下,向1-溴-3-碘苯(2.82 g, 10.0 mmol)及3-側氧基環丁烷-1-羧酸(1.14 g, 10.0 mmol)於THF (30 mL)中之溶液中添加n-BuLi (8 mL,20 mmol,2.5 M之THF)且在-78℃下攪拌混合物4 h,用NH4
Cl (50 mL)淬滅,用1N HCl水溶液中和且用EA (3 ×)萃取。合併之有機層用鹽水洗滌,經Na2
SO4
乾燥,過濾,濃縮且藉由FCC (EA:PE = 1:1)純化,以得到呈無色油狀物的化合物P15a
。
步驟2:3-(3-溴苯基)-3-羥基環丁烷-1-羧酸甲酯(P15b
)
向化合物P15a
(1.35 g, 5.00 mmol)於DMF (20 mL)中之溶液中添加K2
CO3
(1.38 g, 10.0 mmol)及CH3
I (710 mg, 5.00 mmol)且在rt下攪拌混合物2 h。添加水(200 mL)且用EA萃取混合物。合併之EA萃取物用鹽水洗滌、經無水Na2
SO4
乾燥且過濾。在減壓下移除溶劑且藉由FCC (EA:PE = 1:10)純化殘餘物,以得到呈無色油狀物的化合物P15b
。
步驟3:3-(3-溴苯基)環丁烷-1-羧酸甲酯(P15
)
在0℃下向化合物P15b
(1.10 g,3.90 mmol)於TFA (20 mL)中之溶液中添加三乙基矽烷(680 mg,5.85 mmol)且攪拌混合物2 h。向混合物中添加水(200 mL)且用EA萃取混合物。在減壓下移除溶劑且藉由FCC (EA:PE = 1:10)純化殘餘物,以得到呈無色油狀物的化合物P15
。
製備實例P16 步驟 1 : (E)-3-(3- 溴苯基 ) 丙烯酸甲酯 (P16a)
使(E)-3-(3-溴苯基)丙烯酸(3.00 g,13.2 mmol)溶解於DMF (50 mL)中,添加MeI (3.75 g,26.4 mmol)及K2
CO3
(2.74 g,19.8 mmol)且在rt下攪拌混合物2 h。在過濾出不可溶鹽並用EA洗滌後,溶劑用水(3 × 50 mL)、鹽水(2 × 50 mL)洗滌,經Na2
SO4
乾燥,過濾且濃縮,得到無需任何純化即用於下一步驟中之呈黃色固體狀之化合物P16a
。
步驟2:rac
-(1R,2R
)-2-(3-溴苯基)環丙烷-1-羧酸甲酯(P16
)
在氬氣下,NaH (60 %,680 mg,17.0 mmol)最初在DMSO (30 mL)中帶電且在rt下一次性添加三甲基氧化鋶碘(trimethylsulphoxonium iodide) (3.74 g,17.0 mmol)。在氣體逸出停止後,逐滴緩慢添加含化合物P16a
(3.15 g,13.1 mmol)溶解於中之DMSO (10 mL)。在50℃下攪拌隔夜之後,使混合物分配於EA與水之間。用EA萃取水層。合併之有機層經Na2
SO4
乾燥,過濾,濃縮且藉由FCC (EA:PE = 1:20)純化,得到呈無色油狀物的化合物P16
。
製備實例P17 3'- 溴 -[1,1'- 聯苯 ]-3- 羧酸甲酯 ( P17
)
向(3-溴苯基)硼酸(1.50 g,7.47 mmol)於二噁烷(30 mL)中之溶液中添加3-溴苯甲酸甲酯(1.93 g, 8.96 mmol)、Pd(PPh3
)4
(173 mg, 0.15 mmol)及Na2
CO3
(1.58 g, 14.9 mmol)。在100℃下攪拌混合物隔夜。在冷卻至rt後,過濾反應物,濃縮且藉由FCC純化,以得到呈黃色油狀物的化合物P17
。
製備實例P18 步驟 1 : 3'-(( 三甲基矽烷基 ) 乙炔基 )- [1,1'- 聯苯 ]-4- 羧酸甲酯 (P18a)
將Pd(PPh3
)4
(1.98 g,1.72 mmol)、CuI (327 mg,1.72 mmol)及PPh3
(450 mg,1.72 mmol)合併在圓底燒瓶中且燒瓶經脫氣且用N2
再填充三次。添加TEA (86 mL)、3'-溴-[1,1'-聯苯]-4-羧酸甲酯(P5/2
,5.00 g,17.2 mmol)及乙炔基三甲基矽烷(4.86 mL,36.1 mmol)且在60℃下攪拌混合物6 h。在經由矽藻土過濾後,在減壓下濃縮濾液,得到不經進一步純化即用於下一步驟中之呈黑色固體狀之化合物P18a
。
步驟2:3'-乙炔基-[1,1'-聯苯]-4-羧酸甲酯(P18
)
向化合物P18a
(6.21 g,17.2 mmol)於THF (25 mL)中之溶液中添加TBAF (25 mL,1M之THF)且在rt下攪拌混合物3 h。在減壓下濃縮後,藉由FCC (EA:PE = 1:20)純化殘餘物,以得到呈白色固體狀之化合物P18
。
製備實例P19 步驟 1 : 3- 溴呋喃 -2- 甲醯胺 (P19a)
向3-溴呋喃-2-羧酸(1.00 g,5.24 mmol)於DMF (10 mL)中之溶液中添加HATU (2.98 g,7.85 mmol)及DIPEA (1.69 g,13.1 mmol)且在rt下攪拌混合物1 h。添加NH4
Cl (333 mg,6.29 mmol)且持續攪拌隔夜。添加水(30 mL)且用EA (3 × 30 mL)萃取混合物。合併之有機層經Na2
SO4
乾燥,濃縮且藉由FCC純化,以得到呈黃色固體狀之化合物P19a
。
步驟2:3-溴呋喃-2-甲腈(P19
)
在0℃下,向化合物19a
(906 mg, 4.77 mmol)於DCM (10 mL)中之溶液中添加TFAA (2.50 g,11.9 mmol)且攪拌混合物2 h,用水(30 mL)稀釋且用DCM (3 × 30 mL)萃取。合併之有機層經Na2
SO4
乾燥,濃縮且藉由FCC (EA:PE = 1:20)純化,以得到呈白色固體狀之化合物P19
。
製備實例P20 2- 溴 -4- 氟 -6- 甲氧基苯胺 ( P20 )
在-78℃下向4-氟-2-甲氧基苯胺(8.90 g,63.1 mmol)於乾燥DCM (217 mL)中之溶液中添加NBS (12.4 g,69.4 mmol)且在-78℃下攪拌混合物2 h,隨後升溫至0℃並攪拌2 h。在真空中移除溶劑且藉由FCC (EA:PE = 1:10)純化所得殘餘物,以得到呈黃色油狀物的化合物P20
。
製備實例P21 步驟 1 : 2-(4- 溴苯基 )-2-(( 三甲基矽烷基 ) 氧基 ) 丙腈 ( P21a )
向含1-(4-溴苯基)乙-1-酮(5.00 g,50.0 mmol)之DCM (200 mL)中添加氰化三甲基矽烷(4.96 g,50.0 mmol)及碘化鋅(50 mg)。在rt下攪拌此混合物5 h。用水(2 × 20 mL)及鹽水(20 mL)洗滌混合物。有機層經Na2
SO4
乾燥並濃縮,獲得不經任何純化即用於下一步驟中之粗化合物P21a
。
步驟2:2-(4-溴苯基)-2-羥丙酸(P21b
)
向化合物P21a
(12.2 g, 40.9 mmol)於AcOH (50 mL)中之溶液中添加濃HCl (50 mL)。在rt下攪拌混合物隔夜且在100℃下加熱2 h。在減壓下移除溶劑。添加H2
O且用EA (3 × 200 mL)萃取混合物。有機層經Na2
SO4
乾燥並濃縮,得到不經任何純化即用於下一步驟中之呈黃色油狀物的粗化合物P21b
。
步驟3:2-(4-溴苯基)-2-羥基丙酸甲酯(P21c
)
向化合物P21b
(6.50 g,26.5 mmol)於MeOH (60 mL)中之溶液中添加濃H2
SO4
(3 mL)。在rt下攪拌混合物。在減壓下移除溶劑,使其溶解於EA (300 mL)中並用H2
O (30 mL)及飽和NaHCO3
(30 mL)洗滌。有機層經Na2
SO4
乾燥,濃縮且藉由FCC (EA:PE = 1:2)純化,以得到呈無色油狀物的化合物P21c
。
步驟4:2-羥基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧雜硼戊環-2-基)苯基)丙酸甲酯(P21
)
向化合物P21c
(200 mg,0.77 mmol)於二噁烷(10 mL)中之溶液中添加B2
Pin2
(209 mg,0.93 mmol)、KOAc (151 mg,1.54 mmol)及Pd(dppf)Cl2
(56 mg,0.08 mmol)。在N2
下在100℃下攪拌混合物隔夜。在冷卻至rt之後,過濾混合物且在減壓下移除溶劑。藉由prep-TLC (EA:PE = 1:1)純化殘餘物,以獲得呈白色固體狀之化合物P21
。
製備實例P22 (1-及2-三苯甲基異構體之混合物) 步驟 1 : 5-(4- 溴 -3- 氯苯基 )-1H
- 四唑 ( P22a )
向4-溴-3-氯苯并腈(500 mg,2.33 mmol)於DMF (10 mL)中之溶液中添加NaN3
(1.50 g,23.3 mmol)及NH4
Cl (1.20 g,23.3 mmol)。在N2
下在100℃下攪拌混合物隔夜。隨後添加DCM (100 mL)且用鹽水(30 mL)洗滌混合物。有機層經Na2
SO4
乾燥,濃縮且藉由FCC (EA:PE = 1:3)純化,以得到呈白色固體狀之化合物P22a
。
步驟2:5-(4-溴-3-氯苯基)-1-三苯甲基-1H-四唑(P22) ,
(1-及2-三苯甲基異構體之混合物)
向化合物P22a
(350 mg,1.36 mmol)於DCM (50 mL)中之溶液中添加氯化三苯甲基(556 mg,2.00 mmol)及TEA (202 mg,2.00 mmol)。在rt下攪拌混合物12 h。隨後添加DCM (50 mL)且用鹽水(30 mL)洗滌混合物。有機層經Na2
SO4
乾燥,濃縮且藉由FCC (EA:PE = 1:7)純化,以獲得呈白色固體狀之化合物P22
。
製備實例P23 (1-及2-三苯甲基異構體之混合物) 步驟 1 : N-( (3- 溴苯基 )( 甲基 )( 側氧基 )-λ6
- 硫烷亞基 )-2,2,2- 三氟乙醯胺 (P23a)
向1-溴-3-(甲亞磺醯基)苯(950 mg,4.38 mmol)於DCM (10 mL)中之溶液中添加MgO (697 mg,17.4 mmol)、2,2,2-三氟乙醯胺(742 mg,6.57 mmol)、Rh2
(OAc)4
(100 mg)及(二乙醯氧基)碘苯(2.82 g,8.76 mmol)。在40℃下攪拌混合物隔夜且經由矽藻土墊過濾。在減壓下移除溶劑且藉由FCC (PE:EA = 1:2)純化粗產物,以得到呈白色固體狀之化合物P23a
。
步驟2:(3-溴苯基)(亞胺基)(甲基)-λ6
-磺基肟(P23b
)
向化合物P23a
(680 mg, 2.07 mmol)於MeOH (5 mL)中之經攪拌溶液中添加K2
CO3
(713 mg, 5.17 mmol)且在rt下持續攪拌1 h。隨後添加水且用EA (3 × 20 mL)萃取混合物。合併之有機層用鹽水(20 mL)洗滌,經Na2
SO4
乾燥並濃縮,以得到呈白色固體狀之化合物P23b
。
步驟3:N
-((3-溴苯基)(甲基)(側氧基)-λ6
-硫烷亞基)氰胺(P23c
)
向化合物P23b
(430 mg,1.86 mmol)於DCM (5 mL)中之溶液中添加氰化溴化物(235 mg, 2.24 mmol)及TEA (376 mg, 3.72 mmol)。在rt下攪拌混合物3 h,用水稀釋且用EA (3 × 20 mL)萃取。合併之有機層用飽和NaHCO3
(20 mL)水溶液洗滌,經Na2
SO4
乾燥並濃縮,得到呈黃色固體狀之化合物P23c
。
步驟4:((1H- 四唑 -5- 基
)亞胺基)(3-溴苯基)(甲基)-λ6
-磺基肟(P23d
)
向化合物P23c
(420 mg,1.63 mmol)於DMF (5 mL)中之經攪拌之溶液中添加NaN3
(1.06 g, 16.3 mmol)及NH4
Cl (864 mg, 16.3 mmol)。攪拌混合物並加熱至100℃保持隔夜。在冷卻至rt之後,添加水且用EA (3 × 20 mL)萃取混合物。合併之有機層經Na2
SO4
乾燥,過濾,濃縮且藉由prep-TLC (PE:EA = 1:1)純化,以得到呈白色固體狀之化合物P23d
。
步驟5:(3-溴苯基)(甲基)((1-三苯甲基-1H-四唑-5-基)亞胺基)-λ6
-磺基肟(P23
) (1-及2-三苯甲基異構體之混合物)
向化合物P23d
(350 mg,1.16 mmol)於DCM (20 mL)中之經攪拌之溶液中添加氯化三苯甲基(388 mg,1.39 mmol)及TEA (0.3 mL,2.3 mmol)。在rt下持續攪拌隔夜。隨後添加水且用DCM (3 × 50 mL)萃取混合物。合併之有機層用鹽水(20 mL)洗滌,經Na2
SO4
乾燥,濃縮且藉由FCC (EA:PE = 1:3)純化,以得到呈白色固體狀之化合物P23
。
製備實例P24 rel
-(1R
,3r
,5S
)-8-氮雜雙環[3.2.1]辛烷-3-羧酸甲酯鹽酸鹽(P24
)
使rel
-(1R
,3r
,5S
)-8-(第三丁氧基羰基)-8-氮雜雙環[3.2.1]辛烷-3-羧酸(500 mg,1.96 mmol)溶解於含HCl之MeOH (20 mL)中。在rt下攪拌溶液5 h。在減壓下移除溶劑,得到呈白色固體狀之化合物P24
。
製備實例P25 步驟 1 : (4- 溴 -2-( 甲磺醯基 ) 苯基 ) 甲醇 (P25a)
在0℃,向4-溴-2-(甲磺醯基)苯甲酸甲酯(3.00 g,10.2 mmol)於MeOH (20 mL)中之溶液中緩慢添加LiBH4
(4.00 g,100 mmol)。在80℃下攪拌混合物隔夜。在藉由冰浴冷卻下緩慢添加水(40 mL)且用EA (3 × 30 mL)萃取混合物。合併之有機層用鹽水(30 mL)洗滌,經Na2
SO4
乾燥,過濾且減壓濃縮,得到呈淡黃色固體狀之化合物P25a
,其直接地用於下一步驟中。
步驟2:2-(4-溴-2-(甲磺醯基)苯基)乙腈(P25b
)
向氰化溴化物(712 mg,6.70 mmol)及PPh3
(1.76 g,6.70 mmol)於DCM (30 mL)之溶液中添加化合物P25a
(1.50 g, 5.60 mmol)於DCM (50 mL)中之溶液。在15℃下攪拌混合物1 h,隨後在0℃下添加DBU (1.10 g,6.70 mmol)。在0至15℃下攪拌所得混合物另外16 h。在真空中濃縮溶劑。藉由FCC (PE:EA = 4:1)純化殘餘物,以得到呈黃色固體狀之化合物P25b
。
步驟3:2-(4-溴-2-(甲磺醯基)苯基)-2-甲基丙腈(P25c
)
在-78℃下,向化合物P25b
(200 mg, 1.10 mmol)於THF (20 mL)中之溶液中添加第三丁醇鉀(502 mg,4.40 mmol)及碘甲烷(624 mg,4.40 mmol)。使混合物升溫至-20℃且攪拌隔夜,用NH4
Cl水溶液(30 mL)稀釋且用EA (3 × 30 mL)萃取。合併之有機層用鹽水(100 mL)洗滌,經Na2
SO4
乾燥,過濾,濃縮且藉由FCC (PE:EA = 100:8)純化,得到呈黃色固體狀之化合物P25c
。
步驟4:2-(4-溴-2-(甲磺醯基)苯基)-2-甲基丙酸(P25
)
向化合物P25c
(850 mg,2.80 mmol)於EtOH (5 mL)及H2
O (5 mL)中之溶液中添加KOH (1.20 g,22.4 mmol)。在80℃下攪拌混合物2 d。藉由添加1N HCl
水溶液將pH調節至約5且用DCM/MeOH (10/1,3 × 40 mL)萃取混合物。合併之有機層用鹽水(100 mL)洗滌,經Na2
SO4
乾燥,過濾並濃縮,以得到呈黃色固體狀之化合物P25
。
製備實例P26 4- 溴 -3-( 三氟甲基 )-1- 三苯甲基 -1H- 吡唑 ( P26 )
向4-溴-5-(三氟甲基)-1H-吡唑(428 mg,2.00 mmol)於DCM (10 mL)中之經攪拌之溶液中添加TEA (606 mg,6.00 mmol)及(氯甲烷三基)三苯(1.11 g,4.00 mmol)且在rt下持續攪拌隔夜。隨後移除溶劑並添加H2
O (50 mL)且用EA (3 × 50 mL)萃取混合物。合併之有機層用鹽水洗滌,經Na2
SO4
乾燥,過濾,濃縮並藉由FCC (PE:EA =5:1)純化,以得到呈白色固體狀之化合物P26
。
製備實例P27 步驟 1 : 3-(2- 溴苯基 )- 3- 羥基氮雜環丁烷 -1- 羧酸 第三丁 酯 ( P27a )
在-78℃下,向1-溴-2-碘苯(8.43 g,30.0 mmol)於THF (50 mL)中之溶液中緩慢添加含i
-PrMgBr之THF (0.90M,33 mL,30.0 mmol)。在攪拌持續2 h後,在-78℃下向混合物中逐滴添加3-側氧基氮雜環丁烷-1-羧酸第三丁酯(3.20 g,19.0 mmol)於THF (20 mL)中之溶液。在rt下混合物攪拌3 h,且接著用飽和NH4
Cl水溶液稀釋並用EA萃取。有機層用水及鹽水洗滌,經Na2
SO4
乾燥,濃縮並藉由FCC (PE:DCM = 2:1)純化,以獲得呈白色固體狀之化合物P27a
。
步驟2:3-(2-溴苯基)-3-氟氮雜環丁烷-1-羧酸第三丁酯(P27
)
在0℃下,向化合物P27a
(4.30 g,13.1 mmol)於DCM (50 mL)中之經攪拌之溶液中緩慢添加DAST (4.20 g,26.2 mmol)。攪拌4 h後,將混合物傾入水中並用EA萃取。有機層用鹽水洗滌,經Na2
SO4
乾燥,濃縮且藉由FCC (PE:DCM = 3:1)純化,以得到呈無色油狀物的化合物P27
。
製備實例P28 步驟 1 : 3-(3- 溴噻吩 -2- 基 ) 氧雜環丁 -3- 醇 ( P28a )
在N2
下在-60℃下,向3-溴噻吩(13.0 g,80.2 mmol)於THF (20 mL)中之懸浮液中添加LDA (48.0 mL,2.0M之THF,96.0 mmol)。在-60℃下攪拌混合物45 min。隨後添加氧雜環丁-3-酮(8.70 g,121 mmol)並在-60℃下持續攪拌30 min。緩慢添加水且用EA (3 ×)萃取混合物。合併之有機層經Na2
SO4
乾燥,過濾,濃縮且藉由FCC (PE:EA = 10:1至5:1)純化,以得到呈褐色油狀物之化合物P28a
。
步驟2:3-(3-溴噻吩-2-基)氧雜環丁烷(P28
)
在N2
下在0℃下,向化合物P28a
(17.0 g,72.6 mmol)於DCM (120 mL)中之混合物中添加BF3
·Et2
O (18.5 mL, 146 mmol)。在0℃下攪拌混合物30 min。隨後添加三乙基矽烷(35.0 mL,220 mmol)且在0℃下攪拌混合物30 min。添加更多三乙基矽烷(35.0 mL,220 mmol)且在0℃下攪拌混合物30 min。添加第三部分之三乙基矽烷(35.0 mL,220 mmol)並在0℃下持續攪拌30 min。在藉由冰浴冷卻下,向NaOH水溶液(10%,200 g)中添加混合物並用EA (3 ×)萃取。合併之有機層經Na2
SO4
乾燥,過濾,濃縮且藉由FCC (PE/DCM = 10:1至3:1)純化,以得到呈黃色油狀物的化合物P28
。1
H-NMR (CDCl3
, 400 MHz) δ: 7.23 (d, J = 5.2 Hz, 1H), 6.94 (d, J = 5.2 Hz, 1H), 5.08-5.04 (m, 2H), 4.80-4.77 (m, 2H), 4.67-4.59 (m, 1H)。
製備實例P29 步驟 1 : 2- 溴環己 -1- 烯 -1- 甲醯胺 ( P29a )
向2-溴環己-1-烯-1-羧酸(1.20 g,5.88 mmol)於DCM (20 mL)中之溶液中添加HATU (3.35 g,8.82 mmol)、DIPEA (2.16 g,16.7 mmol)及NH4
Cl (3.20 g,58.9 mmol)。在rt下攪拌混合物24 h,過濾,濃縮並藉由FCC (PE:EA = 1:1)純化,以得到呈無色油狀物的化合物P29a
。
步驟2:2-溴環己-1-烯-1-甲腈(P29
)
在0℃下,向化合物P29a
(510 mg,2.51 mmol)於DCM (20 mL)中之溶液中添加TFAA (1.05 g,5.02 mmol)。在rt下攪拌混合物12 h,倒入水(50 mL)中且用DCM (3 × 20 mL)萃取。合併之有機層用鹽水(30 mL)洗滌,經Na2
SO4
乾燥,過濾,濃縮並藉由FCC (PE:EA = 2:1)純化,以得到呈白色固體狀之化合物P29
。
製備實例P30 步驟 1 : 2- 氯 -3'-(( 三甲基矽烷基 ) 乙炔基 )- [1,1'- 聯苯 ]-4- 羧酸甲酯 ( P30a )
將Pd(PPh3
)4
(553 mg,0.48 mmol)、CuI (93 mg,0.48 mmol)及PPh3
(126 mg,0.48 mmol)合併在圓底燒瓶中,隨後脫氣且再填充N2
三次。向混合物中添加TEA (45 mL)、化合物P5
(2.00 g,6.10 mmol)、乙炔基三甲基矽烷(786 mg,10.2 mmol)且隨後在60℃下攪拌混合物6 h,冷卻,經由矽藻土過濾並用EA (40 mL)洗滌。濃縮濾過物並藉由FCC (PE:EA = 20:1)純化,以得到呈黃色固體狀之化合物P30a
。
步驟2:2-氯-3'-乙炔基-[1,1'-聯苯]-4-羧酸甲酯(P30
)
向化合物P30a
(2.05 g,5.89 mmol)於MeOH (5 mL)中之溶液中添加K2
CO3
(778 mg,7.07 mmol)且在rt下攪拌混合物30 min,倒入冰水(50 mL)中並用DCM (2 × 50 mL)萃取。合併之有機層經Na2
SO4
乾燥,過濾並濃縮,以得到呈黃色固體狀之化合物P30
。
製備實例P31 1-(2- 氯吡啶 -3- 基 ) 氮雜環丁 -3- 醇 ( P31 )
在N2
下,向2-氯-3-碘吡啶(1.20 g,5.00 mmol)於甲苯(20 mL)中之溶液中添加氮雜環丁-3-醇鹽酸鹽(1.09 g,10.0 mmol)、Cs2
CO3
(6.52 g,20.0 mmol)、BINAP (311 mg,0.50 mmol)及Pd2
(dba)3
(200 mg)。在N2
下在110℃下攪拌混合物隔夜。在冷卻至rt之後,過濾混合物且在減壓下移除溶劑。藉由FCC (EA:PE = 1:3)純化殘餘物,以獲得呈黃色固體狀之化合物P31
。
製備實例P32 2-(4- 溴苯基 )-2- 羥基丙酸乙酯 ( P32 )
在0℃下,向2-(4-溴苯基)-2-側氧基乙酸乙酯(512 mg, 2.00 mmol)於THF (30 mL)中之溶液中添加MeMgBr (2 mL,1M之THF)。在0℃下攪拌混合物1 h,用水(50 mL)稀釋並用EA (3 × 50 mL)萃取。合併之有機層用鹽水洗滌,經Na2
SO4
乾燥,過濾,濃縮並藉由FCC (PE:EA = 5:1)純化,以得到呈白色固體狀之化合物P32
。
製備實例P33 4- 溴 -3- 氯苯磺酸 ( P31 )
在100℃下攪拌氯化4-溴-3-氯苯磺醯基(576 mg,2.00 mmol)於H2
O (30 mL)中之溶液16 h並濃縮,以得到呈白色固體狀之化合物P33
。
製備實例P34 步驟 1 : N-( (4- 溴 -3- 氯苯基 ) 磺醯基 ) 乙醯胺 (P34a)
使4-溴-3-氯苯磺醯胺(1.5 g,5.5 mmol)溶解於吡啶(5 mL)中。隨後添加DMAP (22 mg,0.18 mmol)及Ac2
O (1.1 mL,12 mmol)且在rt下攪拌混合物3 h,用EA稀釋並用NH4
Cl水溶液(3 ×)及水洗滌。有機層經Na2
SO4
乾燥並濃縮。所得油狀物用PE濕磨且藉由過濾收集沈澱物,以獲得呈白色固體狀之化合物P34a
。
步驟2:N-(
(3-氯-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼戊環-2-基)苯基)磺醯基)乙醯胺(P34
)
向化合物P34a
(310 mg,1.00 mmol)於二噁烷(5 mL)中之溶液中添加添加B2
Pin2
(381 mg,1.50 mmol)、KOAc (276 mg,2.00 mmol)及Pd(dppf)Cl2
(120 mg)。在N2
下在90℃下,攪拌混合物8 h,冷卻,過濾,濃縮並藉由FCC (PE:EA = 5:1)純化,以得到呈黃色固體狀之化合物P34
。
製備實例P35 步驟 1 : 4- 溴吡啶 -3,5- 二羧酸 ( P35a )
向4-溴-3,5-二甲基吡啶(1.24 g,6.72 mmol)於水(15 mL)中之溶液中添加KMnO4
(1.59 g,10.1 mmol)且在100℃下攪拌混合物1 h。隨後,添加額外量之含KMnO4
(1.59 g,10.1 mmol)之水(15 mL)並在100℃下攪拌持續2 h。隨後,過濾混合物且溶劑經濃縮至約5 mL,藉由濃HCl調節至pH=2並濃縮,得到呈白色固體狀之化合物P35a
。
步驟2:4-氯吡啶-3,5-二甲醯胺(P35b
)
向化合物P35a
(1.30 g, 5.30 mmol)於DCM (15 mL)中之溶液中添加SOCl2
(1.5 mL)及DMF (3滴)。在45℃下攪拌混合物2 h,濃縮並再溶解於二噁烷(5 mL)。在0℃下,向溶液中逐滴添加NH3
•H2
O (20 mL)且隨後濃縮,以得到呈黃色固體狀之化合物P35b
。
步驟3:4-氯吡啶-3,5-二甲腈(P35
)
向化合物P35b
(188 mg,0.94 mmol)於DMF (5 mL)中之溶液中添加POCl3
(1 mL)且在rt下攪拌混合物隔夜,用水(30 mL)稀釋並用EA (3 × 50 mL)萃取。合併之有機層用NaHCO3
水溶液(30 mL)洗滌,濃縮並藉由FCC (PE:EA = 5:1)純化,以得到呈白色固體狀之化合物P35
。
常用批註:實例編號前之「C」意謂其為比較實例,而實例編號前之「P」意謂實例含有保護基。此等實例不在技術方案之範疇內。
實例1 步驟 1 : 2-((3- 溴苯基 ) 乙炔基 )- 4- 氟苯胺 (1a)
向1-溴-3-碘苯(5.00 g,17.7 mmol)於Et3
N (50 mL)中之溶液中添加Pd(PPh3
)4
(1.22 g,1.06 mmol)、CuI (269 mg,1.41 mmol)、PPh3
(278 mg,1.06 mmol)及2-乙炔基-4-氟苯胺(2.86 g,21.2 mmol)。在N2
下在60℃下攪拌混合物4 h,冷卻,過濾,濃縮並藉由FCC (PE:EA = 8:1)純化,以得到呈黃色固體狀之化合物1a
。
步驟2:N-(2-(
(3-溴苯基)乙炔基)-4-氟苯基)-4-甲基苯磺醯胺(1b)
向化合物1a
(3.50 g,12.1 mmol)於DCM (50 mL)中之溶液中添加吡啶(3.5 mL)、氯化4-甲基苯-1-磺醯基(4.58 g,24.1 mmol)及DMAP (350 mg)。在rt下攪拌混合物隔夜,用CH2
Cl2
(300 mL)稀釋且隨後用2N HCl (3 × 30 mL)及鹽水(30 mL)洗滌。有機層經Na2
SO4
乾燥,過濾,濃縮且藉由FCC (PE:EA = 5:1)純化,以得到呈白色固體狀之化合物1b
。
步驟3:3-(2-(3-溴苯基)-5-氟-1-甲苯磺醯基-1H
-吲哚-3-基)噻吩-2-甲腈(1)
在N2
下,向化合物1b
(4.20 g, 9.48 mmol)於CH3
CN (60 mL)中之溶液中添加3-溴噻吩-2-甲腈(3.67 g,14.2 mmol)、K2
CO3
(2.62 g,10.0 mmol)及Pd(PPh3
)4
(1.09 g,0.95 mmol)。在100℃下攪拌混合物2 h,冷卻,倒入EA (400 mL)中並用水(50 mL)及鹽水(50 mL)洗滌。有機層經Na2
SO4
乾燥,過濾,濃縮且藉由FCC (EA:PE = 1:3)純化,以得到呈白色固體狀之化合物1
。
實例2 步驟 1 : 3-(5- 氟 -2-(3-(4,4,5,5- 四甲基 -1,3,2- 二氧雜硼戊環 -2- 基 ) 苯基 )-1- 甲苯磺醯基 -1H
- 吲哚 -3- 基 ) 噻吩 -2- 甲腈 (2a)
向化合物1
(2.61 g,4.73 mmol)於二噁烷(40 mL)中之溶液中添加B2
Pin2
(1.44 g,5.68 mmol)、KOAc (928 mg,9.46 mmol)及Pd(dppf)Cl2
(344 mg,0.47 mmol)。在N2
下在80℃下攪拌混合物隔夜,冷卻,過濾,濃縮且藉由FCC (EA:PE = 1:3)純化,以得到呈白色固體狀之化合物2a
。
步驟2:3-(2-(2'-氯-4'-((二甲胺基)甲基)-[1,1'-聯苯]-3-基)-5-氟-1-甲苯磺醯基-1H
-吲哚-3-基)噻吩-2-甲腈(2)
向化合物2a
(150 mg,0.25 mmol)於二噁烷(8 mL)中之溶液中添加1-(4-溴-3-氯苯基)-N,N-
二甲基甲胺(65 mg,0.26 mmol)、Cs2
CO3
(163 mg,0.50 mmol)及Pd(PPh3
)4
(30 mg,25 µmol)。在N2
下在100℃下攪拌混合物隔夜,冷卻,過濾,濃縮且藉由prep-HPLC純化,以得到呈白色固體狀之化合物2
。1
H-NMR (500 MHz, DMSO-d6
) δ: 8.29 (dd, J = 9.5, 4.5 Hz, 1H), 8.02 (d, J = 5.0 Hz, 1H), 7.51-7.32 (m, 8H), 7.26-7.17 (m, 4H), 7.02-6.99 (m, 2H), 3.42 (s, 2H), 2.21 (s, 3H), 2.18 (s, 6H); MS: 639.9 (M+1)+
。
實例3 2-(2- 氯 -3'-(3-(2- 氰基 噻吩 -3- 基 )-5- 氟 -1- 甲苯磺醯基 -1H
- 吲哚 -2- 基 )-[1,1'- 聯苯 ]-4- 基 )-2-( 二甲胺基 ) 乙酸 (3)
向化合物2/3
(80 mg,0.11 mmol)於THF (8 mL)、MeOH (3 mL)及H2
O (3 mL)中之溶液中添加LiOH·H2
O (24 mg, 0.57 mmol)。在rt下攪拌混合物30 min,濃縮,用H2
O (6 mL)稀釋,藉由2 N HCl調節至pH =3且用EA (2 × 50 mL)萃取。合併之有機層經Na2
SO4
乾燥,過濾,濃縮且藉由prep-HPLC純化,以獲得呈白色固體狀之化合物3。1
H-NMR (500 MHz, DMSO-d6
) δ: 8.41 (dd, J = 9.3, 4.3 Hz, 1H), 7.82 (d, J = 5.0 Hz, 1H), 7.74 (d, J = 2.0 Hz, 1H), 7.57 (dd, J = 7.8, 1.7 Hz, 1H), 7.50-7.41 (m, 4H), 7.30-7.25 (m, 3H), 7.18-7.15 (m, 2H), 7.07-7.05 (m, 2H), 6.95 (d, J = 5.0 Hz, 1H), 4.53 (s, 1H), 2.84 (s, 6H), 2.27 (s, 3H); MS: 683.8 (M+1)+
。
實例4 反 -2- (3-(3-(2- 噻吩 -3- 基 )-1- 甲苯磺醯基 -1H
- 吡咯并 [3,2-b] 吡啶 -2- 基 ) 苯基 ) 環丙烷 -1- 羧酸 (4)
在rt下攪拌化合物2/4
(178 mg, 0.32 mmol)及LiOH·H2
O (67 mg, 1.62 mmol)於THF (4.1 mL)、MeOH (4.1 mL)及水(0.81 mL)中之混合物3 h,藉由1 N HCl調節至pH =3,濃縮,用EA (50 mL)稀釋且用水(3 × 5 mL)及鹽水(5 mL)洗滌。在減壓下濃縮有機層,將殘餘物溶解於DMF (2.5 mL),過濾且藉由prep-HPLC純化濾液,以得到呈白色固體狀之化合物4
。1
H-NMR (500 MHz, CD3
OD) δ: 8.90 (dd, J = 8.5, 1.5 Hz, 1H), 8.60 (dd, J = 4.8, 0.8 Hz, 1H), 7.79 (d, J = 5.0 Hz, 1H), 7.62 (dd, J = 8.5, 4.5 Hz, 1H), 7.32-7.25 (m, 6H), 7.15-7.13 (m, 1H), 6.95 (d, J = 5.0 Hz, 1H), 6.76 (s, 1H), 2.39-2.38 (m, 4H), 1.77-1.73 (m, 1H), 1.55-1.51 (m, 1H), 1.25 (br s, 1H); MS: 540.1 (M+1)+
。
實例5 2-((5-(3-(3-(2- 噻吩 -3- 基 )-1- 甲苯磺醯基 -1H
- 吲哚 -2- 基 ) 苯基 ) 吡啶 -3- 基 ) 磺醯基 ) 乙酸 (5)
向化合物2/8
(110 mg,0.17 mmol)於MeOH (2 mL)及THF (1 mL)中之混合物中添加LiOH (2M,0.3 mL)且在rt下攪拌混合物1 h。用1 N HCl中和混合物且用EA (3 ×)萃取。合併之有機層用鹽水洗滌,經Na2
SO4
乾燥,過濾,濃縮並藉由prep-HPLC純化,以得到呈白色固體狀之化合物5
。1
H-NMR (500 MHz, CD3
OD) δ: 9.09 (d, J = 2.0 Hz, 1H), 9.03 (d, J = 2.0 Hz, 1H), 8.44-8.42 (m, 2H), 7.85-7.80 (m, 2H), 7.57-7.39 (m, 6H), 7.33 (d, J = 8.0 Hz, 2H), 7.20 (d, J = 8.0 Hz, 2H), 7.06 (d, J = 4.5 Hz, 1H), 4.54 (s, 2H), 2.29 (s, 3H); MS: 554.1 (M+1)+
。
實例6 3'-(3-(2- 噻吩 -3- 基 )-5- 氟 -1- 甲苯磺醯基 -1H
- 吲哚 -2- 基 )-N- 羥基 -[1,1'- 聯苯 ]-4- 甲醯胺 (6)
向化合物5/3
(120 mg,0.20 mmol)於DMF (5 mL)中之混合物中添加羥胺鹽酸鹽(27 mg,0.40 mmol)、HATU (114 mg,0.30 mmol)及DIPEA (103 mg,0.80 mmol)且在rt下攪拌混合物隔夜,用EA (40 mL)稀釋並用H2
O (30 mL)、1N HCl (20 mL)及鹽水(30 mL)洗滌。有機層經Na2
SO4
乾燥,過濾,濃縮並藉由prep-HPLC純化,以得到呈白色固體狀之化合物6
。1
H-NMR (500 MHz, DMSO-d6
) δ: 10.69 (br s, 1H), 9.15 (br s, 1H), 8.31 (dd, J = 9.3, 4.3 Hz, 1H), 8.02 (d, J = 5.0 Hz, 1H), 7.86 (d, J = 8.5 Hz, 2H), 7.78 (d, J = 8.0 Hz, 1H), 7.62 (d, J = 8.5 Hz, 2H), 7.50-7.47 (m, 2H), 7.41-7.25 (m, 6H), 7.19 (dd, J = 8.5, 2.5 Hz, 1H), 7.07 (d, J = 5.0 Hz, 1H), 2.25 (s, 3H); MS: 605.8 (M-1)-
。
實例7 4-(3-(3-(2- 氰基 噻吩 -3- 基 )-5- 氟 -1- 甲苯磺醯基 -1H
- 吲哚 -2- 基 ) 苯基 )-2,2- 二甲基丁 -3- 炔酸甲酯 (7)
向化合物1
(234 mg,0.52 mmol)於Et3
N (1.5 mL)中之溶液中添加Pd(PPh3
)4
(47 mg)、CuI (80 mg)、PPh3
(11 mg)及2,2-二甲基丁-3-炔酸甲酯(78 mg,0.62 mmol)。在N2
下在60℃下攪拌混合物4 h,冷卻,過濾,濃縮且藉由FCC (PE:EA = 8:1)純化,得到呈黃色固體狀之化合物7
。
實例8 3-(5- 氟 -2-(4'-((4- 甲基哌嗪 -1- 基 ) 甲基 ) -[1,1'- 聯苯 ]-3- 基 )-1- 甲苯磺醯基 -1H
- 吲哚 -3- 基 ) 噻吩 -2- 甲腈 (8)
向化合物1
(250 mg, 0.45 mmol)於二噁烷(20 mL)中之溶液中添加(3-((4-甲基哌嗪-1-基)甲基)苯基)硼酸(116 mg,0.50 mmol)、Cs2
CO3
(293 mg,0.90 mmol)及Pd(PPh3
)4
(52 mg,50 µmol)。在N2
下在100℃下攪拌混合物隔夜,冷卻,過濾,濃縮且藉由prep-HPLC純化,以得到呈白色固體狀之化合物8
。1
H-NMR (500 MHz, CD3
OD) δ: 8.43 (dd, J = 4.5, 9.5 Hz, 1H), 7.82 (d, J = 5.0 Hz, 1H), 7.67 (d, J = 8.0 Hz, 1H), 7.47-7.41 (m, 5H), 7.31-7.15 (m, 7H), 7.06 (dd, J = 2.5, 8.5 Hz, 1H), 6.96 (d, J = 5.0 Hz, 1H), 3.61 (s, 2H), 2.61-2.48 (m, 8H), 2.31 (s, 3H), 2.27 (s, 3H); MS: 661.0 (M+1)+
。
實例9 3'-(3-(2,6- 雙 ( 二氟甲基 ) 苯基 )-1-((4-( 二氟甲基 ) 苯基 ) 磺醯基 )-5- 氟 -1H
- 吲哚 -2- 基 )-2- 氯 -[1,1'- 聯苯 ]-4- 羧酸甲酯 (9)
向化合物1/55
(180 mg, 0.26 mmol)於DCM (10.0 mL)中之溶液中添加DAST (209 mg, 1.30 mmol)且在rt下攪拌混合物隔夜,倒入EA (200 mL)中並用H2
O (2 × 20 mL)及鹽水(20 mL)洗滌。有機層經Na2
SO4
乾燥,濃縮且藉由prep-TLC (EA:PE = 1:3)純化,以得到呈無色油狀物的化合物9
。
實例10 2-(2- 氯 -3'-(3-(2- 氰基 噻吩 -3- 基 )-5- 氟 -1- 甲苯磺醯基 -1H
- 吲哚 -2- 基 )-[1,1'- 聯苯 ]-4- 甲醯胺基 ) 乙烷 -1- 磺酸 (10)
向化合物3/48
(100 mg,0.20 mmol)於DMF (10 mL)中之溶液中添加EDCI (100 mg,0.50 mmol)、DMAP (60 mg,0.50 mmol)及2-胺基乙烷-1-磺酸(22 mg,0.20 mmol)。在rt下攪拌混合物12 h,用水(100 mL)稀釋且用EA (3 × 100 mL)萃取。合併之有機層用鹽水(50 mL)洗滌,濃縮且藉由FCC (PE:EA = 1:4)純化,以得到呈白色固體狀之化合物10
。1
H-NMR (500 MHz, DMSO-d6
) δ: 8.68 (t, J = 5.3 Hz, 1H), 8.29 (dd, J = 4.5, 9.0 Hz, 1H), 8.03 (d, J = 5.0 Hz, 1H), 7.92 (d, J = 2.0 Hz, 1H), 7.81 (dd, J = 1.8, 8.3 Hz, 1H), 7.54-7.17 (m, 10H), 7.03-7.01 (m, 2H), 3.56-3.52 (m, 2H), 2.70-2.67 (m, 2H), 2.21 (s, 3H); MS: 731.9 (M-1)-
。
實例11 2- 氯 -3'-(3-(2- 氰基苯基 ) -5- 氟 -1- 甲苯磺醯基 -1H
- 吲哚 -2- 基 )-[1,1'- 聯苯 ]-4- 羧酸 (11)
向化合物1/32
(165 mg,0.26 mmol)於HCl/二噁烷(4N, 5 mL)中之溶液中添加H2
O (0.5 mL)。在90℃下攪拌混合物隔夜,冷卻,濃縮,用水稀釋且用EA (3 ×)萃取。合併之有機層用鹽水洗滌,經Na2
SO4
乾燥,過濾,濃縮並藉由prep-HPLC純化,以得到呈白色固體狀之化合物11
。1
H-NMR (500 MHz, DMSO-d6
) δ: 13.36 (br s, 1H), 8.28 (dd, J = 4.5, 9.5 Hz, 1H), 7.97-7.94 (m, 2H), 7.86 (d, J = 7.5 Hz, 1H), 7.66 (t, J = 7.5 Hz, 1H), 7.55-7.31 (m, 9H), 7.24 (d, J = 8.5 Hz, 2H), 7.02-7.00 (m, 2H), 2.21 (s, 3H); MS: 619.0 (M-1)-
。
實例12 步驟 1 : 2- 氯 -3'-(3-(2- 氰基 噻吩 -3- 基 )-5- 氟 -1- 甲苯磺醯基 -1H
- 吲哚 -2- 基 )-5- 甲基 - [1,1'- 聯苯 ]-4- 羧酸甲酯 ( 12a )
向化合物2a
(200 mg,0.33 mmol)於二噁烷(2 mL)及水(0.4 mL)中之溶液中添加4-溴-5-氯-2-甲基苯甲酸甲酯(105 mg,0.40 mmol)、Cs2
CO3
(215 mg,0.66 mmol)及Pd(dppf)Cl2
(20 mg)。在N2
下在100℃下攪拌混合物8 h,冷卻至rt,倒入EA (40 mL)中並用H2
O (40 mL)及鹽水(40 mL)洗滌。有機層經Na2
SO4
乾燥,過濾,濃縮且藉由FCC (EA:PE = 1:8)純化,以得到呈白色固體狀之化合物12a
。
步驟2:2-氯-3'-(3-(2-氰基噻吩-3-基)-5-氟-1-甲苯磺醯基-1H-吲哚-2-基)-5-甲基-[1,1'-聯苯]-4-羧酸(12)
向化合物12a
(150 mg, 0.23 mmol)於HCl/二噁烷(4N, 5 mL)中之溶液中添加H2
O (0.5 mL)且在90℃下攪拌混合物隔夜,濃縮,用水稀釋且用EA (3 ×)萃取。合併之有機層用鹽水洗滌,經Na2
SO4
乾燥,過濾,濃縮並藉由prep-HPLC純化,以得到呈白色固體狀之化合物12
。1
H-NMR (500 MHz, DMSO-d6
) δ: 8.29 (dd, J = 9.0, 4.5 Hz, 1H), 8.03 (d, J = 5.0 Hz, 1H), 7.82 (s, 1H), 7.54-7.46 (m, 3H), 7.40-7.32 (m, 3H), 7.24 (d, J = 8.0 Hz, 2H), 7.18 (dd, J = 8.0, 3.0 Hz, 2H), 7.04-7.00 (m, 2H), 2.53 (s, 3H), 2.21 (s, 3H); MS: 638.9 (M-1)-
。
實例13 3-(1-((4- 氯苯基 ) 磺醯基 )-5- 羥基 - 2-( 噻吩 -2- 基 )-1H
- 吲哚 -3- 基 ) 噻吩 -2- 甲腈 (13)
在0℃下,向化合物1/39
(775 mg,1.52 mmol)於DCM (10 mL)中之溶液中添加BBr3
(2 mL,3N之DCM)且攪拌混合物2 h,倒入水(50 mL)中且用EA (3 × 20 mL)萃取。合併之有機層用K2
CO3
水溶液(30 mL)及鹽水(2 × 30 mL)洗滌,經Na2
SO4
乾燥,過濾,濃縮並藉由prep-HPLC純化,以得到呈黃色固體狀之化合物13
。1
H-NMR (500 MHz, DMSO-d6
) δ: 9.63 (s, 1H), 8.05-8.03 (m, 2H), 7.73 (d, J = 5.0 Hz, 1H), 7.59 (d, J = 8.5 Hz, 2H), 7.47 (d, J = 8.5 Hz, 2H), 7.19 (d, J = 3.0 Hz, 1H), 7.12-7.10 (m, 1H), 7.01-6.96 (m, 2H), 6.58 (s, 1H); MS: 496.9 (M+1)+
。
實例14 2-((1-((4- 氯苯基 ) 磺醯基 )-3-(2- 氰基 噻吩 -3- 基 )-2-( 噻吩 -2- 基 )-1H
- 吲哚 -5- 基 ) 氧基 ) 乙酸甲酯 (14)
向化合物13
(120 mg,0.25 mmol)於DMF (5 mL)中之溶液中添加K2
CO3
(69 mg,0.50 mmol)及2-溴乙酸甲酯(46 mg,0.30 mmol)。在rt下攪拌混合物隔夜,用水稀釋且用EA (3 × 20 mL)萃取。合併之有機層用鹽水(20 mL)洗滌,經Na2
SO4
乾燥,過濾,濃縮並藉由FCC純化,以得到呈褐色固體狀之化合物14
。
實例15 2-((1-((4- 氯苯基 ) 磺醯基 )-3-(2- 氰基 噻吩 -3- 基 )-2-( 噻吩 -2- 基 )-1H
- 吲哚 -5- 基 ) 氧基 ) 乙酸 (15)
向化合物14
(74 mg, 0.13 mmol)於MeOH (3 mL)中之溶液中添加LiOH (1 mL, 2N)且在rt下攪拌混合物隔夜,蒸發,藉由2 N HCl調節至pH < 2且用EA (3 × 20 mL)萃取。合併之有機層用鹽水(20 mL)洗滌,經Na2
SO4
乾燥,過濾,濃縮並藉由prep-HPLC純化,以得到呈白色固體狀之化合物15
。1
H-NMR (500 MHz, DMSO-d6
) δ: 13.02 (br s, 1H), 8.16 (d, J = 9.0 Hz, 1H), 8.05 (d, J = 5.0 Hz, 1H), 7.74 (d, J = 5.0 Hz, 1H), 7.60 (d, J = 8.5 Hz, 2H), 7.49 (d, J = 8.5 Hz, 2H), 7.21-7.11 (m, 3H), 7.03 (d, J = 5.0 Hz, 1H), 6.77 (d, J = 2.5 Hz, 1H), 4.67 (s, 2H); MS: 554.6 (M+1)+
。
實例16 3-(1-((4- 氯苯基 ) 磺醯基 )-3-(2- 氰基 噻吩 -3- 基 )-5- 羥基 -2-( 噻吩 -2- 基 )-1H
- 吲哚 -6- 基 ) 丙酸第三丁酯 (16)
向化合物13
(120 mg,0.25 mmol)於DMF (3 mL)中之溶液中添加K2
CO3
(69 mg,0.50 mmol)及2-溴乙酸甲酯(38 mg,0.30 mmol)。在rt下攪拌混合物隔夜,用水稀釋且用EA (3 × 20 mL)萃取。合併之有機層用鹽水(20 mL)洗滌,經Na2
SO4
乾燥,過濾,濃縮並藉由FCC純化,以得到呈褐色固體狀之化合物16
;MS: 624.7 (M+1)+
。
實例17 3-(1-((4- 氯苯基 ) 磺醯基 )-3-(2- 氰基 噻吩 -3- 基 )-5- 羥基 -2-( 噻吩 -2- 基 )-1H
- 吲哚 -6- 基 ) 丙酸 (17)
向化合物16
(32 mg, 50 µmol)於MeOH (2 mL)中之溶液中添加NaOH (0.5 mL, 2N)且在rt下攪拌混合物隔夜,濃縮,藉由2 N HCl調節至pH < 2且用EA (3 × 20 mL)萃取。合併之有機層用鹽水(20 mL)洗滌,經Na2
SO4
乾燥,過濾,濃縮並藉由prep-HPLC純化,以得到呈白色固體狀之化合物17
。1
H-NMR (500 MHz, DMSO-d6
) δ: 12.46 (s, 1H), 10.42 (s, 1H), 7.95 (d, J = 9.0 Hz, 1H), 7.77 (d, J = 5.0 Hz, 1H), 7.70 (d, J = 5.0 Hz, 1H), 7.64 (d, J = 8.5 Hz, 2H), 7.57 (d, J = 9.0 Hz, 2H), 7.18 (d, J = 3.0 Hz, 1H), 7.13-7.11 (m, 1H), 7.06 (d, J = 5.0 Hz, 1H), 6.89 (d, J = 9.0 Hz, 1H), 4.43-4.37 (m, 2H), 2.61 (t, J = 7.8 Hz, 2H); MS: 568.7 (M+1)+
。
實例18 步驟 1 : 3- 胺基 -4-( 噻吩 -2- 基乙炔基 ) 苯甲酸甲酯 ( 18a )
使3-胺基-4-碘-苯甲酸甲酯(1.0 g,3.6 mmol)溶解於脫氣THF (10 mL)中且藉由經由溶液使平緩N2
流鼓泡來使混合物脫氣。在約5 min後,添加DIPEA (5.0 mL,29 mmol)且鼓泡持續幾分鐘,隨後添加2-乙炔基噻吩(0.41 mL,4.3 mmol)。隨後,直接地添加CuI (28 mg,0.15 mmol)繼之以PdCl2
(PPh3
)2
(49 mg,70 µmol)。在rt下攪拌混合物2.5 h,經由矽藻土過濾並用THF洗滌。添加EA (200 mL)且用水(50 mL)及鹽水(50 mL)洗滌混合物。有機層經Na2
SO4
乾燥,過濾,濃縮且藉由FCC純化,以得到化合物18a
。1
H-NMR (400 MHz, CDCl3
): 3.90 (s, 3H), 4.36 (br s, 2H), 7.02-7.04 (m, 1H), 7.30-7.34 (m, 2H), 7.35-7.41 (m, 3H)。
步驟2:4-(噻吩-2-基乙炔基)-3-(2,2,2-三氟乙醯胺基)苯甲酸甲酯(18b
)
使化合物18a
(450 mg,1.68 mmol)溶解於無水THF(1 mL)中且將混合物冷卻至0℃。隨後,逐滴添加2,2,2-三氟乙酸酐(0.47 mL,3.4 mmol)且攪拌混合物15 min,用EA (100 mL)稀釋並用NaHCO3
-水(1:1,50 mL)及鹽水(50 mL)洗滌。有機層經Na2
SO4
乾燥,過濾,濃縮且藉由FCC純化,以得到呈黃色固體狀之化合物18b
。1
H-NMR (400 MHz, CDCl3
): 3.95 (s, 3H), 7.08-7.10 (m, 1H), 7.37-7.38 (m, 1H), 7.43-7.44 (m, 1H), 7.60-7.63 (m, 1H), 7.90-7.92 (m, 1H), 8.75 (br s, 1H), 8.97 (d, 1H)。
步驟3:3-(2-氰基噻吩-3-基)-2-(噻吩-2-基)-1H-吲哚-6-羧酸甲酯(18c
)
向乾燥之微波試管中饋入化合物18b
(187 mg,0.53 mmol)、Cs2
CO3
(259 mg,0.79 mmol)、Pd(PPh3
)4
(31 mg,0.03 mmol)及3-溴噻吩-2-甲腈(149 mg,0.79 mmol)。添加經脫氣CH3
CN (2.5 mL)且用N2
淨化試管。將混合物在100℃下攪拌1 h,冷卻,用EA (80 mL)稀釋並用NaHCO3
:水(1:1,40 mL)、水(20 mL)及鹽水(15 mL)洗滌。有機層經乾燥(Na2
SO4)
,過濾並濃縮,以得到呈黃色固體狀之化合物18c
。1
H-NMR (400 MHz, DMSO-d6
): 3.88 (s, 3H), 7.17-7.19 (m, 1H), 7.33-7.46 (m, 3H), 7.64-7.71 (m, 2H), 8.10 (s, 1H), 8.19-8.21 (m, 1H), 12.32 (s, 1H)。
步驟4:1-((4-氯苯基)磺醯基)-3-(2-氰基噻吩-3-基)-2-(噻吩-2-基)-1H-吲哚-6-羧酸甲酯(18)
使化合物18c
(180 mg,0.49 mmol)溶解於THF (15 mL)中並添加NaH (3.9 mmol分散於礦物油中),繼之以氯化4-氯苯磺醯基(188 mg,0.89 mmol)。在rt下攪拌混合物1 h,藉由謹慎添加水淬滅,用EA (250 mL)稀釋並用水(100 mL)及鹽水(100 mL)洗滌。有機層經Na2
SO4
乾燥,過濾,濃縮且藉由FCC且隨後prep-HPLC (含55-60%乙腈之15 mM NH4
HCO3
緩衝液,pH 10)純化,得到呈白色固體狀之化合物18
。
實例19 1-((4- 氯苯基 ) 磺醯基 )-3-(2- 氰基 噻吩 -3- 基 )-2-( 噻吩 -2- 基 )-1H
- 吲哚 -6- 羧酸 (19)
使化合物18
(77 mg,0.14 mmol)溶解於THF (4 mL)中且冷卻至0℃。在單獨4 mL瓶中,使LiOH (48 mg,2.0 mmol)溶解於水(4 mL)中且冷卻至0℃。將鹼溶液逐滴添加至化合物18
之溶液且劇烈攪拌所得混合物隔夜(反應物經緩慢調適至rt)。將反應物再冷卻至0℃,用2 N HCl (1.4 mL)淬滅且用EA (3 × 20 mL)萃取。合併之有機層經MgSO4
乾燥,過濾,濃縮且藉由prep-HPLC (Xbridge,含30-60%乙腈之0.1% TFA緩衝液)純化,以得到呈白色固體狀之化合物19
。1
H-NMR (400 MHz, DMSO-d6
): 7.07 (d, 1H), 7.12-7.15 (dd, 1H), 7.24-7.25 (dd, 1H), 7.40-7.50 (m, 3H), 7.55-7.63 (m, 2H), 7.76-7.77 (dd, 1H), 7.97-8.00 (dd, 1H), 8.06 (d, 1H), 8.89 (m, 1H), 13.29 (br s, 1H); MS: 542 (M+NH3
+1)+
。
實例20 步驟 1 : 2-( 噻吩 -2- 基乙炔基 ) 苯胺 (20a)
在N2
下,向2-碘苯胺(40.0 g,183 mmol)、CuI (700 mg,3.70 mmol)、Pd(PPh3
)2
Cl2
(1.30 g,1.83 mmol)及TEA (120 mL)於ACN (1 L)中之混合物中添加2-乙炔基噻吩(24.0 g,219 mmol)。在50℃下攪拌混合物隔夜,冷卻,過濾,濃縮且藉由FCC (PE:EA = 50:1)純化,以獲得呈黃色固體狀之化合物20a
。
步驟2:4-氯-N-(2-(
噻吩-2-基乙炔基)苯基)苯磺醯胺(20b
)
在rt下,向化合物20a
(10.0 g,50.3 mmol)、氯化4-氯苯磺醯基(13.1 g,62.3 mmol)及吡啶(4.17 g,52.8 mmol)於DCM (150 mL)中之溶液中添加DMAP (306 mg ,2.5 mmol)。混合物經加熱以回流隔夜,冷卻,用2 N HCl洗滌且用DCM萃取。有機層經Na2
SO4
乾燥,過濾,濃縮且隨後殘基用PE洗滌,得到呈黃色固體狀之化合物20b
。
步驟3:1-((4-氯苯基)磺醯基)-3-(4,4,5,5-四甲基-1,3,2-二氧雜硼戊環-2-基)-2-(噻吩-2-基)-1H-吲哚(20c
)
在N2
下在60℃下,攪拌化合物20b (11.0 g,29.4 mmol)、Cs2
CO3
(19 g,59 mmol)、AsPh3
(1.36 g,4.40 mmol)、Pd2
(dba)3
(1.34 g,1.48 mmol)及B2
Pin2
(15 g,59 mmol)於二噁烷(175 mL) 中之混合物2 h,冷卻,過濾,濃縮且藉由FCC (PE:EA = 20:1至5:1)純化,以獲得呈白色固體狀之化合物20c
。
步驟4:1-((4-氯苯基)磺醯基)-3-(2-氯噻吩-3-基)-2-(噻吩-2-基)-1H-吲哚(20)
在N2
下在100℃下,攪拌化合物20c
(200 mg,0.40 mmol)、3-溴-2-氯噻吩(79 mg,0.40 mmol)、Pd(PPh3
)4
(46 mg,40 µmol)及K3
PO4
(404 mg,1.6 mmol)於二噁烷/H2
O (10:1,22 mL)中之溶液隔夜,冷卻,過濾並用DCM洗滌。隨後濃縮濾液且藉由prep-HPLC純化,以獲得呈白色固體狀之化合物20
。1
H-NMR (CDCl3
, 300 MHz) δ: 8.35 (d, J = 6.6 Hz, 1H), 7.40-7.25 (m, 8H), 7.13 (d, J = 0.6 Hz, 1H), 7.05-7.03 (m, 2H), 6.61 (d, J = 4.2 Hz, 1H); MS: 589.0 (M+1)+
。
實例21 3-(1-((4- 氯苯基 ) 磺醯基 )-2-( 噻吩 -2- 基 )-1H
- 吲哚 -3- 基 ) 噻吩 -2- 羧酸 (21)
在rt下攪拌化合物20/1
(95 mg,0.24 mmol)及TFA (0.5 mL)於DCM (2.5 mL)中之溶液4 h,濃縮且隨後用包括極小量之EA之PE濕磨殘餘物,以得到呈白色固體狀之化合物21
。1
H-NMR (CDCl3
, 400 MHz) δ: 6.79 (d, J = 3.9 Hz, 1H), 7.02-7.04 (m, 1H), 7.11 (dd, J = 1.1, 2.6 Hz, 1H), 7.21 (d, J = 5.7 Hz, 1H), 7.26-7.40 (m, 6H), 7.45-7.49 (m, 1H), 7.55 (d, J = 3.9 Hz, 1H), 8.35 (d, J = 6.3 Hz, 1H); MS: 497.9 (M-1)-
。
實例22 3-(1-((4- 氯苯基 ) 磺醯基 )-2-( 噻吩 -2- 基 )-1H
- 吲哚 -3- 基 ) 噻吩 -2- 甲醯胺 (22)
在rt下向化合物21
(90 mg,0.18 mmol)及HATU (137 mg,0.36 mmol)於DMF (5 mL)中之溶液中添加DIEA (116 mg,0.90 mmol)。攪拌溶液20 min,隨後添加NH4
Cl (19 mg,0.36 mmol)且在rt下攪拌混合物2 h,冷卻,用水稀釋且攪拌10 min過濾混合物,以得到呈黃色固體狀之化合物22
。1
H-NMR (CDCl3
, 300 MHz) δ: 5.16 (br s, 2H), 6.68 (d, J = 5.1 Hz, 1H), 7.03 (dd, J = 3.6, 5.1 Hz, 1H), 7.14 (dd, J = 1.2, 3.6 Hz, 1H), 7.23-7.49 (m, 9H), 8.39 (d, J = 8.4 Hz, 1H); MS: 499.0 (M+1)+
。
實例23 1-((4- 氯苯基 ) 磺醯基 )-3-(2- 氰基 噻吩 -3- 基 )-2-( 噻吩 -2- 基 )-1H
- 吲哚 -5- 羧酸 (23)
在rt下攪拌化合物20/10
(49 mg,90 µmol)及LiOH·H2
O (12 mg,0.27 mmol)於THF/H2
O (3:1,8 mL)中之溶液隔夜,濃縮,藉由1N HCl調節至pH 5-6且藉由prep-HPLC純化,以得到呈黃色固體狀之化合物23
。1
H-NMR (CDCl3
, 300 MHz) δ: 8.48 (d, J = 8.7 Hz, 1H), 8.22-8.18 (m, 2H), 7.53 (d, J = 5.1 Hz, 1H), 7.44-7.26 (m, 6H), 7.10-7.07 (m, 1H), 6.88 (d, J = 4.8 Hz, 1H); MS: 522.8 (M-1)-
。
實例24 步驟 1 : 3-((2- 碘苯基 ) 胺基 ) 丙酸甲酯 (24a)
在90℃下在密封管中攪拌2-碘苯胺(50 g,288 mmol)及丙烯酸甲酯(103 mL,1.14 mol)於AcOH (60 mL)中之混合物48 h,冷卻並過濾。濃縮濾過物,用Na2
CO3
水溶液稀釋並用EA (2 × 100 mL)萃取。合併之有機層用鹽水洗滌,經Na2
SO4
乾燥並濃縮,以得到呈黃色油狀物的化合物24a
。
步驟2:3-((2-碘苯基)(甲基)胺基)丙酸甲酯(24b
)
在80℃下在密封管中攪拌化合物24a
(17.7 g,58.1 mmol)、CH3
I (29 mL,46 mmol)及K2
CO3
(16.3 g,118 mmol)於ACN (120 mL)中之混合物48 h,冷卻並過濾。濃縮濾過物,用H2
O稀釋並用EA (2 × 100 mL)萃取。合併之有機層用鹽水洗滌,經Na2
SO4
乾燥並濃縮,以獲得呈黃色油狀物的化合物24b
。
步驟3:3-(甲基(2-(噻吩-2-基乙炔基)苯基)胺基)丙酸甲酯(24c
)
在80℃下在密封管中攪拌化合物24b
(24.8 g,77.7 mmol)、2-乙炔基-噻吩(15.6 mL,154 mmol)、CuI (296 mg,1.56 mmol)、Pd(PPh3
)2
Cl2
(546 mg,0.778 mmol)及TEA (39.3 g,389 mmol)於ACN (90 mL)中之混合物隔夜,冷卻並過濾。濃縮濾過物且藉由FCC (PE:EA = 20:1)純化,以獲得呈褐色油狀物之化合物24c
。
步驟4:3-(3-(2-氰基噻吩-3-基)-2-(噻吩-2-基)-1H-吲哚-1-基)丙酸甲酯(24d
)
在N2
下在90℃下攪拌化合物24c
(23.2 g,77.6 mmol)、3-溴-噻吩-2-甲腈(16.1 g,85.6 mmol)、n-Bu4
NI (2.90 g,7.76 mmol)及PdCl2
(dppf) (1.70 g,2.33 mmol)於ACN (150 mL)中之混合物隔夜,冷卻,用H2
O淬滅且用EA (2 × 150 mL)萃取。合併之有機層用鹽水洗滌,經Na2
SO4
乾燥,濃縮且藉由FCC (PE:EA = 5:1)純化,以獲得呈褐色油狀物之化合物24d
;MS: 393.0 (M+1)+
。
步驟5:3-(2-(噻吩-2-基)-1H-吲哚-3-基)噻吩-2-甲腈(24e
)
在120℃下攪拌化合物24d
(12.6 g,32.1 mmol)及DBU (10.1 mL,64.2 mmol)於DMF (100 mL)中之混合物隔夜,冷卻,用H2
O稀釋且用EA (2 × 100 mL)萃取。合併之有機層用H2
O (2 ×100 mL)及鹽水洗滌,經Na2
SO4
乾燥,濃縮且藉由FCC (PE:EA = 5:1)純化,以獲得呈黃色固體狀之化合物24e
;MS: 307.0 (M+1)+
。
步驟6:3-(1-(環己磺醯基)-2-(噻吩-2-基)-1H-吲哚-3-基)噻吩-2-甲腈(24)
在N2
下在-78℃下向化合物24e
(200 mg,0.65 mmol)於THF (20 mL)中之溶液中逐滴添加LiHMDS (1.0 M之THF,0.8 mL,0.8 mmol)。在-78℃下攪拌混合物30 min,隨後添加氯化環己烷磺醯基(144 mg,0.80 mmol)。在-78℃下攪拌混合物2 h,用NH4
Cl水溶液稀釋且用DCM (3 ×)萃取。合併之有機層經Na2
SO4
乾燥,過濾,濃縮且藉由prep-HPLC純化,以獲得呈黃色固體狀之化合物24
。1
H-NMR (CDCl3
, 300 MHz) δ: 1.08-1.12 (m, 3H), 1.46-1.60 (m, 3H), 1.73-1.77 (m, 4H), 3.06-3.16 (m, 1H), 6.86 (d, J = 5.4 Hz, 1H), 7.05 (dd, J = 3.6, 4.8 Hz, 1H), 7.27-7.51 (m, 6H), 8.19 (d, J = 8.4 Hz, 1H); MS: 467.7 (M+Na)+
。
實例25 步驟 1 : 2-( 噻唑 -5- 基 ) -1H- 吲哚 -1- 羧酸 第三丁 酯 ( 25a )
在N2
下在100℃下攪拌2-(4,4,5,5-四甲基-1,3,2-二氧雜硼戊環-2-基)-1H-
吲哚-1-羧酸第三丁酯(4.20 g,12.2 mmol)、5-溴-噻唑(2.00 g,12.2 mmol)、Pd(dppf)Cl2
(877 mg,1.20 mmol)及K2
CO3
(5.10 g,36.6 mmol)於二噁烷/H2
O (50 mL/5 mL)中之混合物隔夜,冷卻,用EA (300 mL)稀釋且用鹽水洗滌。有機層經Na2
SO4
乾燥,過濾,濃縮且藉由FCC (PE:EA = 5:1)純化,得到呈無色油狀物的化合物25a
。
步驟2:3-溴-2-(噻唑-5-基)-1H-吲哚-1-羧酸第三丁酯(25b
)
在N2
下在rt下攪拌化合物25a
(2.6 g,8.7 mmol)及NBS (1.85 g,10.4 mmol)於DMF (50 mL)中之混合物隔夜,用水稀釋且用EA (3 × 50 mL)萃取。合併之有機層用鹽水洗滌,經Na2
SO4
乾燥,過濾,濃縮並藉由FCC (PE:EA = 10:1)純化,以得到呈黃色固體狀之化合物25b
。
步驟3:3-(2-氰基噻吩-3-基)-2-(噻唑-5-基)-1H-吲哚-1-羧酸第三丁酯(25c
)
在N2
下在100℃下攪拌化合物25b
(620 mg,1.60 mmol)、3-(4,4,5,5-四甲基-[1,3,2]二氧硼㖦-2-基)-噻吩-2-甲腈(376 mg,1.60 mmol)、Pd(dppf)Cl2
(117 mg,160 µmol)及K2
CO3
(662 mg,4.80 mmol)於二噁烷/H2
O (20 mL/2 mL)中之混合物隔夜,冷卻,用EA (200 mL)稀釋並用鹽水洗滌。有機層經Na2
SO4
乾燥,過濾,濃縮且藉由FCC (PE:EA = 5:1)純化,以獲得呈黃色油狀物的化合物25c
。
步驟4:3-(2-(噻唑-5-基)-1H-吲哚-3-基)噻吩-2-甲腈(25d
)
在rt下攪拌化合物25c
(320 mg,0.79 mmol)及TFA (4 mL)於DCM (10 mL)中之混合物隔夜,濃縮,用飽和NaHCO3
水溶液中和且用EA (3 × 30 mL)萃取。合併之有機層用鹽水洗滌,經Na2
SO4
乾燥,過濾並濃縮,得到化合物25d
,其不經進一步純化即用於下一步驟。
步驟5:3-(1-((4-氯苯基)磺醯基)-2-(噻唑-5-基)-1H-吲哚-3-基)噻吩-2-甲腈(25)
在N2
下在0℃下向化合物25d
(200 mg,0.65 mmol)於THF (10 mL)中之溶液中添加NaH (39 mg,0.98 mmol)。在0℃下攪拌混合物30 min,隨後添加氯化4-氯-苯磺醯(165 mg,0.78 mmol)。在0℃下攪拌混合物30 min,倒入飽和NH4
Cl水溶液(50 mL)中且用EA (3 × 50 mL)萃取。合併之有機層用鹽水洗滌,經Na2
SO4
乾燥,過濾,濃縮且藉由prep-HPLC (CH3
CN/H2
O = 20%至95%,5 mmol NH4
HCO3
)純化,以獲得呈黃色固體狀之化合物25
。1
H-NMR (DMSO-d6
, 400 MHz) δ: 9.28 (d, J = 0.8 Hz, 1H), 8.27 (d, J = 8.4 Hz, 1H), 8.08 (d, J = 5.2 Hz, 1H), 7.91 (d, J = 0.8 Hz, 1H), 7.66-7.56 (m, 5H), 7.43-7.39 (m, 2H), 7.11 (d, J = 5.2 Hz, 1H); MS: 481.8 (M+1)+
。
實例26 步驟 1 : 3-(2- 氰基 噻吩 -3- 基 )-1H- 吲哚 -1- 羧酸 第三丁 酯 ( 26a )
在N2
下向3-(4,4,5,5-四甲基-1,3,2-二氧雜硼戊環-2-基)-1H-
吲哚-1-羧酸第三丁酯(2.0 g,5.8 mmol)、3-溴-噻吩-2-甲腈(1.1 g,5.8 mmol)及K2
CO3
(2.40 g,17.4 mmol)於二噁烷/H2
O (20 mL/2 mL)中之溶液中添加Pd(dppf)Cl2
(413 mg,0.58 mmol)。在90℃下攪拌混合物4 h,蒸發且藉由FCC (PE:EA = 20:1至10:1)純化,以獲得呈黃色油狀物的化合物26a
。
步驟2:2-溴-3-(2-氰基噻吩-3-基)-1H-
吲哚-1-羧酸第三丁酯(26b
)
向化合物26a
(1.30 g,4.01 mmol)於CCl4
(20 mL)中之溶液中添加NBS (1.40 g,8.02 mmol)及AIBN (65.4 mg,401 µmol)。在100℃下攪拌混合物48 h,蒸發且藉由FCC (PE:EA = 10:1)純化,以獲得呈黃色油狀物的化合物26b
。
步驟3:3-(2-氰基噻吩-3-基)-2-苯基-1H-
吲哚-1-羧酸第三丁酯(26c
)
在N2
下向化合物26b
(500 mg,1.24 mmol)、PhB(OH)2
(302 mg,2.48 mmol)及K2
CO3
(513 mg,3.72 mmol)於二噁烷(15 mL)中之溶液中添加Pd(dppf)Cl2
(88.4 mg,124 µmol)。在90℃下攪拌混合物隔夜,濃縮且藉由FCC (PE:EA = 10:1)純化,以獲得呈黃色油狀物的化合物26c
。
步驟4:3-(2-苯基-1H
-吲哚-3-基)噻吩-2-甲腈(26d
)
向化合物26c
(616 mg,1.54 mmol)於DCM (4 mL)中之溶液中添加TFA (2 mL)。在rt下攪拌混合物2 h,濃縮且純化,以獲得呈白色固體狀之化合物26d
。
步驟5:3-(1-((4-氯苯基)磺醯基)-2-苯基-1H- 吲哚 -3- 基 )
噻吩-2-甲腈(26)
在N2
下在0℃下向化合物26d
(147 mg,488 µmol)於DMF (5 mL)中之溶液中添加NaH (78 mg,2.0 mmol)。在0℃下攪拌混合物30 min,隨後添加氯化4-氯-苯磺醯(310 mg,1.46 mmol)。在0℃下攪拌混合物30 min,用飽和NH4
Cl水溶液淬滅且用DCM (3 × 20 mL)萃取。合併之有機層用鹽水洗滌,經Na2
SO4
乾燥,過濾,濃縮並藉由FCC (PE:EA = 20:1)純化,以得到呈白色固體狀之化合物26
。1
H-NMR (DMSO-d6
, 400 MHz) δ: 8.25 (d, J = 8.0 Hz, 1H), 7.99 (d, J = 5.2 Hz, 1H), 7.59 (dd, J = 2.0, 6.8 Hz, 2H), 7.53-7.27 (m, 10H), 6.96 (d, J = 4.8 Hz, 1H); MS: 491.7 (M+18)+
。
實例27 2-(4-((3-(2- 氰基 噻吩 -3- 基 )-2- 苯基 -1H- 吲哚 -1- 基 ) 磺醯基 ) 苯氧基 ) 乙酸 (27)
向化合物1/43
(70 mg,130 µmol)於MeOH (5 mL)中之溶液中添加NaOH (2N,0.5 mL)且攪拌混合物隔夜。隨後移除MeOH且藉由2 N HCl將溶液調節至pH < 2,用EA (10 mL)萃取且用鹽水(10 mL)洗滌。有機層經Na2
SO4
乾燥,過濾,濃縮且藉由prep-HPLC純化,以獲得呈白色固體狀之化合物27
。1
H-NMR (500 MHz, DMSO-d6
) δ: 13.21 (br s, 1H), 8.26 (d, J = 8.5 Hz, 1H), 7.99 (d, J = 5.0 Hz, 1H), 7.52-7.34 (m, 8H), 7.27 (d, J = 7.0 Hz, 2H), 7.01-6.99 (m, 3H), 4.75 (s, 2H); MS: 515.1 (M+1)+
。
實例28 3-(4-(3-(2- 氰基 噻吩 -3- 基 )-1-((4- 甲氧基苯基 ) 磺醯基 )-1H
- 吲哚 -2- 基 ) 苯基 ) 丙醯胺 (28)
向化合物15/6
(200 mg,0.40 mmol)於DMF (10mL)中之溶液中添加EDCI (100 mg,0.50 mmol)、DMAP (60 mg,0.50 mmol)及NH4
Cl (70 mg,0.50 mmol)且在rt下攪拌混合物12 h,用水(100 mL)稀釋且用EA (3 × 100 mL)萃取。合併之有機層用鹽水(50 mL)洗滌,經Na2
SO4
乾燥,過濾,濃縮並藉由prep-HPLC純化,以得到呈白色固體狀之化合物28
。1
H-NMR (500 MHz, DMSO-d6
) δ: 8.26 (d, J = 8.0 Hz, 1H), 7.98 (d, J = 5.5 Hz, 1H), 7.50-7.47 (m, 1H), 7.40-7.33 (m, 5H), 7.20 (d, J = 8.0 Hz, 2H), 7.15 (d, J = 8.0 Hz, 2H), 7.00 (d, J = 9.0 Hz, 2H), 6.93 (d, J = 5.0 Hz, 1H), 6.84 (s, 1H), 3.78 (s, 3H), 2.85 (t, J = 8.0 Hz, 2H), 2.41 (t, J = 8.0 Hz, 2H); MS: 542.1 (M+1)+
。
實例29 步驟 1 : 2- 氯 -3'-((2-((4-( 二氟甲基 ) 苯基 ) 磺醯胺基 )-5- 氟苯基 ) 乙炔基 )-[1,1'- 聯苯 ]-4- 羧酸甲酯 ( 29a )
使用合適構建嵌段如實例1、步驟1及2中所描述類似地合成化合物29a
。
步驟2:2-氯-3'-(1-((4-(二氟甲基)苯基)磺醯基)-5-氟-1H
-吲哚-2-基)-[1,1'-聯苯]-4-羧酸甲酯(29b
)
在N2
下向化合物29a
(400 mg,0.70 mmol)於MeCN (12.0 mL)中之溶液中添加K2
CO3
(193 mg,1.40 mmol)及Pd(PPh3
)4
(81 mg,70 µmol)。在100℃下攪拌混合物2 h,冷卻至rt,倒入EA (200毫升)中並用H2
O (2 × 20 mL)及鹽水(20 mL)洗滌。有機層經Na2
SO4
乾燥,濃縮且藉由FCC (EA:PE = 1:4)純化,以得到呈無色油狀物的化合物29b
。
步驟3:3'-(3-溴-1-((4-(二氟甲基)苯基)磺醯基)-5-氟-1H
-吲哚-2-基)-2-氯-[1,1'-聯苯]-4-羧酸甲酯(29c
)
向化合物29b
(150 mg,0.26 mmol)於THF (15 mL)中之溶液中添加NBS (56 mg,0.31 mmol)。在rt下攪拌混合物隔夜,倒入EA (200 mL)中並用H2
O (2 × 20 mL)及鹽水(20 mL)洗滌。有機層經Na2
SO4
乾燥,濃縮且藉由prep-TLC (EA:PE = 1:4)純化,以得到呈白色固體狀之化合物29c
。
步驟4:2-氯-3'-(1-((4-(二氟甲基)苯基)磺醯基)-3-(2,6-二甲基苯基)-5-氟-1H
-吲哚-2-基)-[1,1'-聯苯]-4-羧酸甲酯(29)
在N2
下向化合物29c
(150 mg,0.23 mmol)於二噁烷(8 mL)中之溶液中添加2,6-二甲基苯基硼酸(45 mg,0.30 mmol)、Cs2
CO3
(176 mg,0.46 mmol)及Pd(dppf)Cl2
(17 mg,23 µmol)。在90℃下攪拌混合物隔夜,冷卻至rt,倒入EA (200 mL)中並用H2
O (2 × 20 mL)及鹽水(20 mL)洗滌。有機層經Na2
SO4
乾燥,濃縮且藉由prep-TLC (EA:PE = 1:4)純化,以得到呈無色油狀物的化合物29
。
實例30 rac -(1R
,2R
)-2-(3-(3-(2- 氰基 噻吩 -3- 基 )-1- 甲苯磺醯基 -1H
- 吲哚 -2- 基 ) 苯基 ) 環丙烷 -1- 羧酸 (30)
向化合物1 /56
(130 mg,0.23 mmol)於MeOH (10 mL)中之溶液中添加LiOH·H2
O (49 mg,1.18 mmol)且在rt下攪拌混合物1 h。隨後,混合物經濃縮,藉由2N HCl水溶液調節至pH < 4且用EA (3 × 30 mL)萃取。合併之有機層用鹽水(10 mL)洗滌,經Na2
SO4
乾燥,濃縮並藉由prep-HPLC純化,以得到呈白色固體狀之化合物30
。1
H-NMR (500 MHz, DMSO-d6
) δ: 12.36 (s, 1H), 8.27 (d, J = 10.0 Hz, 2H), 8.01 (d, J = 5.5 Hz, 1H), 7.52-7.48 (m, 1H), 7.41-7.26 (m, 8H), 7.10-7.08 (m, 1H), 7.02-6.98 (m, 1H), 6.88 (s,1H), 2.38-2.33 (m, 1H), 2.31 (s, 3H), 1.73-1.68 (m, 1H), 1.44-1.39 (m, 1H), 1.25-1.18 (m, 1H). MS: 521 (M-18+H)+
。
實例31 3-((6-(1-((4- 氯苯基 ) 磺醯基 )-3-(2- 氰基 噻吩 -3- 基 )-1H- 吲哚 -2- 基 ) 吡啶 -2- 基 ) 氧基 ) 丙酸 (31)
在rt下攪拌含化合物1 /62
(110 mg,0.19 mmol)之4N HCl於二噁烷(30 mL)中之溶液隔夜。移除溶劑,添加EA (20 mL)且用水(10 mL)及鹽水(10 mL)洗滌混合物。有機層經Na2
SO4
乾燥,濃縮並藉由prep-HPLC純化,以得到呈白色固體狀之化合物31
。1
H-NMR (400 MHz, DMSO-d6
) δ: 12.38 (s, 1H), 8.13 (d, J = 8.5 Hz, 1H), 8.02 (d, J = 5.0 Hz, 1H), 7.94-7.91 (m, 2H), 7.77-7.65 (m, 3H), 7.54-7.42 (m, 1H), 7.41-7.37 (m, 2H), 7.13 (d, J = 6.8 Hz, 1H), 7.00 (d, J = 4.8 Hz, 1H), 6.86 (d, J = 8.0 Hz, 1H), 4.32 (t, J = 6.4 Hz, 2H), 2.67 (t, J = 6.4 Hz, 2H); MS: 563.8 (M+1)+
。
實例32 3'-(3-(2- 氰基 噻吩 -3- 基 )-1- 甲苯磺醯基 -1H
- 吲哚 -2- 基 )-N-( 甲磺醯基 )-[1,1'- 聯苯 ]-3- 甲醯胺 (32)
在rt下攪拌化合物30/1
(100 mg,0.17 mmol)、甲磺醯胺(17 mg,0.17 mmol)、DMAP (21 mg,0.17 mmol)及EDCI (50 mg,0.26 mmol)於DMF (4 mL)中之混濁溶液14 h。產物係來自藉由prep-HPLC純化混合物,以得到呈白色固體狀之化合物32
。1
H-NMR (500 MHz, DMSO-d6
) δ: 12.30 (s, 1H), 8.31-7.92 (m, 4H), 7.83 (t, J = 7.5 Hz, 2H), 7.65-7.62 (m, 2H), 7.55-7.49 (m, 2H), 7.42-7.39 (m, 4H), 7.30-7.26 (m, 3H), 7.07 (d, J
= 2.5 Hz, 1H), 3.42 (s, 3H), 2.25 (s, 3H); MS: 652.1 (M+1)+
。
實例33 3'-(3-(2- 氰基 噻吩 -3- 基 )-5- 氟 -7- 羥基 - 1- 甲苯磺醯基 -1H
- 吲哚 -2- 基 )-[1,1'- 聯苯 ]-4- 羧酸甲酯 (33)
在-78℃下向化合物1/101
(120 mg,0.19 mmol)於DCM (6 mL)中之溶液中緩慢添加BBr3
(10 mL, 1M之DCM)。在此溫度下攪拌混合物40 min且在rt下攪拌1 h,用H2
O (20 mL)淬滅且用EA (2 × 100 mL)萃取。合併之有機層用鹽水(20 mL)洗滌,經Na2
SO4
乾燥並濃縮。藉由prep-TLC (EA:PE = 1:1)純化殘餘物,以獲得呈黃色油狀物的化合物33
。
實例34 步驟 1 : 2-((3'-(3-(2- 氰基 噻吩 -3- 基 )-1- 甲苯磺醯基 -1H
- 吲哚 -2- 基 )-5- 氟 -4-( 羥基甲基 ) -[1,1'- 聯苯 ]-3- 基 ) 磺醯基 ) 乙酸乙酯 ( 34a )
向化合物1
(290 mg,0.54 mmol)於二噁烷(15 mL)中之溶液中添加化合物P3-1
(193 mg,0.54 mmol)、B2
Pin2
(166 mg,0.65 mmol)、Pd(dppf)Cl2
(39 mg,0.05 mmol)及KOAc (107 mg,1.09 mmol)。在100℃下攪拌混合物隔夜。在冷卻至rt之後,過濾混合物,濃縮濾液並減壓且藉由prep-TLC (EA:PE = 1:1)純化殘餘物,以獲得呈黃色油狀物的化合物34a
。
步驟2:2-((3'-(3-(2-氰基噻吩-3-基)-1-甲苯磺醯基-1H
-吲哚-2-基)-5-氟-4-(羥基甲基)-[1,1'-聯苯]-3-基)磺醯基)乙酸(34)
向化合物34a
(90 mg, 0.12 mmol)於EtOH (10 mL)中之溶液中添加LiOH·H2
O (26 mg, 0.62 mmol)且在rt下攪拌混合物1.5 h。隨後移除EtOH,添加水且藉由添加2 N HCl將pH調節至<4。混合物用EA (3 × 40 mL)萃取且合併之有機層用鹽水(10 mL)洗滌,經Na2
SO4
乾燥,濃縮並藉由prep-HPLC純化,以得到呈白色固體狀之化合物34
。1
H-NMR (500 MHz, CD3
OD) δ: 8.42 (d, J = 8.5 Hz, 1H), 7.99 (s, 1H), 7.84 (d, J = 4.5 Hz, 1H), 7.75 (d, J = 8.0 Hz, 1H), 7.64-7.30 (m, 9H), 7.20 (d, J = 8.5 Hz, 2H), 7.03 (d, J = 5.0 Hz, 1H), 5.11 (s, 2H), 4.50 (s, 2H), 2.29 (s, 3H); MS: 718.1 (M+18)+
。
實例35 步驟 1 : 3'-((2- 胺基 -5- 氟苯基 ) 乙炔基 )- 2- 氯 -[1,1'- 聯苯 ]-4- 羧酸甲酯 (35a)
向化合物P5
(5.00 g, 15.4 mmol)於TEA (60 mL)中之溶液中添加Pd(PPh3
)4
(710 mg, 0.61 mmol)、CuI (175 mg, 0.92 mmol)、PPh3
(241 mg, 0.92 mmol)及2-乙炔基-4-氟苯胺(2.70 g, 20.0 mmol)。在N2
下在60℃下攪拌混合物隔夜。在冷卻至rt之後,過濾混合物,濃縮濾液且藉由FCC (PE:EA = 2:1)純化殘餘物,以得到呈淡黃色固體狀之化合物35a
。
步驟2:2-氯-3'-((5-氟-2-(2,2,2-三氟乙醯胺基)苯基)乙炔基)-[1,1'-聯苯]-4-羧酸甲酯(35b
)
向化合物35a (300 mg,0.79 mmol)於DCM (15 mL)中之溶液中添加TFAA (199 mg,0.95 mmol)及TEA (120 mg,1.19 mmol)。在rt下攪拌混合物15 min,隨後添加DCM (20 mL)且用H2
O (2 × 10 mL)及鹽水(20 mL)洗滌混合物。有機層經Na2
SO4
乾燥並濃縮至乾燥,以獲得呈黃色固體狀之粗化合物35b
。
步驟3:2-氯-3'-(3-(2-氰基噻吩-3-基)-5-氟-1H-吲哚-2-基)-[1,1'-聯苯]-4-羧酸甲酯(35c
)
在N2
下向化合物35b
(320 mg,0.67 mmol)於ACN (20 mL)中之溶液中添加3-溴噻吩-2-甲腈(190 mg,1.01 mmol)、K2
CO3
(185 mg,1.34 mmol)及Pd(PPh3
)4
(77 mg,67 µmol)且在100℃下攪拌混合物2 h,冷卻至rt,倒入EA (20 mL)中並用H2
O (2 × 20 mL)及鹽水(20 mL)洗滌。有機層經Na2
SO4
乾燥,濃縮且藉由FCC (EA:PE = 1:3)純化,以得到呈黃色固體狀之化合物35c
。
步驟4:2-氯-3'-(3-(2-氰基噻吩-3-基)-5-氟-1-((6-(三氟甲基)吡啶-3-基)磺醯基)-1H-吲哚-2-基)-[1,1'-聯苯]-4-羧酸甲酯(35)
在0℃下向化合物35c
(200 mg,0.41 mmol)於THF (8 mL)中之溶液中添加NaH (60%於礦物油中,50 mg,1.23 mmol)及氯化6-(三氟甲基)吡啶-3-磺醯基(201 mg,0.82 mmol)。在rt下攪拌混合物1 h且倒入冷飽和NH4
Cl水溶液(50 mL)中。混合物用EA (2 × 50 mL)萃取且用鹽水(20 mL)洗滌。合併之有機層經Na2
SO4
乾燥,濃縮且藉由prep-TLC (EA:PE = 1:3)純化,以獲得呈黃色固體狀之化合物35
。
實例36 5-(3-(3-(2- 氰基 噻吩 -3- 基 )-5- 氟 -1- 甲苯磺醯基 -1H- 吲哚 -2- 基 ) 苯基 )-4- 甲基吡啶羧酸 (36)
在rt下向化合物2/13
(150 mg,0.24 mmol)於THF (10 mL)中之經攪拌之溶液中添加1N LiOH (1 mL)且在rt下攪拌持續2 h。混合物用EA (100 mL)萃取,用鹽水洗滌有機層,經Na2
SO4
乾燥,過濾,濃縮並藉由prep-HPLC純化,以得到呈白色固體狀之化合物36
。1
H-NMR (500 MHz, DMSO-d6
) δ: 8.39 (s, 1H), 8.28 (dd, J = 10.0, 4.5 Hz, 1H), 8.05 (d, J = 5.0 Hz, 1H), 8.01 (s, 1H), 7.57-7.51 (m, 2H), 7.42-7.36 (m, 4H), 7.27 (d, J = 8.5 Hz, 2H), 7.20-7.18 (m, 1H), 7.13 (s, 1H), 7.06 (d, J = 5.0 Hz, 1H), 2.24 (s, 3H), 2.19 (s, 3H); MS: 606.0 (M-1)-
。
實例37 3-(2-(2'- 氯 - 4'-(1H- 四唑 -5- 基 )-[1,1'- 聯苯 ]-3- 基 )-5- 氟 -1- 甲苯磺醯基 -1H- 吲哚 -3- 基 ) 噻吩 -2- 甲腈 (37)
在rt下向化合物P2/15
(150 mg, 0.17 mmol)於丙酮(10 mL)中之經攪拌之溶液中添加1N HCl (1 mL)且攪拌持續2 h。添加水且用EA (100 mL)萃取混合物。有機層用鹽水洗滌,經Na2
SO4
乾燥,過濾,濃縮並藉由prep-HPLC純化,以得到呈白色固體狀之化合物37
。1
H-NMR (500 MHz, DMSO-d6
) δ: 8.31-8.28 (m, 1H), 8.19 (s, 1H), 8.11-8.09 (m, 1H), 8.03 (d, J = 5.0 Hz, 1H), 7.59-7.56 (m, 3H), 7.47-7.20 (m, 7H), 7.11 (s, 1H), 7.04 (d, J = 5.0 Hz, 1H), 2.21 (s, 3H); MS: 649.0 (M-1)-
。
實例38 rel -(2R
,4R
)-1-(3-(3-(2- 氰基 噻吩 -3- 基 )-5- 氟 -1- 甲苯磺醯基 -1H- 吲哚 -2- 基 ) 苯基 )-2- 甲基哌啶 -4- 羧酸甲酯 ( 38 )
在N2
下向化合物1
(500 mg, 0.91 mmol)於甲苯(15 mL)中之溶液中添加rel
-(2R
,4R
)-2-甲基哌啶-4-羧酸甲酯(215 mg,1.36 mmol)、Cs2
CO3
(869 mg,2.27 mmol)、Pd2
(dba)3
(83 mg,90 µmol)及BINAP (113 mg,0.18 mmol)。在100℃下攪拌混合物隔夜,冷卻至rt,倒入EA (200 mL)中並用H2
O (30 mL)及鹽水(30 mL)洗滌。有機層經Na2
SO4
乾燥,濃縮且藉由prep-TLC (EA:PE = 1:1)純化,以得到呈黃色油狀物的化合物38
。
實例39 2- 氯 -3'-(1-((4-( 二氟甲基 ) 苯基 ) 磺醯基 )-5- 氟 -3-(2-(3- 氟氮雜環丁 -3- 基 ) 苯基 )-1H- 吲哚 -2- 基 )-[1,1'- 聯苯 ]-4- 羧酸甲酯 (39)
向化合物1 /114
(30 mg,40 µmol)於DCM (2 mL)中之溶液中添加TFA (0.2 mL)且在rt下攪拌混合物4 h。將混合物倒入水中且藉由飽和NaHCO3
水溶液將pH調節至8。隨後混合物用EA萃取且有機層用鹽水洗滌,經Na2
SO4
乾燥並濃縮至乾燥,以得到呈黃色固體狀之化合物39
。
實例40 2- 氯 -3'-(1-((4-( 二氟甲基 ) 苯基 ) 磺醯基 )-5- 氟 -3-(2-(3- 氟 -1- 甲基 - 氮雜環丁 -3- 基 ) 苯基 )-1H- 吲哚 -2- 基 )-[1,1'- 聯苯 ]-4- 羧酸甲酯 (40)
向化合物39
(27 mg,40 µmol)於MeOH (2 mL)中之溶液中添加甲醛(0.2 mL)且在rt下攪拌混合物1 h。隨後添加NaBH(OAc)3
(82 mg,0.37 mmol)且在rt下攪拌混合物隔夜。添加水(40 mL)且用DCM (3 × 20 mL)萃取混合物。合併之有機層用鹽水(30 mL)洗滌,經Na2
SO4
乾燥,過濾,濃縮並藉由FCC (PE:EA = 1:1)純化,以獲得呈黃色固體狀之化合物40
。
實例41/1及實例41/2 2- 氯 -3'-(3-(2- 氰基 -6- 甲基苯基 )-1-((4-( 二氟甲基 ) 苯基 ) 磺醯基 )-5- 氟 -1H- 吲哚 -2- 基 )-[1,1'- 聯苯 ]-4- 羧酸 之分離滯轉異構體 (41/1 及 41/2)
藉由對掌性HPLC (儀器:Gilson-281;管柱:IE 20*250, 10 µm;移動相:正己烷(0.1% DEA):EtOH (0.1% DEA) = 55:45;運行時間/注射:14 min;注射:0.4 mL;樣本溶液:75 mg於3 mL MeOH中)分離化合物11/36
(300 mg),以得到作為第一溶離異構體(滯留時間:10.28 min)之化合物41/1
及作為第二溶離異構體(滯留時間:14.35 min)之化合物41/2
。NMR對應於實例11/36
; MS: 669.0 (M-1)-
。
實例42 步驟 1 : 4-(N-(4- 氟 -2- 碘苯基 ) 胺磺醯基 ) 苯甲酸甲酯 ( 42a )
向4-氟-2-碘苯胺(2.00 g,8.43 mmol)於吡啶(10 mL)中之溶液中添加4-(氯磺醯基)苯甲酸甲酯(2.20 g, 9.40 mmol)。在rt下攪拌混合物隔夜。添加鹽水(40 mL)且過濾出所形成固體,用EA (30 mL)及水(30 mL)洗滌。將粗產物凍幹,以得到呈白色固體狀之化合物42a
。
步驟2:N-(4- 氟
-2-碘苯基)-4-(2-羥基丙-2-基)苯磺醯胺(42b
)
在-78℃下在20 min期間向化合物42a
(3.50 g, 8.04 mmol)於THF(30 mL)中之溶液中緩慢添加MeMgBr (2.0M之THF, 20 mL, 40.0 mmol)溶液。在-78℃下攪拌混合物6 h,隨後使混合物升溫至rt。添加飽和NH4
Cl水溶液(50 mL)且用EA (3 × 50 mL)萃取所得混合物。合併之有機層經Na2
SO4
乾燥並真空濃縮,以獲得呈白色固體狀之化合物42b
。
步驟3:2-氯-3'-((5-氟-2-((4-(2-羥基丙-2-基)苯基)磺醯胺基)苯基)-乙炔基)-[1,1'-聯苯]-4-羧酸甲酯(42c
)
向化合物42b
(1.30 g,2.98 mmol)及化合物P30
(740 mg,2.74 mmol)於無水THF (20 mL)中之溶液中添加CuI (23 mg,0.12 mmol)、Pd(PPh3
)2
Cl2
(130 mg)及TEA (830 mg,8.22 mmol)。在氬氣下在0℃下攪拌混合物30 min且隨後在rt下攪拌隔夜,用水(30 mL)稀釋且用EA (3 × 40 mL)萃取。合併之有機層用鹽水(2 × 50 mL)洗滌,經Na2
SO4
乾燥,過濾,濃縮且藉由FCC (PE: EA = 5: 1)純化,以得到呈淡黃色固體狀之化合物42c
。
步驟4:2-氯-3'-(5-氟-1-((4-(2-羥基丙-2-基)苯基)磺醯基)-3-碘-1H-
吲哚-2-基)-[1,1'-聯苯]-4-羧酸甲酯(42d
)
在氬氣下在-10℃下,向化合物42c
(500 mg,0.86 mmol)及K2
CO3
(368 mg,2.67 mmol)於ACN (30 mL)中之溶液中添加NIS (608 mg,2.67 mmol)。歷經30 min使混合物升溫至rt且攪拌隔夜。混合物用飽和Na2
S2
O3
水溶液(3 × 20 mL)洗滌且用DCM (2 × 20 mL)萃取。合併之有機層經Na2
SO4
乾燥,過濾,濃縮並藉由prep-HPLC純化,以得到呈白色固體狀之化合物42d
。
步驟5:2-氯-3'-(3-(2-氰基苯基)-5-氟-1-((4-(2-羥基丙-2-基)苯基)磺醯基)-1H-吲哚-2-基[1,1'-聯苯]-4-羧酸甲酯(42)
在氬氣下向化合物42d
(350 mg,0.49 mmol)、(2-氰基苯基)硼酸(217 mg,1.47 mmol)及K2
CO3
(210 mg,1.47 mmol)於二噁烷及H2
O (15 mL,10:1)之混合物中之溶液中添加Pd(dppf)Cl2
(45 mg)。在60℃下攪拌混合物4 h,冷卻,用水(20 mL)淬滅且用EA (3 × 20 mL)萃取。合併之有機層用鹽水(20 mL)洗滌,經Na2
SO4
乾燥,過濾,濃縮並藉由prep-TLC (PE:EA = 8: 5)純化,以得到呈黃色固體狀之化合物42
。
實例43/1及實例43/2 分離異構體 (1s,4s)-4-(3-(3-(2,6- 二氰基苯基 )-1-((4-( 二氟甲基 ) 苯基 ) 磺醯基 )-5- 氟 -1H- 吲哚 -2- 基 ) 苯基 ) 環己烷 -1- 羧酸甲酯 (43/1) 及 (1r,4r)-4-(3-(3-(2,6- 二氰基苯基 )-1-((4-( 二氟甲基 ) 苯基 ) 磺醯基 )-5- 氟 -1H- 吲哚 -2- 基 ) 苯基 ) 環己烷 -1- 羧酸甲酯 (43/2)
向化合物8/4
(665 mg, 1.00 mmol)於MeOH (10 mL)中之溶液中添加Pd/C (100 mg)。在H2
下在rt下攪拌混合物16 h。過濾出催化劑並用MeOH (15 mL)洗滌。濃縮合併的濾液。藉由prep-TLC (EA:PE = 1:3)純化殘餘物,以分別地得到呈白色固體狀之兩種分離化合物43/1
及43/2
。
實例44 步驟 1 : 3'-((2- 胺基 -4- 氟 -5- 甲氧苯基 ) 乙炔基 )-2- 氯 -[1,1'- 聯苯 ]-4- 羧酸甲酯 (44a)
向化合物P30
(1.39 g,5.10 mmol)於TEA (20 mL)中之溶液中添加Pd(PPh3
)4
(237 mg,205 µmol)、CuI (78 mg,0.41 mmol)、PPh3
(108 mg,0.41 mmol)及2-溴-5-氟-4-甲氧基苯胺(1.34 g,6.12 mmol)。在N2
下在60℃下攪拌混合物隔夜。反應物經冷卻,過濾,濃縮且藉由FCC (PE:EA = 1:1)純化,以得到呈淡黃色固體狀之化合物44a
。
步驟2:2-氯-3'-((2-((4-(二氟甲基)苯基)磺醯胺基)-4-氟-5-甲氧苯基)乙炔基)-[1,1'-聯苯]-4-羧酸甲酯(44b
)
向化合物44a
(818mg,2.00mmol)於DCM (10 mL)中之溶液中添加4-(二氟甲基)苯-1-磺醯基氯化物(542 mg,2.40 mmol)、吡啶(316 mg,4.00 mmol)及DMAP (89 mg)。在rt下攪拌混合物隔夜,隨後添加DCM (20 mL)且混合物用2N HCl水溶液(2 × 20 mL)及鹽水(40 mL)洗滌。有機層經Na2
SO4
乾燥,濃縮且藉由FCC (PE:DCM = 1:1)純化,以得到呈白色固體狀之化合物44b
。
步驟3:2-氯-3'-(3-(2,6-二氰基苯基)-1-((4-(二氟甲基)苯基)磺醯基)-6-氟-5-甲氧基-1H-
吲哚-2-基)-[1,1'-聯苯]-4-羧酸甲酯(44c
)
在N2
下向化合物44b
(599 mg, 1.00 mmol)於二噁烷(5 mL)中之溶液中添加2-溴間苯二甲腈(310 mg,1.50 mmol)、K2
CO3
(276 mg,2.00 mmol)及Pd(PPh3
)4
(47 mg,40 µmol)。在N2
下在90℃下攪拌混合物4 h。完成後,將混合物冷卻至rt,倒入中EA (20 mL)並用H2
O (2 × 20 mL)及鹽水(20 mL)洗滌。有機層經Na2
SO4
乾燥,濃縮且藉由FCC (EA:PE = 1:1)純化,以得到呈黃色固體狀之化合物44c
。
步驟4:2-氯-3'-(3-(2,6-二氰基苯基)-1-((4-(二氟甲基)苯基)磺醯基)-6-氟-5-羥基-1H-
吲哚-2-基)-[1,1'-聯苯]-4-羧酸(44
)
向化合物44c
(390 mg, 0.53 mmol)於CCl4
(10 mL)中之溶液中添加碘基三甲基矽烷(5 mL)及NaI (159 mg, 1.06 mmol)且在85℃下攪拌混合物隔夜。移除溶劑且將殘餘物分配於飽和NaS2
O3
水溶液與EA之間。同樣用EA (3 × 20 mL)萃取水相。合併之有機層用鹽水洗滌,經Na2
SO4
乾燥,過濾,濃縮並藉由prep-HPLC純化,以得到呈白色固體狀之化合物44
。1
H-NMR (400 MHz, CD3
OD) δ: 8.12 (d, J = 11.7 Hz, 1H), 8.10-7.93 (m, 4H), 7.70 (t, J = 7.9 Hz, 1H), 7.58-7.29 (m, 8H), 7.00 (s, 1H), 6.83-6.48 (m, 2H). MS: 696.0 (M-1)-
。
實例45 2- 氯 -3'-(3-(2,6- 二氰基苯基 )-1-((4-( 二氟甲基 ) 苯基 ) 磺醯基 )-5- 羥基 - 1H- 吡咯并 [2,3-c] 吡啶 -2- 基 )- [1,1'- 聯苯 ]-4- 羧酸 ( 45 )
若吾人欲在回流下藉由氯三甲基矽烷及碘化鈉處理化合物29/3
於ACN (10 mL)中之溶液,則吾人將獲得化合物45
。
化合物儲備溶液
經測試化合物通常經溶解,測試且儲存為含20 mM儲備溶液之DMSO。由於磺醯基乙酸衍生物在此等條件下傾向於去羰基化,因此此等儲備溶液經製備,測試且儲存為含有100 mM三氟乙酸(5當量)之20 mM DMSO儲備溶液。磺醯基乙酸衍生物於rt下長期呈固體安定存放,如由Griesbrecht等人(Synlett 2010:374)或Faucher等人(J. Med. Chem. 2004;47:18)報導。
TR-FRETβ 活性分析
重組GST-LXRβ配體結合域(LBD;胺基酸156-461;NP009052;SEQ ID NO : 4)表現於大腸桿菌(E . coli
)中且經由谷胱甘肽(gluthatione)-瓊脂糖親和性層析法純化。化學合成(Eurogentec)N 端
生物素標記之NCoA3輔助活化劑肽(SEQ ID NO:7)。在作為LXR-預刺激促效劑之含有KCl、牛血清白蛋白、Triton-X-100及1 µM 24(S)-25-環氧基膽固醇之Tris/HCl緩衝液(pH 6.8)中在384孔格式(最終分析體積25 微升/孔)中進行分析。提供分析緩衝液且滴定測試物品(潛在LXR反向促效劑)以得到以下最終分析濃度:50 µM、16.7 µM、5.6 µM、1.9 µM、0.6 µM、0.2 µM、0.07 µM、0.02 µM、0.007 µM、0.002 µM以及一個媒劑對照。最後,添加含有分別作為螢光供體及受體之抗GST-Tb穴狀合物(CisBio;610SAXLB)及抗生蛋白鏈菌素-XL665(CisBio;610SAXLB)以及輔助活化劑肽及LXRβ-LBD蛋白質(SEQ ID NO: 4)之偵測混合物。反應物經充分混合,在4℃下平衡1 h且藉由在VictorX4多孔板讀數器(PerkinElmer Life Science)中使用340 nm作為激勵且615及665 nm作為發射光波長來量測螢光以偵測LXRβ及輔助活化劑肽之附近。一式三份地執行分析。
組分之最終分析濃度:
240 mM KCl、1 µg/µL BSA、0.002% Triton-X-100、125 pg/µL抗GST-Tb穴狀合物、2.5 ng/µL抗生蛋白鏈菌素-XL665、輔助活化劑肽(400 nM)、LXRβ蛋白質(530 µg/mL,亦即76 nM)。
LXR Gal4 報導子瞬時轉染分析
經由在哺乳動物兩雜交實驗(M2H)中偵測與輔助活化劑及輔助抑制蛋白之相互作用來測定LXRα及LXRβ活性狀態。為此,經由瞬時轉染,LXRα (胺基酸1-447;NP005684;SEQ ID NO:1)或LXRβ-(胺基酸1-461;NP009052;SEQ ID NO:2)之全長(FL)蛋白質或LXRα (胺基酸155-447 SEQ ID NO:3)或LXRβ (胺基酸156-461;SEQ ID NO:4)之配體結合結構域(LBD)由pCMV-AD (Stratagene)表現為NFkB之轉錄活化結構域之融合體。作為輔因子,甾類受體輔助活化劑1 (SRC1;胺基酸552-887;SEQ ID NO:5)或輔助抑制劑NCoR (胺基酸1906-2312;NP006302;SEQ ID NO:6)之結構域表現為酵母轉錄因子GAL4 (來自pCMV-BD;Stratagene)之DNA結合結構域之融合體。經由在含有重複GAL4反應元素(載體pFRLuc;Stratagene)之啟動子之對照下活化共表現螢火蟲螢光素酶報導基因來監測相互作用。經由共轉染組成性活性pRL-CMV海腎(Renilla reniformis
)螢光素酶報導子(Promega)來控制轉染效率。HEK293細胞係在37℃ 5%CO2
下在具有2 mML- 麩醯胺酸及
補充有8.3%胎牛血清、0.1 mM非必需胺基酸、1 mM丙酮酸鈉之厄爾平衡鹽溶液(Earle's balanced salt solution)之最低必需培養基(MEM)中生長。將3.5 × 104
個細胞/孔接種在補充有8.3%胎牛血清之生長培養基中之96孔細胞培養盤中維持16-20 h至約90%融合度。對於轉染,取消培養基且將LXR及輔因子表現質體以及報導質體添加於包括聚乙烯-亞胺(PEI)作為媒劑之30 微升OPTIMEM/孔中。典型質體轉染量/孔:pCMV-AD-LXR (5 ng)、pCMV-BD輔因子(5 ng)、pFR-Luc (100 ng)、pRL-CMV (0.5 ng)。化合物備料係在DMSO中製備,在MEM中預稀釋至總體積120 µL,且在添加經轉染混合物4 h後添加(最終媒劑濃度並未超出0.2%)。將細胞培育額外16 h,在1 ×惰性裂解緩衝液(Promega)中裂解持續10 min且使用含有D
-螢光素及
腔腸素之緩衝劑在相同細胞萃取物中分別依序量測螢火蟲及海腎螢光素酶活性。在BMG光度計中進行螢光之量測。
物質 公司 目錄號
HEK293細胞 DSMZ ACC305
MEM Sigma-Aldrich M2279
OPTIMEM LifeTechnologies 11058-021
FCS Sigma-Aldrich F7542
Glutamax Invitrogen 35050038
Pen/Strep Sigma Aldrich P4333
丙酮酸鈉 Sigma Aldrich S8636
非必需胺基酸 Sigma Aldrich M7145
Trypsin Sigma-Aldrich T3924
PBS Sigma Aldrich D8537
PEI Sigma Aldrich 40.872-7
惰性裂解緩衝液(5x) Promega E1941D
-螢光素 PJK 260150
腔腸素 PJK 26035
表 1. LXR 活性資料
範圍(EC50
): -:未量測到活性;A:>10 µM,B:1 µM至<10 µM,C:100 nM至<1 µM,D: <100 nM;斜體數字指示功效(相較於GW2033)低於40%。
藥物動力學
在單一給藥及經口投藥後在小鼠中評估化合物之藥物動力學。經由LC-MS量測血液/血漿及肝暴露。
研究設計如下:
動物:C57/bl6/J(Janvier)雄性
膳食:標準嚙齒動物食物
劑量:20 mg/kg
動物處理:在投藥之前使動物取消進食至少12 h
設計:單次劑量經口投藥,n=3個動物/組
處死:投與後之規定時間點(4、12或24 h)
生物分析:肝及血液/血漿樣本之LC-MS
表 2. 研究結果
範圍:
血液/血漿暴露:A
:>1 µM,B
:300 nM至≤1 µM,C
:100 nM至<300 nM,D
:100 nM;
肝暴露:A
:<300 nM,B
:300 nM至≤1 µM,C
:1 µM至≤3 µM,D
:>3 µM;
肝/血漿比率:A
: <3,B
:3至 ≤10,C
:10至≤30,D
:>30;
吾等證實結構上不相關之LXR反向促效劑GSK2033
及SR9238
不為經口生物可用的。吾等發現本發明之化合物為經口生物可用的且藉由此類化合物有效達成目標組織肝且可最小化全身性暴露(並不所需)。
短期 HFD 小鼠模型 :
在小鼠中評估藉由LXR調節劑之數個LXR標靶基因之活體內轉錄調節。
為此,C57BL/6J係在8週大時購自Elevage Janvier (Rennes, France)。在兩週環境適應階段後,動物經預饋入高脂膳食(HFD) (Ssniff Spezialdiäten GmbH, Germany, Surwit EF D12330模型, 目錄號E15771-34),以及來自脂肪之60kcal%加上1%(w/w)額外膽固醇(Sigma-Aldrich, St. Louis, MO)5天。在用LXR調節劑處理動物保持此膳食。測試化合物係在0.5%羥基丙基甲基纖維素(HPMC)中調配且根據以下時間表藉由經口管飼以三個劑量(各自1.5至20 mg/kg)投與:在第一天:動物在上午及晚間(約17:00)接收治療,在第二天,動物在4 h禁食後在上午接受最終治療,且在此後4 h後經處死。根據德國之動物護理之國家指導原則進行動物工作。
在結束之後,收集肝,浸漬在冰冷PBS中30秒且切割成合適塊體。塊體在液氮中速凍且儲存於-80℃下。對於血漿之臨床化學物質分析,使用由製造商提供之具有系統套組之完整自動化桌上型分析儀(Respons®
910, DiaSys Greiner GmbH, Flacht, Germany)測定丙胺酸轉胺酶(ALT,IU/mL)、膽固醇(CHOL,mg/dL)及甘油三酯(TG,mg/dL)。
分析肝臟組織中之基因表現 .
為自冷凍肝臟組織中獲得總RNA,首先藉由RLA緩衝液(4M硫氰酸胍,10 mM Tris,0.97% w:v β-巰基-乙醇)均質化樣品(25 mg肝樣品)。使用SV 96 總RNA分離系統(Promega, Madison, Wisconsin, USA)遵循製造商之說明書製備RNA。使用一體式cDNA超混合液逆轉錄酶(Absource Diagnostics, Munich, Germany)由0.8-1 μg 總RNA合成cDNA。使用Prime time基因表現基本混合物(Integrated DNA Technologies, Coralville, Iowa, USA)及384格式ABI 7900HT序列偵測系統(Applied Biosystems, Foster City, USA)執行且分析定量PCR。分析以下基因之表現:硬脂醯基-CoA去飽和酶1 (Scd1) 、
脂肪酸合成酶(Fas
)及固醇調節元素-結合蛋白1 (Srebp1) 。
表3中列出特異性引子及探針序列(可商購)。在95℃下進行qPCR持續3 min,隨後95℃持續15 s及60℃持續30 s循環40次。利用相同RT反應一式兩份操作所有樣品。基因表現係以任意單位表現且使用比較性Ct方法相對於管家基因TATA框結合蛋白(Tbp
)之mRNA經標準化。
表 4. 研究結果
範圍:
血漿暴露:A
:>1 µM,B
:300 nM至≤1 µM,C
:100 nM至<300 nM,D
:<100 nM;
肝暴露:A
:<300 nM,B
:300 nM至 ≤1 µM,C
:1 µM至≤10 µM,D
:>10 µM;
肝/血漿比率:A
:<5,B
:5至≤30,C
:30至≤100,D
:>100;
基因抑制:A
:>0.9,B
:0.6至≤0.9,C
:0.3至 ≤0.6,D
:<0.3;
在小鼠中歷經兩天三次經口給藥(第一天上午及晚間,第二天上午)本發明化合物引起具有有利肝/血漿比率之較高肝暴露。有效抑制肝臟LXR標靶基因。此等基因涉及轉錄調節肝臟重新脂肪生成(Wang等人,Nat. Rev. Mol. Cell Biol. 2015;16:678)。抑制此等基因將降低肝脂肪(肝甘油三酯)。
比較實例說明當吲哚(或類似物)之3位中之環狀部分在1,2-定向上具有至少一個取代基(鄰取代基)時,其可為有利的。
圖1說明由LXR促效劑、拮抗劑及反向促效劑募集輔助活化劑或輔助抑制劑之不同能力例示之LXR促效劑、拮抗劑及反向促效劑之間的差異。
Claims (12)
- 一種由式(I)表示之化合物、其對映異構體、非對映異構體、互變異構體及醫藥學上可接受之鹽,
- 如請求項1或2之化合物、其對映異構體、非對映異構體、互變異構體及醫藥學上可接受之鹽,其作為藥物。
- 如請求項1或2之化合物、其對映異構體、非對映異構體、互變異構體及醫藥學上可接受之鹽,其用於預防及/或治療適於用LXR調節劑治療之疾病。
- 如請求項6之化合物、其對映異構體、非對映異構體、互變異構體及醫藥學上可接受之鹽,其中該疾病選自:非酒精性脂肪肝病、非酒精性脂肪變性肝炎、肝纖維化、肥胖、胰島素抗性、II型糖尿病、家族性高膽固醇血症、腎病症候群之高膽固醇血症、代謝症候群、心臟脂肪變性、癌症、病毒心肌炎、C型肝炎病毒感染或其併發症及長期糖皮質激素治療在疾病中之非所需副作用。
- 如請求項7之化合物、其對映異構體、非對映異構體、互變異構體及醫藥學上可接受之鹽,其中該長期糖皮質激素治療在疾病中之非所需副作用係在選自下列之疾病中:類風濕性關節炎、發炎性腸病及哮喘。
- 一種醫藥組合物,其包含如請求項1至4中任一項之化合物、其對映異構體、非對映異構體、互變異構體及醫藥學上可接受之鹽及醫藥學上可接受之載劑或賦形劑。
- 一種如請求項1至4中任一項之化合物、其對映異構體、非對映異構體、互變異構體及醫藥學上可接受之鹽或如請求項9之醫藥組合物之用途,其用於製造用於預防及/或治療適於用LXR調節劑治療之疾病的藥物。
- 如請求項10之用途,其中該疾病選自:非酒精性脂肪肝病、非酒精性脂肪變性肝炎、肝纖維化、肥胖、胰島素抗性、II型糖尿病、家族性高膽固醇血症、腎病症候群之高膽固醇血症、代謝症候群、心臟脂肪變性、癌症、病毒心肌炎、C型肝炎病毒感染或其併發症及長期糖皮質激素治療在疾病中之非所需副作用。
- 如請求項11之用途,其中該長期糖皮質激素治療在疾病中之非所需副作用係在選自下列之疾病中:類風濕性關節炎、發炎性腸病及哮喘。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP18180450 | 2018-06-28 | ||
| EP18180450.1 | 2018-06-28 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| TW202019907A TW202019907A (zh) | 2020-06-01 |
| TWI748194B true TWI748194B (zh) | 2021-12-01 |
Family
ID=62947921
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| TW108121075A TWI748194B (zh) | 2018-06-28 | 2019-06-18 | 含有雙環核心部分之新穎lxr調節劑 |
Country Status (26)
| Country | Link |
|---|---|
| US (3) | US11618747B2 (zh) |
| EP (1) | EP3814331B9 (zh) |
| JP (1) | JP7214086B2 (zh) |
| KR (1) | KR102678581B1 (zh) |
| CN (1) | CN112689630A (zh) |
| AR (1) | AR117599A1 (zh) |
| AU (1) | AU2019293727B2 (zh) |
| BR (1) | BR112020026405A2 (zh) |
| CA (1) | CA3104956C (zh) |
| CL (1) | CL2020003300A1 (zh) |
| DK (1) | DK3814331T3 (zh) |
| EA (1) | EA202092821A1 (zh) |
| ES (1) | ES2956045T3 (zh) |
| FI (1) | FI3814331T3 (zh) |
| HU (1) | HUE063538T2 (zh) |
| IL (2) | IL279722B2 (zh) |
| LT (1) | LT3814331T (zh) |
| MX (1) | MX2020014258A (zh) |
| PH (1) | PH12020552269A1 (zh) |
| PL (1) | PL3814331T3 (zh) |
| PT (1) | PT3814331T (zh) |
| SI (1) | SI3814331T1 (zh) |
| SM (1) | SMT202300334T1 (zh) |
| TW (1) | TWI748194B (zh) |
| UY (1) | UY38283A (zh) |
| WO (1) | WO2020002611A1 (zh) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FI3796975T3 (fi) | 2018-05-22 | 2023-11-20 | Orsobio Inc | Sulfonyyliaminobentsamidijohdannaisia |
| TWI748194B (zh) * | 2018-06-28 | 2021-12-01 | 德商菲尼克斯 Fxr有限責任公司 | 含有雙環核心部分之新穎lxr調節劑 |
| MX2022011829A (es) * | 2020-04-03 | 2022-12-15 | Vertex Pharma | Derivados de indol como moduladores de alfa-1-antitripsina para tratar la deficiencia de alfa-1-antitripsina (aatd). |
| WO2024097897A1 (en) * | 2022-11-03 | 2024-05-10 | Orsobio, Inc. | Lxr modulators with bicyclic core moiety for treating dyslipidemias |
Family Cites Families (61)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5308850A (en) | 1991-09-30 | 1994-05-03 | Merck Frosst Canada, Inc. | (Bicyclic-hetero-arylmethoxy)indoles as inhibitors of leukotriene biosynthesis |
| US5290798A (en) | 1991-09-30 | 1994-03-01 | Merck Frosst Canada, Inc. | (hetero-arylmethoxy)indoles as inhibitors of leukotriene biosynthesis |
| JPH06145150A (ja) | 1992-11-09 | 1994-05-24 | Kyowa Hakko Kogyo Co Ltd | イミダゾール誘導体 |
| HUP9903330A2 (hu) | 1996-11-19 | 2000-03-28 | Amgen Inc. | Gyulladásgátló hatású, aril- és heteroaril csoporttal szubsztituált kondenzált pirrolszármazékok, valamint ezeket tartalmazó gyógyászati készítmények |
| WO1998022452A1 (fr) | 1996-11-19 | 1998-05-28 | Kyowa Hakko Kogyo Co., Ltd. | Derives de benzofuranes |
| AU757059B2 (en) | 1997-06-19 | 2003-01-30 | Sepracor, Inc. | Quinoline-indole antimicrobial agents, uses and compositions related thereto |
| EP1031571B1 (en) | 1997-10-24 | 2011-02-23 | Nissan Chemical Industries, Ltd. | Sulfamoyl compounds and agricultural or horticultural bactericide |
| GB9902453D0 (en) | 1999-02-05 | 1999-03-24 | Zeneca Ltd | Chemical compounds |
| GB9902459D0 (en) | 1999-02-05 | 1999-03-24 | Zeneca Ltd | Chemical compounds |
| GB9902455D0 (en) | 1999-02-05 | 1999-03-24 | Zeneca Ltd | Chemical compounds |
| EP1284728A4 (en) | 1999-10-22 | 2004-05-19 | Merck & Co Inc | MEDICINES FOR TREATING ADDICTIC ADDICTION |
| WO2002018335A1 (fr) | 2000-08-28 | 2002-03-07 | Yamanouchi Pharmaceutical Co., Ltd. | Derives d'amine cyclique |
| KR100823908B1 (ko) | 2000-10-20 | 2008-04-21 | 바이오비트럼 에이비(피유비엘) | 2-, 3-, 4-, 또는 5-치환-n1-(벤젠술포닐)인돌 및 이의치료 용도 |
| AU2002220051B2 (en) | 2000-11-02 | 2007-05-24 | Wyeth | 1-aryl- or 1-alkylsulfonyl-heterocyclylbenzazoles as 5-hydroxytryptamine-6 ligands |
| US6503907B2 (en) * | 2000-11-28 | 2003-01-07 | Hoffmann-La Roche Inc. | Indole and dihydroindole derivatives |
| MXPA03005432A (es) | 2000-12-22 | 2003-09-10 | Wyeth Corp | Compuestos de heterociclilindazol y -azaindazol como ligandos de 5-hidroxitriptamina-6. |
| EP1487776A4 (en) | 2002-03-27 | 2005-05-25 | Smithkline Beecham Corp | ACID COMPOUNDS AND ESTERS AND METHODS OF USE THEREOF |
| ATE344798T1 (de) | 2002-06-24 | 2006-11-15 | Schering Corp | Als histamin-h3-antagonisten geeignete indolderivate |
| ES2228267B1 (es) | 2003-07-30 | 2006-07-01 | Laboratorios Del Dr. Esteve, S.A. | Combinacion de sustancias activas conteniendo al menos un compuesto con afinidad por el receptor del neuropeptido y (npy) y al menos un compuesto con afinidad por el receptor 5-ht6. |
| GB0323845D0 (en) * | 2003-10-10 | 2003-11-12 | Angeletti P Ist Richerche Bio | Chemical compounds,compositions and uses |
| CN1917870A (zh) | 2004-02-11 | 2007-02-21 | Irm责任有限公司 | 作为lxr调节剂的化合物和组合物 |
| WO2005085188A2 (en) | 2004-03-02 | 2005-09-15 | Compass Pharmaceuticals Llc | Compounds and methods for anti-tumor therapy |
| PT1756096E (pt) * | 2004-05-03 | 2009-10-16 | Hoffmann La Roche | Derivados de indolilo como moduladores do receptor x do fígado |
| WO2005113499A1 (ja) * | 2004-05-20 | 2005-12-01 | Sankyo Company, Limited | インドール化合物 |
| MX2007000791A (es) * | 2004-08-03 | 2007-03-23 | Wyeth Corp | Indazoles utiles en el tratamiento de enfermedades cardiovasculares. |
| WO2007134169A2 (en) | 2006-05-10 | 2007-11-22 | Nuada, Llc | Indole, benzimidazole, and benzolactam boronic acid compounds, analogs thereof and methods of use thereof |
| US20080319044A1 (en) | 2004-11-01 | 2008-12-25 | Nuada, Llc | Compounds and Methods of Use Thereof |
| WO2006109633A1 (ja) * | 2005-04-07 | 2006-10-19 | Daiichi Sankyo Company, Limited | 置換インドール化合物 |
| FR2886293B1 (fr) * | 2005-05-30 | 2007-08-24 | Fournier S A Sa Lab | Nouveaux composes de l'indoline |
| TW200745031A (en) * | 2005-10-13 | 2007-12-16 | Merck & Co Inc | Acyl indoles, compositions containing such compounds and methods of use |
| CN101378807A (zh) | 2005-12-21 | 2009-03-04 | 先灵公司 | H3拮抗剂/反相激动剂与食欲抑制剂的组合 |
| CA2656905A1 (en) | 2006-07-06 | 2008-01-10 | Solvay Pharmaceuticals B.V. | Azaindole derivatives with a combination of partial nicotinic acetylcholine receptor agonism and dopamine reuptake inhibition |
| TW200825054A (en) | 2006-10-18 | 2008-06-16 | Wyeth Corp | Quinoline compounds |
| RU2009139074A (ru) | 2007-03-23 | 2011-04-27 | Эбботт Гмбх Унд Ко.Кг (De) | Азетидиновые соединения, подходящие для лечения расстройств, чувствительных к модуляции сеотонинового 5-нт6-рецептора |
| ES2375586T3 (es) | 2007-03-30 | 2012-03-02 | F. Hoffmann-La Roche Ag | Derivados de imidazolidinona. |
| GB0708141D0 (en) * | 2007-04-26 | 2007-06-06 | Syngenta Participations Ag | Improvements in or relating to organic compounds |
| BRPI0816116A2 (pt) | 2007-08-29 | 2015-03-03 | Schering Corp | Derivados de indol 2,3-substituídos para o tratamento de infecções virais. |
| ATE541845T1 (de) | 2007-08-29 | 2012-02-15 | Schering Corp | 2,3-substituierte azaindolderivate zur behandlung von virusinfektionen |
| CN102099351A (zh) | 2007-11-16 | 2011-06-15 | 先灵公司 | 3-杂环取代的吲哚衍生物及其使用方法 |
| JP5416708B2 (ja) | 2007-11-16 | 2014-02-12 | メルク・シャープ・アンド・ドーム・コーポレーション | 3−アミノスルホニル置換インドール誘導体およびそれらの使用方法 |
| WO2010010186A1 (en) | 2008-07-25 | 2010-01-28 | Galapagos Nv | Novel compounds useful for the treatment of degenerative and inflammatory diseases |
| EP2210891A1 (en) | 2009-01-26 | 2010-07-28 | Domain Therapeutics | New adenosine receptor ligands and uses thereof |
| EP2245936A1 (en) | 2009-04-27 | 2010-11-03 | Bayer CropScience AG | Use of 4-aza indole derivatives for the reduction of mycotoxin contamination |
| AU2010258931B2 (en) | 2009-06-08 | 2015-04-23 | Acceleron Pharma Inc. | Methods for increasing thermogenic adipocytes |
| EP2731436B1 (en) | 2011-07-15 | 2017-03-08 | VIIV Healthcare UK Limited | 2-(pyrrolo[2,3-b]pyridine-5-yl)-2-(t-butoxy)-acetic acid derivatives as hiv replication inhibitors for the treatment of aids |
| WO2013028999A1 (en) | 2011-08-24 | 2013-02-28 | The Trustees Of Columbia University In The City Of New York | Small molecule inducers of gdnf as potential new therapeutics for neuropsychiatric disorders |
| SG11201403266RA (en) | 2011-12-22 | 2014-07-30 | Connexios Life Sciences Pvt Ltd | Derivatives of aza adamantane and uses thereof |
| KR20130142801A (ko) | 2012-06-20 | 2013-12-30 | 안국약품 주식회사 | 11β-HSD1 효소의 억제활성을 갖는 신규한 화합물 또는 이의 약학적으로 허용가능한 염, 이의 제조방법 및 이를 유효성분으로 함유하는 약학적 조성물 |
| US9376420B2 (en) | 2012-10-25 | 2016-06-28 | Yuhan Corporation | 4,5-dihydro-1H-pyrazole derivative or salts thereof, and pharmaceutical composition comprising same |
| WO2014085453A2 (en) | 2012-11-29 | 2014-06-05 | The Scripps Research Institute | Small molecule lxr inverse agonists |
| EP2968275B1 (en) * | 2013-03-15 | 2017-11-29 | Bristol-Myers Squibb Company | Lxr modulators |
| EP2990403A1 (en) | 2014-08-29 | 2016-03-02 | Novartis Tiergesundheit AG | Anthranilamides, sulfonamides and nitro analogues derived therefrom as anthelmintics |
| CA2968299A1 (en) | 2014-11-18 | 2016-05-26 | Rutgers, The State University Of New Jersey | Novel mitochondrial uncouplers for treatment of metabolic diseases and cancer |
| AR103232A1 (es) | 2014-12-22 | 2017-04-26 | Bristol Myers Squibb Co | ANTAGONISTAS DE TGFbR |
| FR3037959B1 (fr) | 2015-06-23 | 2017-08-04 | Servier Lab | Nouveaux derives bicycliques, leur procede de preparation et les compositions pharmaceutiques qui les contiennent |
| JP7017523B2 (ja) | 2016-05-18 | 2022-02-08 | ラットガーズ、ザ ステート ユニバーシティ オブ ニュージャージー | 代謝性疾患および癌の治療のための新規のミトコンドリア脱共役剤 |
| UY37659A (es) * | 2017-04-10 | 2018-10-31 | Phenex Fxr Gmbh | Moduladores del receptor x del hígado (lxr) |
| TWI683808B (zh) * | 2017-07-18 | 2020-02-01 | 德商菲尼克斯 Fxr有限責任公司 | 含有胺或(硫)醯胺之lxr調節劑 |
| FI3796975T3 (fi) | 2018-05-22 | 2023-11-20 | Orsobio Inc | Sulfonyyliaminobentsamidijohdannaisia |
| TWI748194B (zh) * | 2018-06-28 | 2021-12-01 | 德商菲尼克斯 Fxr有限責任公司 | 含有雙環核心部分之新穎lxr調節劑 |
| US20200397807A1 (en) | 2019-06-18 | 2020-12-24 | MitoPower, LLC | Nicotinyl riboside compounds and their uses |
-
2019
- 2019-06-18 TW TW108121075A patent/TWI748194B/zh active
- 2019-06-26 AR ARP190101782A patent/AR117599A1/es not_active Application Discontinuation
- 2019-06-28 CA CA3104956A patent/CA3104956C/en active Active
- 2019-06-28 IL IL279722A patent/IL279722B2/en unknown
- 2019-06-28 AU AU2019293727A patent/AU2019293727B2/en active Active
- 2019-06-28 DK DK19735528.2T patent/DK3814331T3/da active
- 2019-06-28 HU HUE19735528A patent/HUE063538T2/hu unknown
- 2019-06-28 IL IL310623A patent/IL310623A/en unknown
- 2019-06-28 SI SI201930562T patent/SI3814331T1/sl unknown
- 2019-06-28 EA EA202092821A patent/EA202092821A1/ru unknown
- 2019-06-28 BR BR112020026405-9A patent/BR112020026405A2/pt unknown
- 2019-06-28 SM SM20230334T patent/SMT202300334T1/it unknown
- 2019-06-28 UY UY0001038283A patent/UY38283A/es not_active Application Discontinuation
- 2019-06-28 LT LTEPPCT/EP2019/067351T patent/LT3814331T/lt unknown
- 2019-06-28 KR KR1020217002985A patent/KR102678581B1/ko active IP Right Grant
- 2019-06-28 CN CN201980056685.2A patent/CN112689630A/zh active Pending
- 2019-06-28 JP JP2020572372A patent/JP7214086B2/ja active Active
- 2019-06-28 PT PT197355282T patent/PT3814331T/pt unknown
- 2019-06-28 FI FIEP19735528.2T patent/FI3814331T3/fi active
- 2019-06-28 MX MX2020014258A patent/MX2020014258A/es unknown
- 2019-06-28 WO PCT/EP2019/067351 patent/WO2020002611A1/en unknown
- 2019-06-28 EP EP19735528.2A patent/EP3814331B9/en active Active
- 2019-06-28 PL PL19735528.2T patent/PL3814331T3/pl unknown
- 2019-06-28 ES ES19735528T patent/ES2956045T3/es active Active
- 2019-06-28 US US17/255,821 patent/US11618747B2/en active Active
-
2020
- 2020-12-18 CL CL2020003300A patent/CL2020003300A1/es unknown
- 2020-12-28 PH PH12020552269A patent/PH12020552269A1/en unknown
-
2023
- 2023-02-09 US US18/166,831 patent/US11970484B2/en active Active
-
2024
- 2024-03-05 US US18/596,586 patent/US20240317726A1/en active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TWI748194B (zh) | 含有雙環核心部分之新穎lxr調節劑 | |
| TWI721335B (zh) | 鹵代烯丙基胺類ssao/vap-1抑制劑及其用途 | |
| TWI674260B (zh) | 芳基烴受體(AhR)調節劑化合物 | |
| TWI683808B (zh) | 含有胺或(硫)醯胺之lxr調節劑 | |
| TWI690518B (zh) | 肝x受體(lxr)調節劑 | |
| WO2017152857A1 (zh) | 一种含氮烷基化和芳基化亚砜亚胺的吲哚胺-2,3-双加氧酶抑制剂 | |
| EA045482B1 (ru) | Новые модуляторы lxr с бициклическим центральным фрагментом |