TWI701259B - 4﹘1bb抗體及其製備方法和應用 - Google Patents
4﹘1bb抗體及其製備方法和應用 Download PDFInfo
- Publication number
- TWI701259B TWI701259B TW107139554A TW107139554A TWI701259B TW I701259 B TWI701259 B TW I701259B TW 107139554 A TW107139554 A TW 107139554A TW 107139554 A TW107139554 A TW 107139554A TW I701259 B TWI701259 B TW I701259B
- Authority
- TW
- Taiwan
- Prior art keywords
- antibody
- variable region
- seq
- chain variable
- heavy chain
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2878—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70517—CD8
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70575—NGF/TNF-superfamily, e.g. CD70, CD95L, CD153, CD154
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/75—Agonist effect on antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/20—Fusion polypeptide containing a tag with affinity for a non-protein ligand
- C07K2319/21—Fusion polypeptide containing a tag with affinity for a non-protein ligand containing a His-tag
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/33—Fusion polypeptide fusions for targeting to specific cell types, e.g. tissue specific targeting, targeting of a bacterial subspecies
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Gastroenterology & Hepatology (AREA)
- Cell Biology (AREA)
- Toxicology (AREA)
- Zoology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Abstract
本發明提供了一種4-1BB抗體及其製備方法和應用。具體地,本發明提供了一種4-1BB抗體,所述抗體對4-1BB蛋白具有高親和力,能有效啟動4-1BB下游信號,並且在人混合淋巴細胞或T淋巴細胞中顯著增加IFN-γ和IL-2的表達量,可以用於治療癌症以及自身免疫性疾病。
Description
本發明涉及生物醫藥領域,更具體地涉及4-1BB抗體及其製備方法和應用。
4-1BB又名CD137,或TNFRF9,是TNF受體家族的成員之一。4-1BB是一個閱讀框含有255個氨基酸(NCBI:NP _001552)的I型跨膜蛋白,由含有17個氨基酸的N端信號肽,169個氨基酸的胞外區,27個氨基酸的跨膜區和42個氨基酸的C端胞內區組成。4-1BB分子主要表達在活化的T細胞,NK細胞,調節性T細胞,樹突狀細胞,單核細胞,中性粒細胞和嗜酸性細胞中,腫瘤血管的內皮細胞也有報導表達4-1BB。
在T細胞的活化過程中,4-1BB分子能為其提供共刺激信號。當T細胞受體接觸到抗原後,會增加4-1BB的表達量,4-1BB與配體結合後會引起NFκB信號通路的啟動,從而導致T細胞的活化增殖,並且4-1BB還能抑制活化細胞凋亡。動物模型和體外實驗證實,抗4-1BB激動性單抗具有抗腫瘤活性。它能夠選擇性地引起CD8+ T細胞的增殖,上調促炎性細胞因數IFN-γ的表達,並且能夠增強抗原特異性效應型T細胞的殺傷作用,從而促進腫瘤的清除。抗4-1BB激動性單抗也能引起NK細胞的擴增,並能通過其增加CD8+T細胞的細胞毒活性。抗4-1BB的激動性抗體還能夠引起腫瘤細胞的血管的內皮細胞上調黏附分子的表達,促進活化的T淋巴細胞浸潤腫瘤組織。
除此之外,在動物模型中,抗4-1BB啟動性抗體還能減輕自身免疫性疾病,如自身免疫性腦脊髓炎,狼瘡樣綜合徵和膠原誘導型關節炎。
目前,本領域現有的4-1BB抗體在抗原結合活性、啟動4-1BB分子下游信號等方面還有許多的不足,沒有廣泛應用的4-1BB抗體藥物產品,開發4-1BB的激動性抗體是治療癌症以及自身免疫性疾病的迫切需求。
本發明的目的在於提供一種高親和力的4-1BB抗體及其製備方法和應用。
本發明的第一方面,提供了一種抗體的重鏈可變區,所述的重鏈可變區包括以下三個互補決定區CDR:
SEQ ID NO.:2或SEQ ID NO.:10所示的CDR1,
SEQ ID NO.:3或SEQ ID NO.:11所示的CDR2,和
SEQ ID NO.:4或SEQ ID NO.:12所示的CDR3,
其中,上述氨基酸序列中任意一種氨基酸序列還包括任選地經過添加、缺失、修飾和/或取代1個氨基酸並能夠保留4-1BB結合親和力的衍生序列。
在另一優選例中,所述的重鏈可變區包括以下三個互補決定區CDR:
SEQ ID NO.:2所示的CDR1,
SEQ ID NO.:3所示的CDR2,和
SEQ ID NO.:4所示的CDR3;
或者,
SEQ ID NO.:10所示的CDR1,
SEQ ID NO.:11所示的CDR2,和
SEQ ID NO.:12所示的CDR3,
其中,上述氨基酸序列中任意一種氨基酸序列還包括任選地經過添加、缺失、修飾和/或取代1個氨基酸並能夠保留4-1BB結合親和力的衍生序列。
在另一優選例中,所述的CDR3的氨基酸序列包括任選地經過添加、缺失、修飾和/或取代1個氨基酸並能夠保留4-1BB結合親和力的衍生序列。
在另一優選例中,所述重鏈可變區還包括人源的FR區或鼠源的FR區。
在另一優選例中,所述重鏈可變區具有SEQ ID NO.:1或SEQ ID NO.: 9所示的氨基酸序列。
本發明的第二方面,提供了一種抗體的重鏈,所述的重鏈具有如本發明第一方面所述的重鏈可變區。
在另一優選例中,所述的抗體的重鏈還包括重鏈恆定區。
在另一優選例中,所述的重鏈恆定區為人源、鼠源或兔源的。
本發明的第三方面,提供了一種抗體的輕鏈可變區,所述的輕鏈可變區包括以下三個互補決定區CDR:
SEQ ID NO.:6或SEQ ID NO.:14所示的CDR1’,
SEQ ID NO.:7或SEQ ID NO.:15所示的CDR2’,和
SEQ ID NO.:8或SEQ ID NO.:16所示的CDR3’。
在另一優選例中,所述的輕鏈可變區包括以下三個互補決定區CDR:
SEQ ID NO.:6所示的CDR1’,
SEQ ID NO.:7所示的CDR2’,和
SEQ ID NO.:8所示的CDR3’;
或者,
SEQ ID NO.:14所示的CDR1’,
SEQ ID NO.:15所示的CDR2’,和
SEQ ID NO.:16所示的CDR3’。
在另一優選例中,所述輕鏈可變區還包括人源的FR區或鼠源的FR區。
在另一優選例中,所述輕鏈可變區具有SEQ ID NO.:5或SEQ ID NO.:13所示的氨基酸序列。
本發明的第四方面,提供了一種抗體的輕鏈,所述的輕鏈具有如本發明第三方面所述的輕鏈可變區。
在另一優選例中,所述的抗體的輕鏈還包括輕鏈恆定區。
在另一優選例中,所述的輕鏈恆定區為人源、鼠源或兔源的。
本發明的第五方面,提供了一種抗體,所述抗體具有:
(1) 如本發明第一方面所述的重鏈可變區;和/或
(2) 如本發明第三方面所述的輕鏈可變區;
或者,所述抗體具有:如本發明第二方面所述的重鏈;和/或如本發明第四方面所述的輕鏈。
在另一優選例中,所述抗體對NFκB轉錄因數的親和力的EC50
為0.1-5nM。
在另一優選例中,所述抗體交聯後對NFκB轉錄因數的親和力的EC50
為0.4-1nM
在另一優選例中,所述交聯是指抗體可通過其本身的Fc段與其他介質結合富集,所述的其他介質包括特異性結合抗體的Fc段,包括但不限於抗Fc抗體,細胞表面Fc受體。
在另一優選例中,所述的NFκB轉錄因數位於人4-1BB蛋白下游。
在另一優選例中,所述抗體選自:動物源抗體、嵌合抗體、人源化抗體、或其組合。
在另一優選例中,所述的抗體為雙鏈抗體、或單鏈抗體。
在另一優選例中,所述的抗體為單克隆抗體。
在另一優選例中,所述的抗體是部分或全人源化的單克隆抗體。
在另一優選例中,所述抗體的重鏈可變區序列如SEQ ID NO.: 1所示;並且所述的抗體的輕鏈可變區序列如SEQ ID NO.: 5所示。
在另一優選例中,所述抗體的重鏈可變區序列如SEQ ID NO.: 9所示;並且所述的抗體的輕鏈可變區序列如SEQ ID NO.: 13所示。
在另一優選例中,所述的抗體為藥物偶聯物形式。
本發明的第六方面,提供了一種重組蛋白,所述的重組蛋白具有:
(i) 如本發明第一方面所述的重鏈可變區、如本發明第二方面所述的重鏈、如本發明第三方面所述的輕鏈可變區、如本發明第四方面所述的輕鏈、或本發明第五方面所述的抗體;以及
(ii) 任選的協助表達和/或純化的標籤序列。
在另一優選例中,所述的標籤序列包括6His標籤。
在另一優選例中,所述的重組蛋白(或多肽)包括融合蛋白。
在另一優選例中,所述的重組蛋白為單體、二聚體、或多聚體。
本發明的第七方面,提供了一種CAR構建物,其特徵在於,所述的CAR構建物的單克隆抗體抗原結合區域的scFV段為特異性結合於4-1BB的結合區,並且所述scFv具有如本發明第一方面所述的重鏈可變區和如本發明第三方面所述的輕鏈可變區。
本發明的第八方面,提供了一種重組的免疫細胞,其特徵在於,所述的免疫細胞表達外源的如本發明第七方面所述的CAR構建物。
在另一優選例中,所述的免疫細胞選自下組:NK細胞、T細胞。
在另一優選例中,所述的免疫細胞來自人或非人哺乳動物(如鼠)。
本發明的第九方面,提供了一種抗體藥物偶聯物,其特徵在於,所述的抗體藥物偶聯物含有:
(a) 抗體部分,所述抗體部分選自下組:如本發明第一方面所述的重鏈可變區、如本發明第二方面所述的重鏈、如本發明第三方面所述的輕鏈可變區、如本發明第四方面所述的輕鏈、或本發明第五方面所述的抗體、或其組合;和
(b) 與所述抗體部分偶聯的偶聯部分,所述偶聯部分選自下組:可檢測標記物、藥物、毒素、細胞因數、放射性核素、酶、或其組合。
在另一優選例中,所述的抗體部分與所述的偶聯部分通過化學鍵或接頭進行偶聯。
本發明的第十方面,提供了一種活性成分的用途,所述活性成分選自下組:如本發明第一方面所述的重鏈可變區、如本發明第二方面所述的重鏈、如本發明第三方面所述的輕鏈可變區、如本發明第四方面所述的輕鏈、或本發明第五方面所述的抗體、如本發明第六方面所述的重組蛋白、如本發明第八方面所述的免疫細胞、如本發明第九方面所述的抗體藥物偶聯物、或其組合,其特徵在於,所述活性成分用於(a)製備檢測試劑或試劑盒;和/或(b)製備預防和/或治療4-1BB相關疾病的藥物。
在另一優選例中,所述4-1BB相關疾病選自下組:癌症、自身免疫疾病、病毒感染、移植物抗宿主病、炎症性疾病、免疫性疾病、或其組合。
在另一優選例中,所述的癌症包括實體瘤、血液癌。
在另一優選例中,所述的實體瘤選自下組:膀胱癌、膽道癌、腦癌、乳腺癌、結腸癌、食管癌、胃癌、神經膠質瘤、頭癌、白血病、肝癌、肺癌癌症、淋巴瘤、骨髓瘤、頸癌、卵巢癌、黑素瘤、胰腺癌、腎癌、唾液癌、胃癌、胸腺上皮癌和甲狀腺癌、或其組合。
在另一優選例中,所述的自身免疫疾病選自下組:系統性紅斑狼瘡、類風濕關節炎、潰瘍性結腸炎、I型糖尿病、銀屑病、多發性硬化症、或其組合。
在另一優選例中,所述的抗體為藥物偶聯物(ADC)形式。
在另一優選例中,所述的檢測試劑或試劑盒用於診斷4-1BB相關疾病。
在另一優選例中,所述檢測試劑或試劑盒用於檢測樣品中4-1BB。
在另一優選例中,所述的檢測試劑為檢測片。
本發明的第十一方面,提供了一種藥物組合物,所述的藥物組合物含有:
(i) 活性成分,所述活性成分選自下組:如本發明第一方面所述的重鏈可變區、如本發明第二方面所述的重鏈、如本發明第三方面所述的輕鏈可變區、如本發明第四方面所述的輕鏈、或本發明第五方面所述的抗體、如本發明第六方面所述的重組蛋白、如本發明第八方面所述的免疫細胞、如本發明第九方面所述的抗體藥物偶聯物、或其組合;以及
(ii) 藥學上可接受的載體。
在另一優選例中,所述的藥物組合物為液態製劑。
在另一優選例中,所述的藥物組合物為注射劑。
本發明的第十二方面,提供了一種多核苷酸,所述的多核苷酸編碼選自下組的多肽:
(1) 如本發明第一方面所述的重鏈可變區、如本發明第二方面所述的重鏈、如本發明第三方面所述的輕鏈可變區、如本發明第四方面所述的輕鏈、或本發明第五方面所述的抗體;或
(2) 如本發明第六方面所述的重組蛋白;
(3) 如本發明第七方面所述的CAR構建物。
在另一優選例中,編碼所述重鏈可變區的核酸如SEQ ID NO.:106所示和/或編碼所述輕鏈可變區的核酸如SEQ ID NO.:107所示。
在另一優選例中,編碼所述重鏈可變區的核酸如SEQ ID NO.:108所示和/或且編碼所述輕鏈可變區的核酸如序列表SEQ ID NO.:109所示。
本發明的第十三方面,提供了一種載體,所述的載體含有如本發明第十二方面所述的多核苷酸。
在另一優選例中,所述的載體包括:細菌質粒、噬菌體、酵母質粒、植物細胞病毒、哺乳動物細胞病毒如腺病毒、逆轉錄病毒、或其他載體。
本發明的第十四方面,提供了一種遺傳工程化的宿主細胞,所述的宿主細胞含有如本發明第十三方面所述的載體或基因組中整合有如本發明第十二方面所述的多核苷酸。
本發明的第十五方面,提供了一種體外檢測(包括診斷性或非診斷性)樣品中4-1BB的方法,所述方法包括步驟:
(1) 在體外,將所述樣品與如本發明第五方面所述的抗體接觸;
(2) 檢測是否形成抗原-抗體複合物,其中形成複合物就表示樣品中存在4-1BB。
本發明的第十六方面,提供了一種檢測板,所述的檢測板包括:基片(支撐板)和測試條,所述的測試條含有如本發明第五方面所述的抗體或如本發明第九方面所述的免疫偶聯物。
本發明的第十七方面,提供了一種試劑盒,其特徵在於,所述試劑盒中包括:
(1) 第一容器,所述第一容器中含有如本發明第五方面所述的抗體;和/或
(2) 第二容器,所述第二容器中含有抗如本發明第五方面所述的抗體的二抗;
或者,所述試劑盒含有如本發明第十六方面所述的檢測板。
本發明的第十八方面,提供了一種重組多肽的製備方法,其特徵在於,所述方法包括:
(a) 在適合表達的條件下,培養如本發明第十四方面所述的宿主細胞;
(b) 從培養物中分離出重組多肽,所述的重組多肽是如本發明第五方面所述的抗體或如本發明第六方面所述的重組蛋白。
本發明的第十九方面,提供了一種治療4-1BB相關疾病的方法,其特徵在於,所述方法包括:給需要的物件施用如本發明第五方面所述的抗體、所述抗體的抗體-藥物偶聯物、或表達所述抗體的CAR-T細胞、或其組合。
在本發明的另一方面,提供了一種檢測過表達4-1BB蛋白的細胞的方法,包括步驟:如本發明第五方面所述的抗體與待檢樣品在體外接觸,檢測所述抗體與待檢樣品的結合。
在本發明的另一方面,提供了一種檢測過表達4-1BB蛋白的細胞的組合物,包括本發明第五方面所述的抗體作為活性成分。
本發明所要解決的技術問題是為了克服目前缺少4-1BB抗體,尤其是人源化4-1BB抗體的不足,提供一種特異性強,生物學活性高的4-1BB抗體及其製備方法。所述的4-1BB抗體與人源和猴源的4-1BB蛋白均具有高度親和力,能夠啟動4-1BB分子的下游信號,能在人混合淋巴細胞或T淋巴細胞反應中顯著增加IFN-γ和IL-2的表達水準。
本發明先製備人源4-1BB作為免疫原,採用人源抗體轉基因小鼠技術進行全人源抗體的製備,獲得4-1BB抗體的先導抗體。再通過對先導抗體的初步生產、純化和檢定,獲得能有效刺激4-1BB受體,啟動其下游信號,導致在人T淋巴細胞反應中顯著增加IFN-γ和IL-2的表達水準的優異生物水準的抗體。然後通過分子生物學方法測序獲知4-1BB抗體的重鏈可變區和輕鏈可變區的氨基酸序列。
應理解,在本發明範圍內中,本發明的上述各技術特徵和在下文(如實施例)中具體描述的各技術特徵之間都可以互相組合,從而構成新的或優選的技術方案。限於篇幅,在此不再一一累述。
本發明人經過廣泛而深入地研究,首次意外地發現一種具有高親和力和特異性的4-1BB抗體,並基於該抗體而獲得了全人源化抗體。本發明抗體對4-1BB蛋白具有高親和力,能有效啟動4-1BB下游信號,並且在人混合淋巴細胞或T淋巴細胞中顯著增加IFN-γ和IL-2的表達量,可以用於治療癌症以及自身免疫性疾病。在此基礎上完成了本發明。
術語
如本文所用,術語“結合物”是指能夠與靶點結合的可溶性受體或其片段或其類似物,或抗體或其片段或其類似物。
如本文所用,術語“4-1BB結合物”、“4-1BB抗體”、“抗4-1BB抗體”、“本發明抗體”具有相同含義,是指能特異性識別4-1BB並與4-1BB結合的抗體或其片段或其類似物。
如本文所用,術語“給予”和“處理”是指外源性藥物、治療劑、診斷劑或組合物應用於動物、人、受試者、細胞、組織、器官或生物流體。“給予”和“處理”可以指治療、藥物代謝動力學、診斷、研究和實驗方法。細胞的處理包括試劑與細胞的接觸、以及試劑與流體的接觸、流體與細胞的接觸。“給予”和“處理”還意指通過試劑、診斷、結合組合物或通過另一種細胞體外和離體處理。“處理”當應用於人、動物或研究受試者時,是指治療處理、預防或預防性措施,研究和診斷;包括4-1BB結合物與人或動物、受試者、細胞、組織、生理區室或生理流體的接觸。
如本文所用,術語“治療”指給予患者內用或外用治療劑,包含本發明的任何一種4-1BB結合物及其組合物,所述患者具有一種或多種疾病症狀,而已知所述治療劑對這些症狀具有治療作用。通常,以有效緩解一種或多種疾病症狀的治療劑的量(治療有效量)給予患者。
如本文所用,術語“任選”或“任選地”意味著隨後所描述的事件或情況可以發生但不是必須發生。
抗體
如本文所用,術語“抗體”指免疫球蛋白,是由兩條相同的重鏈和兩條相同的輕鏈通過鏈間二硫鍵連接而成的四肽鏈結構。免疫球蛋白重鏈恆定區的氨基酸組成和排列順序不同,故其抗原性也不同。據此,可將免疫球蛋白分為五類,或稱為免疫球蛋白的不同種型,即IgM、IgD、IgG、IgA和IgE,對應於不同類免疫球蛋白的重鏈恆定區分別稱為a、d、e、g、和m。IgG代表免疫球蛋白中最重要的一類,由於化學結構和生物功能差異,它又可以分為4個子類:IgG1、IgG2、IgG3和IgG4。輕鏈通過恆定區的不同分為κ或λ鏈。不同類免疫球蛋白的亞單位結構和三維構型是本領域人員所熟知的。
抗體重鏈和輕鏈靠近N端的約110個氨基酸的序列變化很大,為可變區(V區);靠近C端的其餘氨基酸序列相對穩定,為恆定區(C區)。可變區包括3個高變區(HVR)和4個序列相對保守的FR區(FR)。4個FR的氨基酸序列相對比較保守,不直接參與結合反應。3個高變區決定抗體的特異性,又稱為互補性決定區(CDR)。每條輕鏈可變區(LCVR)和重鏈可變區(HCVR)由3個CDR區和4個FR區組成,從氨基端到羧基端依次排列的順序為FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4。輕鏈的3個CDR區,即輕鏈高變區(LCDR),指LCDR1、LCDR2和LCDR3;重鏈的3個CDR區,即重鏈高變區(HCDR),指HCDR1、HCDR2和HCDR3。發明所述的抗體或抗原結合片段的LCVR和HCVR區的CDR氨基酸殘基在數量和位置符合已知的Kabat編號規則(LCDR1-3,HCDR2-3),或者符合kabat和chothia的編號規則(HCDR1)。天然重鏈和輕鏈可變區中的四個FR區大致上呈b-折疊構型,由形成連接環的三個CDR相連,在某些情況下可形成部分b折疊結構。每條鏈中的CDR通過FR區緊密地靠在一起並與另一鏈的CDR一起形成了抗體的抗原結合部位。可以通過比較同類型的抗體的氨基酸序列來確定是哪些氨基酸構成了FR或CDR區域。恆定區不直接參與抗體與抗原的結合,但是它們表現出不同的效應功能,例如參與抗體的依賴於抗體的細胞毒性。
如本文所用,術語“抗原結合片段”,指具有抗原結合活性的Fab片段,Fab’片段,F(ab’)2片段,或單一Fv片段。Fv抗體含有抗體重鏈可變區、輕鏈可變區,但沒有恆定區,並具有全部抗原結合位元點的最小抗體片段。一般的,Fv抗體還包含VH和VL結構域之間的多肽接頭,且能夠形成抗原結合所需的結構。
如本文所用,術語“抗原決定簇”指抗原上不連續的,由本發明抗體或抗原結合片段識別的三維空間位點。
本發明不僅包括完整的抗體,還包括具有免疫活性的抗體的片段或抗體與其他序列形成的融合蛋白。因此,本發明還包括所述抗體的片段、衍生物和類似物。
在本發明中,抗體包括用本領域技術人員熟知技術所製備的鼠的、嵌合的、人源化的或者全人的抗體。重組抗體,例如嵌合的和人源化的單克隆抗體,包括人的和非人的部分,可以採用本領域熟知的DNA重組技術製備。
如本文所用,術語“單克隆抗體”指得自單個細胞來源的克隆分泌的抗體。單克隆抗體是高度特異性的,針對單個抗原表位。所述的細胞可能是真核的、原核的或噬菌體的克隆細胞株。
如本文所用,術語“嵌合抗體”是由鼠源性抗體的V區基因與人抗體的C區基因拼接為嵌合基因,然後插入載體,轉染宿主細胞表達的抗體分子。既保留了親本鼠抗體的高特異性和親和力,又使其人源Fc段能有效介導生物學效應功能。
如本文所用,術語“人源化抗體”,是本發明鼠抗的一種可變區改造形式,具有源自(或基本上源自)非人類抗體(優選小鼠單克隆抗體)的CDR區,和基本源自人源抗體序列的FR區和恆定區;即將鼠抗的CDR區序列嫁接到不同類型的人種系抗體構架序列上。因為CDR序列負責大部分的抗體-抗原相互作用,所以可以通過構建表達載體來表達模擬特定天然存在的抗體性質的重組抗體。
在本發明中,抗體可以是單特異性、雙特異性、三特異性、或者更多的多重特異性。
在本發明中,本發明的抗體還包括其保守性變異體,指與本發明抗體的氨基酸序列相比,有至多10個,較佳地至多8個,更佳地至多5個,最佳地至多3個氨基酸被性質相似或相近的氨基酸所替換而形成多肽。這些保守性變異多肽最好根據表A進行氨基酸替換而產生。
抗4-1BB抗體
4-1BB又名CD137,或TNFRF9,是TNF受體家族的成員之一。4-1BB是一個閱讀框含有255個氨基酸(NCBI:NP _001552)的I型跨膜蛋白,由含有17個氨基酸的N端信號肽,169個氨基酸的胞外區,27個氨基酸的跨膜區和42個氨基酸的C端胞內區組成,具體序列可見本專利中SEQ ID NO:22。
如本文所用,術語“4-1BB”一般是指天然的或重組的人4-1BB,以及人4-1BB的非人同源物。除非另有指示,否則使用4-1BB的同源二聚體的分子量計算4-1BB的摩爾濃度。
如本文所用,術語“人4-1BB”包括人4-1BB蛋白的成熟形式及其天然變體和多態性。
本發明提供一種針對4-1BB的高親和力的抗體,其包括重鏈和輕鏈,所述重鏈含有重鏈可變區(VH)氨基酸序列,所述輕鏈含有輕鏈可變區(VL)氨基酸序列。
優選地,重鏈可變區(VH)氨基酸序列和輕鏈可變區(VL)氨基酸序列的各自CDR選自下組:
a1) SEQ ID NO.:2或SEQ ID NO.:10;
a2) SEQ ID NO.:3或SEQ ID NO.:11;
a3) SEQ ID NO.:4或SEQ ID NO.:12;
a4) SEQ ID NO.:6或SEQ ID NO.:14;
a5) SEQ ID NO.:7或SEQ ID NO.:15;
a6) SEQ ID NO.:8或SEQ ID NO.:16;
a7) 上述氨基酸序列中任意一種氨基酸序列經過添加、缺失、修飾和/或取代至少一個(如1-5、1-3個,較佳地1-2個,更佳地1個)氨基酸的具有4-1BB結合親和力的序列。
在另一優選例中,所述經過添加、缺失、修飾和/或取代至少一個氨基酸序列所形成的序列優選為同源性為至少80%,較佳地至少90%,更佳地至少為95%,最佳地至少99%的氨基酸序列。
優選地,上述氨基酸序列的編號如表1所示。
其中,表1中的數字即為序列表“SEQ ID NO.”編號,如57B3D10的重鏈蛋白可變區的氨基酸序列為如SEQ ID NO.:1所示,而57B3D10的重鏈蛋白可變區中CDR1域的氨基酸序列為如SEQ ID NO.:2所示。
事實上,發明人在抗體篩選過程中,還針對克隆號為:11H10C9、15G10D4、23G3B8、52F4G2、118F3A2、170D7F2、172E3E3、178D10D11、182A5B3、100F3C4、119B6G5、258F5A8、259G10E11、263A11E3、289B6G6的4-1BB抗體,進行了相關實驗,由於其各項性能低於克隆號57B3D10和113F6C6的抗體,未進行進一步實驗,詳細實驗結果參見實施例。
本發明抗體可以是抗體全長蛋白、抗原抗體結合域蛋白質片段、雙特異性抗體、多特異性抗體、單鏈抗體(single chain antibody fragment,scFv)、單域抗體(single-domain antibody,sdAb)和單區抗體(Signle-domain antibody)中的一種或多種,以及上述抗體所制得的單克隆
抗體或多克隆抗體。所述單克隆抗體可以由多種途徑和技術進行研製,包括雜交瘤技術、噬菌體展示技術、單淋巴細胞基因克隆技術等,主流是通過雜交瘤技術從野生型或轉基因小鼠製備單克隆抗體。
所述的抗體全長蛋白為本領域常規的抗體全長蛋白,其包括重鏈可變區、輕鏈可變區、重鏈恆定區和輕鏈恆定區。所述的蛋白質的重鏈可變區和輕鏈可變區與人源重鏈恆定區和人源輕鏈恆定區構成全人源抗體全長蛋白。較佳地,所述的抗體全長蛋白為IgG1、IgG2、IgG3或IgG4。
所述的單鏈抗體為本領域常規的單鏈抗體,其包括重鏈可變區、輕鏈可變區和15~20個氨基酸的短肽。
所述的抗原抗體結合域蛋白質片段為本領域常規的抗原抗體結合域蛋白質片段,其包括輕鏈可變區、輕鏈恆定區和重鏈恆定區的Fd段。較佳地,所述的抗原抗體結合域蛋白質片段為Fab和F(ab’)。
所述的單域抗體為本領域常規的單域抗體,其包括重鏈可變區和重鏈恆定區。
所述的單區抗體為本領域常規的單區抗體,其僅包括重鏈可變區。
具體地,本發明的抗體可以是雙鏈或單鏈抗體,並且可以是選自動物源抗體、嵌合抗體、人源化抗體,更優選為人源化抗體、人-動物嵌合抗體,更優選為全人源化抗體。
本發明所述抗體衍生物可以是單鏈抗體、和/或抗體片段,如:Fab、Fab’、(Fab’)2
或該領域內其他已知的抗體衍生物等,以及IgA、IgD、IgE、IgG以及IgM抗體或其他亞型的抗體中的任意一種或幾種。
其中,所述動物優選為哺乳動物,如鼠。
本發明抗體可以是靶向人4-1BB的鼠源抗體、嵌合抗體、人源化抗體、CDR嫁接和/或修飾的抗體。
在本發明的一種優選實施例中,上述SEQ ID NO.:2、3和4,或者SEQ ID NO.:6、7和8中任意一種或幾種序列、或它們經過添加、缺失、修飾和/或取代至少一個氨基酸的具有4-1BB結合親和力的序列,位於重鏈可變區(VH)的CDR區。
在本發明的一種優選實施例中,上述SEQ ID NO.:10、11和12,或者SEQ ID NO.:14、15和16中任意一種或幾種序列、或它們經過添加、缺失、修飾和/或取代至少一個氨基酸的具有4-1BB結合親和力的序列,位於輕鏈可變區(VL)的CDR區。
在本發明的一種更優選實施例中,VH CDR1、CDR2、CDR3分別獨立地選自SEQ ID NO.:2、3和4,或者SEQ ID NO.:6、7和8中任意一種或幾種序列、或它們經過添加、缺失、修飾和/或取代至少一個氨基酸的具有4-1BB結合親和力的序列;VL CDR1、CDR2、CDR3分別獨立地選自SEQ ID NO.:10、11和12,或者SEQ ID NO.:14、15和16中任意一種或幾種序列、或它們經過添加、缺失、修飾和/或取代至少一個氨基酸的具有4-1BB結合親和力的序列。
本發明上述內容中,所述添加、缺失、修飾和/或取代的氨基酸數量,優選為不超過初始氨基酸序列總氨基酸數量的30%,更優選為不超過20%,更優選為1-15%,更優選為1-10%。
在本發明中,所述添加、缺失、修飾和/或取代的氨基酸數量通常是1、2、3、4或5個,較佳地為1-3個,更佳地為1-2個,最佳地為1個。
多核苷酸
本發明還提供一種核酸,其編碼上述多肽。
較佳地,編碼所述重鏈可變區的核酸如序列表SEQ ID NO.: 106或序列表SEQ ID NO.: 108所示;和/或,編碼所述輕鏈可變區的核酸的核苷酸序列如序列表SEQ ID NO.:107或序列表SEQ ID NO.:109所示。
更佳地,編碼所述重鏈可變區的核酸如序列表SEQ ID NO.:106所示,且編碼所述輕鏈可變區的核酸如序列表SEQ ID NO.:107所示;編碼所述重鏈可變區的核酸如序列表SEQ ID NO.:108所示,且編碼所述輕鏈可變區的核酸如序列表SEQ ID NO.:109所示。
上述核苷酸序列的編號如表2所示:
其中,表2中的數字即為序列表“SEQ ID NO.”編號,如編碼57B3D10的重鏈蛋白可變區的核苷酸序列為序列表SEQ ID NO.:106。
其中,編碼57B3D10的重鏈蛋白可變區中CDR1域的核苷酸序列為序列表SEQ ID NO.:106中的第91位至第105位;
編碼57B3D10的重鏈蛋白可變區中CDR2域的核苷酸序列為序列表SEQ ID NO.:106中的第148位至第195位;
編碼57B3D10的重鏈蛋白可變區中CDR3域的核苷酸序列為序列表SEQ ID NO.:106中的第292位至第342位;
編碼57B3D10的輕鏈蛋白可變區中CDR1域的核苷酸序列為序列表SEQ ID NO.:107中的第67位至第102位;
編碼57B3D10的輕鏈蛋白可變區中CDR2域的核苷酸序列為序列表SEQ ID NO.:107中的第148位至第168位;
編碼57B3D10的輕鏈蛋白可變區中CDR3域的核苷酸序列為序列表SEQ ID NO.:107中的第265位至第288位;
編碼113F6C6的重鏈蛋白可變區中CDR1域的核苷酸序列為序列表SEQ ID NO.:108中的第位91至第105位;
編碼113F6C6的重鏈蛋白可變區中CDR2域的核苷酸序列為序列表SEQ ID NO.:108中的第148位至第198位;
編碼113F6C6的重鏈蛋白可變區中CDR3域的核苷酸序列為序列表SEQ ID NO.:108中的第295位至第351位;
編碼113F6C6的輕鏈蛋白可變區中CDR1域的核苷酸序列為序列表SEQ ID NO.:109中的第70 位至第102位;
編碼113F6C6的輕鏈蛋白可變區中CDR2域的核苷酸序列為序列表SEQ ID NO.:109中的第148位至第168位;
編碼113F6C6的輕鏈蛋白可變區中CDR3域的核苷酸序列為序列表SEQ ID NO.:109中的第265位至第291位;
所述核酸的製備方法為本領域常規的製備方法,較佳地,包括以下的步驟:通過基因克隆技術獲得編碼上述蛋白質的核酸分子,或者通過人工全序列合成的方法得到編碼上述蛋白質的核酸分子。
本領域技術人員知曉,編碼上述蛋白質的氨基酸序列的堿基序列可以適當引入替換、缺失、改變、插入或增加來提供一個多聚核苷酸的同系物。本發明中多聚核苷酸的同系物可以通過對編碼該蛋白序列基因的一個或多個堿基在保持抗體活性範圍內進行替換、缺失或增加來制得。
抗體的製備
任何適於產生單克隆抗體的方法都可用於產生本發明的抗4-1BB抗體。例如,可以用連接或天然存在的4-1BB同源二聚體或其片段免疫動物。可以使用合適的免疫接種方法,包括佐劑、免疫刺激劑、重複加強免疫接種,可以使用一種或多種途徑。
任何合適形式的4-1BB都可以作為免疫原(抗原),用於產生對4-1BB特異的非人抗體,篩選所述抗體的生物學活性。激發免疫原可以是全長的成熟人4-1BB,包括天然的同源二聚體,或含單個/多個表位的肽。免疫原可以單獨使用,或與本領域已知的一種或多種免疫原性增強劑組合使用。免疫原可以由天然來源純化,或者在遺傳修飾的細胞中產生。編碼免疫原的DNA在來源上可以是基因組或非基因組的(例如cDNA)。可以使用合適的遺傳載體表達編碼免疫原的DNA,所述載體包括但不限於腺病毒載體、腺相關病毒載體、桿狀病毒載體、質料和非病毒載體。
生產本發明的抗人4-1BB抗體的示例性方法描述於實施例1。
全人源化抗體可以選自任何種類的免疫球蛋白,包括IgM、IgD、IgG、IgA和IgE。在本發明中,抗體是IgG抗體,使用IgG4亞型。通過用下文實施例中描述的生物學測定篩選抗體易於實現必需恆定結構域序列的最優化,以產生所需生物學活性。
同樣,任一類輕鏈都可以在本文的化合物和方法中使用。具體地說,κ、λ鏈或其變體在本發明的化合物和方法中是可以用的。
人源化本發明的抗人4-1BB抗體的示例性方法描述於實施例3。
本發明抗體或其片段的DNA分子的序列可以用常規技術,比如利用PCR擴增或基因組文庫篩選等方法獲得。此外,還可將輕鏈和重鏈的編碼序列融合在一起,形成單鏈抗體。
一旦獲得了有關的序列,就可以用重組法來大批量地獲得有關序列。這通常是將其克隆入載體,再轉入細胞,然後通過常規方法從增殖後的宿主細胞中分離得到有關序列。
此外,還可用人工合成的方法來合成有關序列,尤其是片段長度較短時。通常,通過先合成多個小片段,然後再進行連接可獲得序列很長的片段。然後可將該DNA序列引入本領域中已知的各種現有的DNA分子(或如載體)和細胞中。
本發明還涉及包含上述的適當DNA序列以及適當啟動子或者控制序列的載體。這些載體可以用於轉化適當的宿主細胞,以使其能夠表達蛋白質。
宿主細胞為本領域常規的各種宿主細胞,只要能滿足使上述重組表達載體穩定地自行複製,且所攜帶所述的核酸可被有效表達即可。具體地,宿主細胞可以是原核細胞,如細菌細胞;或是低等真核細胞,如酵母細胞;或是高等真核細胞,如哺乳動物細胞。優選的動物細胞包括(但並不限於):CHO-S、CHO-K1、HEK-293細胞。
優選的宿主細胞包括E.coli TG1或BL21細胞(表達單鏈抗體或Fab抗體),或者CHO-K1細胞(表達全長IgG抗體)
本發明中所述的用重組DNA轉化宿主細胞的步驟可用本領域熟知的技術進行。獲得的轉化子可用常規方法培養,轉化子表達本發明的基因所編碼的多肽。根據所用的宿主細胞,用常規培養基在合適的條件下培養。
通常,在適合本發明抗體表達的條件下,培養轉化所得的宿主細胞。然後用常規的免疫球蛋白純化步驟,如蛋白A-Sepharose、羥基磷灰石層析、凝膠電泳、透析、離子交換層析、疏水層析、分子篩層析或親和層析等本領域技術人員熟知的常規分離純化手段純化得到本發明的抗體。
所得單克隆抗體可用常規手段來鑒定。比如,單克隆抗體的結合特異性可用免疫沉澱或體外結合試驗(如放射性免疫測定(RIA)或酶聯免疫吸附測定(ELISA))來測定。
應用
本發明提供了本發明抗體的用途,例如用於製備診斷製劑、或製備用於預防和/或治療4-1BB相關的疾病的藥物。所述4-1BB相關的疾病包括癌症、自身免疫疾病、病毒感染、移植物抗宿主病、炎症性疾病、免疫性疾病、或其組合。其中,所述的癌症包括實體瘤、血液癌,所述的實體瘤選自下組:膀胱癌、膽道癌、腦癌、乳腺癌、結腸癌、食管癌、胃癌、神經膠質瘤、頭癌、白血病、肝癌、肺癌癌症、淋巴瘤、骨髓瘤、頸癌、卵巢癌、黑素瘤、胰腺癌、腎癌、唾液癌、胃癌、胸腺上皮癌和甲狀腺癌、或其組合;所述的自身免疫疾病包括:系統性紅斑狼瘡、類風濕關節炎、潰瘍性結腸炎、I型糖尿病、銀屑病、多發性硬化症、或其組合。
藥物組合物
本發明還提供了一種組合物。在優選例中,所述的組合物是藥物組合物,它含有上述的抗體或其活性片段或其融合蛋白或其ADC或相應的CAR-T細胞,以及藥學上可接受的載體。通常,可將這些物質配製於無毒的、惰性的和藥學上可接受的水性載體介質中,其中pH通常約為5-8,較佳地pH約為6-8,儘管pH值可隨被配製物質的性質以及待治療的病症而有所變化。配製好的藥物組合物可以通過常規途徑進行給藥,其中包括(但並不限於):瘤內、腹膜內、靜脈內、或局部給藥。
本發明所述抗體也可以是由核苷酸序列在細胞內表達用於的細胞治療,比如,所述抗體用於嵌合抗原受體T細胞免疫療法(CAR-T)等。
本發明的藥物組合物可直接用於結合4-1BB蛋白分子,因而可用於預防和治療4-1BB相關的疾病。此外,還可同時使用其他治療劑。
本發明的藥物組合物含有安全有效量(如0.001-99wt%,較佳地0.01-90wt%,更佳地0.1-80wt%)的本發明上述的單克隆抗體(或其偶聯物)以及藥學上可接受的載體或賦形劑。這類載體包括(但並不限於):鹽水、緩衝液、葡萄糖、水、甘油、乙醇、及其組合。藥物製劑應與給藥方式相匹配。本發明的藥物組合物可以被製成針劑形式,例如用生理鹽水或含有葡萄糖和其他輔劑的水溶液通過常規方法進行製備。藥物組合物如針劑、溶液宜在無菌條件下製造。活性成分的給藥量是治療有效量,例如每天約1微克/千克體重-約100毫克/千克體重。此外,本發明的多肽還可與其他治療劑一起使用。
使用藥物組合物時,是將安全有效量的藥物組合物施用於哺乳動物,其中該安全有效量通常至少約10微克/千克體重,而且在大多數情況下不超過約50毫克/千克體重,較佳地該劑量是約10微克/千克體重-約20毫克/千克體重。當然,具體劑量還應考慮給藥途徑、病人健康狀況等因素,這些都是熟練醫師技能範圍之內的。
檢測用途和試劑盒
本發明的抗體可用於檢測應用,例如用於檢測樣本,從而提供診斷資訊。
本發明中,所採用的樣本(樣品)包括細胞、組織樣本和活檢標本。本發明使用的術語“活檢”應包括本領域技術人員已知的所有種類的活檢。因此本發明中使用的活檢可以包括例如通過內窺鏡方法或器官的穿刺或針刺活檢製備的組織樣本。
本發明中使用的樣本包括固定的或保存的細胞或組織樣本。
本發明還提供了一種指含有本發明的抗體(或其片段)的試劑盒,在本發明的一個優選例中,所述的試劑盒還包括容器、使用說明書、緩衝劑等。在優選例中,本發明的抗體可以固定於檢測板。
本發明還提供一種檢測過表達4-1BB蛋白的細胞的方法,包括如下的步驟:上述的蛋白質與待檢樣品在體外接觸,檢測上述的蛋白質與所述待檢樣品的結合即可。
所述的過表達的含義為本領域常規,指4-1BB蛋白在待檢樣品中的RNA或蛋白質的過表達(由於轉錄增加、轉錄後加工、翻譯、翻譯後加工以及蛋白質降解改變),以及由於蛋白質運送模式改變(核定位元增加)而導致的局部過表達和功能活性提高(如在底物的酶水解作用增加的情況下)。
所述結合的檢測方式是本領域常規的檢測方式,較佳地為FACS檢測。
本發明提供一種檢測過表達4-1BB蛋白的細胞的組合物,其包括上述的蛋白質作為活性成分。較佳地,其還包括上述的蛋白質的功能片段組成的化合物作為活性成分。
在符合本領域常識的基礎上,上述各優選條件,可任意組合,即得本發明各較佳實例。
本發明所用試劑和原料均市售可得。
本發明的主要優點包括:
本發明所述的蛋白質是一種全人源4-1BB抗體,其與4-1BB蛋白具有高親和力,能夠結合4-1BB蛋白受體的胞外區,並能夠在細胞水準啟動4-1BB分子下游信號。混合淋巴細胞實驗和T細胞刺激實驗證明,所述的4-1BB抗體具有良好的生物活性,其在人混合淋巴細胞或T淋巴細胞中會顯著增加IFN-γ和IL-2的表達量。由此可見,所述的4-1BB抗體除了為全人源序列外,還具有包括結合人4-1BB蛋白的高度特異性、能夠調節人淋巴細胞免疫反應等優異的特性。
下面結合具體實施例,進一步闡述本發明。應理解,這些實施例僅用於說明本發明而不用於限制本發明的範圍。下列實施例中未注明具體條件的實驗方法,通常按照常規條件,或按照製造廠商所建議的條件。除非另外說明,否則百分比和份數按重量計算。
實施例中所述的室溫為本領域常規的室溫,一般為10~30℃。
若無特別說明,實施例中所述的PBS為PBS磷酸緩衝液,pH7.2。
實施例1
4-1BB抗體的製備
(一)、免疫原A的製備
將人源4-1BB蛋白胞外區氨基酸序列Leu24-Gln186(如序列表SEQ ID NO.:21所示)克隆到帶有人IgG Fc片段(hFc)的pCpC載體(購自Invitrogen,V044-50)並按已建立的標準分子生物學方法製備質粒。對HEK293細胞(購自Invitrogen)進行暫態轉染(PEI,Polysciences)並使用FreeStyleTM
293(Invitrogen)在37℃下進行擴大培養。4天後收集細胞培養液,離心去除細胞成分,得含4-1BB蛋白胞外區的培養上清液。將培養上清液上樣到蛋白A親和層析柱(Mabselect Sure,購自GE Healthcare),同時用紫外(UV)檢測儀監測紫外吸收值(A280nm)的變化。上樣後用PBS磷酸鹽緩衝液(pH7.2)清洗蛋白A親和層析柱直到紫外吸收值回到基線,然後用0.1M甘氨酸鹽酸(pH2.5)洗脫,收集從蛋白A親和層析柱上洗脫下來的帶hFc標籤的4-1BB蛋白(4-1BB-hFc),用PBS磷酸鹽緩衝液(pH7.2)在4℃冰箱透析過夜。透析後的蛋白經0.22微米無菌過濾後分裝於-80℃保存,即獲得純化的免疫原A。免疫原A在使用前需要進行一系列質控檢測,如檢測其蛋白濃度、純度、分子量和生物活性等,結果如圖1和表3所示。表3說明4-1BB與其配體蛋白4-1BBL在蛋白水準的結合隨著4-1BBL的濃度變化而變化,其中對照蛋白為非4-1BB融合蛋白,表中的資料為OD450nm
值。
其中,免疫原A生物活性採用ELISA檢測,具體為:
將帶hFc標籤的4-1BB胞外區蛋白(4-1BB-hFc)用PBS稀釋至0.5μg/mL,以100μl/孔加入ELISA微孔板,4℃孵育過夜。用ELISA封閉液(含1%BSA,pH7.4的PBS磷酸緩衝液,所述百分比為品質百分比)37℃封閉兩小時後,再加入梯度稀釋的his-muCD8a-4-1BBLECD
融合蛋白37℃溫育1小時。his-muCD8a-4-1BBLECD
由4-1BB配體4-1BBL胞外區(NCBI序列NP_003802.1的Arg71-Glu254)和小鼠CD8a胞外區(NCBI序列NP_001074579.1的Lys28-Asp194)融合組成,his標籤在N端。his-muCD8a-4-1BBLECD
蛋白的表達方法如免疫源A,由鎳柱親和層析法製備純化。
接著再加入生物素標記的大鼠抗小鼠CD8a抗體,37℃溫育1小時。加入鏈黴親和素標記的辣根過氧化物酶(購自Sigma商品號S2438),室溫孵育30分鐘後加入100微升/孔TMB顯色液。室溫孵育15分鐘後,加入50微升1N鹽酸終止顯色反應,用ELISA讀板機讀取OD450nm
讀數。
(二)、免疫原B的製備
人源4-1BB全長氨基酸序列(如序列表SEQ ID NO.:23所示)被克隆到pIRES載體(購自Clontech)並製備質粒。對HEK293細胞系和CHOK1細胞系(均購自Invitrogen)進行質粒轉染(轉染使用X-treme GENE HP DNA Transfection Reagent,購自Roche公司,貨號Cat #06 366 236 001,並按說明書操作)後,在含0.5 μg/mL的含10%(w/w)FBS的DMEM培養基中選擇性培養2周,用有限稀釋法在96孔培養板中進行亞克隆,並置於37℃,5%(v/v)CO2
培養。大約2周後選擇部分單克隆孔擴增到6孔板中。對擴增後的克隆用已知的4-1BB抗體(購自BD公司)經流式細胞分析法進行篩選。選擇長勢較好、螢光強度較高、單克隆的細胞系繼續擴大培養並液氮凍存,即獲得免疫原B。具體選擇結果如表4和圖2所示,表4中陽性細胞(%)指陽性細胞占總細胞數目的百分比。表4說明,已經制得一系列4-1BB陽性表達的HEK293細胞系。
(三)、雜交瘤細胞的製備和抗體篩選
Harbour轉基因小鼠引入了人免疫球蛋白可變區基因和大鼠免疫球蛋白恆定區基因,而小鼠本身的Ig表達則被沉默。該轉基因小鼠經抗原免疫後能產生與正常小鼠(如Balb/c)相當的免疫反應和抗體效價。
A、免疫原A免疫採用6~8周齡Harbour人源抗體轉基因小鼠(購自北京維通利華公司),小鼠在SPF條件下飼養。初次免疫時,免疫原(1)蛋白用弗氏完全佐劑乳化後腹腔注射0.25毫升,即每只小鼠注射100微克免疫原A蛋白。加強免疫時,免疫原A蛋白用弗氏不完全佐劑乳化後腹腔注射0.25毫升,即每只小鼠注射50微克免疫原A蛋白。初次免疫與第一次加強免疫之間間隔2周,以後每次加強免疫之間間隔3周。每次加強免疫1周後採血,用ELISA和FACS檢測血清中免疫原(1)的抗體效價和特異性,結果如圖3和表5所示。表5說明,經4-1BB-hFc免疫的小鼠的免疫後血清對免疫原均有不同程度的結合,呈現抗原抗體反應,其中最高稀釋度在一百萬左右。其中空白對照為1%(w/w)BSA,其中批次指第三次加強免疫後第七天的小鼠血清,表中的資料為OD450nm
值。
B、免疫原B免疫採用6~8周齡Harbour人源抗體轉基因小鼠(購自北京維通利華公司),小鼠在SPF條件下飼養。將按實施例1步驟(二)中的得到的含人源4-1BB的HEK293-h4-1BB穩定細胞系在T-75細胞培養瓶中擴大培養至90%匯合度,吸盡培養基。用DMEM基礎培養基(購自Invitrogen)洗滌2次,然後用無酶細胞解離液(購自Invitrogen)37℃處理直至細胞從培養皿壁上可脫落,收集細胞。用DMEM基礎培養基洗滌2次,進行細胞計數後將細胞用磷酸鹽緩衝液(pH7.2)稀釋至2×107
細胞每毫升。每只小鼠每次免疫時腹腔注射0.5毫升細胞懸液。第一次與第二次免疫之間間隔2周,以後每次免疫間隔3周。除第一次免疫以外,每次免疫1周後採血,用FACS檢測血清中抗體效價和特異性。在二次加強免疫後,FACS檢測血清抗體效價通常達到1:1000以上。
通常以免疫原A~B進行免疫,大部分小鼠經3次免疫後FACS效價可達到1:1000以上。
A~B步驟完成前,將所選擇的每只小鼠最後一次免疫腹腔注射100微克純化的4-1BB-hFc(針對免疫原A和免疫原C進行免疫反應的小鼠)或含人源4-1BB的HEK293-h4-1BB穩定細胞系(針對免疫原B進行免疫反應的小鼠),5天後處死小鼠,收集脾細胞。加入NH4
OH至終濃度1%(w/w),裂解脾細胞中參雜的紅細胞,獲得脾細胞懸液。用DMEM基礎培養基1000轉每分鐘離心清洗細胞3次,然後按活細胞數目5:1比率與小鼠骨髓瘤細胞SP2/0混合(購自ATCC),採用高效電融合或PEG方法進行細胞融合。融合後的細胞稀釋到含20%胎牛血清、1×HAT的DMEM培養基中,所述百分比為品質百分比。然後按1×105
/20微升每孔加入到96孔細胞培養板中,放入5% CO2
、37℃培養箱中,所述百分比為體積百分比。14天後用ELISA和Acumen(微孔板細胞檢測法)篩選細胞融合板上清,將ELISA中OD450nm
>1.0和Acumen中MFI值>100的陽性克隆擴增到24孔板,在含10%(w/w)胎牛血清的DMEM(Invitrogen)的培養基中,在37℃,5%(v/v)CO2
條件下擴大培養。培養3天後取24孔板中擴大培養的培養液進行離心,收集上清液,對上清液進行抗體亞型分析。用ELISA、FACS確定對4-1BB蛋白和4-1BB陽性細胞的結合活性(結合活性的檢測方法請分別參見實施例5A和實施例5B),再通過NF-κB螢光素酶報告基因實驗來確定抗體樣品對4-1BB受體啟動的活性(檢測方法請參見實施例5)。
根據24孔板篩選結果,挑選ELISA實驗中OD450nm
>1.0、FACS實驗中MFI值>50,和NF-κB螢光素酶報告基因實驗中雜交瘤細胞培養上清相對於對照IgG組將4-1BB受體啟動在1.0倍以上的雜交瘤細胞為符合條件的陽性克隆。選擇符合條件的雜交瘤細胞用有限稀釋法在96孔板進行亞克隆,在含10%(w/w)FBS的DMEM培養基中(購自Invitrogen)37℃,5%(v/v)CO2
條件下培養。亞克隆後10天用ELISA和Acumen進行初步篩選,挑選陽性單克隆擴增到24孔板繼續培養。3天後用FACS確定抗原結合陽性並用4-1BB受體NF-κB螢光素酶報告基因實驗評估生物活性(評估標準為ELISA實驗中OD450nm
>1.0、FACS實驗中MFI值>5,和NF-κB螢光素酶報告基因實驗中雜交瘤細胞培養上清相對於對照IgG組將4-1BB受體啟動在1.0倍以上)。
根據24孔板樣品檢測結果,陽性克隆在含10%(w/w) FBS的DMEM(購自Invitrogen)培養基中,在37℃,5%(v/v)CO2
條件下進行擴大培養,細胞懸浮於凍存液[含有20%(w/w)FBS和10%(w/w)DMSO的DMEM]中,按常規方法液氮凍存即得本發明雜交瘤細胞,並可用於後續的抗體測序。
實施例2
輕重鏈可變區氨基酸序列測定
總RNA分離:將實施例1亞克隆培養所得的上清液檢驗過抗原結合後(即經過實施例3~6的檢定和活性測定後),選擇部分抗體(詳見表6、7)進行測序。通過離心搜集5×107
個雜交瘤細胞,加入1mL Trizol混勻並轉移到1.5mL離心管中,室溫靜置5分鐘。加0.2mL氯仿,振盪15秒,靜置2分鐘後於4℃,12000g離心5分鐘,取上清轉移到新的1.5mL離心管中。加入0.5mL異丙醇,將管中液體輕輕混勻,室溫靜置10分鐘後於4℃,12000g離心15分鐘,棄上清。加入1mL 75%乙醇(所述百分比為體積百分比),輕輕洗滌沉澱,4℃,12000g離心5分鐘後棄上清,將沉澱物晾乾,加入DEPC處理過的H2
O溶解(55℃水浴促溶10分鐘),即得總RNA。
逆轉錄與PCR:取1μg總RNA,配置20μl體系,加入逆轉錄酶後於42℃反應60分鐘,於7℃反應10分鐘終止反應。配置50μl PCR體系,包括1μl cDNA、每種引物25pmol、1μl DNA聚合酶以及相配的緩衝體系、250μmol dNTPs。設置PCR程式,預變性95℃3分鐘,變性95℃30秒,退火55℃ 30秒,延伸72℃35秒,35個迴圈後再額外於72℃延伸5分鐘,得PCR產物。其中逆轉錄所用的試劑盒為PrimeScript RT Master Mix,購自Takara,貨號RR036;PCR所用的試劑盒為Q5超保真酶,購自NEB,貨號M0492。
克隆與測序:取5μl PCR產物進行瓊脂糖凝膠電泳檢測,將檢測陽性樣品使用柱回收試劑盒純化,其中回收試劑盒為NucleoSpin® Gel & PCR Clean-up,購自MACHEREY-NAGEL,貨號740609。進行連接反應:樣品50ng,T載體50ng,連接酶0.5μl,緩衝液1μl,反應體系10μl,於16℃反應半小時得連接產物,其中連接的試劑盒為T4 DNA連接酶,購自NEB,貨號M0402;取5μl連接產物加入100μl的感受態細胞(Ecos 101competent cells,購自Yeastern,貨號FYE607)中,冰浴5分鐘。而後於42℃水浴熱激1分鐘,放回冰上1分鐘後加入650μl無抗生素SOC培養基,於37℃搖床上以200RPM的速度復甦30分鐘,取出200μl塗布於含抗生素的LB固體培養基上於37℃孵箱過夜培養。次日,使用T載體上引物M13F和M13R配置30μl PCR體系,進行菌落PCR,用移液器槍頭蘸取菌落於PCR反應體系中吹吸,並吸出0.5μl點於另一塊含100nM氨苄青黴素的LB固體培養皿上以保存菌株。PCR反應結束後,取出5μl進行瓊脂糖凝膠電泳檢測,將陽性樣品進行測序。其中,測序的步驟參見Kabat, Sequences of Proteins of Immunological Interest, National Institutes of Health, Bethesda, Md.(1991)。
測序結果如表6~7所示。
其中,表6中的數字即為序列表“SEQ ID NO.”編號,如57B3D10的重鏈蛋白可變區的氨基酸序列為序列表SEQ ID NO.:1,而57B3D10的重鏈蛋白可變區中CDR1域的氨基酸序列為序列表SEQ ID NO.:2。
其中,表7中的數字即為序列表“SEQ ID NO.”編號,如編碼57B3D10的重鏈蛋白可變區的核苷酸序列為序列表SEQ ID NO.:106。
實施例3
全人抗體IgG轉化和製備
(1) 質粒構建與準備:實施例2已從雜交瘤細胞的培養上清液中獲得了純化的4-1BB抗體,並根據實施例1的測序結果明確了4-1BB抗體的重鏈可變區和輕鏈可變區序列。將4-1BB抗體的重鏈可變區序列重組到包含信號肽和人源重鏈抗體IgG1恆定區的表達載體(其中表達載體購買自Invitrogen,重組步驟也由上海睿智化學完成)中,將4-1BB抗體的輕鏈可變區序列重組到包含信號肽和人源抗體輕鏈kappa恆定區的表達載體當中,得重組質粒並經測序驗證(測序方法與實施例7中測序方法相同)。使用堿裂解法試劑盒(購自MACHEREY-NAGEL)中量抽提高純度的重組質粒,品質為500μg以上,經0.22μm濾膜(購自Millopore)過濾,供轉染使用。
(2) 細胞轉染:
在培養基Freestyle 293 expression medium(購自
Invitrogen)培養293E細胞(購自Invitrogen)。搖床設置為37℃、130RPM,8% CO2
(v/v)濃度。
Freestyle 293 expression medium在轉染時添加10% (v/v) F68(購自Invitrogen)至F68終濃度為0.1%(v/v),得含0.1%(v/v)F68的Freestyle 293表達培養基,即培養基A。
取5mL培養基A和200μg/mL PEI(購自Sigma)混勻,得培養基B。取5mL培養基A和100μg/mL步驟(1)所得的重組質粒混勻,得培養基C。5分鐘後將培養基B和培養基C合併混勻,靜置15分鐘,得混合液D。將10mL混合液D緩緩加入100mL含293E細胞的培養基Freestyle 293 expression medium中至293E的細胞密度為1.5×106
/mL,邊加邊振盪,避免PEI過度集中,放入搖床培養。第二天加入蛋白腖至終濃度為0.5%(w/v)。第5~7天,測培養液抗體效價。第6~7天,離心(3500RPM,30分鐘)收集上清,經0.22μm濾膜過濾,得濾好的細胞上清液,以供純化。
(3) 抗體純化:對於連續生產的無內毒素的層析柱和Protein A填料(購自GE),使用0.1M NaOH處理30分鐘或者5個柱體積的0.5M NaOH沖洗。對於長期未使用的柱料和層析柱至少使用1M NaOH浸泡1h,用無內毒的水沖洗至中性,用10倍柱體積的1%(v/v)Triton×100對柱料清洗。使用5個柱體積的PBS(PBS磷酸緩衝液,pH7.2)進行平衡,將步驟(2)所得過濾好的細胞上清液上柱,必要時收集流穿液。上柱完成後,使用5倍柱體積的PBS清洗。用5倍柱體積的0.1M pH3.0的Glycine-HCl進行洗脫,收集洗脫液,並用0.5倍柱體積洗脫液的pH8.5的1MTris-HCl(1.5M NaCl)中和,收穫全人4-1BB抗體。上述所用溶液均需要新配置。收穫全人4-1BB抗體後,在1×PBS中透析4小時,避免內毒素污染。透析結束後,使用分光光度或試劑盒測定濃度,使用HPLC-SEC測定抗體純度,使用內毒素檢測試劑盒(購自Lonza)檢測抗體內毒素含量。並對所獲全人4-1BB抗體進行特性鑒定(同實施例4-8),檢測結果分別如圖4-13和表8-18所示。圖4~13和表8~17說明,經過全人IgG轉化並製備所得全人4-1BB抗體能夠啟動4-1BB分子下游信號通路。
實施例4
先導抗體的檢定
A、酶聯免疫吸附實驗(ELISA)檢測抗體與4-1BB蛋白的結合
對實施例2所得的純化的全人源4-1BB抗體進行與人4-1BB-hFc蛋白、與猴4-1BB-his和與4-1BB蛋白所在家族的其他免疫檢測點蛋白OX40,GITR分別進行交叉反應。
將實施例1獲得的純化的免疫原A(4-1BB-hFc)、猴4-1BB-his、小鼠4-1BB-his[其製備方法參見實施例1步驟(一)免疫原A的製備,其中猴源4-1BB蛋白胞外區(購自ACRO biosystems),小鼠4-1BB蛋白胞外區(購自sino biological)或其他免疫檢測點蛋白分別用PBS稀釋到終濃度1.0µg/mL,然後以100µl每孔加到96孔ELISA板。用塑膠膜封好4℃孵育過夜,第二天用洗板液[含有0.01%(v/v)Tween20的PBS]洗板2次,加入封閉液[含有0.01%(v/v)Tween20和1%(v/v)BSA的PBS]室溫封閉2小時。倒掉封閉液,加入實施例2所得的純化的4-1BB抗體100µl每孔。37℃孵育2小時後,用洗板液[含有0.01%(v/v)Tween20的PBS]洗板3次。加入HRP(辣根過氧化物酶)標記的二抗(購自Sigma),37℃孵育2小時後,用洗板液[含有0.01%(v/v)Tween20的PBS]洗板3次。加入TMB底物100µl每孔,室溫孵育30分鐘後,加入終止液(1.0N HCl)100µl每孔。用ELISA讀板機(SpectraMax 384plus, Molecular Device)讀取A450nm數值,結果如圖4~7和表8~11所示,表8~11說明,純化後的抗體與4-1BB重組蛋白在ELISA水準特異性結合。其中空白為人IgG,CTLA4-Fc作為陰性對照(negative control,NC),表中的資料為OD450nm
值。
B、流式細胞實驗(FACS)檢測抗體與4-1BB表達細胞的結合
將實施例1步驟(二)中所述含有編碼人源4-1BB全長氨基酸序列的核苷酸序列的pIRES質粒轉染CHOK1細胞株得含人4-1BB的CHOK1穩轉細胞株(此處稱為CHOk1-h4-1BB穩定細胞株),將帶有猴源PDL1全長基因的pIRES質粒(其製備方法與實施例1步驟(一)“免疫原A的製備”中帶有人源IgG Fc片段(hFc)的pCpC載體的製備方法相同,其中猴源4-1BB蛋白胞外區(Phe19-Thr239)氨基酸序列的資料庫登錄號為G7PSE7)轉染CHOK1細胞株得含猴4-1BB的CHOK1穩轉細胞株(此處稱為CHOK1-c4-1BB穩定細胞株)。將CHOK1-h4-1BB穩定細胞株和CHOK1-c4-1BB穩定細胞株在T-75細胞培養瓶中擴大培養至90%匯合度,吸盡培養基,用HBSS緩衝液(Hanks Balanced Salt Solution,購自Invitrogen)洗滌2次,然後用無酶細胞解離液(Versene solution,購自Life technology公司)處理和收集細胞。用HBSS緩衝液洗滌細胞2次,進行細胞計數後將細胞用HBSS緩衝液稀釋至2×106
細胞每毫升,加入1%山羊血清封閉液,所述百分比為品質百分比。冰上孵育30分鐘,然後用HBSS緩衝液離心洗滌2次。將收集的細胞用FACS緩衝液(含有1%BSA的HBSS,所述百分比為品質百分比)懸浮至2×106
細胞/mL,按每孔100微升加入到96孔FACS反應板中,加入實施例2所得的純化的4-1BB抗體待測樣品每孔100微升,冰上孵育2小時。用FACS緩衝液離心洗滌2次,加入每孔100微升螢光(Alexa 488)標記的二抗(購自Invitrogen),冰上孵育1小時。用FACS緩衝液離心洗滌3次,加入每孔100微升固定液[4%(v/v)多聚甲醛]懸浮細胞,10分鐘後用FACS緩衝液離心洗滌2次。用100微升FACS緩衝液懸浮細胞,用FACS(FACS Calibur,購自BD公司)檢測和分析結果。結果如圖8-9和表12-13所示,結果說明,待測抗體可結合細胞表面的4-1BB蛋白。其中IgG對照為人IgG,表中的資料為MFI所測細胞群的平均螢光強度值。
實施例5
在NFκB螢光素酶報告基因實驗中檢測4-1BB抗體活性
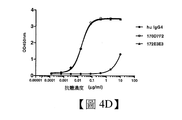
在人4-1BB蛋白陽性的HEK293穩定細胞株(製備方法見實施例1)中進一步轉染NFκB螢光素酶報告基因質粒,製成人4-1BB蛋白陽性的帶NFκB螢光素酶報告基因的穩定細胞株。用抗人或大鼠Fc F(ab’)₂對待檢測抗體進行交聯,然後將交聯好或沒有進行交聯的抗體加入此穩定細胞株中進行細胞培養。5小時後加入螢光素酶檢測試劑,讀取螢光值。結果如圖10A-10B和表14所示,表14說明,全人4-1BB抗體對4-1BB蛋白下游NFκB信號通路有很強的啟動,且在抗體交聯後抗體啟動能力進一步增強(EC50值降低)。這表明4-1BB抗體在體內應用時,可在達到特定區域,如腫瘤組織後,通過表達FcR的細胞介導進行交聯,從而增強抗體活性和安全性。表14所示為全人4-1BB抗體組相對對照組(人IgG)的螢光值倍數和EC50值。
實施例6
檢測4-1BB抗體阻斷4-1BB蛋白與其受體4-1BBL的結合
用表達4-1BB蛋白的CHO細胞檢測4-1BB抗體阻斷4-1BB蛋白與其受體4-1BBL的結合。
按照實施例4 B部分處理CHOK1-h4-1BB細胞株得到2×106
細胞/mL的單懸細胞,按每孔100微升加入到96孔FACS反應板中,加入實施例3所得的純化的4-1BB抗體待測樣品每孔50微升,再加入his-muCD8a-4-1BBLECD
(製作方法見實施例1)融合蛋白50微升,冰上孵育2小時。用FACS緩衝液離心洗滌2次,加入每孔100微升抗小鼠CD8a的螢光(Alexa 488)標記的二抗,冰上孵育1小時。用FACS緩衝液離心洗滌3次,加入每孔100微升固定液[4%(v/v)多聚甲醛]懸浮細胞,10分鐘後用FACS緩衝液離心洗滌2次。用100微升FACS緩衝液懸浮細胞,用FACS(FACS Calibur,購自BD公司)檢測和分析結果。結果如圖11和表15所示,表15說明,待測抗體可抑制4-1BB配體蛋白與4-1BB的結合。其中IgG對照為人IgG,表中的資料為相對於對照組(人IgG)全人4-1BB抗體對配體結合的抑制率。
實施例7
T淋巴細胞刺激實驗
(一)Ficoll分離全血獲取外周血單核淋巴細胞PBMC。
將新鮮獲取的全血用磷酸緩衝液PBS以1:1的體積比例稀釋得稀釋後的全血,用無菌吸管輕輕將稀釋後的全血鋪平在Ficoll液面(購自GE Healthcare),Ficoll與稀釋後的全血的體積比為3:4,避免震盪混勻,以400g轉速室溫20℃梯度離心30分鐘,離心後的離心管分為三層,上層為血漿,中間乳白色分層即為單核淋巴細胞。用無菌吸管輕輕吸取中間層細胞,收集至新的離心管,用PBS磷酸緩衝液稀釋至三倍體積,100g轉速室溫離心10分鐘,棄上清。將淋巴細胞用PBS磷酸緩衝液重懸至10mL,重複前面步驟取出血小板。最後將淋巴細胞重懸至10mL含有10%胎牛血清的多組份RPMI1640培養基(購自Invitrogen)備用,即為外周血單核淋巴細胞PBMC,所述百分比為品質百分比。
(二)T淋巴細胞刺激實驗
構建anti-CD3單鏈抗體在細胞膜上表達的CHOK1細胞株:為使anti-CD3(OKT3)(參見Kipriyanov et al. 1997, PEDS 10:445-453)嵌合的ScFv能錨定在細胞膜上,將該ScFv與mouse CD8a(NCBI Accession No: NP—
001074579.1)的C端113-220氨基酸序列連接,構建成質粒pIRES-OS8。質粒pIRES-OS8的製備方法參見Joe Sambrook,Molecular Cloning: A Laboratory Manual。將上述質粒pIRES-OS8轉染CHOK1細胞,按實施例1中所述的質粒轉染細胞的方法製備穩定傳代細胞株CHOK1- OS8,並將其作為T淋巴細胞刺激因數。同時配製等體積比稀釋的待測實施例2所得的純化的4-1BB抗體,得待測樣品溶液。
用T細胞提純試劑盒(購自Stemcell)按照廠家提供的方法從將實施例7步驟(一)獲得的人外周血單核淋巴細胞中純化人CD3陽性T細胞。將此CD3陽性的T細胞與細胞刺激因數CHOK1- OS8加入96孔細胞培養板,同時加入用抗人或大鼠Fc F(ab’)₂ 交聯好的待檢測抗體,最終每個反應孔有200微升的終體積。於37℃、5%CO2
培養箱共培養72小時後收集上清,將得到的細胞上清於-20℃凍存,上所述百分比為體積百分比。
(三)細胞上清中細胞因數伽馬干擾素(IFN-γ)或白介素IL-2酶聯免疫吸附檢測。
細胞上清中細胞因數伽馬干擾素(IFN-γ)或白介素IL-2酶聯免疫吸附檢測使用R&D system相關檢測試劑盒Human IFN-gamma Quantikin(DIF50)和Quantikine ELISA human IL-2(S2050),並按照說明書操作。除檢測抗體外的所有檢測試劑均由檢測試劑盒提供。
測定細胞上清中細胞因數伽馬干擾素(IFN-γ)或白介素IL-2含量的酶聯免疫吸附檢測採用雙抗夾心ELISA試劑盒(購自R&D Systems,IFN-γCat # DIF50和IL-2 Cat # S2050)。實驗操作嚴格按照試劑盒說明書要求,所有檢測試劑均由試劑盒提供。具體實驗簡述如下:將IFN-γ或IL-2多克隆抗體包被於ELISA微孔板上,將實施例5步驟(二)獲得的細胞上清液作為待測樣品,加入標準品和待測樣品室溫孵育2小時。每孔加入400微升洗液,重複洗板4次;再加入抗人IFN-γ或IL-2的辣根過氧化物酶標抗體,室溫孵育2小時,與微孔板上的IFN-γ或IL-2形成免疫複合物,清洗微孔;加入底物顯色,避光室溫30分鐘,最終加入終止液,用酶標儀測定A450nm吸光度。
檢測抗體在實施例7步驟(二)所述T細胞刺激實驗中對IFN-γ分泌的影響。結果如圖12,和表16所示,表16說明,在PBMC淋巴細胞刺激試驗中待測抗體可使PBMC的IFN-γ分泌增強。其中hIgG對照為人IgG,表中的資料為IFN-g值(pg/mL)。
檢測抗體在實施例7步驟(二)所述T細胞刺激實驗中對IL-2分泌的影響。表17和圖13說明,全人源化4-1BB抗體在T細胞刺激試驗中能夠刺激IL-2分泌。其中IgG對照為人IgG(hIgG),表中資料為IL-2值(pg/mL)。
實施例8
抗4-1BB抗體親和力的分析測定
使用Biacore T200儀器(購自)進行親和常數的測定。具體操作和方法根儀器說明書和廠家提供的詳細方法。用抗人Fc標記的感測器結合抗4-1BB全人源抗體,檢測五個不同梯度的帶his標籤的人4-1BB蛋白抗原與之結合解離情況。然後用軟體擬合得到解離常數與結合常數,親和力常數為解離常數與結合常數的比值。親和力檢測結果如表18所示。
實施例9 抗4-1BB抗體小鼠體內抗腫瘤活性評價
採用MC38同系小鼠模型,使用人4-1BB基因敲入的C57BL/6小鼠評價抗體在小鼠體內的抗腫瘤活性。實驗設計如下:
選擇人4-1BB基因敲入的C57BL/6小鼠,分為4組,每組6只,使用Utomilumab, Urelumab和同型抗體hIgG4作為對照,給藥樣品為113F6C6抗體。給藥途徑為腹腔注射,給藥劑量為3mg/kg(hIgG對照)、1 mg/kg(Utomilumab、Urelumab和113F6C6),在0、4、7、11、14、18天腹腔注射,每週兩次測量,測量腫瘤體積,小鼠體重及小鼠存活率。腫瘤體積(Tumor volume)計算公式為1/2*L長
*L短 2
。
結果如表20和圖15,16所示,本發明的抗體(113F6C6)能夠顯著抑制腫瘤生長,抑制效果顯著優於對照抗體Utomilumab和Urelumab。
對比例
以與本申請的抗體靶點相同的輝瑞公司的Utomilumab抗體(PF-05082566)作為對比抗體,進行對比試驗,試驗方法與實施例7完全一致。
結果如圖14和表19所示,本申請的4-1BB抗體相對於Utomilumab,能刺激T細胞分泌更多的IFN-γ細胞因數,對T細胞的啟動更強。
在本發明提及的所有文獻都在本申請中引用作為參考,就如同每一篇文獻被單獨引用作為參考那樣。此外應理解,在閱讀了本發明的上述講授內容之後,本領域技術人員可以對本發明作各種改動或修改,這些等價形式同樣落於本申請所附權利要求書所限定的範圍。
圖1顯示了4-1BB-hFc蛋白與融合蛋白his-muCD8a-4-1BBL的結合活性。
圖2顯示了4-1BB蛋白轉染的HEK293細胞FACS篩選檢測。
圖3顯示了ELISA檢測4-1BB免疫後Harbour轉基因小鼠血清抗體效價情況。
圖4A-圖4H分別顯示了ELISA檢測各個4-1BB全人源抗體與人4-1BB-hFc蛋白的結合反應。
圖5A和圖5B分別顯示了ELISA檢測各4-1BB全人源抗體與猴4-1BB-hFc蛋白的結合反應。
圖6A和圖6B分別顯示了ELISA檢測各4-1BB全人源抗體與猴4-1BB-hFc蛋白的結合反應。
圖7顯示了ELISA檢測4-1BB全人源抗體與其他免疫檢查點蛋白的結合反應。
圖8A-圖8E分別顯示了FACS檢測各4-1BB全人源抗體與CHOk1-h4-1BB的結合反應。
圖9A-圖9D分別顯示了FACS檢測各4-1BB全人源抗體與CHOk1-c4-1BB的結合反應。
圖10A和圖10B分別顯示了各4-1BB全人源抗體啟動NF-κB下游啟動子的報告基因實驗。
圖11顯示了4-1BB全人源抗體阻斷4-1BB蛋白與其配體4-1BBL的結合反應。
圖12顯示了4-1BB全人源抗體在T淋巴細胞刺激試驗中對IFN-γ分泌的影響。
圖13顯示了4-1BB全人源抗體在T淋巴細胞刺激試驗中對IL-2分泌的影響。
圖14顯示了以輝瑞公司的Utomilumab抗體作為對比抗體進行對比試驗的結果。
圖15顯示了4-1BB抗體對小鼠MC38腫瘤生長的實驗結果。
圖16顯示了不同抗體治療組的小鼠個體的腫瘤體積。
Claims (11)
- 一種抗體的重鏈可變區,其中所述的重鏈可變區包括以下三個互補決定區CDR:SEQ ID NO.:2所示的CDR1,SEQ ID NO.:3所示的CDR2,和SEQ ID NO.:4所示的CDR3;或者SEQ ID NO.:10所示的CDR1,SEQ ID NO.:11所示的CDR2,和SEQ ID NO.:12所示的CDR3。
- 一種抗體的重鏈,其中所述的重鏈具有如請求項1所述的重鏈可變區。
- 一種抗體的輕鏈可變區,其中所述的輕鏈可變區包括以下三個互補決定區CDR:SEQ ID NO.:6所示的CDR1’,SEQ ID NO.:7所示的CDR2’,和SEQ ID NO.:8所示的CDR3’;或者SEQ ID NO.:14所示的CDR1’,SEQ ID NO.:15所示的CDR2’,和SEO ID NO.:16所示的CDR3’。
- 一種抗體的輕鏈,其中所述的輕鏈具有如請求項3所述的輕鏈可變區。
- 一種抗體,其中所述抗體具有:(1)如請求項1所述的重鏈可變區;和/或(2)如請求項3所述的輕鏈可變區;或者,所述抗體具有:如請求項2所述的重鏈;和/或如請求項4所述的輕鏈。
- 如請求項5所述的抗體,其中所述的抗體的重鏈可變區序列如SEQ ID NO.:1所示;和/或所述的抗體的輕鏈可變區序列如SEQ ID NO.:5所示。
- 如請求項5所述的抗體,其中所述的抗體的重鏈可變區序列如SEQ ID NO.:9所示;和/或所述的抗體的輕鏈可變區序列如SEQ ID NO.:13所示。
- 一種重組蛋白,其中所述的重組蛋白具有:(i)如請求項1所述的重鏈可變區、如請求項2所述的重鏈、如請求項3所述的輕鏈可變區、如請求項4所述的輕鏈、或如請求項5所述的抗體;以及(ii)任選的協助表達和/或純化的標籤序列。
- 一種CAR構建物,其中所述的CAR構建物的單克隆抗體抗原結合區域的scFV段為特異性結合於4-1BB的結合區,並且所述scFv具有如請求項1所述的重鏈可變區和如請求項3所述的輕鏈可變區。
- 一種活性成分的用途,所述活性成分選自下組:如請求項1所述的重鏈可變區、如請求項2所述的重鏈、如請求項3所述的輕鏈可變區、如請求項4所述的輕鏈、或如請求項5所述的抗體、如請求項8所述的重組蛋白、或其組合,其中所述活性成分用於製備預防和/或治療4-1BB相關疾病的藥物。
- 一種活性成分的用途,所述活性成分選自下組:如請求項1所述的重鏈可變區、如請求項2所述的重鏈、如請求項3所述的輕鏈可變區、如請求項4所述的輕鏈、或如請求項5所述的抗體、如請求項8所述的重組蛋白、或其組合,其中所述活性成分用於製備檢測試劑或試劑盒。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201711099446.4 | 2017-11-09 | ||
| ??201711099446.4 | 2017-11-09 | ||
| CN201711099446 | 2017-11-09 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| TW201922784A TW201922784A (zh) | 2019-06-16 |
| TWI701259B true TWI701259B (zh) | 2020-08-11 |
Family
ID=66438758
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| TW107139554A TWI701259B (zh) | 2017-11-09 | 2018-11-07 | 4﹘1bb抗體及其製備方法和應用 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US11555077B2 (zh) |
| EP (1) | EP3708582A4 (zh) |
| JP (1) | JP7215759B2 (zh) |
| CN (1) | CN109762066B (zh) |
| TW (1) | TWI701259B (zh) |
| WO (1) | WO2019091436A1 (zh) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN112010973B (zh) * | 2019-05-30 | 2022-08-16 | 山东博安生物技术股份有限公司 | 一种抗4-1bb抗体、含有其的组合物及其应用 |
| AU2020308463A1 (en) * | 2019-06-26 | 2022-02-17 | Ap Biosciences, Inc. | Antibodies for T-cell activation |
| CN114555638B (zh) * | 2019-10-11 | 2023-08-22 | 南京维立志博生物科技有限公司 | 结合4-1bb的抗体及其用途 |
| CN112794905B (zh) * | 2019-11-13 | 2022-10-04 | 合肥瀚科迈博生物技术有限公司 | 一种能够与人4-1bb结合的分子 |
| CN112898426A (zh) * | 2019-11-19 | 2021-06-04 | 非同(成都)生物科技有限公司 | 人源化4-1bb单克隆抗体及其药物组合物 |
| CN113004416B (zh) * | 2019-12-19 | 2022-10-04 | 合肥瀚科迈博生物技术有限公司 | 靶向her2-cd137双特异性抗体的构建及其应用 |
| CN113004415B (zh) * | 2019-12-19 | 2022-09-30 | 合肥瀚科迈博生物技术有限公司 | 靶向her2和4-1bb的双特异性抗体及其应用 |
| TW202144395A (zh) * | 2020-02-12 | 2021-12-01 | 日商中外製藥股份有限公司 | 用於癌症之治療的抗cd137抗原結合分子 |
| MX2023009100A (es) | 2021-02-03 | 2023-09-25 | Mozart Therapeutics Inc | Agentes aglutinantes y métodos para usar los mismos. |
| WO2023076876A1 (en) | 2021-10-26 | 2023-05-04 | Mozart Therapeutics, Inc. | Modulation of immune responses to viral vectors |
| WO2024040195A1 (en) | 2022-08-17 | 2024-02-22 | Capstan Therapeutics, Inc. | Conditioning for in vivo immune cell engineering |
| WO2024249954A1 (en) | 2023-05-31 | 2024-12-05 | Capstan Therapeutics, Inc. | Lipid nanoparticle formulations and compositions |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TWI332844B (en) * | 2003-10-10 | 2010-11-11 | Bristol Myers Squibb Co | Fully human antibodies against human 4-1bb |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6303121B1 (en) | 1992-07-30 | 2001-10-16 | Advanced Research And Technology | Method of using human receptor protein 4-1BB |
| ES2185770T3 (es) * | 1995-04-08 | 2003-05-01 | Lg Chemical Ltd | Anticuerpo monoclonal especifico para 4-1bb humano y linea celular que lo produce. |
| CN1289668C (zh) * | 2003-06-12 | 2006-12-13 | 北京安波特基因工程技术有限公司 | 一种用于抗体改形的体外分子定向进化方法 |
| US7288638B2 (en) | 2003-10-10 | 2007-10-30 | Bristol-Myers Squibb Company | Fully human antibodies against human 4-1BB |
| CN101628940B (zh) * | 2008-07-15 | 2011-11-23 | 中国科学院生物物理研究所 | 一种单克隆抗体及其应用 |
| KR101527300B1 (ko) * | 2010-09-09 | 2015-06-09 | 화이자 인코포레이티드 | 4-1bb 결합 분자 |
| JP2018508509A (ja) * | 2015-02-22 | 2018-03-29 | ソレント・セラピューティクス・インコーポレイテッド | Cd137に結合する抗体医薬 |
| SG10202007987QA (en) * | 2015-04-06 | 2020-09-29 | Subdomain Llc | De novo binding domain containing polypeptides and uses thereof |
| WO2017049452A1 (zh) * | 2015-09-22 | 2017-03-30 | 苏州丁孚靶点生物技术有限公司 | 抗人cd137的完全人抗体及其应用 |
| CN106199005B (zh) | 2016-07-26 | 2019-02-01 | 浙江大学 | 采用cd137表达量检测淋巴细胞抗大肠癌活性的方法 |
-
2018
- 2018-11-07 TW TW107139554A patent/TWI701259B/zh active
- 2018-11-08 CN CN201811327486.4A patent/CN109762066B/zh active Active
- 2018-11-08 EP EP18876555.6A patent/EP3708582A4/en active Pending
- 2018-11-08 JP JP2020544094A patent/JP7215759B2/ja active Active
- 2018-11-08 US US16/762,871 patent/US11555077B2/en active Active
- 2018-11-08 WO PCT/CN2018/114641 patent/WO2019091436A1/zh unknown
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TWI332844B (en) * | 2003-10-10 | 2010-11-11 | Bristol Myers Squibb Co | Fully human antibodies against human 4-1bb |
Also Published As
| Publication number | Publication date |
|---|---|
| CN109762066A (zh) | 2019-05-17 |
| US20200347144A1 (en) | 2020-11-05 |
| US11555077B2 (en) | 2023-01-17 |
| JP7215759B2 (ja) | 2023-01-31 |
| TW201922784A (zh) | 2019-06-16 |
| EP3708582A4 (en) | 2021-12-01 |
| JP2021502407A (ja) | 2021-01-28 |
| WO2019091436A1 (zh) | 2019-05-16 |
| CN109762066B (zh) | 2020-12-11 |
| EP3708582A1 (en) | 2020-09-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TWI701259B (zh) | 4﹘1bb抗體及其製備方法和應用 | |
| WO2022042690A1 (zh) | Ccr8抗体及其应用 | |
| TWI673287B (zh) | 抗b7-h3抗體、其抗原結合片段及其醫藥用途 | |
| US11525005B2 (en) | Anti-CD40 antibody, antigen binding fragment thereof and medical use thereof | |
| WO2020094071A1 (zh) | Nkg2a抗体及其制备方法和应用 | |
| US10981983B2 (en) | Antibody targeting interleukin 17A and preparation method and application thereof | |
| CN112243443B (zh) | 抗trop-2抗体、其抗原结合片段及其医药用途 | |
| CN115109156A (zh) | 一种靶向bcma的纳米抗体及其应用 | |
| CN115298216A (zh) | 抗体或其抗原结合片段、其制备方法及医药用途 | |
| WO2022228183A1 (zh) | 抗siglec15抗体及其制备方法和用途 | |
| JP2024502091A (ja) | Pd-1結合分子およびその使用 | |
| WO2019238074A1 (zh) | 一种高亲和力高生物活性的lag-3抗体及其应用 | |
| WO2019192493A1 (zh) | 抗人lag-3单克隆抗体及其应用 | |
| WO2023029089A1 (zh) | 抗cd3人源化抗体 | |
| CN113461820B (zh) | 抗cd3人源化抗体 | |
| CN118043354A (zh) | 抗tnfr2单克隆抗体及其应用 | |
| WO2022068891A1 (zh) | Pd-1抗体及其制备方法与应用 | |
| RU2792748C2 (ru) | Антитело к b7-h4, его антигенсвязывающий фрагмент и его фармацевтическое применение | |
| RU2779128C2 (ru) | Антитело к cd40, его антигенсвязывающий фрагмент и его медицинское применение | |
| CN117186235A (zh) | 抗4-1BB/抗EGFRvⅢ的双特异抗体及其制备方法和应用 | |
| WO2024193669A1 (zh) | 抗tnfr2/抗pd-1或ctla-4双特异性抗体及其应用 | |
| WO2024187743A1 (zh) | 抗cd27单克隆抗体及其应用 | |
| TW202438528A (zh) | 特異性結合Claudin 18.2的抗體及其製法和應用 | |
| WO2024193665A1 (zh) | 抗pd-1/抗tigit双特异性抗体与il-2的融合蛋白及应用 | |
| CN115785269A (zh) | 抗pd-l1的抗体及其应用 |