RU2678097C2 - Композиции антитела и белка - Google Patents
Композиции антитела и белка Download PDFInfo
- Publication number
- RU2678097C2 RU2678097C2 RU2015111341A RU2015111341A RU2678097C2 RU 2678097 C2 RU2678097 C2 RU 2678097C2 RU 2015111341 A RU2015111341 A RU 2015111341A RU 2015111341 A RU2015111341 A RU 2015111341A RU 2678097 C2 RU2678097 C2 RU 2678097C2
- Authority
- RU
- Russia
- Prior art keywords
- composition
- antibody
- tfpi
- protein
- salt
- Prior art date
Links
- 239000000203 mixture Substances 0.000 title claims abstract description 141
- 102000004169 proteins and genes Human genes 0.000 title description 84
- 108090000623 proteins and genes Proteins 0.000 title description 84
- 239000004475 Arginine Substances 0.000 claims abstract description 31
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 claims abstract description 31
- 238000000034 method Methods 0.000 claims abstract description 23
- 150000001413 amino acids Chemical group 0.000 claims abstract description 22
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 claims abstract description 21
- 208000009292 Hemophilia A Diseases 0.000 claims abstract description 15
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 claims abstract description 13
- 229930182817 methionine Natural products 0.000 claims abstract description 13
- 102100026735 Coagulation factor VIII Human genes 0.000 claims abstract description 12
- 101000911390 Homo sapiens Coagulation factor VIII Proteins 0.000 claims abstract description 12
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 claims abstract description 12
- 239000004472 Lysine Substances 0.000 claims abstract description 12
- 235000000346 sugar Nutrition 0.000 claims abstract description 12
- 102100022641 Coagulation factor IX Human genes 0.000 claims abstract description 11
- 201000003542 Factor VIII deficiency Diseases 0.000 claims abstract description 11
- 208000009429 hemophilia B Diseases 0.000 claims abstract description 10
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims abstract description 9
- 239000002736 nonionic surfactant Substances 0.000 claims abstract description 9
- 150000005846 sugar alcohols Chemical class 0.000 claims abstract description 9
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 claims abstract description 8
- 235000004279 alanine Nutrition 0.000 claims abstract description 8
- 229930006000 Sucrose Natural products 0.000 claims description 27
- 102100030951 Tissue factor pathway inhibitor Human genes 0.000 claims description 27
- 108010013555 lipoprotein-associated coagulation inhibitor Proteins 0.000 claims description 27
- 239000005720 sucrose Substances 0.000 claims description 27
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 claims description 26
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 claims description 26
- 229920000136 polysorbate Polymers 0.000 claims description 23
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 claims description 16
- 229920000053 polysorbate 80 Polymers 0.000 claims description 16
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 claims description 14
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 claims description 14
- 239000004471 Glycine Substances 0.000 claims description 13
- 229950008882 polysorbate Drugs 0.000 claims description 11
- 229920001213 Polysorbate 20 Polymers 0.000 claims description 8
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 claims description 8
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 claims description 8
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 claims description 7
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 claims description 7
- 229930195725 Mannitol Natural products 0.000 claims description 7
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 claims description 7
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 claims description 7
- 239000008121 dextrose Substances 0.000 claims description 7
- 239000008103 glucose Substances 0.000 claims description 7
- 239000000594 mannitol Substances 0.000 claims description 7
- 235000010355 mannitol Nutrition 0.000 claims description 7
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 claims description 6
- 229940068977 polysorbate 20 Drugs 0.000 claims description 6
- 229940068968 polysorbate 80 Drugs 0.000 claims description 6
- 229910017053 inorganic salt Inorganic materials 0.000 claims description 5
- 239000004094 surface-active agent Substances 0.000 claims description 3
- 125000000185 sucrose group Chemical group 0.000 claims 1
- 150000003839 salts Chemical class 0.000 abstract description 17
- 230000000694 effects Effects 0.000 abstract description 8
- 239000000126 substance Substances 0.000 abstract description 4
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 abstract description 2
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 abstract description 2
- 239000003814 drug Substances 0.000 abstract description 2
- 235000018102 proteins Nutrition 0.000 description 83
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 38
- 235000009697 arginine Nutrition 0.000 description 26
- 239000011780 sodium chloride Substances 0.000 description 19
- 239000000243 solution Substances 0.000 description 18
- 235000014304 histidine Nutrition 0.000 description 16
- 238000002347 injection Methods 0.000 description 11
- 239000007924 injection Substances 0.000 description 11
- 235000001014 amino acid Nutrition 0.000 description 8
- 229940024606 amino acid Drugs 0.000 description 8
- -1 for example Chemical class 0.000 description 8
- 239000007788 liquid Substances 0.000 description 8
- 235000018977 lysine Nutrition 0.000 description 8
- 239000003381 stabilizer Substances 0.000 description 8
- 230000036252 glycation Effects 0.000 description 6
- 229920001983 poloxamer Polymers 0.000 description 6
- 241000894007 species Species 0.000 description 6
- 238000010254 subcutaneous injection Methods 0.000 description 6
- 239000007929 subcutaneous injection Substances 0.000 description 6
- 208000031220 Hemophilia Diseases 0.000 description 4
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 4
- 230000002776 aggregation Effects 0.000 description 4
- 238000004220 aggregation Methods 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 4
- 208000035475 disorder Diseases 0.000 description 4
- 238000005259 measurement Methods 0.000 description 4
- 230000007170 pathology Effects 0.000 description 4
- 239000000546 pharmaceutical excipient Substances 0.000 description 4
- 229920000642 polymer Polymers 0.000 description 4
- 150000003077 polyols Chemical class 0.000 description 4
- 238000001556 precipitation Methods 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 3
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 3
- 239000005977 Ethylene Substances 0.000 description 3
- 239000004743 Polypropylene Substances 0.000 description 3
- 239000002552 dosage form Substances 0.000 description 3
- 238000001914 filtration Methods 0.000 description 3
- 238000004811 liquid chromatography Methods 0.000 description 3
- 238000004949 mass spectrometry Methods 0.000 description 3
- 238000004848 nephelometry Methods 0.000 description 3
- 238000006386 neutralization reaction Methods 0.000 description 3
- 229940116406 poloxamer 184 Drugs 0.000 description 3
- 229940044519 poloxamer 188 Drugs 0.000 description 3
- 229920005862 polyol Polymers 0.000 description 3
- 229920001155 polypropylene Polymers 0.000 description 3
- 230000001954 sterilising effect Effects 0.000 description 3
- 150000008163 sugars Chemical class 0.000 description 3
- 238000000108 ultra-filtration Methods 0.000 description 3
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- 101000653189 Homo sapiens Tissue factor pathway inhibitor Proteins 0.000 description 2
- 108060003951 Immunoglobulin Proteins 0.000 description 2
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 2
- 230000023555 blood coagulation Effects 0.000 description 2
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical compound [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 230000015271 coagulation Effects 0.000 description 2
- 238000005345 coagulation Methods 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 229940126534 drug product Drugs 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 102000018358 immunoglobulin Human genes 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000010255 intramuscular injection Methods 0.000 description 2
- 239000007927 intramuscular injection Substances 0.000 description 2
- 238000010253 intravenous injection Methods 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 229910001629 magnesium chloride Inorganic materials 0.000 description 2
- 230000003204 osmotic effect Effects 0.000 description 2
- 230000003647 oxidation Effects 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- 230000035515 penetration Effects 0.000 description 2
- 238000002823 phage display Methods 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- 229940068965 polysorbates Drugs 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 230000004845 protein aggregation Effects 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 238000003998 size exclusion chromatography high performance liquid chromatography Methods 0.000 description 2
- VGTPCRGMBIAPIM-UHFFFAOYSA-M sodium thiocyanate Chemical compound [Na+].[S-]C#N VGTPCRGMBIAPIM-UHFFFAOYSA-M 0.000 description 2
- 238000001179 sorption measurement Methods 0.000 description 2
- 230000000451 tissue damage Effects 0.000 description 2
- 231100000827 tissue damage Toxicity 0.000 description 2
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 108010039209 Blood Coagulation Factors Proteins 0.000 description 1
- 102000015081 Blood Coagulation Factors Human genes 0.000 description 1
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 1
- 108010076282 Factor IX Proteins 0.000 description 1
- 108010054218 Factor VIII Proteins 0.000 description 1
- 102000001690 Factor VIII Human genes 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- ZRALSGWEFCBTJO-UHFFFAOYSA-N Guanidine Chemical group NC(N)=N ZRALSGWEFCBTJO-UHFFFAOYSA-N 0.000 description 1
- 208000032843 Hemorrhage Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 206010022086 Injection site pain Diseases 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- WMFYOYKPJLRMJI-UHFFFAOYSA-N Lercanidipine hydrochloride Chemical compound Cl.COC(=O)C1=C(C)NC(C)=C(C(=O)OC(C)(C)CN(C)CCC(C=2C=CC=CC=2)C=2C=CC=CC=2)C1C1=CC=CC([N+]([O-])=O)=C1 WMFYOYKPJLRMJI-UHFFFAOYSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 241000276498 Pollachius virens Species 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 239000008351 acetate buffer Substances 0.000 description 1
- 239000008186 active pharmaceutical agent Substances 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 1
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 1
- 235000011130 ammonium sulphate Nutrition 0.000 description 1
- SOIFLUNRINLCBN-UHFFFAOYSA-N ammonium thiocyanate Chemical compound [NH4+].[S-]C#N SOIFLUNRINLCBN-UHFFFAOYSA-N 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 150000001450 anions Chemical class 0.000 description 1
- 230000010100 anticoagulation Effects 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 230000000740 bleeding effect Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 239000003114 blood coagulation factor Substances 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 239000002577 cryoprotective agent Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 229940088679 drug related substance Drugs 0.000 description 1
- 229960004222 factor ix Drugs 0.000 description 1
- 229960000301 factor viii Drugs 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 235000004554 glutamine Nutrition 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 208000031169 hemorrhagic disease Diseases 0.000 description 1
- 210000004408 hybridoma Anatomy 0.000 description 1
- 239000000819 hypertonic solution Substances 0.000 description 1
- 229940021223 hypertonic solution Drugs 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 1
- 235000019341 magnesium sulphate Nutrition 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 238000005191 phase separation Methods 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 230000001766 physiological effect Effects 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 235000013930 proline Nutrition 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 229940124272 protein stabilizer Drugs 0.000 description 1
- 230000004850 protein–protein interaction Effects 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052938 sodium sulfate Inorganic materials 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 235000008521 threonine Nutrition 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- JIAARYAFYJHUJI-UHFFFAOYSA-L zinc dichloride Chemical compound [Cl-].[Cl-].[Zn+2] JIAARYAFYJHUJI-UHFFFAOYSA-L 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39591—Stabilisation, fragmentation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/16—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing nitrogen, e.g. nitro-, nitroso-, azo-compounds, nitriles, cyanates
- A61K47/18—Amines; Amides; Ureas; Quaternary ammonium compounds; Amino acids; Oligopeptides having up to five amino acids
- A61K47/183—Amino acids, e.g. glycine, EDTA or aspartame
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/20—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing sulfur, e.g. dimethyl sulfoxide [DMSO], docusate, sodium lauryl sulfate or aminosulfonic acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/22—Heterocyclic compounds, e.g. ascorbic acid, tocopherol or pyrrolidones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/19—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles lyophilised, i.e. freeze-dried, solutions or dispersions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/04—Antihaemorrhagics; Procoagulants; Haemostatic agents; Antifibrinolytic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/38—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against protease inhibitors of peptide structure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/40—Immunoglobulins specific features characterized by post-translational modification
- C07K2317/41—Glycosylation, sialylation, or fucosylation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Immunology (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Dermatology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Endocrinology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
Группа изобретений относится к медицине и касается свободной от соли композиции антитела к TFPI для лечения гемофилии А или гемофилии В у пациента, включающей гистидин, неионное поверхностно-активное вещество, сахар или сахарный спирт, аргинин, лизин или аланин, метионин и человеческое IgGантитело к TFPI, содержащее легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 1, и тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 2. Где указанная композиция имеет значение рН, которое колеблется от рН 4,0 до рН 6,0 и где указанная композиция существенно не содержит неорганической соли. Группа изобретений также касается способа лечения гемофилии А или гемофилии В у пациента, включающего введение пациенту терапевтически эффективного количества композиции. Группа изобретений обеспечивает повышенную растворимость и стабильность антитела к TFPI в композиции. 3 н. и 6 з.п. ф-лы, 4 пр., 2 ил., 7 табл.
Description
Данная заявка является поданной 28 августа 2013 г. как международная патентная заявка РСТ. Она заявляет приоритет в соответствии с патентной заявкой США с регистрационным номером 13/601,598, поданной 31 августа 2012 г., и патентной заявкой США с регистрационным номером 13/843,780, поданной 15 марта 2013 г., раскрытие которых является введенным в данную заявку в качестве ссылки в их целостности.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Данная заявка в общем случае относится к композициям антитела и другого белка, которые являются изотоническими и имеют низкую вязкость, включая композиции, которые являются полезными для инъекции и общего введения.
Пациенты с гемофилией имеют расстройства кровотечения, что приводит к задержке свертывания крови после повреждения или хирургии. Длительное кровотечение вызывается генетической патологией одного или более факторов свертывания крови. Два общих типа гемофилии являются известными - гемофилия А и гемофилия В. Гемофилия А вызывается патологией фактора VIII, в то время как гемофилия В вызывается патологией фактора IX. Приблизительно 75-80% от общего количества пациентов с гемофилией имеют гемофилию А.
Ингибитор пути тканевого фактора (TFPI) представляет собой человеческий ингибитор несвойственного пути коагуляции крови и функционирует при антикоагуляции. Антитела, которые являются направленными против TFPI, включая моноклональные антитела к TFPI (aTFPI МАТ), разрабатываются с целью блокирования функции TFPI. Одно такое aTFPI МАТ представляет собой человеческое IgG2 анти-TFPI МАТ, которое было разработано для лечения пациентов с гемофилией А и В.
Антитела и другие белки могут вводиться пациентам путем внутривенной, внутримышечной и/или подкожной инъекции. Для того, чтобы обеспечить удобства для пациента, является желательным, чтобы дозированные формы для подкожной инъекции были изотоническими и включали небольшие объемы инъекции (<2,0 мл на сайт инъекции). Для снижения объема введения, белки часто вводятся в интервале от 1 мг/мл до 150 мг/мл.
В то время как жидкие, так и лиофилизированные дозированные формы используются для лекарственных продуктов на основе антитела и другого белка, которые в настоящее время продаются на рынке, лиофилизированные формы более часто используются для лекарственных продуктов на основе белка и антитела, которые имеют высокие концентрации белка.
Дозированная форма белка и антитела может вызывать множество проблем при разработке рецептуры, в частности для жидкой композиции. Для композиций, в которых концентрация белка находится рядом с границей предельного насыщения его раствора, может иметь место разделение фаз путем осаждения, образования геля и/или кристаллизации. При высокой концентрации белка стабильность антитела или другого белка может становится проблематичной по причине образования растворимых и нерастворимых агрегатов белок-белок.
Композиции с высокой концентрацией белка часто имеют высокую вязкость, что создает трудности для обработки такой, как ультрафильтрация и стерилизующее фильтрование, а также для инъекции дозированного раствора. Кроме того, при концентрациях белка, которые являются желательными для композиций, предназначенных для внутримышечного или подкожного введения, высокие концентрации стабилизаторов, таких как сахароза и хлорид натрия, являются необходимыми для долгосрочной стабильности белка. Полученные гипертонические растворы часто вызывают боль при инъекции по причине повреждения тканей. Таким образом, является важным сбалансировать количество стабилизаторов для стабильности и осмоляльности композиции с высокой концентрацией белка.
По этой причине в области техники существует потребность в терапевтических композициях на основе антитела и другого белка в жидкой форме, которые демонстрируют высокие концентрации белка при отсутствии проблемы со значительно повышенной агрегацией белка, осмоляльностью или вязкостью, и/или сниженной стабильностью белка. Является, таким образом, желательным, чтобы композиции на основе антитела и другого белка содержали ограниченные количества наполнителей и малые объемы для облегчения терапевтического введения или доставки. Является также желательным, чтобы терапевтические композиции на основе антитела и другого белка были пригодными для лиофилизации с целью повышения стабильности белка при условиях длительного хранения.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Данное описание обеспечивает жидкие и лиофилизированные композиции на основе антитела и белка, которые являются существенно изотоническими и имеют низкую вязкость, а также существенно не содержат никакой неорганической соли. Композиции антитела и другого белка, представленные в данной заявке, содержат от приблизительно 0 мМ до приблизительно 30 мМ гистидина; от приблизительно 50 част, на млн. до приблизительно 200 част, на млн. неионного поверхностно-активного вещества такого, как, например, полисорбат (Твин®) 80 или полисорбат (Твин®) 20; от приблизительно 88 мМ до приблизительно 292 мМ сахара или сахарного спирта такого, как, например, маннит, декстроза, глюкоза, трегалоза и/или сахароза; от приблизительно 0 мМ до приблизительно 50 мМ аргинина; от приблизительно 0 мМ до приблизительно 50 мМ лизина; от приблизительно 0 мМ до приблизительно 133 мМ глицина или аланина; от приблизительно 0 мМ до приблизительно 10 мМ метионина; и от приблизительно 1 мг/мл до приблизительно 150 мг/мл белка при рН от приблизительно рН 4,0 до приблизительно рН 6,0. Композиции, которые раскрываются в данной заявке, демонстрируют вязкость, которая колеблется от приблизительно 1 мПа-сек. до приблизительно 20 мПа-сек. при 22°С, или от приблизительно 1 мПа-сек. до приблизительно 15 мПа-сек. при 22°С, или от приблизительно 1 мПа-сек. до приблизительно 10 мПа-сек. при 22°С или от приблизительно 1 мПа-сек. до приблизительно 8 мПа-сек. при 22°С или от приблизительно 1 мПа-сек. до приблизительно 6 мПа-сек. при 22°С, и осмоляльность, которая колеблется от приблизительно 240 до приблизительно 380 ммоль/кг.
В рамках дополнительных аспектов данное описание обеспечивает способы лечения расстройства у пациента, которые включают введение пациенту терапевтически эффективного количества одной или более композиций, описанных в данной заявке. Например, обеспечиваются способы лечения расстройства у пациента, которые включают введение пациенту терапевтически эффективного количества композиции антитела или другого белка, как описывается более подробно в данной заявке.
Эти и другие признаки настоящего описания являются представленными в данной заявке.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Квалифицированный специалист в данной области техники поймет, что фигуры, описанные ниже, являются приведенными только с целью иллюстрации. Рисунки не являются предназначенными для ограничения объема настоящего изобретения каким-либо образом.
ФИГ. 1 представляет собой графическое представление влияние концентрации хлорида натрия (NaCl) на помутнение композиции на основе 20 мг/мл анти-TFPI МАТ при рН 5,5.
ФИГ. 2 представляет собой графическое представление влияние рН на помутнение лекарственного вещества на основе анти-TFPI МАТ.
ОПИСАНИЕ РАЗЛИЧНЫХ ВОПЛОЩЕНИЙ
Как описывается выше, данное раскрытие обеспечивает композиции антитела и другого белка, которые стабилизируют антитело или другой белок в жидкой форме или лиофилизированной форме при предполагаемых условиях хранения. Композиции, описанные в данной заявке, включают один или более фармацевтически приемлемых наполнителей или стабилизаторов, содержатся в забуференной среде при приемлемом значении рН и являются существенно изоосмотическими с физиологическими жидкостями. Для системного введения инъекция представляет собой один из путей введения, включая внутримышечную, внутривенную, интраперитонеальную и подкожную инъекцию.
По причине их низкой вязкости раскрытые в настоящей заявке белковые композиции могут подвергаться традиционной обработке путем, например, ультрафильтрации и стерилизующего фильтрования и могут вводиться пациенту путем инъекции, включая подкожную инъекцию. Кроме того, поскольку они являются изоосмотическими, раскрытые в настоящей заявке композиции антитела и белка снижают повреждение ткани или другие вредные физиологические эффекты и, таким образом, достигается благоприятная переносимость пациентом и улучшенное соблюдение режима пациентом.
Композиции, описанные в данной заявке, характеризуются существенным отсутствием добавляемой соли, что обеспечивает гибкость для повышения концентраций других стабилизаторов таких, как сахароза, при одновременном поддержании осмоляльности композиции для улучшенной in vivo переносимости и, следовательно, улучшенного соблюдения режима пациентом. Кроме того, низкая вязкость описанных в данной заявке композиций позволяет осуществлять удобную обработку, включая, но не ограничиваясь таковыми, ультрафильтрацию и стерилизующее фильтрование, а также инъекцию раствора лекарственного продукта посредством иглы.
Как используется в данной заявке, термин "вязкость" относится к сопротивлению жидкой композиции к перетеканию, так, например, тогда, когда вводится через иглу шприца во время введения пациенту. Измерения вязкости могут быть сделаны с помощью методики конуса и плоскости при использовании элемента Пельтье, установленного при определенных температурах, таких как 22°С, как описано в данной заявке. Типично, хорошо определенный градиент напряжения сдвига прикладывается к жидкой композиции, и измеряется показатель сдвига. Вязкость представляет собой соотношение сдвигового стресса к показателю сдвига. Как используется в данной заявке, вязкость выражается в единицах мПа-сек. при 22°С, где 1 мПа-сек. = 1 сантипуазу. Низкая вязкость существенно изоосмотической композиции, раскрытой в данной заявке, типично характеризуется наличием вязкости, которая колеблется от приблизительно 1 мПа-сек. до приблизительно 20 мПа сек. при 22°С, или от приблизительно 1 мПа-сек. до приблизительно 15 мПа-сек. при 22°С, или от приблизительно 1 мПа-сек. до приблизительно 10 мПа-сек. при 22°С, или от приблизительно 1 мПа-сек. до приблизительно 8 мПа-сек. при 22°С, или от приблизительно 1 мПа-сек. до приблизительно 6 мПа-сек. при 22°С.
Как используется в данной заявке, термин "осмоляльность" относится к мере концентрации растворенного вещества, которая определяется как количество ммолей растворенного вещества на кг раствора. Желаемый уровень осмоляльности может быть достигнут путем прибавления одного или более стабилизаторов таких, как сахар или сахарный спирт, включая, но без ограничения таковыми, маннит, дектрозу, глюкозу, трегалозу и/или сахарозу. Дополнительные стабилизаторы, которые могут быть приемлемыми для обеспечения осмоляльности, описываются в ссылках таких, как руководство Pharmaceutical Excipients (4-ое издание, Royal Pharmaceutical Society of Great Britain, Science & Practice Publishers) или Remingtons: The Science и Practice of Pharmacy (9-ое издание, Mack Publishing Company).
Как используется в данной заявке, термин "приблизительно" относится к +/- 10% от обеспечиваемого значения единицы. Как используется в данной заявке, термин "существенно" относится к качественному условию демонстрации полной или приблизительной степени характеристики или свойства, которое представляет интерес. Средний специалист в области биологии поймет, что биологические и химические явления редко, если вообще это является возможным, достигают или устраняют абсолютный результат. Термин существенно, таким образом, используется в данной заявке для охвата потенциального отсутствия завершенности, присущей многим биологическим и химическим явлениям. Как используется в данной заявке, термины "изоосмотический" и "изотонический" используются попеременно с терминами "существенно изоосмотический" и "существенно изотонический" и относятся к композиции, которая характеризуется наличием осмотического давления, которое является таким же, как или, по крайней мере, существенно эквивалентным осмотическому давлению другого раствора, которое достигается при использовании композиции, где общая концентрация растворенных веществ, включая как способные к проникновению, так и неспособные к проникновению, растворенные вещества, в композиции является такой же или, по крайней мере, существенно эквивалентной общему количеству растворенных веществ в другом растворе. Таким образом, в то время как специалистам в данной области техники должно быть понятным, что "изоосмотическая" и "изотоническая" композиции, которые используются для in vivo введения, в общем случае имеют осмоляльность, которая колеблется от приблизительно 270 ммоль/кг до приблизительно 310 ммоль/кг, в контексте композиции низкой вязкости в соответствии с настоящим описанием термины "изоосмотический", "изотонический", "существенно изоосмотический" и "существенно изотонический" используются попеременно по отношению к композиции, которая имеет осмоляльность, которая колеблется от приблизительно 240 ммоль/кг до приблизительно 380 ммоль/кг или от приблизительно 270 ммоль/кг до приблизительно 370 ммоль/кг, или от приблизительно 300 ммоль/кг до приблизительно 330 ммоль/кг.
Раскрытая в настоящей заявке композиция изоосмотического антитела и другого белка низкой вязкости существенно содержит от приблизительно 0 мМ до приблизительно 30 мМ гистидина; от приблизительно 50 част, на млн. до приблизительно 200 част, на млн. неионного поверхностно-активного вещества такого как, например, полисорбат (Твин®) 80 или полисорбат (Твин®) 20; от приблизительно 88 мМ до приблизительно 292 мМ сахара или сахарного спирта, такого как, например, маннит, декстроза, глюкоза, трегалоза и/или сахароза; от приблизительно 0 мМ до приблизительно 50 мМ аргинина; от приблизительно 0 мМ до приблизительно 50 мМ лизина; от приблизительно 0 мМ до приблизительно 133 мМ глицина или аланина; от приблизительно 0 мМ до приблизительно 10 мМ метионина; и от приблизительно 1 мг/мл до приблизительно 150 мг/мл белка при рН от приблизительно рН 4 до приблизительно рН 6. Композиции, раскрытые в данной заявке, демонстрируют вязкость, которая колеблется от приблизительно 1 мПа-сек. до приблизительно 20 мПа-сек. при 22°С или от приблизительно 1 мПа-сек. до приблизительно 15 мПа-сек. при 22°С, или от приблизительно 1 мПа-сек. до приблизительно 10 мПа-сек. при 22°С, или от приблизительно 1 мПа-сек. до приблизительно 8 мПа-сек. при 22°С, или от приблизительно 1 мПа-сек. до приблизительно 6 мПа-сек. при 22°С, и осмоляльность, которая колеблется от приблизительно 240 до приблизительно 380 ммоль/кг.
В этой композиции гистидин представляет собой буферный агент, который может использоваться для поддержания значения рН композиции от приблизительно рН 4,0 до приблизительно рН 6,0, или приблизительно рН 5 до приблизительно рН 6, такого как приблизительно рН 5, приблизительно рН 5,5, или приблизительно рН 6. Сахар или сахарные спирты такие, как маннит, декстроза, глюкоза, трегалоза и/или сахароза, используются отдельно или в комбинации, оба в качестве криопротекторов и могут стабилизировать антитело в жидкой композиции, а также в процессе и после лиофилизации. Неионные поверхностно-активные вещества такие, как полисорбаты, включая полисорбат 20 и полисорбат 80; полоксамеры, включая полоксамер 184 и 188; полиолы Плюроник®; и другие блок полимеры этилена/полипропилена стабилизируют антитело в процессе обработки и хранения путем снижения межфазовое взаимодействие и предотвращают адсорбцию белка. Аргинин представляет собой белковый растворитель, а также стабилизатор, который снижает агрегацию антитела и другого белка, такую как агрегация aTFPI МАТ, и гликозилирование. Метионин представляет собой ингибитор окислительных реакций, который предотвращает окисление антитела в процессе обработки и хранения.
Сахара и неорганические соли обычно используются в качестве стабилизаторов белка; однако, оба сахара и неорганические соли являются также эффективными в качестве агентов, регулирующих тоничность. Если композиция требует высокой концентрации одного или более Сахаров для стабилизации белка, то концентрация неорганической соли должна быть равна нулю или поддерживаться на очень низком уровне для того, чтобы обеспечивать осмоляльность композиции так, чтобы боль при инъекции снижалась при введении. Совершенно неожиданно было обнаружено, что хлорид натрия повышает помутнение композиции антитела. В связи с этим неорганические соли существенно исключаются из добавления в композиции, описанные в данной заявке. Такие бессолевые композиции поддерживают осмоляльность композиции антитела и другого белка с повышенной стабильностью и снижают фазовые изменения такие, как преципитация или агрегация.
Как используется в данной заявке, термин "соль" относится к неорганическим солям, которые включают, но не ограничиваются таковыми, хлорид натрия (NaCl), сульфат натрия (Na2SO4), тиоцианат натрия (NaSCN), хлорид магния (MgCl), сульфат магния (MgSO4), тиоцианат аммония (NH4SCN), сульфат аммония ((NH4)2SO4), хлорид аммония (NH4Cl), хлорид кальция (CaCl2), сульфат кальция (CaSO4), хлорид цинка (ZnCl2) и тому подобное, или их комбинации. Композиции антитела и другого белка, раскрытые в данной заявке, характеризуются существенным отсутствием добавленной соли и, таким образом, упоминаются в данной заявке как свободные от соли композиции антитела и/или белка. Квалифицированному специалисту в данной области техники будет понятно, что присутствие неорганических солей в раскрытых в настоящей заявке композициях, которые вводятся для доведения значения рН, не рассматривается как добавление солей, и такие неорганические соли, в случае присутствия в композиция в соответствии с настоящей заявкой, не должны превышать концентрацию приблизительно 2 мМ.
Как используется в данной заявке, термин "поверхностно-активный агент" включает неионные поверхностно-активные вещества, включая, но без ограничения таковыми, полисорбаты такие, как полисорбат 20 или 80, и полоксамеры такие, как полоксамер 184 или 188, полиолы Плюроник® и другие блок полимеры этилена/полипропилена. Количества поверхностно-активных веществ, эффективные для обеспечения стабильной композиции антитела и другого белка, обычно находятся в интервале от 50 част, на млн. до 200 част, на млн.. Применение неионных поверхностно-активных веществ позволяет композиции подвергаться сдвиговому и поверхностному стрессу при отсутствии возникновения денатурации антитела или другого белка, а также снижает адсорбцию на поверхностях в процессе обработки и хранения. Композиции, раскрытые в данной заявке, включают, без ограничения, композиции, которые содержат один или более неионный(х) поверхностно-активный(х) агент(ов) включая, например, один или более полисорбат(ов) таких, как полисорбат 20 или 80; один или более полоксамеров таких, как полоксамер 184 или 188; один или более полиол(ы) Плюроник®; и/или один или более блок полимер(ов) этилена/полипропилена. В качестве примера в данной заявке являются представленными композиции, которые содержат полисорбат, такой как полисорбат 20 (Твин® 20) или полисорбат 80 (Твин® 80).
Как используется в данной заявке, термин "белок" относится к аминокислотным полимерам, содержащим, по крайней мере, пять последовательных аминокислот, которые являются ковалентно связанными с помощью пептидной связи. Составляющие аминокислоты могут быть выбраны из группы аминокислот, которые кодируются генетическим кодом и которые включают: аланин, валин, лейцин, изолейцин, метионин, фенилаланин, тирозин, триптофан, серии, треонин, аспарагин, глутамин, цистеин, глицин, пролин, аргинин, гистидин, лизин, аспарагиновую кислоту и глутаминовую кислоту. Как используется в данной заявке, термин "белок" представляет собой синоним с родственными терминами "пептид" и "полипептид".
Как используется в данной заявке, термин "антитело" относится к классу белков, которые в общем случае являются известными как иммуноглобулины. Антитела включают полноразмерные моноклональные антитела (МАТ) такие, как IgG2, моноклональные антитела, которые включают участки Fe иммуноглобулина. Термин "антитело" также включает биспецифические антитела, диатела, одноцепочечные молекулы и фрагменты антитела такие, как Fab, F(ab')2 и Fv.
Как используется в данной заявке, термин "антитело к TFPI" относится к антителу, которое обладает связывающей специфичностью в отношении человеческого TFPI белка, а также фрагментов и вариантов человеческого TFPI белка. Антитела к TFPI, представленные в данной заявке, могут представлять собой IgG2 антитела и включают анти-TFPI IgG2 моноклональные антитела такие, как химерные, гуманизированные и полностью человеческие анти-TFPI IgG2 моноклональные антитела. Антитела против TFPI в данной заявке являются представленными человеческим анти-TFPI IgG2 моноклональным антителом, которое имеет легкую цепь, включающую последовательность, представленную в данной заявке как SEQ ID NO: 1, и/или тяжелую цепь, представленную в данной заявке как SEQ ID NO: 2. Другие анти-TFPI моноклональные антитела, включая полноразмерные антитела и связывающие антиген фрагменты и их варианты, которые также являются приемлемыми для применения в композициях, раскрытых в данной заявке, являются представленными в публикациях РСТ WO 2011/109452 и WO 2010/017196, которые обе являются введенными в данную заявку в качестве ссылки в своей целостности.
"Моноклональные антитела" характеризуются наличием специфичности для одной антигенной детерминанты. Моноклональные антитела могут, например, быть получены при использовании гибридомной методики, описанной Kohler и Milstein, Nature 256: 495 (1975) или с помощью способов рекомбинантной ДНК таких, как те, что описаны в патенте США №4,816,567. Моноклональные антитела могут также быть изолированы из библиотек фагового дисплея при использовании методик таких, как те, которые описываются у Clackson и др., Nature 352: 624-628 (1991) и Marks и др., J. Mol. Biol. 222: 581-597(1991).
Моноклональные антитела включают "химерные моноклональные антитела", в которых часть тяжелой и/или легкой цепи включает последовательности из антитела, которое имеет происхождение от одних видов, в то время как оставшаяся часть антитела, включая участок Fe, содержит последовательности из антитела, которое имеет происхождение от другого вида, типично, другой вид представляет собой человека. Смотри, например, патент США №4,816,567 и Morrison и др., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984).
Моноклональные антитела также включают "гуманизированные моноклональные антитела", где один или более из участков, определяющих комплементарность (CDR), из последовательности тяжелой и/или легкой цепи антитела, которое имеет происхождение от одного из видов, заменяют одним или более CDR из последовательности тяжелой и/или легкой цепи из антитела, которое имеет происхождение от второго вида, типично, второй вид представляет собой человека. Процесс "гуманизации" обычно применяют к моноклональным антителам, которые разработаны для введения человеку. Смотри, например, Riechmann и др., Nature 332(6162): 323-27 (1988) и Queen и др., Proc. Natl. Acad. Sci. USA 86 (24): 10029-33 (1989).
Моноклональные антитела также включают "полностью человеческие моноклональные антитела", в которых полные последовательности тяжелой и легкой цепей имеют происхождение от последовательностей человеческого антитела. Полностью человеческие моноклональные антитела могут быть получены с помощью методик фагового дисплея и могут быть изолированы от мышей, которые были генетически созданы для экспрессии совокупности человеческих антител. Смотри, например, McCafferty и др., Nature 348(6301): 552-554 (1990), Marks и др., J. Mol. Biol. 222(3): 581-597 (1991), и Carmen и Jermutus, Brief Funct. Genomic Proteomic 1(2): 189-203 (2002).
Как используется в данной заявке, термин "фармацевтически эффективное количество" композиции антитела или другого белка относится к количеству композиции, которое обеспечивает терапевтический эффект при введении. Композиции антитела и белка, раскрытые в данной заявке, типично включают антитело или другой белок при концентрации, которая колеблется от приблизительно 1 мг/мл до приблизительно 150 мг/мл или от приблизительно 1 мг/мл до приблизительно 100 мг/мл, или от приблизительно 1 мг/мл до приблизительно 50 мг/мл, или от приблизительно 1 мг/мл до приблизительно 20 мг/мл, или от приблизительно 1 мг/мл до приблизительно 10 мг/мл, или от приблизительно 10 мг/мл до приблизительно 20 мг/мл, или от приблизительно 20 мг/мл до приблизительно 150 мг/мл, или от приблизительно 50 мг/мл до приблизительно 150 мг/мл, или от приблизительно 60 мг/мл до приблизительно 150 мг/мл, или от приблизительно 70 мг/мл до приблизительно 150 мг/мл, или от приблизительно 80 мг/мл до приблизительно 150 мг/мл, или от приблизительно 90 мг/мл до приблизительно 150 мг/мл, или от приблизительно 100 мг/мл до приблизительно 150 мг/мл, или от приблизительно 120 мг/мл до приблизительно 150 мг/мл, или от приблизительно 140 мг/мл до приблизительно 150 мг/мл. В некоторых аспектах концентрация белка или антитела в этих композициях составляет приблизительно 150 мг/мл. При подкожном введении такие композиции типично вводятся в объеме, который составляет менее чем приблизительно 2,0 мл или приблизительно 1,5 мл, или приблизительно 1 мл, или приблизительно 0,5 мл на сайт инъекции.
В некоторых аспектах композиция антитела или другого белка содержит приблизительно 30 мМ гистидина, приблизительно 100 част, на млн. Твина 80, приблизительно 292 мМ сахарозы, приблизительно 20 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0. В связанных с данным аспектах композиция антитела и другого белка также содержит от приблизительно 30 мМ до приблизительно 50 мМ аргинина.
В других аспектах композиция антитела или другого белка содержит приблизительно 10 мМ гистидина, приблизительно 75 част, на млн. Твина 80, приблизительно 234 мМ сахарозы, приблизительно 50 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0. В связанных с данным аспектах композиция антитела и другого белка также содержит от приблизительно 30 мМ до приблизительно 50 мМ аргинина.
В других аспектах композиция антитела или другого белка содержит приблизительно 10 мМ гистидина, приблизительно 75 част, на млн. Твина 80, приблизительно 234 мМ сахарозы, приблизительно 100 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0. В связанных с данным аспектах композиция антитела и другого белка также содержит от приблизительно 30 мМ до приблизительно 50 мМ аргинина.
В других аспектах композиция антитела или другого белка содержит приблизительно 10 мМ гистидина, приблизительно 75 част, на млн. Твина 80, приблизительно 88 мМ сахарозы, приблизительно 133 мМ глицина, приблизительно 100 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0. В связанных с данным аспектах композиция антитела и другого белка также содержит от приблизительно 30 мМ до приблизительно 50 мМ аргинина.
В других аспектах композиция антитела или другого белка содержит приблизительно 10 мМ гистидина, приблизительно 75 част, на млн. Твина 20, приблизительно 88 мМ сахарозы, приблизительно 133 мМ глицина, приблизительно 100 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0. В связанных с данным аспектах композиция антитела и другого белка также содержит от приблизительно 30 мМ до приблизительно 50 мМ аргинина.
В других аспектах композиция антитела или другого белка содержит приблизительно 10 мМ гистидина, приблизительно 200 част, на млн. Твина 20, приблизительно 88 мМ сахарозы, приблизительно 133 мМ глицина, приблизительно 100 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0. В связанных с данным аспектах композиция антитела и другого белка также содержит от приблизительно 30 мМ до приблизительно 50 мМ аргинина.
В других аспектах композиция антитела или другого белка содержит приблизительно 10 мМ гистидина, приблизительно 75 част, на млн. Твина 80, приблизительно 88 мМ сахарозы, приблизительно 100 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0. В связанных с данным аспектах композиция антитела и другого белка также содержит от приблизительно 30 мМ до приблизительно 50 мМ аргинина.
В других аспектах композиция антитела или другого белка содержит приблизительно 10 мМ гистидина, приблизительно 75 част, на млн. Твина 80, приблизительно 88 мМ сахарозы, приблизительно 133 мМ глицина, приблизительно 10 мМ аргинина, приблизительно 100 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0. В связанных с данным аспектах композиция антитела и другого белка также содержит от приблизительно 0 мМ до приблизительно 10 мМ метионина.
В других аспектах композиция антитела или другого белка содержит приблизительно 10 мМ гистидина, приблизительно 75 част, на млн. Твина 80, приблизительно 88 мМ сахарозы, приблизительно 133 мМ глицина, приблизительно 30 мМ лизина, приблизительно 100 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0.
В других аспектах композиция антитела или другого белка содержит приблизительно 10 мМ гистидина, приблизительно 75 част, на млн. Твина 80, приблизительно 234 мМ сахарозы, приблизительно 30 мМ аргинина, приблизительно 100 мг/мл антитела или другого белка при значении рН, которое колеблется от приблизительно рН 5,0 до приблизительно рН 6,0. В связанных с данным аспектах композиция антитела и другого белка также содержит от приблизительно 0 мМ до приблизительно 10 мМ метионина.
В данной заявке являются представленными композиции антитела, где антитела включают IgG2 антитела, такие как антитела к ингибитору пути тканевого фактора (aTFPI AT), включая человеческое IgG2 моноклональное антитело, которое имеет легкую цепь, включающую последовательность SEQ ID NO: 1, и тяжелую цепь, включающую последовательность SEQ ID NO: 2.
Таким образом, данное изобретение обеспечивает композиции анти-TFPI МАТ, включая композиции анти-TFPI IgG2 МАТ, где анти-TFPI МАТ представляет собой растворимые при высокой концентрации белки. Типично, анти-TFPI МАТ в композициях, раскрытых в данной заявке, остаются растворимыми при концентрациях от приблизительно 1 мг/мл до приблизительно 150 мг/мл, остаются стабильными при изоосмотических условиях хранения, а также демонстрируют сниженную вязкость по сравнению с доступными в настоящее время композициями антитела.
Анти-TFPI антитело, которое имеет легкую цепь, включающую последовательность SEQ ID NO: 1, и тяжелую цепь, включающую последовательность SEQ ID NO: 2, представляет собой IgG2 антитело, которое блокирует ингибитор пути тканевого фактора (TFPI). Поскольку TFPI подавляет несвойственную коагуляцию, антитело к TFPI может способствовать коагуляции, которая направляется несвойственным путем с помощью блокирования TFPI, образуя, таким образом, обходной путь FVIII или FIX патологии в присущем организму пути для лечения гемофилии. Композиции антитела к TFPI, свободные от соли, представленные в данной заявке, могут вводиться пациентам путем подкожной инъекции или с помощью других способов инъекции.
Как часть в соответствии с настоящим изобретением было обнаружено, что растворимость и стабильность антитела к TFPI подвергалась влиянию со стороны наполнителей. Растворимость антитела к TFPI повышается со снижением концентраций NaCl. При отсутствии NaCl растворимость антитела к TFPI выше, чем для композиции, которая включает NaCl. Кроме того, было обнаружено, что позитивно заряженные аминокислоты такие, как аргинин и лизин, могут улучшить стабильность антитела к TFPI, а также что значение рН значительным образом влияет на растворимость антитела к TFPI. Помутнение раствора антитела повышается с повышением значения рН; однако, преципитация является обратимой тогда, когда значение рН снижается. Оптимальное значение рН для стабилизации антитела к TFPI, представленного в данной заявке, колеблется от приблизительно рН 4 до приблизительно рН 6 или от приблизительно рН 5 до приблизительно рН 6, как, например, приблизительно рН 5, приблизительно рН 5,5 или приблизительно рН 6.
В данной заявке представлены композиции, которые описаны выше, где антитело представляет собой антитело к TFPI (aTFPI AT). По крайней мере, в одном антитело к TFPI представляет собой человеческое IgG2 моноклональное антитело. Например, человеческое анти-TFPI IgG2 моноклональное антитело включает антитело, которое содержит легкую цепь, которая имеет аминокислотную последовательность, представленную в SEQ ID NO: 1, и тяжелую цепь, которая имеет аминокислотную последовательность, представленную в SEQ ID NO: 2.
Данное раскрытие также обеспечивает способы лечения расстройства у пациента, которые включают введение пациенту терапевтически эффективного количества одной или более композиций, описанных в данной заявке. Например, обеспечиваются способы лечения расстройства у пациента, которые включают введение пациенту терапевтически эффективного количества композиция антитела или другого белка, которая содержит от приблизительно 0 мМ до приблизительно 30 мМ гистидина, от приблизительно 50 част, на млн. до приблизительно 200 част, на млн. полисорбата (Твина®) 80 или полисорбата (Твина®) 20, от приблизительно 88 мМ до приблизительно 292 мМ сахарозы, от приблизительно 0 мМ до приблизительно 50 мМ аргинина, от приблизительно 0 мМ до приблизительно 50 мМ лизина, от приблизительно 0 мМ до приблизительно 133 мМ глицина или аланина, от приблизительно 0 мМ до приблизительно 10 мМ метионина и от приблизительно 1 мг/мл до приблизительно 150 мг/мл белка при значении рН, которое колеблется от приблизительно рН 4,0 до приблизительно рН 6,0. По крайней мере, в соответствии с одним аспектом этих способов композиция антитела или другого белка может вводиться внутривенно. В рамках других аспектов этих способов композиция антитела или другого белка может вводиться подкожно. В соответствии с другими аспектами этих способов композиция антитела или другого белка может вводиться внутримышечно.
В соответствии с другими близкими аспектами данное раскрытие обеспечивает способы для лечения гемофилии А или гемофилии В у пациента, которые включают введение пациенту терапевтически эффективного количества композиции антитела к TFPI, которая содержит от приблизительно 0 мМ до приблизительно 30 мМ гистидина и от приблизительно 50 част, на млн. до приблизительно 200 част, на млн. полисорбата (Твина®) 80 или полисорбата (Твина®) 20, от приблизительно 88 мМ до приблизительно 292 мМ сахарозы, от приблизительно 0 мМ до приблизительно 50 мМ аргинина, от приблизительно 0 мМ до приблизительно 50 мМ лизина, от приблизительно 0% (0 мМ) до приблизительно 1% (133 мМ) глицина, от приблизительно 0 мМ до приблизительно 10 мМ метионина и от приблизительно 1 мг/мл до приблизительно 150 мг/мл белка при значении рН, которое колеблется от приблизительно рН 4,0 до приблизительно рН 6,0. В рамках, по крайней мере, одного аспекта этих способов композиция антитела к TFPI может вводиться внутривенно. В соответствии с другими аспектами этих способов композиция антитела к TFPI может вводиться подкожно. В соответствии с другими аспектами этих способов композиция антитела или другого белка может вводиться внутримышечно.
В соответствии с определенными аспектами этих способов для лечения гемофилии А или гемофилии В у пациента антитело к TFPI представляет собой человеческое анти-TFPI IgG2 моноклональное антитело такое, как, например, человеческое анти-TFPI IgG2 моноклональное антитело, которое содержит легкую цепь, которая имеет аминокислотную последовательность, представленную в SEQ ID NO: 1, и тяжелую цепь, которая имеет аминокислотную последовательность, представленную в SEQ ID NO: 2.
Для целей интерпретации данного описания будут применяться следующие определения и всякий раз, когда это является уместным, термины, используемые в единственном числе, будут также включать множественное число и наоборот. В случае, когда любое определение, изложенное ниже, входит в конфликт с использованием этого слова в любом другом документе, включая любой документ, который включен в данное описание в качестве ссылки, определения, изложенные ниже, всегда будут находиться под контролем для целей интерпретации данного описания и связанных с ним пунктов формулы изобретения, если только противоположный смысл явным образом не предполагается (например, в документе, где термин первоначально использовался). Применение "или" означает "и/или", если не указано иное. Применение слова "любой" здесь означает "один или более", если не указано иное, или где применение "один или более" явно является неприемлемым. Применение слов "содержат", "содержит", "содержащий", "включают", "включает" и "включающий" являются взаимозаменяющими и не являются предназначенными для ограничения. Кроме того, там, где описание одного или более воплощений использует термин "включающий", квалифицированный специалист в данной области техники поймет, что в некоторых специфических случаях воплощение или воплощения могут альтернативно описываться при использовании выражений "который существенно состоит из" и/или "который состоит из".
Аспекты настоящей заявки могут быть дополнительно раскрыты в свете следующих примеров, которые не являются предназначенными для ограничения объема настоящего раскрытия каким-либо образом.
ПРИМЕРЫ
Пример 1
Влияние концентрации NaCl и рН на помутнение растворов антитела
Этот пример раскрывает влияние концентрации соли (NaCl) и рН на помутнение растворов, которые содержат анти-TFPI человеческое моноклональное антитело, которое имеет легкую цепь с аминокислотной последовательностью, представленной в SEQ ID NO: 1, и тяжелую цепь с аминокислотной последовательностью, представленной в SEQ ID NO: 2.
Помутнение растворов измеряли с помощью нефелометрии для быстрой оценки влияния концентраций соли и рН на растворы aTFPI AT. Композиция анти-TFPI антитела, которая используется в этом Примере, содержит 10 мМ ацетатного буфера, 88 мМ сахарозы и 200 част, на млн. Твина 80. Концентрации NaCl варьировали в пределах от 0 мМ до 300 мМ. Результаты измерений помутнения, зависимого от NaCl, для композиции анти-TFPI при рН 5,5 являются представленными на Фигуре 1. Эти данные демонстрируют, что помутнение композиции анти-TFPI МАТ значительно увеличивалось при повышении концентрации NaCl. Увеличивающаяся от 0 до 300 мМ концентрация соли приводила к повышению на 72 FNU (формазиновая единица мутности) значения помутнения с помощью нефелометрии, что может приписываться преципитации, агрегации или нерастворимости aTFPI AT в растворе. Как результат этого факта, растворы без хлорида натрия были рекомендованы для раскрытых в настоящей заявке композиций антитела к TFPI.
Не имея намерения связывать себя какой-либо теорией, считается, что повышенное помутнение композиции анти-TFPI МАТ с повышенной концентрацией NaCl является результатом нейтрализации позитивных зарядов на боковых цепях аргинина анти-TFPI МАТ. Фазовое поведение aTFPI МАТ при различных значениях рН при воздействии моновалентной соли (NaCl) объясняет, почему могут быть достигнуты стабильные, растворимые, бессолевые и существенно изоосмоляльные композиции aTFPI МАТ.
Раскрытая в настоящей заявке молекула aTFPI МАТ имеет 116 аминокислот (42 аргинина и 74 лизина), имеющих боковую цепь, которая несет позитивные заряды при значении рН ниже PI. Такое антитело к TFPI имеет PI при ~7,9. При значении рН ниже PI, таком, как рН 4-6, это антитело к TFPI имеет общий позитивный заряд. Отталкивание положительных зарядов на поверхности этого антитела к TFPI также предотвращает образование ассоциации белок-белок между отдельными молекулами и, следовательно, значительно увеличивает растворимость. Предполагается, что анион (Cl-) соли связывается с группой гуанидиния на боковых цепях аргинина на поверхности антитела к TFPI с нейтрализацией положительных зарядов, что повышает взаимодействия белок-белок и, следовательно, приводит к низкой растворимости раствора и помутнению. Путем сдвига значения рН до 4-6 были разработаны бессолевые композиции, которые являются описанными в данной заявке, для достижения повышенной растворимости и стабильности антитела (смотри, Фигуру 1). При отсутствии соли концентрация других стабилизаторов таких, как сахароза, может быть увеличена до >150 мМ и <300 мМ без ущерба для осмоляльности.
Влияние рН на помутнение антитела к TFPI также было изучено. Как показано на Фиг. 2, рН может также значительно влиять на помутнение раствора aTFPI AT. Когда значение рН повышали с 4 до 6,5, помутнение раствора aTFPI AT увеличивалась на 81 FNU. При дальнейшем повышении рН до 7, помутнение раствора было вне диапазона для осуществления точного измерения. Однако образование осадка в растворе было обратимым при снижении значения рН. Этот результат можно объяснить нейтрализацией поверхностного заряда при повышении рН до значения, близкого к PI aTFPI AT, поскольку значение PI для aTFPI AT составляет примерно 7,9. По данным этого исследования было установлено, что низкие значения рН являются предпочтительными для композиции aTFPI Т. Однако низкое значение рН может вызвать раздражение тканей во время инъекции. Таким образом, нейтральное значение рН является предпочтительным для пациента с точки зрения безопасности. При балансе между двумя этими факторами оптимальное значение рН композиции aTFPI AT составляет от рН 5 до рН 6.
Пример 2
Композиты антитела к TFPI
На основе неожиданных открытий, представленных в Примере 1, получали существенно изоосмотические композиции антитела к TFPI при отсутствии NaCl. Такие композиции типично использовали высокую концентрацию сахарозы для того, чтобы помочь стабилизировать антитела к TFPI.
Замороженное антитело к TFPI оттаивали и повторно рецептировали при использовании диализа в соответствии с композициями, представленными в Таблице 1. Получали композиции и фильтровали их при использовании фильтра 0,22 мкм, вносили во флаконы из ампульного стекла и закрывали с помощью резиновых пробок.
Было также обнаружено, что отсутствие NaCl и присутствие сахарозы в концентрации от 88 мМ до 292 мМ и полисорбата 80 или полисорбата 20 (50-200 част, на млн.), позитивно заряженных аминокислот, таких как аргинин (10-50 мМ), может эффективно ингибировать гликирование TFPI AT.
Каждую из этих композиций анти-TFPI МАТ подвергали анализу с помощью эксклюзионной ВЭЖХ на агрегацию и разложение белка, жидкостной хроматографии с масс-спектрометрией на структурные изменения aTFPI (гликирование и окисление), нефелометрии для оценки помутнения, вискозиметра для измерения вязкости и устройства для определения осмоляльности. Результаты этих анализов являются представленными в Таблице 2.
Пример 3
Влияние аргинина на гликирование антитела к TFPI
Пример демонстрирует, что композиции антитела к TFPI, которые содержат аргинин, демонстрируют сниженное гликирование антитела по сравнению с композициями антитела к TFPI без добавления аргинина.
Композиции антитела к TFPI, с аргинином или без него, при рН 6 хранили при 40°С в течение 14 дней и исследовали с помощью жидкостной хроматографии с масс-спектрометрией. Результаты, которые представленные в Таблице 3, демонстрируют, что позитивно заряженная аминокислота аргинин снижает гликирование антитела к TFPI, возможно, благодаря уникальной структуре aTFPI антитела, до уровня, обнаруженного в стандартном образце.
На основе этих результатов этого исследования можно сделать вывод, что стабильность антитела aTFPI подвергается значительному влиянию со стороны рН композиции, оптимальное значение рН для стабильности композиции составляет от рН 5 до рН 6, когда рассматривается внутривенная, внутримышечная и подкожная инъекции. Аргинин оказался способным предотвращать гликирование aTFPI антитела. Разработка композиции и изучение стабильности, представленные в Примере 4 и Примере 5, осуществлялись на основе этих открытий.
Пример 4
Стабильность композиции антитела к TFPI
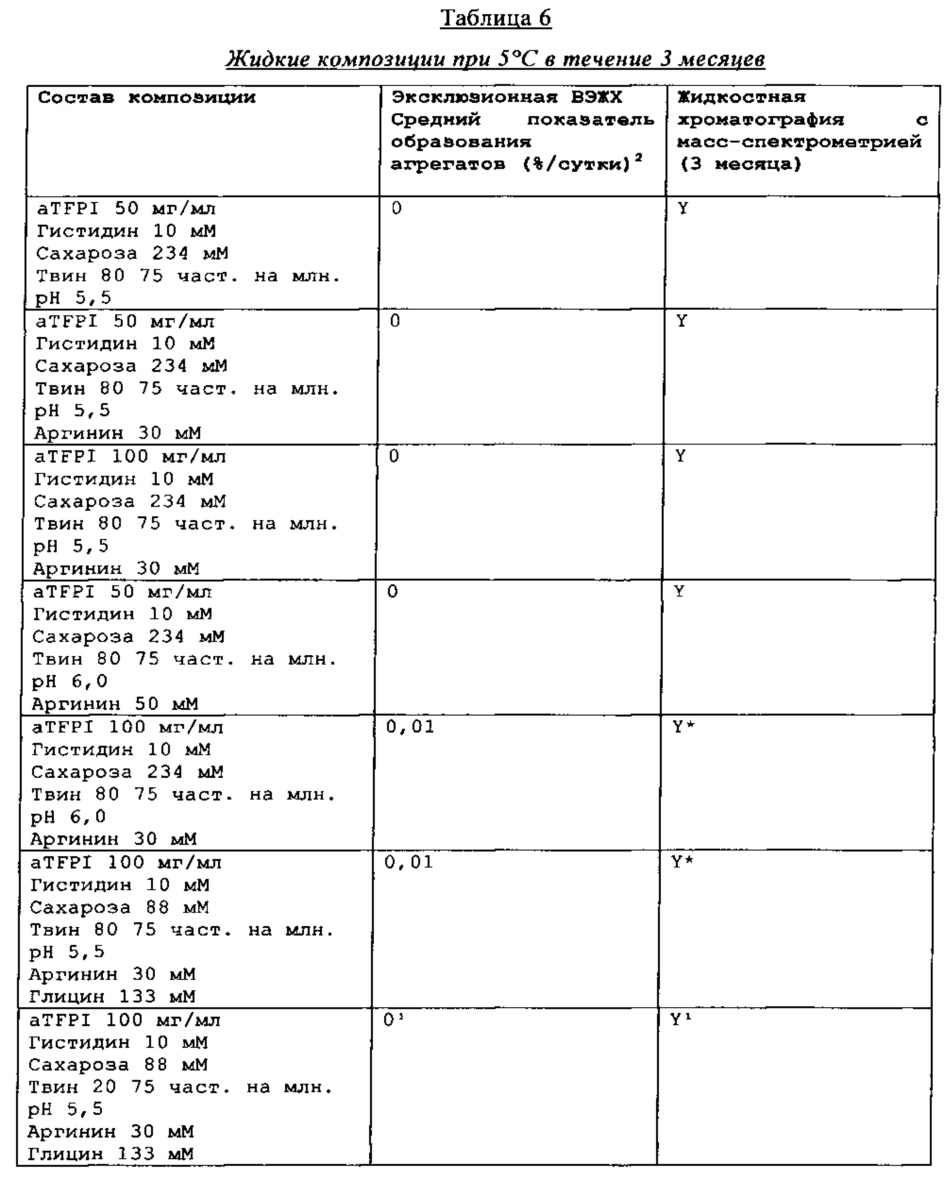
Результаты эксклюзионной ВЭЖХ и результаты жидкостной хроматографии с масс-спектрометрией композиции антителак TFPI подытожены в Таблицах 4-7.
Claims (34)
1. Свободная от соли композиция антитела к TFPI для лечения гемофилии А или гемофилии В у пациента, включающая:
a) от 10 мМ до 30 мМ гистидина;
b) от 50 част. на млн. до 200 част. на млн. неионного поверхностно-активного агента;
c) от 88 мМ до 292 мМ сахара или сахарного спирта, выбранного из маннита, декстрозы, глюкозы, трегалозы и сахарозы;
d) от 10 мМ до 50 мМ аргинина;
e) от 0 мМ до 50 мМ лизина;
f) от 0 мМ до 133 мМ глицина или аланина;
g) от 0 мМ до 10 мМ метионина; и
h) от 1 мг/мл до 150 мг/мл человеческого IgG2 антитела к TFPI, содержащего легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 1, и тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 2; и где указанная композиция имеет значение рН, которое колеблется от рН 4,0 до рН 6,0 и где указанная композиция существенно не содержит неорганической соли.
2. Свободная от соли композиция антитела к TFPI для лечения гемофилии А или гемофилии В у пациента, включающая:
a) от 10 мМ до 30 мМ гистидина,
b) от 50 част. на млн. до 200 част. на млн. неионного поверхностно-активного агента,
c) от 88 мМ до 292 мМ сахара или сахарного спирта, выбранного из маннита, декстрозы, глюкозы, трегалозы и сахарозы,
d) от 0 мМ до 50 мМ аргинина,
e) от 0 мМ до 50 мМ лизина,
f) от 0 мМ до 133 мМ глицина или аланина,
g) от 0 мМ до 10 мМ метионина, и
h) от 20 мг/мл до 150 мг/мл антитела к TFPI;
где указанная композиция имеет значение рН от рН 4,0 до рН 6,0 и где указанная композиция существенно не содержит неорганической соли; и
где указанное антитело к TFPI представляет собой человеческое IgG2 моноклональное антитело и содержит легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 1, и тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 2.
3. Свободная от соли композиция антитела к TFPI в соответствии с п. 2, где указанная композиция имеет значение вязкости, которое колеблется от 1 до 8 мПа-с при 22°С.
4. Свободная от соли композиция антитела к TFPI в соответствии с п. 2, где указанная композиция имеет осмоляльность, которая колеблется от 240 до 380 ммоль/кг.
5. Свободная от соли композиция антитела к TFPI в соответствии с п. 2, где указанный неионный поверхностно-активный агент представляет собой полисорбат, выбранный из полисорбата 20 и полисорбата 80.
6. Свободная от соли композиция антитела к TFPI в соответствии с п. 2, где указанный сахар представляет собой сахарозу.
7. Свободная от соли композиция антитела к TFPI в соответствии с п. 2, включающая:
a) 10 мМ гистидина,
b) 75 част. на млн. Твина 80,
c) 234 мМ сахарозы,
d) 30 мМ аргинина, и
e) 10 мМ метионина, и
f) 100 мг/мл антитела к TFPI;
где указанная композиция имеет значение рН 5,5.
8. Способ лечения гемофилии А или гемофилии В у пациента, где указанный способ включает введение указанному пациенту терапевтически эффективного количества композиции антитела, включающей от 10 мМ до 30 мМ гистидина, от 50 част. на млн. до 200 част. на млн. неионного поверхностно-активного агента, от 88 мМ до 292 мМ сахара или сахарного спирта, выбранного из маннита, декстрозы, глюкозы, трегалозы и сахарозы, от 10 мМ до 50 мМ аргинина, от 0 мМ до 50 мМ лизина, от 0 мМ до 133 мМ глицина или аланина, от 0 мМ до 10 мМ метионина и от 1 мг/мл до 150 мг/мл химерного, гуманизированного или человеческого IgG2 моноклонального антитела к TFPI, содержащего легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 1, и тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 2; где указанная композиция имеет значение рН от рН 4,0 до рН 6,0, и где указанная композиция существенно не содержит неорганической соли.
9. Способ в соответствии с п. 8, где указанная композиция вводится внутривенно, подкожно или внутримышечно.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US13/601,598 US8613919B1 (en) | 2012-08-31 | 2012-08-31 | High concentration antibody and protein formulations |
| US13/601,598 | 2012-08-31 | ||
| US13/843,780 US9592297B2 (en) | 2012-08-31 | 2013-03-15 | Antibody and protein formulations |
| US13/843,780 | 2013-03-15 | ||
| PCT/US2013/056970 WO2014036071A1 (en) | 2012-08-31 | 2013-08-28 | Antibody and protein formulations |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2019100887A Division RU2019100887A (ru) | 2012-08-31 | 2013-08-28 | Композиции антитела и белка |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2015111341A RU2015111341A (ru) | 2016-10-27 |
| RU2678097C2 true RU2678097C2 (ru) | 2019-01-23 |
Family
ID=49162239
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2015111341A RU2678097C2 (ru) | 2012-08-31 | 2013-08-28 | Композиции антитела и белка |
| RU2019100887A RU2019100887A (ru) | 2012-08-31 | 2013-08-28 | Композиции антитела и белка |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2019100887A RU2019100887A (ru) | 2012-08-31 | 2013-08-28 | Композиции антитела и белка |
Country Status (26)
| Country | Link |
|---|---|
| US (7) | US9592297B2 (ru) |
| EP (3) | EP3117837B1 (ru) |
| JP (3) | JP6462567B2 (ru) |
| CN (2) | CN114392353A (ru) |
| AR (2) | AR092388A1 (ru) |
| AU (3) | AU2013308902B2 (ru) |
| BR (1) | BR112015003838A2 (ru) |
| CA (2) | CA3129277A1 (ru) |
| CY (1) | CY1121989T1 (ru) |
| DK (1) | DK3117837T3 (ru) |
| ES (1) | ES2741575T3 (ru) |
| HK (1) | HK1210794A1 (ru) |
| HR (1) | HRP20191299T1 (ru) |
| HU (1) | HUE045652T2 (ru) |
| IL (6) | IL294567A (ru) |
| LT (1) | LT3117837T (ru) |
| MX (2) | MX369653B (ru) |
| PL (1) | PL3117837T3 (ru) |
| PT (1) | PT3117837T (ru) |
| RS (1) | RS59221B1 (ru) |
| RU (2) | RU2678097C2 (ru) |
| SG (2) | SG11201501116RA (ru) |
| SI (1) | SI3117837T1 (ru) |
| TW (4) | TW201825116A (ru) |
| UY (1) | UY34995A (ru) |
| WO (1) | WO2014036071A1 (ru) |
Families Citing this family (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102939098B (zh) | 2010-03-01 | 2016-08-03 | 拜耳医药保健有限公司 | 针对组织因子途径抑制剂(tfpi)的优化的单克隆抗体 |
| CN107090046A (zh) * | 2011-04-01 | 2017-08-25 | 拜尔健康护理有限责任公司 | 针对组织因子途径抑制物(tfpi)的单克隆抗体 |
| AT512589B1 (de) * | 2012-03-12 | 2014-06-15 | Zizala Lichtsysteme Gmbh | Lichtleitelement für einen Laser-Fahrzeugscheinwerfer sowie Fahrzeugscheinwerfer |
| US9592297B2 (en) | 2012-08-31 | 2017-03-14 | Bayer Healthcare Llc | Antibody and protein formulations |
| IL312865B1 (en) | 2013-09-11 | 2025-02-01 | Eagle Biologics Inc | Liquid protein formulations containing viscosity-reducing agents |
| US10478498B2 (en) | 2014-06-20 | 2019-11-19 | Reform Biologics, Llc | Excipient compounds for biopolymer formulations |
| US9982061B2 (en) | 2014-10-01 | 2018-05-29 | Medimmune Limited | Antibodies to ticagrelor and methods of use |
| SG11201702614SA (en) | 2014-10-01 | 2017-04-27 | Eagle Biolog Inc | Polysaccharide and nucleic acid formulations containing viscosity-lowering agents |
| CN107922506B (zh) | 2015-08-19 | 2021-11-09 | 辉瑞公司 | 组织因子途径抑制剂抗体及其用途 |
| SI3769781T1 (sl) | 2015-08-19 | 2023-06-30 | Astrazeneca Ab | Stabilna formulacija proti-IFNAR1 |
| TWI703158B (zh) | 2015-09-18 | 2020-09-01 | 美商希佛隆公司 | 特異性結合tl1a之抗體 |
| CN108025072A (zh) * | 2015-09-22 | 2018-05-11 | 辉瑞公司 | 制备治疗用蛋白质制剂的方法和由这种方法生产的抗体制剂 |
| WO2017180594A1 (en) * | 2016-04-13 | 2017-10-19 | Medimmune, Llc | Use of amino acids as stabilizing compounds in pharmaceutical compositions containing high concentrations of protein-based therapeutic agents |
| MA45562B1 (fr) | 2016-06-30 | 2024-05-31 | Celltrion Inc | Préparation pharmaceutique liquide stable |
| EP3484520A4 (en) * | 2016-07-13 | 2020-07-29 | Reform Biologics, LLC | STABILIZING EXCIPIENTS FOR THERAPEUTIC PROTEIN FORMULATIONS |
| US20190216925A1 (en) | 2016-09-16 | 2019-07-18 | Leukocare Ag | A Novel Method for Stabilization of a Biopharmaceutical Drug Product During Processing |
| MY197200A (en) * | 2016-12-23 | 2023-05-31 | Serum Institute Of India Pvt Ltd | Improved methods for enhancing antibody productivity in mammalian cell culture and minimizing aggregation during downstream, formulation processes and stable antibody formulations obtained thereof |
| JOP20190260A1 (ar) | 2017-05-02 | 2019-10-31 | Merck Sharp & Dohme | صيغ ثابتة لأجسام مضادة لمستقبل الموت المبرمج 1 (pd-1) وطرق استخدامها |
| SG11201909955XA (en) | 2017-05-02 | 2019-11-28 | Merck Sharp & Dohme | Formulations of anti-lag3 antibodies and co-formulations of anti-lag3 antibodies and anti-pd-1 antibodies |
| BR112020019065A2 (pt) * | 2018-03-23 | 2020-12-29 | AbbVie Deutschland GmbH & Co. KG | Formulações de anticorpo anti-tau aquosas estáveis |
| JP7235770B2 (ja) | 2018-05-10 | 2023-03-08 | リジェネロン・ファーマシューティカルズ・インコーポレイテッド | 高濃度vegf受容体融合タンパク質を含む製剤 |
| JP2021529800A (ja) * | 2018-07-05 | 2021-11-04 | バイエル アクチェンゲゼルシャフトBayer Aktiengesellschaft | 抗FXIa抗体のための新規な安定した高濃度製剤 |
| KR102337683B1 (ko) * | 2018-09-21 | 2021-12-13 | 주식회사 녹십자 | 고효율 항-tfpi 항체 조성물 |
| WO2020081408A1 (en) * | 2018-10-18 | 2020-04-23 | Merck Sharp & Dohme Corp. | Formulations of anti-rsv antibodies and methods of use thereof |
| CN111346225A (zh) * | 2018-12-21 | 2020-06-30 | 上海张江生物技术有限公司 | 含有蛋白质的药物制剂 |
| PH12021551916A1 (en) * | 2019-02-18 | 2022-05-23 | Lilly Co Eli | Therapeutic antibody formulation. |
| WO2020223565A1 (en) * | 2019-05-01 | 2020-11-05 | Corvidia Therapeutics, Inc. | Anti-il-6 antibody formulation |
| WO2021094917A1 (en) * | 2019-11-13 | 2021-05-20 | Pfizer Inc. | Stable aqueous anti-tfpi antibody formulation |
| AU2023312911A1 (en) * | 2022-07-27 | 2025-01-02 | Viela Bio, Inc. | Formulations comprising an immunoglobulin-like transcript 7 (ilt7)-binding protein |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007002543A2 (en) * | 2005-06-23 | 2007-01-04 | Medimmune, Inc. | Antibody formulations having optimized aggregation and fragmentation profiles |
| WO2010062896A1 (en) * | 2008-11-28 | 2010-06-03 | Abbott Laboratories | Stable antibody compositions and methods for stabilizing same |
| WO2011104381A2 (en) * | 2010-02-26 | 2011-09-01 | Novo Nordisk A/S | Stable antibody containing compositions |
| WO2011109452A1 (en) * | 2010-03-01 | 2011-09-09 | Bayer Healthcare Llc | Optimized Monoclonal Antibodies against Tissue Factor Pathway Inhibitor (TFPI) |
| WO2012047954A1 (en) * | 2010-10-06 | 2012-04-12 | Regeneron Pharmaceuticals, Inc. | Stabilized formulations containing anti-interleukin-4 receptor (il-4r) antibodies |
Family Cites Families (112)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA1064396A (en) | 1975-02-18 | 1979-10-16 | Myer L. Coval | Fractional precipitation of gamma globulin with polyethylene glycol |
| US4075193A (en) | 1976-11-26 | 1978-02-21 | Parke, Davis & Company | Process for producing intravenous immune globulin |
| US4374763A (en) | 1979-09-17 | 1983-02-22 | Morishita Pharmaceutical Co., Ltd. | Method for producing gamma-globulin for use in intravenous administration and method for producing a pharmaceutical preparation thereof |
| US4499073A (en) | 1981-08-24 | 1985-02-12 | Cutter Laboratories, Inc. | Intravenously injectable immune serum globulin |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4597966A (en) | 1985-01-09 | 1986-07-01 | Ortho Diagnostic Systems, Inc. | Histidine stabilized immunoglobulin and method of preparation |
| DE3782737T3 (de) | 1987-08-21 | 1999-05-20 | Imcera Group Inc., Northbrook, Ill. | Stabilisierung von Wachstumshormonen. |
| US4877608A (en) | 1987-11-09 | 1989-10-31 | Rorer Pharmaceutical Corporation | Pharmaceutical plasma protein formulations in low ionic strength media |
| US4912861A (en) * | 1988-04-11 | 1990-04-03 | Huang Ing Chung | Removable pressure-adjustable shock-absorbing cushion device with an inflation pump for sports goods |
| US5096885A (en) | 1988-04-15 | 1992-03-17 | Genentech, Inc. | Human growth hormone formulation |
| EP0417193B1 (en) | 1988-05-27 | 1993-08-04 | Centocor, Inc. | Freeze-dried formulation for antibody products |
| JPH04504253A (ja) | 1989-03-27 | 1992-07-30 | セントカー・インコーポレーテツド | IgM抗体の安定化のための配合物 |
| US5217954A (en) | 1990-04-04 | 1993-06-08 | Scios Nova Inc. | Formulations for stabilizing fibroblast growth factor |
| JPH0565233A (ja) | 1991-03-08 | 1993-03-19 | Mitsui Toatsu Chem Inc | モノクローナル抗体含有凍結乾燥製剤 |
| JP2966592B2 (ja) | 1991-07-20 | 1999-10-25 | 萩原 義秀 | 安定化されたヒトモノクローナル抗体製剤 |
| US6165467A (en) | 1991-07-20 | 2000-12-26 | Yoshihide Hagiwara | Stabilized human monoclonal antibody preparation |
| GB9122820D0 (en) | 1991-10-28 | 1991-12-11 | Wellcome Found | Stabilised antibodies |
| US5849700A (en) | 1991-12-20 | 1998-12-15 | Novo Nordisk A/S | Pharmaceutical formulation |
| NZ262634A (en) | 1993-02-23 | 1997-02-24 | Genentech Inc | Stabilizing polypeptides against degradation by organic solvents by admixing the peptide with trehalose or mannitol |
| DE4344824C1 (de) | 1993-12-28 | 1995-08-31 | Immuno Ag | Hochkonzentriertes Immunglobulin-Präparat und Verfahren zu seiner Herstellung |
| US5580856A (en) | 1994-07-15 | 1996-12-03 | Prestrelski; Steven J. | Formulation of a reconstituted protein, and method and kit for the production thereof |
| GB9418092D0 (en) | 1994-09-08 | 1994-10-26 | Red Cross Found Cent Lab Blood | Organic compounds |
| US6685940B2 (en) | 1995-07-27 | 2004-02-03 | Genentech, Inc. | Protein formulation |
| WO1997004801A1 (en) | 1995-07-27 | 1997-02-13 | Genentech, Inc. | Stabile isotonic lyophilized protein formulation |
| US6267958B1 (en) | 1995-07-27 | 2001-07-31 | Genentech, Inc. | Protein formulation |
| US6686191B1 (en) | 1995-09-22 | 2004-02-03 | Bayer Healthcare Llc | Preparation of virally inactivated intravenously injectable immune serum globulin |
| US5770700A (en) | 1996-01-25 | 1998-06-23 | Genetics Institute, Inc. | Liquid factor IX formulations |
| ATE251893T1 (de) | 1996-01-25 | 2003-11-15 | Schering Ag | Verbesserte kontrastmittenlösungen für die intravasale anwendung |
| KR100236393B1 (ko) | 1996-02-02 | 1999-12-15 | 나까니시 히로유끼 | 사람성장호르몬을 함유하는 의약제제 |
| TWI240627B (en) | 1996-04-26 | 2005-10-01 | Chugai Pharmaceutical Co Ltd | Erythropoietin solution preparation |
| GB9610992D0 (en) | 1996-05-24 | 1996-07-31 | Glaxo Group Ltd | Concentrated antibody preparation |
| EP0852951A1 (de) | 1996-11-19 | 1998-07-15 | Roche Diagnostics GmbH | Stabile lyophilisierte pharmazeutische Zubereitungen von mono- oder polyklonalen Antikörpern |
| US5994511A (en) | 1997-07-02 | 1999-11-30 | Genentech, Inc. | Anti-IgE antibodies and methods of improving polypeptides |
| CA2302708A1 (en) | 1997-08-21 | 1999-03-04 | Siemens Aktiengesellschaft | Method for transmitting user data that can be allocated to different applications |
| GB9820525D0 (en) | 1998-09-21 | 1998-11-11 | Allergy Therapeutics Ltd | Formulation |
| JP2000247903A (ja) | 1999-03-01 | 2000-09-12 | Chugai Pharmaceut Co Ltd | 長期安定化製剤 |
| US6914128B1 (en) | 1999-03-25 | 2005-07-05 | Abbott Gmbh & Co. Kg | Human antibodies that bind human IL-12 and methods for producing |
| CZ20021186A3 (cs) | 1999-10-04 | 2002-11-13 | Chiron Corporation | Farmaceutické prostředky obsahující stabilizovaný kapalný polypeptid |
| WO2001064241A1 (fr) | 2000-02-29 | 2001-09-07 | Chugai Seiyaku Kabushiki Kaisha | Preparations stabilisees a long terme |
| AU2001251336B2 (en) | 2000-04-07 | 2006-09-14 | Signal Coordinating Therapy, Inc. | Methods and compositions for treating neoplasms |
| AU2001276737A1 (en) | 2000-08-04 | 2002-02-18 | Chugai Seiyaku Kabushiki Kaisha | Protein injection preparations |
| JP5485489B2 (ja) | 2000-08-11 | 2014-05-07 | 中外製薬株式会社 | 抗体含有安定化製剤 |
| NZ524482A (en) | 2000-09-01 | 2005-11-25 | Chugai Pharmaceutical Co Ltd | Solution formulations having long-term stability |
| DE60139944D1 (de) | 2000-10-12 | 2009-10-29 | Genentech Inc | Niederviskose konzentrierte proteinformulierungen |
| GB0113179D0 (en) | 2001-05-31 | 2001-07-25 | Novartis Ag | Organic compounds |
| ATE454137T1 (de) * | 2001-07-25 | 2010-01-15 | Facet Biotech Corp | Stabile lyophilisierte pharmazeutische formulierung des igg-antikörpers daclizumab |
| WO2003032907A2 (en) | 2001-10-16 | 2003-04-24 | Rxkinetix, Inc. | High-concentration protein formulations and method of manufacture |
| DK1441589T3 (da) | 2001-11-08 | 2012-08-06 | Abbott Biotherapeutics Corp | Stabil, flydende, farmaceutisk sammensætning af IgG-antistoffer |
| US20030138416A1 (en) | 2001-12-03 | 2003-07-24 | Jesper Lau | Use of glucokinase activator in combination with a glucagon antagonist for treating type 2 diabetes |
| AU2002351353A1 (en) | 2001-12-19 | 2003-09-02 | Genentech, Inc. | Stabilizing polypeptides which have been exposed to urea |
| EP3578168A1 (en) | 2002-02-14 | 2019-12-11 | Chugai Seiyaku Kabushiki Kaisha | Formulation of antibody-containing solutions comprising a sugar as a stabilizer |
| SI1478394T1 (sl) | 2002-02-27 | 2008-12-31 | Immunex Corp | STABILIZIRAN TNFR-Fc SESTAVEK Z ARGININOM |
| US7425618B2 (en) | 2002-06-14 | 2008-09-16 | Medimmune, Inc. | Stabilized anti-respiratory syncytial virus (RSV) antibody formulations |
| US20040022792A1 (en) | 2002-06-17 | 2004-02-05 | Ralph Klinke | Method of stabilizing proteins at low pH |
| EP1551875A4 (en) | 2002-06-21 | 2006-06-28 | Biogen Idec Inc | TAMPON PREPARATIONS FOR CONCENTRATING ANTIBODIES AND METHODS FOR USE THEREOF |
| WO2004007520A2 (en) | 2002-07-12 | 2004-01-22 | Medarex, Inc. | Methods and compositions for preventing oxidative degradation of proteins |
| US20040033228A1 (en) | 2002-08-16 | 2004-02-19 | Hans-Juergen Krause | Formulation of human antibodies for treating TNF-alpha associated disorders |
| BR0315164A (pt) | 2002-10-08 | 2005-08-23 | Rinat Neuroscience Corp | Métodos para tratar dor pós-cirúrgica administrando um antagonista de fator de crescimento nervoso e composições contendo o mesmo |
| AU2003293543A1 (en) | 2002-12-13 | 2004-07-09 | Abgenix, Inc. | System and method for stabilizing antibodies with histidine |
| US7569364B2 (en) | 2002-12-24 | 2009-08-04 | Pfizer Inc. | Anti-NGF antibodies and methods using same |
| US7449616B2 (en) | 2002-12-24 | 2008-11-11 | Pfizer Inc. | Anti-NGF antibodies and methods using same |
| US20050158303A1 (en) | 2003-04-04 | 2005-07-21 | Genentech, Inc. | Methods of treating IgE-mediated disorders comprising the administration of high concentration anti-IgE antibody formulations |
| DK2335725T3 (en) | 2003-04-04 | 2017-01-23 | Genentech Inc | Highly concentrated antibody and protein formulations |
| EA030259B8 (ru) | 2003-07-15 | 2018-09-28 | Амджен Инк. | Человеческие нейтрализующие антитела к фактору роста нервов (ngf) в качестве селективных ингибиторов метаболического пути ngf |
| DK1698640T4 (da) | 2003-10-01 | 2019-09-02 | Kyowa Hakko Kirin Co Ltd | Fremgangsmåde til stabilisering af antistof og antistofpræparat som stabiliseret opløsning. |
| EP1532983A1 (en) | 2003-11-18 | 2005-05-25 | ZLB Bioplasma AG | Immunoglobulin preparations having increased stability |
| ES2553987T3 (es) | 2003-12-25 | 2015-12-15 | Kyowa Hakko Kirin Co., Ltd. | Preparación farmacéutica de base acuosa estable que contiene anticuerpo |
| EP1755677A4 (en) | 2004-06-14 | 2009-11-25 | Medimmune Vaccines Inc | HIGH-PRESSURE SPRAY DRYING OF BIOACTIVE MATERIALS |
| US20060051347A1 (en) | 2004-09-09 | 2006-03-09 | Winter Charles M | Process for concentration of antibodies and therapeutic products thereof |
| JO3000B1 (ar) | 2004-10-20 | 2016-09-05 | Genentech Inc | مركبات أجسام مضادة . |
| GT200600031A (es) | 2005-01-28 | 2006-08-29 | Formulacion anticuerpo anti a beta | |
| GT200600033A (es) | 2005-01-28 | 2006-10-25 | Formulaciones liquidas estabilizadas de polipeptido | |
| MX2007010971A (es) | 2005-03-08 | 2007-09-19 | Pharmacia & Upjohn Co Llc | Composiciones de anticuerpo anti-citla-4. |
| US20090117103A1 (en) | 2005-03-08 | 2009-05-07 | Pharmacia & Upjohn Company Llc | M-CSF Antibody compositions Having Reduced Levels of Endotoxin |
| US7785595B2 (en) | 2005-04-18 | 2010-08-31 | Yeda Research And Development Company Limited | Stabilized anti-hepatitis B (HBV) antibody formulations |
| ATE501248T1 (de) | 2005-07-02 | 2011-03-15 | Arecor Ltd | Stabile wässrige systeme mit proteinen |
| NZ599176A (en) | 2005-08-03 | 2014-04-30 | Immunogen Inc | Immunoconjugate formulations |
| AU2006295340B2 (en) | 2005-08-05 | 2010-11-11 | Amgen Inc. | Stable aqueous protein or antibody pharmaceutical formulations and their preparation |
| KR101357685B1 (ko) | 2005-11-21 | 2014-02-06 | 사노피 파스퇴르 리미티드 / 사노피 파스퇴르 리미떼 | 재조합 바이러스용 안정화 제형 |
| EP1977763A4 (en) | 2005-12-28 | 2010-06-02 | Chugai Pharmaceutical Co Ltd | STABILIZER PREPARATION CONTAINING ANTIBODIES |
| KR20080098504A (ko) | 2006-02-03 | 2008-11-10 | 메디뮨 엘엘씨 | 단백질 제제 |
| DE102006005094A1 (de) | 2006-02-04 | 2007-08-09 | Degussa Gmbh | Titandioxid und Polycarboxylatether enthaltende Dispersion |
| CN101466404A (zh) | 2006-06-14 | 2009-06-24 | 埃姆克隆系统股份有限公司 | 抗-egfr抗体的冻干制剂 |
| WO2008009545A1 (en) | 2006-06-30 | 2008-01-24 | Novo Nordisk A/S | Anti-nkg2a antibodies and uses thereof |
| CN101522219A (zh) | 2006-10-12 | 2009-09-02 | 惠氏公司 | 改变抗体溶液中离子强度以减少乳光/聚集物 |
| JP2010512356A (ja) * | 2006-12-11 | 2010-04-22 | エフ.ホフマン−ラ ロシュ アーゲー | 非経口aベータ抗体製剤 |
| EP2068923A4 (en) | 2007-03-30 | 2010-11-24 | Medimmune Llc | ANTIBODIES HAVING REDUCED DEAMIDATION PROFILES |
| GB0707938D0 (en) | 2007-04-25 | 2007-05-30 | Univ Strathclyde | Precipitation stabilising compositions |
| MX2009013593A (es) | 2007-06-14 | 2010-01-20 | Biogen Idec Inc | Formulaciones de anticuerpos. |
| MX2009013886A (es) * | 2007-06-25 | 2010-01-27 | Amgen Inc | Composiciones de agentes de aglutinacion especifica al factor de crecimiento de los hepatocitos. |
| UA107557C2 (xx) | 2007-07-06 | 2015-01-26 | Композиція антитіла офатумумабу | |
| EP2225275A4 (en) | 2007-11-28 | 2013-04-03 | Medimmune Llc | PROTEIN FORMULATION |
| CA2708854C (en) | 2007-12-14 | 2017-11-28 | Novo Nordisk A/S | Antibodies against human nkg2d and uses thereof |
| RU2476238C2 (ru) | 2007-12-21 | 2013-02-27 | Ф. Хоффманн-Ля Рош Аг | Препарат антитела |
| KR20100110841A (ko) | 2007-12-28 | 2010-10-13 | 바이오인벤트 인터내셔날 에이비 | 배합물 |
| EP2826791A3 (en) | 2008-02-20 | 2015-07-29 | Novo Nordisk A/S | Humanized anti-C5aR antibodies |
| WO2009120684A1 (en) | 2008-03-25 | 2009-10-01 | Medimmune, Llc | Antibody formulation |
| CA2728685A1 (en) | 2008-06-30 | 2010-01-07 | Novo Nordisk A/S | Anti-human interleukin-20 antibodies |
| UA112050C2 (uk) | 2008-08-04 | 2016-07-25 | БАЄР ХЕЛСКЕР ЛЛСі | Терапевтична композиція, що містить моноклональне антитіло проти інгібітора шляху тканинного фактора (tfpi) |
| MX2011003013A (es) | 2008-09-19 | 2011-04-11 | Pfizer | Formulacion liquida estable de anticuerpos. |
| EP2196476A1 (en) * | 2008-12-10 | 2010-06-16 | Novartis Ag | Antibody formulation |
| RU2562114C2 (ru) | 2008-12-22 | 2015-09-10 | Ново Нордиск А/С | Антитела против ингибитора метаболического пути тканевого фактора |
| SG174258A1 (en) | 2009-03-06 | 2011-10-28 | Genentech Inc | Antibody formulation |
| AU2010263058A1 (en) | 2009-06-18 | 2012-01-12 | Wyeth Llc | Lyophilized formulations for small modular immunopharmaceuticals |
| PT2473527T (pt) | 2009-09-03 | 2017-02-27 | Ablynx Nv | Formulações estáveis de polipéptidos e seus usos |
| EP2332995A1 (en) * | 2009-12-10 | 2011-06-15 | Bayer Schering Pharma Aktiengesellschaft | Neutralizing prolactin receptor antibodies and their therapeutic use |
| WO2011108452A1 (ja) * | 2010-03-02 | 2011-09-09 | Jnc株式会社 | 還元反応器 |
| CA2793465C (en) * | 2010-03-19 | 2022-06-14 | Baxter International Inc. | Tfpi inhibitors and methods of use |
| MX2012013586A (es) * | 2010-05-28 | 2013-01-24 | Novo Nordisk As | Composiciones multi-dosis estables que comprenden un anticuerpo y un conservante. |
| CN107090046A (zh) | 2011-04-01 | 2017-08-25 | 拜尔健康护理有限责任公司 | 针对组织因子途径抑制物(tfpi)的单克隆抗体 |
| US9592297B2 (en) | 2012-08-31 | 2017-03-14 | Bayer Healthcare Llc | Antibody and protein formulations |
| US8613919B1 (en) * | 2012-08-31 | 2013-12-24 | Bayer Healthcare, Llc | High concentration antibody and protein formulations |
-
2013
- 2013-03-15 US US13/843,780 patent/US9592297B2/en active Active
- 2013-08-28 HU HUE16180643A patent/HUE045652T2/hu unknown
- 2013-08-28 DK DK16180643.5T patent/DK3117837T3/da active
- 2013-08-28 IL IL294567A patent/IL294567A/en unknown
- 2013-08-28 RU RU2015111341A patent/RU2678097C2/ru not_active IP Right Cessation
- 2013-08-28 LT LTEP16180643.5T patent/LT3117837T/lt unknown
- 2013-08-28 PT PT16180643T patent/PT3117837T/pt unknown
- 2013-08-28 SG SG11201501116RA patent/SG11201501116RA/en unknown
- 2013-08-28 SI SI201331538T patent/SI3117837T1/sl unknown
- 2013-08-28 WO PCT/US2013/056970 patent/WO2014036071A1/en active Application Filing
- 2013-08-28 CN CN202111330122.3A patent/CN114392353A/zh active Pending
- 2013-08-28 CA CA3129277A patent/CA3129277A1/en active Pending
- 2013-08-28 RS RSP20190976 patent/RS59221B1/sr unknown
- 2013-08-28 EP EP16180643.5A patent/EP3117837B1/en active Active
- 2013-08-28 US US14/421,607 patent/US20150209431A1/en not_active Abandoned
- 2013-08-28 CN CN201380051319.0A patent/CN104684933B/zh not_active Expired - Fee Related
- 2013-08-28 SG SG10201708215YA patent/SG10201708215YA/en unknown
- 2013-08-28 RU RU2019100887A patent/RU2019100887A/ru not_active Application Discontinuation
- 2013-08-28 AU AU2013308902A patent/AU2013308902B2/en not_active Ceased
- 2013-08-28 EP EP19175217.9A patent/EP3590536A1/en not_active Ceased
- 2013-08-28 JP JP2015529977A patent/JP6462567B2/ja not_active Expired - Fee Related
- 2013-08-28 MX MX2015002411A patent/MX369653B/es active IP Right Grant
- 2013-08-28 BR BR112015003838A patent/BR112015003838A2/pt not_active Application Discontinuation
- 2013-08-28 ES ES16180643T patent/ES2741575T3/es active Active
- 2013-08-28 CA CA2883095A patent/CA2883095C/en active Active
- 2013-08-28 EP EP13760179.5A patent/EP2890718A1/en not_active Withdrawn
- 2013-08-28 PL PL16180643T patent/PL3117837T3/pl unknown
- 2013-08-28 IL IL286784A patent/IL286784B/en unknown
- 2013-08-29 UY UY0001034995A patent/UY34995A/es not_active Application Discontinuation
- 2013-08-29 AR ARP130103085A patent/AR092388A1/es unknown
- 2013-08-30 TW TW106131685A patent/TW201825116A/zh unknown
- 2013-08-30 TW TW108113538A patent/TW201927338A/zh unknown
- 2013-08-30 TW TW102131326A patent/TW201414496A/zh unknown
- 2013-08-30 AR ARP130103099A patent/AR092400A1/es unknown
- 2013-08-30 TW TW102131180A patent/TWI609697B/zh not_active IP Right Cessation
- 2013-12-16 US US14/107,658 patent/US20140105892A1/en not_active Abandoned
-
2014
- 2014-08-12 US US14/457,408 patent/US9849181B2/en active Active
-
2015
- 2015-02-11 IL IL237188A patent/IL237188A0/en unknown
- 2015-02-24 MX MX2019013670A patent/MX2019013670A/es unknown
- 2015-11-27 HK HK15111675.2A patent/HK1210794A1/xx unknown
-
2017
- 2017-08-16 US US15/679,053 patent/US20180055940A1/en not_active Abandoned
- 2017-10-18 US US15/787,610 patent/US20180028669A1/en not_active Abandoned
-
2018
- 2018-05-11 AU AU2018203320A patent/AU2018203320B2/en not_active Expired - Fee Related
- 2018-12-17 JP JP2018235273A patent/JP2019048886A/ja active Pending
-
2019
- 2019-04-07 IL IL265865A patent/IL265865A/en unknown
- 2019-04-07 IL IL265864A patent/IL265864B/en active IP Right Grant
- 2019-07-18 HR HRP20191299TT patent/HRP20191299T1/hr unknown
- 2019-08-16 CY CY20191100881T patent/CY1121989T1/el unknown
-
2020
- 2020-01-08 AU AU2020200134A patent/AU2020200134A1/en not_active Abandoned
- 2020-11-11 US US17/095,102 patent/US20230190637A9/en not_active Abandoned
- 2020-12-06 IL IL279237A patent/IL279237A/en unknown
-
2021
- 2021-01-13 JP JP2021003390A patent/JP2021059602A/ja active Pending
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007002543A2 (en) * | 2005-06-23 | 2007-01-04 | Medimmune, Inc. | Antibody formulations having optimized aggregation and fragmentation profiles |
| WO2010062896A1 (en) * | 2008-11-28 | 2010-06-03 | Abbott Laboratories | Stable antibody compositions and methods for stabilizing same |
| WO2011104381A2 (en) * | 2010-02-26 | 2011-09-01 | Novo Nordisk A/S | Stable antibody containing compositions |
| WO2011109452A1 (en) * | 2010-03-01 | 2011-09-09 | Bayer Healthcare Llc | Optimized Monoclonal Antibodies against Tissue Factor Pathway Inhibitor (TFPI) |
| WO2012047954A1 (en) * | 2010-10-06 | 2012-04-12 | Regeneron Pharmaceuticals, Inc. | Stabilized formulations containing anti-interleukin-4 receptor (il-4r) antibodies |
Non-Patent Citations (1)
| Title |
|---|
| MARONEY S.A. et al. Absence of hematopoietic tissue factor pathway inhibitor mitigates bleeding in mice with hemophilia.Proc Natl Acad Sci U S A. 2012 Mar 6;109(10):3927-31. doi: 10.1073/pnas.1119858109. Epub 2012 Feb 21. * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2678097C2 (ru) | Композиции антитела и белка | |
| US8613919B1 (en) | High concentration antibody and protein formulations | |
| TWI688404B (zh) | 抗-催乳素受體抗體調配物 | |
| KR101730694B1 (ko) | TNF-α 항체의 약제학적 제형 | |
| JP2016515515A (ja) | 抗プロラクチン受容体抗体製剤 | |
| KR20230165828A (ko) | 항-MUC16 x 항-CD3 이중특이적 항체를 함유하는 안정화된 제형 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20200829 |