RU2502742C2 - Новые аллергены пшеницы - Google Patents
Новые аллергены пшеницы Download PDFInfo
- Publication number
- RU2502742C2 RU2502742C2 RU2010126590/10A RU2010126590A RU2502742C2 RU 2502742 C2 RU2502742 C2 RU 2502742C2 RU 2010126590/10 A RU2010126590/10 A RU 2010126590/10A RU 2010126590 A RU2010126590 A RU 2010126590A RU 2502742 C2 RU2502742 C2 RU 2502742C2
- Authority
- RU
- Russia
- Prior art keywords
- wheat
- ige
- polypeptide
- pollen
- patients
- Prior art date
Links
- 235000021307 Triticum Nutrition 0.000 title claims abstract description 152
- 241000209140 Triticum Species 0.000 title claims abstract 4
- 239000013566 allergen Substances 0.000 title abstract description 139
- 108090000765 processed proteins & peptides Proteins 0.000 claims abstract description 59
- 102000004196 processed proteins & peptides Human genes 0.000 claims abstract description 59
- 229920001184 polypeptide Polymers 0.000 claims abstract description 56
- 206010020751 Hypersensitivity Diseases 0.000 claims abstract description 39
- 230000007815 allergy Effects 0.000 claims abstract description 39
- 230000001404 mediated effect Effects 0.000 claims abstract description 30
- 238000000034 method Methods 0.000 claims abstract description 25
- 239000000020 Nitrocellulose Substances 0.000 claims abstract description 13
- 208000026935 allergic disease Diseases 0.000 claims abstract description 13
- 229920001220 nitrocellulos Polymers 0.000 claims abstract description 13
- 239000012634 fragment Substances 0.000 claims abstract description 11
- 201000006520 wheat allergy Diseases 0.000 claims abstract description 10
- 239000012528 membrane Substances 0.000 claims abstract description 8
- 238000000338 in vitro Methods 0.000 claims abstract description 7
- 241000124008 Mammalia Species 0.000 claims abstract description 5
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims abstract 8
- 235000013312 flour Nutrition 0.000 claims description 37
- 238000003745 diagnosis Methods 0.000 claims description 16
- 238000002493 microarray Methods 0.000 claims description 13
- 208000028004 allergic respiratory disease Diseases 0.000 claims description 12
- 201000004335 respiratory allergy Diseases 0.000 claims description 12
- 150000007523 nucleic acids Chemical class 0.000 claims description 5
- 239000002773 nucleotide Substances 0.000 claims description 5
- 125000003729 nucleotide group Chemical group 0.000 claims description 5
- 108020004707 nucleic acids Proteins 0.000 claims description 4
- 102000039446 nucleic acids Human genes 0.000 claims description 4
- 239000007787 solid Substances 0.000 claims description 3
- 238000009007 Diagnostic Kit Methods 0.000 claims description 2
- 125000003275 alpha amino acid group Chemical group 0.000 claims 4
- 210000001124 body fluid Anatomy 0.000 claims 1
- 239000010839 body fluid Substances 0.000 claims 1
- 239000003795 chemical substances by application Substances 0.000 claims 1
- 208000006903 Wheat Hypersensitivity Diseases 0.000 abstract description 5
- 239000000126 substance Substances 0.000 abstract description 4
- 239000007788 liquid Substances 0.000 abstract description 3
- 230000000694 effects Effects 0.000 abstract 1
- 239000000758 substrate Substances 0.000 abstract 1
- 244000098338 Triticum aestivum Species 0.000 description 163
- 208000006673 asthma Diseases 0.000 description 78
- 108090000623 proteins and genes Proteins 0.000 description 53
- 210000002966 serum Anatomy 0.000 description 52
- 102000004169 proteins and genes Human genes 0.000 description 51
- 229960004784 allergens Drugs 0.000 description 49
- 235000018102 proteins Nutrition 0.000 description 47
- 241000196324 Embryophyta Species 0.000 description 43
- 208000004262 Food Hypersensitivity Diseases 0.000 description 43
- 235000020932 food allergy Nutrition 0.000 description 43
- 208000010668 atopic eczema Diseases 0.000 description 27
- 210000004027 cell Anatomy 0.000 description 27
- 230000000172 allergic effect Effects 0.000 description 26
- 230000009257 reactivity Effects 0.000 description 25
- 241000283973 Oryctolagus cuniculus Species 0.000 description 23
- 239000002299 complementary DNA Substances 0.000 description 23
- 239000000872 buffer Substances 0.000 description 21
- 239000003001 serine protease inhibitor Substances 0.000 description 21
- 150000001413 amino acids Chemical group 0.000 description 20
- 239000000284 extract Substances 0.000 description 20
- 238000004458 analytical method Methods 0.000 description 17
- 239000000203 mixture Substances 0.000 description 16
- 206010016946 Food allergy Diseases 0.000 description 15
- 230000003053 immunization Effects 0.000 description 15
- 208000024891 symptom Diseases 0.000 description 15
- 208000035285 Allergic Seasonal Rhinitis Diseases 0.000 description 14
- 238000002649 immunization Methods 0.000 description 14
- 240000007594 Oryza sativa Species 0.000 description 13
- 235000007164 Oryza sativa Nutrition 0.000 description 13
- 235000002595 Solanum tuberosum Nutrition 0.000 description 13
- 244000061456 Solanum tuberosum Species 0.000 description 13
- 235000013339 cereals Nutrition 0.000 description 13
- 229940075824 wheat pollen extract Drugs 0.000 description 13
- 101710187074 Serine proteinase inhibitor Proteins 0.000 description 12
- 210000003470 mitochondria Anatomy 0.000 description 12
- 230000000405 serological effect Effects 0.000 description 12
- 206010010741 Conjunctivitis Diseases 0.000 description 11
- 235000001014 amino acid Nutrition 0.000 description 11
- 239000013573 pollen allergen Substances 0.000 description 10
- 235000009566 rice Nutrition 0.000 description 10
- 206010048908 Seasonal allergy Diseases 0.000 description 9
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 9
- 239000011159 matrix material Substances 0.000 description 9
- 239000002245 particle Substances 0.000 description 9
- 201000004338 pollen allergy Diseases 0.000 description 9
- 241001677738 Aleuron Species 0.000 description 8
- 241000209149 Zea Species 0.000 description 8
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 8
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 8
- 235000005822 corn Nutrition 0.000 description 8
- 230000001900 immune effect Effects 0.000 description 8
- 238000011534 incubation Methods 0.000 description 8
- 230000004044 response Effects 0.000 description 8
- 230000002441 reversible effect Effects 0.000 description 8
- 239000000523 sample Substances 0.000 description 8
- 235000010627 Phaseolus vulgaris Nutrition 0.000 description 7
- 244000046052 Phaseolus vulgaris Species 0.000 description 7
- 102000011195 Profilin Human genes 0.000 description 7
- 108050001408 Profilin Proteins 0.000 description 7
- 239000000427 antigen Substances 0.000 description 7
- 102000036639 antigens Human genes 0.000 description 7
- 108091007433 antigens Proteins 0.000 description 7
- 238000010790 dilution Methods 0.000 description 7
- 239000012895 dilution Substances 0.000 description 7
- 229910052737 gold Inorganic materials 0.000 description 7
- 239000010931 gold Substances 0.000 description 7
- 239000003112 inhibitor Substances 0.000 description 7
- 238000001228 spectrum Methods 0.000 description 7
- 238000002560 therapeutic procedure Methods 0.000 description 7
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 6
- SNBCLPGEMZEWLU-QXFUBDJGSA-N 2-chloro-n-[[(2r,3s,5r)-3-hydroxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methyl]acetamide Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CNC(=O)CCl)[C@@H](O)C1 SNBCLPGEMZEWLU-QXFUBDJGSA-N 0.000 description 6
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- 108020004414 DNA Proteins 0.000 description 6
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- 208000003251 Pruritus Diseases 0.000 description 6
- 206010070834 Sensitisation Diseases 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- 230000002009 allergenic effect Effects 0.000 description 6
- 235000013305 food Nutrition 0.000 description 6
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 6
- 238000002372 labelling Methods 0.000 description 6
- 239000003550 marker Substances 0.000 description 6
- 235000012015 potatoes Nutrition 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- 230000000241 respiratory effect Effects 0.000 description 6
- 241000588724 Escherichia coli Species 0.000 description 5
- 241000282326 Felis catus Species 0.000 description 5
- 241000746983 Phleum pratense Species 0.000 description 5
- 241000238711 Pyroglyphidae Species 0.000 description 5
- 208000024780 Urticaria Diseases 0.000 description 5
- 238000005119 centrifugation Methods 0.000 description 5
- 238000012512 characterization method Methods 0.000 description 5
- 230000001086 cytosolic effect Effects 0.000 description 5
- 238000002474 experimental method Methods 0.000 description 5
- 239000000499 gel Substances 0.000 description 5
- 229940046533 house dust mites Drugs 0.000 description 5
- 238000000746 purification Methods 0.000 description 5
- 230000008313 sensitization Effects 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- 235000009051 Ambrosia paniculata var. peruviana Nutrition 0.000 description 4
- 235000003097 Artemisia absinthium Nutrition 0.000 description 4
- 240000001851 Artemisia dracunculus Species 0.000 description 4
- 235000017731 Artemisia dracunculus ssp. dracunculus Nutrition 0.000 description 4
- 235000003261 Artemisia vulgaris Nutrition 0.000 description 4
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 241000894006 Bacteria Species 0.000 description 4
- 235000018185 Betula X alpestris Nutrition 0.000 description 4
- 235000018212 Betula X uliginosa Nutrition 0.000 description 4
- 241000282472 Canis lupus familiaris Species 0.000 description 4
- 208000015943 Coeliac disease Diseases 0.000 description 4
- 208000000059 Dyspnea Diseases 0.000 description 4
- 206010013975 Dyspnoeas Diseases 0.000 description 4
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 4
- 235000010469 Glycine max Nutrition 0.000 description 4
- 240000005979 Hordeum vulgare Species 0.000 description 4
- 235000007340 Hordeum vulgare Nutrition 0.000 description 4
- 102000008100 Human Serum Albumin Human genes 0.000 description 4
- 108091006905 Human Serum Albumin Proteins 0.000 description 4
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 4
- 239000007983 Tris buffer Substances 0.000 description 4
- 239000013504 Triton X-100 Substances 0.000 description 4
- 229920004890 Triton X-100 Polymers 0.000 description 4
- 239000001138 artemisia absinthium Substances 0.000 description 4
- 210000002421 cell wall Anatomy 0.000 description 4
- 238000002983 circular dichroism Methods 0.000 description 4
- 238000010367 cloning Methods 0.000 description 4
- ZJYYHGLJYGJLLN-UHFFFAOYSA-N guanidinium thiocyanate Chemical compound SC#N.NC(N)=N ZJYYHGLJYGJLLN-UHFFFAOYSA-N 0.000 description 4
- 238000002955 isolation Methods 0.000 description 4
- BPHPUYQFMNQIOC-NXRLNHOXSA-N isopropyl beta-D-thiogalactopyranoside Chemical compound CC(C)S[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O BPHPUYQFMNQIOC-NXRLNHOXSA-N 0.000 description 4
- 230000004807 localization Effects 0.000 description 4
- 235000014594 pastries Nutrition 0.000 description 4
- YBYRMVIVWMBXKQ-UHFFFAOYSA-N phenylmethanesulfonyl fluoride Chemical compound FS(=O)(=O)CC1=CC=CC=C1 YBYRMVIVWMBXKQ-UHFFFAOYSA-N 0.000 description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 4
- 239000011347 resin Substances 0.000 description 4
- 229920005989 resin Polymers 0.000 description 4
- 206010039083 rhinitis Diseases 0.000 description 4
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 4
- KDYFGRWQOYBRFD-UHFFFAOYSA-N succinic acid Chemical compound OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 4
- 239000006228 supernatant Substances 0.000 description 4
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 4
- 239000013598 vector Substances 0.000 description 4
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 3
- HEWZVZIVELJPQZ-UHFFFAOYSA-N 2,2-dimethoxypropane Chemical compound COC(C)(C)OC HEWZVZIVELJPQZ-UHFFFAOYSA-N 0.000 description 3
- 206010054928 Allergy to plants Diseases 0.000 description 3
- 240000007087 Apium graveolens Species 0.000 description 3
- 235000015849 Apium graveolens Dulce Group Nutrition 0.000 description 3
- 235000010591 Appio Nutrition 0.000 description 3
- 238000009020 BCA Protein Assay Kit Methods 0.000 description 3
- 108091026890 Coding region Proteins 0.000 description 3
- 241000723382 Corylus Species 0.000 description 3
- 235000007466 Corylus avellana Nutrition 0.000 description 3
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 3
- 238000002965 ELISA Methods 0.000 description 3
- 241001198387 Escherichia coli BL21(DE3) Species 0.000 description 3
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 3
- 244000068988 Glycine max Species 0.000 description 3
- 108010093488 His-His-His-His-His-His Proteins 0.000 description 3
- 108091028043 Nucleic acid sequence Proteins 0.000 description 3
- 241000746981 Phleum Species 0.000 description 3
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 3
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 3
- 229920002472 Starch Polymers 0.000 description 3
- 240000008042 Zea mays Species 0.000 description 3
- 235000007244 Zea mays Nutrition 0.000 description 3
- 108010050181 aleurone Proteins 0.000 description 3
- 239000003392 amylase inhibitor Substances 0.000 description 3
- 238000000376 autoradiography Methods 0.000 description 3
- 239000012620 biological material Substances 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 238000001142 circular dichroism spectrum Methods 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 230000009260 cross reactivity Effects 0.000 description 3
- 235000013399 edible fruits Nutrition 0.000 description 3
- 239000008187 granular material Substances 0.000 description 3
- 230000000774 hypoallergenic effect Effects 0.000 description 3
- 230000005764 inhibitory process Effects 0.000 description 3
- 230000007803 itching Effects 0.000 description 3
- 150000002632 lipids Chemical class 0.000 description 3
- 239000002609 medium Substances 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 239000008188 pellet Substances 0.000 description 3
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 3
- 239000000902 placebo Substances 0.000 description 3
- 229940068196 placebo Drugs 0.000 description 3
- 230000010152 pollination Effects 0.000 description 3
- 238000012216 screening Methods 0.000 description 3
- 230000005562 seed maturation Effects 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 239000002904 solvent Substances 0.000 description 3
- 230000002269 spontaneous effect Effects 0.000 description 3
- 235000019698 starch Nutrition 0.000 description 3
- 239000008107 starch Substances 0.000 description 3
- -1 5 minutes Substances 0.000 description 2
- HGINCPLSRVDWNT-UHFFFAOYSA-N Acrolein Chemical compound C=CC=O HGINCPLSRVDWNT-UHFFFAOYSA-N 0.000 description 2
- 102000004539 Acyl-CoA Oxidase Human genes 0.000 description 2
- 108020001558 Acyl-CoA oxidase Proteins 0.000 description 2
- 101710171801 Alpha-amylase inhibitor Proteins 0.000 description 2
- 241001674044 Blattodea Species 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- 206010011224 Cough Diseases 0.000 description 2
- 108010066072 DNA modification methylase EcoRI Proteins 0.000 description 2
- 241000238557 Decapoda Species 0.000 description 2
- 102000007260 Deoxyribonuclease I Human genes 0.000 description 2
- 108010008532 Deoxyribonuclease I Proteins 0.000 description 2
- 201000004624 Dermatitis Diseases 0.000 description 2
- 206010012735 Diarrhoea Diseases 0.000 description 2
- 241000283074 Equus asinus Species 0.000 description 2
- 229930091371 Fructose Natural products 0.000 description 2
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 2
- 239000005715 Fructose Substances 0.000 description 2
- 241000233866 Fungi Species 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- NTYJJOPFIAHURM-UHFFFAOYSA-N Histamine Chemical compound NCCC1=CN=CN1 NTYJJOPFIAHURM-UHFFFAOYSA-N 0.000 description 2
- 102000009438 IgE Receptors Human genes 0.000 description 2
- 108010073816 IgE Receptors Proteins 0.000 description 2
- 241001625930 Luria Species 0.000 description 2
- 101710175625 Maltose/maltodextrin-binding periplasmic protein Proteins 0.000 description 2
- GXCLVBGFBYZDAG-UHFFFAOYSA-N N-[2-(1H-indol-3-yl)ethyl]-N-methylprop-2-en-1-amine Chemical compound CN(CCC1=CNC2=C1C=CC=C2)CC=C GXCLVBGFBYZDAG-UHFFFAOYSA-N 0.000 description 2
- 206010028735 Nasal congestion Diseases 0.000 description 2
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 2
- 240000007817 Olea europaea Species 0.000 description 2
- 206010068319 Oropharyngeal pain Diseases 0.000 description 2
- 102000003992 Peroxidases Human genes 0.000 description 2
- 201000007100 Pharyngitis Diseases 0.000 description 2
- 229920001213 Polysorbate 20 Polymers 0.000 description 2
- 208000036071 Rhinorrhea Diseases 0.000 description 2
- 206010039101 Rhinorrhoea Diseases 0.000 description 2
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 2
- 102000002933 Thioredoxin Human genes 0.000 description 2
- 235000007218 Tripsacum dactyloides Nutrition 0.000 description 2
- 244000082267 Tripsacum dactyloides Species 0.000 description 2
- 206010047700 Vomiting Diseases 0.000 description 2
- 235000007241 Zea diploperennis Nutrition 0.000 description 2
- 244000083398 Zea diploperennis Species 0.000 description 2
- 238000001042 affinity chromatography Methods 0.000 description 2
- 229940074608 allergen extract Drugs 0.000 description 2
- 125000000539 amino acid group Chemical group 0.000 description 2
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 2
- 229960000723 ampicillin Drugs 0.000 description 2
- 230000003321 amplification Effects 0.000 description 2
- 239000012491 analyte Substances 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 239000012131 assay buffer Substances 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 102000007478 beta-N-Acetylhexosaminidases Human genes 0.000 description 2
- 108010085377 beta-N-Acetylhexosaminidases Proteins 0.000 description 2
- 230000005540 biological transmission Effects 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 206010006451 bronchitis Diseases 0.000 description 2
- 238000010804 cDNA synthesis Methods 0.000 description 2
- 238000010805 cDNA synthesis kit Methods 0.000 description 2
- AIYUHDOJVYHVIT-UHFFFAOYSA-M caesium chloride Chemical compound [Cl-].[Cs+] AIYUHDOJVYHVIT-UHFFFAOYSA-M 0.000 description 2
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 229960002376 chymotrypsin Drugs 0.000 description 2
- 238000004590 computer program Methods 0.000 description 2
- 238000010276 construction Methods 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- NKLPQNGYXWVELD-UHFFFAOYSA-M coomassie brilliant blue Chemical compound [Na+].C1=CC(OCC)=CC=C1NC1=CC=C(C(=C2C=CC(C=C2)=[N+](CC)CC=2C=C(C=CC=2)S([O-])(=O)=O)C=2C=CC(=CC=2)N(CC)CC=2C=C(C=CC=2)S([O-])(=O)=O)C=C1 NKLPQNGYXWVELD-UHFFFAOYSA-M 0.000 description 2
- 235000020247 cow milk Nutrition 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 238000002405 diagnostic procedure Methods 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- 235000005911 diet Nutrition 0.000 description 2
- 230000037213 diet Effects 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 239000000428 dust Substances 0.000 description 2
- 239000013613 expression plasmid Substances 0.000 description 2
- 239000013568 food allergen Substances 0.000 description 2
- 230000002496 gastric effect Effects 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 229940046528 grass pollen Drugs 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 238000003119 immunoblot Methods 0.000 description 2
- 210000003000 inclusion body Anatomy 0.000 description 2
- 231100000037 inhalation toxicity test Toxicity 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 230000035800 maturation Effects 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- 230000011987 methylation Effects 0.000 description 2
- 238000007069 methylation reaction Methods 0.000 description 2
- 238000010369 molecular cloning Methods 0.000 description 2
- 238000003199 nucleic acid amplification method Methods 0.000 description 2
- 208000007892 occupational asthma Diseases 0.000 description 2
- 238000004806 packaging method and process Methods 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 108040007629 peroxidase activity proteins Proteins 0.000 description 2
- 239000008194 pharmaceutical composition Substances 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 2
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 2
- 235000014102 seafood Nutrition 0.000 description 2
- 238000012163 sequencing technique Methods 0.000 description 2
- 239000001632 sodium acetate Substances 0.000 description 2
- 235000017281 sodium acetate Nutrition 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 235000013599 spices Nutrition 0.000 description 2
- 108060008226 thioredoxin Proteins 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 230000008673 vomiting Effects 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 2
- UHEPSJJJMTWUCP-DHDYTCSHSA-N (2r,3r,4r,5r)-2-[(1s,2s,3r,4s,6r)-4,6-diamino-3-[(2s,3r,4r,5s,6r)-3-amino-4,5-dihydroxy-6-[(1r)-1-hydroxyethyl]oxan-2-yl]oxy-2-hydroxycyclohexyl]oxy-5-methyl-4-(methylamino)oxane-3,5-diol;sulfuric acid Chemical compound OS(O)(=O)=O.OS(O)(=O)=O.O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H]([C@@H](C)O)O2)N)[C@@H](N)C[C@H]1N UHEPSJJJMTWUCP-DHDYTCSHSA-N 0.000 description 1
- QFVHZQCOUORWEI-UHFFFAOYSA-N 4-[(4-anilino-5-sulfonaphthalen-1-yl)diazenyl]-5-hydroxynaphthalene-2,7-disulfonic acid Chemical compound C=12C(O)=CC(S(O)(=O)=O)=CC2=CC(S(O)(=O)=O)=CC=1N=NC(C1=CC=CC(=C11)S(O)(=O)=O)=CC=C1NC1=CC=CC=C1 QFVHZQCOUORWEI-UHFFFAOYSA-N 0.000 description 1
- 208000004998 Abdominal Pain Diseases 0.000 description 1
- 240000006487 Aciphylla squarrosa Species 0.000 description 1
- 208000016557 Acute basophilic leukemia Diseases 0.000 description 1
- 235000011746 Amaranthus hypochondriacus Nutrition 0.000 description 1
- 240000003147 Amaranthus hypochondriacus Species 0.000 description 1
- 241000219195 Arabidopsis thaliana Species 0.000 description 1
- 241000743776 Brachypodium distachyon Species 0.000 description 1
- 101100268670 Caenorhabditis elegans acc-3 gene Proteins 0.000 description 1
- 241000220451 Canavalia Species 0.000 description 1
- 102000052052 Casein Kinase II Human genes 0.000 description 1
- 108010010919 Casein Kinase II Proteins 0.000 description 1
- 241000207199 Citrus Species 0.000 description 1
- 108020004705 Codon Proteins 0.000 description 1
- 108091035707 Consensus sequence Proteins 0.000 description 1
- 240000001980 Cucurbita pepo Species 0.000 description 1
- 235000009852 Cucurbita pepo Nutrition 0.000 description 1
- 235000002767 Daucus carota Nutrition 0.000 description 1
- 244000000626 Daucus carota Species 0.000 description 1
- 241001338022 Daucus carota subsp. sativus Species 0.000 description 1
- 206010012438 Dermatitis atopic Diseases 0.000 description 1
- 208000035240 Disease Resistance Diseases 0.000 description 1
- 235000009419 Fagopyrum esculentum Nutrition 0.000 description 1
- 240000008620 Fagopyrum esculentum Species 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 102000005720 Glutathione transferase Human genes 0.000 description 1
- 108010070675 Glutathione transferase Proteins 0.000 description 1
- 244000043261 Hevea brasiliensis Species 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 244000017020 Ipomoea batatas Species 0.000 description 1
- 235000002678 Ipomoea batatas Nutrition 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- 229930182816 L-glutamine Natural products 0.000 description 1
- 235000004431 Linum usitatissimum Nutrition 0.000 description 1
- 240000006240 Linum usitatissimum Species 0.000 description 1
- 241000243662 Lumbricus terrestris Species 0.000 description 1
- 241000219828 Medicago truncatula Species 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 244000302512 Momordica charantia Species 0.000 description 1
- 235000009811 Momordica charantia Nutrition 0.000 description 1
- 241000208125 Nicotiana Species 0.000 description 1
- 241000208128 Nicotiana glauca Species 0.000 description 1
- 241000208136 Nicotiana sylvestris Species 0.000 description 1
- 208000028571 Occupational disease Diseases 0.000 description 1
- 206010073310 Occupational exposures Diseases 0.000 description 1
- 108700026244 Open Reading Frames Proteins 0.000 description 1
- 241000223792 Paramecium tetraurelia Species 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 235000006089 Phaseolus angularis Nutrition 0.000 description 1
- 241000209504 Poaceae Species 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 238000002123 RNA extraction Methods 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 208000037656 Respiratory Sounds Diseases 0.000 description 1
- 235000003142 Sambucus nigra Nutrition 0.000 description 1
- 240000006028 Sambucus nigra Species 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 1
- 108091081024 Start codon Proteins 0.000 description 1
- 241000258128 Strongylocentrotus purpuratus Species 0.000 description 1
- 108010006368 Thioredoxin h Proteins 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- COQLPRJCUIATTQ-UHFFFAOYSA-N Uranyl acetate Chemical compound O.O.O=[U]=O.CC(O)=O.CC(O)=O COQLPRJCUIATTQ-UHFFFAOYSA-N 0.000 description 1
- 235000010749 Vicia faba Nutrition 0.000 description 1
- 240000006677 Vicia faba Species 0.000 description 1
- 240000007098 Vigna angularis Species 0.000 description 1
- 235000010711 Vigna angularis Nutrition 0.000 description 1
- 235000014787 Vitis vinifera Nutrition 0.000 description 1
- 240000006365 Vitis vinifera Species 0.000 description 1
- 206010047924 Wheezing Diseases 0.000 description 1
- 240000003307 Zinnia violacea Species 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 230000037446 allergic sensitization Effects 0.000 description 1
- 102000004139 alpha-Amylases Human genes 0.000 description 1
- 108090000637 alpha-Amylases Proteins 0.000 description 1
- 229940024171 alpha-amylase Drugs 0.000 description 1
- 229940019748 antifibrinolytic proteinase inhibitors Drugs 0.000 description 1
- 230000001174 ascending effect Effects 0.000 description 1
- 201000008937 atopic dermatitis Diseases 0.000 description 1
- 210000003050 axon Anatomy 0.000 description 1
- 210000003651 basophil Anatomy 0.000 description 1
- 239000013575 birch pollen allergen Substances 0.000 description 1
- HOQPTLCRWVZIQZ-UHFFFAOYSA-H bis[[2-(5-hydroxy-4,7-dioxo-1,3,2$l^{2}-dioxaplumbepan-5-yl)acetyl]oxy]lead Chemical compound [Pb+2].[Pb+2].[Pb+2].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O.[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O HOQPTLCRWVZIQZ-UHFFFAOYSA-H 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000020411 cell activation Effects 0.000 description 1
- 239000013592 cell lysate Substances 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 210000000991 chicken egg Anatomy 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 235000020971 citrus fruits Nutrition 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 238000000432 density-gradient centrifugation Methods 0.000 description 1
- 238000003795 desorption Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 239000010432 diamond Substances 0.000 description 1
- 229910003460 diamond Inorganic materials 0.000 description 1
- 238000003748 differential diagnosis Methods 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- SLPJGDQJLTYWCI-UHFFFAOYSA-N dimethyl-(4,5,6,7-tetrabromo-1h-benzoimidazol-2-yl)-amine Chemical compound BrC1=C(Br)C(Br)=C2NC(N(C)C)=NC2=C1Br SLPJGDQJLTYWCI-UHFFFAOYSA-N 0.000 description 1
- 229940042399 direct acting antivirals protease inhibitors Drugs 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 208000002173 dizziness Diseases 0.000 description 1
- 235000013601 eggs Nutrition 0.000 description 1
- 238000001493 electron microscopy Methods 0.000 description 1
- 235000008995 european elder Nutrition 0.000 description 1
- 238000009313 farming Methods 0.000 description 1
- 206010016766 flatulence Diseases 0.000 description 1
- 235000004426 flaxseed Nutrition 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 238000013467 fragmentation Methods 0.000 description 1
- 238000006062 fragmentation reaction Methods 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 235000002532 grape seed extract Nutrition 0.000 description 1
- 229960001340 histamine Drugs 0.000 description 1
- 230000000984 immunochemical effect Effects 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 239000004816 latex Substances 0.000 description 1
- 229920000126 latex Polymers 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 238000009630 liquid culture Methods 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 238000001819 mass spectrum Methods 0.000 description 1
- 238000000816 matrix-assisted laser desorption--ionisation Methods 0.000 description 1
- 238000001840 matrix-assisted laser desorption--ionisation time-of-flight mass spectrometry Methods 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- NZWOPGCLSHLLPA-UHFFFAOYSA-N methacholine Chemical compound C[N+](C)(C)CC(C)OC(C)=O NZWOPGCLSHLLPA-UHFFFAOYSA-N 0.000 description 1
- 229960002329 methacholine Drugs 0.000 description 1
- 238000010208 microarray analysis Methods 0.000 description 1
- 238000001000 micrograph Methods 0.000 description 1
- 230000000877 morphologic effect Effects 0.000 description 1
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 1
- 238000002887 multiple sequence alignment Methods 0.000 description 1
- 230000007498 myristoylation Effects 0.000 description 1
- QCTHLCFVVACBSA-JVNHZCFISA-N n-[(2s,3r,4r,5s,6r)-4,5-dihydroxy-6-(hydroxymethyl)-2-(4-methyl-2-oxochromen-7-yl)oxyoxan-3-yl]acetamide Chemical compound CC(=O)N[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1OC1=CC=C(C(C)=CC(=O)O2)C2=C1 QCTHLCFVVACBSA-JVNHZCFISA-N 0.000 description 1
- 235000021278 navy bean Nutrition 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 231100000675 occupational exposure Toxicity 0.000 description 1
- 210000002220 organoid Anatomy 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000008506 pathogenesis Effects 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 238000013379 physicochemical characterization Methods 0.000 description 1
- 210000002381 plasma Anatomy 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 238000011533 pre-incubation Methods 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 239000012268 protein inhibitor Substances 0.000 description 1
- 229940121649 protein inhibitor Drugs 0.000 description 1
- 239000010453 quartz Substances 0.000 description 1
- 230000008707 rearrangement Effects 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000003014 reinforcing effect Effects 0.000 description 1
- 238000012827 research and development Methods 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 239000012723 sample buffer Substances 0.000 description 1
- 239000013049 sediment Substances 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000004904 shortening Methods 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 239000004332 silver Substances 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 239000012064 sodium phosphate buffer Substances 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 230000009897 systematic effect Effects 0.000 description 1
- 238000004627 transmission electron microscopy Methods 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- 238000005199 ultracentrifugation Methods 0.000 description 1
- 210000003934 vacuole Anatomy 0.000 description 1
- 125000002987 valine group Chemical group [H]N([H])C([H])(C(*)=O)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- AFVLVVWMAFSXCK-UHFFFAOYSA-N α-cyano-4-hydroxycinnamic acid Chemical compound OC(=O)C(C#N)=CC1=CC=C(O)C=C1 AFVLVVWMAFSXCK-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/35—Allergens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/35—Allergens
- A61K39/36—Allergens from pollen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/415—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from plants
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6854—Immunoglobulins
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Organic Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Hematology (AREA)
- Biochemistry (AREA)
- Urology & Nephrology (AREA)
- Mycology (AREA)
- Epidemiology (AREA)
- Biomedical Technology (AREA)
- Pulmonology (AREA)
- Food Science & Technology (AREA)
- Biophysics (AREA)
- Biotechnology (AREA)
- Genetics & Genomics (AREA)
- Cell Biology (AREA)
- Gastroenterology & Hepatology (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Botany (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Настоящее изобретение относится к биотехнологии, конкретно к новым аллергенам, и может быть использовано в диагностике аллергии. Новые аллергены используют в способе диагностики IgE-опосредованной аллергии in vitro на пшеницу, включающем контактирование образца жидкости организма из млекопитающего, у которого предполагается наличие IgE-опосредованной аллергии на пшеницу, по меньшей мере, с одним полипептидом с SEQ ID NO: 2 или 8, или с его фрагментом или вариантом, имеющим общие эпитопы для антител с указанным полипептидом и имеющим последовательность, идентичную SEQ ID NO: 2 или 8 по крайней мере на 95%; и выявление присутствия в образце IgE-антител, специфично связывающихся с указанным полипептидом или полипептидами. Присутствие в образце таких антител является показателем IgE-опосредованной аллергии на пшеницу. Диагностический набор включает указанные полипептиды и средства для выявления связывания IgE с указанным полипептидом, такие как твердая подложка, например нитроцеллюлозная мембрана или микроматрица, содержащая связанный с ней полипептид. Изобретение позволяет эффективно диагностировать IgE-опосредованную аллергию на пшеницу. 5 н. и 3 з.п. ф-лы, 13 ил., 9 табл., 4 пр.
Description
Область техники, к которой относится изобретение
Настоящее изобретение относится к области IgE-опосредованной аллергии, в частности, к профессиональной астме, такой как астма пекарей. Более конкретно изобретение относится к идентификации нового аллергена пшеницы и его применению при терапии и диагностики. Изобретение также относится к способам диагностики и лечения IgE-опосредованной аллергии у млекопитающих.
Уровень техники
Аллергены пшеницы (Triticum aestivum) могут вызывать три разных типа IgE-опосредованной аллергии, респираторную аллергию в результате вдыхания пшеничной муки, пищевую аллергию в результате употребления в пищу продуктов из пшеницы и аллергию на пыльцу пшеницы, которая относится к группе аллергий на пыльцу растений. Аллергическая сенсибилизация к компонентам пшеничной муки является одной из наиболее частых причин профессиональной астмы, и поражает примерно 1-10% работников пекарен, поэтому заболевание называют астмой пекарей. У таких работников пекарни вырабатываются IgE-антитела против аллергенов пшеничной муки и индуцированная действием муки астма и/или ринит. Подтверждение предположения о том, что астма пекарей является настоящим профессиональным заболеванием, получено в результате обнаружения того, что распространенность сенсибилизации к ассоциированным с производством выпечки аллергенов примерно в десять раз выше у людей, подвергающихся воздействию муки, по сравнению с контрольными популяциями, не контактирующими с мукой. Кроме того, оказалось возможным установить пороговые значения в случае воздействия пшеничной муки, которые, как известно, вызывают бронхиальную астму у сенсибилизированных людей. Первое систематическое исследование аллергии на муку было осуществлено еще в 1933 году Baggoe. Другие более ранние сообщения сфокусированы на описании случаев астмы пекарей после механистических исследований, показывающих важность IgE-опосредованных механизмов в развитии астмы пекарей. Затем было предпринято несколько попыток охарактеризовать вызывающие заболевание аллергены муки иммунохимическими способами, с использованием методики RAST, иммуноблоттинга, а недавно с использованием методики молекулярного клонирования.
Triticum aestivum является важным представителем семейства злаковых трав. До 40% всех пациентов с аллергией несут сывороточные IgE-антитела, взаимодействующие с аллергенами пыльцы растений. В нескольких исследованиях сообщалось о перекрестной реактивности между пшеничной мукой и пыльцой растений вследствие наличия общих эпитопов для IgE в белках пшеничной муки и пыльцы растений. Описана перекрестная реактивность между аллергенами пыльцы растений и аллергенами зерна пшеницы, и существует доказательство того, что пациенты, страдающие астмой пекарей и IgE-опосредованной пищевой аллергией на пшеницу, могут узнавать разные аллергены, которые можно использовать для дифференциальной диагностики астмы пекарей, пищевой аллергии на пшеничную муку и аллергии на пыльцу растений. Однако огромное количество растворимых аллергенов пшеничной муки еще не идентифицировано. В настоящее время идентифицировано и охарактеризовано только небольшое количеств аллергенов пшеничной муки, и к ним относятся представители семейства ингибиторов альфа-амилазы, ацил-CoA-оксидаза, пероксидаза, фруктозодифосфатальдолаза, и в последнее время тиоредоксины.
Диагностика, основанная на использовании экстракта пшеничной муки, не позволяет обнаружить различие между пациентами, страдающими респираторной аллергией или пищевой аллергией на пшеницу. Поэтому точная диагностика все еще основана на специальной ингаляционной провокации в случае респираторной аллергии на пшеничную муку и двойной слепой плацебо-контролируемой пищевой провокации (DBPCFC) в случае предполагаемой пищевой аллергии, и остается открытым вопрос, можно ли идентифицировать аллергены, которые могут быть использованы для селективной диагностики и лечения различных индуцированных пшеницей проявлений аллергии, таких как астма пекарей, пищевая аллергия и поллинозы. Таким образом, существует необходимость в идентификации новых аллергенов пшеницы и разработки способов и диагностических тестов, чтобы более точно выявлять пациентов, страдающих IgE-опосредованной аллергией, такой как респираторная аллергия, например, астма пекарей, чтобы отличать их от пациентов, страдающих пищевой аллергией и/или аллергией на пыльцу. Кроме того, существует необходимость в применении таких новых аллергенов пшеницы для лечения IgE-опосредованной аллергии. Настоящее изобретение обращено к проблеме, связанной с необходимостью получения новых аллергенов пшеницы и их применением для терапии и диагностики. Кроме того, настоящее изобретение относится к применению известных пептидов и белков в терапии и диагностике. Некоторые из таких пептидов известны: Gennaro S. D. et al., Biological Chemistry, April 2005, 386: 383-389; UNIPROT, номер доступа P82977; UNIPROT, номер доступа Q6W8Q2; US 7214786 и US2006/0107345.
Сущность изобретения
Как указано выше, несколько аллергенов пшеничной муки, которые были идентифицированы и охарактеризованы, включают представителей семейства ингибиторов альфа-амилазы, ацил-CoA-оксидазу, пероксидазу, фруктозодифосфатальдолазу и тиоредоксины. До настоящего времени не были идентифицированы аллергены, которые можно применять для селективной диагностики и лечения различных индуцированных пшеницей проявлений аллергии, таких как астма пекарей, пищевая аллергия и поллиноз. Это привело авторов настоящего изобретения к поиску дополнительных, еще не идентифицированных аллергенов пшеницы.
Настоящее изобретение, по меньшей мере, частично удовлетворяет потребность предшествующего уровня техники, так как предлагает новые аллергены пшеницы и способы диагностики и лечения IgE-опосредованной аллергии у млекопитающих.
В первом аспекте изобретение относится к полипептидам, представляющим собой новые аллергены пшеницы, выделенным из пшеницы или полученным рекомбинантно, и их фрагментам или вариантам, имеющим общие эпитопы для антител. Изолированные полипептиды содержат аминокислотную последовательность клона №10, №112 или №126.
Во втором аспекте изобретение относится к нуклеиновым кислотам, кодирующим полипептиды согласно изобретению, нуклеиновым кислотам, имеющим нуклеотидную последовательность клона №10, №112 или №126.
В другом аспекте изобретение относится к полипептиду, обладающему идентичностью с клонами №10, №38, №112 или №126, для применения в терапии или диагностике, предпочтительно терапии и диагностике IgE-опосредованной аллергии, такой как респираторная аллергия на пшеничную муку, например, астма пекарей. Кроме того, изобретение относится к изолированному полипептиду, содержащему аминокислотную последовательность клона №37, для применения в терапии или диагностике, предпочтительно терапии и диагностике IgE-опосредованной аллергии, такой как респираторная аллергия на пшеничную муку, например, астма пекарей.
В еще одном аспекте изобретение относится к фармацевтической композиции, содержащей полипептид, обладающий идентичностью с клонами №10, №38, №112, №126 или №37, или к его гипоаллергенной форме, модифицированной с тем, чтобы отменить или ослабить IgE-связывающий ответ, и необязательно фармацевтически приемлемые эксципиенты, носители, буферы и/или разбавители. Гипоаллергенная форма полипептида, обладающего идентичностью с клонами №10, №38, №112, №126 или №37, может быть модифицирована посредством фрагментации, укорочения или образования тандема молекулы, делеции внутренних участков, перестановки доменов, замены аминокислотных остатков, разрушения дисульфидных мостиков.
В следующем аспекте изобретение относится к композиции аллергенов, «обогащенной» полипептидом, обладающим идентичностью с клонами №10, №38, №112, №126 или №37. Такая композиция аллергенов может представлять собой экстракт аллергенов или смесь очищенных или рекомбинантных аллергенных компонентов, которые не содержат или содержат небольшое количество полипептида согласно изобретению, при этом полипептид добавляют для того, чтобы связать IgE у пациентов, у которых IgE может быть не связан или слабо связан с другими аллергенными компонентами в композиции. Данный аспект изобретения также относится к способу получения такой композиции, и такой способ включает стадию добавления полипептида, обладающего идентичностью с клонами №10, №38, №112, №126 или №37, к композиции аллергенов, такой как экстракт аллергенов (необязательно обогащенный другими компонентами) или смесь очищенных нативных или рекомбинантных аллергенных компонентов.
В следующем аспекте изобретение относится к композиции аллергенов, получаемой описанным выше способом.
Изобретение, кроме того, относится к способу диагностики in vitro IgE-опосредованной аллергии, включающему стадии контактирования образца жидкости, такого как образец крови, плазмы или сыворотки, из организма млекопитающего, у которого предполагается наличие IgE-опосредованной аллергии, такой как респираторная аллергия на пшеничную муку, например, астма пекарей, с полипептидом, обладающим идентичностью с клонами №10, №38, №112, №126 или №37, и выявления присутствия в образце IgE-антител, которые специфично связываются с полипептидами по изобретению. Присутствие таких антител, специфично связывающихся с полипептидом, обладающим идентичностью с клонами №10, №38, №112, №126 или №37, является показателем IgE-опосредованной аллергии. Один вариант такого способа включает осуществление способа с использованием анализа на микроматрице.
В следующем аспекте изобретения предлагается диагностический набор для осуществления способа диагностики in vitro IgE-опосредованной аллергии, такой как респираторная аллергия на пшеничную муку, например, астма пекарей, при этом указанный набор содержит полипептид, обладающий идентичностью с клонами №10, №38, №112, №126 или №37, и средства для выявления связывания IgE с указанным полипептидом, такие как твердая подложка, например, нитроцеллюлозная мембрана или микроматрица, содержащая связанный с ней полипептид, обладающий идентичностью с клонами №10, №38, №112, №126 или №37.
В следующем аспекте изобретение относится к способу лечения IgE-опосредованной аллергии у млекопитающего, такой как респираторная аллергия, например, астма пекарей. В одном варианте способ включает введение пациенту, чувствительному к такому лечению, полипептида, обладающего идентичностью с клонами №10, №38, №112, №126 или №37, или его фрагмента или варианта, имеющих общие эпитопы для антител. В другом варианте способ включает введение пациенту, чувствительному к такому лечению, фармацевтической композиции согласно предыдущему аспекту.
Определения
| Таблица A Определения клонов |
||
| Клон | Последовательность нуклеиновой кислоты | Аминокислотная последовательность |
| #10 | SEQ ID №1 | SEQ ID № 2 |
| #37 | SEQ ID №3 | SEQ ID №4 |
| #38 | SEQ ID №5 | SEQ ID №6 |
| #112 | SEQ ID №7 | SEQ ID №8 |
| #126 | SEQ ID №9 | SEQ ID №10 |
Следует считать, что варианты и фрагменты полипептида по изобретению означают белки или пептиды длиной, по меньшей мере, 10 аминокислот, более предпочтительно, по меньшей мере 25, еще более предпочтительно, по меньшей мере, 50 или 75 аминокислотных остатков, и идентичность последовательности с указанным полипептидом, составляющую, по меньшей мере, 50 %, предпочтительно более 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98% или 99%.
Модифицированный полипептид в контексте настоящего изобретения следует толковать как полипептид, который был химически или генетически модифицирован для того, чтобы изменить его иммунологические свойства, например, как проиллюстрировано в отношении аспекта изобретения, связанного с иммунотерапией.
Варианты и фрагменты полипептида, имеющего общие с указанным полипептидом эпитопы для антител, следует толковать как такие фрагменты и варианты, связывание которых с IgE-антителами из образца сыворотки типичного пациента, сенсибилизированного полипептидом согласно изобретению, может быть в значительной степени ингибировано полипептидом. Такой анализ ингибирования может быть, например, осуществлен согласно протоколу, описанному в примере 4.
Гипоаллергенный модифицированный полипептид или вариант или фрагмент полипептида следует толковать как модифицированный полипептид или вариант или фрагмент полипептида, который не способен связывать IgE-антитела, реактивные к указанному полипептиду, из образца сыворотки типичного сенсибилизированного полипептидом пациента, который определен, например, в протоколе согласно примеру 1 или который не проявляет или проявляет в значительной степени сниженную биологическую аллергенную активность, которую определяют с использованием анализа активации клеток, такого как анализ высвобождения гистамина базофилами.
Краткое описание таблиц и фигур
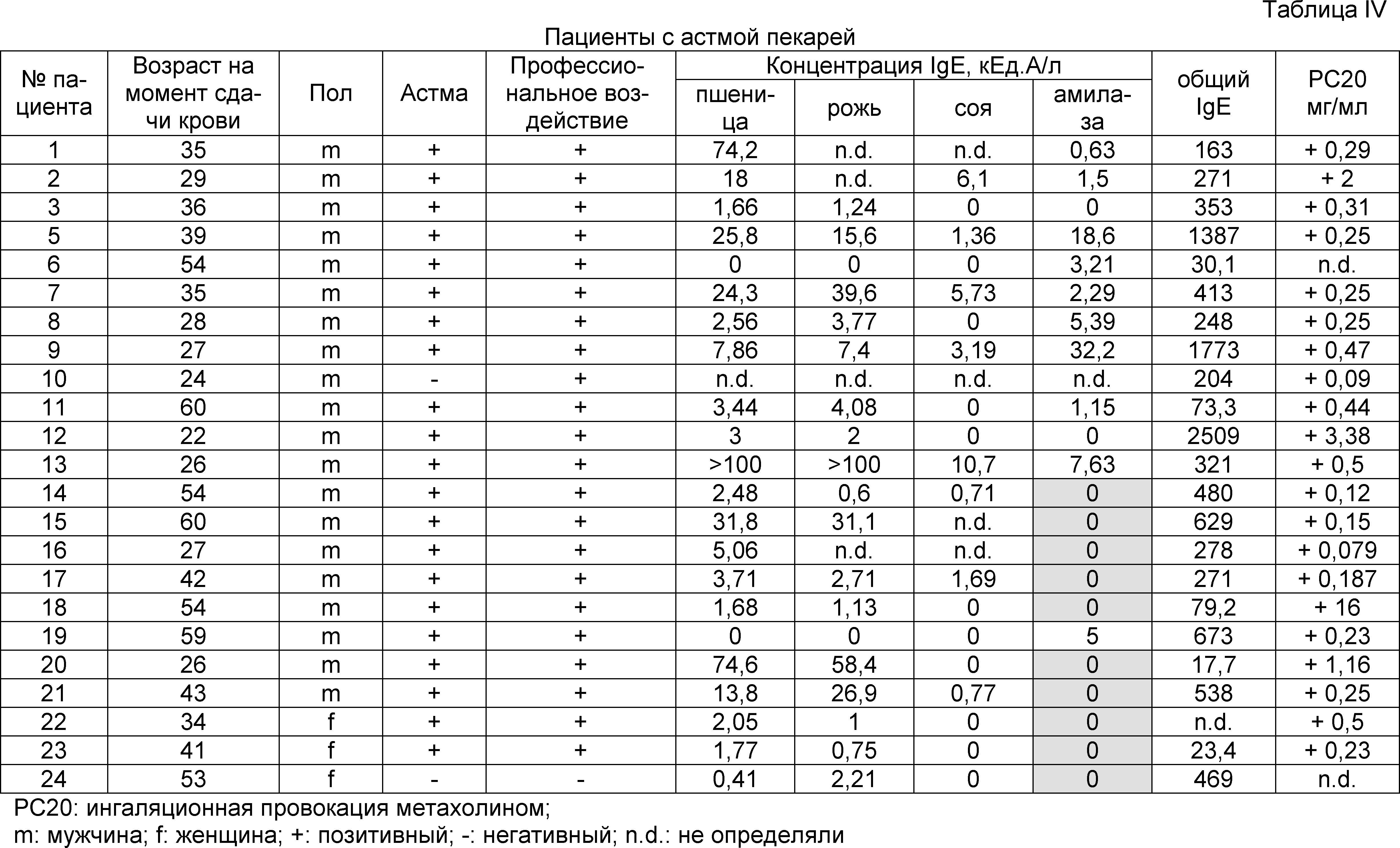
В таблице I показаны демографические, клинические и серологические характеристики пациентов, страдающих астмой пекарей.
В таблице II показаны демографические, клинические и серологические характеристики пациентов, страдающих пищевой аллергией на пшеницу (F1-F4) и аллергией на пыльцу растений (G1-G4).
В таблице III показаны идентичности аминокислотных последовательностей в процентах между полученным из клона 10 аллергеном и гомологичными белками, где следующие белки пронумерованы 1-30: 1. gi|122065237 (Triticum aestivum), 2. gi|66356278 (Triticum aestivum), 3. gi|124122 (Hordeum vulgare подвид vulgare), 4. gi|48093360 (Zea diploperennis), 5. gi|48093418 (Tripsacum dactyloides), 6. gi|75994161 (Zea mays подвид parviglumis), 7. gi|58396945 (Oryza sativa [группа японских сортов]), 8. gi|115649132 (Strongylocentrotus purpuratus), 9. gi|37904392 (Brachypodium distachyon), 10. gi|26224744 (Citrus x paradise), 11. gi|224447 (Vicia faba), 12. gi|124395862 (Paramecium tetraurelia), 13. gi|50262213 (Cucurbita maxima), 14. gi|547743 (Nicotiana sylvestris), 15. gi|54610713 (Lumbricus terrestris), 16. gi|169491 (Solarium tuberosum), 17. gi|218290 (Nicotiana glauca x Nicotiana langsdorffiij, 18. gi|124121 (Vigna angularis), 19. gi|603890 (Sambucus nigra), 20. gi|14718445 (Ipomoea batatas), 21. gi|114950 (Momordica charantia), 22. gi|109138554 (Fagopyrum esculentum), 23. gi|18404883 (Arabidopsis thaliana), 24. gi|27734408 (Canavalia lineate), 25. gi|37901103 (Hevea brasiliensis), 26. gi|92874842 (Medicago truncatula), 27. gi|13959383 (Linum usitatissimum), 28. gi|22759723 (Zinnia elegans), 29. gi|37359345 (Vitis vinifera) и 30. gi|6453287 (Amaranthus hypochondriacus).
В таблице IV показаны клинические данные для пациентов с астмой пекарей из примера 2.
В таблице V показаны клинические данные для пациентов с пищевой аллергией и аллергией на пыльцу растений из примера 2.
В таблице VI показаны ПЦР-праймеры, используемые для амплификации кДНК клонов №10, №38, №112, №123, №126 и №37.
Таблица VII. Демографические, клинические и серологические характеристики пациентов, страдающих астмой пекарей.
Таблица VIII. Демографические, клинические и серологические характеристики пациентов, страдающих аллергией на пыльцу растений.
Таблица IX. Демографические, клинические и серологические характеристики пациентов, страдающих пищевой аллергией на пшеницу.
Фигура 1 иллюстрирует нуклеотидную и рассчитанную аминокислотную последовательность полученного из клона 10 аллергена (SEQ ID NO: 1). Кодирующая и не кодирующая области показаны заглавными буквами и строчными буквами, соответственно, стартовый кодон (ATG) и стоп-кодон подчеркнуты. Надписи аминокислот семейства ингибиторов I картофеля напечатаны на сером фоне. Номера слева указаны для нуклеотидов, а номера справа указаны для аминокислот. Последовательность представлена в GenBank с номером доступа (EU051824).
Фигура 2 иллюстрирует определение параметров очищенного аллергена, подобного ингибитору сериновой протеиназы. A: Окрашенный Кумасси бриллиантовым синим SDS-ПААГ, содержащий очищенный полученный из клона 10 аллерген. Маркер молекулярной массы (кД) показан слева. B: Масс-спектрометрия (МС) очищенного полученного из клона 10 аллергена. Отношение масса/заряд показано на оси x, а интенсивность показана на оси y в виде процента от наиболее интенсивного сигнала, полученного в исследованном диапазоне масс. C: Анализ кругового дихроизма (КД) в дальней ультрафиолетовой области очищенного полученного из клона 10 аллергена. Спектры представлены в виде средней эллиптичности остатков (θ) (ось y), регистрируемой при 25°C (жирная линия), 95°C (обычная линия) и 25°C после охлаждения (пунктирная линия) при заданных длинах волн (ось x).
Фигура 3 иллюстрирует реактивность IgE у пациентов, страдающих астмой пекарей, аллергией на пыльцу растений и пищевой аллергией. Очищенный полученный из клона 10 аллерген, HSA, rPh1 p 1, rPh1 p 5, rPh1 p 7, rPh1 p 12, экстракт пыльцы пшеницы и экстракт зерна пшеницы в виде пятен наносили на полоски нитроцеллюлозной мембраны и инкубировали с сыворотками 22 пациентов с астмой пекарей (1-22), четырьмя сыворотками пациентов с аллергией на пыльцу растений (G1-G4), четырьмя сыворотками пациентов, страдающих пищевой аллергией на пшеницу (F1-F4), одной сывороткой человека, не страдающего аллергией (NC) и с буфером без добавления сыворотки (B). Связанные IgE-антитела выявляли с использованием 125I-меченых антител против IgE человека и визуализировали с помощью авторадиографии.
На фигуре 4 представлена коробчатая диаграмма реактивностей подклассов IgG по отношению к полученному из клона 10 аллергену. Реактивность подклассов IgG1-4 к полученному из клона 10 аллергену определяли в ELISA для пациентов, страдающих астмой пекарей (n=22) и представляли в виде коробчатых диаграмм, где 50% значений находятся в пределах прямоугольников и не являются выбросами за пределы линий, указывающих величины ошибки. Линии внутри прямоугольников указывают медианные значения, кружками указаны выбросы и звездочками указаны экстремальные значения.
Фигура 5 иллюстрирует аллергенную активность аллергена, полученного из клона 10. Клетки RBL нагружали IgE сыворотки от трех пациентов с астмой пекарей (№2, №4, №12) или сывороткой не страдающего аллергией пациента (NC) и затем провоцировали рекомбинантным полученным из клона 10 аллергеном или аллергеном пыльцы тимофеевки луговой rPh1 p 1. Средние значения высвобождения β-гексозаминидазы показаны по оси y в виде процента от общего высвобождения после вычитания процента спонтанного высвобождения.
На фигуре 6 показана экспрессия аллергена, подобного ингибитору сериновых протеиназ, в семенах во время созревания семян. Нитроцеллюлозные блоты экстракта пшеницы из незрелых (7, 10, 15, 20, 25, 30, 35 день) и зрелых (M) семян пшеницы анализировали, используя кроличьи антитела, специфичные для полученного из клона 10 аллергена, и в целях контроля используя соответствующую сыворотку до иммунизации. Молекулярные массы указаны слева в килодальтонах (кД).
На фигуре 7 показана идентификация полученного из клона 10 аллергена в пыльце пшеницы и экстрактах семян. Экстракты на нитроцеллюлозных блотах анализировали, используя кроличьи антитела, специфичные для полученного из клона 10 аллергена (20), антитела, специфичные для профилина пшеницы (I №123), для клещевого аллергена (NC), или используя буфер без добавления кроличьих антител (B). Соответствующие сыворотки, полученные до иммунизации, указаны как P №10 и P №123, соответственно. Связанные IgG-антитела выявляли с использованием 125I-меченых антител осла против Ig кролика и визуализировали с помощью авторадиографии. Маркеры молекулярной массы (в кД) указаны слева.
Фигура 8 иллюстрирует выявление аллергена, подобного ингибитору сериновых протеиназ, в экстрактах семян пшеницы, риса, кукурузы, фасоли и картофеля. A: Окрашенный Кумасси синим гель, содержащий экстракты пшеницы (W), риса (R) и кукурузы (M), фасоли обыкновенной (B) и картофеля (P). B: Экстракты на нитроцеллюлозных блотах подвергали воздействию сыворотки кролика до иммунизации и C: воздействию антител, специфичных для полученного из клона 10 аллергена. Молекулярные массы (кД) указаны слева.
На фигуре 9 показана локализация полученного из клона 10 аллергена в семенах пшеницы с помощью трансмиссионной электронной микроскопии с иммунологическим мечением частицами золота. A и B: Поперечный срез зерна пшеницы при малом (A) и большом (B) увеличении. На фигуре A показана плодовая оболочка и семенная оболочка (C), алейроновый слой (AL) и начало крахмалистого эндосперма (SE). Прямоугольником на фигуре A показана область, сопоставимая с областью, показанной на фигуре B, т.е. граница между алейроновым слоем и крахмалистым эндоспермом. Прямоугольниками на фигуре B очерчены области, показанные при большом увеличении на фигурах C, D и E, F, соответственно. C и D: Детальное изображение алейроновой клетки зерна пшеницы, исследованной с использованием Ig кролика, полученного против клона 10 (C) или Ig, полученного до иммунизации (D). E и F: Микрофотография при большом увеличении крахмалистого эндосперма после локализации на основе иммунологического мечения частицами золота белка пшеницы 10 с использованием Ig кролика, полученного против Ig клона 10 (E) или Ig до иммунизации (F). Связанные кроличьи антитела выявляли с помощью конъюгированной с золотом антисыворотки козы против Ig кролика (частицы золота = черные точки). Стрелки указывают частицы коллоидного золота. Линиями указано: A, 20 мкм; B, 5 мкм; C-F, 0,5 мкм. AG, алейроновое зерно; AL, алейроновый слой; C, многослойная плодовая и семенная оболочка; CY, вещества цитоплазмы; L, липидное тельце; M, митохондрия; SE, крахмалистый эндосперм; SG, крахмально зерно; W, клеточная стенка.
Фигура 10. Дот-блот-анализ IgE пациентов, страдающих астмой пекарей.
Фигура 11. Дот-блот-анализ IgE пациентов, страдающих пищевой аллергией на пшеницу и аллергии на пыльцу растений.
Фигура 12. Микроматрица аллергенов. A: Схема нанесения на микроматрицу белков и экстракта пыльцы пшеницы. Рекомбинантные белки пшеницы обозначены: 10, 37, 38, 112, 123, 126; WP: экстракт пыльцы пшеницы; рекомбинантные аллергены пыльцы тимофеевки луговой: Ph1 p 1, Ph1 p 5, Ph1 p 7 и Ph1 p 12. Числами в находящемся снизу прямоугольнике указаны маркеры положения. B и C: Изображения микроматриц после инкубации с сывороткой и выявления IgE-реактивных пятен с использованием конъюгированных с флуорофором анти-IgE-антител. B: Изображение после инкубации с сывороткой пациента, не страдающего аллергией. C: Изображения после инкубации с сывороткой типичного пациента, страдающего астмой пекарей (1:B4), индуцированной пшеницей пищевой аллергией (2:F26), аллергией на пыльцу растений (3:G16). Пятнами снизу стекол указаны маркеры положения, которые представляли собой очищенный IgE-антитела, выявляемые с использованием конъюгированных с флуорофором анти-IgE-антител.
Фигура 13. Распространенность IgE-реактивности на белки семян пшеницы, экстракт пыльцы пшеницы и аллергены пыльцы растений. Процент пациентов с IgE-реактивностью показан для случаев астмы пекарей (A) (n=23), пищевой аллергии на пшеницу (B) (n=38) и аллергии на пыльцу растений (C) (n= 17) на оси y. На оси x показаны тестируемые рекомбинантные белки пшеницы №10, №37, №38, №112, №123 и №126, экстракт пыльцы пшеницы, рекомбинантные аллергены пыльцы растений Ph1 p 1 , Ph1 p 5, Ph1 p 7 и Ph1 p 12, «пшеничная смесь», содержащая все рекомбинантные белки пшеницы, CAP пшеничной муки и тимофеевки луговой, используемые для измерения IgE-реактивности.
Подробное описание изобретения
Приведенные ниже примеры иллюстрируют настоящее изобретение в отношении выделения и применения полипептида согласно изобретению. Примеры являются только иллюстративными, и их не следует рассматривать как ограничивающие изобретение, которое определено объемом прилагаемой формулы изобретения. Клон №123, упоминаемый в примерах, является профилином, известным, например, из US 7214786.
ПРИМЕР 1: Клон №10 нового аллергена пшеницы
В примере 1 показана идентификация и характеристика нового аллергена семян пшеницы, клона №10, относящегося к семейству ингибиторов картофеля, семейству ингибиторов сериновых протеаз, которые вместе с другими ингибиторами протеаз называют белками, связанными с патогенезом (PR), семейству PR6. Клон №10 является первым аллергеном, идентифицированным и описанным для семейства PR6. Кроме того, в примере 1 показана экспрессия и очистка рекомбинантного полученного из клона 10 аллергена.
Клон №10 специфично распознавался IgE сыворотки пациентов с астмой пекарей, но не проявлял реактивности по отношению к IgE при тестировании с сыворотками от пациентов, страдающих пищевой аллергией на пшеницу, целиакией или аллергией на пыльцу растений. Поэтому полученный из клона 10 аллерген вместе с другими аллергенами пшеницы можно использовать для разработки диагностических тестов, которые позволяют специфично идентифицировать пациентов, страдающих от IgE-опосредованной астмы пекарей, и отличать таких пациентов от пациентов с пищевой аллергией или аллергией на пыльцу.
Способы
Биологические материалы, сыворотки пациентов и антитела
Семена пшеницы Triticum aestivum сорта Michael получали из Osterreichische Agentur fur Gesundheit und Ernahrungssicherheit GmbH и высевали в теплицу. Незрелые семена собирали на 7, 10, 15, 20, 25, 30 и 35 день после начала опыления сразу в жидкий азот и хранили при -80°C вплоть до использования. Пыльцу пшеницы получали из Allergon (Valinge, Sweden). Рис, кукурузу, фасоль и картофель покупали на местном рынке. Рекомбинантные Ph1 p 1, Ph1 p 5, Ph1 p 7 и Ph1 p 12 приобретали из BIOMAY (Vienna, Austria) и сывороточный альбумин человека (HSA) приобретали из Behring (Marburg, Germany). Сыворотки получали от 22 пациентов, страдающих астмой пекарей. Астму пекарей диагностировали на основании положительного анамнеза, IgE, специфичного по отношению к пшеничной и ржаной муке, выявляемого с помощью системы CAP-FEIA (Phadia, Uppsala, Sweden) и специальных провокационных ингаляционных тестов для подтверждения клинически значимой сенсибилизации (1). Демографические, клинические и серологические данные для таких пациентов суммированы в таблице I. Кроме того, в эксперименты включали сыворотку человека, не страдающего аллергией, сыворотки 4 пациентов, страдающих пищевой аллергией на пшеницу и 4 пациентов с аллергией на пыльцу растений без признаков астмы пекарей, но с IgE-реактивностью сыворотки на пшеничную и ржаную муку (таблица II). Сыворотки пациентов с аллергией на пыльцу растений анализировали в отношении общих уровней IgE в сыворотке и IgE, специфичного в отношении пыльцы тимофеевки луговой в системе CAP-FEIA (Phadia), а пациентов с пищевой аллергией на пшеницу характеризовали как описано ранее (2). Специфичность полученного из клона 10 аллергена для астмы пекарей подтверждали в результате тестирования дополнительных 20 сывороток пациентов с целиакией, 119 пациентов с пищевой аллергией, 23 сывороток пациентов с аллергией на пыльцу растений и 25 пациентов с астмой пекарей с использованием анализа чипов (Constantin et al, не опубликовано).
Специфичные кроличьи антитела против полученного из клона 10 аллергена были получены при иммунизации кролика с месячными интервалами очищенным полученным из клона 10 аллергеном (200 мкг на инъекцию) с использованием полного адъюванта Фрейнда и дважды с использованием IFA (Charles River, Kisslegg, Germany). Сыворотку до иммунизации получали от кролика перед иммунизацией. В целях контроля использовали иммунную сыворотку кролика, специфичную для клещевого аллергена домашней пыли, и кроличью антисыворотку, специфичную для профилина пшеницы.
Конструирование библиотеки кДНК λgt11 из семян пшеницы
Суммарную РНК экстрагировали согласно способу Yeh (3) из семян пшеницы, собранных через двадцать пять дней после начала опыления, и хранили при -80°C. Затем осадок РНК растворяли в буфере, содержащем изотиоцианат гуанидиния (4М изотиоцианат гуанидиния, 0,83% об./об. 3М ацетата натрия, pH 6, 11 мМ β-меркаптоэтанол), и очищали ультрацентрифугированием в градиенте плотности хлорида цезия (4). Поли-A+-РНК выделяли аффинной хроматографией на олиго-dT-целлюлозе (Nucleo Trap mRNA; Machery-Nagel) и синтезировали двунитевую кДНК, используя набор для синтеза кДНК (Система для синтеза кДНК; Roche Diagnostics, Mannheim, Germany). После метилирования EcoRI-метилазой (New England Biolabs, Beverly, MA), к кДНК добавляли EcoRI-линкеры (New England Biolabs). Связанную линкерами кДНК расщепляли EcoRI (Roche Diagnostics). Отщепленные линкеры удаляли на колонке Nick (Pharmacia Biotech, Uppsala, Sweden) и кДНК лигировали в плечи λgt11 (Stratagene, La Jolla, CA, USA). Продукт лигирования подвергали упаковке in vitro (набор для клонирования Gigapack III Gold, Stratagene), получая экспрессирующую библиотеку кДНК в λgt11 с 2,43×106 БОЕ.
Выделение и характеристика IgE-реактивных клонов из библиотеки кДНК семян пшеницы
E. coli Y1090 инфицировали, используя 7×105 БОЕ рекомбинантных фагов, и проводили иммунный скрининг, используя IgE сыворотки четырех пациентов (№1, №2, №4, №12), страдающих астмой пекарей, как описано (5). Пятнадцать IgE-реактивных фаговых клонов были отобраны для дальнейшего повторного клонирования, и их ДНК была амплифицирована в ПЦР с использованием смеси для ПЦР Platinum PCR Supermix (Invitrogen, Life Technolgies) и праймеров λgt11 и секвенирована (MWG, Ebersberg, Germany). Полученные последовательности сравнивали с последовательностями, представленными в базе данных GenBank в Национальном центре биотехнологической информации (NCBI). Осуществляли множественное выравнивание последовательностей, используя базу данных GenBank в NCBI. Для определения идентичности аминокислотных последовательностей использовали программу множественных выравниваний Clustal W. Поиск мотивов осуществляли с помощью программы PROSITE, имеющейся на сервере ExPASy proteomics, для аминокислотного состава использовали программу ProtParam ExPASy. Прогнозирование доступности растворителю и вторичной структуры осуществляли, используя компьютерную программу PROT из центра биоинформатики Колумбийского университета. Филогенетическое древо реконструировали на основе аминокислотной последовательности полученного из клона 10 аллергена и гомологичных белков, используя компьютерную программу «Множественное выравнивание и реконструкция филогенетического древа», предоставленную Институтом молекулярной генетики Макса Планка.
Экспрессия и очистка полученного из клона 10 рекомбинантного аллергена
Кодирующую область кДНК клона 10 амплифицировали в ПЦР, используя следующую пару праймеров: прямой 5'-CATATGAGCCCTGTGGTGAAGAAGCCGGAGGGA-3' и обратный 5'-GAATTCTTAGTGATGGTGATGGTGATGGCCGACCCTGGGGAC-3' (MWG). Продукт ПЦР содержат сайты рестрикции NdeI (курсивом), EcoRI (подчеркнут) и последовательность, кодирующую гексагистидиновую метку (жирным шрифтом). Продукт ПЦР субклонировали в векторе AccepTor (Novagen, Madison, WI) и снова секвенировали (MWG). Затем вставку вырезали из вектора AccepTor, используя NdeI и EcoRI (Roche Diagnostics), очищали в геле (Promega, Madison, WI, USA) и субклонировали в экспрессирующей плазмиде pET 17b (Novagen). Последовательность ДНК подтверждали секвенированием обеих нитей ДНК (Microsynth, Balgach, CH). Конструкцией pET 17b-клон 10 трансформировали клетки E. coli BL21 (DE3) (Stratagene) и выращивали в среде Луриа (17), содержащей 100 мг/л ампициллина, при 37°C до OD (600 нм) 0,8-1. Экспрессию белка индуцировали добавлением изопропил-β-D-тиогалактопиранозида (IPTG) до конечной концентрации 0,5 мМ и выращивали бактерии еще в течение 3 часов. Бактерии собирали центрифугированием и гомогенизировали в 25 мМ имидазоле, pH 7,5, 0,1% (об./об.) тритоне X-100, используя Ultraturrax (IKA, Stauffen, Germany). ДНК расщепляли, добавляя ДНКазу I, дополнительно перемешивали еще в течение 10 минут при 20°C, реакцию останавливали, используя 200 мкл 5 М NaCl, и затем центрифугировали при 4°C (6000×g, 20 минут). Большую часть полученного из клона 10 аллергена обнаружили в нерастворимой фракции бактериального экстракта. Полученный из клона 10 аллерген очищали из осадка, содержащего тельца включения, в денатурирующих условиях, используя аффинные колонки с Ni-NTA-смолой, согласно руководству QIAexpressionist (QIAGEN, Hilden, Germany). Фракции, содержащие рекомбинантный аллерген, объединяли и диализовали против 10 мМ NaH2PO4, pH 7,5. Концентрацию белка определяли с помощью набора для анализа белка Micro BCA (Pierce, Rockford, IL).
ELISA
Полученный из клона 10 аллерген растворяли в PBS в концентрации 5 мкг/мл и покрывали планшеты для ELISA (Nunc Maxisorb, Roskilde, Denkmark). После блокирования 1% (масс./об.) БСА в PBS, 0,05% (об./об.) твин-20 (PBST), планшеты инкубировали с сыворотками в разведении 1:50 в PBST с 0,5% (масс./об.) БСА для измерения IgG1, IgG2, IgG3 и IgG4, как описано (6). Связанные антитела выявляли посредством инкубации сначала с моноклональными антителами мыши против подкласса IgG человека (BD Biosciences, Franklin Lakes, NJ) в разведении 1:1000 в PBST, 0,5% (масс./об.) БСА и затем со связанной с пероксидазой хрена антисывороткой овцы против Ig мыши (GE Healthcare, Little Chalfont, UK) в разведении 1:2000 в PBST, 0,5% (масс./об.) БСА, как описано ранее (2). Все определения осуществляли в двух повторах, и результаты выражали в виде средних значений.
Экстракты белков, SDS-ПААГ и иммуноблоты
Экстракты белков с SDS из зрелых и незрелых семян пшеницы, риса (Oryza sativa), кукурузы (Zea mays), фасоли (Phaseolus vulgaris) и картофеля (Solarium tuberosum) готовили посредством гомогенизации 3 грамм ткани в 32 мл буфера для образцов (6) и затем кипятили в течение 10 минут. Чтобы удалить нерастворимые частицы экстракты центрифугировали при 10000×g в течение 10 минут при 4°C и надосадки хранили в виде аликвот при -20°C. Кроме того, готовили экстракт белка в PBS из семян пшеницы, как описано ранее (2). Пыльцу Triticum aestivum (500 мг) экстрагировали при 4°C в течение ночи в 5 мл PBS, 2 мМ EDTA, 1 мМ PMSF. После центрифугирования в течение 1 часа при 13000×g и 4°C определяли концентрацию белка в надосадке, используя набор для анализа белка Micro BCA (Pierce), и аликвоты хранили при -20°C вплоть до использования. Равные количества экстрактов белка с SDS разделяли в 14% препаративных SDS-полиакриламидных гелях (7). В качестве стандарта использовали маркер молекулярной массы (маркер Rainbow, GE Healthcare; стандарт белка Precision Plus, BioRad, Herkules, CA; предварительно окрашенный лэддер белков Page Ruler, Fermentas, Burlington, Ontario). После электрофоретического разделения белки либо окрашивали Кумасси бриллиантовым синим, либо переносили на нитроцеллюлозные мембраны (Schleich and Schuell, Dassel, Germany) (8). Мембраны блокировали в буфере A (50 мМ натрий-фосфатный буфер, pH 7,4, 0,5% масс./об. БСА, 0,5% об./об. твин-20, 0,05% масс./об. NaN3) два раза по 10 минут и один раз в течение 30 минут и инкубировали в течение ночи при 4°C с кроличьей антисывороткой, специфичной для полученного из клона 10 аллергена, с соответствующий сывороткой, полученной до иммунизации, и в целях контроля с кроличьей антисывороткой, специфичной для неродственного антигена, или только с буфером. Сыворотки кролика разводили 1:50000 в буфере A. Связанные антитела выявляли с использованием разведенных 1:2000 в буфере A 125I-меченых антител осла против Ig кролика (GE Healthcare) в течение 2 часов при комнатной температуре и визуализировали на пленках Kodak XOMAT с использованием усиливающих экранов (Kodak, Heidelberg, Germany) при -70°C. В случае дот-блот-экспериментов для анализа IgE 100 нг рекомбинантного полученного из клона 10 аллергена и рекомбинантных аллергенов пыльцы растений, Ph1 p 1 , Ph1 p 5, Ph1 p 7 и Ph1 p 12, а также 3 мкг экстракта пыльцы пшеницы и 2 мкг PBS-экстракта зрелых семян пшеницы в виде пятен наносили на нитроцеллюлозную мембрану. Полоски нитроцеллюлозы блокировали буфером A и подвергали воздействию сыворотки пациентов в разведении 1:10 в буфере A в течение ночи при 4°C. Связанные IgE-антитела выявляли с использованием 125I-меченых антител против IgE человека (RAST RIA, Demeditec Diagnostics, Germany) в разведении 1:20 в буфере A в течение ночи при комнатной температуре и визуализировали с помощью авторадиографии, используя пленки Kodak XOMAT с усиливающими экранами (Kodak) при -70°C.
Анализы МС и КД рекомбинантного клона 10
Масс-спектры с лазерной десорбцией получали в линейном режиме, используя прибор TOF Compact MALDI II (Kratos, Manchester, UK; piCHEM, Research and Development, Graz, Austria). Образцы растворяли в 10% ацетонитриле (0,1% трифторуксусная кислота), и α-циано-4-гидроксикоричную кислоту (растворенную в 60% ацетонитриле с добавлением 0,1% трифторуксусной кислоты) использовали в качестве матрицы. Для получения образцов смесь 1/1 белка и раствора матрицы помещали на мишень и сушили на воздухе.
Измерения КД осуществляли с использованием очищенного полученного из клона 10 аллергена (в H2O) при концентрации белка 0,1 мг/мл на спектрополяриметре Jasco J-810 (Tokyo, Japan), используя прямоугольную кварцевую кювету, длина пути 0,2 см. КД-спектры в дальней ультрафиолетовой области регистрировали от 190 нм до 260 нм с разрешением 0,5 нм и скоростью сканирования 50 нм/мин и получали среднее значение из трех сканирований. Результаты выражены в виде средней остаточной эллиптичности (θ) при данной длине волны. Температурное сканирование осуществляли согласно способу пошагового сканирования, при котором образец нагревали от 25°C до 95°C со скоростью нагревания 2°C/мин и снова охлаждали до 25°C с такой же скоростью. Через каждые 5°C регистрировали спектры с непрерывным изменением длины волны с использованием конкретных параметров. Кроме того, температурное сканирование осуществляли при 215 нм с разрешением шагов 0,5°C. Результаты выражены в виде средней остаточной молярной эллиптичности (θMRE) при данной длине волны. Конечные спектры корректировали, вычитая соответствующий спектр исходного уровня, полученный в идентичных условиях. Информацию о вторичной структуре полученного из клона 10 аллергена рассчитывали с использованием программы оценки вторичной структуры CDSSTR (9).
Анализ клеток базофильного лейкоза крыс, несущих рецептор человека
Для количественной оценки опосредованных IgE-Ат реакций немедленного типа осуществляли анализ высвобождения медиаторов клетками huRBL. Клетки RBL (clone RBL-703/21), трансфицированные FcεRI человека (10), культивировали в RPMI 1640 с добавлением 5% FCS, 4 мМ L-глутамина и 1 мг/мл сульфата G418. Клетки собирали после инкубации с трипсином/EDTA, промывали, ресуспендировали в культуральной среде и концентрацию клеток доводили до 2×106 клеток/мл. Аликвоты суспензии клеток по пятьдесят микролитров добавляли в лунки 96-луночного микропланшета с плоским дном (плотность клеток/лунку составляла 1×105 клеток). Сыворотку человека разбавляли 1:10 в культуральной среде, добавляли к клеткам и инкубировали в течение ночи при 37°C, 7% CO2, относительной влажности 95%. Среду удаляли и планшеты 3 раза промывали 200 мкл/лунку буфера Тайрода +0,1% БСА. Для перекрестного связывания IgE 100 мкл полученного из клона 10 аллергена или rPh1 p 1, (0,3 мкг/мл), разбавленного в буфере Тайрода, содержащем 50% D2O и 0,1% (масс./об.) БСА, добавляли к клеткам. Для спонтанного высвобождения в лунки добавляли буфер Тайрода без белка. Общее высвобождение определяли при добавлении буфера Тайрода, содержащего 10% тритон X-100. После инкубации при 37°C, 7% CO2, относительной влажности 95% в течение 1 часа клетки собирали центрифугированием и 50 мкл надосадка переносили в новый планшет и добавляли 50 мкл раствора для анализа (0,1М лимонная кислота или цитрат натрия, pH 4,5 и 160 мкМ 4-метилумбеллиферил-N-ацетил-β-D-глюкозаминида) на лунку. После дополнительной инкубации еще в течение одного часа реакцию останавливали добавлением 100 мкл глицинового буфера (0,2 М глицин, 0,2% NaCl, pH 10,7) в каждую лунку. Флуоресценцию измеряли при λex:360/λem:465 в устройстве для регистрации флуоресценции в микропланшетах. Спонтанное высвобождение определяли в контрольных лунках, которые не подвергали лизису тритоном X-100. Специфичное высвобождение вычисляли с использованием формулы: (образец-спонтанное/общее-спонтанное) ×100.
Электронная микроскопия с иммунологическим мечением частицами золота
Сухие зерна пшеницы нарезали на небольшие кусочки (кубики размером примерно 0,5 мм), используя острое лезвие бритвы. Чтобы сохранить клетки в сухом состоянии, кубики фиксировали в безводных условиях в парах акролеина в течение 5 суток при комнатной температуре. Кубики переносили при комнатной температуре на 1 сутки в диметоксипропан (DMP) для удаления остаточной воды и заливали в смолу Lowicryl K4M, используя по восходящей серию смеси DMP:этанол и смеси этанол:мономерный Lowicryl K4M в качестве промежуточных стадий. Полимеризацию осуществляли при -35°C.
Нарезали ультратонкие срезы периферических и центральных тканей зерна и помещали на серебряную сетку для иммунологического мечения.
Мечение полученного из клона 10 аллергена осуществляли в камере с увлажнением при комнатной температуре (буфер PBS +1% (масс./об.) БСА, pH 7,4, трис-буфер +1% (масс./об.) БСА, pH 8,2) следующим образом: 1) 5% (масс./об.) БСА в буфере PBS, 15 минут; 2) антитела кролика против белка 10 пшеницы и антитела, полученные до иммунизации в разведении 1:35 в буфере PBS, 2 часа; 3) буфер PBS, 5 минут, трис-буфер, 2×5 минут; 4) антитела козы против IgG кролика, связанные с частицами коллоидного золота размером 10 нм (BioCell, Piano, Wetzlar, Germany) в разведении 1:20 в трис-буфере; 5) трис-буфер, 1×5 минут, дистиллированная вода, 2×5 минут.
Срезы окрашивали, используя уранилацетат (5 минут) и цитрат свинца (10 секунд).
Образцы анализировали в трансмиссионном электронном микроскопе EM 410 (FEI, Eindhoven, The Netherlands).
Результаты
Выделение и характеристика кДНК пшеницы, кодирующей аллерген подобный ингибитору сериновой протеиназы
Экспрессирующую библиотеку кДНК семян пшеницы подвергали скринингу с использованием IgE-антител четырех пациентов, страдающих астмой пекарей. Открытая рамка считывания кДНК IgE-реактивного клона 10 содержала 262 нуклеотидов, кодирующих 84-аминокислотный полипептид (фиг. 1). Молекулярную массу 9,4 кД и изоэлектрическую точку (pI) 6,08 вычислили на основании рассчитанной аминокислотной последовательности полученного из клона 10 аллергена. Анализ аминокислотного состава показал высокое содержание остатков валина (15,5%) и отсутствие остатков цистеина. Согласно компьютеризованному анализу вторичной структуры полученный из клона 10 аллерген, главным образом, состоит из случайных клубков и бета-слоев и одного альфа-спирального домена. Согласно расчетам доступности растворителям почти 80% аминокислот подвергаются воздействию растворителя. Поиск мотивов последовательности показал наличие одного потенциального участка фосфорилирования казеинкиназой II (аминокислота 32), двух N-концевых участков миристоилирования (аминокислоты 11, 55) и признак семейства ингибиторов I картофеля (фиг. 1: аминокислоты 25-36 указаны внутри прямоугольника). Сравнение полученной из клона 10 аминокислотной последовательности с последовательностями, депонированными в базе данных NCBI, показало, что аллерген почти идентичен предшественнику ингибитора WSCI субтилизина-химотрипсина Triticum aestivum (номер доступа gi 122065237) и ингибитору протеиназы WSCI T. aestivum (номер доступа gi 66356278) и проявляет значительную гомологию по последовательности с группой ингибиторов сериновых протеиназ, встречающихся у растений и животных. Такие ингибиторы сериновых протеиназ составляют семейство, названное семейством ингибиторов I картофеля, и характеризуются типичной консенсусной картиной последовательностей, которая консервативна у всех белков. Ингибиторы сериновых протеинах, относящиеся к семейству ингибиторов I картофеля, представляют собой небольшие белки из 60-90 аминокислот, в которых отсутствуют дисульфидные связи, и содержат только один сайт ингибирования. Последовательности ингибиторов сериновых протеиназ пшеницы имеют значительную степень консервативности последовательностей с ингибиторами протеиназ других однодольных растений, подобных ячменю (Hordeum vulgare), кукурузе (Zea mays, Zea diploperennis), трипсакуму (Tripsacum dactyloides) и рису (Oryza sativa), двудольных растений и червей (таблица III). В таблице III показаны проценты идентичности последовательностей между отдельными ингибиторами сериновых протеиназ.
Экспрессия, очистка и физико-химическая характеристика аллергена, подобного ингибиторам сериновых протеиназ
Полученный из клона 10 аллерген экспрессировали в E. coli BL21 (DE3) с C-концевой гексагистидиновой меткой. С использованием хроматографии на никеле из литра жидкой культуры можно очистить примерно 25 мг аллергена, подобного ингибиторам сериновых протеиназ (фиг. 2A). При MALDI-TOF-анализе очищенного рекомбинантного белка 10 получен пик массы 9970,8 Д (фиг. 2B). Спектр КД в дальнем ультрафиолете очищенного рекомбинантного аллергена, полученного из клона 10, (фиг. 2C) показал, что белок подвергается фолдингу и содержит значительное количество β-слоев и небольшое содержание α-спиралей. Спектр характеризуется минимумом при 204 нм и максимумом при 190 нм. При анализе вторичной структуры с использованием программы CDSSTR со ссылкой на набор данных 7 получили 8% α-спирали, 23% β-слоев, 14% β-поворотов и 53% случайных клубков. Значение NRMSD 0,033 показало хорошее соответствие между рассчитанными и экспериментально полученными спектрами. При нагревании до 95°C наблюдали небольшой сдвиг минимума КД-спектра (от 204 нм до 201 нм), свидетельствующий о частичной денатурации белка. При охлаждении до 25°C белок подвергался рефолдингу (фиг. 2C). Однако минимум при 204 нм был ниже, чем до нагревания, что свидетельствует о перестройке β-слоев. Итак, спектры, наблюдаемые при температурном сканировании, свидетельствуют о высокой температурной устойчивости полученного из клона 10 аллергена.
Рекомбинантный полученный из клона 10 аллерген представляет собой новый аллерген пшеницы, подобный ингибиторам сериновых протеиназ
Очищенный полученный из клона 10 аллерген тестировали в отношении IgE-реактивности, используя сыворотки пациентов, страдающих астмой пекарей, аллергией на пыльцу растений и пищевой аллергией на пшеницу, с помощью дот-блот-анализа (фиг. 3). Рекомбинантный полученный из клона 10 аллерген взаимодействовал с IgE-антителами 3 (№1, №4, №12) из 22 пациентов, страдающих астмой пекарей (13,6%). У пациента №1, который имел только низкие уровни IgE, специфичного к основному аллергену пшеницы, ингибитора альфа-амилазы, обнаружили высокую IgE-реактивность к аллергену, подобному ингибитору сериновых протеиназ. Интересно, что полученный из клона 10 аллерген узнавали только IgE-антитела пациентов с астмой пекарей, но не пациентов, страдающих от IgE-опосредованной пищевой аллергии на пшеницу, или пациентов, страдающих аллергией на пыльцу растений. Несколько сывороток из каждой из трех групп пациентов проявляли IgE-реактивность на рекомбинантные аллергены пыльцы тимофеевки луговой вследствие косенсибилизации на пыльцу растений. Специфичная IgE-реактивность на полученный из клона 10 аллерген у пациентов с астмой пекарей была подтверждена в анализе на чипах с использованием дополнительно 20 сывороток пациентов с целиакией, 119 пациентов с пищевой аллергией, 23 сывороток пациентов с аллергией на пыльцу растений и 25 пациентов с астмой пекарей (Constantin et al., не опубликовано, данные не показаны).
Анализ реактивности подклассов IgG на полученный из клона 10 аллерген в группе пациентов с астмой пекарей показал наличие специфичного для аллергена IgG1 и более низкие уровни специфичного для аллергена IgG4, при этом оба факта являются показателями Th2-ответа, тогда как существенной реактивности IgG2 и IgG3, специфичной для полученного из клона 10 аллергена не выявлено (фиг. 4).
Чтобы исследовать аллергическую активность IgE-антител, специфичных для аллергена, подобного ингибитору сериновых протеиназ, клетки RBL, экспрессирующие FcεRI, нагружали IgE сыворотки пациентов, имеющих и не имеющих специфичных IgE-антител, и затем подвергали воздействию аллергена (фиг. 5). В клетках RBL, нагруженных IgE сыворотки пациента №1, наблюдали наиболее сильную дегрануляцию при воздействии аллергена (51% общего высвобождения β-гексозаминидазы). Низкую дегрануляцию наблюдали в случае клеток RBL, которые были нагружены IgE пациентов №4 и №12 (22% и 19%, соответственно), что соответствовало интенсивности распознавания IgE на дот-блотах (фиг. 3). Почти не наблюдали дегрануляции в том случае, когда клетки RBL нагружали сывороткой человека, не страдающего аллергией (фиг. 5: NC). Основной аллерген пыльцы тимофеевки луговой rPh1 p 1 индуцировал сильную дегрануляцию клеток RBL, нагруженных IgE из сыворотки пациента № 12, и умеренную дегрануляцию в том случае, когда клетки RBL нагружали сывороткой пациентов №1 и №4 (фиг. 5). Действительно, пациенты №1, №4 и №12 также страдали аллергией на пыльцу растений (таблица I).
Аллерген, подобный ингибитору сериновых протеиназ, накапливается в семенах пшеницы по время созревания
Кроличьи антитела, специфичные для полученного из клона 10 аллергена, использовали для исследования экспрессии белка во время созревания семян пшеницы (фиг. 6). Нитроцеллюлозные листы, содержащие экстракты семян пшеницы, собранных в разных временных точках созревания семян, исследовали, используя в качестве зондов специфичные кроличьи антитела и Ig, полученный до иммунизации. Специфичные для клона 10 антитела взаимодействовали с белком 40 кД, представляющим собой тетрамер аллергенов, подобных ингибиторам сериновых протеиназ (фиг. 6) (11). Экспрессия белка становилась регистрируемой в 15-дневных семенах и продолжала возрастать в ходе дальнейшего созревания семян (фиг. 6). Иммунореактивность не выявляли, когда блоты инкубировали с Ig, полученными до иммунизации из того же кролика (фиг. 6).
Аллерген, подобный ингибитору сериновых протеиназ, преимущественно выявляется в семенах пшеницы.
Когда авторы сравнили пыльцу и семена, они обнаружили, что аллерген, подобный ингибитору сериновых протеиназ, преимущественно экспрессировался в семенах (фиг. 7), тогда как только слабый сигнал в области примерно 65 кД был получен в случае экстракта пыльцы пшеницы. Паналлерген профилин был выявлен с использованием антител кролика против профилина семян пшеницы в семенах и пыльце пшеницы (фиг. 7: №123). Не обнаружено реактивности в случае использования Ig, полученного до иммунизации (фиг. 7).
Затем авторы использовали антитела, специфичные к аллергену, подобному ингибитору сериновых протеиназ, для поиска перекрестно реагирующих структур риса, кукурузы, фасоли обыкновенной и картофеля, для которых были описаны гомологичные белки с идентичностью последовательностей 50% (фасоль), 49% (кукуруза, рис) и 33% (картофель) (таблица III).
Аллерген, подобный ингибитору сериновых протеиназ снова выявляли в виде тетрамера в семенах пшеницы, полосу в области примерно 23 кД выявляли в рисе, но не выявлено реактивности в кукурузе, фасоли обыкновенной или картофеле (фиг. 8C), несмотря на то, что сравнимые количества каждого экстракта подвергали SDS-ПААГ (фиг. 8A). Реактивности не наблюдали в том случае, когда блоты инкубировали с Ig, полученным до иммунизации (фиг. 8B).
Локализация аллергена, подобного ингибитору сериновых протеиназ, в алейроновом слое и между крахмальными гранулами зерна пшеницы с помощью электронной микроскопии с иммунологическим мечением частицами золота
На фигуре 9A показан ультратонкий срез зерна пшеницы при небольшом увеличении в трансмиссионном электронном микроскопе. Видны три основных морфологических компонента зерна: наружная многослойная плодовая и семенная оболочка (C), алейроновый слой (AL) и начало объемного внутреннего содержимого зерна, крахмалистого эндосперма (SE). Прямоугольником отмечена область, сопоставимая с областью, показанной на фигуре B. На фигуре 9B показана граница между алейроновой клеткой и примыкающим крахмалистым эндоспермом при большем увеличении. Алейроновая клетка заполнена алейроновыми зернами (AG) (белковыми вакуолями), которые окружены небольшими липидными везикулами (L). Оба компонента погружены в цитоплазматический матрикс клетки. Крахмалистый эндосперм состоит из гранул крахмала разного размера, плотно упакованных так, что остаются лишь небольшие промежутки, заполненные аморфным цитоплазматическим веществом. Прямоугольниками указаны области, показанные при большом увеличении на фигурах C, D и E, F, соответственно. На фигуре 9C показана локализация полученного из клона 10 аллергена в алейроновой клетке с использованием Ат, полученных против белка 10 пшеницы. Частицы золота (стрелки) свидетельствуют о присутствии белка 10 пшеницы преимущественно в цитоплазматическом матриксе между органоидами клетки, а также в периферических частях липидных везикул (L). В крахмалистой области белок 10 пшеницы ассоциирован с аморфным цитоплазматическим веществом (CY) между гранулами крахмала (SG) (фигура 9E). Контрольные эксперименты с использованием Ат, полученных до иммунизации, показали очень низкую степень неспецифичного мечения (фиг. 9, D и F).
ПРИМЕР 2: Экспрессия и очистка рекомбинантных аллергенов
В примере 2 показана идентификация и характеристика шести реактивных по отношению к IgE аллергенов семян пшеницы, названных клонами №10, №37, №38, №112, №123 и №126. Кроме того, в примере 2 показан способ экспрессии и очистки рекомбинантных аллергенов указанных клонов.
Биологические материалы, сыворотки пациентов
Семена пшеницы Triticum aestivum сорта Michael получали из Osterreichische Agentur fur Gesundheit und Ernahrungssicherheit GmbH и высевали в теплицу. Незрелые семена собирали непосредственно в жидкий азот через 25 дней после начала опыления и хранили при -80°C вплоть до использования. Сыворотки получали от 24 пациентов, страдающих астмой пекарей (таблица IV). Астму пекарей диагностировали на основе истории болезни, общих уровней IgE в сыворотке, IgE, специфичного для пшеницы и ржи, выявляемого с помощью системы CAP-FEIA (Phadia, Uppsala, Sweden) и после специальных провокационных ингаляционных тестов (1) (фиг. 10). Сыворотку пациентов с аллергией на пыльцу растений анализировали в отношении общих уровней IgE в сыворотке и IgE, специфичного для пыльцы тимофеевки луговой, с использованием системы CAP-FEIA (Phadia), и пациентов с пищевой аллергией на пшеницу характеризовали, как описано ранее (2) (фиг. 11). Клинические данные для таких пациентов суммированы в таблице V. В целях контроля в эксперименты включали сыворотку человека, не страдающего аллергией.
Конструирование библиотеки кДНК λgt11 из семян пшеницы
Суммарную РНК экстрагировали из семян пшеницы, которые хранились при -80°C, согласно способу Yeh [3]. Затем осадок РНК растворяли в буфере, содержащем изотиоцианат гуанидиния (4М изотиоцианат гуанидиния, 0,83% об./об. 3М ацетат натрия, pH 6, 11 мМ β-меркаптоэтанол), и очищали ультрацентрифугированием в градиенте плотности хлорида цезия. Поли-A+-РНК выделяли аффинной хроматографией на олиго-dT-целлюлозе (Nucleo Trap mRNA; Machery-Nagel) и синтезировали двунитевую кДНК, используя набор для синтеза кДНК (Система для синтеза кДНК; Roche Diagnostics, Mannheim, Germany). После метилирования EcoRI-метилазой (New England Biolabs, Beverly, MA), к кДНК добавляли EcoRI-линкеры (New England Biolabs). Связанную линкерами кДНК расщепляли EcoRI (Roche Diagnostics). Отщепленные линкеры удаляли на колонке Nick (Pharmacia Biotech, Uppsala, Sweden) и кДНК лигировали в плечи λgt11 (Stratagene, La Jolla, CA, USA). Продукт лигирования подвергали упаковке in vitro (набор для клонирования Gigapack III Gold, Stratagene), получая экспрессирующую библиотеку кДНК в λgt11 с 2,43×106 БОЕ (бляшкообразующих единиц).
Выделение и характеристика IgE-реактивных клонов из библиотеки кДНК семян пшеницы
E. coli Y1090 инфицировали 7×105 БОЕ рекомбинантных фагов и подвергали иммунологическому скринингу с использованием IgE сыворотки четырех пациентов (№1, №2, №5, №13), страдающих астмой пекарей, как описано [5]. Шесть IgE-реактивных фаговых клонов отбирали для дальнейшего повторного клонирования и их ДНК амплифицировали в ПЦР, используя смесь для ПЦР Platinum PCR Supermix (Invitrogen, Life Technolgies) с праймерами λgt11 и секвенировали (MWG, Ebersberg, Germany). Полученные последовательности сравнивали с последовательностями, представленными в базе данных GenBank в Национальном центре биотехнологической информации (NCBI).
Экспрессия и очистка рекомбинантных аллергенов
Кодирующую область клонов амплифицировали в ПЦР, используя праймеры, перечисленные в таблице VI. Продукты ПЦР субклонировали в векторе AccepTor (Novagen, Madison, WI) и снова секвенировали (MWG). Затем содержащие вставки векторы AccepTor расщепляли, используя NdeI и EcoRI (Roche Diagnostics), вставки очищали в геле (Promega, Madison, WI, USA) и субклонировали в экспрессирующей плазмиде pET 17b (Novagen). Последовательности ДНК подтверждали секвенированием обеих нитей ДНК (Microsynth, Balgach, CH). Конструкциями со вставками pET 17b трансформировали клетки E. coli BL21 (DE3) (Stratagene) и выращивали в среде Луриа (17), содержащей 100 мг/л ампициллина, при 37°C до OD (600 нм) 0,8-1. Экспрессию белка индуцировали добавлением изопропил-β-D-тиогалактопиранозида (IPTG) до конечной концентрации 0,5 мМ и выращивали бактерии еще в течение 3 часов. Затем бактерии собирали центрифугированием и гомогенизировали в 25 мМ имидазоле, pH 7,5, 0,1% (об./об.) тритоне X-100, используя Ultraturrax (IKA, Stauffen, Germany). ДНК расщепляли, добавляя ДНКазу I, дополнительно перемешивали еще в течение 10 минут при 20°C, реакцию останавливали, используя 200 мкл 5 М NaCl, и затем центрифугировали при 4°C (6000×g, 20 минут). Полученный из клона 10 аллерген очищали из содержащего тельца включения осадка в денатурирующих условиях, используя аффинные колонки с Ni-NTA-смолой, согласно руководству QIAexpressionist, протокол 17 (QIAGEN, Hilden, Germany). Фракции, содержащие рекомбинантный аллерген, объединяли и диализовали против 10 мМ NaH2PO4, pH 7,5. Рекомбинантные белки №37, №38, №112, №123 и №126 очищали из осадка лизата бактериальных клеток в обычных условиях на аффинных колонках со смолой Ni-NTA согласно руководству QIAexpressionist, протокол 12 (QIAGEN). Фракции, содержащие рекомбинантные белки, объединяли и диализовали против 10 мМ NaH2PO4 pH 7,5. Образцы белка анализировали в отношении чистоты в 14% SDS-ПААГ-геле и визуализировали, используя окрашивание Кумасси бриллиантовым синим. Концентрации белка определяли с использованием набора для анализа белков Micro BCA (Pierce, Rockford, IL).
ПРИМЕР 3: Матрица аллергенов
В примере 3 показана матрица аллергенов, с помощью которой обнаружено, что рекомбинантные аллергены семян пшеницы, полученные как описано в примере 2, специфично узнаются IgE сыворотки пациентов с астмой пекарей, но не пациентов с пищевой аллергией на пшеницу или аллергией на пыльцу растений. Следовательно, рекомбинантные аллергены специфичны для респираторной аллергии на пшеничную муку. Кроме того, в примере 3 показано применение маркерных аллергенов пыльцы тимофеевки луговой ph1 p 1 и Ph1 p 5 и пыльцы пшеницы для матрицы с целью усовершенствования диагностики респираторной аллергии in vitro.
Методика
Пациенты и сыворотки
Сыворотки получали от пациентов испанцев, страдающих астмой пекарей (B 1-B23), австрийцев (F1-F26) и немцев (F27-F38), страдающих индуцированной пшеницей пищевой аллергией и пациентов австрийцев (G1-G17), страдающих аллергией на пыльцу растений. Пациентов отбирали на основании позитивной истории болезни, специальных ингаляционных провокационных тестов для подтверждения клинически значимой сенсибилизации в случае астмы пекарей (1) и двойной слепой плацебо-контролируемой пищевой провокации (DBPCFC) у детей с пищевой аллергией на пшеницу. Сыворотки всех пациентов анализировали в отношении суммарных уровней IgE в сыворотке и IgE, специфичного для пшеничной муки и пыльцы тимофеевки луговой, используя систему CAP-FEIA (Phadia, Uppsala, Sweden). Демографические, клинические и серологические данные таких пациентов суммированы в таблице VII, VIII и IX. В целях контроля во все эксперименты включали сыворотки здоровых людей.
Биологические материалы
Рекомбинантные белки пшеницы №10, №37, №38, №112, №123 и №126, полученные из библиотеки кДНК с помощью скрининга с использованием сывороток пациентов с астмой пекарей, экспрессировали в E. coli и очищали как описано (12). Пыльцу пшеницы приобретали из Allergon (Vallinge, Sweden), а рекомбинантные Ph1 p 1, Ph1 p 5, Ph1 p 7, Ph1 p 12 из BIOMAY (Vienna, Austria).
Экстракт белков
Пыльцу Triticum aestivum (500 мг) экстрагировали при 4°C в течение ночи в 5 мл PBS, 2 мМ EDTA, 1 мМ PMSF. После центрифугирования в течение 1 часа при 13000×g и 4°C, концентрацию белка в надосадке определяли с использованием набора для анализа белков BCA (Pierce, Rockford, IL) и аликвоты хранили при -20°C вплоть до использования.
Анализ матрицы аллергенов
Экстракт пыльцы пшеницы, 1-1,5 нг/пятно, рекомбинантные и очищенные белки пшеницы и рекомбинантные аллергены пыльцы растений, 0,1-0,15 нг/пятно, наносили в виде пятен с использованием нано-плоттера NP2 (Gesellschaft fur Silizium-Mikrosysteme mbH, Groβerkmannsdorf, Germany) на нитроцеллюлозные мембраны, которые закрепляли на предметных стеклах для микроскопа как описано (13). Очищенные IgE человека использовали в качестве маркера положения (14). Микроматрицы с нанесенными пятнами предварительно промывали 30 мкл буфера для анализа (слабый фосфатный буфер, pH 7,5) и инкубировали с 30 мкл неразбавленной сыворотки пациентов с аллергией или контролями. После промывки 30 мкл буфера для анализа связанные IgE-антитела выявляли, используя 20 мкл конъюгированного с флуорофором анти-IgE-антитела, и интенсивности флуоресценции (FI) измеряли при длине волны 635 нм (GenePix 4000B fran Axon). Уровень отсечения устанавливали на FI=300 на основе значений, полученных с сывороточным альбумином человека.
Результаты
Описание пациентов
Авторы анализировали пациентов, страдающих астмой пекарей, индуцированной пшеницей пищевой аллергией или аллергией на пыльцу растений. Группа пациентов с астмой пекарей состояла из 23 человек (4 женщины, 19 мужчин: средний возраст 39 лет, диапазон 22-60 лет), по роду профессии, подвергающихся воздействию пшеничной муки. Девяносто один процент пациентов с астмой пекарей страдали астмой вследствие вдыхания пшеничной муки и 94% жаловались на симптомы риноконъюнктивита. Сенсибилизация к другим источникам респираторных аллергенов (например, кошка, таракан, собака, пыльца растений, лошадь, клеши домашней пыли, плесневые грибы и/или пыльца оливы) обнаружена у 70% пациентов с астмой пекарей и 48% пациентов, страдающих аллергией на пыльцу растений (таблица VII). Интересно, что ни у одного из пациентов с астмой пекарей не проявлялась аллергия на пищу, и симптомы были ограничены респираторными проявлениями.
Группа пациентов, страдающих индуцированной пшеницей пищевой аллергией, состояла из 38 человек (25 женского пола, 13 мужского пола: средний возраст 13 лет, диапазон 0,5-65 лет) (таблица VIII). Авторы снова обнаружили, что 71% были сенсибилизированы к другим источникам респираторных аллергенов (например, пыльце березы, пыльце злаковых трав, клещам домашней пыли и пыльце полыни), и 58% также были сенсибилизированы на пищевые аллергены (например, морковь, коровье молоко, фундук, куриное яйцо, солод, орехи, апельсин, слива, рис, соя, сельдерей, морепродукты, креветки и/или специи) (таблица VIII). IgE-опосредованная сенсибилизация на пыльцу растений обнаружена у 55% таких пациентов. Симптомы у таких пациентов варьировали от респираторных симптомов (например, астма, бронхит, кашель, конъюнктивит, диспноэ, закупорка носового канала, ринорея, риноконъюнктивит) до желудочно-кишечных симптомов (например, боль в животе, диарея, задержка газов, боль в горле и рвота) и кожных симптомов (например, экзема, зуд и крапивница) (таблица VIII).
Группа пациентов с аллергией на пыльцу растений состояла из 17 пациентов (5 женского пола, 12 мужского пола: средний возраст 13 лет, диапазон 0,5-65 лет). Семьдесят один процент таких пациентов также страдали аллергией на другие источники респираторных аллергенов (например, пыльцу березы, кошек, собак, клещей домашней пыли, кроликов и пыльцу полыни) (таблица IX). Согласно серологии у 65% наблюдали IgE-реактивность на пшеничную муку, и 23% имели IgE против других пищевых аллергенов. Однако только один пациент страдал от крапивницы, и у таких пациентов не регистрировали симптомов пищевой аллергии. Респираторные симптомы, такие как астма, конъюнктивит, диспноэ, риноконъюнктивит и ринит преобладали у пациентов с аллергией на пыльцу растений.
Композиция матрицы аллергенов
Шесть рекомбинантных аллергенов семян пшеницы, названных №10, №37, №38, №112, №123 и №126, в виде пятен наносили на покрытые нитроцеллюлозой предметные стекла (фиг. 12, A). Рекомбинантные белки пшеницы экспрессировали в Escherichia coli на основе кДНК, которые были выделены из библиотеки кДНК семян пшеницы с использованием сывороток пациентов с астмой пекарей, как описано (15). В соответствии с гомологией с последовательностями, депонированными в базе данных NCBI, аллергены пшеницы могут быть описаны следующим образом: №10 имел 96% гомологию предшественником ингибитора WSCI субтилизина-химотрипсина Triticum aestivum (номер доступа gi 122065237), №37 представлял собой тиоредоксин H T. aestivum (номер доступа gi 27461 140), №38 представлял собой глутатионтрансферазу T. aestivum (номер доступа gi 20067419), №112 имел 99% гомологию с 1-Cys-пероксиредоксином T. aestivum (номер доступа gi 34539782), №123 имеет 96% гомологию с профилином T. aestivum (номер доступа gi 1346803) и №126 имеет 69% гомологию с дегидрином 11 Hordeum vulgare (номер доступа gi 4105101).
Кроме рекомбинантных аллергенов пшеницы экстракт пыльцы пшеницы, рекомбинантные аллергены пыльцы тимофеевки луговой (rPh1 p 1, rPh1 p 5, rPh1 p 7 и rPh1 p 12) (16-19) и IgE также наносили в виде пятен на предметные стекла (фиг. 12, A). Типичные изображения микроматриц аллергенов после инкубации с сыворотками показаны на фиг. 12, B-C. На чипе, который анализировали с использованием в качестве зонда сыворотки человека, не страдающего аллергией, не выявляли реактивности ни к одному из аллергенов и выявляли только нанесенные в виде пятен маркеры IgE на основе анти-IgE-конъюгата (фиг. 12, B). На фигуре 12C показаны типичные изображения микроматриц на чипах, инкубированных с сыворотками пациента с астмой пекарей (1), пациента, страдающего индуцированной пшеницей пищевой аллергией (2) и пациента с аллергией на пыльцу растений (3). У пациента с астмой пекарей (1: таблица I: B4) показана высокая IgE-реактивность на рекомбинантные аллергены пшеницы №10 и слабая реактивность на №126 и №112. В случае пациента с пищевой аллергией (2: таблица VIII: F26) наблюдали сильное связывание IgE с рекомбинантным профилином №123 пшеницы и rPh1 p 12 пыльцы тимофеевки луговой и слабое связывание с экстрактом пыльцы пшеницы и rPh1 p 1. На изображении чипа для пациента с аллергией на пыльцу растений (3: G 16) видны сильные сигналы на rPh1 p 5 и rPh1 p 12 и более слабые сигналы на профилин №123 пшеницы, экстракт пыльцы пшеницы и rPh1 p 1.
Идентификация аллергенов семян пшеницы, специфично узнаваемых IgE-антителами пациентом с астмой пекарей
Девяносто один процент пациентов с астмой пекарей были позитивными в CAP на пшеничную муку (таблица VII). Используя нанесенные в виде пятен аллергены пшеницы можно установить профиль IgE-реактивности для 62% пациентов с астмой пекарей. Аллергены №126 (30%), №10 (26%), №123 (22%) и №122 (17%) были наиболее часто выявляемыми компонентами, тогда как №37 и №38 взаимодействовали только с 4% сывороток (фиг. 13, A). Интересно, что два пациента, которые были оценены негативно в CAP на пшеничную муку (B 5, B 18: таблица VII), реагировали на аллерген №126. Сорок восемь процентов пациентов с астмой пекарей проявляли IgE-реактивность на экстракт пыльцы тимофеевки луговой, и каждого из таких пациентов диагностировали с использованием сочетания пятен rPh1 p 1 и rPh1 p 5. Рекомбинантный Ph1 p 12 (35%) всегда был более сильным и более часто узнаваемым, чем профилин пшеницы №123 (22%). Перекрестно реактивный аллерген пыльцы rPh1 p 7 взаимодействовал с 13% сывороток.
Рекомбинантные аллергены семян пшеницы, распознаваемые пациентами с астмой пекарей, не являются мишенями для IgE-антител пациентов, страдающих индуцированной пшеницей пищевой аллергией
Все пациенты с пищевой аллергией на пшеницу были позитивными в CAP в отношении пшеничной муки, но почти не распознавали рекомбинантные белки пшеницы (5%) (фиг. 13, B). Два пациента, которые был позитивными в отношении перекрестно реактивного профилина пыльцы тимофеевки луговой, также имели положительный сигнал на профилин пшеницы №123 на микроматрице. Пятьдесят пять процентов пациентов с индуцированной пшеницей пищевой аллергией, имели IgE-реактивность в CAP в отношении Phleum, но только 18% проявляли реактивность на экстракт пыльцы пшеницы на чипе, и 26% на сочетание пятен rPh1 p 1 и rPh1 p 5. Нанесенные в виде пятен rPh1 p 1 и rPh1 p 5 отдельно распознавались 18% и 16% сывороток, соответственно, перекрестно реактивные аллергены rPh1 p 7 и rPh1 p 12 взаимодействовали с 13% и 26% сывороток.
rPh1 p 1 и rPh1 p 5 являются диагностическими маркерными аллергенами в случае аллергии на пыльцу растений, тогда как профилин является узнаваемым пациентами с астмой пекарей и пищевой аллергией на пшеницу
Шестьдесят пять процентов пациентов с аллергией на пыльцу растений были позитивными в CAP в отношении пшеничной муки. Из рекомбинантных белков пшеницы, тестированных на микроматрице, только рекомбинантный белок пшеницы №123 был узнаваемым 23,5% пациентов (фиг. 13, C). Каждый из таких пациентов также был позитивным на перекрестно реактивный профилин пыльцы тимофеевки луговой rPh1 p 12. Но rPh1 p 12 всегда был сильнее и чаще узнаваемым (35%), чем №123. Все пациенты, страдающие аллергией на пыльцу растений, были позитивными в CAP в отношении пальцы тимофеевки луговой и в отношении сочетания нанесенных в виде пятен rPh1 p 1 и rPh1 p 5. Рекомбинантный Ph1 p 1 отдельно был более часто узнаваемым (94%), чем rPh1 p 5 (88%) пациентами с аллергией на пыльцу растений. Экстракт пыльцы пшеницы взаимодействовал с 82% сывороток, а перекрестно реактивный rPh1 p 7 взаимодействовал с 29% сывороток. Все пациенты с аллергией на пыльцу растений и пациенты с астмой пекарей и аллергией на пыльцу растений были позитивными в отношении сочетания rPh1 p 1 и rPh1 p 5 на микроматрице и в CAP в отношении Phleum (фиг. 13, A; C). Полученные данные согласуются с ранее опубликованными данными, показывающими, что аллергия на пыльцу растений может быть диагностирована по IgE-реактивности на rPh1 p 1 и rPh1 p 5 (20, 21). Однако среди пациентов с индуцированной пшеницей пищевой аллергией только 26% реагировало на rPh1 p 1 и rPh1 p 5 в анализе на микроматрице, но более чем в два раза больше (55%) были позитивными в CAP в отношении Phleum (фиг. 13, B). Кроме того, пациенты, реагирующие на экстракт пыльцы пшеницы в системе CAP и профилин пыльцы тимофеевки луговой (rPh1 p 12) на микроматрице, также были позитивными в отношении профилина пшеницы (22) вследствие перекрестной реактивности профилинов растений (23). Тем не менее, частота и интенсивность узнавания IgE всегда была сильнее на rPh1 p 12, чем на профилин пшеницы (22).
ПРИМЕР 4
Аналит иммобилизовали на твердой подложке, такой как ImmunoCAP (Phadia, Uppsala, Sweden). Образцы сыворотки, по меньшей мере, трех типичных пациентов, сенсибилизированных на аллерген и проявляющих IgE-реактивность на такой аллерген, инкубировали в течение 3 часов при комнатной температуре с аллергеном с конечной концентрации 100 мкг/мл и параллельно в качестве негативных контролей отдельно с буфером и с неаллергенным белком, связывающим мальтозу (MBP), E. coli. Затем образцы анализировали в отношении связывания IgE с использованием тестов ImmunoCAP (Phadia, Uppsala, Sweden), несущих иммобилизованный аналит, чтобы исследовать вызывает ли предварительная инкубация с аллергеном специфичное ингибирование или значительное снижение связывания IgE.
| Таблица I Демографические, клинические и серологические характеристики пациентов, страдающих астмой пекарей |
||||||||||||
| пациент | возраст | пол | астма | Профессиональное воздействие | Концентрация IgE, кЕд.А/л | SPT на пыльцу растений | общий IgE; кЕд./л | РС20 | мг/мл | |||
| пшеница | рожь | соя | α-амилаза грибов | |||||||||
| 1 | 35 | m | + | + | 74,2 | 20,7 | N.d. | 0,63 | + | 163 | + | 0,29 |
| 2 | 29 | m | + | + | 18 | 7,9 | 6,1 | 1,5 | + | 271 | + | 2 |
| 3 | 36 | m | + | + | 1,66 | 1,24 | <0,35 | <0,35 | - | 353 | + | 0,31 |
| 4 | 39 | m | + | + | 25,8 | 15,6 | 1,36 | 18,6 | + | 1387 | + | 0,25 |
| 5 | 54 | m | + | + | <0,35 | <0,35 | <0,35 | 3,21 | - | 30,1 | N.d. | |
| 6 | 35 | m | + | + | 24,3 | 39,6 | 5,73 | 2,29 | + | 416 | + | 0,25 |
| 7 | 28 | m | + | + | 2,58 | 3,77 | <0,35 | 5,39 | + | 248 | + | 0,25 |
| 8 | 27 | m | + | + | 7,86 | 7,4 | 3,19 | 32,2 | + | 1773 | + | 0,47 |
| 9 | 24 | m | - | + | 2,35 | 2,32 | 1,62 | N.d. | + | 204 | + | 0,09 |
| 10 | 60 | m | + | + | 3,44 | 4,08 | <0,35 | 1,15 | + | 73,3 | + | 0,44 |
| 11 | 22 | m | + | + | 3 | 2 | <0,35 | <0,35 | - | 2509 | + | 3,38 |
| 12 | 26 | m | + | + | >100 | >100 | 10,7 | 7,63 | + | 321 | + | 0,5 |
| 13 | 54 | m | + | + | 2,48 | 0,6 | 0,71 | <0,35 | - | 480 | + | 0,12 |
| 14 | 60 | m | + | + | 31,8 | 31,1 | N.d. | <0,35 | + | 629 | + | 0,15 |
| 15 | 27 | m | + | + | 5,06 | N.d. | N.d. | <0,35 | + | 278 | + | 0,079 |
| 16 | 42 | f | + | + | 3,71 | 2,71 | 1,69 | <0,35 | + | 271 | + | 0,187 |
| 17 | 54 | m | + | + | 1,68 | 1,13 | <0,35 | <0,35 | - | 79,2 | + | 16 |
| 18 | 59 | m | + | + | <0,35 | <0,35 | <0,35 | 5 | - | 673 | + | 0,23 |
| 19 | 26 | m | + | + | 74,6 | 58,4 | <0,35 | <0,35 | + | 17,7 | + | 1,16 |
| 20 | 43 | m | + | + | 13,8 | 26,9 | 0,77 | <0,35 | + | 538 | + | 0,25 |
| 21 | 34 | f | + | + | 2,05 | 1 | <0,35 | <0,35 | + | Н.о | + | 0,5 |
| 22 | 41 | f | + | + | 1,77 | 0,75 | <0,35 | <0,35 | + | 23,4 | + | 0,023 |
| m: мужчина; f: женщина; +: позитивный; -: негативный; n.d.: не определяли; кЕд. А/л: килоединиц антигена на литр; SPT: инъекционная кожная проба; PC20: ингаляционная провокация метахолином | ||||||||||||
| Таблица II Демографические, клинические и серологические характеристики пациентов, страдающих пищевой аллергией на пшеницу и аллергией на пыльцу растений |
||||||||
| Пациенты | Возраст | Пол | RC | AD | Астма | Концентрация IgE, кЕд. А/л | общий IgE, кЕд./л | |
| пшеница | рожь | |||||||
| F1 | 34 | f | - | + | + | 18,6 | 13,4 | >200 |
| F2 | 34 | M | + | - | - | 3,1 | 3,08 | 155 |
| F3 | 24 | F | - | + | - | 1,3 | n.d. | 336 |
| F4 | 15 | F | - | + | - | 5,91 | 5,3 | 915 |
| G1 | 45 | M | + | - | + | 1,76 | 2 | 175 |
| G2 | 39 | M | + | - | + | 11,1 | 10,3 | 401 |
| G3 | 55 | F | - | - | - | 3,16 | 1 | 157 |
| G4 | 54 | M | + | - | + | n.d. | n.d. | 1528 |
| F: пищевая аллергия; G: аллергия на пыльцу растений; m: мужчина; f: женщина; RC: риноконъюнктивит; AD: атопический дерматит; +: позитивный; -: негативный; n.d.: не определяли; кЕд. А/л: килоединиц антигена на литр. |
||||||||
| Таблица V Пациенты с пищевой аллергией и аллергией на пыльцу растений |
||||||||
| Возраст на момент сдачи крови | Концентрация IgE, кЕд.А/л | |||||||
| Группа пациентов | Пол | RC | AD | Астма | Пшеница | Рожь | общий IgE | |
| с пищевой аллергией 1 | 32 | m | + | - | - | 3,1 | 3,08 | 155 |
| с пищевой аллергией 2 | 34 | f | - | - | + | 18,6 | n.d. | >2000 |
| с пищевой аллергией 3 | 24 | f | - | + | - | 1,3 | n.d. | 336 |
| с пищевой аллергией 4 | 15 | f | - | + | - | 5,91 | 5,3 | 915 |
| с аллергией на пыльцу растений 1 | 45 | m | + | - | + | n.d. | n.d. | n.d. |
| с аллергией на пыльцу растений 2 | 39 | m | + | - | + | n.d. | n.d. | 401 |
| с аллергией на пыльцу растений 3 | 55 | f | - | - | - | n.d. | n.d. | n.d. |
| с аллергией на пыльцу растений 4 | 54 | m | + | - | + | n.d. | n.d. | 1528 |
| m: мужчина; f: женщина; +: позитивный; -: негативный; n.d.: не определяли | ||||||||
| Таблица VI Праймеры ПЦР, используемые для амплификации кДНК |
||
| Праймер | Последовательность | |
| 10 прямой | 5' CAT ATG AGC CCT GIG GTG AAG AAG CCG GAG GGA | 3' |
| 10 обратный | 5' GAATTC TTA GTG ATG GTG ATG GTG ATG GCC GAC CCT GGG GAC | 3' |
| 37 прямой | 5' CAT ATG GCC GCC GAG GAG GGA GCC GTG ATA | 3' |
| 37 обратный | 5' GAATTC TTA GTG ATG GTG ATG GTG ATG GGC AGA TGC AGA ACC | 3' |
| 38 прямой | 5' CAT ATG GCG GGC GAG AAG GGC CTG GTG CTG | 3' |
| 38 обратный | 5' GAATTC TTA GTG ATG GTG ATG GTG ATG CTC GAT GCC GTA CTT | 3' |
| 112 прямой | 5' CAT ATG CCG GGC CTC ACC ATC GGC GAC ACC GTC | 3' |
| 112 обратный | 5' GAATTC TTA GTG ATG GTG ATG GTG ATG GAC CTT GGT GAA GCG | 3' |
| 123 прямой | 5' CAT ATG TCG TGG CAG ACG TAC GTC GAC GAC | 3' |
| 123 обратный | 5'GAATTC TTA GTG ATG GTG ATG GTG ATG GAA ACC CTG CTC GAC | 3' |
| 126 прямой | 5' CAT ATG GCG GAC TAC GGT GGA GAG TAC GGG | 3' |
| 126 обратный | 5' GAATTC TTA GTG ATG GTG ATG GTG GTG TCC AGG GAG CTT | 3' |
| Сайты рестрикции NdeI показаны курсивом, сайты рестрикции EcoRI подчеркнуты, гексагистидиновые метки показаны жирным шрифтом | ||
| Таблица VII Демографические, клинические и серологические характеристики пациентов, страдающих астмой пекарей |
|||||||||||
| Пациент | Пол | Возраст | IgE пшеничной муки кЕд.А/л | IgE Phleum pretense кЕд.А/л | общий IgE, кЕд./л | профессия | продолжительность воздействия, годы | симпто мы |
другие аллергены | РС20 мг/мл |
SIC пшени цы, мг/кг |
| В1 | M | 35 | 74,2 | 5,25 | 163 | кондитер | 20 | A,RC | g | 0,29 | 0,039 |
| В2 | m | 29 | 18 | 53,5 | 271 | кондитер | 12 | A,RC | g | 2 | n.d. |
| В3 | m | 36 | 1,66 | <0,35 | 353 | пекарь | 8 | A,RC | n.k. | 0,31 | n.d. |
| В4 | m | 39 | 25,8 | 0,73 | 1387 | пекарь-кондитер | 20 | A,RC, U | g | 0,25 | n.d. |
| В5 | m | 54 | <0,35 | <0,35 | 30,1 | пекарь | 42 | RC, A | n.k. | n.d. | n.d. |
| В6 | m | 35 | 24,3 | 4,67 | 416 | пекарь | 12 | RC, A | G | 0,25 | n.d. |
| В7 | m | 28 | 2,58 | <0,35 | 246 | пекарь | 14 | A, RC | c, d, h, hdm | 0,25 | n.d. |
| В8 | m | 27 | 7,86 | >100 | 1773 | пекарь | 26 | A, RC | n.k. | 0,47 | 0,625 |
| В9 | m | 24 | 2,35 | >100 | 204 | пекарь | 18 | RC | c, d, g, h, hdm | 0,09 | n.d. |
| В10 | m | 60 | 3,44 | <0,35 | 73,3 | кондитер | 46 | A, RC | hdm, m | 0,44 | n.d. |
| В11 | m | 22 | 3 | <0,35 | 2509 | пекарь | 5 | A, RC, U | n.k | 3,36 | 0,0015 |
| В12 | m | 28 | >100 | >100 | 321 | пекарь-кондитер | 5 | A, RC | g | 0,5 | n.d. |
| В13 | m | 54 | 2,48 | <0,35 | 480 | кондитер | 25 | A, RC | n.k. | 0,12 | n.d. |
| В14 | m | 60 | 31,8 | <0,35 | 628 | пекарь | 13 | A | c, cr, d | 0,15 | 0,002 |
| В15 | m | 27 | 5,06 | 42,2 | 278 | кондитер | 10 | A, RC | c, cr, d, g | 0,079 | 0,078 |
| В16 | f | 42 | 3,71 | 2,15 | 271 | пицеолло | 12 | A, RC, U | G | 0,187 | 0,625 |
| В17 | m | 54 | 1,68 | <0,35 | 79,2 | кондитер | 38 | A | hdm | 16 | n.d. |
| В18 | m | 59 | <0,35 | <0,35 | 673 | пекарь-кондитер | 22 | A,RC | n.k. | 0,23 | n.d. |
| В19 | m | 26 | 74,6 | 57,4 | 17,7 | кондитер | 16 | A,RC | g | 1,16 | 0,15 |
| В20 | m | 43 | 13,8 | 11 | 538 | пекарь | 19 | A | g, p | 0,25 | EAR |
| В21 | f | 34 | 2,05 | <0,35 | 229 | кондитер | 2 | A | hdm, o | 0,5 | DAR |
| В22 | f | 41 | 1,77 | <0,35 | 23,4 | повар/кондитер | 1 | A | o | 0,23 | EAR |
| В23 | f | 53 | 0,41 | <0,35 | 469 | домработница | n.k. | n.k. | n.k. | n.d. | n.d. |
| m: мужчина; f: женщина; кЕд.А/л: килоединиц антигена на литр; n.k.: не известно; A: астма; RC: риноконъюнктивит; U: крапивница; с: кошка; cr: таракан; d: собака; g: пыльца растений; h: лошадь; hdm: клещи домашней пыли; m: плесень; o: пыльца оливы; PC20: ингаляционная провокация метахолином (позитивная, если <16 мг/мл); SIC: специфичная ингаляционная провокация; EAR: ранний астматический ответ; DAR: двойной астматический ответ; LAR: поздний астматический ответ; n.d.: не определяли | |||||||||||
| Таблица VIII Демографические, клинические и серологические характеристики пациентов, страдающих пищевой аллергией |
||||||||
| Пациент | Пол | Возраст | IgE пшеничной муки кЕд.А/л | IgE Phleum pratense кЕд.А/л | общий IgE, кЕд./л | симптомы | DBPCFC | другие аллергены |
| F1 | f | 56 | 0,74 | <0,35 | 820 | U | n.d. | s |
| F2 | f | 50 | 0,78 | <0,35 | 275 | Ad, CJ, Di, F | n.d. | hdm |
| F3 | f | 49 | >100 | 0,65 | 1794 | отсутствие симптомов-диеты | n.d. | g, hdm, n, sh |
| F4 | f | 72 | 5,98 | <0,35 | 325 | E, D, P | n.d. | he, n, s |
| F5 | f | 11 | 2,15 | 3,28 | 11 | A,C,Ri | n.d. | g, n, s, o |
| F6 | f | 40 | 1,9 | <0,35 | 19,3 | C, CJ, B | n.d. | n.k. |
| F7 | m | 11 | 0,92 | 1,21 | 118 | n.k. | n.d. | g, n, s |
| F8 | m | 24 | 5,78 | <0,35 | 111 | C, CJ, N, R | n.d. | n.k. |
| F9 | f | 21 | 1,22 | 25,8 | 94,8 | C, N, P, R | n.d. | g |
| F10 | f | 5 | 1,93 | 34,3 | 453 | RC | n.d. | a, b, cm, g. r |
| F11 | f | 29 | 1,55 | 10,4 | 101 | De, Rj | n.d. | c, b, g, p |
| F12 | f | 45 | 5,72 | 1,12 | 30,1 | A, C, D, волдыри на языке | n.d. | g, n, s, r |
| F13 | m | 7 | 2,8 | >100 | <2000 | B, RC | n.d. | a, b, g |
| F14 | f | 1 | 0,81 | n.d. | 46,3 | n.k. | n.d. | cm, he |
| F15 | f | 26 | 1,27 | >100 | 616 | n.k. | n.d. | a, cm, g, l, m |
| F16 | m | 50 | 7,57 | 22,6 | 450 | A, C, D, N, RC | n.d. | b, g |
| F17 | f | 51 | 3,97 | 5,12 | 44,1 | Di, F | n.d. | f, g, n |
| F18 | f | 43 | 1,03 | 59,3 | 338 | C | n.d. | b, g, n, s |
| F19 | f | 19 | 20,5 | <0,35 | 949 | A, C, D, R | n.d. | n.k. |
| F20 | f | 57 | 17,8 | <0,35 | 174 | n.k. | n.d. | n.k. |
| F21 | m | 12 | 0,81 | 1,47 | 769 | A, RC | n.d. | he, g, w |
| F22 | f | 55 | 2,11 | <0,35 | 152 | отсутствие симптомов-диеты | n.d. | n, sea |
| F23 | m | 43 | 4,24 | 2,41 | 207 | n.k. | n.d. | n.k. |
| F24 | F | 33 | 1,55 | Б0б35 | 253 | n.k. | n.d. | n.k. |
| F25 | m | 51 | 1,64 | >100 | 45 | n.k. | n.d. | n.k. |
| F26 | m | 27 | 6,11 | 67,7 | 974 | C, Cj, D, Ri, в прошлом A | n.d. | ca, he, g, ce, sp |
| F27 | f | 9 | 6,47 | >100 | 1233,5 | E, Ri | + | n.k. |
| F28 | m | 0,5 | 7,39 | <0,35 | 65,2 | E, U свистящее дыхание | + | n.k. |
| F29 | f | 1 | 33,5 | <0,35 | 201 | покраснение, зуд | + | cm, he |
| F30 | f | 1 | 10 | n.d. | 25,5 | U, зуд | + | cm, he, s |
| F31 | m | 1 | 18,9 | n.d. | 1343 | U | + | s |
| F32 | m | 1 | 35,1 | 0,83 | 325 | U, Ri зуд | + | g,s |
| F33 | f | 1 | 4,27 | <0,35 | 38,4 | U, Ri покраснение | + | n.k. |
| F34 | f | 0,5 | 21,3 | <0,35 | 1511 | U | + | cm |
| F35 | f | 1 | 5,21 | n.d. | 1718 | AD, G, U | + | cm |
| F36 | m | 1 | 61,4 | 0,69 | 876 | покраснение, зуд | + | g, cm |
| F37 | m | 1 | 52 | 0,38 | 254 | Ri, U | + | cm, he g |
| F38 | f | 0,5 | 94,4 | 1,9 | 1524 | De, Ri | открытый провокаци онный тест |
n.k. |
| m: мужчина; f: женщина; n.k.: не известно; n.d.: не определяли; кЕд.А/л: килоединиц антигена на литр; A: астма; Ab: абдоминалгия; B: бронхит; C: кашель; CJ: конъюнктивит; D: диспноэ; De: дерматит; Di: диарея; E: энзема; F: метеоризм; G: желудочно-кишечные симптомы; N: заложенность носа: P: зуд; R: ринорея; RC: риноконъюнктивит; Ri: ринит; S: боль в горле; U: крапивница; V: головокружение; Vo: рвота; DBPCFC: двойная слепая плацебо-контролируемая пищевая провокация; a: полынь; b: пыльца березы; с: кошка; ca: морковь; cm: коровье молоко; f: формальдегид; g: пыльца растений; h: фундук; he: куриные яйца; hdm: клещи домашней пыли; l: латекс; m: солод; n: орехи; o: апельсин; p: слива; r: рис; s: соя; ce: сельдерей; sea: морепродукты; sh: креветки; sp: специи; w:. | ||||||||
| Таблица IX Демографические, клинические и серологические характеристики пациентов, страдающих аллергией на пыльцу растений |
|||||||
| Пациент | Пол | Возраст | IgE Phleum pratense кЕд.А/л | IgE пшеничной муки кЕд.А/л | общий IgE, кЕд./л симптомы | Симптомы | другие аллергены |
| G1 | m | 22 | 37,8 | 1,13 | 529 | D, RC, U | c, b, d, hdm, s |
| G2 | m | 30 | 44,6 | 0,52 | 290 | D, RC | b, a, hdm, d |
| G3 | f | 25 | 59,8 | <0,35 | 1004 | RC | b, d, hdm, h, ce |
| G4 | m | n.k. | 25,9 | 3,62 | 140 | RC | a, b |
| G5 | f | 22 | 37,2 | <0,35 | 566 | R | b, c, hdm |
| G6 | f | 22 | 22,4 | <0,35 | 77,4 | RC | hdm, r |
| G7 | m | 24 | 30,8 | <0,35 | 60,8 | n.k. | n.k. |
| G8 | m | 35 | 9,92 | <0,35 | 88,6 | D | b |
| G9 | m | 36 | 20,7 | 0,45 | 128 | R | ap, b, hdm |
| G10 | f | 22 | >100 | 4,13 | >5000 | RC | b, c, hdm, rye |
| G11 | m | 41 | 49,3 | 4,01 | >2000 | A, CJ | a, b, c, hdm |
| G12 | m | 37 | n.d. | 1,11 | 243 | n.k. | n.k. |
| G13 | m | 28 | 39,3 | 1,06 | 144 | RC | b, a |
| G14 | f | 27 | >100 | <0,35 | 260 | A, RC | n.k. |
| G15 | m | 39 | >100 | 11,1 | 401 | n.k. | n.k. |
| G16 | m | 54 | >100 | 9,93 | 1528 | A, CJ | n.k. |
| G17 | m | 45 | n.d. | 1,76 | 175 | RC | d, hdm, s, p |
| m: мужчина; f: женщина; n.k.: не известно; n.d.: не определяли; кЕд.А/л: килоединиц антигена на литр; A: астма; CJ: конъюнктивит; D: диспноэ; RC: риноконъюнктивит; R: ринит; U: крапивница; a: полынь; ap: яблоко; b: пыльца березы; с: кошка; d: собака; h: фундук; hdm: клещи домашней пыли; r: кролик; s: соя; ce: сельдерей; p: картофель. | |||||||
Ссылки
1. Quirce, S., M. Fernandez-Nieto, C. Escudero, J. Cuesta, M. de Las Heras, and J. Sastre. 2006. Bronchial responsiveness to bakery-derived allergens is strongly dependent on specific skin sensitivity. Allergy 61:1202-1208.
2. Constantin, C, W. D. Huber, G. Granditsch, M. Weghofer, and R.Valenta. 2005. Different profiles of wheat antigens are recognised by patients suffering from coeliac disease and IgE-mediated food allergy. Int Arch Allergy Immunol 138:257-266.
3. Yeh, K., R. Juang, and J. Su. 1991. A rapid and efficient method for a RNA isolation from plants with high carbohydrate content. Focus 13:102-103.
4. Sambrook, J., E. F. Fritsch, and T. Maniatis. 1989. Molecular Cloning: A laboratory Manual. Cold Spring Harbor Laboratory Press.
5. Breiteneder, H., K. Pettenburger, A. Bito, R. Valenta, D. Kraft, H.Rumpold, O. Scheiner, and M. Breitenbach. 1989. The gene coding for the major birch pollen allergen Betvl, is highly homologous to a pea disease resistance response gene. Embo J8:1935-1938.
6. Stern, D. A., J. Riedler, D. Nowak, C. Braun-Fahrlander, I. Swoboda, N.Balic, K. W. Chen, S. Vrtala, H. Gronlund, M. van Hage, R. Valenta, S.Spitzauer, E. Von Mutius, and D. Vercelli. 2007. Exposure to a farming environment has allergen-specific protective effects on TH2-dependent isotype switching in response to common inhalants. J Allergy Clin Immunol 119:351-358.
7. Laemmli, U. K. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227:680-685.
8. Towbin, H., T. Staehelin, and J. Gordon. 1979. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. ProcNatlAcad Sci US A 76:4350-4354.
9. Whitmore, L., and B. A. Wallace. 2004. DICHROWEB, an online server for protein secondary structure analyses from circular dichroism spectroscopic data. Nucleic Acids Res 32:W668-673.
10. Kaul, S., D. Luttkopf, B. Kastner, L. Vogel, G. Holtz, S. Vieths, and A. Hoffmann. 2007. Mediator release assays based on human or murine immunoglobulin E in allergen standardization. Clin Bxp Allergy 37:141-150.
11. Richardson, M., and L. Cossins. 1974. Chymotryptic inhibitor I from potatoes: the amino acid sequences of subunits B, C, and D. FEBS Lett 45:11-13.
12. Vrtala S, Fischer S, Grote M, Vangelista L, Pastore A, Sperr WR, et al. 1999. Molecular, immunological, and structural characterization of Phi p6, a major allergen and P-particle-associated protein from Timothy grass (Phleum pratense) pollen. J Immunol 163:5489-96.
13. Nystrand M. 2006. A multiplexed immunoassay for the rapid detection of specific IgE in allergy diagnosis. TVDT 2006:61.
14. Nilsson K, Bennich H, Johansson SG, Ponten J. 1970. Established immunoglobulin producing myeloma (IgE) and lymphoblastoid (IgG) cell lines from an IgE myeloma patient. Clin Exp Immunol 7:477-89.
15. Constantin C, Quirce S, Grote M, Touraev A, Swoboda I, Stoecklinger A, et al. Molecular and immunological characterization of a wheat serine proteinase-inhibitor as a novel allergen in baker's asthma. Unpublished.
16. Laffer S, Valenta R, Vrtala S, Susani M, van Ree R, Kraft D, et al. 1994. Complementary DNA cloning of the major allergen Phi p I from timothy grass (Phleum pratense); recombinant Phi p I inhibits IgE binding to group I allergens from eight different grass species. J Allergy Clin Immunol 94:689-98.
17. Vrtala S, Sperr WR, Reimitzer I, van Ree R, Laffer S, Muller WD, et al. 1993. cDNA cloning of a major allergen from timothy grass (Phleumpratense) pollen; characterization of the recombinant Phi pV allergen. J Immunol 151:4773-81.
18. Niederberger V, Hayek B, Vrtala S, Laffer S, Twardosz A, Vangelista L, et al. 1999, Calcium-dependent immunoglobulin E recognition of the apo-and calcium-bound form of a cross-reactive two EF-hand timothy grass pollen allergen, Phi p 7. Faseb J 13:843-56.
19. Valenta R, Ball T, Vrtala S, Duchene M, Kraft D, Scheiner O. 1994. cDNA cloning and expression of timothy grass (Phleum pratense) pollen profiling in Escherichia coli: comparison with birch pollen profilin. Biochem BiophysRes Commun 199:106-18.
20. Kazemi-Shirazi L, Niederberger V, Linhart B, Lidholm J, Kraft D, Valenta R. 2002. Recombinant marker allergens: diagnostic gatekeepers for the treatment of allergy. Int Arch Allergy Immunol 127:259-68.
21. Andersson K, Lidholm J. 2003. Characteristics and immunobiology of grass pollen allergens. Int Arch Allergy Immunol 130:87-107.
22. Sampson HA. 1999. Food allergy. Part 2: diagnosis and management. J Allergy CUn Immunol 103:981-9.
23. Radauer C, Willerroider M, Fuchs H, Hoffmann-Sommergruber K, Thalhamer J, Ferreira F, et al. 2006. Cross-reactive and species-specific immunoglobulin E epitopes of plant profilins: an experimental and structure-based analysis. Clin Exp Allergy 36:920-9.
Claims (8)
1. Изолированный полипептид, имеющий аминокислотную последовательность согласно SEQ ID NO: 2 или 8, для применения в диагностике IgE-опосредованной аллергии на пшеницу.
2. Полипептид по п.1, отличающийся тем, что он выделен из пшеницы или получен рекомбинантно.
3. Изолированная молекула нуклеиновой кислоты, кодирующая полипептид по п.1 или 2.
4. Нуклеиновая кислота по п.3, имеющая нуклеотидную последовательность, согласно SEQ ID NO: 1,7.
5. Применение изолированного полипептида, имеющего аминокислотную последовательность согласно SEQ ID NO: 2 или 8, или его фрагмента или варианта, имеющего общие эпитопы для антител с указанным полипептидом и имеющего последовательность идентичную SEQ ID NO: 2 или 8 по крайней мере на 95%, для диагностики IgE-опосредованной аллергии на пшеницу.
6. Способ диагностики IgE-опосредованной аллергии in vitro на пшеницу, включающий стадии
- контактирования образца жидкости организма из млекопитающего, у которого предполагается наличие IgE-опосредованной аллергии на пшеницу, по меньшей мере, с одним полипептидом, имеющим аминокислотную последовательность согласно SEQ ID NO: 2 или 8, или с его фрагментом или вариантом, имеющим общие эпитопы для антител с указанным полипептидом и имеющим последовательность идентичную SEQ ID NO: 2 или 8 по крайней мере на 95%; и
- выявления присутствия в образце IgE-антител, специфично связывающихся с указанным полипептидом или полипептидами;
при этом присутствие таких антител, специфично связывающихся с указанным полипептидом или полипептидами, является показателем IgE-опосредованной аллергии на пшеницу.
- контактирования образца жидкости организма из млекопитающего, у которого предполагается наличие IgE-опосредованной аллергии на пшеницу, по меньшей мере, с одним полипептидом, имеющим аминокислотную последовательность согласно SEQ ID NO: 2 или 8, или с его фрагментом или вариантом, имеющим общие эпитопы для антител с указанным полипептидом и имеющим последовательность идентичную SEQ ID NO: 2 или 8 по крайней мере на 95%; и
- выявления присутствия в образце IgE-антител, специфично связывающихся с указанным полипептидом или полипептидами;
при этом присутствие таких антител, специфично связывающихся с указанным полипептидом или полипептидами, является показателем IgE-опосредованной аллергии на пшеницу.
7. Способ по п.6, в котором IgE-опосредованной аллергией является респираторная аллергия на пшеничную муку.
8. Диагностический набор для осуществления способа по п.6 или 7, содержащий полипептид, имеющий аминокислотную последовательность согласно SEQ ID NO: 2 или 8, или его фрагмент или вариант, имеющий общие эпитопы для антител с указанным полипептидом и имеющий последовательность идентичную SEQ ID NO: 2 или 8 по крайней мере на 95%, и средства для выявления связывания IgE с указанным полипептидом, такие как твердая подложка, например, нитроцеллюлозная мембрана или микроматрица, содержащая связанный с ней полипептид.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US99133807P | 2007-11-30 | 2007-11-30 | |
| SE0702680-0 | 2007-11-30 | ||
| US60/991,338 | 2007-11-30 | ||
| SE0702680 | 2007-11-30 | ||
| PCT/SE2008/051377 WO2009070118A1 (en) | 2007-11-30 | 2008-11-28 | Novel wheat allergens |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2010126590A RU2010126590A (ru) | 2012-01-10 |
| RU2502742C2 true RU2502742C2 (ru) | 2013-12-27 |
Family
ID=40678844
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2010126590/10A RU2502742C2 (ru) | 2007-11-30 | 2008-11-28 | Новые аллергены пшеницы |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US9173934B2 (ru) |
| EP (1) | EP2225266B1 (ru) |
| JP (1) | JP5542685B2 (ru) |
| CN (1) | CN101932597B (ru) |
| AU (1) | AU2008330230A1 (ru) |
| CA (1) | CA2707190C (ru) |
| DK (1) | DK2225266T3 (ru) |
| ES (1) | ES2634241T3 (ru) |
| RU (1) | RU2502742C2 (ru) |
| WO (1) | WO2009070118A1 (ru) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014031939A1 (en) * | 2012-08-23 | 2014-02-27 | The Trustees Of Columbia University In The City Of New York | Wheat proteomic microarray for biomarker discovery |
| US11141047B2 (en) | 2015-05-19 | 2021-10-12 | Tyto Care Ltd. | Systems and methods for throat imaging |
| JP6568193B2 (ja) * | 2017-12-19 | 2019-08-28 | ホーユー株式会社 | エピトープ |
| JP7420330B2 (ja) * | 2019-06-13 | 2024-01-23 | 学校法人藤田学園 | アレルギーの抗原およびそのエピトープ |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0556745A1 (en) * | 1992-02-21 | 1993-08-25 | Abbott Laboratories | Method for detection of anti-wheat-protein antibodies |
| RU2276790C2 (ru) * | 2000-10-03 | 2006-05-20 | Вбс-Джиномикс Байосайенс Рисерч Гмбх | Микроанализ на аллергены |
| US7214786B2 (en) * | 2000-12-14 | 2007-05-08 | Kovalic David K | Nucleic acid molecules and other molecules associated with plants and uses thereof for plant improvement |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20050108791A1 (en) * | 2001-12-04 | 2005-05-19 | Edgerton Michael D. | Transgenic plants with improved phenotypes |
| US7569389B2 (en) * | 2004-09-30 | 2009-08-04 | Ceres, Inc. | Nucleotide sequences and polypeptides encoded thereby useful for modifying plant characteristics |
| US20070277269A1 (en) | 2006-04-17 | 2007-11-29 | Ceres, Inc. | Nucleotide sequences and polypeptides encoded thereby useful for modifying plant characteristics |
| US20060107345A1 (en) * | 2003-09-30 | 2006-05-18 | Nickolai Alexandrov | Sequence-determined DNA fragments and corresponding polypeptides encoded thereby |
| US20060048240A1 (en) * | 2004-04-01 | 2006-03-02 | Nickolai Alexandrov | Sequence-determined DNA fragments and corresponding polypeptides encoded thereby |
| CA2558612C (en) * | 2004-03-05 | 2013-10-01 | Prima Meat Packers, Ltd. | Method and antibodies for detecting milk allergens |
| US20060041961A1 (en) * | 2004-03-25 | 2006-02-23 | Abad Mark S | Genes and uses for pant improvement |
-
2008
- 2008-11-28 DK DK08854961.3T patent/DK2225266T3/en active
- 2008-11-28 ES ES08854961.3T patent/ES2634241T3/es active Active
- 2008-11-28 AU AU2008330230A patent/AU2008330230A1/en not_active Abandoned
- 2008-11-28 EP EP08854961.3A patent/EP2225266B1/en active Active
- 2008-11-28 CA CA2707190A patent/CA2707190C/en active Active
- 2008-11-28 US US12/744,885 patent/US9173934B2/en active Active
- 2008-11-28 CN CN200880125943XA patent/CN101932597B/zh active Active
- 2008-11-28 RU RU2010126590/10A patent/RU2502742C2/ru active
- 2008-11-28 JP JP2010535920A patent/JP5542685B2/ja active Active
- 2008-11-28 WO PCT/SE2008/051377 patent/WO2009070118A1/en active Application Filing
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0556745A1 (en) * | 1992-02-21 | 1993-08-25 | Abbott Laboratories | Method for detection of anti-wheat-protein antibodies |
| RU2276790C2 (ru) * | 2000-10-03 | 2006-05-20 | Вбс-Джиномикс Байосайенс Рисерч Гмбх | Микроанализ на аллергены |
| US7214786B2 (en) * | 2000-12-14 | 2007-05-08 | Kovalic David K | Nucleic acid molecules and other molecules associated with plants and uses thereof for plant improvement |
Non-Patent Citations (7)
| Title |
|---|
| BITTNER ЕТ AL., Identification of wheat gliadins as an allergen family related to baker's asthma, JOURNAL OF ALLERGY AND CLINICAL IMMUNOLOGY, 2007, v.121, n.3, p.744-749. * |
| База данных «GenBank» последовательность под CAL40951.1, unnamed protein product [Hordeum vulgare], размещена в БД 08.09.2006. * |
| База данных «GenBank» последовательность под CAL40953.1, unnamed protein product [Triticum turgidum], размещена в БД 08.09.2006. * |
| База данных «GenBank» последовательность под АВТ5 2204.1, Sequence 139674 from patent US 7214786, размещена в БД 10.08.2007. * |
| База данных «GenBank» последовательность под АВТ52205.1, Sequence 139675 from patent US 7214786, размещена в БД 10.08.2007. * |
| База данных «UniProtKB/Swiss-Prot» последовательность под № Р82977 (ICIW_WHEAT), размещена в БД 09.01.2007. База данных «GenBank» последовательность под № АВТ5 2204.1, Sequence 139674 from patent US 7214786, размещена в БД 10.08.2007. База данных «GenBank» последовательность под № АВТ52205.1, Sequence 139675 from patent US 7214786, размещена в БД 10.08.2007. База данных «GenBank» последовательность под № CAL40951.1, unnamed protein product [Hordeum vulgare], размещена в БД 08.09.2006. База данных «GenBank» последовательность под № CAL40953.1, unnamed protein product [Triticum turgidum], размещена в БД 08.09.2006. * |
| База данных «UniProtKB/Swiss-Prot» последовательность под Р82977 (ICIW_WHEAT), размещена в БД 09.01.2007. * |
Also Published As
| Publication number | Publication date |
|---|---|
| ES2634241T3 (es) | 2017-09-27 |
| JP5542685B2 (ja) | 2014-07-09 |
| CN101932597B (zh) | 2013-10-30 |
| EP2225266B1 (en) | 2017-04-19 |
| EP2225266A4 (en) | 2012-08-15 |
| US20100305049A1 (en) | 2010-12-02 |
| JP2011505134A (ja) | 2011-02-24 |
| AU2008330230A1 (en) | 2009-06-04 |
| CA2707190A1 (en) | 2009-06-04 |
| DK2225266T3 (en) | 2017-08-07 |
| CA2707190C (en) | 2018-01-02 |
| EP2225266A1 (en) | 2010-09-08 |
| WO2009070118A1 (en) | 2009-06-04 |
| RU2010126590A (ru) | 2012-01-10 |
| CN101932597A (zh) | 2010-12-29 |
| US9173934B2 (en) | 2015-11-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Costa et al. | Almond allergens: molecular characterization, detection, and clinical relevance | |
| Willison et al. | Pistachio vicilin, Pis v 3, is immunoglobulin E‐reactive and cross‐reacts with the homologous cashew allergen, Ana o 1 | |
| Salcedo et al. | 1 Wheat Allergens Associated With Baker's Asthma | |
| Schulmeister et al. | Cloning, expression, and mapping of allergenic determinants of αS1-casein, a major cow’s milk allergen | |
| Karamloo et al. | Pyr c 1, the major allergen from pear (Pyrus communis), is a new member of the Bet v 1 allergen family | |
| Villalba et al. | Modelling diseases: the allergens of Olea europaea pollen | |
| Constantin et al. | Molecular and immunological characterization of a wheat serine proteinase inhibitor as a novel allergen in baker's asthma | |
| US8273856B2 (en) | Purified linear epitopes from cashew nuts, nucleic acids encoding therefor and associated methods | |
| Radauer et al. | Latex-allergic patients sensitized to the major allergen hevein and hevein-like domains of class I chitinases show no increased frequency of latex-associated plant food allergy | |
| Shankar et al. | Recombinant glutathione-S-transferase a major allergen from Alternaria alternata for clinical use in allergy patients | |
| Jeong et al. | Allergenicity of recombinant profilins from Japanese hop, Humulus japonicus | |
| Aleksic et al. | Molecular and immunological characterization of Mus a 5 allergen from banana fruit | |
| RU2502742C2 (ru) | Новые аллергены пшеницы | |
| Jeong et al. | Allergenic characterization of tropomyosin from the dusky brown cockroach, Periplaneta fuliginosa | |
| Jiang et al. | Characterization of Der f 29, a new allergen from dermatophagoides farinae | |
| Jiao et al. | Purification and characterization of enolase as a novel allergen in Platanus acerifolia pollen | |
| Westritschnig et al. | A hypoallergenic vaccine obtained by tail-to-head restructuring of timothy grass pollen profilin, Phl p 12, for the treatment of cross-sensitization to profilin | |
| JP5937970B2 (ja) | 新規ヒノキ花粉アレルゲン | |
| Cases et al. | Watermelon profilin: characterization of a major allergen as a model for plant-derived food profilins | |
| Wu et al. | IgE‐binding epitopes of the American cockroach Per a 3 allergen | |
| Lin et al. | Characterization and analysis of a cDNA coding for the group 29b (Der f 29b) allergen of Dermatophagoides farinae | |
| JP2005503113A (ja) | ブタクサアレルゲン | |
| Sharma et al. | Molecular and immunological characterization of cytochrome c: a potential cross‐reactive allergen in fungi and grasses | |
| AU2013202338A1 (en) | Novel wheat allergens | |
| US7947460B2 (en) | Method for diagnosis and therapy of hazelnut-induced systemic reaction |