RU2395280C2 - Фармацевтическая лекарственная форма аторвастатина - Google Patents
Фармацевтическая лекарственная форма аторвастатина Download PDFInfo
- Publication number
- RU2395280C2 RU2395280C2 RU2008118974/15A RU2008118974A RU2395280C2 RU 2395280 C2 RU2395280 C2 RU 2395280C2 RU 2008118974/15 A RU2008118974/15 A RU 2008118974/15A RU 2008118974 A RU2008118974 A RU 2008118974A RU 2395280 C2 RU2395280 C2 RU 2395280C2
- Authority
- RU
- Russia
- Prior art keywords
- atorvastatin
- dosage form
- pharmaceutical dosage
- maximum
- particle size
- Prior art date
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/401—Proline; Derivatives thereof, e.g. captopril
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/4025—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil not condensed and containing further heterocyclic rings, e.g. cromakalim
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2009—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
- A61K9/2018—Sugars, or sugar alcohols, e.g. lactose, mannitol; Derivatives thereof, e.g. polysorbates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/2027—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2054—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2059—Starch, including chemically or physically modified derivatives; Amylose; Amylopectin; Dextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/28—Dragees; Coated pills or tablets, e.g. with film or compression coating
- A61K9/2806—Coating materials
- A61K9/2833—Organic macromolecular compounds
- A61K9/286—Polysaccharides, e.g. gums; Cyclodextrin
- A61K9/2866—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Epidemiology (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Inorganic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Diabetes (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
Abstract
Предложены фармацевтические композиции аторвастатина, содержащие эффективное количество аторвастатина для снижения уровня липопротеина низкой плотности и фармацевтически приемлемый носитель, и способы приготовления таких композиций. Композиция содержит аторвастатин со средним размером частиц максимум 50 микрон или микронизированный аторвастатин. Композиции по изобретению обеспечивают уменьшение влияния пищи на биологическую доступность аторвастатина. 9 н. и 39 з.п. ф-лы, 2 табл.
Description
Связанные патентные заявки
Для настоящей патентной заявки истребуется преимущество приоритета по предварительной патентной заявке США № 60/738828, номер в досье патентного поверенного: 1662/98401), поданной 21 ноября 2005 года и включаемой в настоящую патентную заявку по ссылке.
Область техники, к которой относится предлагаемое изобретение
Предлагаемое изобретение относится к фармацевтическим композициям, действующим началом которых является аторвастатин, и которые способны уменьшать влияние пищи на биологическую доступность аторвастатина, к способам получения таких композиций, а также к способу понижения содержания липопротеина низкой плотности при приеме фармацевтической лекарственной формы аторвастатина по предлагаемому изобретению.
Предпосылки создания предлагаемого изобретения
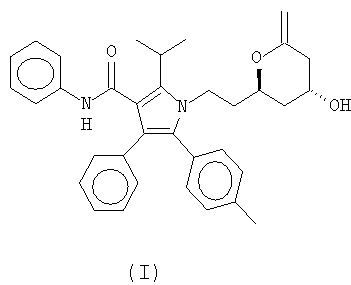
Аторвастатин имеет химическое название [R-(R*,R*]-2-(4-фенил)-бета-дигидрокси-(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-пиррол-1-гептановая кислота и ниже показан в лактоновой форме (структурная формула (I)) и в форме кальциевой соли (структурная формула (II)):
Аторвастатин относится к классу лекарственных веществ, именуемых статинами. В настоящее время статины являются, пожалуй, наиболее терапевтически эффективными лекарственными веществами для понижения концентрации частиц липопротеина низкой плотности LDL (аббревиатура от low density lipoprotein - липопротеин низкой плотности) в кровотоке пациента.
Механизм действия статиновых лекарственных веществ до некоторой степени выяснен. Предположительно, статины препятствуют синтезу холестерина и других стеринов в печени, конкурентно ингибируя фермент-редуктазу 3-гидрокси-3-метилглутарил-кофермент ("HMG-CoA-редуктаза") (HMG-CoA аббревиатура от 3-hydroxy-3-methylglutaryl-CoA). Согласно сообщениям, HMG-СоА-редуктаза является катализатором превращения 3-гидрокси-3-метил-глутарила в мевалонат, что является определяющим этапом с точки зрения скорости биологического синтеза холестерина.
Предполагается, что аторвастатин был раскрыт в патентной заявке США №4681893. Тригидрат полукальциевой соли аторвастатина выпускается на рынок компанией «Пфайзер, Инк.» (Pfizer, Inc.) под товарным знаком «Липитор» (LIPITOR®).
В целом известно, что при пероральном приеме любого конкретного фармацевтического агента на его всасывание и биологическую доступность может влиять множество различных факторов. В число этих факторов входит присутствие пищи в желудочно-кишечном тракте, потому что, в общем, в присутствии пищи время удержания в желудке лекарственного вещества обычно значительно больше, чем при приеме его натощак. Если влияние присутствия пищи в желудочно-кишечном тракте на биологическую доступность лекарственного вещества выше некоторого предела, то говорят, что это лекарственное средство подвержено влиянию пищи.
Влияние пищи имеет важное значение, поскольку, если это влияние для какого-либо лекарственного средства является неблагоприятным, то прием этого лекарственного средства пациентом, который недавно поел, становится рискованным. Этот риск заключается в том, что влияние пищи на всасывание лекарственного агента в кровоток может быть ниже, чем это необходимо при том состоянии, для лечения которого и был осуществлен прием лекарственного средства.
Согласно сообщениям, при приеме с пищей всасывание аторвастатина весьма мало по сравнению с его всасыванием при отдельном приеме. Поэтому при разработке препаратов аторвастатина одной из главных проблем является влияние пищи на биологическую доступность аторвастатина. Показано, например, что при приеме аторвастатина с пищей его биологическая доступность может быть уменьшена на целых 70%.
Поэтому существует потребность в лекарственных композициях аторвастатина и способах их получения, обеспечивающих уменьшение влияния пищи при приеме аторвастатина.
Краткое описание предлагаемого изобретения
Предлагаемым изобретением предусматриваются фармацевтические композиции аторвастатина, способные уменьшать влияние пищи при приеме аторвастатина.
В одном из вариантов осуществления предметом предлагаемого изобретения является фармацевтическая лекарственная форма, способная уменьшать влияние пищи при приеме аторвастатина, содержащая эффективное количество аторвастатина и фармацевтически приемлемый инертный наполнитель, при этом у упомянутой лекарственной формы показатель влияния пищи, определенный на основе значений максимальной плазменной концентрации лекарственного вещества (Сmах), меньше, чем приблизительно 45%, а аторвастатин содержит по меньшей мере одну из следующих форм аторвастатина: полукальциевая соль аторвастатина Формы V, аторвастатин со средним размером частиц максимум 50 микрон, тонкоизмельченный аторвастатин.
В другом варианте осуществления предметом предлагаемого изобретения является фармацевтическая лекарственная форма, способная уменьшать влияние пищи при приеме аторвастатина, содержащая эффективное количество аторвастатина и фармацевтически приемлемый инертный наполнитель, при этом у упомянутой лекарственной формы показатель влияния пищи, определенный на основе значений максимальной плазменной концентрации лекарственного вещества (Сmах), меньше, чем приблизительно 45%, а аторвастатин содержит по меньшей мере одну из следующих форм аторвастатина: полукальциевая соль аторвастатина Формы V, тонкоизмельченный аторвастатин. Предпочтительно, максимальный размер частиц упомянутого тонкоизмельченного аторвастатина составляет приблизительно 20 микрон, а более предпочтительно - 10 микрон.
В предпочтительных вариантах осуществления предлагаемого изобретения показатель влияния пищи, измеренный по значениям Сmах, меньше, чем приблизительно 30%, более предпочтительно - меньше, чем приблизительно 20%.
В одном из предпочтительных вариантов осуществления предлагаемого изобретения лекарственная форма обеспечивает значение Cmax-fed по меньшей мере приблизительно 20 нг/мл при дозе аторвастатина приблизительно 80 мг. Предпочтительно, значение Cmax-fed составляет по меньшей мере приблизительно 30 нг/мл, более предпочтительно - по меньшей мере приблизительно 40 нг/мл при дозе аторвастатина приблизительно 80 мг.
Предпочтительно, лекарственная форма по предлагаемому изобретению содержит по меньшей мере одну из следующих форм аторвастатина: полукальциевая соль аторвастатина Формы V, полукальциевая соль аторвастатина Формы VIII, средний размер частиц которого максимум приблизительно 50 микрон, тонкоизмельченная полукальциевая соль аторвастатина Формы V, тонкоизмельченная полукальциевая соль аторвастатина Формы VIII. Представляется предпочтительным также, чтобы лекарственная форма содержала по меньшей мере одну из следующих форм аторвастатина: этанолат полукальциевой соли аторвастатина (содержание этанола до 3%), изопропанолат полукальциевой соли аторвастатина (содержание изопропанола до 6%), гидрат полукальциевой соли аторвастатина.
Еще в одном из предпочтительных вариантов осуществления предлагаемого изобретения лекарственная форма содержит аторвастатин, средний размер частиц которого составляет максимум приблизительно 20 микрон, более предпочтительно - максимум приблизительно 10 микрон.
В одном из предпочтительных вариантов осуществления предлагаемого изобретения инертный наполнитель состоит по меньшей мере из одного из веществ из следующего перечня: витамин Е, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза, кросповидон, бикарбонат натрия, меглюмин, полакрилин, фосфат кальция, лактоза, коллоидный диоксид кремния, тальк, стеарат магния, кроскармеллоза, карбонат натрия, полипласдон, смешанный силикат магния и алюминия, стеарилфумарат натрия, а также включает покрытие.
Еще в одном из предпочтительных вариантов осуществления предлагаемого изобретения инертный наполнитель состоит по меньшей мере из одного из веществ из следующего перечня: маннит, кросповидон, поливинилпирролидон, витамин Е, трис-гидроксиметиламиноэтан, двухосновный фосфат кальция безводный, стеарилфумарат натрия, а также включает покрытие.
Еще в одном варианте осуществления предлагаемого изобретения инертный наполнитель состоит по меньшей мере из одного из веществ из следующего перечня: оксид кальция, оксид магния, смешанный карбонат кальция и магния, карбонаты или бикарбонаты натрия, калия или аммония, соли фосфорной или пирофосфорной кислот и аммония или щелочных металлов, соли карбоксиловых или жирных кислот и аммония или щелочных металлов, смешанный ацетат кальция и магния, соли аспарагиновой или глутаминовой кислот и аммония или щелочных металлов, карбонаты лизина или аргинина, бикарбонаты лизина, аргинина, цистина или гистидина, свободные основные формы лизина, аргинина, триптофана, гистидина, аспарагина или глутамина, соли карбоксиловой кислоты и лизина, аргинина или гистидина, солевые формы цистина, фенолов, биофенолов или флавоноидов, витамин Р, тирозин, изофлавоны, полимеры - носители функций аминов, полимеры - носители кислотных функций в своих солевых формах, поливинилацетат или фталат, пептиды или протеины с изоэлектрической точкой выше 4,5.
В предпочтительных вариантах осуществления лекарственная форма по предлагаемому изобретению это лекарственная форма для перорального приема, более предпочтительно, это таблетка.
Предлагаемым изобретением предусматривается также создание способов получения лекарственных форм по предлагаемому изобретению.
В одном из вариантов осуществления предлагаемым изобретением предусматривается способ получения фармацевтической лекарственной формы, способной уменьшать влияние пищи при приеме аторвастатина, включающий следующие стадии: приготовление смеси аторвастатина и фармацевтически приемлемого инертного наполнителя и приготовление из полученной смеси лекарственной формы, при этом у полученной лекарственной формы показатель влияния пищи, определенный на основе значений максимальной плазменной концентрации лекарственного вещества (Сmах), меньше, чем приблизительно 45%, а аторвастатин содержит по меньшей мере одну из следующих форм аторвастатина: полукальциевая соль аторвастатина Формы V, тонкоизмельченный аторвастатин.
В одном из предпочтительных вариантов осуществления предлагаемого изобретения инертный наполнитель состоит по меньшей мере из одного из веществ из следующего перечня: витамин Е, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза, кросповидон, бикарбонат натрия, меглюмин, полакрилин, фосфат кальция, лактоза, коллоидный диоксид кремния, тальк, стеарат магния, кроскармеллоза, карбонат натрия, полипласдон, смешанный силикат магния и алюминия, стеарилфумарат натрия, а также включает покрытие.
Еще в одном из предпочтительных вариантов осуществления предлагаемого изобретения инертный наполнитель состоит по меньшей мере из одного из веществ из следующего перечня: маннит, кросповидон, поливинилпирролидон, витамин Е, трис-гидроксиметиламиноэтан, двухосновный фосфат кальция безводный, стеарилфумарат натрия, а также включает покрытие.
Еще в одном предпочтительном варианте осуществления предлагаемого изобретения инертный наполнитель состоит по меньшей мере из одного из веществ из следующего перечня: оксид кальция, оксид магния, смешанный карбонат кальция и магния, карбонаты или бикарбонаты натрия, калия или аммония, соли фосфорной или пирофосфорной кислот и аммония или щелочных металлов, соли карбоксиловых или жирных кислот и аммония или щелочных металлов, смешанный ацетат кальция и магния, соли аспарагиновой или глутаминовой кислот и аммония или щелочных металлов, карбонаты лизина или аргинина, бикарбонаты лизина, аргинина, цистина или гистидина, свободные основные формы лизина, аргинина, триптофана, гистидина, аспарагина или глутамина, соли карбоксиловой кислоты и лизина, аргинина или гистидина, солевые формы цистина, фенолов, биофенолов или флавоноидов, витамин Р, тирозин, изофлавоны, полимеры - носители функций аминов, полимеры - носители кислотных функций в своих солевых формах, поливинилацетат или фталат, пептиды или протеины с изоэлектрической точкой выше 4,5.
В одном из предпочтительных вариантов осуществления предлагаемого изобретения способ получения фармацевтической лекарственной формы, способной уменьшать влияние пищи при приеме аторвастатина, включает следующие стадии: приготовление смеси аторвастатина и фармацевтически приемлемого инертного наполнителя, гранулирование полученной смеси для получения гранул и приготовление из полученных гранул лекарственной формы.
В еще одном из предпочтительных вариантов осуществления предлагаемого изобретения способ получения фармацевтической лекарственной формы, способной уменьшать влияние пищи при приеме аторвастатина, включает следующие стадии: приготовление смеси аторвастатина и по меньшей мере одного фармацевтически приемлемого инертного наполнителя, приготовление раствора, содержащего витамин Е и гидроксипропилцеллюлозу, гранулирование полученного раствора с упомянутой смесью для получения гранул, комбинирование с полученными гранулами по меньшей мере одного вещества из следующего перечня: кросповидон, коллоидный диоксид кремния, и добавление к полученной комбинации по меньшей мере одного вещества из следующего перечня: стеарат магния, тальк, - для получения лекарственной формы. Предпочтительно, перед стадией гранулирования к смеси добавляют по меньшей мере одно из веществ из следующего перечня: микрокристаллическая целлюлоза, кросповидон, бикарбонат натрия, меглюмин, полакрилин калия, двухосновный фосфат кальция безводный, моногидрат лактозы.
В более предпочтительном варианте осуществления предлагаемого изобретения способ получения фармацевтической лекарственной формы, способной уменьшать влияние пищи при приеме аторвастатина, включает следующие стадии: приготовление смеси полукальциевой соли аторвастатина, микрокристаллической целлюлозы, кросповидона, бикарбоната натрия, меглюмина, полакрилина калия, двухосновного фосфата кальция безводного и моногидрата лактозы, приготовления раствора, содержащего витамин Е и гидроксипропилцеллюлозу, гранулирование полученного раствора с упомянутой смесью для получения гранул, подмешивание к полученным гранулам кросповидона и коллоидного диоксида кремния, добавление стеарата магния и талька для получения гранулосмеси, прессование полученной гранулосмеси в таблетку и нанесение на полученную таблетку покрытия для получения лекарственной формы.
В одном из предпочтительных вариантов осуществления предлагаемого изобретения лекарственные формы по предлагаемому изобретению получают как лекарственные формы для перорального приема, предпочтительно, в форме таблетки, в более предпочтительных вариантах таблетка снабжена покрытием.
Еще одним аспектом предлагаемого изобретения является создание способа понижения содержания липопротеина низкой плотности путем приема нуждающимся в этом пациентом эффективного количества той или иной лекарственной формы по предлагаемому изобретению.
Подробное описание предлагаемого изобретения
Предлагаемым изобретением предусматривается создание фармацевтических лекарственных форм, способных уменьшать влияние пищи при приеме аторвастатина, способов получения таких лекарственных форм и способов лечения с использованием этих лекарственных форм.
В одном из вариантов осуществления предлагаемым изобретением предусматривается создание фармацевтической лекарственной формы, способной уменьшать влияние пищи при приеме аторвастатина, содержащей эффективное количество аторвастатина и фармацевтически приемлемого наполнителя, при этом у упомянутой лекарственной формы показатель влияния пищи, вычисленный как определено ниже, меньше, чем приблизительно 45%. Предпочтительно, упомянутый показатель влияния пищи меньше, чем приблизительно 30%, более предпочтительно - меньше, чем приблизительно 20%.
Под «влиянием пищи» здесь понимается превышающая некоторый предел зависимость максимальной концентрации лекарственного вещества в плазме крови пациента (Сmах) от наличия пищи в его желудочно-кишечном тракте.
Влияние пищи может быть выявлено и определено количественно, как описано, например, в статье Тутейкер и др. (Toothaker et al.) в Ann.Rev.Pharmacol.Toxicol, том 20, стр.173-199, 1980 г., или в статье Уэллинг и др. (Welling et al.) в J.Pharm.Sci., том 68(2), стр.150-155, 1979 г. Влияние пищи может быть выявлено и определено количественно, как описано в вышеупомянутых источниках, например путем определения площади под кривой AUC (аббревиатура от area under a curve - площадь под кривой), отражающей изменение сывороточной концентрации (например, в мкг/мл) аторвастатина, откладываемой по оси ординат (ось Y) в зависимости от времени, откладываемого по оси абсцисс (ось X). Обычно величина площади под кривой получена на основе ряда величин, взятых у всей группы испытуемых пациентов, и представляет собой усредненную величину по испытуемой группе. Измерив площадь под кривой для накормленных пациентов AUCfed (аббревиатура от area under the curve for a ted population of subjects - площадь под кривой для накормленной группы) и площадь под кривой для той же группы пациентов натощак AUCfast (аббревиатура от area under the curve for the same population of fasted subjects - площадь под кривой для той же группы натощак), можно определить, оказывает ли пища на данное лекарственное вещество неблагоприятное влияние. Влияние пищи может быть определено, например, следующим образом:
Показатель влияния пищи =AUCfed/AUCfast×100.
Показатель влияния пищи может быть вычислен также путем определения пикового значения плазменной концентрации (Сmах) аторвастатина для группы испытуемых пациентов. Определив пиковую плазменную концентрацию аторвастатина для группы испытуемых пациентов натощак (Сmax-fast) и сравнив ее с пиковой плазменной концентрацией аторвастатина для той же группы накормленных испытуемых пациентов (Cmax-fed), можно определить, оказывает ли пища на данное лекарственное вещество неблагоприятное влияние.
В материалах настоящей патентной заявки показатель влияния пищи определен следующим образом:
Показатель влияния пищи =(Cmax-fast-Cmax-fed)/Cmax-fast×100.
Влияние пищи считается уменьшенным, если его показатель, определенный на основе значений максимальной плазменной концентрации лекарственного вещества (Сmах), меньше, чем приблизительно 45%.
В другом варианте осуществления при применении лекарственных форм по предлагаемому изобретению обеспечивается значение Cmax-fed по меньшей мере приблизительно 20 нг/мл при дозе атовастатина приблизительно 80 мг. Предпочтительно, значение Cmax-fed составляет по меньшей мере приблизительно 30 нг/мл при дозе атовастатина приблизительно 80 мг, более предпочтительно, значение Cmax-fed составляет по меньшей мере приблизительно 40 нг/мл при дозе атовастатина приблизительно 80 мг. Среднему специалисту в данной отрасли должно быть понятно, что значения пиковой плазменной концентрации (Сmах) аторвастатина будут изменяться с изменением принятой дозы аторвастатина.
Под «группой накормленных испытуемых пациентов» в материалах настоящей патентной заявки понимается группа испытуемых пациентов, каждый из которых съел рекомендуемый Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США FDA (аббревиатура от Food and Drug Administration - Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) стандартный завтрак с высоким содержанием жиров в течение 20 минут, после чего немедленно проглотил испытуемую лекарственную форму. Стандартный завтрак с высоким содержанием жиров состоит, например, из двух яиц, жареных с одной столовой ложкой сливочного масла, двух ломтиков бекона, шести унций (≈170,1 г) картофельного блюда «хэш-браунз» (блинчики из тертого вареного картофеля, перемешанного с луком, с добавлением жира, поджаренные до подрумянивания), двух подрумяненных в тостере ломтиков хлеба с двумя чайными ложками сливочного масла и двумя кружочками конфитюра и восьми унций (≈226,8 г) цельного молока. Этот стандартный завтрак с высоким содержанием жира содержит приблизительно 964 калории, из которых 54% дают жиры (58 г) и 12% протеин, как это рассчитано по методике, изложенной в монографии "Nutritive Value of Foods" («Питательная ценность пищевых продуктов») в №72 Бюллетеня Сельскохозяйственного департамента США (U.S. Department of Agriculture Home and Garden Bulletin No.72). В течение того же двадцатиминутного периода испытуемый может принять дополнительную пищу, и при этом также будет определен как «накормленный». Под состоянием «натощак» здесь понимается такое состояние, когда испытуемый перед измерением значения AUCfast до проглатывания лекарственной формы не ел по меньшей мере в течение десяти часов, обычно в течение ночи.
В материалах настоящей патентной заявки под термином «аторвастатин» понимается собственно аторвастатин, любые его ангидраты (в оригинале "anhydrate"), гидраты, сольваты, соли и их эквиваленты, а также любые его кристаллические или аморфные формы. Предпочтительным является использование полукальциевой соли аторвастатина. Предпочтительным представляется также использование аторвастатина в формах гидрата, изопропанолата (содержание изопропанола до 6%) и этанолата (содержание этанола до 3%).
Аторвастатин, используемый в лекарственных формах по предлагаемому изобретению, включает по меньшей мере одну его форму из следующего перечня: полукальциевая соль аторвастатина Формы V, аторвастатин со средним размером частиц максимум 50 микрон. Кроме того, аторвастатин, используемый в лекарственных формах по предлагаемому изобретению, может включать также тонкоизмельченный аторвастатин.
Полукальциевая соль аторвастатина Формы V раскрыта в международной публикации WO 01/36384, которая полностью включена в настоящую патентную заявку по ссылке. Полукальциевая соль аторвастатина Формы VIII раскрыта в международной публикации WO 02/43732, которая также полностью включена в настоящую патентную заявку по ссылке.
Представляется предпочтительным, чтобы лекарственные формы по предлагаемому изобретению, содержащие полукальциевую соль аторвастатина Формы V, содержали аторвастатин в этой форме в количестве по меньшей мере приблизительно 50 мас.%. Аторвастатин может быть как в тонкоизмельченной, так и не в тонкоизмельченной форме.
Представляется предпочтительным также, чтобы лекарственные формы по предлагаемому изобретению, содержащие полукальциевую соль аторвастатина Формы VIII, содержали аторвастатин в этой форме в количестве по меньшей мере приблизительно 50 мас.%. Аторвастатин в этих лекарственных формах предпочтительно используется в тонкоизмельченной форме.
В одном из предпочтительных вариантов осуществления лекарственные формы по предлагаемому изобретению содержат аторвастатин со средним размером частиц максимум приблизительно 50 микрон при измерении по наибольшему поперечнику, предпочтительно, этот средний размер составляет максимум приблизительно 20 микрон, более предпочтительно, приблизительно 10 микрон. Под «средним размером частиц» в материалах настоящей патентной заявки понимается размер, который имеют по меньшей мере 50% частиц в образце.
Еще в одном из предпочтительных вариантов осуществления лекарственные формы по предлагаемому изобретению содержат тонкоизмельченный аторвастатин. Обычно аторвастатин в тонкоизмельченной форме обладает значительными фармацевтическими преимуществами. Термином «тонкоизмельченный аторвастатин» в материалах настоящей патентной заявки обозначен аторвастатин с таким распределением размеров частиц, при котором у по меньшей мере 90% частиц имеют размер максимум 50 микрон при измерении по наибольшему поперечнику. Предпочтительно, размер частиц тонкоизмельченного аторвастатина составляет максимум приблизительно 20 микрон, более предпочтительно, приблизительно 10 микрон.
Тонкое измельчение частиц может быть осуществлено механическим способом путем приложения к частицам силы, под действием которой происходит их размельчение. Такая сила может быть обеспечена при столкновении частиц, которым придана высокая скорость, между собой. Тонкое измельчение с целью получения тонкоизмельченных частиц может быть осуществлено, например, с помощью перемалывания, с применением воздушно-струйной микронной коллоидной мельницы, с применением шаровой мельницы или с применение штифтовой мельницы.
Размер частиц может быть определен любыми способами, общеизвестными в отрасли. Могут быть использованы, например, следующие способы: просеивание сквозь сита, седиментация, электрозонное сенсирование (с помощью счетчика Каултера), микроскопия, малоугловое лазерное светорассеяние LALLS (аббревиатура от Low-Angle Laser Light-Scattering - малоугловое лазерное светорассеяние). Предпочтительными для использования в предлагаемом изобретении являются способы измерения размеров частиц, наиболее широко используемые в фармацевтической промышленности, такие как лазерная дифракция или ситовый анализ.
Лекарственные формы по предлагаемому изобретению могут содержать любой известный в данной отрасли фармацевтически приемлемый инертный наполнитель.
В одном из предпочтительных вариантов осуществления предлагаемого изобретения инертный наполнитель состоит по меньшей мере из одного из веществ из следующего перечня: витамин Е, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза, кросповидон, бикарбонат натрия, меглюмин, полакрилин (в том числе полакрилин калия), фосфат кальция (такой как двухосновный фосфат кальция безводный), лактоза (в том числе моногидрат лактозы), коллоидный диоксид кремния, тальк, стеарат магния, кроскармеллоза, карбонат натрия, полипласдон, смешанный силикат магния и алюминия, стеарилфумарат натрия или покрытие, такое как опадри.
Еще в одном из предпочтительных вариантов осуществления предлагаемого изобретения инертный наполнитель состоит по меньшей мере из одного из веществ из следующего перечня: маннит, кросповидон, поливинил-пирролидон, витамин Е, трис-гидроксиметиламиноэтан, двухосновный фосфат кальция безводный, стеарилфумарат натрия, или покрытие, такое как опадри.
Еще в одном из предпочтительных вариантов осуществления предлагаемого изобретения инертный наполнитель состоит по меньшей мере из одного из веществ из следующего перечня: оксид кальция, оксид магния, смешанный карбонат кальция и магния, карбонаты или бикарбонаты натрия, калия или аммония, соли фосфорной или пирофосфорной кислот и аммония или щелочных металлов, соли карбоксиловых или жирных кислот и аммония или щелочных металлов, смешанный ацетат кальция и магния, соли аспарагиновой или глутаминовой кислот и аммония или щелочных металлов, карбонаты лизина или аргинина, бикарбонаты лизина, аргинина, цистина или гистидина, свободные основные формы лизина, аргинина, триптофана, гистидина, аспарагина или глутамина, соли карбоксиловой кислоты и лизина, аргинина или гистидина, солевые формы цистина, фенолов, биофенолов или флавоноидов, витамин Р, тирозин, изофлавоны, полимеры - носители функций аминов, полимеры - носители кислотных функций в своих солевых формах, поливинилацетат или фталат, пептиды или протеины с изоэлектрической точкой выше 4,5.
Объем предлагаемого изобретения включает также способы получения фармацевтических лекарственных форм по предлагаемому изобретению.
В одном из вариантов осуществления предлагаемым изобретением предусматривается способ получения фармацевтической лекарственной формы, способной уменьшать влияние пищи при приеме аторвастатина, путем приготовления смеси аторвастатина и фармацевтически приемлемого инертного наполнителя с последующим приготовлением из полученной смеси лекарственной формы, при этом у полученной лекарственной формы показатель влияния пищи, определенный на основе значений максимальной плазменной концентрации лекарственного вещества (Сmах), меньше, чем приблизительно 45%.
Аторвастатин содержит по меньшей мере одну из следующих форм аторвастатина: полукальциевая соль аторвастатина Формы V, аторвастатин со средним размером частиц максимум 50 микрон, тонкоизмельченный аторвастатин. В другом варианте осуществления способа по предлагаемому изобретению аторвастатин содержит по меньшей мере одну из следующих форм аторвастатина: полукальциевая соль аторвастатина Формы V, тонкоизмельченный аторвастатин.
В одном из вариантов осуществления предлагаемого изобретения способ получения фармацевтической лекарственной формы по предлагаемому изобретению включает стадию приготовления смеси аторвастатина и по меньшей мере одного из веществ из следующего перечня: витамин Е, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза, кросповидон, бикарбонат натрия, меглюмин, полакрилин (в том числе полакрилин калия), фосфат кальция (такой как двухосновный фосфат кальция безводный), лактоза (в том числе моногидрат лактозы), коллоидный диоксид кремния, тальк, стеарат магния, кроскармеллоза, карбонат натрия, полипласдон, смешанный силикат магния и алюминия, стеарилфумарат натрия с последующим приготовлением из полученной смеси лекарственной формы.
Еще в одном из вариантов осуществления предлагаемого изобретения способ получения фармацевтической лекарственной формы по предлагаемому изобретению включает стадию приготовления смеси аторвастатина и по меньшей мере одного из веществ из следующего перечня: маннит, кросповидон, поливинилпирролидон, витамин Е, трис-гидроксиметиламиноэтан, двухосновный фосфат кальция безводный, стеарилфумарат натрия с последующим приготовлением из полученной смеси лекарственной формы.
Среднему специалисту в данной отрасли должно быть понятно, что к смеси, содержащей аторвастатин, могут добавляться и другие инертные наполнители, отличные от тех, которые перечислялись выше в качестве примеров.
Лекарственные формы по предлагаемому изобретению могут приготовляться с помощью обычных известных в фармацевтической отрасли технологий получения композиций, когда ингредиенты подвергаются надлежащей обработке и формованию, например в таблетки, содержащие фармацевтически приемлемые инертные наполнители.
В одном из предпочтительных вариантов осуществления способ по предлагаемому изобретению включает стадию получения лекарственной формы в виде лекарственной формы для перорального применения, такой как таблетка. В более предпочтительном варианте лекарственную форму получают в виде таблетки, снабженной покрытием, таким как опадри.
В одном из вариантов осуществления способ по предлагаемому изобретению включает следующие стадии: приготовление смеси аторвастатина и фармацевтически приемлемого инертного наполнителя, гранулирование полученной смеси для получения гранул и приготовление из полученных гранул лекарственной формы.
В материалах настоящей патентной заявки под термином «гранулирование» понимается процесс приготовления гранул. Процесс гранулирования может осуществляться любыми способами, известными в данной отрасли.
В одном из вариантов осуществления способ по предлагаемому изобретению включает следующие стадии: приготовление смеси аторвастатина и по меньшей мере одного фармацевтически приемлемого инертного наполнителя, приготовление раствора, содержащего витамин Е и гидроксипропилцеллюлозу, гранулирование полученного раствора с упомянутой смесью для получения гранул, комбинирование с полученными гранулами по меньшей мере одного вещества из следующего перечня: кросповидон, коллоидный диоксид кремния, и добавление к полученной комбинации по меньшей мере одного вещества из следующего перечня: стеарат магния, тальк, - для получения лекарственной формы.
В одном из предпочтительных вариантов осуществления способа по предлагаемому изобретению перед стадией гранулирования к полученной на предыдущей стадии смеси добавляют по меньшей мере одно из веществ из следующего перечня: микрокристаллическая целлюлоза, кросповидон, бикарбонат натрия, меглюмин, полакрилин, фосфат кальция, лактоза. Предпочтительно, в смесь добавляют все вышеуказанные ингредиенты перед гранулированием, более предпочтительно, в следующем порядке: кальциевая соль аторвастатина, микрокристаллическая целлюлоза, кросповидон, бикарбонат натрия, меглюмин, полакрилин, фосфат кальция, лактоза.
В более предпочтительном варианте осуществления предлагаемого изобретения способ получения фармацевтической лекарственной формы, способной уменьшать влияние пищи при приеме аторвастатина, включает следующие стадии: приготовление смеси аторвастатина и по меньшей мере одного вещества из следующего перечня: микрокристаллическая целлюлоза, кросповидон, бикарбонат натрия, меглюмин, полакрилин калия, двухосновный фосфат кальция безводный, моногидрат лактозы, приготовление раствора, содержащего витамин Е и гидроксипропилцеллюлозу, гранулирование полученного раствора с упомянутой смесью для получения гранул, подмешивание к полученным гранулам кросповидона и коллоидного диоксида кремния, добавление стеарата магния и талька для получения гранулосмеси, прессование полученной гранулосмеси в таблетку и нанесение на полученную таблетку покрытия для получения лекарственной формы.
Еще одним аспектом осуществления предлагаемого изобретения предусматривается создание способа понижения содержания липопротеина низкой плотности путем приема нуждающимся в этом пациентом эффективного количества той или иной лекарственной формы по предлагаемому изобретению.
В материалах настоящей патентной заявки под термином «эффективное количество» понимается такое количество аторвастатина, которого при приеме пациентом для лечения какого-либо недуга или другого нежелательного состояния достаточно для получения благоприятного эффекта с точки зрения лечения этого недуга или другого нежелательного состояния. «Эффективное количество» может быть различным в зависимости от природы недуга или другого нежелательного состояния и его остроты, а также от возраста пациента, массы его тела и других факторов. Определение эффективного количества аторвастатина вполне по силам среднему специалисту в данной отрасли и не требует особого умения, помимо рутинного экспериментирования.
В одном из предпочтительных вариантов осуществления предлагаемого изобретения аторвастатин присутствует в количестве от приблизительно 5% до приблизительно 20%, в более предпочтительных вариантах - в количестве от приблизительно 5% до приблизительно 10%, в еще более предпочтительном варианте - в количестве приблизительно 8%.
Единичные дозы фармацевтической композиции по предлагаемому изобретению обычно содержат от 0,5 до 100 мг аторвастатина. Более типичное содержание аторвастатина в единичной дозе находится в пределах от 2,5 до 80 мг.
Лекарственные формы по предлагаемому изобретению могут содержать разбавители, такие как материалы - производные целлюлозы, например, порошкообразная целлюлоза, микрокристаллическая целлюлоза, тонкодисперсная целлюлоза, метилцеллюлоза, этилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, соли карбоксиметилцеллюлозы и другие замещенные и незамещенные производные целлюлозы, крахмал, желатинизированный крахмал, неорганические разбавители, такие как карбонат кальция и дифосфат кальция, а также другие разбавители, известные в фармацевтической промышленности. В число других подходящих разбавителей входят воски, сахара и шестиатомные спирты, например маннит и сорбит, акрилатные полимеры и сополимеры, а также пектин, декстрин и желатин.
В число прочих инертных наполнителей, пригодных для использования в предлагаемом изобретении, входят связующие вещества, такие как аравийская камедь, желатинизированный крахмал, альгинат натрия, глюкоза и другие связующие вещества, использующиеся в процессах влажного и сухого гранулирования и непосредственного таблетировочного прессования. Кроме того, в число инертных наполнителей могут входить дезинтегрирующие агенты, такие как натриевая соль гликолята крахмала, кросповидон, гидроксипропилцеллюлоза с низкой степенью замещения и другие. Кроме того, в число прочих инертных наполнителей, пригодных для использования в предлагаемом изобретении, могут входить таблетировочные лубриканты, такие как смешанный стеарат магния и кальция и стеарилфумарат натрия, а также ароматизаторы, подсластители, консерванты, фармацевтические агенты для парентерального (в том числе подкожного, внутримышечного и внутривенного), ингаляционного и офтальмологического введения. Хотя наиболее подходящий способ применения зависит от природы и остроты состояния, подлежащего лечению, все же наиболее предпочтительным способом применения лекарственных форм по предлагаемому изобретению представляется пероральное применение. Лекарственные формы по предлагаемому изобретению могут быть удобно представлены в виде единичных доз и приготовлены любым способом, хорошо известным в фармацевтике.
Лекарственные формы включают твердые лекарственные формы, такие как таблетки, порошки, капсулы, суппозитории, пакетики-саше, пастилки, таблетки для рассасывания, а также жидкие суспензии и эликсиры.
Капсулы могут быть выполнены из желатина или другого удобного для капсулирования материала. Таблетки и частицы порошков могут быть снабжены покрытием. Для покрытия частиц кишечно-растворимых порошков могут быть использованы такие вещества, как ацетат целлюлозы фталевой кислоты, фталат гидроксипропилметилцеллюлозы, фталат поливинилового спирта, карбоксиметилэтилцеллюлоза, сополимер стирола и малеиновой кислоты, сополимер метакриловой кислоты и метилметакрилата и т.п., а при желании эти вещества могут быть использованы вместе с подходящими смягчителями и/или разрыхлители. Таблетка, снабженная покрытием, может иметь это покрытие на своей внешней поверхности, или же это может быть таблетка, полученная прессованием снабженных покрытием гранул или частиц порошка.
После ознакомления с описанием определенных предпочтительных вариантов осуществления предлагаемого изобретения для специалиста в данной отрасли станут очевидными и другие возможные варианты его осуществления. Дальнейшее описание предлагаемого изобретения проводится на конкретных примерах, в которых детально рассматривается приготовление фармацевтических композиций по предлагаемому изобретению и способы их применения. Для специалиста в данной отрасли должно быть понятно, что без выхода за пределы предлагаемого изобретения возможны его многочисленные модификации как в отношении материалов, так и в отношении способов.
Примеры
Приготовление композиции аторвастатина в Примере 9
Раствор для гранулирования: Витамин Е (d-альфа-токоферил-полиэтиленгликоль 1000 сукцинат; TPGS) и гидроксипропилцеллюлоза были растворены в 95%-ном этаноле.
Часть I. В мешалку с большими сдвиговыми усилиями производства компании «Диосна» (Diosna) зафужались в порядке упоминания следующие вещества: моногидрат лактозы, кроскармеллоза натрия, полукальциевая соль аторвастатина, меглюмин, бикарбонат натрия, двухосновный фосфат кальция безводный, смешанный метасиликат магния и алюминия, полакрилин калия и микрокристаллическая целлюлоза. Перемешивание осуществлялось в течение 3 минут, после чего полученная смесь подвергалась сухому гранулированию в сушилке с псевдоожиженным слоем марки Glatt GPCS-15 до потери 2,2% на сушке. Полученные гранулы калибровались по размеру путем пропускания со средней скоростью через вибрирующий гранулятор марки «Фрюитт» (Frewitt), снабженный набором 0,8-миллиметровых сит, после чего загружались в сухой смеситель.
Часть II. С полученными гранулами в течение 10 минут перемешивался кросповидон.
Часть III. К полученной смеси добавлялись тальк и стеарат магния, осуществлялось перемешивание в течение 5 минут, после чего полученный перемешанный материал прессовался в таблетки массой 963 мг.
Таблетки снабжались покрытием из суспензии белого Опадри YS 1R 7003 Н в очищенной воде для получения покрытых оболочкой таблеток при следующих условиях: температура входящего воздуха 55-65°С, температура выходящего воздуха 38-44°С, норма расхода суспензии при опрыскивании 15-25 г/мин, все для партии из 2500 таблеток.
В Примерах 1-8, 10 и 11 может быть использована аналогичная технология.
Результаты биологической доступности композиций аторвастатина
В приводимой ниже таблице сведены данные по композициям и биологической доступности композиций аторвастатина, приготовленных в Примерах 1-11.
Композиции в Примерах 1-8 содержат удовлетворяющую требованиям к активным фармацевтическим ингредиентам API (аббревиатура от active pharmaceutical ingredients - активные фармацевтические ингредиенты) полукальциевую соль аторвастатина Формы VIII, не являющуюся тонкоизмельченной. Композиция в Примере 9 содержит удовлетворяющую требованиям к активным фармацевтическим ингредиентам полукальциевую соль аторвастатина Формы VIII, тонкоизмельченную с помощью воздухоструйной мельницы. Тонкоизмельченный аторвастатиновый продукт содержит 90% частиц с размером меньше 10 микрон и 50% частиц с размером меньше 6 микрон.
Композиция в Примере 10 содержит удовлетворяющую требованиям к активным фармацевтическим ингредиентам тонкоизмельченную полукальциевую соль аторвастатина Формы V. Композиция в Примере 11 содержит удовлетворяющую требованиям к активным фармацевтическим ингредиентам полукальциевую соль аторвастатина Формы V, не являющуюся тонкоизмельченной.
Как можно видеть в Таблице 1, эффект пищи при приеме аторвастатина у накормленных испытуемых уменьшается при приеме лекарственных форм по предлагаемому изобретению, полученных в Примерах 9, 10 и 11.
Испытуемые, принимавшие композиции аторвастатина натощак перед приемом не ели в течение 10 часов (ночь), доза составляла 80 мг. Средняя площадь под кривой для накормленных испытуемых добровольцев в количестве от 12 до 18, принимавших композиции аторвастатина по предлагаемому изобретению, больше, чем площадь под кривой для них же, принимавших в накормленном состоянии препарат аторвастатина, выпускаемый на рынок под товарным знаком «Липитор» (Lipitor®).
Результаты растворения композиций аторвастатина
В помещаемой ниже таблице содержатся данные по растворению в Примерах 1-11, полученные с помощью лопаточного способа (США тип II) при скорости вращения 50 оборотов в минуту, при этом в качестве среды, в которой осуществлялось растворение, использовалась вода в количестве 900 мл при температуре 37°С.
Claims (48)
1. Фармацевтическая лекарственная форма, способная уменьшать влияние пищи при приеме аторвастатина, содержащая
(а) эффективное количество аторвастатина для снижения уровня липопротеина низкой плотности и
(б) фармацевтически приемлемый наполнитель,
у которой показатель влияния пищи, определенный на основе значений максимальной плазменной концентрации аторвастатина Сmах, меньше приблизительно 45%, а аторвастатин содержит по меньшей мере одну из форм аторвастатина, выбранную из группы, состоящей из аторвастатина со средним размером частиц максимум 50 мкм, микронизированного аторвастатина.
(а) эффективное количество аторвастатина для снижения уровня липопротеина низкой плотности и
(б) фармацевтически приемлемый наполнитель,
у которой показатель влияния пищи, определенный на основе значений максимальной плазменной концентрации аторвастатина Сmах, меньше приблизительно 45%, а аторвастатин содержит по меньшей мере одну из форм аторвастатина, выбранную из группы, состоящей из аторвастатина со средним размером частиц максимум 50 мкм, микронизированного аторвастатина.
2. Фармацевтическая лекарственная форма по п.1, содержащая микронизированный аторвастатин.
3. Фармацевтическая лекарственная форма по п.1, у которой показатель влияния пищи меньше приблизительно 30%.
4. Фармацевтическая лекарственная форма по п.1, у которой показатель влияния пищи меньше приблизительно 20%.
5. Фармацевтическая лекарственная форма по п.1, обеспечивающая значение максимальной плазменной концентрации аторвастатина для группы накормленных испытуемых пациентов Cmax-fed по меньшей мере приблизительно 20 нг/мл при дозе аторвастатина приблизительно 80 мг.
6. Фармацевтическая лекарственная форма по п.1, обеспечивающая значение максимальной плазменной концентрации аторвастатина для группы накормленных испытуемых пациентов Cmax-fed по меньшей мере приблизительно 30 нг/мл при дозе аторвастатина приблизительно 80 мг.
7. Фармацевтическая лекарственная форма по п.1, обеспечивающая значение максимальной плазменной концентрации аторвастатина для группы накормленных испытуемых пациентов Cmax-fed по меньшей мере приблизительно 40 нг/мл при дозе аторвастатина приблизительно 80 мг.
8. Фармацевтическая лекарственная форма по п.1, в которой аторвастатин со средним размером частиц максимум 50 мкм и микронизированный аторвастатин являются полукальциевой солью аторвастатина в Форме V.
9. Фармацевтическая лекарственная форма по п.1, в которой аторвастатин со средним размером частиц максимум 50 мкм и микронизированный аторвастатин являются полукальциевой солью аторвастатина в Форме VIII.
10. Фармацевтическая лекарственная форма по п.1, содержащая по меньшей мере одну из следующих форм аторвастатина: этанолат полукальциевой соли аторвастатина, изопропанолат полукальциевой соли аторвастатина, гидрат полукальциевой соли аторвастатина.
11. Фармацевтическая лекарственная форма по п.1, содержащая аторвастатин со средним размером частиц максимум 50 мкм.
12. Фармацевтическая лекарственная форма по п.1, содержащая аторвастатин со средним размером частиц максимум 20 мкм.
13. Фармацевтическая лекарственная форма по п.1, содержащая аторвастатин со средним размером частиц максимум 10 мкм.
14. Фармацевтическая лекарственная форма по п.2, содержащая тонкоизмельченный аторвастатин со средним размером частиц максимум 50 мкм.
15. Фармацевтическая лекарственная форма по п.2, содержащая тонкоизмельченный аторвастатин со средним размером частиц максимум 20 мкм.
16. Фармацевтическая лекарственная форма по п.2, содержащая тонкоизмельченный аторвастатин со средним размером частиц максимум 10 мкм.
17. Фармацевтическая лекарственная форма по п.2, содержащая тонкоизмельченную полукальциевую соль аторвастатина Формы V со средним размером частиц максимум 50 мкм.
18. Фармацевтическая лекарственная форма по п.2, содержащая тонкоизмельченную полукальциевую соль аторвастатина Формы VIII со средним размером частиц максимум 50 мкм.
19. Фармацевтическая лекарственная форма по п.1, в которой инертный наполнитель является по меньшей мере одним из веществ из следующего перечня: витамин Е, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза, кросповидон, бикарбонат натрия, меглюмин, полакрилин, фосфат кальция, лактоза, коллоидный диоксид кремния, тальк, стеарат магния, кроскармеллоза, карбонат натрия, полипласдон, смешанный силикат магния и алюминия, стеарил-фумарат натрия, и включает покрытие.
20. Фармацевтическая лекарственная форма по п.1, в которой инертный наполнитель является по меньшей мере одним из веществ из следующего перечня: маннит, кросповидон, поливинилпирролидон, витамин Е, трис-гидроксиметиламиноэтан, двухосновный фосфат кальция безводный, стеарилфумарат натрия, и включает покрытие.
21. Фармацевтическая лекарственная форма по п.1, в которой инертный наполнитель является по меньшей мере одним из веществ из следующего перечня: оксид кальция, оксид магния, смешанный карбонат кальция и магния, карбонаты или бикарбонаты натрия, калия или аммония, соли фосфорной или пирофосфорной кислот и аммония или щелочных металлов, соли карбоксиловых или жирных кислот и аммония или щелочных металлов, смешанный ацетат кальция и магния, соли аспарагиновой или глутаминовой кислот и аммония или щелочных металлов, карбонаты лизина или аргинина, бикарбонаты лизина, аргинина, цистина или гистидина, свободные основные формы лизина, аргинина, триптофана, гистидина, аспарагина или глутамина, соли карбоксиловой кислоты и лизина, аргинина или гистидина, солевые формы цистина, фенолов, биофенолов или флавоноидов, витамин Р, тирозин, изофлавоны, полимеры - носители функций аминов, полимеры - носители кислотных функций в своих солевых формах, поливинилацетат или фталат, пептиды или протеины с изоэлектрической точкой выше 4,5.
22. Фармацевтическая лекарственная форма по п.1, представляющая собой лекарственную форму для перорального приема.
23. Фармацевтическая лекарственная форма по п.1, представляющая собой таблетку.
24. Способ получения фармацевтической композиции, способной уменьшать влияние пищи при приеме аторвастатина, включающий следующие стадии:
(а) приготовление смеси аторвастатина и по меньшей мере одного фармацевтически приемлемого инертного наполнителя и
(б) приготовление из полученной смеси лекарственной формы, при этом у упомянутой лекарственной формы показатель влияния пищи, определенный на основе значений максимальной плазменной концентрации аторвастатина Сmax, меньше приблизительно 45%, а аторвастатин является по меньшей мере одной из форм аторвастатина, выбранных из группы, состоящей из аторвастатина со средним размером частиц максимум 50 мкм, микронизированного аторвастатина.
(а) приготовление смеси аторвастатина и по меньшей мере одного фармацевтически приемлемого инертного наполнителя и
(б) приготовление из полученной смеси лекарственной формы, при этом у упомянутой лекарственной формы показатель влияния пищи, определенный на основе значений максимальной плазменной концентрации аторвастатина Сmax, меньше приблизительно 45%, а аторвастатин является по меньшей мере одной из форм аторвастатина, выбранных из группы, состоящей из аторвастатина со средним размером частиц максимум 50 мкм, микронизированного аторвастатина.
25. Способ по п.24, при котором аторвастатин содержит микронизированный аторвастатин.
26. Способ по п.24, при котором значение максимальной плазменной концентрации аторвастатина для группы накормленных испытуемых пациентов Сmах-fed составляет по меньшей мере приблизительно 20 нг/мл при дозе аторвастатина приблизительно 80 мг.
27. Способ по п.24, при котором значение максимальной плазменной концентрации аторвастатина для группы накормленных испытуемых пациентов Cmax-fed составляет по меньшей мере приблизительно 30 нг/мл при дозе аторвастатина приблизительно 80 мг.
28. Способ по п.24, при котором значение максимальной плазменной концентрации аторвастатина для группы накормленных испытуемых пациентов Cmax-fed составляет по меньшей мере приблизительно 40 нг/мл при дозе аторвастатина приблизительно 80 мг.
29. Способ по п.24, в котором аторвастатин со средним размером частиц максимум 50 мкм и микронизированный аторвастатин представляют собой полукальциевую соль аторвастатина Формы V.
30. Способ по п.24, в котором аторвастатин со средним размером частиц максимум 50 мкм и микронизированный аторвастатин представляют собой полукальциевую соль аторвастатина Формы VIII.
31. Способ по п.24, в котором аторвастатин содержит аторвастатин со средним размером частиц максимум 50 мкм.
32. Способ по п.24, в котором инертный наполнитель является по меньшей мере одним из веществ, выбранных из следующего перечня: витамин Е, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза, кросповидон, бикарбонат натрия, меглюмин, полакрилин, фосфат кальция, лактоза, коллоидный диоксид кремния, тальк, стеарат магния, кроскармеллоза, карбонат натрия, полипласдон, смешанный силикат магния и алюминия, стеарилфумарат натрия, и включает покрытие.
33. Способ по п.24, в котором инертный наполнитель является по меньшей мере одним из веществ, выбранных из следующего перечня: маннит, кросповидон, поливинилпирролидон, витамин Е, трис-гидроксиметиламиноэтан, двухосновный фосфат кальция безводный, стеарилфумарат натрия, и включает покрытие.
34. Способ по п.24, в котором инертный наполнитель является по меньшей мере одним из веществ, выбранных из следующего перечня: оксид кальция, оксид магния, смешанный карбонат кальция и магния, карбонаты или бикарбонаты натрия, калия или аммония, соли фосфорной или пирофосфорной кислот и аммония или щелочных металлов, соли карбоксиловых или жирных кислот и аммония или щелочных металлов, смешанный ацетат кальция и магния, соли аспарагиновой или глутаминовой кислот и аммония или щелочных металлов, карбонаты лизина или аргинина, бикарбонаты лизина, аргинина, цистина или гистидина, свободные основные формы лизина, аргинина, триптофана, гистидина, аспарагина или глутамина, соли карбоксиловой кислоты и лизина, аргинина или гистидина, солевые формы цистина, фенолов, биофенолов или флавоноидов, витамин Р, тирозин, изофлавоны, полимеры - носители функций аминов, полимеры - носители кислотных функций в своих солевых формах, поливинилацетат или фталат, пептиды или протеины с изоэлектрической точкой выше 4,5.
35. Способ по п.24, включающий следующие стадии:
(а) приготовление смеси аторвастатина и фармацевтически приемлемого инертного наполнителя,
(б) гранулирование полученной смеси для получения гранул,
(в) изготовление из полученных гранул лекарственной формы.
(а) приготовление смеси аторвастатина и фармацевтически приемлемого инертного наполнителя,
(б) гранулирование полученной смеси для получения гранул,
(в) изготовление из полученных гранул лекарственной формы.
36. Способ по п.24, включающий следующие стадии:
(а) приготовление смеси аторвастатина и фармацевтически приемлемого инертного наполнителя,
(б) приготовление раствора, содержащего витамин Е и гидроксипропилцеллюлозу,
(в) гранулирование полученной смеси с полученным раствором для получения гранул,
(г) смешивание с полученными гранулами по меньшей мере одного из следующих веществ: кросповидон, коллоидный диоксид кремния,
(д) добавление по меньшей мере одного из следующих веществ: стеарат магния, тальк, - для получения лекарственной формы.
(а) приготовление смеси аторвастатина и фармацевтически приемлемого инертного наполнителя,
(б) приготовление раствора, содержащего витамин Е и гидроксипропилцеллюлозу,
(в) гранулирование полученной смеси с полученным раствором для получения гранул,
(г) смешивание с полученными гранулами по меньшей мере одного из следующих веществ: кросповидон, коллоидный диоксид кремния,
(д) добавление по меньшей мере одного из следующих веществ: стеарат магния, тальк, - для получения лекарственной формы.
37. Способ по п.36, дополнительно содержащий стадию добавления к смеси, полученной на стадии (а), по меньшей мере одного вещества из следующего перечня: микрокристаллическая целлюлоза, кросповидон, бикарбонат натрия, меглюмин, полакрилин калия, двухосновный фосфат кальция безводный, моногидрат лактозы.
38. Способ по п.24, при котором из полученной смеси приготовляют лекарственную форму для перорального приема.
39. Способ по п.24, при котором полученную смесь прессуют в таблетку.
40. Способ по п.35, дополнительно включающий стадию нанесения покрытия на полученную таблетку.
41. Способ по п.24, включающий следующие стадии:
(а) приготовление смеси из следующих веществ: полукальциевая соль аторвастатина, микрокристаллическая целлюлоза, кросповидон, бикарбонат натрия, меглюмин, полакрилин калия, двухосновный фосфат кальция безводный, моногидрат лактозы,
(б) приготовление раствора, содержащего витамин Е и гидроксипропилцеллюлозу,
(в) гранулирование полученной смеси с полученным раствором для получения гранул,
(г) смешивание с полученными гранулами кросповидона и коллоидного диоксида кремния,
(д) добавление стеарата магния и талька,
(е) прессование полученной смеси в таблетку,
(ж) нанесение на указанную таблетку покрытия для получения
лекарственной формы.
(а) приготовление смеси из следующих веществ: полукальциевая соль аторвастатина, микрокристаллическая целлюлоза, кросповидон, бикарбонат натрия, меглюмин, полакрилин калия, двухосновный фосфат кальция безводный, моногидрат лактозы,
(б) приготовление раствора, содержащего витамин Е и гидроксипропилцеллюлозу,
(в) гранулирование полученной смеси с полученным раствором для получения гранул,
(г) смешивание с полученными гранулами кросповидона и коллоидного диоксида кремния,
(д) добавление стеарата магния и талька,
(е) прессование полученной смеси в таблетку,
(ж) нанесение на указанную таблетку покрытия для получения
лекарственной формы.
42. Лекарственная форма, приготовленная способом по п.24.
43. Лекарственная форма, приготовленная способом по п.25.
44. Способ снижения содержания липопротеина низкой плотности, включающий прием пациентом, нуждающимся в таком лечении, лекарственной формы, приготовленной способом по п.24.
45. Способ снижения содержания липопротеина низкой плотности, включающий прием пациентом, нуждающимся в таком лечении, лекарственной формы, приготовленной способом по п.25.
46. Способ уменьшения влияния пищи при приеме лекарственной формы аторвастатина, включающий пероральный прием пациентом, нуждающимся в уменьшении влияния пищи при пероральном приеме аторвастатина, фармацевтической лекарственной формы аторвастатина, выбранной из следующего перечня: полукальциевая соль аторвастатина Формы V, аторвастатин со средним размером частиц максимум 50 микрон, микронизированный аторвастатин.
47. Применение аторвастатина, выбранного из группы, состоящей из полукальциевой соли аторвастатина Формы V, аторвастатина со средним размером частиц максимум 50 мкм и микронизированного аторвастатина, для получения медикамента для снижения уровня липопротеина низкой плотности и уменьшения влияния пищи при пероральном приеме аторвастатина.
48. Применение аторвастатина, выбранного из группы, состоящей из полукальциевой соли аторвастатина Формы V, аторвастатина со средним размером частиц максимум 50 мкм и микронизированного аторвастатина, с целью уменьшения влияния пищи при пероральном приеме аторвастатина.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US73882805P | 2005-11-21 | 2005-11-21 | |
| US60/738828 | 2005-11-21 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2008118974A RU2008118974A (ru) | 2009-12-27 |
| RU2395280C2 true RU2395280C2 (ru) | 2010-07-27 |
Family
ID=36753965
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2008118974/15A RU2395280C2 (ru) | 2005-11-21 | 2005-11-23 | Фармацевтическая лекарственная форма аторвастатина |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US20070116758A1 (ru) |
| JP (1) | JP2009516681A (ru) |
| KR (1) | KR20080079646A (ru) |
| BR (1) | BRPI0520669A2 (ru) |
| CA (1) | CA2628666A1 (ru) |
| IL (1) | IL191287A0 (ru) |
| RU (1) | RU2395280C2 (ru) |
| WO (1) | WO2007058664A1 (ru) |
Families Citing this family (39)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2220208A4 (en) * | 2007-11-23 | 2010-12-29 | Rappaport Family Inst For Res | USE OF HAPTOGLOBIN ENTYPIZATION FOR THE DIAGNOSIS AND TREATMENT OF CARDIOVASCULAR DISEASES |
| ES2632967T3 (es) | 2008-09-02 | 2017-09-18 | Amarin Pharmaceuticals Ireland Limited | Composición farmacéutica que comprende ácido eicosapentaenoico y ácido nicotínico y métodos de uso de la misma |
| BRPI1014405A2 (pt) | 2009-04-29 | 2016-04-05 | Amarin Corp Plc | composições farmacêuticas compreendendo epa e um agente cardiovascular e métodos de seu uso |
| RU2538691C2 (ru) | 2009-04-29 | 2015-01-10 | Амарин Фарма, Инк. | Стабильные фармацевтические композиции и способы их применения |
| DK3318255T3 (da) | 2009-06-15 | 2021-06-07 | Amarin Pharmaceuticals Ie Ltd | Sammensætninger og fremgangsmåder til behandling af slagtilfælde hos en patient på samtidig statin-terapi |
| WO2011038122A1 (en) | 2009-09-23 | 2011-03-31 | Amarin Corporation Plc | Pharmaceutical composition comprising omega-3 fatty acid and hydroxy-derivative of a statin and methods of using same |
| HUP1000299A2 (hu) | 2010-06-08 | 2012-02-28 | Nanoform Cardiovascular Therapeutics Ltd | Nanostrukturált Atorvastatint, gyógyszerészetileg elfogadott sóit és kokristályait tartalmazó készítmény és eljárás elõállításukra |
| KR20120011249A (ko) | 2010-07-28 | 2012-02-07 | 주식회사 경보제약 | 아토바스타틴 헤미칼슘염의 신규한 결정형, 이의 수화물, 및 그의 제조방법 |
| US9044394B2 (en) * | 2010-10-18 | 2015-06-02 | PruGen IP Holdings, Inc. | Bioavailability enhancement delivery composition |
| US20120095098A1 (en) * | 2010-10-18 | 2012-04-19 | Bhiku Patel | Bioavailability Enhancement Delivery System |
| US11712429B2 (en) | 2010-11-29 | 2023-08-01 | Amarin Pharmaceuticals Ireland Limited | Low eructation composition and methods for treating and/or preventing cardiovascular disease in a subject with fish allergy/hypersensitivity |
| WO2012074930A2 (en) | 2010-11-29 | 2012-06-07 | Amarin Pharma, Inc. | Low eructation composition and methods for treating and/or preventing cardiovascular disease in a subject with fish allergy/hypersensitivity |
| CN103702982A (zh) * | 2011-07-01 | 2014-04-02 | 中化帝斯曼制药有限公司荷兰公司 | 阿托伐他汀半钙的超细晶体 |
| US11291643B2 (en) | 2011-11-07 | 2022-04-05 | Amarin Pharmaceuticals Ireland Limited | Methods of treating hypertriglyceridemia |
| WO2013070735A1 (en) | 2011-11-07 | 2013-05-16 | Amarin Pharmaceuticals Ireland Limited | Methods of treating hypertriglyceridemia |
| JP5065519B1 (ja) * | 2011-11-16 | 2012-11-07 | 小林化工株式会社 | 結晶性アトルバスタチンカルシウム含有錠剤の製造方法 |
| JP6307442B2 (ja) | 2012-01-06 | 2018-04-04 | アマリン ファーマシューティカルス アイルランド リミテッド | 対象の高感度(hs−crp)のレベルを低下させる組成物および方法 |
| CN104582698A (zh) | 2012-06-29 | 2015-04-29 | 阿玛林制药爱尔兰有限公司 | 在接受抑制素治疗的受试者中降低心血管事件风险的方法 |
| US20150265566A1 (en) | 2012-11-06 | 2015-09-24 | Amarin Pharmaceuticals Ireland Limited | Compositions and Methods for Lowering Triglycerides without Raising LDL-C Levels in a Subject on Concomitant Statin Therapy |
| US9814733B2 (en) | 2012-12-31 | 2017-11-14 | A,arin Pharmaceuticals Ireland Limited | Compositions comprising EPA and obeticholic acid and methods of use thereof |
| US20140187633A1 (en) | 2012-12-31 | 2014-07-03 | Amarin Pharmaceuticals Ireland Limited | Methods of treating or preventing nonalcoholic steatohepatitis and/or primary biliary cirrhosis |
| US9452151B2 (en) | 2013-02-06 | 2016-09-27 | Amarin Pharmaceuticals Ireland Limited | Methods of reducing apolipoprotein C-III |
| US9624492B2 (en) | 2013-02-13 | 2017-04-18 | Amarin Pharmaceuticals Ireland Limited | Compositions comprising eicosapentaenoic acid and mipomersen and methods of use thereof |
| US9662307B2 (en) | 2013-02-19 | 2017-05-30 | The Regents Of The University Of Colorado | Compositions comprising eicosapentaenoic acid and a hydroxyl compound and methods of use thereof |
| WO2014134466A1 (en) * | 2013-03-01 | 2014-09-04 | Amarin Pharmaceuticals Ireland Limited. | Co-administration of atorvastatin and ethyl eicosapentaenoic acid or a derivative thereof |
| US9283201B2 (en) | 2013-03-14 | 2016-03-15 | Amarin Pharmaceuticals Ireland Limited | Compositions and methods for treating or preventing obesity in a subject in need thereof |
| US20140271841A1 (en) | 2013-03-15 | 2014-09-18 | Amarin Pharmaceuticals Ireland Limited | Pharmaceutical composition comprising eicosapentaenoic acid and derivatives thereof and a statin |
| US10966968B2 (en) | 2013-06-06 | 2021-04-06 | Amarin Pharmaceuticals Ireland Limited | Co-administration of rosiglitazone and eicosapentaenoic acid or a derivative thereof |
| US20150065572A1 (en) | 2013-09-04 | 2015-03-05 | Amarin Pharmaceuticals Ireland Limited | Methods of treating or preventing prostate cancer |
| US9585859B2 (en) | 2013-10-10 | 2017-03-07 | Amarin Pharmaceuticals Ireland Limited | Compositions and methods for lowering triglycerides without raising LDL-C levels in a subject on concomitant statin therapy |
| US10561631B2 (en) | 2014-06-11 | 2020-02-18 | Amarin Pharmaceuticals Ireland Limited | Methods of reducing RLP-C |
| WO2015195662A1 (en) | 2014-06-16 | 2015-12-23 | Amarin Pharmaceuticals Ireland Limited | Methods of reducing or preventing oxidation of small dense ldl or membrane polyunsaturated fatty acids |
| US10406130B2 (en) | 2016-03-15 | 2019-09-10 | Amarin Pharmaceuticals Ireland Limited | Methods of reducing or preventing oxidation of small dense LDL or membrane polyunsaturated fatty acids |
| EP3468606A1 (en) | 2016-06-08 | 2019-04-17 | FTF Pharma Private Limited | A novel pharmaceutical composition of a lipid lowering compound |
| TW201900160A (zh) | 2017-05-19 | 2019-01-01 | 愛爾蘭商艾瑪琳製藥愛爾蘭有限公司 | 用於降低腎功能下降之個體中的三酸甘油酯之組合物及方法 |
| US11058661B2 (en) | 2018-03-02 | 2021-07-13 | Amarin Pharmaceuticals Ireland Limited | Compositions and methods for lowering triglycerides in a subject on concomitant statin therapy and having hsCRP levels of at least about 2 mg/L |
| KR20210110890A (ko) | 2018-09-24 | 2021-09-09 | 애머린 파마슈티칼스 아일랜드 리미티드 | 대상체에서 심혈관 사건의 위험도를 감소시키는 방법 |
| WO2022129003A1 (en) * | 2020-12-15 | 2022-06-23 | Dsm Ip Assets B.V. | Multiparticulate solid oral dosage form comprising statin and vitamin e |
| EP4326244A4 (en) | 2021-04-21 | 2025-03-19 | Amarin Pharmaceuticals Ie Ltd | METHODS FOR REDUCING THE RISK OF HEART FAILURE |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4681893A (en) * | 1986-05-30 | 1987-07-21 | Warner-Lambert Company | Trans-6-[2-(3- or 4-carboxamido-substituted pyrrol-1-yl)alkyl]-4-hydroxypyran-2-one inhibitors of cholesterol synthesis |
| US6248363B1 (en) * | 1999-11-23 | 2001-06-19 | Lipocine, Inc. | Solid carriers for improved delivery of active ingredients in pharmaceutical compositions |
| US7411075B1 (en) * | 2000-11-16 | 2008-08-12 | Teva Pharmaceutical Industries Ltd. | Polymorphic form of atorvastatin calcium |
| EP1274401B2 (en) * | 2000-04-10 | 2014-08-13 | Teva Pharmaceutical Industries Ltd. | Stable pharmaceutical compositions containing 7-substituted-3,5-dihydroxyheptanoic acids or 7-substituted-3,5-dihydroxyheptenoic acids |
| US6806290B2 (en) * | 2000-06-09 | 2004-10-19 | Lek Pharmaceuticals D.D. | Stabilized pharmaceutically effective composition and pharmaceutical formulation comprising the same |
| AU6294501A (en) * | 2000-09-20 | 2002-04-02 | Rtp Pharma Inc | Spray drying process and compositions of fenofibrate |
| IL155734A0 (en) * | 2000-11-03 | 2003-11-23 | Teve Pharmaceutical Ind Ltd | Atorvastatin hemi-calcium form vii |
| SI20848A (sl) * | 2001-03-14 | 2002-10-31 | Lek, Tovarna Farmacevtskih In Kemijskih Izdelkov, D.D. | Farmacevtska formulacija, ki vsebuje atorvastatin kalcij |
| EP1423364B1 (en) * | 2001-06-29 | 2015-11-04 | Warner-Lambert Company LLC | Crystalline forms of [r-(r*,r*)]-2-(4-fluorophenyl)-beta, delta-dihydroxy-5-(1-methylethyl)-3-phenyl-4-phenylamino)carbonyl]-1h-pyrrole-1-heptanoic acid calcium salt (2:1) (atorvastatin) |
| US20030104052A1 (en) * | 2001-10-25 | 2003-06-05 | Bret Berner | Gastric retentive oral dosage form with restricted drug release in the lower gastrointestinal tract |
| US7790197B2 (en) * | 2003-06-09 | 2010-09-07 | Warner-Lambert Company Llc | Pharmaceutical compositions of atorvastatin |
| US8987322B2 (en) * | 2003-11-04 | 2015-03-24 | Circ Pharma Research And Development Limited | Pharmaceutical formulations for carrier-mediated transport statins and uses thereof |
-
2005
- 2005-11-23 BR BRPI0520669-3A patent/BRPI0520669A2/pt not_active IP Right Cessation
- 2005-11-23 RU RU2008118974/15A patent/RU2395280C2/ru not_active IP Right Cessation
- 2005-11-23 JP JP2008541141A patent/JP2009516681A/ja active Pending
- 2005-11-23 US US11/285,961 patent/US20070116758A1/en not_active Abandoned
- 2005-11-23 KR KR1020087013341A patent/KR20080079646A/ko not_active Application Discontinuation
- 2005-11-23 WO PCT/US2005/042789 patent/WO2007058664A1/en active Application Filing
- 2005-11-23 CA CA002628666A patent/CA2628666A1/en not_active Abandoned
-
2008
- 2008-05-06 IL IL191287A patent/IL191287A0/en unknown
-
2009
- 2009-08-19 US US12/544,120 patent/US20090311322A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| CA2628666A1 (en) | 2007-05-24 |
| BRPI0520669A2 (pt) | 2009-06-02 |
| WO2007058664A1 (en) | 2007-05-24 |
| IL191287A0 (en) | 2008-12-29 |
| US20070116758A1 (en) | 2007-05-24 |
| RU2008118974A (ru) | 2009-12-27 |
| JP2009516681A (ja) | 2009-04-23 |
| US20090311322A1 (en) | 2009-12-17 |
| KR20080079646A (ko) | 2008-09-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2395280C2 (ru) | Фармацевтическая лекарственная форма аторвастатина | |
| JP7627302B2 (ja) | パルボシクリブの固形剤形 | |
| RU2343905C2 (ru) | Твердые дозированные формы, включающие фибрат и статин | |
| KR100415897B1 (ko) | 생체 이용율이 높은 페노피브레이트 제약학적 조성물 | |
| EP1242091B1 (en) | Use of pharmaceutical compositions comprising oxcarbazepine in the fasted state | |
| CA2606510C (en) | Pharmaceutical preparation for oral administration comprising an imide compound | |
| RU2311903C2 (ru) | Таблетки тамзулосина | |
| US8529952B2 (en) | Pharmaceutical composition containing fenofibrate and method for the preparation thereof | |
| JP2002003492A (ja) | ジプラシドン組成物 | |
| AU2010210123B2 (en) | Process for the preparation of a pharmaceutical composition comprising ezetimibe | |
| EA000276B1 (ru) | Таблетки валацикловира, содержащие коллоидный диоксид кремния | |
| WO2004032901A1 (en) | Pharmaceutical excipients comprising inorganic particles in association with an organic polymeric material and forming a solid reticulated matrix, compositions, manufacturing and use thereof | |
| JPWO2008149894A1 (ja) | セルロース系微小核粒子及びその製造方法 | |
| JP2006527256A (ja) | 造粒することなく製造されたアトルバスタチン含有医薬組成物 | |
| US20050096391A1 (en) | Compositions comprising fenofibrate and rosuvastatin | |
| US20040142033A1 (en) | Pharmaceutical composition, containing oxcarbazepine with sustained release of an active-ingredient | |
| US20100196464A1 (en) | Orlistat pharmaceutical formulations | |
| RU2325903C2 (ru) | Фармацевтические композиции аторвастатина | |
| US20050096390A1 (en) | Compositions comprising fenofibrate and pravastatin | |
| US20100034885A1 (en) | Formulations containing glimepiride and/or its salts | |
| TWI356711B (en) | Saquinavir mesylate oral dosage form | |
| EP1923057A1 (en) | Atorvastatin pharmaceutical formulation | |
| EP1808162A1 (en) | Atorvastatin pharmaceutical formulation | |
| CN117695285A (zh) | 一种jak激酶抑制剂药物组合物 | |
| Nandhini et al. | Formulation development and evaluation of methylprednisolone dispersible tablets |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20101124 |