KR101030007B1 - 헤테로방향환 함유 화합물, 이의 제조 방법 및 이를 이용한유기 발광 소자 - Google Patents
헤테로방향환 함유 화합물, 이의 제조 방법 및 이를 이용한유기 발광 소자 Download PDFInfo
- Publication number
- KR101030007B1 KR101030007B1 KR1020070059101A KR20070059101A KR101030007B1 KR 101030007 B1 KR101030007 B1 KR 101030007B1 KR 1020070059101 A KR1020070059101 A KR 1020070059101A KR 20070059101 A KR20070059101 A KR 20070059101A KR 101030007 B1 KR101030007 B1 KR 101030007B1
- Authority
- KR
- South Korea
- Prior art keywords
- substituted
- unsubstituted
- group
- layer
- light emitting
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/622—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing four rings, e.g. pyrene
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/14—Carrier transporting layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6572—Polycyclic condensed heteroaromatic hydrocarbons comprising only nitrogen in the heteroaromatic polycondensed ring system, e.g. phenanthroline or carbazole
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2102/00—Constructional details relating to the organic devices covered by this subclass
- H10K2102/10—Transparent electrodes, e.g. using graphene
- H10K2102/101—Transparent electrodes, e.g. using graphene comprising transparent conductive oxides [TCO]
- H10K2102/103—Transparent electrodes, e.g. using graphene comprising transparent conductive oxides [TCO] comprising indium oxides, e.g. ITO
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Physics & Mathematics (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Optics & Photonics (AREA)
- Electroluminescent Light Sources (AREA)
Abstract
Description
따라서, 구체적으로 서술되지 않은 비치환된 C7-C20 아릴알콕시기, 비치환된 C6-C20 아릴아미노기, 비치환된 C6-C20 헤테로아릴아미노기, 또는 비치환된 C2-C20 헤테로 고리기, 비치환된 C2-C20 알킬알콕시기, 비치환된 C7-C20 아릴알콕시기, 비치환된 C6-C20 아릴아미노기, 비치환된 C1-C20 알킬아미노기, 비치환된 C6-C20 헤테로아릴아미노기, 또는 비치환된 C2-C20 헤테로 고리기 등은 상술한 페닐기의 경우와 마찬가지의 치환기로 치환가능하다.
| 전자 수송층 재료(200Å) | 구동전압(100mA/cm2에서) | 수명(100mA/cm2에서 휘도 반감기) | |
| 실시예 1 | 화합물 1 | 6.0 V | 200 시간 |
| 실시예 2 | 화합물 3 | 8.4 V | 210 시간 |
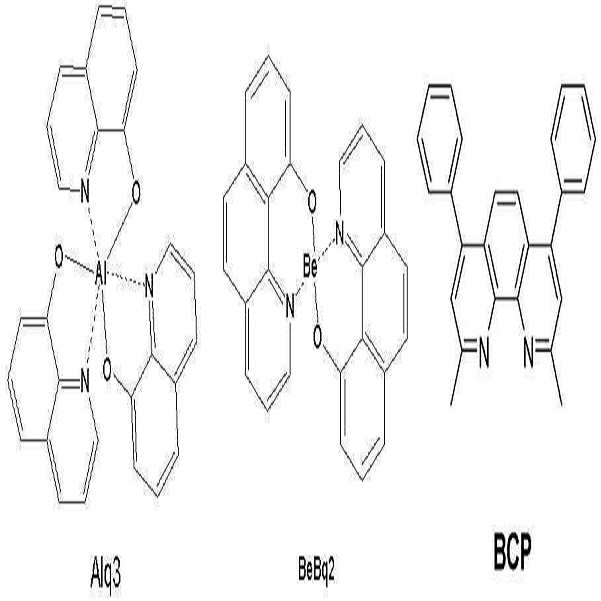
| 비교예 | Alq3 | 9.5 V | 440 시간 |
Claims (24)
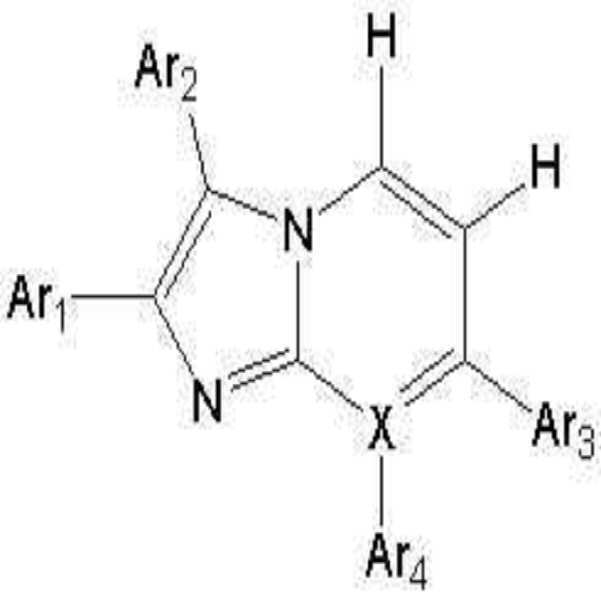
- 하기 화학식 1로 표시되는 유기 발광 소자용 헤테로방향환 화합물:[화학식 1]상기 식 중,X는 N을 나타내고;Ar1은 치환 또는 비치환된 페닐기, 치환 또는 비치환된 C6-C20 아릴기, 치환 또는 비치환된 C7-C20 아릴알킬기, 치환 또는 비치환된 C7-C20 아릴알콕시기, 치환 또는 비치환된 C6-C20 아릴아미노기, 치환 또는 비치환된 C6-C20 헤테로아릴아미노기, 치환 또는 비치환된 C2-C20 헤테로 고리기를 나타내고;Ar2 및 Ar3은 각각 독립적으로, 수소 원자, 시아노기, 하이드록시기, 니트로기, 할로겐 원자, 치환 또는 비치환된 페닐기, 치환 또는 비치환된 C1-C20 알킬기, 치환 또는 비치환된 C1-C20 알콕시기, 치환 또는 비치환된 C6-C20 아릴기, 치환 또는 비치환된 C7-C20 아릴알킬기, 치환 또는 비치환된 C2-C20 알킬알콕시기, 치환 또는 비치환된 C7-C20 아릴알콕시기, 치환 또는 비치환된 C6-C20 아릴아미노기, 치환 또는 비치환된 C1-C20 알킬아미노기, 치환 또는 비치환된 C6-C20 헤테로아릴아미노기, 또는 치환 또는 비치환된 C2-C20 헤테로 고리기를 나타내고;Ar4는 비공유전자쌍을 나타낸다.
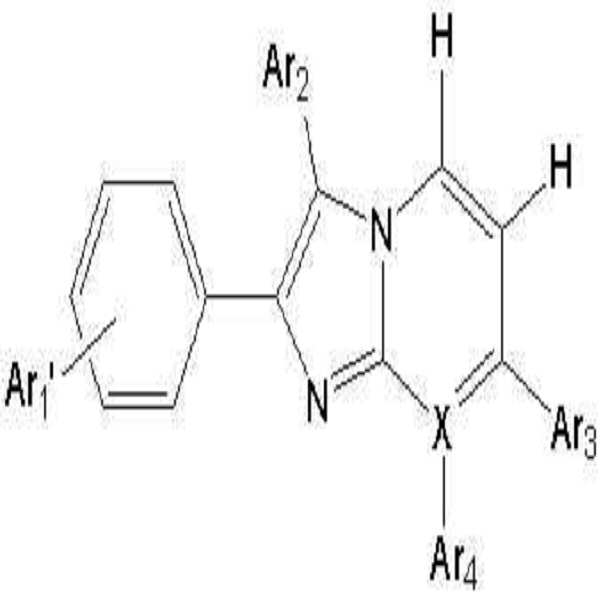
- 하기 화학식 2로 표시되는 것을 특징으로 하는 유기 발광 소자용 헤테로방향환 화합물:[화학식 2]상기 식 중,X는 C를 나타내고;Ar1'은 하기 화합물 중 어느 하나를 나타내고:Ar2, Ar3 및 Ar4는 각각 독립적으로, 수소 원자, 시아노기, 하이드록시기, 니트로기, 할로겐 원자, 치환 또는 비치환된 페닐기, 치환 또는 비치환된 C1-C20 알킬기, 치환 또는 비치환된 C1-C20 알콕시기, 치환 또는 비치환된 C6-C20 아릴기, 치환 또는 비치환된 C7-C20 아릴알킬기, 치환 또는 비치환된 C2-C20 알킬알콕시기, 치환 또는 비치환된 C7-C20 아릴알콕시기, 치환 또는 비치환된 C6-C20 아릴아미노기, 치환 또는 비치환된 C1-C20 알킬아미노기, 치환 또는 비치환된 C6-C20 헤테로아릴아미노기, 또는 치환 또는 비치환된 C2-C20 헤테로 고리기를 나타낸다 (단, Ar3 및 Ar4는 서로 결합하여 포화 또는 불포화 탄소고리를 형성할 수 있다).
- 제1항에 있어서, 상기 화합물이 하기 화학식 2로 표시되는 것을 특징으로 하는 유기 발광 소자용 헤테로방향환 화합물:[화학식 2]상기 식 중,X는 N을 나타내고;Ar1'는 치환 또는 비치환된 페닐기, 치환 또는 비치환된 C6-C20 아릴기, 치환 또는 비치환된 C7-C20 아릴알킬기, 치환 또는 비치환된 C7-C20 아릴알콕시기, 치환 또는 비치환된 C6-C20 아릴아미노기, 치환 또는 비치환된 C6-C20 헤테로아릴아미노기, 또는 치환 또는 비치환된 C2-C20 헤테로 고리기를 나타내고;Ar2 및 Ar3은 각각 독립적으로, 수소 원자, 시아노기, 하이드록시기, 니트로기, 할로겐 원자, 치환 또는 비치환된 페닐기, 치환 또는 비치환된 C1-C20 알킬기, 치환 또는 비치환된 C1-C20 알콕시기, 치환 또는 비치환된 C6-C20 아릴기, 치환 또는 비치환된 C7-C20 아릴알킬기, 치환 또는 비치환된 C2-C20 알킬알콕시기, 치환 또는 비치환된 C7-C20 아릴알콕시기, 치환 또는 비치환된 C6-C20 아릴아미노기, 치환 또는 비치환된 C1-C20 알킬아미노기, 치환 또는 비치환된 C6-C20 헤테로아릴아미노기, 또는 치환 또는 비치환된 C2-C20 헤테로 고리기를 나타내고;Ar4는 비공유전자쌍을 나타낸다.
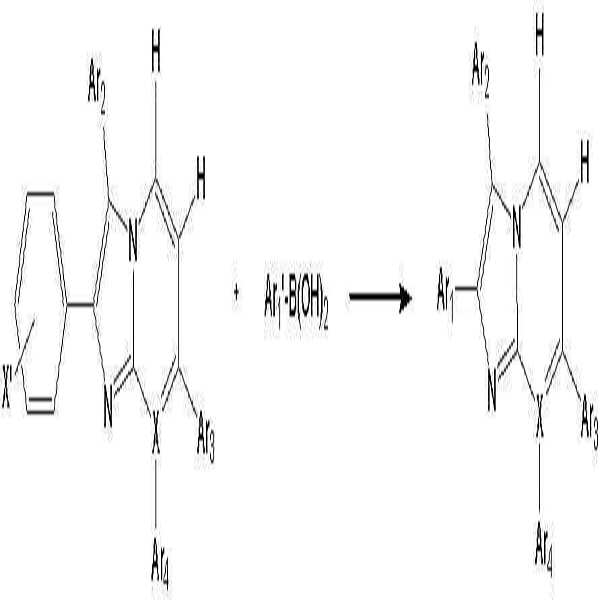
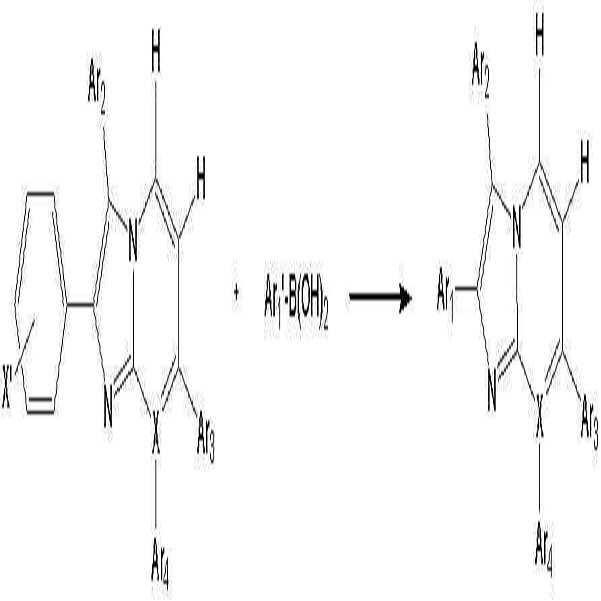
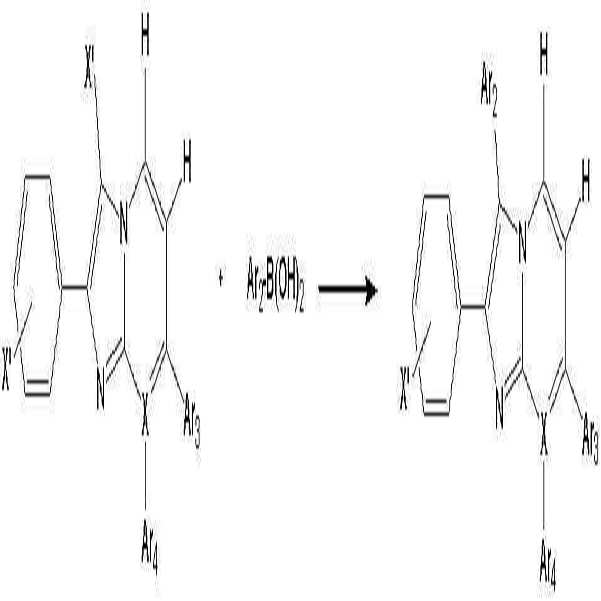
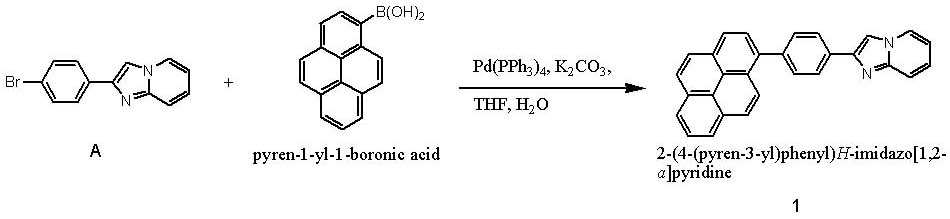
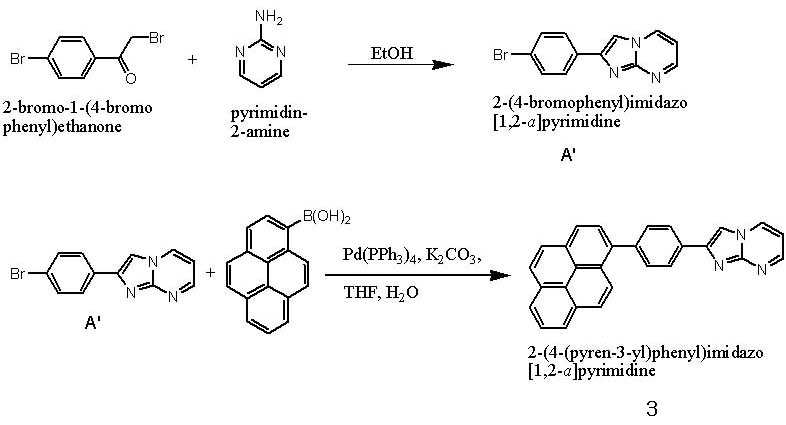
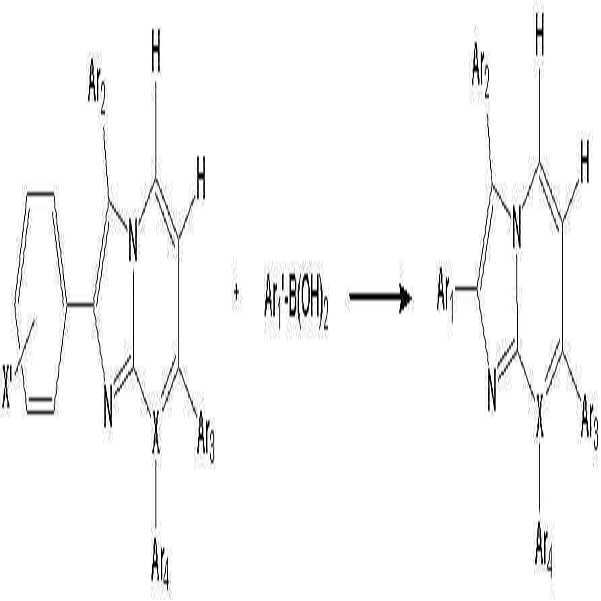
- 이미다졸 유도체 (B')와 보론산 유도체 (C')를 반응시키는 것을 특징으로 하는 하기 화학식 1로 표시되는 유기 발광 소자용 헤테로방향환 화합물의 제조 방법:(B') (C') [화학식 1]상기 반응식 중,X는 N 또는 C를 나타내고;X'는 할로겐 원소를 나타내며;Ar1' 및 Ar1은 각각 독립적으로 치환 또는 비치환된 페닐기, 치환 또는 비치환된 C6-C20 아릴기, 치환 또는 비치환된 C7-C20 아릴알킬기, 치환 또는 비치환된 C7-C20 아릴알콕시기, 치환 또는 비치환된 C6-C20 아릴아미노기, 치환 또는 비치환된 C6-C20 헤테로아릴아미노기, 또는 치환 또는 비치환된 C2-C20 헤테로 고리기를 나타내고;Ar2, Ar3 및 Ar4는 각각 독립적으로, 수소 원자, 시아노기, 하이드록시기, 니트로기, 할로겐 원자, 치환 또는 비치환된 페닐기, 치환 또는 비치환된 C1-C20 알킬기, 치환 또는 비치환된 C1-C20 알콕시기, 치환 또는 비치환된 C6-C20 아릴기, 치환 또는 비치환된 C7-C20 아릴알킬기, 치환 또는 비치환된 C2-C20 알킬알콕시기, 치환 또는 비치환된 C7-C20 아릴알콕시기, 치환 또는 비치환된 C6-C20 아릴아미노기, 치환 또는 비치환된 C1-C20 알킬아미노기, 치환 또는 비치환된 C6-C20 헤테로아릴아미노기, 또는 치환 또는 비치환된 C2-C20 헤테로 고리기를 나타낸다. (단, X가 N인 경우 Ar4는 비공유전자쌍을 나타내며, X가 C인 경우 Ar3 및 Ar4는 서로 결합하여 포화 또는 불포화 탄소고리를 형성할 수 있다)
- 제6항에 있어서, 상기 이미다졸 유도체 (B')의 Ar2는 하기 이미다졸 유도체 (D')와 하기 보론산 유도체 (E')의 반응에 의해 도입되는 것을 특징으로 하는 화학식 1로 표시되는 유기 발광 소자용 헤테로방향환 화합물의 제조 방법:(D') (E') (B')상기 반응식 중,X는 N 또는 C를 나타내고;X'는 동일하거나 다른 할로겐 원소를 나타내며;Ar2, Ar3 및 Ar4는 각각 독립적으로, 수소 원자, 시아노기, 하이드록시기, 니트로기, 할로겐 원자, 치환 또는 비치환된 페닐기, 치환 또는 비치환된 C1-C20 알킬기, 치환 또는 비치환된 C1-C20 알콕시기, 치환 또는 비치환된 C6-C20 아릴기, 치환 또는 비치환된 C7-C20 아릴알킬기, 치환 또는 비치환된 C2-C20 알킬알콕시기, 치환 또는 비치환된 C7-C20 아릴알콕시기, 치환 또는 비치환된 C6-C20 아릴아미노기, 치환 또는 비치환된 C1-C20 알킬아미노기, 치환 또는 비치환된 C6-C20 헤테로아릴아미노기, 또는 치환 또는 비치환된 C2-C20 헤테로 고리기를 나타낸다. (단, X가 N인 경우 Ar4는 비공유전자쌍을 나타내며, X가 C인 경우 Ar3 및 Ar4는 서로 결합하여 포화 또는 불포화 탄소고리를 형성할 수 있다)
- 제7항에 있어서, 상기 이미다졸 유도체 (D')는 하기 이미다졸 유도체 (F')와 N-할로숙신이미드 (N-halosuccinimide)의 반응에 의해 생성되는 것을 특징으로 하는 화학식 1로 표시되는 유기 발광 소자용 헤테로방향환 화합물의 제조 방법:(F') (D')상기 반응식 중,X는 N 또는 C를 나타내고;X'는 동일하거나 다른 할로겐 원소를 나타내며;Ar3 및 Ar4는 각각 독립적으로, 수소 원자, 시아노기, 하이드록시기, 니트로기, 할로겐 원자, 치환 또는 비치환된 페닐기, 치환 또는 비치환된 C1-C20 알킬기, 치환 또는 비치환된 C1-C20 알콕시기, 치환 또는 비치환된 C6-C20 아릴기, 치환 또는 비치환된 C7-C20 아릴알킬기, 치환 또는 비치환된 C2-C20 알킬알콕시기, 치환 또는 비치환된 C7-C20 아릴알콕시기, 치환 또는 비치환된 C6-C20 아릴아미노기, 치환 또는 비치환된 C1-C20 알킬아미노기, 치환 또는 비치환된 C6-C20 헤테로아릴아미노기, 또는 치환 또는 비치환된 C2-C20 헤테로 고리기를 나타내며 (단, X가 N인 경우 Ar4는 비공유전자쌍을 나타내며, X가 C인 경우 Ar3 및 Ar4는 서로 결합하여 포화 또는 불포화 탄소고리를 형성할 수 있다);상기 N-할로숙신이미드는 N-아이오도숙신이미드, N-브로모숙신이미드 또는 N-클로로숙신이미드이다.
- 제8항에 있어서, 상기 이미다졸 유도체 (F')는 α-할로 케톤 유도체 (H')와 헤테로아릴아민 유도체 (G')의 반응에 의해 생성되는 것을 특징으로 하는 화학식 1로 표시되는 유기 발광 소자용 헤테로방향환 화합물의 제조 방법:(H') (G') (F')상기 반응식 중,X는 N 또는 C를 나타내고;X'는 동일하거나 다른 할로겐 원소를 나타내며;Ar3 및 Ar4는 각각 독립적으로, 수소 원자, 시아노기, 하이드록시기, 니트로기, 할로겐 원자, 치환 또는 비치환된 페닐기, 치환 또는 비치환된 C1-C20 알킬기, 치환 또는 비치환된 C1-C20 알콕시기, 치환 또는 비치환된 C6-C20 아릴기, 치환 또는 비치환된 C7-C20 아릴알킬기, 치환 또는 비치환된 C2-C20 알킬알콕시기, 치환 또는 비치환된 C7-C20 아릴알콕시기, 치환 또는 비치환된 C6-C20 아릴아미노기, 치환 또는 비치환된 C1-C20 알킬아미노기, 치환 또는 비치환된 C6-C20 헤테로아릴아미노기, 또는 치환 또는 비치환된 C2-C20 헤테로 고리기를 나타낸다. (단, X가 N인 경우 Ar4는 비공유전자쌍을 나타내며, X가 C인 경우 Ar3 및 Ar4는 서로 결합하여 포화 또는 불포화 탄소고리를 형성할 수 있다)
- 제6항에 있어서, 상기 반응이 Pd(PPh3)4 및 염기 존재하에서 실시되며, 반응 온도는 50℃ 내지 120℃인 것을 특징으로 하는 화학식 1로 표시되는 유기 발광 소자용 헤테로방향환 화합물의 제조 방법.
- 제7항에 있어서, 상기 반응이 Pd(PPh3)4 및 염기 존재하에서 실시되며, 반응 온도는 50℃ 내지 120℃인 것을 특징으로 하는 화학식 1로 표시되는 유기 발광 소자용 헤테로방향환 화합물의 제조 방법.
- 제1전극 및 제2전극 사이에 위치하는 단층 또는 복수층의 유기막을 구비한 유기 발광 소자로서, 상기 유기막이 제1항 내지 제3항 중 어느 한 항에 따른 헤테로방향환 화합물을 포함하는 것을 특징으로 하는 유기 발광 소자.
- 제1전극 및 제2전극 사이에 위치하는 단층 또는 복수층의 유기막을 구비한 유기 발광 소자로서, 상기 유기막이 제4항에 따른 헤테로방향환 화합물을 포함하는 것을 특징으로 하는 유기 발광 소자.
- 제1전극 및 제2전극 사이에 위치하는 단층 또는 복수층의 유기막을 구비한 유기 발광 소자로서, 상기 유기막이 제5항에 따른 헤테로방향환 화합물을 포함하는 것을 특징으로 하는 유기 발광 소자.
- 제12항에 있어서, 상기 유기막이 전자수송층 또는 전자주입층인 것을 특징으로 하는 유기 발광 소자.
- 제13항 또는 제14항에 있어서, 상기 유기막이 전자수송층 또는 전자주입층인 것을 특징으로 하는 유기 발광 소자.
- 제12항에 있어서, 상기 유기막이 발광층을 포함하는 것을 특징으로 하는 유기 발광 소자.
- 제13항 또는 제14항에 있어서, 상기 유기막이 발광층을 포함하는 것을 특징으로 하는 유기 발광 소자.
- 제12항에 있어서, 상기 유기막이 정공주입층, 정공수송층, 발광층, 정공저지층, 전자수송층 및 전자주입층으로 이루어진 군으로부터 선택된 하나 이상의 층을 더 포함하는 것을 특징으로 하는 유기 발광 소자.
- 제13항 또는 제14항에 있어서, 상기 유기막이 정공주입층, 정공수송층, 발광층, 정공저지층, 전자수송층 및 전자주입층으로 이루어진 군으로부터 선택된 하나 이상의 층을 더 포함하는 것을 특징으로 하는 유기 발광 소자.
- 제15항, 제17항 또는 제19항에 있어서, 상기 소자가 제1전극/정공주입층/정공수송층/발광층/전자수송층/전자주입층/제2전극 또는 제1전극/정공주입층/정공수송층/발광층/정공저지층/전자수송층/전자주입층/제2전극의 구조를 갖는 것을 특징으로 하는 유기 발광 소자.
- 제16항에 있어서, 상기 소자가 제1전극/정공주입층/정공수송층/발광층/전자수송층/전자주입층/제2전극 또는 제1전극/정공주입층/정공수송층/발광층/정공저지층/전자수송층/전자주입층/제2전극의 구조를 갖는 것을 특징으로 하는 유기 발광 소자.
- 제18항에 있어서, 상기 소자가 제1전극/정공주입층/정공수송층/발광층/전자수송층/전자주입층/제2전극 또는 제1전극/정공주입층/정공수송층/발광층/정공저지층/전자수송층/전자주입층/제2전극의 구조를 갖는 것을 특징으로 하는 유기 발광 소자.
- 제20항에 있어서, 상기 소자가 제1전극/정공주입층/정공수송층/발광층/전자수송층/전자주입층/제2전극 또는 제1전극/정공주입층/정공수송층/발광층/정공저지층/전자수송층/전자주입층/제2전극의 구조를 갖는 것을 특징으로 하는 유기 발광 소자.
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020070059101A KR101030007B1 (ko) | 2007-06-15 | 2007-06-15 | 헤테로방향환 함유 화합물, 이의 제조 방법 및 이를 이용한유기 발광 소자 |
| US12/213,097 US20090153035A1 (en) | 2007-06-15 | 2008-06-13 | Heteroaromatic cycle-containing compound, method of preparing the same and organic light emitting device comprising the same |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020070059101A KR101030007B1 (ko) | 2007-06-15 | 2007-06-15 | 헤테로방향환 함유 화합물, 이의 제조 방법 및 이를 이용한유기 발광 소자 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20080110399A KR20080110399A (ko) | 2008-12-18 |
| KR101030007B1 true KR101030007B1 (ko) | 2011-04-20 |
Family
ID=40369317
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020070059101A Active KR101030007B1 (ko) | 2007-06-15 | 2007-06-15 | 헤테로방향환 함유 화합물, 이의 제조 방법 및 이를 이용한유기 발광 소자 |
Country Status (2)
| Country | Link |
|---|---|
| US (1) | US20090153035A1 (ko) |
| KR (1) | KR101030007B1 (ko) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2010311511B2 (en) | 2009-10-30 | 2014-07-17 | Janssen Pharmaceutica Nv | Imidazo[1,2-b]pyridazine derivatives and their use as PDE10 inhibitors |
| AR080754A1 (es) | 2010-03-09 | 2012-05-09 | Janssen Pharmaceutica Nv | Derivados de imidazo (1,2-a) pirazina y su uso como inhibidores de pde10 |
| KR20250026895A (ko) | 2011-02-16 | 2025-02-25 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 발광 엘리먼트 |
| CN114315840A (zh) * | 2011-03-25 | 2022-04-12 | Udc 爱尔兰有限责任公司 | 用于电子应用的4H-咪唑并[1,2-a]咪唑 |
| US9806270B2 (en) | 2011-03-25 | 2017-10-31 | Udc Ireland Limited | 4H-imidazo[1,2-a]imidazoles for electronic applications |
| CN103619846B (zh) | 2011-06-27 | 2016-08-17 | 詹森药业有限公司 | 1-芳基-4-甲基-[1,2,4]三唑[4,3-a]喹喔啉衍生物 |
| CN108299439B (zh) * | 2011-11-10 | 2021-02-09 | Udc 爱尔兰有限责任公司 | 用于电子应用的4H-咪唑并[1,2-a]咪唑 |
| JP2013232629A (ja) | 2012-04-06 | 2013-11-14 | Semiconductor Energy Lab Co Ltd | 発光素子、発光装置、電子機器、および照明装置 |
| RU2657540C2 (ru) | 2012-06-26 | 2018-06-14 | Янссен Фармацевтика Нв | Комбинации, содержащие ингибиторы pde 2, такие как 1-арил-4-метил-[1,2,4]триазоло[4,3-а]хиноксалиновые соединения, и ингибиторы pde 10, для применения в лечении неврологических или метаболических расстройств |
| WO2014009305A1 (en) | 2012-07-09 | 2014-01-16 | Janssen Pharmaceutica Nv | Inhibitors of phosphodiesterase 10 enzyme |
| KR102451454B1 (ko) | 2012-07-10 | 2022-10-06 | 유디씨 아일랜드 리미티드 | 전자 응용을 위한 벤즈이미다조[1,2-a]벤즈이미다졸 유도체 |
| CN103709180B (zh) * | 2012-09-29 | 2016-12-21 | 昆山维信诺显示技术有限公司 | 含咪唑并[1,2-a]吡啶基团的稠环芳烃衍生物及其在OLED中的应用 |
| CN104650117B (zh) * | 2013-12-26 | 2017-08-01 | 北京鼎材科技有限公司 | 一种有机化合物及其在有机电致发光器件中的应用 |
| KR102698887B1 (ko) | 2016-05-04 | 2024-08-28 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001006877A (ja) | 1999-06-21 | 2001-01-12 | Toray Ind Inc | 発光素子 |
| JP2001057292A (ja) * | 1999-08-20 | 2001-02-27 | Toray Ind Inc | 発光素子 |
| KR20050035569A (ko) * | 2003-10-13 | 2005-04-19 | 삼성에스디아이 주식회사 | 이미다졸 고리 함유 화합물 및 이를 이용한 유기 전계발광 소자 |
| KR20050074478A (ko) * | 2002-10-09 | 2005-07-18 | 이데미쓰 고산 가부시키가이샤 | 유기 전기발광 소자 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4356429A (en) * | 1980-07-17 | 1982-10-26 | Eastman Kodak Company | Organic electroluminescent cell |
| US5141671A (en) * | 1991-08-01 | 1992-08-25 | Eastman Kodak Company | Mixed ligand 8-quinolinolato aluminum chelate luminophors |
| US6559256B2 (en) * | 1994-12-28 | 2003-05-06 | Cambridge Display Technology Ltd. | Polymers for use in optical devices |
| US6620529B1 (en) * | 1999-10-27 | 2003-09-16 | Fuji Photo Film Co., Ltd. | Materials for light emitting devices and light emitting devices using the same |
| US6998487B2 (en) * | 2001-04-27 | 2006-02-14 | Lg Chem, Ltd. | Double-spiro organic compounds and organic electroluminescent devices using the same |
| EP1582516B1 (en) * | 2003-01-10 | 2013-07-17 | Idemitsu Kosan Co., Ltd. | Nitrogenous heterocyclic derivative and organic electroluminescent element employing the same |
| KR20040072004A (ko) * | 2003-02-07 | 2004-08-16 | 삼성에스디아이 주식회사 | 유기 전계 발광 소자용 발광 화합물 및 그를 이용한 유기전계발광 소자 |
| US7622584B2 (en) * | 2006-11-24 | 2009-11-24 | Samsung Mobile Display Co., Ltd. | Imidazopyridine-based compound and organic light emitting diode including organic layer comprising the imidazopyridine-based compound |
-
2007
- 2007-06-15 KR KR1020070059101A patent/KR101030007B1/ko active Active
-
2008
- 2008-06-13 US US12/213,097 patent/US20090153035A1/en not_active Abandoned
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001006877A (ja) | 1999-06-21 | 2001-01-12 | Toray Ind Inc | 発光素子 |
| JP2001057292A (ja) * | 1999-08-20 | 2001-02-27 | Toray Ind Inc | 発光素子 |
| KR20050074478A (ko) * | 2002-10-09 | 2005-07-18 | 이데미쓰 고산 가부시키가이샤 | 유기 전기발광 소자 |
| KR20050035569A (ko) * | 2003-10-13 | 2005-04-19 | 삼성에스디아이 주식회사 | 이미다졸 고리 함유 화합물 및 이를 이용한 유기 전계발광 소자 |
Also Published As
| Publication number | Publication date |
|---|---|
| KR20080110399A (ko) | 2008-12-18 |
| US20090153035A1 (en) | 2009-06-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101030007B1 (ko) | 헤테로방향환 함유 화합물, 이의 제조 방법 및 이를 이용한유기 발광 소자 | |
| KR102201097B1 (ko) | 유기발광소자용 화합물 및 이를 포함하는 유기 발광 소자 | |
| KR101022649B1 (ko) | 헤테로고리 화합물 및 이를 이용한 유기 전계 발광 장치 | |
| KR101600453B1 (ko) | 신규한 유기발광화합물 및 이를 포함하는 유기전기발광소자 | |
| KR100863905B1 (ko) | 함불소계 화합물 및 이를 이용한 유기 발광 소자 | |
| TWI633094B (zh) | 雜環化合物及包含其之有機發光元件 | |
| KR101996651B1 (ko) | 플루오렌 유도체 및 이를 포함하는 유기전계발광소자 | |
| KR101050459B1 (ko) | 플루오렌 화합물 및 이를 이용한 유기 전계 발광 장치 | |
| KR102507585B1 (ko) | 신규한 유기 화합물 및 이를 포함하는 유기 발광 소자 | |
| KR102309065B1 (ko) | 유기발광소자용 화합물 및 이를 포함하는 유기 발광 소자 | |
| KR20120038032A (ko) | 이형고리 화합물 및 이를 포함하는 유기전계발광소자 | |
| KR20160021424A (ko) | 신규한 화합물 및 이를 포함하는 유기발광소자 | |
| KR100863906B1 (ko) | 카바졸계 화합물 및 이를 포함한 유기막을 구비한 유기발광 소자 | |
| KR101463597B1 (ko) | 아민 유도체 및 이를 포함하는 유기전계발광소자 | |
| KR102437956B1 (ko) | 신규한 화합물 및 이를 포함하는 유기발광소자 | |
| KR100846607B1 (ko) | 유기 발광 소자 | |
| US8053093B2 (en) | Organometallic complex, method of preparing the same and organic light emitting device comprising the same | |
| KR20080048758A (ko) | 안트라센 유도체 화합물 및 이를 이용한 유기 발광 소자 | |
| KR20140091496A (ko) | 중수소로 치환된 신규한 유기발광 화합물 및 이를 포함하는 유기발광소자 | |
| KR102390954B1 (ko) | 신규한 화합물 및 이를 포함하는 유기발광소자 | |
| KR102394381B1 (ko) | 신규한 정공주입·정공수송 화합물 및 이를 포함하는 유기발광소자 | |
| KR20150095208A (ko) | 신규한 정공주입·정공수송 화합물 및 이를 포함하는 유기발광소자 | |
| KR101855308B1 (ko) | 신규한 9H-인데노[2,1-b]피리딘 화합물 및 이를 포함하는 유기 발광 소자 | |
| KR102149449B1 (ko) | 유기발광소자용 화합물 및 이를 포함하는 유기 발광 소자 | |
| KR100846596B1 (ko) | 헤테로환 함유 유기금속착물 및 이를 이용한 유기 발광소자 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| PA0109 | Patent application |
Patent event code: PA01091R01D Comment text: Patent Application Patent event date: 20070615 |
|
| PA0201 | Request for examination | ||
| N231 | Notification of change of applicant | ||
| PN2301 | Change of applicant |
Patent event date: 20081120 Comment text: Notification of Change of Applicant Patent event code: PN23011R01D |
|
| E902 | Notification of reason for refusal | ||
| PE0902 | Notice of grounds for rejection |
Comment text: Notification of reason for refusal Patent event date: 20081124 Patent event code: PE09021S01D |
|
| PG1501 | Laying open of application | ||
| AMND | Amendment | ||
| E90F | Notification of reason for final refusal | ||
| PE0902 | Notice of grounds for rejection |
Comment text: Final Notice of Reason for Refusal Patent event date: 20090409 Patent event code: PE09021S02D |
|
| AMND | Amendment | ||
| E601 | Decision to refuse application | ||
| E801 | Decision on dismissal of amendment | ||
| PE0601 | Decision on rejection of patent |
Patent event date: 20091014 Comment text: Decision to Refuse Application Patent event code: PE06012S01D Patent event date: 20090409 Comment text: Final Notice of Reason for Refusal Patent event code: PE06011S02I Patent event date: 20081124 Comment text: Notification of reason for refusal Patent event code: PE06011S01I |
|
| PE0801 | Dismissal of amendment |
Patent event code: PE08012E01D Comment text: Decision on Dismissal of Amendment Patent event date: 20091014 Patent event code: PE08011R01I Comment text: Amendment to Specification, etc. Patent event date: 20090609 Patent event code: PE08011R01I Comment text: Amendment to Specification, etc. Patent event date: 20090128 |
|
| AMND | Amendment | ||
| J201 | Request for trial against refusal decision | ||
| PJ0201 | Trial against decision of rejection |
Patent event date: 20091112 Comment text: Request for Trial against Decision on Refusal Patent event code: PJ02012R01D Patent event date: 20091014 Comment text: Decision to Refuse Application Patent event code: PJ02011S01I Appeal kind category: Appeal against decision to decline refusal Decision date: 20110225 Appeal identifier: 2009101010329 Request date: 20091112 |
|
| PB0901 | Examination by re-examination before a trial |
Comment text: Amendment to Specification, etc. Patent event date: 20091112 Patent event code: PB09011R02I Comment text: Request for Trial against Decision on Refusal Patent event date: 20091112 Patent event code: PB09011R01I Comment text: Amendment to Specification, etc. Patent event date: 20090609 Patent event code: PB09011R02I Comment text: Amendment to Specification, etc. Patent event date: 20090128 Patent event code: PB09011R02I |
|
| B601 | Maintenance of original decision after re-examination before a trial | ||
| PB0601 | Maintenance of original decision after re-examination before a trial | ||
| J301 | Trial decision |
Free format text: TRIAL DECISION FOR APPEAL AGAINST DECISION TO DECLINE REFUSAL REQUESTED 20091112 Effective date: 20110225 Free format text: TRIAL NUMBER: 2009101010329; TRIAL DECISION FOR APPEAL AGAINST DECISION TO DECLINE REFUSAL REQUESTED 20091112 Effective date: 20110225 |
|
| PJ1301 | Trial decision |
Patent event code: PJ13011S01D Patent event date: 20110228 Comment text: Trial Decision on Objection to Decision on Refusal Appeal kind category: Appeal against decision to decline refusal Request date: 20091112 Decision date: 20110225 Appeal identifier: 2009101010329 |
|
| GRNT | Written decision to grant | ||
| PR0701 | Registration of establishment |
Comment text: Registration of Establishment Patent event date: 20110412 Patent event code: PR07011E01D |
|
| PR1002 | Payment of registration fee |
Payment date: 20110413 End annual number: 3 Start annual number: 1 |
|
| PG1601 | Publication of registration | ||
| FPAY | Annual fee payment |
Payment date: 20140401 Year of fee payment: 4 |
|
| PR1001 | Payment of annual fee |
Payment date: 20140401 Start annual number: 4 End annual number: 4 |
|
| FPAY | Annual fee payment |
Payment date: 20160329 Year of fee payment: 6 |
|
| PR1001 | Payment of annual fee |
Payment date: 20160329 Start annual number: 6 End annual number: 6 |
|
| FPAY | Annual fee payment |
Payment date: 20180403 Year of fee payment: 8 |
|
| PR1001 | Payment of annual fee |
Payment date: 20180403 Start annual number: 8 End annual number: 8 |
|
| FPAY | Annual fee payment |
Payment date: 20190401 Year of fee payment: 9 |
|
| PR1001 | Payment of annual fee |
Payment date: 20190401 Start annual number: 9 End annual number: 9 |
|
| PR1001 | Payment of annual fee |
Payment date: 20200402 Start annual number: 10 End annual number: 10 |
|
| PR1001 | Payment of annual fee |
Payment date: 20210401 Start annual number: 11 End annual number: 11 |
|
| PR1001 | Payment of annual fee |
Payment date: 20220323 Start annual number: 12 End annual number: 12 |
|
| PR1001 | Payment of annual fee |
Payment date: 20240321 Start annual number: 14 End annual number: 14 |