JPWO2008016131A1 - 縮合複素環化合物 - Google Patents
縮合複素環化合物 Download PDFInfo
- Publication number
- JPWO2008016131A1 JPWO2008016131A1 JP2008527796A JP2008527796A JPWO2008016131A1 JP WO2008016131 A1 JPWO2008016131 A1 JP WO2008016131A1 JP 2008527796 A JP2008527796 A JP 2008527796A JP 2008527796 A JP2008527796 A JP 2008527796A JP WO2008016131 A1 JPWO2008016131 A1 JP WO2008016131A1
- Authority
- JP
- Japan
- Prior art keywords
- alkyl
- optionally substituted
- aromatic heterocyclic
- substituted
- pyridin
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Abandoned
Links
- 150000002391 heterocyclic compounds Chemical class 0.000 title 1
- 150000001875 compounds Chemical class 0.000 claims abstract description 343
- 125000001424 substituent group Chemical group 0.000 claims abstract description 223
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims abstract description 63
- 239000003814 drug Substances 0.000 claims abstract description 53
- 150000003839 salts Chemical class 0.000 claims abstract description 35
- 229940124597 therapeutic agent Drugs 0.000 claims abstract description 21
- 206010012601 diabetes mellitus Diseases 0.000 claims abstract description 17
- 208000027866 inflammatory disease Diseases 0.000 claims abstract description 12
- 229910052799 carbon Inorganic materials 0.000 claims abstract description 11
- 230000000069 prophylactic effect Effects 0.000 claims abstract description 8
- 125000004432 carbon atom Chemical group C* 0.000 claims abstract description 6
- -1 N-hydroxycarbamoyl Chemical group 0.000 claims description 389
- 125000000217 alkyl group Chemical group 0.000 claims description 202
- 125000006615 aromatic heterocyclic group Chemical group 0.000 claims description 131
- 125000005843 halogen group Chemical group 0.000 claims description 109
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 93
- 125000003118 aryl group Chemical group 0.000 claims description 82
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 61
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 49
- 125000003545 alkoxy group Chemical group 0.000 claims description 46
- 125000004916 (C1-C6) alkylcarbonyl group Chemical group 0.000 claims description 43
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 38
- 125000004454 (C1-C6) alkoxycarbonyl group Chemical group 0.000 claims description 33
- 125000000623 heterocyclic group Chemical group 0.000 claims description 33
- 125000004739 (C1-C6) alkylsulfonyl group Chemical group 0.000 claims description 30
- 125000006376 (C3-C10) cycloalkyl group Chemical group 0.000 claims description 29
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 23
- 238000000034 method Methods 0.000 claims description 22
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 claims description 20
- 150000004945 aromatic hydrocarbons Chemical class 0.000 claims description 19
- 229940002612 prodrug Drugs 0.000 claims description 12
- 239000000651 prodrug Substances 0.000 claims description 12
- 125000005974 C6-C14 arylcarbonyl group Chemical group 0.000 claims description 11
- 238000004519 manufacturing process Methods 0.000 claims description 10
- SMJAMOAYGIVKRI-UHFFFAOYSA-N 4-tert-butyl-n-(6-imidazol-1-ylimidazo[1,2-a]pyridin-2-yl)benzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(C=C2)N3C=NC=C3)C2=N1 SMJAMOAYGIVKRI-UHFFFAOYSA-N 0.000 claims description 7
- 125000005530 alkylenedioxy group Chemical group 0.000 claims description 7
- 125000004391 aryl sulfonyl group Chemical group 0.000 claims description 7
- 125000006254 cycloalkyl carbonyl group Chemical group 0.000 claims description 7
- UYXMZDOQJDAYOG-UHFFFAOYSA-N 6-tert-butyl-n-(6-imidazol-1-ylimidazo[1,2-a]pyridin-2-yl)pyridine-3-carboxamide Chemical compound C1=NC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(C=C2)N3C=NC=C3)C2=N1 UYXMZDOQJDAYOG-UHFFFAOYSA-N 0.000 claims description 6
- 125000004397 aminosulfonyl group Chemical group NS(=O)(=O)* 0.000 claims description 6
- XBKNNPZVSZKDRB-UHFFFAOYSA-N 4-tert-butyl-n-[6-(1h-pyrazol-4-yl)imidazo[1,2-a]pyridin-2-yl]benzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(C=C2)C3=CNN=C3)C2=N1 XBKNNPZVSZKDRB-UHFFFAOYSA-N 0.000 claims description 5
- FBVFVKCWUBKXIT-UHFFFAOYSA-N 4-tert-butyl-n-(1,2-dihydrofuro[2,3-e]imidazo[1,2-a]pyridin-7-yl)benzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C2=C(OCC2)C=C2)C2=N1 FBVFVKCWUBKXIT-UHFFFAOYSA-N 0.000 claims description 4
- KTLBBXXAVUFMIJ-UHFFFAOYSA-N 4-tert-butyl-n-(6-imidazol-1-ylimidazo[1,2-b]pyridazin-2-yl)benzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(N=C(C=C2)N3C=NC=C3)C2=N1 KTLBBXXAVUFMIJ-UHFFFAOYSA-N 0.000 claims description 4
- 241000124008 Mammalia Species 0.000 claims description 4
- 125000002373 5 membered heterocyclic group Chemical group 0.000 claims description 3
- 125000004356 hydroxy functional group Chemical group O* 0.000 claims description 3
- SMKYAHIAPQOLBK-UHFFFAOYSA-N n-(7-methylimidazo[1,2-a]pyridin-2-yl)benzamide Chemical compound N1=C2C=C(C)C=CN2C=C1NC(=O)C1=CC=CC=C1 SMKYAHIAPQOLBK-UHFFFAOYSA-N 0.000 claims description 3
- SYKCZFPMTZONOC-UHFFFAOYSA-N n-imidazo[1,2-a]pyridin-2-ylbenzamide Chemical compound C=1N2C=CC=CC2=NC=1NC(=O)C1=CC=CC=C1 SYKCZFPMTZONOC-UHFFFAOYSA-N 0.000 claims description 3
- XXUNIGZDNWWYED-UHFFFAOYSA-N 2-methylbenzamide Chemical compound CC1=CC=CC=C1C(N)=O XXUNIGZDNWWYED-UHFFFAOYSA-N 0.000 claims description 2
- 229940127254 ASK1 inhibitor Drugs 0.000 claims description 2
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 2
- PXQLVRUNWNTZOS-UHFFFAOYSA-N sulfanyl Chemical class [SH] PXQLVRUNWNTZOS-UHFFFAOYSA-N 0.000 claims description 2
- 102100033127 Mitogen-activated protein kinase kinase kinase 5 Human genes 0.000 abstract description 36
- 230000002401 inhibitory effect Effects 0.000 abstract description 8
- 239000008177 pharmaceutical agent Substances 0.000 abstract description 3
- 101001018196 Homo sapiens Mitogen-activated protein kinase kinase kinase 5 Proteins 0.000 abstract 1
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 360
- 238000005160 1H NMR spectroscopy Methods 0.000 description 176
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 140
- 230000002829 reductive effect Effects 0.000 description 112
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 108
- 239000002904 solvent Substances 0.000 description 108
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 95
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 91
- 238000002844 melting Methods 0.000 description 88
- 230000008018 melting Effects 0.000 description 88
- 239000000243 solution Substances 0.000 description 83
- 238000000921 elemental analysis Methods 0.000 description 78
- 238000006243 chemical reaction Methods 0.000 description 74
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 69
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 69
- 239000000203 mixture Substances 0.000 description 64
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 63
- 238000010898 silica gel chromatography Methods 0.000 description 55
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 51
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 51
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 49
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 48
- 229910052731 fluorine Inorganic materials 0.000 description 37
- 125000001153 fluoro group Chemical group F* 0.000 description 37
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 36
- 108010075639 MAP Kinase Kinase Kinase 5 Proteins 0.000 description 35
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 35
- 235000002639 sodium chloride Nutrition 0.000 description 35
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 34
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 34
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 33
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 33
- 125000004076 pyridyl group Chemical group 0.000 description 33
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 32
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 32
- 239000011541 reaction mixture Substances 0.000 description 32
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 30
- 125000002883 imidazolyl group Chemical group 0.000 description 27
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 26
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 24
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 24
- 235000017557 sodium bicarbonate Nutrition 0.000 description 24
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 24
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 23
- 229930195733 hydrocarbon Natural products 0.000 description 23
- 150000002430 hydrocarbons Chemical group 0.000 description 23
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 22
- 229920006395 saturated elastomer Polymers 0.000 description 22
- 239000007787 solid Substances 0.000 description 22
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 21
- 201000010099 disease Diseases 0.000 description 21
- 229940079593 drug Drugs 0.000 description 21
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical class O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 21
- KXDAEFPNCMNJSK-UHFFFAOYSA-N Benzamide Chemical compound NC(=O)C1=CC=CC=C1 KXDAEFPNCMNJSK-UHFFFAOYSA-N 0.000 description 20
- 239000004215 Carbon black (E152) Substances 0.000 description 20
- 239000007788 liquid Substances 0.000 description 20
- 238000002360 preparation method Methods 0.000 description 20
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 19
- 239000003795 chemical substances by application Substances 0.000 description 19
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 19
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 18
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 18
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 18
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 16
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 16
- 125000003226 pyrazolyl group Chemical group 0.000 description 15
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 14
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 14
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 14
- 239000012043 crude product Substances 0.000 description 14
- VZGDMQKNWNREIO-UHFFFAOYSA-N tetrachloromethane Chemical compound ClC(Cl)(Cl)Cl VZGDMQKNWNREIO-UHFFFAOYSA-N 0.000 description 14
- 125000001309 chloro group Chemical group Cl* 0.000 description 13
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 13
- 125000003386 piperidinyl group Chemical group 0.000 description 13
- 229910000027 potassium carbonate Inorganic materials 0.000 description 13
- 125000003831 tetrazolyl group Chemical group 0.000 description 13
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 12
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 12
- 230000006907 apoptotic process Effects 0.000 description 12
- 239000000460 chlorine Substances 0.000 description 12
- 125000002541 furyl group Chemical group 0.000 description 12
- 238000003756 stirring Methods 0.000 description 12
- ZGLIWZSUORDLNM-UHFFFAOYSA-N 6-chloroimidazo[1,2-a]pyridin-2-amine Chemical compound C1=C(Cl)C=CC2=NC(N)=CN21 ZGLIWZSUORDLNM-UHFFFAOYSA-N 0.000 description 11
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 11
- 239000013078 crystal Substances 0.000 description 11
- 125000002950 monocyclic group Chemical group 0.000 description 11
- 229910052757 nitrogen Inorganic materials 0.000 description 11
- 125000004433 nitrogen atom Chemical group N* 0.000 description 11
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 11
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical group [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 10
- 241000699670 Mus sp. Species 0.000 description 10
- 229910052801 chlorine Inorganic materials 0.000 description 10
- 238000001704 evaporation Methods 0.000 description 10
- 239000012044 organic layer Substances 0.000 description 10
- 238000001953 recrystallisation Methods 0.000 description 10
- 125000003396 thiol group Chemical class [H]S* 0.000 description 10
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 10
- 125000006717 (C3-C10) cycloalkenyl group Chemical group 0.000 description 9
- OISVCGZHLKNMSJ-UHFFFAOYSA-N 2,6-dimethylpyridine Chemical compound CC1=CC=CC(C)=N1 OISVCGZHLKNMSJ-UHFFFAOYSA-N 0.000 description 9
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 9
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 9
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonium chloride Substances [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 9
- 125000006374 C2-C10 alkenyl group Chemical group 0.000 description 9
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 9
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 9
- 125000005018 aryl alkenyl group Chemical group 0.000 description 9
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 9
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 9
- 238000004587 chromatography analysis Methods 0.000 description 9
- 125000001041 indolyl group Chemical group 0.000 description 9
- 239000012046 mixed solvent Substances 0.000 description 9
- 125000001715 oxadiazolyl group Chemical group 0.000 description 9
- 125000002971 oxazolyl group Chemical group 0.000 description 9
- 239000000843 powder Substances 0.000 description 9
- 125000004434 sulfur atom Chemical group 0.000 description 9
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 9
- 125000001113 thiadiazolyl group Chemical group 0.000 description 9
- 125000000335 thiazolyl group Chemical group 0.000 description 9
- 125000001544 thienyl group Chemical group 0.000 description 9
- 229930192474 thiophene Natural products 0.000 description 9
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 8
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 8
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 8
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 8
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 8
- 239000002253 acid Substances 0.000 description 8
- 150000001408 amides Chemical class 0.000 description 8
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 8
- 150000001721 carbon Chemical group 0.000 description 8
- 210000004027 cell Anatomy 0.000 description 8
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 8
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 8
- 238000000605 extraction Methods 0.000 description 8
- 125000002962 imidazol-1-yl group Chemical group [*]N1C([H])=NC([H])=C1[H] 0.000 description 8
- 239000003112 inhibitor Substances 0.000 description 8
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 8
- 125000002757 morpholinyl group Chemical group 0.000 description 8
- 239000012299 nitrogen atmosphere Substances 0.000 description 8
- 235000011121 sodium hydroxide Nutrition 0.000 description 8
- 238000011282 treatment Methods 0.000 description 8
- QAEDZJGFFMLHHQ-UHFFFAOYSA-N trifluoroacetic anhydride Chemical compound FC(F)(F)C(=O)OC(=O)C(F)(F)F QAEDZJGFFMLHHQ-UHFFFAOYSA-N 0.000 description 8
- ICSNLGPSRYBMBD-UHFFFAOYSA-N 2-aminopyridine Chemical compound NC1=CC=CC=N1 ICSNLGPSRYBMBD-UHFFFAOYSA-N 0.000 description 7
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 7
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 7
- 239000002585 base Substances 0.000 description 7
- 230000015572 biosynthetic process Effects 0.000 description 7
- 150000001924 cycloalkanes Chemical group 0.000 description 7
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 7
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 description 7
- 238000001914 filtration Methods 0.000 description 7
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 7
- 125000003373 pyrazinyl group Chemical group 0.000 description 7
- 125000004526 pyridazin-2-yl group Chemical group N1N(C=CC=C1)* 0.000 description 7
- 238000000926 separation method Methods 0.000 description 7
- 229910000029 sodium carbonate Inorganic materials 0.000 description 7
- 229910052717 sulfur Inorganic materials 0.000 description 7
- 238000003786 synthesis reaction Methods 0.000 description 7
- 125000001425 triazolyl group Chemical group 0.000 description 7
- PAMIQIKDUOTOBW-UHFFFAOYSA-N 1-methylpiperidine Chemical compound CN1CCCCC1 PAMIQIKDUOTOBW-UHFFFAOYSA-N 0.000 description 6
- JKTCBAGSMQIFNL-UHFFFAOYSA-N 2,3-dihydrofuran Chemical compound C1CC=CO1 JKTCBAGSMQIFNL-UHFFFAOYSA-N 0.000 description 6
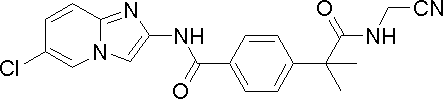
- TVKOGHPURGXLOW-UHFFFAOYSA-N 2-[4-[(6-chloroimidazo[1,2-a]pyridin-2-yl)carbamoyl]phenyl]-2-methylpropanoic acid Chemical compound C1=CC(C(C)(C(O)=O)C)=CC=C1C(=O)NC1=CN(C=C(Cl)C=C2)C2=N1 TVKOGHPURGXLOW-UHFFFAOYSA-N 0.000 description 6
- CFJLPCKTUNAUIH-UHFFFAOYSA-N 4-(1-methoxy-2-methyl-1-oxopropan-2-yl)benzoic acid Chemical compound COC(=O)C(C)(C)C1=CC=C(C(O)=O)C=C1 CFJLPCKTUNAUIH-UHFFFAOYSA-N 0.000 description 6
- GAMYYCRTACQSBR-UHFFFAOYSA-N 4-azabenzimidazole Chemical compound C1=CC=C2NC=NC2=N1 GAMYYCRTACQSBR-UHFFFAOYSA-N 0.000 description 6
- XTRIMXHGWLURTH-UHFFFAOYSA-N 4-tert-butyl-n-(6-formylimidazo[1,2-a]pyridin-2-yl)benzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(C=O)C=C2)C2=N1 XTRIMXHGWLURTH-UHFFFAOYSA-N 0.000 description 6
- STWDCZJRUNUAFK-UHFFFAOYSA-N 4-tert-butyl-n-(6-iodoimidazo[1,2-a]pyridin-2-yl)benzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(I)C=C2)C2=N1 STWDCZJRUNUAFK-UHFFFAOYSA-N 0.000 description 6
- HFTVJMFWJUFBNO-UHFFFAOYSA-N 5h-pyrrolo[2,3-b]pyrazine Chemical compound C1=CN=C2NC=CC2=N1 HFTVJMFWJUFBNO-UHFFFAOYSA-N 0.000 description 6
- CTFSFUSMLGMIPV-UHFFFAOYSA-N 6-iodoimidazo[1,2-a]pyridin-2-amine Chemical compound C1=C(I)C=CC2=NC(N)=CN21 CTFSFUSMLGMIPV-UHFFFAOYSA-N 0.000 description 6
- 102000004127 Cytokines Human genes 0.000 description 6
- 108090000695 Cytokines Proteins 0.000 description 6
- QUSNBJAOOMFDIB-UHFFFAOYSA-N Ethylamine Chemical compound CCN QUSNBJAOOMFDIB-UHFFFAOYSA-N 0.000 description 6
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 6
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 6
- JLTDJTHDQAWBAV-UHFFFAOYSA-N N,N-dimethylaniline Chemical compound CN(C)C1=CC=CC=C1 JLTDJTHDQAWBAV-UHFFFAOYSA-N 0.000 description 6
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 6
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 6
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 6
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 6
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 6
- 238000007796 conventional method Methods 0.000 description 6
- 238000001816 cooling Methods 0.000 description 6
- LSXDOTMGLUJQCM-UHFFFAOYSA-M copper(i) iodide Chemical compound I[Cu] LSXDOTMGLUJQCM-UHFFFAOYSA-M 0.000 description 6
- JGFBRKRYDCGYKD-UHFFFAOYSA-N dibutyl(oxo)tin Chemical compound CCCC[Sn](=O)CCCC JGFBRKRYDCGYKD-UHFFFAOYSA-N 0.000 description 6
- 238000004821 distillation Methods 0.000 description 6
- 150000002170 ethers Chemical class 0.000 description 6
- OAYLNYINCPYISS-UHFFFAOYSA-N ethyl acetate;hexane Chemical compound CCCCCC.CCOC(C)=O OAYLNYINCPYISS-UHFFFAOYSA-N 0.000 description 6
- UREBWPXBXRYXRJ-UHFFFAOYSA-N ethyl acetate;methanol Chemical compound OC.CCOC(C)=O UREBWPXBXRYXRJ-UHFFFAOYSA-N 0.000 description 6
- 150000008282 halocarbons Chemical class 0.000 description 6
- DMEGYFMYUHOHGS-UHFFFAOYSA-N heptamethylene Natural products C1CCCCCC1 DMEGYFMYUHOHGS-UHFFFAOYSA-N 0.000 description 6
- 125000000842 isoxazolyl group Chemical group 0.000 description 6
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 6
- RKHQRTVLMXOBPH-UHFFFAOYSA-N n-(6-chloroimidazo[1,2-a]pyridin-2-yl)-4-(2-cyanopropan-2-yl)benzamide Chemical compound C1=CC(C(C)(C#N)C)=CC=C1C(=O)NC1=CN(C=C(Cl)C=C2)C2=N1 RKHQRTVLMXOBPH-UHFFFAOYSA-N 0.000 description 6
- 150000002825 nitriles Chemical class 0.000 description 6
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 6
- HXITXNWTGFUOAU-UHFFFAOYSA-N phenylboronic acid Chemical compound OB(O)C1=CC=CC=C1 HXITXNWTGFUOAU-UHFFFAOYSA-N 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- FVSKHRXBFJPNKK-UHFFFAOYSA-N propionitrile Chemical compound CCC#N FVSKHRXBFJPNKK-UHFFFAOYSA-N 0.000 description 6
- 125000000714 pyrimidinyl group Chemical group 0.000 description 6
- 125000005493 quinolyl group Chemical group 0.000 description 6
- 239000002994 raw material Substances 0.000 description 6
- 230000035484 reaction time Effects 0.000 description 6
- 150000003462 sulfoxides Chemical class 0.000 description 6
- 239000000725 suspension Substances 0.000 description 6
- LBUJPTNKIBCYBY-UHFFFAOYSA-N 1,2,3,4-tetrahydroquinoline Chemical compound C1=CC=C2CCCNC2=C1 LBUJPTNKIBCYBY-UHFFFAOYSA-N 0.000 description 5
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 5
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 5
- 230000004913 activation Effects 0.000 description 5
- 239000000556 agonist Substances 0.000 description 5
- 239000007864 aqueous solution Substances 0.000 description 5
- 125000004429 atom Chemical group 0.000 description 5
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 5
- 239000001768 carboxy methyl cellulose Substances 0.000 description 5
- 125000006639 cyclohexyl carbonyl group Chemical group 0.000 description 5
- 125000006255 cyclopropyl carbonyl group Chemical group [H]C1([H])C([H])([H])C1([H])C(*)=O 0.000 description 5
- SPWVRYZQLGQKGK-UHFFFAOYSA-N dichloromethane;hexane Chemical compound ClCCl.CCCCCC SPWVRYZQLGQKGK-UHFFFAOYSA-N 0.000 description 5
- 125000005842 heteroatom Chemical group 0.000 description 5
- 230000002757 inflammatory effect Effects 0.000 description 5
- 150000007529 inorganic bases Chemical class 0.000 description 5
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical compound C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 description 5
- 239000010410 layer Substances 0.000 description 5
- FBGWLLCALYCYMH-UHFFFAOYSA-N methyl 2-[4-[(6-iodoimidazo[1,2-a]pyridin-2-yl)carbamoyl]phenyl]-2-methylpropanoate Chemical compound C1=CC(C(C)(C)C(=O)OC)=CC=C1C(=O)NC1=CN(C=C(I)C=C2)C2=N1 FBGWLLCALYCYMH-UHFFFAOYSA-N 0.000 description 5
- 125000004430 oxygen atom Chemical group O* 0.000 description 5
- 125000003170 phenylsulfonyl group Chemical group C1(=CC=CC=C1)S(=O)(=O)* 0.000 description 5
- 125000004193 piperazinyl group Chemical group 0.000 description 5
- 125000005400 pyridylcarbonyl group Chemical group N1=C(C=CC=C1)C(=O)* 0.000 description 5
- 238000010992 reflux Methods 0.000 description 5
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 5
- 238000005406 washing Methods 0.000 description 5
- UWYZHKAOTLEWKK-UHFFFAOYSA-N 1,2,3,4-tetrahydroisoquinoline Chemical compound C1=CC=C2CNCCC2=C1 UWYZHKAOTLEWKK-UHFFFAOYSA-N 0.000 description 4
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical compound C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 4
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 4
- ZKAMEFMDQNTDFK-UHFFFAOYSA-N 1h-imidazo[4,5-b]pyrazine Chemical compound C1=CN=C2NC=NC2=N1 ZKAMEFMDQNTDFK-UHFFFAOYSA-N 0.000 description 4
- GQHTUMJGOHRCHB-UHFFFAOYSA-N 2,3,4,6,7,8,9,10-octahydropyrimido[1,2-a]azepine Chemical compound C1CCCCN2CCCN=C21 GQHTUMJGOHRCHB-UHFFFAOYSA-N 0.000 description 4
- HBEDSQVIWPRPAY-UHFFFAOYSA-N 2,3-dihydrobenzofuran Chemical compound C1=CC=C2OCCC2=C1 HBEDSQVIWPRPAY-UHFFFAOYSA-N 0.000 description 4
- 125000000389 2-pyrrolyl group Chemical group [H]N1C([*])=C([H])C([H])=C1[H] 0.000 description 4
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 4
- MBNQKVKDCZQPFO-UHFFFAOYSA-N 4-tert-butyl-n-(5-methylimidazo[1,2-a]pyridin-2-yl)benzamide Chemical compound C=1N2C(C)=CC=CC2=NC=1NC(=O)C1=CC=C(C(C)(C)C)C=C1 MBNQKVKDCZQPFO-UHFFFAOYSA-N 0.000 description 4
- RXJVFGCNOQXDCR-UHFFFAOYSA-N 6-iodoimidazo[1,2-b]pyridazin-2-amine Chemical compound N1=C(I)C=CC2=NC(N)=CN21 RXJVFGCNOQXDCR-UHFFFAOYSA-N 0.000 description 4
- LGOIRRFMNUSHIY-UHFFFAOYSA-N 6-tert-butyl-n-(6-iodoimidazo[1,2-a]pyridin-2-yl)pyridine-3-carboxamide Chemical compound C1=NC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(I)C=C2)C2=N1 LGOIRRFMNUSHIY-UHFFFAOYSA-N 0.000 description 4
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 4
- 239000005711 Benzoic acid Substances 0.000 description 4
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 4
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 4
- WTDHULULXKLSOZ-UHFFFAOYSA-N Hydroxylamine hydrochloride Chemical compound Cl.ON WTDHULULXKLSOZ-UHFFFAOYSA-N 0.000 description 4
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 4
- 206010061218 Inflammation Diseases 0.000 description 4
- AMIMRNSIRUDHCM-UHFFFAOYSA-N Isopropylaldehyde Chemical compound CC(C)C=O AMIMRNSIRUDHCM-UHFFFAOYSA-N 0.000 description 4
- 108010055717 JNK Mitogen-Activated Protein Kinases Proteins 0.000 description 4
- 102000001291 MAP Kinase Kinase Kinase Human genes 0.000 description 4
- 108060006687 MAP kinase kinase kinase Proteins 0.000 description 4
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 4
- AHVYPIQETPWLSZ-UHFFFAOYSA-N N-methyl-pyrrolidine Natural products CN1CC=CC1 AHVYPIQETPWLSZ-UHFFFAOYSA-N 0.000 description 4
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 4
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 4
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 4
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 4
- 229930006000 Sucrose Natural products 0.000 description 4
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 4
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 4
- 150000008065 acid anhydrides Chemical class 0.000 description 4
- 125000002252 acyl group Chemical group 0.000 description 4
- 150000001447 alkali salts Chemical class 0.000 description 4
- 235000019270 ammonium chloride Nutrition 0.000 description 4
- 150000001540 azides Chemical class 0.000 description 4
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 4
- 235000010233 benzoic acid Nutrition 0.000 description 4
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical compound C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 description 4
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 4
- 229910000024 caesium carbonate Inorganic materials 0.000 description 4
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 4
- 125000004230 chromenyl group Chemical group O1C(C=CC2=CC=CC=C12)* 0.000 description 4
- 239000000470 constituent Substances 0.000 description 4
- 125000001485 cycloalkadienyl group Chemical group 0.000 description 4
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 4
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 4
- 239000000975 dye Substances 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 150000002148 esters Chemical class 0.000 description 4
- 125000006125 ethylsulfonyl group Chemical group 0.000 description 4
- 239000000706 filtrate Substances 0.000 description 4
- 230000007062 hydrolysis Effects 0.000 description 4
- 238000006460 hydrolysis reaction Methods 0.000 description 4
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 4
- 125000004857 imidazopyridinyl group Chemical class N1C(=NC2=C1C=CC=N2)* 0.000 description 4
- 230000001965 increasing effect Effects 0.000 description 4
- 230000004054 inflammatory process Effects 0.000 description 4
- 229910052740 iodine Inorganic materials 0.000 description 4
- PGLTVOMIXTUURA-UHFFFAOYSA-N iodoacetamide Chemical compound NC(=O)CI PGLTVOMIXTUURA-UHFFFAOYSA-N 0.000 description 4
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 4
- 238000011813 knockout mouse model Methods 0.000 description 4
- IUYHWZFSGMZEOG-UHFFFAOYSA-M magnesium;propane;chloride Chemical compound [Mg+2].[Cl-].C[CH-]C IUYHWZFSGMZEOG-UHFFFAOYSA-M 0.000 description 4
- 235000010355 mannitol Nutrition 0.000 description 4
- 239000011259 mixed solution Substances 0.000 description 4
- 102000002574 p38 Mitogen-Activated Protein Kinases Human genes 0.000 description 4
- 108010068338 p38 Mitogen-Activated Protein Kinases Proteins 0.000 description 4
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 4
- 239000008194 pharmaceutical composition Substances 0.000 description 4
- 239000002244 precipitate Substances 0.000 description 4
- 230000002265 prevention Effects 0.000 description 4
- 125000001501 propionyl group Chemical group O=C([*])C([H])([H])C([H])([H])[H] 0.000 description 4
- 125000002098 pyridazinyl group Chemical group 0.000 description 4
- 125000000168 pyrrolyl group Chemical group 0.000 description 4
- XSCHRSMBECNVNS-UHFFFAOYSA-N quinoxaline Chemical compound N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 description 4
- 230000035882 stress Effects 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 239000005720 sucrose Substances 0.000 description 4
- 125000003039 tetrahydroisoquinolinyl group Chemical group C1(NCCC2=CC=CC=C12)* 0.000 description 4
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 4
- 125000005942 tetrahydropyridyl group Chemical group 0.000 description 4
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 4
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 4
- OVSIZPSFSNABPC-UHFFFAOYSA-N 1,2-dihydrofuro[2,3-e]imidazo[1,2-a]pyridine-7-amine Chemical compound C1=CC2=NC(N)=CN2C2=C1OCC2 OVSIZPSFSNABPC-UHFFFAOYSA-N 0.000 description 3
- AVFZOVWCLRSYKC-UHFFFAOYSA-N 1-methylpyrrolidine Chemical compound CN1CCCC1 AVFZOVWCLRSYKC-UHFFFAOYSA-N 0.000 description 3
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 3
- QUBDMRWROOGJPT-UHFFFAOYSA-N 3-[4-[(6-chloroimidazo[1,2-a]pyridin-2-yl)carbamoyl]phenyl]-3-methylbutanoic acid Chemical compound C1=CC(C(C)(CC(O)=O)C)=CC=C1C(=O)NC1=CN(C=C(Cl)C=C2)C2=N1 QUBDMRWROOGJPT-UHFFFAOYSA-N 0.000 description 3
- CWLKGDAVCFYWJK-UHFFFAOYSA-N 3-aminophenol Chemical compound NC1=CC=CC(O)=C1 CWLKGDAVCFYWJK-UHFFFAOYSA-N 0.000 description 3
- 229940018563 3-aminophenol Drugs 0.000 description 3
- MAVFXLXXHAMJTB-UHFFFAOYSA-N 4-(2-cyanopropan-2-yl)benzoic acid Chemical compound N#CC(C)(C)C1=CC=C(C(O)=O)C=C1 MAVFXLXXHAMJTB-UHFFFAOYSA-N 0.000 description 3
- TVOJIBGZFYMWDT-UHFFFAOYSA-N 4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-1h-pyrazole Chemical compound O1C(C)(C)C(C)(C)OB1C1=CNN=C1 TVOJIBGZFYMWDT-UHFFFAOYSA-N 0.000 description 3
- XLSQCAMBWUZIKZ-UHFFFAOYSA-N 4-(4-cyano-2-methylbutan-2-yl)benzoic acid Chemical compound N#CCCC(C)(C)C1=CC=C(C(O)=O)C=C1 XLSQCAMBWUZIKZ-UHFFFAOYSA-N 0.000 description 3
- QRSCGRQOYHYZRX-UHFFFAOYSA-N 4-[4-[(6-chloroimidazo[1,2-a]pyridin-2-yl)carbamoyl]phenyl]-4-methylpentanoic acid Chemical compound C1=CC(C(C)(CCC(O)=O)C)=CC=C1C(=O)NC1=CN(C=C(Cl)C=C2)C2=N1 QRSCGRQOYHYZRX-UHFFFAOYSA-N 0.000 description 3
- JUJMCVCAHFVRPW-UHFFFAOYSA-N 4-tert-butyl-n-(6-phenylimidazo[1,2-a]pyridin-2-yl)benzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(C=C2)C=3C=CC=CC=3)C2=N1 JUJMCVCAHFVRPW-UHFFFAOYSA-N 0.000 description 3
- HRYXZJRQXNMUTE-UHFFFAOYSA-N 4-tert-butyl-n-(6-pyridin-3-ylimidazo[1,2-a]pyridin-2-yl)benzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(C=C2)C=3C=NC=CC=3)C2=N1 HRYXZJRQXNMUTE-UHFFFAOYSA-N 0.000 description 3
- WDILEVNVQVNUMP-UHFFFAOYSA-N 4-tert-butyl-n-[6-(1h-imidazol-5-yl)imidazo[1,2-a]pyridin-2-yl]benzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(C=C2)C=3NC=NC=3)C2=N1 WDILEVNVQVNUMP-UHFFFAOYSA-N 0.000 description 3
- WNLMYNASWOULQY-UHFFFAOYSA-N 4-tert-butylbenzoyl chloride Chemical compound CC(C)(C)C1=CC=C(C(Cl)=O)C=C1 WNLMYNASWOULQY-UHFFFAOYSA-N 0.000 description 3
- YYROPELSRYBVMQ-UHFFFAOYSA-N 4-toluenesulfonyl chloride Chemical compound CC1=CC=C(S(Cl)(=O)=O)C=C1 YYROPELSRYBVMQ-UHFFFAOYSA-N 0.000 description 3
- CVGXKEVUQXTBGM-UHFFFAOYSA-N 6-tert-butylpyridine-3-carboxylic acid Chemical compound CC(C)(C)C1=CC=C(C(O)=O)C=N1 CVGXKEVUQXTBGM-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- 229940123208 Biguanide Drugs 0.000 description 3
- XNCOSPRUTUOJCJ-UHFFFAOYSA-N Biguanide Chemical compound NC(N)=NC(N)=N XNCOSPRUTUOJCJ-UHFFFAOYSA-N 0.000 description 3
- 241000283690 Bos taurus Species 0.000 description 3
- 229910021595 Copper(I) iodide Inorganic materials 0.000 description 3
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 3
- RGSFGYAAUTVSQA-UHFFFAOYSA-N Cyclopentane Chemical compound C1CCCC1 RGSFGYAAUTVSQA-UHFFFAOYSA-N 0.000 description 3
- 208000002249 Diabetes Complications Diseases 0.000 description 3
- 206010012655 Diabetic complications Diseases 0.000 description 3
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- 208000031226 Hyperlipidaemia Diseases 0.000 description 3
- 102000004877 Insulin Human genes 0.000 description 3
- 108090001061 Insulin Proteins 0.000 description 3
- 206010022489 Insulin Resistance Diseases 0.000 description 3
- 102000000589 Interleukin-1 Human genes 0.000 description 3
- 108010002352 Interleukin-1 Proteins 0.000 description 3
- 108010063738 Interleukins Proteins 0.000 description 3
- 102000015696 Interleukins Human genes 0.000 description 3
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical group CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 3
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 3
- 102000043136 MAP kinase family Human genes 0.000 description 3
- 108091054455 MAP kinase family Proteins 0.000 description 3
- 108090000744 Mitogen-Activated Protein Kinase Kinases Proteins 0.000 description 3
- 102000004232 Mitogen-Activated Protein Kinase Kinases Human genes 0.000 description 3
- SVYKKECYCPFKGB-UHFFFAOYSA-N N,N-dimethylcyclohexylamine Chemical compound CN(C)C1CCCCC1 SVYKKECYCPFKGB-UHFFFAOYSA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 229920002472 Starch Polymers 0.000 description 3
- 229940100389 Sulfonylurea Drugs 0.000 description 3
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 3
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 3
- 230000002378 acidificating effect Effects 0.000 description 3
- 125000000304 alkynyl group Chemical group 0.000 description 3
- 235000001014 amino acid Nutrition 0.000 description 3
- 150000001413 amino acids Chemical class 0.000 description 3
- 239000005557 antagonist Substances 0.000 description 3
- 239000000883 anti-obesity agent Substances 0.000 description 3
- 229940030600 antihypertensive agent Drugs 0.000 description 3
- 239000002220 antihypertensive agent Substances 0.000 description 3
- 239000002246 antineoplastic agent Substances 0.000 description 3
- 150000004982 aromatic amines Chemical class 0.000 description 3
- QRUDEWIWKLJBPS-UHFFFAOYSA-N benzotriazole Chemical compound C1=CC=C2N[N][N]C2=C1 QRUDEWIWKLJBPS-UHFFFAOYSA-N 0.000 description 3
- 239000012964 benzotriazole Substances 0.000 description 3
- 230000037396 body weight Effects 0.000 description 3
- HQABUPZFAYXKJW-UHFFFAOYSA-N butan-1-amine Chemical compound CCCCN HQABUPZFAYXKJW-UHFFFAOYSA-N 0.000 description 3
- 159000000007 calcium salts Chemical class 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000002425 crystallisation Methods 0.000 description 3
- 230000007812 deficiency Effects 0.000 description 3
- HPYNZHMRTTWQTB-UHFFFAOYSA-N dimethylpyridine Natural products CC1=CC=CN=C1C HPYNZHMRTTWQTB-UHFFFAOYSA-N 0.000 description 3
- 210000002472 endoplasmic reticulum Anatomy 0.000 description 3
- MVEAAGBEUOMFRX-UHFFFAOYSA-N ethyl acetate;hydrochloride Chemical compound Cl.CCOC(C)=O MVEAAGBEUOMFRX-UHFFFAOYSA-N 0.000 description 3
- 235000019253 formic acid Nutrition 0.000 description 3
- 239000008103 glucose Substances 0.000 description 3
- 125000005179 haloacetyl group Chemical group 0.000 description 3
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 3
- 230000006698 induction Effects 0.000 description 3
- 229940125396 insulin Drugs 0.000 description 3
- IRZFPNGLRONLJK-UHFFFAOYSA-N methyl 2-[4-[(6-chloroimidazo[1,2-a]pyridin-2-yl)carbamoyl]phenyl]-2-methylpropanoate Chemical compound C1=CC(C(C)(C)C(=O)OC)=CC=C1C(=O)NC1=CN(C=C(Cl)C=C2)C2=N1 IRZFPNGLRONLJK-UHFFFAOYSA-N 0.000 description 3
- PGXWDLGWMQIXDT-UHFFFAOYSA-N methylsulfinylmethane;hydrate Chemical compound O.CS(C)=O PGXWDLGWMQIXDT-UHFFFAOYSA-N 0.000 description 3
- JQUBHAZSXQUISS-UHFFFAOYSA-N n-(6-bromoimidazo[1,2-a]pyridin-2-yl)-4-tert-butylbenzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(Br)C=C2)C2=N1 JQUBHAZSXQUISS-UHFFFAOYSA-N 0.000 description 3
- HWIKQAODHHCAIK-UHFFFAOYSA-N n-(6-chloroimidazo[1,2-a]pyridin-2-yl)-4-(4-cyano-2-methylbutan-2-yl)benzamide Chemical compound C1=CC(C(C)(CCC#N)C)=CC=C1C(=O)NC1=CN(C=C(Cl)C=C2)C2=N1 HWIKQAODHHCAIK-UHFFFAOYSA-N 0.000 description 3
- AJXWYFWUCSUFSK-UHFFFAOYSA-N n-(6-imidazol-1-ylimidazo[1,2-a]pyridin-2-yl)-4-propan-2-ylbenzamide Chemical compound C1=CC(C(C)C)=CC=C1C(=O)NC1=CN(C=C(C=C2)N3C=NC=C3)C2=N1 AJXWYFWUCSUFSK-UHFFFAOYSA-N 0.000 description 3
- GEKUVJPGNBTFMW-UHFFFAOYSA-N n-[6-(3-aminophenoxy)imidazo[1,2-b]pyridazin-2-yl]acetamide Chemical compound C1=CC2=NC(NC(=O)C)=CN2N=C1OC1=CC=CC(N)=C1 GEKUVJPGNBTFMW-UHFFFAOYSA-N 0.000 description 3
- 125000001624 naphthyl group Chemical group 0.000 description 3
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 3
- 230000003287 optical effect Effects 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 150000007530 organic bases Chemical class 0.000 description 3
- 125000006239 protecting group Chemical group 0.000 description 3
- USPWKWBDZOARPV-UHFFFAOYSA-N pyrazolidine Chemical compound C1CNNC1 USPWKWBDZOARPV-UHFFFAOYSA-N 0.000 description 3
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 3
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 3
- 239000008107 starch Substances 0.000 description 3
- 235000019698 starch Nutrition 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 125000006253 t-butylcarbonyl group Chemical group [H]C([H])([H])C(C(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 3
- IMFACGCPASFAPR-UHFFFAOYSA-N tributylamine Chemical compound CCCCN(CCCC)CCCC IMFACGCPASFAPR-UHFFFAOYSA-N 0.000 description 3
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 3
- YFTHZRPMJXBUME-UHFFFAOYSA-N tripropylamine Chemical compound CCCN(CCC)CCC YFTHZRPMJXBUME-UHFFFAOYSA-N 0.000 description 3
- JOYRKODLDBILNP-UHFFFAOYSA-N urethane group Chemical group NC(=O)OCC JOYRKODLDBILNP-UHFFFAOYSA-N 0.000 description 3
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 2
- VCGRFBXVSFAGGA-UHFFFAOYSA-N (1,1-dioxo-1,4-thiazinan-4-yl)-[6-[[3-(4-fluorophenyl)-5-methyl-1,2-oxazol-4-yl]methoxy]pyridin-3-yl]methanone Chemical compound CC=1ON=C(C=2C=CC(F)=CC=2)C=1COC(N=C1)=CC=C1C(=O)N1CCS(=O)(=O)CC1 VCGRFBXVSFAGGA-UHFFFAOYSA-N 0.000 description 2
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 2
- 125000004738 (C1-C6) alkyl sulfinyl group Chemical group 0.000 description 2
- OTPDWCMLUKMQNO-UHFFFAOYSA-N 1,2,3,4-tetrahydropyrimidine Chemical compound C1NCC=CN1 OTPDWCMLUKMQNO-UHFFFAOYSA-N 0.000 description 2
- FYADHXFMURLYQI-UHFFFAOYSA-N 1,2,4-triazine Chemical compound C1=CN=NC=N1 FYADHXFMURLYQI-UHFFFAOYSA-N 0.000 description 2
- KTZQTRPPVKQPFO-UHFFFAOYSA-N 1,2-benzoxazole Chemical compound C1=CC=C2C=NOC2=C1 KTZQTRPPVKQPFO-UHFFFAOYSA-N 0.000 description 2
- IOEPOEDBBPRAEI-UHFFFAOYSA-N 1,2-dihydroisoquinoline Chemical compound C1=CC=C2CNC=CC2=C1 IOEPOEDBBPRAEI-UHFFFAOYSA-N 0.000 description 2
- IRFSXVIRXMYULF-UHFFFAOYSA-N 1,2-dihydroquinoline Chemical compound C1=CC=C2C=CCNC2=C1 IRFSXVIRXMYULF-UHFFFAOYSA-N 0.000 description 2
- BCMCBBGGLRIHSE-UHFFFAOYSA-N 1,3-benzoxazole Chemical compound C1=CC=C2OC=NC2=C1 BCMCBBGGLRIHSE-UHFFFAOYSA-N 0.000 description 2
- WNXJIVFYUVYPPR-UHFFFAOYSA-N 1,3-dioxolane Chemical compound C1COCO1 WNXJIVFYUVYPPR-UHFFFAOYSA-N 0.000 description 2
- ABADUMLIAZCWJD-UHFFFAOYSA-N 1,3-dioxole Chemical compound C1OC=CO1 ABADUMLIAZCWJD-UHFFFAOYSA-N 0.000 description 2
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 2
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- 125000006017 1-propenyl group Chemical group 0.000 description 2
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 2
- BAXOFTOLAUCFNW-UHFFFAOYSA-N 1H-indazole Chemical compound C1=CC=C2C=NNC2=C1 BAXOFTOLAUCFNW-UHFFFAOYSA-N 0.000 description 2
- AMFYRKOUWBAGHV-UHFFFAOYSA-N 1h-pyrazolo[4,3-b]pyridine Chemical compound C1=CN=C2C=NNC2=C1 AMFYRKOUWBAGHV-UHFFFAOYSA-N 0.000 description 2
- WCXFPLXZZSWROM-UHFFFAOYSA-N 1h-pyrazolo[4,3-c]pyridine Chemical compound C1=NC=C2C=NNC2=C1 WCXFPLXZZSWROM-UHFFFAOYSA-N 0.000 description 2
- WGSMVIHKBMAWRN-UHFFFAOYSA-N 2,3,3a,4-tetrahydro-1-benzofuran Chemical compound C1C=CC=C2OCCC21 WGSMVIHKBMAWRN-UHFFFAOYSA-N 0.000 description 2
- KNBKMDSCOIGXEO-UHFFFAOYSA-N 2,3-dihydroimidazo[1,2-a]pyridine Chemical compound C1=CC=C[C]2[N]CCN21 KNBKMDSCOIGXEO-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- IMSODMZESSGVBE-UHFFFAOYSA-N 2-Oxazoline Chemical compound C1CN=CO1 IMSODMZESSGVBE-UHFFFAOYSA-N 0.000 description 2
- NGNBDVOYPDDBFK-UHFFFAOYSA-N 2-[2,4-di(pentan-2-yl)phenoxy]acetyl chloride Chemical compound CCCC(C)C1=CC=C(OCC(Cl)=O)C(C(C)CCC)=C1 NGNBDVOYPDDBFK-UHFFFAOYSA-N 0.000 description 2
- RDIOQRZEUVKHCR-UHFFFAOYSA-N 2-[4-(1,2-dihydrofuro[2,3-e]imidazo[1,2-a]pyridin-7-ylcarbamoyl)phenyl]-2-methylpropanoic acid Chemical compound C1=CC(C(C)(C(O)=O)C)=CC=C1C(=O)NC1=CN(C2=C(OCC2)C=C2)C2=N1 RDIOQRZEUVKHCR-UHFFFAOYSA-N 0.000 description 2
- FHEYFIGWYQJVDR-ACJLOTCBSA-N 2-[[3-[(2r)-2-[[(2r)-2-(3-chlorophenyl)-2-hydroxyethyl]amino]propyl]-1h-indol-7-yl]oxy]acetic acid Chemical compound C1([C@@H](O)CN[C@@H](CC=2C3=CC=CC(OCC(O)=O)=C3NC=2)C)=CC=CC(Cl)=C1 FHEYFIGWYQJVDR-ACJLOTCBSA-N 0.000 description 2
- 125000006176 2-ethylbutyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(C([H])([H])*)C([H])([H])C([H])([H])[H] 0.000 description 2
- WRMNZCZEMHIOCP-UHFFFAOYSA-N 2-phenylethanol Chemical compound OCCC1=CC=CC=C1 WRMNZCZEMHIOCP-UHFFFAOYSA-N 0.000 description 2
- VSWICNJIUPRZIK-UHFFFAOYSA-N 2-piperideine Chemical compound C1CNC=CC1 VSWICNJIUPRZIK-UHFFFAOYSA-N 0.000 description 2
- MGADZUXDNSDTHW-UHFFFAOYSA-N 2H-pyran Chemical compound C1OC=CC=C1 MGADZUXDNSDTHW-UHFFFAOYSA-N 0.000 description 2
- PCJFEVUKVKQSSL-UHFFFAOYSA-N 2h-1,2,4-oxadiazol-5-one Chemical compound O=C1N=CNO1 PCJFEVUKVKQSSL-UHFFFAOYSA-N 0.000 description 2
- DTXVKPOKPFWSFF-UHFFFAOYSA-N 3(S)-hydroxy-13-cis-eicosenoyl-CoA Chemical compound NC1=CC=C(Cl)N=N1 DTXVKPOKPFWSFF-UHFFFAOYSA-N 0.000 description 2
- HCDMJFOHIXMBOV-UHFFFAOYSA-N 3-(2,6-difluoro-3,5-dimethoxyphenyl)-1-ethyl-8-(morpholin-4-ylmethyl)-4,7-dihydropyrrolo[4,5]pyrido[1,2-d]pyrimidin-2-one Chemical compound C=1C2=C3N(CC)C(=O)N(C=4C(=C(OC)C=C(OC)C=4F)F)CC3=CN=C2NC=1CN1CCOCC1 HCDMJFOHIXMBOV-UHFFFAOYSA-N 0.000 description 2
- 125000003682 3-furyl group Chemical group O1C([H])=C([*])C([H])=C1[H] 0.000 description 2
- UBOOKRVGOBKDMM-UHFFFAOYSA-N 3h-imidazo[4,5-c]pyridine Chemical compound C1=NC=C2NC=NC2=C1 UBOOKRVGOBKDMM-UHFFFAOYSA-N 0.000 description 2
- ATFAVDRBJTXHCT-UHFFFAOYSA-N 4-(1-amino-2-methylpropan-2-yl)-n-(6-chloroimidazo[1,2-a]pyridin-2-yl)benzamide Chemical compound C1=CC(C(C)(CN)C)=CC=C1C(=O)NC1=CN(C=C(Cl)C=C2)C2=N1 ATFAVDRBJTXHCT-UHFFFAOYSA-N 0.000 description 2
- PSOGCRTXEAQODD-UHFFFAOYSA-N 4-(2-cyanopropan-2-yl)benzoyl chloride Chemical compound N#CC(C)(C)C1=CC=C(C(Cl)=O)C=C1 PSOGCRTXEAQODD-UHFFFAOYSA-N 0.000 description 2
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 2
- HSOHHAANNUTZPW-UHFFFAOYSA-N 4-(4-cyano-2-methylbutan-2-yl)-n-(6-iodoimidazo[1,2-a]pyridin-2-yl)benzamide Chemical compound C1=CC(C(C)(CCC#N)C)=CC=C1C(=O)NC1=CN(C=C(I)C=C2)C2=N1 HSOHHAANNUTZPW-UHFFFAOYSA-N 0.000 description 2
- OHIMIUFWPIEZGH-UHFFFAOYSA-N 4-(5-ethoxy-2-methyl-5-oxopentan-2-yl)benzoic acid Chemical compound CCOC(=O)CCC(C)(C)C1=CC=C(C(O)=O)C=C1 OHIMIUFWPIEZGH-UHFFFAOYSA-N 0.000 description 2
- KVCQTKNUUQOELD-UHFFFAOYSA-N 4-amino-n-[1-(3-chloro-2-fluoroanilino)-6-methylisoquinolin-5-yl]thieno[3,2-d]pyrimidine-7-carboxamide Chemical compound N=1C=CC2=C(NC(=O)C=3C4=NC=NC(N)=C4SC=3)C(C)=CC=C2C=1NC1=CC=CC(Cl)=C1F KVCQTKNUUQOELD-UHFFFAOYSA-N 0.000 description 2
- USEDMAWWQDFMFY-UHFFFAOYSA-N 4-cyanobenzoyl chloride Chemical compound ClC(=O)C1=CC=C(C#N)C=C1 USEDMAWWQDFMFY-UHFFFAOYSA-N 0.000 description 2
- DEOBVWIARXAOEC-UHFFFAOYSA-N 4-methyl-n-(5-methylpyridin-2-yl)benzenesulfonamide Chemical compound C1=CC(C)=CC=C1S(=O)(=O)NC1=CC=C(C)C=N1 DEOBVWIARXAOEC-UHFFFAOYSA-N 0.000 description 2
- QKMKMLHBEZRVMT-UHFFFAOYSA-N 4-methyl-n-(6-methylpyridin-2-yl)benzenesulfonamide Chemical compound C1=CC(C)=CC=C1S(=O)(=O)NC1=CC=CC(C)=N1 QKMKMLHBEZRVMT-UHFFFAOYSA-N 0.000 description 2
- XFJJGEIKODBFGJ-UHFFFAOYSA-N 4-methyl-n-quinolin-2-ylbenzenesulfonamide Chemical compound C1=CC(C)=CC=C1S(=O)(=O)NC1=CC=C(C=CC=C2)C2=N1 XFJJGEIKODBFGJ-UHFFFAOYSA-N 0.000 description 2
- VZRKQJNPYFIBCM-UHFFFAOYSA-N 4-tert-butyl-n-(4-tert-butylbenzoyl)-n-(5-methylimidazo[1,2-a]pyridin-2-yl)benzamide Chemical compound C=1N2C(C)=CC=CC2=NC=1N(C(=O)C=1C=CC(=CC=1)C(C)(C)C)C(=O)C1=CC=C(C(C)(C)C)C=C1 VZRKQJNPYFIBCM-UHFFFAOYSA-N 0.000 description 2
- HCPFOHXFZNPPGO-UHFFFAOYSA-N 4-tert-butyl-n-(6-chloro-3-methylimidazo[1,2-b]pyridazin-2-yl)benzamide Chemical compound N1=C2C=CC(Cl)=NN2C(C)=C1NC(=O)C1=CC=C(C(C)(C)C)C=C1 HCPFOHXFZNPPGO-UHFFFAOYSA-N 0.000 description 2
- HAAXAFNSRADSMK-UHFFFAOYSA-N 5-[[4-[2-(5-methyl-2-phenyl-1,3-oxazol-4-yl)ethoxy]-1-benzothiophen-7-yl]methyl]-1,3-thiazolidine-2,4-dione Chemical compound CC=1OC(C=2C=CC=CC=2)=NC=1CCOC(C=1C=CSC=11)=CC=C1CC1SC(=O)NC1=O HAAXAFNSRADSMK-UHFFFAOYSA-N 0.000 description 2
- YAOIHVYZLHGUHK-UHFFFAOYSA-N 5-methylimidazo[1,2-a]pyridin-2-amine Chemical compound CC1=CC=CC2=NC(N)=CN12 YAOIHVYZLHGUHK-UHFFFAOYSA-N 0.000 description 2
- RXQZLSRIOOYKLF-UHFFFAOYSA-N 5H-pyrazolo[4,3-d]triazine Chemical compound N1=NN=C2C=NNC2=C1 RXQZLSRIOOYKLF-UHFFFAOYSA-N 0.000 description 2
- QFRBJDYEGSCHIP-UHFFFAOYSA-N 6-[3-[[3-(trifluoromethyl)benzoyl]amino]phenoxy]imidazo[1,2-b]pyridazine-2-carboxylic acid Chemical compound C1=CC2=NC(C(=O)O)=CN2N=C1OC(C=1)=CC=CC=1NC(=O)C1=CC=CC(C(F)(F)F)=C1 QFRBJDYEGSCHIP-UHFFFAOYSA-N 0.000 description 2
- LAUJNLOJYLUKCP-UHFFFAOYSA-N 6-bromoimidazo[1,2-a]pyridin-2-amine Chemical compound C1=C(Br)C=CC2=NC(N)=CN21 LAUJNLOJYLUKCP-UHFFFAOYSA-N 0.000 description 2
- BXJSRZOMPUKDET-UHFFFAOYSA-N 6-chloro-3-methylimidazo[1,2-b]pyridazin-2-amine Chemical compound C1=CC(Cl)=NN2C(C)=C(N)N=C21 BXJSRZOMPUKDET-UHFFFAOYSA-N 0.000 description 2
- RQAJYYNVORRHHY-UHFFFAOYSA-N 6-fluoroimidazo[1,2-a]pyridin-2-amine Chemical compound C1=C(F)C=CC2=NC(N)=CN21 RQAJYYNVORRHHY-UHFFFAOYSA-N 0.000 description 2
- GKDWHNMQINVMGP-UHFFFAOYSA-N 6-methylimidazo[1,2-a]pyridin-2-amine Chemical compound C1=C(C)C=CC2=NC(N)=CN21 GKDWHNMQINVMGP-UHFFFAOYSA-N 0.000 description 2
- ULCWGSAOOXZHSK-UHFFFAOYSA-N 6-phenylimidazo[1,2-b]pyridazin-2-amine Chemical compound C1=CC2=NC(N)=CN2N=C1C1=CC=CC=C1 ULCWGSAOOXZHSK-UHFFFAOYSA-N 0.000 description 2
- HNAWYTYCAQSNID-UHFFFAOYSA-N 6-tert-butyl-n-(1,2-dihydrofuro[2,3-e]imidazo[1,2-a]pyridin-7-yl)nicotinamide Chemical compound C1=NC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C2=C(OCC2)C=C2)C2=N1 HNAWYTYCAQSNID-UHFFFAOYSA-N 0.000 description 2
- 244000215068 Acacia senegal Species 0.000 description 2
- 241000251169 Alopias vulpinus Species 0.000 description 2
- 229940077274 Alpha glucosidase inhibitor Drugs 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 125000005914 C6-C14 aryloxy group Chemical group 0.000 description 2
- 206010006895 Cachexia Diseases 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 2
- 241000282693 Cercopithecidae Species 0.000 description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 2
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 2
- OKKJLVBELUTLKV-MZCSYVLQSA-N Deuterated methanol Chemical compound [2H]OC([2H])([2H])[2H] OKKJLVBELUTLKV-MZCSYVLQSA-N 0.000 description 2
- 229920001353 Dextrin Polymers 0.000 description 2
- 239000004375 Dextrin Substances 0.000 description 2
- 208000007342 Diabetic Nephropathies Diseases 0.000 description 2
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 2
- ROSDSFDQCJNGOL-UHFFFAOYSA-N Dimethylamine Chemical compound CNC ROSDSFDQCJNGOL-UHFFFAOYSA-N 0.000 description 2
- QXNVGIXVLWOKEQ-UHFFFAOYSA-N Disodium Chemical compound [Na][Na] QXNVGIXVLWOKEQ-UHFFFAOYSA-N 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- 208000010228 Erectile Dysfunction Diseases 0.000 description 2
- 108010011459 Exenatide Proteins 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- 229920000084 Gum arabic Polymers 0.000 description 2
- 206010019280 Heart failures Diseases 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 2
- WRYCSMQKUKOKBP-UHFFFAOYSA-N Imidazolidine Chemical compound C1CNCN1 WRYCSMQKUKOKBP-UHFFFAOYSA-N 0.000 description 2
- 229940122199 Insulin secretagogue Drugs 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 102000016267 Leptin Human genes 0.000 description 2
- 108010092277 Leptin Proteins 0.000 description 2
- 239000002841 Lewis acid Substances 0.000 description 2
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 2
- 229920000881 Modified starch Polymers 0.000 description 2
- IRLWJILLXJGJTD-UHFFFAOYSA-N Muraglitazar Chemical compound C1=CC(OC)=CC=C1OC(=O)N(CC(O)=O)CC(C=C1)=CC=C1OCCC1=C(C)OC(C=2C=CC=CC=2)=N1 IRLWJILLXJGJTD-UHFFFAOYSA-N 0.000 description 2
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 2
- OKJHGOPITGTTIM-DEOSSOPVSA-N Naveglitazar Chemical compound C1=CC(C[C@H](OC)C(O)=O)=CC=C1OCCCOC(C=C1)=CC=C1OC1=CC=CC=C1 OKJHGOPITGTTIM-DEOSSOPVSA-N 0.000 description 2
- 206010028980 Neoplasm Diseases 0.000 description 2
- 108010025020 Nerve Growth Factor Proteins 0.000 description 2
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 2
- 241000283973 Oryctolagus cuniculus Species 0.000 description 2
- 208000001132 Osteoporosis Diseases 0.000 description 2
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 2
- WYNCHZVNFNFDNH-UHFFFAOYSA-N Oxazolidine Chemical compound C1COCN1 WYNCHZVNFNFDNH-UHFFFAOYSA-N 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 229940122907 Phosphatase inhibitor Drugs 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 239000004373 Pullulan Substances 0.000 description 2
- 229920001218 Pullulan Polymers 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- IIDJRNMFWXDHID-UHFFFAOYSA-N Risedronic acid Chemical compound OP(=O)(O)C(P(O)(O)=O)(O)CC1=CC=CN=C1 IIDJRNMFWXDHID-UHFFFAOYSA-N 0.000 description 2
- YASAKCUCGLMORW-UHFFFAOYSA-N Rosiglitazone Chemical compound C=1C=CC=NC=1N(C)CCOC(C=C1)=CC=C1CC1SC(=O)NC1=O YASAKCUCGLMORW-UHFFFAOYSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 2
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 2
- 108090000373 Tissue Plasminogen Activator Proteins 0.000 description 2
- 102000003978 Tissue Plasminogen Activator Human genes 0.000 description 2
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 2
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 2
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 2
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 2
- 206010046543 Urinary incontinence Diseases 0.000 description 2
- 208000036142 Viral infection Diseases 0.000 description 2
- 239000000205 acacia gum Substances 0.000 description 2
- 235000010489 acacia gum Nutrition 0.000 description 2
- 125000004054 acenaphthylenyl group Chemical group C1(=CC2=CC=CC3=CC=CC1=C23)* 0.000 description 2
- PMZXXNPJQYDFJX-UHFFFAOYSA-N acetonitrile;2,2,2-trifluoroacetic acid Chemical compound CC#N.OC(=O)C(F)(F)F PMZXXNPJQYDFJX-UHFFFAOYSA-N 0.000 description 2
- WETWJCDKMRHUPV-UHFFFAOYSA-N acetyl chloride Chemical compound CC(Cl)=O WETWJCDKMRHUPV-UHFFFAOYSA-N 0.000 description 2
- 239000012346 acetyl chloride Substances 0.000 description 2
- 238000005903 acid hydrolysis reaction Methods 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- ORILYTVJVMAKLC-UHFFFAOYSA-N adamantane Chemical compound C1C(C2)CC3CC1CC2C3 ORILYTVJVMAKLC-UHFFFAOYSA-N 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 125000005196 alkyl carbonyloxy group Chemical group 0.000 description 2
- 125000004414 alkyl thio group Chemical group 0.000 description 2
- 239000003888 alpha glucosidase inhibitor Substances 0.000 description 2
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 2
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 2
- 229910021529 ammonia Inorganic materials 0.000 description 2
- 235000011114 ammonium hydroxide Nutrition 0.000 description 2
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 2
- 239000003146 anticoagulant agent Substances 0.000 description 2
- 229940125710 antiobesity agent Drugs 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- 235000006708 antioxidants Nutrition 0.000 description 2
- 229960004676 antithrombotic agent Drugs 0.000 description 2
- 125000005099 aryl alkyl carbonyl group Chemical group 0.000 description 2
- 125000002102 aryl alkyloxo group Chemical group 0.000 description 2
- 125000005110 aryl thio group Chemical group 0.000 description 2
- ZSIQJIWKELUFRJ-UHFFFAOYSA-N azepane Chemical compound C1CCCNCC1 ZSIQJIWKELUFRJ-UHFFFAOYSA-N 0.000 description 2
- RFRXIWQYSOIBDI-UHFFFAOYSA-N benzarone Chemical compound CCC=1OC2=CC=CC=C2C=1C(=O)C1=CC=C(O)C=C1 RFRXIWQYSOIBDI-UHFFFAOYSA-N 0.000 description 2
- MTZQAGJQAFMTAQ-UHFFFAOYSA-N benzoic acid ethyl ester Natural products CCOC(=O)C1=CC=CC=C1 MTZQAGJQAFMTAQ-UHFFFAOYSA-N 0.000 description 2
- SESFRYSPDFLNCH-UHFFFAOYSA-N benzyl benzoate Chemical compound C=1C=CC=CC=1C(=O)OCC1=CC=CC=C1 SESFRYSPDFLNCH-UHFFFAOYSA-N 0.000 description 2
- WGQKYBSKWIADBV-UHFFFAOYSA-N benzylamine Chemical compound NCC1=CC=CC=C1 WGQKYBSKWIADBV-UHFFFAOYSA-N 0.000 description 2
- 125000000051 benzyloxy group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])O* 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- ILAHWRKJUDSMFH-UHFFFAOYSA-N boron tribromide Chemical compound BrB(Br)Br ILAHWRKJUDSMFH-UHFFFAOYSA-N 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 244000309464 bull Species 0.000 description 2
- 201000011510 cancer Diseases 0.000 description 2
- LEMUFSYUPGXXCM-JNEQYSBXSA-N caninsulin Chemical compound [Zn].C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@H]1CSSC[C@H]2C(=O)N[C@H](C(=O)N[C@@H](CO)C(=O)N[C@H](C(=O)N[C@H](C(N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=3C=CC(O)=CC=3)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC3N=CN=C3)NC(=O)[C@H](CO)NC(=O)CNC1=O)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)O)C(O)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O)=O)CSSC[C@@H](C(N2)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](NC(=O)CN)[C@@H](C)CC)[C@@H](C)CC)[C@@H](C)O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CC=1C=CC=CC=1)C(C)C)C1C=NC=N1 LEMUFSYUPGXXCM-JNEQYSBXSA-N 0.000 description 2
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 2
- 125000002057 carboxymethyl group Chemical group [H]OC(=O)C([H])([H])[*] 0.000 description 2
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 2
- 229940105329 carboxymethylcellulose Drugs 0.000 description 2
- UCAGLBKTLXCODC-UHFFFAOYSA-N carzenide Chemical compound NS(=O)(=O)C1=CC=C(C(O)=O)C=C1 UCAGLBKTLXCODC-UHFFFAOYSA-N 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 208000026106 cerebrovascular disease Diseases 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- QZHPTGXQGDFGEN-UHFFFAOYSA-N chromene Chemical compound C1=CC=C2C=C[CH]OC2=C1 QZHPTGXQGDFGEN-UHFFFAOYSA-N 0.000 description 2
- RRGUKTPIGVIEKM-UHFFFAOYSA-N cilostazol Chemical compound C=1C=C2NC(=O)CCC2=CC=1OCCCCC1=NN=NN1C1CCCCC1 RRGUKTPIGVIEKM-UHFFFAOYSA-N 0.000 description 2
- 229960004588 cilostazol Drugs 0.000 description 2
- 239000003086 colorant Substances 0.000 description 2
- 238000004440 column chromatography Methods 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- 150000001925 cycloalkenes Chemical class 0.000 description 2
- HGCIXCUEYOPUTN-UHFFFAOYSA-N cyclohexene Chemical compound C1CCC=CC1 HGCIXCUEYOPUTN-UHFFFAOYSA-N 0.000 description 2
- LPIQUOYDBNQMRZ-UHFFFAOYSA-N cyclopentene Chemical compound C1CC=CC1 LPIQUOYDBNQMRZ-UHFFFAOYSA-N 0.000 description 2
- 125000006638 cyclopentyl carbonyl group Chemical group 0.000 description 2
- 230000016396 cytokine production Effects 0.000 description 2
- 229940127089 cytotoxic agent Drugs 0.000 description 2
- 239000003405 delayed action preparation Substances 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 235000019425 dextrin Nutrition 0.000 description 2
- 208000033679 diabetic kidney disease Diseases 0.000 description 2
- 230000004069 differentiation Effects 0.000 description 2
- 125000000118 dimethyl group Chemical group [H]C([H])([H])* 0.000 description 2
- 125000005879 dioxolanyl group Chemical group 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- 239000007884 disintegrant Substances 0.000 description 2
- 208000035475 disorder Diseases 0.000 description 2
- 239000002934 diuretic Substances 0.000 description 2
- ADEBPBSSDYVVLD-UHFFFAOYSA-N donepezil Chemical compound O=C1C=2C=C(OC)C(OC)=CC=2CC1CC(CC1)CCN1CC1=CC=CC=C1 ADEBPBSSDYVVLD-UHFFFAOYSA-N 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 206010013990 dysuria Diseases 0.000 description 2
- 208000030172 endocrine system disease Diseases 0.000 description 2
- DQYBDCGIPTYXML-UHFFFAOYSA-N ethoxyethane;hydrate Chemical compound O.CCOCC DQYBDCGIPTYXML-UHFFFAOYSA-N 0.000 description 2
- SSQPWTVBQMWLSZ-AAQCHOMXSA-N ethyl (5Z,8Z,11Z,14Z,17Z)-icosapentaenoate Chemical compound CCOC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CC SSQPWTVBQMWLSZ-AAQCHOMXSA-N 0.000 description 2
- RSUJESQLWXFVIQ-UHFFFAOYSA-N ethyl 3-methyl-3-(4-methylphenyl)butanoate Chemical compound CCOC(=O)CC(C)(C)C1=CC=C(C)C=C1 RSUJESQLWXFVIQ-UHFFFAOYSA-N 0.000 description 2
- GQUXKURSWGLMJL-UHFFFAOYSA-N ethyl 6-(3-aminophenoxy)imidazo[1,2-b]pyridazine-2-carboxylate Chemical compound C1=CC2=NC(C(=O)OCC)=CN2N=C1OC1=CC=CC(N)=C1 GQUXKURSWGLMJL-UHFFFAOYSA-N 0.000 description 2
- 235000003599 food sweetener Nutrition 0.000 description 2
- CYEFKCRAAGLNHW-UHFFFAOYSA-N furan-3-ylboronic acid Chemical compound OB(O)C=1C=COC=1 CYEFKCRAAGLNHW-UHFFFAOYSA-N 0.000 description 2
- ASUTZQLVASHGKV-JDFRZJQESA-N galanthamine Chemical compound O1C(=C23)C(OC)=CC=C2CN(C)CC[C@]23[C@@H]1C[C@@H](O)C=C2 ASUTZQLVASHGKV-JDFRZJQESA-N 0.000 description 2
- 210000004211 gastric acid Anatomy 0.000 description 2
- 238000010353 genetic engineering Methods 0.000 description 2
- LEQAOMBKQFMDFZ-UHFFFAOYSA-N glyoxal Chemical compound O=CC=O LEQAOMBKQFMDFZ-UHFFFAOYSA-N 0.000 description 2
- 150000004820 halides Chemical class 0.000 description 2
- 208000014951 hematologic disease Diseases 0.000 description 2
- 229920000669 heparin Polymers 0.000 description 2
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 2
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 2
- 229960002600 icosapent ethyl Drugs 0.000 description 2
- MSLLWNIMUNLJEE-UHFFFAOYSA-N imidazo[1,2-a]quinolin-2-amine Chemical compound C1=CC=C2N3C=C(N)N=C3C=CC2=C1 MSLLWNIMUNLJEE-UHFFFAOYSA-N 0.000 description 2
- MTNDZQHUAFNZQY-UHFFFAOYSA-N imidazoline Chemical compound C1CN=CN1 MTNDZQHUAFNZQY-UHFFFAOYSA-N 0.000 description 2
- 239000002955 immunomodulating agent Substances 0.000 description 2
- 201000001881 impotence Diseases 0.000 description 2
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 2
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 2
- LPAGFVYQRIESJQ-UHFFFAOYSA-N indoline Chemical compound C1=CC=C2NCCC2=C1 LPAGFVYQRIESJQ-UHFFFAOYSA-N 0.000 description 2
- CGIGDMFJXJATDK-UHFFFAOYSA-N indomethacin Chemical compound CC1=C(CC(O)=O)C2=CC(OC)=CC=C2N1C(=O)C1=CC=C(Cl)C=C1 CGIGDMFJXJATDK-UHFFFAOYSA-N 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000002198 insoluble material Substances 0.000 description 2
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 2
- KQNPFQTWMSNSAP-UHFFFAOYSA-M isobutyrate Chemical compound CC(C)C([O-])=O KQNPFQTWMSNSAP-UHFFFAOYSA-M 0.000 description 2
- ZRKSVHFXTRFQFL-UHFFFAOYSA-N isocyanomethane Chemical compound C[N+]#[C-] ZRKSVHFXTRFQFL-UHFFFAOYSA-N 0.000 description 2
- 125000004491 isohexyl group Chemical group C(CCC(C)C)* 0.000 description 2
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 2
- ZLTPDFXIESTBQG-UHFFFAOYSA-N isothiazole Chemical compound C=1C=NSC=1 ZLTPDFXIESTBQG-UHFFFAOYSA-N 0.000 description 2
- 239000007951 isotonicity adjuster Substances 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- NRYBAZVQPHGZNS-ZSOCWYAHSA-N leptin Chemical compound O=C([C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CC(C)C)CCSC)N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](CS)C(O)=O NRYBAZVQPHGZNS-ZSOCWYAHSA-N 0.000 description 2
- 229940039781 leptin Drugs 0.000 description 2
- 150000007517 lewis acids Chemical class 0.000 description 2
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 2
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 2
- 201000007270 liver cancer Diseases 0.000 description 2
- 208000014018 liver neoplasm Diseases 0.000 description 2
- 229940031703 low substituted hydroxypropyl cellulose Drugs 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 2
- 235000019341 magnesium sulphate Nutrition 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- 230000004060 metabolic process Effects 0.000 description 2
- 229940098779 methanesulfonic acid Drugs 0.000 description 2
- VDKNOCBCIJGIOC-UHFFFAOYSA-N methyl 1-(4-methylphenyl)cyclopropane-1-carboxylate Chemical compound C=1C=C(C)C=CC=1C1(C(=O)OC)CC1 VDKNOCBCIJGIOC-UHFFFAOYSA-N 0.000 description 2
- RMNYVJFOGIGKEE-UHFFFAOYSA-N methyl 2-[4-(1,2-dihydrofuro[2,3-e]imidazo[1,2-a]pyridin-7-ylcarbamoyl)phenyl]-2-methylpropanoate Chemical compound C1=CC(C(C)(C)C(=O)OC)=CC=C1C(=O)NC1=CN(C2=C(OCC2)C=C2)C2=N1 RMNYVJFOGIGKEE-UHFFFAOYSA-N 0.000 description 2
- KWTKKNWUQMGIHL-UHFFFAOYSA-N methyl 2-methyl-2-[4-[(6-methylimidazo[1,2-a]pyridin-2-yl)carbamoyl]phenyl]propanoate Chemical compound C1=CC(C(C)(C)C(=O)OC)=CC=C1C(=O)NC1=CN(C=C(C)C=C2)C2=N1 KWTKKNWUQMGIHL-UHFFFAOYSA-N 0.000 description 2
- 229920000609 methyl cellulose Polymers 0.000 description 2
- 239000001923 methylcellulose Substances 0.000 description 2
- 235000010981 methylcellulose Nutrition 0.000 description 2
- 125000006216 methylsulfinyl group Chemical group [H]C([H])([H])S(*)=O 0.000 description 2
- 239000003094 microcapsule Substances 0.000 description 2
- 230000027939 micturition Effects 0.000 description 2
- 150000007522 mineralic acids Chemical class 0.000 description 2
- 201000006417 multiple sclerosis Diseases 0.000 description 2
- FVNSMZWARZYAAL-UHFFFAOYSA-N n-(2,3-dihydrofuro[3,2-b]pyridin-5-yl)-4-methylbenzenesulfonamide Chemical compound C1=CC(C)=CC=C1S(=O)(=O)NC1=CC=C(OCC2)C2=N1 FVNSMZWARZYAAL-UHFFFAOYSA-N 0.000 description 2
- QBIVFIWHPIAKEY-UHFFFAOYSA-N n-(5-fluoropyridin-2-yl)-4-methylbenzenesulfonamide Chemical compound C1=CC(C)=CC=C1S(=O)(=O)NC1=CC=C(F)C=N1 QBIVFIWHPIAKEY-UHFFFAOYSA-N 0.000 description 2
- MSMMZGHSTURHGH-UHFFFAOYSA-N n-(6-chloroimidazo[1,2-a]pyridin-2-yl)-4-sulfamoylbenzamide Chemical compound C1=CC(S(=O)(=O)N)=CC=C1C(=O)NC1=CN(C=C(Cl)C=C2)C2=N1 MSMMZGHSTURHGH-UHFFFAOYSA-N 0.000 description 2
- FPWWTEMQIYEEQX-UHFFFAOYSA-N n-(6-chloropyridazin-3-yl)-4-methylbenzenesulfonamide Chemical compound C1=CC(C)=CC=C1S(=O)(=O)NC1=CC=C(Cl)N=N1 FPWWTEMQIYEEQX-UHFFFAOYSA-N 0.000 description 2
- YOAAYGZVKQQJKV-UHFFFAOYSA-N n-(6-iodoimidazo[1,2-b]pyridazin-2-yl)acetamide Chemical compound N1=C(I)C=CC2=NC(NC(=O)C)=CN21 YOAAYGZVKQQJKV-UHFFFAOYSA-N 0.000 description 2
- HTQRPHGYFNJROW-UHFFFAOYSA-N n-[3-(2-acetamidoimidazo[1,2-b]pyridazin-6-yl)oxyphenyl]-3-(1-cyanocyclopropyl)benzamide Chemical compound C1=CC2=NC(NC(=O)C)=CN2N=C1OC(C=1)=CC=CC=1NC(=O)C(C=1)=CC=CC=1C1(C#N)CC1 HTQRPHGYFNJROW-UHFFFAOYSA-N 0.000 description 2
- CRTHIBLODQGAFV-UHFFFAOYSA-N n-[3-(2-acetamidoimidazo[1,2-b]pyridazin-6-yl)oxyphenyl]cyclopropanecarboxamide Chemical compound C1=CC2=NC(NC(=O)C)=CN2N=C1OC(C=1)=CC=CC=1NC(=O)C1CC1 CRTHIBLODQGAFV-UHFFFAOYSA-N 0.000 description 2
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- OELFLUMRDSZNSF-BRWVUGGUSA-N nateglinide Chemical compound C1C[C@@H](C(C)C)CC[C@@H]1C(=O)N[C@@H](C(O)=O)CC1=CC=CC=C1 OELFLUMRDSZNSF-BRWVUGGUSA-N 0.000 description 2
- 229960000698 nateglinide Drugs 0.000 description 2
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 210000005036 nerve Anatomy 0.000 description 2
- 230000004770 neurodegeneration Effects 0.000 description 2
- 208000015122 neurodegenerative disease Diseases 0.000 description 2
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- WCPAKWJPBJAGKN-UHFFFAOYSA-N oxadiazole Chemical compound C1=CON=N1 WCPAKWJPBJAGKN-UHFFFAOYSA-N 0.000 description 2
- 230000036542 oxidative stress Effects 0.000 description 2
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 2
- 125000003538 pentan-3-yl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- YNPNZTXNASCQKK-UHFFFAOYSA-N phenanthrene Chemical compound C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 description 2
- DHHVAGZRUROJKS-UHFFFAOYSA-N phentermine Chemical compound CC(C)(N)CC1=CC=CC=C1 DHHVAGZRUROJKS-UHFFFAOYSA-N 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- XHXFXVLFKHQFAL-UHFFFAOYSA-N phosphoryl trichloride Chemical compound ClP(Cl)(Cl)=O XHXFXVLFKHQFAL-UHFFFAOYSA-N 0.000 description 2
- 230000004962 physiological condition Effects 0.000 description 2
- HYAFETHFCAUJAY-UHFFFAOYSA-N pioglitazone Chemical compound N1=CC(CC)=CC=C1CCOC(C=C1)=CC=C1CC1C(=O)NC(=O)S1 HYAFETHFCAUJAY-UHFFFAOYSA-N 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 108010040003 polyglutamine Proteins 0.000 description 2
- 229920000155 polyglutamine Polymers 0.000 description 2
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 2
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 2
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 2
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 2
- 238000002953 preparative HPLC Methods 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 230000003449 preventive effect Effects 0.000 description 2
- WYVAMUWZEOHJOQ-UHFFFAOYSA-N propionic anhydride Chemical compound CCC(=O)OC(=O)CC WYVAMUWZEOHJOQ-UHFFFAOYSA-N 0.000 description 2
- 235000018102 proteins Nutrition 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- 235000019423 pullulan Nutrition 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- DNXIASIHZYFFRO-UHFFFAOYSA-N pyrazoline Chemical compound C1CN=NC1 DNXIASIHZYFFRO-UHFFFAOYSA-N 0.000 description 2
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical compound C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 2
- ABMYEXAYWZJVOV-UHFFFAOYSA-N pyridin-3-ylboronic acid Chemical compound OB(O)C1=CC=CN=C1 ABMYEXAYWZJVOV-UHFFFAOYSA-N 0.000 description 2
- NHZMQXZHNVQTQA-UHFFFAOYSA-N pyridoxamine Chemical compound CC1=NC=C(CO)C(CN)=C1O NHZMQXZHNVQTQA-UHFFFAOYSA-N 0.000 description 2
- JWVCLYRUEFBMGU-UHFFFAOYSA-N quinazoline Chemical compound N1=CN=CC2=CC=CC=C21 JWVCLYRUEFBMGU-UHFFFAOYSA-N 0.000 description 2
- 229940089617 risedronate Drugs 0.000 description 2
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 230000019491 signal transduction Effects 0.000 description 2
- 239000000741 silica gel Substances 0.000 description 2
- 229910002027 silica gel Inorganic materials 0.000 description 2
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 2
- 235000012239 silicon dioxide Nutrition 0.000 description 2
- 239000000779 smoke Substances 0.000 description 2
- 159000000000 sodium salts Chemical class 0.000 description 2
- 229960002920 sorbitol Drugs 0.000 description 2
- 229940033331 soy sterol Drugs 0.000 description 2
- YROXIXLRRCOBKF-UHFFFAOYSA-N sulfonylurea Chemical class OC(=N)N=S(=O)=O YROXIXLRRCOBKF-UHFFFAOYSA-N 0.000 description 2
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 2
- 239000000375 suspending agent Substances 0.000 description 2
- 239000003765 sweetening agent Substances 0.000 description 2
- RMMXLENWKUUMAY-UHFFFAOYSA-N telmisartan Chemical compound CCCC1=NC2=C(C)C=C(C=3N(C4=CC=CC=C4N=3)C)C=C2N1CC(C=C1)=CC=C1C1=CC=CC=C1C(O)=O RMMXLENWKUUMAY-UHFFFAOYSA-N 0.000 description 2
- TYJHIPSRWRAUER-UHFFFAOYSA-N tert-butyl n-[6-[3-[[3-(trifluoromethyl)benzoyl]amino]phenoxy]imidazo[1,2-b]pyridazin-2-yl]carbamate Chemical compound C1=CC2=NC(NC(=O)OC(C)(C)C)=CN2N=C1OC(C=1)=CC=CC=1NC(=O)C1=CC=CC(C(F)(F)F)=C1 TYJHIPSRWRAUER-UHFFFAOYSA-N 0.000 description 2
- 125000001973 tert-pentyl group Chemical group [H]C([H])([H])C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- CXGTZJYQWSUFET-IBGZPJMESA-N tesaglitazar Chemical compound C1=CC(C[C@H](OCC)C(O)=O)=CC=C1OCCC1=CC=C(OS(C)(=O)=O)C=C1 CXGTZJYQWSUFET-IBGZPJMESA-N 0.000 description 2
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 2
- 125000001984 thiazolidinyl group Chemical group 0.000 description 2
- CBDKQYKMCICBOF-UHFFFAOYSA-N thiazoline Chemical compound C1CN=CS1 CBDKQYKMCICBOF-UHFFFAOYSA-N 0.000 description 2
- BRNULMACUQOKMR-UHFFFAOYSA-N thiomorpholine Chemical compound C1CSCCN1 BRNULMACUQOKMR-UHFFFAOYSA-N 0.000 description 2
- IBBLKSWSCDAPIF-UHFFFAOYSA-N thiopyran Chemical compound S1C=CC=C=C1 IBBLKSWSCDAPIF-UHFFFAOYSA-N 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 125000005147 toluenesulfonyl group Chemical group C=1(C(=CC=CC1)S(=O)(=O)*)C 0.000 description 2
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 2
- BWHDROKFUHTORW-UHFFFAOYSA-N tritert-butylphosphane Chemical compound CC(C)(C)P(C(C)(C)C)C(C)(C)C BWHDROKFUHTORW-UHFFFAOYSA-N 0.000 description 2
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 2
- 230000009385 viral infection Effects 0.000 description 2
- GNLJBJNONOOOQC-UHFFFAOYSA-N $l^{3}-carbane;magnesium Chemical compound [Mg]C GNLJBJNONOOOQC-UHFFFAOYSA-N 0.000 description 1
- DBGIVFWFUFKIQN-VIFPVBQESA-N (+)-Fenfluramine Chemical compound CCN[C@@H](C)CC1=CC=CC(C(F)(F)F)=C1 DBGIVFWFUFKIQN-VIFPVBQESA-N 0.000 description 1
- DBGIVFWFUFKIQN-UHFFFAOYSA-N (+-)-Fenfluramine Chemical compound CCNC(C)CC1=CC=CC(C(F)(F)F)=C1 DBGIVFWFUFKIQN-UHFFFAOYSA-N 0.000 description 1
- PROQIPRRNZUXQM-UHFFFAOYSA-N (16alpha,17betaOH)-Estra-1,3,5(10)-triene-3,16,17-triol Natural products OC1=CC=C2C3CCC(C)(C(C(O)C4)O)C4C3CCC2=C1 PROQIPRRNZUXQM-UHFFFAOYSA-N 0.000 description 1
- FTLYMKDSHNWQKD-UHFFFAOYSA-N (2,4,5-trichlorophenyl)boronic acid Chemical compound OB(O)C1=CC(Cl)=C(Cl)C=C1Cl FTLYMKDSHNWQKD-UHFFFAOYSA-N 0.000 description 1
- XUFXOAAUWZOOIT-SXARVLRPSA-N (2R,3R,4R,5S,6R)-5-[[(2R,3R,4R,5S,6R)-5-[[(2R,3R,4S,5S,6R)-3,4-dihydroxy-6-methyl-5-[[(1S,4R,5S,6S)-4,5,6-trihydroxy-3-(hydroxymethyl)-1-cyclohex-2-enyl]amino]-2-oxanyl]oxy]-3,4-dihydroxy-6-(hydroxymethyl)-2-oxanyl]oxy]-6-(hydroxymethyl)oxane-2,3,4-triol Chemical compound O([C@H]1O[C@H](CO)[C@H]([C@@H]([C@H]1O)O)O[C@H]1O[C@@H]([C@H]([C@H](O)[C@H]1O)N[C@@H]1[C@@H]([C@@H](O)[C@H](O)C(CO)=C1)O)C)[C@@H]1[C@@H](CO)O[C@@H](O)[C@H](O)[C@H]1O XUFXOAAUWZOOIT-SXARVLRPSA-N 0.000 description 1
- VXEVKSKAINMPFG-QWUNSSNDSA-N (2S)-5-[[(5S)-5-[[(2S)-2-[[(2S)-2-[[(2S)-5-amino-2-[[2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S,3R)-2-[[(2S)-2-[[(2S,3R)-2-[[2-[[(2S)-2-[[(2S)-2-[[(2S)-2-amino-3-(1H-imidazol-4-yl)propanoyl]amino]propanoyl]amino]-4-carboxybutanoyl]amino]acetyl]amino]-3-hydroxybutanoyl]amino]-3-phenylpropanoyl]amino]-3-hydroxybutanoyl]amino]-3-hydroxypropanoyl]amino]-3-carboxypropanoyl]amino]-3-methylbutanoyl]amino]-3-hydroxypropanoyl]amino]-3-hydroxypropanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-methylpentanoyl]amino]-4-carboxybutanoyl]amino]acetyl]amino]-5-oxopentanoyl]amino]propanoyl]amino]propanoyl]amino]-6-[[(2S)-4-carboxy-1-[[(2S)-1-[[(2S,3S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[2-[[(2S)-1-(carboxymethylamino)-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-2-oxoethyl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-3-(1H-indol-3-yl)-1-oxopropan-2-yl]amino]-1-oxopropan-2-yl]amino]-3-methyl-1-oxopentan-2-yl]amino]-1-oxo-3-phenylpropan-2-yl]amino]-1-oxobutan-2-yl]amino]-6-oxohexyl]amino]-2-(hexadecanoylamino)-5-hydroxypentanoic acid Chemical compound CCCCCCCCCCCCCCCC(=O)N[C@@H](CCC(NCCCC[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(=O)N[C@@H](CC2=CNC3=CC=CC=C32)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)NCC(=O)N[C@@H](CCCN=C(N)N)C(=O)NCC(=O)O)NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(=O)N)NC(=O)CNC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC4=CC=C(C=C4)O)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC5=CC=CC=C5)NC(=O)[C@H]([C@@H](C)O)NC(=O)CNC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](C)NC(=O)[C@H](CC6=CNC=N6)N)O)C(=O)O VXEVKSKAINMPFG-QWUNSSNDSA-N 0.000 description 1
- VLPIATFUUWWMKC-SNVBAGLBSA-N (2r)-1-(2,6-dimethylphenoxy)propan-2-amine Chemical compound C[C@@H](N)COC1=C(C)C=CC=C1C VLPIATFUUWWMKC-SNVBAGLBSA-N 0.000 description 1
- WDQLRUYAYXDIFW-RWKIJVEZSA-N (2r,3r,4s,5r,6r)-4-[(2s,3r,4s,5r,6r)-3,5-dihydroxy-4-[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-6-[[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxymethyl]oxan-2-yl]oxy-6-(hydroxymethyl)oxane-2,3,5-triol Chemical compound O[C@@H]1[C@@H](CO)O[C@@H](O)[C@H](O)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)[C@H](O)[C@@H](CO[C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)O1 WDQLRUYAYXDIFW-RWKIJVEZSA-N 0.000 description 1
- ZXEIEKDGPVTZLD-NDEPHWFRSA-N (2s)-2-dodecylsulfanyl-n-(4-hydroxy-2,3,5-trimethylphenyl)-2-phenylacetamide Chemical compound O=C([C@@H](SCCCCCCCCCCCC)C=1C=CC=CC=1)NC1=CC(C)=C(O)C(C)=C1C ZXEIEKDGPVTZLD-NDEPHWFRSA-N 0.000 description 1
- WMUIIGVAWPWQAW-DEOSSOPVSA-N (2s)-2-ethoxy-3-{4-[2-(10h-phenoxazin-10-yl)ethoxy]phenyl}propanoic acid Chemical compound C1=CC(C[C@H](OCC)C(O)=O)=CC=C1OCCN1C2=CC=CC=C2OC2=CC=CC=C21 WMUIIGVAWPWQAW-DEOSSOPVSA-N 0.000 description 1
- KWSPYUOBNIMILB-SANMLTNESA-N (2s)-2-methyl-3-[4-[2-(5-methyl-2-thiophen-2-yl-1,3-oxazol-4-yl)ethoxy]phenyl]-2-phenoxypropanoic acid Chemical compound O([C@@](C)(CC1=CC=C(C=C1)OCCC=1N=C(OC=1C)C=1SC=CC=1)C(O)=O)C1=CC=CC=C1 KWSPYUOBNIMILB-SANMLTNESA-N 0.000 description 1
- ZGGHKIMDNBDHJB-NRFPMOEYSA-M (3R,5S)-fluvastatin sodium Chemical compound [Na+].C12=CC=CC=C2N(C(C)C)C(\C=C\[C@@H](O)C[C@@H](O)CC([O-])=O)=C1C1=CC=C(F)C=C1 ZGGHKIMDNBDHJB-NRFPMOEYSA-M 0.000 description 1
- GQPYTJVDPQTBQC-KLQYNRQASA-N (3r)-3-amino-1-[3-(trifluoromethyl)-6,8-dihydro-5h-[1,2,4]triazolo[4,3-a]pyrazin-7-yl]-4-(2,4,5-trifluorophenyl)butan-1-one;phosphoric acid;hydrate Chemical compound O.OP(O)(O)=O.C([C@H](CC(=O)N1CC=2N(C(=NN=2)C(F)(F)F)CC1)N)C1=CC(F)=C(F)C=C1F GQPYTJVDPQTBQC-KLQYNRQASA-N 0.000 description 1
- VMDKRSNUUUUARH-MQDBWYGVSA-N (3s)-4-[[(2s)-1-[[(2s)-2-[[(2s)-3-(1h-indol-3-yl)-2-[[2-[[(2s)-2-[[2-(4-sulfooxyphenyl)acetyl]amino]hexanoyl]amino]acetyl]amino]propanoyl]amino]hexanoyl]amino]-1-oxo-3-phenylpropan-2-yl]amino]-3-(methylamino)-4-oxobutanoic acid Chemical compound N([C@@H](CCCC)C(=O)NCC(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCCC)C(=O)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@H](CC(O)=O)NC)C(=O)CC1=CC=C(OS(O)(=O)=O)C=C1 VMDKRSNUUUUARH-MQDBWYGVSA-N 0.000 description 1
- JONIMGVUGJVFQD-UHFFFAOYSA-N (4-methylphenyl)sulfonylformonitrile Chemical compound CC1=CC=C(S(=O)(=O)C#N)C=C1 JONIMGVUGJVFQD-UHFFFAOYSA-N 0.000 description 1
- BMHZAHGTGIZZCT-LJQANCHMSA-N (4r)-2-[(4-bromo-2-fluorophenyl)methyl]-6-fluorospiro[isoquinoline-4,3'-pyrrolidine]-1,2',3,5'-tetrone Chemical compound C1([C@]2(C(NC(=O)C2)=O)C2=O)=CC(F)=CC=C1C(=O)N2CC1=CC=C(Br)C=C1F BMHZAHGTGIZZCT-LJQANCHMSA-N 0.000 description 1
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 description 1
- 125000006700 (C1-C6) alkylthio group Chemical group 0.000 description 1
- KWTSXDURSIMDCE-QMMMGPOBSA-N (S)-amphetamine Chemical compound C[C@H](N)CC1=CC=CC=C1 KWTSXDURSIMDCE-QMMMGPOBSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- SPEUIVXLLWOEMJ-UHFFFAOYSA-N 1,1-dimethoxyethane Chemical compound COC(C)OC SPEUIVXLLWOEMJ-UHFFFAOYSA-N 0.000 description 1
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical compound C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 description 1
- 125000001607 1,2,3-triazol-1-yl group Chemical group [*]N1N=NC([H])=C1[H] 0.000 description 1
- 125000001359 1,2,3-triazol-4-yl group Chemical group [H]N1N=NC([*])=C1[H] 0.000 description 1
- UUZJJNBYJDFQHL-UHFFFAOYSA-N 1,2,3-triazolidine Chemical compound C1CNNN1 UUZJJNBYJDFQHL-UHFFFAOYSA-N 0.000 description 1
- 125000003626 1,2,4-triazol-1-yl group Chemical group [*]N1N=C([H])N=C1[H] 0.000 description 1
- 125000001305 1,2,4-triazol-3-yl group Chemical group [H]N1N=C([*])N=C1[H] 0.000 description 1
- UDGKZGLPXCRRAM-UHFFFAOYSA-N 1,2,5-thiadiazole Chemical compound C=1C=NSN=1 UDGKZGLPXCRRAM-UHFFFAOYSA-N 0.000 description 1
- GCMNJUJAKQGROZ-UHFFFAOYSA-N 1,2-Dihydroquinolin-2-imine Chemical compound C1=CC=CC2=NC(N)=CC=C21 GCMNJUJAKQGROZ-UHFFFAOYSA-N 0.000 description 1
- CFGDUGSIBUXRMR-UHFFFAOYSA-N 1,2-dihydropyrrol-2-ide Chemical class C=1C=[C-]NC=1 CFGDUGSIBUXRMR-UHFFFAOYSA-N 0.000 description 1
- 125000004509 1,3,4-oxadiazol-2-yl group Chemical group O1C(=NN=C1)* 0.000 description 1
- 125000004521 1,3,4-thiadiazol-2-yl group Chemical group S1C(=NN=C1)* 0.000 description 1
- OGYGFUAIIOPWQD-UHFFFAOYSA-N 1,3-thiazolidine Chemical compound C1CSCN1 OGYGFUAIIOPWQD-UHFFFAOYSA-N 0.000 description 1
- GFNPCJCIUWSWIV-UHFFFAOYSA-N 1-(4-methylphenyl)cyclobutane-1-carboxylic acid Chemical compound C1=CC(C)=CC=C1C1(C(O)=O)CCC1 GFNPCJCIUWSWIV-UHFFFAOYSA-N 0.000 description 1
- BEVYUARQHKRBMH-UHFFFAOYSA-N 1-(4-methylphenyl)cyclohexane-1-carboxylic acid Chemical compound C1=CC(C)=CC=C1C1(C(O)=O)CCCCC1 BEVYUARQHKRBMH-UHFFFAOYSA-N 0.000 description 1
- YKDWTRWSHHGVII-UHFFFAOYSA-N 1-(4-methylphenyl)cyclopentane-1-carboxylic acid Chemical compound C1=CC(C)=CC=C1C1(C(O)=O)CCCC1 YKDWTRWSHHGVII-UHFFFAOYSA-N 0.000 description 1
- AYUGAOYMYXSOKU-UHFFFAOYSA-N 1-(4-methylphenyl)cyclopropane-1-carboxylic acid Chemical compound C1=CC(C)=CC=C1C1(C(O)=O)CC1 AYUGAOYMYXSOKU-UHFFFAOYSA-N 0.000 description 1
- KMXPHBJUGYLXDM-UHFFFAOYSA-N 1-(7-hydroxy-6,6-dimethyl-7,8-dihydropyrano[2,3-f][2,1,3]benzoxadiazol-8-yl)piperidin-2-one Chemical compound OC1C(C)(C)OC2=CC3=NON=C3C=C2C1N1CCCCC1=O KMXPHBJUGYLXDM-UHFFFAOYSA-N 0.000 description 1
- BOVGTQGAOIONJV-BETUJISGSA-N 1-[(3ar,6as)-3,3a,4,5,6,6a-hexahydro-1h-cyclopenta[c]pyrrol-2-yl]-3-(4-methylphenyl)sulfonylurea Chemical compound C1=CC(C)=CC=C1S(=O)(=O)NC(=O)NN1C[C@H]2CCC[C@H]2C1 BOVGTQGAOIONJV-BETUJISGSA-N 0.000 description 1
- ABDDQTDRAHXHOC-QMMMGPOBSA-N 1-[(7s)-5,7-dihydro-4h-thieno[2,3-c]pyran-7-yl]-n-methylmethanamine Chemical compound CNC[C@@H]1OCCC2=C1SC=C2 ABDDQTDRAHXHOC-QMMMGPOBSA-N 0.000 description 1
- WSDSEIUBXJOEIQ-UHFFFAOYSA-N 1-[1-(3-ethoxyphenyl)-4-methylcyclohexyl]-4-phenylpiperazine;methanesulfonic acid Chemical compound CS(O)(=O)=O.CCOC1=CC=CC(C2(CCC(C)CC2)N2CCN(CC2)C=2C=CC=CC=2)=C1 WSDSEIUBXJOEIQ-UHFFFAOYSA-N 0.000 description 1
- YWRBLSYOLXMZGA-UHFFFAOYSA-N 1-[2-(oxan-2-yloxy)ethyl]-4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pyrazole Chemical compound O1C(C)(C)C(C)(C)OB1C1=CN(CCOC2OCCCC2)N=C1 YWRBLSYOLXMZGA-UHFFFAOYSA-N 0.000 description 1
- 125000004973 1-butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000004972 1-butynyl group Chemical group [H]C([H])([H])C([H])([H])C#C* 0.000 description 1
- UZKWTJUDCOPSNM-UHFFFAOYSA-N 1-ethenoxybutane Chemical compound CCCCOC=C UZKWTJUDCOPSNM-UHFFFAOYSA-N 0.000 description 1
- 125000006039 1-hexenyl group Chemical group 0.000 description 1
- 125000001088 1-naphthoyl group Chemical group C1(=CC=CC2=CC=CC=C12)C(=O)* 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- 125000000530 1-propynyl group Chemical group [H]C([H])([H])C#C* 0.000 description 1
- 125000004214 1-pyrrolidinyl group Chemical group [H]C1([H])N(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000001462 1-pyrrolyl group Chemical group [*]N1C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 229940126558 11β-HSD1 inhibitor Drugs 0.000 description 1
- 102000004899 14-3-3 Proteins Human genes 0.000 description 1
- 101710112812 14-3-3 protein Proteins 0.000 description 1
- DUHQBKLTAVUXFF-FERBBOLQSA-N 192050-59-2 Chemical compound CS(O)(=O)=O.O=C1NC(=O)C2=C1C(C1=CC=CC=C11)=CN1CCO[C@H](CN(C)C)CCN1C3=CC=CC=C3C2=C1 DUHQBKLTAVUXFF-FERBBOLQSA-N 0.000 description 1
- QWENRTYMTSOGBR-UHFFFAOYSA-N 1H-1,2,3-Triazole Chemical compound C=1C=NNN=1 QWENRTYMTSOGBR-UHFFFAOYSA-N 0.000 description 1
- KEZNMOUMHOZFRA-UHFFFAOYSA-N 1h-pyrazol-4-ylboronic acid Chemical compound OB(O)C=1C=NNC=1 KEZNMOUMHOZFRA-UHFFFAOYSA-N 0.000 description 1
- SNTWKPAKVQFCCF-UHFFFAOYSA-N 2,3-dihydro-1h-triazole Chemical compound N1NC=CN1 SNTWKPAKVQFCCF-UHFFFAOYSA-N 0.000 description 1
- MNFATGGLUXHNDC-UHFFFAOYSA-N 2,3-dihydrofuro[3,2-b]pyridin-5-amine Chemical compound NC1=CC=C2OCCC2=N1 MNFATGGLUXHNDC-UHFFFAOYSA-N 0.000 description 1
- GCUOLJOTJRUDIZ-UHFFFAOYSA-N 2-(2-bromoethoxy)oxane Chemical compound BrCCOC1CCCCO1 GCUOLJOTJRUDIZ-UHFFFAOYSA-N 0.000 description 1
- DDTQLPXXNHLBAB-UHFFFAOYSA-N 2-(4-chlorophenyl)-2-[3-(trifluoromethyl)phenoxy]acetic acid Chemical compound C=1C=C(Cl)C=CC=1C(C(=O)O)OC1=CC=CC(C(F)(F)F)=C1 DDTQLPXXNHLBAB-UHFFFAOYSA-N 0.000 description 1
- UYGLXGHUDBKZKX-UHFFFAOYSA-N 2-(chloromethyl)pyridin-1-ium;iodide Chemical compound [I-].ClCC1=CC=CC=[NH+]1 UYGLXGHUDBKZKX-UHFFFAOYSA-N 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-N 2-Methylbenzenesulfonic acid Chemical compound CC1=CC=CC=C1S(O)(=O)=O LBLYYCQCTBFVLH-UHFFFAOYSA-N 0.000 description 1
- CMLUGNQVANVZHY-POURPWNDSA-N 2-[1-[2-[(3r,5s)-1-(3-acetyloxy-2,2-dimethylpropyl)-7-chloro-5-(2,3-dimethoxyphenyl)-2-oxo-5h-4,1-benzoxazepin-3-yl]acetyl]piperidin-4-yl]acetic acid Chemical compound COC1=CC=CC([C@@H]2C3=CC(Cl)=CC=C3N(CC(C)(C)COC(C)=O)C(=O)[C@@H](CC(=O)N3CCC(CC(O)=O)CC3)O2)=C1OC CMLUGNQVANVZHY-POURPWNDSA-N 0.000 description 1
- GUIVJWUZSCXPLF-UHFFFAOYSA-N 2-[4-[(6-imidazol-1-ylimidazo[1,2-a]pyridin-2-yl)carbamoyl]phenyl]-2-methylpropanoic acid Chemical compound C1=CC(C(C)(C(O)=O)C)=CC=C1C(=O)NC1=CN(C=C(C=C2)N3C=NC=C3)C2=N1 GUIVJWUZSCXPLF-UHFFFAOYSA-N 0.000 description 1
- PKQLRQRSWBHMQO-UHFFFAOYSA-N 2-[4-[[6-(furan-3-yl)imidazo[1,2-a]pyridin-2-yl]carbamoyl]phenyl]-2-methylpropanoic acid Chemical compound C1=CC(C(C)(C(O)=O)C)=CC=C1C(=O)NC1=CN(C=C(C=C2)C3=COC=C3)C2=N1 PKQLRQRSWBHMQO-UHFFFAOYSA-N 0.000 description 1
- NSVFSAJIGAJDMR-UHFFFAOYSA-N 2-[benzyl(phenyl)amino]ethyl 5-(5,5-dimethyl-2-oxido-1,3,2-dioxaphosphinan-2-yl)-2,6-dimethyl-4-(3-nitrophenyl)-1,4-dihydropyridine-3-carboxylate Chemical compound CC=1NC(C)=C(C(=O)OCCN(CC=2C=CC=CC=2)C=2C=CC=CC=2)C(C=2C=C(C=CC=2)[N+]([O-])=O)C=1P1(=O)OCC(C)(C)CO1 NSVFSAJIGAJDMR-UHFFFAOYSA-N 0.000 description 1
- YGZFYDFBHIDIBH-UHFFFAOYSA-N 2-[bis(2-hydroxyethyl)amino]icosan-1-ol Chemical compound CCCCCCCCCCCCCCCCCCC(CO)N(CCO)CCO YGZFYDFBHIDIBH-UHFFFAOYSA-N 0.000 description 1
- BJBCSGQLZQGGIQ-QGZVFWFLSA-N 2-acetamidoethyl (2r)-2-(4-chlorophenyl)-2-[3-(trifluoromethyl)phenoxy]acetate Chemical compound O([C@@H](C(=O)OCCNC(=O)C)C=1C=CC(Cl)=CC=1)C1=CC=CC(C(F)(F)F)=C1 BJBCSGQLZQGGIQ-QGZVFWFLSA-N 0.000 description 1
- 125000004174 2-benzimidazolyl group Chemical group [H]N1C(*)=NC2=C([H])C([H])=C([H])C([H])=C12 0.000 description 1
- YWNJQQNBJQUKME-UHFFFAOYSA-N 2-bromo-5-methylpyridine Chemical compound CC1=CC=C(Br)N=C1 YWNJQQNBJQUKME-UHFFFAOYSA-N 0.000 description 1
- JUIKUQOUMZUFQT-UHFFFAOYSA-N 2-bromoacetamide Chemical compound NC(=O)CBr JUIKUQOUMZUFQT-UHFFFAOYSA-N 0.000 description 1
- AUHYZQCEIVEMFH-UHFFFAOYSA-N 2-bromopropanamide Chemical compound CC(Br)C(N)=O AUHYZQCEIVEMFH-UHFFFAOYSA-N 0.000 description 1
- 125000004974 2-butenyl group Chemical group C(C=CC)* 0.000 description 1
- 125000000069 2-butynyl group Chemical group [H]C([H])([H])C#CC([H])([H])* 0.000 description 1
- JIVPVXMEBJLZRO-CQSZACIVSA-N 2-chloro-5-[(1r)-1-hydroxy-3-oxo-2h-isoindol-1-yl]benzenesulfonamide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC([C@@]2(O)C3=CC=CC=C3C(=O)N2)=C1 JIVPVXMEBJLZRO-CQSZACIVSA-N 0.000 description 1
- JCCBZCMSYUSCFM-UHFFFAOYSA-N 2-chlorobenzenesulfonamide Chemical compound NS(=O)(=O)C1=CC=CC=C1Cl JCCBZCMSYUSCFM-UHFFFAOYSA-N 0.000 description 1
- 125000001731 2-cyanoethyl group Chemical group [H]C([H])(*)C([H])([H])C#N 0.000 description 1
- WMUIIGVAWPWQAW-UHFFFAOYSA-N 2-ethoxy-3-[4-(2-phenoxazin-10-ylethoxy)phenyl]propanoic acid Chemical compound C1=CC(CC(OCC)C(O)=O)=CC=C1OCCN1C2=CC=CC=C2OC2=CC=CC=C21 WMUIIGVAWPWQAW-UHFFFAOYSA-N 0.000 description 1
- ZBOQEBCMZASNFS-UHFFFAOYSA-N 2-ethoxy-3-[[4-[2-(5-oxo-1,2,4-oxadiazolidin-3-yl)phenyl]phenyl]methyl]benzimidazole-4-carboxylic acid Chemical compound CCOC1=NC2=CC=CC(C(O)=O)=C2N1CC(C=C1)=CC=C1C1=CC=CC=C1C1NOC(=O)N1 ZBOQEBCMZASNFS-UHFFFAOYSA-N 0.000 description 1
- 125000002941 2-furyl group Chemical group O1C([*])=C([H])C([H])=C1[H] 0.000 description 1
- CFMZSMGAMPBRBE-UHFFFAOYSA-N 2-hydroxyisoindole-1,3-dione Chemical compound C1=CC=C2C(=O)N(O)C(=O)C2=C1 CFMZSMGAMPBRBE-UHFFFAOYSA-N 0.000 description 1
- QOGNDJLSYMJGPP-UHFFFAOYSA-N 2-methoxy-5-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pyridine Chemical compound C1=NC(OC)=CC=C1B1OC(C)(C)C(C)(C)O1 QOGNDJLSYMJGPP-UHFFFAOYSA-N 0.000 description 1
- 125000006020 2-methyl-1-propenyl group Chemical group 0.000 description 1
- VCSBTPVGIGROGB-UHFFFAOYSA-N 2-methyl-2-(4-methylphenyl)propanenitrile Chemical compound CC1=CC=C(C(C)(C)C#N)C=C1 VCSBTPVGIGROGB-UHFFFAOYSA-N 0.000 description 1
- UYPYPLRWAZMPFC-UHFFFAOYSA-N 2-methyl-2-[4-[(6-thiophen-3-ylimidazo[1,2-a]pyridin-2-yl)carbamoyl]phenyl]propanoic acid Chemical compound C1=CC(C(C)(C(O)=O)C)=CC=C1C(=O)NC1=CN(C=C(C=C2)C3=CSC=C3)C2=N1 UYPYPLRWAZMPFC-UHFFFAOYSA-N 0.000 description 1
- BDALCJOXBVZFIM-UHFFFAOYSA-N 2-methyl-2-[4-[[6-(1h-pyrazol-4-yl)imidazo[1,2-a]pyridin-2-yl]carbamoyl]phenyl]propanoic acid Chemical compound C1=CC(C(C)(C(O)=O)C)=CC=C1C(=O)NC1=CN(C=C(C=C2)C3=CNN=C3)C2=N1 BDALCJOXBVZFIM-UHFFFAOYSA-N 0.000 description 1
- XWKFPIODWVPXLX-UHFFFAOYSA-N 2-methyl-5-methylpyridine Natural products CC1=CC=C(C)N=C1 XWKFPIODWVPXLX-UHFFFAOYSA-N 0.000 description 1
- BSKHPKMHTQYZBB-UHFFFAOYSA-N 2-methylpyridine Chemical compound CC1=CC=CC=N1 BSKHPKMHTQYZBB-UHFFFAOYSA-N 0.000 description 1
- 125000001216 2-naphthoyl group Chemical group C1=C(C=CC2=CC=CC=C12)C(=O)* 0.000 description 1
- 125000006024 2-pentenyl group Chemical group 0.000 description 1
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 1
- 125000004485 2-pyrrolidinyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])([H])C1([H])* 0.000 description 1
- MVPXJVKKNFNIQH-UHFFFAOYSA-N 2-tert-butyl-5-methylpyridine Chemical compound CC1=CC=C(C(C)(C)C)N=C1 MVPXJVKKNFNIQH-UHFFFAOYSA-N 0.000 description 1
- 125000000175 2-thienyl group Chemical group S1C([*])=C([H])C([H])=C1[H] 0.000 description 1
- JMTMSDXUXJISAY-UHFFFAOYSA-N 2H-benzotriazol-4-ol Chemical compound OC1=CC=CC2=C1N=NN2 JMTMSDXUXJISAY-UHFFFAOYSA-N 0.000 description 1
- BCSVCWVQNOXFGL-UHFFFAOYSA-N 3,4-dihydro-4-oxo-3-((5-trifluoromethyl-2-benzothiazolyl)methyl)-1-phthalazine acetic acid Chemical compound O=C1C2=CC=CC=C2C(CC(=O)O)=NN1CC1=NC2=CC(C(F)(F)F)=CC=C2S1 BCSVCWVQNOXFGL-UHFFFAOYSA-N 0.000 description 1
- NDMPLJNOPCLANR-UHFFFAOYSA-N 3,4-dihydroxy-15-(4-hydroxy-18-methoxycarbonyl-5,18-seco-ibogamin-18-yl)-16-methoxy-1-methyl-6,7-didehydro-aspidospermidine-3-carboxylic acid methyl ester Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 NDMPLJNOPCLANR-UHFFFAOYSA-N 0.000 description 1
- HPOIPOPJGBKXIR-UHFFFAOYSA-N 3,6-dimethoxy-10-methyl-galantham-1-ene Natural products O1C(C(=CC=2)OC)=C3C=2CN(C)CCC23C1CC(OC)C=C2 HPOIPOPJGBKXIR-UHFFFAOYSA-N 0.000 description 1
- PVBYCSQRUNOEMD-UHFFFAOYSA-N 3-(1-cyanocyclopropyl)benzoic acid Chemical compound OC(=O)C1=CC=CC(C2(CC2)C#N)=C1 PVBYCSQRUNOEMD-UHFFFAOYSA-N 0.000 description 1
- RMNLMKOJDVKOHO-UHFFFAOYSA-N 3-(6-methyl-4,8-dioxo-1,3,6,2-dioxazaborocan-2-yl)benzonitrile Chemical compound O1C(=O)CN(C)CC(=O)OB1C1=CC=CC(C#N)=C1 RMNLMKOJDVKOHO-UHFFFAOYSA-N 0.000 description 1
- AEDQNOLIADXSBB-UHFFFAOYSA-N 3-(dodecylazaniumyl)propanoate Chemical compound CCCCCCCCCCCCNCCC(O)=O AEDQNOLIADXSBB-UHFFFAOYSA-N 0.000 description 1
- WNEODWDFDXWOLU-QHCPKHFHSA-N 3-[3-(hydroxymethyl)-4-[1-methyl-5-[[5-[(2s)-2-methyl-4-(oxetan-3-yl)piperazin-1-yl]pyridin-2-yl]amino]-6-oxopyridin-3-yl]pyridin-2-yl]-7,7-dimethyl-1,2,6,8-tetrahydrocyclopenta[3,4]pyrrolo[3,5-b]pyrazin-4-one Chemical compound C([C@@H](N(CC1)C=2C=NC(NC=3C(N(C)C=C(C=3)C=3C(=C(N4C(C5=CC=6CC(C)(C)CC=6N5CC4)=O)N=CC=3)CO)=O)=CC=2)C)N1C1COC1 WNEODWDFDXWOLU-QHCPKHFHSA-N 0.000 description 1
- DGENZVKCTGIDRZ-UHFFFAOYSA-N 3-[4-[(3-phenoxyphenyl)methylamino]phenyl]propanoic acid Chemical compound C1=CC(CCC(=O)O)=CC=C1NCC1=CC=CC(OC=2C=CC=CC=2)=C1 DGENZVKCTGIDRZ-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- 125000004975 3-butenyl group Chemical group C(CC=C)* 0.000 description 1
- 125000000474 3-butynyl group Chemical group [H]C#CC([H])([H])C([H])([H])* 0.000 description 1
- WZFZJEPHYDDFCT-UHFFFAOYSA-N 3-chloro-2-methyl-n-[4-[2-(3-oxomorpholin-4-yl)ethyl]-1,3-thiazol-2-yl]benzenesulfonamide Chemical compound CC1=C(Cl)C=CC=C1S(=O)(=O)NC1=NC(CCN2C(COCC2)=O)=CS1 WZFZJEPHYDDFCT-UHFFFAOYSA-N 0.000 description 1
- 125000006041 3-hexenyl group Chemical group 0.000 description 1
- LXMASNUOAKLCJK-UHFFFAOYSA-N 3-methyl-3-(4-methylphenyl)butanoic acid Chemical compound CC1=CC=C(C(C)(C)CC(O)=O)C=C1 LXMASNUOAKLCJK-UHFFFAOYSA-N 0.000 description 1
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 description 1
- 125000001397 3-pyrrolyl group Chemical group [H]N1C([H])=C([*])C([H])=C1[H] 0.000 description 1
- 125000001541 3-thienyl group Chemical group S1C([H])=C([*])C([H])=C1[H] 0.000 description 1
- FQXQBFUUVCDIRK-UHFFFAOYSA-N 3-trifluoromethylbenzoic acid Chemical compound OC(=O)C1=CC=CC(C(F)(F)F)=C1 FQXQBFUUVCDIRK-UHFFFAOYSA-N 0.000 description 1
- FFZHICFAHSDFKZ-UHFFFAOYSA-N 4,4,5,5-tetramethyl-2-thiophen-2-yl-1,3,2-dioxaborolane Chemical compound O1C(C)(C)C(C)(C)OB1C1=CC=CS1 FFZHICFAHSDFKZ-UHFFFAOYSA-N 0.000 description 1
- HQXQOBAEDQBINI-UHFFFAOYSA-N 4,4,5,5-tetramethyl-2-thiophen-3-yl-1,3,2-dioxaborolane Chemical compound O1C(C)(C)C(C)(C)OB1C1=CSC=C1 HQXQOBAEDQBINI-UHFFFAOYSA-N 0.000 description 1
- MKOSTTOXUKIDMZ-UHFFFAOYSA-N 4-(1-acetamido-2-methylpropan-2-yl)-n-(6-chloroimidazo[1,2-a]pyridin-2-yl)benzamide Chemical compound C1=CC(C(C)(C)CNC(=O)C)=CC=C1C(=O)NC1=CN(C=C(Cl)C=C2)C2=N1 MKOSTTOXUKIDMZ-UHFFFAOYSA-N 0.000 description 1
- ROGWTEAYBGELMP-UHFFFAOYSA-N 4-(1-methoxycarbonylcyclobutyl)benzoic acid Chemical compound C=1C=C(C(O)=O)C=CC=1C1(C(=O)OC)CCC1 ROGWTEAYBGELMP-UHFFFAOYSA-N 0.000 description 1
- AQCKWXDPZVZEFR-UHFFFAOYSA-N 4-(1-methoxycarbonylcyclohexyl)benzoic acid Chemical compound C=1C=C(C(O)=O)C=CC=1C1(C(=O)OC)CCCCC1 AQCKWXDPZVZEFR-UHFFFAOYSA-N 0.000 description 1
- LARXVHBVBFOFSP-UHFFFAOYSA-N 4-(1-methoxycarbonylcyclopentyl)benzoic acid Chemical compound C=1C=C(C(O)=O)C=CC=1C1(C(=O)OC)CCCC1 LARXVHBVBFOFSP-UHFFFAOYSA-N 0.000 description 1
- GMOUXACCXBMBMS-UHFFFAOYSA-N 4-(1-methoxycarbonylcyclopropyl)benzoic acid Chemical compound C=1C=C(C(O)=O)C=CC=1C1(C(=O)OC)CC1 GMOUXACCXBMBMS-UHFFFAOYSA-N 0.000 description 1
- UZKXVFBKGNVTFE-UHFFFAOYSA-N 4-(4-chlorophenyl)-2-(2-methylimidazol-1-yl)-5-[3-(2-methylphenoxy)propyl]-1,3-oxazole Chemical compound CC1=NC=CN1C(O1)=NC(C=2C=CC(Cl)=CC=2)=C1CCCOC1=CC=CC=C1C UZKXVFBKGNVTFE-UHFFFAOYSA-N 0.000 description 1
- ABPGAUONGBMCRF-UHFFFAOYSA-N 4-(4-cyano-2-methylbutan-2-yl)-n-(6-imidazol-1-ylimidazo[1,2-a]pyridin-2-yl)benzamide Chemical compound C1=CC(C(C)(CCC#N)C)=CC=C1C(=O)NC1=CN(C=C(C=C2)N3C=NC=C3)C2=N1 ABPGAUONGBMCRF-UHFFFAOYSA-N 0.000 description 1
- PXHAKLWKUKUXEB-UHFFFAOYSA-N 4-(4-ethoxy-2-methyl-4-oxobutan-2-yl)benzoic acid Chemical compound CCOC(=O)CC(C)(C)C1=CC=C(C(O)=O)C=C1 PXHAKLWKUKUXEB-UHFFFAOYSA-N 0.000 description 1
- FVSNAIHGVFBPPU-UHFFFAOYSA-N 4-(acetylsulfamoyl)-n-(6-chloroimidazo[1,2-a]pyridin-2-yl)benzamide Chemical compound C1=CC(S(=O)(=O)NC(=O)C)=CC=C1C(=O)NC1=CN(C=C(Cl)C=C2)C2=N1 FVSNAIHGVFBPPU-UHFFFAOYSA-N 0.000 description 1
- UGJDXRVQCYBXAJ-UHFFFAOYSA-N 4-(dimethylamino)benzoyl chloride Chemical compound CN(C)C1=CC=C(C(Cl)=O)C=C1 UGJDXRVQCYBXAJ-UHFFFAOYSA-N 0.000 description 1
- XIWZUWWVOULHGZ-UHFFFAOYSA-N 4-(methanesulfonamido)benzoyl chloride Chemical compound CS(=O)(=O)NC1=CC=C(C(Cl)=O)C=C1 XIWZUWWVOULHGZ-UHFFFAOYSA-N 0.000 description 1
- SROHFTOYGFCJAF-UHFFFAOYSA-N 4-[(methylsulfonyl)amino]benzoic acid Chemical compound CS(=O)(=O)NC1=CC=C(C(O)=O)C=C1 SROHFTOYGFCJAF-UHFFFAOYSA-N 0.000 description 1
- UWOJUMIKVKCBQM-UHFFFAOYSA-N 4-[1-[tert-butyl(dimethyl)silyl]oxy-2-methylpropan-2-yl]-n-(6-iodoimidazo[1,2-a]pyridin-2-yl)benzamide Chemical compound C1=CC(C(C)(C)CO[Si](C)(C)C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(I)C=C2)C2=N1 UWOJUMIKVKCBQM-UHFFFAOYSA-N 0.000 description 1
- DGUFRXXOEYARSY-UHFFFAOYSA-N 4-[1-[tert-butyl(dimethyl)silyl]oxy-2-methylpropan-2-yl]benzoic acid Chemical compound CC(C)(C)[Si](C)(C)OCC(C)(C)C1=CC=C(C(O)=O)C=C1 DGUFRXXOEYARSY-UHFFFAOYSA-N 0.000 description 1
- SJYWZAOFMFPKBA-UHFFFAOYSA-N 4-[1-[tert-butyl(dimethyl)silyl]oxy-2-methylpropan-2-yl]benzoyl chloride Chemical compound CC(C)(C)[Si](C)(C)OCC(C)(C)C1=CC=C(C(Cl)=O)C=C1 SJYWZAOFMFPKBA-UHFFFAOYSA-N 0.000 description 1
- JUUIRLHLMYUONA-UHFFFAOYSA-N 4-[4-[tert-butyl(dimethyl)silyl]oxy-2-methylbutan-2-yl]benzoic acid Chemical compound CC(C)(C)[Si](C)(C)OCCC(C)(C)C1=CC=C(C(O)=O)C=C1 JUUIRLHLMYUONA-UHFFFAOYSA-N 0.000 description 1
- NRXSHAKGAWIHFH-UHFFFAOYSA-N 4-[ethyl(methylsulfonyl)amino]benzoic acid Chemical compound CCN(S(C)(=O)=O)C1=CC=C(C(O)=O)C=C1 NRXSHAKGAWIHFH-UHFFFAOYSA-N 0.000 description 1
- DENKGPBHLYFNGK-UHFFFAOYSA-N 4-bromobenzoyl chloride Chemical compound ClC(=O)C1=CC=C(Br)C=C1 DENKGPBHLYFNGK-UHFFFAOYSA-N 0.000 description 1
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N 4-hydroxybenzoic acid Chemical class OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 125000003119 4-methyl-3-pentenyl group Chemical group [H]\C(=C(/C([H])([H])[H])C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- FTPDQRMONOCZNJ-UHFFFAOYSA-N 4-methyl-4-(4-methylphenyl)pentanenitrile Chemical compound CC1=CC=C(C(C)(C)CCC#N)C=C1 FTPDQRMONOCZNJ-UHFFFAOYSA-N 0.000 description 1
- JOAMFNBWGMGSTJ-UHFFFAOYSA-N 4-methyl-4-[4-[(6-methylimidazo[1,2-a]pyridin-2-yl)carbamoyl]phenyl]pentanoic acid Chemical compound C=1N2C=C(C)C=CC2=NC=1NC(=O)C1=CC=C(C(C)(C)CCC(O)=O)C=C1 JOAMFNBWGMGSTJ-UHFFFAOYSA-N 0.000 description 1
- IPEIDGXNXFPGBG-UHFFFAOYSA-N 4-methylsulfonylbenzoyl chloride Chemical compound CS(=O)(=O)C1=CC=C(C(Cl)=O)C=C1 IPEIDGXNXFPGBG-UHFFFAOYSA-N 0.000 description 1
- LBSYWDTVBUZMCM-UHFFFAOYSA-N 4-propan-2-ylbenzoyl chloride Chemical compound CC(C)C1=CC=C(C(Cl)=O)C=C1 LBSYWDTVBUZMCM-UHFFFAOYSA-N 0.000 description 1
- UHDHZXQMHIQHSO-UHFFFAOYSA-N 4-pyrazol-1-ylbenzoyl chloride Chemical compound C1=CC(C(=O)Cl)=CC=C1N1N=CC=C1 UHDHZXQMHIQHSO-UHFFFAOYSA-N 0.000 description 1
- 125000000339 4-pyridyl group Chemical group N1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 1
- SOSVTEHBZNSARP-UHFFFAOYSA-N 4-sulfamoylbenzoyl chloride Chemical compound NS(=O)(=O)C1=CC=C(C(Cl)=O)C=C1 SOSVTEHBZNSARP-UHFFFAOYSA-N 0.000 description 1
- GGUDNAJEGVAELQ-UHFFFAOYSA-N 4-tert-butyl-n-(6-chloroimidazo[1,2-a]pyridin-2-yl)benzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(Cl)C=C2)C2=N1 GGUDNAJEGVAELQ-UHFFFAOYSA-N 0.000 description 1
- YQXAFKLJIYOYNA-UHFFFAOYSA-N 4-tert-butyl-n-(6-chloroimidazo[1,2-b]pyridazin-2-yl)benzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(N=C(Cl)C=C2)C2=N1 YQXAFKLJIYOYNA-UHFFFAOYSA-N 0.000 description 1
- ZLYBMXPIVBZJMT-UHFFFAOYSA-N 4-tert-butyl-n-(6-cyanoimidazo[1,2-a]pyridin-2-yl)benzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(C=C2)C#N)C2=N1 ZLYBMXPIVBZJMT-UHFFFAOYSA-N 0.000 description 1
- ASCZQBOCPAWSJS-UHFFFAOYSA-N 4-tert-butyl-n-(6-fluoroimidazo[1,2-a]pyridin-2-yl)benzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(F)C=C2)C2=N1 ASCZQBOCPAWSJS-UHFFFAOYSA-N 0.000 description 1
- VVHFGDXFXFYOPH-UHFFFAOYSA-N 4-tert-butyl-n-(6-imidazol-1-yl-3-methylimidazo[1,2-b]pyridazin-2-yl)benzamide Chemical compound N1=C2C=CC(N3C=NC=C3)=NN2C(C)=C1NC(=O)C1=CC=C(C(C)(C)C)C=C1 VVHFGDXFXFYOPH-UHFFFAOYSA-N 0.000 description 1
- IKKLFEDUYFZNBO-UHFFFAOYSA-N 4-tert-butyl-n-(6-imidazol-1-ylimidazo[1,2-a]pyridin-2-yl)benzamide;dihydrochloride Chemical compound Cl.Cl.C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(C=C2)N3C=NC=C3)C2=N1 IKKLFEDUYFZNBO-UHFFFAOYSA-N 0.000 description 1
- XRDHAJPBGPUPQR-UHFFFAOYSA-N 4-tert-butyl-n-(6-methylimidazo[1,2-a]pyridin-2-yl)benzamide Chemical compound C=1N2C=C(C)C=CC2=NC=1NC(=O)C1=CC=C(C(C)(C)C)C=C1 XRDHAJPBGPUPQR-UHFFFAOYSA-N 0.000 description 1
- CCKSRTCMHOQKBE-UHFFFAOYSA-N 4-tert-butyl-n-(6-pyrrol-1-ylimidazo[1,2-a]pyridin-2-yl)benzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(C=C2)N3C=CC=C3)C2=N1 CCKSRTCMHOQKBE-UHFFFAOYSA-N 0.000 description 1
- SUUHQRJLSBVTGK-UHFFFAOYSA-N 4-tert-butyl-n-[6-(1-hydroxyethyl)imidazo[1,2-a]pyridin-2-yl]benzamide Chemical compound C=1N2C=C(C(O)C)C=CC2=NC=1NC(=O)C1=CC=C(C(C)(C)C)C=C1 SUUHQRJLSBVTGK-UHFFFAOYSA-N 0.000 description 1
- FGHOOVBMFAYMJY-UHFFFAOYSA-N 4-tert-butyl-n-[6-(1-phenylpyrazol-4-yl)imidazo[1,2-a]pyridin-2-yl]benzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(C=C2)C3=CN(N=C3)C=3C=CC=CC=3)C2=N1 FGHOOVBMFAYMJY-UHFFFAOYSA-N 0.000 description 1
- YHMPPYMXWLYJRY-UHFFFAOYSA-N 4-tert-butyl-n-[6-(1h-imidazol-2-yl)imidazo[1,2-a]pyridin-2-yl]benzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(C=C2)C=3NC=CN=3)C2=N1 YHMPPYMXWLYJRY-UHFFFAOYSA-N 0.000 description 1
- UCSXTBCOAIEWAZ-UHFFFAOYSA-N 4-tert-butyl-n-[6-(6-methoxypyridin-3-yl)imidazo[1,2-a]pyridin-2-yl]benzamide Chemical compound C1=NC(OC)=CC=C1C1=CN2C=C(NC(=O)C=3C=CC(=CC=3)C(C)(C)C)N=C2C=C1 UCSXTBCOAIEWAZ-UHFFFAOYSA-N 0.000 description 1
- UOGNTLGGWUGHOI-UHFFFAOYSA-N 4-tert-butyl-n-[6-(dimethylamino)imidazo[1,2-b]pyridazin-2-yl]benzamide;hydrochloride Chemical compound Cl.C=1N2N=C(N(C)C)C=CC2=NC=1NC(=O)C1=CC=C(C(C)(C)C)C=C1 UOGNTLGGWUGHOI-UHFFFAOYSA-N 0.000 description 1
- CFOTXBVSBAUSMW-UHFFFAOYSA-N 4-tert-butyl-n-[6-(methylaminomethyl)imidazo[1,2-a]pyridin-2-yl]benzamide Chemical compound C=1N2C=C(CNC)C=CC2=NC=1NC(=O)C1=CC=C(C(C)(C)C)C=C1 CFOTXBVSBAUSMW-UHFFFAOYSA-N 0.000 description 1
- SOIJCBSQJHUKAG-UHFFFAOYSA-N 4-tert-butyl-n-imidazo[1,2-a]pyridin-2-ylbenzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=CC=C2)C2=N1 SOIJCBSQJHUKAG-UHFFFAOYSA-N 0.000 description 1
- 125000004487 4-tetrahydropyranyl group Chemical group [H]C1([H])OC([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- KDDQRKBRJSGMQE-UHFFFAOYSA-N 4-thiazolyl Chemical group [C]1=CSC=N1 KDDQRKBRJSGMQE-UHFFFAOYSA-N 0.000 description 1
- 125000004229 4H-chromen-2-yl group Chemical group [H]C1=C([H])C([H])=C2C(OC(*)=C([H])C2([H])[H])=C1[H] 0.000 description 1
- HMXDWDSNPRNUKI-UHFFFAOYSA-N 5-(4-bromophenyl)-1-(2,4-dichlorophenyl)-4-ethyl-N-(1-piperidinyl)-3-pyrazolecarboxamide Chemical compound CCC=1C(C(=O)NN2CCCCC2)=NN(C=2C(=CC(Cl)=CC=2)Cl)C=1C1=CC=C(Br)C=C1 HMXDWDSNPRNUKI-UHFFFAOYSA-N 0.000 description 1
- IETKPTYAGKZLKY-UHFFFAOYSA-N 5-[[4-[(3-methyl-4-oxoquinazolin-2-yl)methoxy]phenyl]methyl]-1,3-thiazolidine-2,4-dione Chemical compound N=1C2=CC=CC=C2C(=O)N(C)C=1COC(C=C1)=CC=C1CC1SC(=O)NC1=O IETKPTYAGKZLKY-UHFFFAOYSA-N 0.000 description 1
- OFKWIQJLYCKDNY-UHFFFAOYSA-N 5-bromo-2-methylpyridine Chemical compound CC1=CC=C(Br)C=N1 OFKWIQJLYCKDNY-UHFFFAOYSA-N 0.000 description 1
- YJTXQLYMECWULH-UHFFFAOYSA-N 5-fluoropyridin-2-amine Chemical compound NC1=CC=C(F)C=N1 YJTXQLYMECWULH-UHFFFAOYSA-N 0.000 description 1
- 125000006043 5-hexenyl group Chemical group 0.000 description 1
- CMBSSVKZOPZBKW-UHFFFAOYSA-N 5-methylpyridin-2-amine Chemical compound CC1=CC=C(N)N=C1 CMBSSVKZOPZBKW-UHFFFAOYSA-N 0.000 description 1
- HQIGJXSJDFYVHU-UHFFFAOYSA-N 5-tert-butyl-n-(6-chloroimidazo[1,2-a]pyridin-2-yl)pyridine-2-carboxamide Chemical compound N1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(Cl)C=C2)C2=N1 HQIGJXSJDFYVHU-UHFFFAOYSA-N 0.000 description 1
- DGRBVCDHIXAHRB-UHFFFAOYSA-N 5-tert-butylpyridine-2-carbonyl chloride Chemical compound CC(C)(C)C1=CC=C(C(Cl)=O)N=C1 DGRBVCDHIXAHRB-UHFFFAOYSA-N 0.000 description 1
- BWSHOYXWNFLBBR-UHFFFAOYSA-N 5-tert-butylpyridine-2-carboxylic acid Chemical compound CC(C)(C)C1=CC=C(C(O)=O)N=C1 BWSHOYXWNFLBBR-UHFFFAOYSA-N 0.000 description 1
- CWDWFSXUQODZGW-UHFFFAOYSA-N 5-thiazolyl Chemical group [C]1=CN=CS1 CWDWFSXUQODZGW-UHFFFAOYSA-N 0.000 description 1
- VEUTWXHROPKTDP-UHFFFAOYSA-N 6-(3-aminophenoxy)imidazo[1,2-b]pyridazin-2-amine Chemical compound C1=CC2=NC(N)=CN2N=C1OC1=CC=CC(N)=C1 VEUTWXHROPKTDP-UHFFFAOYSA-N 0.000 description 1
- LVGMDHJPLZOAON-UHFFFAOYSA-N 6-(4-methoxyphenyl)imidazo[1,2-b]pyridazin-2-amine Chemical compound C1=CC(OC)=CC=C1C1=NN2C=C(N)N=C2C=C1 LVGMDHJPLZOAON-UHFFFAOYSA-N 0.000 description 1
- ORRZCFMOOYJHJF-UHFFFAOYSA-N 6-(trifluoromethyl)imidazo[1,2-a]pyridin-2-amine Chemical compound C1=C(C(F)(F)F)C=CC2=NC(N)=CN21 ORRZCFMOOYJHJF-UHFFFAOYSA-N 0.000 description 1
- BKYKPTRYDKTTJY-UHFFFAOYSA-N 6-chloro-3-(cyclopentylmethyl)-1,1-dioxo-3,4-dihydro-2H-1$l^{6},2,4-benzothiadiazine-7-sulfonamide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC(S(N2)(=O)=O)=C1NC2CC1CCCC1 BKYKPTRYDKTTJY-UHFFFAOYSA-N 0.000 description 1
- VEHNVCGISXDBIG-UHFFFAOYSA-N 6-chloroimidazo[1,2-b]pyridazin-2-amine Chemical compound N1=C(Cl)C=CC2=NC(N)=CN21 VEHNVCGISXDBIG-UHFFFAOYSA-N 0.000 description 1
- QHEUBRHRIJMZOR-UHFFFAOYSA-N 6-iodopyridazin-3-amine Chemical compound NC1=CC=C(I)N=N1 QHEUBRHRIJMZOR-UHFFFAOYSA-N 0.000 description 1
- QUXLCYFNVNNRBE-UHFFFAOYSA-N 6-methylpyridin-2-amine Chemical compound CC1=CC=CC(N)=N1 QUXLCYFNVNNRBE-UHFFFAOYSA-N 0.000 description 1
- IOUUIFJMTGCINF-UHFFFAOYSA-N 6-pyridin-3-ylimidazo[1,2-b]pyridazin-2-amine Chemical compound C1=CC2=NC(N)=CN2N=C1C1=CC=CN=C1 IOUUIFJMTGCINF-UHFFFAOYSA-N 0.000 description 1
- 125000004939 6-pyridyl group Chemical group N1=CC=CC=C1* 0.000 description 1
- DYEGEGUKCNKAPQ-UHFFFAOYSA-N 6-tert-butyl-n-(1,2-dihydrofuro[2,3-e]imidazo[1,2-a]pyridin-7-yl)nicotinamide dihydrochloride Chemical compound Cl.Cl.C1=NC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C2=C(OCC2)C=C2)C2=N1 DYEGEGUKCNKAPQ-UHFFFAOYSA-N 0.000 description 1
- LMVIYKJJILFSOJ-UHFFFAOYSA-N 6-tert-butyl-n-[6-(1-methylpyrazol-4-yl)imidazo[1,2-a]pyridin-2-yl]pyridine-3-carboxamide Chemical compound C1=NN(C)C=C1C1=CN2C=C(NC(=O)C=3C=NC(=CC=3)C(C)(C)C)N=C2C=C1 LMVIYKJJILFSOJ-UHFFFAOYSA-N 0.000 description 1
- BNBGXFKXNXXHEZ-UHFFFAOYSA-N 6-tert-butyl-n-[6-(1h-pyrazol-4-yl)imidazo[1,2-a]pyridin-2-yl]pyridine-3-carboxamide Chemical compound C1=NC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(C=C2)C3=CNN=C3)C2=N1 BNBGXFKXNXXHEZ-UHFFFAOYSA-N 0.000 description 1
- JHHURKBLEGFPPB-UHFFFAOYSA-N 6-tert-butylpyridine-3-carbonitrile Chemical compound CC(C)(C)C1=CC=C(C#N)C=N1 JHHURKBLEGFPPB-UHFFFAOYSA-N 0.000 description 1
- CYJRNFFLTBEQSQ-UHFFFAOYSA-N 8-(3-methyl-1-benzothiophen-5-yl)-N-(4-methylsulfonylpyridin-3-yl)quinoxalin-6-amine Chemical compound CS(=O)(=O)C1=C(C=NC=C1)NC=1C=C2N=CC=NC2=C(C=1)C=1C=CC2=C(C(=CS2)C)C=1 CYJRNFFLTBEQSQ-UHFFFAOYSA-N 0.000 description 1
- LRFVTYWOQMYALW-UHFFFAOYSA-N 9H-xanthine Chemical class O=C1NC(=O)NC2=C1NC=N2 LRFVTYWOQMYALW-UHFFFAOYSA-N 0.000 description 1
- 239000005541 ACE inhibitor Substances 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 102000011690 Adiponectin Human genes 0.000 description 1
- 108010076365 Adiponectin Proteins 0.000 description 1
- JBMKAUGHUNFTOL-UHFFFAOYSA-N Aldoclor Chemical class C1=C(Cl)C(S(=O)(=O)N)=CC2=C1NC=NS2(=O)=O JBMKAUGHUNFTOL-UHFFFAOYSA-N 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- 206010002383 Angina Pectoris Diseases 0.000 description 1
- 108020000948 Antisense Oligonucleotides Proteins 0.000 description 1
- 208000019901 Anxiety disease Diseases 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 206010003210 Arteriosclerosis Diseases 0.000 description 1
- 108010011485 Aspartame Proteins 0.000 description 1
- 108010078286 Ataxins Proteins 0.000 description 1
- 102000014461 Ataxins Human genes 0.000 description 1
- XUKUURHRXDUEBC-KAYWLYCHSA-N Atorvastatin Chemical compound C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CC[C@@H](O)C[C@@H](O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-KAYWLYCHSA-N 0.000 description 1
- XUKUURHRXDUEBC-UHFFFAOYSA-N Atorvastatin Natural products C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CCC(O)CC(O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-UHFFFAOYSA-N 0.000 description 1
- 206010003694 Atrophy Diseases 0.000 description 1
- 241000972773 Aulopiformes Species 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- PTQXTEKSNBVPQJ-UHFFFAOYSA-N Avasimibe Chemical compound CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1CC(=O)NS(=O)(=O)OC1=C(C(C)C)C=CC=C1C(C)C PTQXTEKSNBVPQJ-UHFFFAOYSA-N 0.000 description 1
- 208000000412 Avitaminosis Diseases 0.000 description 1
- 208000037914 B-cell disorder Diseases 0.000 description 1
- 108010028845 BIM 23190 Proteins 0.000 description 1
- 108700001281 BIM 51077 Proteins 0.000 description 1
- OMPJBNCRMGITSC-UHFFFAOYSA-N Benzoylperoxide Chemical compound C=1C=CC=CC=1C(=O)OOC(=O)C1=CC=CC=C1 OMPJBNCRMGITSC-UHFFFAOYSA-N 0.000 description 1
- 208000019838 Blood disease Diseases 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 208000014644 Brain disease Diseases 0.000 description 1
- 102000004219 Brain-derived neurotrophic factor Human genes 0.000 description 1
- 108090000715 Brain-derived neurotrophic factor Proteins 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 1
- 239000002083 C09CA01 - Losartan Substances 0.000 description 1
- 239000002080 C09CA02 - Eprosartan Substances 0.000 description 1
- 239000004072 C09CA03 - Valsartan Substances 0.000 description 1
- 239000002947 C09CA04 - Irbesartan Substances 0.000 description 1
- 239000002081 C09CA05 - Tasosartan Substances 0.000 description 1
- 239000005537 C09CA07 - Telmisartan Substances 0.000 description 1
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 1
- 125000003320 C2-C6 alkenyloxy group Chemical group 0.000 description 1
- 125000005915 C6-C14 aryl group Chemical group 0.000 description 1
- 108010055448 CJC 1131 Proteins 0.000 description 1
- 229940127291 Calcium channel antagonist Drugs 0.000 description 1
- GHOSNRCGJFBJIB-UHFFFAOYSA-N Candesartan cilexetil Chemical compound C=12N(CC=3C=CC(=CC=3)C=3C(=CC=CC=3)C3=NNN=N3)C(OCC)=NC2=CC=CC=1C(=O)OC(C)OC(=O)OC1CCCCC1 GHOSNRCGJFBJIB-UHFFFAOYSA-N 0.000 description 1
- 229940122820 Cannabinoid receptor antagonist Drugs 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 206010007559 Cardiac failure congestive Diseases 0.000 description 1
- 206010008025 Cerebellar ataxia Diseases 0.000 description 1
- 206010008088 Cerebral artery embolism Diseases 0.000 description 1
- 206010008132 Cerebral thrombosis Diseases 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- LPCKPBWOSNVCEL-UHFFFAOYSA-N Chlidanthine Natural products O1C(C(=CC=2)O)=C3C=2CN(C)CCC23C1CC(OC)C=C2 LPCKPBWOSNVCEL-UHFFFAOYSA-N 0.000 description 1
- RKWGIWYCVPQPMF-UHFFFAOYSA-N Chloropropamide Chemical compound CCCNC(=O)NS(=O)(=O)C1=CC=C(Cl)C=C1 RKWGIWYCVPQPMF-UHFFFAOYSA-N 0.000 description 1
- JZUFKLXOESDKRF-UHFFFAOYSA-N Chlorothiazide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC2=C1NCNS2(=O)=O JZUFKLXOESDKRF-UHFFFAOYSA-N 0.000 description 1
- 101800001982 Cholecystokinin Proteins 0.000 description 1
- 102100025841 Cholecystokinin Human genes 0.000 description 1
- 229920001268 Cholestyramine Polymers 0.000 description 1
- 108010005939 Ciliary Neurotrophic Factor Proteins 0.000 description 1
- 102100031614 Ciliary neurotrophic factor Human genes 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- JSMCFBBKFRKVGC-UHFFFAOYSA-N ClC1=C(N=C2N1C=CC=C2)N Chemical compound ClC1=C(N=C2N1C=CC=C2)N JSMCFBBKFRKVGC-UHFFFAOYSA-N 0.000 description 1
- 206010009269 Cleft palate Diseases 0.000 description 1
- BMOVQUBVGICXQN-UHFFFAOYSA-N Clinofibrate Chemical compound C1=CC(OC(C)(CC)C(O)=O)=CC=C1C1(C=2C=CC(OC(C)(CC)C(O)=O)=CC=2)CCCCC1 BMOVQUBVGICXQN-UHFFFAOYSA-N 0.000 description 1
- GJSURZIOUXUGAL-UHFFFAOYSA-N Clonidine Chemical compound ClC1=CC=CC(Cl)=C1NC1=NCCN1 GJSURZIOUXUGAL-UHFFFAOYSA-N 0.000 description 1
- 206010009900 Colitis ulcerative Diseases 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 102000007644 Colony-Stimulating Factors Human genes 0.000 description 1
- 108010071942 Colony-Stimulating Factors Proteins 0.000 description 1
- 206010053138 Congenital aplastic anaemia Diseases 0.000 description 1
- 208000020406 Creutzfeldt Jacob disease Diseases 0.000 description 1
- 208000003407 Creutzfeldt-Jakob Syndrome Diseases 0.000 description 1
- 208000010859 Creutzfeldt-Jakob disease Diseases 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 208000011231 Crohn disease Diseases 0.000 description 1
- 229920002785 Croscarmellose sodium Polymers 0.000 description 1
- 206010011703 Cyanosis Diseases 0.000 description 1
- PMPVIKIVABFJJI-UHFFFAOYSA-N Cyclobutane Chemical compound C1CCC1 PMPVIKIVABFJJI-UHFFFAOYSA-N 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- LVZWSLJZHVFIQJ-UHFFFAOYSA-N Cyclopropane Chemical compound C1CC1 LVZWSLJZHVFIQJ-UHFFFAOYSA-N 0.000 description 1
- 208000026292 Cystic Kidney disease Diseases 0.000 description 1
- 239000004287 Dehydroacetic acid Substances 0.000 description 1
- 206010012289 Dementia Diseases 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 208000032131 Diabetic Neuropathies Diseases 0.000 description 1
- 206010012689 Diabetic retinopathy Diseases 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 1
- 229940124213 Dipeptidyl peptidase 4 (DPP IV) inhibitor Drugs 0.000 description 1
- XIQVNETUBQGFHX-UHFFFAOYSA-N Ditropan Chemical compound C=1C=CC=CC=1C(O)(C(=O)OCC#CCN(CC)CC)C1CCCCC1 XIQVNETUBQGFHX-UHFFFAOYSA-N 0.000 description 1
- 102100023275 Dual specificity mitogen-activated protein kinase kinase 3 Human genes 0.000 description 1
- 102100023401 Dual specificity mitogen-activated protein kinase kinase 6 Human genes 0.000 description 1
- 102100023332 Dual specificity mitogen-activated protein kinase kinase 7 Human genes 0.000 description 1
- 206010058314 Dysplasia Diseases 0.000 description 1
- GKQLYSROISKDLL-UHFFFAOYSA-N EEDQ Chemical compound C1=CC=C2N(C(=O)OCC)C(OCC)C=CC2=C1 GKQLYSROISKDLL-UHFFFAOYSA-N 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 108010061435 Enalapril Proteins 0.000 description 1
- 208000017701 Endocrine disease Diseases 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 102000003951 Erythropoietin Human genes 0.000 description 1
- 108090000394 Erythropoietin Proteins 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 1
- 208000007530 Essential hypertension Diseases 0.000 description 1
- VXLCNTLWWUDBSO-UHFFFAOYSA-N Ethiazide Chemical compound ClC1=C(S(N)(=O)=O)C=C2S(=O)(=O)NC(CC)NC2=C1 VXLCNTLWWUDBSO-UHFFFAOYSA-N 0.000 description 1
- HTQBXNHDCUEHJF-XWLPCZSASA-N Exenatide Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)NCC(=O)NCC(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CO)C(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCSC)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)CNC(=O)[C@@H](N)CC=1NC=NC=1)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=CC=C1 HTQBXNHDCUEHJF-XWLPCZSASA-N 0.000 description 1
- 201000004939 Fanconi anemia Diseases 0.000 description 1
- 102100023374 Forkhead box protein M1 Human genes 0.000 description 1
- PNKUSGQVOMIXLU-UHFFFAOYSA-N Formamidine Chemical compound NC=N PNKUSGQVOMIXLU-UHFFFAOYSA-N 0.000 description 1
- 101710198884 GATA-type zinc finger protein 1 Proteins 0.000 description 1
- 229940125827 GPR40 agonist Drugs 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 101800001586 Ghrelin Proteins 0.000 description 1
- 102400000442 Ghrelin-28 Human genes 0.000 description 1
- 206010018364 Glomerulonephritis Diseases 0.000 description 1
- 102400000321 Glucagon Human genes 0.000 description 1
- 108060003199 Glucagon Proteins 0.000 description 1
- DTHNMHAUYICORS-KTKZVXAJSA-N Glucagon-like peptide 1 Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(N)=O)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC=1N=CNC=1)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=CC=C1 DTHNMHAUYICORS-KTKZVXAJSA-N 0.000 description 1
- 229940089838 Glucagon-like peptide 1 receptor agonist Drugs 0.000 description 1
- FAEKWTJYAYMJKF-QHCPKHFHSA-N GlucoNorm Chemical compound C1=C(C(O)=O)C(OCC)=CC(CC(=O)N[C@@H](CC(C)C)C=2C(=CC=CC=2)N2CCCCC2)=C1 FAEKWTJYAYMJKF-QHCPKHFHSA-N 0.000 description 1
- 229940121931 Gluconeogenesis inhibitor Drugs 0.000 description 1
- 208000002705 Glucose Intolerance Diseases 0.000 description 1
- 102000003638 Glucose-6-Phosphatase Human genes 0.000 description 1
- 108010086800 Glucose-6-Phosphatase Proteins 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- HNSCCNJWTJUGNQ-UHFFFAOYSA-N Glyclopyramide Chemical compound C1=CC(Cl)=CC=C1S(=O)(=O)NC(=O)NN1CCCC1 HNSCCNJWTJUGNQ-UHFFFAOYSA-N 0.000 description 1
- 229920002527 Glycogen Polymers 0.000 description 1
- BIVBRWYINDPWKA-VLQRKCJKSA-L Glycyrrhizinate dipotassium Chemical compound [K+].[K+].O([C@@H]1[C@@H](O)[C@H](O)[C@H](O[C@@H]1O[C@H]1CC[C@]2(C)[C@H]3C(=O)C=C4[C@@H]5C[C@](C)(CC[C@@]5(CC[C@@]4(C)[C@]3(C)CC[C@H]2C1(C)C)C)C(O)=O)C([O-])=O)[C@@H]1O[C@H](C([O-])=O)[C@@H](O)[C@H](O)[C@H]1O BIVBRWYINDPWKA-VLQRKCJKSA-L 0.000 description 1
- 208000009329 Graft vs Host Disease Diseases 0.000 description 1
- 102000004269 Granulocyte Colony-Stimulating Factor Human genes 0.000 description 1
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 1
- 108010051696 Growth Hormone Proteins 0.000 description 1
- 229940121710 HMGCoA reductase inhibitor Drugs 0.000 description 1
- 206010061192 Haemorrhagic fever Diseases 0.000 description 1
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 1
- 101001115394 Homo sapiens Dual specificity mitogen-activated protein kinase kinase 3 Proteins 0.000 description 1
- 101001115395 Homo sapiens Dual specificity mitogen-activated protein kinase kinase 4 Proteins 0.000 description 1
- 101000624426 Homo sapiens Dual specificity mitogen-activated protein kinase kinase 6 Proteins 0.000 description 1
- 101000624594 Homo sapiens Dual specificity mitogen-activated protein kinase kinase 7 Proteins 0.000 description 1
- 101000907578 Homo sapiens Forkhead box protein M1 Proteins 0.000 description 1
- 101000976075 Homo sapiens Insulin Proteins 0.000 description 1
- 208000023105 Huntington disease Diseases 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 1
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 1
- AVXURJPOCDRRFD-UHFFFAOYSA-N Hydroxylamine Chemical compound ON AVXURJPOCDRRFD-UHFFFAOYSA-N 0.000 description 1
- 206010020772 Hypertension Diseases 0.000 description 1
- 239000003458 I kappa b kinase inhibitor Substances 0.000 description 1
- 206010021245 Idiopathic thrombocytopenic purpura Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 1
- 102000004218 Insulin-Like Growth Factor I Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 102000013462 Interleukin-12 Human genes 0.000 description 1
- 108010065805 Interleukin-12 Proteins 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 102000000588 Interleukin-2 Human genes 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 208000029523 Interstitial Lung disease Diseases 0.000 description 1
- 201000001429 Intracranial Thrombosis Diseases 0.000 description 1
- SFBODOKJTYAUCM-UHFFFAOYSA-N Ipriflavone Chemical compound C=1C(OC(C)C)=CC=C(C2=O)C=1OC=C2C1=CC=CC=C1 SFBODOKJTYAUCM-UHFFFAOYSA-N 0.000 description 1
- 208000033463 Ischaemic neuropathy Diseases 0.000 description 1
- 108010041872 Islet Amyloid Polypeptide Proteins 0.000 description 1
- 102000036770 Islet Amyloid Polypeptide Human genes 0.000 description 1
- KLDXJTOLSGUMSJ-JGWLITMVSA-N Isosorbide Chemical compound O[C@@H]1CO[C@@H]2[C@@H](O)CO[C@@H]21 KLDXJTOLSGUMSJ-JGWLITMVSA-N 0.000 description 1
- 208000007766 Kaposi sarcoma Diseases 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- 229920001491 Lentinan Polymers 0.000 description 1
- 108090000581 Leukemia inhibitory factor Proteins 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- ZPXSCAKFGYXMGA-UHFFFAOYSA-N Mazindol Chemical compound N12CCN=C2C2=CC=CC=C2C1(O)C1=CC=C(Cl)C=C1 ZPXSCAKFGYXMGA-UHFFFAOYSA-N 0.000 description 1
- 102000029828 Melanin-concentrating hormone receptor Human genes 0.000 description 1
- 108010047068 Melanin-concentrating hormone receptor Proteins 0.000 description 1
- 101710151321 Melanostatin Proteins 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- QPJVMBTYPHYUOC-UHFFFAOYSA-N Methyl benzoate Natural products COC(=O)C1=CC=CC=C1 QPJVMBTYPHYUOC-UHFFFAOYSA-N 0.000 description 1
- IBAQFPQHRJAVAV-ULAWRXDQSA-N Miglitol Chemical compound OCCN1C[C@H](O)[C@@H](O)[C@H](O)[C@H]1CO IBAQFPQHRJAVAV-ULAWRXDQSA-N 0.000 description 1
- 229930192392 Mitomycin Natural products 0.000 description 1
- PCZOHLXUXFIOCF-UHFFFAOYSA-N Monacolin X Natural products C12C(OC(=O)C(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 PCZOHLXUXFIOCF-UHFFFAOYSA-N 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 1
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 1
- AYCPARAPKDAOEN-LJQANCHMSA-N N-[(1S)-2-(dimethylamino)-1-phenylethyl]-6,6-dimethyl-3-[(2-methyl-4-thieno[3,2-d]pyrimidinyl)amino]-1,4-dihydropyrrolo[3,4-c]pyrazole-5-carboxamide Chemical compound C1([C@H](NC(=O)N2C(C=3NN=C(NC=4C=5SC=CC=5N=C(C)N=4)C=3C2)(C)C)CN(C)C)=CC=CC=C1 AYCPARAPKDAOEN-LJQANCHMSA-N 0.000 description 1
- JTVPZMFULRWINT-UHFFFAOYSA-N N-[2-(diethylamino)ethyl]-2-methoxy-5-methylsulfonylbenzamide Chemical compound CCN(CC)CCNC(=O)C1=CC(S(C)(=O)=O)=CC=C1OC JTVPZMFULRWINT-UHFFFAOYSA-N 0.000 description 1
- 238000005481 NMR spectroscopy Methods 0.000 description 1
- 208000001894 Nasopharyngeal Neoplasms Diseases 0.000 description 1
- 206010061306 Nasopharyngeal cancer Diseases 0.000 description 1
- 229930182559 Natural dye Natural products 0.000 description 1
- 206010058116 Nephrogenic anaemia Diseases 0.000 description 1
- 102000015336 Nerve Growth Factor Human genes 0.000 description 1
- 102000007072 Nerve Growth Factors Human genes 0.000 description 1
- 102400000064 Neuropeptide Y Human genes 0.000 description 1
- 108090000742 Neurotrophin 3 Proteins 0.000 description 1
- 102100029268 Neurotrophin-3 Human genes 0.000 description 1
- ZBBHBTPTTSWHBA-UHFFFAOYSA-N Nicardipine Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OCCN(C)CC=2C=CC=CC=2)C1C1=CC=CC([N+]([O-])=O)=C1 ZBBHBTPTTSWHBA-UHFFFAOYSA-N 0.000 description 1
- KUEUWHJGRZKESU-UHFFFAOYSA-N Niceritrol Chemical compound C=1C=CN=CC=1C(=O)OCC(COC(=O)C=1C=NC=CC=1)(COC(=O)C=1C=NC=CC=1)COC(=O)C1=CC=CN=C1 KUEUWHJGRZKESU-UHFFFAOYSA-N 0.000 description 1
- VRAHPESAMYMDQI-UHFFFAOYSA-N Nicomol Chemical compound C1CCC(COC(=O)C=2C=NC=CC=2)(COC(=O)C=2C=NC=CC=2)C(O)C1(COC(=O)C=1C=NC=CC=1)COC(=O)C1=CC=CN=C1 VRAHPESAMYMDQI-UHFFFAOYSA-N 0.000 description 1
- 244000061176 Nicotiana tabacum Species 0.000 description 1
- 235000002637 Nicotiana tabacum Nutrition 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 1
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 1
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 229940123973 Oxygen scavenger Drugs 0.000 description 1
- 108010016731 PPAR gamma Proteins 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- CZYWHNTUXNGDGR-UHFFFAOYSA-L Pamidronate disodium Chemical compound O.O.O.O.O.[Na+].[Na+].NCCC(O)(P(O)([O-])=O)P(O)([O-])=O CZYWHNTUXNGDGR-UHFFFAOYSA-L 0.000 description 1
- 102000019280 Pancreatic lipases Human genes 0.000 description 1
- 108050006759 Pancreatic lipases Proteins 0.000 description 1
- 206010033645 Pancreatitis Diseases 0.000 description 1
- 206010033647 Pancreatitis acute Diseases 0.000 description 1
- 206010033661 Pancytopenia Diseases 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- 208000031481 Pathologic Constriction Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 102100038825 Peroxisome proliferator-activated receptor gamma Human genes 0.000 description 1
- 229940080774 Peroxisome proliferator-activated receptor gamma agonist Drugs 0.000 description 1
- 229940122294 Phosphorylase inhibitor Drugs 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- UJEWTUDSLQGTOA-UHFFFAOYSA-N Piretanide Chemical compound C=1C=CC=CC=1OC=1C(S(=O)(=O)N)=CC(C(O)=O)=CC=1N1CCCC1 UJEWTUDSLQGTOA-UHFFFAOYSA-N 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 208000008601 Polycythemia Diseases 0.000 description 1
- CYLWJCABXYDINA-UHFFFAOYSA-N Polythiazide Polymers ClC1=C(S(N)(=O)=O)C=C2S(=O)(=O)N(C)C(CSCC(F)(F)F)NC2=C1 CYLWJCABXYDINA-UHFFFAOYSA-N 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 229940127315 Potassium Channel Openers Drugs 0.000 description 1
- TUZYXOIXSAXUGO-UHFFFAOYSA-N Pravastatin Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(O)C=C21 TUZYXOIXSAXUGO-UHFFFAOYSA-N 0.000 description 1
- 208000024777 Prion disease Diseases 0.000 description 1
- 102100040918 Pro-glucagon Human genes 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-N Propionic acid Chemical compound CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 102000007327 Protamines Human genes 0.000 description 1
- 108010007568 Protamines Proteins 0.000 description 1
- 102000002727 Protein Tyrosine Phosphatase Human genes 0.000 description 1
- YZCKVEUIGOORGS-IGMARMGPSA-N Protium Chemical compound [1H] YZCKVEUIGOORGS-IGMARMGPSA-N 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 206010037660 Pyrexia Diseases 0.000 description 1
- 208000015634 Rectal Neoplasms Diseases 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- XSVMFMHYUFZWBK-NSHDSACASA-N Rivastigmine Chemical compound CCN(C)C(=O)OC1=CC=CC([C@H](C)N(C)C)=C1 XSVMFMHYUFZWBK-NSHDSACASA-N 0.000 description 1
- RYMZZMVNJRMUDD-UHFFFAOYSA-N SJ000286063 Natural products C12C(OC(=O)C(C)(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 RYMZZMVNJRMUDD-UHFFFAOYSA-N 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- POQBIDFFYCYHOB-UHFFFAOYSA-N Sarpogrelate hydrochloride Chemical compound Cl.COC1=CC=CC(CCC=2C(=CC=CC=2)OCC(CN(C)C)OC(=O)CCC(O)=O)=C1 POQBIDFFYCYHOB-UHFFFAOYSA-N 0.000 description 1
- 229920002305 Schizophyllan Polymers 0.000 description 1
- 206010039710 Scleroderma Diseases 0.000 description 1
- JLRNKCZRCMIVKA-UHFFFAOYSA-N Simfibrate Chemical compound C=1C=C(Cl)C=CC=1OC(C)(C)C(=O)OCCCOC(=O)C(C)(C)OC1=CC=C(Cl)C=C1 JLRNKCZRCMIVKA-UHFFFAOYSA-N 0.000 description 1
- 208000021386 Sjogren Syndrome Diseases 0.000 description 1
- 208000000453 Skin Neoplasms Diseases 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- ABBQHOQBGMUPJH-UHFFFAOYSA-M Sodium salicylate Chemical compound [Na+].OC1=CC=CC=C1C([O-])=O ABBQHOQBGMUPJH-UHFFFAOYSA-M 0.000 description 1
- 102000000070 Sodium-Glucose Transport Proteins Human genes 0.000 description 1
- 108010080361 Sodium-Glucose Transport Proteins Proteins 0.000 description 1
- 229940127504 Somatostatin Receptor Agonists Drugs 0.000 description 1
- 229940123051 Somatostatin receptor agonist Drugs 0.000 description 1
- 102100038803 Somatotropin Human genes 0.000 description 1
- 208000009415 Spinocerebellar Ataxias Diseases 0.000 description 1
- 244000228451 Stevia rebaudiana Species 0.000 description 1
- 208000005718 Stomach Neoplasms Diseases 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-N Sulfurous acid Chemical compound OS(O)=O LSNNMFCWUKXFEE-UHFFFAOYSA-N 0.000 description 1
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical compound [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 description 1
- 206010042496 Sunburn Diseases 0.000 description 1
- 208000000389 T-cell leukemia Diseases 0.000 description 1
- 208000028530 T-cell lymphoblastic leukemia/lymphoma Diseases 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 239000004809 Teflon Substances 0.000 description 1
- 229920006362 Teflon® Polymers 0.000 description 1
- 206010043276 Teratoma Diseases 0.000 description 1
- DHXVGJBLRPWPCS-UHFFFAOYSA-N Tetrahydropyran Chemical compound C1CCOCC1 DHXVGJBLRPWPCS-UHFFFAOYSA-N 0.000 description 1
- YPWFISCTZQNZAU-UHFFFAOYSA-N Thiane Chemical compound C1CCSCC1 YPWFISCTZQNZAU-UHFFFAOYSA-N 0.000 description 1
- 102100036407 Thioredoxin Human genes 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 208000031981 Thrombocytopenic Idiopathic Purpura Diseases 0.000 description 1
- 206010043693 Thyroid atrophy Diseases 0.000 description 1
- JLRGJRBPOGGCBT-UHFFFAOYSA-N Tolbutamide Chemical compound CCCCNC(=O)NS(=O)(=O)C1=CC=C(C)C=C1 JLRGJRBPOGGCBT-UHFFFAOYSA-N 0.000 description 1
- 206010044278 Trace element deficiency Diseases 0.000 description 1
- 208000032109 Transient ischaemic attack Diseases 0.000 description 1
- FNYLWPVRPXGIIP-UHFFFAOYSA-N Triamterene Chemical compound NC1=NC2=NC(N)=NC(N)=C2N=C1C1=CC=CC=C1 FNYLWPVRPXGIIP-UHFFFAOYSA-N 0.000 description 1
- 201000006704 Ulcerative Colitis Diseases 0.000 description 1
- 108090000435 Urokinase-type plasminogen activator Proteins 0.000 description 1
- 102000003990 Urokinase-type plasminogen activator Human genes 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 208000002495 Uterine Neoplasms Diseases 0.000 description 1
- 206010047627 Vitamin deficiencies Diseases 0.000 description 1
- FZNCGRZWXLXZSZ-CIQUZCHMSA-N Voglibose Chemical compound OCC(CO)N[C@H]1C[C@](O)(CO)[C@@H](O)[C@H](O)[C@H]1O FZNCGRZWXLXZSZ-CIQUZCHMSA-N 0.000 description 1
- 208000008383 Wilms tumor Diseases 0.000 description 1
- BXNCIERBDJYIQT-PRDVQWLOSA-N [(2r,3s,4s,5r,6s)-6-[2-[3-(1-benzofuran-5-yl)propanoyl]-3-hydroxy-5-methylphenoxy]-3,4,5-trihydroxyoxan-2-yl]methyl methyl carbonate Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](COC(=O)OC)O[C@H]1OC1=CC(C)=CC(O)=C1C(=O)CCC1=CC=C(OC=C2)C2=C1 BXNCIERBDJYIQT-PRDVQWLOSA-N 0.000 description 1
- SSIUXDZTVISVRB-UHFFFAOYSA-M [K+].NC(=O)C1=CC=CC=C1C([O-])=O Chemical compound [K+].NC(=O)C1=CC=CC=C1C([O-])=O SSIUXDZTVISVRB-UHFFFAOYSA-M 0.000 description 1
- YKTSYUJCYHOUJP-UHFFFAOYSA-N [O--].[Al+3].[Al+3].[O-][Si]([O-])([O-])[O-] Chemical compound [O--].[Al+3].[Al+3].[O-][Si]([O-])([O-])[O-] YKTSYUJCYHOUJP-UHFFFAOYSA-N 0.000 description 1
- WLLIXJBWWFGEHT-UHFFFAOYSA-N [tert-butyl(dimethyl)silyl] trifluoromethanesulfonate Chemical compound CC(C)(C)[Si](C)(C)OS(=O)(=O)C(F)(F)F WLLIXJBWWFGEHT-UHFFFAOYSA-N 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 229960002632 acarbose Drugs 0.000 description 1
- XUFXOAAUWZOOIT-UHFFFAOYSA-N acarviostatin I01 Natural products OC1C(O)C(NC2C(C(O)C(O)C(CO)=C2)O)C(C)OC1OC(C(C1O)O)C(CO)OC1OC1C(CO)OC(O)C(O)C1O XUFXOAAUWZOOIT-UHFFFAOYSA-N 0.000 description 1
- BZKPWHYZMXOIDC-UHFFFAOYSA-N acetazolamide Chemical compound CC(=O)NC1=NN=C(S(N)(=O)=O)S1 BZKPWHYZMXOIDC-UHFFFAOYSA-N 0.000 description 1
- 229960000571 acetazolamide Drugs 0.000 description 1
- HXGDTGSAIMULJN-UHFFFAOYSA-N acetnaphthylene Natural products C1=CC(C=C2)=C3C2=CC=CC3=C1 HXGDTGSAIMULJN-UHFFFAOYSA-N 0.000 description 1
- 229960001466 acetohexamide Drugs 0.000 description 1
- VGZSUPCWNCWDAN-UHFFFAOYSA-N acetohexamide Chemical compound C1=CC(C(=O)C)=CC=C1S(=O)(=O)NC(=O)NC1CCCCC1 VGZSUPCWNCWDAN-UHFFFAOYSA-N 0.000 description 1
- XBJFCYDKBDVADW-UHFFFAOYSA-N acetonitrile;formic acid Chemical compound CC#N.OC=O XBJFCYDKBDVADW-UHFFFAOYSA-N 0.000 description 1
- PBCJIPOGFJYBJE-UHFFFAOYSA-N acetonitrile;hydrate Chemical compound O.CC#N PBCJIPOGFJYBJE-UHFFFAOYSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 201000003229 acute pancreatitis Diseases 0.000 description 1
- 230000010933 acylation Effects 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 229940009456 adriamycin Drugs 0.000 description 1
- MKOMESMZHZNBIZ-UHFFFAOYSA-M alagebrium Chemical compound [Cl-].CC1=C(C)SC=[N+]1CC(=O)C1=CC=CC=C1 MKOMESMZHZNBIZ-UHFFFAOYSA-M 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 239000003288 aldose reductase inhibitor Substances 0.000 description 1
- 229940090865 aldose reductase inhibitors used in diabetes Drugs 0.000 description 1
- 239000002170 aldosterone antagonist Substances 0.000 description 1
- DCSBSVSZJRSITC-UHFFFAOYSA-M alendronate sodium trihydrate Chemical compound O.O.O.[Na+].NCCCC(O)(P(O)(O)=O)P(O)([O-])=O DCSBSVSZJRSITC-UHFFFAOYSA-M 0.000 description 1
- 229960004343 alendronic acid Drugs 0.000 description 1
- OFHCOWSQAMBJIW-AVJTYSNKSA-N alfacalcidol Chemical compound C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@H](C)CCCC(C)C)=C\C=C1\C[C@@H](O)C[C@H](O)C1=C OFHCOWSQAMBJIW-AVJTYSNKSA-N 0.000 description 1
- 229960002535 alfacalcidol Drugs 0.000 description 1
- 150000007933 aliphatic carboxylic acids Chemical class 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 238000005904 alkaline hydrolysis reaction Methods 0.000 description 1
- 150000004703 alkoxides Chemical class 0.000 description 1
- 125000005115 alkyl carbamoyl group Chemical group 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- 230000029936 alkylation Effects 0.000 description 1
- 238000005804 alkylation reaction Methods 0.000 description 1
- JAZBEHYOTPTENJ-JLNKQSITSA-N all-cis-5,8,11,14,17-icosapentaenoic acid Chemical compound CC\C=C/C\C=C/C\C=C/C\C=C/C\C=C/CCCC(O)=O JAZBEHYOTPTENJ-JLNKQSITSA-N 0.000 description 1
- KEJICOXJTRHYAK-XFULWGLBSA-N alogliptin benzoate Chemical compound OC(=O)C1=CC=CC=C1.C=1C=CC=C(C#N)C=1CN1C(=O)N(C)C(=O)C=C1N1CCC[C@@H](N)C1 KEJICOXJTRHYAK-XFULWGLBSA-N 0.000 description 1
- 229960000447 alogliptin benzoate Drugs 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229960003318 alteplase Drugs 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 238000007112 amidation reaction Methods 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- DFNYGALUNNFWKJ-UHFFFAOYSA-N aminoacetonitrile Chemical compound NCC#N DFNYGALUNNFWKJ-UHFFFAOYSA-N 0.000 description 1
- HTIQEAQVCYTUBX-UHFFFAOYSA-N amlodipine Chemical compound CCOC(=O)C1=C(COCCN)NC(C)=C(C(=O)OC)C1C1=CC=CC=C1Cl HTIQEAQVCYTUBX-UHFFFAOYSA-N 0.000 description 1
- 229960000528 amlodipine Drugs 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 208000007502 anemia Diseases 0.000 description 1
- 238000002399 angioplasty Methods 0.000 description 1
- 239000002333 angiotensin II receptor antagonist Substances 0.000 description 1
- 229940044094 angiotensin-converting-enzyme inhibitor Drugs 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000003957 anion exchange resin Substances 0.000 description 1
- 230000000507 anthelmentic effect Effects 0.000 description 1
- 239000000921 anthelmintic agent Substances 0.000 description 1
- 125000005428 anthryl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C(*)=C([H])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 230000001887 anti-feedant effect Effects 0.000 description 1
- 230000000340 anti-metabolite Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 229940125682 antidementia agent Drugs 0.000 description 1
- 229940006133 antiglaucoma drug and miotics carbonic anhydrase inhibitors Drugs 0.000 description 1
- 229940100197 antimetabolite Drugs 0.000 description 1
- 239000002256 antimetabolite Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 229940127218 antiplatelet drug Drugs 0.000 description 1
- 239000000074 antisense oligonucleotide Substances 0.000 description 1
- 238000012230 antisense oligonucleotides Methods 0.000 description 1
- 239000004019 antithrombin Substances 0.000 description 1
- 208000031056 aortic malformation Diseases 0.000 description 1
- VMWNQDUVQKEIOC-CYBMUJFWSA-N apomorphine Chemical compound C([C@H]1N(C)CC2)C3=CC=C(O)C(O)=C3C3=C1C2=CC=C3 VMWNQDUVQKEIOC-CYBMUJFWSA-N 0.000 description 1
- 229960004046 apomorphine Drugs 0.000 description 1
- 239000002830 appetite depressant Substances 0.000 description 1
- 125000005140 aralkylsulfonyl group Chemical group 0.000 description 1
- KXNPVXPOPUZYGB-XYVMCAHJSA-N argatroban Chemical compound OC(=O)[C@H]1C[C@H](C)CCN1C(=O)[C@H](CCCN=C(N)N)NS(=O)(=O)C1=CC=CC2=C1NC[C@H](C)C2 KXNPVXPOPUZYGB-XYVMCAHJSA-N 0.000 description 1
- 229960003856 argatroban Drugs 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 208000011775 arteriosclerosis disease Diseases 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 125000005098 aryl alkoxy carbonyl group Chemical group 0.000 description 1
- 125000004659 aryl alkyl thio group Chemical group 0.000 description 1
- 125000005116 aryl carbamoyl group Chemical group 0.000 description 1
- 125000005161 aryl oxy carbonyl group Chemical group 0.000 description 1
- 125000004104 aryloxy group Chemical group 0.000 description 1
- 229940072107 ascorbate Drugs 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 239000000605 aspartame Substances 0.000 description 1
- IAOZJIPTCAWIRG-QWRGUYRKSA-N aspartame Chemical compound OC(=O)C[C@H](N)C(=O)N[C@H](C(=O)OC)CC1=CC=CC=C1 IAOZJIPTCAWIRG-QWRGUYRKSA-N 0.000 description 1
- 235000010357 aspartame Nutrition 0.000 description 1
- 229960003438 aspartame Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 229960005370 atorvastatin Drugs 0.000 description 1
- 230000037444 atrophy Effects 0.000 description 1
- 208000016627 atrophy of thyroid Diseases 0.000 description 1
- 201000003710 autoimmune thrombocytopenic purpura Diseases 0.000 description 1
- 201000004562 autosomal dominant cerebellar ataxia Diseases 0.000 description 1
- 229950010046 avasimibe Drugs 0.000 description 1
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 1
- IIOPLILENRZKRV-UHFFFAOYSA-N azosemide Chemical compound C=1C=CSC=1CNC=1C=C(Cl)C(S(=O)(=O)N)=CC=1C1=NN=N[N]1 IIOPLILENRZKRV-UHFFFAOYSA-N 0.000 description 1
- 229960004988 azosemide Drugs 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 229950010663 balaglitazone Drugs 0.000 description 1
- RQPZNWPYLFFXCP-UHFFFAOYSA-L barium dihydroxide Chemical compound [OH-].[OH-].[Ba+2] RQPZNWPYLFFXCP-UHFFFAOYSA-L 0.000 description 1
- 229910001863 barium hydroxide Inorganic materials 0.000 description 1
- ZUDYPQRUOYEARG-UHFFFAOYSA-L barium(2+);dihydroxide;octahydrate Chemical compound O.O.O.O.O.O.O.O.[OH-].[OH-].[Ba+2] ZUDYPQRUOYEARG-UHFFFAOYSA-L 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- UDSRUCAJZSIRHZ-UHFFFAOYSA-N benzamide dihydrochloride Chemical compound Cl.Cl.NC(=O)C1=CC=CC=C1.NC(=O)C1=CC=CC=C1 UDSRUCAJZSIRHZ-UHFFFAOYSA-N 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- BMWITAUNXBHIPO-OZZZDHQUSA-N benzenesulfonic acid;(2s,4s)-4-fluoro-1-[2-[(1-hydroxy-2-methylpropan-2-yl)amino]acetyl]pyrrolidine-2-carbonitrile Chemical compound OS(=O)(=O)C1=CC=CC=C1.OCC(C)(C)NCC(=O)N1C[C@@H](F)C[C@H]1C#N BMWITAUNXBHIPO-OZZZDHQUSA-N 0.000 description 1
- UREZNYTWGJKWBI-UHFFFAOYSA-M benzethonium chloride Chemical compound [Cl-].C1=CC(C(C)(C)CC(C)(C)C)=CC=C1OCCOCC[N+](C)(C)CC1=CC=CC=C1 UREZNYTWGJKWBI-UHFFFAOYSA-M 0.000 description 1
- 229960001950 benzethonium chloride Drugs 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000004603 benzisoxazolyl group Chemical group O1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000003354 benzotriazolyl group Chemical group N1N=NC2=C1C=CC=C2* 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- SNIABFMMCKVXSY-UHFFFAOYSA-N benzoylazanium;chloride Chemical compound Cl.NC(=O)C1=CC=CC=C1 SNIABFMMCKVXSY-UHFFFAOYSA-N 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- 229960002903 benzyl benzoate Drugs 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- QQFYLZXBFWWJHR-UHFFFAOYSA-M benzyl(triethyl)phosphanium;bromide Chemical compound [Br-].CC[P+](CC)(CC)CC1=CC=CC=C1 QQFYLZXBFWWJHR-UHFFFAOYSA-M 0.000 description 1
- XKXHCNPAFAXVRZ-UHFFFAOYSA-N benzylazanium;chloride Chemical compound [Cl-].[NH3+]CC1=CC=CC=C1 XKXHCNPAFAXVRZ-UHFFFAOYSA-N 0.000 description 1
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 1
- 229960002890 beraprost Drugs 0.000 description 1
- YTCZZXIRLARSET-VJRSQJMHSA-M beraprost sodium Chemical compound [Na+].O([C@H]1C[C@@H](O)[C@@H]([C@@H]21)/C=C/[C@@H](O)C(C)CC#CC)C1=C2C=CC=C1CCCC([O-])=O YTCZZXIRLARSET-VJRSQJMHSA-M 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- AGSPXMVUFBBBMO-UHFFFAOYSA-N beta-aminopropionitrile Chemical compound NCCC#N AGSPXMVUFBBBMO-UHFFFAOYSA-N 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 229960000516 bezafibrate Drugs 0.000 description 1
- IIBYAHWJQTYFKB-UHFFFAOYSA-N bezafibrate Chemical compound C1=CC(OC(C)(C)C(O)=O)=CC=C1CCNC(=O)C1=CC=C(Cl)C=C1 IIBYAHWJQTYFKB-UHFFFAOYSA-N 0.000 description 1
- 125000002619 bicyclic group Chemical group 0.000 description 1
- GPRLTFBKWDERLU-UHFFFAOYSA-N bicyclo[2.2.2]octane Chemical compound C1CC2CCC1CC2 GPRLTFBKWDERLU-UHFFFAOYSA-N 0.000 description 1
- GNTFBMAGLFYMMZ-UHFFFAOYSA-N bicyclo[3.2.2]nonane Chemical compound C1CC2CCC1CCC2 GNTFBMAGLFYMMZ-UHFFFAOYSA-N 0.000 description 1
- WNTGVOIBBXFMLR-UHFFFAOYSA-N bicyclo[3.3.1]nonane Chemical compound C1CCC2CCCC1C2 WNTGVOIBBXFMLR-UHFFFAOYSA-N 0.000 description 1
- KVLCIHRZDOKRLK-UHFFFAOYSA-N bicyclo[4.2.1]nonane Chemical compound C1C2CCC1CCCC2 KVLCIHRZDOKRLK-UHFFFAOYSA-N 0.000 description 1
- QEGGPUAKCVWNOT-UHFFFAOYSA-N bicyclo[4.3.1]decane Chemical compound C1C2CCCC1CCCC2 QEGGPUAKCVWNOT-UHFFFAOYSA-N 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- XSEUMFJMFFMCIU-UHFFFAOYSA-N buformin Chemical compound CCCC\N=C(/N)N=C(N)N XSEUMFJMFFMCIU-UHFFFAOYSA-N 0.000 description 1
- 229960004111 buformin Drugs 0.000 description 1
- MAEIEVLCKWDQJH-UHFFFAOYSA-N bumetanide Chemical compound CCCCNC1=CC(C(O)=O)=CC(S(N)(=O)=O)=C1OC1=CC=CC=C1 MAEIEVLCKWDQJH-UHFFFAOYSA-N 0.000 description 1
- 229960004064 bumetanide Drugs 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- YHASWHZGWUONAO-UHFFFAOYSA-N butanoyl butanoate Chemical compound CCCC(=O)OC(=O)CCC YHASWHZGWUONAO-UHFFFAOYSA-N 0.000 description 1
- 125000004063 butyryl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- BBBFJLBPOGFECG-VJVYQDLKSA-N calcitonin Chemical compound N([C@H](C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(N)=O)C(C)C)C(=O)[C@@H]1CSSC[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1 BBBFJLBPOGFECG-VJVYQDLKSA-N 0.000 description 1
- 229960003773 calcitonin (salmon synthetic) Drugs 0.000 description 1
- GMRQFYUYWCNGIN-NKMMMXOESA-N calcitriol Chemical compound C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@@H](CCCC(C)(C)O)C)=C\C=C1\C[C@@H](O)C[C@H](O)C1=C GMRQFYUYWCNGIN-NKMMMXOESA-N 0.000 description 1
- 229960005084 calcitriol Drugs 0.000 description 1
- 235000020964 calcitriol Nutrition 0.000 description 1
- 239000011612 calcitriol Substances 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- GDDSFMMICZTVCA-UHFFFAOYSA-L calcium;2-carboxyphenolate;3,7-dimethylpurine-2,6-dione Chemical compound [Ca+2].OC1=CC=CC=C1C([O-])=O.OC1=CC=CC=C1C([O-])=O.CN1C(=O)NC(=O)C2=C1N=CN2C GDDSFMMICZTVCA-UHFFFAOYSA-L 0.000 description 1
- 229960004349 candesartan cilexetil Drugs 0.000 description 1
- 239000003536 cannabinoid receptor antagonist Substances 0.000 description 1
- 210000000692 cap cell Anatomy 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- FAKRSMQSSFJEIM-RQJHMYQMSA-N captopril Chemical compound SC[C@@H](C)C(=O)N1CCC[C@H]1C(O)=O FAKRSMQSSFJEIM-RQJHMYQMSA-N 0.000 description 1
- 229960000830 captopril Drugs 0.000 description 1
- 125000003739 carbamimidoyl group Chemical group C(N)(=N)* 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 239000003489 carbonate dehydratase inhibitor Substances 0.000 description 1
- 125000005708 carbonyloxy group Chemical group [*:2]OC([*:1])=O 0.000 description 1
- 229960004562 carboplatin Drugs 0.000 description 1
- 229940084030 carboxymethylcellulose calcium Drugs 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- 208000015100 cartilage disease Diseases 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 230000005779 cell damage Effects 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 208000037887 cell injury Diseases 0.000 description 1
- 229940112021 centrally acting muscle relaxants carbamic acid ester Drugs 0.000 description 1
- 208000025434 cerebellar degeneration Diseases 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 206010008118 cerebral infarction Diseases 0.000 description 1
- VYLVYHXQOHJDJL-UHFFFAOYSA-K cerium trichloride Chemical compound Cl[Ce](Cl)Cl VYLVYHXQOHJDJL-UHFFFAOYSA-K 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- MVCQKIKWYUURMU-UHFFFAOYSA-N cetilistat Chemical compound C1=C(C)C=C2C(=O)OC(OCCCCCCCCCCCCCCCC)=NC2=C1 MVCQKIKWYUURMU-UHFFFAOYSA-N 0.000 description 1
- 229950002397 cetilistat Drugs 0.000 description 1
- JUFFVKRROAPVBI-PVOYSMBESA-N chembl1210015 Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(=O)N[C@H]1[C@@H]([C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO[C@]3(O[C@@H](C[C@H](O)[C@H](O)CO)[C@H](NC(C)=O)[C@@H](O)C3)C(O)=O)O2)O)[C@@H](CO)O1)NC(C)=O)C(=O)NCC(=O)NCC(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CO)C(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCSC)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)CNC(=O)[C@@H](N)CC=1NC=NC=1)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=CC=C1 JUFFVKRROAPVBI-PVOYSMBESA-N 0.000 description 1
- KXZJHVJKXJLBKO-UHFFFAOYSA-N chembl1408157 Chemical compound N=1C2=CC=CC=C2C(C(=O)O)=CC=1C1=CC=C(O)C=C1 KXZJHVJKXJLBKO-UHFFFAOYSA-N 0.000 description 1
- DDPFHDCZUJFNAT-PZPWKVFESA-N chembl2104402 Chemical compound N([C@H](C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1N=CNC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(N)=O)C(C)C)C(=O)[C@@H]1CCCCCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1 DDPFHDCZUJFNAT-PZPWKVFESA-N 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- 229930002875 chlorophyll Natural products 0.000 description 1
- 235000019804 chlorophyll Nutrition 0.000 description 1
- ATNHDLDRLWWWCB-AENOIHSZSA-M chlorophyll a Chemical compound C1([C@@H](C(=O)OC)C(=O)C2=C3C)=C2N2C3=CC(C(CC)=C3C)=[N+]4C3=CC3=C(C=C)C(C)=C5N3[Mg-2]42[N+]2=C1[C@@H](CCC(=O)OC\C=C(/C)CCC[C@H](C)CCC[C@H](C)CCCC(C)C)[C@H](C)C2=C5 ATNHDLDRLWWWCB-AENOIHSZSA-M 0.000 description 1
- 229960001761 chlorpropamide Drugs 0.000 description 1
- 229960001523 chlortalidone Drugs 0.000 description 1
- 229940107137 cholecystokinin Drugs 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- 239000000544 cholinesterase inhibitor Substances 0.000 description 1
- 235000019504 cigarettes Nutrition 0.000 description 1
- 230000001886 ciliary effect Effects 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- 229950003072 clinofibrate Drugs 0.000 description 1
- 229960002492 clobenzorex Drugs 0.000 description 1
- LRXXRIXDSAEIOR-ZDUSSCGKSA-N clobenzorex Chemical compound C([C@H](C)NCC=1C(=CC=CC=1)Cl)C1=CC=CC=C1 LRXXRIXDSAEIOR-ZDUSSCGKSA-N 0.000 description 1
- 229960001214 clofibrate Drugs 0.000 description 1
- KNHUKKLJHYUCFP-UHFFFAOYSA-N clofibrate Chemical compound CCOC(=O)C(C)(C)OC1=CC=C(Cl)C=C1 KNHUKKLJHYUCFP-UHFFFAOYSA-N 0.000 description 1
- 229960002896 clonidine Drugs 0.000 description 1
- 206010009887 colitis Diseases 0.000 description 1
- 239000008119 colloidal silica Substances 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 239000012230 colorless oil Substances 0.000 description 1
- 229940000425 combination drug Drugs 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- DOBRDRYODQBAMW-UHFFFAOYSA-N copper(i) cyanide Chemical compound [Cu+].N#[C-] DOBRDRYODQBAMW-UHFFFAOYSA-N 0.000 description 1
- OPQARKPSCNTWTJ-UHFFFAOYSA-L copper(ii) acetate Chemical compound [Cu+2].CC([O-])=O.CC([O-])=O OPQARKPSCNTWTJ-UHFFFAOYSA-L 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 229960001681 croscarmellose sodium Drugs 0.000 description 1
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 1
- 125000000392 cycloalkenyl group Chemical group 0.000 description 1
- 125000000000 cycloalkoxy group Chemical group 0.000 description 1
- 125000006310 cycloalkyl amino group Chemical group 0.000 description 1
- ZXIJMRYMVAMXQP-UHFFFAOYSA-N cycloheptene Chemical compound C1CCC=CCC1 ZXIJMRYMVAMXQP-UHFFFAOYSA-N 0.000 description 1
- MGNZXYYWBUKAII-UHFFFAOYSA-N cyclohexa-1,3-diene Chemical compound C1CC=CC=C1 MGNZXYYWBUKAII-UHFFFAOYSA-N 0.000 description 1
- 125000004210 cyclohexylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000002933 cyclohexyloxy group Chemical group C1(CCCCC1)O* 0.000 description 1
- WJTCGQSWYFHTAC-UHFFFAOYSA-N cyclooctane Chemical compound C1CCCCCCC1 WJTCGQSWYFHTAC-UHFFFAOYSA-N 0.000 description 1
- 239000004914 cyclooctane Substances 0.000 description 1
- URYYVOIYTNXXBN-UPHRSURJSA-N cyclooctene Chemical compound C1CCC\C=C/CC1 URYYVOIYTNXXBN-UPHRSURJSA-N 0.000 description 1
- 239000004913 cyclooctene Substances 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- ZSWFCLXCOIISFI-UHFFFAOYSA-N cyclopentadiene Chemical compound C1C=CC=C1 ZSWFCLXCOIISFI-UHFFFAOYSA-N 0.000 description 1
- 229960003206 cyclopenthiazide Drugs 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- ZOOSILUVXHVRJE-UHFFFAOYSA-N cyclopropanecarbonyl chloride Chemical compound ClC(=O)C1CC1 ZOOSILUVXHVRJE-UHFFFAOYSA-N 0.000 description 1
- 208000024389 cytopenia Diseases 0.000 description 1
- 229940018872 dalteparin sodium Drugs 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 235000019258 dehydroacetic acid Nutrition 0.000 description 1
- JEQRBTDTEKWZBW-UHFFFAOYSA-N dehydroacetic acid Chemical compound CC(=O)C1=C(O)OC(C)=CC1=O JEQRBTDTEKWZBW-UHFFFAOYSA-N 0.000 description 1
- 229940061632 dehydroacetic acid Drugs 0.000 description 1
- PGRHXDWITVMQBC-UHFFFAOYSA-N dehydroacetic acid Natural products CC(=O)C1C(=O)OC(C)=CC1=O PGRHXDWITVMQBC-UHFFFAOYSA-N 0.000 description 1
- WOUOLAUOZXOLJQ-MBSDFSHPSA-N delapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N(CC(O)=O)C1CC2=CC=CC=C2C1)CC1=CC=CC=C1 WOUOLAUOZXOLJQ-MBSDFSHPSA-N 0.000 description 1
- 229960005227 delapril Drugs 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- 229960004597 dexfenfluramine Drugs 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 125000005433 dihydrobenzodioxinyl group Chemical group O1C(COC2=C1C=CC=C2)* 0.000 description 1
- 125000000723 dihydrobenzofuranyl group Chemical group O1C(CC2=C1C=CC=C2)* 0.000 description 1
- 125000001070 dihydroindolyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000004611 dihydroisoindolyl group Chemical group C1(NCC2=CC=CC=C12)* 0.000 description 1
- 125000005045 dihydroisoquinolinyl group Chemical group C1(NC=CC2=CC=CC=C12)* 0.000 description 1
- 125000005046 dihydronaphthyl group Chemical group 0.000 description 1
- 125000005049 dihydrooxadiazolyl group Chemical group O1N(NC=C1)* 0.000 description 1
- 125000005044 dihydroquinolinyl group Chemical group N1(CC=CC2=CC=CC=C12)* 0.000 description 1
- 125000005058 dihydrotriazolyl group Chemical group N1(NNC=C1)* 0.000 description 1
- 125000006222 dimethylaminomethyl group Chemical group [H]C([H])([H])N(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 239000003603 dipeptidyl peptidase IV inhibitor Substances 0.000 description 1
- MKRTXPORKIRPDG-UHFFFAOYSA-N diphenylphosphoryl azide Chemical compound C=1C=CC=CC=1P(=O)(N=[N+]=[N-])C1=CC=CC=C1 MKRTXPORKIRPDG-UHFFFAOYSA-N 0.000 description 1
- WJJMNDUMQPNECX-UHFFFAOYSA-N dipicolinic acid Chemical compound OC(=O)C1=CC=CC(C(O)=O)=N1 WJJMNDUMQPNECX-UHFFFAOYSA-N 0.000 description 1
- 229940101029 dipotassium glycyrrhizinate Drugs 0.000 description 1
- 230000008034 disappearance Effects 0.000 description 1
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 229960001446 distigmine Drugs 0.000 description 1
- GJHSNEVFXQVOHR-UHFFFAOYSA-L distigmine bromide Chemical compound [Br-].[Br-].C=1C=C[N+](C)=CC=1OC(=O)N(C)CCCCCCN(C)C(=O)OC1=CC=C[N+](C)=C1 GJHSNEVFXQVOHR-UHFFFAOYSA-L 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 230000001882 diuretic effect Effects 0.000 description 1
- DLNKOYKMWOXYQA-UHFFFAOYSA-N dl-pseudophenylpropanolamine Natural products CC(N)C(O)C1=CC=CC=C1 DLNKOYKMWOXYQA-UHFFFAOYSA-N 0.000 description 1
- 229960003530 donepezil Drugs 0.000 description 1
- ZWAOHEXOSAUJHY-ZIYNGMLESA-N doxifluridine Chemical compound O[C@@H]1[C@H](O)[C@@H](C)O[C@H]1N1C(=O)NC(=O)C(F)=C1 ZWAOHEXOSAUJHY-ZIYNGMLESA-N 0.000 description 1
- 229950005454 doxifluridine Drugs 0.000 description 1
- 238000009509 drug development Methods 0.000 description 1
- 229940125542 dual agonist Drugs 0.000 description 1
- 229950000195 edaglitazone Drugs 0.000 description 1
- 229950005925 eflucimibe Drugs 0.000 description 1
- 229950003102 efonidipine Drugs 0.000 description 1
- 229960005135 eicosapentaenoic acid Drugs 0.000 description 1
- JAZBEHYOTPTENJ-UHFFFAOYSA-N eicosapentaenoic acid Natural products CCC=CCC=CCC=CCC=CCC=CCCCC(O)=O JAZBEHYOTPTENJ-UHFFFAOYSA-N 0.000 description 1
- 235000020673 eicosapentaenoic acid Nutrition 0.000 description 1
- 108700032313 elcatonin Proteins 0.000 description 1
- 229960000756 elcatonin Drugs 0.000 description 1
- 229950000269 emiglitate Drugs 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- GBXSMTUPTTWBMN-XIRDDKMYSA-N enalapril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(O)=O)CC1=CC=CC=C1 GBXSMTUPTTWBMN-XIRDDKMYSA-N 0.000 description 1
- 229960000873 enalapril Drugs 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- CHNUOJQWGUIOLD-NFZZJPOKSA-N epalrestat Chemical compound C=1C=CC=CC=1\C=C(/C)\C=C1/SC(=S)N(CC(O)=O)C1=O CHNUOJQWGUIOLD-NFZZJPOKSA-N 0.000 description 1
- 229950010170 epalrestat Drugs 0.000 description 1
- CHNUOJQWGUIOLD-UHFFFAOYSA-N epalrestate Natural products C=1C=CC=CC=1C=C(C)C=C1SC(=S)N(CC(O)=O)C1=O CHNUOJQWGUIOLD-UHFFFAOYSA-N 0.000 description 1
- OROAFUQRIXKEMV-LDADJPATSA-N eprosartan Chemical compound C=1C=C(C(O)=O)C=CC=1CN1C(CCCC)=NC=C1\C=C(C(O)=O)/CC1=CC=CS1 OROAFUQRIXKEMV-LDADJPATSA-N 0.000 description 1
- 229960004563 eprosartan Drugs 0.000 description 1
- 229940105423 erythropoietin Drugs 0.000 description 1
- 201000004101 esophageal cancer Diseases 0.000 description 1
- 230000032050 esterification Effects 0.000 description 1
- 238000005886 esterification reaction Methods 0.000 description 1
- PROQIPRRNZUXQM-ZXXIGWHRSA-N estriol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H]([C@H](O)C4)O)[C@@H]4[C@@H]3CCC2=C1 PROQIPRRNZUXQM-ZXXIGWHRSA-N 0.000 description 1
- 229960001348 estriol Drugs 0.000 description 1
- AVOLMBLBETYQHX-UHFFFAOYSA-N etacrynic acid Chemical compound CCC(=C)C(=O)C1=CC=C(OCC(O)=O)C(Cl)=C1Cl AVOLMBLBETYQHX-UHFFFAOYSA-N 0.000 description 1
- 229960003199 etacrynic acid Drugs 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- 125000005678 ethenylene group Chemical group [H]C([*:1])=C([H])[*:2] 0.000 description 1
- GYJDDFRINXUYPA-UHFFFAOYSA-N ethyl 3-(4-carbonochloridoylphenyl)-3-methylbutanoate Chemical compound CCOC(=O)CC(C)(C)C1=CC=C(C(Cl)=O)C=C1 GYJDDFRINXUYPA-UHFFFAOYSA-N 0.000 description 1
- FCYGLXWGXGRHHN-UHFFFAOYSA-N ethyl 3-[4-[(6-chloroimidazo[1,2-a]pyridin-2-yl)carbamoyl]phenyl]-3-methylbutanoate Chemical compound C1=CC(C(C)(C)CC(=O)OCC)=CC=C1C(=O)NC1=CN(C=C(Cl)C=C2)C2=N1 FCYGLXWGXGRHHN-UHFFFAOYSA-N 0.000 description 1
- MYLXXWMBDCUKFZ-UHFFFAOYSA-N ethyl 4-(1-hydroxy-2-methylpropan-2-yl)benzoate Chemical compound CCOC(=O)C1=CC=C(C(C)(C)CO)C=C1 MYLXXWMBDCUKFZ-UHFFFAOYSA-N 0.000 description 1
- YHQODDMNOXIAPP-UHFFFAOYSA-N ethyl 4-(4-carbonochloridoylphenyl)-4-methylpentanoate Chemical compound CCOC(=O)CCC(C)(C)C1=CC=C(C(Cl)=O)C=C1 YHQODDMNOXIAPP-UHFFFAOYSA-N 0.000 description 1
- NWWORXYTJRPSMC-QKPAOTATSA-N ethyl 4-[2-[(2r,3r,4r,5s)-3,4,5-trihydroxy-2-(hydroxymethyl)piperidin-1-yl]ethoxy]benzoate Chemical compound C1=CC(C(=O)OCC)=CC=C1OCCN1[C@H](CO)[C@@H](O)[C@H](O)[C@@H](O)C1 NWWORXYTJRPSMC-QKPAOTATSA-N 0.000 description 1
- XZIAFENWXIQIKR-UHFFFAOYSA-N ethyl 4-bromobenzoate Chemical compound CCOC(=O)C1=CC=C(Br)C=C1 XZIAFENWXIQIKR-UHFFFAOYSA-N 0.000 description 1
- KJFAZWAKNQAGEA-UHFFFAOYSA-N ethyl 4-methyl-4-(4-methylphenyl)pentanoate Chemical compound CCOC(=O)CCC(C)(C)C1=CC=C(C)C=C1 KJFAZWAKNQAGEA-UHFFFAOYSA-N 0.000 description 1
- TVQNGNAAEOSILN-UHFFFAOYSA-N ethyl 4-methyl-4-[4-[(6-methylimidazo[1,2-a]pyridin-2-yl)carbamoyl]phenyl]pentanoate Chemical compound C1=CC(C(C)(C)CCC(=O)OCC)=CC=C1C(=O)NC1=CN(C=C(C)C=C2)C2=N1 TVQNGNAAEOSILN-UHFFFAOYSA-N 0.000 description 1
- IOFOQBGKWGVLDW-UHFFFAOYSA-N ethyl 6-iodoimidazo[1,2-b]pyridazine-2-carboxylate Chemical compound N1=C(I)C=CC2=NC(C(=O)OCC)=CN21 IOFOQBGKWGVLDW-UHFFFAOYSA-N 0.000 description 1
- 125000004494 ethyl ester group Chemical group 0.000 description 1
- WMKXMEBGSGFRMT-UHFFFAOYSA-N ethyl n-(2-chloroacetyl)carbamate Chemical compound CCOC(=O)NC(=O)CCl WMKXMEBGSGFRMT-UHFFFAOYSA-N 0.000 description 1
- WXLNAUSSFNNAEL-UHFFFAOYSA-N ethyl n-(6-iodoimidazo[1,2-b]pyridazin-2-yl)carbamate Chemical compound N1=C(I)C=CC2=NC(NC(=O)OCC)=CN21 WXLNAUSSFNNAEL-UHFFFAOYSA-N 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 229960001519 exenatide Drugs 0.000 description 1
- 235000019197 fats Nutrition 0.000 description 1
- 229960001582 fenfluramine Drugs 0.000 description 1
- 229940125753 fibrate Drugs 0.000 description 1
- 239000003527 fibrinolytic agent Substances 0.000 description 1
- WAAPEIZFCHNLKK-PELKAZGASA-N fidarestat Chemical compound C([C@@H](OC1=CC=C(F)C=C11)C(=O)N)[C@@]21NC(=O)NC2=O WAAPEIZFCHNLKK-PELKAZGASA-N 0.000 description 1
- 229950007256 fidarestat Drugs 0.000 description 1
- XOEVKNFZUQEERE-UHFFFAOYSA-N flavoxate hydrochloride Chemical compound Cl.C1=CC=C2C(=O)C(C)=C(C=3C=CC=CC=3)OC2=C1C(=O)OCCN1CCCCC1 XOEVKNFZUQEERE-UHFFFAOYSA-N 0.000 description 1
- 229960003064 flavoxate hydrochloride Drugs 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 229960002949 fluorouracil Drugs 0.000 description 1
- 229960003765 fluvastatin Drugs 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 235000011087 fumaric acid Nutrition 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 239000000417 fungicide Substances 0.000 description 1
- JKFAIQOWCVVSKC-UHFFFAOYSA-N furazan Chemical compound C=1C=NON=1 JKFAIQOWCVVSKC-UHFFFAOYSA-N 0.000 description 1
- ZZUFCTLCJUWOSV-UHFFFAOYSA-N furosemide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC(C(O)=O)=C1NCC1=CC=CO1 ZZUFCTLCJUWOSV-UHFFFAOYSA-N 0.000 description 1
- 229960003883 furosemide Drugs 0.000 description 1
- AIWAEWBZDJARBJ-PXUUZXDZSA-N fz7co35x2s Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CCCCNC(=O)COCCOCCNC(=O)CCN1C(C=CC1=O)=O)C(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(N)=O)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](C)NC(=O)[C@@H](N)CC=1N=CNC=1)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=CC=C1 AIWAEWBZDJARBJ-PXUUZXDZSA-N 0.000 description 1
- 229960003980 galantamine Drugs 0.000 description 1
- BGLNUNCBNALFOZ-WMLDXEAASA-N galanthamine Natural products COc1ccc2CCCC[C@@]34C=CCC[C@@H]3Oc1c24 BGLNUNCBNALFOZ-WMLDXEAASA-N 0.000 description 1
- ASUTZQLVASHGKV-UHFFFAOYSA-N galanthamine hydrochloride Natural products O1C(=C23)C(OC)=CC=C2CN(C)CCC23C1CC(O)C=C2 ASUTZQLVASHGKV-UHFFFAOYSA-N 0.000 description 1
- FODTZLFLDFKIQH-FSVGXZBPSA-N gamma-Oryzanol (TN) Chemical compound C1=C(O)C(OC)=CC(\C=C\C(=O)O[C@@H]2C([C@@H]3CC[C@H]4[C@]5(C)CC[C@@H]([C@@]5(C)CC[C@@]54C[C@@]53CC2)[C@H](C)CCC=C(C)C)(C)C)=C1 FODTZLFLDFKIQH-FSVGXZBPSA-N 0.000 description 1
- 206010017758 gastric cancer Diseases 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 208000004104 gestational diabetes Diseases 0.000 description 1
- GNKDKYIHGQKHHM-RJKLHVOGSA-N ghrelin Chemical compound C([C@H](NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)CN)COC(=O)CCCCCCC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1N=CNC=1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C1=CC=CC=C1 GNKDKYIHGQKHHM-RJKLHVOGSA-N 0.000 description 1
- 229960004580 glibenclamide Drugs 0.000 description 1
- 229960000346 gliclazide Drugs 0.000 description 1
- 229960004346 glimepiride Drugs 0.000 description 1
- WIGIZIANZCJQQY-RUCARUNLSA-N glimepiride Chemical compound O=C1C(CC)=C(C)CN1C(=O)NCCC1=CC=C(S(=O)(=O)NC(=O)N[C@@H]2CC[C@@H](C)CC2)C=C1 WIGIZIANZCJQQY-RUCARUNLSA-N 0.000 description 1
- 229960001381 glipizide Drugs 0.000 description 1
- ZJJXGWJIGJFDTL-UHFFFAOYSA-N glipizide Chemical compound C1=NC(C)=CN=C1C(=O)NCCC1=CC=C(S(=O)(=O)NC(=O)NC2CCCCC2)C=C1 ZJJXGWJIGJFDTL-UHFFFAOYSA-N 0.000 description 1
- MASNOZXLGMXCHN-ZLPAWPGGSA-N glucagon Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O)C(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC=1NC=NC=1)[C@@H](C)O)[C@@H](C)O)C1=CC=CC=C1 MASNOZXLGMXCHN-ZLPAWPGGSA-N 0.000 description 1
- 229960004666 glucagon Drugs 0.000 description 1
- 239000003877 glucagon like peptide 1 receptor agonist Substances 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- ZNNLBTZKUZBEKO-UHFFFAOYSA-N glyburide Chemical compound COC1=CC=C(Cl)C=C1C(=O)NCCC1=CC=C(S(=O)(=O)NC(=O)NC2CCCCC2)C=C1 ZNNLBTZKUZBEKO-UHFFFAOYSA-N 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 229940075507 glyceryl monostearate Drugs 0.000 description 1
- 229950002888 glyclopyramide Drugs 0.000 description 1
- 229940096919 glycogen Drugs 0.000 description 1
- 229940015043 glyoxal Drugs 0.000 description 1
- 208000024908 graft versus host disease Diseases 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 239000000122 growth hormone Substances 0.000 description 1
- 229910001385 heavy metal Inorganic materials 0.000 description 1
- 208000018706 hematopoietic system disease Diseases 0.000 description 1
- ZFGMDIBRIDKWMY-PASTXAENSA-N heparin Chemical compound CC(O)=N[C@@H]1[C@@H](O)[C@H](O)[C@@H](COS(O)(=O)=O)O[C@@H]1O[C@@H]1[C@@H](C(O)=O)O[C@@H](O[C@H]2[C@@H]([C@@H](OS(O)(=O)=O)[C@@H](O[C@@H]3[C@@H](OC(O)[C@H](OS(O)(=O)=O)[C@H]3O)C(O)=O)O[C@@H]2O)CS(O)(=O)=O)[C@H](O)[C@H]1O ZFGMDIBRIDKWMY-PASTXAENSA-N 0.000 description 1
- 229960002897 heparin Drugs 0.000 description 1
- 229940095529 heparin calcium Drugs 0.000 description 1
- 229960001008 heparin sodium Drugs 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 210000003494 hepatocyte Anatomy 0.000 description 1
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000001072 heteroaryl group Chemical group 0.000 description 1
- 125000005553 heteroaryloxy group Chemical group 0.000 description 1
- 125000005368 heteroarylthio group Chemical group 0.000 description 1
- 125000003104 hexanoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000005980 hexynyl group Chemical group 0.000 description 1
- 235000009200 high fat diet Nutrition 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 230000003054 hormonal effect Effects 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229960002003 hydrochlorothiazide Drugs 0.000 description 1
- DMDGGSIALPNSEE-UHFFFAOYSA-N hydroflumethiazide Chemical compound C1=C(C(F)(F)F)C(S(=O)(=O)N)=CC2=C1NCNS2(=O)=O DMDGGSIALPNSEE-UHFFFAOYSA-N 0.000 description 1
- 229960003313 hydroflumethiazide Drugs 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000012433 hydrogen halide Substances 0.000 description 1
- 229910000039 hydrogen halide Inorganic materials 0.000 description 1
- 229920001477 hydrophilic polymer Polymers 0.000 description 1
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 1
- 229940071826 hydroxyethyl cellulose Drugs 0.000 description 1
- 229920003063 hydroxymethyl cellulose Polymers 0.000 description 1
- 229940031574 hydroxymethyl cellulose Drugs 0.000 description 1
- 239000002471 hydroxymethylglutaryl coenzyme A reductase inhibitor Substances 0.000 description 1
- 229940071676 hydroxypropylcellulose Drugs 0.000 description 1
- 206010020718 hyperplasia Diseases 0.000 description 1
- 229960001101 ifosfamide Drugs 0.000 description 1
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 1
- CQABHABFPKXGAF-UHFFFAOYSA-N imidazo[1,2-a]pyridin-2-amine Chemical compound C1=CC=CC2=NC(N)=CN21 CQABHABFPKXGAF-UHFFFAOYSA-N 0.000 description 1
- 125000003037 imidazol-2-yl group Chemical group [H]N1C([*])=NC([H])=C1[H] 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 125000004283 imidazolin-2-yl group Chemical group [H]N1C(*)=NC([H])([H])C1([H])[H] 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 150000005233 imidazopyridazines Chemical class 0.000 description 1
- 239000012729 immediate-release (IR) formulation Substances 0.000 description 1
- 208000026278 immune system disease Diseases 0.000 description 1
- 230000002434 immunopotentiative effect Effects 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- LWRDQHOZTAOILO-UHFFFAOYSA-N incadronic acid Chemical compound OP(O)(=O)C(P(O)(O)=O)NC1CCCCCC1 LWRDQHOZTAOILO-UHFFFAOYSA-N 0.000 description 1
- 229950006971 incadronic acid Drugs 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- NDDAHWYSQHTHNT-UHFFFAOYSA-N indapamide Chemical compound CC1CC2=CC=CC=C2N1NC(=O)C1=CC=C(Cl)C(S(N)(=O)=O)=C1 NDDAHWYSQHTHNT-UHFFFAOYSA-N 0.000 description 1
- 229960004569 indapamide Drugs 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000000593 indol-1-yl group Chemical group [H]C1=C([H])C([H])=C2N([*])C([H])=C([H])C2=C1[H] 0.000 description 1
- 125000002249 indol-2-yl group Chemical group [H]C1=C([H])C([H])=C2N([H])C([*])=C([H])C2=C1[H] 0.000 description 1
- 125000004531 indol-5-yl group Chemical group [H]N1C([H])=C([H])C2=C([H])C(*)=C([H])C([H])=C12 0.000 description 1
- 229960000905 indomethacin Drugs 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 230000006882 induction of apoptosis Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 206010022000 influenza Diseases 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- PBGKTOXHQIOBKM-FHFVDXKLSA-N insulin (human) Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@H]1CSSC[C@H]2C(=O)N[C@H](C(=O)N[C@@H](CO)C(=O)N[C@H](C(=O)N[C@H](C(N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=3C=CC(O)=CC=3)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=3NC=NC=3)NC(=O)[C@H](CO)NC(=O)CNC1=O)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(O)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O)=O)CSSC[C@@H](C(N2)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](NC(=O)CN)[C@@H](C)CC)[C@@H](C)CC)[C@@H](C)O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CC=1C=CC=CC=1)C(C)C)C1=CN=CN1 PBGKTOXHQIOBKM-FHFVDXKLSA-N 0.000 description 1
- 230000003914 insulin secretion Effects 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 229940047122 interleukins Drugs 0.000 description 1
- 201000010849 intracranial embolism Diseases 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- HVTICUPFWKNHNG-UHFFFAOYSA-N iodoethane Chemical compound CCI HVTICUPFWKNHNG-UHFFFAOYSA-N 0.000 description 1
- 238000000752 ionisation method Methods 0.000 description 1
- 229960005431 ipriflavone Drugs 0.000 description 1
- 229960002198 irbesartan Drugs 0.000 description 1
- YCPOHTHPUREGFM-UHFFFAOYSA-N irbesartan Chemical compound O=C1N(CC=2C=CC(=CC=2)C=2C(=CC=CC=2)C=2[N]N=NN=2)C(CCCC)=NC21CCCC2 YCPOHTHPUREGFM-UHFFFAOYSA-N 0.000 description 1
- 230000000302 ischemic effect Effects 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 125000005956 isoquinolyl group Chemical group 0.000 description 1
- 229960002479 isosorbide Drugs 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 210000002510 keratinocyte Anatomy 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 208000022013 kidney Wilms tumor Diseases 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 229960001375 lactose Drugs 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 229940115286 lentinan Drugs 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 229960004773 losartan Drugs 0.000 description 1
- KJJZZJSZUJXYEA-UHFFFAOYSA-N losartan Chemical compound CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C=2[N]N=NN=2)C=C1 KJJZZJSZUJXYEA-UHFFFAOYSA-N 0.000 description 1
- 229960004844 lovastatin Drugs 0.000 description 1
- PCZOHLXUXFIOCF-BXMDZJJMSA-N lovastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 PCZOHLXUXFIOCF-BXMDZJJMSA-N 0.000 description 1
- QLJODMDSTUBWDW-UHFFFAOYSA-N lovastatin hydroxy acid Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(C)C=C21 QLJODMDSTUBWDW-UHFFFAOYSA-N 0.000 description 1
- 231100000053 low toxicity Toxicity 0.000 description 1
- 229940083747 low-ceiling diuretics xanthine derivative Drugs 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- IYVSXSLYJLAZAT-NOLJZWGESA-N lycoramine Natural products CN1CC[C@@]23CC[C@H](O)C[C@@H]2Oc4cccc(C1)c34 IYVSXSLYJLAZAT-NOLJZWGESA-N 0.000 description 1
- HZZOEADXZLYIHG-UHFFFAOYSA-N magnesiomagnesium Chemical compound [Mg][Mg] HZZOEADXZLYIHG-UHFFFAOYSA-N 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- NXPHGHWWQRMDIA-UHFFFAOYSA-M magnesium;carbanide;bromide Chemical compound [CH3-].[Mg+2].[Br-] NXPHGHWWQRMDIA-UHFFFAOYSA-M 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- ANEBWFXPVPTEET-UHFFFAOYSA-N manidipine Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OCCN2CCN(CC2)C(C=2C=CC=CC=2)C=2C=CC=CC=2)C1C1=CC=CC([N+]([O-])=O)=C1 ANEBWFXPVPTEET-UHFFFAOYSA-N 0.000 description 1
- 229960003963 manidipine Drugs 0.000 description 1
- 238000001819 mass spectrum Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 229960000299 mazindol Drugs 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 229960004296 megestrol acetate Drugs 0.000 description 1
- RQZAXGRLVPAYTJ-GQFGMJRRSA-N megestrol acetate Chemical compound C1=C(C)C2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 RQZAXGRLVPAYTJ-GQFGMJRRSA-N 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- LVWZTYCIRDMTEY-UHFFFAOYSA-N metamizole Chemical compound O=C1C(N(CS(O)(=O)=O)C)=C(C)N(C)N1C1=CC=CC=C1 LVWZTYCIRDMTEY-UHFFFAOYSA-N 0.000 description 1
- XZWYZXLIPXDOLR-UHFFFAOYSA-N metformin Chemical compound CN(C)C(=N)NC(N)=N XZWYZXLIPXDOLR-UHFFFAOYSA-N 0.000 description 1
- 229960003105 metformin Drugs 0.000 description 1
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 1
- WVJKHCGMRZGIJH-UHFFFAOYSA-N methanetriamine Chemical compound NC(N)N WVJKHCGMRZGIJH-UHFFFAOYSA-N 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- 238000006063 methoxycarbonylation reaction Methods 0.000 description 1
- SJFNDMHZXCUXSA-UHFFFAOYSA-M methoxymethyl(triphenyl)phosphanium;chloride Chemical compound [Cl-].C=1C=CC=CC=1[P+](C=1C=CC=CC=1)(COC)C1=CC=CC=C1 SJFNDMHZXCUXSA-UHFFFAOYSA-M 0.000 description 1
- FWMHZWMPUWAUPL-NDEPHWFRSA-N methyl (4s)-3-[3-[4-(3-acetamidophenyl)piperidin-1-yl]propylcarbamoyl]-4-(3,4-difluorophenyl)-6-(methoxymethyl)-2-oxo-1,4-dihydropyrimidine-5-carboxylate Chemical compound N1([C@H](C(=C(NC1=O)COC)C(=O)OC)C=1C=C(F)C(F)=CC=1)C(=O)NCCCN(CC1)CCC1C1=CC=CC(NC(C)=O)=C1 FWMHZWMPUWAUPL-NDEPHWFRSA-N 0.000 description 1
- IVAQJHSXBVHUQT-ZVHZXABRSA-N methyl (e)-3-(3,5-dimethoxyphenyl)-2-[4-[4-[(2,4-dioxo-1,3-thiazolidin-5-yl)methyl]phenoxy]phenyl]prop-2-enoate Chemical compound C=1C=C(OC=2C=CC(CC3C(NC(=O)S3)=O)=CC=2)C=CC=1/C(C(=O)OC)=C\C1=CC(OC)=CC(OC)=C1 IVAQJHSXBVHUQT-ZVHZXABRSA-N 0.000 description 1
- JCZIMWWXXFZEDV-UHFFFAOYSA-N methyl 1-(4-methylphenyl)cyclopentane-1-carboxylate Chemical compound C=1C=C(C)C=CC=1C1(C(=O)OC)CCCC1 JCZIMWWXXFZEDV-UHFFFAOYSA-N 0.000 description 1
- AEQBQMUJJMQZFW-UHFFFAOYSA-N methyl 2-methyl-2-(4-methylphenyl)propanoate Chemical compound COC(=O)C(C)(C)C1=CC=C(C)C=C1 AEQBQMUJJMQZFW-UHFFFAOYSA-N 0.000 description 1
- KWUWEPXREVDVKV-UHFFFAOYSA-N methyl 4-[(6-iodoimidazo[1,2-a]pyridin-2-yl)carbamoyl]benzoate Chemical compound C1=CC(C(=O)OC)=CC=C1C(=O)NC1=CN(C=C(I)C=C2)C2=N1 KWUWEPXREVDVKV-UHFFFAOYSA-N 0.000 description 1
- CVXXHXPNTZBZEL-UHFFFAOYSA-N methyl 4-carbonochloridoylbenzoate Chemical compound COC(=O)C1=CC=C(C(Cl)=O)C=C1 CVXXHXPNTZBZEL-UHFFFAOYSA-N 0.000 description 1
- 229940095102 methyl benzoate Drugs 0.000 description 1
- SYWSERLZKPGKDI-UHFFFAOYSA-N methyl n-(2-chloroacetyl)carbamate Chemical compound COC(=O)NC(=O)CCl SYWSERLZKPGKDI-UHFFFAOYSA-N 0.000 description 1
- 229960002900 methylcellulose Drugs 0.000 description 1
- DVSDBMFJEQPWNO-UHFFFAOYSA-N methyllithium Chemical compound C[Li] DVSDBMFJEQPWNO-UHFFFAOYSA-N 0.000 description 1
- TTWJBBZEZQICBI-UHFFFAOYSA-N metoclopramide Chemical compound CCN(CC)CCNC(=O)C1=CC(Cl)=C(N)C=C1OC TTWJBBZEZQICBI-UHFFFAOYSA-N 0.000 description 1
- 229960004503 metoclopramide Drugs 0.000 description 1
- 229960003404 mexiletine Drugs 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 229960001110 miglitol Drugs 0.000 description 1
- 229950002259 minalrestat Drugs 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 229960003365 mitiglinide Drugs 0.000 description 1
- WPGGHFDDFPHPOB-BBWFWOEESA-N mitiglinide Chemical compound C([C@@H](CC(=O)N1C[C@@H]2CCCC[C@@H]2C1)C(=O)O)C1=CC=CC=C1 WPGGHFDDFPHPOB-BBWFWOEESA-N 0.000 description 1
- 239000003226 mitogen Substances 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 239000001788 mono and diglycerides of fatty acids Substances 0.000 description 1
- 229950005805 monteplase Drugs 0.000 description 1
- 108010075698 monteplase Proteins 0.000 description 1
- 125000004573 morpholin-4-yl group Chemical group N1(CCOCC1)* 0.000 description 1
- 229950001135 muraglitazar Drugs 0.000 description 1
- BSOQXXWZTUDTEL-ZUYCGGNHSA-N muramyl dipeptide Chemical class OC(=O)CC[C@H](C(N)=O)NC(=O)[C@H](C)NC(=O)[C@@H](C)O[C@H]1[C@H](O)[C@@H](CO)O[C@@H](O)[C@@H]1NC(C)=O BSOQXXWZTUDTEL-ZUYCGGNHSA-N 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 208000010125 myocardial infarction Diseases 0.000 description 1
- 208000031225 myocardial ischemia Diseases 0.000 description 1
- ACTNHJDHMQSOGL-UHFFFAOYSA-N n',n'-dibenzylethane-1,2-diamine Chemical compound C=1C=CC=CC=1CN(CCN)CC1=CC=CC=C1 ACTNHJDHMQSOGL-UHFFFAOYSA-N 0.000 description 1
- HWMFFWCDLWDYGX-UHFFFAOYSA-N n-(4-aminophenyl)furan-2-carboxamide Chemical compound C1=CC(N)=CC=C1NC(=O)C1=CC=CO1 HWMFFWCDLWDYGX-UHFFFAOYSA-N 0.000 description 1
- WYQXOYDBOITEQZ-UHFFFAOYSA-N n-(6-acetylimidazo[1,2-a]pyridin-2-yl)-4-tert-butylbenzamide Chemical compound C=1N2C=C(C(=O)C)C=CC2=NC=1NC(=O)C1=CC=C(C(C)(C)C)C=C1 WYQXOYDBOITEQZ-UHFFFAOYSA-N 0.000 description 1
- NQGWZRFBVPODHX-UHFFFAOYSA-N n-(6-chloroimidazo[1,2-a]pyridin-2-yl)-4-[1-(2-cyanoethylamino)-2-methyl-1-oxopropan-2-yl]benzamide Chemical compound C1=CC(C(C)(C(=O)NCCC#N)C)=CC=C1C(=O)NC1=CN(C=C(Cl)C=C2)C2=N1 NQGWZRFBVPODHX-UHFFFAOYSA-N 0.000 description 1
- GCVLUGYIHBOLDZ-UHFFFAOYSA-N n-(6-chloroimidazo[1,2-a]pyridin-2-yl)-4-[1-(ethylamino)-2-methyl-1-oxopropan-2-yl]benzamide Chemical compound C1=CC(C(C)(C)C(=O)NCC)=CC=C1C(=O)NC1=CN(C=C(Cl)C=C2)C2=N1 GCVLUGYIHBOLDZ-UHFFFAOYSA-N 0.000 description 1
- DYAISMQGTPMTAT-UHFFFAOYSA-N n-(6-chloroimidazo[1,2-a]pyridin-2-yl)-4-[1-(hydroxyamino)-2-methyl-1-oxopropan-2-yl]benzamide Chemical compound C1=CC(C(C)(C(=O)NO)C)=CC=C1C(=O)NC1=CN(C=C(Cl)C=C2)C2=N1 DYAISMQGTPMTAT-UHFFFAOYSA-N 0.000 description 1
- XUEOUPPFXDMOGY-UHFFFAOYSA-N n-(6-chloroimidazo[1,2-a]pyridin-2-yl)-4-[2-methyl-4-(2h-tetrazol-5-yl)butan-2-yl]benzamide Chemical compound C=1C=C(C(=O)NC=2N=C3C=CC(Cl)=CN3C=2)C=CC=1C(C)(C)CCC1=NN=NN1 XUEOUPPFXDMOGY-UHFFFAOYSA-N 0.000 description 1
- LOJGDAQTDNTIPP-UHFFFAOYSA-N n-(6-chloroimidazo[1,2-a]pyridin-2-yl)-4-[3-cyano-1-(cyanomethylamino)-2-methyl-1-oxopropan-2-yl]benzamide Chemical compound C1=CC(C(CC#N)(C(=O)NCC#N)C)=CC=C1C(=O)NC1=CN(C=C(Cl)C=C2)C2=N1 LOJGDAQTDNTIPP-UHFFFAOYSA-N 0.000 description 1
- DZGKBQZAHPHQJA-UHFFFAOYSA-N n-(6-iodoimidazo[1,2-a]pyridin-2-yl)-4-propan-2-ylbenzamide Chemical compound C1=CC(C(C)C)=CC=C1C(=O)NC1=CN(C=C(I)C=C2)C2=N1 DZGKBQZAHPHQJA-UHFFFAOYSA-N 0.000 description 1
- BSRNVAGQZFZQQM-UHFFFAOYSA-N n-[3-(2-aminoimidazo[1,2-b]pyridazin-6-yl)oxyphenyl]-3-(1-cyanocyclopropyl)benzamide Chemical compound C1=CC2=NC(N)=CN2N=C1OC(C=1)=CC=CC=1NC(=O)C(C=1)=CC=CC=1C1(C#N)CC1 BSRNVAGQZFZQQM-UHFFFAOYSA-N 0.000 description 1
- NVOSGYJENDIAKH-UHFFFAOYSA-N n-[3-(2-aminoimidazo[1,2-b]pyridazin-6-yl)oxyphenyl]-3-(trifluoromethyl)benzamide Chemical compound C1=CC2=NC(N)=CN2N=C1OC(C=1)=CC=CC=1NC(=O)C1=CC=CC(C(F)(F)F)=C1 NVOSGYJENDIAKH-UHFFFAOYSA-N 0.000 description 1
- DUVGRLRQOBYYGV-UHFFFAOYSA-N n-[3-(2-aminoimidazo[1,2-b]pyridazin-6-yl)oxyphenyl]cyclopropanecarboxamide Chemical compound C1=CC2=NC(N)=CN2N=C1OC(C=1)=CC=CC=1NC(=O)C1CC1 DUVGRLRQOBYYGV-UHFFFAOYSA-N 0.000 description 1
- UEWRXYXODWOUDS-UHFFFAOYSA-N n-[3-bromo-5-(bromomethyl)imidazo[1,2-a]pyridin-2-yl]-4-tert-butyl-n-(4-tert-butylbenzoyl)benzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)N(C1=C(N2C(CBr)=CC=CC2=N1)Br)C(=O)C1=CC=C(C(C)(C)C)C=C1 UEWRXYXODWOUDS-UHFFFAOYSA-N 0.000 description 1
- JAIIZWCZERLWEK-UHFFFAOYSA-N n-[4-[2-(diethylamino)ethoxy]-3-methoxyphenyl]-n-methyl-4-[4-(trifluoromethyl)phenyl]benzamide Chemical compound C1=C(OC)C(OCCN(CC)CC)=CC=C1N(C)C(=O)C1=CC=C(C=2C=CC(=CC=2)C(F)(F)F)C=C1 JAIIZWCZERLWEK-UHFFFAOYSA-N 0.000 description 1
- VEDCXOBVUKRDBY-UHFFFAOYSA-N n-[5-(trifluoromethyl)pyridin-2-yl]methanesulfonamide Chemical compound CS(=O)(=O)NC1=CC=C(C(F)(F)F)C=N1 VEDCXOBVUKRDBY-UHFFFAOYSA-N 0.000 description 1
- RRHDOIXEKIQKQZ-UHFFFAOYSA-N n-[6-(benzylamino)imidazo[1,2-a]pyridin-2-yl]-4-tert-butylbenzamide Chemical compound C1=CC(C(C)(C)C)=CC=C1C(=O)NC1=CN(C=C(NCC=2C=CC=CC=2)C=C2)C2=N1 RRHDOIXEKIQKQZ-UHFFFAOYSA-N 0.000 description 1
- XVDBWWRIXBMVJV-UHFFFAOYSA-N n-[bis(dimethylamino)phosphanyl]-n-methylmethanamine Chemical compound CN(C)P(N(C)C)N(C)C XVDBWWRIXBMVJV-UHFFFAOYSA-N 0.000 description 1
- NDHOJKOJMUTFCY-UHFFFAOYSA-N n-imidazo[1,2-a]pyridin-2-yl-4-methylbenzamide Chemical compound C1=CC(C)=CC=C1C(=O)NC1=CN(C=CC=C2)C2=N1 NDHOJKOJMUTFCY-UHFFFAOYSA-N 0.000 description 1
- LZIJKEIPCFEOLH-UHFFFAOYSA-N n-pyridin-2-ylbenzamide Chemical compound C=1C=CC=CC=1C(=O)NC1=CC=CC=N1 LZIJKEIPCFEOLH-UHFFFAOYSA-N 0.000 description 1
- 125000004923 naphthylmethyl group Chemical group C1(=CC=CC2=CC=CC=C12)C* 0.000 description 1
- 229940037525 nasal preparations Drugs 0.000 description 1
- 229950002774 nateplase Drugs 0.000 description 1
- 239000000978 natural dye Substances 0.000 description 1
- 229950003494 naveglitazar Drugs 0.000 description 1
- 201000008026 nephroblastoma Diseases 0.000 description 1
- PKWDZWYVIHVNKS-UHFFFAOYSA-N netoglitazone Chemical compound FC1=CC=CC=C1COC1=CC=C(C=C(CC2C(NC(=O)S2)=O)C=C2)C2=C1 PKWDZWYVIHVNKS-UHFFFAOYSA-N 0.000 description 1
- 229950001628 netoglitazone Drugs 0.000 description 1
- 230000014511 neuron projection development Effects 0.000 description 1
- 201000001119 neuropathy Diseases 0.000 description 1
- 230000007823 neuropathy Effects 0.000 description 1
- 239000003900 neurotrophic factor Substances 0.000 description 1
- 230000032064 neurotrophin production Effects 0.000 description 1
- 229960001783 nicardipine Drugs 0.000 description 1
- 229960000827 niceritrol Drugs 0.000 description 1
- 229950001071 nicomol Drugs 0.000 description 1
- 229960003512 nicotinic acid Drugs 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 229960001597 nifedipine Drugs 0.000 description 1
- HYIMSNHJOBLJNT-UHFFFAOYSA-N nifedipine Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OC)C1C1=CC=CC=C1[N+]([O-])=O HYIMSNHJOBLJNT-UHFFFAOYSA-N 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 125000000018 nitroso group Chemical group N(=O)* 0.000 description 1
- 125000001400 nonyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000002664 nootropic agent Substances 0.000 description 1
- UMRZSTCPUPJPOJ-KNVOCYPGSA-N norbornane Chemical compound C1C[C@H]2CC[C@@H]1C2 UMRZSTCPUPJPOJ-KNVOCYPGSA-N 0.000 description 1
- URPYMXQQVHTUDU-OFGSCBOVSA-N nucleopeptide y Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](N)CC=1C=CC(O)=CC=1)C1=CC=C(O)C=C1 URPYMXQQVHTUDU-OFGSCBOVSA-N 0.000 description 1
- 208000030212 nutrition disease Diseases 0.000 description 1
- 235000003170 nutritional factors Nutrition 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- TVMXDCGIABBOFY-UHFFFAOYSA-N octane Chemical compound CCCCCCCC TVMXDCGIABBOFY-UHFFFAOYSA-N 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 229940125395 oral insulin Drugs 0.000 description 1
- 239000006191 orally-disintegrating tablet Substances 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 239000011368 organic material Substances 0.000 description 1
- 125000001181 organosilyl group Chemical group [SiH3]* 0.000 description 1
- AHLBNYSZXLDEJQ-FWEHEUNISA-N orlistat Chemical compound CCCCCCCCCCC[C@H](OC(=O)[C@H](CC(C)C)NC=O)C[C@@H]1OC(=O)[C@H]1CCCCCC AHLBNYSZXLDEJQ-FWEHEUNISA-N 0.000 description 1
- 229960001243 orlistat Drugs 0.000 description 1
- 229960003104 ornithine Drugs 0.000 description 1
- 201000008482 osteoarthritis Diseases 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 125000000160 oxazolidinyl group Chemical group 0.000 description 1
- 125000005968 oxazolinyl group Chemical group 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 229960005434 oxybutynin Drugs 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 1
- 229960003978 pamidronic acid Drugs 0.000 description 1
- 229950003603 pamiteplase Drugs 0.000 description 1
- 108010085108 pamiteplase Proteins 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 229940116369 pancreatic lipase Drugs 0.000 description 1
- 208000003154 papilloma Diseases 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 description 1
- 208000028169 periodontal disease Diseases 0.000 description 1
- 208000033808 peripheral neuropathy Diseases 0.000 description 1
- 239000003873 peroxisome proliferator activated receptor gamma antagonist Substances 0.000 description 1
- XDJOIMJURHQYDW-UHFFFAOYSA-N phenalene Chemical compound C1=CC(CC=C2)=C3C2=CC=CC3=C1 XDJOIMJURHQYDW-UHFFFAOYSA-N 0.000 description 1
- 125000005561 phenanthryl group Chemical group 0.000 description 1
- ICFJFFQQTFMIBG-UHFFFAOYSA-N phenformin Chemical compound NC(=N)NC(=N)NCCC1=CC=CC=C1 ICFJFFQQTFMIBG-UHFFFAOYSA-N 0.000 description 1
- 229960003243 phenformin Drugs 0.000 description 1
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 1
- 229960003562 phentermine Drugs 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 description 1
- DLNKOYKMWOXYQA-APPZFPTMSA-N phenylpropanolamine Chemical compound C[C@@H](N)[C@H](O)C1=CC=CC=C1 DLNKOYKMWOXYQA-APPZFPTMSA-N 0.000 description 1
- 229960000395 phenylpropanolamine Drugs 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 125000005633 phthalidyl group Chemical group 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 229960005095 pioglitazone Drugs 0.000 description 1
- IWELDVXSEVIIGI-UHFFFAOYSA-N piperazin-2-one Chemical compound O=C1CNCCN1 IWELDVXSEVIIGI-UHFFFAOYSA-N 0.000 description 1
- 125000004483 piperidin-3-yl group Chemical group N1CC(CCC1)* 0.000 description 1
- 125000004482 piperidin-4-yl group Chemical group N1CCC(CC1)* 0.000 description 1
- 229960001085 piretanide Drugs 0.000 description 1
- VGYFMXBACGZSIL-MCBHFWOFSA-N pitavastatin Chemical compound OC(=O)C[C@H](O)C[C@H](O)\C=C\C1=C(C2CC2)N=C2C=CC=CC2=C1C1=CC=C(F)C=C1 VGYFMXBACGZSIL-MCBHFWOFSA-N 0.000 description 1
- 229960002797 pitavastatin Drugs 0.000 description 1
- 229940096701 plain lipid modifying drug hmg coa reductase inhibitors Drugs 0.000 description 1
- 235000002378 plant sterols Nutrition 0.000 description 1
- 239000000106 platelet aggregation inhibitor Substances 0.000 description 1
- 125000005575 polycyclic aromatic hydrocarbon group Chemical group 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 108010001062 polysaccharide-K Proteins 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229940068965 polysorbates Drugs 0.000 description 1
- 229960005483 polythiazide Drugs 0.000 description 1
- 229920000046 polythiazide Polymers 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 1
- 239000012286 potassium permanganate Substances 0.000 description 1
- WSHYKIAQCMIPTB-UHFFFAOYSA-M potassium;2-oxo-3-(3-oxo-1-phenylbutyl)chromen-4-olate Chemical compound [K+].[O-]C=1C2=CC=CC=C2OC(=O)C=1C(CC(=O)C)C1=CC=CC=C1 WSHYKIAQCMIPTB-UHFFFAOYSA-M 0.000 description 1
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 description 1
- 229960003611 pramlintide Drugs 0.000 description 1
- 108010029667 pramlintide Proteins 0.000 description 1
- NRKVKVQDUCJPIZ-MKAGXXMWSA-N pramlintide acetate Chemical compound C([C@@H](C(=O)NCC(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CS)NC(=O)[C@@H](N)CCCCN)[C@@H](C)O)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=CC=C1 NRKVKVQDUCJPIZ-MKAGXXMWSA-N 0.000 description 1
- 229960002965 pravastatin Drugs 0.000 description 1
- TUZYXOIXSAXUGO-PZAWKZKUSA-N pravastatin Chemical compound C1=C[C@H](C)[C@H](CC[C@@H](O)C[C@@H](O)CC(O)=O)[C@H]2[C@@H](OC(=O)[C@@H](C)CC)C[C@H](O)C=C21 TUZYXOIXSAXUGO-PZAWKZKUSA-N 0.000 description 1
- 201000009104 prediabetes syndrome Diseases 0.000 description 1
- 125000001844 prenyl group Chemical group [H]C([*])([H])C([H])=C(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- FYPMFJGVHOHGLL-UHFFFAOYSA-N probucol Chemical compound C=1C(C(C)(C)C)=C(O)C(C(C)(C)C)=CC=1SC(C)(C)SC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 FYPMFJGVHOHGLL-UHFFFAOYSA-N 0.000 description 1
- 229960003912 probucol Drugs 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 150000003145 progesterone derivatives Chemical class 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 229960001187 propiverine hydrochloride Drugs 0.000 description 1
- 125000004742 propyloxycarbonyl group Chemical group 0.000 description 1
- 239000002599 prostaglandin synthase inhibitor Substances 0.000 description 1
- 229940048914 protamine Drugs 0.000 description 1
- 108010008361 protein phosphatase 5 Proteins 0.000 description 1
- 108020000494 protein-tyrosine phosphatase Proteins 0.000 description 1
- 208000020016 psychiatric disease Diseases 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 208000005069 pulmonary fibrosis Diseases 0.000 description 1
- 208000002815 pulmonary hypertension Diseases 0.000 description 1
- 125000004309 pyranyl group Chemical group O1C(C=CC=C1)* 0.000 description 1
- 125000004307 pyrazin-2-yl group Chemical group [H]C1=C([H])N=C(*)C([H])=N1 0.000 description 1
- 125000004290 pyrazolidin-3-yl group Chemical group [H]N1N([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000003072 pyrazolidinyl group Chemical group 0.000 description 1
- 125000002755 pyrazolinyl group Chemical group 0.000 description 1
- 125000002206 pyridazin-3-yl group Chemical group [H]C1=C([H])C([H])=C(*)N=N1 0.000 description 1
- 125000004940 pyridazin-4-yl group Chemical group N1=NC=C(C=C1)* 0.000 description 1
- QLULGIRFKAWHOJ-UHFFFAOYSA-N pyridin-4-ylboronic acid Chemical compound OB(O)C1=CC=NC=C1 QLULGIRFKAWHOJ-UHFFFAOYSA-N 0.000 description 1
- 235000008151 pyridoxamine Nutrition 0.000 description 1
- 239000011699 pyridoxamine Substances 0.000 description 1
- HNWCOANXZNKMLR-UHFFFAOYSA-N pyridoxamine dihydrochloride Chemical compound Cl.Cl.CC1=NC=C(CO)C(CN)=C1O HNWCOANXZNKMLR-UHFFFAOYSA-N 0.000 description 1
- 125000000246 pyrimidin-2-yl group Chemical group [H]C1=NC(*)=NC([H])=C1[H] 0.000 description 1
- 125000004527 pyrimidin-4-yl group Chemical group N1=CN=C(C=C1)* 0.000 description 1
- 125000004528 pyrimidin-5-yl group Chemical group N1=CN=CC(=C1)* 0.000 description 1
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- 125000004548 quinolin-3-yl group Chemical group N1=CC(=CC2=CC=CC=C12)* 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 229950008257 ragaglitazar Drugs 0.000 description 1
- HELXLJCILKEWJH-NCGAPWICSA-N rebaudioside A Chemical compound O([C@H]1[C@H](O)[C@@H](CO)O[C@H]([C@@H]1O[C@H]1[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O1)O)O[C@]12C(=C)C[C@@]3(C1)CC[C@@H]1[C@@](C)(CCC[C@]1([C@@H]3CC2)C)C(=O)O[C@H]1[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O1)O)[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O HELXLJCILKEWJH-NCGAPWICSA-N 0.000 description 1
- 239000002464 receptor antagonist Substances 0.000 description 1
- 229940044551 receptor antagonist Drugs 0.000 description 1
- 206010038038 rectal cancer Diseases 0.000 description 1
- 239000006215 rectal suppository Substances 0.000 description 1
- 201000001275 rectum cancer Diseases 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000006722 reduction reaction Methods 0.000 description 1
- 229960002354 repaglinide Drugs 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- 208000023504 respiratory system disease Diseases 0.000 description 1
- 230000000250 revascularization Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- JZCPYUJPEARBJL-UHFFFAOYSA-N rimonabant Chemical compound CC=1C(C(=O)NN2CCCCC2)=NN(C=2C(=CC(Cl)=CC=2)Cl)C=1C1=CC=C(Cl)C=C1 JZCPYUJPEARBJL-UHFFFAOYSA-N 0.000 description 1
- 238000006798 ring closing metathesis reaction Methods 0.000 description 1
- CRPGRUONUFDYBG-UHFFFAOYSA-N risarestat Chemical compound C1=C(OCC)C(OCCCCC)=CC=C1C1C(=O)NC(=O)S1 CRPGRUONUFDYBG-UHFFFAOYSA-N 0.000 description 1
- 229960004136 rivastigmine Drugs 0.000 description 1
- XMSXOLDPMGMWTH-UHFFFAOYSA-N rivoglitazone Chemical compound CN1C2=CC(OC)=CC=C2N=C1COC(C=C1)=CC=C1CC1SC(=O)NC1=O XMSXOLDPMGMWTH-UHFFFAOYSA-N 0.000 description 1
- 229960004586 rosiglitazone Drugs 0.000 description 1
- BPRHUIZQVSMCRT-VEUZHWNKSA-N rosuvastatin Chemical compound CC(C)C1=NC(N(C)S(C)(=O)=O)=NC(C=2C=CC(F)=CC=2)=C1\C=C\[C@@H](O)C[C@@H](O)CC(O)=O BPRHUIZQVSMCRT-VEUZHWNKSA-N 0.000 description 1
- 229960000672 rosuvastatin Drugs 0.000 description 1
- 229950000261 ruboxistaurin Drugs 0.000 description 1
- 229940085605 saccharin sodium Drugs 0.000 description 1
- 235000019515 salmon Nutrition 0.000 description 1
- 108010068072 salmon calcitonin Proteins 0.000 description 1
- 229950005789 sarpogrelate Drugs 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- QGJUIPDUBHWZPV-SGTAVMJGSA-N saxagliptin Chemical compound C1C(C2)CC(C3)CC2(O)CC13[C@H](N)C(=O)N1[C@H](C#N)C[C@@H]2C[C@@H]21 QGJUIPDUBHWZPV-SGTAVMJGSA-N 0.000 description 1
- 108010033693 saxagliptin Proteins 0.000 description 1
- 229960004937 saxagliptin Drugs 0.000 description 1
- 201000000980 schizophrenia Diseases 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 229960004425 sibutramine Drugs 0.000 description 1
- UNAANXDKBXWMLN-UHFFFAOYSA-N sibutramine Chemical compound C=1C=C(Cl)C=CC=1C1(C(N(C)C)CC(C)C)CCC1 UNAANXDKBXWMLN-UHFFFAOYSA-N 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- DEIYFTQMQPDXOT-UHFFFAOYSA-N sildenafil citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.CCCC1=NN(C)C(C(N2)=O)=C1N=C2C(C(=CC=1)OCC)=CC=1S(=O)(=O)N1CCN(C)CC1 DEIYFTQMQPDXOT-UHFFFAOYSA-N 0.000 description 1
- 229960002639 sildenafil citrate Drugs 0.000 description 1
- 229960004058 simfibrate Drugs 0.000 description 1
- XGVXKJKTISMIOW-ZDUSSCGKSA-N simurosertib Chemical compound N1N=CC(C=2SC=3C(=O)NC(=NC=3C=2)[C@H]2N3CCC(CC3)C2)=C1C XGVXKJKTISMIOW-ZDUSSCGKSA-N 0.000 description 1
- 229960002855 simvastatin Drugs 0.000 description 1
- RYMZZMVNJRMUDD-HGQWONQESA-N simvastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)C(C)(C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 RYMZZMVNJRMUDD-HGQWONQESA-N 0.000 description 1
- IZTQOLKUZKXIRV-YRVFCXMDSA-N sincalide Chemical compound C([C@@H](C(=O)N[C@@H](CCSC)C(=O)NCC(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(N)=O)NC(=O)[C@@H](N)CC(O)=O)C1=CC=C(OS(O)(=O)=O)C=C1 IZTQOLKUZKXIRV-YRVFCXMDSA-N 0.000 description 1
- 229960004115 sitagliptin phosphate Drugs 0.000 description 1
- 201000000849 skin cancer Diseases 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 239000012279 sodium borohydride Substances 0.000 description 1
- 229910000033 sodium borohydride Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- QDRKDTQENPPHOJ-UHFFFAOYSA-N sodium ethoxide Chemical compound [Na+].CC[O-] QDRKDTQENPPHOJ-UHFFFAOYSA-N 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 229910000104 sodium hydride Inorganic materials 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 229960004025 sodium salicylate Drugs 0.000 description 1
- 239000012321 sodium triacetoxyborohydride Substances 0.000 description 1
- WSRBRQQGWDWSON-UHFFFAOYSA-M sodium;3,7-dimethylpurine-2,6-dione;2-hydroxybenzoate Chemical compound [Na+].OC1=CC=CC=C1C([O-])=O.CN1C(=O)NC(=O)C2=C1N=CN2C WSRBRQQGWDWSON-UHFFFAOYSA-M 0.000 description 1
- SNOOUWRIMMFWNE-UHFFFAOYSA-M sodium;6-[(3,4,5-trimethoxybenzoyl)amino]hexanoate Chemical compound [Na+].COC1=CC(C(=O)NCCCCCC([O-])=O)=CC(OC)=C1OC SNOOUWRIMMFWNE-UHFFFAOYSA-M 0.000 description 1
- 239000007901 soft capsule Substances 0.000 description 1
- 239000008247 solid mixture Substances 0.000 description 1
- 238000000638 solvent extraction Methods 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- LXMSZDCAJNLERA-ZHYRCANASA-N spironolactone Chemical compound C([C@@H]1[C@]2(C)CC[C@@H]3[C@@]4(C)CCC(=O)C=C4C[C@H]([C@@H]13)SC(=O)C)C[C@@]21CCC(=O)O1 LXMSZDCAJNLERA-ZHYRCANASA-N 0.000 description 1
- 229960002256 spironolactone Drugs 0.000 description 1
- 239000004059 squalene synthase inhibitor Substances 0.000 description 1
- 229940032147 starch Drugs 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 230000036262 stenosis Effects 0.000 description 1
- 208000037804 stenosis Diseases 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 201000011549 stomach cancer Diseases 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 125000005504 styryl group Chemical group 0.000 description 1
- 239000006190 sub-lingual tablet Substances 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 229960004793 sucrose Drugs 0.000 description 1
- 125000000020 sulfo group Chemical group O=S(=O)([*])O[H] 0.000 description 1
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 238000001308 synthesis method Methods 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 229960001685 tacrine Drugs 0.000 description 1
- YLJREFDVOIBQDA-UHFFFAOYSA-N tacrine Chemical compound C1=CC=C2C(N)=C(CCCC3)C3=NC2=C1 YLJREFDVOIBQDA-UHFFFAOYSA-N 0.000 description 1
- 108010009573 talabostat Proteins 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- ADXGNEYLLLSOAR-UHFFFAOYSA-N tasosartan Chemical compound C12=NC(C)=NC(C)=C2CCC(=O)N1CC(C=C1)=CC=C1C1=CC=CC=C1C=1N=NNN=1 ADXGNEYLLLSOAR-UHFFFAOYSA-N 0.000 description 1
- 229960000651 tasosartan Drugs 0.000 description 1
- WRGVLTAWMNZWGT-VQSPYGJZSA-N taspoglutide Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)NC(C)(C)C(=O)N[C@@H](CCCNC(N)=N)C(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(N)=O)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)C(C)(C)NC(=O)[C@@H](N)CC=1NC=NC=1)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=CC=C1 WRGVLTAWMNZWGT-VQSPYGJZSA-N 0.000 description 1
- 229950007151 taspoglutide Drugs 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- 229960005187 telmisartan Drugs 0.000 description 1
- RTZRUVMEWWPNRR-UHFFFAOYSA-N tert-butyl n-(3-iodo-1h-pyrrolo[2,3-b]pyridin-5-yl)carbamate Chemical compound CC(C)(C)OC(=O)NC1=CN=C2NC=C(I)C2=C1 RTZRUVMEWWPNRR-UHFFFAOYSA-N 0.000 description 1
- BCNZYOJHNLTNEZ-UHFFFAOYSA-N tert-butyldimethylsilyl chloride Chemical compound CC(C)(C)[Si](C)(C)Cl BCNZYOJHNLTNEZ-UHFFFAOYSA-N 0.000 description 1
- 125000001981 tert-butyldimethylsilyl group Chemical group [H]C([H])([H])[Si]([H])(C([H])([H])[H])[*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 150000003512 tertiary amines Chemical class 0.000 description 1
- 229950004704 tesaglitazar Drugs 0.000 description 1
- 210000001550 testis Anatomy 0.000 description 1
- 125000005887 tetrahydrobenzofuranyl group Chemical group 0.000 description 1
- 125000004192 tetrahydrofuran-2-yl group Chemical group [H]C1([H])OC([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000001712 tetrahydronaphthyl group Chemical group C1(CCCC2=CC=CC=C12)* 0.000 description 1
- 125000004632 tetrahydrothiopyranyl group Chemical group S1C(CCCC1)* 0.000 description 1
- 125000004523 tetrazol-1-yl group Chemical group N1(N=NN=C1)* 0.000 description 1
- 125000004299 tetrazol-5-yl group Chemical group [H]N1N=NC(*)=N1 0.000 description 1
- 150000003536 tetrazoles Chemical class 0.000 description 1
- VLLMWSRANPNYQX-UHFFFAOYSA-N thiadiazole Chemical compound C1=CSN=N1.C1=CSN=N1 VLLMWSRANPNYQX-UHFFFAOYSA-N 0.000 description 1
- 239000003451 thiazide diuretic agent Substances 0.000 description 1
- 125000004300 thiazolidin-2-yl group Chemical group [H]N1C([H])([H])C([H])([H])SC1([H])* 0.000 description 1
- 125000004301 thiazolin-2-yl group Chemical group [H]C1([H])SC(*)=NC1([H])[H] 0.000 description 1
- 125000002769 thiazolinyl group Chemical group 0.000 description 1
- 238000004809 thin layer chromatography Methods 0.000 description 1
- 150000007970 thio esters Chemical class 0.000 description 1
- 150000003573 thiols Chemical class 0.000 description 1
- 125000005505 thiomorpholino group Chemical group 0.000 description 1
- QNMBSXGYAQZCTN-UHFFFAOYSA-N thiophen-3-ylboronic acid Chemical compound OB(O)C=1C=CSC=1 QNMBSXGYAQZCTN-UHFFFAOYSA-N 0.000 description 1
- 108060008226 thioredoxin Proteins 0.000 description 1
- 229940094937 thioredoxin Drugs 0.000 description 1
- 229960000103 thrombolytic agent Drugs 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 229960005344 tiapride Drugs 0.000 description 1
- MTKNGOHFNXIVOS-UHFFFAOYSA-N ticlopidine hydrochloride Chemical compound [H+].[Cl-].ClC1=CC=CC=C1CN1CC(C=CS2)=C2CC1 MTKNGOHFNXIVOS-UHFFFAOYSA-N 0.000 description 1
- 229960002961 ticlopidine hydrochloride Drugs 0.000 description 1
- 229960002277 tolazamide Drugs 0.000 description 1
- OUDSBRTVNLOZBN-UHFFFAOYSA-N tolazamide Chemical compound C1=CC(C)=CC=C1S(=O)(=O)NC(=O)NN1CCCCCC1 OUDSBRTVNLOZBN-UHFFFAOYSA-N 0.000 description 1
- 229960005371 tolbutamide Drugs 0.000 description 1
- LUBHDINQXIHVLS-UHFFFAOYSA-N tolrestat Chemical compound OC(=O)CN(C)C(=S)C1=CC=CC2=C(C(F)(F)F)C(OC)=CC=C21 LUBHDINQXIHVLS-UHFFFAOYSA-N 0.000 description 1
- 229960003069 tolrestat Drugs 0.000 description 1
- RLUJQBLWUQZMDG-UHFFFAOYSA-N toluene;hydrochloride Chemical compound Cl.CC1=CC=CC=C1 RLUJQBLWUQZMDG-UHFFFAOYSA-N 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 201000010875 transient cerebral ischemia Diseases 0.000 description 1
- 229960001288 triamterene Drugs 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 150000003852 triazoles Chemical class 0.000 description 1
- LMJSLTNSBFUCMU-UHFFFAOYSA-N trichlormethiazide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC2=C1NC(C(Cl)Cl)NS2(=O)=O LMJSLTNSBFUCMU-UHFFFAOYSA-N 0.000 description 1
- 229960004813 trichlormethiazide Drugs 0.000 description 1
- FAQYAMRNWDIXMY-UHFFFAOYSA-N trichloroborane Chemical compound ClB(Cl)Cl FAQYAMRNWDIXMY-UHFFFAOYSA-N 0.000 description 1
- SEDZOYHHAIAQIW-UHFFFAOYSA-N trimethylsilyl azide Chemical compound C[Si](C)(C)N=[N+]=[N-] SEDZOYHHAIAQIW-UHFFFAOYSA-N 0.000 description 1
- IHIXIJGXTJIKRB-UHFFFAOYSA-N trisodium vanadate Chemical compound [Na+].[Na+].[Na+].[O-][V]([O-])([O-])=O IHIXIJGXTJIKRB-UHFFFAOYSA-N 0.000 description 1
- 229960005356 urokinase Drugs 0.000 description 1
- 206010046766 uterine cancer Diseases 0.000 description 1
- 239000006216 vaginal suppository Substances 0.000 description 1
- 125000003774 valeryl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 229960004699 valsartan Drugs 0.000 description 1
- ACWBQPMHZXGDFX-QFIPXVFZSA-N valsartan Chemical compound C1=CC(CN(C(=O)CCCC)[C@@H](C(C)C)C(O)=O)=CC=C1C1=CC=CC=C1C1=NN=NN1 ACWBQPMHZXGDFX-QFIPXVFZSA-N 0.000 description 1
- 208000019553 vascular disease Diseases 0.000 description 1
- 229940124549 vasodilator Drugs 0.000 description 1
- 239000003071 vasodilator agent Substances 0.000 description 1
- SYOKIDBDQMKNDQ-XWTIBIIYSA-N vildagliptin Chemical compound C1C(O)(C2)CC(C3)CC1CC32NCC(=O)N1CCC[C@H]1C#N SYOKIDBDQMKNDQ-XWTIBIIYSA-N 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- HHJUWIANJFBDHT-KOTLKJBCSA-N vindesine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(N)=O)N4C)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 HHJUWIANJFBDHT-KOTLKJBCSA-N 0.000 description 1
- 229960004355 vindesine Drugs 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 150000003722 vitamin derivatives Chemical class 0.000 description 1
- 229960001729 voglibose Drugs 0.000 description 1
- 229960005080 warfarin Drugs 0.000 description 1
- PJVWKTKQMONHTI-UHFFFAOYSA-N warfarin Chemical compound OC=1C2=CC=CC=C2OC(=O)C=1C(CC(=O)C)C1=CC=CC=C1 PJVWKTKQMONHTI-UHFFFAOYSA-N 0.000 description 1
- 229960000883 warfarin potassium Drugs 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
- SXONDGSPUVNZLO-UHFFFAOYSA-N zenarestat Chemical compound O=C1N(CC(=O)O)C2=CC(Cl)=CC=C2C(=O)N1CC1=CC=C(Br)C=C1F SXONDGSPUVNZLO-UHFFFAOYSA-N 0.000 description 1
- 229950006343 zenarestat Drugs 0.000 description 1
- 229910000166 zirconium phosphate Inorganic materials 0.000 description 1
- 229950005346 zopolrestat Drugs 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/02—Nutrients, e.g. vitamins, minerals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/16—Antivirals for RNA viruses for influenza or rhinoviruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/12—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains three hetero rings
- C07D471/14—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/12—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains three hetero rings
- C07D491/14—Ortho-condensed systems
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Virology (AREA)
- Diabetes (AREA)
- Biomedical Technology (AREA)
- Physical Education & Sports Medicine (AREA)
- Neurology (AREA)
- Oncology (AREA)
- Hematology (AREA)
- Neurosurgery (AREA)
- Rheumatology (AREA)
- Communicable Diseases (AREA)
- Immunology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Psychiatry (AREA)
- Molecular Biology (AREA)
- Obesity (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Endocrinology (AREA)
- Transplantation (AREA)
- Hospice & Palliative Care (AREA)
- Tropical Medicine & Parasitology (AREA)
- AIDS & HIV (AREA)
- Pulmonology (AREA)
- Addiction (AREA)
- Nutrition Science (AREA)
Abstract
Description
本発明は、Apoptosis signal regulating kinase 1(以下、「ASK1」と略記することがある)阻害作用を有し、糖尿病、炎症性疾患等の治療剤として有用なイミダゾピリジン化合物およびイミダゾピリダジン化合物に関する。
Mitogen-activated protein(MAP)キナーゼカスケードは物理化学的ストレスや腫瘍壊死因子−α(TNF-α)、インターロイキン−1(IL-1)などの炎症性サイトカインによって活性化されたMAPキナーゼキナーゼキナーゼ(MAPKKK)が、MAPキナーゼキナーゼ(MAPKK)、MAPキナーゼ(MAPK)を逐次的に活性化するシグナル伝達機構であり、細胞はこれらの刺激に応じて、生存、増殖、分化、死(アポトーシス)などの表現型を示す。c-Jun N-terminal kinase(JNK)およびp38 MAP kinase(p38)は、アポトーシスを誘導するシグナル伝達経路の一部を担うMAPKとして知られている(例えば、Science, 270: 1326 (1995)参照)。
JNKおよびp38は、MAPKKであるMKK4/MKK7およびMKK3/MKK6によってそれぞれ活性化される。これらのMAPKKは、Apoptosis signal regulating kinase 1(ASK1)と呼ばれるMAPKKKによって活性化される(例えば、Science, 275: 90-94 (1997)参照)。MAPKKKは、ASK1以外にも多数報告されているが、ASK1は、JNKおよび/またはp38の活性化を介したシグナル伝達を通じて、細胞にアポトーシスを誘導する能力を有することにより特徴づけられる。最近、ASK1の活性化がケラチノサイトの分化やPC12細胞の神経突起伸長などの細胞分化にも関与することが示唆されており、ASK1はアポトーシスに限らず細胞の運命のコントロールに重要な役割を果たしていることが明らかになってきている。
このように、ASK1は細胞の以後の運命を左右する重要な分子であるが故に、その活性化/不活性化には様々な因子が関与し、複雑な制御を受けていると考えられる。例えば、protein phosphatase 5(PP5)はH2O2刺激下でASK1に直接結合し、スレオニンを脱リン酸化することで活性化されたASK1を不活性状態に戻すと考えられている(例えば、EMBO Journal,20: 6028-6036 (2001)参照)。また、レドックス制御因子であるチオレドキシンは、酸化ストレスのないときにはASK1のN末端側ドメインと恒常的に結合してASK1の活性化インヒビターとして働いており、酸化ストレスを与えるとASK1から離れ、それによりASK1の活性化が起こることや(例えば、EMBO Journal, 17: 2596-2606 (1998)参照)、14-3-3蛋白質はASK1のC末端側ドメインに結合することによりその活性化を阻害すること(例えば、Proceedings of National Academy of Sciences, USA,96: 8511-8515 (1999)参照)なども報告されている。
一方、ASK1ノックアウト(KO)マウスの細胞を小胞体ストレス誘発剤で処理すると、野生型マウスの細胞に比べてアポトーシスが有意に抑制されること、また、該KOマウス細胞をLPSで刺激すると、野生型マウス細胞に比べてサイトカイン・ケモカインの産生が有意に抑制されることから、ASK1は小胞体ストレスによるアポトーシス誘導およびサイトカイン・ケモカイン産生と密接に関連しており、従って、上記のチオレドキシンや14-3-3蛋白質等のASK1阻害物質や、ASK1ドミナントネガティブ変異体、ASK1アンチセンスオリゴヌクレオチドなどは、神経変性疾患(例、ポリグルタミン病等)などの小胞体ストレス関連疾患および免疫疾患の予防・治療に有効であることが示唆されている(例えば、国際公開第02/38179号パンフレットおよび国際公開第03/00826号パンフレット参照)。
また、ASK1ノックアウトマウスを用いた病態モデルの研究において、ASK1ノックアウトマウスにストレプトゾシンを投与して作製した糖尿病モデルでは、同様に処置した野生型マウスに比べて神経障害の進行が抑制されること、ASK1ノックアウトマウスでは、野生型マウスに比べて高脂肪食下での血糖値上昇が有意に抑制されること、並びに糖尿病性腎症モデル(db/db)マウスでは、正常マウスに比べて腎臓でのASK1発現量が増大していること、さらには、ASK1ノックアウトマウスをタバコ煙に曝露させて作製した慢性閉塞性肺疾患(COPD)モデルでは、同様に処置した野生型マウスに比べて肺における炎症性変化が抑制され、さらに野生型マウスをタバコ煙に曝露することによって、肺における活性化ASK1の発現量が増大していることが報告されている(例えば、国際公開第2005/103288号パンフレット参照)。これらの結果は、ASK1が糖尿病およびその合併症ならびにCOPDの発症・進行に深く関与しており、ASK1の発現もしくは活性を阻害することは、糖尿病およびその合併症ならびにCOPDのような炎症性疾患の予防および治療に有効であることを示すものである。
一方、イミダゾピリジン化合物としては、非特許文献1に下記式(A)、(B)および(C)
[式中、Meはメチルを、Phはフェニルを表す]で表される化合物が記載され;
特許文献1には、下記式
特許文献1には、下記式
[式中、Meはメチルを、nPrはn−プロピルを、Phはフェニルを表す]で表される化合物が記載されている。
また特許文献2では、下記一般式
また特許文献2では、下記一般式
[式中、Rは5または6員の単環性芳香族複素環などを示すか、または一般式
(式中、Xは、OまたはSを示し;R2は、水素原子、低級アルキルを示し;R3は、水素原子、C1−8アルキル、シクロアルキル、アリール、アラルキル、ヘテロアリール、低級アルキルでモノ置換されたアミノ、低級アルキルでジ置換されたアミノ、シクロアルキルアミノ、低級アルコキシ、低級アルキルチオ、アリールオキシ、アリールチオ、ヘテロアリールオキシ、ヘテロアリールチオを示す。)を示し;
R1は、水素原子、低級アルキル、低級アルコキシ、低級アルキルチオ、フェニル、ナフチル、フェノキシ、ナフチルオキシ、ニトロ、アミノを示すか、または一般式
R1は、水素原子、低級アルキル、低級アルコキシ、低級アルキルチオ、フェニル、ナフチル、フェノキシ、ナフチルオキシ、ニトロ、アミノを示すか、または一般式
(X、R2、R3は、上記と同義である。)を示す。]で表される化合物が、駆虫剤、防カビ剤として有用であることが記載されている。
しかし、上記の文献には、イミダゾピリジン誘導体がASK1阻害作用を有することは開示されていない。
国際公開第2004/103991号パンフレット
米国特許第3701780号明細書
Dopovidi Natsional'noi Akademii Nauk Ukraini (2005), (4), 128-133
しかし、上記の文献には、イミダゾピリジン誘導体がASK1阻害作用を有することは開示されていない。
本発明は、ASK1阻害作用を有し、糖尿病、炎症性疾患等の予防・治療剤等の医薬として有用な化合物を提供することを目的とする。
本発明者らは、種々鋭意検討を重ねた結果、以下の式(I)で表される化合物が、予想外にも優れたASK1阻害作用を有し、更に安定性等の医薬品としての物性においても優れた性質を有しており、安全でかつ有用な医薬となることを見出し、これらの知見に基づいて本発明を完成した。
即ち、本発明は、
[1]式(I):
[1]式(I):
[式中、
環Aは、さらに置換されていてもよい環を;
R1は、水素原子または置換基を;
R2は、水素原子または置換基を;
R3は、水素原子または置換基を;
R4は、水素原子または置換基を;
R5は、水素原子または置換基を;
R6は、水素原子または置換基を;
Xは、=N−または=C(Z)−(Zは、水素原子または置換基を示す)を示し;
Xが=C(Z)−である場合、ZとR6が結合して、それらが結合する炭素原子と共に、置換されていてもよい環を形成してもよい。
但し、Xが=CH−である場合、R6は置換されていてもよい2−ピペリジニルでない]で表される化合物(但し、N−イミダゾ[1,2−a]ピリジン−2−イル−4−メチル−ベンズアミド、N−イミダゾ[1,2−a]ピリジン−2−イル−ベンズアミドおよびN−(7−メチルイミダゾ[1,2−a]ピリジン−2−イル)−ベンズアミドを除く。)またはその塩(以下、「化合物(I)」と略称する場合がある);
[2]Xが=C(Z)−(Zは、水素原子または置換基を示す)である上記[1]記載の化合物;
[3]Xが=N−であり、環Aがさらに置換基を有していてもよい芳香族炭化水素または置換基を有していてもよい5員の複素環である上記[1]記載の化合物;
[4]R1が、
(1) 水素原子、
(2) (a) 芳香族複素環基、
(b) (i) C1−6アルキル、
(ii) ヒドロキシおよび芳香族複素環基から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル−カルボニル、
(iii) C6−14アリール−カルボニル、
(iv) C1−6アルキル−スルホニル、および
(v) 芳香族複素環−カルボニル、
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(c) シアノ、
(d) カルボキシル、
(e) C1−6アルコキシ−カルボニル、
(f) N−ヒドロキシカルバモイル、
(g) (i)シアノ、(ii)ヒドロキシ、(iii)芳香族複素環基、および(iv)C1−6アルキルを1ないし3個有していてもよい非芳香族複素環基から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキルでモノまたはジ置換されていてもよいカルバモイル、
(h) ハロゲン原子、
(i) ジC1−6アルキルホスホリル、
(j) ヒドロキシ、ならびに
(k) 非芳香族複素環基
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル;
(3) (a) C1−6アルコキシ−カルボニル、および
(b) カルボキシル
から選ばれる1ないし3個の置換基で置換されていてもよいC3−10シクロアルキル;
(4) 芳香族複素環基;
(5) C1−6アルキルで置換されていてもよいヒドロキシ;
(6) (a) C1−6アルキル、および
(b) C1−6アルキル−スルホニル
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(7) シアノ;
(8) カルボキシル;
(9) C1−6アルコキシ−カルボニル;
(10) C1−6アルキル−スルホニル;
(11) (a) C1−6アルキル、および
(b) C1−6アルキル−カルボニル
から選ばれる置換基でモノまたはジ置換されていてもよいスルファモイル;あるいは
(12) ハロゲン原子
である上記[2]または[3]記載の化合物;
[5]R2が水素原子である上記[2]または[3]記載の化合物;
[6]R3が水素原子、C1−6アルキルまたはハロゲン原子である上記[2]または[3]記載の化合物;
[7]R4が水素原子である上記[2]または[3]記載の化合物;
[8]R5が水素原子である上記[2]または[3]記載の化合物;
[9]R6が、
(1) 水素原子;
(2) (a) ヒドロキシ、
(b) C1−6アルキルでモノまたはジ置換されていてもよいアミノ、および
(c) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル;
(3) (a) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(b) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルコキシ、
(c) C1−6アルコキシ−カルボニル、
(d) (i)C1−6アルキル、および
(ii) C1−6アルキル−カルボニル
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(e) C1−6アルキル−スルホニル、
(f) シアノ、ならびに
(g) C1−3アルキレンジオキシ
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール;
(4) (a) (i) 非芳香族複素環基で置換されていてもよいヒドロキシ、および
(ii) シアノ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、
(b) C6−14アリール、
(c) 芳香族複素環基、
(d) C1−6アルコキシ、ならびに
(e) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基;
(5) (a) (i) C6−14アリール、
(ii) 芳香族複素環基、および
(iii) C1−6アルキルで置換されていてもよいヒドロキシ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、
(b) C1−6アルコキシ、およびハロゲン原子から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール、
(c) 芳香族複素環基、
(d) ヒドロキシ、
(e) C1−6アルキル−カルボニルでモノまたはジ置換されていてもよいアミノ、
(f) カルボキシル、
(g) C7−13アラルキルでモノまたはジ置換されていてもよいカルバモイル、
(h) C1−6アルキル−スルホニル、ならびに
(i) C6−14アリール−スルホニル
から選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基;
(6) (a) (i) (A) ハロゲン原子、
(B) C1−6アルキルでモノまたはジ置換されていてもよいアミノ、および
(C) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキルで1ないし3個置換されていてもよい芳香族複素環基
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、
(ii)1ないし3個のC1−6アルキルで置換されていてもよい芳香族複素環基、
(iii) 非芳香族複素環基、
(iv) (A)ハロゲン原子および(B)カルボキシルから選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルコキシ、
(v) (A) C1−6アルキル、
(B) C1−6アルキル−カルボニル、
(C) C3−10シクロアルキル−カルボニル、
(D) (1’)1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、(2’)ハロゲン原子、および、(3’)1ないし3個のシアノで置換されていてもよいC3−10シクロアルキルから選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール−カルボニル、ならびに
(E) 1ないし3個のC1−6アルキルで置換されていてもよい芳香族複素環−カルボニル
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(vi) カルボキシル、ならびに
(vii) C1−6アルキルおよびオキソから選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環−カルボニル
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール、
(b) (i) C1−6アルキル、
(ii) C1−6アルキル−カルボニル、および
(iii) カルボキシル
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基、ならびに
(c) C1−6アルキルおよびオキソから選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基
から選ばれる置換基で置換されていてもよいヒドロキシ;
(7) (a) (i) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(ii) C6−14アリール、および
(iii) 芳香族複素環基
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基、
で置換されていてもよいメルカプト;
(8) (a) (i) 芳香族複素環基、
(ii) ヒドロキシ、
(iii) C1−6アルコキシ、および
(iv) C1−6アルキルでモノまたはジ置換されていてもよいアミノ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、
(b) C3−10シクロアルキル、
(c) C7−13アラルキル、ならびに
(d) 1ないし3個のC1−6アルキルで置換されていてもよい非芳香族複素環基
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(9) シアノ;
(10) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル−カルボニル;
(11) ハロゲン原子;あるいは
(12) オキソで置換されていてもよいC3−10シクロアルカンと縮合したC6−14アリールで置換されたヒドロキシである上記[2]または[3]記載の化合物;
[10]Zが、水素原子、または1ないし3個のヒドロキシで置換されていてもよいC1−6アルキルであるか、あるいは、ZとR6が結合して、それらが結合する炭素原子と共に、それぞれ1ないし3個のC1−6アルキルで置換されていてもよい、芳香族炭化水素または複素環を形成する上記[2]記載の化合物;
[11]
下記化合物またはその塩。
4−tert−ブチル−N−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イル)ベンズアミド、
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド、
6−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミド、
4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド、
4−tert−ブチル−N−[6−(1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド、
4−(1−シアノ−1−メチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド、
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド。
[12]上記[1]記載の化合物のプロドラッグ;
[13]上記[1]記載の化合物またはそのプロドラッグを含有してなる、医薬;
[14]ASK1阻害剤である上記[13]記載の医薬;
[15]糖尿病の予防または治療剤である、上記[13]記載の医薬;
[16]炎症性疾患の予防または治療剤である、上記[13]記載の医薬;
[17]哺乳動物に対し上記[1]記載の化合物またはそのプロドラッグの有効量を投与することを特徴とする糖尿病および/または炎症性疾患の予防・治療方法。
[18]糖尿病および/または炎症性疾患の予防・治療剤を製造するための上記[1]記載の化合物またはそのプロドラッグの使用;等に関する。
環Aは、さらに置換されていてもよい環を;
R1は、水素原子または置換基を;
R2は、水素原子または置換基を;
R3は、水素原子または置換基を;
R4は、水素原子または置換基を;
R5は、水素原子または置換基を;
R6は、水素原子または置換基を;
Xは、=N−または=C(Z)−(Zは、水素原子または置換基を示す)を示し;
Xが=C(Z)−である場合、ZとR6が結合して、それらが結合する炭素原子と共に、置換されていてもよい環を形成してもよい。
但し、Xが=CH−である場合、R6は置換されていてもよい2−ピペリジニルでない]で表される化合物(但し、N−イミダゾ[1,2−a]ピリジン−2−イル−4−メチル−ベンズアミド、N−イミダゾ[1,2−a]ピリジン−2−イル−ベンズアミドおよびN−(7−メチルイミダゾ[1,2−a]ピリジン−2−イル)−ベンズアミドを除く。)またはその塩(以下、「化合物(I)」と略称する場合がある);
[2]Xが=C(Z)−(Zは、水素原子または置換基を示す)である上記[1]記載の化合物;
[3]Xが=N−であり、環Aがさらに置換基を有していてもよい芳香族炭化水素または置換基を有していてもよい5員の複素環である上記[1]記載の化合物;
[4]R1が、
(1) 水素原子、
(2) (a) 芳香族複素環基、
(b) (i) C1−6アルキル、
(ii) ヒドロキシおよび芳香族複素環基から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル−カルボニル、
(iii) C6−14アリール−カルボニル、
(iv) C1−6アルキル−スルホニル、および
(v) 芳香族複素環−カルボニル、
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(c) シアノ、
(d) カルボキシル、
(e) C1−6アルコキシ−カルボニル、
(f) N−ヒドロキシカルバモイル、
(g) (i)シアノ、(ii)ヒドロキシ、(iii)芳香族複素環基、および(iv)C1−6アルキルを1ないし3個有していてもよい非芳香族複素環基から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキルでモノまたはジ置換されていてもよいカルバモイル、
(h) ハロゲン原子、
(i) ジC1−6アルキルホスホリル、
(j) ヒドロキシ、ならびに
(k) 非芳香族複素環基
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル;
(3) (a) C1−6アルコキシ−カルボニル、および
(b) カルボキシル
から選ばれる1ないし3個の置換基で置換されていてもよいC3−10シクロアルキル;
(4) 芳香族複素環基;
(5) C1−6アルキルで置換されていてもよいヒドロキシ;
(6) (a) C1−6アルキル、および
(b) C1−6アルキル−スルホニル
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(7) シアノ;
(8) カルボキシル;
(9) C1−6アルコキシ−カルボニル;
(10) C1−6アルキル−スルホニル;
(11) (a) C1−6アルキル、および
(b) C1−6アルキル−カルボニル
から選ばれる置換基でモノまたはジ置換されていてもよいスルファモイル;あるいは
(12) ハロゲン原子
である上記[2]または[3]記載の化合物;
[5]R2が水素原子である上記[2]または[3]記載の化合物;
[6]R3が水素原子、C1−6アルキルまたはハロゲン原子である上記[2]または[3]記載の化合物;
[7]R4が水素原子である上記[2]または[3]記載の化合物;
[8]R5が水素原子である上記[2]または[3]記載の化合物;
[9]R6が、
(1) 水素原子;
(2) (a) ヒドロキシ、
(b) C1−6アルキルでモノまたはジ置換されていてもよいアミノ、および
(c) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル;
(3) (a) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(b) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルコキシ、
(c) C1−6アルコキシ−カルボニル、
(d) (i)C1−6アルキル、および
(ii) C1−6アルキル−カルボニル
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(e) C1−6アルキル−スルホニル、
(f) シアノ、ならびに
(g) C1−3アルキレンジオキシ
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール;
(4) (a) (i) 非芳香族複素環基で置換されていてもよいヒドロキシ、および
(ii) シアノ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、
(b) C6−14アリール、
(c) 芳香族複素環基、
(d) C1−6アルコキシ、ならびに
(e) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基;
(5) (a) (i) C6−14アリール、
(ii) 芳香族複素環基、および
(iii) C1−6アルキルで置換されていてもよいヒドロキシ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、
(b) C1−6アルコキシ、およびハロゲン原子から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール、
(c) 芳香族複素環基、
(d) ヒドロキシ、
(e) C1−6アルキル−カルボニルでモノまたはジ置換されていてもよいアミノ、
(f) カルボキシル、
(g) C7−13アラルキルでモノまたはジ置換されていてもよいカルバモイル、
(h) C1−6アルキル−スルホニル、ならびに
(i) C6−14アリール−スルホニル
から選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基;
(6) (a) (i) (A) ハロゲン原子、
(B) C1−6アルキルでモノまたはジ置換されていてもよいアミノ、および
(C) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキルで1ないし3個置換されていてもよい芳香族複素環基
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、
(ii)1ないし3個のC1−6アルキルで置換されていてもよい芳香族複素環基、
(iii) 非芳香族複素環基、
(iv) (A)ハロゲン原子および(B)カルボキシルから選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルコキシ、
(v) (A) C1−6アルキル、
(B) C1−6アルキル−カルボニル、
(C) C3−10シクロアルキル−カルボニル、
(D) (1’)1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、(2’)ハロゲン原子、および、(3’)1ないし3個のシアノで置換されていてもよいC3−10シクロアルキルから選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール−カルボニル、ならびに
(E) 1ないし3個のC1−6アルキルで置換されていてもよい芳香族複素環−カルボニル
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(vi) カルボキシル、ならびに
(vii) C1−6アルキルおよびオキソから選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環−カルボニル
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール、
(b) (i) C1−6アルキル、
(ii) C1−6アルキル−カルボニル、および
(iii) カルボキシル
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基、ならびに
(c) C1−6アルキルおよびオキソから選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基
から選ばれる置換基で置換されていてもよいヒドロキシ;
(7) (a) (i) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(ii) C6−14アリール、および
(iii) 芳香族複素環基
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基、
で置換されていてもよいメルカプト;
(8) (a) (i) 芳香族複素環基、
(ii) ヒドロキシ、
(iii) C1−6アルコキシ、および
(iv) C1−6アルキルでモノまたはジ置換されていてもよいアミノ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、
(b) C3−10シクロアルキル、
(c) C7−13アラルキル、ならびに
(d) 1ないし3個のC1−6アルキルで置換されていてもよい非芳香族複素環基
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(9) シアノ;
(10) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル−カルボニル;
(11) ハロゲン原子;あるいは
(12) オキソで置換されていてもよいC3−10シクロアルカンと縮合したC6−14アリールで置換されたヒドロキシである上記[2]または[3]記載の化合物;
[10]Zが、水素原子、または1ないし3個のヒドロキシで置換されていてもよいC1−6アルキルであるか、あるいは、ZとR6が結合して、それらが結合する炭素原子と共に、それぞれ1ないし3個のC1−6アルキルで置換されていてもよい、芳香族炭化水素または複素環を形成する上記[2]記載の化合物;
[11]
下記化合物またはその塩。
4−tert−ブチル−N−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イル)ベンズアミド、
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド、
6−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミド、
4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド、
4−tert−ブチル−N−[6−(1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド、
4−(1−シアノ−1−メチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド、
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド。
[12]上記[1]記載の化合物のプロドラッグ;
[13]上記[1]記載の化合物またはそのプロドラッグを含有してなる、医薬;
[14]ASK1阻害剤である上記[13]記載の医薬;
[15]糖尿病の予防または治療剤である、上記[13]記載の医薬;
[16]炎症性疾患の予防または治療剤である、上記[13]記載の医薬;
[17]哺乳動物に対し上記[1]記載の化合物またはそのプロドラッグの有効量を投与することを特徴とする糖尿病および/または炎症性疾患の予防・治療方法。
[18]糖尿病および/または炎症性疾患の予防・治療剤を製造するための上記[1]記載の化合物またはそのプロドラッグの使用;等に関する。
本発明の化合物は、優れたASK1阻害活性を有し、糖尿病、炎症性疾患等の予防・治療剤等の医薬として有用である。
本明細書中の「ハロゲン原子」は、特に断りのない限り、フッ素原子、塩素原子、臭素原子、ヨウ素原子を意味する。
本明細書中の「C1−3アルキレンジオキシ」は、特に断りのない限り、メチレンジオキシ、エチレンジオキシ等を意味する。
本明細書中の「C1−6アルキル」は、特に断りのない限り、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、sec−ブチル、tert−ブチル、ペンチル、イソペンチル、ネオペンチル、tert−ペンチル、1−エチルプロピル、ヘキシル、イソヘキシル、1,1−ジメチルブチル、2,2−ジメチルブチル、3,3−ジメチルブチル、2−エチルブチル等を意味する。
本明細書中の「C1−6アルコキシ」は、特に断りのない限り、メトキシ、エトキシ、プロポキシ、イソプロポキシ、ブトキシ、イソブトキシ、sec−ブトキシ、tert−ブトキシ等を意味する。
本明細書中の「C1−6アルコキシ−カルボニル」は、特に断りのない限り、メトキシカルボニル、エトキシカルボニル、プロポキシカルボニル、tert−ブトキシカルボニル等を意味する。
本明細書中の「C1−6アルキル−カルボニル」は、特に断りのない限り、アセチル、プロパノイル、ブタノイル、イソブタノイル、ペンタノイル、イソペンタノイル、ヘキサノイル等を意味する。
本明細書中の「C1−3アルキレンジオキシ」は、特に断りのない限り、メチレンジオキシ、エチレンジオキシ等を意味する。
本明細書中の「C1−6アルキル」は、特に断りのない限り、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、sec−ブチル、tert−ブチル、ペンチル、イソペンチル、ネオペンチル、tert−ペンチル、1−エチルプロピル、ヘキシル、イソヘキシル、1,1−ジメチルブチル、2,2−ジメチルブチル、3,3−ジメチルブチル、2−エチルブチル等を意味する。
本明細書中の「C1−6アルコキシ」は、特に断りのない限り、メトキシ、エトキシ、プロポキシ、イソプロポキシ、ブトキシ、イソブトキシ、sec−ブトキシ、tert−ブトキシ等を意味する。
本明細書中の「C1−6アルコキシ−カルボニル」は、特に断りのない限り、メトキシカルボニル、エトキシカルボニル、プロポキシカルボニル、tert−ブトキシカルボニル等を意味する。
本明細書中の「C1−6アルキル−カルボニル」は、特に断りのない限り、アセチル、プロパノイル、ブタノイル、イソブタノイル、ペンタノイル、イソペンタノイル、ヘキサノイル等を意味する。
以下、式(I)で用いられる各記号の定義について詳述する。
R1、R2、R3、R4、R5、R6およびZは同一または異なって、それぞれ水素原子または置換基を示す。
R1、R2、R3、R4、R5、R6およびZで示される「置換基」としては、「置換されていてもよい炭化水素基」、「置換されていてもよい複素環基」、「置換されていてもよいヒドロキシ」、「置換されていてもよいメルカプト」、「置換されていてもよいアミノ」、「シアノ」、「ニトロ」、「アシル」、「ハロゲン原子」等が挙げられる。
R1、R2、R3、R4、R5、R6およびZは同一または異なって、それぞれ水素原子または置換基を示す。
R1、R2、R3、R4、R5、R6およびZで示される「置換基」としては、「置換されていてもよい炭化水素基」、「置換されていてもよい複素環基」、「置換されていてもよいヒドロキシ」、「置換されていてもよいメルカプト」、「置換されていてもよいアミノ」、「シアノ」、「ニトロ」、「アシル」、「ハロゲン原子」等が挙げられる。
前記「置換されていてもよい炭化水素基」の「炭化水素基」としては、例えば、C1−10アルキル、C2−10アルケニル、C2−10アルキニル、C3−10シクロアルキル、C3−10シクロアルケニル、C4−10シクロアルカジエニル、C6−14アリール、C7−13アラルキル、C8−13アリールアルケニル、C3−10シクロアルキル−C1−6アルキル等が挙げられる。
ここで、C1−10アルキルとしては、例えば、メチル、エチル、プロピル、イソプロピル、ブチル、イソブチル、sec−ブチル、tert−ブチル、ペンチル、イソペンチル、ネオペンチル、tert−ペンチル、1−エチルプロピル、ヘキシル、イソヘキシル、1,1−ジメチルブチル、2,2−ジメチルブチル、3,3−ジメチルブチル、2−エチルブチル、ヘプチル、オクチル、ノニル、デシル等が挙げられる。
C2−10アルケニルとしては、例えば、エテニル、1−プロペニル、2−プロペニル、2−メチル−1−プロペニル、1−ブテニル、2−ブテニル、3−ブテニル、3−メチル−2−ブテニル、1−ペンテニル、2−ペンテニル、3−ペンテニル、4−ペンテニル、4−メチル−3−ペンテニル、1−ヘキセニル、3−ヘキセニル、5−ヘキセニル、1−ヘプテニル、1−オクテニル等が挙げられる。
C2−10アルキニルとしては、例えば、エチニル、1−プロピニル、2−プロピニル、1−ブチニル、2−ブチニル、3−ブチニル、1−ペンチニル、2−ペンチニル、3−ペンチニル、4−ペンチニル、1−ヘキシニル、2−ヘキシニル、3−ヘキシニル、4−ヘキシニル、5−ヘキシニル、1−ヘプチニル、1−オクチニル等が挙げられる。
C2−10アルケニルとしては、例えば、エテニル、1−プロペニル、2−プロペニル、2−メチル−1−プロペニル、1−ブテニル、2−ブテニル、3−ブテニル、3−メチル−2−ブテニル、1−ペンテニル、2−ペンテニル、3−ペンテニル、4−ペンテニル、4−メチル−3−ペンテニル、1−ヘキセニル、3−ヘキセニル、5−ヘキセニル、1−ヘプテニル、1−オクテニル等が挙げられる。
C2−10アルキニルとしては、例えば、エチニル、1−プロピニル、2−プロピニル、1−ブチニル、2−ブチニル、3−ブチニル、1−ペンチニル、2−ペンチニル、3−ペンチニル、4−ペンチニル、1−ヘキシニル、2−ヘキシニル、3−ヘキシニル、4−ヘキシニル、5−ヘキシニル、1−ヘプチニル、1−オクチニル等が挙げられる。
C3−10シクロアルキルとしては、例えば、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、シクロオクチル、ビシクロ[2.2.1]ヘプチル、ビシクロ[2.2.2]オクチル、ビシクロ[3.2.1]オクチル、ビシクロ[3.2.2]ノニル、ビシクロ[3.3.1]ノニル、ビシクロ[4.2.1]ノニル、ビシクロ[4.3.1]デシル、アダマンチル等が挙げられる。
C3−10シクロアルケニルとしては、例えば、2−シクロペンテン−1−イル、3−シクロペンテン−1−イル、2−シクロヘキセン−1−イル、3−シクロヘキセン−1−イル等が挙げられる。
C4−10シクロアルカジエニルとしては、例えば、2,4−シクロペンタジエン−1−イル、2,4−シクロヘキサジエン−1−イル、2,5−シクロヘキサジエン−1−イル等が挙げられる。
上記のC3−10シクロアルキル、C3−10シクロアルケニルおよびC4−10シクロアルカジエニルは、それぞれベンゼン環と縮合していてもよく、このような縮合環基としては、例えば、インダニル、ジヒドロナフチル、テトラヒドロナフチル、フルオレニル等が挙げられる。
C3−10シクロアルケニルとしては、例えば、2−シクロペンテン−1−イル、3−シクロペンテン−1−イル、2−シクロヘキセン−1−イル、3−シクロヘキセン−1−イル等が挙げられる。
C4−10シクロアルカジエニルとしては、例えば、2,4−シクロペンタジエン−1−イル、2,4−シクロヘキサジエン−1−イル、2,5−シクロヘキサジエン−1−イル等が挙げられる。
上記のC3−10シクロアルキル、C3−10シクロアルケニルおよびC4−10シクロアルカジエニルは、それぞれベンゼン環と縮合していてもよく、このような縮合環基としては、例えば、インダニル、ジヒドロナフチル、テトラヒドロナフチル、フルオレニル等が挙げられる。
C6−14アリールとしては、例えば、フェニル、ナフチル、アントリル、フェナントリル、アセナフチレニル、ビフェニリル等が挙げられる。
C7−13アラルキルとしては、例えば、ベンジル、フェネチル、ナフチルメチル、ビフェニリルメチル等が挙げられる。
C8−13アリールアルケニルとしては、例えば、スチリル等が挙げられる。
C3−10シクロアルキル−C1−6アルキルとしては、例えば、シクロヘキシルメチル等が挙げられる。
C7−13アラルキルとしては、例えば、ベンジル、フェネチル、ナフチルメチル、ビフェニリルメチル等が挙げられる。
C8−13アリールアルケニルとしては、例えば、スチリル等が挙げられる。
C3−10シクロアルキル−C1−6アルキルとしては、例えば、シクロヘキシルメチル等が挙げられる。
前記「炭化水素基」として例示した、C1−10アルキル、C2−10アルケニルおよびC2−10アルキニルは、置換可能な位置に1ないし3個の置換基を有していてもよい。
このような置換基としては、例えば、
(1)(a) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(b) ヒドロキシ、
(c) C1−6アルコキシ、および
(d) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよいC3−10シクロアルキル(例、シクロプロピル、シクロヘキシル);
(2)(a) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(b) ヒドロキシ、
(c) C1−6アルコキシ、および
(d) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル、ナフチル);
(3)(a) ハロゲン原子およびヒドロキシから選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、
(b) ヒドロキシ、
(c) C1−6アルコキシ、および
(d) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、チエニル、フリル、ピリジル、オキサゾリル、チアゾリル、テトラゾリル、オキサジアゾリル、ピラジニル、キノリル、インドリル、ピリミジニル、イミダゾリル、ピラゾリル、チアジアゾリル、イソキサゾリル);
(4)(a) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(b) ヒドロキシ、
(c) C1−6アルコキシ、および
(d) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基(例、テトラヒドロフリル、モルホリニル、チオモルホリニル、ピペリジニル、ピロリジニル、ピペラジニル、ジオキソリル、ジオキソラニル、1,3−ジヒドロ−2−ベンゾフラニル、チアゾリジニル、オキソオキサジアゾリル);
(5)(a) (i) C1−6アルコキシ、
(ii) C6−14アリールオキシ(例、フェノキシ)、
(iii) カルボキシル、
(iv) C1−6アルコキシーカルボニル、および
(v) ヒドロキシ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、
(b) C7−13アラルキルオキシ(例、ベンジルオキシ)、
(c) (i) ヒドロキシ、および
(ii) 芳香族複素環基(例、チエニル、フリル、ピリジル、オキサゾリル、チアゾリル、テトラゾリル、オキサジアゾリル、ピラジニル、キノリル、インドリル、イミダゾリル、ピラゾリル、チアジアゾリル、イソキサゾリル)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル−カルボニル、
(d) C3−10シクロアルキル−カルボニル(例、シクロプロピルカルボニル、シクロペンチルカルボニル、シクロヘキシルカルボニル)、
(e) C1−6アルコキシ−カルボニル、
(f) (i) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル(例、トリフルオロメチル)、および
(ii) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール−カルボニル(例、ベンゾイル)、
(g) C7−13アラルキル−カルボニル(例、ベンジルカルボニル、フェネチルカルボニル)、
(h) 1ないし3個のC1−6アルキルで置換されていてもよい芳香族複素環−カルボニル(例、チエニルカルボニル、フリルカルボニル、ピリジルカルボニル、オキサゾリルカルボニル、チアゾリルカルボニル、テトラゾリルカルボニル、オキサジアゾリルカルボニル、ピラジニルカルボニル、キノリルカルボニル、インドリルカルボニル、イミダゾリルカルボニル、ピラゾリルカルボニル、チアジアゾリルカルボニル、イソキサゾリルカルボニル)、
(i) 芳香族複素環−カルバモイル(例、チエニルカルバモイル、フリルカルバモイル、ピリジルカルバモイル、オキサゾリルカルバモイル、チアゾリルカルバモイル、テトラゾリルカルバモイル、オキサジアゾリルカルバモイル、ピラジニルカルバモイル、キノリルカルバモイル、インドリルカルバモイル、イミダゾリルカルバモイル、ピラゾリルカルバモイル、チアジアゾリルカルバモイル、イソキサゾリルカルバモイル)、
(j) C1−6アルキル−カルバモイル(例、メチルカルバモイル、エチルカルバモイル)、
(k) C6−14アリール−カルバモイル(例、フェニルカルバモイル、1−ナフチルカルバモイル、2−ナフチルカルバモイル)、
(l) C7−13アラルキル−カルバモイル(例、ベンジルカルバモイル)、
(m) C1−6アルキル−スルホニル(例、メチルスルホニル、エチルスルホニル、イソプロピルスルホニル)、
(n) C6−14アリール−スルホニル(例、ベンゼンスルホニル、トルエンスルホニル、1−ナフタレンスルホニル、2−ナフタレンスルホニル)、ならびに
(o) C7−13アラルキル−スルホニル(例、ベンジルスルホニル)、
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(6)アミジノ;
(7)1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル−カルボニル;
(8)1ないし3個のハロゲン原子で置換されていてもよいC1−6アルコキシ−カルボニル;
(9)1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキルスルホニル(例、メチルスルホニル);
(10)(a) (i) ハロゲン原子、
(ii) シアノ、
(iii) ヒドロキシ、および
(iv) 芳香族複素環基(例、チエニル、フリル、ピリジル、オキサゾリル、チアゾリル、テトラゾリル、オキサジアゾリル、ピラジニル、キノリル、インドリル、イミダゾリル、ピラゾリル、チアジアゾリル、イソキサゾリル)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、
(b) C6−14アリール(例、フェニル)、
(c) C7−13アラルキル(例、ベンジル)、ならびに
(d) 芳香族複素環−C1−6アルキル(例、フルフリル)
から選ばれる置換基でモノまたはジ置換されていてもよいカルバモイル;
(11)1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキルでモノまたはジ置換されていてもよいチオカルバモイル;
(12)1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキルでモノまたはジ置換されていてもよいスルファモイル;
(13)カルボキシル;
(14)ヒドロキシ;
(15)(a) ハロゲン原子、
(b) カルボキシル、
(c) C1−6アルコキシ、および
(d) C1−6アルコキシ−カルボニル
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルコキシ;
(16)1ないし3個のハロゲン原子で置換されていてもよいC2−6アルケニルオキシ(例、エテニルオキシ);
(17)C3−10シクロアルキルオキシ(例、シクロヘキシルオキシ);
(18)C7−13アラルキルオキシ(例、ベンジルオキシ);
(19)C6−14アリールオキシ(例、フェニルオキシ、ナフチルオキシ);
(20)C1−6アルキル−カルボニルオキシ(例、アセチルオキシ、tert−ブチルカルボニルオキシ);
(21)メルカプト;
(22)1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキルチオ(例、メチルチオ、エチルチオ);
(23)C7−13アラルキルチオ(例、ベンジルチオ);
(24)C6−14アリールチオ(例、フェニルチオ、ナフチルチオ);
(25)スルホ;
(26)シアノ;
(27)アジド;
(28)ニトロ;
(29)ニトロソ;
(30)ハロゲン原子;
(31)C1−6アルキルスルフィニル(例、メチルスルフィニル);
(32)C3−10シクロアルキル−C1−6アルキルオキシ(例、シクロプロピルメチルオキシ);
(33)C1−3アルキレンジオキシ;
(34)N−ヒドロキシカルバモイル;
(35)モノまたはジC1−6アルキルホスホリル(例、ジエチルホスホリル);
(36)C6−14アリールスルホニル(例、フェニルスルホニル);
(37)(a) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(b) ヒドロキシ、
(c) C1−6アルコキシ、および
(d) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環−カルボニル(例、テトラヒドロフリルカルボニル、モルホリニルカルボニル、チオモルホリニルカルボニル、ピペリジニルカルボニル、ピロリジニルカルボニル、ピペラジニルカルボニル、ジオキソリルカルボニル、ジオキソラニルカルボニル、1,3−ジヒドロ−2−ベンゾフラニルカルボニル、チアゾリジニルカルボニル);
等が挙げられる。置換基が2個以上である場合、各置換基は同一でも異なっていてもよい。
このような置換基としては、例えば、
(1)(a) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(b) ヒドロキシ、
(c) C1−6アルコキシ、および
(d) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよいC3−10シクロアルキル(例、シクロプロピル、シクロヘキシル);
(2)(a) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(b) ヒドロキシ、
(c) C1−6アルコキシ、および
(d) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル、ナフチル);
(3)(a) ハロゲン原子およびヒドロキシから選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、
(b) ヒドロキシ、
(c) C1−6アルコキシ、および
(d) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、チエニル、フリル、ピリジル、オキサゾリル、チアゾリル、テトラゾリル、オキサジアゾリル、ピラジニル、キノリル、インドリル、ピリミジニル、イミダゾリル、ピラゾリル、チアジアゾリル、イソキサゾリル);
(4)(a) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(b) ヒドロキシ、
(c) C1−6アルコキシ、および
(d) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基(例、テトラヒドロフリル、モルホリニル、チオモルホリニル、ピペリジニル、ピロリジニル、ピペラジニル、ジオキソリル、ジオキソラニル、1,3−ジヒドロ−2−ベンゾフラニル、チアゾリジニル、オキソオキサジアゾリル);
(5)(a) (i) C1−6アルコキシ、
(ii) C6−14アリールオキシ(例、フェノキシ)、
(iii) カルボキシル、
(iv) C1−6アルコキシーカルボニル、および
(v) ヒドロキシ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、
(b) C7−13アラルキルオキシ(例、ベンジルオキシ)、
(c) (i) ヒドロキシ、および
(ii) 芳香族複素環基(例、チエニル、フリル、ピリジル、オキサゾリル、チアゾリル、テトラゾリル、オキサジアゾリル、ピラジニル、キノリル、インドリル、イミダゾリル、ピラゾリル、チアジアゾリル、イソキサゾリル)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル−カルボニル、
(d) C3−10シクロアルキル−カルボニル(例、シクロプロピルカルボニル、シクロペンチルカルボニル、シクロヘキシルカルボニル)、
(e) C1−6アルコキシ−カルボニル、
(f) (i) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル(例、トリフルオロメチル)、および
(ii) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール−カルボニル(例、ベンゾイル)、
(g) C7−13アラルキル−カルボニル(例、ベンジルカルボニル、フェネチルカルボニル)、
(h) 1ないし3個のC1−6アルキルで置換されていてもよい芳香族複素環−カルボニル(例、チエニルカルボニル、フリルカルボニル、ピリジルカルボニル、オキサゾリルカルボニル、チアゾリルカルボニル、テトラゾリルカルボニル、オキサジアゾリルカルボニル、ピラジニルカルボニル、キノリルカルボニル、インドリルカルボニル、イミダゾリルカルボニル、ピラゾリルカルボニル、チアジアゾリルカルボニル、イソキサゾリルカルボニル)、
(i) 芳香族複素環−カルバモイル(例、チエニルカルバモイル、フリルカルバモイル、ピリジルカルバモイル、オキサゾリルカルバモイル、チアゾリルカルバモイル、テトラゾリルカルバモイル、オキサジアゾリルカルバモイル、ピラジニルカルバモイル、キノリルカルバモイル、インドリルカルバモイル、イミダゾリルカルバモイル、ピラゾリルカルバモイル、チアジアゾリルカルバモイル、イソキサゾリルカルバモイル)、
(j) C1−6アルキル−カルバモイル(例、メチルカルバモイル、エチルカルバモイル)、
(k) C6−14アリール−カルバモイル(例、フェニルカルバモイル、1−ナフチルカルバモイル、2−ナフチルカルバモイル)、
(l) C7−13アラルキル−カルバモイル(例、ベンジルカルバモイル)、
(m) C1−6アルキル−スルホニル(例、メチルスルホニル、エチルスルホニル、イソプロピルスルホニル)、
(n) C6−14アリール−スルホニル(例、ベンゼンスルホニル、トルエンスルホニル、1−ナフタレンスルホニル、2−ナフタレンスルホニル)、ならびに
(o) C7−13アラルキル−スルホニル(例、ベンジルスルホニル)、
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(6)アミジノ;
(7)1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル−カルボニル;
(8)1ないし3個のハロゲン原子で置換されていてもよいC1−6アルコキシ−カルボニル;
(9)1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキルスルホニル(例、メチルスルホニル);
(10)(a) (i) ハロゲン原子、
(ii) シアノ、
(iii) ヒドロキシ、および
(iv) 芳香族複素環基(例、チエニル、フリル、ピリジル、オキサゾリル、チアゾリル、テトラゾリル、オキサジアゾリル、ピラジニル、キノリル、インドリル、イミダゾリル、ピラゾリル、チアジアゾリル、イソキサゾリル)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、
(b) C6−14アリール(例、フェニル)、
(c) C7−13アラルキル(例、ベンジル)、ならびに
(d) 芳香族複素環−C1−6アルキル(例、フルフリル)
から選ばれる置換基でモノまたはジ置換されていてもよいカルバモイル;
(11)1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキルでモノまたはジ置換されていてもよいチオカルバモイル;
(12)1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキルでモノまたはジ置換されていてもよいスルファモイル;
(13)カルボキシル;
(14)ヒドロキシ;
(15)(a) ハロゲン原子、
(b) カルボキシル、
(c) C1−6アルコキシ、および
(d) C1−6アルコキシ−カルボニル
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルコキシ;
(16)1ないし3個のハロゲン原子で置換されていてもよいC2−6アルケニルオキシ(例、エテニルオキシ);
(17)C3−10シクロアルキルオキシ(例、シクロヘキシルオキシ);
(18)C7−13アラルキルオキシ(例、ベンジルオキシ);
(19)C6−14アリールオキシ(例、フェニルオキシ、ナフチルオキシ);
(20)C1−6アルキル−カルボニルオキシ(例、アセチルオキシ、tert−ブチルカルボニルオキシ);
(21)メルカプト;
(22)1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキルチオ(例、メチルチオ、エチルチオ);
(23)C7−13アラルキルチオ(例、ベンジルチオ);
(24)C6−14アリールチオ(例、フェニルチオ、ナフチルチオ);
(25)スルホ;
(26)シアノ;
(27)アジド;
(28)ニトロ;
(29)ニトロソ;
(30)ハロゲン原子;
(31)C1−6アルキルスルフィニル(例、メチルスルフィニル);
(32)C3−10シクロアルキル−C1−6アルキルオキシ(例、シクロプロピルメチルオキシ);
(33)C1−3アルキレンジオキシ;
(34)N−ヒドロキシカルバモイル;
(35)モノまたはジC1−6アルキルホスホリル(例、ジエチルホスホリル);
(36)C6−14アリールスルホニル(例、フェニルスルホニル);
(37)(a) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(b) ヒドロキシ、
(c) C1−6アルコキシ、および
(d) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環−カルボニル(例、テトラヒドロフリルカルボニル、モルホリニルカルボニル、チオモルホリニルカルボニル、ピペリジニルカルボニル、ピロリジニルカルボニル、ピペラジニルカルボニル、ジオキソリルカルボニル、ジオキソラニルカルボニル、1,3−ジヒドロ−2−ベンゾフラニルカルボニル、チアゾリジニルカルボニル);
等が挙げられる。置換基が2個以上である場合、各置換基は同一でも異なっていてもよい。
また、前記「炭化水素基」として例示した、C3−10シクロアルキル、C3−10シクロアルケニル、C4−10シクロアルカジエニル、C6−14アリール、C7−13アラルキル、C8−13アリールアルケニルおよびC3−10シクロアルキル−C1−6アルキルは、置換可能な位置に1ないし3個の置換基を有していてもよい。
このような置換基としては、例えば、
(1)前記したC1−10アルキル等が有していてもよい置換基として例示した基;
(2)(a) ハロゲン原子、
(b) カルボキシル、
(c) 非芳香族複素環基(例、ピペリジノ、テトラヒドロピラニル)で置換されていてもよいヒドロキシ、
(d) C1−6アルキルでモノまたはジ置換されていてもよいアミノ、
(e) C6−14アリール(例、フェニル)、
(f) C1−6アルコキシ−カルボニル、
(g) C1−6アルキル−カルボニルオキシ(例、アセチルオキシ、tert−ブチルカルボニルオキシ)、
(h) カルバモイル、
(i) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル(例、ヒドロキシメチル)で1ないし3個置換されていてもよい芳香族複素環基(例、チエニル、フリル、ピリジル、オキサゾリル、チアゾリル、テトラゾリル、オキサジアゾリル、ピラジニル、キノリル、インドリル、イミダゾリル、ピラゾリル、チアジアゾリル、イソキサゾリル)、および
(j) 非芳香族複素環基(例、ピペリジノ、テトラヒドロピラニル)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル;
(3)(a) ハロゲン原子、
(b) カルボキシル、
(c) C1−6アルコキシ−カルボニル、および
(d) カルバモイル
から選ばれる1ないし3個の置換基で置換されていてもよいC2−6アルケニル(例、エテニル、1−プロペニル);
(4)(a) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(b) ヒドロキシ、
(c) C1−6アルコキシ、および
(d) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよいC7−13アラルキル(例、ベンジル);
等が挙げられる。置換基が2個以上である場合、各置換基は同一でも異なっていてもよい。
このような置換基としては、例えば、
(1)前記したC1−10アルキル等が有していてもよい置換基として例示した基;
(2)(a) ハロゲン原子、
(b) カルボキシル、
(c) 非芳香族複素環基(例、ピペリジノ、テトラヒドロピラニル)で置換されていてもよいヒドロキシ、
(d) C1−6アルキルでモノまたはジ置換されていてもよいアミノ、
(e) C6−14アリール(例、フェニル)、
(f) C1−6アルコキシ−カルボニル、
(g) C1−6アルキル−カルボニルオキシ(例、アセチルオキシ、tert−ブチルカルボニルオキシ)、
(h) カルバモイル、
(i) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル(例、ヒドロキシメチル)で1ないし3個置換されていてもよい芳香族複素環基(例、チエニル、フリル、ピリジル、オキサゾリル、チアゾリル、テトラゾリル、オキサジアゾリル、ピラジニル、キノリル、インドリル、イミダゾリル、ピラゾリル、チアジアゾリル、イソキサゾリル)、および
(j) 非芳香族複素環基(例、ピペリジノ、テトラヒドロピラニル)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル;
(3)(a) ハロゲン原子、
(b) カルボキシル、
(c) C1−6アルコキシ−カルボニル、および
(d) カルバモイル
から選ばれる1ないし3個の置換基で置換されていてもよいC2−6アルケニル(例、エテニル、1−プロペニル);
(4)(a) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(b) ヒドロキシ、
(c) C1−6アルコキシ、および
(d) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよいC7−13アラルキル(例、ベンジル);
等が挙げられる。置換基が2個以上である場合、各置換基は同一でも異なっていてもよい。
前記「置換されていてもよい複素環基」における「複素環基」としては、芳香族複素環基および非芳香族複素環基が挙げられる。
ここで、芳香族複素環基としては、例えば、環構成原子として炭素原子以外に酸素原子、硫黄原子および窒素原子から選ばれるヘテロ原子を1ないし4個含有する4〜7員(好ましくは5または6員)の単環式芳香族複素環基および縮合芳香族複素環基が挙げられる。該縮合芳香族複素環基としては、例えば、これら4〜7員の単環式芳香族複素環基と、1ないし2個の窒素原子を含む5または6員の芳香族複素環(例、ピロール、イミダゾール、ピラゾール、ピラジン、ピリジン、ピリミジン)、1個の硫黄原子を含む5員の芳香族複素環(例、チオフェン)、あるいはベンゼン環等とが1ないし2個縮合した基等が挙げられる。
芳香族複素環基の好適な例としては、
フリル(例、2−フリル、3−フリル)、チエニル(例、2−チエニル、3−チエニル)、ピリジル(例、2−ピリジル、3−ピリジル、4−ピリジル)、ピリミジニル(例、2−ピリミジニル、4−ピリミジニル、5−ピリミジニル)、ピリダジニル(例、3−ピリダジニル、4−ピリダジニル)、ピラジニル(例、2−ピラジニル)、ピロリル(例、1−ピロリル、2−ピロリル、3−ピロリル)、イミダゾリル(例、1−イミダゾリル、2−イミダゾリル、4−イミダゾリル、5−イミダゾリル)、ピラゾリル(例、1−ピラゾリル、3−ピラゾリル、4−ピラゾリル)、チアゾリル(例、2−チアゾリル、4−チアゾリル、5−チアゾリル)、イソチアゾリル(例、3−イソチアゾリル、4−イソチアゾリル、5−イソチアゾリル)、オキサゾリル(例、2−オキサゾリル、4−オキサゾリル、5−オキサゾリル)、イソオキサゾリル(例、3−イソオキサゾリル、4−イソオキサゾリル、5−イソオキサゾリル)、オキサジアゾリル(例、1,2,4−オキサジアゾール−5−イル、1,3,4−オキサジアゾール−2−イル)、チアジアゾリル(例、1,3,4−チアジアゾール−2−イル)、トリアゾリル(例、1,2,4−トリアゾール−1−イル、1,2,4−トリアゾール−3−イル、1,2,3−トリアゾール−1−イル、1,2,3−トリアゾール−2−イル、1,2,3−トリアゾール−4−イル)、テトラゾリル(例、テトラゾール−1−イル、テトラゾール−5−イル)、トリアジニル(例、1,2,4−トリアジン−5−イル、1,2,4−トリアジン−3−イル、1,2,4−トリアジン−6−イル)等の単環式芳香族複素環基;
キノリル(例、2−キノリル、3−キノリル、4−キノリル、6−キノリル)、イソキノリル(例、3−イソキノリル)、キナゾリル(例、2−キナゾリル、4−キナゾリル)、キノキサリル(例、2−キノキサリル、6−キノキサリル)、ベンゾフラニル(例、2−ベンゾフラニル、3−ベンゾフラニル、4−ベンゾフラニル、5−ベンゾフラニル、6−ベンゾフラニル、7−ベンゾフラニル)、ベンゾチエニル(例、2−ベンゾチエニル、3−ベンゾチエニル)、ベンズオキサゾリル(例、2−ベンズオキサゾリル)、ベンズイソオキサゾリル(例、7−ベンズイソオキサゾリル)、ベンゾチアゾリル(例、2−ベンゾチアゾリル)、ベンズイミダゾリル(例、ベンズイミダゾール−1−イル、ベンズイミダゾール−2−イル、ベンズイミダゾール−5−イル)、ベンゾトリアゾリル(例、1H−1,2,3−ベンゾトリアゾール−5−イル)、インドリル(例、インドール−1−イル、インドール−2−イル、インドール−3−イル、インドール−5−イル)、インダゾリル(例、1H−インダゾール−3−イル)、ピロロピラジニル(例、1H−ピロロ[2,3−b]ピラジン−2−イル、1H−ピロロ[2,3−b]ピラジン−6−イル)、イミダゾピリジニル(例、1H−イミダゾ[4,5−b]ピリジン−2−イル、1H−イミダゾ[4,5−c]ピリジン−2−イル、2H−イミダゾ[1,2−a]ピリジン−3−イル)、イミダゾピラジニル(例、1H−イミダゾ[4,5−b]ピラジン−2−イル)、ピラゾロピリジニル(例、1H−ピラゾロ[4,3−c]ピリジン−3−イル)、ピラゾロチエニル(例、2H−ピラゾロ[3,4−b]チオフェン−2−イル)、ピラゾロトリアジニル(例、ピラゾロ[5,1−c][1,2,4]トリアジン−3−イル)等の縮合芳香族複素環基;
等が挙げられる。
ここで、芳香族複素環基としては、例えば、環構成原子として炭素原子以外に酸素原子、硫黄原子および窒素原子から選ばれるヘテロ原子を1ないし4個含有する4〜7員(好ましくは5または6員)の単環式芳香族複素環基および縮合芳香族複素環基が挙げられる。該縮合芳香族複素環基としては、例えば、これら4〜7員の単環式芳香族複素環基と、1ないし2個の窒素原子を含む5または6員の芳香族複素環(例、ピロール、イミダゾール、ピラゾール、ピラジン、ピリジン、ピリミジン)、1個の硫黄原子を含む5員の芳香族複素環(例、チオフェン)、あるいはベンゼン環等とが1ないし2個縮合した基等が挙げられる。
芳香族複素環基の好適な例としては、
フリル(例、2−フリル、3−フリル)、チエニル(例、2−チエニル、3−チエニル)、ピリジル(例、2−ピリジル、3−ピリジル、4−ピリジル)、ピリミジニル(例、2−ピリミジニル、4−ピリミジニル、5−ピリミジニル)、ピリダジニル(例、3−ピリダジニル、4−ピリダジニル)、ピラジニル(例、2−ピラジニル)、ピロリル(例、1−ピロリル、2−ピロリル、3−ピロリル)、イミダゾリル(例、1−イミダゾリル、2−イミダゾリル、4−イミダゾリル、5−イミダゾリル)、ピラゾリル(例、1−ピラゾリル、3−ピラゾリル、4−ピラゾリル)、チアゾリル(例、2−チアゾリル、4−チアゾリル、5−チアゾリル)、イソチアゾリル(例、3−イソチアゾリル、4−イソチアゾリル、5−イソチアゾリル)、オキサゾリル(例、2−オキサゾリル、4−オキサゾリル、5−オキサゾリル)、イソオキサゾリル(例、3−イソオキサゾリル、4−イソオキサゾリル、5−イソオキサゾリル)、オキサジアゾリル(例、1,2,4−オキサジアゾール−5−イル、1,3,4−オキサジアゾール−2−イル)、チアジアゾリル(例、1,3,4−チアジアゾール−2−イル)、トリアゾリル(例、1,2,4−トリアゾール−1−イル、1,2,4−トリアゾール−3−イル、1,2,3−トリアゾール−1−イル、1,2,3−トリアゾール−2−イル、1,2,3−トリアゾール−4−イル)、テトラゾリル(例、テトラゾール−1−イル、テトラゾール−5−イル)、トリアジニル(例、1,2,4−トリアジン−5−イル、1,2,4−トリアジン−3−イル、1,2,4−トリアジン−6−イル)等の単環式芳香族複素環基;
キノリル(例、2−キノリル、3−キノリル、4−キノリル、6−キノリル)、イソキノリル(例、3−イソキノリル)、キナゾリル(例、2−キナゾリル、4−キナゾリル)、キノキサリル(例、2−キノキサリル、6−キノキサリル)、ベンゾフラニル(例、2−ベンゾフラニル、3−ベンゾフラニル、4−ベンゾフラニル、5−ベンゾフラニル、6−ベンゾフラニル、7−ベンゾフラニル)、ベンゾチエニル(例、2−ベンゾチエニル、3−ベンゾチエニル)、ベンズオキサゾリル(例、2−ベンズオキサゾリル)、ベンズイソオキサゾリル(例、7−ベンズイソオキサゾリル)、ベンゾチアゾリル(例、2−ベンゾチアゾリル)、ベンズイミダゾリル(例、ベンズイミダゾール−1−イル、ベンズイミダゾール−2−イル、ベンズイミダゾール−5−イル)、ベンゾトリアゾリル(例、1H−1,2,3−ベンゾトリアゾール−5−イル)、インドリル(例、インドール−1−イル、インドール−2−イル、インドール−3−イル、インドール−5−イル)、インダゾリル(例、1H−インダゾール−3−イル)、ピロロピラジニル(例、1H−ピロロ[2,3−b]ピラジン−2−イル、1H−ピロロ[2,3−b]ピラジン−6−イル)、イミダゾピリジニル(例、1H−イミダゾ[4,5−b]ピリジン−2−イル、1H−イミダゾ[4,5−c]ピリジン−2−イル、2H−イミダゾ[1,2−a]ピリジン−3−イル)、イミダゾピラジニル(例、1H−イミダゾ[4,5−b]ピラジン−2−イル)、ピラゾロピリジニル(例、1H−ピラゾロ[4,3−c]ピリジン−3−イル)、ピラゾロチエニル(例、2H−ピラゾロ[3,4−b]チオフェン−2−イル)、ピラゾロトリアジニル(例、ピラゾロ[5,1−c][1,2,4]トリアジン−3−イル)等の縮合芳香族複素環基;
等が挙げられる。
非芳香族複素環基としては、例えば、環構成原子として炭素原子以外に酸素原子、硫黄原子および窒素原子から選ばれるヘテロ原子を1ないし4個含有する4〜7員(好ましくは5または6員)の単環式非芳香族複素環基および縮合非芳香族複素環基が挙げられる。該縮合非芳香族複素環基としては、例えば、これら4〜7員の単環式非芳香族複素環基と、1ないし2個の窒素原子を含む5または6員の芳香族または非芳香族複素環(例、ピロール、イミダゾール、ピラゾール、ピラジン、ピリジン、ピリミジン)、1個の硫黄原子を含む5員の芳香族または非芳香族複素環(例、チオフェン)、あるいはベンゼン環等とが1ないし2個縮合した基等が挙げられる。
非芳香族複素環基の好適な例としては、
ピロリジニル(例、1−ピロリジニル、2−ピロリジニル)、ピペリジニル(例、ピペリジノ、2−ピペリジニル、3−ピペリジニル、4−ピペリジニル)、ホモピペリジニル(例、ホモピペリジノ、2−ホモピペリジニル、3−ホモピペリジニル、4−ホモピペリジニル)、テトラヒドロピリジル(例、1,2,3,6−テトラヒドロピリジン−1−イル)、モルホリニル(例、モルホリノ)、チオモルホリニル(例、チオモルホリノ)、ピペラジニル(例、1−ピペラジニル、2−ピペラジニル、3−ピペラジニル)、ヘキサメチレンイミニル(例、ヘキサメチレンイミン−1−イル)、オキサゾリジニル(例、オキサゾリジン−2−イル)、チアゾリジニル(例、チアゾリジン−2−イル)、イミダゾリジニル(例、イミダゾリジン−2−イル、イミダゾリジン−3−イル)、オキサゾリニル(例、オキサゾリン−2−イル)、チアゾリニル(例、チアゾリン−2−イル)、イミダゾリニル(例、イミダゾリン−2−イル、イミダゾリン−3−イル)、ジオキソリル(例、1,3−ジオキソール−4−イル)、ジオキソラニル(例、1,3−ジオキソラン−4−イル)、ジヒドロオキサジアゾリル(例、4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)、2−チオキソ−1,3−オキサゾリジン−5−イル、ピラニル(例、4−ピラニル)、テトラヒドロピラニル(例、2−テトラヒドロピラニル、3−テトラヒドロピラニル、4−テトラヒドロピラニル)、チオピラニル(例、4−チオピラニル)、テトラヒドロチオピラニル(例、2−テトラヒドロチオピラニル、3−テトラヒドロチオピラニル、4−テトラヒドロチオピラニル)、1−オキシドテトラヒドロチオピラニル(例、1−オキシドテトラヒドロチオピラン−4−イル)、1,1−ジオキシドテトラヒドロチオピラニル(例、1,1−ジオキシドテトラヒドロチオピラン−4−イル)、テトラヒドロフリル(例、テトラヒドロフラン−3−イル、テトラヒドロフラン−2−イル)、ピラゾリジニル(例、ピラゾリジン−1−イル、ピラゾリジン−3−イル)、ピラゾリニル(例、ピラゾリン−1−イル)、テトラヒドロピリミジニル(例、テトラヒドロピリミジン−1−イル)、ジヒドロトリアゾリル(例、2,3−ジヒドロ−1H−1,2,3−トリアゾール−1−イル)、テトラヒドロトリアゾリル(例、2,3,4,5−テトラヒドロ−1H−1,2,3−トリアゾール−1−イル)、オキソジヒドロオキサジアゾリル(例、5−オキソ−4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)等の単環式非芳香族複素環基;
ジヒドロインドリル(例、2,3−ジヒドロ−1H−インドール−1−イル)、ジヒドロイソインドリル(例、1,3−ジヒドロ−2H−イソインドール−2−イル)、ジヒドロベンゾフラニル(例、2,3−ジヒドロ−1−ベンゾフラン−5−イル)、ジヒドロベンゾジオキシニル(例、2,3−ジヒドロ−1,4−ベンゾジオキシニル)、ジヒドロベンゾジオキセピニル(例、3,4−ジヒドロ−2H−1,5−ベンゾジオキセピニル)、テトラヒドロベンゾフラニル(例、4,5,6,7−テトラヒドロ−1−ベンゾフラン−3−イル)、クロメニル(例、4H−クロメン−2−イル、2H−クロメン−3−イル、2H−クロメン−7−イル)、ジヒドロキノリニル(例、1,2−ジヒドロキノリン−4−イル)、テトラヒドロキノリニル(例、1,2,3,4−テトラヒドロキノリン−4−イル)、ジヒドロイソキノリニル(例、1,2−ジヒドロイソキノリン−4−イル)、テトラヒドロイソキノリニル(例、1,2,3,4−テトラヒドロイソキノリン−4−イル、1,2,3,4−テトラヒドロイソキノリン−2−イル)、ジヒドロフタラジニル(例、1,4−ジヒドロフタラジン−4−イル)、テトラヒドロベンゾアゼピニル(例、2,3,4,5−テトラヒドロ−1H−ベンゾ[c]アゼピン−1−イル)等の縮合非芳香族複素環基;
等が挙げられる。
非芳香族複素環基の好適な例としては、
ピロリジニル(例、1−ピロリジニル、2−ピロリジニル)、ピペリジニル(例、ピペリジノ、2−ピペリジニル、3−ピペリジニル、4−ピペリジニル)、ホモピペリジニル(例、ホモピペリジノ、2−ホモピペリジニル、3−ホモピペリジニル、4−ホモピペリジニル)、テトラヒドロピリジル(例、1,2,3,6−テトラヒドロピリジン−1−イル)、モルホリニル(例、モルホリノ)、チオモルホリニル(例、チオモルホリノ)、ピペラジニル(例、1−ピペラジニル、2−ピペラジニル、3−ピペラジニル)、ヘキサメチレンイミニル(例、ヘキサメチレンイミン−1−イル)、オキサゾリジニル(例、オキサゾリジン−2−イル)、チアゾリジニル(例、チアゾリジン−2−イル)、イミダゾリジニル(例、イミダゾリジン−2−イル、イミダゾリジン−3−イル)、オキサゾリニル(例、オキサゾリン−2−イル)、チアゾリニル(例、チアゾリン−2−イル)、イミダゾリニル(例、イミダゾリン−2−イル、イミダゾリン−3−イル)、ジオキソリル(例、1,3−ジオキソール−4−イル)、ジオキソラニル(例、1,3−ジオキソラン−4−イル)、ジヒドロオキサジアゾリル(例、4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)、2−チオキソ−1,3−オキサゾリジン−5−イル、ピラニル(例、4−ピラニル)、テトラヒドロピラニル(例、2−テトラヒドロピラニル、3−テトラヒドロピラニル、4−テトラヒドロピラニル)、チオピラニル(例、4−チオピラニル)、テトラヒドロチオピラニル(例、2−テトラヒドロチオピラニル、3−テトラヒドロチオピラニル、4−テトラヒドロチオピラニル)、1−オキシドテトラヒドロチオピラニル(例、1−オキシドテトラヒドロチオピラン−4−イル)、1,1−ジオキシドテトラヒドロチオピラニル(例、1,1−ジオキシドテトラヒドロチオピラン−4−イル)、テトラヒドロフリル(例、テトラヒドロフラン−3−イル、テトラヒドロフラン−2−イル)、ピラゾリジニル(例、ピラゾリジン−1−イル、ピラゾリジン−3−イル)、ピラゾリニル(例、ピラゾリン−1−イル)、テトラヒドロピリミジニル(例、テトラヒドロピリミジン−1−イル)、ジヒドロトリアゾリル(例、2,3−ジヒドロ−1H−1,2,3−トリアゾール−1−イル)、テトラヒドロトリアゾリル(例、2,3,4,5−テトラヒドロ−1H−1,2,3−トリアゾール−1−イル)、オキソジヒドロオキサジアゾリル(例、5−オキソ−4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)等の単環式非芳香族複素環基;
ジヒドロインドリル(例、2,3−ジヒドロ−1H−インドール−1−イル)、ジヒドロイソインドリル(例、1,3−ジヒドロ−2H−イソインドール−2−イル)、ジヒドロベンゾフラニル(例、2,3−ジヒドロ−1−ベンゾフラン−5−イル)、ジヒドロベンゾジオキシニル(例、2,3−ジヒドロ−1,4−ベンゾジオキシニル)、ジヒドロベンゾジオキセピニル(例、3,4−ジヒドロ−2H−1,5−ベンゾジオキセピニル)、テトラヒドロベンゾフラニル(例、4,5,6,7−テトラヒドロ−1−ベンゾフラン−3−イル)、クロメニル(例、4H−クロメン−2−イル、2H−クロメン−3−イル、2H−クロメン−7−イル)、ジヒドロキノリニル(例、1,2−ジヒドロキノリン−4−イル)、テトラヒドロキノリニル(例、1,2,3,4−テトラヒドロキノリン−4−イル)、ジヒドロイソキノリニル(例、1,2−ジヒドロイソキノリン−4−イル)、テトラヒドロイソキノリニル(例、1,2,3,4−テトラヒドロイソキノリン−4−イル、1,2,3,4−テトラヒドロイソキノリン−2−イル)、ジヒドロフタラジニル(例、1,4−ジヒドロフタラジン−4−イル)、テトラヒドロベンゾアゼピニル(例、2,3,4,5−テトラヒドロ−1H−ベンゾ[c]アゼピン−1−イル)等の縮合非芳香族複素環基;
等が挙げられる。
前記「置換されていてもよい複素環基」における「複素環基」は、置換可能な位置に1ないし3個の置換基を有していてもよい。このような置換基としては、例えば、前記「置換されていてもよい炭化水素基」の「炭化水素基」として例示したC3−10シクロアルキル等が有していてもよい置換基として例示したものが挙げられる。置換基が2個以上である場合、各置換基は同一でも異なっていてもよい。
前記「置換されていてもよいヒドロキシ」としては、例えば、それぞれ置換されていてもよい、C1−10アルキル、C2−10アルケニル、C3−10シクロアルキル、C3−10シクロアルケニル、C6−14アリール、C7−13アラルキル、C8−13アリールアルケニル、C1−6アルキル−カルボニル、複素環基等から選ばれる置換基で置換されていてもよいヒドロキシが挙げられる。
さらに、前記「置換されていてもよいヒドロキシ」としては、オキソで置換されていてもよいC3−10シクロアルカンと縮合したC6−14アリール(例、5−オキソテトラヒドロベンゾアヌレン−2−イル)で置換されたヒドロキシを含む。
ここで、「それぞれ置換されていてもよい、C1−10アルキル、C2−10アルケニル、C3−10シクロアルキル、C3−10シクロアルケニル、C6−14アリール、C7−13アラルキルおよびC8−13アリールアルケニル」としては、それぞれ前記「置換されていてもよい炭化水素基」として例示したものが挙げられる。
ここで、「それぞれ置換されていてもよい、C1−10アルキル、C2−10アルケニル、C3−10シクロアルキル、C3−10シクロアルケニル、C6−14アリール、C7−13アラルキルおよびC8−13アリールアルケニル」としては、それぞれ前記「置換されていてもよい炭化水素基」として例示したものが挙げられる。
前記「置換されていてもよいヒドロキシ」の置換基としても「置換されていてもよい複素環基」としては、R1などで示される「置換基」としての「置換されていてもよい複素環基」として例示したものが挙げられる。
前記「置換されていてもよいメルカプト」としては、例えば、それぞれ置換されていてもよい、C1−10アルキル、C2−10アルケニル、C3−10シクロアルキル、C3−10シクロアルケニル、C6−14アリール、C7−13アラルキル、C8−13アリールアルケニル、C1−6アルキル−カルボニル、複素環基等から選ばれる置換基で置換されていてもよいメルカプトが挙げられる。
ここで、「それぞれ置換されていてもよい、C1−10アルキル、C2−10アルケニル、C3−10シクロアルキル、C3−10シクロアルケニル、C6−14アリール、C7−13アラルキルおよびC8−13アリールアルケニル」としては、それぞれ前記「置換されていてもよい炭化水素基」として例示したものが挙げられる。
ここで、「それぞれ置換されていてもよい、C1−10アルキル、C2−10アルケニル、C3−10シクロアルキル、C3−10シクロアルケニル、C6−14アリール、C7−13アラルキルおよびC8−13アリールアルケニル」としては、それぞれ前記「置換されていてもよい炭化水素基」として例示したものが挙げられる。
前記「置換されていてもよいメルカプト」の置換基としても「置換されていてもよい複素環基」としては、R1などで示される「置換基」としての「置換されていてもよい複素環基」として例示したものが挙げられる。
前記「置換されていてもよいアミノ」としては、例えば、それぞれ置換されていてもよい、C1−10アルキル、C2−10アルケニル、C3−10シクロアルキル、C3−10シクロアルケニル、C6−14アリール、C7−13アラルキル、C8−13アリールアルケニルおよび複素環基;ならびにアシル等から選ばれる1または2個の置換基で置換されていてもよいアミノが挙げられる。
ここで、「それぞれ置換されていてもよいC1−10アルキル、C2−10アルケニル、C3−10シクロアルキル、C3−10シクロアルケニル、C6−14アリール、C7−13アラルキル、C8−13アリールアルケニル」としては、それぞれ前記「置換されていてもよい炭化水素基」として例示したものが挙げられる。
前記「置換されていてもよいアミノ」の置換基としても「置換されていてもよい複素環基」としては、R1などで示される「置換基」としての「置換されていてもよい複素環基」が挙げられ、なかでも、置換されていてもよい5または6員の非芳香族複素環基(例、ピロリジン、ピペリジン)が好ましい。
ここで、「それぞれ置換されていてもよいC1−10アルキル、C2−10アルケニル、C3−10シクロアルキル、C3−10シクロアルケニル、C6−14アリール、C7−13アラルキル、C8−13アリールアルケニル」としては、それぞれ前記「置換されていてもよい炭化水素基」として例示したものが挙げられる。
前記「置換されていてもよいアミノ」の置換基としても「置換されていてもよい複素環基」としては、R1などで示される「置換基」としての「置換されていてもよい複素環基」が挙げられ、なかでも、置換されていてもよい5または6員の非芳香族複素環基(例、ピロリジン、ピペリジン)が好ましい。
「置換されていてもよいアミノ」の置換基およびR1、R2、R3、R4、R5、R6およびZで示される「置換基」として例示した「アシル」としては、例えば、式:−CORa、−CO−ORa、−SO2Ra、−SORa、−CO−NRa’Rb’、−SO2−NRa’Rb’ 、−SO2−NRa’(CORb’)、−CS−NRa’Rb’[式中、Raは、水素原子、置換されていてもよい炭化水素基または置換されていてもよい複素環基を示す。Ra’は、水素原子、ヒドロキシ、置換されていてもよい炭化水素基または置換されていてもよい複素環基を示す。Rb’は、水素原子、置換されていてもよい炭化水素基または置換されていてもよい複素環基を示す。あるいはRa’およびRb’は、隣接する窒素原子と共に置換されていてもよい含窒素複素環を形成する]で表される基等が挙げられる。
Ra、Ra’またはRb’で示される「置換されていてもよい炭化水素基」および「置換されていてもよい複素環基」としては、それぞれR1などで示される「置換基」として例示した「置換されていてもよい炭化水素基」および「置換されていてもよい複素環基」と同様のものが挙げられる。
Ra、Ra’またはRb’で示される「置換されていてもよい炭化水素基」および「置換されていてもよい複素環基」としては、それぞれR1などで示される「置換基」として例示した「置換されていてもよい炭化水素基」および「置換されていてもよい複素環基」と同様のものが挙げられる。
Ra’およびRb’が隣接する窒素原子と共に形成する「置換されていてもよい含窒素複素環」における「含窒素複素環」としては、例えば、環構成原子として炭素原子以外に少なくとも1個の窒素原子を含み、さらに酸素原子、硫黄原子および窒素原子から選ばれるヘテロ原子を1ないし2個含有していてもよい5〜7員の含窒素複素環が挙げられる。該含窒素複素環の好適な例としては、ピロリジン、イミダゾリジン、ピラゾリジン、ピペリジン、ピペラジン、モルホリン、チオモルホリン、オキソピペラジン等が挙げられる。
該含窒素複素環は、置換可能な位置に1ないし3個(好ましくは1または2個)の置換基を有していてもよい。このような置換基としては、前記「置換されていてもよい炭化水素基」の「炭化水素基」として例示したC3−10シクロアルキル基等が有していてもよい置換基として例示したものが挙げられる。置換基が2個以上である場合、各置換基は同一でも異なっていてもよい。
該含窒素複素環は、置換可能な位置に1ないし3個(好ましくは1または2個)の置換基を有していてもよい。このような置換基としては、前記「置換されていてもよい炭化水素基」の「炭化水素基」として例示したC3−10シクロアルキル基等が有していてもよい置換基として例示したものが挙げられる。置換基が2個以上である場合、各置換基は同一でも異なっていてもよい。
「アシル」の好適な例としては、
(1) ホルミル;
(2) カルボキシル;
(3) ヒドロキシおよび芳香族複素環基から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル−カルボニル;
(4) (a) カルボキシル、
(b) カルバモイル、
(c) チオカルバモイル、
(d) C1−6アルコキシ−カルボニル、および
(e) C1−6アルキル−カルボニルオキシ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルコキシ−カルボニル;
(5) C3−10シクロアルキル−カルボニル(例、シクロプロピルカルボニル、シクロペンチルカルボニル、シクロヘキシルカルボニル);
(6) (a) ハロゲン原子、
(b) シアノ、
(c) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(d) C1−6アルコキシ、
(e) カルボキシル、
(f) C1−6アルコキシ−カルボニル、および
(g) カルバモイル
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール−カルボニル(例、ベンゾイル、1−ナフトイル、2−ナフトイル);
(7) (a) カルボキシル、
(b) C1−6アルコキシ−カルボニル、および
(c) カルバモイル
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリールオキシ−カルボニル(例、フェニルオキシカルボニル、ナフチルオキシカルボニル);
(8) (a) カルボキシル、
(b) カルバモイル、
(c) チオカルバモイル、
(d) C1−6アルコキシ−カルボニル、
(e) ハロゲン原子、
(f) シアノ、
(g) ニトロ、
(h) C1−6アルコキシ、
(i) C1−6アルキル−スルホニル、および
(j) C1−6アルキル
から選ばれる1ないし3個の置換基で置換されていてもよいC7−13アラルキルオキシ−カルボニル(例、ベンジルオキシカルボニル、フェネチルオキシカルボニル、カルボキシベンジルオキシカルボニル、メトキシカルボニルベンジルオキシカルボニル、ビフェニリルメトキシカルボニル);
(9) シアノ、ヒドロキシ、芳香族複素環基(例、チエニル、フリル、ピリジル、オキサゾリル、チアゾリル、テトラゾリル、オキサジアゾリル、ピラジニル、キノリル、インドリル、ピリミジニル、イミダゾリル、ピラゾリル、チアジアゾリル、イソキサゾリル)、ハロゲン原子、およびC1−6アルコキシから選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキルでモノまたはジ置換されていてもよいカルバモイル(例、メチルカルバモイル、エチルカルバモイル、ジメチルカルバモイル、ジエチルカルバモイル、エチルメチルカルバモイル、プロピルカルバモイル、イソプロピルカルバモイル、ブチルカルバモイル、イソブチルカルバモイル、トリフルオロエチルカルバモイル、N−メトキシエチル−N−メチルカルバモイル);
(10) (a) カルボキシル、
(b) カルバモイル、および
(c) C1−6アルコキシ−カルボニル
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキルスルホニル(例、メチルスルホニル、カルボキシメチルスルホニル);
(11)C1−6アルキルスルフィニル(例、メチルスルフィニル);
(12)チオカルバモイル;
(13)C7−13アラルキル−カルボニル(例、ベンジルカルボニル、フェネチルカルボニル);
(14) (a) C1−6アルキル、
(b) C6−14アリール、
(c) C7−13アラルキル、
(d) C1−6アルコキシ、
(e) カルボキシル、
(f) C1−6アルコキシ−カルボニル、および
(g) カルバモイル
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環−カルボニル(例、フリルカルボニル、チエニルカルボニル、チアゾリルカルボニル、ピラゾリルカルボニル、ピリジルカルボニル、ピラジニルカルボニル、ベンゾフラニルカルボニル、ベンゾチエニルカルボニル、キノキサリニルカルボニル、チアジアゾリルカルボニル、イソキサゾリルカルボニル);
(15)(a) ハロゲン原子およびC1−6アルコキシから選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、および
(b) C1−6アルキル−カルボニル
から選ばれる置換基でモノまたはジ置換されていてもよいスルファモイル(例、メチルスルファモイル、エチルスルファモイル、ジメチルスルファモイル、ジエチルスルファモイル、エチルメチルスルファモイル、プロピルスルファモイル、イソプロピルスルファモイル、ブチルスルファモイル、イソブチルスルファモイル、トリフルオロエチルスルファモイル、N−メトキシエチル−N−メチルスルファモイル、アセチルスルファモイル);
(16)N−ヒドロキシカルバモイル;
(17)(a) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(b) ヒドロキシ、
(c) C1−6アルコキシ、および
(d) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環−カルボニル(例、テトラヒドロフリルカルボニル、モルホリニルカルボニル、チオモルホリニルカルボニル、ピペリジニルカルボニル、ピロリジニルカルボニル、ピペラジニルカルボニル、ジオキソリルカルボニル、ジオキソラニルカルボニル、1,3−ジヒドロ−2−ベンゾフラニルカルボニル、チアゾリジニルカルボニル);
等が挙げられる。
(1) ホルミル;
(2) カルボキシル;
(3) ヒドロキシおよび芳香族複素環基から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル−カルボニル;
(4) (a) カルボキシル、
(b) カルバモイル、
(c) チオカルバモイル、
(d) C1−6アルコキシ−カルボニル、および
(e) C1−6アルキル−カルボニルオキシ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルコキシ−カルボニル;
(5) C3−10シクロアルキル−カルボニル(例、シクロプロピルカルボニル、シクロペンチルカルボニル、シクロヘキシルカルボニル);
(6) (a) ハロゲン原子、
(b) シアノ、
(c) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(d) C1−6アルコキシ、
(e) カルボキシル、
(f) C1−6アルコキシ−カルボニル、および
(g) カルバモイル
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール−カルボニル(例、ベンゾイル、1−ナフトイル、2−ナフトイル);
(7) (a) カルボキシル、
(b) C1−6アルコキシ−カルボニル、および
(c) カルバモイル
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリールオキシ−カルボニル(例、フェニルオキシカルボニル、ナフチルオキシカルボニル);
(8) (a) カルボキシル、
(b) カルバモイル、
(c) チオカルバモイル、
(d) C1−6アルコキシ−カルボニル、
(e) ハロゲン原子、
(f) シアノ、
(g) ニトロ、
(h) C1−6アルコキシ、
(i) C1−6アルキル−スルホニル、および
(j) C1−6アルキル
から選ばれる1ないし3個の置換基で置換されていてもよいC7−13アラルキルオキシ−カルボニル(例、ベンジルオキシカルボニル、フェネチルオキシカルボニル、カルボキシベンジルオキシカルボニル、メトキシカルボニルベンジルオキシカルボニル、ビフェニリルメトキシカルボニル);
(9) シアノ、ヒドロキシ、芳香族複素環基(例、チエニル、フリル、ピリジル、オキサゾリル、チアゾリル、テトラゾリル、オキサジアゾリル、ピラジニル、キノリル、インドリル、ピリミジニル、イミダゾリル、ピラゾリル、チアジアゾリル、イソキサゾリル)、ハロゲン原子、およびC1−6アルコキシから選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキルでモノまたはジ置換されていてもよいカルバモイル(例、メチルカルバモイル、エチルカルバモイル、ジメチルカルバモイル、ジエチルカルバモイル、エチルメチルカルバモイル、プロピルカルバモイル、イソプロピルカルバモイル、ブチルカルバモイル、イソブチルカルバモイル、トリフルオロエチルカルバモイル、N−メトキシエチル−N−メチルカルバモイル);
(10) (a) カルボキシル、
(b) カルバモイル、および
(c) C1−6アルコキシ−カルボニル
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキルスルホニル(例、メチルスルホニル、カルボキシメチルスルホニル);
(11)C1−6アルキルスルフィニル(例、メチルスルフィニル);
(12)チオカルバモイル;
(13)C7−13アラルキル−カルボニル(例、ベンジルカルボニル、フェネチルカルボニル);
(14) (a) C1−6アルキル、
(b) C6−14アリール、
(c) C7−13アラルキル、
(d) C1−6アルコキシ、
(e) カルボキシル、
(f) C1−6アルコキシ−カルボニル、および
(g) カルバモイル
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環−カルボニル(例、フリルカルボニル、チエニルカルボニル、チアゾリルカルボニル、ピラゾリルカルボニル、ピリジルカルボニル、ピラジニルカルボニル、ベンゾフラニルカルボニル、ベンゾチエニルカルボニル、キノキサリニルカルボニル、チアジアゾリルカルボニル、イソキサゾリルカルボニル);
(15)(a) ハロゲン原子およびC1−6アルコキシから選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、および
(b) C1−6アルキル−カルボニル
から選ばれる置換基でモノまたはジ置換されていてもよいスルファモイル(例、メチルスルファモイル、エチルスルファモイル、ジメチルスルファモイル、ジエチルスルファモイル、エチルメチルスルファモイル、プロピルスルファモイル、イソプロピルスルファモイル、ブチルスルファモイル、イソブチルスルファモイル、トリフルオロエチルスルファモイル、N−メトキシエチル−N−メチルスルファモイル、アセチルスルファモイル);
(16)N−ヒドロキシカルバモイル;
(17)(a) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(b) ヒドロキシ、
(c) C1−6アルコキシ、および
(d) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環−カルボニル(例、テトラヒドロフリルカルボニル、モルホリニルカルボニル、チオモルホリニルカルボニル、ピペリジニルカルボニル、ピロリジニルカルボニル、ピペラジニルカルボニル、ジオキソリルカルボニル、ジオキソラニルカルボニル、1,3−ジヒドロ−2−ベンゾフラニルカルボニル、チアゾリジニルカルボニル);
等が挙げられる。
R1は、好ましくは、水素原子、置換されていてもよいC1−10アルキル(好ましくは、置換されていてもよいC1−6アルキル)、置換されていてもよいC3−10シクロアルキル、置換されていてもよい芳香族複素環基、置換されていてもよいヒドロキシ、置換されていてもよいアミノ、シアノ、カルボキシル、置換されていてもよいC1−6アルコキシ−カルボニル、置換されていてもよいC1−6アルキル−スルホニル、置換されていてもよいスルファモイル、ハロゲン原子などである。
R1は、さらに好ましくは、
(1) 水素原子、
(2) (a) 芳香族複素環基(例、テトラゾリル、オキサジアゾリル)、
(b) (i)C1−6アルキル(例、プロピル)、
(ii) ヒドロキシおよび芳香族複素環基(例、イミダゾリル)から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル−カルボニル(例、アセチル、プロピオニル)、
(iii) C6−14アリール−カルボニル(例、ベンゾイル)、
(iv) C1−6アルキル−スルホニル(例、メチルスルホニル)、および
(v) 芳香族複素環−カルボニル(例、イミダゾリルカルボニル)、
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(c) シアノ、
(d) カルボキシル、
(e) C1−6アルコキシ−カルボニル(例、メトキシカルボニル、エトキシカルボニル)、
(f) N−ヒドロキシカルバモイル、
(g) (i)シアノ、(ii)ヒドロキシ、および(iii)芳香族複素環基(例、テトラゾリル)および(iv)C1−6アルキルを1ないし3個有していてもよい非芳香族複素環基(例、ジオキソリル)から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル、プロピル)でモノまたはジ置換されていてもよいカルバモイル、
(h) ハロゲン原子(例、フッ素原子)、
(i) ジC1−6アルキルホスホリル(例、ジエチルホスホリル)、
(j) ヒドロキシ、
(k) 非芳香族複素環基(例、オキソオキサジアゾリニル)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、プロピル、イソプロピル、tert−ブチル、2−メチルブタン−2−イル);
(3) (a) C1−6アルコキシ−カルボニル(例、メトキシカルボニル)、および
(b) カルボキシル
から選ばれる1ないし3個の置換基で置換されていてもよいC3−10シクロアルキル(例、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル);
(4) 芳香族複素環基(例、ピリジル、フリル、イミダゾリル、ピラゾリル);
(5) C1−6アルキル(メチル)で置換されていてもよいヒドロキシ;
(6) (a) C1−6アルキル(例、メチル、エチル)、および
(b) C1−6アルキル−スルホニル(例、メチルスルホニル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(7) シアノ;
(8) カルボキシル;
(9) C1−6アルコキシ−カルボニル(例、メトキシカルボニル);
(10) C1−6アルキル−スルホニル(例、メチルスルホニル);
(11) (a) C1−6アルキル(例、メチル)、および
(b) C1−6アルキル−カルボニル(例、アセチル)
から選ばれる置換基でモノまたはジ置換されていてもよいスルファモイル;
(12) ハロゲン原子(例、塩素原子);
などである。
R1は、さらに好ましくは、
(1) 水素原子、
(2) (a) 芳香族複素環基(例、テトラゾリル、オキサジアゾリル)、
(b) (i)C1−6アルキル(例、プロピル)、
(ii) ヒドロキシおよび芳香族複素環基(例、イミダゾリル)から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル−カルボニル(例、アセチル、プロピオニル)、
(iii) C6−14アリール−カルボニル(例、ベンゾイル)、
(iv) C1−6アルキル−スルホニル(例、メチルスルホニル)、および
(v) 芳香族複素環−カルボニル(例、イミダゾリルカルボニル)、
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(c) シアノ、
(d) カルボキシル、
(e) C1−6アルコキシ−カルボニル(例、メトキシカルボニル、エトキシカルボニル)、
(f) N−ヒドロキシカルバモイル、
(g) (i)シアノ、(ii)ヒドロキシ、および(iii)芳香族複素環基(例、テトラゾリル)および(iv)C1−6アルキルを1ないし3個有していてもよい非芳香族複素環基(例、ジオキソリル)から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル、プロピル)でモノまたはジ置換されていてもよいカルバモイル、
(h) ハロゲン原子(例、フッ素原子)、
(i) ジC1−6アルキルホスホリル(例、ジエチルホスホリル)、
(j) ヒドロキシ、
(k) 非芳香族複素環基(例、オキソオキサジアゾリニル)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、プロピル、イソプロピル、tert−ブチル、2−メチルブタン−2−イル);
(3) (a) C1−6アルコキシ−カルボニル(例、メトキシカルボニル)、および
(b) カルボキシル
から選ばれる1ないし3個の置換基で置換されていてもよいC3−10シクロアルキル(例、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル);
(4) 芳香族複素環基(例、ピリジル、フリル、イミダゾリル、ピラゾリル);
(5) C1−6アルキル(メチル)で置換されていてもよいヒドロキシ;
(6) (a) C1−6アルキル(例、メチル、エチル)、および
(b) C1−6アルキル−スルホニル(例、メチルスルホニル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(7) シアノ;
(8) カルボキシル;
(9) C1−6アルコキシ−カルボニル(例、メトキシカルボニル);
(10) C1−6アルキル−スルホニル(例、メチルスルホニル);
(11) (a) C1−6アルキル(例、メチル)、および
(b) C1−6アルキル−カルボニル(例、アセチル)
から選ばれる置換基でモノまたはジ置換されていてもよいスルファモイル;
(12) ハロゲン原子(例、塩素原子);
などである。
R2は、好ましくは、水素原子である。
R3は、好ましくは、水素原子、置換されていてもよいC1−10アルキル(好ましくは、置換されていてもよいC1−6アルキル)、またはハロゲン原子であり、より好ましくは、水素原子、C1−6アルキル(例、メチル)、またはハロゲン原子(例、臭素原子)である。
R4は、好ましくは、水素原子である。
R5は、好ましくは、水素原子である。
R3は、好ましくは、水素原子、置換されていてもよいC1−10アルキル(好ましくは、置換されていてもよいC1−6アルキル)、またはハロゲン原子であり、より好ましくは、水素原子、C1−6アルキル(例、メチル)、またはハロゲン原子(例、臭素原子)である。
R4は、好ましくは、水素原子である。
R5は、好ましくは、水素原子である。
R6は、好ましくは、水素原子、置換されていてもよいC1−10アルキル(好ましくは、置換されていてもよいC1−6アルキル)、置換されていてもよいC6−14アリール、置換されていてもよい芳香族複素環基、置換されていてもよい非芳香族複素環基、置換されていてもよいヒドロキシ、置換されていてもよいメルカプト、置換されていてもよいアミノ、シアノ、置換されていてもよいC1−6アルキル−カルボニル、ハロゲン原子などである。
R6は、より好ましくは、
(1) 水素原子;
(2) (a) ヒドロキシ、
(b) C1−6アルキル(例、メチル)でモノまたはジ置換されていてもよいアミノ、および
(c) ハロゲン原子(例、フッ素原子)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル);
(3) (a) 1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルキル(例、メチル)(具体例、トリフルオロメチル)、
(b) 1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルコキシ(例、メトキシ)(具体例、メトキシ、トリフルオロメトキシ)、
(c) C1−6アルコキシ−カルボニル(例、メトキシカルボニル、エトキシカルボニル)、
(d) (i) C1−6アルキル(例、メチル)、および
(ii) C1−6アルキル−カルボニル(例、アセチル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(e) C1−6アルキル−スルホニル(例、メチルスルホニル)、
(f) シアノ、ならびに
(g) C1−3アルキレンジオキシ(例、メチレンジオキシ)
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル);
(4) (a) (i) 非芳香族複素環基(例、テトラヒドロピラニル)で置換されていてもよいヒドロキシ、および
(ii) シアノ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル、イソプロピル、tert-ブチル)、
(b) C6−14アリール(例、フェニル)、
(c) 芳香族複素環基(例、ピリジル)、
(d) C1−6アルコキシ(例、メトキシ)、ならびに
(e) ハロゲン原子(例、フッ素原子、塩素原子、臭素原子)
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、チエニル、フリル、ピロリル、イミダゾリル、ピラゾリル、オキサゾリル、トリアゾリル、ピリジル、ピリダジニル、インドリル);
(5) (a) (i) C6−14アリール(例、フェニル)、
(ii) 芳香族複素環基(例、ピリジル)、および
(iii) C1−6アルキル(例、メチル)で置換されていてもよいヒドロキシ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル)、
(b) C1−6アルコキシ(例、メトキシ)、およびハロゲン原子(例、フッ素原子)から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル)、
(c) 芳香族複素環基(例、ピリジル、ピリミジニル)、
(d) ヒドロキシ、
(e) C1−6アルキル−カルボニル(例、アセチル)でモノまたはジ置換されていてもよいアミノ、
(f) カルボキシル、
(g) C7−13アラルキル(例、ベンジル)でモノまたはジ置換されていてもよいカルバモイル、
(h) C1−6アルキル−スルホニル(例、エチルスルホニル)、ならびに
(i) C6−14アリール−スルホニル(例、ベンゼンスルホニル)
から選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基(例、ピロリジニル、ピペリジニル、ホモピペリジニル、テトラヒドロピリジル、ピペラジニル、モルホリニル、チオモルホリニル、テトラヒドロイソキノリニル、ジヒドロイソインドリル、テトラヒドロベンゾアゼピニル);
(6) (a) (i) (A) ハロゲン原子(例、フッ素原子)、
(B) C1−6アルキル(例、メチル)でモノまたはジ置換されていてもよいアミノ、および
(C) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル(例、メチル)(具体例、ヒドロキシメチル)で1ないし3個置換されていてもよい芳香族複素環基(例、イミダゾリル)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、エチル、プロピル、ブチル)、
(ii) 1ないし3個のC1−6アルキル(例、メチル)で置換されていてもよい芳香族複素環基(例、イミダゾリル、ピラゾリル)、
(iii) 非芳香族複素環基(例、モルホリニル)、
(iv) (A)ハロゲン原子(例、フッ素原子)および(B)カルボキシルから選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルコキシ(例、メトキシ)、
(v) (A) C1−6アルキル(例、メチル、エチル)、
(B) C1−6アルキル−カルボニル(例、アセチル、tert−ブチルカルボニル)、
(C) C3−10シクロアルキル−カルボニル(例、シクロプロピルカルボニル、シクロヘキシルカルボニル)、
(D) (1’)1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルキル(例、メチル)(具体例、トリフルオロメチル)、(2’)ハロゲン原子(例、フッ素原子、塩素原子)、および(3’)1ないし3個のシアノで置換されていてもよいC3−10シクロアルキル(具体例、1−シアノシクロプロピル)から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール−カルボニル(例、ベンゾイル)、ならびに
(E) 1ないし3個のC1−6アルキル(例、メチル)で置換されていてもよい芳香族複素環−カルボニル(例、チエニルカルボニル、フリルカルボニル、ピリジルカルボニル、ピラゾリルカルボニル、チアジアゾリルカルボニル、イソキサゾリルカルボニル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(vi) カルボキシル、ならびに
(vii) C1−6アルキル(例、メチル)およびオキソから選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環−カルボニル(例、ピロリジニルカルボニル)
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル)、
(b) (i) C1−6アルキル(例、メチル)、
(ii) C1−6アルキル−カルボニル(例、アセチル)、および
(iii) カルボキシル
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、ピリジル、ベンゾフラニル)、ならびに
(c) C1−6アルキル(例、メチル)およびオキソから選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基(例、ピロリジニル、ピペリジニル、クロメニル)
から選ばれる置換基で置換されていてもよいヒドロキシ;
(7) (a) (i) 1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルキル(例、メチル)(具体例、メチル、トリフルオロメチル)、
(ii) C6−14アリール(例、フェニル)、および
(iii) 芳香族複素環基(例、ピリジル)
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、ピリジル、イミダゾリル、チアゾリル、チアジアゾリル、トリアゾリル)、
で置換されていてもよいメルカプト;
(8) (a) (i) 芳香族複素環基(例、ピリジル、イミダゾリル)、
(ii) ヒドロキシ、
(iii) C1−6アルコキシ(例、メトキシ)、および
(iv) C1−6アルキル(例、メチル)でモノまたはジ置換されていてもよいアミノ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル、プロピル)、
(b) C3−10シクロアルキル(例、シクロプロピル、シクロペンチル、シクロヘキシル)、
(c) C7−13アラルキル(例、ベンジル)、ならびに
(d) 1ないし3個のC1−6アルキル(例、メチル)で置換されていてもよい非芳香族複素環基(例、ピロリジニル、ピペリジニル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(9) シアノ;
(10) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル−カルボニル(例、アセチル);
(11) ハロゲン原子(例、フッ素原子、塩素原子、臭素原子、ヨウ素原子);
(12) オキソで置換されていてもよいC3−10シクロアルカン(例、シクロヘプタン)と縮合したC6−14アリール基(例、フェニル)(具体例、5−オキソテトラヒドロベンゾアヌレン−2−イル)で置換されたヒドロキシ;
などである。
R6は、より好ましくは、
(1) 水素原子;
(2) (a) ヒドロキシ、
(b) C1−6アルキル(例、メチル)でモノまたはジ置換されていてもよいアミノ、および
(c) ハロゲン原子(例、フッ素原子)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル);
(3) (a) 1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルキル(例、メチル)(具体例、トリフルオロメチル)、
(b) 1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルコキシ(例、メトキシ)(具体例、メトキシ、トリフルオロメトキシ)、
(c) C1−6アルコキシ−カルボニル(例、メトキシカルボニル、エトキシカルボニル)、
(d) (i) C1−6アルキル(例、メチル)、および
(ii) C1−6アルキル−カルボニル(例、アセチル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(e) C1−6アルキル−スルホニル(例、メチルスルホニル)、
(f) シアノ、ならびに
(g) C1−3アルキレンジオキシ(例、メチレンジオキシ)
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル);
(4) (a) (i) 非芳香族複素環基(例、テトラヒドロピラニル)で置換されていてもよいヒドロキシ、および
(ii) シアノ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル、イソプロピル、tert-ブチル)、
(b) C6−14アリール(例、フェニル)、
(c) 芳香族複素環基(例、ピリジル)、
(d) C1−6アルコキシ(例、メトキシ)、ならびに
(e) ハロゲン原子(例、フッ素原子、塩素原子、臭素原子)
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、チエニル、フリル、ピロリル、イミダゾリル、ピラゾリル、オキサゾリル、トリアゾリル、ピリジル、ピリダジニル、インドリル);
(5) (a) (i) C6−14アリール(例、フェニル)、
(ii) 芳香族複素環基(例、ピリジル)、および
(iii) C1−6アルキル(例、メチル)で置換されていてもよいヒドロキシ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル)、
(b) C1−6アルコキシ(例、メトキシ)、およびハロゲン原子(例、フッ素原子)から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル)、
(c) 芳香族複素環基(例、ピリジル、ピリミジニル)、
(d) ヒドロキシ、
(e) C1−6アルキル−カルボニル(例、アセチル)でモノまたはジ置換されていてもよいアミノ、
(f) カルボキシル、
(g) C7−13アラルキル(例、ベンジル)でモノまたはジ置換されていてもよいカルバモイル、
(h) C1−6アルキル−スルホニル(例、エチルスルホニル)、ならびに
(i) C6−14アリール−スルホニル(例、ベンゼンスルホニル)
から選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基(例、ピロリジニル、ピペリジニル、ホモピペリジニル、テトラヒドロピリジル、ピペラジニル、モルホリニル、チオモルホリニル、テトラヒドロイソキノリニル、ジヒドロイソインドリル、テトラヒドロベンゾアゼピニル);
(6) (a) (i) (A) ハロゲン原子(例、フッ素原子)、
(B) C1−6アルキル(例、メチル)でモノまたはジ置換されていてもよいアミノ、および
(C) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル(例、メチル)(具体例、ヒドロキシメチル)で1ないし3個置換されていてもよい芳香族複素環基(例、イミダゾリル)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、エチル、プロピル、ブチル)、
(ii) 1ないし3個のC1−6アルキル(例、メチル)で置換されていてもよい芳香族複素環基(例、イミダゾリル、ピラゾリル)、
(iii) 非芳香族複素環基(例、モルホリニル)、
(iv) (A)ハロゲン原子(例、フッ素原子)および(B)カルボキシルから選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルコキシ(例、メトキシ)、
(v) (A) C1−6アルキル(例、メチル、エチル)、
(B) C1−6アルキル−カルボニル(例、アセチル、tert−ブチルカルボニル)、
(C) C3−10シクロアルキル−カルボニル(例、シクロプロピルカルボニル、シクロヘキシルカルボニル)、
(D) (1’)1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルキル(例、メチル)(具体例、トリフルオロメチル)、(2’)ハロゲン原子(例、フッ素原子、塩素原子)、および(3’)1ないし3個のシアノで置換されていてもよいC3−10シクロアルキル(具体例、1−シアノシクロプロピル)から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール−カルボニル(例、ベンゾイル)、ならびに
(E) 1ないし3個のC1−6アルキル(例、メチル)で置換されていてもよい芳香族複素環−カルボニル(例、チエニルカルボニル、フリルカルボニル、ピリジルカルボニル、ピラゾリルカルボニル、チアジアゾリルカルボニル、イソキサゾリルカルボニル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(vi) カルボキシル、ならびに
(vii) C1−6アルキル(例、メチル)およびオキソから選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環−カルボニル(例、ピロリジニルカルボニル)
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル)、
(b) (i) C1−6アルキル(例、メチル)、
(ii) C1−6アルキル−カルボニル(例、アセチル)、および
(iii) カルボキシル
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、ピリジル、ベンゾフラニル)、ならびに
(c) C1−6アルキル(例、メチル)およびオキソから選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基(例、ピロリジニル、ピペリジニル、クロメニル)
から選ばれる置換基で置換されていてもよいヒドロキシ;
(7) (a) (i) 1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルキル(例、メチル)(具体例、メチル、トリフルオロメチル)、
(ii) C6−14アリール(例、フェニル)、および
(iii) 芳香族複素環基(例、ピリジル)
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、ピリジル、イミダゾリル、チアゾリル、チアジアゾリル、トリアゾリル)、
で置換されていてもよいメルカプト;
(8) (a) (i) 芳香族複素環基(例、ピリジル、イミダゾリル)、
(ii) ヒドロキシ、
(iii) C1−6アルコキシ(例、メトキシ)、および
(iv) C1−6アルキル(例、メチル)でモノまたはジ置換されていてもよいアミノ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル、プロピル)、
(b) C3−10シクロアルキル(例、シクロプロピル、シクロペンチル、シクロヘキシル)、
(c) C7−13アラルキル(例、ベンジル)、ならびに
(d) 1ないし3個のC1−6アルキル(例、メチル)で置換されていてもよい非芳香族複素環基(例、ピロリジニル、ピペリジニル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(9) シアノ;
(10) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル−カルボニル(例、アセチル);
(11) ハロゲン原子(例、フッ素原子、塩素原子、臭素原子、ヨウ素原子);
(12) オキソで置換されていてもよいC3−10シクロアルカン(例、シクロヘプタン)と縮合したC6−14アリール基(例、フェニル)(具体例、5−オキソテトラヒドロベンゾアヌレン−2−イル)で置換されたヒドロキシ;
などである。
Zは、好ましくは、水素原子、または置換されていてもよいC1−10アルキル(好ましくは、置換されていてもよいC1−6アルキル)であり、より好ましくは、水素原子、または1〜3個のヒドロキシで置換されていてもよいC1−6アルキル基(例、メチル)である。
環Aで表される「さらに置換されていてもよい環」の「環」としては、例えば、「脂環式炭化水素」、「芳香族炭化水素」、「複素環」などが挙げられる。
「脂環式炭化水素」としては、例えば、C3−10シクロアルカン、C3−10シクロアルケン、およびC4−10シクロアルカンジエン、ならびにこれらとベンゼンとの2環式縮合環などの、飽和もしくは不飽和の単環式または縮合多環式の脂環式炭化水素が挙げられる。
C3−10シクロアルカンとしては、例えば、シクロプロパン、シクロブタン、シクロペンタン、シクロヘキサン、シクロヘプタン、シクロオクタン、ビシクロ[2.2.1]ヘプタン、ビシクロ[2.2.2]オクタン、ビシクロ[3.2.1]オクタン、ビシクロ[3.2.2]ノナン、ビシクロ[3.3.1]ノナン、ビシクロ[4.2.1]ノナン、ビシクロ[4.3.1]デカン、アダマンタン等が挙げられる。
C3−10シクロアルケンとしては、例えば、シクロペンテン、シクロヘキセン、シクロヘプテン、シクロオクテン等が挙げられる。
C4−10シクロアルカジエンとしては、例えば、2,4−シクロペンタジエン、2,4−シクロヘキサジエン等が挙げられる。
「芳香族炭化水素」としては、単環式又は縮合多環式芳香族炭化水素が用いられ、好ましくは、C6−14芳香族炭化水素などである。具体的には、例えば、ベンゼン、ナフタレン、アントラセン、フェナントレン、アセナフチレン、フェナレン、ビフェニルなどであり、好ましくは、ベンゼン、ナフタレンなどが用いられる。
「脂環式炭化水素」としては、例えば、C3−10シクロアルカン、C3−10シクロアルケン、およびC4−10シクロアルカンジエン、ならびにこれらとベンゼンとの2環式縮合環などの、飽和もしくは不飽和の単環式または縮合多環式の脂環式炭化水素が挙げられる。
C3−10シクロアルカンとしては、例えば、シクロプロパン、シクロブタン、シクロペンタン、シクロヘキサン、シクロヘプタン、シクロオクタン、ビシクロ[2.2.1]ヘプタン、ビシクロ[2.2.2]オクタン、ビシクロ[3.2.1]オクタン、ビシクロ[3.2.2]ノナン、ビシクロ[3.3.1]ノナン、ビシクロ[4.2.1]ノナン、ビシクロ[4.3.1]デカン、アダマンタン等が挙げられる。
C3−10シクロアルケンとしては、例えば、シクロペンテン、シクロヘキセン、シクロヘプテン、シクロオクテン等が挙げられる。
C4−10シクロアルカジエンとしては、例えば、2,4−シクロペンタジエン、2,4−シクロヘキサジエン等が挙げられる。
「芳香族炭化水素」としては、単環式又は縮合多環式芳香族炭化水素が用いられ、好ましくは、C6−14芳香族炭化水素などである。具体的には、例えば、ベンゼン、ナフタレン、アントラセン、フェナントレン、アセナフチレン、フェナレン、ビフェニルなどであり、好ましくは、ベンゼン、ナフタレンなどが用いられる。
「複素環」としては、芳香族複素環および非芳香族複素環が挙げられる。
ここで、芳香族複素環としては、例えば、環構成原子として炭素原子以外に酸素原子、硫黄原子および窒素原子から選ばれるヘテロ原子を1ないし4個含有する4〜7員(好ましくは5または6員)の単環式芳香族複素環および縮合芳香族複素環が挙げられる。該縮合芳香族複素環としては、例えば、これら4〜7員の単環式芳香族複素環と、1ないし2個の窒素原子を含む5もしくは6員の芳香族複素環(例、ピロール、イミダゾール、ピラゾール、ピラジン、ピリジン、ピリミジン)、1個の硫黄原子を含む5員の芳香族複素環(例、チオフェン)、またはベンゼン環等とが、1ないし2個縮合した環等が挙げられる。
芳香族複素環の好適な例としては、
フラン、チオフェン、ピリジン、ピリミジン、ピリダジン、ピラジン、ピロール、イミダゾール、ピラゾール、チアゾール、イソチアゾール、オキサゾール、イソキサゾール、オキサジアゾール、チアジアゾール、トリアゾール、テトラゾール、トリアジン等の単環式芳香族複素環;
キノリン、イソキノリン、キナゾリン、キノキサリン、ベンゾフラン、ベンゾチオフェン、ベンズオキサゾール、ベンズイソオキサゾール、ベンゾチアゾール、ベンズイミダゾール、ベンゾトリアゾール、インドール、インダゾール、ピロロピラジン(例、1H−ピロロ[2,3−b]ピラジン、1H−ピロロ[2,3−b]ピラジン)、イミダゾピリジン(例、1H−イミダゾ[4,5−b]ピリジン、1H−イミダゾ[4,5−c]ピリジン、2H−イミダゾ[1,2−a]ピリジン)、イミダゾピラジン(例、1H−イミダゾ[4,5−b]ピラジン)、ピラゾロピリジン(例、1H−ピラゾロ[4,3−c]ピリジン)、ピラゾロチエニル(例、2H−ピラゾロ[3,4−b]チオフェン−2−イル)、ピラゾロトリアジン(例、ピラゾロ[5,1−c][1,2,4]トリアジン)等の縮合芳香族複素環;
が挙げられる。
ここで、芳香族複素環としては、例えば、環構成原子として炭素原子以外に酸素原子、硫黄原子および窒素原子から選ばれるヘテロ原子を1ないし4個含有する4〜7員(好ましくは5または6員)の単環式芳香族複素環および縮合芳香族複素環が挙げられる。該縮合芳香族複素環としては、例えば、これら4〜7員の単環式芳香族複素環と、1ないし2個の窒素原子を含む5もしくは6員の芳香族複素環(例、ピロール、イミダゾール、ピラゾール、ピラジン、ピリジン、ピリミジン)、1個の硫黄原子を含む5員の芳香族複素環(例、チオフェン)、またはベンゼン環等とが、1ないし2個縮合した環等が挙げられる。
芳香族複素環の好適な例としては、
フラン、チオフェン、ピリジン、ピリミジン、ピリダジン、ピラジン、ピロール、イミダゾール、ピラゾール、チアゾール、イソチアゾール、オキサゾール、イソキサゾール、オキサジアゾール、チアジアゾール、トリアゾール、テトラゾール、トリアジン等の単環式芳香族複素環;
キノリン、イソキノリン、キナゾリン、キノキサリン、ベンゾフラン、ベンゾチオフェン、ベンズオキサゾール、ベンズイソオキサゾール、ベンゾチアゾール、ベンズイミダゾール、ベンゾトリアゾール、インドール、インダゾール、ピロロピラジン(例、1H−ピロロ[2,3−b]ピラジン、1H−ピロロ[2,3−b]ピラジン)、イミダゾピリジン(例、1H−イミダゾ[4,5−b]ピリジン、1H−イミダゾ[4,5−c]ピリジン、2H−イミダゾ[1,2−a]ピリジン)、イミダゾピラジン(例、1H−イミダゾ[4,5−b]ピラジン)、ピラゾロピリジン(例、1H−ピラゾロ[4,3−c]ピリジン)、ピラゾロチエニル(例、2H−ピラゾロ[3,4−b]チオフェン−2−イル)、ピラゾロトリアジン(例、ピラゾロ[5,1−c][1,2,4]トリアジン)等の縮合芳香族複素環;
が挙げられる。
非芳香族複素環としては、例えば、環構成原子として炭素原子以外に酸素原子、硫黄原子および窒素原子から選ばれるヘテロ原子を1ないし4個含有する4〜7員(好ましくは5または6員)の単環式非芳香族複素環および縮合非芳香族複素環が挙げられる。該縮合非芳香族複素環としては、例えば、これら4〜7員の単環式非芳香族複素環と、1ないし2個の窒素原子を含む5もしくは6員の芳香族または非芳香族複素環(例、ピロール、イミダゾール、ピラゾール、ピラジン、ピリジン、ピリミジン)、1個の硫黄原子を含む5員の芳香族または非芳香族複素環(例、チオフェン)、またはベンゼン環等とが、1ないし2個縮合した環等が挙げられる。
非芳香族複素環の好適な例としては、
ピロリジン、ピペリジン、ホモピペリジン、テトラヒドロピリジン、モルホリン、チオモルホリン、ピペラジン、ヘキサメチレンイミン、オキサゾリジン、チアゾリジン、イミダゾリジン、オキサゾリン、チアゾリン、イミダゾリン、ジオキソール、ジオキソラン、ジヒドロオキサジアゾール、2−チオキソ−1,3−オキサゾリジン、ピラン、テトラヒドロピラン、チオピラン、テトラヒドロチオピラン、1−オキシドテトラヒドロチオピラン、1,1−ジオキシドテトラヒドロチオピラン、テトラヒドロフラン、ピラゾリジン、ピラゾリン、テトラヒドロピリミジン、ジヒドロトリアゾール、テトラヒドロトリアゾール等の単環式非芳香族複素環;
ジヒドロインドール、ジヒドロイソインドール、ジヒドロベンゾフラン、ジヒドロベンゾジオキシン、ジヒドロベンゾジオキセピン、テトラヒドロベンゾフラン、クロメン、ジヒドロキノリン、テトラヒドロキノリン、ジヒドロイソキノリン、テトラヒドロイソキノリン、ジヒドロフタラジン、テトラヒドロベンゾアゼピン等の縮合非芳香族複素環;
等が挙げられる。
非芳香族複素環の好適な例としては、
ピロリジン、ピペリジン、ホモピペリジン、テトラヒドロピリジン、モルホリン、チオモルホリン、ピペラジン、ヘキサメチレンイミン、オキサゾリジン、チアゾリジン、イミダゾリジン、オキサゾリン、チアゾリン、イミダゾリン、ジオキソール、ジオキソラン、ジヒドロオキサジアゾール、2−チオキソ−1,3−オキサゾリジン、ピラン、テトラヒドロピラン、チオピラン、テトラヒドロチオピラン、1−オキシドテトラヒドロチオピラン、1,1−ジオキシドテトラヒドロチオピラン、テトラヒドロフラン、ピラゾリジン、ピラゾリン、テトラヒドロピリミジン、ジヒドロトリアゾール、テトラヒドロトリアゾール等の単環式非芳香族複素環;
ジヒドロインドール、ジヒドロイソインドール、ジヒドロベンゾフラン、ジヒドロベンゾジオキシン、ジヒドロベンゾジオキセピン、テトラヒドロベンゾフラン、クロメン、ジヒドロキノリン、テトラヒドロキノリン、ジヒドロイソキノリン、テトラヒドロイソキノリン、ジヒドロフタラジン、テトラヒドロベンゾアゼピン等の縮合非芳香族複素環;
等が挙げられる。
前記「さらに置換されていてもよい環」における「環」は、式(I)において
で表される基およびR1基以外に、置換可能な位置に1ないし3個の置換基を有していてもよい。このような置換基としては、例えば、前記「置換されていてもよい炭化水素基」の「炭化水素基」として例示したC3−10シクロアルキル基等が有していてもよい置換基として例示したものが挙げられる。置換基が2個以上である場合、各置換基は同一でも異なっていてもよい。
環Aは、好ましくは、置換されていてもよい芳香族炭化水素(より好ましくは、ベンゼン)、または置換されていてもよい5員の芳香族複素環(より好ましくは、フラン、チオフェン、イソキサゾール)である。
ZとR6が結合して、それらが結合する炭素原子と共に形成する「置換されていてもよい環」の「環」としては、前記環Aにおける「さらに置換されていてもよい環」の「環」として例示されたもののうち、環内にビニレン構造を含むものが挙げられる。
そのような環としては、「脂環式炭化水素」または「芳香族炭化水素」として例示されたもの(例、ベンゼン);
フラン、チオフェン、ピリジン、ピリミジン、ピリダジン、ピラジン、ピロール、イミダゾール、ピラゾール、チアゾール、イソチアゾール、オキサゾール、イソキサゾール、1,2,3−オキサジアゾール、1,2,5−オキサジアゾール、1,2,3−チアジアゾール、1,2,5−チアジアゾール、1,2,3−トリアゾール等の単環式芳香族複素環;
キノリン、イソキノリン、キナゾリン、キノキサリン、ベンゾフラン、ベンゾチオフェン、ベンズオキサゾール、ベンズイソオキサゾール、ベンゾチアゾール、ベンズイミダゾール、ベンゾトリアゾール、インドール、インダゾール、ピロロピラジン(例、1H−ピロロ[2,3−b]ピラジン、1H−ピロロ[2,3−b]ピラジン)、イミダゾピリジン(例、1H−イミダゾ[4,5−b]ピリジン、1H−イミダゾ[4,5−c]ピリジン、2H−イミダゾ[1,2−a]ピリジン)、イミダゾピラジン(例、1H−イミダゾ[4,5−b]ピラジン)、ピラゾロピリジン(例、1H−ピラゾロ[4,3−c]ピリジン)、ピラゾロチエニル(例、2H−ピラゾロ[3,4−b]チオフェン−2−イル)、ピラゾロトリアジン(例、ピラゾロ[5,1−c][1,2,4]トリアジン)等の縮合芳香族複素環;
テトラヒドロピリジン、オキサゾリン、チアゾリン、イミダゾリン、ジオキソール、ジオキソラン、ジヒドロオキサジアゾール、ピラン、チオピラン、ピラゾリジン、ピラゾリン、テトラヒドロピリミジン、ジヒドロフラン(例、2,3−ジヒドロフラン)等の単環式非芳香族複素環;
ジヒドロインドール、ジヒドロイソインドール、ジヒドロベンゾフラン、ジヒドロベンゾジオキシン、ジヒドロベンゾジオキセピン、テトラヒドロベンゾフラン、クロメン、ジヒドロキノリン、テトラヒドロキノリン、ジヒドロイソキノリン、テトラヒドロイソキノリン、ジヒドロフタラジン、テトラヒドロベンゾアゼピン等の縮合非芳香族複素環;
等が挙げられる。
前記「置換されていてもよい環」における「環」は、好ましくは、ベンゼン、ジヒドロフラン、イミダゾールである。
そのような環としては、「脂環式炭化水素」または「芳香族炭化水素」として例示されたもの(例、ベンゼン);
フラン、チオフェン、ピリジン、ピリミジン、ピリダジン、ピラジン、ピロール、イミダゾール、ピラゾール、チアゾール、イソチアゾール、オキサゾール、イソキサゾール、1,2,3−オキサジアゾール、1,2,5−オキサジアゾール、1,2,3−チアジアゾール、1,2,5−チアジアゾール、1,2,3−トリアゾール等の単環式芳香族複素環;
キノリン、イソキノリン、キナゾリン、キノキサリン、ベンゾフラン、ベンゾチオフェン、ベンズオキサゾール、ベンズイソオキサゾール、ベンゾチアゾール、ベンズイミダゾール、ベンゾトリアゾール、インドール、インダゾール、ピロロピラジン(例、1H−ピロロ[2,3−b]ピラジン、1H−ピロロ[2,3−b]ピラジン)、イミダゾピリジン(例、1H−イミダゾ[4,5−b]ピリジン、1H−イミダゾ[4,5−c]ピリジン、2H−イミダゾ[1,2−a]ピリジン)、イミダゾピラジン(例、1H−イミダゾ[4,5−b]ピラジン)、ピラゾロピリジン(例、1H−ピラゾロ[4,3−c]ピリジン)、ピラゾロチエニル(例、2H−ピラゾロ[3,4−b]チオフェン−2−イル)、ピラゾロトリアジン(例、ピラゾロ[5,1−c][1,2,4]トリアジン)等の縮合芳香族複素環;
テトラヒドロピリジン、オキサゾリン、チアゾリン、イミダゾリン、ジオキソール、ジオキソラン、ジヒドロオキサジアゾール、ピラン、チオピラン、ピラゾリジン、ピラゾリン、テトラヒドロピリミジン、ジヒドロフラン(例、2,3−ジヒドロフラン)等の単環式非芳香族複素環;
ジヒドロインドール、ジヒドロイソインドール、ジヒドロベンゾフラン、ジヒドロベンゾジオキシン、ジヒドロベンゾジオキセピン、テトラヒドロベンゾフラン、クロメン、ジヒドロキノリン、テトラヒドロキノリン、ジヒドロイソキノリン、テトラヒドロイソキノリン、ジヒドロフタラジン、テトラヒドロベンゾアゼピン等の縮合非芳香族複素環;
等が挙げられる。
前記「置換されていてもよい環」における「環」は、好ましくは、ベンゼン、ジヒドロフラン、イミダゾールである。
前記「置換されていてもよい環」における「環」は、置換可能な位置に1ないし3個の置換基を有していてもよい。このような置換基としては、例えば、前記「置換されていてもよい炭化水素基」の「炭化水素基」として例示したC3−10シクロアルキル等が有していてもよい置換基として例示したものが挙げられ、中でも、C1−6アルキルが好ましい。置換基が2個以上である場合、各置換基は同一でも異なっていてもよい。
ZとR6が結合して、それらが結合する炭素原子と共に形成する「置換されていてもよい環」は、好ましくは、それぞれ1〜3個のC1−6アルキルで置換されていてもよい、芳香族炭化水素(好ましくは、ベンゼン)または複素環(好ましくは、ジヒドロフラン、イミダゾール)である。
下記(i)〜(iv)に示される化合物は、化合物(I)の範囲から除かれる。
(i) Xが=CH−である場合に、R6は置換されていてもよい2−ピペリジニルである化合物、
(ii) N-イミダゾ[1,2−a]ピリジン−2−イル−4−メチル−ベンズアミド、
(iii) N-イミダゾ[1,2−a]ピリジン−2−イル−ベンズアミド、および
(iv) N-(7−メチルイミダゾ[1,2−a]ピリジン−2−イル)−ベンズアミド。
(i) Xが=CH−である場合に、R6は置換されていてもよい2−ピペリジニルである化合物、
(ii) N-イミダゾ[1,2−a]ピリジン−2−イル−4−メチル−ベンズアミド、
(iii) N-イミダゾ[1,2−a]ピリジン−2−イル−ベンズアミド、および
(iv) N-(7−メチルイミダゾ[1,2−a]ピリジン−2−イル)−ベンズアミド。
化合物(I)の好適な例は以下の通りである。
(イミダゾピリジン誘導体)
(I−1)
環Aが、芳香族炭化水素(好ましくは、ベンゼン)、または芳香族複素環(好ましくは、フラン、チオフェン、イソキサゾール、ピリジン)であり;
(イミダゾピリジン誘導体)
(I−1)
環Aが、芳香族炭化水素(好ましくは、ベンゼン)、または芳香族複素環(好ましくは、フラン、チオフェン、イソキサゾール、ピリジン)であり;
R1が、
(1) 水素原子、
(2) (a) 芳香族複素環基(例、テトラゾリル、オキサジアゾリル)、
(b) (i) C1−6アルキル(例、プロピル)、
(ii) ヒドロキシおよび芳香族複素環基(例、イミダゾリル)から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル−カルボニル(例、アセチル、プロピオニル)、
(iii) C6−14アリール−カルボニル(例、ベンゾイル)、
(iv) C1−6アルキル−スルホニル(例、メチルスルホニル)、および
(v) 芳香族複素環−カルボニル(例、イミダゾリルカルボニル)、
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(c) シアノ、
(d) カルボキシル、
(e) C1−6アルコキシ−カルボニル(例、メトキシカルボニル、エトキシカルボニル)、
(f) N−ヒドロキシカルバモイル、
(g) (i)シアノ、(ii)ヒドロキシ、(iii)芳香族複素環基(例、テトラゾリル)、および(iv)C1−6アルキルを1ないし3個有していてもよい非芳香族複素環基(例、ジオキソリル)から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル、プロピル)でモノまたはジ置換されていてもよいカルバモイル、
(h) ハロゲン原子(例、フッ素原子)、
(i) ジC1−6アルキルホスホリル(例、ジエチルホスホリル)、
(j) ヒドロキシ、ならびに
(k) 非芳香族複素環基(例、オキソオキサジアゾリル)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、プロピル、イソプロピル、tert−ブチル、2−メチルブタン−2−イル);
(3) (a) C1−6アルコキシ−カルボニル(例、メトキシカルボニル)、および
(b) カルボキシル
から選ばれる1ないし3個の置換基で置換されていてもよいC3−10シクロアルキル(例、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル);
(4) 芳香族複素環基(例、ピリジル、フリル、イミダゾリル、ピラゾリル);
(5) C1−6アルキル(例、メチル)で置換されていてもよいヒドロキシ;
(6) (a) C1−6アルキル(例、メチル、エチル)、および
(b) C1−6アルキル−スルホニル(例、メチルスルホニル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(7) シアノ;
(8) カルボキシル;
(9) C1−6アルコキシ−カルボニル(例、メトキシカルボニル);
(10) C1−6アルキル−スルホニル(例、メチルスルホニル);
(11) (a) C1−6アルキル(例、メチル)、および
(b) C1−6アルキル−カルボニル(例、アセチル)
から選ばれる置換基でモノまたはジ置換されていてもよいスルファモイル;あるいは
(12) ハロゲン原子(例、塩素原子);
であり、
(1) 水素原子、
(2) (a) 芳香族複素環基(例、テトラゾリル、オキサジアゾリル)、
(b) (i) C1−6アルキル(例、プロピル)、
(ii) ヒドロキシおよび芳香族複素環基(例、イミダゾリル)から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル−カルボニル(例、アセチル、プロピオニル)、
(iii) C6−14アリール−カルボニル(例、ベンゾイル)、
(iv) C1−6アルキル−スルホニル(例、メチルスルホニル)、および
(v) 芳香族複素環−カルボニル(例、イミダゾリルカルボニル)、
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(c) シアノ、
(d) カルボキシル、
(e) C1−6アルコキシ−カルボニル(例、メトキシカルボニル、エトキシカルボニル)、
(f) N−ヒドロキシカルバモイル、
(g) (i)シアノ、(ii)ヒドロキシ、(iii)芳香族複素環基(例、テトラゾリル)、および(iv)C1−6アルキルを1ないし3個有していてもよい非芳香族複素環基(例、ジオキソリル)から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル、プロピル)でモノまたはジ置換されていてもよいカルバモイル、
(h) ハロゲン原子(例、フッ素原子)、
(i) ジC1−6アルキルホスホリル(例、ジエチルホスホリル)、
(j) ヒドロキシ、ならびに
(k) 非芳香族複素環基(例、オキソオキサジアゾリル)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、プロピル、イソプロピル、tert−ブチル、2−メチルブタン−2−イル);
(3) (a) C1−6アルコキシ−カルボニル(例、メトキシカルボニル)、および
(b) カルボキシル
から選ばれる1ないし3個の置換基で置換されていてもよいC3−10シクロアルキル(例、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル);
(4) 芳香族複素環基(例、ピリジル、フリル、イミダゾリル、ピラゾリル);
(5) C1−6アルキル(例、メチル)で置換されていてもよいヒドロキシ;
(6) (a) C1−6アルキル(例、メチル、エチル)、および
(b) C1−6アルキル−スルホニル(例、メチルスルホニル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(7) シアノ;
(8) カルボキシル;
(9) C1−6アルコキシ−カルボニル(例、メトキシカルボニル);
(10) C1−6アルキル−スルホニル(例、メチルスルホニル);
(11) (a) C1−6アルキル(例、メチル)、および
(b) C1−6アルキル−カルボニル(例、アセチル)
から選ばれる置換基でモノまたはジ置換されていてもよいスルファモイル;あるいは
(12) ハロゲン原子(例、塩素原子);
であり、
R2が、水素原子であり、
R3が、水素原子、C1−6アルキル(例、メチル)、またはハロゲン原子(例、臭素原子)であり、
R4が、水素原子であり、
R5が、水素原子であり、
R3が、水素原子、C1−6アルキル(例、メチル)、またはハロゲン原子(例、臭素原子)であり、
R4が、水素原子であり、
R5が、水素原子であり、
R6が、
(1) 水素原子;
(2) (a) ヒドロキシ、
(b) C1−6アルキル(例、メチル)でモノまたはジ置換されていてもよいアミノ、および
(c) ハロゲン原子(例、フッ素原子)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル);
(3) (a) 1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルキル(例、メチル)(具体例、トリフルオロメチル)、
(b) 1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルコキシ(例、メトキシ)(具体例、メトキシ、トリフルオロメトキシ)、
(c) C1−6アルコキシ−カルボニル(例、メトキシカルボニル、エトキシカルボニル)、
(d) (i)C1−6アルキル(例、メチル)、および
(ii) C1−6アルキル−カルボニル(例、アセチル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(e) C1−6アルキル−スルホニル(例、メチルスルホニル)、
(f) シアノ、ならびに
(g) C1−3アルキレンジオキシ(例、メチレンジオキシ)
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル);
(4) (a) (i) 非芳香族複素環基(例、テトラヒドロピラニル)で置換されていてもよいヒドロキシ、および
(ii) シアノ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル,エチル、イソプロピル、tert−ブチル)、
(b) C6−14アリール(例、フェニル)、
(c) 芳香族複素環基(例、ピリジル)、
(d) C1−6アルコキシ(例、メトキシ)、ならびに
(e) ハロゲン原子(例、フッ素原子、塩素原子、臭素原子)
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、チエニル、フリル、ピロリル、イミダゾリル、ピラゾリル、オキサゾリル、トリアゾリル、ピリジル、ピリダジニル、インドリル);
(5) (a) (i) C6−14アリール(例、フェニル)、
(ii) 芳香族複素環基(例、ピリジル)、および
(iii) C1−6アルキル(例、メチル)で置換されていてもよいヒドロキシ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル)、
(b) C1−6アルコキシ(例、メトキシ)、およびハロゲン原子(例、フッ素原子)から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル)、
(c) 芳香族複素環基(例、ピリジル、ピリミジニル)、
(d) ヒドロキシ、
(e) C1−6アルキル−カルボニル(例、アセチル)でモノまたはジ置換されていてもよいアミノ、
(f) カルボキシル、
(g) C7−13アラルキル(例、ベンジル)でモノまたはジ置換されていてもよいカルバモイル、
(h) C1−6アルキル−スルホニル(例、エチルスルホニル)、ならびに
(i) C6−14アリール−スルホニル(例、ベンゼンスルホニル)
から選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基(例、ピロリジニル、ピペリジニル、ホモピペリジニル、テトラヒドロピリジル、ピペラジニル、モルホリニル、チオモルホリニル、テトラヒドロイソキノリニル、ジヒドロイソインドリル、テトラヒドロベンゾアゼピニル);
(6) (a) (i) (A) ハロゲン原子(例、フッ素原子)、
(B) C1−6アルキル(例、メチル)でモノまたはジ置換されていてもよいアミノ、および
(C) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル(例、メチル)(具体例、ヒドロキシメチル)で1ないし3個置換されていてもよい芳香族複素環基(例、イミダゾリル)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、エチル、プロピル、ブチル)、
(ii)1ないし3個のC1−6アルキル(例、メチル)で置換されていてもよい芳香族複素環基(例、イミダゾリル、ピラゾリル)、
(iii) 非芳香族複素環基(例、モルホリニル)、
(iv) (A)ハロゲン原子(例、フッ素原子)および(B)カルボキシルから選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルコキシ(例、メトキシ)、
(v) (A) C1−6アルキル(例、メチル、エチル)、
(B) C1−6アルキル−カルボニル(例、アセチル、tert−ブチルカルボニル)、
(C) C3−10シクロアルキル−カルボニル(例、シクロプロピルカルボニル、シクロヘキシルカルボニル)、
(D) (1’)1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルキル(例、メチル)(具体例、トリフルオロメチル)、および(2’)ハロゲン原子(例、フッ素原子、塩素原子)から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール−カルボニル(例、ベンゾイル)、ならびに
(E) 1ないし3個のC1−6アルキル(例、メチル)で置換されていてもよい芳香族複素環−カルボニル(例、チエニルカルボニル、フリルカルボニル、ピリジルカルボニル、ピラゾリルカルボニル、チアジアゾリルカルボニル、イソキサゾリルカルボニル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(vi) カルボキシル、ならびに
(vii) C1−6アルキル(例、メチル)およびオキソから選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環−カルボニル(例、ピロリジニルカルボニル)
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル)、
(b) (i) C1−6アルキル(例、メチル)、
(ii) C1−6アルキル−カルボニル(例、アセチル)、および
(iii) カルボキシル
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、ピリジル、ベンゾフラニル)、ならびに
(c) C1−6アルキル(例、メチル)およびオキソから選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基(例、ピロリジニル、ピペリジニル、クロメニル)
から選ばれる置換基で置換されていてもよいヒドロキシ;
(7) (a) (i) 1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルキル(例、メチル)(具体例、メチル、トリフルオロメチル)、
(ii) C6−14アリール(例、フェニル)、および
(iii) 芳香族複素環基(例、ピリジル)
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、ピリジル、イミダゾリル、チアゾリル、チアジアゾリル、トリアゾリル)、
で置換されていてもよいメルカプト;
(8) (a) (i) 芳香族複素環基(例、ピリジル、イミダゾリル)、
(ii) ヒドロキシ、
(iii) C1−6アルコキシ(例、メトキシ)、および
(iv) C1−6アルキル(例、メチル)でモノまたはジ置換されていてもよいアミノ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル、プロピル)、
(b) C3−10シクロアルキル(例、シクロプロピル、シクロペンチル、シクロヘキシル)、
(c) C7−13アラルキル(例、ベンジル)、ならびに
(d) 1〜3個のC1−6アルキル(例、メチル)で置換されていてもよい非芳香族複素環基(例、ピロリジニル、ピペリジニル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(9) シアノ;
(10) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル−カルボニル(例、アセチル);
(11) ハロゲン原子(例、フッ素原子、塩素原子、臭素原子、ヨウ素原子);あるいは
(12) オキソで置換されていてもよいC3−10シクロアルカン(例、シクロヘプタン)と縮合したC6−14アリール(例、フェニル)(具体例、5−オキソテトラヒドロベンゾアヌレン−2−イル)で置換されたヒドロキシ;
であり、
(1) 水素原子;
(2) (a) ヒドロキシ、
(b) C1−6アルキル(例、メチル)でモノまたはジ置換されていてもよいアミノ、および
(c) ハロゲン原子(例、フッ素原子)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル);
(3) (a) 1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルキル(例、メチル)(具体例、トリフルオロメチル)、
(b) 1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルコキシ(例、メトキシ)(具体例、メトキシ、トリフルオロメトキシ)、
(c) C1−6アルコキシ−カルボニル(例、メトキシカルボニル、エトキシカルボニル)、
(d) (i)C1−6アルキル(例、メチル)、および
(ii) C1−6アルキル−カルボニル(例、アセチル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(e) C1−6アルキル−スルホニル(例、メチルスルホニル)、
(f) シアノ、ならびに
(g) C1−3アルキレンジオキシ(例、メチレンジオキシ)
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル);
(4) (a) (i) 非芳香族複素環基(例、テトラヒドロピラニル)で置換されていてもよいヒドロキシ、および
(ii) シアノ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル,エチル、イソプロピル、tert−ブチル)、
(b) C6−14アリール(例、フェニル)、
(c) 芳香族複素環基(例、ピリジル)、
(d) C1−6アルコキシ(例、メトキシ)、ならびに
(e) ハロゲン原子(例、フッ素原子、塩素原子、臭素原子)
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、チエニル、フリル、ピロリル、イミダゾリル、ピラゾリル、オキサゾリル、トリアゾリル、ピリジル、ピリダジニル、インドリル);
(5) (a) (i) C6−14アリール(例、フェニル)、
(ii) 芳香族複素環基(例、ピリジル)、および
(iii) C1−6アルキル(例、メチル)で置換されていてもよいヒドロキシ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル)、
(b) C1−6アルコキシ(例、メトキシ)、およびハロゲン原子(例、フッ素原子)から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル)、
(c) 芳香族複素環基(例、ピリジル、ピリミジニル)、
(d) ヒドロキシ、
(e) C1−6アルキル−カルボニル(例、アセチル)でモノまたはジ置換されていてもよいアミノ、
(f) カルボキシル、
(g) C7−13アラルキル(例、ベンジル)でモノまたはジ置換されていてもよいカルバモイル、
(h) C1−6アルキル−スルホニル(例、エチルスルホニル)、ならびに
(i) C6−14アリール−スルホニル(例、ベンゼンスルホニル)
から選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基(例、ピロリジニル、ピペリジニル、ホモピペリジニル、テトラヒドロピリジル、ピペラジニル、モルホリニル、チオモルホリニル、テトラヒドロイソキノリニル、ジヒドロイソインドリル、テトラヒドロベンゾアゼピニル);
(6) (a) (i) (A) ハロゲン原子(例、フッ素原子)、
(B) C1−6アルキル(例、メチル)でモノまたはジ置換されていてもよいアミノ、および
(C) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル(例、メチル)(具体例、ヒドロキシメチル)で1ないし3個置換されていてもよい芳香族複素環基(例、イミダゾリル)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、エチル、プロピル、ブチル)、
(ii)1ないし3個のC1−6アルキル(例、メチル)で置換されていてもよい芳香族複素環基(例、イミダゾリル、ピラゾリル)、
(iii) 非芳香族複素環基(例、モルホリニル)、
(iv) (A)ハロゲン原子(例、フッ素原子)および(B)カルボキシルから選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルコキシ(例、メトキシ)、
(v) (A) C1−6アルキル(例、メチル、エチル)、
(B) C1−6アルキル−カルボニル(例、アセチル、tert−ブチルカルボニル)、
(C) C3−10シクロアルキル−カルボニル(例、シクロプロピルカルボニル、シクロヘキシルカルボニル)、
(D) (1’)1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルキル(例、メチル)(具体例、トリフルオロメチル)、および(2’)ハロゲン原子(例、フッ素原子、塩素原子)から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール−カルボニル(例、ベンゾイル)、ならびに
(E) 1ないし3個のC1−6アルキル(例、メチル)で置換されていてもよい芳香族複素環−カルボニル(例、チエニルカルボニル、フリルカルボニル、ピリジルカルボニル、ピラゾリルカルボニル、チアジアゾリルカルボニル、イソキサゾリルカルボニル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(vi) カルボキシル、ならびに
(vii) C1−6アルキル(例、メチル)およびオキソから選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環−カルボニル(例、ピロリジニルカルボニル)
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル)、
(b) (i) C1−6アルキル(例、メチル)、
(ii) C1−6アルキル−カルボニル(例、アセチル)、および
(iii) カルボキシル
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、ピリジル、ベンゾフラニル)、ならびに
(c) C1−6アルキル(例、メチル)およびオキソから選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基(例、ピロリジニル、ピペリジニル、クロメニル)
から選ばれる置換基で置換されていてもよいヒドロキシ;
(7) (a) (i) 1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルキル(例、メチル)(具体例、メチル、トリフルオロメチル)、
(ii) C6−14アリール(例、フェニル)、および
(iii) 芳香族複素環基(例、ピリジル)
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、ピリジル、イミダゾリル、チアゾリル、チアジアゾリル、トリアゾリル)、
で置換されていてもよいメルカプト;
(8) (a) (i) 芳香族複素環基(例、ピリジル、イミダゾリル)、
(ii) ヒドロキシ、
(iii) C1−6アルコキシ(例、メトキシ)、および
(iv) C1−6アルキル(例、メチル)でモノまたはジ置換されていてもよいアミノ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル、プロピル)、
(b) C3−10シクロアルキル(例、シクロプロピル、シクロペンチル、シクロヘキシル)、
(c) C7−13アラルキル(例、ベンジル)、ならびに
(d) 1〜3個のC1−6アルキル(例、メチル)で置換されていてもよい非芳香族複素環基(例、ピロリジニル、ピペリジニル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(9) シアノ;
(10) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル−カルボニル(例、アセチル);
(11) ハロゲン原子(例、フッ素原子、塩素原子、臭素原子、ヨウ素原子);あるいは
(12) オキソで置換されていてもよいC3−10シクロアルカン(例、シクロヘプタン)と縮合したC6−14アリール(例、フェニル)(具体例、5−オキソテトラヒドロベンゾアヌレン−2−イル)で置換されたヒドロキシ;
であり、
Xが、=C(Z)−であり、
Zが、水素原子、または1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル(例、メチル)であるか、
あるいは、Xが=C(Z)−である場合、ZとR6が結合して、それらが結合する炭素原子と共に、それぞれ1〜3個のC1−6アルキルで置換されていてもよい、芳香族炭化水素(例、ベンゼン)または複素環(例、ジヒドロフラン、イミダゾール)を形成してもよい化合物。
Zが、水素原子、または1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル(例、メチル)であるか、
あるいは、Xが=C(Z)−である場合、ZとR6が結合して、それらが結合する炭素原子と共に、それぞれ1〜3個のC1−6アルキルで置換されていてもよい、芳香族炭化水素(例、ベンゼン)または複素環(例、ジヒドロフラン、イミダゾール)を形成してもよい化合物。
具体的には、
4−tert−ブチル−N−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イル)ベンズアミド、
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド、
6−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミド、
4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド、
4−tert−ブチル−N−[6−(1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド、
4−(1−シアノ−1−メチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミドが好ましい例としてあげられる。
4−tert−ブチル−N−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イル)ベンズアミド、
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド、
6−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミド、
4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド、
4−tert−ブチル−N−[6−(1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド、
4−(1−シアノ−1−メチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミドが好ましい例としてあげられる。
(イミダゾピリジン誘導体)
(I−2)
環Aが、芳香族炭化水素(好ましくは、ベンゼン)、または5員の芳香族複素環(好ましくは、フラン、チオフェン、イソキサゾール)であり;
(I−2)
環Aが、芳香族炭化水素(好ましくは、ベンゼン)、または5員の芳香族複素環(好ましくは、フラン、チオフェン、イソキサゾール)であり;
R1が、
(1) 水素原子、
(2) (a) 芳香族複素環基(例、テトラゾリル、オキサジアゾリル)、
(b) (i) C1−6アルキル(例、プロピル)、
(ii) ヒドロキシおよび芳香族複素環基(例、イミダゾリル)から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル−カルボニル(例、アセチル、プロピオニル)、
(iii) C6−14アリール−カルボニル(例、ベンゾイル)、
(iv) C1−6アルキル−スルホニル(例、メチルスルホニル)、および
(v) 芳香族複素環−カルボニル(例、イミダゾリルカルボニル)、
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(c) シアノ、
(d) カルボキシル、
(e) C1−6アルコキシ−カルボニル(例、メトキシカルボニル、エトキシカルボニル)、
(f) N−ヒドロキシカルバモイル、
(g) (i)シアノ、(ii)ヒドロキシ、(iii)芳香族複素環基(例、テトラゾリル)、および(iv)C1−6アルキルを1ないし3個有していてもよい非芳香族複素環基(例、ジオキソリル)から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル、プロピル)でモノまたはジ置換されていてもよいカルバモイル、
(h) ハロゲン原子(例、フッ素原子)、
(i) ジC1−6アルキルホスホリル(例、ジエチルホスホリル)、
(j) ヒドロキシ、ならびに
(k) 非芳香族複素環基(例、オキソオキサジアゾリル)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、プロピル、イソプロピル、tert−ブチル、2−メチルブタン−2−イル);
(3) (a) C1−6アルコキシ−カルボニル(例、メトキシカルボニル)、および
(b) カルボキシル
から選ばれる1ないし3個の置換基で置換されていてもよいC3−10シクロアルキル(例、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル);
(4) 芳香族複素環基(例、ピリジル、フリル、イミダゾリル、ピラゾリル);
(5) C1−6アルキル(例、メチル)で置換されていてもよいヒドロキシ;
(6) (a) C1−6アルキル(例、メチル、エチル)、および
(b) C1−6アルキル−スルホニル(例、メチルスルホニル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(7) シアノ;
(8) カルボキシル;
(9) C1−6アルコキシ−カルボニル(例、メトキシカルボニル);
(10) C1−6アルキル−スルホニル(例、メチルスルホニル);
(11) (a) C1−6アルキル(例、メチル)、および
(b) C1−6アルキル−カルボニル(例、アセチル)
から選ばれる置換基でモノまたはジ置換されていてもよいスルファモイル;あるいは
(12) ハロゲン原子(例、塩素原子);
であり、
(1) 水素原子、
(2) (a) 芳香族複素環基(例、テトラゾリル、オキサジアゾリル)、
(b) (i) C1−6アルキル(例、プロピル)、
(ii) ヒドロキシおよび芳香族複素環基(例、イミダゾリル)から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル−カルボニル(例、アセチル、プロピオニル)、
(iii) C6−14アリール−カルボニル(例、ベンゾイル)、
(iv) C1−6アルキル−スルホニル(例、メチルスルホニル)、および
(v) 芳香族複素環−カルボニル(例、イミダゾリルカルボニル)、
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(c) シアノ、
(d) カルボキシル、
(e) C1−6アルコキシ−カルボニル(例、メトキシカルボニル、エトキシカルボニル)、
(f) N−ヒドロキシカルバモイル、
(g) (i)シアノ、(ii)ヒドロキシ、(iii)芳香族複素環基(例、テトラゾリル)、および(iv)C1−6アルキルを1ないし3個有していてもよい非芳香族複素環基(例、ジオキソリル)から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル、プロピル)でモノまたはジ置換されていてもよいカルバモイル、
(h) ハロゲン原子(例、フッ素原子)、
(i) ジC1−6アルキルホスホリル(例、ジエチルホスホリル)、
(j) ヒドロキシ、ならびに
(k) 非芳香族複素環基(例、オキソオキサジアゾリル)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、プロピル、イソプロピル、tert−ブチル、2−メチルブタン−2−イル);
(3) (a) C1−6アルコキシ−カルボニル(例、メトキシカルボニル)、および
(b) カルボキシル
から選ばれる1ないし3個の置換基で置換されていてもよいC3−10シクロアルキル(例、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル);
(4) 芳香族複素環基(例、ピリジル、フリル、イミダゾリル、ピラゾリル);
(5) C1−6アルキル(例、メチル)で置換されていてもよいヒドロキシ;
(6) (a) C1−6アルキル(例、メチル、エチル)、および
(b) C1−6アルキル−スルホニル(例、メチルスルホニル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(7) シアノ;
(8) カルボキシル;
(9) C1−6アルコキシ−カルボニル(例、メトキシカルボニル);
(10) C1−6アルキル−スルホニル(例、メチルスルホニル);
(11) (a) C1−6アルキル(例、メチル)、および
(b) C1−6アルキル−カルボニル(例、アセチル)
から選ばれる置換基でモノまたはジ置換されていてもよいスルファモイル;あるいは
(12) ハロゲン原子(例、塩素原子);
であり、
R2が、水素原子であり、
R3が、水素原子、C1−6アルキル(例、メチル)、またはハロゲン原子(例、臭素原子)であり、
R4が、水素原子であり、
R5が、水素原子であり、
R3が、水素原子、C1−6アルキル(例、メチル)、またはハロゲン原子(例、臭素原子)であり、
R4が、水素原子であり、
R5が、水素原子であり、
R6が、
(1) 水素原子;
(2) (a) ヒドロキシ、
(b) C1−6アルキル(例、メチル)でモノまたはジ置換されていてもよいアミノ、および
(c) ハロゲン原子(例、フッ素原子)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル);
(3) (a) 1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルキル(例、メチル)(具体例、トリフルオロメチル)、
(b) 1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルコキシ(例、メトキシ)(具体例、メトキシ、トリフルオロメトキシ)、
(c) C1−6アルコキシ−カルボニル(例、メトキシカルボニル、エトキシカルボニル)、
(d) (i)C1−6アルキル(例、メチル)、および
(ii) C1−6アルキル−カルボニル(例、アセチル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(e) C1−6アルキル−スルホニル(例、メチルスルホニル)、
(f) シアノ、ならびに
(g) C1−3アルキレンジオキシ(例、メチレンジオキシ)
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル);
(4) (a) (i) 非芳香族複素環基(例、テトラヒドロピラニル)で置換されていてもよいヒドロキシ、および
(ii) シアノ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル,エチル、イソプロピル、tert-ブチル)、
(b) C6−14アリール(例、フェニル)、
(c) 芳香族複素環基(例、ピリジル)、
(d) C1−6アルコキシ(例、メトキシ)、ならびに
(e) ハロゲン原子(例、フッ素原子、塩素原子、臭素原子)
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、チエニル、フリル、ピロリル、イミダゾリル、ピラゾリル、オキサゾリル、トリアゾリル、ピリジル、ピリダジニル、インドリル);
(5) (a) (i) C6−14アリール(例、フェニル)、
(ii) 芳香族複素環基(例、ピリジル)、および
(iii) C1−6アルキル(例、メチル)で置換されていてもよいヒドロキシ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル)、
(b) C1−6アルコキシ(例、メトキシ)、およびハロゲン原子(例、フッ素原子)から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル)、
(c) 芳香族複素環基(例、ピリジル、ピリミジニル)、
(d) ヒドロキシ、
(e) C1−6アルキル−カルボニル(例、アセチル)でモノまたはジ置換されていてもよいアミノ、
(f) カルボキシル、
(g) C7−13アラルキル(例、ベンジル)でモノまたはジ置換されていてもよいカルバモイル、
(h) C1−6アルキル−スルホニル(例、エチルスルホニル)、ならびに
(i) C6−14アリール−スルホニル(例、ベンゼンスルホニル)
から選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基(例、ピロリジニル、ピペリジニル、ホモピペリジニル、テトラヒドロピリジル、ピペラジニル、モルホリニル、チオモルホリニル、テトラヒドロイソキノリニル、ジヒドロイソインドリル、テトラヒドロベンゾアゼピニル);
(6) (a) (i) (A) ハロゲン原子(例、フッ素原子)、
(B) C1−6アルキル(例、メチル)でモノまたはジ置換されていてもよいアミノ、および
(C) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル(例、メチル)(具体例、ヒドロキシメチル)で1ないし3個置換されていてもよい芳香族複素環基(例、イミダゾリル)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、エチル、プロピル、ブチル)、
(ii)1ないし3個のC1−6アルキル(例、メチル)で置換されていてもよい芳香族複素環基(例、イミダゾリル、ピラゾリル)、
(iii) 非芳香族複素環基(例、モルホリニル)、
(iv) (A)ハロゲン原子(例、フッ素原子)および(B)カルボキシルから選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルコキシ(例、メトキシ)、
(v) (A) C1−6アルキル(例、メチル、エチル)、
(B) C1−6アルキル−カルボニル(例、アセチル、tert−ブチルカルボニル)、
(C) C3−10シクロアルキル−カルボニル(例、シクロプロピルカルボニル、シクロヘキシルカルボニル)、
(D) (1’)1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルキル(例、メチル)(具体例、トリフルオロメチル)、および(2’)ハロゲン原子(例、フッ素原子、塩素原子)から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール−カルボニル(例、ベンゾイル)、ならびに
(E) 1ないし3個のC1−6アルキル(例、メチル)で置換されていてもよい芳香族複素環−カルボニル(例、チエニルカルボニル、フリルカルボニル、ピリジルカルボニル、ピラゾリルカルボニル、チアジアゾリルカルボニル、イソキサゾリルカルボニル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(vi) カルボキシル、ならびに
(vii) C1−6アルキル(例、メチル)およびオキソから選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環−カルボニル(例、ピロリジニルカルボニル)
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル)、
(b) (i) C1−6アルキル(例、メチル)、
(ii) C1−6アルキル−カルボニル(例、アセチル)、および
(iii) カルボキシル
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、ピリジル、ベンゾフラニル)、ならびに
(c) C1−6アルキル(例、メチル)およびオキソから選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基(例、ピロリジニル、ピペリジニル、クロメニル)
から選ばれる置換基で置換されていてもよいヒドロキシ;
(7) (a) (i) 1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルキル(例、メチル)(具体例、メチル、トリフルオロメチル)、
(ii) C6−14アリール(例、フェニル)、および
(iii) 芳香族複素環基(例、ピリジル)
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、ピリジル、イミダゾリル、チアゾリル、チアジアゾリル、トリアゾリル)、
で置換されていてもよいメルカプト;
(8) (a) (i) 芳香族複素環基(例、ピリジル、イミダゾリル)、
(ii) ヒドロキシ、
(iii) C1−6アルコキシ(例、メトキシ)、および
(iv) C1−6アルキル(例、メチル)でモノまたはジ置換されていてもよいアミノ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル、プロピル)、
(b) C3−10シクロアルキル(例、シクロプロピル、シクロペンチル、シクロヘキシル)、
(c) C7−13アラルキル(例、ベンジル)、ならびに
(d) 1〜3個のC1−6アルキル(例、メチル)で置換されていてもよい非芳香族複素環基(例、ピロリジニル、ピペリジニル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(9) シアノ;
(10) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル−カルボニル(例、アセチル);
(11) ハロゲン原子(例、フッ素原子、塩素原子、臭素原子、ヨウ素原子);あるいは
(12) オキソで置換されていてもよいC3−10シクロアルカン(例、シクロヘプタン)と縮合したC6−14アリール(例、フェニル)(具体例、5−オキソテトラヒドロベンゾアヌレン−2−イル)で置換されたヒドロキシ;
であり、
(1) 水素原子;
(2) (a) ヒドロキシ、
(b) C1−6アルキル(例、メチル)でモノまたはジ置換されていてもよいアミノ、および
(c) ハロゲン原子(例、フッ素原子)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル);
(3) (a) 1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルキル(例、メチル)(具体例、トリフルオロメチル)、
(b) 1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルコキシ(例、メトキシ)(具体例、メトキシ、トリフルオロメトキシ)、
(c) C1−6アルコキシ−カルボニル(例、メトキシカルボニル、エトキシカルボニル)、
(d) (i)C1−6アルキル(例、メチル)、および
(ii) C1−6アルキル−カルボニル(例、アセチル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(e) C1−6アルキル−スルホニル(例、メチルスルホニル)、
(f) シアノ、ならびに
(g) C1−3アルキレンジオキシ(例、メチレンジオキシ)
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル);
(4) (a) (i) 非芳香族複素環基(例、テトラヒドロピラニル)で置換されていてもよいヒドロキシ、および
(ii) シアノ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル,エチル、イソプロピル、tert-ブチル)、
(b) C6−14アリール(例、フェニル)、
(c) 芳香族複素環基(例、ピリジル)、
(d) C1−6アルコキシ(例、メトキシ)、ならびに
(e) ハロゲン原子(例、フッ素原子、塩素原子、臭素原子)
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、チエニル、フリル、ピロリル、イミダゾリル、ピラゾリル、オキサゾリル、トリアゾリル、ピリジル、ピリダジニル、インドリル);
(5) (a) (i) C6−14アリール(例、フェニル)、
(ii) 芳香族複素環基(例、ピリジル)、および
(iii) C1−6アルキル(例、メチル)で置換されていてもよいヒドロキシ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル)、
(b) C1−6アルコキシ(例、メトキシ)、およびハロゲン原子(例、フッ素原子)から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル)、
(c) 芳香族複素環基(例、ピリジル、ピリミジニル)、
(d) ヒドロキシ、
(e) C1−6アルキル−カルボニル(例、アセチル)でモノまたはジ置換されていてもよいアミノ、
(f) カルボキシル、
(g) C7−13アラルキル(例、ベンジル)でモノまたはジ置換されていてもよいカルバモイル、
(h) C1−6アルキル−スルホニル(例、エチルスルホニル)、ならびに
(i) C6−14アリール−スルホニル(例、ベンゼンスルホニル)
から選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基(例、ピロリジニル、ピペリジニル、ホモピペリジニル、テトラヒドロピリジル、ピペラジニル、モルホリニル、チオモルホリニル、テトラヒドロイソキノリニル、ジヒドロイソインドリル、テトラヒドロベンゾアゼピニル);
(6) (a) (i) (A) ハロゲン原子(例、フッ素原子)、
(B) C1−6アルキル(例、メチル)でモノまたはジ置換されていてもよいアミノ、および
(C) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル(例、メチル)(具体例、ヒドロキシメチル)で1ないし3個置換されていてもよい芳香族複素環基(例、イミダゾリル)
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、エチル、プロピル、ブチル)、
(ii)1ないし3個のC1−6アルキル(例、メチル)で置換されていてもよい芳香族複素環基(例、イミダゾリル、ピラゾリル)、
(iii) 非芳香族複素環基(例、モルホリニル)、
(iv) (A)ハロゲン原子(例、フッ素原子)および(B)カルボキシルから選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルコキシ(例、メトキシ)、
(v) (A) C1−6アルキル(例、メチル、エチル)、
(B) C1−6アルキル−カルボニル(例、アセチル、tert−ブチルカルボニル)、
(C) C3−10シクロアルキル−カルボニル(例、シクロプロピルカルボニル、シクロヘキシルカルボニル)、
(D) (1’)1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルキル(例、メチル)(具体例、トリフルオロメチル)、および(2’)ハロゲン原子(例、フッ素原子、塩素原子)から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール−カルボニル(例、ベンゾイル)、ならびに
(E) 1ないし3個のC1−6アルキル(例、メチル)で置換されていてもよい芳香族複素環−カルボニル(例、チエニルカルボニル、フリルカルボニル、ピリジルカルボニル、ピラゾリルカルボニル、チアジアゾリルカルボニル、イソキサゾリルカルボニル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(vi) カルボキシル、ならびに
(vii) C1−6アルキル(例、メチル)およびオキソから選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環−カルボニル(例、ピロリジニルカルボニル)
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール(例、フェニル)、
(b) (i) C1−6アルキル(例、メチル)、
(ii) C1−6アルキル−カルボニル(例、アセチル)、および
(iii) カルボキシル
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、ピリジル、ベンゾフラニル)、ならびに
(c) C1−6アルキル(例、メチル)およびオキソから選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基(例、ピロリジニル、ピペリジニル、クロメニル)
から選ばれる置換基で置換されていてもよいヒドロキシ;
(7) (a) (i) 1ないし3個のハロゲン原子(例、フッ素原子)で置換されていてもよいC1−6アルキル(例、メチル)(具体例、メチル、トリフルオロメチル)、
(ii) C6−14アリール(例、フェニル)、および
(iii) 芳香族複素環基(例、ピリジル)
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基(例、ピリジル、イミダゾリル、チアゾリル、チアジアゾリル、トリアゾリル)、
で置換されていてもよいメルカプト;
(8) (a) (i) 芳香族複素環基(例、ピリジル、イミダゾリル)、
(ii) ヒドロキシ、
(iii) C1−6アルコキシ(例、メトキシ)、および
(iv) C1−6アルキル(例、メチル)でモノまたはジ置換されていてもよいアミノ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル(例、メチル、エチル、プロピル)、
(b) C3−10シクロアルキル(例、シクロプロピル、シクロペンチル、シクロヘキシル)、
(c) C7−13アラルキル(例、ベンジル)、ならびに
(d) 1〜3個のC1−6アルキル(例、メチル)で置換されていてもよい非芳香族複素環基(例、ピロリジニル、ピペリジニル)
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(9) シアノ;
(10) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル−カルボニル(例、アセチル);
(11) ハロゲン原子(例、フッ素原子、塩素原子、臭素原子、ヨウ素原子);あるいは
(12) オキソで置換されていてもよいC3−10シクロアルカン(例、シクロヘプタン)と縮合したC6−14アリール(例、フェニル)(具体例、5−オキソテトラヒドロベンゾアヌレン−2−イル)で置換されたヒドロキシ;
であり、
Xが、=N−であり、
Zが、水素原子、または1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル(例、メチル)であるか、
あるいは、Xが=C(Z)−である場合、ZとR6が結合して、それらが結合する炭素原子と共に、それぞれ1〜3個のC1−6アルキルで置換されていてもよい、芳香族炭化水素(例、ベンゼン)または複素環(例、ジヒドロフラン、イミダゾール)を形成してもよい化合物。
Zが、水素原子、または1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル(例、メチル)であるか、
あるいは、Xが=C(Z)−である場合、ZとR6が結合して、それらが結合する炭素原子と共に、それぞれ1〜3個のC1−6アルキルで置換されていてもよい、芳香族炭化水素(例、ベンゼン)または複素環(例、ジヒドロフラン、イミダゾール)を形成してもよい化合物。
具体的には、4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミドが好ましい例としてあげられる。
化合物(I)における塩としては、薬理学的に許容される塩が好ましく、このような塩としては、例えば、無機塩基との塩、有機塩基との塩、無機酸との塩、有機酸との塩、塩基性または酸性アミノ酸との塩等が挙げられる。
無機塩基との塩の好適な例としては、ナトリウム塩、カリウム塩等のアルカリ金属塩;カルシウム塩、マグネシウム塩等のアルカリ土類金属塩;アルミニウム塩;アンモニウム塩等が挙げられる。
有機塩基との塩の好適な例としては、トリメチルアミン、トリエチルアミン、ピリジン、ピコリン、エタノールアミン、ジエタノールアミン、トリエタノールアミン、ジシクロヘキシルアミン、N,N−ジベンジルエチレンジアミン等との塩が挙げられる。
無機酸との塩の好適な例としては、塩酸、臭化水素酸、硝酸、硫酸、リン酸等との塩が挙げられる。
有機酸との塩の好適な例としては、ギ酸、酢酸、トリフルオロ酢酸、フマル酸、シュウ酸、酒石酸、マレイン酸、クエン酸、コハク酸、リンゴ酸、メタンスルホン酸、ベンゼンスルホン酸、p−トルエンスルホン酸等との塩が挙げられる。
塩基性アミノ酸との塩の好適な例としては、アルギニン、リジン、オルニチン等との塩が挙げられる。
酸性アミノ酸との塩の好適な例としては、アスパラギン酸、グルタミン酸等との塩が挙げられる。
無機塩基との塩の好適な例としては、ナトリウム塩、カリウム塩等のアルカリ金属塩;カルシウム塩、マグネシウム塩等のアルカリ土類金属塩;アルミニウム塩;アンモニウム塩等が挙げられる。
有機塩基との塩の好適な例としては、トリメチルアミン、トリエチルアミン、ピリジン、ピコリン、エタノールアミン、ジエタノールアミン、トリエタノールアミン、ジシクロヘキシルアミン、N,N−ジベンジルエチレンジアミン等との塩が挙げられる。
無機酸との塩の好適な例としては、塩酸、臭化水素酸、硝酸、硫酸、リン酸等との塩が挙げられる。
有機酸との塩の好適な例としては、ギ酸、酢酸、トリフルオロ酢酸、フマル酸、シュウ酸、酒石酸、マレイン酸、クエン酸、コハク酸、リンゴ酸、メタンスルホン酸、ベンゼンスルホン酸、p−トルエンスルホン酸等との塩が挙げられる。
塩基性アミノ酸との塩の好適な例としては、アルギニン、リジン、オルニチン等との塩が挙げられる。
酸性アミノ酸との塩の好適な例としては、アスパラギン酸、グルタミン酸等との塩が挙げられる。
化合物(I)のプロドラッグは、生体内における生理条件下で酵素や胃酸等による反応により化合物(I)に変換する化合物、すなわち酵素的に酸化、還元、加水分解等を起こして化合物(I)に変化する化合物、胃酸等により加水分解等を起こして化合物(I)に変化する化合物である。化合物(I)のプロドラッグとしては、化合物(I)のアミノがアシル化、アルキル化、リン酸化された化合物(例、化合物(I)のアミノがエイコサノイル化、アラニル化、ペンチルアミノカルボニル化、(5−メチル−2−オキソ−1,3−ジオキソレン−4−イル)メトキシカルボニル化、テトラヒドロフラニル化、ピロリジルメチル化、ピバロイルオキシメチル化、tert−ブチル化された化合物);化合物(I)のヒドロキシがアシル化、アルキル化、リン酸化、ホウ酸化された化合物(例、化合物(I)のヒドロキシがアセチル化、パルミトイル化、プロパノイル化、ピバロイル化、サクシニル化、フマリル化、アラニル化、ジメチルアミノメチルカルボニル化された化合物);化合物(I)のカルボキシがエステル化、アミド化された化合物(例、化合物(I)のカルボキシがエチルエステル化、フェニルエステル化、カルボキシメチルエステル化、ジメチルアミノメチルエステル化、ピバロイルオキシメチルエステル化、エトキシカルボニルオキシエチルエステル化、フタリジルエステル化、(5−メチル−2−オキソ−1,3−ジオキソレン−4−イル)メチルエステル化、シクロヘキシルオキシカルボニルエチルエステル化、メチルアミド化された化合物)等が挙げられる。これらの化合物は自体公知の方法によって化合物(I)から製造することができる。
また、化合物(I)のプロドラッグは、広川書店1990年刊「医薬品の開発」第7巻分子設計163頁から198頁に記載されているような、生理的条件で化合物(I)に変化するものであってもよい。
また、化合物(I)は、同位元素(例、3H、14C、35S、125I)等で標識されていてもよい。
さらに、化合物(I)は、無水物であっても、水和物であってもよい。
また、化合物(I)のプロドラッグは、広川書店1990年刊「医薬品の開発」第7巻分子設計163頁から198頁に記載されているような、生理的条件で化合物(I)に変化するものであってもよい。
また、化合物(I)は、同位元素(例、3H、14C、35S、125I)等で標識されていてもよい。
さらに、化合物(I)は、無水物であっても、水和物であってもよい。
化合物(I)またはそのプロドラッグ(以下、単に本発明化合物と略記することがある)は、毒性が低く、そのまま、または薬理学的に許容し得る担体等と混合して医薬組成物とすることにより、哺乳動物(例、ヒト、マウス、ラット、ウサギ、イヌ、ネコ、ウシ、ウマ、ブタ、サル)に対して、後述する各種疾患の予防または治療剤として用いることができる。
ここにおいて、薬理学的に許容される担体としては、製剤素材として慣用の各種有機あるいは無機担体物質が用いられ、固形製剤における賦形剤、滑沢剤、結合剤、崩壊剤;液状製剤における溶剤、溶解補助剤、懸濁化剤、等張化剤、緩衝剤、無痛化剤等として配合される。また必要に応じて、防腐剤、抗酸化剤、着色剤、甘味剤等の製剤添加物を用いることもできる。
賦形剤の好適な例としては、乳糖、白糖、D−マンニトール、D−ソルビトール、デンプン、α化デンプン、デキストリン、結晶セルロース、低置換度ヒドロキシプロピルセルロース、カルボキシメチルセルロースナトリウム、アラビアゴム、プルラン、軽質無水ケイ酸、合成ケイ酸アルミニウム、メタケイ酸アルミン酸マグネシウム等が挙げられる。
滑沢剤の好適な例としては、ステアリン酸マグネシウム、ステアリン酸カルシウム、タルク、コロイドシリカ等が挙げられる。
結合剤の好適な例としては、α化デンプン、ショ糖、ゼラチン、アラビアゴム、メチルセルロース、カルボキシメチルセルロース、カルボキシメチルセルロースナトリウム、結晶セルロース、白糖、D−マンニトール、トレハロース、デキストリン、プルラン、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン等が挙げられる。
崩壊剤の好適な例としては、乳糖、白糖、デンプン、カルボキシメチルセルロース、カルボキシメチルセルロースカルシウム、クロスカルメロースナトリウム、カルボキシメチルスターチナトリウム、軽質無水ケイ酸、低置換度ヒドロキシプロピルセルロース等が挙げられる。
ここにおいて、薬理学的に許容される担体としては、製剤素材として慣用の各種有機あるいは無機担体物質が用いられ、固形製剤における賦形剤、滑沢剤、結合剤、崩壊剤;液状製剤における溶剤、溶解補助剤、懸濁化剤、等張化剤、緩衝剤、無痛化剤等として配合される。また必要に応じて、防腐剤、抗酸化剤、着色剤、甘味剤等の製剤添加物を用いることもできる。
賦形剤の好適な例としては、乳糖、白糖、D−マンニトール、D−ソルビトール、デンプン、α化デンプン、デキストリン、結晶セルロース、低置換度ヒドロキシプロピルセルロース、カルボキシメチルセルロースナトリウム、アラビアゴム、プルラン、軽質無水ケイ酸、合成ケイ酸アルミニウム、メタケイ酸アルミン酸マグネシウム等が挙げられる。
滑沢剤の好適な例としては、ステアリン酸マグネシウム、ステアリン酸カルシウム、タルク、コロイドシリカ等が挙げられる。
結合剤の好適な例としては、α化デンプン、ショ糖、ゼラチン、アラビアゴム、メチルセルロース、カルボキシメチルセルロース、カルボキシメチルセルロースナトリウム、結晶セルロース、白糖、D−マンニトール、トレハロース、デキストリン、プルラン、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン等が挙げられる。
崩壊剤の好適な例としては、乳糖、白糖、デンプン、カルボキシメチルセルロース、カルボキシメチルセルロースカルシウム、クロスカルメロースナトリウム、カルボキシメチルスターチナトリウム、軽質無水ケイ酸、低置換度ヒドロキシプロピルセルロース等が挙げられる。
溶剤の好適な例としては、注射用水、生理的食塩水、リンゲル液、アルコール、プロピレングリコール、ポリエチレングリコール、ゴマ油、トウモロコシ油、オリーブ油、綿実油等が挙げられる。
溶解補助剤の好適な例としては、ポリエチレングリコール、プロピレングリコール、D−マンニトール、トレハロース、安息香酸ベンジル、エタノール、トリスアミノメタン、コレステロール、トリエタノールアミン、炭酸ナトリウム、クエン酸ナトリウム、サリチル酸ナトリウム、酢酸ナトリウム等が挙げられる。
懸濁化剤の好適な例としては、ステアリルトリエタノールアミン、ラウリル硫酸ナトリウム、ラウリルアミノプロピオン酸、レシチン、塩化ベンザルコニウム、塩化ベンゼトニウム、モノステアリン酸グリセリン等の界面活性剤;例えば、ポリビニルアルコール、ポリビニルピロリドン、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシメチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース等の親水性高分子;ポリソルベート類、ポリオキシエチレン硬化ヒマシ油等が挙げられる。
等張化剤の好適な例としては、塩化ナトリウム、グリセリン、D−マンニトール、D−ソルビトール、ブドウ糖等が挙げられる。
緩衝剤の好適な例としては、リン酸塩、酢酸塩、炭酸塩、クエン酸塩等の緩衝液等が挙げられる。
無痛化剤の好適な例としては、ベンジルアルコール等が挙げられる。
防腐剤の好適な例としては、パラオキシ安息香酸エステル類、クロロブタノール、ベンジルアルコール、フェネチルアルコール、デヒドロ酢酸、ソルビン酸等が挙げられる。
抗酸化剤の好適な例としては、亜硫酸塩、アスコルビン酸塩等が挙げられる。
着色剤の好適な例としては、水溶性食用タール色素(例、食用赤色2号および3号、食用黄色4号および5号、食用青色1号および2号等の食用色素)、水不溶性レーキ色素(例、前記水溶性食用タール色素のアルミニウム塩)、天然色素(例、β−カロチン、クロロフィル、ベンガラ)等が挙げられる。
甘味剤の好適な例としては、サッカリンナトリウム、グリチルリチン酸二カリウム、アスパルテーム、ステビア等が挙げられる。
溶解補助剤の好適な例としては、ポリエチレングリコール、プロピレングリコール、D−マンニトール、トレハロース、安息香酸ベンジル、エタノール、トリスアミノメタン、コレステロール、トリエタノールアミン、炭酸ナトリウム、クエン酸ナトリウム、サリチル酸ナトリウム、酢酸ナトリウム等が挙げられる。
懸濁化剤の好適な例としては、ステアリルトリエタノールアミン、ラウリル硫酸ナトリウム、ラウリルアミノプロピオン酸、レシチン、塩化ベンザルコニウム、塩化ベンゼトニウム、モノステアリン酸グリセリン等の界面活性剤;例えば、ポリビニルアルコール、ポリビニルピロリドン、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシメチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース等の親水性高分子;ポリソルベート類、ポリオキシエチレン硬化ヒマシ油等が挙げられる。
等張化剤の好適な例としては、塩化ナトリウム、グリセリン、D−マンニトール、D−ソルビトール、ブドウ糖等が挙げられる。
緩衝剤の好適な例としては、リン酸塩、酢酸塩、炭酸塩、クエン酸塩等の緩衝液等が挙げられる。
無痛化剤の好適な例としては、ベンジルアルコール等が挙げられる。
防腐剤の好適な例としては、パラオキシ安息香酸エステル類、クロロブタノール、ベンジルアルコール、フェネチルアルコール、デヒドロ酢酸、ソルビン酸等が挙げられる。
抗酸化剤の好適な例としては、亜硫酸塩、アスコルビン酸塩等が挙げられる。
着色剤の好適な例としては、水溶性食用タール色素(例、食用赤色2号および3号、食用黄色4号および5号、食用青色1号および2号等の食用色素)、水不溶性レーキ色素(例、前記水溶性食用タール色素のアルミニウム塩)、天然色素(例、β−カロチン、クロロフィル、ベンガラ)等が挙げられる。
甘味剤の好適な例としては、サッカリンナトリウム、グリチルリチン酸二カリウム、アスパルテーム、ステビア等が挙げられる。
前記医薬組成物の剤形としては、例えば、錠剤(舌下錠、口腔内崩壊錠を含む)、カプセル剤(ソフトカプセル、マイクロカプセルを含む)、顆粒剤、散剤、トローチ剤、シロップ剤、乳剤、懸濁剤等の経口剤;および注射剤(例、皮下注射剤、静脈内注射剤、筋肉内注射剤、腹腔内注射剤、点滴剤)、外用剤(例、経皮製剤、軟膏剤)、坐剤(例、直腸坐剤、膣坐剤)、ペレット、経鼻剤、経肺剤(吸入剤)、点眼剤等の非経口剤が挙げられ、これらはそれぞれ経口的あるいは非経口的に安全に投与できる。
これらの製剤は、速放性製剤または徐放性製剤等の放出制御製剤(例、徐放性マイクロカプセル)であってもよい。
医薬組成物は、製剤技術分野において慣用の方法、例えば、日本薬局方に記載の方法等により製造することができる。
なお、医薬組成物中の本発明化合物の含量は、剤形、本発明化合物の投与量等により異なるが、例えば、約0.1〜100重量%である。
これらの製剤は、速放性製剤または徐放性製剤等の放出制御製剤(例、徐放性マイクロカプセル)であってもよい。
医薬組成物は、製剤技術分野において慣用の方法、例えば、日本薬局方に記載の方法等により製造することができる。
なお、医薬組成物中の本発明化合物の含量は、剤形、本発明化合物の投与量等により異なるが、例えば、約0.1〜100重量%である。
本発明化合物は、優れたASK1阻害作用を示すことから、これらの作用に基づく安全な医薬品としても有用である。
例えば、本発明化合物を含有してなる医薬は、哺乳動物(例えば、マウス、ラット、ハムスター、ウサギ、ネコ、イヌ、ウシ、ヒツジ、サル、ヒト等)に対して、アポトーシスまたは炎症関連疾患の予防・治療に有効である。ここで「アポトーシスまたは炎症関連疾患」とは、アポトーシス誘導もしくは炎症性サイトカイン産生の不全または異常亢進に起因するか、あるいは結果としてそのような状態を生じる疾患または病態をいう。
例えば、本発明化合物を含有してなる医薬は、哺乳動物(例えば、マウス、ラット、ハムスター、ウサギ、ネコ、イヌ、ウシ、ヒツジ、サル、ヒト等)に対して、アポトーシスまたは炎症関連疾患の予防・治療に有効である。ここで「アポトーシスまたは炎症関連疾患」とは、アポトーシス誘導もしくは炎症性サイトカイン産生の不全または異常亢進に起因するか、あるいは結果としてそのような状態を生じる疾患または病態をいう。
「アポトーシスまたは炎症関連疾患」としては、アポトーシス誘導もしくは炎症性サイトカイン産生の異常亢進に関連する疾患、例えば、ウイルス感染症(例、AIDS、インフルエンザ、不明熱等)、内分泌疾患(例、ホルモン欠乏症、サイトカイン欠乏症等)、血液疾患(例、血球減少症、腎性貧血等)、臓器形成不全(例、甲状腺萎縮、口蓋裂等)、移植臓器拒絶、移植片対宿主病、免疫不全、神経変性疾患(例、ポリグルタミン病、アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症、プリオン病、小脳変性症、クロイツフェルト−ヤコブ病、ハンチントン舞踏病、多発性硬化症、脊髄小脳失調症等)、精神疾患(例、統合失調症、うつ病、不安障害等)、脳血管障害(例、脳血栓症、脳塞栓症、一過性脳虚血発作等)、放射線障害、紫外線障害(例、日焼け等)、中毒性疾患(例、重金属による腎尿細管細胞傷害、アルコールによる肝細胞傷害等)、栄養障害(例、ビタミン、微量元素欠乏による胸腺の萎縮等)、炎症性疾患(例、急性膵炎、関節炎、歯周病、大腸炎、慢性閉塞性肺疾患(COPD)等)、虚血性神経障害、血管系疾患(例、動脈硬化等)、呼吸器系疾患(例、間質性肺炎、肺繊維症等)、軟骨疾患(例、変形性関節炎等)などが挙げられる。
また、「アポトーシスまたは炎症関連疾患」としては、アポトーシス誘導もしくは炎症性サイトカイン産生の不全に関連する疾患、例えば、癌(例、白血病、食道癌、胃癌、大腸癌、直腸癌、肺癌、肝臓癌、腎臓癌、乳癌、子宮癌、卵巣癌、前立腺癌、メラノーマ、骨髄腫、骨肉腫、脳腫瘍等)、自己免疫疾患(例、全身性エリテマトーデス、強皮症、慢性関節リウマチ、シェーグレン症候群、多発性硬化症、1型糖尿病、乾癬、潰瘍性大腸炎、特発性血小板減少性紫斑病、クローン病、糸球体腎炎等)、ウイルス感染症(例、出血熱、T細胞白血病、カポジ肉腫、伝染性単核症、リンパ腫、上咽頭癌、子宮頚癌、皮膚癌、肝炎、肝癌等)、内分泌疾患(例、ホルモン過剰症、サイトカイン過剰症等)、血液疾患(例、血球増加症、B細胞リンパ腫、多血症等)、臓器過形成(例、半陰陽、停留睾丸、奇形腫、腎芽細胞癌、多発性嚢胞腎、心・大動脈奇形、合指症等)、血管形成術後再狭窄、癌切除術後の再発なども挙げられる。
本発明化合物は、糖尿病(例、1型糖尿病、2型糖尿病、妊娠糖尿病)およびその合併症(例、糖尿病性腎症、糖尿病網膜症、糖尿病性神経障害等)、肥満症、ならびに耐糖能不全の予防・治療に特に有効である。また、本発明化合物は、心不全(うっ血性心不全など)、虚血性脳疾患(例、脳梗塞、脳卒中等)、虚血性心疾患(例、狭心症、心筋梗塞等)、貧血(ファンコーニ貧血など)、および高血圧(本態性高血圧、肺高血圧など)の予防・治療にも有効である。
ここで、上記疾患の「予防」とは、例えば、当該疾患に関連する何らかの因子により、発症の危険性が高いと予想される当該疾患を発症していない患者あるいは発症しているが自覚症状のない患者に対し、本発明の化合物を含む医薬を投与すること、あるいは当該疾患治療後、当該疾患の再発が懸念される患者に対し、本発明の化合物を含む医薬を投与することを意味する。
本発明化合物の投与量は、投与対象、投与ルート、対象疾患、症状等によっても異なるが、例えば、成人の糖尿病患者に経口投与する場合、通常1回量として約0.01〜100mg/kg体重、好ましくは0.05〜30mg/kg体重、さらに好ましくは0.1〜10mg/kg体重であり、この量を1日1回〜3回投与するのが望ましい。
本発明化合物は、糖尿病治療剤、糖尿病性合併症治療剤、高脂血症治療剤、降圧剤、抗肥満剤、利尿剤、化学療法剤、免疫療法剤、抗血栓剤、骨粗鬆症治療剤、抗痴呆剤、勃起不全改善剤、尿失禁・頻尿治療剤、排尿困難治療剤等の薬剤(以下、併用薬剤と略記する)と組み合わせて用いることができる。この際、本発明化合物と併用薬剤の投与時期は限定されず、これらを投与対象に対し、同時に投与してもよいし、時間差をおいて投与してもよい。さらに、本発明化合物と併用薬剤とは、それぞれの活性成分を含む2種類の製剤として投与されてもよいし、両方の活性成分を含む単一の製剤として投与されてもよい。
併用薬剤の投与量は、臨床上用いられている用量を基準として適宜選択することができる。また、本発明化合物と併用薬剤の配合比は、投与対象、投与ルート、対象疾患、症状、組み合わせ等により適宜選択することができる。例えば、投与対象がヒトである場合、本発明化合物1重量部に対し、併用薬剤を0.01〜100重量部用いればよい。
併用薬剤の投与量は、臨床上用いられている用量を基準として適宜選択することができる。また、本発明化合物と併用薬剤の配合比は、投与対象、投与ルート、対象疾患、症状、組み合わせ等により適宜選択することができる。例えば、投与対象がヒトである場合、本発明化合物1重量部に対し、併用薬剤を0.01〜100重量部用いればよい。
なお、糖尿病治療剤としては、例えばインスリン製剤(例、ウシ、ブタの膵臓から抽出された動物インスリン製剤;大腸菌またはイーストを用い、遺伝子工学的に合成したヒトインスリン製剤;インスリン亜鉛;プロタミンインスリン亜鉛;インスリンのフラグメントまたは誘導体(例、INS-1)、経口インスリン製剤)、インスリン抵抗性改善剤(例、ピオグリタゾンまたはその塩(好ましくは塩酸塩)、ロシグリタゾンまたはその塩(好ましくはマレイン酸塩)、ネトグリタゾン(Netoglitazone)、エダグリタゾン(Edaglitazone)(BM-13.1258)、リボグリタゾン(Rivoglitazone)(CS-011)、FK-614、WO01/38325に記載の化合物、テサグリタザール(Tesaglitazar)(AZ−242)、ラガグリタザール(Ragaglitazar)(NN-622)、ムラグリタザール(Muraglitazar)(BMS-298585)、メタグリダセン(Metaglidasen)(MBX-102)、ナベグリタザール(Naveglitazar)(LY-519818)、MX-6054、LY-510929、バラグリタゾン(Balaglitazone)(NN-2344)、T-131またはその塩、THR-0921)、PPARγアゴニスト、PPARγアンタゴニスト、PPARγ/αデュアルアゴニスト、α−グルコシダーゼ阻害剤(例、ボグリボース、アカルボース、ミグリトール、エミグリテート)、ビグアナイド剤(例、フェンホルミン、メトホルミン、ブホルミンまたはそれらの塩(例、塩酸塩、フマール酸塩、コハク酸塩))、インスリン分泌促進剤[スルホニルウレア剤(例、トルブタミド、グリベンクラミド、グリクラジド、クロルプロパミド、トラザミド、アセトヘキサミド、グリクロピラミド、グリメピリド、グリピザイド、グリブゾール)、レパグリニド、セナグリニド、ナテグリニド、ミチグリニドまたはそのカルシウム塩水和物]、GPR40アゴニスト、GLP-1受容体アゴニスト[例、GLP-1、GLP-1MR剤、NN-2211、AC-2993(exendin-4)、BIM-51077、Aib(8,35)hGLP-1(7,37)NH2、CJC-1131]、アミリンアゴニスト(例、プラムリンチド)、フォスフォチロシンフォスファターゼ阻害剤(例、バナジン酸ナトリウム)、ジペプチジルペプチダーゼIV阻害剤(例、NVP-DPP-278、PT-100、P32/98、アログリプチン ベンゾエート (Alogliptin benzoate)、ヴィルダグリプチン(Vildagliptin)(LAF-237)、P93/01、TS-021、シタグリプチン フォスフェート(Sitagliptin phosphate)(MK-431)、サクサグリプチン(Saxagliptin)(BMS-477118) 、E-3024、T-6666(TA-6666)、823093、825964、815541)、β3アゴニスト(例、AJ-9677)、糖新生阻害剤(例、グリコーゲンホスホリラーゼ阻害剤、グルコース−6−ホスファターゼ阻害剤、グルカゴン拮抗剤)、SGLT(sodium-glucose cotransporter)阻害剤(例、T-1095)、11β-HSD1阻害薬(例、BVT-3498)、アジポネクチンまたはその作動薬、IKK阻害薬(例、AS-2868)、レプチン抵抗性改善薬、ソマトスタチン受容体作動薬(例、WO01/25228、WO03/42204、WO98/44921、WO98/45285、WO99/22735に記載の化合物)等が挙げられる。
糖尿病性合併症治療剤としては、例えば、アルドース還元酵素阻害剤(例、トルレスタット、エパルレスタット、ゼナレスタット、ゾポルレスタット、ミナルレスタット、フィダレスタット、CT-112)、神経栄養因子およびその増加薬(例、NGF、NT-3、BDNF、WO01/14372に記載のニューロトロフィン産生・分泌促進剤(例、4−(4−クロロフェニル)−2−(2−メチル−1−イミダゾリル)−5−[3−(2−メチルフェノキシ)プロピル]オキサゾール))、神経再生促進薬(例、Y-128)、PKC阻害剤(例、ルボキシスタウリン メシレート(ruboxistaurin mesylate))、AGE阻害剤(例、ALT946、ピマゲジン、N-フェナシルチアゾリウム ブロマイド(ALT766)、ALT-711、EXO-226、ピリドリン(Pyridorin)、ピリドキサミン)、活性酸素消去薬(例、チオクト酸)、脳血管拡張剤(例、チアプリド、メキシレチン)、ソマトスタチン受容体作動薬(例、BIM23190)、アポトーシスシグナルレギュレーティングキナーゼ−1(ASK−1)阻害薬が挙げられる。
高脂血症治療剤としては、例えば、HMG−CoA還元酵素阻害剤(例、プラバスタチン、シンバスタチン、ロバスタチン、アトルバスタチン、フルバスタチン、ピタバスタチン、ロスバスタチンまたはそれらの塩(例、ナトリウム塩、カルシウム塩))、スクアレン合成酵素阻害剤(例、WO97/10224に記載の化合物、例えば、N−[[(3R,5S)−1−(3−アセトキシ−2,2−ジメチルプロピル)−7−クロロ−5−(2,3−ジメトキシフェニル)−2−オキソ−1,2,3,5−テトラヒドロ−4,1−ベンズオキサゼピン−3−イル]アセチル]ピペリジン−4−酢酸)、フィブラート系化合物(例、ベザフィブラート、クロフィブラート、シムフィブラート、クリノフィブラート)、ACAT阻害剤(例、アバシマイブ(Avasimibe)、エフルシマイブ(Eflucimibe))、陰イオン交換樹脂(例、コレスチラミン)、プロブコール、ニコチン酸系薬剤(例、ニコモール(nicomol)、ニセリトロール(niceritrol))、イコサペント酸エチル、植物ステロール(例、ソイステロール(soysterol)、ガンマオリザノール(γ−oryzanol))等が挙げられる。
高脂血症治療剤としては、例えば、HMG−CoA還元酵素阻害剤(例、プラバスタチン、シンバスタチン、ロバスタチン、アトルバスタチン、フルバスタチン、ピタバスタチン、ロスバスタチンまたはそれらの塩(例、ナトリウム塩、カルシウム塩))、スクアレン合成酵素阻害剤(例、WO97/10224に記載の化合物、例えば、N−[[(3R,5S)−1−(3−アセトキシ−2,2−ジメチルプロピル)−7−クロロ−5−(2,3−ジメトキシフェニル)−2−オキソ−1,2,3,5−テトラヒドロ−4,1−ベンズオキサゼピン−3−イル]アセチル]ピペリジン−4−酢酸)、フィブラート系化合物(例、ベザフィブラート、クロフィブラート、シムフィブラート、クリノフィブラート)、ACAT阻害剤(例、アバシマイブ(Avasimibe)、エフルシマイブ(Eflucimibe))、陰イオン交換樹脂(例、コレスチラミン)、プロブコール、ニコチン酸系薬剤(例、ニコモール(nicomol)、ニセリトロール(niceritrol))、イコサペント酸エチル、植物ステロール(例、ソイステロール(soysterol)、ガンマオリザノール(γ−oryzanol))等が挙げられる。
降圧剤としては、例えば、アンジオテンシン変換酵素阻害剤(例、カプトプリル、エナラプリル、デラプリル)、アンジオテンシンII受容体拮抗剤(例、カンデサルタン シレキセチル、ロサルタン、エプロサルタン、バルサルタン、テルミサルタン、イルベサルタン、タソサルタン、1−[[2’−(2,5−ジヒドロ−5−オキソ−4H−1,2,4−オキサジアゾール−3−イル)ビフェニル−4−イル]メチル]−2−エトキシ−1H−ベンズイミダゾール−7−カルボン酸)、カルシウム拮抗剤(例、マニジピン、ニフェジピン、アムロジピン、エホニジピン、ニカルジピン)、カリウムチャンネル開口薬(例、レブクロマカリム、L-27152、AL 0671、NIP-121)、クロニジン等が挙げられる。
抗肥満剤としては、例えば、中枢性抗肥満薬(例、デキスフェンフルラミン、フェンフルラミン、フェンテルミン、シブトラミン、アンフェプラモン、デキサンフェタミン、マジンドール、フェニルプロパノールアミン、クロベンゾレックス;MCH受容体拮抗薬(例、SB-568849;SNAP-7941;WO01/82925およびWO01/87834に記載の化合物);ニューロペプチドY拮抗薬(例、CP-422935);カンナビノイド受容体拮抗薬(例、SR-141716、SR-147778);グレリン拮抗薬)、膵リパーゼ阻害薬(例、オルリスタット、ATL-962)、β3アゴニスト(例、AJ-9677)、ペプチド性食欲抑制薬(例、レプチン、CNTF(毛様体神経栄養因子))、コレシストキニンアゴニスト(例、リンチトリプト、FPL-15849)、摂食抑制薬(例、P-57)等が挙げられる。
抗肥満剤としては、例えば、中枢性抗肥満薬(例、デキスフェンフルラミン、フェンフルラミン、フェンテルミン、シブトラミン、アンフェプラモン、デキサンフェタミン、マジンドール、フェニルプロパノールアミン、クロベンゾレックス;MCH受容体拮抗薬(例、SB-568849;SNAP-7941;WO01/82925およびWO01/87834に記載の化合物);ニューロペプチドY拮抗薬(例、CP-422935);カンナビノイド受容体拮抗薬(例、SR-141716、SR-147778);グレリン拮抗薬)、膵リパーゼ阻害薬(例、オルリスタット、ATL-962)、β3アゴニスト(例、AJ-9677)、ペプチド性食欲抑制薬(例、レプチン、CNTF(毛様体神経栄養因子))、コレシストキニンアゴニスト(例、リンチトリプト、FPL-15849)、摂食抑制薬(例、P-57)等が挙げられる。
利尿剤としては、例えば、キサンチン誘導体(例、サリチル酸ナトリウムテオブロミン、サリチル酸カルシウムテオブロミン)、チアジド系製剤(例、エチアジド、シクロペンチアジド、トリクロルメチアジド、ヒドロクロロチアジド、ヒドロフルメチアジド、ベンチルヒドロクロロチアジド、ペンフルチジド、ポリチアジド、メチクロチアジド)、抗アルドステロン製剤(例、スピロノラクトン、トリアムテレン)、炭酸脱水酵素阻害剤(例、アセタゾラミド)、クロルベンゼンスルホンアミド系製剤(例、クロルタリドン、メフルシド、インダパミド)、アゾセミド、イソソルビド、エタクリン酸、ピレタニド、ブメタニド、フロセミド等が挙げられる。
化学療法剤としては、例えば、アルキル化剤(例、サイクロフォスファミド、イフォスファミド)、代謝拮抗剤(例、メソトレキセート、5−フルオロウラシルまたはその誘導体)、抗癌性抗生物質(例、マイトマイシン、アドリアマイシン)、植物由来抗癌剤(例、ビンクリスチン、ビンデシン、タキソール)、シスプラチン、カルボプラチン、エトポシド等が挙げられる。なかでも5−フルオロウラシル誘導体であるフルツロンあるいはネオフルツロン等が好ましい。
免疫療法剤としては、例えば、微生物または細菌成分(例、ムラミルジペプチド誘導体、ピシバニール)、免疫増強活性のある多糖類(例、レンチナン、シゾフィラン、クレスチン)、遺伝子工学的手法で得られるサイトカイン(例、インターフェロン、インターロイキン(IL))、コロニー刺激因子(例、顆粒球コロニー刺激因子、エリスロポエチン)等が挙げられ、なかでもIL−1、IL−2、IL−12等のインターロイキンが好ましい。
化学療法剤としては、例えば、アルキル化剤(例、サイクロフォスファミド、イフォスファミド)、代謝拮抗剤(例、メソトレキセート、5−フルオロウラシルまたはその誘導体)、抗癌性抗生物質(例、マイトマイシン、アドリアマイシン)、植物由来抗癌剤(例、ビンクリスチン、ビンデシン、タキソール)、シスプラチン、カルボプラチン、エトポシド等が挙げられる。なかでも5−フルオロウラシル誘導体であるフルツロンあるいはネオフルツロン等が好ましい。
免疫療法剤としては、例えば、微生物または細菌成分(例、ムラミルジペプチド誘導体、ピシバニール)、免疫増強活性のある多糖類(例、レンチナン、シゾフィラン、クレスチン)、遺伝子工学的手法で得られるサイトカイン(例、インターフェロン、インターロイキン(IL))、コロニー刺激因子(例、顆粒球コロニー刺激因子、エリスロポエチン)等が挙げられ、なかでもIL−1、IL−2、IL−12等のインターロイキンが好ましい。
抗血栓剤としては、例えば、ヘパリン(例、ヘパリンナトリウム、ヘパリンカルシウム、ダルテパリンナトリウム(dalteparin sodium))、ワルファリン(例、ワルファリンカリウム)、抗トロンビン薬(例、アルガトロバン(argatroban))、血栓溶解薬(例、ウロキナーゼ(urokinase)、チソキナーゼ(tisokinase)、アルテプラーゼ(alteplase)、ナテプラーゼ(nateplase)、モンテプラーゼ(monteplase)、パミテプラーゼ(pamiteplase))、血小板凝集抑制薬(例、塩酸チクロピジン(ticlopidine hydrochloride)、シロスタゾール(cilostazol)、イコサペント酸エチル、ベラプロストナトリウム(beraprost sodium)、塩酸サルポグレラート(sarpogrelate hydrochloride))等が挙げられる。
骨粗鬆症治療剤としては、例えば、アルファカルシドール(alfacalcidol)、カルシトリオール(calcitriol)、エルカトニン(elcatonin)、サケカルシトニン(calcitonin salmon)、エストリオール(estriol)、イプリフラボン(ipriflavone)、リセドロン酸二ナトリウム(risedronate disodium)、パミドロン酸二ナトリウム(pamidronate disodium)、アレンドロン酸ナトリウム水和物(alendronate sodium hydrate)、インカドロン酸二ナトリウム(incadronate disodium)等が挙げられる。
抗痴呆剤としては、例えば、タクリン(tacrine)、ドネペジル(donepezil)、リバスチグミン(rivastigmine)、ガランタミン(galanthamine)等が挙げられる。
勃起不全改善剤としては、例えば、アポモルフィン(apomorphine)、クエン酸シルデナフィル(sildenafil citrate)等が挙げられる。
尿失禁・頻尿治療剤としては、例えば、塩酸フラボキサート(flavoxate hydrochloride)、塩酸オキシブチニン(oxybutynin hydrochloride)、塩酸プロピベリン(propiverine hydrochloride)等が挙げられる。
排尿困難治療剤としては、例えば、アセチルコリンエステラーゼ阻害薬(例、ジスチグミン)等が挙げられる。
骨粗鬆症治療剤としては、例えば、アルファカルシドール(alfacalcidol)、カルシトリオール(calcitriol)、エルカトニン(elcatonin)、サケカルシトニン(calcitonin salmon)、エストリオール(estriol)、イプリフラボン(ipriflavone)、リセドロン酸二ナトリウム(risedronate disodium)、パミドロン酸二ナトリウム(pamidronate disodium)、アレンドロン酸ナトリウム水和物(alendronate sodium hydrate)、インカドロン酸二ナトリウム(incadronate disodium)等が挙げられる。
抗痴呆剤としては、例えば、タクリン(tacrine)、ドネペジル(donepezil)、リバスチグミン(rivastigmine)、ガランタミン(galanthamine)等が挙げられる。
勃起不全改善剤としては、例えば、アポモルフィン(apomorphine)、クエン酸シルデナフィル(sildenafil citrate)等が挙げられる。
尿失禁・頻尿治療剤としては、例えば、塩酸フラボキサート(flavoxate hydrochloride)、塩酸オキシブチニン(oxybutynin hydrochloride)、塩酸プロピベリン(propiverine hydrochloride)等が挙げられる。
排尿困難治療剤としては、例えば、アセチルコリンエステラーゼ阻害薬(例、ジスチグミン)等が挙げられる。
さらに、動物モデルや臨床で悪液質改善作用が認められている薬剤、すなわち、シクロオキシゲナーゼ阻害剤(例、インドメタシン)、プロゲステロン誘導体(例、メゲステロールアセテート)、糖質ステロイド(例、デキサメサゾン)、メトクロプラミド系薬剤、テトラヒドロカンナビノール系薬剤、脂肪代謝改善剤(例、エイコサペンタエン酸)、成長ホルモン、IGF−1、あるいは悪液質を誘導する因子であるTNF−α、LIF、IL−6、オンコスタチンMに対する抗体等も本発明化合物と併用することができる。
併用薬剤は、好ましくはインスリン製剤、インスリン抵抗性改善剤、α−グルコシダーゼ阻害剤、ビグアナイド剤、インスリン分泌促進剤(好ましくはスルホニルウレア剤)等である。
上記併用薬剤は、2種以上を適宜の割合で組み合せて用いてもよい。
本発明化合物が併用薬剤と組み合せて使用される場合には、お互いの剤の量は、それらの剤の反対効果を考えて安全な範囲内で低減できる。特に、インスリン抵抗性改善剤、インスリン分泌促進剤(好ましくはスルホニルウレア剤)およびビグアナイド剤は通常の投与量よりも低減できる。したがって、これらの剤により引き起こされるであろう反対効果は安全に防止できる。それに加えて、糖尿病性合併症治療剤、高脂血症治療剤、降圧剤の投与量は低減でき、その結果これらの剤により引き起こされるであろう反対効果は効果的に防止できる。
上記併用薬剤は、2種以上を適宜の割合で組み合せて用いてもよい。
本発明化合物が併用薬剤と組み合せて使用される場合には、お互いの剤の量は、それらの剤の反対効果を考えて安全な範囲内で低減できる。特に、インスリン抵抗性改善剤、インスリン分泌促進剤(好ましくはスルホニルウレア剤)およびビグアナイド剤は通常の投与量よりも低減できる。したがって、これらの剤により引き起こされるであろう反対効果は安全に防止できる。それに加えて、糖尿病性合併症治療剤、高脂血症治療剤、降圧剤の投与量は低減でき、その結果これらの剤により引き起こされるであろう反対効果は効果的に防止できる。
化合物(I)の製造法について、下記スキームを参照して説明するが、これらの製造方法に限定されるものでない。化合物(I)を合成するに際し、合成順序は以下に説明するものに限定されず、適宜工程を入れ替えて行ってもよい。
また、特に説明はなくとも、官能基変換を行うために下記工程以外にエステル化、アミド化、加水分解、還元、酸化などを行ってもよい。
さらに、反応の進行を促進させるために、例示した試薬以外の試薬を適宜用いることができる。
また、特に説明はなくとも、官能基変換を行うために下記工程以外にエステル化、アミド化、加水分解、還元、酸化などを行ってもよい。
さらに、反応の進行を促進させるために、例示した試薬以外の試薬を適宜用いることができる。
(式中、Rは、ハロゲン原子で置換されていてもよいC1−6アルキル(例、メチル、エチルなど)を示し、Pは、トルエンスルホニル、メチルスルホニルなどの保護基を示し、他の記号は前記と同義である。)
以下において、上記スキームの、式(I)、式(II)、式(III)、式(IV)、式(V)、式(VI)で表される化合物を、それぞれ、「化合物(I)」、「化合物(II)」、「化合物(III)」、「化合物(IV)」、「化合物(V)」、「化合物(VI)」と略記する。
以下において、上記スキームの、式(I)、式(II)、式(III)、式(IV)、式(V)、式(VI)で表される化合物を、それぞれ、「化合物(I)」、「化合物(II)」、「化合物(III)」、「化合物(IV)」、「化合物(V)」、「化合物(VI)」と略記する。
(閉環)
化合物(III)は、自体公知の方法、例えばジャーナル オブ メディシナル ケミストリー(J. Med. Chem.),21巻, 235頁(1978)などに記載の方法、またはこれらに準じた方法に従って製造することができる。詳しくは、化合物(III)は、化合物(II)と(ハロアセチル)カルバミン酸エステルを反応させることにより製造される(スキーム1)。
化合物(III)は、自体公知の方法、例えばジャーナル オブ メディシナル ケミストリー(J. Med. Chem.),21巻, 235頁(1978)などに記載の方法、またはこれらに準じた方法に従って製造することができる。詳しくは、化合物(III)は、化合物(II)と(ハロアセチル)カルバミン酸エステルを反応させることにより製造される(スキーム1)。
化合物(II)1モルに対し(ハロアセチル)カルバミン酸エステルを約1.0〜10.0モル、好ましくは約1.0〜5.0モル用いる。(ハロアセチル)カルバミン酸エステルとしては、例えば(クロロアセチル)カルバミン酸メチル、(ヨードアセチル)カルバミン酸メチルなどが挙げられる。
本反応は、反応に不活性な溶媒を用いて行うのが有利である。このような溶媒は、反応が進行する限り特に限定されないが、例えば、ジクロロメタン、クロロホルム、四塩化炭素、1,2−ジクロロエタンなどのハロゲン化炭化水素類;ベンゼン、トルエンなどの芳香族炭化水素類;テトラヒドロフラン、ジオキサン、1,2−ジメトキシエタンなどのエーテル類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミドなどのアミド類;アセトニトリル、プロピオニトリルなどのニトリル類;ジメチルスルホキシドなどのスルホキシド類;N,N,N’,N’,N’’,N’’−ヘキサメチル亜リン酸 トリアミドなどのリン酸アミド類;あるいはそれらの混合溶媒などが好ましい。
反応時間は、通常1時間〜60時間、好ましくは1時間〜24時間である。反応温度は通常−10〜200℃、好ましくは0〜150℃である。
生成物(III)は、反応液のままか、または粗製物として次の反応に用いることもできるが、常法に従って反応混合物から単離することもでき、例えば、洗浄、再結晶、蒸留、クロマトグラフィーなどの分離手段により容易に精製することができる。
また、化合物(III)は、自体公知の方法、例えば、ジャーナル オブ メディシナル ケミストリー(J. Med. Chem.),46巻, 4333頁(2003)やシンセシス(Synthesis),6巻, 867頁(1998)などに記載の方法、またはこれらに準じた方法に従って製造することができる。詳しくは、化合物(III)は、化合物(VI)と酸無水物を反応させることにより製造される(スキーム2)。化合物(VI)1モルに対し酸無水物を約1.0〜100.0モル、好ましくは約1.0〜10.0モル用いる。酸無水物としては、例えば無水トリフルオロ酢酸、無水酢酸などが挙げられる。
本反応は、反応に不活性な溶媒を用いて行うのが有利である。このような溶媒は、反応が進行する限り特に限定されないが、例えば、ジクロロメタン、クロロホルム、四塩化炭素、1,2−ジクロロエタンなどのハロゲン化炭化水素類;ベンゼン、トルエンなどの芳香族炭化水素類;テトラヒドロフラン、ジオキサン、1,2−ジメトキシエタンなどのエーテル類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミドなどのアミド類;アセトニトリル、プロピオニトリルなどのニトリル類;ジメチルスルホキシドなどのスルホキシド類;あるいはそれらの混合溶媒などが好ましい。
反応時間は、通常1時間〜60時間、好ましくは1時間〜24時間である。反応温度は、通常−10〜200℃、好ましくは0〜100℃である。
得られた化合物(III)は、反応液のままか、または粗製物として次の反応に用いることもできるが、常法に従って反応混合物から単離することもでき、例えば、洗浄、再結晶、蒸留、クロマトグラフィーなどの分離手段により容易に精製することができる。
(加水分解)
化合物(IV)は、化合物(III)のアミドを酸加水分解またはアルカリ加水分解することにより製造される(スキーム1および2)。
酸加水分解には、一般に、塩酸、硫酸などの鉱酸類や三塩化ホウ素、三臭化ホウ素などのルイス酸類、ルイス酸とチオールまたはスルフィドの併用、トリフルオロ酢酸、p−トルエンスルホン酸などの有機酸類が用いられる。
アルカリ加水分解には、水酸化ナトリウム、水酸化カリウム、水酸化バリウムなどの無機塩基類、炭酸ナトリウム、炭酸カリウムなどの塩基性塩類、ナトリウムメトキシド、ナトリウムエトキシド、カリウム第三ブトキシドなどの金属アルコキシド類、トリエチルアミン、イミダゾール、ホルムアミジンなどの有機塩基類などが用いられる。
これら酸および塩基は、化合物(III)1モルに対して約0.5〜10モル、好ましくは約0.5〜6.0モル用いる。
化合物(IV)は、化合物(III)のアミドを酸加水分解またはアルカリ加水分解することにより製造される(スキーム1および2)。
酸加水分解には、一般に、塩酸、硫酸などの鉱酸類や三塩化ホウ素、三臭化ホウ素などのルイス酸類、ルイス酸とチオールまたはスルフィドの併用、トリフルオロ酢酸、p−トルエンスルホン酸などの有機酸類が用いられる。
アルカリ加水分解には、水酸化ナトリウム、水酸化カリウム、水酸化バリウムなどの無機塩基類、炭酸ナトリウム、炭酸カリウムなどの塩基性塩類、ナトリウムメトキシド、ナトリウムエトキシド、カリウム第三ブトキシドなどの金属アルコキシド類、トリエチルアミン、イミダゾール、ホルムアミジンなどの有機塩基類などが用いられる。
これら酸および塩基は、化合物(III)1モルに対して約0.5〜10モル、好ましくは約0.5〜6.0モル用いる。
本反応は無溶媒で行うか、反応に不活性な溶媒を用いて行うのが有利である。このような溶媒は、反応が進行する限り特に限定されないが、例えば、メタノール、エタノール、プロパノールなどのアルコール類;ベンゼン、トルエンなどの芳香族炭化水素類;シクロヘキサン、ヘキサンなどの飽和炭化水素類;ギ酸、酢酸などの有機酸類;テトラヒドロフラン、ジオキサン、1,2−ジメトキシエタンなどのエーテル類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミドなどのアミド類;ジクロロメタン、クロロホルム、四塩化炭素、1,2−ジクロロエタンなどのハロゲン化炭化水素類;アセトニトリル、プロピオニトリルなどのニトリル類;アセトン、メチルエチルケトンなどのケトン類;ジメチルスルホキシドなどのスルホキシド類;水などの溶媒;あるいはそれらの混合溶媒などが好ましい。
反応時間は、通常10分〜60時間、好ましくは10分〜12時間である。反応温度は通常−10〜200℃、好ましくは0〜120℃である。
得られた化合物(IV)は、反応液のままか、または粗製物として次の反応に用いることもできるが、常法に従って反応混合物から単離することもでき、例えば、再結晶、蒸留、クロマトグラフィーなどの分離手段により容易に精製することができる。
(アシル化)
化合物(I)は、化合物(IV)と、カルボン酸、その塩またはその反応性誘導体とを反応させることにより製造される(スキーム1および2)。該カルボン酸としては、例えば、下式(VII)
化合物(I)は、化合物(IV)と、カルボン酸、その塩またはその反応性誘導体とを反応させることにより製造される(スキーム1および2)。該カルボン酸としては、例えば、下式(VII)
(式中、環AおよびR1は前記と同意義を示す。)で表される化合物が挙げられる。以下、式(VII)で表される化合物またはその塩を「化合物(VII)」と略記する。
化合物(VII)の反応性誘導体としては、例えば、酸ハロゲン化物(例、酸塩化物、酸臭化物)、酸アミド(例、ピラゾール、イミダゾール、ベンゾトリアゾールなどとの酸アミド)、酸無水物(例、無水酢酸、無水プロピオン酸、無水酪酸などのC1−6脂肪族カルボン酸無水物)、酸アジド、活性エステル(例、ジエトキシリン酸エステル、ジフェノキシリン酸エステル、p−ニトロフェニルエステル、2,4−ジニトロフェニルエステル、シアノメチルエステル、ペンタクロロフェニルエステル、N−ヒドロキシスクシンイミドとのエステル、N−ヒドロキシフタルイミドとのエステル、1−ヒドロキシベンゾトリアゾールとのエステル、6−クロロ−1−ヒドロキシベンゾトリアゾールとのエステル、1−ヒドロキシ−1H−2−ピリドンとのエステル)、活性チオエステル(例、2−ピリジルチオエステル、2−ベンゾチアゾリルチオエステル)などが用いられる。
また該反応性誘導体を用いる代わりに、化合物(VII)を適当な縮合剤の存在下、化合物(IV)と直接反応させても良い。このような縮合剤としては、例えば、N,N'−ジシクロヘキシルカルボジイミド、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド(WSC)塩酸塩などのN,N'−ジ置換カルボジイミド類;N,N'−カルボニルジイミダゾールなどのアゾライド類;N−エトキシカルボニル−2−エトキシ−1,2−ジヒドロキノリン、オキシ塩化リン、アルコキシアセチレンなどの脱水剤;2−クロロメチルピリジニウムヨージド、2−フルオロ−1−メチルピリジニウムヨージドなどの2−ハロゲノピリジニウム塩などが用いられる。これらの縮合剤を用いた場合、反応はカルボン酸の反応性誘導体を経て進行し得る。
化合物(VII)またはその反応性誘導体は、化合物(IV)1モルに対し、通常約1.0〜5.0モル、好ましくは約1.0〜2.0モル用いる。本反応は、反応に不活性な溶媒を用いて行うのが有利である。このような溶媒は、反応が進行する限り特に限定されないが、例えば、ジエチルエーテル、テトラヒドロフラン、ジオキサン、1,2−ジメトキシエタンなどのエーテル類;ベンゼン、トルエン、シクロヘキサンなどの炭化水素類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミドなどのアミド類;ジクロロメタン、クロロホルム、四塩化炭素、1,2−ジクロロエタンなどのハロゲン化炭化水素類;アセトニトリル、プロピオニトリルなどのニトリル類;ジメチルスルホキシドなどのスルホキシド類;水などの溶媒;あるいはそれらの混合溶媒などが好ましい。
カルボン酸の反応性誘導体として酸ハロゲン化物を用いる場合は、放出されるハロゲン化水素を反応系内から除去する目的で、脱酸剤の存在下に反応を行うことができる。このような脱酸剤としては、例えば、炭酸ナトリウム、炭酸カリウム、炭酸水素ナトリウムなどの塩基性塩類;ピリジン、ルチジンなどの芳香族アミン類;トリエチルアミン、トリプロピルアミン、トリブチルアミン、シクロヘキシルジメチルアミン、4−ジメチルアミノピリジン、N,N−ジメチルアニリン、N−メチルピペリジン、N−メチルピロリジン、N−メチルモルホリンなどの第3級アミン類などを加えておくのが望ましい。
反応時間は、用いる試薬や溶媒により異なるが、通常30分〜24時間、好ましくは30分〜4時間である。反応温度は、通常0〜100℃、好ましくは0〜70℃である。
あるいは、R6が1−イミダゾリルの場合、化合物(I)は、ジャーナル オブ ジ アメリカン ケミカル ソサイエティー(J. Am. Chem. Soc.),120巻, 12459頁(1998)及び、ジャーナル オブ ジ アメリカン ケミカル ソサイエティー(J. Am. Chem. Soc.),124巻, 7421頁(2002)などに記載の方法、またはこれらに準じた方法に従って製造することができる。また、R6が1−イミダゾリル以外の5員の複素環基の場合、化合物(I)は、ケミカル レビュー(Chem. Rev),95巻, 2457頁(1995)などに記載の方法、またはこれらに準じた方法に従って製造することができる。
得られた化合物(I)は、反応液のままか、または粗製物として次の反応に用いることもできるが、常法に従って反応混合物から単離することもでき、例えば洗浄、再結晶、蒸留、クロマトグラフィーなどの分離手段により容易に精製することができる。
(アルキル化)
化合物(VI)は、自体公知の方法、例えば、シンセシス(Synthesis),6巻, 867頁(1998)などに記載の方法、またはこれらに準じた方法に従って製造することができる(スキーム2)。化合物(VI)は、塩基の存在下、化合物(V)とハロアセトアミド(例えば、ブロモアセトアミド、ヨードアセトアミド)から製造される。
化合物(VI)は、自体公知の方法、例えば、シンセシス(Synthesis),6巻, 867頁(1998)などに記載の方法、またはこれらに準じた方法に従って製造することができる(スキーム2)。化合物(VI)は、塩基の存在下、化合物(V)とハロアセトアミド(例えば、ブロモアセトアミド、ヨードアセトアミド)から製造される。
化合物(V)1モルに対しハロアセトアミドを約1.0〜5.0モル、好ましくは約1.0〜2.0モル用いる。
塩基としては、例えば、水酸化ナトリウム、水酸化カリウムなどの無機塩基類;炭酸ナトリウム、炭酸カリウム、炭酸セシウム、炭酸水素ナトリウムなどの塩基性塩類;ピリジン、ルチジンなどの芳香族アミン類;トリエチルアミン、ジイソプロピルエチルアミン、トリプロピルアミン、トリブチルアミン、シクロヘキシルジメチルアミン、4−ジメチルアミノピリジン、N,N−ジメチルアニリン、N−メチルピペリジン、N−メチルピロリジン、N−メチルモルホリンなどの第3級アミン類などが挙げられる。これら塩基の使用量は、化合物(V)1モルに対し約1.0〜5.0モル、好ましくは約1.0〜2.0モル用いる。
本反応は、反応に不活性な溶媒を用いて行うのが有利である。このような溶媒は、反応が進行する限り特に限定されないが、例えば、ベンゼン、トルエンなどの芳香族炭化水素類;テトラヒドロフラン、ジオキサン、1,2−ジメトキシエタンなどのエーテル類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミドなどのアミド類;ジクロロメタン、クロロホルム、四塩化炭素、1,2−ジクロロエタンなどのハロゲン化炭化水素類;アセトニトリル、プロピオニトリルなどのニトリル類;ジメチルスルホキシドなどのスルホキシド類もしくはそれらの混合溶媒などが好ましい。
反応時間は、通常1時間〜60時間、好ましくは1時間〜24時間である。反応温度は、通常−10〜200℃、好ましくは0〜100℃である。
生成物(VI)は反応液のままか、または粗製物として次の反応に用いることもできるが、常法に従って反応混合物から単離することもでき、例えば、洗浄、再結晶、蒸留、クロマトグラフィーなどの分離手段により容易に精製することができる。
(保護)
化合物(V)は、自体公知の方法、例えば、シンセシス(Synthesis),6巻, 867頁(1998)などに記載の方法、またはこれらに準じた方法に従って製造することができる(スキーム2)。詳しくは、化合物(V)は、塩基の存在下、化合物(II)と塩化スルホニル(例えば、塩化p−トルエンスルホニル、塩化メチルスルホニルなど)から製造される。
化合物(V)は、自体公知の方法、例えば、シンセシス(Synthesis),6巻, 867頁(1998)などに記載の方法、またはこれらに準じた方法に従って製造することができる(スキーム2)。詳しくは、化合物(V)は、塩基の存在下、化合物(II)と塩化スルホニル(例えば、塩化p−トルエンスルホニル、塩化メチルスルホニルなど)から製造される。
化合物(V)1モルに対し塩化スルホニルを約1.0〜5.0モル、好ましくは約1.0〜2.0モル用いる。
塩基としては、例えば、水酸化ナトリウム、水酸化カリウムなどの無機塩基類;炭酸ナトリウム、炭酸カリウム、炭酸セシウム、炭酸水素ナトリウムなどの塩基性塩類;ピリジン、ルチジンなどの芳香族アミン類;トリエチルアミン、ジイソプロピルエチルアミン、トリプロピルアミン、トリブチルアミン、シクロヘキシルジメチルアミン、4−ジメチルアミノピリジン、N,N−ジメチルアニリン、N−メチルピペリジン、N−メチルピロリジン、N−メチルモルホリンなどの第3級アミン類などが挙げられる。これら塩基の使用量は、化合物(V)1モルに対し約1.0〜5.0モル、好ましくは約1.0〜2.0モル用いる。
本反応は、反応に不活性な溶媒を用いて行うのが有利である。このような溶媒は、反応が進行する限り特に限定されないが、例えば、ベンゼン、トルエンなどの芳香族炭化水素類;テトラヒドロフラン、ジオキサン、1,2−ジメトキシエタンなどのエーテル類;N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミドなどのアミド類;ジクロロメタン、クロロホルム、四塩化炭素、1,2−ジクロロエタンなどのハロゲン化炭化水素類;アセトニトリル、プロピオニトリルなどのニトリル類;ジメチルスルホキシドなどのスルホキシド類;あるいはそれらの混合溶媒などが好ましい。
反応時間は、通常1時間〜60時間、好ましくは1時間〜24時間である。反応温度は、通常−10〜200℃、好ましくは0〜100℃である。生成物(VI)は、反応液のままか、または粗製物として次の反応に用いることもできるが、常法に従って反応混合物から単離することもでき、洗浄、再結晶、蒸留、クロマトグラフィーなどの分離手段により容易に精製することができる。
上記の各製造法において、原料化合物または化合物(I)が、アミノ、カルボキシ、ヒドロキシまたはメルカプトを有する場合、これらの基にペプチド化学等で一般的に用いられるような保護基が導入されていてもよく、該保護基は各反応式の任意の工程において、通常の脱保護法により除去することができる。
また、上記の各製造法により得られる本発明化合物は、濃縮、減圧濃縮、溶媒抽出、晶出、再結晶、転溶、クロマトグラフィー等の公知の手段により単離精製することができる。また、上記の各製造法において用いられる各原料化合物は、前記と同様の公知の手段によって単離精製することができる。一方、これら原料化合物を単離することなく、そのまま反応混合物として、次の工程の原料として用いてもよい。
化合物(I)の製造に際し、原料化合物が塩を形成し得る場合には、該化合物を塩として用いてもよい。このような塩としては、例えば、化合物(I)の塩として例示したものが挙げられる。
化合物(I)が、光学異性体、立体異性体、位置異性体、回転異性体を含有する場合には、これらも化合物(I)として含有されるとともに、自体公知の合成手法、分離手法によりそれぞれを単品として得ることができる。例えば、化合物(I)に光学異性体が存在する場合には、該化合物から分割された光学異性体も本発明化合物に包含される。
化合物(I)は、結晶であってもよい。
化合物(I)の結晶は、化合物(I)に自体公知の結晶化法を適用して、結晶化することによって製造することができる。
化合物(I)の結晶は、物理化学的性質(例、融点、溶解度、安定性)および生物学的性質(例、体内動態(吸収性、分布、代謝、排泄)、薬効発現)に優れ、医薬として極めて有用である。
また、上記の各製造法により得られる本発明化合物は、濃縮、減圧濃縮、溶媒抽出、晶出、再結晶、転溶、クロマトグラフィー等の公知の手段により単離精製することができる。また、上記の各製造法において用いられる各原料化合物は、前記と同様の公知の手段によって単離精製することができる。一方、これら原料化合物を単離することなく、そのまま反応混合物として、次の工程の原料として用いてもよい。
化合物(I)の製造に際し、原料化合物が塩を形成し得る場合には、該化合物を塩として用いてもよい。このような塩としては、例えば、化合物(I)の塩として例示したものが挙げられる。
化合物(I)が、光学異性体、立体異性体、位置異性体、回転異性体を含有する場合には、これらも化合物(I)として含有されるとともに、自体公知の合成手法、分離手法によりそれぞれを単品として得ることができる。例えば、化合物(I)に光学異性体が存在する場合には、該化合物から分割された光学異性体も本発明化合物に包含される。
化合物(I)は、結晶であってもよい。
化合物(I)の結晶は、化合物(I)に自体公知の結晶化法を適用して、結晶化することによって製造することができる。
化合物(I)の結晶は、物理化学的性質(例、融点、溶解度、安定性)および生物学的性質(例、体内動態(吸収性、分布、代謝、排泄)、薬効発現)に優れ、医薬として極めて有用である。
本発明は更に、以下の参考例、実施例、製剤例および実験例によって詳しく説明されるが、これらは単なる例示であって、本発明を限定するものではなく、また本発明の範囲を逸脱しない範囲で変化させてもよい。
以下の参考例、実施例中の「室温」は、通常、約10℃ないし約35℃を示す。「%」は特記しない限り重量パーセントを示す。但し、収率はmol/mol%を示す。
以下の参考例、実施例中の「室温」は、通常、約10℃ないし約35℃を示す。「%」は特記しない限り重量パーセントを示す。但し、収率はmol/mol%を示す。
その他の本文中で用いられている略号は下記の意味を示す。
s:シングレット(singlet)
d:ダブレット(doublet)
t:トリプレット(triplet)
q:カルテット(quartet)
dd:ダブルダブレット(double doublet)
ddd:ダブルダブルダブレット(double double doublet)
dt:ダブルトリプレット(double triplet)
br:ブロード(broad)
J:カップリング定数(coupling constant)
Hz:ヘルツ(Hertz)
CDCl3:重クロロホルム
DMSO−d6:重ジメチルスルホキシド
CD3OD:重メタノール
1H−NMR:プロトン核磁気共鳴
o:オルト
m:メタ
p:パラ
n:ノルマル
DMF:N,N−ジメチルホルムアミド
THF:テトラヒドロフラン
NMP:1−メチル−2−ピロリジノン
DME:1,2−ジメトキシエタン
WSC:塩酸1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド
HOBt:1−ヒドロキシベンゾトリアゾール
DMAP:4−ジメチルアミノピリジン
s:シングレット(singlet)
d:ダブレット(doublet)
t:トリプレット(triplet)
q:カルテット(quartet)
dd:ダブルダブレット(double doublet)
ddd:ダブルダブルダブレット(double double doublet)
dt:ダブルトリプレット(double triplet)
br:ブロード(broad)
J:カップリング定数(coupling constant)
Hz:ヘルツ(Hertz)
CDCl3:重クロロホルム
DMSO−d6:重ジメチルスルホキシド
CD3OD:重メタノール
1H−NMR:プロトン核磁気共鳴
o:オルト
m:メタ
p:パラ
n:ノルマル
DMF:N,N−ジメチルホルムアミド
THF:テトラヒドロフラン
NMP:1−メチル−2−ピロリジノン
DME:1,2−ジメトキシエタン
WSC:塩酸1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド
HOBt:1−ヒドロキシベンゾトリアゾール
DMAP:4−ジメチルアミノピリジン
以下の実施例におけるLC/MS分析は、以下の条件により実施した。
測定機器:ウォーターズ社 LC/MSシステム
HPLC部:アジレント社 HP1100
MS部:マイクロマス社 ZMD
カラム:CAPCELL PAK c18UG120 S-3μm、1.5×35 mm(資生堂製)
溶媒:A液;0.05%トリフルオロ酢酸水溶液、B液;0.04%トリフルオロ酢酸アセトニトリル溶液
グラジェントサイクル:0分(A液/B液=90/10)、2.00分(A液/B液=5/95)、2.75分(A液/B液=5/95)、2.76分(A液/B液=90/10)、3.60分(A液/B液=90/10)
注入量:2μL、流速:0.5 mL/min、検出法:UV 220 nm
MS条件 イオン化法:ESI
測定機器:ウォーターズ社 LC/MSシステム
HPLC部:アジレント社 HP1100
MS部:マイクロマス社 ZMD
カラム:CAPCELL PAK c18UG120 S-3μm、1.5×35 mm(資生堂製)
溶媒:A液;0.05%トリフルオロ酢酸水溶液、B液;0.04%トリフルオロ酢酸アセトニトリル溶液
グラジェントサイクル:0分(A液/B液=90/10)、2.00分(A液/B液=5/95)、2.75分(A液/B液=5/95)、2.76分(A液/B液=90/10)、3.60分(A液/B液=90/10)
注入量:2μL、流速:0.5 mL/min、検出法:UV 220 nm
MS条件 イオン化法:ESI
以下の実施例における分取HLPCによる精製は以下の条件により実施した。
機器:ギルソン社ハイスループット精製システム
カラム:YMC CombiPrep ODS-A S-5μm、50×20 mm 又はYMC Hydrosphere C18 S-5μm
溶媒:A液;0.1% トリフルオロ酢酸水溶液、B液;0.1% トリフルオロ酢酸アセトニトリル溶液、又はA液;水、B液;アセトニトリル、又はA液;0.1% ギ酸水溶液、B液;0.1% ギ酸アセトニトリル溶液
代表的グラジェントサイクル:0分(A液/B液=98/2)、1.00分(A液/B液=98/2)、5.20分(A液/B液=0/100)、6.40分(A液/B液=0/100)、6.50分(A液/B液=98/2)、6.60分(A液/B液=98/2)
流速:25 mL/min、検出法:UV 220 nm
機器:ギルソン社ハイスループット精製システム
カラム:YMC CombiPrep ODS-A S-5μm、50×20 mm 又はYMC Hydrosphere C18 S-5μm
溶媒:A液;0.1% トリフルオロ酢酸水溶液、B液;0.1% トリフルオロ酢酸アセトニトリル溶液、又はA液;水、B液;アセトニトリル、又はA液;0.1% ギ酸水溶液、B液;0.1% ギ酸アセトニトリル溶液
代表的グラジェントサイクル:0分(A液/B液=98/2)、1.00分(A液/B液=98/2)、5.20分(A液/B液=0/100)、6.40分(A液/B液=0/100)、6.50分(A液/B液=98/2)、6.60分(A液/B液=98/2)
流速:25 mL/min、検出法:UV 220 nm
参考例1
4−(2−メトキシ−1,1−ジメチル−2−オキソエチル)安息香酸
4−(2−メトキシ−1,1−ジメチル−2−オキソエチル)安息香酸
過マンガン酸カリウム(94.5g,0.60mol)を2−メチル−2−(4−メチルフェニル)プロパン酸メチル(23.0g,0.12mol,J. Am. Chem. Soc., 2002, 124, 12557.)のピリジン(60mL)/水(575mL)混合溶液に加えた後、反応混合物を100℃で3時間攪拌した。反応液を室温まで放冷した後、不溶物をろ過し、ろ液を酢酸エチルで洗浄した。水層を6規定塩酸を用いて酸性にし、酢酸エチルで抽出した。抽出液を無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去し、表題化合物(収量14.5g,収率55%)を得た。
1H-NMR (DMSO-d6) δ: 1.52 (6H, s), 3.60 (3H, s), 7.43 (2H, d, J = 8.3 Hz), 7.91 (2H, d, J = 8.3 Hz), 12.92 (1H, br)。
元素分析値:C12H14O4として
計算値:C, 64.85; H, 6.35。
実測値:C, 64.57; H, 6.21。
1H-NMR (DMSO-d6) δ: 1.52 (6H, s), 3.60 (3H, s), 7.43 (2H, d, J = 8.3 Hz), 7.91 (2H, d, J = 8.3 Hz), 12.92 (1H, br)。
元素分析値:C12H14O4として
計算値:C, 64.85; H, 6.35。
実測値:C, 64.57; H, 6.21。
参考例2
4−(1−シアノ−1−メチルエチル)安息香酸
4−(1−シアノ−1−メチルエチル)安息香酸
2−メチル−2−(4−メチルフェニル)プロパンニトリル(24.0g,0.15mol,Tetrahedron, 2004, 60, 2843.)を用い、参考例1と同様にして反応を行い、表題化合物(収量7.8g,収率27%)を得た。
1H-NMR (DMSO-d6) δ: 1.71 (6H, s), 7.65 (2H, d, J = 8.7 Hz), 7.99 (2H, d, J = 8.7 Hz), 13.10 (1H, br)。
1H-NMR (DMSO-d6) δ: 1.71 (6H, s), 7.65 (2H, d, J = 8.7 Hz), 7.99 (2H, d, J = 8.7 Hz), 13.10 (1H, br)。
参考例3
4−(3−シアノ−1,1−ジメチルプロピル)安息香酸
4−(3−シアノ−1,1−ジメチルプロピル)安息香酸
4−メチル−4−(4−メチルフェニル)ペンタンニトリル(12.7g,68mmol,Tetrahedron Lett., 1977, 20, 1713.)を用い、参考例1と同様にして反応を行った。得られた粗結晶をジエチルエーテル/ヘキサンから再結晶することにより、表題化合物(収量7.3g,収率50%)を得た。
1H-NMR (CDCl3) δ: 1.40 (6H, s), 1.92-2.18 (4H, m), 7.42 (2H, d, J = 8.3 Hz), 8.08 (2H, d, J = 8.3 Hz), 13.10 (1H, br)。
1H-NMR (CDCl3) δ: 1.40 (6H, s), 1.92-2.18 (4H, m), 7.42 (2H, d, J = 8.3 Hz), 8.08 (2H, d, J = 8.3 Hz), 13.10 (1H, br)。
参考例4
3−メチル−3−(4−メチルフェニル)ブタン酸エチル
3−メチル−3−(4−メチルフェニル)ブタン酸エチル
3−メチル−3−(4−メチルフェニル)ブタン酸(11.6g,60mmol,Synth. Commun., 2001, 31, 679.)と濃硫酸(100μL)をエタノール(100mL)中、60℃で終夜攪拌した。反応液を室温まで放冷した後、減圧下溶媒を留去した。残渣に飽和炭酸水素ナトリウム水溶液を加えて酢酸エチルで抽出した。抽出液を無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去し、表題化合物(収量12.4g,収率93%)を得た。
1H-NMR (CDCl3) δ: 1.11 (3H, t, J = 7.2 Hz), 1.44 (6H, s), 2.31 (3H, s), 2.58 (2H, s), 3.99 (2H, q, J = 7.2 Hz), 7.11 (2H, d, J = 8.3 Hz), 7.25 (2H, d, J = 8.3 Hz)。
1H-NMR (CDCl3) δ: 1.11 (3H, t, J = 7.2 Hz), 1.44 (6H, s), 2.31 (3H, s), 2.58 (2H, s), 3.99 (2H, q, J = 7.2 Hz), 7.11 (2H, d, J = 8.3 Hz), 7.25 (2H, d, J = 8.3 Hz)。
参考例5
4−(3−エトキシ−1,1−ジメチル−3−オキソプロピル)安息香酸
4−(3−エトキシ−1,1−ジメチル−3−オキソプロピル)安息香酸
参考例4で得られた3−メチル−3−(4−メチルフェニル)ブタン酸エチル(12.4g,56mmol)を用い、参考例1と同様にして反応を行った。得られた残渣をシリカゲルカラムクロマトグラフィー(30−80% 酢酸エチル/ヘキサン)で精製することにより表題化合物(収量3.8g,収率23%)を得た。
1H-NMR (CDCl3) δ: 1.08 (3H, t, J = 7.2 Hz), 1.48 (6H, s), 2.66 (2H, s), 3.97 (2H, q, J = 7.2 Hz), 7.47 (2H, d, J = 8.3 Hz), 8.04 (2H, d, J = 8.3 Hz), hidden (1H)。
1H-NMR (CDCl3) δ: 1.08 (3H, t, J = 7.2 Hz), 1.48 (6H, s), 2.66 (2H, s), 3.97 (2H, q, J = 7.2 Hz), 7.47 (2H, d, J = 8.3 Hz), 8.04 (2H, d, J = 8.3 Hz), hidden (1H)。
参考例6
4−(4−エトキシ−1,1−ジメチル−4−オキソブチル)安息香酸
4−(4−エトキシ−1,1−ジメチル−4−オキソブチル)安息香酸
4−メチル−4−(4−メチルフェニル)ペンタン酸エチル(5.4g,25mmol,Tetrahedron Lett., 1994, 35, 3017.)を用い、参考例1と同様にして反応を行った。得られた残渣をシリカゲルカラムクロマトグラフィー(25−30% 酢酸エチル/ヘキサン)で精製することにより表題化合物(収量4.6g,収率75%)を得た。
1H-NMR (CDCl3) δ: 1.21 (3H, t, J = 7.1 Hz), 1.36 (6H, s), 2.00-2.04 (4H, m), 4.05 (2H, q, J = 7.1 Hz), 7.44 (2H, d, J = 8.7 Hz), 8.05 (2H, d, J = 8.7 Hz), hidden (1H)。
1H-NMR (CDCl3) δ: 1.21 (3H, t, J = 7.1 Hz), 1.36 (6H, s), 2.00-2.04 (4H, m), 4.05 (2H, q, J = 7.1 Hz), 7.44 (2H, d, J = 8.7 Hz), 8.05 (2H, d, J = 8.7 Hz), hidden (1H)。
参考例7
1−(4−メチルフェニル)シクロプロパンカルボン酸メチル
1−(4−メチルフェニル)シクロプロパンカルボン酸メチル
1−(4−メチルフェニル)シクロプロパンカルボン酸(1.0g,5.6mmol)と濃硫酸(60μL)をメタノール(60mL)中で1時間加熱還流した。反応液を室温まで放冷した後、減圧下溶媒を留去した。残渣に飽和炭酸水素ナトリウム水溶液を加えて酢酸エチルで抽出した。抽出液を無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去し、表題化合物(収量0.80g,収率80%)を得た。
1H-NMR (CDCl3) δ: 1.13-1.19 (2H, m), 1.54-1.60 (2H, m), 2.34 (3H, s), 3.62 (3H, s), 7.12 (2H, d, J = 8.0 Hz), 7.23 (2H, d, J = 8.0 Hz)。
1H-NMR (CDCl3) δ: 1.13-1.19 (2H, m), 1.54-1.60 (2H, m), 2.34 (3H, s), 3.62 (3H, s), 7.12 (2H, d, J = 8.0 Hz), 7.23 (2H, d, J = 8.0 Hz)。
参考例8
1−(4−メチルフェニル)シクロブタンカルボン酸メチル
1−(4−メチルフェニル)シクロブタンカルボン酸メチル
参考例7と同様にして、1−(4−メチルフェニル)シクロブタンカルボン酸(0.45g,2.3mmol,J. Org. Chem., 1998, 63, 3814.)を用い、表題化合物(収量0.53g,収率89%)を得た。
1H-NMR (DMSO-d6) δ: 1.69-2.01 (2H, s), 2.27 (3H, s), 2.33-2.47 (2H, m), 2.63-2.78 (2H, m), 3.55 (3H, s), 7.15 (4H, s)。
1H-NMR (DMSO-d6) δ: 1.69-2.01 (2H, s), 2.27 (3H, s), 2.33-2.47 (2H, m), 2.63-2.78 (2H, m), 3.55 (3H, s), 7.15 (4H, s)。
参考例9
1−(4−メチルフェニル)シクロペンタンカルボン酸メチル
1−(4−メチルフェニル)シクロペンタンカルボン酸メチル
参考例7と同様にして、1−(4−メチルフェニル)シクロペンタンカルボン酸(1.6g,7.5mmol)を用い、表題化合物(収量1.5g,収率93%)を得た。
1H-NMR (CDCl3) δ: 1.63-1.81 (4H, m), 1.81-1.99 (2H, m), 2.32 (3H, s), 2.56-2.69 (2H, m), 3.60 (3H, s), 7.11 (2H, d, J = 8.3 Hz), 7.25 (2H, d, J = 8.3 Hz)。
1H-NMR (CDCl3) δ: 1.63-1.81 (4H, m), 1.81-1.99 (2H, m), 2.32 (3H, s), 2.56-2.69 (2H, m), 3.60 (3H, s), 7.11 (2H, d, J = 8.3 Hz), 7.25 (2H, d, J = 8.3 Hz)。
参考例10
1−(4−メチルフェニル)シクロヘキサンカルボン酸メチル
1−(4−メチルフェニル)シクロヘキサンカルボン酸メチル
参考例7と同様にして、1−(4−メチルフェニル)シクロヘキサンカルボン酸(1.5g,6.5mmol)を用い、表題化合物(収量1.4g,収率91%)を得た。
1H-NMR (CDCl3) δ: 1.17-1.36 (1H, m), 1.36-1.55 (2H, m), 1.55-1.79 (5H, m), 2.31 (3H, s), 2.39-2.53 (2H, m), 3.63 (3H, s), 7.13 (2H, d, J = 8.3 Hz), 7.27 (2H, d, J = 8.3 Hz)。
1H-NMR (CDCl3) δ: 1.17-1.36 (1H, m), 1.36-1.55 (2H, m), 1.55-1.79 (5H, m), 2.31 (3H, s), 2.39-2.53 (2H, m), 3.63 (3H, s), 7.13 (2H, d, J = 8.3 Hz), 7.27 (2H, d, J = 8.3 Hz)。
参考例11
4−[1−(メトキシカルボニル)シクロプロピル]安息香酸
4−[1−(メトキシカルボニル)シクロプロピル]安息香酸
参考例7で得られた1−(4−メチルフェニル)シクロプロパンカルボン酸メチル(0.84g,4.3mmol)を用い、参考例1と同様にして反応を行った。得られた残渣をシリカゲルカラムクロマトグラフィー(40−50% 酢酸エチル/ヘキサン)で精製することにより表題化合物(収量0.29g,収率31%)を得た。
1H-NMR (DMSO-d6) δ: 1.23-1.26 (2H, m), 1.51-1.54 (2H, m), 3.56 (3H, s), 7.46 (2H, d, J = 8.2 Hz), 7.88 (2H, d, J = 8.2 Hz), 12.92 (1H, br)。
1H-NMR (DMSO-d6) δ: 1.23-1.26 (2H, m), 1.51-1.54 (2H, m), 3.56 (3H, s), 7.46 (2H, d, J = 8.2 Hz), 7.88 (2H, d, J = 8.2 Hz), 12.92 (1H, br)。
参考例12
4−[1−(メトキシカルボニル)シクロブチル]安息香酸
4−[1−(メトキシカルボニル)シクロブチル]安息香酸
参考例8で得られた1−(4−メチルフェニル)シクロブタンカルボン酸メチル(0.58g,2.8mmol)を用い、参考例1と同様にして反応を行った。得られた残渣をシリカゲルカラムクロマトグラフィー(40% 酢酸エチル/ヘキサン)で精製することにより表題化合物(収量0.48g,収率73%)を得た。
1H-NMR (DMSO-d6) δ: 1.74-1.91 (1H, m), 1.91-2.07 (1H, m), 2.40-2.53 (2H, m), 2.68-2.84 (2H, m), 3.59 (3H, s), 7.39 (2H, d, J = 8.3 Hz), 7.92 (2H, d, J = 8.3 Hz), 12.93 (1H, br)。
1H-NMR (DMSO-d6) δ: 1.74-1.91 (1H, m), 1.91-2.07 (1H, m), 2.40-2.53 (2H, m), 2.68-2.84 (2H, m), 3.59 (3H, s), 7.39 (2H, d, J = 8.3 Hz), 7.92 (2H, d, J = 8.3 Hz), 12.93 (1H, br)。
参考例13
4−[1−(メトキシカルボニル)シクロペンチル]安息香酸
4−[1−(メトキシカルボニル)シクロペンチル]安息香酸
参考例9で得られた1−(4−メチルフェニル)シクロペンタンカルボン酸メチル(1.5g,6.8mmol)を用い、参考例1と同様にして反応を行った。得られた粗結晶をジイソプロピルエーテルから再結晶することにより、表題化合物(収量1.0g,収率59%)を得た。
1H-NMR (CDCl3) δ: 1.68-1.85 (4H, m), 1.85-2.04 (2H, m), 2.60-2.77 (2H, m), 3.63 (3H, s), 7.47 (2H, d, J = 8.3 Hz), 8.05 (2H, d, J = 8.3 Hz)。
1H-NMR (CDCl3) δ: 1.68-1.85 (4H, m), 1.85-2.04 (2H, m), 2.60-2.77 (2H, m), 3.63 (3H, s), 7.47 (2H, d, J = 8.3 Hz), 8.05 (2H, d, J = 8.3 Hz)。
参考例14
4−[1−(メトキシカルボニル)シクロヘキシル]安息香酸
4−[1−(メトキシカルボニル)シクロヘキシル]安息香酸
参考例10で得られた1−(4−メチルフェニル)シクロヘキサンカルボン酸メチル(1.4g,5.8mmol)を用い、参考例1と同様にして反応を行った。得られた粗結晶をジイソプロピルエーテルから再結晶することにより、表題化合物(収量0.65g,収率43%)を得た。
1H-NMR (DMSO-d6) δ: 1.16-1.50 (3H, m), 1.50-1.82 (5H, m), 2.28-2.45 (2H, m), 3.60 (3H, s), 7.47 (2H, d, J = 8.3 Hz), 7.91 (2H, d, J = 8.3 Hz), 12.91 (1H, br)。
1H-NMR (DMSO-d6) δ: 1.16-1.50 (3H, m), 1.50-1.82 (5H, m), 2.28-2.45 (2H, m), 3.60 (3H, s), 7.47 (2H, d, J = 8.3 Hz), 7.91 (2H, d, J = 8.3 Hz), 12.91 (1H, br)。
参考例15
N−(2,3−ジヒドロフロ[3,2−b]ピリジン−5−イル)−4−メチルベンゼンスルホンアミド
N−(2,3−ジヒドロフロ[3,2−b]ピリジン−5−イル)−4−メチルベンゼンスルホンアミド
2,3−ジヒドロフロ[3,2−b]ピリジン−5−アミン(5.1g,37mmol,Chem. Pharm. Bull., 1984, 32, 4914.)のピリジン(100mL)溶液に塩化 4−メチルベンゼンスルホニル(7.4g,39mmol)を加えた後、反応混合物を室温で1時間攪拌した。反応混合物に水を加え、酢酸エチルで抽出した。抽出液を飽和炭酸水素ナトリウム水溶液と飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。残渣をメタノールと酢酸エチルで洗浄し、表題化合物(収量9.4g,収率87%)を得た。
1H-NMR (DMSO-d6) δ: 2.34 (3H, s), 3.10 (2H, t, J = 8.8 Hz), 4.54 (2H, t, J = 8.8 Hz), 6.86 (2H, d, J = 8.5 Hz), 7.08 (2H, d, J = 8.5 Hz), 7.35 (2H, d, J = 8.3 Hz), 7.71 (2H, d, J = 8.3 Hz), 10.54 (1H, br)。
1H-NMR (DMSO-d6) δ: 2.34 (3H, s), 3.10 (2H, t, J = 8.8 Hz), 4.54 (2H, t, J = 8.8 Hz), 6.86 (2H, d, J = 8.5 Hz), 7.08 (2H, d, J = 8.5 Hz), 7.35 (2H, d, J = 8.3 Hz), 7.71 (2H, d, J = 8.3 Hz), 10.54 (1H, br)。
参考例16
2−[5−{[(4−メチルフェニル)スルホニル]イミノ}−3,5−ジヒドロフロ[3,2−b]ピリジン−4(2H)−イル]アセトアミド
2−[5−{[(4−メチルフェニル)スルホニル]イミノ}−3,5−ジヒドロフロ[3,2−b]ピリジン−4(2H)−イル]アセトアミド
参考例15で得られたN−(2,3−ジヒドロフロ[3,2−b]ピリジン−5−イル)−4−メチルベンゼンスルホンアミド(9.4g,32mmol)、2−ヨードアセトアミド(12.0g,65mmol)、ジイソプロピルエチルアミン(11.3mL,65mmol)をDMF(150mL)に溶解させ、反応混合物を60℃で24時間攪拌した。減圧下溶媒を留去した後、残渣をメタノールで洗浄し、表題化合物(収量6.7g,収率60%)を得た。
1H-NMR (DMSO-d6) δ: 2.32 (3H, s), 3.35 (2H, t, J = 8.9 Hz), 4.60 (2H, t, J = 8.9 Hz), 4.86 (2H, s), 7.12 (1H, d, J = 9.4 Hz), 7.24 (2H, d, J = 8.1 Hz), 7.39-7.53 (2H, m), 7.62 (2H, d, J = 8.1 Hz), 7.85 (1H, s)。
1H-NMR (DMSO-d6) δ: 2.32 (3H, s), 3.35 (2H, t, J = 8.9 Hz), 4.60 (2H, t, J = 8.9 Hz), 4.86 (2H, s), 7.12 (1H, d, J = 9.4 Hz), 7.24 (2H, d, J = 8.1 Hz), 7.39-7.53 (2H, m), 7.62 (2H, d, J = 8.1 Hz), 7.85 (1H, s)。
参考例17
1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−アミン
1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−アミン
参考例16で得られた2−[5−{[(4−メチルフェニル)スルホニル]イミノ}−3,5−ジヒドロフロ[3,2−b]ピリジン−4(2H)−イル]アセトアミド(6.7g,19mmol)のジクロロメタン(100mL)溶液に無水トリフルオロ酢酸(50mL)を加え、反応混合物を室温で1時間攪拌した。減圧下溶媒を留去した後、残渣に飽和炭酸水素ナトリウム水溶液を加え、酢酸エチルとTHFで抽出した。抽出液を無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。得られた残渣をエタノール(100mL)に溶解させた。反応混合液にn−ブチルアミン(39mL,340mmol)を加え、100℃で3時間攪拌した。反応液を室温まで放冷した後、減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(5−20% メタノール/酢酸エチル)で精製することにより表題化合物(収量0.66g,収率19%)を得た。
1H-NMR (DMSO-d6) δ: 3.35 (2H, t, J = 9.0 Hz), 4.66 (2H, t, J = 9.0 Hz), 5.03 (2H, br), 6.69 (1H, s), 6.76 (1H, d, J = 9.2 Hz), 6.99 (1H, d, J = 9.2 Hz)。
1H-NMR (DMSO-d6) δ: 3.35 (2H, t, J = 9.0 Hz), 4.66 (2H, t, J = 9.0 Hz), 5.03 (2H, br), 6.69 (1H, s), 6.76 (1H, d, J = 9.2 Hz), 6.99 (1H, d, J = 9.2 Hz)。
参考例18
4−メチル−N−(6−メチルピリジン−2−イル)ベンゼンスルホンアミド
4−メチル−N−(6−メチルピリジン−2−イル)ベンゼンスルホンアミド
参考例15と同様にして、6−メチルピリジン−2−アミン(6.1g,55mmol)を用いて、表題化合物(収量13.5g,収率91%)を得た。
参考例19
2−[6−メチル−2−{[(4−メチルフェニル)スルホニル]イミノ}ピリジン−1(2H)−イル]アセトアミド
2−[6−メチル−2−{[(4−メチルフェニル)スルホニル]イミノ}ピリジン−1(2H)−イル]アセトアミド
参考例16と同様にして、4−メチル−N−(6−メチルピリジン−2−イル)ベンゼンスルホンアミド(13.5g,50mmol)を用いて、表題化合物(収量10.1g,収率63%)を得た。
1H-NMR (DMSO-d6) δ: 2.33 (3H, s), 2.39 (3H, s), 4.96 (2H, br), 6.66 (1H, d, J = 7.2 Hz), 7.19 (1H, d, J = 9.0 Hz), 7.26 (2H, d, J = 8.3 Hz), 7.38 (1H, s), 7.59 (1H, dd, J = 9.0, 7.2 Hz), 7.65 (2H, d, J = 8.3 Hz), 7.82 (1H, s)。
1H-NMR (DMSO-d6) δ: 2.33 (3H, s), 2.39 (3H, s), 4.96 (2H, br), 6.66 (1H, d, J = 7.2 Hz), 7.19 (1H, d, J = 9.0 Hz), 7.26 (2H, d, J = 8.3 Hz), 7.38 (1H, s), 7.59 (1H, dd, J = 9.0, 7.2 Hz), 7.65 (2H, d, J = 8.3 Hz), 7.82 (1H, s)。
参考例20
5−メチルイミダゾ[1,2−a]ピリジン−2−アミン
5−メチルイミダゾ[1,2−a]ピリジン−2−アミン
参考例17と同様にして、2−[6−メチル−2−{[(4−メチルフェニル)スルホニル]イミノ}ピリジン−1(2H)−イル]アセトアミド(0.97g,3.0mmol)を用いて、表題化合物(収量0.35g,収率81%)を得た。
1H-NMR (DMSO-d6) δ: 2.44 (3H, s), 5.04 (2H, s), 6.58 (1H, d, J = 7.0 Hz), 6.71 (1H, s), 6.94-7.01 (1H, m), 7.08 (1H, d, J = 8.7 Hz)。
1H-NMR (DMSO-d6) δ: 2.44 (3H, s), 5.04 (2H, s), 6.58 (1H, d, J = 7.0 Hz), 6.71 (1H, s), 6.94-7.01 (1H, m), 7.08 (1H, d, J = 8.7 Hz)。
参考例21
6−クロロイミダゾ[1,2−a]ピリジン−2−アミン
6−クロロイミダゾ[1,2−a]ピリジン−2−アミン
参考例17と同様にして、2−[5−クロロ−2−{[(4−メチルフェニル)スルホニル]イミノ}ピリジン−1(2H)−イル]アセトアミド(78.0g,0.23mol,Synthesis, 1998, 6, 867.)を用いて、表題化合物(収量14.0g,収率36%)を得た。
1H-NMR (DMSO-d6) δ: 5.19 (2H, s), 6.99-7.02 (1H, m), 7.18 (1H, d, J = 9.5 Hz), 8.53 (1H, dd, J = 1.9, 0.8 Hz)。
1H-NMR (DMSO-d6) δ: 5.19 (2H, s), 6.99-7.02 (1H, m), 7.18 (1H, d, J = 9.5 Hz), 8.53 (1H, dd, J = 1.9, 0.8 Hz)。
参考例22
6−ブロモイミダゾ[1,2−a]ピリジン−2−アミン
6−ブロモイミダゾ[1,2−a]ピリジン−2−アミン
参考例17と同様にして、2−[5−ブロモ−2−{[(4−メチルフェニル)スルホニル]イミノ}ピリジン−1(2H)−イル]アセトアミド(23.6g,61mmol,Tetrahedron Lett., 2002, 43, 9051.)を用いて、表題化合物(収量14g,収率90%)を得た。
1H-NMR (DMSO-d6) δ: 5.20 (2H, br), 7.00 (1H, s), 7.04-7.18 (2H, m), 8.60 (1H, d, J = 0.9 Hz)。
1H-NMR (DMSO-d6) δ: 5.20 (2H, br), 7.00 (1H, s), 7.04-7.18 (2H, m), 8.60 (1H, d, J = 0.9 Hz)。
参考例23
6−ヨードイミダゾ[1,2−a]ピリジン−2−アミン
6−ヨードイミダゾ[1,2−a]ピリジン−2−アミン
参考例17と同様にして、2−[5−ヨード−2−{[(4−メチルフェニル)スルホニル]イミノ}ピリジン−1(2H)−イル]アセトアミド(78g,0.23mol,Synthesis, 1998, 6, 867.)を用いて、表題化合物(収量14.0g,収率36%)を得た。
1H-NMR (DMSO-d6) δ: 5.17 (2H, s), 6.97 (1H, s), 7.02 (1H, d, J = 9.1 Hz), 7.16 (1H, dd, J = 9.1, 1.5 Hz), 8.63 (1H, d, J = 1.5 Hz)。
1H-NMR (DMSO-d6) δ: 5.17 (2H, s), 6.97 (1H, s), 7.02 (1H, d, J = 9.1 Hz), 7.16 (1H, dd, J = 9.1, 1.5 Hz), 8.63 (1H, d, J = 1.5 Hz)。
参考例24
4−メチル−N−(5−メチルピリジン−2−イル)ベンゼンスルホンアミド
4−メチル−N−(5−メチルピリジン−2−イル)ベンゼンスルホンアミド
参考例15と同様にして、5−メチルピリジン−2−アミン(5.0g,46mmol)を用いて、表題化合物(収量11.6g,収率86%)を得た。
1H-NMR (DMSO-d6) δ: 2.13 (3H, s), 2.33 (3H, s), 7.05 (1H, d, J = 8.7 Hz), 7.32 (2H, t, J = 8.3 Hz), 7.53 (1H, dd, J = 8.7, 2.3 Hz), 7.73 (2H, d, J = 8.3 Hz), 7.87 (1H, s), 11.53 (1H, s)。
1H-NMR (DMSO-d6) δ: 2.13 (3H, s), 2.33 (3H, s), 7.05 (1H, d, J = 8.7 Hz), 7.32 (2H, t, J = 8.3 Hz), 7.53 (1H, dd, J = 8.7, 2.3 Hz), 7.73 (2H, d, J = 8.3 Hz), 7.87 (1H, s), 11.53 (1H, s)。
参考例25
2−[5−メチル−2−{[(4−メチルフェニル)スルホニル]イミノ}ピリジン−1(2H)−イル]アセトアミド
2−[5−メチル−2−{[(4−メチルフェニル)スルホニル]イミノ}ピリジン−1(2H)−イル]アセトアミド
参考例16と同様にして、4−メチル−N−(5−メチルピリジン−2−イル)ベンゼンスルホンアミド(5.0g,19mmol)を用いて、表題化合物(収量5.4g,収率89%)を得た。
1H-NMR (DMSO-d6) δ: 2.10 (3H, s), 2.32 (3H, s), 4.79 (2H, s), 7.23-7.26 (3H, m), 7.35 (1H, s), 7.59 (1H, dd, J = 9.3, 2.1 Hz), 7.64 (2H, d, J = 8.3 Hz), 7.76 (1H, s), 7.84 (1H, s)。
1H-NMR (DMSO-d6) δ: 2.10 (3H, s), 2.32 (3H, s), 4.79 (2H, s), 7.23-7.26 (3H, m), 7.35 (1H, s), 7.59 (1H, dd, J = 9.3, 2.1 Hz), 7.64 (2H, d, J = 8.3 Hz), 7.76 (1H, s), 7.84 (1H, s)。
参考例26
6−メチルイミダゾ[1,2−a]ピリジン−2−アミン
6−メチルイミダゾ[1,2−a]ピリジン−2−アミン
参考例17と同様にして、2−[5−メチル−2−{[(4−メチルフェニル)スルホニル]イミノ}ピリジン−1(2H)−イル]アセトアミド(6.6g,0.21mol)を用いて、表題化合物(収量2.6g,収率84%)を得た。
1H-NMR (CDCl3) δ: 2.28 (3H, s), 4.12 (2H, br), 6.83 (1H, s), 6.93 (1H, d, J = 9.1 Hz), 7.26 (1H, d, J = 9.1 Hz), 7.73 (1H, s)。
1H-NMR (CDCl3) δ: 2.28 (3H, s), 4.12 (2H, br), 6.83 (1H, s), 6.93 (1H, d, J = 9.1 Hz), 7.26 (1H, d, J = 9.1 Hz), 7.73 (1H, s)。
参考例27
4−メチル−N−キノリン−2−イルベンゼンスルホンアミド
4−メチル−N−キノリン−2−イルベンゼンスルホンアミド
キノリン−2−アミン(0.34g,2.4mmol)のピリジン(10mL)溶液に塩化 4−メチルベンゼンスルホニル(0.67g,3.5mmol)を加えた後、反応混合物を室温で2時間攪拌した。反応混合物に水を加え、酢酸エチルで抽出した。抽出液を飽和炭酸水素ナトリウム水溶液と飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(20−100% 酢酸エチル/ヘキサン)で精製することにより表題化合物(収量0.31g,収率44%)を得た。
MS (ESI+): 299 (M+H)。
1H-NMR (CDCl3) δ: 2.40 (3H, s), 6.85 (1H, d, J = 9.4 Hz), 7.27 (2H, s), 7.32-7.44 (2H, m), 7.57-7.67 (2H, m), 7.81-7.94 (3H, m), 11.78 (1H, s)。
MS (ESI+): 299 (M+H)。
1H-NMR (CDCl3) δ: 2.40 (3H, s), 6.85 (1H, d, J = 9.4 Hz), 7.27 (2H, s), 7.32-7.44 (2H, m), 7.57-7.67 (2H, m), 7.81-7.94 (3H, m), 11.78 (1H, s)。
参考例28
イミダゾ[1,2−a]キノリン−2−アミン
イミダゾ[1,2−a]キノリン−2−アミン
参考例27で得られた4−メチル−N−キノリン−2−イルベンゼンスルホンアミド(0.31g,1.0mmol)、2−ヨードアセトアミド(0.21g,1.1mmol)、ジイソプロピルエチルアミン(0.16mg,1.2mmol)をDMF(150mL)に溶解させ、反応混合物を60℃で24時間攪拌した。減圧下溶媒を留去した後、得られた残渣をシリカゲルカラムクロマトグラフィー(20−100% 酢酸エチル/ヘキサン)で精製した。得られた残渣を無水トリフルオロ酢酸(10mL)のジクロロメタン(10mL)溶液に溶解させ、室温で30分攪拌した。減圧下溶媒を留去した後、残渣に飽和炭酸水素ナトリウム水溶液を加えて酢酸エチルで抽出した。抽出液を無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。得られた残渣を2規定のアンモニア・メタノール溶液に溶解させ、マイクロウェーブ照射下、80℃で30分攪拌した。減圧下溶媒を留去し、得られた残渣をシリカゲルカラムクロマトグラフィーで精製することにより表題化合物(収量0.12g,収率66%)を得た。
1H-NMR (DMSO-d6) δ: 5.01 (2H, s), 7.30 (1H, d, J = 9.2 Hz), 7.41 (1H, t, J = 7.5 Hz), 7.49 (1H, s), 7.52 (1H, d, J = 9.2 Hz), 7.59-7.67 (1H, m), 7.89 (1H, dd, J = 7.9, 1.3 Hz), 8.06 (1H, d, J = 8.5 Hz)。
1H-NMR (DMSO-d6) δ: 5.01 (2H, s), 7.30 (1H, d, J = 9.2 Hz), 7.41 (1H, t, J = 7.5 Hz), 7.49 (1H, s), 7.52 (1H, d, J = 9.2 Hz), 7.59-7.67 (1H, m), 7.89 (1H, dd, J = 7.9, 1.3 Hz), 8.06 (1H, d, J = 8.5 Hz)。
参考例29
N−(6−クロロピリダジン−3−イル)−4−メチルベンゼンスルホンアミド
N−(6−クロロピリダジン−3−イル)−4−メチルベンゼンスルホンアミド
参考例27と同様にして、6−クロロピリダジン−3−アミン(10.0g,77mmol)を用いて、表題化合物(収量8.3g,収率38%)を得た。
1H-NMR (CDCl3) δ: 2.41 (3H, s), 7.29 (2H, d, J = 7.9 Hz), 7.35 (1H, d, J = 9.4 Hz), 7.47 (1H, d, J = 9.4 Hz), 7.81 (2H, d, J = 8.5 Hz), 10.35-10.42 (1H, m)。
1H-NMR (CDCl3) δ: 2.41 (3H, s), 7.29 (2H, d, J = 7.9 Hz), 7.35 (1H, d, J = 9.4 Hz), 7.47 (1H, d, J = 9.4 Hz), 7.81 (2H, d, J = 8.5 Hz), 10.35-10.42 (1H, m)。
参考例30
6−クロロ−3−メチルイミダゾ[1,2−b]ピリダジン−2−アミン
6−クロロ−3−メチルイミダゾ[1,2−b]ピリダジン−2−アミン
参考例28と同様にして、参考例29で得られたN−(6−クロロピリダジン−3−イル)−4−メチルベンゼンスルホンアミド(2.0g,7.1mmol)、2−ブロモプロパンアミド(1.2g,7.8mmol)を用いて、表題化合物(収量1.0g,収率77%)を得た。
1H-NMR (CDCl3) δ: 2.33 (3H, s), 5.67 (2H, s), 6.94 (1H, d, J = 9.0 Hz), 7.63 (1H, d, J = 9.0 Hz)。
1H-NMR (CDCl3) δ: 2.33 (3H, s), 5.67 (2H, s), 6.94 (1H, d, J = 9.0 Hz), 7.63 (1H, d, J = 9.0 Hz)。
参考例31
N−(5−フルオロピリジン−2−イル)−4−メチルベンゼンスルホンアミド
N−(5−フルオロピリジン−2−イル)−4−メチルベンゼンスルホンアミド
参考例27と同様にして、5−フルオロピリジン−2−アミン(4.8g,42mmol)を用いて、表題化合物(収量8.5g,収率75%)を得た。
1H-NMR (CDCl3) δ: 2.38 (3H, s), 7.22 (2H, d, J = 8.1 Hz), 7.35-7.51 (2H, m), 7.68 (2H, d, J = 8.3 Hz), 8.31 (1H, d, J = 2.6 Hz), 10.04 (1H, s)。
1H-NMR (CDCl3) δ: 2.38 (3H, s), 7.22 (2H, d, J = 8.1 Hz), 7.35-7.51 (2H, m), 7.68 (2H, d, J = 8.3 Hz), 8.31 (1H, d, J = 2.6 Hz), 10.04 (1H, s)。
参考例32
6−フルオロイミダゾ[1,2−a]ピリジン−2−アミン
6−フルオロイミダゾ[1,2−a]ピリジン−2−アミン
参考例28と同様にして、参考例31で得られたN−(5−フルオロピリジン−2−イル)−4−メチルベンゼンスルホンアミド(7.4g,28mmol)を用いて、表題化合物(収量0.74g,収率18%)を得た。
1H-NMR (CDCl3) δ: 5.10 (2H, s), 6.97-7.04 (2H, m), 7.17 (1H, dd, J = 9.6, 5.3 Hz), 8.84 (1H, dd, J = 5.3, 2.0 Hz)。
1H-NMR (CDCl3) δ: 5.10 (2H, s), 6.97-7.04 (2H, m), 7.17 (1H, dd, J = 9.6, 5.3 Hz), 8.84 (1H, dd, J = 5.3, 2.0 Hz)。
参考例33
(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)カルバミン酸エチル
(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)カルバミン酸エチル
6−クロロピリダジン−3−アミン(40g,0.31mol,J. Med. Chem. 1981, 24, 59)をN,N−ジメチルアセトアミド(310ml)に溶かし、(クロロアセチル)カルバミン酸エチル(51g,0.31mol)及びリン酸水素二ナトリウム(66g,0.46mol)を加えた後110℃で3時間攪拌した。反応液を冷却後、水(930ml)を加えて析出した茶褐色の粉体をろ取し、これを水(200ml)、アセトニトリル(200ml)及びジエチルエーテル(200ml)で順に洗浄した後乾燥して茶白色の表題化合物(収量38.5g,収率52%)を得た。
参考例34
6−クロロイミダゾ[1,2−b]ピリダジン−2−アミン
6−クロロイミダゾ[1,2−b]ピリダジン−2−アミン
水酸化バリウム八水和物を水(750ml)に溶かした後、N−メチルピロリジノン(250ml)及び参考例33で得られた(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)カルバミン酸エチル(38.5g,0.16mol)を加え120℃で11時間攪拌した。反応液を冷却後、テトラヒドロフラン(500ml)/酢酸エチル(500ml)の混合溶媒で三回抽出し、有機層を飽和食塩水で洗浄し、硫酸マグネシウムで乾燥後ろ過した後、溶媒を減圧溜去して黄色の針状物を含む緑色油状粗製物を得た。この粗製物をトルエンで共沸した後、残った針状物をジエチルエーテルで洗浄して黄色針状の表題化合物(収量21.7g,収率81%)を得た。
1H-NMR (DMSO-d6) δ: 5.67 (2H, s), 7.04 (1H, d, J = 9.2 Hz), 7.37 (1H, s), 7.69 (1H, d, J = 9.2 Hz)。
1H-NMR (DMSO-d6) δ: 5.67 (2H, s), 7.04 (1H, d, J = 9.2 Hz), 7.37 (1H, s), 7.69 (1H, d, J = 9.2 Hz)。
参考例35
(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)カルバミン酸エチル
(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)カルバミン酸エチル
参考例33と同様にして、6−ヨードピリダジン−3−アミン(10.5g,48mmol,Tetrahedron, 2000, 56, 1777)を用いて、表題化合物(収量11.6g,収率74%)を得た。
1H-NMR (DMSO-d6) δ: 1.26 (3H, t, J = 7.2 Hz), 4.18 (2H, q, J = 7.2 Hz), 7.48 (1H, d, J = 9.2 Hz), 7.71 (1H, dd, J = 9.2, 0.6 Hz), 8.08 (1H, s), 10.52 (1H, s)。
1H-NMR (DMSO-d6) δ: 1.26 (3H, t, J = 7.2 Hz), 4.18 (2H, q, J = 7.2 Hz), 7.48 (1H, d, J = 9.2 Hz), 7.71 (1H, dd, J = 9.2, 0.6 Hz), 8.08 (1H, s), 10.52 (1H, s)。
参考例36
6−ヨードイミダゾ[1,2−b]ピリダジン−2−アミン
6−ヨードイミダゾ[1,2−b]ピリダジン−2−アミン
参考例34と同様にして、参考例35で得られた(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)カルバミン酸エチル(10.2g,31mmol)を用いて、表題化合物(収量7.0g,収率87%)を得た。
1H-NMR (DMSO-d6) δ: 5.61 (2H, s), 7.23 (1H, d, J = 9.0 Hz), 7.37 (1H, s), 7.39 (1H, d, J = 9.0 Hz)。
1H-NMR (DMSO-d6) δ: 5.61 (2H, s), 7.23 (1H, d, J = 9.0 Hz), 7.37 (1H, s), 7.39 (1H, d, J = 9.0 Hz)。
参考例37
6−tert−ブチルニコチン酸
6−tert−ブチルニコチン酸
6−tert−ブチルニコチノニトリル (10.5g,65.5mmol,Tetrahedron, 1974, 30, 4201)を濃塩酸(55ml)に溶かして100℃で20分間攪拌した。反応溶液を冷却後、溶媒を減圧溜去し、得られた粗製物にアセトニトリル(100ml)を加え、析出した白色固体をろ取し、アセトニトリルとジエチルエーテルで洗浄した。有機層を合わせて再び減圧下濃縮し、同様にして白色固体を得た。これを数回繰り返して得られた白色固体を合わせて、水(50ml)に溶かし8規定水酸化ナトリウム水溶液で弱酸性になるようにpHを調整すると(pH=3−4)白色の沈殿が生成した。この懸濁液を減圧下濃縮した後アセトニトリルで共沸して蒸発乾固した。この白色固体の混合物に塩化メチレン(500ml)を加えて無水硫酸マグネシウムで乾燥してろ過した。ろ液を減圧下濃縮して白色の油状粗製物を得た。これを酢酸エチルに溶かして減圧下濃縮すると白色固体の表題化合物(収量11.4g, 収率97%)が得られた。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.57 (1H, d, J = 8.3 Hz), 8.19 (1H, dd, J = 8.3, 2.3 Hz), 9.01 (1H, d, J = 2.3 Hz), 12.50-14.20(1H, brs)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.57 (1H, d, J = 8.3 Hz), 8.19 (1H, dd, J = 8.3, 2.3 Hz), 9.01 (1H, d, J = 2.3 Hz), 12.50-14.20(1H, brs)。
参考例38
1−[2−(テトラヒドロ−2H−ピラン−2−イルオキシ)エチル]−4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ピラゾール
1−[2−(テトラヒドロ−2H−ピラン−2−イルオキシ)エチル]−4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ピラゾール
4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ピラゾール(400mg,2.06mmol)をN,N−ジメチルホルムアミド(10ml)に溶かし、水素化ナトリウム(ミネラルオイル中60%,123.7mg,3.09mmol)を室温で加え5分間攪拌後、2−(2−ブロモエトキシ)テトラヒドロ−2H−ピランを加え室温で更に1時間攪拌した。その後反応溶液を水(10ml)中に注ぎ、ジエチルエーテル(50ml)で3回抽出後、有機層を合わせて飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥、ろ過後溶媒を減圧溜去して無色油状の粗製物を得た。これをシリカゲルクロマトグラフィーで精製して無色油状の表題化合物(収量126mg,収率19.0%)を得た。
1H-NMR (CDCl3) δ: 1.32 (12H, s), 1.40-1.85(6H, m), 3.39-3.48 (1H, m), 3.57-3.68 (1H, m), 3.73-3.83 (1H, m), 4.00-4.08 (1H, m), 4.30-4.37 (2H, m), 4.49-4.54 (1H, m), 7.78 (1H, s), 7.79 (1H, s)。
1H-NMR (CDCl3) δ: 1.32 (12H, s), 1.40-1.85(6H, m), 3.39-3.48 (1H, m), 3.57-3.68 (1H, m), 3.73-3.83 (1H, m), 4.00-4.08 (1H, m), 4.30-4.37 (2H, m), 4.49-4.54 (1H, m), 7.78 (1H, s), 7.79 (1H, s)。
参考例39
4−tert−ブチル−N−(4−tert−ブチルベンゾイル)−N−(5−メチルイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
4−tert−ブチル−N−(4−tert−ブチルベンゾイル)−N−(5−メチルイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
実施例65で得られた4−tert−ブチル−N−(5−メチルイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(1.0g,3.25mmol)をアセトニトリル(30ml)に入れ80℃まで加熱して完全に溶かした。そこへ塩化 4−tert−ブチルベンゾイル(783mg,3.90mmol)及びトリエチルアミン(672mg,6.64mmol)を加えて5分間攪拌した。薄層クロマトグラフィーで原料の消失を確認し、冷却後反応液を飽和炭酸水素ナトリウム水溶液(30ml)に注ぎ、酢酸エチル(50 ml)で3回抽出した。有機層を合わせ、飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥、ろ過後溶媒を減圧溜去して橙色の粗製固体を得た。これをシリカゲルクロマトグラフィー(25−30%酢酸エチル/ヘキサン)で精製して黄緑色の固体を得た。更にこれをジエチルエーテルで洗浄して白色固体の表題化合物(収量1.06g,収率69.7%)を得た。
1H-NMR (CDCl3) δ: 1.27 (18H, s), 2.49(3H, s), 6.62 (1H, d, J = 6.8 Hz), 7.15 (1H, dd, J = 9.1, 6.8 Hz), 7.34 (4H, d, J = 8.7 Hz), 7.39 (1H, s), 7.49(1H, d, J = 9.1 Hz), 7.80 (4H, d, J = 8.7 Hz)。
1H-NMR (CDCl3) δ: 1.27 (18H, s), 2.49(3H, s), 6.62 (1H, d, J = 6.8 Hz), 7.15 (1H, dd, J = 9.1, 6.8 Hz), 7.34 (4H, d, J = 8.7 Hz), 7.39 (1H, s), 7.49(1H, d, J = 9.1 Hz), 7.80 (4H, d, J = 8.7 Hz)。
参考例40
N−[3−ブロモ−5−(ブロモメチル)イミダゾ[1,2−a]ピリジン−2−イル]−4−tert−ブチル−N−(4−tert−ブチルベンゾイル)ベンズアミド
N−[3−ブロモ−5−(ブロモメチル)イミダゾ[1,2−a]ピリジン−2−イル]−4−tert−ブチル−N−(4−tert−ブチルベンゾイル)ベンズアミド
参考例39で得られた4−tert−ブチル−N−(4−tert−ブチルベンゾイル)−N−(5−メチルイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(1.06g, 2.22mmol)及びN−ブロモスクシンイミド(928mg,5.21mmol)を四塩化炭素(100ml)に懸濁させて還流下5分間攪拌すると黄色の溶液となり、反応原料は完全に消失した。反応液を冷却後、更にジフェニルペルオキシ無水物(71.8 mg, 0.30mmol)を加えて還流下15分間攪拌した。冷却後反応液を飽和炭酸水素ナトリウム水溶液(100ml)に注ぎ、塩化メチレン(100ml)で3回抽出した。有機層を合わせ、飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥、ろ過後溶媒を減圧溜去して橙色の粗製固体を得た。これをシリカゲルクロマトグラフィー(25−30%酢酸エチル/ヘキサン)で精製して黄白色固体の表題化合物(収量1.10g,収率79.2%)を得た。
1H-NMR (CDCl3)δ: 1.27 (18H, s), 5.11(3H, s), 6.90 (1H, dd, J = 9.0, 1.3 Hz), 7.17 (1H, dd, J = 9.0, 7.0 Hz), 7.35 (4H, d, J = 8.5 Hz), 7.59(1H, dd, J = 7.0, 1.3 Hz), 7.79 (4H, d, J = 8.5 Hz)。
1H-NMR (CDCl3)δ: 1.27 (18H, s), 5.11(3H, s), 6.90 (1H, dd, J = 9.0, 1.3 Hz), 7.17 (1H, dd, J = 9.0, 7.0 Hz), 7.35 (4H, d, J = 8.5 Hz), 7.59(1H, dd, J = 7.0, 1.3 Hz), 7.79 (4H, d, J = 8.5 Hz)。
参考例41
2−アミノ−6−フェニルイミダゾ[1,2−b]ピリダジン
2−アミノ−6−フェニルイミダゾ[1,2−b]ピリダジン
参考例36で得られた6−ヨードイミダゾ[1,2−b]ピリダジン−2−アミン(1.56g,6.0mmol)、フェニルボロン酸(1.44g,12.0mmol)、炭酸カリウム(2.46g,18.0mmol)、テトラキス(トリフェニルホスフィン)パラジウム(0.69g,0.6mmol)を1,2−ジメトキシエタン(30mL)、水(30mL)の混合物に懸濁し、マイクロウエーブ反応装置を用い、160℃で300秒間加熱攪拌した。反応混合物を水で希釈し、酢酸エチルで抽出した。酢酸エチル層を無水硫酸マグネシウムで乾燥し、濃縮して残留物をシリカゲルカラムクロマトグラフィーで精製し、メタノール−酢酸エチル(1:9、体積比)溶出部から表題化合物(1.03g、収率87%)を得た。
1H-NMR (CDCl3) δ: 4.09 (2H, s), 7.35 (1H, d, J = 9.3 Hz), 7.41 (1H, s), 7.44 - 7.54(3H, m), 7.69 (1H, d, J = 9.3 Hz), 7.91 (1H, d, J = 9.3 Hz)。
1H-NMR (CDCl3) δ: 4.09 (2H, s), 7.35 (1H, d, J = 9.3 Hz), 7.41 (1H, s), 7.44 - 7.54(3H, m), 7.69 (1H, d, J = 9.3 Hz), 7.91 (1H, d, J = 9.3 Hz)。
参考例41と同様にして、以下の化合物を合成した。
参考例42
2−アミノ−6−(3−ピリジニル)イミダゾ[1,2−b]ピリダジン
参考例42
2−アミノ−6−(3−ピリジニル)イミダゾ[1,2−b]ピリダジン
収率61%
1H-NMR (CDCl3) δ: 4.14 (2H, s), 7.35 (1H, dd, J = 9.2, 1.6 Hz), 7.38-7.49 (2H, m), 7.73 (1H, d, J = 9.3 Hz), 8.24(1H, dd, J = 8.0, 1.8 Hz), 8.59-8.77 (1H, m), 9.15 (1H, s)。
1H-NMR (CDCl3) δ: 4.14 (2H, s), 7.35 (1H, dd, J = 9.2, 1.6 Hz), 7.38-7.49 (2H, m), 7.73 (1H, d, J = 9.3 Hz), 8.24(1H, dd, J = 8.0, 1.8 Hz), 8.59-8.77 (1H, m), 9.15 (1H, s)。
参考例43
2−アミノ−6−(4−メトキシフェニル)イミダゾ[1,2−b]ピリダジン
2−アミノ−6−(4−メトキシフェニル)イミダゾ[1,2−b]ピリダジン
収率21%
1H-NMR (CDCl3) δ: 3.88 (3H, s), 4.05 (2H, s), 7.01 (2H, d, J = 8.6 Hz), 7.30 (1H, d, J = 9.3 Hz), 7.37 (1H, s), 7.65 (1H, d, J = 9.3 Hz), 7.86 (2H, d, J = 8.6 Hz)。
1H-NMR (CDCl3) δ: 3.88 (3H, s), 4.05 (2H, s), 7.01 (2H, d, J = 8.6 Hz), 7.30 (1H, d, J = 9.3 Hz), 7.37 (1H, s), 7.65 (1H, d, J = 9.3 Hz), 7.86 (2H, d, J = 8.6 Hz)。
参考例44
2−tert−ブチル−5−メチルピリジン
2−tert−ブチル−5−メチルピリジン
2N−tert−ブチルマグネシウムクロリド−THF溶液(120mmol、60mL)をシアン化銅(60mmol、5400mg)のTHF懸濁液(200mL)に滴下し、−78℃で20分間攪拌した。その後、2−ブロモ−5−メチルピリジン(12mmol、2060mg)を加え−78℃で2時間攪拌させ、さらに室温で終夜攪拌した。25%アンモニア水溶液(100mL)を加えて30分間攪拌し、酢酸エチルを用いて抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=0:10〜1:9)で精製し、表題化合物(1.6g、89%)を得た。
参考例46
5−tert−ブチルピリジン−2−カルボン酸
5−tert−ブチルピリジン−2−カルボン酸
参考例44、続いて参考例1に準じ、5−ブロモ−2−メチルピリジンより表題化合物を合成した。
参考例47
6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−アミン
6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−アミン
N−[5−(トリフルオロメチル)ピリジン−2−イル]メタンスルホンアミド(22.5g,91.8mmol, Chem. Pharm. Bull. 1995, 43, 1696)、2−ヨードアセトアミド(22.50g,119.3mmol)およびジイソプロピルエチルアミン(21.2mL,119.3mmol)をDMF(180mL)に溶解し室温で12時間攪拌した。その後溶媒を減圧溜去し、得られた油状物に水(500mL)を加えて析出した固体をろ取し、水、アセトニトリル及びジエチルエーテルで洗浄後乾燥して黄白色固体(収量21.6g)を得た。この固体(20g)を塩化メチレン(134mL)中に懸濁し、そこへ無水トリフルオロ酢酸(47.4mL,336mmol)を室温で徐々に加えて10分攪拌すると黄色の溶液となった。その後更に室温で30分攪拌した後溶媒を減圧溜去し、50%エタノール/トルエンの混合溶媒で共沸して黄白色の固体を得た。これに飽和炭酸水素ナトリウム水溶液(60mL)を加えた後酢酸エチルで抽出し、有機層を飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥し溶媒を減圧溜去して黄白色の固体(収量21.0g)の粗製物を得た。この粗製物を20%n−ブチルアミン/エタノール溶液(350mL)に溶かし6時間加熱還流した。反応液を冷却後トルエン(100mL)を加えて反応溶液を減圧下濃縮し、橙色の油状粗製物を得た。これをシリカゲルクロマトグラフィー(80−100%酢酸エチル/ヘキサン)で精製して表題化合物(収量9.8g,収率64%)を得た。
1H-NMR (DMSO-d6) δ:4.04 (2H, brs), 6.99 (1H, s), 7.21 (1H, dd, J = 9.5, 1.9 Hz), 7.41 (1H, dd, J = 9.5, 0.8 Hz), 8.27-8.31 (1H, m)。
1H-NMR (DMSO-d6) δ:4.04 (2H, brs), 6.99 (1H, s), 7.21 (1H, dd, J = 9.5, 1.9 Hz), 7.41 (1H, dd, J = 9.5, 0.8 Hz), 8.27-8.31 (1H, m)。
参考例48
4−(2−ヒドロキシ−1,1−ジメチルエチル)安息香酸エチル
4−(2−ヒドロキシ−1,1−ジメチルエチル)安息香酸エチル
イソブチルアルデヒド(200mmol、14.4g)、4−ブロモ安息香酸エチル(100mmol、22.9g)、酢酸パラジウム(2.0mmol、450mg)、トリ−tert−ブチルホスフィン(4.0mmol、809mg)、炭酸セシウム(120mmol、39g)をジオキサン(200mL)中に懸濁させた後に、窒素下、110℃で4時間攪拌した。ジオキサン不溶物を、シリカゲルクロマトグラフィーを用いて除いた後に、溶媒およびイソブチルアルデヒドを減圧下留去した。残留物(4−(1,1−ジメチル−2−オキソエチル)安息香酸エチル)をTHF(100mL)中に溶解させた後に、水素化ホウ素酸ナトリウム(200mmol、7.5g)を加えて、1時間攪拌した。飽和塩化アンモニウム水を加えた後に、酢酸エチルを用いて抽出した。
抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=1:9〜3:7)で精製し、表題化合物(9.8g、22%)を得た。
1H-NMR (CDCl3) δ: 1.34-1.42 (9H, m), 3.65 (2H, d, J = 6.2 Hz), 4.37 (2H, q, J = 7.2 Hz), 7.44-7.49 (2H, m), 7.98-8.04 (2H, m), hidden (1H)。
抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=1:9〜3:7)で精製し、表題化合物(9.8g、22%)を得た。
1H-NMR (CDCl3) δ: 1.34-1.42 (9H, m), 3.65 (2H, d, J = 6.2 Hz), 4.37 (2H, q, J = 7.2 Hz), 7.44-7.49 (2H, m), 7.98-8.04 (2H, m), hidden (1H)。
参考例49
4−(2−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルエチル)安息香酸エチル
4−(2−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルエチル)安息香酸エチル
参考例48で得られた4−(2−ヒドロキシ−1,1−ジメチルエチル)安息香酸エチル(44.1mmol、9.8g)、2,6−ルチジン(88.2mmol、9.5g)をジクロロメタン(200mL)中に溶解させた後に、TBDMSOTf(66.1mmol、17.5g)を加え1時間攪拌した。水を加えた後にジクロロメタンを用いて抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=0.5:9.5〜2:8)で精製して表題化合物(13.3g、90%)を得た。
1H-NMR (CDCl3) δ: -0.07 (6H, s), 0.83 (9H, s), 1.31 (6H, s), 1.38 (3H, t, J = 7.1 Hz), 3.55 (2H, s), 4.36 (2H, q, J = 7.1 Hz), 7.44 (2H, d, J = 8.4 Hz), 7.96 (2H, d, J = 8.4Hz)。
1H-NMR (CDCl3) δ: -0.07 (6H, s), 0.83 (9H, s), 1.31 (6H, s), 1.38 (3H, t, J = 7.1 Hz), 3.55 (2H, s), 4.36 (2H, q, J = 7.1 Hz), 7.44 (2H, d, J = 8.4 Hz), 7.96 (2H, d, J = 8.4Hz)。
参考例50
4−(2−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルエチル)安息香酸
4−(2−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルエチル)安息香酸
参考例49で得られた4−(2−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルエチル)安息香酸エチル(3.0mmol、1040mg)に水酸化カリウム(9.0mmol、505mg)、水(10mL)、THF(10mL)、メタノール(10mL)を加え、70℃で1時間攪拌した。溶媒を留去した後に、希塩酸を加え、ジクロロメタンを用いて抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去して、表題化合物(770mg、82%)を得た。
1H-NMR (CDCl3) δ: -0.07 (6H, s), 0.82 (9H, s), 1.32 (6H, s), 3.56 (2H, s), 7.48 (2H, d, J = 8.5 Hz), 8.02 (2H, d, J = 8.5 Hz), hidden (1H)。
1H-NMR (CDCl3) δ: -0.07 (6H, s), 0.82 (9H, s), 1.32 (6H, s), 3.56 (2H, s), 7.48 (2H, d, J = 8.5 Hz), 8.02 (2H, d, J = 8.5 Hz), hidden (1H)。
参考例51
4−(3−ヒドロキシ−1,1−ジメチルプロピル)安息香酸エチル
4−(3−ヒドロキシ−1,1−ジメチルプロピル)安息香酸エチル
(メトキシメチル)トリフェニルホスホニウム クロリド(114.4mmol、39.2g)のTHF300mL懸濁液中にtert−ブトキシカリウムを加え、0℃で30分攪拌した。その後、参考例48で得られた中間体4−(1,1−ジメチル−2−オキソエチル)安息香酸エチル(95.3mmol、21.0g)を加え、室温で終夜攪拌した。飽和食塩水を加えた後に、酢酸エチルを用いて抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物に2N−HCl水(50mL)およびTHF(150mL)を加え、40℃で1時間攪拌した。飽和食塩水を加えた後に、酢酸エチルを用いて抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した後に、残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=0.5:9.5〜3:7)で精製してアルデヒド体(11.7g)を得た。続いてTHF(200mL)に溶解させた後に、NaBH4(50mmol、1.89g)を加えて、室温で終夜攪拌した。希塩酸を加えた後に、酢酸エチルを用いて抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した後に、残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=1:9〜1:1)で精製して表題化合物(9.9g、41%)を無色液体として得た。
1H-NMR (DMSO-d6) δ: 1.22-1.39 (9H, m), 1.78-1.86 (2H, m), 1.99 (1H, s), 3.13-3.22 (2H, m), 4.30 (2H, q, J = 6.7 Hz), 7.49 (2H, d, J = 8.3 Hz), 7.89 (2H, d, J = 8.3 Hz)。
1H-NMR (DMSO-d6) δ: 1.22-1.39 (9H, m), 1.78-1.86 (2H, m), 1.99 (1H, s), 3.13-3.22 (2H, m), 4.30 (2H, q, J = 6.7 Hz), 7.49 (2H, d, J = 8.3 Hz), 7.89 (2H, d, J = 8.3 Hz)。
参考例52
4−(3−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルプロピル)安息香酸
4−(3−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルプロピル)安息香酸
参考例49および参考例50に準じ、参考例51で得られた4−(3−ヒドロキシ−1,1−ジメチルプロピル)安息香酸エチルを用いて表題化合物を合成した。
1H-NMR (DMSO-d6) δ: -0.04 (6H, s), 0.83 (9H, s), 1.35 (6H, s), 1.90 (2H, t, J = 7.4 Hz), 3.41 (2H, t, J = 7.4 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.91 (2H, d, J = 8.5 Hz), hidden (1H)。
1H-NMR (DMSO-d6) δ: -0.04 (6H, s), 0.83 (9H, s), 1.35 (6H, s), 1.90 (2H, t, J = 7.4 Hz), 3.41 (2H, t, J = 7.4 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.91 (2H, d, J = 8.5 Hz), hidden (1H)。
参考例53
4−[エチル(メチルスルホニル)アミノ]安息香酸
4−[エチル(メチルスルホニル)アミノ]安息香酸
4−メチルスルホニルアミノ安息香酸(5mmol、1.07g)、炭酸カリウム(20mmol、2.76g)およびヨウ化エチル(20mmol、3.12g)のDMF(50mL)懸濁液を60℃で終夜攪拌した。揮発性成分を減圧下で留去後、飽和食塩水を加えて酢酸エチルで抽出した。抽出液を水洗、乾燥(MgSO4)後、溶媒を留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=5:5〜10:0)で精製し、表題化合物のエチルエステルを得た(1.19g、88%)。その後、参考例50に準じて表題化合物を得た。
1H-NMR (DMSO-d6) δ: 1.02 (3H, t, J = 7.1 Hz), 3.74 (2H, q, J = 7.1 Hz), 7.47-7.53 (2H, m), 7.94-8.01 (2H, m), 13.05 (1H, s)。
1H-NMR (DMSO-d6) δ: 1.02 (3H, t, J = 7.1 Hz), 3.74 (2H, q, J = 7.1 Hz), 7.47-7.53 (2H, m), 7.94-8.01 (2H, m), 13.05 (1H, s)。
参考例54
6−(3−アミノフェノキシ)イミダゾ[1,2−b]ピリダジン−2−アミン
6−(3−アミノフェノキシ)イミダゾ[1,2−b]ピリダジン−2−アミン
6−ヨードイミダゾ[1,2−b]ピリダジン−2−アミン(390mg,1.5mmol)、3−アミノフェノール(491mg,4.5mmol)、炭酸カリウム(415mg,3.0mmol)、N,N−ジメチルホルムアミド(3mL)の混合物を、マイクロウェーブ反応装置を用い、180℃で40分間撹拌した。反応混合物を水で希釈し、酢酸エチル/テトラヒドロフラン(1:1)混合溶媒で抽出した。有機層を減圧濃縮し、残留物をカラムクロマトグラフィー(シリカゲル,酢酸エチル/メタノール=100/0→60/40)に付した。目的画分を減圧濃縮後、残留物をカラムクロマトグラフィー(NHシリカゲル,酢酸エチル/メタノール=100/0→80/20)で精製、酢酸エチルより析出させて、表題化合物(133mg,収率37%)を紫色固体として得た。
1H-NMR (DMSO-d6, 300 MHz) δ 5.27 (2H, s), 5.31 (2H, s), 6.23 (1H, ddd, J= 7.8, 2.4, 0.9 Hz), 6.27 (1H, t, J = 2.1 Hz), 6.38 (1H, ddd, J = 8.1, 2.1, 0.9 Hz), 6.69 (1H, d, J = 9.3 Hz), 7.02 (1H, t, J = 7.9 Hz), 7.14 (1H, s), 7.68 (1H, dd, J = 9.3, 0.6 Hz)。
参考例55
6−(3−アミノフェノキシ)イミダゾ[1,2−b]ピリダジン−2−カルボン酸エチル
6−(3−アミノフェノキシ)イミダゾ[1,2−b]ピリダジン−2−カルボン酸エチル
6−ヨードイミダゾ[1,2−b]ピリダジン−2−カルボン酸エチル(951mg,3.00mmol)、3−アミノフェノール(655mg,6.00mmol)、炭酸カリウム(622mg,4.50mmol)、N,N−ジメチルホルムアミド(9.0mL)の混合物を、150℃で6時間撹拌した。反応液を室温まで冷却後に酢酸エチル、水を加え、不溶物をセライトを用いて濾去した。ろ液から有機層を集め、飽和重曹水で洗浄し、無水硫酸マグネシウムで乾燥後、減圧下溶媒を留去した。残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル/ヘキサン=1/19→酢酸エチルのみ)で精製し、表題化合物(350mg,39%)を得た。
1H-NMR (DMSO-d6, 300 MHz) δ 1.30 (3H, t, J = 7.2 Hz), 4.29 (2H, q, J = 7.2 Hz), 5.34 (2H, brs), 6.35-6.48 (3H, m), 7.07 (1H, t, J = 8.1 Hz), 7.17 (1H, d, J = 9.9 Hz), 8.20 (1H, d, J = 9.6 Hz), 8.61 (1H, s)。
1H-NMR (DMSO-d6, 300 MHz) δ 1.30 (3H, t, J = 7.2 Hz), 4.29 (2H, q, J = 7.2 Hz), 5.34 (2H, brs), 6.35-6.48 (3H, m), 7.07 (1H, t, J = 8.1 Hz), 7.17 (1H, d, J = 9.9 Hz), 8.20 (1H, d, J = 9.6 Hz), 8.61 (1H, s)。
参考例56
6−(3−{[3−(トリフルオロメチル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−カルボン酸エチル
6−(3−{[3−(トリフルオロメチル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−カルボン酸エチル
6−(3−アミノフェノキシ)イミダゾ[1,2−b]ピリダジン−2−カルボン酸エチル(350mg,1.17mmol)、3−(トリフルオロメチル)安息香酸(342mg,1.80mmol)、1−ヒドロキシベンゾトリアゾール(243mg,1.80mmol)、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(345mg,1.80mmol)、N,N−ジメチルホルムアミド(5.0mL)の混合物を室温で一晩撹拌した。反応混合物を飽和重曹水に注ぎ込み、酢酸エチルで抽出し、抽出液を硫酸マグネシウムで乾燥後、減圧下濃縮した。残渣をアミノシリカゲルカラムクロマトグラフィー(ヘキサン−酢酸エチル=19:1から酢酸エチルのみ)で精製し、得られた固形物を酢酸エチル−ヘキサンで洗浄して、表題化合物(496mg,90%)を白色粉末として得た。
1H-NMR (DMSO-d6, 300 MHz) δ1.29 (3H, t, J = 7.1 Hz), 4.29 (2H, q, J = 7.1 Hz), 7.10 (1H, dd, J = 1.5, 7.5 Hz), 7.29 (1H, d, J = 9.9 Hz), 7.49 (1H, t, J = 8.4 Hz), 7.68-7.82 (3H, m), 7.97-8.00 (1H, m), 8.25-8.28 (3H, m), 8.62 (1H, s), 10.63 (1H, s)。
1H-NMR (DMSO-d6, 300 MHz) δ1.29 (3H, t, J = 7.1 Hz), 4.29 (2H, q, J = 7.1 Hz), 7.10 (1H, dd, J = 1.5, 7.5 Hz), 7.29 (1H, d, J = 9.9 Hz), 7.49 (1H, t, J = 8.4 Hz), 7.68-7.82 (3H, m), 7.97-8.00 (1H, m), 8.25-8.28 (3H, m), 8.62 (1H, s), 10.63 (1H, s)。
参考例57
6−(3−{[3−(トリフルオロメチル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−カルボン酸
6−(3−{[3−(トリフルオロメチル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−カルボン酸
6−(3−{[3−(トリフルオロメチル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−カルボン酸エチル(470mg,1.00mmol)、8規定水酸化ナトリウム水溶液(2.0mL)、メタノール(6.0mL)の混合物を室温で4時間撹拌した。6規定塩酸(2.7mL)、水(25mL)を加えた後、酢酸エチル(50mL)で抽出した。抽出液を無水硫酸マグネシウムで乾燥後、減圧下溶媒を留去して、表題化合物(425mg,96%)を白色粉末として得た。
1H-NMR (DMSO-d6, 300 MHz) δ 7.10 (1H, dd, J = 2.1, 7.8 Hz), 7.27 (1H, d, J = 9.9 Hz), 7.48 (1H, t, J = 7.8 Hz), 7.69-7.82 (3H, m), 7.98 (1H, d, J = 7.5 Hz), 8.23-8.29 (3H, m), 8.52 (1H, s), 10.62 (1H, s), 12.85 (1H, brs)。
1H-NMR (DMSO-d6, 300 MHz) δ 7.10 (1H, dd, J = 2.1, 7.8 Hz), 7.27 (1H, d, J = 9.9 Hz), 7.48 (1H, t, J = 7.8 Hz), 7.69-7.82 (3H, m), 7.98 (1H, d, J = 7.5 Hz), 8.23-8.29 (3H, m), 8.52 (1H, s), 10.62 (1H, s), 12.85 (1H, brs)。
参考例58
tert−ブチル[6−(3−{[3−(トリフルオロメチル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]カルバマート
tert−ブチル[6−(3−{[3−(トリフルオロメチル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]カルバマート
6−(3−{[3−(トリフルオロメチル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−カルボン酸(111mg,0.25mmol)、ジフェニルホスホリルアジド(103mg,0.375mmol)、トリエチルアミン(51mg,0.5mmol)、t−ブタノール(5.0mL)の懸濁液を室温で5分間撹拌後、100℃に加温し、一晩撹拌した。反応液を室温まで冷却後に酢酸エチルを加え、飽和重曹水で洗浄し、無水硫酸マグネシウムで乾燥、ろ過した。減圧下溶媒を留去、残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル/ヘキサン=1/19→酢酸エチルのみ)で精製し、表題化合物(79mg,39%)を白色固体として得た。
1H-NMR (DMSO-d6, 300 MHz) δ 1.47 (9H, s), 7.00-7.05 (2H, m), 7.45 (1H, t, J = 8.1 Hz), 7.65-7.81 (4H, m), 7.96-8.03 (2H, m), 8.24-8.28 (2H, m), 10.04 (1H, brs), 10.58 (1H, brs)。
1H-NMR (DMSO-d6, 300 MHz) δ 1.47 (9H, s), 7.00-7.05 (2H, m), 7.45 (1H, t, J = 8.1 Hz), 7.65-7.81 (4H, m), 7.96-8.03 (2H, m), 8.24-8.28 (2H, m), 10.04 (1H, brs), 10.58 (1H, brs)。
参考例59
N−{3−[(2−アミノイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}−3−(トリフルオロメチル)ベンズアミド
N−{3−[(2−アミノイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}−3−(トリフルオロメチル)ベンズアミド
tert−ブチル[6−(3−{[3−(トリフルオロメチル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]カルバマート(2.37g,4.62mmol)、4規定塩酸−酢酸エチル溶液(50mL)、メタノール(50mL)の混合物を室温で6時間撹拌した。溶媒を減圧下留去し、残渣に飽和重曹水を加え、酢酸エチルで抽出した。抽出液を無水硫酸マグネシウムで乾燥後、減圧下留去し、残渣をシリカゲルカラムクロマトグラフィー(酢酸エチルのみ→酢酸エチル/メタノール=4:1)で精製し、表題化合物(1.57g,82%)を緑色固体として得た。
1H-NMR (DMSO-d6, 300 MHz) δ5.33 (2H, brs), 6.80 (1H, d, J = 9.0 Hz), 6.94 (1H, m), 7.15 (1H, s), 7.42 (1H, t, J = 7.8 Hz), 7.63-7.80 (4H, m), 7.97 (1H, d, J = 7.5 Hz), 8.23-8.27 (2H, m), 10.54 (1H, s)。
1H-NMR (DMSO-d6, 300 MHz) δ5.33 (2H, brs), 6.80 (1H, d, J = 9.0 Hz), 6.94 (1H, m), 7.15 (1H, s), 7.42 (1H, t, J = 7.8 Hz), 7.63-7.80 (4H, m), 7.97 (1H, d, J = 7.5 Hz), 8.23-8.27 (2H, m), 10.54 (1H, s)。
参考例60
N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)アセトアミド
N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)アセトアミド
6−ヨードイミダゾ[1,2−b]ピリダジン−2−アミン(5.0g,19.2mmol)のN,N−ジメチルアセトアミド(60mL)溶液に塩化アセチル(1.64mL,23.0mmol)のN,N−ジメチルアセトアミド(30mL)溶液を加え、室温で16時間攪拌した。反応混合物に水を加え析出物をろ過し、水で洗浄し、表題化合物(5.21g,90%)を淡黄色粉末として得た。
1H-NMR (DMSO-d6, 300 MHz) δ 2.09 (3H, s), 7.49 (1H, d, J = 9.2 Hz), 7.73 (1H, d, J = 9.2 Hz), 8.25 (1H, s), 10.90 (1H, s)。
1H-NMR (DMSO-d6, 300 MHz) δ 2.09 (3H, s), 7.49 (1H, d, J = 9.2 Hz), 7.73 (1H, d, J = 9.2 Hz), 8.25 (1H, s), 10.90 (1H, s)。
参考例61
N−[6−(3−アミノフェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]アセトアミド
N−[6−(3−アミノフェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]アセトアミド
N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)アセトアミド(5.10g,16.8mmol)、3−アミノフェノール(3.68g,33.7mmol)、炭酸カリウム(5.34g,33.7mmol)、N,N−ジメチルホルムアミド(70mL)の混合物を150℃で6時間攪拌した。室温まで冷却後、酢酸エチル、水を加え、不溶物をセライト上で濾去した。ろ液を酢酸エチルで抽出後、有機層を飽和重曹水で洗浄し、無水硫酸マグネシウムで乾燥、ろ過した。減圧下溶媒を留去、残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル/ヘキサン=35/65→100/0)で精製し表題化合物(3.73g,78%)を淡橙色粉末として得た。
1H-NMR (DMSO-d6, 300 MHz) δ 2.07 (3H, s), 5.30 (2H, s), 6.28-6.33 (1H, m), 6.36 (1H, t, J = 2.2 Hz), 6.41-6.46 (1H, m), 6.95 (1H, d, J = 9.6 Hz), 7.05 (1H, t, J = 8.0 Hz), 7.96-8.02 (2H, m), 10.78 (1H, s)。
1H-NMR (DMSO-d6, 300 MHz) δ 2.07 (3H, s), 5.30 (2H, s), 6.28-6.33 (1H, m), 6.36 (1H, t, J = 2.2 Hz), 6.41-6.46 (1H, m), 6.95 (1H, d, J = 9.6 Hz), 7.05 (1H, t, J = 8.0 Hz), 7.96-8.02 (2H, m), 10.78 (1H, s)。
参考例62
N−{3−[(2−アセトアミドイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}−3−(1−シアノシクロプロピル)ベンズアミド
N−{3−[(2−アセトアミドイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}−3−(1−シアノシクロプロピル)ベンズアミド
3−(1−シアノシクロプロピル)安息香酸(1.50g,8.01mmol)のテトラヒドロフラン(30mL)溶液にN,N−ジメチルホルムアミド(2滴)、オキサリルクロライド(1.16mL,13.3mmol)を加え、室温で1.5時間撹拌した。減圧下溶媒を留去、残渣とN−[6−(3−アミノフェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]アセトアミド(1.89g,6.67mmol)をN−メチルピロリドン(30mL)に溶解させ、室温で3時間撹拌した。反応混合物に飽和重曹水を加え、酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄、無水硫酸マグネシウムで乾燥、ろ過した。残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル/ヘキサン=0/100→100/0)で精製し、表題化合物(2.25g,75%)を淡茶色粉末として得た。
1H-NMR (DMSO-d6, 300 MHz) δ 1.58-1.65 (2H, m), 1.77-1.84 (2H, m), 2.07 (3H, s), 6.99-7.11 (2H, m), 7.45 (1H, t, J = 8.2 Hz), 7.51-7.60 (2H, m), 7.62-7.68 (1H, m), 7.72 (1H, t, J = 2.1 Hz), 7.82 (1H, s), 7.84-7.90 (1H, m), 8.00 (1H, s), 8.05 (1H, d, J = 9.6 Hz), 10.42 (1H, s), 10.80 (1H, s)。
1H-NMR (DMSO-d6, 300 MHz) δ 1.58-1.65 (2H, m), 1.77-1.84 (2H, m), 2.07 (3H, s), 6.99-7.11 (2H, m), 7.45 (1H, t, J = 8.2 Hz), 7.51-7.60 (2H, m), 7.62-7.68 (1H, m), 7.72 (1H, t, J = 2.1 Hz), 7.82 (1H, s), 7.84-7.90 (1H, m), 8.00 (1H, s), 8.05 (1H, d, J = 9.6 Hz), 10.42 (1H, s), 10.80 (1H, s)。
参考例63
N−{3−[(2−アミノイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}−3−(1−シアノシクロプロピル)ベンズアミド
N−{3−[(2−アミノイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}−3−(1−シアノシクロプロピル)ベンズアミド
N−{3−[(2−アセトアミドイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}−3−(1−シアノシクロプロピル)ベンズアミド(2.20g,4.86mmol)、4規定塩酸−酢酸エチル溶液(35mL)、メタノール(35mL)の混合物を室温で14時間撹拌した。8規定水酸化ナトリウム水溶液を加えて中和し、酢酸エチルにて抽出した。抽出液を飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥、ろ過した。減圧下溶媒を留去、残渣をジイソプロピルエーテルで洗浄し、表題化合物(1.63g,82%)を黄色粉末として得た。
1H-NMR (DMSO-d6, 300 MHz) δ 1.58-1.64 (2H, m), 1.77-1.84 (2H, m), 5.34 (2H, brs), 6.80 (1H, d, J = 9.3 Hz), 6.91-6.97 (1H, m), 7.15 (1H, s), 7.41 (1H, t, J = 8.3 Hz), 7.51-7.67 (4H, m), 7.73 (1H, d, J = 9.3 Hz), 7.81 (1H, s), 7.84-7.89 (1H, m), 10.38 (1H, s)。
1H-NMR (DMSO-d6, 300 MHz) δ 1.58-1.64 (2H, m), 1.77-1.84 (2H, m), 5.34 (2H, brs), 6.80 (1H, d, J = 9.3 Hz), 6.91-6.97 (1H, m), 7.15 (1H, s), 7.41 (1H, t, J = 8.3 Hz), 7.51-7.67 (4H, m), 7.73 (1H, d, J = 9.3 Hz), 7.81 (1H, s), 7.84-7.89 (1H, m), 10.38 (1H, s)。
参考例64
N−(3−{[2−(アセチルアミノ)イミダゾ[1,2−b]ピリダジン−6−イル]オキシ}フェニル)シクロプロパンカルボキサミド
N−(3−{[2−(アセチルアミノ)イミダゾ[1,2−b]ピリダジン−6−イル]オキシ}フェニル)シクロプロパンカルボキサミド
N−[6−(3−アミノフェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]アセトアミド(17mg,0.06mmol)、シクロプロパンカルボニルクロライド(9.5mg,0.09mmol)、N,N−ジメチルアセトアミド(0.5mL)の混合物を室温で14時間撹拌した。反応混合物を分取HPLCで精製して表題化合物(10.8mg,51%)を得た。
LC-MS 352(M+H).
LC-MS 352(M+H).
参考例65
N−{3−[(2−アミノイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}シクロプロパンカルボキサミド
N−{3−[(2−アミノイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}シクロプロパンカルボキサミド
N−{3−[(2−アセトアミドイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}シクロプロパンカルボキサミド(465mg,1.32mmol)、4規定塩酸−酢酸エチル溶液(10mL)、メタノール(10mL)の混合物を室温で14時間撹拌した。8規定水酸化ナトリウム水溶液を加えて中和し、酢酸エチルにて抽出した。抽出液を飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥、ろ過した。減圧下溶媒を留去、残渣を酢酸エチル/ジイソプロピルエーテルで洗浄し、表題化合物(376mg,92%)を淡緑色粉末として得た。
1H-NMR (DMSO-d6, 300 MHz) δ 0.75-0.81 (4H, m), 1.69-1.79 (1H, m), 5.33 (2H, s), 6.76 (1H, d, J = 9.3 Hz), 6.80-6.86 (1H, m), 7.14 (1H, s), 7.28-7.39 (2H, m), 7.47 (1H, t, J = 1.9 Hz), 7.71 (1H, d, J = 9.3 Hz), 10.30 (1H, s)。
1H-NMR (DMSO-d6, 300 MHz) δ 0.75-0.81 (4H, m), 1.69-1.79 (1H, m), 5.33 (2H, s), 6.76 (1H, d, J = 9.3 Hz), 6.80-6.86 (1H, m), 7.14 (1H, s), 7.28-7.39 (2H, m), 7.47 (1H, t, J = 1.9 Hz), 7.71 (1H, d, J = 9.3 Hz), 10.30 (1H, s)。
実施例1
4−シアノ−N−(6−フェニルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド トリフルオロ酢酸塩
4−シアノ−N−(6−フェニルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド トリフルオロ酢酸塩
参考例41で得られた2−アミノ−6−フェニルイミダゾ[1,2−b]ピリダジン(11mg,0.05mmol)、4−シアノベンゾイルクロライド(10mg,0.06mmol)、N,N−ジメチルアセトアミド(0.5mL)の混合物を室温で14時間攪拌した。反応混合物に水を加え、ジクロロメタンで抽出した。有機層をテフロン(登録商標)製フィルターでろ過し、濃縮して残留物を分取HPLCで精製して表題化合物(10.1mg、収率44%)を得た。
LC-MS 340(M+H).
LC-MS 340(M+H).
実施例2〜13
実施例1と同様の方法に従い、各種アミン体と酸クロライドとの反応を行い、目的生成物を純度80%以上(LC/MS)で得た。実施例2〜13で得られた化合物の構造式およびマススペクトルのデータを表1および表2に示す。
実施例1と同様の方法に従い、各種アミン体と酸クロライドとの反応を行い、目的生成物を純度80%以上(LC/MS)で得た。実施例2〜13で得られた化合物の構造式およびマススペクトルのデータを表1および表2に示す。
実施例14
4−tert−ブチル−N−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イル)ベンズアミド
4−tert−ブチル−N−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イル)ベンズアミド
参考例17で合成した1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−アミン(120mg,0.69mmol)、塩化 4-tert-ブチルベンゾイル(0.14mL,0.73mmol)、トリエチルアミン(0.24mL,1.7mmol)をTHF(30mL)に溶解させ、室温で2時間攪拌した。反応混合物を水で希釈し、酢酸エチル/THFで抽出した。抽出液を飽和炭酸水素ナトリウム水溶液と飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。得られた残渣を塩基性シリカゲルカラムクロマトグラフィー(50−100% 酢酸エチル/ヘキサン)で精製した。得られた粗結晶をアセトニトリルから再結晶することにより、表題化合物(収量49mg,収率21%)を得た。
融点 266−268℃
MS (ESI+): 336 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 3.53 (2H, t, J = 8.9 Hz), 4.75 (2H, t, J = 8.9Hz), 7.06 (1H, d, J = 9.1 Hz), 7.31 (1H, d, J = 9.1 Hz), 7.53 (2H, d, J = 8.3 Hz), 7.97-8.06 (3H, m), 11.13 (1H, s)。
元素分析値:C20H21N3O2として
計算値:C, 71.62; H, 6.31; N, 12.53。
実測値:C, 71.58; H, 6.35; N, 12.58。
融点 266−268℃
MS (ESI+): 336 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 3.53 (2H, t, J = 8.9 Hz), 4.75 (2H, t, J = 8.9Hz), 7.06 (1H, d, J = 9.1 Hz), 7.31 (1H, d, J = 9.1 Hz), 7.53 (2H, d, J = 8.3 Hz), 7.97-8.06 (3H, m), 11.13 (1H, s)。
元素分析値:C20H21N3O2として
計算値:C, 71.62; H, 6.31; N, 12.53。
実測値:C, 71.58; H, 6.35; N, 12.58。
実施例15
2−[4−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イルカルバモイル)フェニル]−2−メチルプロパン酸メチル
2−[4−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イルカルバモイル)フェニル]−2−メチルプロパン酸メチル
参考例1で合成した4−(2−メトキシ−1,1−ジメチル−2−オキソエチル)安息香酸(0.35g,1.6mmol)をジクロロメタン(10mL)に懸濁させ、二塩化オキサリル(0.20mL,2.3mmol)と触媒量のDMFを加え、室温で30分攪拌した。減圧下溶媒を留去し、残渣にトルエンを加え、再び、減圧下溶媒を留去した。得られた残渣をTHF(20mL)に溶解させ、参考例17で合成した1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−アミン(0.24g,1.4mmol)とトリエチルアミン(0.59mL,2.3mmol)を加え、室温で3時間攪拌した。反応混合物を水で希釈し、酢酸エチル/THFで抽出した。抽出液を飽和炭酸水素ナトリウム水溶液と飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。残渣を塩基性シリカゲルカラムクロマトグラフィー(50−100% 酢酸エチル/ヘキサン)で精製することにより、表題化合物(収量0.16g,収率30%)を得た。
融点 235−237℃
1H-NMR (DMSO-d6) δ: 1.55 (6H, s), 3.53 (2H, t, J = 8.9 Hz), 3.62 (3H, s), 4.75 (2H, t, J = 8.9 Hz), 7.07 (1H, d, J = 9.5 Hz), 7.32 (1H, d, J = 9.5 Hz), 7.44 (2H, d, J = 8.3 Hz), 8.00 (1H, s), 8.04 (2H, d, J = 8.3 Hz), 11.20 (1H, s)。
元素分析値:C21H21N3O4として
計算値:C, 66.48; H, 5.58; N, 11.08。
実測値:C, 66.30; H, 5.50; N, 11.20。
融点 235−237℃
1H-NMR (DMSO-d6) δ: 1.55 (6H, s), 3.53 (2H, t, J = 8.9 Hz), 3.62 (3H, s), 4.75 (2H, t, J = 8.9 Hz), 7.07 (1H, d, J = 9.5 Hz), 7.32 (1H, d, J = 9.5 Hz), 7.44 (2H, d, J = 8.3 Hz), 8.00 (1H, s), 8.04 (2H, d, J = 8.3 Hz), 11.20 (1H, s)。
元素分析値:C21H21N3O4として
計算値:C, 66.48; H, 5.58; N, 11.08。
実測値:C, 66.30; H, 5.50; N, 11.20。
実施例16
2−[4−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イルカルバモイル)フェニル]−2−メチルプロパン酸
2−[4−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イルカルバモイル)フェニル]−2−メチルプロパン酸
実施例15で合成した2−[4−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イルカルバモイル)フェニル]−2−メチルプロパン酸メチル(0.14g,0.36mmol)のメタノール(10mL)/THF(10mL)/水(10mL)混合溶液に8規定の水酸化カリウム水溶液(0.45mL,3.6mmol)を加え、50℃で3時間攪拌した。反応混合物を減圧下濃縮し、これに水と酢酸エチルを加えた。水層を1規定塩酸で酸性にし、生じた白色沈殿をろ取した。得られた白色沈殿をアセトニトリルとジエチルエーテルで洗浄し、DMSO/エタノールから再結晶することにより、標題化合物(収量0.67g,収率51%)を得た。
融点 293−295℃
MS (ESI+): 366 (M+H)。
1H-NMR (DMSO-d6) δ: 1.51 (6H, s), 3.53 (2H, t, J = 9.1 Hz), 4.75 (2H, t, J = 9.1 Hz), 7.06 (1H, d, J = 9.5 Hz), 7.31 (1H, d, J = 9.5 Hz), 7.47 (2H, d, J = 8.3 Hz), 8.00 (1H, s), 8.04 (2H, d, J = 8.3 Hz), 11.18 (1H, s), 12.52 (1H, br)。
元素分析値:C20H19N3O4として
計算値:C, 65.74; H, 5.24; N, 11.50。
実測値:C, 65.52; H, 5.11; N, 11.41。
融点 293−295℃
MS (ESI+): 366 (M+H)。
1H-NMR (DMSO-d6) δ: 1.51 (6H, s), 3.53 (2H, t, J = 9.1 Hz), 4.75 (2H, t, J = 9.1 Hz), 7.06 (1H, d, J = 9.5 Hz), 7.31 (1H, d, J = 9.5 Hz), 7.47 (2H, d, J = 8.3 Hz), 8.00 (1H, s), 8.04 (2H, d, J = 8.3 Hz), 11.18 (1H, s), 12.52 (1H, br)。
元素分析値:C20H19N3O4として
計算値:C, 65.74; H, 5.24; N, 11.50。
実測値:C, 65.52; H, 5.11; N, 11.41。
実施例17
6−tert−ブチル−N−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イル)ニコチンアミド
6−tert−ブチル−N−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イル)ニコチンアミド
実施例15と同様にして、参考例37で合成した6−tert−ブチルニコチン酸(0.11g,0.63mmol)と参考例17で合成した1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−アミン(0.10g,0.57mmol)を用い、表題化合物(収量0.10g,収率52%)を得た。
融点 246−248℃
MS (ESI+): 337 (M+H)。
1H-NMR (DMSO-d6) δ: 1.35 (9H, s), 3.53 (2H, t, J = 9.1 Hz), 4.76 (2H, t, J = 9.1 Hz), 7.08 (1H, d, J = 9.5 Hz), 7.33 (1H, d, J = 9.5 Hz), 7.58 (1H, d, J = 8.3 Hz), 8.01 (1H, s), 8.35 (1H, dd, J = 8.3, 1.9 Hz), 9.13 (1H, d, J = 1.9 Hz), 11.39 (1H, s)。
元素分析値:C19H20N4O2として
計算値:C, 67.84; H, 5.99; N, 16.66。
実測値:C, 67.69; H, 5.99; N, 16.66。
融点 246−248℃
MS (ESI+): 337 (M+H)。
1H-NMR (DMSO-d6) δ: 1.35 (9H, s), 3.53 (2H, t, J = 9.1 Hz), 4.76 (2H, t, J = 9.1 Hz), 7.08 (1H, d, J = 9.5 Hz), 7.33 (1H, d, J = 9.5 Hz), 7.58 (1H, d, J = 8.3 Hz), 8.01 (1H, s), 8.35 (1H, dd, J = 8.3, 1.9 Hz), 9.13 (1H, d, J = 1.9 Hz), 11.39 (1H, s)。
元素分析値:C19H20N4O2として
計算値:C, 67.84; H, 5.99; N, 16.66。
実測値:C, 67.69; H, 5.99; N, 16.66。
実施例18
6−tert−ブチル−N−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イル)ニコチンアミド 二塩酸塩
6−tert−ブチル−N−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イル)ニコチンアミド 二塩酸塩
実施例17で合成した6−tert−ブチル−N−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イル)ニコチンアミド(50mg,0.15mmol)をメタノールに溶解させ、10%HClのメタノール溶液を加え、室温で30分攪拌した。減圧下溶媒を留去し、残渣をメタノール/ジエチルエーテルから再結晶することにより、表題化合物(収量50mg,収率81%)を得た。
融点 199−200℃
MS (ESI+): 337 (M+H)。
1H-NMR (DMSO-d6) δ: 1.39 (9H, s), 3.68 (2H, t, J = 9.1 Hz), 4.86 (2H, t, J = 9.1 Hz), 7.54 (1H, d, J = 9.5 Hz), 7.72-7.76 (2H, m), 8.12 (1H, s), 8.51 (1H, dd, J = 8.3, 1.9 Hz), 9.24 (1H, d, J = 1.9 Hz), 12.50 (1H, s)。
元素分析値:C19H20N4O2・2HCl+0.1H2Oとして
計算値:C, 55.51; H, 5.44; N, 13.63; Cl, 17.25。
実測値:C, 55.15; H, 5.29; N, 13.67; Cl. 17.23。
融点 199−200℃
MS (ESI+): 337 (M+H)。
1H-NMR (DMSO-d6) δ: 1.39 (9H, s), 3.68 (2H, t, J = 9.1 Hz), 4.86 (2H, t, J = 9.1 Hz), 7.54 (1H, d, J = 9.5 Hz), 7.72-7.76 (2H, m), 8.12 (1H, s), 8.51 (1H, dd, J = 8.3, 1.9 Hz), 9.24 (1H, d, J = 1.9 Hz), 12.50 (1H, s)。
元素分析値:C19H20N4O2・2HCl+0.1H2Oとして
計算値:C, 55.51; H, 5.44; N, 13.63; Cl, 17.25。
実測値:C, 55.15; H, 5.29; N, 13.67; Cl. 17.23。
実施例19
2−メチル−2−{4−[(6−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}プロパン酸メチル
2−メチル−2−{4−[(6−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}プロパン酸メチル
実施例15と同様にして、参考例1で合成した4−(2−メトキシ−1,1−ジメチル−2−オキソエチル)安息香酸(1.9g,8.7mmol)と参考例26で合成した6−メチルイミダゾ[1,2−a]ピリジン−2−アミン(1.1g,7.3mmol)を用い、表題化合物(収量0.32g,収率12%)を得た。
融点 228−230℃
MS (ESI+): 352 (M+H)。
1H-NMR (DMSO-d6) δ: 1.54 (6H, s), 2.28 (3H, s), 3.61 (3H, s), 7.10 (1H, dd, J = 9.1, 1.7 Hz), 7.36 (1H, d, J = 9.1 Hz), 7.43 (2H, d, J = 8.3 Hz), 8.03 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.38 (1H, s), 11.12 (1H, s)。
元素分析値:C20H21N3O3として
計算値:C, 68.36; H, 6.02; N, 11.96。
実測値:C, 68.24; H, 6.04; N, 11.96。
融点 228−230℃
MS (ESI+): 352 (M+H)。
1H-NMR (DMSO-d6) δ: 1.54 (6H, s), 2.28 (3H, s), 3.61 (3H, s), 7.10 (1H, dd, J = 9.1, 1.7 Hz), 7.36 (1H, d, J = 9.1 Hz), 7.43 (2H, d, J = 8.3 Hz), 8.03 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.38 (1H, s), 11.12 (1H, s)。
元素分析値:C20H21N3O3として
計算値:C, 68.36; H, 6.02; N, 11.96。
実測値:C, 68.24; H, 6.04; N, 11.96。
実施例20
2−[4−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イルカルバモイル)フェニル]−2−メチルプロパン酸
2−[4−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イルカルバモイル)フェニル]−2−メチルプロパン酸
実施例16と同様にして、実施例19で合成した2−メチル−2−{4−[(6−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}プロパン酸メチル(0.20g,0.57mmol)を用い、表題化合物(収量0.12g,収率62%)を得た。
融点 275−277℃
MS (ESI+): 338 (M+H)。
1H-NMR (DMSO-d6) δ: 1.51 (6H, s), 2.28 (3H, s), 7.10 (1H, dd, J = 9.0, 1.6 Hz), 7.36 (1H, d, J = 9.0 Hz), 7.46 (2H, d, J = 8.7 Hz), 8.03 (2H, d, J = 8.7 Hz), 8.19 (1H, s), 8.39 (1H, s), 11.11 (1H, s), 12.51 (1H, br)。
元素分析値:C19H19N3O3+0.1H2Oとして
計算値:C, 67.28; H, 5.71; N, 12.39。
実測値:C, 67.11; H, 5.69; N, 12.24。
融点 275−277℃
MS (ESI+): 338 (M+H)。
1H-NMR (DMSO-d6) δ: 1.51 (6H, s), 2.28 (3H, s), 7.10 (1H, dd, J = 9.0, 1.6 Hz), 7.36 (1H, d, J = 9.0 Hz), 7.46 (2H, d, J = 8.7 Hz), 8.03 (2H, d, J = 8.7 Hz), 8.19 (1H, s), 8.39 (1H, s), 11.11 (1H, s), 12.51 (1H, br)。
元素分析値:C19H19N3O3+0.1H2Oとして
計算値:C, 67.28; H, 5.71; N, 12.39。
実測値:C, 67.11; H, 5.69; N, 12.24。
実施例21
4−メチル−4−{4−[(6−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}ペンタン酸エチル
4−メチル−4−{4−[(6−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}ペンタン酸エチル
実施例15と同様にして、参考例6で合成した4−(4−エトキシ−1,1−ジメチル−4−オキソブチル)安息香酸(0.99g,3.7mmol)と参考例26で合成した6−メチルイミダゾ[1,2−a]ピリジン−2−アミン(0.50g,3.4mmol)を用い、表題化合物(収量0.24g,収率18%)を得た。
融点 152−154℃
MS (ESI+): 394 (M+H)。
1H-NMR (DMSO-d6) δ: 1.12 (3H, t, J = 6.9 Hz), 1.30 (6H, s), 1.81-2.08 (4H, m), 2.28 (3H, s), 3.97 (2H, q, J = 6.9 Hz), 7.10 (1H, dd, J = 9.1, 1.5 Hz), 7.36 (1H, d, J = 9.1 Hz), 7.47 (2H, d, J = 8.7 Hz), 8.03 (2H, d, J = 8.7 Hz), 8.19 (1H, s), 8.38 (1H, s), 11.07 (1H, s)。
元素分析値:C23H27N3O3として
計算値:C, 70.21; H, 6.92; N, 10.68。
実測値:C, 70.21; H, 6.92; N, 10.76。
融点 152−154℃
MS (ESI+): 394 (M+H)。
1H-NMR (DMSO-d6) δ: 1.12 (3H, t, J = 6.9 Hz), 1.30 (6H, s), 1.81-2.08 (4H, m), 2.28 (3H, s), 3.97 (2H, q, J = 6.9 Hz), 7.10 (1H, dd, J = 9.1, 1.5 Hz), 7.36 (1H, d, J = 9.1 Hz), 7.47 (2H, d, J = 8.7 Hz), 8.03 (2H, d, J = 8.7 Hz), 8.19 (1H, s), 8.38 (1H, s), 11.07 (1H, s)。
元素分析値:C23H27N3O3として
計算値:C, 70.21; H, 6.92; N, 10.68。
実測値:C, 70.21; H, 6.92; N, 10.76。
実施例22
4−メチル−4−{4−[(6−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}ペンタン酸
4−メチル−4−{4−[(6−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}ペンタン酸
実施例16と同様にして、実施例21で合成した4−メチル−4−{4−[(6−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}ペンタン酸エチル(0.21g,0.54mmol)を用い、表題化合物(収量0.15g,収率76%)を得た。
融点 280−282℃
MS (ESI+): 366 (M+H)。
1H-NMR (DMSO-d6) δ: 1.30 (6H, s), 1.88 (4H, s), 2.28 (3H, s), 7.08-7.11 (1H, m), 7.36 (1H, d, J = 9.1 Hz), 7.47 (2H, d, J = 8.3 Hz), 8.02 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.39 (1H, s), 11.07 (1H, s)。
元素分析値:C21H23N3O3として
計算値:C, 69.02; H, 6.34; N, 11.50。
実測値:C, 68.93; H, 6.26; N, 11.55。
融点 280−282℃
MS (ESI+): 366 (M+H)。
1H-NMR (DMSO-d6) δ: 1.30 (6H, s), 1.88 (4H, s), 2.28 (3H, s), 7.08-7.11 (1H, m), 7.36 (1H, d, J = 9.1 Hz), 7.47 (2H, d, J = 8.3 Hz), 8.02 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.39 (1H, s), 11.07 (1H, s)。
元素分析値:C21H23N3O3として
計算値:C, 69.02; H, 6.34; N, 11.50。
実測値:C, 68.93; H, 6.26; N, 11.55。
実施例23
2−{4−[(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}−2−メチルプロパン酸メチル
2−{4−[(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}−2−メチルプロパン酸メチル
実施例15と同様にして、参考例1で合成した4−(2−メトキシ−1,1−ジメチル−2−オキソエチル)安息香酸(4.7g,21mmol)と参考例23で合成した6−ヨードイミダゾ[1,2−a]ピリジン−2−アミン(5.0g,19mmol)を用い、表題化合物(収量3.3g,収率37%)を得た。
融点 234−235℃
MS (ESI+): 464 (M+H)。
1H-NMR (DMSO-d6) δ: 1.54 (6H, s), 3.62 (3H, s), 7.32 (1H, d, J = 9.1 Hz), 7.40-7.45 (3H, m), 8.03 (2H, d, J = 8.3 Hz), 8.28 (1H, s), 8.97 (1H, s), 11.23 (1H, s)。
元素分析値:C19H18N3O3Iとして
計算値:C, 49.26; H, 3.92; N, 9.07。
実測値:C, 49.20; H, 3.86; N, 9.28。
融点 234−235℃
MS (ESI+): 464 (M+H)。
1H-NMR (DMSO-d6) δ: 1.54 (6H, s), 3.62 (3H, s), 7.32 (1H, d, J = 9.1 Hz), 7.40-7.45 (3H, m), 8.03 (2H, d, J = 8.3 Hz), 8.28 (1H, s), 8.97 (1H, s), 11.23 (1H, s)。
元素分析値:C19H18N3O3Iとして
計算値:C, 49.26; H, 3.92; N, 9.07。
実測値:C, 49.20; H, 3.86; N, 9.28。
実施例24
2−メチル−2−(4−{[6−(3−チエニル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)プロパン酸メチル
2−メチル−2−(4−{[6−(3−チエニル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)プロパン酸メチル
実施例23で合成した2−{4−[(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}−2−メチルプロパン酸メチル(0.50g,1.1mmol)、3−チエニルボロン酸(0.41g,3.2mmol)、テトラキス(トリフェニルホスフィン)パラジウム(0)(0.12g,0.11mmol)、炭酸ナトリウム(0.69g,6.5mmol)を1,2−ジメトキシエタン(25mL)/水(5mL)混合溶液に溶解させ、窒素雰囲気下、100℃で終夜攪拌した。反応液を室温まで放冷した後、水で希釈し、酢酸エチル/THFで抽出した。抽出液を飽和食塩水で洗浄した後、無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。残渣をシリカゲルカラムクロマトグラフィー(20−50% 酢酸エチル/ヘキサン)で精製した。得られた粗結晶をアセトニトリルから再結晶することにより、表題化合物(収量0.28g,収率67%)を得た。
融点 200−201℃
MS (ESI+): 420 (M+H)。
1H-NMR (DMSO-d6) δ: 1.55 (6H, s), 3.62 (3H, s), 7.45 (2H, d, J = 8.3 Hz), 7.51 (1H, d, J = 9.1 Hz), 7.59 (1H, d, J = 4.9 Hz), 7.66-7.73 (2H, m), 7.91-7.92 (1H, m), 8.05 (2H, d, J = 8.3 Hz), 8.29 (1H, s), 9.04 (1H, s), 11.22 (1H, s)。
元素分析値:C23H21N3O3Sとして
計算値:C, 65.85; H, 5.05; N, 10.02。
実測値:C, 65.89; H, 5.06; N, 10.09。
融点 200−201℃
MS (ESI+): 420 (M+H)。
1H-NMR (DMSO-d6) δ: 1.55 (6H, s), 3.62 (3H, s), 7.45 (2H, d, J = 8.3 Hz), 7.51 (1H, d, J = 9.1 Hz), 7.59 (1H, d, J = 4.9 Hz), 7.66-7.73 (2H, m), 7.91-7.92 (1H, m), 8.05 (2H, d, J = 8.3 Hz), 8.29 (1H, s), 9.04 (1H, s), 11.22 (1H, s)。
元素分析値:C23H21N3O3Sとして
計算値:C, 65.85; H, 5.05; N, 10.02。
実測値:C, 65.89; H, 5.06; N, 10.09。
実施例25
2−メチル−2−(4−{[6−(3−チエニル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)プロパン酸
2−メチル−2−(4−{[6−(3−チエニル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)プロパン酸
実施例16と同様にして、実施例24で合成した2−メチル−2−(4−{[6−(3−チエニル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)プロパン酸メチル(0.20g,0.47mmol)を用い、表題化合物(収量0.10g,収率53%)を得た。
融点 304−306℃
MS (ESI+): 406 (M+H)。
1H-NMR (DMSO-d6) δ: 1.51 (6H, s), 7.46-7.52 (3H, m), 7.59 (1H, dd, J = 4.9, 1.3 Hz), 7.67 (1H, dd, J = 9.3, 1.7 Hz), 7.71 (1H, dd, J = 4.9, 2.8 Hz), 7.91 (1H, dd, J = 2.8, 1.3 Hz),8.05 (2H, d, J = 8.3 Hz), 8.29 (1H, s), 9.04 (1H, s), 11.21 (1H, s), 12.51 (1H, br)。
元素分析値:C22H19N3O3Sとして
計算値:C, 65.17; H, 4.72; N, 10.36。
実測値:C, 64.93; H, 4.80; N, 10.32。
融点 304−306℃
MS (ESI+): 406 (M+H)。
1H-NMR (DMSO-d6) δ: 1.51 (6H, s), 7.46-7.52 (3H, m), 7.59 (1H, dd, J = 4.9, 1.3 Hz), 7.67 (1H, dd, J = 9.3, 1.7 Hz), 7.71 (1H, dd, J = 4.9, 2.8 Hz), 7.91 (1H, dd, J = 2.8, 1.3 Hz),8.05 (2H, d, J = 8.3 Hz), 8.29 (1H, s), 9.04 (1H, s), 11.21 (1H, s), 12.51 (1H, br)。
元素分析値:C22H19N3O3Sとして
計算値:C, 65.17; H, 4.72; N, 10.36。
実測値:C, 64.93; H, 4.80; N, 10.32。
実施例26
2−メチル−2−(4−{[6−(3−フリル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)プロパン酸メチル
2−メチル−2−(4−{[6−(3−フリル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)プロパン酸メチル
実施例24と同様にして、実施例23で合成した2−{4−[(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}−2−メチルプロパン酸メチル(0.50g,1.1mmol)、3−フリルボロン酸(0.36g,3.2mmol)を用い、表題化合物(収量0.26g,収率61%)を得た。
融点 202−203℃
MS (ESI+): 404 (M+H)。
1H-NMR (DMSO-d6) δ: 1.55 (6H, s), 3.62 (3H, s), 6.97 (1H, s), 7.43-7.57 (4H, m), 7.79 (1H, d, J = 1.5 Hz), 8.05 (2H, d, J = 8.3 Hz), 8.23-8.25 (2H, m), 8.91 (1H, s), 11.21 (1H, s)。
元素分析値:C23H21N3O4として
計算値:C, 68.47; H, 5.25; N, 10.42。
実測値:C, 68.47; H, 5.32; N, 10.52。
融点 202−203℃
MS (ESI+): 404 (M+H)。
1H-NMR (DMSO-d6) δ: 1.55 (6H, s), 3.62 (3H, s), 6.97 (1H, s), 7.43-7.57 (4H, m), 7.79 (1H, d, J = 1.5 Hz), 8.05 (2H, d, J = 8.3 Hz), 8.23-8.25 (2H, m), 8.91 (1H, s), 11.21 (1H, s)。
元素分析値:C23H21N3O4として
計算値:C, 68.47; H, 5.25; N, 10.42。
実測値:C, 68.47; H, 5.32; N, 10.52。
実施例27
2−メチル−2−(4−{[6−(3−フリル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)プロパン酸
2−メチル−2−(4−{[6−(3−フリル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)プロパン酸
実施例16と同様にして、実施例26で合成した2−メチル−2−(4−{[6−(3−フリル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)プロパン酸メチル(0.18g,0.43mmol)を用い、表題化合物(収量76mg,収率45%)を得た。
融点 307−309℃
MS (ESI+): 390 (M+H)。
1H-NMR (DMSO-d6) δ: 1.51 (6H, s), 6.98 (1H, s), 7.46-7.50 (3H, m), 7.79 (1H, d, J = 1.5 Hz), 8.05 (2H, d, J = 8.3 Hz), 8.23-8.26 (2H, m), 8.91 (1H, s), 11.20 (1H, s), 12.51 (1H, br)。
元素分析値:C22H19N3O4+0.1H2Oとして
計算値:C, 67.54; H, 4.95; N, 10.74。
実測値:C, 67.31; H, 4.94; N, 10.58。
融点 307−309℃
MS (ESI+): 390 (M+H)。
1H-NMR (DMSO-d6) δ: 1.51 (6H, s), 6.98 (1H, s), 7.46-7.50 (3H, m), 7.79 (1H, d, J = 1.5 Hz), 8.05 (2H, d, J = 8.3 Hz), 8.23-8.26 (2H, m), 8.91 (1H, s), 11.20 (1H, s), 12.51 (1H, br)。
元素分析値:C22H19N3O4+0.1H2Oとして
計算値:C, 67.54; H, 4.95; N, 10.74。
実測値:C, 67.31; H, 4.94; N, 10.58。
実施例28
2−メチル−2−(4−{[6−(1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)プロパン酸メチル
2−メチル−2−(4−{[6−(1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)プロパン酸メチル
実施例24と同様にして、実施例23で合成した2−{4−[(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}−2−メチルプロパン酸メチル(0.50g,1.1mmol)、1H−ピラゾール−4−イルボロン酸(0.36g,3.2mmol)を用い、表題化合物(収量90mg,収率21%)を得た。
融点 248−249℃
1H-NMR (DMSO-d6) δ: 1.55 (6H, s), 3.62 (3H, s), 7.43-7.56 (4H, m), 8.05 (2H, d, J = 8.7 Hz), 8.16 (2H, br), 8.23 (1H, s), 8.89 (1H, s), 11.20 (1H, s), 13.02 (1H, br)。
融点 248−249℃
1H-NMR (DMSO-d6) δ: 1.55 (6H, s), 3.62 (3H, s), 7.43-7.56 (4H, m), 8.05 (2H, d, J = 8.7 Hz), 8.16 (2H, br), 8.23 (1H, s), 8.89 (1H, s), 11.20 (1H, s), 13.02 (1H, br)。
実施例29
2−メチル−2−(4−{[6−(1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)プロパン酸
2−メチル−2−(4−{[6−(1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)プロパン酸
実施例16と同様にして、実施例28で合成した2−メチル−2−(4−{[6−(1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)プロパン酸メチル(0.11g,0.27mmol)を用い、表題化合物(収量76mg,収率45%)を得た。
融点 306−307℃
MS (ESI+): 390 (M+H)。
1H-NMR (DMSO-d6) δ: 1.51 (6H, s), 7.46-7.49 (3H, m), 7.54 (1H, dd, J = 9.1, 1.9Hz), 7.96-8.10 (4H, m), 8.23 (1H, s), 8.88 (1H, s), 11.17 (1H, s), 12.76 (2H, br)。
元素分析値:C21H19N5O3+0.3H2Oとして
計算値:C, 63.88; H, 5.00; N, 17.74。
実測値:C, 63.96; H, 4.99; N, 17.40。
融点 306−307℃
MS (ESI+): 390 (M+H)。
1H-NMR (DMSO-d6) δ: 1.51 (6H, s), 7.46-7.49 (3H, m), 7.54 (1H, dd, J = 9.1, 1.9Hz), 7.96-8.10 (4H, m), 8.23 (1H, s), 8.88 (1H, s), 11.17 (1H, s), 12.76 (2H, br)。
元素分析値:C21H19N5O3+0.3H2Oとして
計算値:C, 63.88; H, 5.00; N, 17.74。
実測値:C, 63.96; H, 4.99; N, 17.40。
実施例30
2−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}−2−メチルプロパン酸メチル
2−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}−2−メチルプロパン酸メチル
実施例15と同様にして、参考例1で合成した4−(2−メトキシ−1,1−ジメチル−2−オキソエチル)安息香酸(0.36g,1.7mmol)と参考例21で合成した6−クロロイミダゾ[1,2−a]ピリジン−2−アミン(0.23g,1.4mmol)を用い、表題化合物(収量0.21g,収率41%)を得た。
融点 245−246℃
1H-NMR (DMSO-d6) δ: 1.54 (6H, s), 3.61 (3H, s), 7.28 (1H, dd, J = 9.3, 2.0 Hz), 7.43 (2H, d, J = 8.1 Hz), 7.50 (1H, d, J = 9.3 Hz), 8.03 (2H, d, J = 8.1 Hz), 8.32 (1H, s), 8.87-8.88 (1H, m), 11.27 (1H, s)。
元素分析値:C19H18N3O3Clとして
計算値:C, 61.38; H, 4.88; N, 11.30。
実測値:C, 61.30; H, 4.99; N, 11.43。
融点 245−246℃
1H-NMR (DMSO-d6) δ: 1.54 (6H, s), 3.61 (3H, s), 7.28 (1H, dd, J = 9.3, 2.0 Hz), 7.43 (2H, d, J = 8.1 Hz), 7.50 (1H, d, J = 9.3 Hz), 8.03 (2H, d, J = 8.1 Hz), 8.32 (1H, s), 8.87-8.88 (1H, m), 11.27 (1H, s)。
元素分析値:C19H18N3O3Clとして
計算値:C, 61.38; H, 4.88; N, 11.30。
実測値:C, 61.30; H, 4.99; N, 11.43。
実施例31
2−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}−2−メチルプロパン酸
2−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}−2−メチルプロパン酸
実施例16と同様にして、実施例30で合成した2−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}−2−メチルプロパン酸メチル(1.2g,0.27mmol)を用い、表題化合物(収量0.73g,収率64%)を得た。
融点 311−313℃
MS (ESI+): 358 (M+H)。
1H-NMR (DMSO-d6) δ: 1.51 (6H, s), 7.28 (1H, dd, J = 9.5, 2.2 Hz), 7.46-7.52 (3H, m), 8.03 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 8.88 (1H, dd, J = 2.2, 0.9 Hz), 11.27 (1H, s), 12.52 (1H, br)。
元素分析値:C18H16N3O3Cl+0.2H2Oとして
計算値:C, 59.82; H, 4.57; N, 11.63。
実測値:C, 59.81; H, 4.63; N, 11.41。
融点 311−313℃
MS (ESI+): 358 (M+H)。
1H-NMR (DMSO-d6) δ: 1.51 (6H, s), 7.28 (1H, dd, J = 9.5, 2.2 Hz), 7.46-7.52 (3H, m), 8.03 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 8.88 (1H, dd, J = 2.2, 0.9 Hz), 11.27 (1H, s), 12.52 (1H, br)。
元素分析値:C18H16N3O3Cl+0.2H2Oとして
計算値:C, 59.82; H, 4.57; N, 11.63。
実測値:C, 59.81; H, 4.63; N, 11.41。
実施例32
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(3−シアノ−1,1−ジメチルプロピル)ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(3−シアノ−1,1−ジメチルプロピル)ベンズアミド
実施例15と同様にして、参考例3で合成した4−(3−シアノ−1,1−ジメチルプロピル)安息香酸(0.71g,3.3mmol)と参考例21で合成した6−クロロイミダゾ[1,2−a]ピリジン−2−アミン(0.50g,3.0mmol)を用い、表題化合物(収量0.60g,収率55%)を得た。
融点 198−199℃
MS (ESI+): 367 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (6H, s), 2.00 (2H, t, J = 8.3 Hz), 2.18 (2H, t, J = 8.3 Hz), 7.29 (1H, dd, J = 9.5, 1.9 Hz), 7.49-7.52 (3H, m), 8.05 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.88 (1H, d, J = 1.9 Hz), 11.24 (1H, s)。
元素分析値:C20H19N4OCl+0.5H2Oとして
計算値:C, 63.91; H, 5.36; N, 14.91。
実測値:C, 63.94; H, 5.24; N, 15.17。
融点 198−199℃
MS (ESI+): 367 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (6H, s), 2.00 (2H, t, J = 8.3 Hz), 2.18 (2H, t, J = 8.3 Hz), 7.29 (1H, dd, J = 9.5, 1.9 Hz), 7.49-7.52 (3H, m), 8.05 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.88 (1H, d, J = 1.9 Hz), 11.24 (1H, s)。
元素分析値:C20H19N4OCl+0.5H2Oとして
計算値:C, 63.91; H, 5.36; N, 14.91。
実測値:C, 63.94; H, 5.24; N, 15.17。
実施例33
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[2−(ヒドロキシアミノ)−1,1−ジメチル−2−オキソエチル]ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[2−(ヒドロキシアミノ)−1,1−ジメチル−2−オキソエチル]ベンズアミド
実施例31で合成した2−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}−2−メチルプロパン酸(0.10g,0.28mmol)とヒドロキシルアミン・塩酸塩(53mg,0.42mmol)を用い、実施例15と同様にして反応を行った。得られた粗結晶をアセトニトリルから再結晶することにより、表題化合物(収量40mg,収率12%)を得た。
融点 212−213℃
MS (ESI+): 373 (M+H)。
1H-NMR (DMSO-d6) δ: 1.48 (6H, s), 7.29 (1H, dd, J = 9.5, 1.9 Hz), 7.44 (2H, d, J = 8.3 Hz), 7.50 (1H, d, J = 9.5 Hz), 8.03 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.74 (1H, s), 8.89 (1H, d, J = 1.9 Hz), 10.34 (1H, s), 11.25 (1H, s)。
元素分析値:C18H17N4O3Clとして
計算値:C, 57.99; H, 4.60; N, 15.03。
実測値:C, 58.36; H, 4.71; N, 14.82。
融点 212−213℃
MS (ESI+): 373 (M+H)。
1H-NMR (DMSO-d6) δ: 1.48 (6H, s), 7.29 (1H, dd, J = 9.5, 1.9 Hz), 7.44 (2H, d, J = 8.3 Hz), 7.50 (1H, d, J = 9.5 Hz), 8.03 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.74 (1H, s), 8.89 (1H, d, J = 1.9 Hz), 10.34 (1H, s), 11.25 (1H, s)。
元素分析値:C18H17N4O3Clとして
計算値:C, 57.99; H, 4.60; N, 15.03。
実測値:C, 58.36; H, 4.71; N, 14.82。
実施例34
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−{2−[(シアノメチル)アミノ]−シアノ−1,1−ジメチル−2−オキソエチル}ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−{2−[(シアノメチル)アミノ]−シアノ−1,1−ジメチル−2−オキソエチル}ベンズアミド
実施例31で合成した2−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}−2−メチルプロパン酸(0.25g,0.70mmol)、アミノアセトニトリル(0.12g,2.1mmol)、WSC(0.16g,0.84mmol)、HOBt(0.11g,0.84mmol)をDMF(10mL)に溶解させ、室温で24時間攪拌した。反応混合液を水で希釈し、酢酸エチル/THFで抽出した。抽出液を無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。残渣をアセトニトリルから再結晶することにより、表題化合物(収量0.13g,収率45%)を得た。
融点 268−269℃
MS (ESI+): 396 (M+H)。
1H-NMR (DMSO-d6) δ: 1.50 (6H, s), 4.07 (2H, d, J = 5.5 Hz), 7.29 (1H, dd, J = 9.5, 1.5 Hz), 7.42 (2H, d, J = 8.3 Hz), 7.50 (1H, d, J = 9.5 Hz), 8.06 (2H, d, J = 8.3 Hz), 8.20 (1H, t, J = 5.5 Hz), 8.33 (1H, s), 8.88 (1H, d, J = 1.5 Hz), 11.27 (1H, s)。
元素分析値:C20H18N5O2Clとして
計算値:C, 60.68; H, 4.58; N, 17.69。
実測値:C, 60.41; H, 4.48; N, 17.67。
融点 268−269℃
MS (ESI+): 396 (M+H)。
1H-NMR (DMSO-d6) δ: 1.50 (6H, s), 4.07 (2H, d, J = 5.5 Hz), 7.29 (1H, dd, J = 9.5, 1.5 Hz), 7.42 (2H, d, J = 8.3 Hz), 7.50 (1H, d, J = 9.5 Hz), 8.06 (2H, d, J = 8.3 Hz), 8.20 (1H, t, J = 5.5 Hz), 8.33 (1H, s), 8.88 (1H, d, J = 1.5 Hz), 11.27 (1H, s)。
元素分析値:C20H18N5O2Clとして
計算値:C, 60.68; H, 4.58; N, 17.69。
実測値:C, 60.41; H, 4.48; N, 17.67。
実施例35
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−{2−[(2−シアノエチル)アミノ]−1,1−ジメチル−2−オキソエチル}ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−{2−[(2−シアノエチル)アミノ]−1,1−ジメチル−2−オキソエチル}ベンズアミド
実施例34と同様にして、実施例31で合成した2−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}−2−メチルプロパン酸(0.20g,0.56mmol)と3−アミノプロパンニトリル(78mg,1.1mmol)を用い、表題化合物(収量0.19g,収率84%)を得た。
融点 208−209℃
MS (ESI+): 410 (M+H)。
1H-NMR (DMSO-d6) δ: 1.49 (6H, s), 2.64 (2H, t, J = 6.4 Hz), 3.27-3.30 (2H, m), 7.29 (1H, dd, J = 9.5, 2.3 Hz), 7.44 (2H, d, J = 8.3 Hz), 7.50 (1H, d, J = 9.5 Hz), 7.80 (1H, t, J = 5.7 Hz), 8.04 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.88 (1H, d, J = 2.3 Hz), 11.25 (1H, s)。
融点 208−209℃
MS (ESI+): 410 (M+H)。
1H-NMR (DMSO-d6) δ: 1.49 (6H, s), 2.64 (2H, t, J = 6.4 Hz), 3.27-3.30 (2H, m), 7.29 (1H, dd, J = 9.5, 2.3 Hz), 7.44 (2H, d, J = 8.3 Hz), 7.50 (1H, d, J = 9.5 Hz), 7.80 (1H, t, J = 5.7 Hz), 8.04 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.88 (1H, d, J = 2.3 Hz), 11.25 (1H, s)。
実施例36
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[1,1−ジメチル−3−(1H−テトラゾール−5−イル)プロピル]ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[1,1−ジメチル−3−(1H−テトラゾール−5−イル)プロピル]ベンズアミド
実施例32で合成したN−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(3−シアノ−1,1−ジメチルプロピル)ベンズアミド(0.30g,0.82mmol)、アジドトリメチルシラン(3.0mL,22.6mmol)、酸化ジブチルすず(IV)(40mg,0.16mmol)をトルエン(30mL)中で24時間加熱還流した後、参考例21で合成した6−クロロイミダゾ[1,2−a]ピリジン−2−アミン(0.50g,3.0mmol)を用い、表題化合物(収量0.60g,収率55%)を得た。減圧下溶媒を留去した後、残渣にメタノールを加え、再び減圧下溶媒を留去した。残渣に1規定水酸化ナトリウム水溶液(5mL)を加え、水で希釈した後、酢酸エチルで洗浄した。得られた水層を1規定塩酸で酸性にした後、酢酸エチルで抽出した。抽出液を無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。残渣をアセトニトリルから再結晶することにより、表題化合物(収量0.15g,収率45%)を得た。
融点 250−251℃
MS (ESI+): 410 (M+H)。
1H-NMR (DMSO-d6) δ: 1.37 (6H, s), 2.06-2.11 (2H, m), 2.57-2.62 (2H, m), 7.33 (1H, dd, J = 9.5, 1.9 Hz), 7.52-7.57 (3H, m), 8.06 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.90 (1H, d, J = 1.9 Hz), 11.27 (1H, s)。
元素分析値:C20H20N7OClとして
計算値:C, 58.61; H, 4.92; N, 23.92。
実測値:C, 58.48; H, 4.87; N, 23.95。
融点 250−251℃
MS (ESI+): 410 (M+H)。
1H-NMR (DMSO-d6) δ: 1.37 (6H, s), 2.06-2.11 (2H, m), 2.57-2.62 (2H, m), 7.33 (1H, dd, J = 9.5, 1.9 Hz), 7.52-7.57 (3H, m), 8.06 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.90 (1H, d, J = 1.9 Hz), 11.27 (1H, s)。
元素分析値:C20H20N7OClとして
計算値:C, 58.61; H, 4.92; N, 23.92。
実測値:C, 58.48; H, 4.87; N, 23.95。
実施例37
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[1,1−ジメチル−ジメチル−3−(5−オキソ−4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)プロピル]ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[1,1−ジメチル−ジメチル−3−(5−オキソ−4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)プロピル]ベンズアミド
実施例32で合成したN−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(3−シアノ−1,1−ジメチルプロピル)ベンズアミド(0.15g,0.41mmol)、ヒドロキシルアミン・塩酸塩(0.28g,4.1mmol)、炭酸水素ナトリウム(0.41g,4.9mmol)をDMSO(7mL)中、60℃で終夜攪拌した。反応混合液を水で希釈し、酢酸エチル/THFで抽出した。抽出液を無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。得られた残渣をTHF(10mL)に溶解させ、N,N’−カルボニルジイミダゾール(0.10g,0.61mmol)と1,8−ジアザビシクロ[5.4.0]ウンデカ−7−エン(93mg,0.61mmol)を加え、室温で終夜攪拌した。反応混合液を水で希釈し、酢酸エチル/THFで抽出した。抽出液を無水硫酸マグネシウムで乾燥し、減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(0−5% メタノール/酢酸エチル)で精製した。得られた粗結晶をアセトニトリルから再結晶することにより、表題化合物(収量24mg,収率15%)を得た。
MS (ESI+): 426 (M+H)。
1H-NMR (DMSO-d6) δ: 1.34 (6H, s), 1.95-2.00 (2H, m), 2.17-2.20 (2H, m), 7.28 (1H, dd, J = 9.5, 2.1 Hz), 7.48-7.52 (3H, m), 8.05 (2H, d, J = 8.5 Hz), 8.32 (1H, s), 8.88 (1H, d, J = 1.9 Hz), 11.23 (1H, s), 12.10 (1H, br)。
元素分析値:C21H20N5O3Clとして
計算値:C, 59.23; H, 4.73; N, 16.44。
実測値:C, 59.18; H, 4.88; N, 16.65。
MS (ESI+): 426 (M+H)。
1H-NMR (DMSO-d6) δ: 1.34 (6H, s), 1.95-2.00 (2H, m), 2.17-2.20 (2H, m), 7.28 (1H, dd, J = 9.5, 2.1 Hz), 7.48-7.52 (3H, m), 8.05 (2H, d, J = 8.5 Hz), 8.32 (1H, s), 8.88 (1H, d, J = 1.9 Hz), 11.23 (1H, s), 12.10 (1H, br)。
元素分析値:C21H20N5O3Clとして
計算値:C, 59.23; H, 4.73; N, 16.44。
実測値:C, 59.18; H, 4.88; N, 16.65。
実施例38
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(1−シアノ−1−メチルエチル)ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(1−シアノ−1−メチルエチル)ベンズアミド
実施例15と同様にして、参考例2で合成した4−(1−シアノ−1−メチルエチル)安息香酸(1.2g,6.6mmol)と参考例21で合成した6−クロロイミダゾ[1,2−a]ピリジン−2−アミン(1.0g,6.0mmol)を用い、表題化合物(収量0.95g,収率47%)を得た。
融点 248−250℃
MS (ESI+): 339 (M+H)。
1H-NMR (DMSO-d6) δ: 1.73 (6H, s), 7.29 (1H, d, J = 9.4 Hz), 7.51 (1H, d, J = 9.4 Hz), 7.66 (2H, d, J = 8.6 Hz), 8.13 (2H, d, J = 8.6 Hz), 8.34 (1H, s), 8.89 (1H ,s), 11.35 (1H ,s)。
元素分析値:C18H15N4OCl+0.7H2Oとして
計算値:C, 61.52; H, 4.70; N, 15.94。
実測値:C, 61.31; H, 4.40; N, 16.09。
融点 248−250℃
MS (ESI+): 339 (M+H)。
1H-NMR (DMSO-d6) δ: 1.73 (6H, s), 7.29 (1H, d, J = 9.4 Hz), 7.51 (1H, d, J = 9.4 Hz), 7.66 (2H, d, J = 8.6 Hz), 8.13 (2H, d, J = 8.6 Hz), 8.34 (1H, s), 8.89 (1H ,s), 11.35 (1H ,s)。
元素分析値:C18H15N4OCl+0.7H2Oとして
計算値:C, 61.52; H, 4.70; N, 15.94。
実測値:C, 61.31; H, 4.40; N, 16.09。
実施例39
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[1−メチル−1−(1H−テトラゾール−5−イル)エチル]ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[1−メチル−1−(1H−テトラゾール−5−イル)エチル]ベンズアミド
実施例36と同様にして、実施例38で合成したN−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(1−シアノ−1−メチルエチル)ベンズアミド(0.20g,0.59mmol)を用いて、表題化合物(収量0.10g,収率43%)を得た。
融点 266−267℃
MS (ESI+): 382 (M+H)。
1H-NMR (DMSO-d6) δ: 1.81 (6H, s), 7.27-7.33 (3H, m), 7.50 (1H, d, J = 9.5 Hz), 8.03 (2H, d, J = 8.7 Hz), 8.32 (1H, s), 8.88 (1H, d, J = 1.5 Hz), 11.27 (1H, s)。
元素分析値:C18H16N7OClとして
計算値:C, 56.09; H, 4.29; N, 25.44。
実測値:C, 55.95; H, 4.42; N, 25.27。
融点 266−267℃
MS (ESI+): 382 (M+H)。
1H-NMR (DMSO-d6) δ: 1.81 (6H, s), 7.27-7.33 (3H, m), 7.50 (1H, d, J = 9.5 Hz), 8.03 (2H, d, J = 8.7 Hz), 8.32 (1H, s), 8.88 (1H, d, J = 1.5 Hz), 11.27 (1H, s)。
元素分析値:C18H16N7OClとして
計算値:C, 56.09; H, 4.29; N, 25.44。
実測値:C, 55.95; H, 4.42; N, 25.27。
実施例40
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[1−メチル−1−(5−オキソ−4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)エチル]ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[1−メチル−1−(5−オキソ−4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)エチル]ベンズアミド
実施例37と同様にして、実施例38で合成したN−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(1−シアノ−1−メチルエチル)ベンズアミド(68mg,0.20mmol)を用いて、表題化合物(収量13mg,収率16%)を得た。
融点 310−312℃
MS (ESI+): 397 (M+H)。
1H-NMR (DMSO-d6) δ: 1.63 (6H, s), 7.26-7.32 (1H, m), 7.43-7.54 (3H, m), 8.07 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 8.87-8.90 (1H, m), 11.31 (1H, s), 12.29 (1H, m)。
融点 310−312℃
MS (ESI+): 397 (M+H)。
1H-NMR (DMSO-d6) δ: 1.63 (6H, s), 7.26-7.32 (1H, m), 7.43-7.54 (3H, m), 8.07 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 8.87-8.90 (1H, m), 11.31 (1H, s), 12.29 (1H, m)。
実施例41
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−{1,1−ジメチル−2−オキソ−2−[(1H−テトラゾール−5−イルメチル)アミノ]エチル}ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−{1,1−ジメチル−2−オキソ−2−[(1H−テトラゾール−5−イルメチル)アミノ]エチル}ベンズアミド
実施例36と同様にして、実施例34で合成したN−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−{2−[(シアノメチル)アミノ]−シアノ−1,1−ジメチル−2−オキソエチル}ベンズアミド(0.50mg,0.13mmol)を用いて、表題化合物(収量9.0mg,収率16%)を得た。
MS (ESI+): 439 (M+H)。
1H-NMR (DMSO-d6) δ: 1.51 (6H, s), 4.51 (2H, d, J = 5.3 Hz), 7.28 (1H, dd, J = 9.5, 1.9 Hz), 7.44 (2H, d, J = 8.3 Hz), 7.50 (1H, d, J = 9.5 Hz), 8.03 (2H, d, J = 8.3 Hz), 8.23 (1H, t, J = 5.3 Hz), 8.33 (1H, s), 8.88 (1H, d, J = 1.9 Hz), 11.24 (1H, s)。
MS (ESI+): 439 (M+H)。
1H-NMR (DMSO-d6) δ: 1.51 (6H, s), 4.51 (2H, d, J = 5.3 Hz), 7.28 (1H, dd, J = 9.5, 1.9 Hz), 7.44 (2H, d, J = 8.3 Hz), 7.50 (1H, d, J = 9.5 Hz), 8.03 (2H, d, J = 8.3 Hz), 8.23 (1H, t, J = 5.3 Hz), 8.33 (1H, s), 8.88 (1H, d, J = 1.9 Hz), 11.24 (1H, s)。
実施例42
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(1,1−ジメチル−2−オキソ−2−{[2−(1H−テトラゾール−5−イル)エチル]アミノ}エチル)ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(1,1−ジメチル−2−オキソ−2−{[2−(1H−テトラゾール−5−イル)エチル]アミノ}エチル)ベンズアミド
実施例36と同様にして、実施例35で合成したN−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−{2−[(2−シアノエチル)アミノ]−1,1−ジメチル−2−オキソエチル}ベンズアミド(0.50mg,0.12mmol)を用いて、表題化合物(収量9.0mg,収率17%)を得た。
MS (ESI+): 453 (M+H)。
1H-NMR (DMSO-d6) δ: 1.44 (6H, s), 3.02 (2H, t, J = 7.0 Hz), 3.38-3.46 (2H, m), 7.29 (1H, dd, J = 9.7, 1.9 Hz), 7.36 (2H, d, J = 8.7 Hz), 7.51 (1H, d, J=9.5Hz), 7.63 (1H, t, J=5.7Hz), 8.00 (2H, d, J=8.7Hz), 8.33 (1H, s), 8.88 (1H, d, J=1.9Hz), 11.24 (1H, s), 15.98 (1H, br)。
MS (ESI+): 453 (M+H)。
1H-NMR (DMSO-d6) δ: 1.44 (6H, s), 3.02 (2H, t, J = 7.0 Hz), 3.38-3.46 (2H, m), 7.29 (1H, dd, J = 9.7, 1.9 Hz), 7.36 (2H, d, J = 8.7 Hz), 7.51 (1H, d, J=9.5Hz), 7.63 (1H, t, J=5.7Hz), 8.00 (2H, d, J=8.7Hz), 8.33 (1H, s), 8.88 (1H, d, J=1.9Hz), 11.24 (1H, s), 15.98 (1H, br)。
実施例43
2−(4−{[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)−2−メチルプロパン酸
2−(4−{[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)−2−メチルプロパン酸
実施例23で合成した2−{4−[(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}−2−メチルプロパン酸メチル(1.5g,3.2mmol)、イミダゾール(0.44g,6.5mmol)、炭酸カリウム(0.90g,6.5mmol)、ヨウ化銅(I)(62mg,0.32mmol)をDMF(50mL)に溶解させ、窒素雰囲気下、160℃で終夜攪拌した。反応液を室温まで放冷した後、減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(0−10% メタノール/酢酸エチル)で精製した。得られた固体をメタノール(10mL)/THF(10mL)/水酸化カリウム水溶液(1.6規定、10mL)の混合溶液に溶解させ、50℃で2時間攪拌した。減圧下溶媒を留去し、水を加え、酢酸エチルで洗浄した。水層を1規定塩酸を用いて酸性にした。析出してきた固体をろ取し、水、アセトニトリル、ジエチルエーテルで洗浄した。得られた粗結晶をDMSO/エタノールから再結晶することにより、表題化合物(収量0.37g,収率30%)を得た。
1H-NMR (DMSO-d6) δ: 1.51 (6H, s), 7.15 (1H, dd, J = 1.4, 1.0 Hz), 7.48 (2H, d, J = 8.7 Hz), 7.58 (1H, dd, J = 9.5, 2.0 Hz), 7.63 (1H, d, J = 9.5 Hz), 7.70 (1H, t, J = 1.4 Hz), 8.05 (2H, d, J = 8.7 Hz), 8.20 (1H, dd, J = 1.4, 1.0 Hz), 8.35 (1H, s), 9.07 (1H, dd, J = 2.0, 1.0 Hz), 11.28 (1H, s), 12.52 (1H, br)。
元素分析値:C21H19N5O3として
計算値:C, 64.77; H, 4.92; N, 17.98。
実測値:C, 64.75; H, 4.83; N, 17.91。
1H-NMR (DMSO-d6) δ: 1.51 (6H, s), 7.15 (1H, dd, J = 1.4, 1.0 Hz), 7.48 (2H, d, J = 8.7 Hz), 7.58 (1H, dd, J = 9.5, 2.0 Hz), 7.63 (1H, d, J = 9.5 Hz), 7.70 (1H, t, J = 1.4 Hz), 8.05 (2H, d, J = 8.7 Hz), 8.20 (1H, dd, J = 1.4, 1.0 Hz), 8.35 (1H, s), 9.07 (1H, dd, J = 2.0, 1.0 Hz), 11.28 (1H, s), 12.52 (1H, br)。
元素分析値:C21H19N5O3として
計算値:C, 64.77; H, 4.92; N, 17.98。
実測値:C, 64.75; H, 4.83; N, 17.91。
実施例44
N−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)−4−(3−シアノ−1,1−ジメチルプロピル)ベンズアミド
N−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)−4−(3−シアノ−1,1−ジメチルプロピル)ベンズアミド
実施例15と同様にして、参考例3で合成した4−(3−シアノ−1,1−ジメチルプロピル)安息香酸(2.8g,12.7mmol)と参考例23で合成した6−ヨードイミダゾ[1,2−a]ピリジン−2−アミン(3.0g,11.6mmol)を用い、表題化合物(収量1.7g,収率30%)を得た。
1H-NMR (DMSO-d6) δ: 1.32 (6H, s), 1.95-2.06 (2H, m), 2.13-2.23 (2H, m), 7.32 (1H, d, J = 9.1 Hz), 7.42 (1H, dd, J = 9.1, 1.9 Hz), 7.51 (2H, d, J = 8.3 Hz), 8.05 (2H, d, J = 8.3 Hz), 8.28 (1H, s), 8.97-8.98 (1H, m), 11.19 (1H, s)。
1H-NMR (DMSO-d6) δ: 1.32 (6H, s), 1.95-2.06 (2H, m), 2.13-2.23 (2H, m), 7.32 (1H, d, J = 9.1 Hz), 7.42 (1H, dd, J = 9.1, 1.9 Hz), 7.51 (2H, d, J = 8.3 Hz), 8.05 (2H, d, J = 8.3 Hz), 8.28 (1H, s), 8.97-8.98 (1H, m), 11.19 (1H, s)。
実施例45
4−(3−シアノ−1,1−ジメチルプロピル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−(3−シアノ−1,1−ジメチルプロピル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例44で合成したN−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)−4−(3−シアノ−1,1−ジメチルプロピル)ベンズアミド(0.20g,0.45mmol)、イミダゾール(59mg,0.90mmol)、炭酸カリウム(0.12g,0.90mmol)、ヨウ化銅(I)(10mg,0.050mmol)をDMF(10mL)に溶解させ、窒素雰囲気下、160℃で6時間攪拌した。反応液を室温まで放冷した後、減圧下溶媒を留去した。得られた残渣をシリカゲルカラムクロマトグラフィー(0−10% メタノール/酢酸エチル)で精製した。得られた残渣を酢酸エチル/ヘキサンから再結晶することにより、表題化合物(収量75mg,収率42%)を得た。
融点 233−234℃
MS (ESI+): 399 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (6H, s), 1.99-2.03 (2H, m), 2.16-2.21 (2H, m), 7.15 (1H, s), 7.52 (2H, d, J = 8.3 Hz), 7.57 (1H, dd, J = 9.5, 1.9 Hz), 7.70-7.71 (1H, m), 8.07 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.35 (1H, s), 9.07 (1H, s), 11.26 (1H, s)。
元素分析値:C23H22N6Oとして
計算値:C, 69.33; H, 5.57; N, 21.09。
実測値:C, 69.17; H, 5.50; N, 21.06。
融点 233−234℃
MS (ESI+): 399 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (6H, s), 1.99-2.03 (2H, m), 2.16-2.21 (2H, m), 7.15 (1H, s), 7.52 (2H, d, J = 8.3 Hz), 7.57 (1H, dd, J = 9.5, 1.9 Hz), 7.70-7.71 (1H, m), 8.07 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.35 (1H, s), 9.07 (1H, s), 11.26 (1H, s)。
元素分析値:C23H22N6Oとして
計算値:C, 69.33; H, 5.57; N, 21.09。
実測値:C, 69.17; H, 5.50; N, 21.06。
実施例46
4−[1,1−ジメチル−3−(1H−テトラゾール−5−イル)プロピル]−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−[1,1−ジメチル−3−(1H−テトラゾール−5−イル)プロピル]−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例36と同様にして、実施例45で合成した4−(3−シアノ−1,1−ジメチルプロピル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド(0.20g,0.50mmol)を用いて、表題化合物(収量50mg,収率23%)を得た。
融点 266−267℃
MS (ESI+): 442 (M+H)。
1H-NMR (DMSO-d6) δ: 1.38 (6H, s), 2.06-2.12 (2H, m), 2.57-2.63 (2H, m), 7.16 (1H, s), 7.54-7.64 (4H, m), 7.70 (1H, t, J = 1.3 Hz), 8.06 (2H, d, J = 8.7 Hz), 8.19 (1H, s), 8.35 (1H, s), 9.06-9.07 (1H, m), 11.26 (1H, s), 12.92 (1H, br)。
元素分析値:C23H23N9Oとして
計算値:C, 62.57; H, 5.25; N, 28.55。
実測値:C, 62.46; H, 5.27; N, 28.55。
融点 266−267℃
MS (ESI+): 442 (M+H)。
1H-NMR (DMSO-d6) δ: 1.38 (6H, s), 2.06-2.12 (2H, m), 2.57-2.63 (2H, m), 7.16 (1H, s), 7.54-7.64 (4H, m), 7.70 (1H, t, J = 1.3 Hz), 8.06 (2H, d, J = 8.7 Hz), 8.19 (1H, s), 8.35 (1H, s), 9.06-9.07 (1H, m), 11.26 (1H, s), 12.92 (1H, br)。
元素分析値:C23H23N9Oとして
計算値:C, 62.57; H, 5.25; N, 28.55。
実測値:C, 62.46; H, 5.27; N, 28.55。
実施例47
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
実施例49に準じ、参考例21で得られた6−クロロイミダゾ[1,2−a]ピリジン−2−アミンを用いて表題化合物を合成した。
融点 250−251℃
MS (ESI+): 328 (M+H)。
1H-NMR (CDCl3) δ: 1.36(9H, s), 7.13 (1H, dd, J = 9.4, 2.0 Hz), 7.31 (1H, d, J = 9.4 Hz), 7.52 (2H, d, J = 8.8 Hz), 7.87 (2H, d, J = 8.8 Hz), 8.15-8.16 (1H, m), 8.22(1H, s), 8.92 (1H ,s)。
元素分析値:C18H18ClN3Oとして
計算値:C, 65.95; H, 5.53; N, 12.82。
実測値:C, 65.96; H, 5.56; N, 12.86。
融点 250−251℃
MS (ESI+): 328 (M+H)。
1H-NMR (CDCl3) δ: 1.36(9H, s), 7.13 (1H, dd, J = 9.4, 2.0 Hz), 7.31 (1H, d, J = 9.4 Hz), 7.52 (2H, d, J = 8.8 Hz), 7.87 (2H, d, J = 8.8 Hz), 8.15-8.16 (1H, m), 8.22(1H, s), 8.92 (1H ,s)。
元素分析値:C18H18ClN3Oとして
計算値:C, 65.95; H, 5.53; N, 12.82。
実測値:C, 65.96; H, 5.56; N, 12.86。
実施例48
4−tert−ブチル−N−(6−ブロモイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
4−tert−ブチル−N−(6−ブロモイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
実施例49に準じ、参考例22で得られた6−ブロモイミダゾ[1,2−a]ピリジン−2−アミンを用いて表題化合物を合成した。
融点 249−250℃
MS (ESI+): 372, 374 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32(9H, s), 7.32-7.38 (1H, m), 7.42-7.47 (1H, m), 7.53 (2H, d, J = 8.3 Hz), 8.01 (2H, d, J = 8.3 Hz), 8.32 (1H, s), 8.95 (1H, s), 11.19 (1H ,s)。
融点 249−250℃
MS (ESI+): 372, 374 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32(9H, s), 7.32-7.38 (1H, m), 7.42-7.47 (1H, m), 7.53 (2H, d, J = 8.3 Hz), 8.01 (2H, d, J = 8.3 Hz), 8.32 (1H, s), 8.95 (1H, s), 11.19 (1H ,s)。
実施例49
4−tert−ブチル−N−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
4−tert−ブチル−N−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
4−tert-ブチル安息香酸クロリド(28.0g、108mmol)を参考例23で得られた6−ヨードイミダゾ[1,2−a]ピリジン−2−アミンおよびトリエチルアミンのTHF溶液に滴下した後に、室温下で1時間攪拌した。その後、揮発性成分を減圧下で留去した後に、残留物をジクロロメタン−ヘキサン(1/1)溶液で洗浄し、表題化合物(31.2g、収率69%)を得た。
MS (ESI+): 419 (M)。
1H-NMR (DMSO-d6) δ: 1.31(9H, s), 7.31 (1H, d, J = 9.3 Hz), 7.42 (1H, d, J = 9.3 Hz), 7.53 (2H, d, J = 8.5 Hz), 8.01 (2H, d, J = 8.5 Hz), 8.28 (1H, s), 8.97 (1H, s), 11.17 (1H ,s)。
MS (ESI+): 419 (M)。
1H-NMR (DMSO-d6) δ: 1.31(9H, s), 7.31 (1H, d, J = 9.3 Hz), 7.42 (1H, d, J = 9.3 Hz), 7.53 (2H, d, J = 8.5 Hz), 8.01 (2H, d, J = 8.5 Hz), 8.28 (1H, s), 8.97 (1H, s), 11.17 (1H ,s)。
実施例50
4−tert−ブチル−N−(イミダゾ[1,2−a]キノリン−3−イル)ベンズアミド
4−tert−ブチル−N−(イミダゾ[1,2−a]キノリン−3−イル)ベンズアミド
実施例49に準じ、参考例28で得られたイミダゾ[1,2−a]キノリン−2−アミンを用いて表題化合物を合成した。
融点 204−205℃
MS (ESI+): 344 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33(9H, s), 7.50-7.57 (4H, m), 7.70-7.77 (2H, m), 8.00 (1H, dd, J = 7.9, 1.1 Hz), 8.03-8.08 (2H, m), 8.34 (1H, d, J = 8.5 Hz), 8.78 (1H, s), 11.18 (1H ,s)。
元素分析値:C22H21N3Oとして
計算値:C, 76.94; H, 6.16; N, 12.24。
実測値:C, 76.78; H, 6.15; N, 12.28。
融点 204−205℃
MS (ESI+): 344 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33(9H, s), 7.50-7.57 (4H, m), 7.70-7.77 (2H, m), 8.00 (1H, dd, J = 7.9, 1.1 Hz), 8.03-8.08 (2H, m), 8.34 (1H, d, J = 8.5 Hz), 8.78 (1H, s), 11.18 (1H ,s)。
元素分析値:C22H21N3Oとして
計算値:C, 76.94; H, 6.16; N, 12.24。
実測値:C, 76.78; H, 6.15; N, 12.28。
実施例51
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例49で得られた4−tert−ブチル−N−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(20.0g,4.77mmol)、イミダゾール(6.5g,95.4mmol)およびCuI(908mg,47.7mmol)をN,N−ジメチルホルムアミド(500mL)中、窒素雰囲気下、160℃で8時間撹拌した。反応液を室温まで放冷した後、ろ過し、減圧下揮発性成分を留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:メタノール=10:0〜7:3)で精製し、メタノールから再結晶することにより表題化合物(収量7.3g,収率42%)を得た。
融点 289−291℃
MS (ESI+): 360 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.15 (1H, s), 7.55 (2H, d, J = 8.4 Hz), 7.58-7.64 (2H, m), 7.70 (1H, s), 8.03 (2H, d, J = 8.4 Hz), 8.19 (1H, s), 8.34 (1H ,s), 9.07 (1H ,s), 11.23 (1H ,s)。
元素分析値:C21H21N5Oとして
計算値:C, 70.17; H, 5.89; N, 19.48。
実測値:C, 70.08; H, 5.81; N, 19.39。
融点 289−291℃
MS (ESI+): 360 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.15 (1H, s), 7.55 (2H, d, J = 8.4 Hz), 7.58-7.64 (2H, m), 7.70 (1H, s), 8.03 (2H, d, J = 8.4 Hz), 8.19 (1H, s), 8.34 (1H ,s), 9.07 (1H ,s), 11.23 (1H ,s)。
元素分析値:C21H21N5Oとして
計算値:C, 70.17; H, 5.89; N, 19.48。
実測値:C, 70.08; H, 5.81; N, 19.39。
実施例52
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド 2塩酸塩
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド 2塩酸塩
実施例51で得られた4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド(900mg,2.5mmol)をメタノールに溶解させた後に、4規定塩酸ガス含有酢酸エチル(5ml)を加えて10分間攪拌した。揮発性成分を減圧下留去した後に、メタノール−酢酸エチルを用いて再結晶を行ない、表題化合物(850mg)を得た。
MS (ESI+): 360 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.56 (2H, d, J = 8.5 Hz), 7.72-7.83 (2H, m), 7.98 (1H, s), 8.05 (2H, d, J = 8.5 Hz), 8.25-8.29 (1H, m), 8.43 (1H ,s), 9.35 (1H ,d, J = 1.9 Hz), 9.74 (1H, s), 11.46 (1H ,s)。
元素分析値:C21H21N5O・2HCl・H2Oとして
計算値:C, 56.00; H, 5.60; N, 15.55。
実測値:C, 56.08; H, 5.64; N, 15.55。
MS (ESI+): 360 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.56 (2H, d, J = 8.5 Hz), 7.72-7.83 (2H, m), 7.98 (1H, s), 8.05 (2H, d, J = 8.5 Hz), 8.25-8.29 (1H, m), 8.43 (1H ,s), 9.35 (1H ,d, J = 1.9 Hz), 9.74 (1H, s), 11.46 (1H ,s)。
元素分析値:C21H21N5O・2HCl・H2Oとして
計算値:C, 56.00; H, 5.60; N, 15.55。
実測値:C, 56.08; H, 5.64; N, 15.55。
実施例53
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド 2メタンスルホン酸塩
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド 2メタンスルホン酸塩
実施例51で得られた4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド(180mg,0.5mmol)をメタノールに溶解させた後に、メタンスルホン酸(115mg,1.2mmol)を加えて10分間攪拌した。揮発性成分を減圧下留去した後に、メタノール−酢酸エチルを用いて再結晶を行ない、表題化合物(120mg)を得た。
MS (ESI+): 360 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 2.32 (6H, s), 7.55 (2H, d, J = 8.5 Hz), 7.67 (1H, dd, J = 9.6, 2.1 Hz), 7.77 (1H, d, J = 9.6 Hz), 7.97 (1H, s), 8.04 (2H, d, J = 8.5 Hz), 8.25-8.29 (1H, m), 8.43 (1H ,s), 9.26 (1H ,d, J = 1.3 Hz), 9.66 (1H, s), 11.34 (1H ,s)。
元素分析値:C21H21N5O・2MsOH・H2Oとして
計算値:C, 48.49; H, 5.49; N, 12.29。
実測値:C, 48.33; H, 5.45; N, 12.33。
MS (ESI+): 360 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 2.32 (6H, s), 7.55 (2H, d, J = 8.5 Hz), 7.67 (1H, dd, J = 9.6, 2.1 Hz), 7.77 (1H, d, J = 9.6 Hz), 7.97 (1H, s), 8.04 (2H, d, J = 8.5 Hz), 8.25-8.29 (1H, m), 8.43 (1H ,s), 9.26 (1H ,d, J = 1.3 Hz), 9.66 (1H, s), 11.34 (1H ,s)。
元素分析値:C21H21N5O・2MsOH・H2Oとして
計算値:C, 48.49; H, 5.49; N, 12.29。
実測値:C, 48.33; H, 5.45; N, 12.33。
実施例54
4−tert−ブチル−N−(イミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
4−tert−ブチル−N−(イミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
実施例51に準じ、実施例48で得られた4−tert−ブチル−N−(6−ブロモイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミドとイミダゾールとの反応による副生成物(収率3%)として表題化合物を得た。
融点 230−231℃
MS (ESI+): 294 (M+H)。
1H-NMR (CDCl3) δ: 1.35(9H, s), 6.75-6.83 (1H, m), 7.06-7.15(1H, m), 7.17-7.22(1H, m), 7.48 (2H, d, J = 8.7 Hz), 7.89 (2H, d, J = 8.7 Hz), 8.09-8.15 (1H, m), 8.25 (1H, s), 9.55 (1H ,s)。
元素分析値:C18H19N3O・0.2H2Oとして
計算値:C, 72.80; H, 6.58; N, 14.15。
実測値:C, 72.78; H, 6.56; N, 14.18。
融点 230−231℃
MS (ESI+): 294 (M+H)。
1H-NMR (CDCl3) δ: 1.35(9H, s), 6.75-6.83 (1H, m), 7.06-7.15(1H, m), 7.17-7.22(1H, m), 7.48 (2H, d, J = 8.7 Hz), 7.89 (2H, d, J = 8.7 Hz), 8.09-8.15 (1H, m), 8.25 (1H, s), 9.55 (1H ,s)。
元素分析値:C18H19N3O・0.2H2Oとして
計算値:C, 72.80; H, 6.58; N, 14.15。
実測値:C, 72.78; H, 6.56; N, 14.18。
実施例55
4−tert−ブチル−N−(6−クロロ−3−メチルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
4−tert−ブチル−N−(6−クロロ−3−メチルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
実施例49に準じ、参考例30で得られた6−クロロ−3−メチルイミダゾ[1,2−b]ピリダジン−2−アミンを用いて表題化合物を合成した。
融点 269−270℃
MS (ESI+): 342 (M)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 2.41 (3H, s), 7.34 (1H, d, J = 9.4 Hz), 7.55 (2H, d, J = 8.5 Hz), 7.99 (2H, d, J = 8.5 Hz), 8.15 (1H, d, J = 9.4 Hz), 10.66 (1H ,s)。
元素分析値:C18H19N4OClとして
計算値:C, 63.06; H, 5.59; N, 16.34。
実測値:C, 62.93; H, 5.53; N, 16.34。
融点 269−270℃
MS (ESI+): 342 (M)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 2.41 (3H, s), 7.34 (1H, d, J = 9.4 Hz), 7.55 (2H, d, J = 8.5 Hz), 7.99 (2H, d, J = 8.5 Hz), 8.15 (1H, d, J = 9.4 Hz), 10.66 (1H ,s)。
元素分析値:C18H19N4OClとして
計算値:C, 63.06; H, 5.59; N, 16.34。
実測値:C, 62.93; H, 5.53; N, 16.34。
実施例56
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)−3−メチルイミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)−3−メチルイミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
実施例55で得られた4−tert−ブチル−N−(6−クロロ−3−メチルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(0.5mmol、171mg)、イミダゾール(1.0mmol、68mg)および炭酸セシウム(1.2mmol、391mg)をN,N−ジメチルホルムアミド(5mL)中、マイクロウエーブを用いて、160℃で30分撹拌した。反応液を室温まで放冷した後、減圧下溶媒を留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:メタノール=8:2)で精製し、酢酸エチルから再結晶することにより表題化合物(収量10mg,収率5%)を得た。
融点 302−303℃
MS (ESI+): 375 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 2.47 (3H, s), 7.21 (1H, s), 7.56 (2H, d, J = 8.5 Hz), 7.76 (1H, d, J = 9.6 Hz), 8.00 (2H, d, J = 8.5 Hz), 8.05 (1H, s), 8.29 (1H, d, J = 9.6 Hz), 8.63 (1H, s), 10.65 (1H ,s)。
融点 302−303℃
MS (ESI+): 375 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 2.47 (3H, s), 7.21 (1H, s), 7.56 (2H, d, J = 8.5 Hz), 7.76 (1H, d, J = 9.6 Hz), 8.00 (2H, d, J = 8.5 Hz), 8.05 (1H, s), 8.29 (1H, d, J = 9.6 Hz), 8.63 (1H, s), 10.65 (1H ,s)。
実施例57
4−tert−ブチル−N−[6−(ピリジン−3−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(ピリジン−3−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例48で得られた4−tert−ブチル−N−(6−ブロモイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(0.5mmol、186mg)、ピリジン−3−ボロン酸(1.0mmol、123mg)、Pd(PPh3)4(0.05mmol、58mg)、炭酸ナトリウム(2.0mmol、212mg)を1,2−ジメトキシエタン(7mL)−水(3mL)溶液中、窒素雰囲気下、100℃で3時間攪拌した。反応液を室温まで放冷した後、減圧下溶媒を留去した。飽和食塩水を加えて酢酸エチルを用いて抽出した。抽出液を水洗し、乾燥(MgSO4)後、減圧下溶媒を留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=6:4〜10:0)で精製し、ジクロロメタン−ヘキサンから再結晶することにより表題化合物(収量70mg,収率38%)を得た。
融点 288−289℃
MS (ESI+): 371 (M+H)。
1H-NMR (CDCl3) δ: 1.37 (9H, s), 7.36-7.56 (5H, m), 7.84-7.93 (3H, m), 8.30-8.35 (2H, m), 8.66 (1H, dd, J = 4.8, 1.4 Hz), 8.85 (1H, d, J = 1.9 Hz), 8.94 (1H ,s)。
元素分析値:C23H22N4Oとして
計算値:C, 74.57; H, 5.99; N, 15.12。
実測値:C, 74.44; H, 5.99; N, 15.06。
融点 288−289℃
MS (ESI+): 371 (M+H)。
1H-NMR (CDCl3) δ: 1.37 (9H, s), 7.36-7.56 (5H, m), 7.84-7.93 (3H, m), 8.30-8.35 (2H, m), 8.66 (1H, dd, J = 4.8, 1.4 Hz), 8.85 (1H, d, J = 1.9 Hz), 8.94 (1H ,s)。
元素分析値:C23H22N4Oとして
計算値:C, 74.57; H, 5.99; N, 15.12。
実測値:C, 74.44; H, 5.99; N, 15.06。
実施例58
4−tert−ブチル−N−[6−(ピリジン−3−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド 2塩酸塩
4−tert−ブチル−N−[6−(ピリジン−3−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド 2塩酸塩
実施例52に準じ、実施例57で得られた4−tert−ブチル−N−[6−(ピリジン−3−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミドより表題化合物を合成した。
MS (ESI+): 371 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.58 (2H, d, J = 8.4 Hz), 7.78-7.97 (3H, m), 8.05 (2H, d, J = 8.4 Hz), 8.37 (1H, s), 8.57 (1H, d, J = 7.7 Hz), 8.81 (1H, d, J = 5.1 Hz), 9.17 (1H, s), 9.29 (1H, s), 11.54 (1H, s)。
MS (ESI+): 371 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.58 (2H, d, J = 8.4 Hz), 7.78-7.97 (3H, m), 8.05 (2H, d, J = 8.4 Hz), 8.37 (1H, s), 8.57 (1H, d, J = 7.7 Hz), 8.81 (1H, d, J = 5.1 Hz), 9.17 (1H, s), 9.29 (1H, s), 11.54 (1H, s)。
実施例59
4−tert−ブチル−N−[6−(ピリジン−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(ピリジン−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例57に準じ、ピリジン−4−ボロン酸を用いて表題化合物を合成した。
融点 293−294℃
MS (ESI+): 371 (M+H)。
1H-NMR (CDCl3) δ: 1.36 (9H, s), 7.35-7.46 (2H, m), 7.47-7.55 (4H, m), 7.87-7.96 (2H, m), 8.34 (1H, s), 8.42 (1H, s), 8.68-8.75 (2H, m), 9.27 (1H, s)。
融点 293−294℃
MS (ESI+): 371 (M+H)。
1H-NMR (CDCl3) δ: 1.36 (9H, s), 7.35-7.46 (2H, m), 7.47-7.55 (4H, m), 7.87-7.96 (2H, m), 8.34 (1H, s), 8.42 (1H, s), 8.68-8.75 (2H, m), 9.27 (1H, s)。
実施例60
4−tert−ブチル−N−(6−フルオロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
4−tert−ブチル−N−(6−フルオロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
実施例49に準じ、参考例32で得られた6−フルオロイミダゾ[1,2−a]ピリジン−2−アミンを用いて表題化合物を合成した。
融点 250−251℃
MS (ESI+): 312 (M+H)。
1H-NMR (CDCl3) δ: 1.36 (9H, s), 7.13 (1H, dd, J = 9.4, 2.0 Hz), 7.31 (1H, d, J = 9.4 Hz), 7.52 (2H, d, J = 8.8 Hz), 7.87 (2H, d, J = 8.8 Hz), 8.15-8.16 (1H, m), 8.22 (1H, s), 8.92 (1H ,s)。
元素分析値:C18H18ClN3Oとして
計算値:C, 65.95; H, 5.53; N, 12.82。
実測値:C, 65.96; H, 5.56; N, 12.86。
融点 250−251℃
MS (ESI+): 312 (M+H)。
1H-NMR (CDCl3) δ: 1.36 (9H, s), 7.13 (1H, dd, J = 9.4, 2.0 Hz), 7.31 (1H, d, J = 9.4 Hz), 7.52 (2H, d, J = 8.8 Hz), 7.87 (2H, d, J = 8.8 Hz), 8.15-8.16 (1H, m), 8.22 (1H, s), 8.92 (1H ,s)。
元素分析値:C18H18ClN3Oとして
計算値:C, 65.95; H, 5.53; N, 12.82。
実測値:C, 65.96; H, 5.56; N, 12.86。
実施例61
4−tert−ブチル−N−[6−(3−フリル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(3−フリル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例57に準じ、3−フリルボロン酸を用いて表題化合物を合成した。
融点 258−259℃
MS (ESI+): 360 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 6.98 (1H, s), 7.45-7.58 (4H, m), 7.80 (1H, s), 8.03 (2H, d, J = 8.5 Hz), 8.23 (1H, s), 8.25 (1H, s), 8.91 (1H, s), 11.15 (1H, s)。
融点 258−259℃
MS (ESI+): 360 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 6.98 (1H, s), 7.45-7.58 (4H, m), 7.80 (1H, s), 8.03 (2H, d, J = 8.5 Hz), 8.23 (1H, s), 8.25 (1H, s), 8.91 (1H, s), 11.15 (1H, s)。
実施例62
4−tert−ブチル−N−[6−(1H−ピロール−2−イル)−イミダゾ[1,2−a]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(1H−ピロール−2−イル)−イミダゾ[1,2−a]ピリダジン−2−イル]ベンズアミド
実施例57に準じ、1−tert−(ブトキシカルボニル)ピロール−2−ボロン酸を用いて反応を行ない2−{2−[(4−tert−ブチルベンゾイル)アミノ]イミダゾ[1,2−a]ピリジン−6−イル}−1H−ピロール−1−カルボン酸 tert−ブチルを合成した。その後に、メタノール中4規定塩酸ガス含有酢酸エチル(5ml)を加えて終夜攪拌した。揮発性成分を減圧下で留去後、飽和食塩水および重曹水を加えて酢酸エチルで抽出した。抽出液を水洗、乾燥(MgSO4)後、溶媒を留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=8:2〜10:0)で精製し、酢酸エチルから再結晶することにより表題化合物を得た。
融点 279−280℃
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 6.15 (1H, s), 6.50 (1H, s), 6.89 (1H, s), 7.40-7.61 (4H, m), 8.03 (2H, d, J = 8.3 Hz), 8.21 (1H, s), 8.78 (1H, s), 11.13 (1H ,s), 11.32 (1H, s)。
元素分析値:C22H22N4Oとして
計算値:C, 73.72; H, 6.19; N, 15.63。
実測値:C, 73.61; H, 6.22; N, 15.61。
融点 279−280℃
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 6.15 (1H, s), 6.50 (1H, s), 6.89 (1H, s), 7.40-7.61 (4H, m), 8.03 (2H, d, J = 8.3 Hz), 8.21 (1H, s), 8.78 (1H, s), 11.13 (1H ,s), 11.32 (1H, s)。
元素分析値:C22H22N4Oとして
計算値:C, 73.72; H, 6.19; N, 15.63。
実測値:C, 73.61; H, 6.22; N, 15.61。
実施例63
4−tert−ブチル−N−[6−(1H−ピロール−2−イル)−イミダゾ[1,2−a]ピリダジン−2−イル]ベンズアミド 塩酸塩
4−tert−ブチル−N−[6−(1H−ピロール−2−イル)−イミダゾ[1,2−a]ピリダジン−2−イル]ベンズアミド 塩酸塩
実施例52に準じ、実施例62で得られた4−tert−ブチル−N−[6−(1H−ピロール−2−イル)−イミダゾ[1,2−a]ピリダジン−2−イル]ベンズアミドより表題化合物を合成した。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 6.16-6.20 (1H, m), 6.55-6.60 (1H, m), 6.92-6.96 (1H, m), 7.59 (2H, d, J = 8.7 Hz), 7.69 (1H, d, J = 9.1 Hz), 7.85 (1H, d, J = 9.1 Hz), 8.03 (2H, d, J = 8.7 Hz), 8.21 (1H, s), 8.94 (1H, s), 11.50 (2H, br)。
元素分析値:C22H22N4O・HCl・0.5H2Oとして
計算値:C, 65.42; H, 5.99; N, 13.87。
実測値:C, 65.45; H, 5.96; N, 13.72。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 6.16-6.20 (1H, m), 6.55-6.60 (1H, m), 6.92-6.96 (1H, m), 7.59 (2H, d, J = 8.7 Hz), 7.69 (1H, d, J = 9.1 Hz), 7.85 (1H, d, J = 9.1 Hz), 8.03 (2H, d, J = 8.7 Hz), 8.21 (1H, s), 8.94 (1H, s), 11.50 (2H, br)。
元素分析値:C22H22N4O・HCl・0.5H2Oとして
計算値:C, 65.42; H, 5.99; N, 13.87。
実測値:C, 65.45; H, 5.96; N, 13.72。
実施例64
4−tert−ブチル−N−[6−(1H−ピロール−1−イル)−イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(1H−ピロール−1−イル)−イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例51に準じ、実施例49で得られた4−tert−ブチル−N−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミドとピロールとの反応を行ない、表題化合物を合成した。
融点 274−275℃
MS (ESI+): 359 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 6.31 (2H, t, J = 2.2 Hz), 7.32 (2H, t, J = 2.2 Hz), 7.51-7.59 (4H, m), 8.03 (2H, d, J = 8.5 Hz), 8.32 (1H, s), 8.96 (1H, t, J = 1.5 Hz), 11.18 (1H, s)。
元素分析値:C22H22N4Oとして
計算値:C, 73.72; H, 6.19; N, 15.63。
実測値:C, 73.61; H, 6.22; N, 15.66。
融点 274−275℃
MS (ESI+): 359 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 6.31 (2H, t, J = 2.2 Hz), 7.32 (2H, t, J = 2.2 Hz), 7.51-7.59 (4H, m), 8.03 (2H, d, J = 8.5 Hz), 8.32 (1H, s), 8.96 (1H, t, J = 1.5 Hz), 11.18 (1H, s)。
元素分析値:C22H22N4Oとして
計算値:C, 73.72; H, 6.19; N, 15.63。
実測値:C, 73.61; H, 6.22; N, 15.66。
実施例65
4−tert−ブチル−N−[5−メチルイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[5−メチルイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例49に準じ、参考例20で得られた5−メチルイミダゾ[1,2−a]ピリジン−2−アミンを用いて表題化合物を合成した。
融点 204−205℃
MS (ESI+): 308 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 2.62 (3H, s), 6.80 (1H, d, J = 7.0 Hz), 7.23 (1H, dd, J = 8.9, 7.0 Hz), 7.37 (1H, d, J = 8.9 Hz), 7.53 (2H, d, J = 8.5 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.07 (1H, s), 11.16 (1H, s)。
元素分析値:C19H21N3Oとして
計算値:C, 74.24; H, 6.89; N, 13.67。
実測値:C, 74.14; H, 6.83; N, 13.65。
融点 204−205℃
MS (ESI+): 308 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 2.62 (3H, s), 6.80 (1H, d, J = 7.0 Hz), 7.23 (1H, dd, J = 8.9, 7.0 Hz), 7.37 (1H, d, J = 8.9 Hz), 7.53 (2H, d, J = 8.5 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.07 (1H, s), 11.16 (1H, s)。
元素分析値:C19H21N3Oとして
計算値:C, 74.24; H, 6.89; N, 13.67。
実測値:C, 74.14; H, 6.83; N, 13.65。
実施例66
4−tert−ブチル−N−[5−メチルイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド 塩酸塩
4−tert−ブチル−N−[5−メチルイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド 塩酸塩
実施例52に準じ、実施例65で得られた4−tert−ブチル−N−[5−メチルイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミドより表題化合物を合成した。
融点 204−205℃
MS (ESI+): 308 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 2.71 (3H, s), 7.16 (1H, d, J = 6.8 Hz), 7.57-7.70 (4H, m), 8.02-8.07 (3H, m), 11.69 (1H, s)。
融点 204−205℃
MS (ESI+): 308 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 2.71 (3H, s), 7.16 (1H, d, J = 6.8 Hz), 7.57-7.70 (4H, m), 8.02-8.07 (3H, m), 11.69 (1H, s)。
実施例67
4−tert−ブチル−N−[6−メチルイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−メチルイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例49に準じ、参考例26で得られた6−メチルイミダゾ[1,2−a]ピリジン−2−アミンを用いて表題化合物を合成した。
融点 259−260℃
MS (ESI+): 308 (M+H)。
1H-NMR (CDCl3) δ: 1.35 (9H, s), 2.33 (3H, s), 7.00 (1H, d, J = 9.1 Hz), 7.20-7.29 (1H, m), 7.51 (2H, d, J = 8.7 Hz), 7.87 (2H, d, J = 8.7 Hz), 7.89-7.91 (1H, m), 8.14 (1H, s), 9.01 (1H, s)。
元素分析値:C19H21N3Oとして
計算値:C, 74.24; H, 6.89; N, 13.67。
実測値:C, 74.03; H, 6.95; N, 13.69。
融点 259−260℃
MS (ESI+): 308 (M+H)。
1H-NMR (CDCl3) δ: 1.35 (9H, s), 2.33 (3H, s), 7.00 (1H, d, J = 9.1 Hz), 7.20-7.29 (1H, m), 7.51 (2H, d, J = 8.7 Hz), 7.87 (2H, d, J = 8.7 Hz), 7.89-7.91 (1H, m), 8.14 (1H, s), 9.01 (1H, s)。
元素分析値:C19H21N3Oとして
計算値:C, 74.24; H, 6.89; N, 13.67。
実測値:C, 74.03; H, 6.95; N, 13.69。
実施例68
4−tert−ブチル−N−[6−フェニルイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−フェニルイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例57に準じ、フェニルボロン酸を用いて表題化合物を合成した。
融点 252−253℃
MS (ESI+): 370 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.36-7.44 (1H, m), 7.47-7.57 (5H, m), 7.61 (1H, dd, J = 9.4, 1.7 Hz), 7.70-7.75 (2H, m), 8.04 (2H, d, J = 8.7 Hz), 8.35 (1H, s), 8.98 (1H, s), 11.17 (1H, s)。
元素分析値:C24H23N3Oとして
計算値:C, 78.02; H, 6.27; N, 11.37。
実測値:C, 77.96; H, 6.14; N, 11.34。
融点 252−253℃
MS (ESI+): 370 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.36-7.44 (1H, m), 7.47-7.57 (5H, m), 7.61 (1H, dd, J = 9.4, 1.7 Hz), 7.70-7.75 (2H, m), 8.04 (2H, d, J = 8.7 Hz), 8.35 (1H, s), 8.98 (1H, s), 11.17 (1H, s)。
元素分析値:C24H23N3Oとして
計算値:C, 78.02; H, 6.27; N, 11.37。
実測値:C, 77.96; H, 6.14; N, 11.34。
実施例69
4−tert−ブチル−N−[6−フェニルイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド 塩酸塩
4−tert−ブチル−N−[6−フェニルイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド 塩酸塩
実施例52に準じ、実施例68で得られた4−tert−ブチル−N−[6−フェニルイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミドより表題化合物を合成した。
MS (ESI+): 370 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.41-7.49 (1H, m), 7.51-7.62 (4H, m), 7.72-7.81 (3H, m), 7.91 (1H, d, J = 8.7 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 9.14 (1H, s), 11.58 (1H, s)。
元素分析値:C24H23N3O・1HClとして
計算値:C, 71.01; H, 5.96; N, 10.35。
実測値:C, 70.96; H, 5.88; N, 10.43。
MS (ESI+): 370 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.41-7.49 (1H, m), 7.51-7.62 (4H, m), 7.72-7.81 (3H, m), 7.91 (1H, d, J = 8.7 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 9.14 (1H, s), 11.58 (1H, s)。
元素分析値:C24H23N3O・1HClとして
計算値:C, 71.01; H, 5.96; N, 10.35。
実測値:C, 70.96; H, 5.88; N, 10.43。
実施例70
4−tert−ブチル−N−[6−ヒドロキシメチルイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−ヒドロキシメチルイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例49で合成した4−tert−ブチル−N−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(2.0g,4.77mmol)を窒素雰囲気下、THF(60mL)中に懸濁させた後に、イソプロピルマグネシウムクロリド(1M THF溶液)(24mL,24.0mmol)を加え、−20℃で2時間撹拌した。その後、N,N−ジメチルホルムアミド(1.75g、24mmol)を加え、10℃で3時間撹拌した後に、飽和塩化アンモニウム水溶液を加えて、室温下で30分攪拌、酢酸エチルで抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をシリカゲルクロマトグラフィーで精製したところ、4−tert−ブチル−N−(6−ホルミルイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(1.4g、純度約50%、4−tert−ブチル−N−イミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(実施例54)との混合物)を得た。この化合物(168mg(純度約50%)、約0.25mmol)をTHF(10mL)中に溶解させた後にテトラヒドロホウ酸リチウム(5.7mg、0.26mmol)を加え、5℃で10分間攪拌した。水を加えた後、酢酸エチルを用いて抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=6:4〜10:0)で精製し、酢酸エチル−ヘキサンから再結晶することにより表題化合物(21mg、収率50%)を得た。
融点 249−250℃
MS (ESI+): 324 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 4.49 (2H, d, J = 5.7 Hz), 5.32 (1H, t, J = 5.7 Hz), 7.20 (1H, d, J = 9.2 Hz), 7.42 (1H, d, J = 9.2 Hz), 7.52 (2H, d, J = 8.5 Hz), 8.01 (2H, d, J = 8.5 Hz), 8.26 (1H, s), 8.49 (1H, s), 11.07 (1H, s)。
元素分析値:C19H21N3O2として
計算値:C, 70.57; H, 6.55; N, 12.99。
実測値:C, 70.43; H, 6.66; N, 13.05。
融点 249−250℃
MS (ESI+): 324 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 4.49 (2H, d, J = 5.7 Hz), 5.32 (1H, t, J = 5.7 Hz), 7.20 (1H, d, J = 9.2 Hz), 7.42 (1H, d, J = 9.2 Hz), 7.52 (2H, d, J = 8.5 Hz), 8.01 (2H, d, J = 8.5 Hz), 8.26 (1H, s), 8.49 (1H, s), 11.07 (1H, s)。
元素分析値:C19H21N3O2として
計算値:C, 70.57; H, 6.55; N, 12.99。
実測値:C, 70.43; H, 6.66; N, 13.05。
実施例71
4−tert−ブチル−N−[6−(1−ヒドロキシエチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(1−ヒドロキシエチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例70で得られた4−tert−ブチル−N−(6−ホルミルイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(168mg(純度約50%)、約0.25mmol)をTHF(20mL)に溶解させた後に、メチルマグネシウムブロミド(1M THF溶液)(1mL,1.0mmol)を加え、5℃で30分攪拌した。水を加えた後、酢酸エチルを用いて抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=6:4〜10:0)で精製し、酢酸エチル−ヘキサンから再結晶することにより表題化合物(55mg、収率65%)を得た。
融点 249−250℃
MS (ESI+): 338 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 1.39 (3H, d, J = 6.4 Hz), 4.69-4.81 (1H, m), 5.33 (1H, d, J = 4.1 Hz), 7.25 (1H, d, J = 9.1 Hz), 7.41 (1H, d, J = 9.1 Hz), 7.52 (2H, d, J = 8.5 Hz), 8.01 (2H, d, J = 8.5 Hz), 8.25 (1H, s), 8.50 (1H, s), 11.05 (1H, s)。
元素分析値:C20H23N3O2として
計算値:C, 71.19; H, 6.87; N, 12.45。
実測値:C, 71.11; H, 6.69; N, 12.44。
融点 249−250℃
MS (ESI+): 338 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 1.39 (3H, d, J = 6.4 Hz), 4.69-4.81 (1H, m), 5.33 (1H, d, J = 4.1 Hz), 7.25 (1H, d, J = 9.1 Hz), 7.41 (1H, d, J = 9.1 Hz), 7.52 (2H, d, J = 8.5 Hz), 8.01 (2H, d, J = 8.5 Hz), 8.25 (1H, s), 8.50 (1H, s), 11.05 (1H, s)。
元素分析値:C20H23N3O2として
計算値:C, 71.19; H, 6.87; N, 12.45。
実測値:C, 71.11; H, 6.69; N, 12.44。
実施例72
4−tert−ブチル−N−[6−(メチルアミノメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(メチルアミノメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例70で得られた4−tert−ブチル−N−(6−ホルミルイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(168mg(純度約50%)、約0.25mmol)、メチルアミン(40%メタノール用溶液、102μL、1.0mmol)および酢酸(500μL)をジクロロメタン(2.5mL)−N,N−ジメチルホルムアミド(2.5mL)中に溶解させ、室温下で30分攪拌し、その後水素化トリアセトキシホウ素ナトリウム(212mg、1.0mmol)を加えて更に3時間攪拌した。水を加えた後、酢酸エチルを用いて抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:メタノール=10:0〜8:2)で精製し、酢酸エチル−ヘキサンから再結晶することにより表題化合物(60mg、収率71%)を得た。
融点 204−205℃
MS (ESI+): 337 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 2.28 (3H, s), 3.62 (2H, s), 7.23 (1H, d, J = 9.0 Hz), 7.40 (1H, d, J = 9.0 Hz), 7.52 (2H, d, J = 8.6 Hz), 8.02 (2H, d, J = 8.6 Hz), 8.22 (1H, s), 8.46 (1H, s), 11.06 (1H, s), hidden (1H)。
元素分析値:C20H24N4Oとして
計算値:C, 71.40; H, 7.19; N, 16.65。
実測値:C, 71.12; H, 7.16; N, 16.52。
融点 204−205℃
MS (ESI+): 337 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 2.28 (3H, s), 3.62 (2H, s), 7.23 (1H, d, J = 9.0 Hz), 7.40 (1H, d, J = 9.0 Hz), 7.52 (2H, d, J = 8.6 Hz), 8.02 (2H, d, J = 8.6 Hz), 8.22 (1H, s), 8.46 (1H, s), 11.06 (1H, s), hidden (1H)。
元素分析値:C20H24N4Oとして
計算値:C, 71.40; H, 7.19; N, 16.65。
実測値:C, 71.12; H, 7.16; N, 16.52。
実施例73
4−tert−ブチル−N−[6−(1H−イミダゾール−2−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(1H−イミダゾール−2−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例70で得られた4−tert−ブチル−N−(6−ホルミルイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(337mg(純度約50%)、約0.5mmol)にグリオキサール(1mL)を2規定アンモニアガス含有メタノール(100mL)に溶解させ、室温下で終夜攪拌した。減圧下、揮発性成分を留去した後に、残留物をシリカゲルクロマトグラフィー(酢酸エチル:メタノール=10:0〜8:2)で精製し、酢酸エチルから再結晶することにより表題化合物(75mg、収率42%)を得た。
融点 300−301℃
MS (ESI+): 360 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 7.05 (1H, s), 7.29 (1H, s), 7.29-7.60 (3H, m), 7.79 (1H, d, J = 9.2 Hz), 8.03 (2H, d, J = 8.5 Hz), 8.34 (1H, s), 9.08 (1H, s), 11.17 (1H, s), 12.57 (1H, s)。
融点 300−301℃
MS (ESI+): 360 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 7.05 (1H, s), 7.29 (1H, s), 7.29-7.60 (3H, m), 7.79 (1H, d, J = 9.2 Hz), 8.03 (2H, d, J = 8.5 Hz), 8.34 (1H, s), 9.08 (1H, s), 11.17 (1H, s), 12.57 (1H, s)。
実施例74
4−tert−ブチル−N−[6−(1,3−オキサゾール−5−イル)イミダゾ[1,2−a]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(1,3−オキサゾール−5−イル)イミダゾ[1,2−a]ピリダジン−2−イル]ベンズアミド
実施例70で得られた4−tert−ブチル−N−(6−ホルミルイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(168mg(純度約50%)、約0.25mmol)および(パラトリルスルホニル)メチルイソシアニド(73mg、0.38mmol)をメタノール(25mL)中に溶解させた後に、ナトリウムメトキサイド(54mg、1.0mmol)を加え、100℃で3時間攪拌した。減圧下、揮発性成分を留去した後に、水を加えて、酢酸エチルで抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=3:7〜7:3)で精製し、ジクロロメタン−ヘキサンから再結晶することにより表題化合物(35mg、収率39%)を得た。
融点 265−266℃
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 7.54 (2H, d, J = 8.7 Hz), 7.56-7.65 (2H, m), 7.70 (1H, s), 8.03 (2H, d, J = 8.7 Hz), 8.40 (1H, s), 8.51 (1H, s), 9.04 (1H, s), 11.20 (1H, s)。
元素分析値:C21H20N4O2として
計算値:C, 69.98; H, 5.59; N, 15.55。
実測値:C, 69.83; H, 5.61; N, 15.50。
融点 265−266℃
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 7.54 (2H, d, J = 8.7 Hz), 7.56-7.65 (2H, m), 7.70 (1H, s), 8.03 (2H, d, J = 8.7 Hz), 8.40 (1H, s), 8.51 (1H, s), 9.04 (1H, s), 11.20 (1H, s)。
元素分析値:C21H20N4O2として
計算値:C, 69.98; H, 5.59; N, 15.55。
実測値:C, 69.83; H, 5.61; N, 15.50。
実施例75
4−tert−ブチル−N−[6−(1,3−オキサゾール−5−イル)イミダゾ[1,2−a]ピリダジン−2−イル]ベンズアミド 2塩酸塩
4−tert−ブチル−N−[6−(1,3−オキサゾール−5−イル)イミダゾ[1,2−a]ピリダジン−2−イル]ベンズアミド 2塩酸塩
実施例52に準じ、実施例74で得られた4−tert−ブチル−N−[6−(1,3−オキサゾール−5−イル)イミダゾ[1,2−a]ピリダジン−2−イル]ベンズアミドより表題化合物を合成した。
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.59 (2H, d, J = 8.4 Hz), 7.78-7.84 (2H, m), 7.93 (1H, d, J = 9.4 Hz), 8.05 (2H, d, J = 8.3 Hz), 8.41 (1H, s), 8.58 (1H, s), 9.21 (1H, s), 11.68 (1H, s)。
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.59 (2H, d, J = 8.4 Hz), 7.78-7.84 (2H, m), 7.93 (1H, d, J = 9.4 Hz), 8.05 (2H, d, J = 8.3 Hz), 8.41 (1H, s), 8.58 (1H, s), 9.21 (1H, s), 11.68 (1H, s)。
実施例76
4−tert−ブチル−N−[6−(1H−イミダゾール−5−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(1H−イミダゾール−5−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例70で得られた4−tert−ブチル−N−(6−ホルミルイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(500mg(純度約50%)、約0.75mmol)および(パラトリルスルホニル)メチルイソシアニド(195mg、1.0mmol)をメタノール(200mL)中に溶解させた後に、シアン化ナトリウム(20mg、0.55mmol)を加え、室温下で4時間攪拌した。減圧下、揮発性成分を留去した後に、2規定アンモニアガス含有メタノール(15mL)に溶解させ、マイクロウエーブを用いて110℃で40分間攪拌した。減圧下、揮発性成分を留去した後に、残留物をシリカゲルクロマトグラフィー(酢酸エチル:メタノール=10:0〜8:2)で精製することにより、表題化合物(90mg、収率34%)を得た。
融点 297−298℃
MS (ESI+): 360 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 7.45 (1H, d, J = 9.2 Hz), 7.53 (2H, d, J = 8.6 Hz), 7.61-7.70 (2H, m), 7.75 (1H, s), 8.03 (2H, d, J = 8.6 Hz), 8.30 (1H, s), 8.93 (1H, s), 11.09 (1H, s), 12.23 (1H, s)。
元素分析値:C21H21N5O・0.2H2Oとして
計算値:C, 69.48; H, 5.94; N, 19.29。
実測値:C, 69.43; H, 6.03; N, 18.93。
融点 297−298℃
MS (ESI+): 360 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 7.45 (1H, d, J = 9.2 Hz), 7.53 (2H, d, J = 8.6 Hz), 7.61-7.70 (2H, m), 7.75 (1H, s), 8.03 (2H, d, J = 8.6 Hz), 8.30 (1H, s), 8.93 (1H, s), 11.09 (1H, s), 12.23 (1H, s)。
元素分析値:C21H21N5O・0.2H2Oとして
計算値:C, 69.48; H, 5.94; N, 19.29。
実測値:C, 69.43; H, 6.03; N, 18.93。
実施例77
4−tert−ブチル−N−[6−(1H−イミダゾール−5−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド 2塩酸塩
4−tert−ブチル−N−[6−(1H−イミダゾール−5−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド 2塩酸塩
実施例52に準じ、実施例76で得られた4−tert−ブチル−N−[6−(1H−イミダゾール−5−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミドより表題化合物を合成した。
MS (ESI+): 360 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.55 (2H, d, J = 8.5 Hz), 7.67-7.72 (2H, m), 8.04 (2H, d, J = 8.5 Hz), 8.13 (1H, s), 8.33 (1H, s), 9.11-9.23 (2H, m), 11.33 (1H, s), hidden (1H)。
MS (ESI+): 360 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.55 (2H, d, J = 8.5 Hz), 7.67-7.72 (2H, m), 8.04 (2H, d, J = 8.5 Hz), 8.13 (1H, s), 8.33 (1H, s), 9.11-9.23 (2H, m), 11.33 (1H, s), hidden (1H)。
実施例78
4−tert−ブチル−N−[6−シアノイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−シアノイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例49で合成した4−tert−ブチル−N−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(839mg,2.0mmol)を窒素雰囲気下、THF(50mL)中に懸濁させた後に、イソプロピルマグネシウムクロリド(1M THF溶液)(8mL,8.0mmol)を加え、−20℃で2時間撹拌した。その後、−70℃でパラトルエンスルホニルシアニド(725mg、4mmol)を加え、−20℃で4時間撹拌した。水を加えた後に、酢酸エチルで抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=3:7〜7:3)で精製し、酢酸エチル−ヘキサンから再結晶することにより表題化合物(90mg、収率14%)を得た。
融点 300−301℃
MS (ESI+): 319 (M+H)。
1H-NMR (CDCl3) δ: 1.35 (9H, s), 7.13-7.24 (2H, m), 7.51 (2H, d, J = 8.3 Hz), 7.89 (2H, d, J = 8.3 Hz), 8.38 (1H, s), 8.56 (1H, s), 9.63 (1H, s)。
融点 300−301℃
MS (ESI+): 319 (M+H)。
1H-NMR (CDCl3) δ: 1.35 (9H, s), 7.13-7.24 (2H, m), 7.51 (2H, d, J = 8.3 Hz), 7.89 (2H, d, J = 8.3 Hz), 8.38 (1H, s), 8.56 (1H, s), 9.63 (1H, s)。
実施例79
4−tert−ブチル−N−[6−アセチルイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−アセチルイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例49で合成した4−tert−ブチル−N−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(210mg,0.5mmol)、酢酸パラジウム(11mg,0.05mmol)、塩化リチウム(11mg,0.25mmol)、n−ブチルビニルエーテル(150mg,1.5mmol)および炭酸カリウム(173mg,1.25mmol)を窒素雰囲気下、DMF(10mL)中、100℃で終夜攪拌した。その後、溶媒を減圧下留去した。残留物に飽和食塩水を加えた後に、ジクロロメタンで抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=3:7〜8:2)で精製した。その後、生成物をジクロロメタン(10mL)に溶解させ、10%塩酸含有メタノール(5mL)を加え、10分間攪拌した。溶媒を減圧下留去した後に、残留物に重曹水を加え、ジクロロメタンで抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=3:7〜8:2)で精製し、表題化合物(18mg、収率11%)を得た。
MS (ESI+): 336 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 2.60 (3H, s), 7.49-7.56 (3H, m), 7.69 (1H, d, J = 9.4 Hz), 8.03 (2H, d, J = 8.7 Hz), 8.42 (1H, s), 9.49 (1H, s), 11.26 (1H, s)。
MS (ESI+): 336 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 2.60 (3H, s), 7.49-7.56 (3H, m), 7.69 (1H, d, J = 9.4 Hz), 8.03 (2H, d, J = 8.7 Hz), 8.42 (1H, s), 9.49 (1H, s), 11.26 (1H, s)。
実施例80
4−tert−ブチル−N−[6−(ジメチルアミノメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(ジメチルアミノメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例72に準じて、ジメチルアミンを用いて表題化合物を合成した。
融点 236−237℃
MS (ESI+): 351 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 2.17 (6H, s), 3.37 (2H, s), 7.20 (1H, d, J = 9.0 Hz), 7.40 (1H, d, J = 9.0 Hz), 7.52 (2H, d, J = 8.6 Hz), 8.02 (2H, d, J = 8.6 Hz), 8.24 (1H, s), 8.47 (1H, s), 11.07 (1H, s)。
融点 236−237℃
MS (ESI+): 351 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 2.17 (6H, s), 3.37 (2H, s), 7.20 (1H, d, J = 9.0 Hz), 7.40 (1H, d, J = 9.0 Hz), 7.52 (2H, d, J = 8.6 Hz), 8.02 (2H, d, J = 8.6 Hz), 8.24 (1H, s), 8.47 (1H, s), 11.07 (1H, s)。
実施例81
4−ジメチルアミノ−N−[6−ヨード[1,2−a]ピリジン−2−イル]ベンズアミド
4−ジメチルアミノ−N−[6−ヨード[1,2−a]ピリジン−2−イル]ベンズアミド
実施例49に準じ、4−ジメチルアミノ安息香酸クロリドを用いて表題化合物を合成した。
融点237−238℃
MS (ESI+): 406 (M+H)。
1H-NMR (CDCl3) δ: 3.00 (9H, s), 6.73 (2H, d, J = 9.0 Hz), 7.29 (1H, d, J = 9.2 Hz), 7.39 (1H, d, J = 9.2 Hz), 7.97 (2H, d, J = 9.0 Hz), 8.23 (1H, s), 8.94 (1H, s), 10.81 (1H, s)。
融点237−238℃
MS (ESI+): 406 (M+H)。
1H-NMR (CDCl3) δ: 3.00 (9H, s), 6.73 (2H, d, J = 9.0 Hz), 7.29 (1H, d, J = 9.2 Hz), 7.39 (1H, d, J = 9.2 Hz), 7.97 (2H, d, J = 9.0 Hz), 8.23 (1H, s), 8.94 (1H, s), 10.81 (1H, s)。
実施例82
4−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリダジン−2−イル]アミノカルボニル安息香酸カリウム
4−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリダジン−2−イル]アミノカルボニル安息香酸カリウム
実施例99で得られた4−{[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}安息香酸メチル(60mg、0.17mmol)をTHF(10mL)−メタノール(5mL)−水(5mL)に溶解させた後に、水酸化カリウム(28mg、0.5mmol)を加えて、80℃で3時間攪拌した。減圧下で溶媒を留去した後に、アセトニトリル−水を用いて再結晶を行ない、表題化合物(33mg、45%)を合成した。
融点 >400℃
MS (ESI+): 347 (M+H)。
1H-NMR (DMSO-d6) δ: 7.15 (1H, s), 7.56 (1H, d, J = 9.5 Hz), 7.63 (1H, d, J = 9.5 Hz), 7.70 (1H, s), 7.88 (2H, d, J = 8.3 Hz), 7.94 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.35 (1H, s), 9.07 (1H, s), 11.07 (1H, s)。
元素分析値:C18H12N5O3K+2.5H2Oとして
計算値:C, 50.22; H, 3.98; N, 16.27。
実測値:C, 50.45; H, 3.98; N, 16.38。
融点 >400℃
MS (ESI+): 347 (M+H)。
1H-NMR (DMSO-d6) δ: 7.15 (1H, s), 7.56 (1H, d, J = 9.5 Hz), 7.63 (1H, d, J = 9.5 Hz), 7.70 (1H, s), 7.88 (2H, d, J = 8.3 Hz), 7.94 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.35 (1H, s), 9.07 (1H, s), 11.07 (1H, s)。
元素分析値:C18H12N5O3K+2.5H2Oとして
計算値:C, 50.22; H, 3.98; N, 16.27。
実測値:C, 50.45; H, 3.98; N, 16.38。
実施例83
4−(1−ヒドロキシ−1−メチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−(1−ヒドロキシ−1−メチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例99で得られた4−{[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}安息香酸メチル(60mg、0.17mmol)をTHF(20mL)中に溶解させた後に、1Mのメチルマグネシウムブロミド−THF溶液(3.4mL、3.4mmol)を加え、80℃で3時間攪拌した。飽和塩化アンモニウム水溶液を加えた後に、酢酸エチルを用いて抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:メタノール=10:0〜8:2)で精製した後に、酢酸エチル−メタノールを用いて再結晶を行ない、表題化合物(28mg、41%)を合成した。
融点 281−282℃
MS (ESI+): 362 (M+H)。
1H-NMR (DMSO-d6) δ: 1.46 (6H, s), 5.16 (1H, s), 7.15 (1H, s), 7.55-7.64 (4H, m), 7.70 (1H, s), 8.03 (2H, d, J = 8.5 Hz), 8.19 (1H, s), 8.34 (1H, s), 9.07 (1H, s), 11.22 (1H, s)。
元素分析値:C20H19N5O2として
計算値:C, 66.47; H, 5.30; N, 19.38。
実測値:C, 66.37; H, 5.30; N, 19.29。
融点 281−282℃
MS (ESI+): 362 (M+H)。
1H-NMR (DMSO-d6) δ: 1.46 (6H, s), 5.16 (1H, s), 7.15 (1H, s), 7.55-7.64 (4H, m), 7.70 (1H, s), 8.03 (2H, d, J = 8.5 Hz), 8.19 (1H, s), 8.34 (1H, s), 9.07 (1H, s), 11.22 (1H, s)。
元素分析値:C20H19N5O2として
計算値:C, 66.47; H, 5.30; N, 19.38。
実測値:C, 66.37; H, 5.30; N, 19.29。
実施例84
4−(1−ヒドロキシ−1−メチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド 2塩酸塩
4−(1−ヒドロキシ−1−メチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド 2塩酸塩
実施例52に準じ実施例83で得られた4−(1−ヒドロキシ−1−メチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミドを用いて表題化合物を合成した。
MS (ESI+): 362 (M+H)。
1H-NMR (DMSO-d6) δ: 1.46 (6H, s), 5.06 (1H, s), 7.61 (2H, d, J = 8.5 Hz), 7.69 (1H, dd, J = 9.6, 2.1 Hz), 7.77 (1H, d, J = 9.6 Hz), 7.96 (1H, t, J = 1.7 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.24 (1H, t, J = 1.7 Hz), 8.43 (1H, s), 9.28 (1H, t, J = 1.3 Hz), 9.68 (1H, s), 11.36 (1H, s)。
MS (ESI+): 362 (M+H)。
1H-NMR (DMSO-d6) δ: 1.46 (6H, s), 5.06 (1H, s), 7.61 (2H, d, J = 8.5 Hz), 7.69 (1H, dd, J = 9.6, 2.1 Hz), 7.77 (1H, d, J = 9.6 Hz), 7.96 (1H, t, J = 1.7 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.24 (1H, t, J = 1.7 Hz), 8.43 (1H, s), 9.28 (1H, t, J = 1.3 Hz), 9.68 (1H, s), 11.36 (1H, s)。
実施例85
4−ジメチルアミノ−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−ジメチルアミノ−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例51に準じ、実施例81で得られた4−ジメチルアミノ−N−[6−ヨード[1,2−a]ピリジン−2−イル]ベンズアミドを用いて表題化合物を合成した。
融点 247−248℃
MS (ESI+): 347 (M+H)。
1H-NMR (DMSO-d6) δ: 3.01 (6H, s), 6.74 (2H, d, J = 9.0 Hz),7.15 (1H, s), 7.50-7.62 (2H, m), 7.69 (1H, s), 7.99 (2H, d, J = 9.0 Hz), 8.18 (1H, s), 8.30 (1H ,s), 9.04 (1H ,s), 10.86 (1H ,s)。
元素分析値:C19H18N6Oとして
計算値:C, 65.88; H, 5.24; N, 24.26。
実測値:C, 65.64; H, 5.22; N, 24.12。
融点 247−248℃
MS (ESI+): 347 (M+H)。
1H-NMR (DMSO-d6) δ: 3.01 (6H, s), 6.74 (2H, d, J = 9.0 Hz),7.15 (1H, s), 7.50-7.62 (2H, m), 7.69 (1H, s), 7.99 (2H, d, J = 9.0 Hz), 8.18 (1H, s), 8.30 (1H ,s), 9.04 (1H ,s), 10.86 (1H ,s)。
元素分析値:C19H18N6Oとして
計算値:C, 65.88; H, 5.24; N, 24.26。
実測値:C, 65.64; H, 5.22; N, 24.12。
実施例86
6−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミド
6−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミド
実施例49に準じ、参考例23で得られた6−ヨードイミダゾ[1,2−a]ピリジン−2−アミンおよび参考例45で合成した6−tert−ブチルニコチン酸より得られた塩化 6−tert−ブチルニコチノイルを用いて6−tert−ブチル−N−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)ニコチンアミドを合成した。実施例51に準じ、この化合物を用いて表題化合物を合成した。
融点 242−245℃
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.36 (9H, s), 7.16 (s, 1H), 7.56-7.66 (3H, m), 7.71 (1H, s), 8.20 (1H, s), 8.32-8.38 (2H, m), 9.07-9.09 (1H, m), 9.14 (1H, d), 11.46 (1H, s)。
元素分析値:C20H20N6O・0.6H2Oとして
計算値:C, 64.71; H, 5.76; N, 22.64。
実測値:C, 64.45; H, 5.69; N, 22.35。
融点 242−245℃
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.36 (9H, s), 7.16 (s, 1H), 7.56-7.66 (3H, m), 7.71 (1H, s), 8.20 (1H, s), 8.32-8.38 (2H, m), 9.07-9.09 (1H, m), 9.14 (1H, d), 11.46 (1H, s)。
元素分析値:C20H20N6O・0.6H2Oとして
計算値:C, 64.71; H, 5.76; N, 22.64。
実測値:C, 64.45; H, 5.69; N, 22.35。
実施例87
6−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミド 3塩酸塩
6−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミド 3塩酸塩
実施例52に準じ実施例86で得られた6−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミドを用いて表題化合物を合成した。
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.39 (9H, s), 7.69-7.75 (2H, m), 7.80 (1H, d, J = 9.6 Hz), 7.98 (1H, t, J = 1.7 Hz), 8.26 (1H, t, J = 1.7 Hz), 8.44 (1H, s), 8.51 (1H, dd, J = 8.4, 2.2 Hz), 9.20 (1H, d, J = 1.9 Hz), 9.30-9.34 (1H, m), 9.73 (1H, t, J = 1.4 Hz), 11.74 (1H, s)。
元素分析値:C20H20N6O・3HClとして
計算値:C, 51.13; H, 4.93; N, 17.89。
実測値:C, 51.01; H, 5.00; N, 17.90。
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.39 (9H, s), 7.69-7.75 (2H, m), 7.80 (1H, d, J = 9.6 Hz), 7.98 (1H, t, J = 1.7 Hz), 8.26 (1H, t, J = 1.7 Hz), 8.44 (1H, s), 8.51 (1H, dd, J = 8.4, 2.2 Hz), 9.20 (1H, d, J = 1.9 Hz), 9.30-9.34 (1H, m), 9.73 (1H, t, J = 1.4 Hz), 11.74 (1H, s)。
元素分析値:C20H20N6O・3HClとして
計算値:C, 51.13; H, 4.93; N, 17.89。
実測値:C, 51.01; H, 5.00; N, 17.90。
実施例88
4−(1H−イミダゾール−2−イル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−(1H−イミダゾール−2−イル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例49に準じ、参考例23で得られた6−ヨードイミダゾ[1,2−a]ピリジン−2−アミンおよび塩化 4−ブロモベンゾイルを用いて4−ブロモ−N−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミドを合成した。実施例51に準じ、この化合物(3.5g、7.9mmol)を用いて反応を行なったところ、4−ブロモ−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド(350mg、12%)および表題化合物(120mg、4%)が得られた。
融点 276−279℃(decomposed)
MS (ESI+): 370 (M+H)。
1H-NMR (DMSO-d6) δ: 7.16 (2H, s), 7.56-7.67 (2H, m), 7.70 (1H, s), 7.86 (2H, d, J = 8.7 Hz), 7.91 (1H, s), 8.20 (1H, s), 8.25 (2H, d, J = 8.7 Hz), 8.37 (1H, s), 8.44 (1H, s), 9.08 (1H, d), 11.42 (1H, s)。
元素分析値:C20H15N7O+H2Oとして
計算値:C, 62.01; H, 4.42; N, 25.31。
実測値:C, 61.92; H, 4.62; N, 25.22。
融点 276−279℃(decomposed)
MS (ESI+): 370 (M+H)。
1H-NMR (DMSO-d6) δ: 7.16 (2H, s), 7.56-7.67 (2H, m), 7.70 (1H, s), 7.86 (2H, d, J = 8.7 Hz), 7.91 (1H, s), 8.20 (1H, s), 8.25 (2H, d, J = 8.7 Hz), 8.37 (1H, s), 8.44 (1H, s), 9.08 (1H, d), 11.42 (1H, s)。
元素分析値:C20H15N7O+H2Oとして
計算値:C, 62.01; H, 4.42; N, 25.31。
実測値:C, 61.92; H, 4.62; N, 25.22。
実施例89
4−(3−フリル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−(3−フリル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例57に準じ、実施例88で得られた4−ブロモ−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミドを用いて、表題化合物を合成した。
融点 261−263℃
MS (ESI+): 370 (M+H)。
1H-NMR (DMSO-d6) δ: 7.07-7.10 (1H, m), 7.14-7.17 (1H, m), 7.56-7.65 (2H, m), 7.70 (1H, t, J = 1.4 Hz), 7.76-7.81 (3H, m), 8.12 (2H, d, J = 8.5 Hz), 8.20 (1H, s), 8.36 (2H, br), 9.07-9.09 (1H, m), 11.31 (1H, s)。
元素分析値:C21H15N5O2として
計算値:C, 68.28; H, 4.09; N, 18.96。
実測値:C, 68.00; H, 4.10; N, 18.86。
融点 261−263℃
MS (ESI+): 370 (M+H)。
1H-NMR (DMSO-d6) δ: 7.07-7.10 (1H, m), 7.14-7.17 (1H, m), 7.56-7.65 (2H, m), 7.70 (1H, t, J = 1.4 Hz), 7.76-7.81 (3H, m), 8.12 (2H, d, J = 8.5 Hz), 8.20 (1H, s), 8.36 (2H, br), 9.07-9.09 (1H, m), 11.31 (1H, s)。
元素分析値:C21H15N5O2として
計算値:C, 68.28; H, 4.09; N, 18.96。
実測値:C, 68.00; H, 4.10; N, 18.86。
実施例90
N−[6−クロロイミダゾ[1,2−a]ピリジン−2−イル]−4−(2−ヒドロキシ−1,1−ジメチルエチル)ベンズアミド
N−[6−クロロイミダゾ[1,2−a]ピリジン−2−イル]−4−(2−ヒドロキシ−1,1−ジメチルエチル)ベンズアミド
実施例49に準じ、参考例21で得られた6−クロロイミダゾ[1,2−a]ピリジン−2−アミンおよび4−(2−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルエチル)安息香酸より得られる塩化 4−(2−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルエチル)ベンゾイルを用いて4−(2−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルエチル)−N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミドを合成した。得られたこの化合物(330mg、0.72mmol)をTHF(50mL)に溶解させ、1M−テトラ−N−ブチルアンモニウムフルオリド−THF溶液(14.4mL、14.4mmol)を加え、45℃で4時間、攪拌した。減圧下、溶媒を留去した後に、飽和食塩水を加え、ジクロロメタンを用いて抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=6:4〜10:0)で精製し、酢酸エチルを用いて再結晶を行ない、表題化合物(110mg、44%)を得た。
融点 240−242℃
MS (ESI+): 344 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.46 (2H, d, J = 5.5 Hz), 4.73 (1H, t, J = 5.5 Hz), 7.28 (1H, d, J = 9.5 Hz), 7.47-7.53 (3H, m), 8.00 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 8.88 (1H ,s), 11.19 (1H ,s)。
元素分析値:C18H18N3O2Clとして
計算値:C, 62.88; H, 5.28; N, 12.22。
実測値:C, 62.79; H, 5.35; N, 12.18。
融点 240−242℃
MS (ESI+): 344 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.46 (2H, d, J = 5.5 Hz), 4.73 (1H, t, J = 5.5 Hz), 7.28 (1H, d, J = 9.5 Hz), 7.47-7.53 (3H, m), 8.00 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 8.88 (1H ,s), 11.19 (1H ,s)。
元素分析値:C18H18N3O2Clとして
計算値:C, 62.88; H, 5.28; N, 12.22。
実測値:C, 62.79; H, 5.35; N, 12.18。
実施例91
N−[6−クロロイミダゾ[1,2−a]ピリジン−2−イル]−4−(2−ヒドロキシ−1,1−ジメチルエチル)ベンズアミド 塩酸塩
N−[6−クロロイミダゾ[1,2−a]ピリジン−2−イル]−4−(2−ヒドロキシ−1,1−ジメチルエチル)ベンズアミド 塩酸塩
実施例52に準じ、実施例90で得たN−[6−クロロイミダゾ[1,2−a]ピリジン−2−イル]−4−(2−ヒドロキシ−1,1−ジメチルエチル)ベンズアミドを用いて表題化合物を合成した。
MS (ESI+): 344 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.47 (2H, s), 7.42-7.68 (4H, m), 8.01 (2H, d, J = 8.5 Hz), 8.32 (1H, s), 8.98 (1H ,s), 11.47 (1H ,s), hidden (1H)。
元素分析値:C18H18N3O2Cl・HClとして
計算値:C, 56.85; H, 5.04; N, 11.05。
実測値:C, 56.75; H, 5.29; N, 11.32。
MS (ESI+): 344 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.47 (2H, s), 7.42-7.68 (4H, m), 8.01 (2H, d, J = 8.5 Hz), 8.32 (1H, s), 8.98 (1H ,s), 11.47 (1H ,s), hidden (1H)。
元素分析値:C18H18N3O2Cl・HClとして
計算値:C, 56.85; H, 5.04; N, 11.05。
実測値:C, 56.75; H, 5.29; N, 11.32。
実施例92
4−(1−アミノ−1−メチルエチル)−N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
4−(1−アミノ−1−メチルエチル)−N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
実施例49に準じ、参考例21で得られた6−クロロイミダゾ[1,2−a]ピリジン−2−アミンおよび塩化 4−シアノベンゾイルを用いて4−シアノ−N−[6−クロロイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミドを合成した。セリウムクロリド(60mmol、4.9g)のTHF(60mL)懸濁溶液(−60℃)にメチルリチウム(1.5M−THF溶液)(60mmol、40mL)を加え、−60℃で1時間攪拌した。その後、4−シアノ−N−[6−クロロイミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド(3.0mmol、890mg)を加え、室温下で4時間攪拌した。減圧下、溶媒を留去した後に、飽和塩化アンモニウム水溶液を加え、ジクロロメタンを用いて抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=8:2〜10:0)で精製し、メタノールを用いて再結晶を行ない、表題化合物(90mg、9%)を得た。
融点 235−237℃
MS (ESI+): 329 (M+H)。
1H-NMR (DMSO-d6) δ: 1.39 (6H, s), 1.98 (2H, s), 7.28 (1H, d, J = 9.5 Hz), 7.50 (1H, d, J = 9.5 Hz), 7.66 (2H, d, J = 8.5 Hz), 8.01 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 8.88 (1H ,s), 11.19 (1H ,s)。
元素分析値:C17H17N4OClとして
計算値:C, 62.10; H, 5.21; N, 17.04。
実測値:C, 61.93; H, 5.12; N, 16.98。
融点 235−237℃
MS (ESI+): 329 (M+H)。
1H-NMR (DMSO-d6) δ: 1.39 (6H, s), 1.98 (2H, s), 7.28 (1H, d, J = 9.5 Hz), 7.50 (1H, d, J = 9.5 Hz), 7.66 (2H, d, J = 8.5 Hz), 8.01 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 8.88 (1H ,s), 11.19 (1H ,s)。
元素分析値:C17H17N4OClとして
計算値:C, 62.10; H, 5.21; N, 17.04。
実測値:C, 61.93; H, 5.12; N, 16.98。
実施例93
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(1−シアノ−1−メチルエチル)ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(1−シアノ−1−メチルエチル)ベンズアミド
実施例49に準じ、参考例21で得られた6−クロロイミダゾ[1,2−a]ピリジン−2−アミンおよび参考例2で得られた4−(1−シアノ−1−メチルエチル)安息香酸より得られる塩化 4−(1−シアノ−1−メチルエチル)ベンゾイルを用いて表題化合物を合成した。
融点 248−250℃
MS (ESI+): 339 (M+H)。
1H-NMR (DMSO-d6) δ: 1.73 (6H, s), 7.29 (1H, d, J = 9.4 Hz), 7.51 (1H, d, J = 9.4 Hz), 7.66 (2H, d, J = 8.6 Hz), 8.13 (2H, d, J = 8.6 Hz), 8.34 (1H, s), 8.89 (1H ,s), 11.35 (1H ,s)。
元素分析値:C18H15N4OCl+0.7H2Oとして
計算値:C, 61.52; H, 4.70; N, 15.94。
実測値:C, 61.31; H, 4.40; N, 16.09。
融点 248−250℃
MS (ESI+): 339 (M+H)。
1H-NMR (DMSO-d6) δ: 1.73 (6H, s), 7.29 (1H, d, J = 9.4 Hz), 7.51 (1H, d, J = 9.4 Hz), 7.66 (2H, d, J = 8.6 Hz), 8.13 (2H, d, J = 8.6 Hz), 8.34 (1H, s), 8.89 (1H ,s), 11.35 (1H ,s)。
元素分析値:C18H15N4OCl+0.7H2Oとして
計算値:C, 61.52; H, 4.70; N, 15.94。
実測値:C, 61.31; H, 4.40; N, 16.09。
実施例94
4−(2−アミノ−1,1−ジメチルエチル)−N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
4−(2−アミノ−1,1−ジメチルエチル)−N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
実施例93で得られたN−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(1−シアノ−1−メチルエチル)ベンズアミド(0.3mmol、100mg)を3N−アンモニア含有メタノール(50mL)に溶解させ、Raney−Co(1.0g)を加えて、水素雰囲気下、50℃で10分間攪拌した。Raney−Coをろ過により除いた後に溶媒を減圧下留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:メタノール=10:0〜9:1)で精製し、ジクロロメタン−ヘキサンを用いて再結晶を行ない、表題化合物(60mg、58%)を得た。
融点 245−247℃
MS (ESI+): 343 (M+H)。
1H-NMR (CDCl3) δ: 1.34 (6H, s), 2.85 (2H, s), 7.12 (1H, d, J = 9.4Hz), 7.21-7.26 (1H, m), 7.47 (2H, d, J = 8.5 Hz), 7.90 (2H, d, J = 8.5 Hz), 8.17 (1H, s), 8.23 (1H ,s), 9.15 (1H ,s), hidden (2H)。
元素分析値:C18H19N4OClとして
計算値:C, 63.06; H, 5.59; N, 16.34。
実測値:C, 62.83; H, 5.60; N, 16.31。
融点 245−247℃
MS (ESI+): 343 (M+H)。
1H-NMR (CDCl3) δ: 1.34 (6H, s), 2.85 (2H, s), 7.12 (1H, d, J = 9.4Hz), 7.21-7.26 (1H, m), 7.47 (2H, d, J = 8.5 Hz), 7.90 (2H, d, J = 8.5 Hz), 8.17 (1H, s), 8.23 (1H ,s), 9.15 (1H ,s), hidden (2H)。
元素分析値:C18H19N4OClとして
計算値:C, 63.06; H, 5.59; N, 16.34。
実測値:C, 62.83; H, 5.60; N, 16.31。
実施例95
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(1H−ピラゾール−1−イル)ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(1H−ピラゾール−1−イル)ベンズアミド
実施例49に準じ、参考例21で得られた6−クロロイミダゾ[1,2−a]ピリジン−2−アミンおよび塩化 4−(1H−ピラゾール−1−イル)ベンゾイルを用いて表題化合物を合成した。
融点 287−289℃
MS (ESI+): 338 (M+H)。
1H-NMR (DMSO-d6) δ: 6.61 (1H, t, J = 2.1 Hz), 7.29 (1H, dd, J = 9.4, 2.1 Hz), 7.52 (1H, d, J = 9.4 Hz), 7.82 (1H, s), 8.00 (2H, d, J = 8.8 Hz), 8.22 (2H, d, J = 8.8 Hz), 8.35 (1H, s), 8.66 (1H ,s), 8.89 (1H ,s), 11.35 (1H, s)。
元素分析値:C17H12N5OClとして
計算値:C, 60.45; H, 3.58; N, 20.73。
実測値:C, 60.38; H, 3.57; N, 20.84。
融点 287−289℃
MS (ESI+): 338 (M+H)。
1H-NMR (DMSO-d6) δ: 6.61 (1H, t, J = 2.1 Hz), 7.29 (1H, dd, J = 9.4, 2.1 Hz), 7.52 (1H, d, J = 9.4 Hz), 7.82 (1H, s), 8.00 (2H, d, J = 8.8 Hz), 8.22 (2H, d, J = 8.8 Hz), 8.35 (1H, s), 8.66 (1H ,s), 8.89 (1H ,s), 11.35 (1H, s)。
元素分析値:C17H12N5OClとして
計算値:C, 60.45; H, 3.58; N, 20.73。
実測値:C, 60.38; H, 3.57; N, 20.84。
実施例96
5−tert−ブチル−N−[6−クロロイミダゾ[1,2−a]ピリジン−2−イル]ピリジン−2−カルボキサミド
5−tert−ブチル−N−[6−クロロイミダゾ[1,2−a]ピリジン−2−イル]ピリジン−2−カルボキサミド
実施例49に準じ、参考例21で得られた6−クロロイミダゾ[1,2−a]ピリジン−2−アミンおよび参考例46から得られる塩化 5−tert−ブチルピリジン−2−カルボニルを用いて表題化合物を合成した。
MS (ESI+): 329 (M+H)。
1H-NMR (CDCl3) δ: 1.40 (9H, s), 7.15 (1H, d, J = 9.5 Hz), 7.43 (1H, d, J = 9.5 Hz), 7.88 (1H, dd, J = 8.2, 2.4 Hz), 8.16-8.24 (3H, m), 8.67 (1H, d, J = 2.4 Hz), 10.35 (1H, s)。
MS (ESI+): 329 (M+H)。
1H-NMR (CDCl3) δ: 1.40 (9H, s), 7.15 (1H, d, J = 9.5 Hz), 7.43 (1H, d, J = 9.5 Hz), 7.88 (1H, dd, J = 8.2, 2.4 Hz), 8.16-8.24 (3H, m), 8.67 (1H, d, J = 2.4 Hz), 10.35 (1H, s)。
実施例97
N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]−4−イソプロピルベンズアミド
N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]−4−イソプロピルベンズアミド
実施例49に準じ、4−イソプロピル安息香酸クロリドを用いてN−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)−4−イソプロピルベンズアミドを合成した後に、実施例51に準じ表題化合物へと変換した。
融点 291−293℃
MS (ESI+): 346 (M+H)。
1H-NMR (DMSO-d6) δ: 1.24 (6H, d, J = 7.0 Hz), 2.92-3.03 (1H, m), 7.15 (1H, s), 7.39 (2H, d, J = 8.3 Hz), 7.54-7.65 (2H, m), 7.70 (1H, t, J = 1.3 Hz), 8.02 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.34 (1H, s), 9.05-9.08 (1H, m), 11.22 (1H, s)。
元素分析値:C20H19N5Oとして
計算値:C, 69.55; H, 5.54; N, 20.28。
実測値:C, 69.32; H, 5.48; N, 20.28。
融点 291−293℃
MS (ESI+): 346 (M+H)。
1H-NMR (DMSO-d6) δ: 1.24 (6H, d, J = 7.0 Hz), 2.92-3.03 (1H, m), 7.15 (1H, s), 7.39 (2H, d, J = 8.3 Hz), 7.54-7.65 (2H, m), 7.70 (1H, t, J = 1.3 Hz), 8.02 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.34 (1H, s), 9.05-9.08 (1H, m), 11.22 (1H, s)。
元素分析値:C20H19N5Oとして
計算値:C, 69.55; H, 5.54; N, 20.28。
実測値:C, 69.32; H, 5.48; N, 20.28。
実施例98
N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]−4−イソプロピルベンズアミド 2メタンスルホン酸塩
N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]−4−イソプロピルベンズアミド 2メタンスルホン酸塩
実施例53に準じ、実施例97で得られたN−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]−4−イソプロピルベンズアミドを用いて表題化合物を合成した。
MS (ESI+): 346 (M+H)。
1H-NMR (DMSO-d6) δ: 1.24 (6H, d, J = 6.8 Hz), 2.34 (6H, s), 2.93-3.04 (1H, m), 7.41 (2H, d, J = 8.3 Hz), 7.69 (1H, dd, J = 9.5, 2.1 Hz), 7.78 (1H, d, J = 9.5 Hz), 7.96-7.98 (1H, m), 8.03 (2H, d, J = 8.3 Hz), 8.25 (1H, t, J = 1.7 Hz), 8.43 (1H, s), 9.27 (1H, d, J = 1.3 Hz), 9.67 (1H, s), 11.35 (1H, s)。
元素分析値:C20H19N5O・2MsOH・0.5H2Oとして
計算値:C, 69.55; H, 5.54; N, 20.28。
実測値:C, 69.32; H, 5.48; N, 20.28。
MS (ESI+): 346 (M+H)。
1H-NMR (DMSO-d6) δ: 1.24 (6H, d, J = 6.8 Hz), 2.34 (6H, s), 2.93-3.04 (1H, m), 7.41 (2H, d, J = 8.3 Hz), 7.69 (1H, dd, J = 9.5, 2.1 Hz), 7.78 (1H, d, J = 9.5 Hz), 7.96-7.98 (1H, m), 8.03 (2H, d, J = 8.3 Hz), 8.25 (1H, t, J = 1.7 Hz), 8.43 (1H, s), 9.27 (1H, d, J = 1.3 Hz), 9.67 (1H, s), 11.35 (1H, s)。
元素分析値:C20H19N5O・2MsOH・0.5H2Oとして
計算値:C, 69.55; H, 5.54; N, 20.28。
実測値:C, 69.32; H, 5.48; N, 20.28。
実施例99
4−{[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}安息香酸メチル
4−{[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}安息香酸メチル
実施例49に準じ、4−(クロロカルボニル)安息香酸メチルを用いて4−[(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]安息香酸メチルを合成した後に、実施例51に準じ表題化合物へと変換した。
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 3.90 (3H, s), 7.16 (1H, s), 7.59 (1H, d, J = 9.5 Hz), 7.65 (1H, d, J = 9.5 Hz), 7.70 (1H, t, J = 1.3 Hz), 8.08 (2H, d, J = 8.7 Hz), 8.17-8.22 (3H, m), 8.37 (1H, s), 9.07-9.10 (1H, m), 11.55 (1H, s)。
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 3.90 (3H, s), 7.16 (1H, s), 7.59 (1H, d, J = 9.5 Hz), 7.65 (1H, d, J = 9.5 Hz), 7.70 (1H, t, J = 1.3 Hz), 8.08 (2H, d, J = 8.7 Hz), 8.17-8.22 (3H, m), 8.37 (1H, s), 9.07-9.10 (1H, m), 11.55 (1H, s)。
実施例100
6−tert−ブチル−N−[6−(1,3−オキサゾール−5−イル)イミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミド
6−tert−ブチル−N−[6−(1,3−オキサゾール−5−イル)イミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミド
実施例74に準じ、実施例86で得られた6−tert−ブチル−N−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)ニコチンアミドを用いて表題化合物を合成した。
融点 251−253℃
MS (ESI+): 362 (M+H)。
1H-NMR (DMSO-d6) δ: 1.35 (9H, s), 7.56-7.66 (3H, m), 7.70 (1H, s), 8.32-8.37 (1H, m), 8.41 (1H, s), 8.51 (1H, s), 9.06 (1H, s), 9.14 (1H, s), 11.44 (1H, s)。
融点 251−253℃
MS (ESI+): 362 (M+H)。
1H-NMR (DMSO-d6) δ: 1.35 (9H, s), 7.56-7.66 (3H, m), 7.70 (1H, s), 8.32-8.37 (1H, m), 8.41 (1H, s), 8.51 (1H, s), 9.06 (1H, s), 9.14 (1H, s), 11.44 (1H, s)。
実施例101
6−tert−ブチル−N−[6−(1,3−オキサゾール−5−イル)イミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミド 2塩酸塩
6−tert−ブチル−N−[6−(1,3−オキサゾール−5−イル)イミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミド 2塩酸塩
実施例52に準じ、実施例100で得られた6−tert−ブチル−N−[6−(1,3−オキサゾール−5−イル)イミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミドを用いて表題化合物を合成した。
MS (ESI+): 362 (M+H)。
1H-NMR (DMSO-d6) δ: 1.39 (9H, s), 7.70-7.79 (3H, m), 7.80-7.86 (1H, m), 8.44 (1H, s), 8.51 (1H, dd, J = 8.5, 2.3 Hz), 8.56 (1H, s), 9.15-9.22 (2H, m), 11.89 (1H, s)。
元素分析値:C20H19N5O2・2HCl・1.5H2Oとして
計算値:C, 69.55; H, 5.54; N, 20.28。
実測値:C, 69.32; H, 5.48; N, 20.28。
MS (ESI+): 362 (M+H)。
1H-NMR (DMSO-d6) δ: 1.39 (9H, s), 7.70-7.79 (3H, m), 7.80-7.86 (1H, m), 8.44 (1H, s), 8.51 (1H, dd, J = 8.5, 2.3 Hz), 8.56 (1H, s), 9.15-9.22 (2H, m), 11.89 (1H, s)。
元素分析値:C20H19N5O2・2HCl・1.5H2Oとして
計算値:C, 69.55; H, 5.54; N, 20.28。
実測値:C, 69.32; H, 5.48; N, 20.28。
実施例102
6−tert−ブチル−N−(6−(ピリジン−3−イル)イミダゾ[1,2−a]ピリジン−2−イル)ニコチンアミド
6−tert−ブチル−N−(6−(ピリジン−3−イル)イミダゾ[1,2−a]ピリジン−2−イル)ニコチンアミド
実施例57に準じ、実施例86で得られた6−tert−ブチル−N−[6−ヨードイミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミドを用いて表題化合物を合成した。
融点 272−274℃
MS (ESI+): 372 (M+H)。
1H-NMR (DMSO-d6) δ: 1.36 (9H, s), 7.50-7.70 (4H, m), 8.12-8.16 (1H, m), 8.33-8.39 (2H, m), 8.61 (1H, dd, J = 4.8, 1.6 Hz), 8.96 (1H, d, J = 1.7 Hz), 9.08-9.10 (1H, m), 9.15 (1H, d, J = 1.7 Hz), 11.43 (1H, s)。
元素分析値:C22H21N5O・0.2H2Oとして
計算値:C, 70.46; H, 5.75; N, 18.67。
実測値:C, 70.69; H, 5.60; N, 18.67。
融点 272−274℃
MS (ESI+): 372 (M+H)。
1H-NMR (DMSO-d6) δ: 1.36 (9H, s), 7.50-7.70 (4H, m), 8.12-8.16 (1H, m), 8.33-8.39 (2H, m), 8.61 (1H, dd, J = 4.8, 1.6 Hz), 8.96 (1H, d, J = 1.7 Hz), 9.08-9.10 (1H, m), 9.15 (1H, d, J = 1.7 Hz), 11.43 (1H, s)。
元素分析値:C22H21N5O・0.2H2Oとして
計算値:C, 70.46; H, 5.75; N, 18.67。
実測値:C, 70.69; H, 5.60; N, 18.67。
実施例103
4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例49に準じ、参考例23で得られた6−ヨードイミダゾ[1,2−a]ピリジン−2−アミン(1.03g、4.0mmol)および参考例50で得られた4−(2−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルエチル)安息香酸(1.23g、4.0mmol)より得られる塩化 4−(2−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルエチル)ベンゾイルを用いて4−(2−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルエチル)−N−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(770mg、1.40mmol)を合成した。得られたこの化合物を実施例51に準じ、反応を行ない、4−(2−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド(370mg、0.76mmol)を合成した。その後、1M−テトラ−N−ブチルアンモニウムフルオリド−THF溶液(2.28mL)を加え、45℃で4時間、攪拌した。減圧下、溶媒を留去した後に、残留物をシリカゲルクロマトグラフィー(酢酸エチル:メタノール=10:0〜8:2)で精製し、ジクロロメタン−ヘキサンを用いて再結晶を行ない、表題化合物(210mg、74%)を得た。
融点 278−280℃
MS (ESI+): 376 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.47 (2H, d, J = 5.3 Hz), 4.74 (1H, t, J = 5.3 Hz), 7.15 (1H, s), 7.51 (2H, d, J = 8.6 Hz), 7.55-7.64 (2H, m), 7.70 (1H, t, J = 1.2 Hz), 8.02 (2H, d, J = 8.6 Hz), 8.19 (1H, s), 8.34 (1H, s), 9.05-9.08 (1H, m), 11.22 (1H, s)。
元素分析値:C21H21N5O2・0.5H2Oとして
計算値:C, 65.61; H, 5.77; N, 18.22。
実測値:C, 65.30; H, 5.76; N, 18.03。
融点 278−280℃
MS (ESI+): 376 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.47 (2H, d, J = 5.3 Hz), 4.74 (1H, t, J = 5.3 Hz), 7.15 (1H, s), 7.51 (2H, d, J = 8.6 Hz), 7.55-7.64 (2H, m), 7.70 (1H, t, J = 1.2 Hz), 8.02 (2H, d, J = 8.6 Hz), 8.19 (1H, s), 8.34 (1H, s), 9.05-9.08 (1H, m), 11.22 (1H, s)。
元素分析値:C21H21N5O2・0.5H2Oとして
計算値:C, 65.61; H, 5.77; N, 18.22。
実測値:C, 65.30; H, 5.76; N, 18.03。
実施例104
4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド 2塩酸塩
4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド 2塩酸塩
実施例52に準じ、実施例103で得られた4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミドを用いて表題化合物を合成した。
MS (ESI+): 376 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.47 (2H, s), 7.52 (2H, d, J = 8.5 Hz), 7.67 (1H, dd, J = 9.6, 2.1 Hz), 7.76 (1H, d, J = 9.6 Hz), 7.95 (1H, s), 8.02 (2H, d, J = 8.5 Hz), 8.23 (1H, s), 8.42 (1H, s), 9.24-9.27 (1H, m), 9.64 (1H, s), 11.22 (1H, s), hidden (1H)。
元素分析値:C21H21N5O2・2HCl・1.4H2Oとして
計算値:C, 53.26; H, 5.49; N, 14.79。
実測値:C, 53.58; H, 5.77; N, 14.69。
MS (ESI+): 376 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.47 (2H, s), 7.52 (2H, d, J = 8.5 Hz), 7.67 (1H, dd, J = 9.6, 2.1 Hz), 7.76 (1H, d, J = 9.6 Hz), 7.95 (1H, s), 8.02 (2H, d, J = 8.5 Hz), 8.23 (1H, s), 8.42 (1H, s), 9.24-9.27 (1H, m), 9.64 (1H, s), 11.22 (1H, s), hidden (1H)。
元素分析値:C21H21N5O2・2HCl・1.4H2Oとして
計算値:C, 53.26; H, 5.49; N, 14.79。
実測値:C, 53.58; H, 5.77; N, 14.69。
実施例105
6−tert−ブチル−N−[6−(1−メチル−1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミド
6−tert−ブチル−N−[6−(1−メチル−1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミド
実施例57に準じ、実施例86で得られた6−tert−ブチル−N−[6−ヨードイミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミドおよび1−メチル−4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ピラゾールを用いて表題化合物を合成した。
融点 228−230℃
MS (ESI+): 375 (M+H)。
1H-NMR (DMSO-d6) δ: 1.35 (9H, s), 3.89 (3H, s), 7.49 (2H, br), 7.58 (1H, dd, J = 8.5, 0.8 Hz), 7.87 (1H, d, J = 0.8 Hz), 8.14 (1H, s), 8.24 (1H, s), 8.35 (1H, dd, J = 8.3, 2.4 Hz), 8.86 (1H, t, J = 1.3 Hz), 9.12-9.15 (1H, m), 11.36 (1H, s)。
元素分析値:C21H22N6O・0.2H2Oとして
計算値:C, 66.72; H, 5.97; N, 22.23。
実測値:C, 66.89; H, 5.90; N, 22.22。
融点 228−230℃
MS (ESI+): 375 (M+H)。
1H-NMR (DMSO-d6) δ: 1.35 (9H, s), 3.89 (3H, s), 7.49 (2H, br), 7.58 (1H, dd, J = 8.5, 0.8 Hz), 7.87 (1H, d, J = 0.8 Hz), 8.14 (1H, s), 8.24 (1H, s), 8.35 (1H, dd, J = 8.3, 2.4 Hz), 8.86 (1H, t, J = 1.3 Hz), 9.12-9.15 (1H, m), 11.36 (1H, s)。
元素分析値:C21H22N6O・0.2H2Oとして
計算値:C, 66.72; H, 5.97; N, 22.23。
実測値:C, 66.89; H, 5.90; N, 22.22。
実施例106
4−tert−ブチル−N−[6−(6−メトキシピリジン−3−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(6−メトキシピリジン−3−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例57に準じ、2−メトキシ−5−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)ピリジンを用いて表題化合物を合成した。
融点 245−247℃
MS (ESI+): 401 (M+H)。
1H-NMR (CDCl3) δ: 1.35 (9H, s), 4.00 (3H, s), 6.87 (1H, d, J = 8.7 Hz), 7.28-7.30 (2H, m), 7.50 (2H, d, J = 8.6 Hz), 7.75 (1H, dd, J = 8.7, 2.6 Hz), 7.91 (2H, d, J = 8.6 Hz), 8.23 (1H, t, J = 1.4 Hz), 8.30 (1H, s), 8.36 (1H ,d, J = 2.1 Hz), 9.45 (1H, s)。
元素分析値:C24H24N4O2として
計算値:C, 71.98; H, 6.04; N, 13.99。
実測値:C, 71.22; H, 6.13; N, 13.81。
融点 245−247℃
MS (ESI+): 401 (M+H)。
1H-NMR (CDCl3) δ: 1.35 (9H, s), 4.00 (3H, s), 6.87 (1H, d, J = 8.7 Hz), 7.28-7.30 (2H, m), 7.50 (2H, d, J = 8.6 Hz), 7.75 (1H, dd, J = 8.7, 2.6 Hz), 7.91 (2H, d, J = 8.6 Hz), 8.23 (1H, t, J = 1.4 Hz), 8.30 (1H, s), 8.36 (1H ,d, J = 2.1 Hz), 9.45 (1H, s)。
元素分析値:C24H24N4O2として
計算値:C, 71.98; H, 6.04; N, 13.99。
実測値:C, 71.22; H, 6.13; N, 13.81。
実施例107
4−tert−ブチル−N−[6−(2−チエニル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(2−チエニル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例57に準じ、4,4,5,5−テトラメチル−2−(2−チエニル)−1,3,2−ジオキサボロランを用いて表題化合物を合成した。
融点 273−275℃
MS (ESI+): 376 (M+H)。
1H-NMR (CDCl3) δ: 1.35 (9H, s), 7.10-7.14 (1H, m), 7.27-7.34 (2H, m), 7.37 (1H, d, J = 9.3 Hz), 7.43 (1H, d, J = 9.3 Hz), 7.52 (2H, d, J = 8.6 Hz), 7.89 (2H, d, J = 8.6 Hz), 8.26 (1H, s), 8.34 (1H, s), 9.01 (1H, s)。
元素分析値:C22H21N3OSとして
計算値:C, 70.37; H, 5.64; N, 11.19。
実測値:C, 70.07; H, 5.60; N, 11.16。
融点 273−275℃
MS (ESI+): 376 (M+H)。
1H-NMR (CDCl3) δ: 1.35 (9H, s), 7.10-7.14 (1H, m), 7.27-7.34 (2H, m), 7.37 (1H, d, J = 9.3 Hz), 7.43 (1H, d, J = 9.3 Hz), 7.52 (2H, d, J = 8.6 Hz), 7.89 (2H, d, J = 8.6 Hz), 8.26 (1H, s), 8.34 (1H, s), 9.01 (1H, s)。
元素分析値:C22H21N3OSとして
計算値:C, 70.37; H, 5.64; N, 11.19。
実測値:C, 70.07; H, 5.60; N, 11.16。
実施例108
4−tert−ブチル−N−[6−(3−チエニル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(3−チエニル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例57に準じ、4,4,5,5−テトラメチル−2−(3−チエニル)−1,3,2−ジオキサボロランを用いて表題化合物を合成した。
融点 261−263℃
MS (ESI+): 376 (M+H)。
1H-NMR (CDCl3) δ: 1.36 (9H, s), 7.31-7.48 (5H, m), 7.51 (2H, d, J = 8.6 Hz), 7.90 (2H, d, J = 8.6 Hz), 8.26 (1H, s), 8.31-8.34 (1H, m), 9.12 (1H, s)。
元素分析値:C22H21N3OSとして
計算値:C, 70.37; H, 5.64; N, 11.19。
実測値:C, 70.02; H, 5.54; N, 11.13。
融点 261−263℃
MS (ESI+): 376 (M+H)。
1H-NMR (CDCl3) δ: 1.36 (9H, s), 7.31-7.48 (5H, m), 7.51 (2H, d, J = 8.6 Hz), 7.90 (2H, d, J = 8.6 Hz), 8.26 (1H, s), 8.31-8.34 (1H, m), 9.12 (1H, s)。
元素分析値:C22H21N3OSとして
計算値:C, 70.37; H, 5.64; N, 11.19。
実測値:C, 70.02; H, 5.54; N, 11.13。
実施例109
N−[6−(ベンジルアミノ)イミダゾ[1,2−a]ピリジン−2−イル]−4−tert−ブチルベンズアミド
N−[6−(ベンジルアミノ)イミダゾ[1,2−a]ピリジン−2−イル]−4−tert−ブチルベンズアミド
実施例51に準じ、ベンジルアミンを用いて表題化合物を得た。
MS (ESI+): 399 (M+H)。
1H-NMR (DMSO-d6) δ: 1.31 (9H, s), 4.20 (2H, d, J = 6.0 Hz), 5.99 (1H, t, J = 6.0 Hz), 6.92 (1H, dd, J = 9.5, 2.2 Hz), 7.20-7.30 (2H, m), 7.32-7.39 (2H, m), 7.41-7.46 (2H, m), 7.50 (2H, d, J = 8.6 Hz), 7.66 (1H, d, J = 1.9 Hz), 7.99 (2H, d, J = 8.6 Hz), 8.02 (1H, s), 10.89 (1H, s)。
MS (ESI+): 399 (M+H)。
1H-NMR (DMSO-d6) δ: 1.31 (9H, s), 4.20 (2H, d, J = 6.0 Hz), 5.99 (1H, t, J = 6.0 Hz), 6.92 (1H, dd, J = 9.5, 2.2 Hz), 7.20-7.30 (2H, m), 7.32-7.39 (2H, m), 7.41-7.46 (2H, m), 7.50 (2H, d, J = 8.6 Hz), 7.66 (1H, d, J = 1.9 Hz), 7.99 (2H, d, J = 8.6 Hz), 8.02 (1H, s), 10.89 (1H, s)。
実施例110
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[(メチルスルホニル)アミノ]ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[(メチルスルホニル)アミノ]ベンズアミド
実施例49に準じ、参考例21で得られた6−クロロイミダゾ[1,2−a]ピリジン−2−アミンおよび塩化 4−[(メチルスルホニル)アミノ]ベンゾイルを用いて表題化合物を合成した。
融点 293−295℃
MS (ESI+): 365 (M+H)。
1H-NMR (DMSO-d6) δ: 3.09 (3H, s), 7.24-7.31 (3H, m), 7.50 (1H, d, J = 9.4 Hz), 8.05 (2H, d, J = 8.9 Hz), 8.31 (1H, s), 8.86-8.89 (1H, m), 10.22 (1H, s), 11.16 (1H, s)。
元素分析値:C15H13N4O3SClとして
計算値:C, 49.39; H, 3.59; N, 15.36。
実測値:C, 49.36; H, 3.65; N, 15.39。
融点 293−295℃
MS (ESI+): 365 (M+H)。
1H-NMR (DMSO-d6) δ: 3.09 (3H, s), 7.24-7.31 (3H, m), 7.50 (1H, d, J = 9.4 Hz), 8.05 (2H, d, J = 8.9 Hz), 8.31 (1H, s), 8.86-8.89 (1H, m), 10.22 (1H, s), 11.16 (1H, s)。
元素分析値:C15H13N4O3SClとして
計算値:C, 49.39; H, 3.59; N, 15.36。
実測値:C, 49.36; H, 3.65; N, 15.39。
実施例111
4−tert−ブチル−N−[6−(1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例57に準じ、4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ピラゾールを用いて表題化合物を合成した。
融点 278−280℃
MS (ESI+): 360 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 7.44-7.57 (4H, m), 7.98-8.24 (5H, m), 8.88 (1H, s), 11.11 (1H, s), 13.01 (1H, s)。
元素分析値:C21H21N5Oとして
計算値:C, 70.17; H, 5.89; N, 19.48。
実測値:C, 70.04; H, 6.04; N, 19.20。
融点 278−280℃
MS (ESI+): 360 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 7.44-7.57 (4H, m), 7.98-8.24 (5H, m), 8.88 (1H, s), 11.11 (1H, s), 13.01 (1H, s)。
元素分析値:C21H21N5Oとして
計算値:C, 70.17; H, 5.89; N, 19.48。
実測値:C, 70.04; H, 6.04; N, 19.20。
実施例112
4−tert−ブチル−N−[6−(1−フェニル−1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(1−フェニル−1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例111で得られた、4−tert−ブチル−N−[6−(1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド(0.25mmol、90mg)、酢酸銅(0.25mmol、45mg)、ピリジン(0.375mmol、30mg)、フェニルボロン酸(0.5mmol、61mg)をDMF(3mL)に懸濁させ、マイクロウエーブを用いて100℃で20分間攪拌した。減圧下、溶媒を留去した後に、アンモニア水を加えた後に、酢酸エチルを用いて抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:メタノール=10:0〜9:1)で精製し、表題化合物(8mg、7%)を合成した。
MS (ESI+): 436 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.35 (1H, t, J = 7.4 Hz), 7.51-7.70 (6H, m), 7.90 (2H, d, J = 8.6 Hz), 8.04 (2H, d, J = 8.6 Hz), 8.25 (2H, d, J = 6.8 Hz), 9.00 (1H, s), 9.04 (1H, s), 11.16 (1H, s)。
MS (ESI+): 436 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.35 (1H, t, J = 7.4 Hz), 7.51-7.70 (6H, m), 7.90 (2H, d, J = 8.6 Hz), 8.04 (2H, d, J = 8.6 Hz), 8.25 (2H, d, J = 6.8 Hz), 9.00 (1H, s), 9.04 (1H, s), 11.16 (1H, s)。
実施例113
4−tert−ブチル−N−[6−(1−ピリジン−3−イル−1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(1−ピリジン−3−イル−1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例112に準じ、3−ピリジンボロン酸を用いて表題化合物(8mg、7%)を合成した。
MS (ESI+): 437 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.50-7.66 (5H, m), 8.05 (2H, d, J = 8.5 Hz), 8.26-8.33 (3H, m), 8.55-8.58 (1H, m), 9.02 (1H, s), 9.13 (1H, s), 9.17 (1H, d, J = 2.5 Hz), 11.17 (1H, s)。
MS (ESI+): 437 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.50-7.66 (5H, m), 8.05 (2H, d, J = 8.5 Hz), 8.26-8.33 (3H, m), 8.55-8.58 (1H, m), 9.02 (1H, s), 9.13 (1H, s), 9.17 (1H, d, J = 2.5 Hz), 11.17 (1H, s)。
実施例114
6−tert−ブチル−N−[6−(1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミド
6−tert−ブチル−N−[6−(1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミド
実施例57に準じ、4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ピラゾールおよび実施例86で得られた6−tert−ブチル−N−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)ニコチンアミドを用いて表題化合物を合成した。
融点 238−240℃
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.35 (9H, s), 7.48 (1H, d, J = 9.1 Hz), 7.52-7.60 (2H, m), 7.92-8.16 (2H, m), 8.23 (1H, s), 8.35 (1H, d, J = 8.3 Hz), 8.89 (1H, s), 9.13 (1H, d, J = 1.9 Hz), 11.36 (1H, s), 13.01 (1H, s)。
融点 238−240℃
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.35 (9H, s), 7.48 (1H, d, J = 9.1 Hz), 7.52-7.60 (2H, m), 7.92-8.16 (2H, m), 8.23 (1H, s), 8.35 (1H, d, J = 8.3 Hz), 8.89 (1H, s), 9.13 (1H, d, J = 1.9 Hz), 11.36 (1H, s), 13.01 (1H, s)。
実施例115
4−tert−ブチル−N−[6−(ジメチルアミノ)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 塩酸塩
4−tert−ブチル−N−[6−(ジメチルアミノ)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 塩酸塩
実施例138で得られた4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(0.73mmol、240mg)、ベンジルアミン塩酸塩(1.46mmol、209mg)、炭酸カリウム(2.92mmol、403mg)をDMF(4mL)中に懸濁させ、マイクロウエーブを用いて、130℃で30分間攪拌した。減圧下、溶媒を留去した後に、飽和食塩水を加え、酢酸エチルを用いて抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=8:2〜10:0)で精製した後に、実施例52に準じ、表題化合物(60mg、22%)を得た。
融点 259−260℃
MS (ESI+): 338 (M+H)。
1H-NMR (CDCl3) δ: 1.35 (9H, s), 3.20 (6H, s), 7.09 (1H, d, J = 10.0 Hz), 7.56 (2H, d, J = 8.6 Hz), 7.79 (1H, d, J = 10.0 Hz), 8.16 (2H, d, J = 8.6 Hz), 8.30-8.37 (1H, m), 11.68 (1H, s)。
元素分析値:C19H23N5O・HCl・0.4H2Oとして
計算値:C, 59.88; H, 6.56; N, 18.38。
実測値:C, 59.69; H, 6.53; N, 18.28。
融点 259−260℃
MS (ESI+): 338 (M+H)。
1H-NMR (CDCl3) δ: 1.35 (9H, s), 3.20 (6H, s), 7.09 (1H, d, J = 10.0 Hz), 7.56 (2H, d, J = 8.6 Hz), 7.79 (1H, d, J = 10.0 Hz), 8.16 (2H, d, J = 8.6 Hz), 8.30-8.37 (1H, m), 11.68 (1H, s)。
元素分析値:C19H23N5O・HCl・0.4H2Oとして
計算値:C, 59.88; H, 6.56; N, 18.38。
実測値:C, 59.69; H, 6.53; N, 18.28。
実施例116
2−(4−{[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)−2−メチルプロパン酸
2−(4−{[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)−2−メチルプロパン酸
実施例15と同様にして、参考例1で合成した4−(2−メトキシ−1,1−ジメチル−2−オキソエチル)安息香酸と参考例21で合成した6−クロロイミダゾ[1,2−a]ピリジン−2−アミンを用い2−メチル−2−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}プロパン酸メチルを得、これを実施例116と同様に処理して表題化合物を合成した。
融点 311−313℃(decomp.)
MS (ESI+): 357 (M+)。
1H-NMR (DMSO-d6) δ: 1.50 (6H, s), 7.28 (1H, dd, J = 9.5, 2.3 Hz), 7.44-7.53 (3H, m), 8.03 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.86-8.89 (1H, m), 11.24 (1H, s), hidden (1H)。
元素分析値:C18H16N3O3Clとして
計算値:C, 60.42; H, 4.51; N, 11.74。
実測値:C, 60.51; H, 4.81; N, 11.35。
融点 311−313℃(decomp.)
MS (ESI+): 357 (M+)。
1H-NMR (DMSO-d6) δ: 1.50 (6H, s), 7.28 (1H, dd, J = 9.5, 2.3 Hz), 7.44-7.53 (3H, m), 8.03 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.86-8.89 (1H, m), 11.24 (1H, s), hidden (1H)。
元素分析値:C18H16N3O3Clとして
計算値:C, 60.42; H, 4.51; N, 11.74。
実測値:C, 60.51; H, 4.81; N, 11.35。
実施例117
3−(4−{[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)−3−メチルブタン酸
3−(4−{[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)−3−メチルブタン酸
実施例119で得られた3−(4−{[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)−3−メチルブタン酸エチル(0.15mmol、60mg)のTHF(3mL)−メタノール(3mL)溶液に1規定水酸化リチウム水溶液(1.5mL)を加えて80℃で3時間攪拌した。減圧下で揮発性溶媒を留去した後に、残留物に塩酸を加え、表題化合物を固化させた。その固体をろ取した後に、DMSO−水を用いて再結晶を行って表題化合物(45mg、81%)を得た。
融点 304−306℃(decomp.)
MS (ESI+): 371(M+)。
1H-NMR (DMSO-d6) δ: 1.40 (6H, s), 2.63 (2H, s), 7.28 (1H, dd, J = 9.5, 2.3 Hz), 7.47-7.55 (3H, m), 8.00 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.88 (1H, s), 11.20 (1H, s), hidden (1H)。
元素分析値:C19H18N3O3Clとして
計算値:C, 61.38; H, 4.88; N, 11.30。
実測値:C, 61.34; H, 4.60; N, 11.28。
融点 304−306℃(decomp.)
MS (ESI+): 371(M+)。
1H-NMR (DMSO-d6) δ: 1.40 (6H, s), 2.63 (2H, s), 7.28 (1H, dd, J = 9.5, 2.3 Hz), 7.47-7.55 (3H, m), 8.00 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.88 (1H, s), 11.20 (1H, s), hidden (1H)。
元素分析値:C19H18N3O3Clとして
計算値:C, 61.38; H, 4.88; N, 11.30。
実測値:C, 61.34; H, 4.60; N, 11.28。
実施例118
4−(4−{[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)−4−メチルペンタン酸
4−(4−{[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)−4−メチルペンタン酸
実施例117に準じ、実施例120で得られた4−(4−{[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)−4−メチルペンタン酸エチルを用いて表題化合物を合成した。
融点 309−311℃(decomp.)
MS (ESI+): 385 (M+)。
1H-NMR (DMSO-d6) δ: 1.30 (6H, s), 1.86-1.93 (4H, m), 7.28 (1H, dd, J = 9.4, 2.1 Hz), 7.43-7.54 (3H, m), 8.03 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 8.88 (1H, s), 11.21 (1H, s), 11.99 (1H, s)。
元素分析値:C20H20N3O3Clとして
計算値:C, 62.26; H, 5.22; N, 10.89。
実測値:C, 62.14; H, 5.23; N, 10.80。
融点 309−311℃(decomp.)
MS (ESI+): 385 (M+)。
1H-NMR (DMSO-d6) δ: 1.30 (6H, s), 1.86-1.93 (4H, m), 7.28 (1H, dd, J = 9.4, 2.1 Hz), 7.43-7.54 (3H, m), 8.03 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 8.88 (1H, s), 11.21 (1H, s), 11.99 (1H, s)。
元素分析値:C20H20N3O3Clとして
計算値:C, 62.26; H, 5.22; N, 10.89。
実測値:C, 62.14; H, 5.23; N, 10.80。
実施例119
3−(4−{[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)−3−メチルブタン酸エチル
3−(4−{[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)−3−メチルブタン酸エチル
実施例49に準じ、参考例21で得られた6−クロロイミダゾ[1,2−a]ピリジン−2−アミンおよび参考例5で得られた4−(3−エトキシ−1,1−ジメチル−3−オキソプロピル)安息香酸より得られる3−[4−(クロロカルボニル)フェニル]−3−メチルブタン酸エチルを用いて表題化合物を合成した。
MS (ESI+): 365 (M+)。
1H-NMR (DMSO-d6) δ: 1.02 (3H, t, J = 7.2 Hz), 1.46 (6H, s), 2.70 (2H, s), 3.90 (2H, q, J = 7.2 Hz), 7.28 (1H, dd, J = 9.5, 1.9 Hz), 7.48-7.53 (3H, m), 8.01 (2H, d, J = 8.7 Hz), 8.33 (1H, s), 8.88 (1H, s), 11.21 (1H, s)。
MS (ESI+): 365 (M+)。
1H-NMR (DMSO-d6) δ: 1.02 (3H, t, J = 7.2 Hz), 1.46 (6H, s), 2.70 (2H, s), 3.90 (2H, q, J = 7.2 Hz), 7.28 (1H, dd, J = 9.5, 1.9 Hz), 7.48-7.53 (3H, m), 8.01 (2H, d, J = 8.7 Hz), 8.33 (1H, s), 8.88 (1H, s), 11.21 (1H, s)。
実施例120
4−(4−{[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)−4−メチルペンタン酸エチル
4−(4−{[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)−4−メチルペンタン酸エチル
実施例49に準じ、参考例21で得られた6−クロロイミダゾ[1,2−a]ピリジン−2−アミンおよび参考例6で得られた4−(4−エトキシ−1,1−ジメチル−4−オキソブチル)安息香酸より得られる4−[4−(クロロカルボニル)フェニル]−4−メチルペンタン酸エチルを用いて表題化合物を合成した。
MS (ESI+): 399 (M+H)。
1H-NMR (CDCl3) δ: 1.21 (3H, t, J = 7.2 Hz), 1.35 (6H, s), 1.97-2.13 (4H, m), 4.06 (2H, q, J = 7.2 Hz), 7.11 (1H, d, J = 9.5 Hz), 7.21 (1H, d, J = 9.5 Hz), 7.44 (2H, d, J = 8.2 Hz), 7.90 (2H, d, J = 8.2 Hz), 8.17 (1H, s), 8.24 (1H, s), 9.42 (1H, s)。
MS (ESI+): 399 (M+H)。
1H-NMR (CDCl3) δ: 1.21 (3H, t, J = 7.2 Hz), 1.35 (6H, s), 1.97-2.13 (4H, m), 4.06 (2H, q, J = 7.2 Hz), 7.11 (1H, d, J = 9.5 Hz), 7.21 (1H, d, J = 9.5 Hz), 7.44 (2H, d, J = 8.2 Hz), 7.90 (2H, d, J = 8.2 Hz), 8.17 (1H, s), 8.24 (1H, s), 9.42 (1H, s)。
実施例121
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[1−メチル−1−(5−オキソ−4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)エチル]ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[1−メチル−1−(5−オキソ−4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)エチル]ベンズアミド
ヒドロキシルアミン(2.0mmol、139mg)および炭酸水素ナトリウム(2.4mmol、201mg)をDMSO(3mL)中に懸濁させ40℃で10分間攪拌した。その後に実施例93で得られたN−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(1−シアノ−1−メチルエチル)ベンズアミド(0.2mmol、68mg)を加え、60℃で終夜攪拌した。水を加えた後に、酢酸エチルで抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物(60mg)をTHF(10mL)中に溶解させた後にN,N’−カルボニルジイミダゾール(0.3mmol、49mg)および1,8−ジアザビシクロ[5.4.0]ウンデカ−7−エン(0.3mmol、46mg)を加え、3時間攪拌した。水を加えた後に、酢酸エチルで抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をDMSO−水で再結晶を行ない、表題化合物(13mg、16%)を合成した。
融点 310−312℃(decomp.)
MS (ESI+): 397 (M)。
1H-NMR (DMSO-d6) δ: 1.63 (6H, s), 7.26-7.32 (1H, m), 7.43-7.54 (3H, m), 8.07 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 8.87-8.90 (1H, m), 11.31 (1H, s), 12.29 (1H, m)。
融点 310−312℃(decomp.)
MS (ESI+): 397 (M)。
1H-NMR (DMSO-d6) δ: 1.63 (6H, s), 7.26-7.32 (1H, m), 7.43-7.54 (3H, m), 8.07 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 8.87-8.90 (1H, m), 11.31 (1H, s), 12.29 (1H, m)。
実施例122
4−[2−(アセチルアミノ)−1,1−ジメチルエチル]−N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
4−[2−(アセチルアミノ)−1,1−ジメチルエチル]−N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
実施例94で得られた4−(2−アミノ−1,1−ジメチルエチル)−N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(0.1mmol、34mg)、トリエチルアミン(0.2mmol、20mg)をTHF(20mL)に溶解させた後に、アセチルクロリド(0.2mmol、16mg)を加え、2時間攪拌した。減圧下、揮発性成分を留去した後に、残留物をシリカゲルクロマトグラフィー(酢酸エチル:メタノール=10:0〜8:2)で精製し、メタノール−酢酸エチルを用いて再結晶を行ない、表題化合物(24mg、63%)を得た。
融点 220−222℃
MS (ESI+): 384 (M)。
1H-NMR (DMSO-d6) δ: 1.27 (6H, s), 1.78 (3H, s), 3.27-3.33 (2H, m), 7.29 (1H, d, J = 9.4, 2.1 Hz), 7.46-7.54 (3H, m), 7.62-7.69 (1H, m), 8.03 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 8.88 (1H, d, J = 2.1 Hz), 11.22 (1H, s)。
融点 220−222℃
MS (ESI+): 384 (M)。
1H-NMR (DMSO-d6) δ: 1.27 (6H, s), 1.78 (3H, s), 3.27-3.33 (2H, m), 7.29 (1H, d, J = 9.4, 2.1 Hz), 7.46-7.54 (3H, m), 7.62-7.69 (1H, m), 8.03 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 8.88 (1H, d, J = 2.1 Hz), 11.22 (1H, s)。
実施例123
4−(アミノスルホニル)−N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
4−(アミノスルホニル)−N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
実施例49に準じ、参考例21で得られた6−クロロイミダゾ[1,2−a]ピリジン−2−アミンおよび4−カルボキシベンゼンスルホンアミドより得られる塩化 4−(アミノスルホニル)ベンゾイルを用いて表題化合物を合成した。
融点 >320℃
1H-NMR (DMSO-d6) δ: 7.30 (1H, dd, J = 9.4, 2.1 Hz), 7.49-7.57 (3H, m), 7.94 (2H, d, J = 8.3 Hz), 8.20 (2H, d, J = 8.3 Hz), 8.30 (1H, s), 8.90 (1H, d, J = 2.1 Hz), 11.52 (1H, s)。
融点 >320℃
1H-NMR (DMSO-d6) δ: 7.30 (1H, dd, J = 9.4, 2.1 Hz), 7.49-7.57 (3H, m), 7.94 (2H, d, J = 8.3 Hz), 8.20 (2H, d, J = 8.3 Hz), 8.30 (1H, s), 8.90 (1H, d, J = 2.1 Hz), 11.52 (1H, s)。
実施例124
4−[(アセチルアミノ)スルホニル]−N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
4−[(アセチルアミノ)スルホニル]−N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
実施例123で得られた4−(アミノスルホニル)−N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(0.23mmol、80mg)をピリジン(10mL)に溶解させた後に、無水酢酸(0.5mL)を加え、80℃で終夜攪拌した。減圧下で揮発性成分を留去した後に、塩酸を加え、酢酸エチルで抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をDMSO−水で再結晶を行ない、表題化合物(10mg、11%)を合成した。
MS (ESI+): 392 (M+)。
1H-NMR (DMSO-d6) δ: 1.93 (3H, t, J = 7.8 Hz), 7.30 (1H, dd, J = 9.5, 2.1 Hz), 7.52 (1H, d, J = 9.5 Hz), 8.01 (2H, d, J = 8.5 Hz), 8.22 (2H, d, J = 8.5 Hz), 8.36 (1H, s), 8.90 (1H, d, J = 1.5 Hz), 11.56 (1H, s), 12.25 (1H, s)。
MS (ESI+): 392 (M+)。
1H-NMR (DMSO-d6) δ: 1.93 (3H, t, J = 7.8 Hz), 7.30 (1H, dd, J = 9.5, 2.1 Hz), 7.52 (1H, d, J = 9.5 Hz), 8.01 (2H, d, J = 8.5 Hz), 8.22 (2H, d, J = 8.5 Hz), 8.36 (1H, s), 8.90 (1H, d, J = 1.5 Hz), 11.56 (1H, s), 12.25 (1H, s)。
実施例125
N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]−4−(メチルスルホニル)ベンズアミド
N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]−4−(メチルスルホニル)ベンズアミド
実施例49に準じ、参考例23で得られた6−ヨードイミダゾ[1,2−a]ピリジン−2−アミン(2.59g、10.0mmol)および塩化 4−(メチルスルホニル)ベンゾイル(2.0g、10.0mmol)を用いてN−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)−4−(メチルスルホニル)ベンズアミド(2.4g、54%)を合成した。実施例51に準じ、この化合物(1.0mmol、440mg)を用いて表題化合物(130mg、34%)を合成した。
融点 305−308℃(decomp.)
1H-NMR (DMSO-d6) δ: 3.31 (3H, s), 7.16 (1H, s), 7.57-7.68 (2H, m), 7.71 (1H, s), 8.07 (2H, d, J = 8.5 Hz), 8.20 (1H, s), 8.30 (2H, d, J = 8.5 Hz), 8.38 (1H, s), 9.09 (1H, s), 11.64 (1H, s)。
融点 305−308℃(decomp.)
1H-NMR (DMSO-d6) δ: 3.31 (3H, s), 7.16 (1H, s), 7.57-7.68 (2H, m), 7.71 (1H, s), 8.07 (2H, d, J = 8.5 Hz), 8.20 (1H, s), 8.30 (2H, d, J = 8.5 Hz), 8.38 (1H, s), 9.09 (1H, s), 11.64 (1H, s)。
実施例126
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[1,1−ジメチル−2−(プロピオニルアミノ)エチル]ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[1,1−ジメチル−2−(プロピオニルアミノ)エチル]ベンズアミド
実施例122に準じ、プロパン酸無水物を用いて表題化合物を合成した。
融点 225−227℃
MS (ESI+): 399 (M+H)。
1H-NMR (DMSO-d6) δ: 0.93 (3H, t, J = 7.8 Hz), 1.26 (6H, s), 1.97-2.09 (2H, m), 3.30 (2H, d, J = 6.4 Hz), 7.29 (1H, dd, J = 9.5, 1.9 Hz), 7.47-7.53 (3H, m), 7.58 (1H, t, J = 6.3 Hz), 8.03 (2H, d, J = 8.7 Hz), 8.33 (1H, s), 8.88 (1H, d, J = 1.9 Hz), 11.22 (1H, s)。
融点 225−227℃
MS (ESI+): 399 (M+H)。
1H-NMR (DMSO-d6) δ: 0.93 (3H, t, J = 7.8 Hz), 1.26 (6H, s), 1.97-2.09 (2H, m), 3.30 (2H, d, J = 6.4 Hz), 7.29 (1H, dd, J = 9.5, 1.9 Hz), 7.47-7.53 (3H, m), 7.58 (1H, t, J = 6.3 Hz), 8.03 (2H, d, J = 8.7 Hz), 8.33 (1H, s), 8.88 (1H, d, J = 1.9 Hz), 11.22 (1H, s)。
実施例127
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[2−(エチルアミノ)−1,1−ジメチル−2−オキソエチル]ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[2−(エチルアミノ)−1,1−ジメチル−2−オキソエチル]ベンズアミド
実施例116で合成した2−(4−{[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)−2−メチルプロパン酸(0.3mmol、100mg)をジクロロメタン(30mL)に懸濁させた後に、二塩化オギザリル(1mmol、127mg)、DMF(0.1mL)を加え、1時間攪拌した。減圧下、揮発性成分を留去した後に、残留物を、2規定エチルアミン含有THF溶液(3mmol、1.5mL)およびトリエチルアミン(1.2mmol、121mg)のTHF(30mL)溶液に加えた後に、終夜攪拌した。減圧下で揮発性成分を留去した後に、残留物をシリカゲルクロマトグラフィー(酢酸エチル:メタノール=10:0〜8:2)で精製し、メタノール−酢酸エチルを用いて再結晶を行ない、表題化合物(70mg、61%)を得た。
融点 228−230℃
MS (ESI+): 385 (M+H)。
1H-NMR (DMSO-d6) δ: 0.97 (3H, t, J = 7.2 Hz), 1.47 (6H, s), 3.00-3.12 (2H, m), 7.29 (1H, dd, J = 9.5, 1.9 Hz), 7.39-7.53 (4H, m), 8.03 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.88 (1H, d, J = 1.9 Hz), 11.23 (1H, s)。
融点 228−230℃
MS (ESI+): 385 (M+H)。
1H-NMR (DMSO-d6) δ: 0.97 (3H, t, J = 7.2 Hz), 1.47 (6H, s), 3.00-3.12 (2H, m), 7.29 (1H, dd, J = 9.5, 1.9 Hz), 7.39-7.53 (4H, m), 8.03 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.88 (1H, d, J = 1.9 Hz), 11.23 (1H, s)。
実施例128
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[1,1−ジメチル−3−(メチルアミノ)−3−オキソプロピル]ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[1,1−ジメチル−3−(メチルアミノ)−3−オキソプロピル]ベンズアミド
実施例127に準じ、実施例117で得られた3−(4−{[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)−3−メチルブタン酸を用いて表題化合物を得た。
融点 228−230℃
MS (ESI+): 385 (M+H)。
1H-NMR (DMSO-d6) δ: 1.38 (6H, s), 2.41 (2H, s), 2.47 (3H, s), 7.28 (1H, dd, J = 9.7, 2.1 Hz), 7.46-7.53 (3H, m), 7.61-7.69 (1H, m), 8.01 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.88 (1H, s), 11.20 (1H, s)。
融点 228−230℃
MS (ESI+): 385 (M+H)。
1H-NMR (DMSO-d6) δ: 1.38 (6H, s), 2.41 (2H, s), 2.47 (3H, s), 7.28 (1H, dd, J = 9.7, 2.1 Hz), 7.46-7.53 (3H, m), 7.61-7.69 (1H, m), 8.01 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.88 (1H, s), 11.20 (1H, s)。
実施例129
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[1−メチル−1−(プロピオニルアミノ)エチル]ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[1−メチル−1−(プロピオニルアミノ)エチル]ベンズアミド
実施例126に準じ、実施例92で得られた4−(1−アミノ−1−メチルエチル)−N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミドを用いて表題化合物を得た。
融点 249−252℃
MS (ESI+): 385 (M+H)。
1H-NMR (DMSO-d6) δ: 0.96 (3H, t, J = 7.6 Hz), 1.55 (6H, s), 2.13 (2H, q, J = 7.6 Hz), 7.28 (1H, dd, J = 9.5, 2.3 Hz), 7.42 (2H, d, J = 8.5 Hz), 7.50 (1H, d, J = 9.5 Hz), 7.98 (2H, d, J = 8.5 Hz), 8.07 (1H, s), 8.33 (1H, s), 8.87 (1H, d, J = 1.5 Hz), 11.19 (1H, s)。
融点 249−252℃
MS (ESI+): 385 (M+H)。
1H-NMR (DMSO-d6) δ: 0.96 (3H, t, J = 7.6 Hz), 1.55 (6H, s), 2.13 (2H, q, J = 7.6 Hz), 7.28 (1H, dd, J = 9.5, 2.3 Hz), 7.42 (2H, d, J = 8.5 Hz), 7.50 (1H, d, J = 9.5 Hz), 7.98 (2H, d, J = 8.5 Hz), 8.07 (1H, s), 8.33 (1H, s), 8.87 (1H, d, J = 1.5 Hz), 11.19 (1H, s)。
実施例130
4−(1−シアノ−1−メチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−(1−シアノ−1−メチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例49および51に準じ、参考例2で得られた4−(1−シアノ−1−メチルエチル)安息香酸から得られる塩化 4−(1−シアノ−1−メチルエチル)ベンゾイルを用いて表題化合物を合成した。
融点 241−244℃
MS (ESI+): 371 (M+H)。
1H-NMR (DMSO-d6) δ: 1.74 (6H, s), 7.14-7.16 (1H, m), 7.56-7.63 (2H, m), 7.65-7.71 (3H, m), 8.14 (2H, d, J = 8.7 Hz), 8.19-8.20 (1H, m), 8.35 (1H, s), 9.06-9.09 (1H, m), 11.38 (1H, s)。
融点 241−244℃
MS (ESI+): 371 (M+H)。
1H-NMR (DMSO-d6) δ: 1.74 (6H, s), 7.14-7.16 (1H, m), 7.56-7.63 (2H, m), 7.65-7.71 (3H, m), 8.14 (2H, d, J = 8.7 Hz), 8.19-8.20 (1H, m), 8.35 (1H, s), 9.06-9.09 (1H, m), 11.38 (1H, s)。
実施例131
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[エチル(メチルスルホニル)アミノ]ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[エチル(メチルスルホニル)アミノ]ベンズアミド
実施例49に準じ、参考例21で得られた6−クロロイミダゾ[1,2−a]ピリジン−2−アミンおよび参考例53で得られた4−[エチル(メチルスルホニル)アミノ]安息香酸より得られる塩化 4−[エチル(メチルスルホニル)アミノ]ベンゾイルを用いて合成した。
融点 245−247℃
MS (ESI+): 392 (M)。
1H-NMR (DMSO-d6) δ: 1.01 (3H, t, J = 7.2 Hz), 3.03 (3H, s), 3.75 (2H, q, J = 7.2 Hz), 7.29 (1H, dd, J = 9.5, 2.3 Hz), 7.49-7.55 (3H, m), 8.12 (2H, d, J = 8.7 Hz), 8.32-8.36 (1H, m), 8.89 (1H, d, J = 1.5 Hz), 11.35 (1H, s)。
融点 245−247℃
MS (ESI+): 392 (M)。
1H-NMR (DMSO-d6) δ: 1.01 (3H, t, J = 7.2 Hz), 3.03 (3H, s), 3.75 (2H, q, J = 7.2 Hz), 7.29 (1H, dd, J = 9.5, 2.3 Hz), 7.49-7.55 (3H, m), 8.12 (2H, d, J = 8.7 Hz), 8.32-8.36 (1H, m), 8.89 (1H, d, J = 1.5 Hz), 11.35 (1H, s)。
実施例132
4−(2−アミノ−1,1−ジメチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−(2−アミノ−1,1−ジメチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例94に準じ、実施例130で得られた4−(1−シアノ−1−メチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミドを用いて表題化合物を合成した。
融点 258−260℃
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 2.69 (2H, s), 7.14-7.17 (1H, m), 7.48 (2H, d, J = 8.5 Hz), 7.55-7.65 (2H, m), 7.70 (1H, t, J = 1.3 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.18-8.20 (1H, m), 8.34 (1H, s), 9.05-9.09 (1H, m), 11.22 (1H, s), hidden (2H)。
融点 258−260℃
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 2.69 (2H, s), 7.14-7.17 (1H, m), 7.48 (2H, d, J = 8.5 Hz), 7.55-7.65 (2H, m), 7.70 (1H, t, J = 1.3 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.18-8.20 (1H, m), 8.34 (1H, s), 9.05-9.09 (1H, m), 11.22 (1H, s), hidden (2H)。
実施例133
4−{1,1−ジメチル−2−[(メチルスルホニル)アミノ]エチル}−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−{1,1−ジメチル−2−[(メチルスルホニル)アミノ]エチル}−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例132で得られた4−(2−アミノ−1,1−ジメチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド(0.2mmol、74mg)およびトリエチルアミン(0.6mmol、47mg)をTHF(60mL)に溶解させた後に、塩化メタンスルホニル(0.3mmol、34mg)を加えて終夜攪拌した。減圧下で揮発性成分を留去した後に、残留物をシリカゲルクロマトグラフィー(酢酸エチル:メタノール=10:0〜7:3)で精製し、ヘキサン−酢酸エチルを用いて再結晶を行ない、表題化合物(34mg、38%)を得た。
MS (ESI+): 453 (M+H)。
1H-NMR (DMSO-d6) δ: 1.31 (6H, s), 2.76 (3H, s), 3.14 (2H, d, J = 6.4 Hz), 6.84-6.90 (1H, m), 7.15 (1H, s), 7.50-7.65 (4H, m), 7.70 (1H, s), 8.06 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.35 (1H, s), 9.07 (1H, s), 11.26 (1H, s)。
MS (ESI+): 453 (M+H)。
1H-NMR (DMSO-d6) δ: 1.31 (6H, s), 2.76 (3H, s), 3.14 (2H, d, J = 6.4 Hz), 6.84-6.90 (1H, m), 7.15 (1H, s), 7.50-7.65 (4H, m), 7.70 (1H, s), 8.06 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.35 (1H, s), 9.07 (1H, s), 11.26 (1H, s)。
実施例134
4−[2−(ベンゾイルアミノ)−1,1−ジメチルエチル]−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−[2−(ベンゾイルアミノ)−1,1−ジメチルエチル]−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例133に準じ、塩化ベンゾイルを用いて表題化合物を合成した。
MS (ESI+): 479 (M+H)。
1H-NMR (DMSO-d6) δ: 1.35 (6H, s), 3.51 (2H, d, J = 6.4 Hz), 7.15 (1H, s), 7.40-7.79 (10H, m), 8.06 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.28 (1H, t, J = 6.3 Hz), 8.34 (1H, s), 9.07 (1H, s), 11.25 (1H, s)。
MS (ESI+): 479 (M+H)。
1H-NMR (DMSO-d6) δ: 1.35 (6H, s), 3.51 (2H, d, J = 6.4 Hz), 7.15 (1H, s), 7.40-7.79 (10H, m), 8.06 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.28 (1H, t, J = 6.3 Hz), 8.34 (1H, s), 9.07 (1H, s), 11.25 (1H, s)。
実施例135
4−[2−(アセチルアミノ)−1,1−ジメチルエチル]−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−[2−(アセチルアミノ)−1,1−ジメチルエチル]−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例133に準じ、塩化アセチルを用いて表題化合物を合成した。
融点 242−244℃
MS (ESI+): 417 (M+H)。
1H-NMR (DMSO-d6) δ: 1.27 (6H, s), 1.78 (3H, s), 3.27-3.31 (2H, m), 7.15 (1H, s), 7.50 (2H, d, J = 8.3 Hz), 7.55-7.68 (3H, m), 7.70 (1H, s), 8.05 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.35 (1H, s), 9.07 (1H, s), 11.24 (1H, s)。
融点 242−244℃
MS (ESI+): 417 (M+H)。
1H-NMR (DMSO-d6) δ: 1.27 (6H, s), 1.78 (3H, s), 3.27-3.31 (2H, m), 7.15 (1H, s), 7.50 (2H, d, J = 8.3 Hz), 7.55-7.68 (3H, m), 7.70 (1H, s), 8.05 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.35 (1H, s), 9.07 (1H, s), 11.24 (1H, s)。
実施例136
4−[1,1−ジメチル−2−(プロピルアミノ)エチル]−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−[1,1−ジメチル−2−(プロピルアミノ)エチル]−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例132で得られた4−(2−アミノ−1,1−ジメチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド(0.2mmol、75mg)、プロピオンアルデヒド(0.2mmol、12mg)、酢酸(0.03mL)をDMF(5mL)−ジクロロメタン(5mL)に溶解させ、30分間攪拌した後に、トリアセトキシ水素化ホウ素ナトリウム(0.8mmol、170mg)を加え、終夜攪拌した。減圧下で揮発性成分を留去した後に、残留物をシリカゲルクロマトグラフィー(酢酸エチル:メタノール=10:0〜8:2)で精製し、ヘキサン−ジクロロメタンを用いて再結晶を行ない、表題化合物(30mg、36%)を得た。
融点 162−164℃
MS (ESI+): 417 (M+H)。
1H-NMR (DMSO-d6) δ: 0.78 (3H, t, J = 7.4 Hz), 1.27-1.40 (8H, m), 2.41 (2H, t, J = 7.1 Hz), 2.68 (2H, s), 7.14-7.17 (1H, m), 7.50 (2H, d, J = 8.5 Hz), 7.55-7.65 (2H, m), 7.70 (1H, t, J = 1.3 Hz), 8.03 (2H, d, J = 8.5 Hz), 8.19 (1H, s), 8.34 (1H, s), 9.05-9.08 (1H, m), 11.22 (1H, s), hidden (1H)。
融点 162−164℃
MS (ESI+): 417 (M+H)。
1H-NMR (DMSO-d6) δ: 0.78 (3H, t, J = 7.4 Hz), 1.27-1.40 (8H, m), 2.41 (2H, t, J = 7.1 Hz), 2.68 (2H, s), 7.14-7.17 (1H, m), 7.50 (2H, d, J = 8.5 Hz), 7.55-7.65 (2H, m), 7.70 (1H, t, J = 1.3 Hz), 8.03 (2H, d, J = 8.5 Hz), 8.19 (1H, s), 8.34 (1H, s), 9.05-9.08 (1H, m), 11.22 (1H, s), hidden (1H)。
実施例137
4−tert−ブチル−N−(2−tert−ブチル−ジイミダゾ[1,2−a:4’,5’−e]ピリジン−7−イル)ベンズアミド
4−tert−ブチル−N−(2−tert−ブチル−ジイミダゾ[1,2−a:4’,5’−e]ピリジン−7−イル)ベンズアミド
6−クロロ−3−ニトロピリジン−2−アミン(9.8g,56.5mmol)を2,2−ジメチルプロパン酸 無水物(60ml)に溶解させた後に、濃硫酸(1mL)を加えて90℃で1時間攪拌した。放冷後、水(60mL)を加えて30分攪拌した。析出した固体をろ過し、水−アセトニトリル混合溶媒を用いて洗浄し、N−(6−クロロ−3−ニトロピリジン−2−イル)−2,2−ジメチルプロパンアミド(14g、94%)を合成した。この化合物(257mg,1mmol)、4−メチルベンゼンスルホンアミド(342mg,2mmol)、炭酸セシウム(489mg,1.5mmol)、酢酸パラジウム(11mg,0.05mmol)、9,9−ジメチル−4,5−ビス(ジフェニルホスフィノ)キサンテン(43mg,0.075mmol)をジオキサン(6mL)に懸濁させ、窒素下、100℃で1時間攪拌した。水を加えた後にジクロロメタンを用いて抽出した。抽出液を乾燥(MgSO4)後、溶媒を減圧下留去した。残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=3:7〜6:4)で精製した。得られた粗生成物(350mg、2,2−ジメチル−N−(6−{[(4−メチルフェニル)スルホニル]アミノ}−3−ニトロピリジン−2−イル)プロパンアミドおよび4−メチルベンゼンスルホンアミド混合物)をメタノールに溶解させた後に、10%パラジウム−カーボン粉末(150mg)を加え水素雰囲気下で2時間攪拌した。10%パラジウム−カーボン粉末をろ過後、ろ液を濃縮した。残留物に酢酸(5mL)を加えて、60℃で2時間攪拌した。溶媒を減圧下留去した後に、残留物をシリカゲルクロマトグラフィー(酢酸エチル:ヘキサン=5:5〜8:2)で精製し、N−(2−tert−ブチル−1H−イミダゾ[4,5−b]ピリジン−5−イル)−4−メチルベンゼンスルホンアミド(150mg)を合成した。続いてこの化合物を、参考例16および17に準じて反応を行い、2−tert−ブチル−3H−ジイミダゾ[1,2−a:4’,5’−e]ピリジン−7−アミンを合成、さらに塩化 4−tert−ブチルベンゾイルを用いてアシル化を行い、表題化合物を得た。
MS (ESI+): 390 (M+H)。
1H-NMR (DMSO-d6) δ: 1.34 (9H, s), 1.42 (9H, s), 7.27 (1H, d, J = 9.4 Hz), 7.46 (1H, d, J = 9.4 Hz), 7.60 (2H, d, J = 8.5 Hz), 7.67 (1H, s), 8.03 (2H, d, J = 8.5 Hz), 10.89 (1H, s), 12.79 (1H, s)。
MS (ESI+): 390 (M+H)。
1H-NMR (DMSO-d6) δ: 1.34 (9H, s), 1.42 (9H, s), 7.27 (1H, d, J = 9.4 Hz), 7.46 (1H, d, J = 9.4 Hz), 7.60 (2H, d, J = 8.5 Hz), 7.67 (1H, s), 8.03 (2H, d, J = 8.5 Hz), 10.89 (1H, s), 12.79 (1H, s)。
実施例138
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
参考例34で得られた6−クロロイミダゾ[1,2−b]ピリダジン−2−アミン(5.1g,30mmol)をN,N−ジメチルアセトアミド(100ml)中に溶かした後、塩化4−tert−ブチルベンゾイル(6.5g,33mmol)を加えて室温で攪拌すると30分後沈殿が生成した。その後更に30分攪拌した後反応液中に水(100ml)を加えて沈殿物をろ過し、水(100ml)、アセトニトリル(30ml)で二回、更にジエチルエーテル(50ml)で洗浄し緑白色蛍光の表題化合物(収量9.6g、収率96%)を得た。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 7.37 (1H, d, J = 9.4 Hz), 7.55(2H, d, J = 8.5 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.12 (1H, d, J = 9.4 Hz), 8.50 (1H, s), 11.40 (1H, s)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 7.37 (1H, d, J = 9.4 Hz), 7.55(2H, d, J = 8.5 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.12 (1H, d, J = 9.4 Hz), 8.50 (1H, s), 11.40 (1H, s)。
実施例139
4−tert−ブチル−N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
4−tert−ブチル−N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
実施例138と同様にして参考例36で得られた6−ヨードイミダゾ[1,2−b]ピリダジン−2−アミン(3.6g,14mmol)を用いて、表題化合物(収量5.4g、収率93%)を得た。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 7.53 (1H, d, J = 9.2 Hz), 7.54(2H, d, J = 8.5 Hz), 7.79 (1H, d, J = 9.2 Hz), 8.03 (2H, d, J = 8.5 Hz), 8.49 (1H, s), 11.36 (1H, s)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 7.53 (1H, d, J = 9.2 Hz), 7.54(2H, d, J = 8.5 Hz), 7.79 (1H, d, J = 9.2 Hz), 8.03 (2H, d, J = 8.5 Hz), 8.49 (1H, s), 11.36 (1H, s)。
実施例140
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
実施例138で得られた4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(400mg,1.2mmol)、イミダゾール(331mg,4.9mmol)及び炭酸カリウム(673mg,4.9mmol)をN,N−ジメチルホルムアミド(10ml)に懸濁し、マイクロウェーブを用いて180℃で20分間攪拌した。反応液を冷却後水(50ml)を加えて析出してきた沈殿をろ取してアセトニトリルで洗浄した。その後この沈殿物を塩基性シリカゲルカラムクロマトグラフィー(1−5% メタノール/酢酸エチル)で精製して表題化合物(収量280mg,収率64%)を得た。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.21 (1H, s), 7.55 (2H, d, J = 8.5 Hz), 7.80 (1H, d, J = 9.6 Hz), 8.00 (1H, t, J = 1.3 Hz), 8.05 (2H, d, J = 8.5 Hz), 8.27 (1H, d, J = 9.6 Hz), 8.48 (1H, s), 8.59 (1H, s), 11.40 (1H, s)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.21 (1H, s), 7.55 (2H, d, J = 8.5 Hz), 7.80 (1H, d, J = 9.6 Hz), 8.00 (1H, t, J = 1.3 Hz), 8.05 (2H, d, J = 8.5 Hz), 8.27 (1H, d, J = 9.6 Hz), 8.48 (1H, s), 8.59 (1H, s), 11.40 (1H, s)。
実施例141
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド・2塩酸塩
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド・2塩酸塩
実施例140で得られた4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド(200mg,0.555mmol)をメタノール(5ml)中に懸濁し10%塩酸メタノール溶液(2ml)を加えて溶液とした。これを活性炭で脱色してろ液を減圧下濃縮して蒸発乾固した後再び10%塩酸メタノール溶液(2ml)に溶かし、ジエチルエーテル(4ml)を加えて析出した黄白色の粉体をろ取し、ジエチルエーテルで洗浄後乾燥して表題化合物(収量347mg、収率80%)を得た。
融点 298−300℃
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.56 (2H, d, J = 8.3 Hz), 7.98 (1H, d, J = 9.6 Hz),7.99 (1H, s), 8.05 (2H, d, J = 8.3 Hz), 8.46 (1H, d, J = 9.6 Hz), 8.50 (1H, t, J = 1.5 Hz), 8.58 (1H, s), 10.12 (1H, s), 11.53 (1H, s)。
元素分析値:C20H20N6O・2HCl・0.8H2Oとして
計算値:C, 53.65; H, 5.31; N, 18.77; Cl, 15.84。
実測値:C, 53.61; H, 5.31; N, 18.75; Cl, 15.63。
融点 298−300℃
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.56 (2H, d, J = 8.3 Hz), 7.98 (1H, d, J = 9.6 Hz),7.99 (1H, s), 8.05 (2H, d, J = 8.3 Hz), 8.46 (1H, d, J = 9.6 Hz), 8.50 (1H, t, J = 1.5 Hz), 8.58 (1H, s), 10.12 (1H, s), 11.53 (1H, s)。
元素分析値:C20H20N6O・2HCl・0.8H2Oとして
計算値:C, 53.65; H, 5.31; N, 18.77; Cl, 15.84。
実測値:C, 53.61; H, 5.31; N, 18.75; Cl, 15.63。
実施例142
4−tert−ブチル−N−{6−[4−(シアノメチル)−1H−イミダゾール−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
4−tert−ブチル−N−{6−[4−(シアノメチル)−1H−イミダゾール−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
実施例140と同様にして4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(500mg,1.5mmol)、1H−イミダゾール−4−イルアセトニトリル(552mg,5.2mmol)及び炭酸カリウム(841mg,6.1mmol)を用いて表題化合物(収量340mg、収率62%)を得た。
融点 314−316℃ (decomp.)
MS (ESI+): 400 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 4.00 (2H, s), 7.55 (2H, d, J = 8.7 Hz), 7.81 (1H, d, J = 9.6 Hz), 7.94 (1H, d, J = 1.3 Hz), 8.05 (2H, d, J = 8.7 Hz), 8.27 (1H, d, J = 9.6 Hz), 8.49 (1H, s), 8.61 (1H, d, J = 1.3 Hz), 11.4 (1H, s)。
元素分析値:C22H21N7Oとして
計算値:C, 66.15; H, 5.30; N, 24.55。
実測値:C, 65.62; H, 5.32; N, 24.27。
融点 314−316℃ (decomp.)
MS (ESI+): 400 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 4.00 (2H, s), 7.55 (2H, d, J = 8.7 Hz), 7.81 (1H, d, J = 9.6 Hz), 7.94 (1H, d, J = 1.3 Hz), 8.05 (2H, d, J = 8.7 Hz), 8.27 (1H, d, J = 9.6 Hz), 8.49 (1H, s), 8.61 (1H, d, J = 1.3 Hz), 11.4 (1H, s)。
元素分析値:C22H21N7Oとして
計算値:C, 66.15; H, 5.30; N, 24.55。
実測値:C, 65.62; H, 5.32; N, 24.27。
実施例143
4−tert−ブチル−N−[6−(2,4−ジメチル−1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(2,4−ジメチル−1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
実施例140と同様にして4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(500mg,1.5mmol)、2,4−ジメチル−1H−イミダゾール(731mg,7.6mmol)及び炭酸カリウム(841mg,6.1mmol)を用いて200℃で40分間攪拌して表題化合物(収量210mg,収率36%)を得た。
融点 254−255℃(アセトニトリル)
MS (ESI+): 389 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 2.13 (3H, d, J = 1.1 Hz), 2.49 (3H, s), 7.32 (1H, d, J = 1.1 Hz), 7.48 (1H, d, J = 9.4 Hz), 7.55 (2H, d, J = 8.7 Hz), 8.05 (2H, d, J = 8.7 Hz), 8.21 (1H, d, J = 9.4 Hz), 8.50 (1H, s), 11.40 (1H, s)。
元素分析値:C22H24N6Oとして
計算値:C, 68.02; H, 6.23; N, 21.63。
実測値:C, 67.77; H, 6.19; N, 21.67。
融点 254−255℃(アセトニトリル)
MS (ESI+): 389 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 2.13 (3H, d, J = 1.1 Hz), 2.49 (3H, s), 7.32 (1H, d, J = 1.1 Hz), 7.48 (1H, d, J = 9.4 Hz), 7.55 (2H, d, J = 8.7 Hz), 8.05 (2H, d, J = 8.7 Hz), 8.21 (1H, d, J = 9.4 Hz), 8.50 (1H, s), 11.40 (1H, s)。
元素分析値:C22H24N6Oとして
計算値:C, 68.02; H, 6.23; N, 21.63。
実測値:C, 67.77; H, 6.19; N, 21.67。
実施例144
4−tert−ブチル−N−[6−(2−エチル−4−メチル−1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(2−エチル−4−メチル−1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
実施例140と同様にして4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(500mg,1.5mmol)、2−エチル−4−メチル−1H−イミダゾール(670mg,6.1mmol)及び炭酸カリウム(631mg,4.6mmol)を用いて200℃で60分間攪拌して表題化合物(収量242mg,収率40%)を得た。
融点 220−221℃(アセトニトリル)
MS (ESI+): 403 (M+H)。
1H-NMR (DMSO-d6) δ: 1.21 (3H, t, J = 7.4 Hz), 1.33 (9H, s), 2.15 (3H, s), 2.86 (2H, q, J = 7.4 Hz), 7.29 (1H, d, J = 0.9 Hz), 7.46 (1H, d, J = 9.4 Hz), 7.55 (2H, d, J = 8.5 Hz), 8.05 (2H, d, J = 8.5 Hz), 8.21 (1H, d, J = 9.4 Hz), 8.50 (1H, s), 11.41 (1H, s)。
元素分析値:C23H25N6Oとして
計算値:C, 68.63; H, 6.51; N, 20.88。
実測値:C, 68.64; H, 6.50; N, 20.93。
融点 220−221℃(アセトニトリル)
MS (ESI+): 403 (M+H)。
1H-NMR (DMSO-d6) δ: 1.21 (3H, t, J = 7.4 Hz), 1.33 (9H, s), 2.15 (3H, s), 2.86 (2H, q, J = 7.4 Hz), 7.29 (1H, d, J = 0.9 Hz), 7.46 (1H, d, J = 9.4 Hz), 7.55 (2H, d, J = 8.5 Hz), 8.05 (2H, d, J = 8.5 Hz), 8.21 (1H, d, J = 9.4 Hz), 8.50 (1H, s), 11.41 (1H, s)。
元素分析値:C23H25N6Oとして
計算値:C, 68.63; H, 6.51; N, 20.88。
実測値:C, 68.64; H, 6.50; N, 20.93。
実施例145
4−tert−ブチル−N−{6−[4−(ヒドロキシメチル)−1H−イミダゾール−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
4−tert−ブチル−N−{6−[4−(ヒドロキシメチル)−1H−イミダゾール−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(500mg,1.5mmol)、1H−イミダゾール−4−イルメタノール(614mg,4.6mmol)、水素化ナトリウム(60%/ミネラルオイル,243mg,6.1mmol)及びテトラブチルアンモニウムヨージド(281mg,0.76mmol)をN−メチルピロリジノン(10ml)に懸濁して110℃で12時間攪拌した。冷却後水(20ml)を加えて50%酢酸エチル/テトラヒドロフランの混合溶媒(50ml)で抽出し、飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥、ろ過後減圧下濃縮した。こうして得られた粗製物にジエチルエーテルを加えて析出した橙色固体をろ取した。これをメタノールから再結晶して薄黄色の表題化合物(収量88mg,収率15%)を得た。
融点 298−301℃(メタノール)
MS (ESI+): 391 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 4.45 (2H, d, J = 5.7 Hz), 5.10 (1H, t, J = 5.7 Hz), 7.55 (2H, d, J = 8.5 Hz), 7.79 (1H, d, J = 9.6 Hz), 7.81 (1H, s), 8.04 (2H, d, J = 8.5 Hz), 8.25 (1H, d, J = 9.6 Hz), 8.52 (1H, d, J = 1.1 Hz), 11.38 (1H, s)。
元素分析値:C21H22N6O2として
計算値:C, 64.60; H, 5.68; N, 21.52。
実測値:C, 63.58; H, 5.69; N, 21.24。
融点 298−301℃(メタノール)
MS (ESI+): 391 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 4.45 (2H, d, J = 5.7 Hz), 5.10 (1H, t, J = 5.7 Hz), 7.55 (2H, d, J = 8.5 Hz), 7.79 (1H, d, J = 9.6 Hz), 7.81 (1H, s), 8.04 (2H, d, J = 8.5 Hz), 8.25 (1H, d, J = 9.6 Hz), 8.52 (1H, d, J = 1.1 Hz), 11.38 (1H, s)。
元素分析値:C21H22N6O2として
計算値:C, 64.60; H, 5.68; N, 21.52。
実測値:C, 63.58; H, 5.69; N, 21.24。
実施例146
4−tert−ブチル−N−[6−(4,5−ジクロロ−1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(4,5−ジクロロ−1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
実施例143と同様にして4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(500mg,1.5mmol)、4,5−ジクロロ−1H−イミダゾール(625mg,4.6mmol)及び炭酸カリウム(631mg,4.6mmol)を用いて反応を行った後、塩基性シリカゲルクロマトグラフィー(50%塩化メチレン/酢酸エチル)で精製後アセトニトリルから再結晶して表題化合物(収量133mg,収率20%)を得た。
融点 281−282℃(アセトニトリル)
MS (ESI+): 429 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.56 (2H, d, J = 8.5 Hz), 7.62 (2H, d, J = 9.4 Hz), 8.05 (2H, d, J = 8.5 Hz), 8.36 (1H, dd, J = 9.4, 0.6 Hz), 8.37 (1H, s), 8.59 (1H, d, J = 0.6 Hz), 11.50 (1H, s)。
元素分析値:C20H18Cl2N6Oとして
計算値:C, 55.95; H, 4.23; N, 19.58。
実測値:C, 56.09; H, 4.26; N, 19.66。
融点 281−282℃(アセトニトリル)
MS (ESI+): 429 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.56 (2H, d, J = 8.5 Hz), 7.62 (2H, d, J = 9.4 Hz), 8.05 (2H, d, J = 8.5 Hz), 8.36 (1H, dd, J = 9.4, 0.6 Hz), 8.37 (1H, s), 8.59 (1H, d, J = 0.6 Hz), 11.50 (1H, s)。
元素分析値:C20H18Cl2N6Oとして
計算値:C, 55.95; H, 4.23; N, 19.58。
実測値:C, 56.09; H, 4.26; N, 19.66。
実施例147
N−[6−(4−ブロモ−1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]−4−tert−ブチルベンズアミド
N−[6−(4−ブロモ−1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]−4−tert−ブチルベンズアミド
実施例140と同様にして4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(500mg,1.5mmol)、4−ブロモ−1H−イミダゾール(670mg,4.6mmol)及び炭酸カリウム(840mg,6.1mmol)を用いて反応を行った後、塩基性シリカゲルクロマトグラフィー(100%THF)で精製後テトラヒドロフランから再結晶して白色の表題化合物(収量180mg,収率27%)を得た。
融点 306−307℃(テトラヒドロフラン)
MS (ESI+): 441 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.55 (2H, d, J = 8.5 Hz), 7.78 (1H, d, J = 9.6 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.18 (1H, d, J = 1.3 Hz), 8.30 (1H, d, J = 9.6 Hz), 8.48 (1H, s), 8.59 (1H, d, J = 1.3 Hz), 11.42 (1H, s)。
元素分析値:C20H19N6OBrとして
計算値:C, 54.68; H, 4.36; N, 19.13; Br, 18.19。
実測値:C, 54.58; H, 4.30; N, 19.18; Br, 18.06。
融点 306−307℃(テトラヒドロフラン)
MS (ESI+): 441 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.55 (2H, d, J = 8.5 Hz), 7.78 (1H, d, J = 9.6 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.18 (1H, d, J = 1.3 Hz), 8.30 (1H, d, J = 9.6 Hz), 8.48 (1H, s), 8.59 (1H, d, J = 1.3 Hz), 11.42 (1H, s)。
元素分析値:C20H19N6OBrとして
計算値:C, 54.68; H, 4.36; N, 19.13; Br, 18.19。
実測値:C, 54.58; H, 4.30; N, 19.18; Br, 18.06。
実施例148
N−(6−アミノイミダゾ[1,2−b]ピリダジン−2−イル)−4−tert−ブチルベンズアミド
N−(6−アミノイミダゾ[1,2−b]ピリダジン−2−イル)−4−tert−ブチルベンズアミド
実施例138で得られた4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(1.0g,3.0mmol)およびアジ化ナトリウム(590mg,9.1mmol)をN,N−ジメチルホルムアミド(30ml)に懸濁し、110℃で48時間攪拌した。その後減圧下溶媒を溜去した後得られた褐色粗製物を50%テトラヒドロフラン/酢酸エチル混合溶媒(100ml)に溶かし、水、飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥後ろ過して、溶媒を減圧下溜去して得られた褐色固体を塩基性シリカゲルクロマトグラフィー(100%テトラヒドロフラン)で精製してN−(6−アジドイミダゾ[1,2−b]ピリダジン−2−イル)−4−tert−ブチルベンズアミドを反応原料との混合物として得た(830mg)。
この混合物(480mg)をテトラヒドロフラン(20ml)に溶かし10%活性炭パラジウム(400mg)を加えて水素雰囲気下室温で30分攪拌した。その後反応液をろ過して、ろ液を減圧下濃縮して得られた黄色個体を塩基性シリカゲルクロマトグラフィー(80%酢酸エチル/ヘキサン―100%酢酸エチル)で精製して白色の表題化合物(収量270mg,収率49%)を得た。
融点 267−268℃(アセトニトリル)
MS (ESI+): 310 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 6.29 (2H, s), 6.62 (1H, d, J = 9.6 Hz), 7.52 (2H, d, J = 8.5 Hz), 7.61 (1H, d, J = 9.6 Hz), 7.99 (1H, s), 8.00 (2H, d, J = 8.5 Hz), 11.01 (1H, s)。
元素分析値:C17H19N5Oとして
計算値:C, 66.00; H, 6.19; N, 22.64。
実測値:C, 65.95; H, 6.16; N, 22.69。
この混合物(480mg)をテトラヒドロフラン(20ml)に溶かし10%活性炭パラジウム(400mg)を加えて水素雰囲気下室温で30分攪拌した。その後反応液をろ過して、ろ液を減圧下濃縮して得られた黄色個体を塩基性シリカゲルクロマトグラフィー(80%酢酸エチル/ヘキサン―100%酢酸エチル)で精製して白色の表題化合物(収量270mg,収率49%)を得た。
融点 267−268℃(アセトニトリル)
MS (ESI+): 310 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 6.29 (2H, s), 6.62 (1H, d, J = 9.6 Hz), 7.52 (2H, d, J = 8.5 Hz), 7.61 (1H, d, J = 9.6 Hz), 7.99 (1H, s), 8.00 (2H, d, J = 8.5 Hz), 11.01 (1H, s)。
元素分析値:C17H19N5Oとして
計算値:C, 66.00; H, 6.19; N, 22.64。
実測値:C, 65.95; H, 6.16; N, 22.69。
実施例149
N−(6−アミノイミダゾ[1,2−b]ピリダジン−2−イル)−4−tert−ブチルベンズアミド・塩酸塩
N−(6−アミノイミダゾ[1,2−b]ピリダジン−2−イル)−4−tert−ブチルベンズアミド・塩酸塩
実施例148で得られたN−(6−アミノイミダゾ[1,2−b]ピリダジン−2−イル)−4−tert−ブチルベンズアミド(110mg,0.36mmol)にテトラヒドロフラン(5ml)を加え、1.5規定塩酸メタノール溶液(10ml)を加えて完全に溶かした後、溶媒を減圧下溜去して白色の固体を得た。この固体をメタノールで数回共沸した。その後この白色固体をエタノール中に溶かしてヘキサンを加えることにより再結晶し、表題化合物(収量41mg,収率33%)を得た。
融点 312−313℃(エタノール/ヘキサン)
MS (ESI+): 310 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 3.65-5.24 (3H, brs), 6.94 (1H, d, J = 9.6 Hz), 7.58(2H, d, J = 8.5 Hz), 7.86 (1H, d, J = 9.6 Hz), 7.97 (1H, s), 8.04 (2H, d, J = 8.5 Hz), 11.69 (1H, s)。
元素分析値:C17H19N5O・HClとして
計算値:C, 59.04; H, 5.83; N, 20.25。
実測値:C, 58.78; H, 5.85; N, 20.09。
融点 312−313℃(エタノール/ヘキサン)
MS (ESI+): 310 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 3.65-5.24 (3H, brs), 6.94 (1H, d, J = 9.6 Hz), 7.58(2H, d, J = 8.5 Hz), 7.86 (1H, d, J = 9.6 Hz), 7.97 (1H, s), 8.04 (2H, d, J = 8.5 Hz), 11.69 (1H, s)。
元素分析値:C17H19N5O・HClとして
計算値:C, 59.04; H, 5.83; N, 20.25。
実測値:C, 58.78; H, 5.85; N, 20.09。
実施例150
4−tert−ブチル−N−(6−ピロリジン−1−イルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド・塩酸塩・1水和物
4−tert−ブチル−N−(6−ピロリジン−1−イルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド・塩酸塩・1水和物
実施例140と同様にして4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(400mg,1.2mmol)、ピロリジン(865mg,12.2mmol)及び炭酸カリウム(504mg,3.7mmol)を用いて反応を行った後、水(60ml)を加えて析出した黄色固体をろ取し30%アセトニトリル/ジエチルエーテルで洗浄した。さらにこれをメタノール(10ml)中に懸濁後、10%塩酸メタノール溶液(4ml)を加えて完全な溶液とした。その後メタノールを減圧下溜去して、メタノール/トルエン混合溶媒で共沸して白色の固体を得た。これをアセトニトリルで再結晶して針状白色の表題化合物(収量210mg,収率43%)を得た。
融点 257−259℃(アセトニトリル)
MS (ESI+): 364 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 1.92-2.03 (4H, m), 3.41-3.51 (4H, m), 7.18 (1H, d, J = 10.0 Hz), 7.59 (2H, d, J = 8.5 Hz), 7.99 (1H, d, J = 10.0 Hz), 8.07 (1H, s), 8.09 (2H, d, J = 8.5 Hz), 12.03 (1H, s)。
元素分析値:C21H26N5O・H2O・HClとして
計算値:C, 60.35; H, 6.75; N, 16.76; Cl, 8.48。
実測値:C, 60.38; H, 6.72; N, 16.87; Cl, 8.40。
融点 257−259℃(アセトニトリル)
MS (ESI+): 364 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 1.92-2.03 (4H, m), 3.41-3.51 (4H, m), 7.18 (1H, d, J = 10.0 Hz), 7.59 (2H, d, J = 8.5 Hz), 7.99 (1H, d, J = 10.0 Hz), 8.07 (1H, s), 8.09 (2H, d, J = 8.5 Hz), 12.03 (1H, s)。
元素分析値:C21H26N5O・H2O・HClとして
計算値:C, 60.35; H, 6.75; N, 16.76; Cl, 8.48。
実測値:C, 60.38; H, 6.72; N, 16.87; Cl, 8.40。
実施例151
N−(6−アセチルイミダゾ[1,2−b]ピリダジン−2−イル)−4−tert−ブチルベンズアミド
N−(6−アセチルイミダゾ[1,2−b]ピリダジン−2−イル)−4−tert−ブチルベンズアミド
実施例138で得られた4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(13g,39.5mmol)、トリブチル(1−エトキシビニル)スズ(15.7g,43.5mmol)及びビス(トリフェニルホスフィン)パラジウム(II)塩化物(1.4g,2.0mmol)をN,N−ジメチルホルムアミド(130ml)に溶かし、100℃で18時間攪拌した。反応後フッ化カリウム(5g,86.3mmol)を水(150ml)に溶かして加え、出てきた固体をろ取し、アセトニトリル、ジエチルエーテルで順次洗浄して緑色固体を得た。この固体をメタノール/塩化メチレン(100ml/200ml)混合溶媒に溶かし、3規定塩酸(100ml)を加えて室温で5時間攪拌した。溶媒を減圧溜去し、残渣に飽和炭酸水素ナトリウム水溶液を加えて弱アルカリ性にした後塩化メチレンで抽出した。有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後ろ過し、溶媒を減圧溜去して緑色の固体を得た。これをシリカゲルクロマトグラフィー(50%酢酸エチル/塩化メチレン)で精製後得られた緑色固体をジエチルエーテルで洗浄して薄黄色粉体の表題化合物(収量9.7g,収率72%)を得た。
融点 237−238℃
MS (ESI+): 337 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 2.69 (3H, s), 7.55 (2H, d, J = 8.5 Hz), 7.70 (1H, d, J = 9.4 Hz), 8.06 (2H, d, J = 8.5 Hz), 8.14 (1H, d, J = 9.4 Hz), 8.58 (1H, s), 11.49 (1H, s)。
元素分析値:C19H20N4O2として
計算値:C, 67.48; H, 5.99; N, 16.66。
実測値:C, 67.74; H, 5.98; N, 16.64。
融点 237−238℃
MS (ESI+): 337 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 2.69 (3H, s), 7.55 (2H, d, J = 8.5 Hz), 7.70 (1H, d, J = 9.4 Hz), 8.06 (2H, d, J = 8.5 Hz), 8.14 (1H, d, J = 9.4 Hz), 8.58 (1H, s), 11.49 (1H, s)。
元素分析値:C19H20N4O2として
計算値:C, 67.48; H, 5.99; N, 16.66。
実測値:C, 67.74; H, 5.98; N, 16.64。
実施例152
4−tert−ブチル−N−(6−グリコロイルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
4−tert−ブチル−N−(6−グリコロイルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
実施例151で得られたN−(6−アセチルイミダゾ[1,2−b]ピリダジン−2−イル)−4−tert−ブチルベンズアミド(3.2g,9.6mmol)を50%メタノール/塩化メチレン(100ml)に溶かし、ナトリウムメトキシド(28%メタノール溶液,1.3g,24mmol)及びヨードソベンゼン(3.2g,14mmol)を順次室温で加えて10分間攪拌した。その後反応溶液中に飽和炭酸水素ナトリウム水溶液(50ml)を加えて溶媒を減圧溜去し、得られた残渣を水、アセトニトリル及びジエチルエーテルで洗浄して黄白色の固体(2.9g)を得た。この固体(2.9g)をアセトン(150ml)に入れ更にp−トルエンスルホン酸・1水和物(2.8g,15mmol)及び水(45ml)を加えて80℃で6時間加熱した。反応溶液を冷却後、アセトンを減圧溜去し、残渣に飽和炭酸水素ナトリウム水溶液(50ml)を加えて50%テトラヒドロフラン/酢酸エチルで抽出した。有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後ろ過して溶媒を減圧溜去して得られた橙色の粗製物を酢酸エチルで洗浄して黄色粉体の表題化合物(収量1.9g,収率56%)を得た。
MS (ESI+): 353 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 4.99 (2H, d, J = 6.0 Hz), 5.26 (1H, t, J = 6.0 Hz), 7.55 (2H, d, J = 8.5 Hz), 7.69 (1H, d, J = 9.4 Hz), 8.01 (2H, d, J = 8.5 Hz), 8.16 (1H, d, J = 9.4 Hz), 8.56 (1H, s), 11.50 (1H, s)。
MS (ESI+): 353 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 4.99 (2H, d, J = 6.0 Hz), 5.26 (1H, t, J = 6.0 Hz), 7.55 (2H, d, J = 8.5 Hz), 7.69 (1H, d, J = 9.4 Hz), 8.01 (2H, d, J = 8.5 Hz), 8.16 (1H, d, J = 9.4 Hz), 8.56 (1H, s), 11.50 (1H, s)。
実施例153
4−tert−ブチル−N−[6−(1H−イミダゾール−5−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(1H−イミダゾール−5−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
実施例152で得られた4−tert−ブチル−N−(6−グリコロイルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(160mg,0.45mmol)、二酢酸銅(II)(820mg,4.5mmol)及びホルムアルデヒド(37%水溶液,74mg,0.91mmol)をN,N−ジメチルホルムアミド/28%アンモニア水溶液(8ml/24ml)混合溶媒に入れ100℃で30分攪拌した。反応溶媒を冷却後、水(10ml)を加えて析出した黄褐色の固体をろ取し、アセトニトリル、ジエチルエーテルで順次洗浄した。この黄褐色固体をエタノール(50ml)に入れ80℃に加熱しながら硫化水素を10分間吹き込んだ。その後析出してきた硫化銅を熱時ろ過で除き、ろ液を減圧下濃縮して黄色の粗製物固体を得た。これを塩基性シリカゲルクロマトグラフィー(50%酢酸エチル/塩化メチレン―10%メタノール/塩化メチレン)で精製して黄色の表題化合物(収量90mg,収率66%)を得た。
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ:1.33 (9H, s), 7.54 (2H, d, J = 8.5 Hz), 7.80 (1H, d, J = 9.4 Hz), 7.85(1H, s), 7.88 (1H, s), 8.00 (1H, d, J = 9.4 Hz), 8.05 (2H, d, J = 8.5 Hz), 8.39 (1H, s), 11.29 (1H, s)。
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ:1.33 (9H, s), 7.54 (2H, d, J = 8.5 Hz), 7.80 (1H, d, J = 9.4 Hz), 7.85(1H, s), 7.88 (1H, s), 8.00 (1H, d, J = 9.4 Hz), 8.05 (2H, d, J = 8.5 Hz), 8.39 (1H, s), 11.29 (1H, s)。
実施例154
4−tert−ブチル−N−[6−(1H−イミダゾール−5−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド・塩酸塩
4−tert−ブチル−N−[6−(1H−イミダゾール−5−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド・塩酸塩
実施例150と同様にして実施例153で得られた4−tert−ブチル−N−[6−(1H−イミダゾール−5−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド(90mg,0.25mmol)から塩酸塩を調製し、クロロホルムから再結晶した。
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 4.20-4.80 (4H, brs), 7.56 (2H, d, J = 8.5 Hz), 7.86 (1H, d, J = 9.4 Hz), 8.05 (2H, d, J = 8.5 Hz), 8.26 (1H, d, J = 9.4 Hz), 8.53 (1H, s), 8.57 (1H, d, J = 0.8 Hz), 9.33 (1H, d, J = 0.8 Hz), 11.47 (1H, s)。
元素分析値:C21H26N5O・1.7H2O・1.7HClとして
計算値:C, 53.02; H, 5.58; N, 18.55; Cl, 13.30。
実測値:C, 52.50; H, 5.23; N, 18.30; Cl, 13.31。
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 4.20-4.80 (4H, brs), 7.56 (2H, d, J = 8.5 Hz), 7.86 (1H, d, J = 9.4 Hz), 8.05 (2H, d, J = 8.5 Hz), 8.26 (1H, d, J = 9.4 Hz), 8.53 (1H, s), 8.57 (1H, d, J = 0.8 Hz), 9.33 (1H, d, J = 0.8 Hz), 11.47 (1H, s)。
元素分析値:C21H26N5O・1.7H2O・1.7HClとして
計算値:C, 53.02; H, 5.58; N, 18.55; Cl, 13.30。
実測値:C, 52.50; H, 5.23; N, 18.30; Cl, 13.31。
実施例155
4−tert−ブチル−N−[6−(2−メチル−1H−イミダゾール−5−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(2−メチル−1H−イミダゾール−5−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
実施例153と同様にして4−tert−ブチル−N−(6−グリコロイルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(200mg,0.57mmol)、二酢酸銅(II)(1000mg,5.7mmol)及びアセトアルデヒド(90%水溶液,56mg,1.1mmol)を用いて表題化合物(収量89mg,収率53%)を得た。
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.54 (2H, d, J = 8.5 Hz), 7.80 (1H, d, J = 9.4 Hz), 7.85(1H, s), 7.88 (1H, s), 8.00 (1H, d, J = 9.4 Hz), 8.05 (2H, d, J = 8.5 Hz), 8.39 (1H, s), 11.29 (1H, s)。
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.54 (2H, d, J = 8.5 Hz), 7.80 (1H, d, J = 9.4 Hz), 7.85(1H, s), 7.88 (1H, s), 8.00 (1H, d, J = 9.4 Hz), 8.05 (2H, d, J = 8.5 Hz), 8.39 (1H, s), 11.29 (1H, s)。
実施例156
4−tert−ブチル−N−[6−(2−メチル−1H−イミダゾール−5−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド・塩酸塩
4−tert−ブチル−N−[6−(2−メチル−1H−イミダゾール−5−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド・塩酸塩
実施例150と同様にして実施例155で得られた4−tert−ブチル−N−[6−(2−メチル−1H−イミダゾール−5−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド(87mg,0.23mmol)から塩酸塩を調製し、メタノール/アセトニトリルから再結晶して表題化合物(収量39mg,収率41%)を得た。
融点 295−297℃ (decomp.)
MS (ESI+): 375 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 2.66 (3H, s), 7.55 (2H, d, J = 8.5 Hz), 7.80 (1H, d, J = 9.4 Hz), 8.05 (2H, d, J = 8.5 Hz), 8.24 (1H, d, J = 9.4 Hz), 8.43 (1H, s), 8.52 (1H, s,), 9.33 (1H, d, J = 0.8 Hz), 11.45 (1H, s), 14.52-15.17 (2H, brs)。
元素分析値:C21H22N6O・1.3H2O・HClとして
計算値:C, 58.07; H, 5.94; N, 19.35; Cl, 8.16。
実測値:C, 57.44; H, 5.34; N, 19.10; Cl, 8.57。
融点 295−297℃ (decomp.)
MS (ESI+): 375 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 2.66 (3H, s), 7.55 (2H, d, J = 8.5 Hz), 7.80 (1H, d, J = 9.4 Hz), 8.05 (2H, d, J = 8.5 Hz), 8.24 (1H, d, J = 9.4 Hz), 8.43 (1H, s), 8.52 (1H, s,), 9.33 (1H, d, J = 0.8 Hz), 11.45 (1H, s), 14.52-15.17 (2H, brs)。
元素分析値:C21H22N6O・1.3H2O・HClとして
計算値:C, 58.07; H, 5.94; N, 19.35; Cl, 8.16。
実測値:C, 57.44; H, 5.34; N, 19.10; Cl, 8.57。
実施例157
4−tert−ブチル−N−[6−(2−イソプロピル−1H−イミダゾール−5−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(2−イソプロピル−1H−イミダゾール−5−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
実施例153と同様にして4−tert−ブチル−N−(6−グリコロイルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(200mg,0.57mmol)、二酢酸銅(II)(1000mg,5.7mmol)及び2−メチルプロパナール(82mg,1.1mmol)を用いて表題化合物(収量100mg,収率56%)を得た。
MS (ESI+): 403 (M+H)。
1H-NMR (DMSO-d6) δ: 1.25-1.37 (15H, m), 3.04 (1H, sept, J = 7.0 Hz), 7.54 (2H, d, J = 8.5 Hz), 7.72-7.80 (2H, m), 7.96(1H, d, J = 9.5 Hz),8.05 (2H, d, J = 8.5 Hz), 8.38 (0.7H, s), 8.41 (0.3H, s), 11.28 (0.7H, s), 11.32 (0.3H, s),12.20 (0.7H, s), 12.50 (0.3H, s)。
MS (ESI+): 403 (M+H)。
1H-NMR (DMSO-d6) δ: 1.25-1.37 (15H, m), 3.04 (1H, sept, J = 7.0 Hz), 7.54 (2H, d, J = 8.5 Hz), 7.72-7.80 (2H, m), 7.96(1H, d, J = 9.5 Hz),8.05 (2H, d, J = 8.5 Hz), 8.38 (0.7H, s), 8.41 (0.3H, s), 11.28 (0.7H, s), 11.32 (0.3H, s),12.20 (0.7H, s), 12.50 (0.3H, s)。
実施例158
4−tert−ブチル−N−[6−(2−イソプロピル−1H−イミダゾール−5−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド・塩酸塩
4−tert−ブチル−N−[6−(2−イソプロピル−1H−イミダゾール−5−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド・塩酸塩
実施例156と同様に実施例157で得た4−tert−ブチル−N−[6−(2−イソプロピル−1H−イミダゾール−5−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド(100mg,0.27mmol)から塩酸を調製し表題化合物(収量40mg,収率36%)を得た。
融点 304−305℃ (decom.)
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 1.42 (6H, d, J = 7.0 Hz), 3.42 (1H, m, J = 7.0 Hz), 7.55 (2H, d, J = 8.5 Hz), 7.84 (1H, d, J = 9.4 Hz), 8.05 (2H, d, J = 8.5 Hz), 8.23 (1H, d, J = 9.4 Hz), 8.46 (1H, s), 8.53 (1H, s), 11.45 (1H, s), 14.83(1.5H, brs)。
元素分析値:C23H26N6O・H2O・HClとして
計算値:C, 60.45; H, 6.40; N, 18.39; Cl, 7.76。
実測値:C, 60.33; H, 6.23; N, 18.42; Cl, 7.42。
融点 304−305℃ (decom.)
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 1.42 (6H, d, J = 7.0 Hz), 3.42 (1H, m, J = 7.0 Hz), 7.55 (2H, d, J = 8.5 Hz), 7.84 (1H, d, J = 9.4 Hz), 8.05 (2H, d, J = 8.5 Hz), 8.23 (1H, d, J = 9.4 Hz), 8.46 (1H, s), 8.53 (1H, s), 11.45 (1H, s), 14.83(1.5H, brs)。
元素分析値:C23H26N6O・H2O・HClとして
計算値:C, 60.45; H, 6.40; N, 18.39; Cl, 7.76。
実測値:C, 60.33; H, 6.23; N, 18.42; Cl, 7.42。
実施例159
4−tert−ブチル−N−{6−[(ピリジン−4−イルメチル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
4−tert−ブチル−N−{6−[(ピリジン−4−イルメチル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
実施例139で得られた4−tert−ブチル−N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(110mg,0.26mmol),ヨウ化銅(I)(25.4mg,0.13mmol),プロリン(15.4mg,0.13mmol)、1−ピリジン−4−イルメタンアミン(86.7mg,0.79mmol)及び炭酸カリウム(148mg,1.0mmol)をジメチルスルホキシド(2.0ml)に入れ、窒素雰囲気下80℃で2.5時間攪拌した。その後反応液を50%テトラヒドロフラン/酢酸エチル(50ml)で希釈し、28%アンモニア水溶液(5ml)で3回洗浄した後飽和食塩水で洗浄した。有機層を無水硫酸マグネシウムで乾燥、ろ過後溶媒を減圧溜去して褐色の粗製物を得た。これを塩基性シリカゲルクロマトグラフィー(90−100%酢酸エチル/ヘキサン)で精製後再びシリカゲルクロマトグラフィー(0−5%メタノール/酢酸エチル)で精製して薄黄色の表題化合物(収量44mg,収率42%)を得た。
融点 222−223℃(アセトニトリル)
MS (ESI+): 401 (M+H)。
1H-NMR (DMSO-d6) δ: 1.31 (9H, s), 4.49 (2H, d, J = 6.0 Hz), 6.74 (1H, d, J = 9.6 Hz), 7.39 (2H, d, J = 5.8 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.55 (1H, d, J = 6.0 Hz), 7.65 (1H, d, J = 9.6 Hz), 7.97 (1H, s), 7.99 (2H, d, J = 8.5 Hz), 8.52 (2H, d, J = 5.8 Hz), 10.99 (1H, s)。
元素分析値:C23H24N6Oとして
計算値:C, 68.98; H, 6.04; N, 20.99。
実測値:C, 68.56; H, 5.88; N, 20.79。
融点 222−223℃(アセトニトリル)
MS (ESI+): 401 (M+H)。
1H-NMR (DMSO-d6) δ: 1.31 (9H, s), 4.49 (2H, d, J = 6.0 Hz), 6.74 (1H, d, J = 9.6 Hz), 7.39 (2H, d, J = 5.8 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.55 (1H, d, J = 6.0 Hz), 7.65 (1H, d, J = 9.6 Hz), 7.97 (1H, s), 7.99 (2H, d, J = 8.5 Hz), 8.52 (2H, d, J = 5.8 Hz), 10.99 (1H, s)。
元素分析値:C23H24N6Oとして
計算値:C, 68.98; H, 6.04; N, 20.99。
実測値:C, 68.56; H, 5.88; N, 20.79。
実施例160
4−tert−ブチル−N−{6−[(ピリジン−3−イルメチル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
4−tert−ブチル−N−{6−[(ピリジン−3−イルメチル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
実施例139で得られた4−tert−ブチル−N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(200mg,0.48mmol),ヨウ化銅(I)(46.2mg,0.24mmol),プロリン(28.0mg,0.24mmol)、1−ピリジン−3−イルメタンアミン(157.5mg,1.43mmol)及び炭酸カリウム(268mg,1.9mmol)をジメチルスルホキシド(5.0ml)に入れ、窒素雰囲気下80℃で3.0時間攪拌した。その後反応液を50%テトラヒドロフラン/酢酸エチル(100ml)で希釈し、28%アンモニア水溶液(10ml)で3回洗浄した後飽和食塩水で洗浄した。有機層を無水硫酸マグネシウムで乾燥、ろ過後溶媒を減圧溜去して褐色の粗製物を得た。これを塩基性シリカゲルクロマトグラフィー(90−100%酢酸エチル/ヘキサン)で精製後再びシリカゲルクロマトグラフィー(0−5%メタノール/酢酸エチル)で精製して薄黄色の表題化合物(収量100mg,収率53%)を得た。
融点 232−233℃ (アセトニトリル)
MS (ESI+): 401 (M+H)。
1H-NMR (DMSO-d6) δ: 1.31 (9H, s), 4.47 (2H, d, J = 5.7 Hz), 6.70 (1H, d, J = 9.6 Hz), 7.38 (1H, dd, J = 7.7, 4.7 Hz), 7.46 (1H, t, J = 5.7 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.63 (1H, d, J = 9.6 Hz), 7.83 (1H, ddd, J = 7.7, 7.4, 1.7 Hz), 8.00 (2H, d, J = 8.5 Hz), 8.02 (1H, s), 8.48 (1H, dd, J = 4.7, 1.3 Hz), 8.64 (1H, d, J = 1.7 Hz), 10.99 (1H, s)。
元素分析値:C23H24N6Oとして
計算値:C, 68.98; H, 6.04; N, 20.99。
実測値:C, 68.56; H, 5.88; N, 20.79。
融点 232−233℃ (アセトニトリル)
MS (ESI+): 401 (M+H)。
1H-NMR (DMSO-d6) δ: 1.31 (9H, s), 4.47 (2H, d, J = 5.7 Hz), 6.70 (1H, d, J = 9.6 Hz), 7.38 (1H, dd, J = 7.7, 4.7 Hz), 7.46 (1H, t, J = 5.7 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.63 (1H, d, J = 9.6 Hz), 7.83 (1H, ddd, J = 7.7, 7.4, 1.7 Hz), 8.00 (2H, d, J = 8.5 Hz), 8.02 (1H, s), 8.48 (1H, dd, J = 4.7, 1.3 Hz), 8.64 (1H, d, J = 1.7 Hz), 10.99 (1H, s)。
元素分析値:C23H24N6Oとして
計算値:C, 68.98; H, 6.04; N, 20.99。
実測値:C, 68.56; H, 5.88; N, 20.79。
実施例161
4−tert−ブチル−N−{6−[(ピリジン−2−イルメチル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
4−tert−ブチル−N−{6−[(ピリジン−2−イルメチル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
実施例160と同様に1−ピリジン−2−イルメタンアミン(157.5mg,1.43mmol)を用いて表題化合物(収量123mg,収率65%)を得た。
融点 196−197℃ (アセトニトリル)
MS (ESI+): 401 (M+H)。
1H-NMR (DMSO-d6) δ: 1.31 (9H, s), 4.55 (2H, d, J = 5.7 Hz), 6.81 (1H, d, J = 9.6 Hz), 7.28 (1H, dd, J = 7.5, 4.9 Hz), 7.44 (1H, d, J = 7.9 Hz), 7.47-7.54 (1H, m), 7.51 (2H, d, J = 8.5 Hz), 7.63 (1H, d, J = 9.6 Hz), 7.77 (1H, td, J = 7.7, 1.7 Hz), 7.97 (1H, s), 7.99 (2H, d, J = 8.5 Hz), 8.55 (1H, m), 10.89 (1H, s)。
元素分析値:C23H24N6Oとして
計算値:C, 68.98; H, 6.04; N, 20.99。
実測値:C, 68.84; H, 5.99; N, 20.97。
融点 196−197℃ (アセトニトリル)
MS (ESI+): 401 (M+H)。
1H-NMR (DMSO-d6) δ: 1.31 (9H, s), 4.55 (2H, d, J = 5.7 Hz), 6.81 (1H, d, J = 9.6 Hz), 7.28 (1H, dd, J = 7.5, 4.9 Hz), 7.44 (1H, d, J = 7.9 Hz), 7.47-7.54 (1H, m), 7.51 (2H, d, J = 8.5 Hz), 7.63 (1H, d, J = 9.6 Hz), 7.77 (1H, td, J = 7.7, 1.7 Hz), 7.97 (1H, s), 7.99 (2H, d, J = 8.5 Hz), 8.55 (1H, m), 10.89 (1H, s)。
元素分析値:C23H24N6Oとして
計算値:C, 68.98; H, 6.04; N, 20.99。
実測値:C, 68.84; H, 5.99; N, 20.97。
実施例162
4−tert−ブチル−N−{6−[(2−ピリジン−4−イルエチル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
4−tert−ブチル−N−{6−[(2−ピリジン−4−イルエチル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
実施例160と同様に2−ピリジン−4−イルエタンアミン(177.9mg,1.43mmol)を用いて表題化合物(収量135mg,収率68%)を得た。
融点 279℃(アセトニトリル)
MS (ESI+): 415 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 2.94 (2H, t, J = 7.0 Hz), 3.30 (2H, td, J = 7.0, 5.5 Hz), 6.62 (1H, d, J = 9.6 Hz), 7.01 (1H, t, J = 5.5 Hz), 7.32 (2H, d, J = 5.8 Hz), 7.52 (2H, d, J = 8.5 Hz), 7.59 (1H, d, J = 9.6 Hz), 8.00 (2H, d, J = 8.5 Hz), 8.05 (1H, s), 8.48 (2H, d, J = 5.8 Hz), 10.99 (1H, s)。
元素分析値:C24H26N6Oとして
計算値:C, 69.54; H, 6.32; N, 20.27。
実測値:C, 69.46; H, 6.26; N, 20.24。
融点 279℃(アセトニトリル)
MS (ESI+): 415 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 2.94 (2H, t, J = 7.0 Hz), 3.30 (2H, td, J = 7.0, 5.5 Hz), 6.62 (1H, d, J = 9.6 Hz), 7.01 (1H, t, J = 5.5 Hz), 7.32 (2H, d, J = 5.8 Hz), 7.52 (2H, d, J = 8.5 Hz), 7.59 (1H, d, J = 9.6 Hz), 8.00 (2H, d, J = 8.5 Hz), 8.05 (1H, s), 8.48 (2H, d, J = 5.8 Hz), 10.99 (1H, s)。
元素分析値:C24H26N6Oとして
計算値:C, 69.54; H, 6.32; N, 20.27。
実測値:C, 69.46; H, 6.26; N, 20.24。
実施例163
4−tert−ブチル−N−{6−[(2−ピリジン−3−イルエチル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
4−tert−ブチル−N−{6−[(2−ピリジン−3−イルエチル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
実施例160と同様に2−ピリジン−3−イルエタンアミン(177.9mg,1.43mmol)を用いて表題化合物(収量138mg,収率70%)を得た。
融点 231℃(アセトニトリル)
MS (ESI+): 415 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 2.93 (2H, t, J = 7.0 Hz), 3.49 (2H, td, J = 7.0, 5.5 Hz), 6.63 (1H, d, J = 9.6 Hz), 7.01 (1H, t, J = 5.5 Hz), 7.34 (1H, dd, J = 7.7, 4.7 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.59 (1H, d, J = 9.6 Hz), 7.72 (1H, ddd, J = 7.7, 2.1, 1.5 Hz), 8.00 (2H, d, J = 8.5 Hz), 8.04 (1H, s), 8.43 (1H, dd, J = 4.7, 1.5 Hz), 8.51 (1H, d, J = 2.1 Hz), 10.99 (1H, s)。
元素分析値:C24H26N6Oとして
計算値:C, 69.54; H, 6.32; N, 20.27。
実測値:C, 69.45; H, 6.28; N, 20.37。
融点 231℃(アセトニトリル)
MS (ESI+): 415 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 2.93 (2H, t, J = 7.0 Hz), 3.49 (2H, td, J = 7.0, 5.5 Hz), 6.63 (1H, d, J = 9.6 Hz), 7.01 (1H, t, J = 5.5 Hz), 7.34 (1H, dd, J = 7.7, 4.7 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.59 (1H, d, J = 9.6 Hz), 7.72 (1H, ddd, J = 7.7, 2.1, 1.5 Hz), 8.00 (2H, d, J = 8.5 Hz), 8.04 (1H, s), 8.43 (1H, dd, J = 4.7, 1.5 Hz), 8.51 (1H, d, J = 2.1 Hz), 10.99 (1H, s)。
元素分析値:C24H26N6Oとして
計算値:C, 69.54; H, 6.32; N, 20.27。
実測値:C, 69.45; H, 6.28; N, 20.37。
実施例164
4−tert−ブチル−N−[6−(シクロヘキシルアミノ)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(シクロヘキシルアミノ)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
実施例160と同様にシクロヘキシルアミン(144.5mg,1.43mmol)を用いて反応を行った後、反応液を28%アンモニア水溶液(25ml)に注ぎ、50%テトラヒドロフラン/酢酸エチル(40ml)で3回抽出した。有機層を合わせて飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥、ろ過後溶媒を減圧溜去して粗製物を得た。これを塩基性シリカゲルクロマトグラフィー(50−75%酢酸エチル/ヘキサン)にて精製して表題化合物(収量110mg,収率59%)を得た。
融点 296−297℃(アセトニトリル)
MS (ESI+): 392 (M+H)。
1H-NMR (DMSO-d6) δ: 1.14-1.46 (5H, m), 1.32 (9H, s), 1.54-1.67 (1H, m), 1.67-1.81 (2H, m), 1.93-2.05 (2H, m), 3.53-3.73 (1H, m), 6.63 (1H, d, J = 9.6 Hz), 6.71 (1H, d, J = 7.5 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.56 (1H, d, J = 9.6 Hz), 7.98 (1H, s), 7.99 (2H, d, J = 8.5 Hz), 10.95 (1H, s)。
元素分析値:C23H29N5Oとして
計算値:C, 70.56; H, 7.47; N, 17.89。
実測値:C, 70.49; H, 7.44; N, 18.01。
融点 296−297℃(アセトニトリル)
MS (ESI+): 392 (M+H)。
1H-NMR (DMSO-d6) δ: 1.14-1.46 (5H, m), 1.32 (9H, s), 1.54-1.67 (1H, m), 1.67-1.81 (2H, m), 1.93-2.05 (2H, m), 3.53-3.73 (1H, m), 6.63 (1H, d, J = 9.6 Hz), 6.71 (1H, d, J = 7.5 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.56 (1H, d, J = 9.6 Hz), 7.98 (1H, s), 7.99 (2H, d, J = 8.5 Hz), 10.95 (1H, s)。
元素分析値:C23H29N5Oとして
計算値:C, 70.56; H, 7.47; N, 17.89。
実測値:C, 70.49; H, 7.44; N, 18.01。
実施例165
4−tert−ブチル−N−[6−(シクロペンチルアミノ)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(シクロペンチルアミノ)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
実施例164と同様にシクロペンチルアミン(124mg,1.43mmol)を用いて反応を行い、粗製物を得た。これを塩基性シリカゲルクロマトグラフィー(50%酢酸エチル/ヘキサン−100%酢酸エチル)にて精製して表題化合物(収量120mg,収率66.8%)を得た。
融点 272−273℃(アセトニトリル)
MS (ESI+): 392 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 1.40-1.78 (6H, m), 1.90-2.06 (2H, m), 4.03 (1H, m, J = 6.4 Hz), 6.61 (1H, d, J = 9.6 Hz), 6.85 (1H, d, J = 6.4 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.56 (1H, d, J = 9.6 Hz), 8.00 (1H, s), 8.00 (2H, d, J = 8.5 Hz), 10.95 (1H, s)。
元素分析値:C22H27N5Oとして
計算値:C, 70.00; H, 7.21; N, 18.55。
実測値:C, 70.03; H, 7.19; N, 18.65。
融点 272−273℃(アセトニトリル)
MS (ESI+): 392 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 1.40-1.78 (6H, m), 1.90-2.06 (2H, m), 4.03 (1H, m, J = 6.4 Hz), 6.61 (1H, d, J = 9.6 Hz), 6.85 (1H, d, J = 6.4 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.56 (1H, d, J = 9.6 Hz), 8.00 (1H, s), 8.00 (2H, d, J = 8.5 Hz), 10.95 (1H, s)。
元素分析値:C22H27N5Oとして
計算値:C, 70.00; H, 7.21; N, 18.55。
実測値:C, 70.03; H, 7.19; N, 18.65。
実施例166
4−tert−ブチル−N−[6−(シクロプロピルアミノ)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(シクロプロピルアミノ)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
実施例164と同様にシクロプロピルアミン(138.6mg,2.38mmol)を用いて表題化合物(収量124mg,収率74.6%)を得た。
融点 274−275℃ (アセトニトリル)
MS (ESI+): 350 (M+H)。
1H-NMR (DMSO-d6) δ: 0.43-0.51 (2H, m), 0.74 (2H, td, J = 6.8, 4.7 Hz), 1.32 (9H, s), 2.57-2.67 (1H, m), 6.63 (1H, d, J = 9.6 Hz), 7.15 (1H, d, J = 2.8 Hz), 7.52 (2H, d, J = 8.5 Hz), 7.61 (1H, d, J = 9.6 Hz), 8.00 (2H, d, J = 8.5 Hz), 8.05 (1H, s), 10.99 (1H, s)。
元素分析値:C20H23N5Oとして
計算値:C, 68.74; H, 6.63; N, 20.04。
実測値:C, 68.59; H, 6.62; N, 20.18。
融点 274−275℃ (アセトニトリル)
MS (ESI+): 350 (M+H)。
1H-NMR (DMSO-d6) δ: 0.43-0.51 (2H, m), 0.74 (2H, td, J = 6.8, 4.7 Hz), 1.32 (9H, s), 2.57-2.67 (1H, m), 6.63 (1H, d, J = 9.6 Hz), 7.15 (1H, d, J = 2.8 Hz), 7.52 (2H, d, J = 8.5 Hz), 7.61 (1H, d, J = 9.6 Hz), 8.00 (2H, d, J = 8.5 Hz), 8.05 (1H, s), 10.99 (1H, s)。
元素分析値:C20H23N5Oとして
計算値:C, 68.74; H, 6.63; N, 20.04。
実測値:C, 68.59; H, 6.62; N, 20.18。
実施例167
4−tert−ブチル−N−[6−(プロピルアミノ)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(プロピルアミノ)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
実施例164と同様にプロピルアミン(143.5mg,2.38mmol)を用いて表題化合物(収量120mg,収率71.8%)を得た。
融点 243−244℃ (アセトニトリル)
MS (ESI+): 352 (M+H)。
1H-NMR (DMSO-d6) δ: 0.96 (3H, t, J = 7.4 Hz), 1.32 (9H, s), 1.61 (2H, qt, J = 7.4, 6.8 Hz), 3.18 (2H, td, J = 6.8, 5.3 Hz), 6.64 (1H, d, J = 9.6 Hz), 6.85 (1H, t, J = 5.3 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.57 (1H, d, J = 9.6 Hz), 8.00 (1H, s), 8.00 (2H, d, J = 8.5 Hz), 10.96 (1H, s)。
元素分析値:C20H25N5Oとして
計算値:C, 68.35; H, 7.17; N, 19.93。
実測値:C, 68.39; H, 7.14; N, 20.10。
融点 243−244℃ (アセトニトリル)
MS (ESI+): 352 (M+H)。
1H-NMR (DMSO-d6) δ: 0.96 (3H, t, J = 7.4 Hz), 1.32 (9H, s), 1.61 (2H, qt, J = 7.4, 6.8 Hz), 3.18 (2H, td, J = 6.8, 5.3 Hz), 6.64 (1H, d, J = 9.6 Hz), 6.85 (1H, t, J = 5.3 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.57 (1H, d, J = 9.6 Hz), 8.00 (1H, s), 8.00 (2H, d, J = 8.5 Hz), 10.96 (1H, s)。
元素分析値:C20H25N5Oとして
計算値:C, 68.35; H, 7.17; N, 19.93。
実測値:C, 68.39; H, 7.14; N, 20.10。
実施例168
4−tert−ブチル−N−{6−[(1−メチルピペリジン−4−イル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
4−tert−ブチル−N−{6−[(1−メチルピペリジン−4−イル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
実施例164と同様に1−メチルピペリジン−4−イルアミン(271.3mg,1.43mmol)を用いて表題化合物(収量118mg,収率61.0%)を得た。
融点 275−277℃(アセトニトリル)
MS (ESI+): 407 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 1.37-1.55 (2H, m), 1.89-2.11 (4H, m), 2.18 (3H, s), 2.67-2.79 (2H, m),3.50-3.66 (1H, m), 6.62 (1H, d, J = 9.6 Hz), 6.76 (1H, d, J = 7.4 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.57 (1H, d, J = 9.6 Hz), 7.99 (1H, s), 7.99 (2H, d, J = 8.5 Hz), 10.96 (1H, s)。
元素分析値:C23H30N6Oとして
計算値:C, 67.95; H, 7.44; N, 20.67。
実測値:C, 67.25; H, 7.46; N, 20.50。
MS (ESI+): 407 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 1.37-1.55 (2H, m), 1.89-2.11 (4H, m), 2.18 (3H, s), 2.67-2.79 (2H, m),3.50-3.66 (1H, m), 6.62 (1H, d, J = 9.6 Hz), 6.76 (1H, d, J = 7.4 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.57 (1H, d, J = 9.6 Hz), 7.99 (1H, s), 7.99 (2H, d, J = 8.5 Hz), 10.96 (1H, s)。
元素分析値:C23H30N6Oとして
計算値:C, 67.95; H, 7.44; N, 20.67。
実測値:C, 67.25; H, 7.46; N, 20.50。
実施例169
4−tert−ブチル−N−{6−[(2−ヒドロキシエチル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
4−tert−ブチル−N−{6−[(2−ヒドロキシエチル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
実施例164と同様に2−アミノエタノール(89.0mg,1.43mmol)を用いて粗製物を得た後、塩基性シリカゲルクロマトグラフィー(80%酢酸エチル/ヘキサン―3%メタノール/酢酸エチル)で精製し表題化合物(収量146mg,収率86.8%)を得た。
融点 231−233℃ (アセトニトリル)
MS (ESI+): 354 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 3.31 (2H, q, J = 5.7 Hz), 3.61 (2H, q, J = 5.7 Hz), 4.76 (1H, t, J = 5.5 Hz), 6.69 (1H, d, J = 9.6 Hz), 6.90 (1H, t, J = 5.5 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.57 (1H, d, J = 9.6 Hz), 8.00 (2H, d, J = 8.5 Hz), 8.00 (1H, s), 10.97 (1H, s)。
元素分析値:C19H23N5O2として
計算値:C, 64.57; H, 6.56; N, 19.82。
実測値:C, 64.53; H, 6.56; N, 19.96。
融点 231−233℃ (アセトニトリル)
MS (ESI+): 354 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 3.31 (2H, q, J = 5.7 Hz), 3.61 (2H, q, J = 5.7 Hz), 4.76 (1H, t, J = 5.5 Hz), 6.69 (1H, d, J = 9.6 Hz), 6.90 (1H, t, J = 5.5 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.57 (1H, d, J = 9.6 Hz), 8.00 (2H, d, J = 8.5 Hz), 8.00 (1H, s), 10.97 (1H, s)。
元素分析値:C19H23N5O2として
計算値:C, 64.57; H, 6.56; N, 19.82。
実測値:C, 64.53; H, 6.56; N, 19.96。
実施例170
4−tert−ブチル−N−{6−[(ピロリジン−3−イル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
4−tert−ブチル−N−{6−[(ピロリジン−3−イル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
実施例164と同様に3−アミノピロリジン−1−カルボン酸 tert−ブチルエステル(271.3mg,1.43mmol)を用いて粗製物を得た後、塩基性シリカゲルクロマトグラフィー(30−50%酢酸エチル/ヘキサン)で精製し3−({2−[(4−tert−ブチルベンゾイル)アミノ]イミダゾ[1,2−b]ピリダジン−6−イル}アミノ)ピロリジン−1−カルボン酸 tert−ブチルエステル(収量154mg)を得た。更にこれを20%トリフルオロ酢酸/ジクロロメタン(10ml)中で一昼夜攪拌した後、溶媒を減圧溜去し、残渣を10%メタノール/酢酸エチル(50ml)で希釈して1規定水酸化ナトリウム水溶液(5ml)で洗浄後更に飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥し、ろ過後溶媒を減圧溜去して粗製物を得た。これを塩基性シリカゲルクロマトグラフィー(100%酢酸エチル―20%メタノール/酢酸エチル)で精製して表題化合物(収量78mg,収率43.3%)を得た。
融点 264−265℃(アセトニトリル)
MS (ESI+): 379 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 1.49-1.76 (1H, m), 1.96-2.12 (1H, m), 2.63 (1H, dd, J = 11.3, 4.3 Hz), 2.72-2.95 (2H, m), 3.07 (1H, dd, J = 11.3, 6.4 Hz), 6.62 (1H, d, J = 9.6 Hz), 6.95 (1H, d, J = 6.4 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.57 (1H, d, J = 9.6 Hz), 8.00 (2H, d, J = 8.5 Hz), 8.01 (1H, s), 10.97 (1H, s)。
元素分析値:C21H26N6O・0.5H2Oとして
計算値:C, 65.09; H, 7.02; N, 21.69。
実測値:C, 65.03; H, 6.95; N, 21.56。
融点 264−265℃(アセトニトリル)
MS (ESI+): 379 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 1.49-1.76 (1H, m), 1.96-2.12 (1H, m), 2.63 (1H, dd, J = 11.3, 4.3 Hz), 2.72-2.95 (2H, m), 3.07 (1H, dd, J = 11.3, 6.4 Hz), 6.62 (1H, d, J = 9.6 Hz), 6.95 (1H, d, J = 6.4 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.57 (1H, d, J = 9.6 Hz), 8.00 (2H, d, J = 8.5 Hz), 8.01 (1H, s), 10.97 (1H, s)。
元素分析値:C21H26N6O・0.5H2Oとして
計算値:C, 65.09; H, 7.02; N, 21.69。
実測値:C, 65.03; H, 6.95; N, 21.56。
実施例171
4−tert−ブチル−N−[6−(ピペリジン−4−イルアミノ)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(ピペリジン−4−イルアミノ)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
実施例164と同様に4−アミノピペリジン−1−カルボン酸 tert−ブチルエステル(291.8mg,1.43mmol)を用いて反応を行い、粗製物を得た後、塩基性シリカゲルクロマトグラフィー(30−80%酢酸エチル/ヘキサン)で精製し4−({2−[(4−tert−ブチルベンゾイル)アミノ]イミダゾ[1,2−b]ピリダジン−6−イル}アミノ)ピペリジン−1−カルボン酸 tert−ブチルエステル(収量210mg)を得た。更にこれを10%濃塩酸/エタノール(6ml)に溶かして70℃で30分攪拌した。冷却後、反応液を飽和炭酸水素ナトリウム水溶液(30ml)に注ぎ、10%メタノール/ジクロロメタン(40ml)で3回抽出した。有機層を合わせて飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥、ろ過後溶媒を減圧溜去して得られた粗製物を塩基性シリカゲルクロマトグラフィー(5−15%メタノール/酢酸エチル)で精製して表題化合物(収量133mg,収率41.3%)を得た。
融点 242−243℃(アセトニトリル)
MS (ESI+): 393 (M+H)。
1H-NMR (DMSO-d6) δ: 1.19-1.37 (2H, m), 1.32 (9H, s), 1.86-1.98 (2H, m), 1.96-2.12 (1H, brs), 2.51-2.62 (2H, m), 2.89-3.01 (2H, m),3.57-3.74 (1H, m), 6.62 (1H, d, J = 9.6 Hz), 6.76 (1H, d, J = 7.4 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.57 (1H, d, J = 9.6 Hz), 7.98 (1H, s), 7.99 (2H, d, J = 8.5 Hz), 10.96 (1H, s)。
元素分析値:C22H28N6Oとして
計算値:C, 67.32; H, 7.19; N, 21.41。
実測値:C, 67.38; H, 7.21; N, 21.56。
融点 242−243℃(アセトニトリル)
MS (ESI+): 393 (M+H)。
1H-NMR (DMSO-d6) δ: 1.19-1.37 (2H, m), 1.32 (9H, s), 1.86-1.98 (2H, m), 1.96-2.12 (1H, brs), 2.51-2.62 (2H, m), 2.89-3.01 (2H, m),3.57-3.74 (1H, m), 6.62 (1H, d, J = 9.6 Hz), 6.76 (1H, d, J = 7.4 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.57 (1H, d, J = 9.6 Hz), 7.98 (1H, s), 7.99 (2H, d, J = 8.5 Hz), 10.96 (1H, s)。
元素分析値:C22H28N6Oとして
計算値:C, 67.32; H, 7.19; N, 21.41。
実測値:C, 67.38; H, 7.21; N, 21.56。
実施例172
4−tert−ブチル−N−(6−{[2−(メチルアミノ)エチル]アミノ}イミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
4−tert−ブチル−N−(6−{[2−(メチルアミノ)エチル]アミノ}イミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
実施例164と同様に(2−アミノエチル)メチルカルバミン酸 tert−ブチルエステル(253.8mg,1.43mmol)を用いて反応を行い、粗製物を得た後、塩基性シリカゲルクロマトグラフィー(30−80%酢酸エチル/ヘキサン)で精製し[2−({2−[(4−tert−ブチルベンゾイル)アミノ]イミダゾ[1,2−b]ピリダジン−6−イル}アミノ)エチル]メチルカルバミン酸 tert−ブチルエステル(収量192mg)を得た。更にこれを実施例171と同様に脱保護を行い、塩基性シリカゲルクロマトグラフィー(5−15%メタノール/酢酸エチル)で精製して表題化合物(収量108mg,収率59.2%)を得た。
融点 200−201℃(トルエン)
MS (ESI+): 367 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 1.81 (1H, brs), 2.32 (3H, s), 2.70 (2H, t, J = 6.2 Hz), 3.29 (2H, td, J = 6.2, 5.3 Hz), 6.67 (1H, d, J = 9.6 Hz), 6.81 (1H, t, J = 5.3 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.57 (1H, d, J = 9.6 Hz), 8.00 (1H, s), 8.00 (2H, d, J = 8.5 Hz), 10.97 (1H, s)。
元素分析値:C20H26N6O・0.2H2Oとして
計算値:C, 64.91; H, 7.19; N, 22.71。
実測値:C, 64.72; H, 7.14; N, 22.64。
融点 200−201℃(トルエン)
MS (ESI+): 367 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 1.81 (1H, brs), 2.32 (3H, s), 2.70 (2H, t, J = 6.2 Hz), 3.29 (2H, td, J = 6.2, 5.3 Hz), 6.67 (1H, d, J = 9.6 Hz), 6.81 (1H, t, J = 5.3 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.57 (1H, d, J = 9.6 Hz), 8.00 (1H, s), 8.00 (2H, d, J = 8.5 Hz), 10.97 (1H, s)。
元素分析値:C20H26N6O・0.2H2Oとして
計算値:C, 64.91; H, 7.19; N, 22.71。
実測値:C, 64.72; H, 7.14; N, 22.64。
実施例173
4−tert−ブチル−N−[6−(1−メチル−1H−ピラゾール−4−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(1−メチル−1H−ピラゾール−4−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
実施例139で得られた4−tert−ブチル−N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(200mg,0.48mmol)をN,N−ジメチルホルムアミド/1,2−ジメトキシエタン(1/2)混合溶媒(7.5ml)に入れ、更に1−メチル−4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ピラゾール(197mg,0.93mmol)、二酢酸パラジウム(II)(9.0mg,0.05mmol)、2M−炭酸ナトリウム水溶液(0.46ml,0.93mmol)及びトリフェニルホスフィン(37.3mg,0.14mmol)を加えた後、窒素雰囲気下、80℃で1.5時間攪拌した。冷却後反応溶液を水(10ml)に注ぎ50%テトラヒドロフラン/酢酸エチル(40ml)で3回抽出し、合わせた有機層を飽和食塩水で洗浄、無水硫酸マグネシウムで乾燥、ろ過後溶媒を減圧溜去して粗製物を得た。これを塩基性シリカゲルクロマトグラフィー(50−70%酢酸エチル/ヘキサン)で精製し薄黄色の表題化合物(収量168mg、収率96.5%)を得た。
融点 245−246℃(アセトニトリル)
MS (ESI+): 375 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 3.93 (3H, s), 7.54 (2H, d, J = 8.5 Hz), 7.57 (1H, d, J = 9.4 Hz), 8.01 (1H, d, J = 9.4 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.09 (1H, s), 8.39 (1H, s), 8.44 (1H, s), 11.29 (1H, s)。
元素分析値:C21H22N6Oとして
計算値:C, 67.36; H, 5.92; N, 22.44。
実測値:C, 67.14; H, 5.93; N, 22.43。
融点 245−246℃(アセトニトリル)
MS (ESI+): 375 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 3.93 (3H, s), 7.54 (2H, d, J = 8.5 Hz), 7.57 (1H, d, J = 9.4 Hz), 8.01 (1H, d, J = 9.4 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.09 (1H, s), 8.39 (1H, s), 8.44 (1H, s), 11.29 (1H, s)。
元素分析値:C21H22N6Oとして
計算値:C, 67.36; H, 5.92; N, 22.44。
実測値:C, 67.14; H, 5.93; N, 22.43。
実施例174
4−tert−ブチル−N−[6−(1H−ピラゾール−4−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(1H−ピラゾール−4−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
実施例173と同様に4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ピラゾール(184mg,0.93mmol)を用いて反応を行った後、得られた粗製物をテトラヒドロフランで洗浄して薄黄色の表題化合物(収量64mg,収率38%)を得た。
融点 358−362℃ (decompose)(テトラヒドロフラン)
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.54 (2H, d, J = 8.5 Hz), 7.63 (1H, d, J = 9.4 Hz), 8.01 (1H, d, J = 9.4 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.15 (1H, brs), 8.40 (1H, s), 8.48 (1H, brs), 11.78 (1H, s), 13.28 (1H, s)。
元素分析値:C20H20N6O・0.3H2Oとして
計算値:C, 65.67; H, 5.68; N, 22.97。
実測値:C, 66.00; H, 5.66; N, 22.59。
融点 358−362℃ (decompose)(テトラヒドロフラン)
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.54 (2H, d, J = 8.5 Hz), 7.63 (1H, d, J = 9.4 Hz), 8.01 (1H, d, J = 9.4 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.15 (1H, brs), 8.40 (1H, s), 8.48 (1H, brs), 11.78 (1H, s), 13.28 (1H, s)。
元素分析値:C20H20N6O・0.3H2Oとして
計算値:C, 65.67; H, 5.68; N, 22.97。
実測値:C, 66.00; H, 5.66; N, 22.59。
実施例175
6−tert−ブチル−N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)ニコチンアミド
6−tert−ブチル−N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)ニコチンアミド
参考例37で得られた6−tert−ブチルニコチン酸(179mg,1.0mmol)及び参考例36で得られた6−ヨードイミダゾ[1,2−b]ピリダジン−2−アミン(200mg,0.77mmol)をN,N−ジメチルホルムアミド(4mL)に溶かし、そこへシアノリン酸ジエチル(90%溶液,266mg,1.15mmol)次いでトリエチルアミン(238mg,2.31mmol)を室温で加え、終夜攪拌した。反応後溶媒を減圧下溜去し、得られた残渣を塩基性シリカゲルクロマトグラフィー(50%酢酸エチル/ヘキサン)で精製し黄白色の表題化合物(収量88mg,収率27%)を得た。
1H-NMR (DMSO-d6) δ: 1.35 (9H, s), 7.55 (1H, d, J = 9.3 Hz), 7.59 (1H, d, J = 8.3 Hz), 7.81 (1H, d, J = 9.3 Hz), 8.36 (1H, dd, J = 8.3, 2.4 Hz), 8.49 (1H, s), 9.14 (1H, d, J = 2.4 Hz), 11.61 (1H, s)。
1H-NMR (DMSO-d6) δ: 1.35 (9H, s), 7.55 (1H, d, J = 9.3 Hz), 7.59 (1H, d, J = 8.3 Hz), 7.81 (1H, d, J = 9.3 Hz), 8.36 (1H, dd, J = 8.3, 2.4 Hz), 8.49 (1H, s), 9.14 (1H, d, J = 2.4 Hz), 11.61 (1H, s)。
実施例176
6−tert−ブチル−N−[6−(1−メチル−1H−ピラゾール−4−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ニコチンアミド
6−tert−ブチル−N−[6−(1−メチル−1H−ピラゾール−4−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ニコチンアミド
実施例175で得られた6−tert−ブチル−N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)ニコチンアミド(82mg,0.19mmol)を用いて実施例173と同様に表題化合物(収量68mg,収率93.3%)を得た。
融点 251−252℃(アセトニトリル)
MS (ESI+): 376 (M+H)。
1H-NMR (DMSO-d6) δ: 1.36 (9H, s), 3.93 (3H, s), 7.59 (1H, d, J = 9.6 Hz), 7.59 (1H, d, J = 8.5 Hz), 8.03 (1H, d, J = 9.6 Hz), 8.09 (1H, s), 8.36 (1H, dd, J = 8.5, 2.5 Hz), 8.39 (1H, s), 8.44 (1H, s), 9.15 (1H, d, J = 2.5 Hz), 11.51 (1H, s)。
元素分析値:C20H21N7O・H2Oとして
計算値:C, 61.05; H, 5.89; N, 24.92。
実測値:C, 60.75; H, 5.83; N, 24.84。
融点 251−252℃(アセトニトリル)
MS (ESI+): 376 (M+H)。
1H-NMR (DMSO-d6) δ: 1.36 (9H, s), 3.93 (3H, s), 7.59 (1H, d, J = 9.6 Hz), 7.59 (1H, d, J = 8.5 Hz), 8.03 (1H, d, J = 9.6 Hz), 8.09 (1H, s), 8.36 (1H, dd, J = 8.5, 2.5 Hz), 8.39 (1H, s), 8.44 (1H, s), 9.15 (1H, d, J = 2.5 Hz), 11.51 (1H, s)。
元素分析値:C20H21N7O・H2Oとして
計算値:C, 61.05; H, 5.89; N, 24.92。
実測値:C, 60.75; H, 5.83; N, 24.84。
実施例177
4−tert−ブチル−N−(6−{1−[2−(テトラヒドロ−2H−ピラン−2−イルオキシ)エチル]−1H−ピラゾール−4−イル}イミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
4−tert−ブチル−N−(6−{1−[2−(テトラヒドロ−2H−ピラン−2−イルオキシ)エチル]−1H−ピラゾール−4−イル}イミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
参考例38で得られた1−[2−(テトラヒドロ−2H−ピラン−2−イルオキシ)エチル]−4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ピラゾール(125mg,0.93mmol)を用いて実施例173と同様に反応を行った後、得られた粗製物を塩基性シリカゲルクロマトグラフィー(50−80%酢酸エチル/ヘキサン)で精製して黄色の固体を得た。これをジエチルエーテルで洗浄して薄黄色の表題化合物(収量90mg,収率77.4%)を得た。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 1.35-1.50 (4H, m), 1.51-1.75 (2H, m), 3.34-3.44 (1H, m), 3.51-3.64 (1H, m), 3.74-3.86 (1H, m), 3.92-4.06 (1H, m), 4.31-4.45 (2H, m), 4.54-4.61 (1H, m), 7.54 (2H, d, J = 8.3 Hz), 7.59 (1H, d, J = 9.4 Hz), 8.01 (1H, d, J = 9.4 Hz), 8.04 (2H, d, J = 8.3 Hz), 8.13 (1H, s), 8.39 (1H, s), 8.48 (1H, s), 11.28 (1H, s)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 1.35-1.50 (4H, m), 1.51-1.75 (2H, m), 3.34-3.44 (1H, m), 3.51-3.64 (1H, m), 3.74-3.86 (1H, m), 3.92-4.06 (1H, m), 4.31-4.45 (2H, m), 4.54-4.61 (1H, m), 7.54 (2H, d, J = 8.3 Hz), 7.59 (1H, d, J = 9.4 Hz), 8.01 (1H, d, J = 9.4 Hz), 8.04 (2H, d, J = 8.3 Hz), 8.13 (1H, s), 8.39 (1H, s), 8.48 (1H, s), 11.28 (1H, s)。
実施例178
4−tert−ブチル−N−{6−[1−(2−ヒドロキシエチル)−1H−ピラゾール−4−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
4−tert−ブチル−N−{6−[1−(2−ヒドロキシエチル)−1H−ピラゾール−4−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド
実施例177で得られた4−tert−ブチル−N−{6−[1−(2−ヒドロキシエチル)−1H−ピラゾール−4−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド(85mg,0.17mmol)を10%濃塩酸/エタノール(3ml)に溶かして70℃で15分攪拌した。冷却後、反応液を飽和炭酸水素ナトリウム水溶液(30ml)に注ぎ、酢酸エチル(30ml)で3回抽出した。有機層を合わせて飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥、ろ過後溶媒を減圧溜去して得られた粗製物を塩基性シリカゲルクロマトグラフィー(0−5%メタノール/酢酸エチル)で精製して表題化合物(収量63mg,収率89.5%)を得た。
融点 226−229℃(アセトニトリル)
MS (ESI+): 405 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 3.79 (2H, td, J = 5.5, 4.7Hz), 4.22 (2H, t, J = 5.5 Hz), 4.98 (1H, t, J = 4.7 Hz), 7.54 (2H, d, J = 8.5 Hz), 7.60 (1H, d, J = 9.4 Hz), 8.01 (1H, d, J = 9.4 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.11 (1H, s), 8.39 (1H, s), 8.44 (1H, s), 11.28 (1H, s)。
元素分析値:C22H24N6O2として
計算値:C, 65.33; H, 5.98; N, 20.78。
実測値:C, 65.26; H, 6.01; N, 20.87。
融点 226−229℃(アセトニトリル)
MS (ESI+): 405 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 3.79 (2H, td, J = 5.5, 4.7Hz), 4.22 (2H, t, J = 5.5 Hz), 4.98 (1H, t, J = 4.7 Hz), 7.54 (2H, d, J = 8.5 Hz), 7.60 (1H, d, J = 9.4 Hz), 8.01 (1H, d, J = 9.4 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.11 (1H, s), 8.39 (1H, s), 8.44 (1H, s), 11.28 (1H, s)。
元素分析値:C22H24N6O2として
計算値:C, 65.33; H, 5.98; N, 20.78。
実測値:C, 65.26; H, 6.01; N, 20.87。
実施例179
2−メチル−2−{4−[(5−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}プロパン酸メチル
2−メチル−2−{4−[(5−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}プロパン酸メチル
参考例1で得られた4−(2−メトキシ−1,1−ジメチル−2−オキソエチル)安息香酸(200mg,0.88mmol)をジクロロメタン(8ml)に溶かし二塩化オキザリル(171mg,1.35mmol)及びN,N−ジメチルホルムアミド(13mg,0.18mmol)を加え、室温で30分攪拌した。その後溶媒を減圧溜去し、残渣をトルエン混合溶媒で共沸して無色の酸塩化物を得た。一方、参考例20で得られた5−メチルイミダゾ[1,2−a]ピリジン−2−アミン(125mg,0.85mmol)及びトリエチルアミン(263mg,2.60mmol)をテトラヒドロフラン(10ml)に溶かし、そこへ先ほど得られた酸塩化物をテトラヒドロフラン(5ml)に溶かして室温で加えた。30分間攪拌後、反応溶液に飽和炭酸水素ナトリウム水溶液(15ml)を加え、酢酸エチル(50ml)で3回抽出した。有機層を合わせて飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥、ろ過後溶媒を減圧溜去して黄白色の粗製固体を得た。これを塩基性シリカゲルクロマトグラフィー(50%酢酸エチル/ヘキサン)で精製し白色固体の表題化合物(収量273mg,収率91.6%)を得た。
1H-NMR (CDCl3) δ: 1.58 (6H, s), 2.63 (3H, s), 3.66 (3H, s), 6.62(1H, d, J = 7.0 Hz), 6.85 (1H, d, J = 9.0 Hz), 7.02 (1H, dd, J = 9.0, 7.0 Hz), 7.38 (2H, d, J = 8.5 Hz), 7.95 (2H, d, J = 8.5 Hz), 8.18 (1H, s), 10.60 (1H, s)。
1H-NMR (CDCl3) δ: 1.58 (6H, s), 2.63 (3H, s), 3.66 (3H, s), 6.62(1H, d, J = 7.0 Hz), 6.85 (1H, d, J = 9.0 Hz), 7.02 (1H, dd, J = 9.0, 7.0 Hz), 7.38 (2H, d, J = 8.5 Hz), 7.95 (2H, d, J = 8.5 Hz), 8.18 (1H, s), 10.60 (1H, s)。
実施例180
4−メチル−4−{4−[(5−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}ペンタン酸エチル
4−メチル−4−{4−[(5−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}ペンタン酸エチル
参考例6で得られた4−(4−エトキシ−1,1−ジメチル−4−オキソブチル)安息香酸(400mg,1.48mmol)を用いて、実施例179と同様に反応を行い表題化合物(収量551mg,収率95.9%)を得た。
1H-NMR (DMSO-d6) δ: 1.13 (3H, t, J = 7.2 Hz), 1.31 (6H, s), 1.86-2.10 (4H, m), 2.62 (3H, s), 3.97 (2H, q, J = 7.2 Hz), 6.80 (1H, d, J = 7.0 Hz), 7.23 (1H, dd, J = 9.0, 7.0 Hz), 7.38 (1H, d, J = 9.0 Hz), 7.49 (2H, d, J = 8.5 Hz), 8.06 (2H, d, J = 8.5 Hz), 8.07 (1H, s), 11.18 (1H, s)。
1H-NMR (DMSO-d6) δ: 1.13 (3H, t, J = 7.2 Hz), 1.31 (6H, s), 1.86-2.10 (4H, m), 2.62 (3H, s), 3.97 (2H, q, J = 7.2 Hz), 6.80 (1H, d, J = 7.0 Hz), 7.23 (1H, dd, J = 9.0, 7.0 Hz), 7.38 (1H, d, J = 9.0 Hz), 7.49 (2H, d, J = 8.5 Hz), 8.06 (2H, d, J = 8.5 Hz), 8.07 (1H, s), 11.18 (1H, s)。
実施例181
1−{4−[(5−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロブタンカルボン酸メチル
1−{4−[(5−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロブタンカルボン酸メチル
参考例12で得られた4−[1−(メトキシカルボニル)シクロブチル]安息香酸(191mg,0.80mmol)を用いて実施例179と同様に反応を行い表題化合物(収量264mg,収率90.8%)を得た。
1H-NMR (CDCl3) δ: 1.80-1.95 (1H, m), 2.00-2.16 (1H, m), 2.40-2.55 (2H, m), 2.63 (3H, s), 2.78-2.91 (2H, m), 3.65 (3H, s), 6.61(1H, d, J = 7.0 Hz), 6.75 (1H, d, J = 9.0 Hz), 6.99 (1H, dd, J = 9.0, 7.0 Hz), 7.32 (2H, d, J = 8.3 Hz), 7.97 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 11.08 (1H, s)。
1H-NMR (CDCl3) δ: 1.80-1.95 (1H, m), 2.00-2.16 (1H, m), 2.40-2.55 (2H, m), 2.63 (3H, s), 2.78-2.91 (2H, m), 3.65 (3H, s), 6.61(1H, d, J = 7.0 Hz), 6.75 (1H, d, J = 9.0 Hz), 6.99 (1H, dd, J = 9.0, 7.0 Hz), 7.32 (2H, d, J = 8.3 Hz), 7.97 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 11.08 (1H, s)。
実施例182
1−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロプロパンカルボン酸メチル
1−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロプロパンカルボン酸メチル
参考例11で得られた4−[1−(メトキシカルボニル)シクロプロピル]安息香酸(250mg,1.11mmol)及び参考例21で得られた6−クロロイミダゾ[1,2−a]ピリジン−2−アミン(150mg,0.89mmol)を用いて実施例179と同様に反応を行い表題化合物(収量202mg,収率61.0%)を得た。
1H-NMR (CDCl3) δ: 1.21 (2H, dd, J = 7.2, 4.2 Hz), 1.67(2H, dd, J = 7.2, 4.2 Hz), 3.65 (3H, s), 7.03-7.11 (2H, m), 7.44 (2H, d, J = 8.3Hz), 7.90 (2H, d, J = 8.3 Hz), 8.16 (1H, t, J = 1.5 Hz), 8.25 (1H, s), 9.74 (1H, s)。
1H-NMR (CDCl3) δ: 1.21 (2H, dd, J = 7.2, 4.2 Hz), 1.67(2H, dd, J = 7.2, 4.2 Hz), 3.65 (3H, s), 7.03-7.11 (2H, m), 7.44 (2H, d, J = 8.3Hz), 7.90 (2H, d, J = 8.3 Hz), 8.16 (1H, t, J = 1.5 Hz), 8.25 (1H, s), 9.74 (1H, s)。
実施例183
1−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロブタンカルボン酸メチル
1−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロブタンカルボン酸メチル
参考例12で得られた4−[1−(メトキシカルボニル)シクロブチル]安息香酸(270mg,1.13mmol)を用いて実施例182と同様に反応を行い表題化合物(収量232mg,収率67.5%)を得た。
1H-NMR (CDCl3) δ: 1.82-1.98 (1H, m), 2.01-2.19 (1H, m), 2.43-2.58 (2H, m), 2.81-2.95 (2H, m), 3.66 (3H, s), 6.93 (1H, d, J = 9.5 Hz), 7.04 (1H, dd, J = 9.5, 1.9 Hz), 7.38 (2H, d, J = 8.3 Hz), 7.92 (2H, d, J = 8.3 Hz), 8.16 (1H, d, J = 1.9 Hz), 8.26 (1H, s), 10.12 (1H, s)。
1H-NMR (CDCl3) δ: 1.82-1.98 (1H, m), 2.01-2.19 (1H, m), 2.43-2.58 (2H, m), 2.81-2.95 (2H, m), 3.66 (3H, s), 6.93 (1H, d, J = 9.5 Hz), 7.04 (1H, dd, J = 9.5, 1.9 Hz), 7.38 (2H, d, J = 8.3 Hz), 7.92 (2H, d, J = 8.3 Hz), 8.16 (1H, d, J = 1.9 Hz), 8.26 (1H, s), 10.12 (1H, s)。
実施例184
1−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロペンタンカルボン酸メチル
1−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロペンタンカルボン酸メチル
参考例13で得られた4−[1−(メトキシカルボニル)シクロペンチル]安息香酸(200mg,0.79mmol)を用いて実施例182と同様に反応を行い表題化合物(収量200mg,収率70.2%)を得た。
1H-NMR (CDCl3) δ: 1.71-1.82 (4H, m), 1.84-1.99 (2H, m), 2.60-2.72 (2H, m), 3.63 (3H, s), 6.90 (1H, d, J = 9.5 Hz), 7.02 (1H, dd, J = 9.5, 1.9 Hz), 7.43 (2H, d, J = 8.3 Hz), 7.90 (2H, d, J = 8.3 Hz), 8.16 (1H, dd, J = 1.9, 0.8 Hz), 8.26 (1H, s), 10.18 (1H, s)。
1H-NMR (CDCl3) δ: 1.71-1.82 (4H, m), 1.84-1.99 (2H, m), 2.60-2.72 (2H, m), 3.63 (3H, s), 6.90 (1H, d, J = 9.5 Hz), 7.02 (1H, dd, J = 9.5, 1.9 Hz), 7.43 (2H, d, J = 8.3 Hz), 7.90 (2H, d, J = 8.3 Hz), 8.16 (1H, dd, J = 1.9, 0.8 Hz), 8.26 (1H, s), 10.18 (1H, s)。
実施例185
1−(4−{[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)シクロヘキサンカルボン酸メチル
1−(4−{[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)シクロヘキサンカルボン酸メチル
参考例14で得られた4−[1−(メトキシカルボニル)シクロヘキシル]安息香酸(250mg,0.99mmol)を用いて実施例182と同様に反応を行い表題化合物(収量140mg,収率70.1%)を得た。
MS (ESI+): 412 (M+H)。
1H-NMR (CDCl3) δ: 1.21-1.39 (1H, m), 1.40-1.58 (2H, m), 1.59-1.82 (5H, m), 2.41-2.54 (2H, m), 3.65 (3H, s), 6.95 (1H, d, J = 9.5 Hz), 7.04 (1H, dd, J = 9.5, 1.9 Hz), 7.47 (2H, d, J = 8.3 Hz), 7.91 (2H, d, J = 8.3 Hz), 8.16 (1H, dd, J = 1.9, 0.8 Hz), 8.25 (1H, s), 10.03 (1H, s)。
元素分析値:C22H22N3O3Clとして
計算値:C, 64.15; H, 5.38; N, 10.20。
実測値:C, 64.09; H, 5.40; N, 10.23。
MS (ESI+): 412 (M+H)。
1H-NMR (CDCl3) δ: 1.21-1.39 (1H, m), 1.40-1.58 (2H, m), 1.59-1.82 (5H, m), 2.41-2.54 (2H, m), 3.65 (3H, s), 6.95 (1H, d, J = 9.5 Hz), 7.04 (1H, dd, J = 9.5, 1.9 Hz), 7.47 (2H, d, J = 8.3 Hz), 7.91 (2H, d, J = 8.3 Hz), 8.16 (1H, dd, J = 1.9, 0.8 Hz), 8.25 (1H, s), 10.03 (1H, s)。
元素分析値:C22H22N3O3Clとして
計算値:C, 64.15; H, 5.38; N, 10.20。
実測値:C, 64.09; H, 5.40; N, 10.23。
実施例186
2−メチル−2−{4−[(5−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}プロパン酸
2−メチル−2−{4−[(5−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}プロパン酸
実施例179で得られた2−メチル−2−{4−[(5−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}プロパン酸メチル(220mg,0.61mmol)を50%テトラヒドロフラン/メタノール(6.0ml)に入れ、更に2規定水酸化カリウム水溶液(3.0ml, 6.0 mmol)を加えて45−50℃で3時間攪拌した。その後溶媒を減圧溜去して得られた白色の粗製固体に水(5ml)を加え、1規定塩酸でpH4−5の弱酸性にすると白色の沈殿が析出した。この沈殿物をろ取して、水、アセトニトリル次いでジエチルエーテルで順に洗浄し、乾燥後白色の表題化合物(収量98mg,収率47%)を得た。
融点 282−283℃(アセトニトリル)
MS (ESI+): 338 (M+H)。
1H-NMR (DMSO-d6) δ: 1.52 (6H, s), 2.62 (3H, m), 6.80 (1H, d, J = 6.8Hz), 7.23 (1H, dd, J = 8.9, 6.8 Hz), 7.38 (1H, d, J = 8.9 Hz), 7.48 (2H, d, J = 8.5 Hz), 8.06 (2H, d, J = 8.5 Hz), 8. 07 (1H, s), 11.23 (1H, s), 12.50 (1H, s)。
元素分析値:C19H19N3O3として
計算値:C, 67.64; H, 5.68; N, 12.46。
実測値:C, 67.52; H, 5.54; N, 12.43。
融点 282−283℃(アセトニトリル)
MS (ESI+): 338 (M+H)。
1H-NMR (DMSO-d6) δ: 1.52 (6H, s), 2.62 (3H, m), 6.80 (1H, d, J = 6.8Hz), 7.23 (1H, dd, J = 8.9, 6.8 Hz), 7.38 (1H, d, J = 8.9 Hz), 7.48 (2H, d, J = 8.5 Hz), 8.06 (2H, d, J = 8.5 Hz), 8. 07 (1H, s), 11.23 (1H, s), 12.50 (1H, s)。
元素分析値:C19H19N3O3として
計算値:C, 67.64; H, 5.68; N, 12.46。
実測値:C, 67.52; H, 5.54; N, 12.43。
実施例187
4−メチル−4−(4−{[(5−メチルイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)ペンタン酸
4−メチル−4−(4−{[(5−メチルイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)ペンタン酸
実施例180で得られた4−メチル−4−{4−[(5−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}ペンタン酸エチル(220mg,0.56mmol)を50%テトラヒドロフラン/エタノール(4.0ml)に入れ、更に5規定水酸化カリウム水溶液(1.0ml,5mmol)を加えて室温で一昼夜攪拌した。その後溶媒を減圧溜去して得られた白色の粗製固体に水(5ml)を加え、1規定塩酸でpH4−5の弱酸性にすると白色の沈殿が析出した。この沈殿物をろ取して、水、アセトニトリル次いでジエチルエーテルで順に洗浄し、乾燥後白色の表題化合物(収量148mg,収率72%)を得た。
融点 260℃(アセトニトリル)
MS (ESI+): 366 (M+H)。
1H-NMR (DMSO-d6) δ: 1.31 (6H, s), 1.91 (4H, s), 2.62 (3H, m), 6.80 (1H, d, J = 6.8 Hz), 7.23 (1H, dd, J = 8.9, 6.8 Hz), 7.38 (1H, d, J = 8.9 Hz), 7.49 (2H, d, J = 8.5 Hz), 8.06 (2H, d, J = 8.5 Hz), 8. 07 (1H, s), 11.17 (1H, s), 12.04 (1H, s)。
元素分析値:C21H23N3O3として
計算値:C, 69.02; H, 6.34; N, 11.50。
実測値:C, 69.02; H, 6.33; N, 11.51。
融点 260℃(アセトニトリル)
MS (ESI+): 366 (M+H)。
1H-NMR (DMSO-d6) δ: 1.31 (6H, s), 1.91 (4H, s), 2.62 (3H, m), 6.80 (1H, d, J = 6.8 Hz), 7.23 (1H, dd, J = 8.9, 6.8 Hz), 7.38 (1H, d, J = 8.9 Hz), 7.49 (2H, d, J = 8.5 Hz), 8.06 (2H, d, J = 8.5 Hz), 8. 07 (1H, s), 11.17 (1H, s), 12.04 (1H, s)。
元素分析値:C21H23N3O3として
計算値:C, 69.02; H, 6.34; N, 11.50。
実測値:C, 69.02; H, 6.33; N, 11.51。
実施例188
1−{4−[(5−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロブタンカルボン酸
1−{4−[(5−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロブタンカルボン酸
実施例181で得られた1−{4−[(5−メチルイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロブタンカルボン酸メチル(252mg,0.69mmol)を50%テトラヒドロフラン/エタノール(6.0ml)に入れ、更に5規定水酸化カリウム水溶液(1.0ml)を加えて50℃で1.5時間攪拌した。以下実施例186と同様にして白色の表題化合物(収量169mg,収率70%)を得た。
融点 272℃(アセトニトリル)
MS (ESI+): 350 (M+H)。
1H-NMR (DMSO-d6) δ: 1.73-1.89 (1H, m), 1.89-2.07 (1H, m), 2.38-2.49 (2H, m), 2.62(3H, s), 2.68-2.82 (2H, m), 6.80(1H, d, J = 6.8 Hz), 7.23 (1H, dd, J = 9.1, 6.8 Hz), 7.38 (1H, d, J = 9.1 Hz),7.40 (2H, d, J = 8.3 Hz), 8.07 (2H, d, J = 8.3 Hz), 8.07 (1H, s), 11.23 (1H, s), 12.52 (1H, s)。
元素分析値:C21H23N3O3として
計算値:C, 68.75; H, 5.48; N, 12.03。
実測値:C, 68.82; H, 5.44; N, 12.00。
融点 272℃(アセトニトリル)
MS (ESI+): 350 (M+H)。
1H-NMR (DMSO-d6) δ: 1.73-1.89 (1H, m), 1.89-2.07 (1H, m), 2.38-2.49 (2H, m), 2.62(3H, s), 2.68-2.82 (2H, m), 6.80(1H, d, J = 6.8 Hz), 7.23 (1H, dd, J = 9.1, 6.8 Hz), 7.38 (1H, d, J = 9.1 Hz),7.40 (2H, d, J = 8.3 Hz), 8.07 (2H, d, J = 8.3 Hz), 8.07 (1H, s), 11.23 (1H, s), 12.52 (1H, s)。
元素分析値:C21H23N3O3として
計算値:C, 68.75; H, 5.48; N, 12.03。
実測値:C, 68.82; H, 5.44; N, 12.00。
実施例189
1−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロプロパンカルボン酸
1−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロプロパンカルボン酸
実施例182で得られた1−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロプロパンカルボン酸メチル(198mg,0.54mmol)を50%テトラヒドロフラン/エタノール(6.0ml)に入れ、更に5規定水酸化カリウム水溶液(1.0ml)を加えて40−50℃で3時間攪拌した。以下実施例186と同様にして白色の表題化合物(収量152mg,収率79.8%)を得た。
融点 330−331℃(ジメチルスルホキシド/エタノール)
MS (ESI+): 356 (M+H)。
1H-NMR (DMSO-d6) δ: 1.15-1.25 (2H, m), 1.45-1.53 (2H, m), 7.29 (1H, dd, J = 9.5, 1.9 Hz), 7.46 (2H, d, J = 8.3 Hz), 7.50 (1H, d, J = 9.5 Hz), 8.00 (2H, d, J = 8.3 Hz), 8.34 (1H, s), 8.88 (1H, d, J = 1.9 Hz), 11.28 (1H, s), 12.48 (1H, s)。
元素分析値:C18H14N3O3Clとして
計算値:C, 60.77; H, 3.97; N, 11.81。
実測値:C, 60.36; H, 4.12; N, 11.57。
融点 330−331℃(ジメチルスルホキシド/エタノール)
MS (ESI+): 356 (M+H)。
1H-NMR (DMSO-d6) δ: 1.15-1.25 (2H, m), 1.45-1.53 (2H, m), 7.29 (1H, dd, J = 9.5, 1.9 Hz), 7.46 (2H, d, J = 8.3 Hz), 7.50 (1H, d, J = 9.5 Hz), 8.00 (2H, d, J = 8.3 Hz), 8.34 (1H, s), 8.88 (1H, d, J = 1.9 Hz), 11.28 (1H, s), 12.48 (1H, s)。
元素分析値:C18H14N3O3Clとして
計算値:C, 60.77; H, 3.97; N, 11.81。
実測値:C, 60.36; H, 4.12; N, 11.57。
実施例190
1−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロブタンカルボン酸
1−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロブタンカルボン酸
実施例183で得られた1−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロブタンカルボン酸メチル(218mg,0.57mmol)を用いて実施例189と同様に行い白色の表題化合物(収量163mg,収率77.6%)を得た。
融点 317.7℃ (decompose)(ジメチルスルホキシド/エタノール)
MS (ESI+): 370 (M+H)。
1H-NMR (DMSO-d6) δ: 1.71-2.08 (2H, m), 2.36-2.52 (2H, m), 2.68-2.82 (2H, m), 7.29 (1H, dd, J = 9.5, 1.9 Hz), 7.40 (2H, d, J = 8.3 Hz), 7.51 (1H, d, J = 9.5 Hz), 8.05 (2H, d, J = 8.3 Hz), 8.34 (1H, s), 8.89 (1H, d, J = 1.9 Hz), 11.28 (1H, s), 12.54 (1H, s)。
元素分析値:C19H16N3O3Clとして
計算値:C, 61.71; H, 4.36; N, 11.36。
実測値:C, 61.55; H, 4.35; N, 11.31。
融点 317.7℃ (decompose)(ジメチルスルホキシド/エタノール)
MS (ESI+): 370 (M+H)。
1H-NMR (DMSO-d6) δ: 1.71-2.08 (2H, m), 2.36-2.52 (2H, m), 2.68-2.82 (2H, m), 7.29 (1H, dd, J = 9.5, 1.9 Hz), 7.40 (2H, d, J = 8.3 Hz), 7.51 (1H, d, J = 9.5 Hz), 8.05 (2H, d, J = 8.3 Hz), 8.34 (1H, s), 8.89 (1H, d, J = 1.9 Hz), 11.28 (1H, s), 12.54 (1H, s)。
元素分析値:C19H16N3O3Clとして
計算値:C, 61.71; H, 4.36; N, 11.36。
実測値:C, 61.55; H, 4.35; N, 11.31。
実施例191
1−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロペンタンカルボン酸
1−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロペンタンカルボン酸
実施例184で得られた1−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}シクロペンタンカルボン酸メチル(200mg,0.50mmol)を用いて実施例189と同様に行い白色の表題化合物(収量153mg,収率79.3%)を得た。
融点 313℃ (decompose) (ジメチルスルホキシド/エタノール)
MS (ESI+): 384 (M+H)。
1H-NMR (DMSO-d6) δ: 1.55-1.77 (4H, m), 1.77-1.95 (2H, m), 2.50-2.65 (2H, m), 7.29 (1H, dd, J = 9.5, 2.3 Hz), 7.47 (2H, d, J = 8.3 Hz), 7.51 (1H, d, J = 9.5 Hz), 8.02 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.88 (1H, d, J = 2.3 Hz), 11.26 (1H, s), 12.45 (1H, s)。
元素分析値:C20H18N3O3Clとして
計算値:C, 62.58; H, 4.73; N, 10.95; Cl, 9.24。
実測値:C, 62.20; H, 4.69; N, 10.81; Cl, 9.19。
融点 313℃ (decompose) (ジメチルスルホキシド/エタノール)
MS (ESI+): 384 (M+H)。
1H-NMR (DMSO-d6) δ: 1.55-1.77 (4H, m), 1.77-1.95 (2H, m), 2.50-2.65 (2H, m), 7.29 (1H, dd, J = 9.5, 2.3 Hz), 7.47 (2H, d, J = 8.3 Hz), 7.51 (1H, d, J = 9.5 Hz), 8.02 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.88 (1H, d, J = 2.3 Hz), 11.26 (1H, s), 12.45 (1H, s)。
元素分析値:C20H18N3O3Clとして
計算値:C, 62.58; H, 4.73; N, 10.95; Cl, 9.24。
実測値:C, 62.20; H, 4.69; N, 10.81; Cl, 9.19。
実施例192
1−(4−{[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)シクロヘキサンカルボン酸
1−(4−{[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)シクロヘキサンカルボン酸
実施例185で得られた1−(4−{[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)アミノ]カルボニル}フェニル)シクロヘキサンカルボン酸メチル(145mg,0.36mmol)を用いて実施例189と同様に行い白色の表題化合物(収量98mg,収率70.1%)を得た。
融点 288℃ (ジメチルスルホキシド/水)
MS (ESI+): 398 (M+H)。
1H-NMR (DMSO-d6) δ: 1.16-1.81 (8H, m), 2.25-2.34 (2H, m), 7.29 (1H, dd, J = 9.4, 2.1 Hz), 7.51 (1H, d, J = 9.4 Hz), 7.52 (2H, d, J = 8.5 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 8.88 (1H, d, J = 2.1 Hz), 11.26 (1H, s), 12.52 (1H, s)。
元素分析値:C21H20N3O3Clとして
計算値:C, 63.40; H, 5.07; N, 10.56。
実測値:C, 63.16; H, 5.03; N, 10.37。
融点 288℃ (ジメチルスルホキシド/水)
MS (ESI+): 398 (M+H)。
1H-NMR (DMSO-d6) δ: 1.16-1.81 (8H, m), 2.25-2.34 (2H, m), 7.29 (1H, dd, J = 9.4, 2.1 Hz), 7.51 (1H, d, J = 9.4 Hz), 7.52 (2H, d, J = 8.5 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 8.88 (1H, d, J = 2.1 Hz), 11.26 (1H, s), 12.52 (1H, s)。
元素分析値:C21H20N3O3Clとして
計算値:C, 63.40; H, 5.07; N, 10.56。
実測値:C, 63.16; H, 5.03; N, 10.37。
実施例193
N−[3−ブロモ−5−(ヒドロキシメチル)イミダゾ[1,2−a]ピリジン−2−イル]−4−tert−ブチルベンズアミド
N−[3−ブロモ−5−(ヒドロキシメチル)イミダゾ[1,2−a]ピリジン−2−イル]−4−tert−ブチルベンズアミド
参考例40で得られたN−[3−ブロモ−5−(ブロモメチル)イミダゾ[1,2−a]ピリジン−2−イル]−4−tert−ブチル−N−(4−tert−ブチルベンゾイル)ベンズアミド(1.00g,1.57mmol)及び酢酸カリウム(1.57g,15.7mmol)を25%クロロホルム/エタノール混合溶媒(20ml)に入れ、還流下60分攪拌した。冷却後溶媒を減圧溜去し、得られた粗製物を塩化メチレン(200ml)に溶かし、飽和炭酸水素ナトリウム水溶液及び飽和食塩水で順に洗浄し、無水硫酸マグネシウムで乾燥、ろ過後溶媒を減圧溜去して黄色の粗製固体を得た。この粗製物をメタノール(20ml)に溶かしてナトリウムメトキシド(28%メタノール溶液,1.51g,7.84mmol)を加えて室温で60分攪拌した。その後反応溶液に水(50ml)を加え、析出した黄白色の固体をろ取し、水、アセトニトリル及びジエチルエーテルで洗浄して乾燥後黄白色の表題化合物(収量506mg,収率80%)を得た。
MS (ESI+): 402 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 5.23 (2H, d, J = 5.5 Hz), 5.71 (1H, t, J = 5.5 Hz), 7.08 (1H, dd, J = 7.0, 0.8 Hz), 7.33 (1H, dd, J = 8.9, 7.0 Hz), 7.52 (1H, d, J = 8.9, 0.8 Hz), 7.55 (2H, d, J = 8.5 Hz), 7.95 (2H, d, J = 8.5 Hz), 10.33 (1H, s)。
元素分析値:C19H20BrN3O2・0.3H2Oとして
計算値:C, 55.97; H, 5.09; N, 10.31。
実測値:C, 55.95; H, 5.08; N, 10.39。
MS (ESI+): 402 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 5.23 (2H, d, J = 5.5 Hz), 5.71 (1H, t, J = 5.5 Hz), 7.08 (1H, dd, J = 7.0, 0.8 Hz), 7.33 (1H, dd, J = 8.9, 7.0 Hz), 7.52 (1H, d, J = 8.9, 0.8 Hz), 7.55 (2H, d, J = 8.5 Hz), 7.95 (2H, d, J = 8.5 Hz), 10.33 (1H, s)。
元素分析値:C19H20BrN3O2・0.3H2Oとして
計算値:C, 55.97; H, 5.09; N, 10.31。
実測値:C, 55.95; H, 5.08; N, 10.39。
実施例194
4−tert−ブチル−N−[5−(ヒドロキシメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[5−(ヒドロキシメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例193で得られたN−[3−ブロモ−5−(ヒドロキシメチル)イミダゾ[1,2−a]ピリジン−2−イル]−4−tert−ブチルベンズアミド(200mg,0.49mmol)をテトラヒドロフラン(15ml)中に懸濁し、超音波洗浄機にて細かく粉砕した。その後この懸濁液を−78℃に冷却し、n−ブチルリチウム(1.6Mヘキサン溶液,1.37ml,2.19mmol)を加えた後30分間攪拌すると懸濁液は橙色の溶液となった。その後反応溶液にメタノール(1ml)を加え、水(40ml)に注いだ。塩化メチレン(50ml)で3回抽出した後有機層を合わせ、10%チオ硫酸ナトリウム水溶液(10ml)及び飽和食塩水で順に洗浄し、無水硫酸マグネシウムで乾燥、ろ過後溶媒を減圧溜去して黄色の粗製固体を得た。この粗製物をトルエン/ジエチルエーテル(1/2)混合溶媒(12ml)で洗浄して白色固体の表題化合物(収量147mg,収率93.6%)を得た。
融点 229−230℃(アセトニトリル)
MS (ESI+): 324 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 4.77 (2H, d, J = 5.5 Hz), 5.73 (1H, t, J = 5.5 Hz), 6.93 (1H, d, J = 8.0 Hz), 7.28 (1H, dd, J = 8.9, 8.0 Hz), 7.43 (1H, d, J = 8.9 Hz), 7.54 (2H, d, J = 8.5 Hz), 8.03 (2H, d, J = 8.5 Hz), 8. 20 (1H, s), 11.15 (1H, s)。
融点 229−230℃(アセトニトリル)
MS (ESI+): 324 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (9H, s), 4.77 (2H, d, J = 5.5 Hz), 5.73 (1H, t, J = 5.5 Hz), 6.93 (1H, d, J = 8.0 Hz), 7.28 (1H, dd, J = 8.9, 8.0 Hz), 7.43 (1H, d, J = 8.9 Hz), 7.54 (2H, d, J = 8.5 Hz), 8.03 (2H, d, J = 8.5 Hz), 8. 20 (1H, s), 11.15 (1H, s)。
実施例195
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
6−クロロイミダゾ[1,2−b]ピリダジン−2−アミン(3.37g, 20.0mmol)、4−tert−ブチルベンゾイルクロリド(4.00g,20.3mmol)、N,N−ジメチルアセトアミド(50mL)の混合物を室温で1時間攪拌した。反応混合物を水に注ぎ、析出した固体をろ取し、水、ついでイソプロピルエーテルで洗浄して表題化合物(5.88g,89%)を淡黄色結晶として得た。
1H-NMR (CDCl3) δ: 1.36 (9H, s), 6.99 (1H, d, J = 9.2 Hz), 7.43 (1H, d, J = 9.2 Hz), 7.48-7.53 (2H, m), 7.90-7.96 (2H, m), 8.62 (1H, s), 9.80 (1H, s)。
LC-MS 329(M+H), 351(M+Na).
1H-NMR (CDCl3) δ: 1.36 (9H, s), 6.99 (1H, d, J = 9.2 Hz), 7.43 (1H, d, J = 9.2 Hz), 7.48-7.53 (2H, m), 7.90-7.96 (2H, m), 8.62 (1H, s), 9.80 (1H, s)。
LC-MS 329(M+H), 351(M+Na).
実施例196
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(86mg,0.26mmol)、1H−イミダゾール(340mg,5.0mmol)、炭酸カリウム(690mg,5.0mmol)、N,N−ジメチルホルムアミド(2mL)の混合物を120℃で5時間加熱攪拌した。反応混合物を水に注ぎ、析出した固体をろ取し、水、次いでイソプロピルエーテルで洗浄して表題化合物(55mg,59%)を淡黄色結晶として得た。
1H NMR (CDCl3) δ: 1.37 (9H, s), 7.20 (1H, d, J = 9.6 Hz), 7.54 (2H, d, J = 8.3 Hz), 7.66 (1H, s), 7.76 (1H, d, J = 9.6 Hz), 7.91 (2H, d, J = 8.3 Hz), 8.26 (1H, s), 8.64 (1H, s), 9.11 (1H, s).
LC-MS 361(M+H), 383(M+Na).
1H NMR (CDCl3) δ: 1.37 (9H, s), 7.20 (1H, d, J = 9.6 Hz), 7.54 (2H, d, J = 8.3 Hz), 7.66 (1H, s), 7.76 (1H, d, J = 9.6 Hz), 7.91 (2H, d, J = 8.3 Hz), 8.26 (1H, s), 8.64 (1H, s), 9.11 (1H, s).
LC-MS 361(M+H), 383(M+Na).
実施例197
4−tert−ブチル−N−[6−(1H−ピラゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(1H−ピラゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
実施例196と同様にして、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドから収率61%で表題化合物を合成した。
1H-NMR (CDCl3) δ: 1.36 (9H, s), 6.55 (1H, dd, J = 2.6, 1.7 Hz), 7.49-7.55 (2H, m), 7.65 (1H, d, J = 9.6 Hz), 7.79 (1H, d, J = 1.1 Hz), 7.85-7.95 (3H, m), 8.50 (1H, d, J = 2.1 Hz), 8.58 (1H, s), 9.28 (1H, s)。
LC-MS 361(M+H), 383(M+Na).
1H-NMR (CDCl3) δ: 1.36 (9H, s), 6.55 (1H, dd, J = 2.6, 1.7 Hz), 7.49-7.55 (2H, m), 7.65 (1H, d, J = 9.6 Hz), 7.79 (1H, d, J = 1.1 Hz), 7.85-7.95 (3H, m), 8.50 (1H, d, J = 2.1 Hz), 8.58 (1H, s), 9.28 (1H, s)。
LC-MS 361(M+H), 383(M+Na).
実施例198
4−tert−ブチル−N−[6−(1H−1,2,4−トリアゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(1H−1,2,4−トリアゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
実施例196と同様にして、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドから収率39%で表題化合物を合成した。
1H-NMR (CDCl3) δ: 1.36 (9H, s), 7.49-7.57 (2H, m), 7.66-7.79 (2H, m), 7.87-7.97 (2H, m), 8.16 (1H, s), 8.66 (1H, s), 9.13 (1H, s), 9.40 (1H, s)。
LC-MS 362(M+H), 384(M+Na).
1H-NMR (CDCl3) δ: 1.36 (9H, s), 7.49-7.57 (2H, m), 7.66-7.79 (2H, m), 7.87-7.97 (2H, m), 8.16 (1H, s), 8.66 (1H, s), 9.13 (1H, s), 9.40 (1H, s)。
LC-MS 362(M+H), 384(M+Na).
実施例199
4−tert−ブチル−N−[6−(2−メチル−1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(2−メチル−1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
実施例196と同様にして、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドから収率25%で表題化合物を合成した。
LC-MS 375(M+H).
LC-MS 375(M+H).
実施例200
4−tert−ブチル−N−(6−フェニルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
4−tert−ブチル−N−(6−フェニルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(71mg,0.22mmol)、ジヒドロキシフェニルボラン(40mg,0.33mmol)、炭酸カリウム(30mg,0.22mmol),PS−PPh3−Pd(50mg、0.005mmol of Pd)、1,2−ジメトキシエタン(10mL)、エタノール(5mL)、水(5mL)の混合物を100℃で14時間攪拌した。樹脂試薬をろ過で除き、ろ液を濃縮して残留物を分取HPLCで精製して表題化合物(22mg, 27%)を淡黄色結晶として得た。
1H-NMR (CDCl3) δ: 1.36 (9H, s), 7.44-7.59 (6H, m), 7.68 (1H, d, J = 9.4 Hz), 7.88-8.00 (4H, m), 8.67 (1H, s), 9.28 (1H, s)。
LC-MS 371(M+H), 393(M+Na).
1H-NMR (CDCl3) δ: 1.36 (9H, s), 7.44-7.59 (6H, m), 7.68 (1H, d, J = 9.4 Hz), 7.88-8.00 (4H, m), 8.67 (1H, s), 9.28 (1H, s)。
LC-MS 371(M+H), 393(M+Na).
実施例201
4−tert−ブチル−N−イミダゾ[1,2−b]ピリダジン−2−イルベンズアミド
4−tert−ブチル−N−イミダゾ[1,2−b]ピリダジン−2−イルベンズアミド
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(50mg,0.152mmol)、パラジウム炭素(20mg)、エタノール(5mL)、テトラヒドロフラン(5mL)の混合物を大気圧の水素雰囲気下、室温で14時間攪拌した。不溶物をろ過で除き、ろ液を濃縮して残留物を分取HPLCで精製して表題化合物(22mg, 27%)を黄色結晶として得た。
1H-NMR (CDCl3) δ: 1.36 (9H, s), 6.99 (1H, dd, J = 9.1, 4.6 Hz), 7.47-7.60 (3H, m), 7.86-7.95 (2H, m), 8.30 (1H, dd, J = 4.6, 1.6 Hz), 8.64 (1H, s), 9.27 (1H, s)。
LC-MS 295(M+H), 317(M+Na).
1H-NMR (CDCl3) δ: 1.36 (9H, s), 6.99 (1H, dd, J = 9.1, 4.6 Hz), 7.47-7.60 (3H, m), 7.86-7.95 (2H, m), 8.30 (1H, dd, J = 4.6, 1.6 Hz), 8.64 (1H, s), 9.27 (1H, s)。
LC-MS 295(M+H), 317(M+Na).
実施例202
4−tert−ブチル−N−(6−ピリジン−3−イルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
4−tert−ブチル−N−(6−ピリジン−3−イルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(330mg,1.0mmol)、ピリジン−3−イルボロン酸(190mg,1.5mmol)、1規定炭酸カリウム水溶液(1mL,1.0mmol),PS−PPh3−Pd(100mg、0.01mmol of Pd)、1,2−ジメトキシエタン(2mL)の混合物を封管中、マイクロウェーブ反応装置を用い160℃で20分間攪拌した。樹脂試薬をろ過で除き、ろ液を酢酸エチルで希釈、水で洗浄後、濃縮して残留物を分取HPLCで精製して表題化合物(55mg,17%)を淡黄色結晶として得た。
1H-NMR (CDCl3) δ: 1.37 (9H, s), 7.41-7.59 (4H, m), 7.75 (1H, d, J = 9.4 Hz), 7.92 (2H, d, J = 8.5 Hz), 8.29-8.37 (1H, m), 8.70 (1H, s), 8.74 (1H, dd, J = 4.7, 1.5 Hz), 9.03-9.12 (1H, m), 9.18 (1H, d, J = 1.7 Hz)。
LC-MS 372(M+H), 394(M+Na).
1H-NMR (CDCl3) δ: 1.37 (9H, s), 7.41-7.59 (4H, m), 7.75 (1H, d, J = 9.4 Hz), 7.92 (2H, d, J = 8.5 Hz), 8.29-8.37 (1H, m), 8.70 (1H, s), 8.74 (1H, dd, J = 4.7, 1.5 Hz), 9.03-9.12 (1H, m), 9.18 (1H, d, J = 1.7 Hz)。
LC-MS 372(M+H), 394(M+Na).
実施例203
4−tert−ブチル−N−(6−メチルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
4−tert−ブチル−N−(6−メチルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(33mg,0.1mmol)、メチルボロン酸(30mg,1.0mmol)、炭酸カリウム(27mg,0.2mmol),PS−PPh3−Pd(50mg、0.005mmol of Pd)、1,4−ジオキサン(3mL)の混合物を100℃で12時間攪拌した。樹脂試薬をろ過で除き、ろ液を酢酸エチルで希釈、水で洗浄後、濃縮して残留物を分取HPLCで精製して表題化合物(5.0mg,16%)を淡黄色油状物として得た。
LC-MS 309(M+H), 331(M+Na).
LC-MS 309(M+H), 331(M+Na).
実施例204
4−tert−ブチル−N−{6−[3−(トリフルオロメチル)フェニル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド トリフルオロ酢酸塩
4−tert−ブチル−N−{6−[3−(トリフルオロメチル)フェニル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド トリフルオロ酢酸塩
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(25mg,0.076mmol)、[3−(トリフルオロメチル)フェニル]ボロン酸(57mg,0.3mmol)、炭酸カリウム(138mg,1.0mmol)、PS−PPh3−Pd(50mg、0.005mmol of Pd)、1,2−ジメトキシエタン(2mL)、エタノール(1mL)、水(1mL)の混合物を100℃で14時間攪拌した。樹脂試薬をろ過で除き、ろ液を濃縮して残留物を分取HPLCで精製して表題化合物(7.0mg,17%)を得た。
LC-MS 439(M+H), 461(M+Na).
LC-MS 439(M+H), 461(M+Na).
実施例204と同様の方法に従い、実施例205〜213の化合物を合成した。
実施例205
4−{2−[(4−tert−ブチルベンゾイル)アミノ]イミダゾ[1,2−b]ピリダジン−6−イル}安息香酸メチル トリフルオロ酢酸塩
4−{2−[(4−tert−ブチルベンゾイル)アミノ]イミダゾ[1,2−b]ピリダジン−6−イル}安息香酸メチル トリフルオロ酢酸塩
実施例204と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと[4−(メトキシカルボニル)フェニル]ボロン酸の反応により、収率11%で表題化合物を合成した。
LC-MS 429(M+H), 451(M+Na).
LC-MS 429(M+H), 451(M+Na).
実施例206
4−{2−[(4−tert−ブチルベンゾイル)アミノ]イミダゾ[1,2−b]ピリダジン−6−イル}安息香酸エチル トリフルオロ酢酸塩
4−{2−[(4−tert−ブチルベンゾイル)アミノ]イミダゾ[1,2−b]ピリダジン−6−イル}安息香酸エチル トリフルオロ酢酸塩
実施例205の反応における副生成物(溶媒のエタノールによるエステル交換反応の結果)として表題化合物を収率6%で得た。
LC-MS 443(M+H), 465(M+Na).
LC-MS 443(M+H), 465(M+Na).
実施例207
N−{6−[3−(アセチルアミノ)フェニル]イミダゾ[1,2−b]ピリダジン−2−イル}−4−tert−ブチルベンズアミド トリフルオロ酢酸塩
N−{6−[3−(アセチルアミノ)フェニル]イミダゾ[1,2−b]ピリダジン−2−イル}−4−tert−ブチルベンズアミド トリフルオロ酢酸塩
実施例204と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと[3−(アセチルアミノ)フェニル]ボロン酸の反応により、収率24%で表題化合物を合成した。
LC-MS 428(M+H).
LC-MS 428(M+H).
実施例208
4−tert−ブチル−N−{6−[3−(トリフルオロメトキシ)フェニル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド トリフルオロ酢酸塩
4−tert−ブチル−N−{6−[3−(トリフルオロメトキシ)フェニル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド トリフルオロ酢酸塩
実施例204と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと[3−(トリフルオロメトキシ)フェニル]ボロン酸の反応により、収率2.3%で表題化合物を合成した。
LC-MS 455(M+H), 477(M+Na).
LC-MS 455(M+H), 477(M+Na).
実施例209
4−tert−ブチル−N−{6−[4−(ジメチルアミノ)フェニル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 2トリフルオロ酢酸塩
4−tert−ブチル−N−{6−[4−(ジメチルアミノ)フェニル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 2トリフルオロ酢酸塩
実施例204と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと[4−(ジメチルアミノ)フェニル]ボロン酸の反応により、収率2.5%で表題化合物を合成した。
LC-MS 414(M+H), 436(M+Na).
LC-MS 414(M+H), 436(M+Na).
実施例210
4−tert−ブチル−N−[6−(4−メトキシフェニル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド トリフルオロ酢酸塩
4−tert−ブチル−N−[6−(4−メトキシフェニル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド トリフルオロ酢酸塩
実施例204と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと(4−メトキシフェニル)ボロン酸の反応により、収率25%で表題化合物を合成した。
1H-NMR (CDCl3) δ: 1.37 (9H, s), 3.91 (3H, s), 7.05-7.10 (2H, m), 7.57 (2H, d, J = 8.7 Hz), 7.78 (1H, d, J = 9.6 Hz), 7.94-7.99 (2H, m), 8.06 (1H, d, J = 9.4 Hz), 8.11 (2H, d, J = 8.5 Hz), 8.75 (1H, s), 11.87 (1H, s)。
LC-MS 401(M+H).
1H-NMR (CDCl3) δ: 1.37 (9H, s), 3.91 (3H, s), 7.05-7.10 (2H, m), 7.57 (2H, d, J = 8.7 Hz), 7.78 (1H, d, J = 9.6 Hz), 7.94-7.99 (2H, m), 8.06 (1H, d, J = 9.4 Hz), 8.11 (2H, d, J = 8.5 Hz), 8.75 (1H, s), 11.87 (1H, s)。
LC-MS 401(M+H).
実施例211
4−tert−ブチル−N−[6−(4−シアノフェニル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド トリフルオロ酢酸塩
4−tert−ブチル−N−[6−(4−シアノフェニル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド トリフルオロ酢酸塩
実施例204と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと(4−シアノフェニル)ボロン酸の反応により、収率10%で表題化合物を合成した。
LC-MS 396 (M+H), 418(M+Na).
LC-MS 396 (M+H), 418(M+Na).
実施例212
4−tert−ブチル−N−{6−[4−(メチルスルホニル)フェニル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 2トリフルオロ酢酸塩
4−tert−ブチル−N−{6−[4−(メチルスルホニル)フェニル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 2トリフルオロ酢酸塩
実施例204と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと[4−(メチルスルホニル)フェニル]ボロン酸の反応により、収率22%で表題化合物を合成した。
LC-MS 449(M+H), 471(M+Na).
LC-MS 449(M+H), 471(M+Na).
実施例213
4−tert−ブチル−N−(6−ピリミジン−5−イルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド 2トリフルオロ酢酸塩
4−tert−ブチル−N−(6−ピリミジン−5−イルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド 2トリフルオロ酢酸塩
実施例204と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと(ピリミジン−5−イル)ボロン酸の反応により、収率3.5%で表題化合物を合成した。
LC-MS 373(M+H), 395(M+Na).
LC-MS 373(M+H), 395(M+Na).
実施例214
4−tert−ブチル−N−[6−(1H−ピロール−2−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド ギ酸塩
4−tert−ブチル−N−[6−(1H−ピロール−2−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド ギ酸塩
実施例204と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと[1−(tert−ブトキシカルボニル)−1H−ピロール−2−イル]ボロン酸の反応を行った。反応混合物を分取HPLC(グラジエントサイクル:B)で精製して、収率3.4%で表題化合物を合成した。
LC-MS 360 (M+H), 382 (M+Na).
LC-MS 360 (M+H), 382 (M+Na).
実施例215
4−tert−ブチル−N−[6−(3−フリル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド ギ酸塩
4−tert−ブチル−N−[6−(3−フリル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド ギ酸塩
実施例214と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと3−フリルボロン酸の反応により、収率2.5%で表題化合物を合成した。
LC-MS 361 (M+H), 383 (M+Na).
LC-MS 361 (M+H), 383 (M+Na).
実施例216
N−[6−(1,3−ベンゾジオキソール−5−イル)イミダゾ[1,2−b]ピリダジン−2−イル]−4−tert−ブチルベンズアミド ギ酸塩
N−[6−(1,3−ベンゾジオキソール−5−イル)イミダゾ[1,2−b]ピリダジン−2−イル]−4−tert−ブチルベンズアミド ギ酸塩
実施例214と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと(1,3−ベンゾジオキソール−5−イル)ボロン酸の反応により、収率4.3%で表題化合物を合成した。
LC-MS 415 (M+H).
LC-MS 415 (M+H).
実施例217
4−tert−ブチル−N−(6−モルホリン−4−イルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド 2ギ酸塩
4−tert−ブチル−N−(6−モルホリン−4−イルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド 2ギ酸塩
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(33mg,0.10mmol)、モルホリン(0.2mL)、N,N−ジメチルホルムアミド(3mL)の混合物を封管中、マイクロウェーブ反応装置を用い180℃で20分間攪拌した。反応混合物を分取HPLCで精製して表題化合物(10.1mg、収率21%)を黄色油状物として得た。
LC-MS 380(M+H), 402(M+Na).
LC-MS 380(M+H), 402(M+Na).
実施例218
4−tert−ブチル−N−{6−[メチル(ピリジン−2−イルメチル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 3トリフルオロ酢酸塩
4−tert−ブチル−N−{6−[メチル(ピリジン−2−イルメチル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 3トリフルオロ酢酸塩
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(33mg,0.10mmol)、メチル(ピリジン−2−イルメチル)アミン(41mg)、N,N−ジメチルホルムアミド(2mL)の混合物を封管中、マイクロウェーブ反応装置を用い220℃で10分間攪拌した。反応混合物を分取HPLCで精製して表題化合物(7.7mg,収率10%)を黄色油状物として得た。
LC-MS 415(M+H).
LC-MS 415(M+H).
実施例219
4−tert−ブチル−N−{6−[メチル(2−ピリジン−2−イルエチル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 3トリフルオロ酢酸塩
4−tert−ブチル−N−{6−[メチル(2−ピリジン−2−イルエチル)アミノ]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 3トリフルオロ酢酸塩
実施例218と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドとメチル(2−ピリジン−2−イルエチル)アミンから収率10%で表題化合物を合成した。
LC-MS 429(M+H), 451(M+Na).
LC-MS 429(M+H), 451(M+Na).
実施例220
4−tert−ブチル−N−[6−(2−ピリジン−2−イルピロリジン−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 3トリフルオロ酢酸塩
4−tert−ブチル−N−[6−(2−ピリジン−2−イルピロリジン−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 3トリフルオロ酢酸塩
実施例218と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと2−(ピロリジン−2−イル)ピリジンから収率13%で表題化合物を合成した。
LC-MS 441(M+H), 463(M+Na).
LC-MS 441(M+H), 463(M+Na).
実施例221
4−tert−ブチル−N−[6−(2−ピリジン−3−イルピロリジン−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 3トリフルオロ酢酸塩
4−tert−ブチル−N−[6−(2−ピリジン−3−イルピロリジン−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 3トリフルオロ酢酸塩
実施例218と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと3−(ピロリジン−2−イル)ピリジンから収率1.4%で表題化合物を合成した。
LC-MS 441(M+H), 463(M+Na).
LC-MS 441(M+H), 463(M+Na).
実施例222
4−tert−ブチル−N−[6−(2−ピリジン−4−イルピロリジン−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 3トリフルオロ酢酸塩
4−tert−ブチル−N−[6−(2−ピリジン−4−イルピロリジン−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 3トリフルオロ酢酸塩
実施例218と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと4−(ピロリジン−2−イル)ピリジンから収率0.6%で表題化合物を合成した。
LC-MS 441(M+H), 463(M+Na).
LC-MS 441(M+H), 463(M+Na).
実施例223
4−tert−ブチル−N−{6−[2−(ピリジン−3−イルメチル)ピロリジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 3トリフルオロ酢酸塩
4−tert−ブチル−N−{6−[2−(ピリジン−3−イルメチル)ピロリジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 3トリフルオロ酢酸塩
実施例218と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと3−(ピロリジン−2−イルメチル)ピリジンから収率5.8%で表題化合物を合成した。
LC-MS 455(M+H), 477(M+Na).
LC-MS 455(M+H), 477(M+Na).
実施例224
4−tert−ブチル−N−{6−[4−(ピリジン−2−イルメチル)ピペラジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 4トリフルオロ酢酸塩
4−tert−ブチル−N−{6−[4−(ピリジン−2−イルメチル)ピペラジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 4トリフルオロ酢酸塩
実施例218と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと1−(ピリジン−2−イルメチル)ピペラジンから収率14%で表題化合物を合成した。
LC-MS 470(M+H), 492(M+Na).
LC-MS 470(M+H), 492(M+Na).
実施例225
4−tert−ブチル−N−{6−[4−(ピリジン−3−イルメチル)ピペラジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 4トリフルオロ酢酸塩
4−tert−ブチル−N−{6−[4−(ピリジン−3−イルメチル)ピペラジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 4トリフルオロ酢酸塩
実施例218と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと1−(ピリジン−3−イルメチル)ピペラジンから収率24%で表題化合物を合成した。
1HNMR (CDCl3) δ: 1.36 (9H, s), 3.20-3.27 (4H, m), 3.85-3.95 (4H, m), 4.32 (2H, s), 7.14 (1H, d, J = 10.0 Hz), 7.55 (2H, d, J = 8.7 Hz), 7.88 (1H, dd, J = 7.9, 5.3 Hz), 7.99 (1H, d, J = 9.6 Hz), 8.07 (2H, d, J = 8.5 Hz), 8.47 (1H, s), 8.49 (1H, s), 8.81 (1H, dd, J = 5.6, 1.2 Hz), 9.11 (1H, d, J = 1.7 Hz), 12.00 (1H, s)。
LC-MS 470(M+H), 492(M+Na).
1HNMR (CDCl3) δ: 1.36 (9H, s), 3.20-3.27 (4H, m), 3.85-3.95 (4H, m), 4.32 (2H, s), 7.14 (1H, d, J = 10.0 Hz), 7.55 (2H, d, J = 8.7 Hz), 7.88 (1H, dd, J = 7.9, 5.3 Hz), 7.99 (1H, d, J = 9.6 Hz), 8.07 (2H, d, J = 8.5 Hz), 8.47 (1H, s), 8.49 (1H, s), 8.81 (1H, dd, J = 5.6, 1.2 Hz), 9.11 (1H, d, J = 1.7 Hz), 12.00 (1H, s)。
LC-MS 470(M+H), 492(M+Na).
実施例226
4−tert−ブチル−N−{6−[4−(ピリジン−4−イルメチル)ピペラジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 4トリフルオロ酢酸塩
4−tert−ブチル−N−{6−[4−(ピリジン−4−イルメチル)ピペラジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 4トリフルオロ酢酸塩
実施例218と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと1−(ピリジン−4−イルメチル)ピペラジンから収率17%で表題化合物を合成した。
LC-MS 470(M+H), 492(M+Na).
LC-MS 470(M+H), 492(M+Na).
実施例227
実施例218と同様の方法に従い、4−tert−ブチル−N−{6−[4−(ピリジン−2−イルメチル)ピペリジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 3トリフルオロ酢酸塩
実施例218と同様の方法に従い、4−tert−ブチル−N−{6−[4−(ピリジン−2−イルメチル)ピペリジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 3トリフルオロ酢酸塩
実施例218と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと4−(ピリジン−2−イルメチル)ピペリジンから収率7.2%で表題化合物を合成した。
LC-MS 469(M+H), 491(M+Na).
LC-MS 469(M+H), 491(M+Na).
実施例228
4−tert−ブチル−N−{6−[4−(ピリジン−3−イルメチル)ピペリジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 3トリフルオロ酢酸塩
4−tert−ブチル−N−{6−[4−(ピリジン−3−イルメチル)ピペリジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 3トリフルオロ酢酸塩
実施例218と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと4−(ピリジン−3−イルメチル)ピペリジンから収率5.2%で表題化合物を合成した。LC-MS 469(M+H), 491(M+Na).
実施例229
4−tert−ブチル−N−{6−[4−(ピリジン−4−イルメチル)ピペリジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 3トリフルオロ酢酸塩
4−tert−ブチル−N−{6−[4−(ピリジン−4−イルメチル)ピペリジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 3トリフルオロ酢酸塩
実施例218と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと4−(ピリジン−4−イルメチル)ピペリジンから収率3.5%で表題化合物を合成した。LC-MS 469(M+H), 491(M+Na).
実施例230
4−tert−ブチル−N−{6−[4−(フェニルスルホニル)ピペリジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 2トリフルオロ酢酸塩
4−tert−ブチル−N−{6−[4−(フェニルスルホニル)ピペリジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 2トリフルオロ酢酸塩
実施例218と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと4−(フェニルスルホニル)ピペリジンから収率2.0%で表題化合物を合成した。
LC-MS 518(M+H).
LC-MS 518(M+H).
実施例231
4−tert−ブチル−N−(6−チオモルホリン−4−イルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
4−tert−ブチル−N−(6−チオモルホリン−4−イルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(165mg,0.5mmol)、チオモルホリン(31mg,0.3mmol)、1,3−ジメチル−2−イミダゾリジノン(2mL)の混合物をマイクロウェーブ反応装置を用い、220℃で10分間加熱攪拌した。反応混合物を水に注ぎ、酢酸エチルで抽出した。酢酸エチル層を濃縮し、残留物をシリカゲルカラムクロマトグラフィー(酢酸エチル:ヘキサン=1:9〜4:1、容積比)で精製して表題化合物(90mg,収率46%)を得た。淡黄色結晶。
1H-NMR (CDCl3) δ: 1.35 (9H, s), 2.69-2.76 (4H, m), 3.85-3.91 (4H, m), 6.65 (1H, d, J = 10.0 Hz), 7.20 (1H, d, J = 9.6 Hz), 7.48 (2H, d, J = 8.5 Hz), 7.89 (2H, d, J = 8.5 Hz), 8.32 (1H, s), 9.63 (1H, s)。
1H-NMR (CDCl3) δ: 1.35 (9H, s), 2.69-2.76 (4H, m), 3.85-3.91 (4H, m), 6.65 (1H, d, J = 10.0 Hz), 7.20 (1H, d, J = 9.6 Hz), 7.48 (2H, d, J = 8.5 Hz), 7.89 (2H, d, J = 8.5 Hz), 8.32 (1H, s), 9.63 (1H, s)。
実施例232
4−tert−ブチル−N−(6−ピロリジン−1−イルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド 2トリフルオロ酢酸塩
4−tert−ブチル−N−(6−ピロリジン−1−イルイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド 2トリフルオロ酢酸塩
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(33mg,0.1mmol)、ピロリジン(10.5mg,0.15mmol)、炭酸カリウム(28.0mg,0.2mmol)、N,N−ジメチルホルムアミド(2mL)の混合物をマイクロウェーブ反応装置を用い、220℃で500秒間加熱攪拌した。反応混合物をろ過し、ろ液を分取HPLCで精製して表題化合物(11.7mg,収率20%)を得た。淡黄色結晶。
LC-MS 364(M+H).
LC-MS 364(M+H).
実施例233
4−tert−ブチル−N−[6−(3−ヒドロキシピロリジン−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 2トリフルオロ酢酸塩
4−tert−ブチル−N−[6−(3−ヒドロキシピロリジン−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 2トリフルオロ酢酸塩
実施例232と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと3−ヒドロキシピロリジンから収率15%で表題化合物を合成した。淡黄色結晶。
LC-MS 380(M+H).
LC-MS 380(M+H).
実施例234
4−tert−ブチル−N−[6−(ピロリジン−3−イルオキシ)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 2トリフルオロ酢酸塩
4−tert−ブチル−N−[6−(ピロリジン−3−イルオキシ)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 2トリフルオロ酢酸塩
実施例233の反応の副生成物として、収率10%で表題化合物を合成した。淡黄色結晶。
LC-MS 380(M+H).
LC-MS 380(M+H).
実施例235
4−tert−ブチル−N−[6−(4−ヒドロキシピペリジン−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 2トリフルオロ酢酸塩
4−tert−ブチル−N−[6−(4−ヒドロキシピペリジン−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 2トリフルオロ酢酸塩
実施例232と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと4−ヒドロキシピペリジンから収率8.7%で表題化合物を合成した。淡黄色結晶。
LC-MS 394(M+H).
LC-MS 394(M+H).
実施例236
4−tert−ブチル−N−[6−(ピペリジン−4−イルオキシ)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 2トリフルオロ酢酸塩
4−tert−ブチル−N−[6−(ピペリジン−4−イルオキシ)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 2トリフルオロ酢酸塩
実施例235の反応の副生成物として、収率6.4%で表題化合物を合成した。淡黄色結晶。
LC-MS 394(M+H).
LC-MS 394(M+H).
実施例237
4−tert−ブチル−N−[6−(3−ヒドロキシピペリジン−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 2トリフルオロ酢酸塩
4−tert−ブチル−N−[6−(3−ヒドロキシピペリジン−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 2トリフルオロ酢酸塩
実施例232と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと3−ヒドロキシピペリジンから収率9.5%で表題化合物を合成した。淡黄色結晶。
LC-MS 394(M+H).
LC-MS 394(M+H).
実施例238
4−tert−ブチル−N−[6−(ピペリジン−3−イルオキシ)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 2トリフルオロ酢酸塩
4−tert−ブチル−N−[6−(ピペリジン−3−イルオキシ)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 2トリフルオロ酢酸塩
実施例237の反応の副生成物として、収率5.8%で表題化合物を合成した。淡黄色結晶。
LC-MS 394(M+H).
LC-MS 394(M+H).
実施例239
4−tert−ブチル−N−{6−[(2S)−2−(メトキシメチル)ピロリジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 2トリフルオロ酢酸塩
4−tert−ブチル−N−{6−[(2S)−2−(メトキシメチル)ピロリジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 2トリフルオロ酢酸塩
実施例232と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと(2S)−2−(メトキシメチル)ピロリジンから収率2.0%で表題化合物を合成した。淡黄色結晶。
LC-MS 408(M+H).
LC-MS 408(M+H).
実施例240
4−tert−ブチル−N−[6−(1,3−ジヒドロ−2H−イソインドール−2−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 2トリフルオロ酢酸塩
4−tert−ブチル−N−[6−(1,3−ジヒドロ−2H−イソインドール−2−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド 2トリフルオロ酢酸塩
実施例232と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと1,3−ジヒドロ−2H−イソインドールから収率2.7%で表題化合物を合成した。淡黄色結晶。
LC-MS 412(M+H).
LC-MS 412(M+H).
実施例241
1−{2−[(4−tert−ブチルベンゾイル)アミノ]イミダゾ[1,2−b]ピリダジン−6−イル}ピペリジン−4−カルボキサミド 2トリフルオロ酢酸塩
1−{2−[(4−tert−ブチルベンゾイル)アミノ]イミダゾ[1,2−b]ピリダジン−6−イル}ピペリジン−4−カルボキサミド 2トリフルオロ酢酸塩
実施例232と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドとピペリジン−4−カルボキサミドから収率5.7%で表題化合物を合成した。淡黄色結晶。
LC-MS 421(M+H).
LC-MS 421(M+H).
実施例242
1−{2−[(4−tert−ブチルベンゾイル)アミノ]イミダゾ[1,2−b]ピリダジン−6−イル}ピペリジン−3−カルボキサミド 2トリフルオロ酢酸塩
1−{2−[(4−tert−ブチルベンゾイル)アミノ]イミダゾ[1,2−b]ピリダジン−6−イル}ピペリジン−3−カルボキサミド 2トリフルオロ酢酸塩
実施例232と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドとピペリジン−3−カルボキサミドから収率4.9%で表題化合物を合成した。淡黄色結晶。
LC-MS 421(M+H).
LC-MS 421(M+H).
実施例243
N−{6−[3−(アセチルアミノ)ピロリジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}−4−tert−ブチルベンズアミド 2トリフルオロ酢酸塩
N−{6−[3−(アセチルアミノ)ピロリジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}−4−tert−ブチルベンズアミド 2トリフルオロ酢酸塩
実施例232と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと3−(アセチルアミノ)ピロリジンから収率11%で表題化合物を合成した。淡黄色結晶。
LC-MS 421(M+H).
LC-MS 421(M+H).
実施例244
4−tert−ブチル−N−{6−[2−(2−ヒドロキシエチル)ピペリジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 2トリフルオロ酢酸塩
4−tert−ブチル−N−{6−[2−(2−ヒドロキシエチル)ピペリジン−1−イル]イミダゾ[1,2−b]ピリダジン−2−イル}ベンズアミド 2トリフルオロ酢酸塩
実施例232と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと2−(2−ヒドロキシエチル)ピペリジンから収率26%で表題化合物を合成した。淡黄色結晶。
LC-MS 422(M+H).
LC-MS 422(M+H).
実施例245
1−{2−[(4−tert−ブチルベンゾイル)アミノ]イミダゾ[1,2−b]ピリダジン−6−イル}ピペリジン−3−カルボン酸 2トリフルオロ酢酸塩
1−{2−[(4−tert−ブチルベンゾイル)アミノ]イミダゾ[1,2−b]ピリダジン−6−イル}ピペリジン−3−カルボン酸 2トリフルオロ酢酸塩
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(33mg,0.1mmol)、ピペリジン−3−カルボン酸エチル(23.0mg,0.15mmol)、炭酸カリウム(28.0mg,0.2mmol)、N,N−ジメチルホルムアミド(2mL)の混合物をマイクロウェーブ反応装置を用い、220℃で500秒間加熱攪拌した。反応混合物をろ過し、ろ液を分取HPLCで精製して表題化合物(6.9mg,収率11%)を得た。淡黄色結晶。
LC-MS 422(M+H).
LC-MS 422(M+H).
実施例246
4−tert−ブチル−N−[6−(5−フルオロ−1H−インドール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド トリフルオロ酢酸塩
4−tert−ブチル−N−[6−(5−フルオロ−1H−インドール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド トリフルオロ酢酸塩
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(33mg,0.1mmol)、5−フルオロインドリン(20.5mg,0.15mmol)、炭酸カリウム(28.0mg,0.2mmol)、N,N−ジメチルホルムアミド(2mL)の混合物をマイクロウェーブ反応装置を用い、220℃で500秒間加熱攪拌した。反応混合物をろ過し、ろ液を分取HPLCで精製して表題化合物(2.8mg,収率5.2%)を得た。淡黄色結晶。
LC-MS 428(M+H).
LC-MS 428(M+H).
実施例247
[3−({2−[(4−tert−ブチルベンゾイル)アミノ]イミダゾ[1,2−b]ピリダジン−6−イル}オキシ)フェノキシ]酢酸 トリフルオロ酢酸塩
[3−({2−[(4−tert−ブチルベンゾイル)アミノ]イミダゾ[1,2−b]ピリダジン−6−イル}オキシ)フェノキシ]酢酸 トリフルオロ酢酸塩
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(33mg,0.1mmol)、(3−ヒドロキシフェノキシ)酢酸エチル(29.0mg,0.15mmol)、炭酸カリウム(28.0mg,0.2mmol)、N,N−ジメチルホルムアミド(2mL)の混合物をマイクロウェーブ反応装置を用い、220℃で500秒間加熱攪拌した。反応混合物をろ過し、ろ液を分取HPLCで精製して表題化合物(12.8mg,収率22%)を得た。淡黄色結晶。
LC-MS 461(M+H).
LC-MS 461(M+H).
実施例248〜271
実施例247と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと各種フェノール、アミン、メルカプタンとの反応を行い、目的生成物を純度80%以上(LC/MS)で得た。実施例248〜271で得られた化合物の構造式およびマススペクトルのデータを表3〜表6に示す
実施例247と同様の方法に従い、4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミドと各種フェノール、アミン、メルカプタンとの反応を行い、目的生成物を純度80%以上(LC/MS)で得た。実施例248〜271で得られた化合物の構造式およびマススペクトルのデータを表3〜表6に示す
実施例272
4−tert−ブチル−N−[6−(4−tert−ブチル−1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(4−tert−ブチル−1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド
4−tert−ブチル−N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド(164mg)、4−tert−ブチルイミダゾール(124mg,1.0mmol)、炭酸カリウム(138mg,1.0mmol)、N,N−ジメチルホルムアミド(5mL)の混合物を、マイクロウェーブ反応装置を用い、180℃で500秒間加熱攪拌した。反応混合物を水に注ぎ、酢酸エチルで抽出した。有機層を無水硫酸マグネシウムで乾燥後、濃縮した。残留物をシリカゲルカラムクロマトグラフィーで精製し、ヘキサン−酢酸エチル(体積比4:1から0:1までグラジエント)で展開して目的物(70mg、収率34%)を無色結晶として得た。
1H-NMR (CDCl3) δ 1.36 (18H, s), 7.17 (1H, d, J = 9.4 Hz), 7.35 (1H, d, J = 1.1 Hz), 7.53 (2H, d, J = 8.5 Hz), 7.68 (1H, d, J = 9.4 Hz), 7.91 (2H, d, J = 8.3 Hz), 8.15 (1H, s), 8.62 (1H, s), 9.23 (1H, s)。
1H-NMR (CDCl3) δ 1.36 (18H, s), 7.17 (1H, d, J = 9.4 Hz), 7.35 (1H, d, J = 1.1 Hz), 7.53 (2H, d, J = 8.5 Hz), 7.68 (1H, d, J = 9.4 Hz), 7.91 (2H, d, J = 8.3 Hz), 8.15 (1H, s), 8.62 (1H, s), 9.23 (1H, s)。
実施例273〜278
実施例195と同様の方法に従い、6−クロロイミダゾ[1,2−b]ピリダジン−2−アミンと各種酸クロライドの反応により、実施例273〜278の化合物を合成した。合成した化合物を表7に示した。
実施例195と同様の方法に従い、6−クロロイミダゾ[1,2−b]ピリダジン−2−アミンと各種酸クロライドの反応により、実施例273〜278の化合物を合成した。合成した化合物を表7に示した。
実施例279
N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)−4−[(ジメチルアミノ)スルホニル]ベンズアミド
N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)−4−[(ジメチルアミノ)スルホニル]ベンズアミド
6−クロロイミダゾ[1,2−b]ピリダジン−2−アミン(168mg,1.0mmol)、4−[(ジメチルアミノ)スルホニル]安息香酸(230mg,1.0mmol)、シアノリン酸ジエチル(180mg,1.1mmol)、トリエチルアミン(110mg,1.1mmol)、N,N−ジメチルホルムアミド(3mL)の混合物を室温で3時間攪拌した。反応混合物を水に注ぎ、酢酸エチルで抽出した。有機層を無水硫酸マグネシウムで乾燥後、濃縮した。残留物をシリカゲルカラムクロマトグラフィーで精製し、ヘキサン−酢酸エチル(体積比4:1から0:1までグラジエント)で展開して目的物(21mg、収率5.5%)を淡黄色結晶として得た。
1H-NMR (DMSO-d6) δ 2.66 (6H, s), 7.40 (1H, d, J = 9.4 Hz), 7.90 (2H, d, J = 8.5 Hz), 8.15 (1H, d, J = 9.4 Hz), 8.30 (2H, d, J = 8.5 Hz), 8.52 (1H, s), 11.77 (1H, s)。
1H-NMR (DMSO-d6) δ 2.66 (6H, s), 7.40 (1H, d, J = 9.4 Hz), 7.90 (2H, d, J = 8.5 Hz), 8.15 (1H, d, J = 9.4 Hz), 8.30 (2H, d, J = 8.5 Hz), 8.52 (1H, s), 11.77 (1H, s)。
実施例280
(4−{[(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)アミノ]カルボニル}ベンジル)ホスホン酸ジエチル
(4−{[(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)アミノ]カルボニル}ベンジル)ホスホン酸ジエチル
実施例279と同様の方法に従い、6−クロロイミダゾ[1,2−b]ピリダジン−2−アミンと4−[(ジエチルホスホノエチル)メチル]安息香酸から表題化合物を収率12%で合成した。
LC-MS 423(M+H).
LC-MS 423(M+H).
実施例281
2,5−ジメチル−N−{6−[(1−メチル−1H−イミダゾール−2−イル)チオ]イミダゾ[1,2−b]ピリダジン−2−イル}−3−フルアミド
2,5−ジメチル−N−{6−[(1−メチル−1H−イミダゾール−2−イル)チオ]イミダゾ[1,2−b]ピリダジン−2−イル}−3−フルアミド
N−(6−クロロイミダゾ[1,2−b]ピリダジン−2−イル)−2,5−ジメチル−3−フルアミド(29mg,0.1mmol)、2−メルカプト−1−メチルイミダゾール(23mg,0.2mmol)、炭酸カリウム(27mg,0.2mmol)、N,N−ジメチルホルムアミド(2mL)の混合物を、マイクロウェーブ反応装置を用い、180℃で500秒間加熱攪拌した。反応混合物をろ過し、ろ液を分取HPLCで精製して表題化合物(23.3mg,収率63%)を得た。
LC-MS 369(M+H).
LC-MS 369(M+H).
実施例282〜313
実施例281と同様の方法に従い、実施例282−313で得られた化合物と各種フェノール、アミン、メルカプタンとの反応を行い、目的生成物を純度80%以上(LC/MS)で得た。実施例282〜313で得られた化合物の構造式およびマススペクトルのデータを表8〜表11に示す。
実施例281と同様の方法に従い、実施例282−313で得られた化合物と各種フェノール、アミン、メルカプタンとの反応を行い、目的生成物を純度80%以上(LC/MS)で得た。実施例282〜313で得られた化合物の構造式およびマススペクトルのデータを表8〜表11に示す。
実施例314
N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)−4−プロピルベンズアミド
N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)−4−プロピルベンズアミド
6−ヨードイミダゾ[1,2−b]ピリダジン−2−アミン(520mg, 2.0mmol)、4−プロピルベンゾイルクロリド(390mg,2.2mmol)、N,N−ジメチルアセトアミド(2.5mL)の混合物を室温で1時間攪拌した。反応混合物を水に注ぎ、析出する固体をろ取し、水、ついでイソプロピルエーテルで洗浄して表題化合物(0.72g,収率89%)を淡黄色結晶として得た。
1H-NMR (400 MHz, CDCl3) δ 0.96 (3H, t, J = 7.3 Hz), 1.63-1.73 (2H, m), 2.66 (2H, t, J = 7.7 Hz), 7.17-7.32 (4H, m), 7.87 (2H, d, J = 8.3 Hz), 8.63 (1H, s), 9.38 (1H, s)。
1H-NMR (400 MHz, CDCl3) δ 0.96 (3H, t, J = 7.3 Hz), 1.63-1.73 (2H, m), 2.66 (2H, t, J = 7.7 Hz), 7.17-7.32 (4H, m), 7.87 (2H, d, J = 8.3 Hz), 8.63 (1H, s), 9.38 (1H, s)。
実施例314と同様の方法で、実施例315〜317の化合物を合成した。
実施例315
3−トリフルオロメチル−N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
実施例315
3−トリフルオロメチル−N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
収率91%
1H-NMR (CDCl3) δ 7.12 (1H, d, J = 9.3 Hz), 7.24-7.31 (1H, m), 7.62 (1H, t, J = 7.8 Hz), 7.82 (1H, d, J = 7.8 Hz), 8.16 (1H, d, J = 7.8 Hz), 8.24 (1H, s), 8.66 (1H, s), 10.05 (1H, s)。
1H-NMR (CDCl3) δ 7.12 (1H, d, J = 9.3 Hz), 7.24-7.31 (1H, m), 7.62 (1H, t, J = 7.8 Hz), 7.82 (1H, d, J = 7.8 Hz), 8.16 (1H, d, J = 7.8 Hz), 8.24 (1H, s), 8.66 (1H, s), 10.05 (1H, s)。
実施例316
N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)ニコチンアミド
N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)ニコチンアミド
収率78%
1H-NMR (DMSO-d6) δ 7.49-7.60 (2H, m), 7.80 (1H, d, J = 9.3 Hz), 8.40 (1H, d, J = 8.1 Hz), 8.49 (1H, s), 8.76 (1H, d, J = 3.7 Hz), 9.20 (1H, d, J = 1.7 Hz)。
1H-NMR (DMSO-d6) δ 7.49-7.60 (2H, m), 7.80 (1H, d, J = 9.3 Hz), 8.40 (1H, d, J = 8.1 Hz), 8.49 (1H, s), 8.76 (1H, d, J = 3.7 Hz), 9.20 (1H, d, J = 1.7 Hz)。
実施例317
2−クロロ−N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
2−クロロ−N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
収率87%
1H-NMR (CDCl3) δ 7.18 (1H, d, J = 9.3 Hz), 7.29 (1H, d, J = 9.3 Hz), 7.36-7.48 (3H, m), 7.83 (1H, d, J = 7.8 Hz), 8.62 (1H, s), 9.61 (1H, s)。
1H-NMR (CDCl3) δ 7.18 (1H, d, J = 9.3 Hz), 7.29 (1H, d, J = 9.3 Hz), 7.36-7.48 (3H, m), 7.83 (1H, d, J = 7.8 Hz), 8.62 (1H, s), 9.61 (1H, s)。
実施例318
N−(6−モルホリン−4−イルイミダゾ[1,2−b]ピリダジン−2−イル)−4−プロピルベンズアミド 2トリフルオロ酢酸塩
N−(6−モルホリン−4−イルイミダゾ[1,2−b]ピリダジン−2−イル)−4−プロピルベンズアミド 2トリフルオロ酢酸塩
N−(6−ヨードイミダゾ[1,2−b]ピリダジン−2−イル)−4−プロピルベンズアミド(24mg,0.06mmol)、モルホリン(43mg,0.5mmol)、1−メチル−2−ピロリドン(0.5mL)の混合物を、マイクロウェーブ反応装置を用い、230℃で720秒間加熱攪拌した。反応混合物を分取HPLCで精製して表題化合物(23.3mg,収率33%)を得た。
LC-MS 366(M+H).
LC-MS 366(M+H).
実施例319〜398
実施例318と同様の方法に従い反応を行い、目的生成物を純度80%以上(LC/MS)で得た。実施例319〜398で得られた化合物の構造式およびマススペクトルのデータを表12〜表21に示す
実施例318と同様の方法に従い反応を行い、目的生成物を純度80%以上(LC/MS)で得た。実施例319〜398で得られた化合物の構造式およびマススペクトルのデータを表12〜表21に示す
実施例399
N−(6−{3−[(シクロプロピルカルボニル)アミノ]フェノキシ}イミダゾ[1,2−b]ピリダジン−2−イル)−3−メチルチオフェン−2−カルボキサミド
N−(6−{3−[(シクロプロピルカルボニル)アミノ]フェノキシ}イミダゾ[1,2−b]ピリダジン−2−イル)−3−メチルチオフェン−2−カルボキサミド
N−[6−(3−アミノフェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]−3−メチルチオフェン−2−カルボキサミド(22mg,0.06mmol)、シクロプロパンカルボニルクロライド(95mg,0.09mmol)、N,N−ジメチルアセトアミド(0.5mL)の混合物を室温で14時間攪拌した。反応混合物をHPLCで精製して表題化合物(11.8mg、収率45%)を得た。
LC-MS 434(M+H).
LC-MS 434(M+H).
実施例403−436
実施例399と同様の方法に従い、各種アミン体と酸クロライドとの反応を行い、目的生成物を純度80%以上(LC/MS)で得た。実施例403〜436で得られた化合物の構造式およびマススペクトルのデータを表22〜表25に示す。
実施例399と同様の方法に従い、各種アミン体と酸クロライドとの反応を行い、目的生成物を純度80%以上(LC/MS)で得た。実施例403〜436で得られた化合物の構造式およびマススペクトルのデータを表22〜表25に示す。
実施例437
4−[1,1−ジメチル−3−(5−オキソ−4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)プロピル]−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−[1,1−ジメチル−3−(5−オキソ−4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)プロピル]−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例37と同様にして、実施例45で合成した4−(3−シアノ−1,1−ジメチルプロピル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド(0.20g,0.50mmol)を用いて、表題化合物(収量64mg,収率28%)を得た。
融点 283−284℃
MS (ESI+): 458 (M+H)。
1H-NMR (DMSO-d6) δ: 1.35 (6H, s), 1.95-2.01 (2H, m), 2.18-2.24 (2H, m), 7.14-7.15 (1H, m), 7.51 (2H, d, J = 8.5 Hz), 7.57 (1H, dd, J = 9.5, 2.0 Hz), 7.62 (1H, d, J = 9.5 Hz), 7.69 (1H, t, J = 1.3 Hz), 8.06 (2H, d, J = 8.5 Hz), 8.18-8.19 (1H, m), 8.34 (1H, s), 9.06 (1H, dd, J = 2.0, 1.0 Hz), 11.25 (1H, s), 12.11 (1H, br)。
元素分析値:C24H23N7O3として
計算値:C, 63.01; H, 5.07; N, 21.43。
実測値:C, 62.98; H, 5.10; N, 21.64。
融点 283−284℃
MS (ESI+): 458 (M+H)。
1H-NMR (DMSO-d6) δ: 1.35 (6H, s), 1.95-2.01 (2H, m), 2.18-2.24 (2H, m), 7.14-7.15 (1H, m), 7.51 (2H, d, J = 8.5 Hz), 7.57 (1H, dd, J = 9.5, 2.0 Hz), 7.62 (1H, d, J = 9.5 Hz), 7.69 (1H, t, J = 1.3 Hz), 8.06 (2H, d, J = 8.5 Hz), 8.18-8.19 (1H, m), 8.34 (1H, s), 9.06 (1H, dd, J = 2.0, 1.0 Hz), 11.25 (1H, s), 12.11 (1H, br)。
元素分析値:C24H23N7O3として
計算値:C, 63.01; H, 5.07; N, 21.43。
実測値:C, 62.98; H, 5.10; N, 21.64。
実施例438
4−(3−シアノ−1,1−ジメチルプロピル)−N−(6−メチルイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
4−(3−シアノ−1,1−ジメチルプロピル)−N−(6−メチルイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
実施例15と同様にして、参考例3で合成した4−(3−シアノ−1,1−ジメチルプロピル)安息香酸(1.5g,7.0mmol)と参考例26で合成した6−メチルイミダゾ[1,2−a]ピリジン−2−アミン(1.0g,3.0mmol)を用い、表題化合物(収量0.57g,収率24%)を得た。
融点 194−195℃
MS (ESI+): 347 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (6H, s), 2.00 (2H, t, J = 8.0 Hz), 2.19 (2H, t, J = 8.0 Hz), 2.28 (3H, s), 7.10 (1H, d, J = 9.1 Hz), 7.36 (1H, d, J = 9.1 Hz), 7.58 (2H, d, J = 8.3 Hz), 8.05 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.38 (1H, s), 11.09 (1H, s)。
元素分析値:C21H22N4Oとして
計算値:C, 72.81; H, 6.40; N, 16.17。
実測値:C, 72.78; H, 6.36; N, 16.26。
融点 194−195℃
MS (ESI+): 347 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (6H, s), 2.00 (2H, t, J = 8.0 Hz), 2.19 (2H, t, J = 8.0 Hz), 2.28 (3H, s), 7.10 (1H, d, J = 9.1 Hz), 7.36 (1H, d, J = 9.1 Hz), 7.58 (2H, d, J = 8.3 Hz), 8.05 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.38 (1H, s), 11.09 (1H, s)。
元素分析値:C21H22N4Oとして
計算値:C, 72.81; H, 6.40; N, 16.17。
実測値:C, 72.78; H, 6.36; N, 16.26。
実施例439
4−[1,1−ジメチル−3−(1H−テトラゾール−5−イル)プロピル]−N−(6−メチルイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
4−[1,1−ジメチル−3−(1H−テトラゾール−5−イル)プロピル]−N−(6−メチルイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
実施例36と同様にして、実施例438で合成した4−(3−シアノ−1,1−ジメチルプロピル)−N−(6−メチルイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(0.20g,0.58mmol)を用いて、表題化合物(収量56mg,収率25%)を得た。
融点 245−246℃
MS (ESI+): 390 (M+H)。
1H-NMR (DMSO-d6) δ: 1.37 (6H, s), 2.05-2.11 (2H, m), 2.28 (3H, s), 2.55-2.62 (2H, m), 7.10 (1H, dd, J = 9.1, 1.7 Hz), 7.36 (1H, d, J = 9.1 Hz), 7.54 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.38 (1H, s), 11.09 (1H, s), 15.91 (1H, br)。
元素分析値:C21H23N7Oとして
計算値:C, 64.79; H, 5.95; N, 25.18。
実測値:C, 64.62; H, 5.95; N, 25.12。
融点 245−246℃
MS (ESI+): 390 (M+H)。
1H-NMR (DMSO-d6) δ: 1.37 (6H, s), 2.05-2.11 (2H, m), 2.28 (3H, s), 2.55-2.62 (2H, m), 7.10 (1H, dd, J = 9.1, 1.7 Hz), 7.36 (1H, d, J = 9.1 Hz), 7.54 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.38 (1H, s), 11.09 (1H, s), 15.91 (1H, br)。
元素分析値:C21H23N7Oとして
計算値:C, 64.79; H, 5.95; N, 25.18。
実測値:C, 64.62; H, 5.95; N, 25.12。
実施例440
4−[1,1−ジメチル−3−(5−オキソ−4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)プロピル]−N−(6−メチルイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
4−[1,1−ジメチル−3−(5−オキソ−4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)プロピル]−N−(6−メチルイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド
実施例37と同様にして、実施例438で合成した4−(3−シアノ−1,1−ジメチルプロピル)−N−(6−メチルイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(0.17g,0.50mmol)を用いて、表題化合物(収量35mg,収率17%)を得た。
融点 267−268℃
MS (ESI+): 406 (M+H)。
1H-NMR (DMSO-d6) δ: 1.34 (6H, s), 1.95-2.01 (2H, m), 2.18-2.24 (2H, m), 2.28 (3H, s), 7.10 (1H, dd, J = 9.2, 1.6 Hz), 7.36 (1H, d, J = 9.2 Hz), 7.51 (2H, d, J = 8.5 Hz), 8.05 (2H, d, J = 8.5 Hz), 8.19 (1H, s), 8.38 (1H, s), 11.08 (1H, s), 12.11 (1H, br)。
元素分析値:C24H23N5O3として
計算値:C, 65.17; H, 5.72; N, 17.27。
実測値:C, 65.15; H, 5.57; N, 17.46。
融点 267−268℃
MS (ESI+): 406 (M+H)。
1H-NMR (DMSO-d6) δ: 1.34 (6H, s), 1.95-2.01 (2H, m), 2.18-2.24 (2H, m), 2.28 (3H, s), 7.10 (1H, dd, J = 9.2, 1.6 Hz), 7.36 (1H, d, J = 9.2 Hz), 7.51 (2H, d, J = 8.5 Hz), 8.05 (2H, d, J = 8.5 Hz), 8.19 (1H, s), 8.38 (1H, s), 11.08 (1H, s), 12.11 (1H, br)。
元素分析値:C24H23N5O3として
計算値:C, 65.17; H, 5.72; N, 17.27。
実測値:C, 65.15; H, 5.57; N, 17.46。
実施例441
4−(3−シアノ−1,1−ジメチルプロピル)−N−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イル)ベンズアミド
4−(3−シアノ−1,1−ジメチルプロピル)−N−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イル)ベンズアミド
実施例15と同様にして、参考例3で合成した4−(3−シアノ−1,1−ジメチルプロピル)安息香酸(0.46g,2.1mmol)と参考例17で合成した1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−アミン(0.35g,2.0mmol)を用い、表題化合物(収量0.29g,収率37%)を得た。
融点 227−228℃
MS (ESI+): 375 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (6H, s), 1.97-2.04 (2H, m), 2.16-2.21 (2H, m), 3.53 (2H, t, J = 9.1 Hz), 4.76 (2H, t, J = 9.1 Hz), 7.06 (1H, d, J = 9.5 Hz), 7.31 (1H, d, J = 9.5 Hz), 7.51 (2H, d, J = 8.3 Hz), 8.01 (1H, s), 8.06 (2H, d, J = 8.3 Hz), 11.16 (1H, s)。
元素分析値:C22H22N4O2として
計算値:C, 70.57; H, 5.92; N, 14.96。
実測値:C, 70.43; H, 5.89; N, 15.19。
融点 227−228℃
MS (ESI+): 375 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (6H, s), 1.97-2.04 (2H, m), 2.16-2.21 (2H, m), 3.53 (2H, t, J = 9.1 Hz), 4.76 (2H, t, J = 9.1 Hz), 7.06 (1H, d, J = 9.5 Hz), 7.31 (1H, d, J = 9.5 Hz), 7.51 (2H, d, J = 8.3 Hz), 8.01 (1H, s), 8.06 (2H, d, J = 8.3 Hz), 11.16 (1H, s)。
元素分析値:C22H22N4O2として
計算値:C, 70.57; H, 5.92; N, 14.96。
実測値:C, 70.43; H, 5.89; N, 15.19。
実施例442
N−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イル)−4−[1,1−ジメチル−3−(5−オキソ−4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)プロピル]ベンズアミド
N−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イル)−4−[1,1−ジメチル−3−(5−オキソ−4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)プロピル]ベンズアミド
実施例37と同様にして、実施例441で合成した4−(3−シアノ−1,1−ジメチルプロピル)−N−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イル)ベンズアミド(0.19g,0.50mmol)を用いて、表題化合物(収量25mg,収率12%)を得た。
MS (ESI+): 434 (M+H)。
1H-NMR (DMSO-d6) δ: 1.34 (6H, s), 1.94-2.01 (2H, m), 2.17-2.24 (2H, m), 3.53 (2H, t, J = 9.1 Hz), 4.76 (2H, t, J = 9.1 Hz), 7.06 (1H, d, J = 9.5 Hz), 7.31 (1H, d, J = 9.5 Hz), 7.51 (2H, d, J = 8.7 Hz), 8.01 (1H, s), 8.07 (2H, d, J = 8.7 Hz), 11.14 (1H, s), 12.09 (1H, br)。
MS (ESI+): 434 (M+H)。
1H-NMR (DMSO-d6) δ: 1.34 (6H, s), 1.94-2.01 (2H, m), 2.17-2.24 (2H, m), 3.53 (2H, t, J = 9.1 Hz), 4.76 (2H, t, J = 9.1 Hz), 7.06 (1H, d, J = 9.5 Hz), 7.31 (1H, d, J = 9.5 Hz), 7.51 (2H, d, J = 8.7 Hz), 8.01 (1H, s), 8.07 (2H, d, J = 8.7 Hz), 11.14 (1H, s), 12.09 (1H, br)。
実施例443
4−(3−シアノ−1,1−ジメチルプロピル)−N−[6−(3−チエニル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−(3−シアノ−1,1−ジメチルプロピル)−N−[6−(3−チエニル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例24と同様にして、実施例44で合成したN−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)−4−(3−シアノ−1,1−ジメチルプロピル)ベンズアミド(0.60g,1.3mmol)、3−チエニルボロン酸(0.50g,3.9mmol)を用い、表題化合物(収量0.44g,収率82%)を得た。
MS (ESI+): 415 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (6H, s), 1.97-2.04 (2H, m), 2.16-2.22 (2H, m), 7.49-7.53 (3H, m), 7.59 (1H, dd, J = 5.1, 1.9 Hz), 7.67 (1H, dd, J = 9.5, 1.9 Hz), 7.71 (1H, dd, J = 5.1, 3.0 Hz), 7.91 (1H, dd, J = 3.0, 1.1 Hz), 8.07 (2H, d, J = 8.3 Hz), 8.29 (1H, s), 9.03 (1H, s), 11.18 (1H, s)。
元素分析値:C24H22N4OS+0.1H2Oとして
計算値:C, 69.24; H, 5.37; N, 13.46。
実測値:C, 69.47; H, 5.66; N, 13.08。
MS (ESI+): 415 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (6H, s), 1.97-2.04 (2H, m), 2.16-2.22 (2H, m), 7.49-7.53 (3H, m), 7.59 (1H, dd, J = 5.1, 1.9 Hz), 7.67 (1H, dd, J = 9.5, 1.9 Hz), 7.71 (1H, dd, J = 5.1, 3.0 Hz), 7.91 (1H, dd, J = 3.0, 1.1 Hz), 8.07 (2H, d, J = 8.3 Hz), 8.29 (1H, s), 9.03 (1H, s), 11.18 (1H, s)。
元素分析値:C24H22N4OS+0.1H2Oとして
計算値:C, 69.24; H, 5.37; N, 13.46。
実測値:C, 69.47; H, 5.66; N, 13.08。
実施例444
4−[1,1−ジメチル−3−(5−オキソ−4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)プロピル]−N−[6−(3−チエニル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−[1,1−ジメチル−3−(5−オキソ−4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)プロピル]−N−[6−(3−チエニル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例37と同様にして、実施例443で合成した4−(3−シアノ−1,1−ジメチルプロピル)−N−[6−(3−チエニル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド(0.21g,0.50mmol)を用いて、表題化合物(収量90mg,収率38%)を得た。
MS (ESI+): 474 (M+H)。
1H-NMR (DMSO-d6) δ: 1.34 (6H, s), 1.95-2.01 (2H, m), 2.18-2.24 (2H, m), 7.49-7.53 (3H, m), 7.59 (1H, dd, J = 5.1, 1.3 Hz), 7.66 (1H, dd, J = 9.3, 1.7 Hz), 7.71 (1H, dd, J = 5.1, 2.8 Hz), 7.91 (1H, dd, J = 2.8, 1.3 Hz), 8.07 (2H, d, J = 8.7 Hz), 8.29 (1H, s), 9.03 (1H, s), 11.16 (1H, s), 12.10 (1H, br)。
MS (ESI+): 474 (M+H)。
1H-NMR (DMSO-d6) δ: 1.34 (6H, s), 1.95-2.01 (2H, m), 2.18-2.24 (2H, m), 7.49-7.53 (3H, m), 7.59 (1H, dd, J = 5.1, 1.3 Hz), 7.66 (1H, dd, J = 9.3, 1.7 Hz), 7.71 (1H, dd, J = 5.1, 2.8 Hz), 7.91 (1H, dd, J = 2.8, 1.3 Hz), 8.07 (2H, d, J = 8.7 Hz), 8.29 (1H, s), 9.03 (1H, s), 11.16 (1H, s), 12.10 (1H, br)。
実施例445
4−(3−シアノ−1,1−ジメチルプロピル)−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−(3−シアノ−1,1−ジメチルプロピル)−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例15と同様にして、参考例3で合成した4−(3−シアノ−1,1−ジメチルプロピル)安息香酸(1.27g,5.9mmol)と参考例47で合成した6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−アミン(1.1g,5.3mmol)を用い、表題化合物(収量0.85g,収率40%)を得た。
融点 233−234℃
MS (ESI+): 401 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (6H, s), 1.98-2.03 (2H, m), 2.16-2.21 (2H, m), 7.47 (1H, dd, J = 9.4, 1.9 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.65 (1H, dd, J = 9.4, 0.8 Hz), 8.06 (2H, d, J = 8.3 Hz), 8.47 (1H, s), 9.26-9.28 (1H, m), 11.31 (1H, s)。
元素分析値:C21H19N4OF3として
計算値:C, 62.99; H, 4.78; N, 13.99。
実測値:C, 62.91; H, 4.81; N, 14.09。
融点 233−234℃
MS (ESI+): 401 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (6H, s), 1.98-2.03 (2H, m), 2.16-2.21 (2H, m), 7.47 (1H, dd, J = 9.4, 1.9 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.65 (1H, dd, J = 9.4, 0.8 Hz), 8.06 (2H, d, J = 8.3 Hz), 8.47 (1H, s), 9.26-9.28 (1H, m), 11.31 (1H, s)。
元素分析値:C21H19N4OF3として
計算値:C, 62.99; H, 4.78; N, 13.99。
実測値:C, 62.91; H, 4.81; N, 14.09。
実施例446
4−[1,1−ジメチル−3−(1H−テトラゾール−5−イル)プロピル]−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−[1,1−ジメチル−3−(1H−テトラゾール−5−イル)プロピル]−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例36と同様にして、実施例445で合成した4−(3−シアノ−1,1−ジメチルプロピル)−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド(0.30g,0.75mmol)を用いて、表題化合物(収量0.17g,収率50%)を得た。
融点 250−251℃
MS (ESI+): 444 (M+H)。
1H-NMR (DMSO-d6) δ: 1.38 (6H, s), 2.05-2.12 (2H, m), 2.55-2.63 (2H, m), 7.47 (1H, dd, J = 9.5, 1.9 Hz), 7.55 (2H, d, J = 8.3 Hz), 7.66 (1H, d, J = 9.5 Hz), 8.08 (2H, d, J = 8.3 Hz), 8.48 (1H, s), 9.28(1H, s), 11.31 (1H, s)。
元素分析値:C21H20N7OF3として
計算値:C, 56.88; H, 4.55; N, 22.11。
実測値:C, 56.48; H, 4.75; N, 22.48。
融点 250−251℃
MS (ESI+): 444 (M+H)。
1H-NMR (DMSO-d6) δ: 1.38 (6H, s), 2.05-2.12 (2H, m), 2.55-2.63 (2H, m), 7.47 (1H, dd, J = 9.5, 1.9 Hz), 7.55 (2H, d, J = 8.3 Hz), 7.66 (1H, d, J = 9.5 Hz), 8.08 (2H, d, J = 8.3 Hz), 8.48 (1H, s), 9.28(1H, s), 11.31 (1H, s)。
元素分析値:C21H20N7OF3として
計算値:C, 56.88; H, 4.55; N, 22.11。
実測値:C, 56.48; H, 4.75; N, 22.48。
実施例447
4−[1,1−ジメチル−3−(5−オキソ−4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)プロピル]−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−[1,1−ジメチル−3−(5−オキソ−4,5−ジヒドロ−1,2,4−オキサジアゾール−3−イル)プロピル]−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例37と同様にして、実施例445で合成した4−(3−シアノ−1,1−ジメチルプロピル)−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド(0.30g,0.75mmol)を用いて、表題化合物(収量0.16g,収率47%)を得た。
融点 268−270℃
MS (ESI+): 460 (M+H)。
1H-NMR (DMSO-d6) δ: 1.35 (6H, s), 1.95-2.02 (2H, m), 2.18-2.25 (2H, m), 7.48 (1H, d, J = 9.5 Hz), 7.53 (2H, d, J = 8.3 Hz), 7.66 (1H, d, J = 9.5 Hz), 8.07 (2H, d, J = 8.3 Hz), 8.48 (1H, s), 9.29 (1H, s), 11.30 (1H, s), 12.09 (1H, br)。
元素分析値:C22H20N5O3F3として
計算値:C, 57.51; H, 4.39; N, 15.24。
実測値:C, 57.44; H, 4.36; N, 15.31。
融点 268−270℃
MS (ESI+): 460 (M+H)。
1H-NMR (DMSO-d6) δ: 1.35 (6H, s), 1.95-2.02 (2H, m), 2.18-2.25 (2H, m), 7.48 (1H, d, J = 9.5 Hz), 7.53 (2H, d, J = 8.3 Hz), 7.66 (1H, d, J = 9.5 Hz), 8.07 (2H, d, J = 8.3 Hz), 8.48 (1H, s), 9.29 (1H, s), 11.30 (1H, s), 12.09 (1H, br)。
元素分析値:C22H20N5O3F3として
計算値:C, 57.51; H, 4.39; N, 15.24。
実測値:C, 57.44; H, 4.36; N, 15.31。
実施例448
4−{2−[(2,3−ジヒドロキシプロピル)アミノ]−1,1−ジメチル−2−オキソエチル}−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−{2−[(2,3−ジヒドロキシプロピル)アミノ]−1,1−ジメチル−2−オキソエチル}−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例43で合成した2−(4−{[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)−2−メチルプロパン酸(84mg,0.21mmol)、3−アミノプロパン−1,2−ジオール(39.3mg,0.43mmol)、WSC(82.7mg,0.43mmol)及びHOBt(49.6mg,0.32mmol)を用いて実施例34と同様に行い、得られた粗製物を塩基性シリカゲルクロマトグラフィー(0−20%メタノール/酢酸エチル)で精製して表題化合物(収量34mg,収率35%)を得た。
MS (ESI+): 463 (M+H)。
1H-NMR (DMSO-d6) δ: 1.50 (6H, s), 2.96-3.09 (1H, m), 3.12-3.28 (3H, m), 3.42-3.57 (1H, m), 4.48 (1H, t, J = 5.7 Hz), 4.70 (1H, d, J = 4.9 Hz), 7.15 (1H, s), 7.28 (1H, t, J = 5.5 Hz), 7.45 (2H, d, J = 8.3 Hz), 7.57 (1H, dd, J = 9.8, 1.9 Hz), 7.63 (1H, d, J = 7.6 Hz), 7.68-7.73 (1H, m), 8.05 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.35 (1H, s), 9.04-9.10 (1H, m), 11.27 (1H, s)。
MS (ESI+): 463 (M+H)。
1H-NMR (DMSO-d6) δ: 1.50 (6H, s), 2.96-3.09 (1H, m), 3.12-3.28 (3H, m), 3.42-3.57 (1H, m), 4.48 (1H, t, J = 5.7 Hz), 4.70 (1H, d, J = 4.9 Hz), 7.15 (1H, s), 7.28 (1H, t, J = 5.5 Hz), 7.45 (2H, d, J = 8.3 Hz), 7.57 (1H, dd, J = 9.8, 1.9 Hz), 7.63 (1H, d, J = 7.6 Hz), 7.68-7.73 (1H, m), 8.05 (2H, d, J = 8.3 Hz), 8.19 (1H, s), 8.35 (1H, s), 9.04-9.10 (1H, m), 11.27 (1H, s)。
実施例449
4−[2−(グリセロイルアミノ)−1,1−ジメチルエチル]−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−[2−(グリセロイルアミノ)−1,1−ジメチルエチル]−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例132で得られた4−(2−アミノ−1,1−ジメチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド(90mg,0.24mmol)、グリセリン酸(40%水溶液125mg,0.48mmol)、WSC(92.2mg,0.48mmol)及びHOBt(55.2mg,0.36mmol)を用いて実施例448と同様に行い表題化合物(収量42mg,収率39%)を得た。
MS (ESI+): 463 (M+H)。
1H-NMR (DMSO-d6) δ: 1.28 (6H, s), 3.36 (2H, d, J = 6.4 Hz), 3.48-3.58 (1H, m), 3.80-3.90 (1H, m), 4.68 (1H, t, J = 5.7 Hz), 5.52 (1H, d, J = 5.3 Hz), 7.15 (1H, s), 7.17 (1H, t, J = 6.4 Hz), 7.53 (2H, d, J = 8.7 Hz), 7.57 (1H, dd, J = 9.5, 1.9 Hz), 7.63 (1H, d, J = 9.5 Hz), 7.70 (1H, t, J = 1.3 Hz), 8.06 (2H, d, J = 8.7 Hz), 8.19 (1H, s), 8.35 (1H, s), 9.07 (1H, s), 11.26 (1H, s)。
MS (ESI+): 463 (M+H)。
1H-NMR (DMSO-d6) δ: 1.28 (6H, s), 3.36 (2H, d, J = 6.4 Hz), 3.48-3.58 (1H, m), 3.80-3.90 (1H, m), 4.68 (1H, t, J = 5.7 Hz), 5.52 (1H, d, J = 5.3 Hz), 7.15 (1H, s), 7.17 (1H, t, J = 6.4 Hz), 7.53 (2H, d, J = 8.7 Hz), 7.57 (1H, dd, J = 9.5, 1.9 Hz), 7.63 (1H, d, J = 9.5 Hz), 7.70 (1H, t, J = 1.3 Hz), 8.06 (2H, d, J = 8.7 Hz), 8.19 (1H, s), 8.35 (1H, s), 9.07 (1H, s), 11.26 (1H, s)。
実施例450
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[2−(グリセロイルアミノ)−1,1−ジメチルエチル]ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−[2−(グリセロイルアミノ)−1,1−ジメチルエチル]ベンズアミド
実施例94で得られた4−(2−アミノ−1,1−ジメチルエチル)−N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(65.1mg,0.19mmol)、グリセリン酸(40%水溶液126mg,0.48mmol)、WSC(82.2mg,0.43mmol)及びHOBt(45mg,0.29mmol)を用いて実施例448と同様に行い表題化合物(収量31mg,収率38%)を得た。
融点 228-229℃
MS (ESI+): 431 (M+H)。
1H-NMR (DMSO-d6) δ: 1.28 (6H, s), 3.36 (2H, d, J = 6.4 Hz), 3.41 (1H, t, J = 6.1 Hz), 3.48-3.59 (1H, m), 3.79-3.91 (1H, m), 4.66 (1H, dd, J = 6.1 Hz), 5.50 (1H, d, J = 5.3 Hz), 7.16 (1H, t, J = 6.4 Hz), 7.28 (1H, dd, J = 9.5, 1.9 Hz), 7.50 (1H, d, J = 9.5 Hz), 7.52 (2H, d, J = 8.3 Hz), 8.05 (2H, d, J = 8.3 Hz), 8.34 (1H, s), 8.88 (1H, d, J = 1.9 Hz), 11.23 (1H, s)。
融点 228-229℃
MS (ESI+): 431 (M+H)。
1H-NMR (DMSO-d6) δ: 1.28 (6H, s), 3.36 (2H, d, J = 6.4 Hz), 3.41 (1H, t, J = 6.1 Hz), 3.48-3.59 (1H, m), 3.79-3.91 (1H, m), 4.66 (1H, dd, J = 6.1 Hz), 5.50 (1H, d, J = 5.3 Hz), 7.16 (1H, t, J = 6.4 Hz), 7.28 (1H, dd, J = 9.5, 1.9 Hz), 7.50 (1H, d, J = 9.5 Hz), 7.52 (2H, d, J = 8.3 Hz), 8.05 (2H, d, J = 8.3 Hz), 8.34 (1H, s), 8.88 (1H, d, J = 1.9 Hz), 11.23 (1H, s)。
実施例451
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−{2−[(1H−イミダゾール−5−イルアセチル)アミノ]−1,1−ジメチルエチル}ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−{2−[(1H−イミダゾール−5−イルアセチル)アミノ]−1,1−ジメチルエチル}ベンズアミド
実施例94で合成した4−(2−アミノ−1,1−ジメチルエチル)−N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミド(65.1mg,0.19mmol)、1H−イミダゾール−5−イル酢酸 塩酸塩(154mg,0.38mmol)、WSC(82.2mg,0.43mmol)、HOBt(45mg,0.29mmol)及びトリエチルアミン(59mg,0.58mmol)を用いて実施例448と同様に行い表題化合物(収量82mg,収率96%)を得た。
融点 270℃ (decomp.)
MS (ESI+): 451 (M+H)。
1H-NMR (DMSO-d6) δ: 1.25 (6H, s), 3.16-3.55 (4H, m), 6.60 (0.3H, s), 6.87 (0.7H, brs), 7.28 (1H, dd, J = 9.5, 1.89 Hz), 7.47 (2H, d, J = 8.3 Hz), 7.50 (1H, d, J = 9.5 Hz), 7.54 (1H, brs), 7.69 (1H, t, J = 6.1Hz), 8.02 (2H, d, J = 8.3 Hz), 8.34 (1H, s), 8.88 (1H, d, J = 1.9 Hz), 11.21 (1H, brs), 11.86 (1H, brs)。
融点 270℃ (decomp.)
MS (ESI+): 451 (M+H)。
1H-NMR (DMSO-d6) δ: 1.25 (6H, s), 3.16-3.55 (4H, m), 6.60 (0.3H, s), 6.87 (0.7H, brs), 7.28 (1H, dd, J = 9.5, 1.89 Hz), 7.47 (2H, d, J = 8.3 Hz), 7.50 (1H, d, J = 9.5 Hz), 7.54 (1H, brs), 7.69 (1H, t, J = 6.1Hz), 8.02 (2H, d, J = 8.3 Hz), 8.34 (1H, s), 8.88 (1H, d, J = 1.9 Hz), 11.21 (1H, brs), 11.86 (1H, brs)。
実施例452
4−tert−ブチル−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
参考例47で合成した6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−アミン(70mg,0.35mmol)、塩化4−tert−ブチルベンゾイル(83.8mg,0.42mmol)、トリエチルアミン(53.9mg,0.53mmol)を用いて実施例14と同様に反応を行い、得られた粗製物をシリカゲルクロマトグラフィー(25−30%酢酸エチル/ヘキサン)で精製して白色固体の表題化合物(収量80mg,収率64%)を得た。
融点 234−235℃
MS (ESI+): 362 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32, (9H, s), 7.47 (1H, dd, J = 9.5, 1.5 Hz), 7.54 (2H, d, J = 8.3 Hz), 7.66 (1H, d, J = 9.5 Hz), 8.03 (2H, d, J = 8.3 Hz), 8.47 (1H, s), 9.29 (1H, s), 11.29 (1H, s)。
融点 234−235℃
MS (ESI+): 362 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32, (9H, s), 7.47 (1H, dd, J = 9.5, 1.5 Hz), 7.54 (2H, d, J = 8.3 Hz), 7.66 (1H, d, J = 9.5 Hz), 8.03 (2H, d, J = 8.3 Hz), 8.47 (1H, s), 9.29 (1H, s), 11.29 (1H, s)。
実施例453
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(2−{[(2,2−ジメチル−1,3−ジオキソラン−4−イル)メチル]アミノ}−1,1−ジメチル−2−オキソエチル)ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(2−{[(2,2−ジメチル−1,3−ジオキソラン−4−イル)メチル]アミノ}−1,1−ジメチル−2−オキソエチル)ベンズアミド
実施例116で合成した2−{4−[(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)カルバモイル]フェニル}−2−メチルプロパン酸(80mg,0.22mmol)、1−(2,2−ジメチル−1,3−ジオキソラン−4−イル)メタンアミン(74.8mg,0.57mmol)、WSC(96.2mg,0.50mmol)及びHOBt(52.4mg,0.34mmol)を用いて実施例448と同様に行い、得られた粗製物をシリカゲルクロマトグラフィー(80−100%酢酸エチル/ヘキサン)で精製し表題化合物(収量83mg,収率79%)を得た。
1H-NMR (DMSO-d6) δ: 1.23 (3H, s), 1.27 (3H, s), 1.48 (6H, s), 3.04-3.16 (1H, m), 3.19-3.31 (1H, m), 3.54 (1H, dd, J = 8.3, 6.1 Hz), 3.85 (1H, dd, J = 8.3, 6.1 Hz), 3.99-4.11 (3H, m), 7.28 (2H, dd, J = 9.5, 1.9 Hz), 7.43 (5H, d, J = 8.3 Hz), 7.49 (1H, t, J = 5.9 Hz), 7.50 (1H, d, J = 9.5 Hz), 8.04 (2H, d, J = 8.3 Hz),8.88 (1H, d, J = 1.9 Hz), 11.24 (1H, s)。
1H-NMR (DMSO-d6) δ: 1.23 (3H, s), 1.27 (3H, s), 1.48 (6H, s), 3.04-3.16 (1H, m), 3.19-3.31 (1H, m), 3.54 (1H, dd, J = 8.3, 6.1 Hz), 3.85 (1H, dd, J = 8.3, 6.1 Hz), 3.99-4.11 (3H, m), 7.28 (2H, dd, J = 9.5, 1.9 Hz), 7.43 (5H, d, J = 8.3 Hz), 7.49 (1H, t, J = 5.9 Hz), 7.50 (1H, d, J = 9.5 Hz), 8.04 (2H, d, J = 8.3 Hz),8.88 (1H, d, J = 1.9 Hz), 11.24 (1H, s)。
実施例454
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−{2−[(2,3−ジヒドロキシプロピル)アミノ]−1,1−ジメチル−2−オキソエチル}ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−{2−[(2,3−ジヒドロキシプロピル)アミノ]−1,1−ジメチル−2−オキソエチル}ベンズアミド
実施例453で合成したN−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(2−{[(2,2−ジメチル−1,3−ジオキソラン−4−イル)メチル]アミノ}−1,1−ジメチル−2−オキソエチル)ベンズアミド(78mg,0.16mmol)をメタノール(6mL)に溶かし、そこへp−トルエンスルホン酸−1水和物(15.8mg,0,08mmol)を加えて室温で終夜(18時間)攪拌した。その後溶媒を減圧溜去し、得られた白色個体に水(10mL)、飽和炭酸水素ナトリウム水溶液(5mL)を加えた後10%メタノール/酢酸エチル混合溶媒で抽出した。有機層を飽和食塩水で洗浄し、硫酸マグネシウムで乾燥後溶媒を減圧溜去して得られた粗製物をアセトニトリルで再結晶して白色針状結晶の表題化合物(収量64mg,収率92%)を得た。
融点 198−199℃
MS (ESI+): 431 (M+H)。
1H-NMR (DMSO-d6) δ: 1.49 (6H, s), 2.96-3.08 (1H, m), 3.11-3.20 (1H, m), 3.23 (2H, t, J = 5.5 Hz), 3.42-3.55 (1H, m), 4.47 (1H, t, J = 5.7 Hz), 4.69 (1H, d, J = 4.9 Hz), 7.27 (1H, t, J = 5.7 Hz), 7.28 (1H, dd, J = 9.5, 1.9 Hz), 7.44 (2H, d, J = 8.3 Hz), 7.50 (1H, d, J = 9.5 Hz), 8.04 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.82-8.95 (1H, m), 11.24 (1H, s)。
融点 198−199℃
MS (ESI+): 431 (M+H)。
1H-NMR (DMSO-d6) δ: 1.49 (6H, s), 2.96-3.08 (1H, m), 3.11-3.20 (1H, m), 3.23 (2H, t, J = 5.5 Hz), 3.42-3.55 (1H, m), 4.47 (1H, t, J = 5.7 Hz), 4.69 (1H, d, J = 4.9 Hz), 7.27 (1H, t, J = 5.7 Hz), 7.28 (1H, dd, J = 9.5, 1.9 Hz), 7.44 (2H, d, J = 8.3 Hz), 7.50 (1H, d, J = 9.5 Hz), 8.04 (2H, d, J = 8.3 Hz), 8.33 (1H, s), 8.82-8.95 (1H, m), 11.24 (1H, s)。
実施例455
4−(1−シアノ−1−メチルエチル)−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−(1−シアノ−1−メチルエチル)−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例15と同様にして、参考例2で得られた4−(1−シアノ−1−メチルエチル)安息香酸(1.0g,5.2mmol)と参考例47で得られた6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−アミン(0.96g,4.7mmol)を用いて反応を行い、得られた粗製物をシリカゲルクロマトグラフィー(30−40%酢酸エチル/ヘキサン)で精製し表題化合物(収量1.4g,収率63%)を得た。
融点 230−231℃
MS (ESI+): 373 (M+H)。
1H-NMR (DMSO-d6) δ: 1.74 (6H, s), 7.48 (1H, dd, J = 9.4, 1.7 Hz), 7.66 (1H, d, J = 9.4 Hz), 7.68 (2H, d, J = 8.7 Hz), 8.15 (2H, d, J =8.7Hz), 8.48 (1H, s), 9.27-9.32 (1H, m), 11.44 (1H, s)。
融点 230−231℃
MS (ESI+): 373 (M+H)。
1H-NMR (DMSO-d6) δ: 1.74 (6H, s), 7.48 (1H, dd, J = 9.4, 1.7 Hz), 7.66 (1H, d, J = 9.4 Hz), 7.68 (2H, d, J = 8.7 Hz), 8.15 (2H, d, J =8.7Hz), 8.48 (1H, s), 9.27-9.32 (1H, m), 11.44 (1H, s)。
実施例456
N−[2−メチル−2−(4−{[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)プロピル]−1H−イミダゾール−4(5)−カルボキサミド
N−[2−メチル−2−(4−{[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)プロピル]−1H−イミダゾール−4(5)−カルボキサミド
ラネーコバルト(300mg)を水、メタノールで洗浄後、実施例455で合成した4−(1−シアノ−1−メチルエチル)−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド(150mg, 0.40mmol)とともに2規定アンモニア/メタノール溶液中にて水素雰囲気下で8時間攪拌した後、ろ過し、ろ液を減圧下濃縮して白色固体の4−(2−アミノ−1,1−ジメチルエチル)−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミドを得た。これを予め調製した1H−イミダゾール−4(5)−カルボン酸(68.4mg,0.61mmol)、WSC(117mg,0.61mmol)及びHOBt(74.7mg,0.49mmol)のDMF(5mL)溶液に加えて室温で終夜攪拌した。その後反応液に水(10mL)を加えて50%THF/酢酸エチル混合溶媒で抽出し、有機層を飽和食塩水で洗浄後、無水硫酸マグネシウムで乾燥し、溶媒を減圧溜去して褐色の粗製物を得た。これをシリカゲルクロマトグラフィー(0−10%メタノール/酢酸エチル)で精製して表題化合物(収量173mg、収率92%)を得た。
融点 174−176℃ (アセトニトリル)
MS (ESI+): 471 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (6H, s), 3.54 (2H, d, J = 6.4 Hz), 7.26 (1H, t, J = 6.4 Hz), 7.47 (1H, dd, J = 9.4, 1.7 Hz,) 7.53-7.62 (3H, m), 7.63-7.71 (2H, m), 8.07 (2H, d, J = 8.5 Hz), 8.48 (1H, s), 9.29 (1H, s), 11.33 (1H, s), 12.46 (1H, brs)。
融点 174−176℃ (アセトニトリル)
MS (ESI+): 471 (M+H)。
1H-NMR (DMSO-d6) δ: 1.32 (6H, s), 3.54 (2H, d, J = 6.4 Hz), 7.26 (1H, t, J = 6.4 Hz), 7.47 (1H, dd, J = 9.4, 1.7 Hz,) 7.53-7.62 (3H, m), 7.63-7.71 (2H, m), 8.07 (2H, d, J = 8.5 Hz), 8.48 (1H, s), 9.29 (1H, s), 11.33 (1H, s), 12.46 (1H, brs)。
実施例457
N−[2−メチル−2−(4−{[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)プロピル]−1H−イミダゾール−2−カルボキサミド
N−[2−メチル−2−(4−{[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)プロピル]−1H−イミダゾール−2−カルボキサミド
1H−イミダゾール−2−カルボン酸(68.4mg,0.61mmol)を用いて実施例456と同様にして表題化合物(収量123mg,収率66%)を得た。
融点 292−293℃
MS (ESI+): 471 (M+H)。
1H-NMR (DMSO-d6) δ: 1.34 (6H, s), 3.54 (2H, d, J = 6.6 Hz), 7.11 (2H, brs) 7.47 (1H, dd, J = 9.4, 1.9 Hz), 7.58 (2H, d, J = 8.5 Hz), 7.66 (1H, d, J = 9.4 Hz), 7.76 (1H, t, J = 6.6 Hz), 8.07 (2H, d, J = 8.5 Hz), 8.48 (1H, s), 9.25-9.33 (1H, m), 11.33 (1H, brs), 13.01 (1H, brs)。
融点 292−293℃
MS (ESI+): 471 (M+H)。
1H-NMR (DMSO-d6) δ: 1.34 (6H, s), 3.54 (2H, d, J = 6.6 Hz), 7.11 (2H, brs) 7.47 (1H, dd, J = 9.4, 1.9 Hz), 7.58 (2H, d, J = 8.5 Hz), 7.66 (1H, d, J = 9.4 Hz), 7.76 (1H, t, J = 6.6 Hz), 8.07 (2H, d, J = 8.5 Hz), 8.48 (1H, s), 9.25-9.33 (1H, m), 11.33 (1H, brs), 13.01 (1H, brs)。
実施例458
4−{2−[(1H−イミダゾール−5−イルアセチル)アミノ]−1,1−ジメチルエチル}−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−{2−[(1H−イミダゾール−5−イルアセチル)アミノ]−1,1−ジメチルエチル}−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
1H−イミダゾール−4−イル酢酸 塩酸塩(362mg,0.89mmol)及びトリエチルアミン(138mg,1.37mmol)を用いて実施例456と同様にして粗製物を得た後、塩基性シリカゲルクロマトグラフィー(0−10%メタノール/酢酸エチル)で精製して表題化合物(収量67mg,収率31%)を得た。
融点 261−263℃
MS (ESI+): 485 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.28-3.37 (4H, m), 6.80 (1H, s), 7.44-7.56 (4H, m), 7.66 (1H, d, J = 9.2 Hz), 7.69 (1H, t, J = 6.1 Hz), 8.03 (2H, d, J = 8.5 Hz), 8.48 (1H, s), 9.29 (1H, s), 11.31 (1H, s), 11.87 (1H, brs)。
融点 261−263℃
MS (ESI+): 485 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.28-3.37 (4H, m), 6.80 (1H, s), 7.44-7.56 (4H, m), 7.66 (1H, d, J = 9.2 Hz), 7.69 (1H, t, J = 6.1 Hz), 8.03 (2H, d, J = 8.5 Hz), 8.48 (1H, s), 9.29 (1H, s), 11.31 (1H, s), 11.87 (1H, brs)。
実施例459
4−(3−ヒドロキシ−1,1−ジメチルプロピル)−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−(3−ヒドロキシ−1,1−ジメチルプロピル)−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
参考例47で合成した6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−アミン(1.0g,3.9mmol)を実施例21と同様にアシル化し、シリカゲルクロマトグラフィー(40−50%酢酸エチル/ヘキサン)で精製して4−メチル−4−(4−{[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)ブタン酸エチルを得た(収量1.39g,収率82%)。この化合物(1.1g, 2.5mmol)をテトラヒドロフラン(30mL)に溶かして、氷冷下ジイソブチルアルミニウムヒドリド(1Mヘキサン溶液,11mL,11mmol)を3分間掛けて滴下し、さらに氷冷下15分間攪拌した。その後10%酒石酸ナトリウムカリウム水溶液を加えて室温で30分間攪拌後、酢酸エチルで抽出した。有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後、溶媒を減圧溜去して得られた粗製物をシリカゲルクロマトグラフィー(60−80%酢酸エチル/ヘキサン)で精製して白色固体の表題化合物(収量930mg,収率79%)を得た。
融点 152−153℃
MS (ESI+): 392 (M+H)。
1H-NMR (DMSO-d6) δ: 1.31 (6H, s), 1.75-1.94 (2H, m), 3.12-3.28 (2H, m), 4.27 (1H, t, J = 5.1 Hz), 7.47 (1H, dd, J = 9.2, 1.9 Hz), 7.49 (2H, d, J = 8.5 Hz), 7.66 (1H, d, J = 9.2 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.47 (1H, s), 9.25-9.33 (1H, m), 11.29 (1H, s)。
融点 152−153℃
MS (ESI+): 392 (M+H)。
1H-NMR (DMSO-d6) δ: 1.31 (6H, s), 1.75-1.94 (2H, m), 3.12-3.28 (2H, m), 4.27 (1H, t, J = 5.1 Hz), 7.47 (1H, dd, J = 9.2, 1.9 Hz), 7.49 (2H, d, J = 8.5 Hz), 7.66 (1H, d, J = 9.2 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.47 (1H, s), 9.25-9.33 (1H, m), 11.29 (1H, s)。
実施例460
4−(4−ヒドロキシ−1,1−ジメチルブチル)−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−(4−ヒドロキシ−1,1−ジメチルブチル)−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
参考例47で合成した6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−アミン(1.14g,5.6mmol)を実施例180と同様にアシル化し、シリカゲルクロマトグラフィー(40−50%酢酸エチル/ヘキサン)で精製して4−メチル−4−(4−{[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]カルバモイル}フェニル)ペンタン酸エチルを得た(収量1.94g,収率78%)。この化合物(1.93g,4.23mmol)を実施例459と同様に還元し、得られた粗製物をシリカゲルクロマトグラフィー(60−80%酢酸エチル/ヘキサン)で精製して表題化合物(収量1.5g,収率87%)を得た。
MS (ESI+): 406 (M+H)。
1H-NMR (DMSO-d6) δ: 1.07-1.24 (2H, m), 1.30 (6H, s), 1.56-1.69 (2H, m), 3.30 (2H, td, J = 6.4, 5.3 Hz), 4.33 (1H, t, J = 5.3 Hz), 7.47 (1H, dd, J = 9.4, 1.9 Hz), 7.48 (2H, d, J = 8.5 Hz), 7.66 (1H, d, J = 9.4 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.48 (1H, s), 9.28 (1H, s), 11.29 (1H, s)。
MS (ESI+): 406 (M+H)。
1H-NMR (DMSO-d6) δ: 1.07-1.24 (2H, m), 1.30 (6H, s), 1.56-1.69 (2H, m), 3.30 (2H, td, J = 6.4, 5.3 Hz), 4.33 (1H, t, J = 5.3 Hz), 7.47 (1H, dd, J = 9.4, 1.9 Hz), 7.48 (2H, d, J = 8.5 Hz), 7.66 (1H, d, J = 9.4 Hz), 8.04 (2H, d, J = 8.5 Hz), 8.48 (1H, s), 9.28 (1H, s), 11.29 (1H, s)。
実施例461
4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
参考例47で合成した6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−アミン(929mg,4.5mmol)を実施例90と同様にアシル化し、精製して4−(2−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルエチル)−N−[6−(トリフルオロメチル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミドを得た(収量1.7g, 収率88%)。この化合物をTHF(30mL)に溶かし、テトラブチルアンモニウムフルオリド(1M THF溶液,6.9mL,6.9mmol)を室温で徐々に加えて終夜攪拌した。その後反応液へ飽和塩化アンモニウム水溶液を注ぎ、酢酸エチルで抽出後、有機層を飽和食塩水で洗浄し、無水硫酸マグネシウムで乾燥後溶媒を減圧溜去して橙色の油状粗製物を得た。これをシリカゲルクロマトグラフィー(60−80%酢酸エチル/ヘキサン)で精製して白色の表題化合物(収量1.2g,収率95%)を得た。
融点 227−229℃
MS (ESI+): 378 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.47 (2H, d, J = 5.3 Hz), 4.74 (1H, t, J = 5.3 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.47 (1H, dd, J = 9.4, 1.9 Hz), 7.65 (1H, d, J = 9.4 Hz), 8.03 (2H, d, J = 8.5 Hz), 8.48 (1H, s), 9.27-9.30 (1H, m), 11.29 (1H, s)。
融点 227−229℃
MS (ESI+): 378 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.47 (2H, d, J = 5.3 Hz), 4.74 (1H, t, J = 5.3 Hz), 7.51 (2H, d, J = 8.5 Hz), 7.47 (1H, dd, J = 9.4, 1.9 Hz), 7.65 (1H, d, J = 9.4 Hz), 8.03 (2H, d, J = 8.5 Hz), 8.48 (1H, s), 9.27-9.30 (1H, m), 11.29 (1H, s)。
実施例462
4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(1−メチル−1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(1−メチル−1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例103に準じ、4−(2−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルエチル)−N−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミドを合成した後に、実施例57および実施例103に準じ、1−メチル−4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ピラゾールを用いて表題化合物を合成した。
融点 275−277℃
MS (ESI+): 390 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.47 (2H, d, J = 5.5 Hz), 3.89 (3H, s), 4.73 (1H, t, J = 5.5 Hz), 7.45-7.53 (4H, m), 7.87 (1H, s), 8.01 (2H, d, J = 8.3 Hz), 8.14 (1H, s), 8.23 (1H, s), 8.84 (1H, s), 11.11 (1H, s)。
融点 275−277℃
MS (ESI+): 390 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.47 (2H, d, J = 5.5 Hz), 3.89 (3H, s), 4.73 (1H, t, J = 5.5 Hz), 7.45-7.53 (4H, m), 7.87 (1H, s), 8.01 (2H, d, J = 8.3 Hz), 8.14 (1H, s), 8.23 (1H, s), 8.84 (1H, s), 11.11 (1H, s)。
実施例463
4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(1−メチル−1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド 塩酸塩
4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(1−メチル−1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド 塩酸塩
実施例52に準じ、実施例462で得た4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(1−メチル−1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミドを用いて表題化合物を合成した。
MS (ESI+): 390 (M+H)。
1H-NMR (DMSO-d6) δ: 1.27 (6H, s), 3.48 (2H, s), 3.91 (3H, s), 7.58 (2H, d, J = 8.7 Hz), 7.83 (1H, d, J = 9.1 Hz), 7.93-7.98 (2H, m), 8.03 (2H, d, J = 8.3 Hz), 8.22-8.25 (2H, m), 9.11 (1H, s), 11.82 (1H, s), hidden (1H)。
MS (ESI+): 390 (M+H)。
1H-NMR (DMSO-d6) δ: 1.27 (6H, s), 3.48 (2H, s), 3.91 (3H, s), 7.58 (2H, d, J = 8.7 Hz), 7.83 (1H, d, J = 9.1 Hz), 7.93-7.98 (2H, m), 8.03 (2H, d, J = 8.3 Hz), 8.22-8.25 (2H, m), 9.11 (1H, s), 11.82 (1H, s), hidden (1H)。
実施例464
4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例103に準じ、4−(2−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルエチル)−N−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミドを合成した後に、実施例57および103に準じ、4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ピラゾールを用いて表題化合物を合成した。
融点 293−296℃
MS (ESI+): 376 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.47 (2H, d, J = 5.3 Hz), 4.73 (1H, t, J = 5.3 Hz), 7.44-7.57 (4H, m), 8.01 (2H, d, J = 8.3 Hz), 8.22 (1H, s), 8.88 (1H, s), 11.11 (1H, s), 13.01 (1H, s), hidden (2H)。
融点 293−296℃
MS (ESI+): 376 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.47 (2H, d, J = 5.3 Hz), 4.73 (1H, t, J = 5.3 Hz), 7.44-7.57 (4H, m), 8.01 (2H, d, J = 8.3 Hz), 8.22 (1H, s), 8.88 (1H, s), 11.11 (1H, s), 13.01 (1H, s), hidden (2H)。
実施例465
N−[6−(3−フリル)イミダゾ[1,2−a]ピリジン−2−イル]−4−(2−ヒドロキシ−1,1−ジメチルエチル)ベンズアミド
N−[6−(3−フリル)イミダゾ[1,2−a]ピリジン−2−イル]−4−(2−ヒドロキシ−1,1−ジメチルエチル)ベンズアミド
実施例103に準じ、4−(2−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルエチル)−N−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミドを合成した後に、実施例57および103に準じ、3−フリルボロン酸を用いて表題化合物を合成した。
融点 246−248℃
MS (ESI+): 376 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.47 (2H, d, J = 5.1 Hz), 4.73 (1H, t, J = 5.1 Hz), 6.98 (1H, d, J = 1.5 Hz), 7.46-7.56 (4H, m), 7.79 (1H, s), 8.01 (2H, d, J = 8.3 Hz), 8.22 (1H, s), 8.25 (1H, s), 8.90 (1H, s), 11.14 (1H, s)。
元素分析値:C22H21N3O3として
計算値:C, 70.38; H, 5.64; N, 11.19。
実測値:C, 70.27; H, 5.52; N, 11.31。
融点 246−248℃
MS (ESI+): 376 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.47 (2H, d, J = 5.1 Hz), 4.73 (1H, t, J = 5.1 Hz), 6.98 (1H, d, J = 1.5 Hz), 7.46-7.56 (4H, m), 7.79 (1H, s), 8.01 (2H, d, J = 8.3 Hz), 8.22 (1H, s), 8.25 (1H, s), 8.90 (1H, s), 11.14 (1H, s)。
元素分析値:C22H21N3O3として
計算値:C, 70.38; H, 5.64; N, 11.19。
実測値:C, 70.27; H, 5.52; N, 11.31。
実施例466
4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(3−チエニル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(3−チエニル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例103に準じ、4−(2−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルエチル)−N−(6−ヨードイミダゾ[1,2−a]ピリジン−2−イル)ベンズアミドを合成した後に、実施例57および103に準じ、3−チエニルボロン酸を用いて表題化合物を合成した。
融点 250−252℃
MS (ESI+): 392 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.47 (2H, d, J = 5.4 Hz), 4.73 (1H, t, J = 5.4 Hz), 7.47-7.53 (3H, m), 7.59 (1H, d, J = 4.9 Hz), 7.63-7.74 (2H, m), 7.89-7.92 (1H, m), 8.02 (2H, d, J = 8.3 Hz), 8.28 (1H, s), 9.03 (1H, s), 11.14 (1H, s)。
元素分析値:C22H21N3O2Sとして
計算値:C, 67.50; H, 5.41; N, 10.73。
実測値:C, 67.44; H, 5.33; N, 10.87。
融点 250−252℃
MS (ESI+): 392 (M+H)。
1H-NMR (DMSO-d6) δ: 1.26 (6H, s), 3.47 (2H, d, J = 5.4 Hz), 4.73 (1H, t, J = 5.4 Hz), 7.47-7.53 (3H, m), 7.59 (1H, d, J = 4.9 Hz), 7.63-7.74 (2H, m), 7.89-7.92 (1H, m), 8.02 (2H, d, J = 8.3 Hz), 8.28 (1H, s), 9.03 (1H, s), 11.14 (1H, s)。
元素分析値:C22H21N3O2Sとして
計算値:C, 67.50; H, 5.41; N, 10.73。
実測値:C, 67.44; H, 5.33; N, 10.87。
実施例467
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(3−ヒドロキシ−1,1−ジメチルプロピル)ベンズアミド
N−(6−クロロイミダゾ[1,2−a]ピリジン−2−イル)−4−(3−ヒドロキシ−1,1−ジメチルプロピル)ベンズアミド
実施例90に準じ、参考例52で得られた4−(3−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルプロピル)安息香酸を用いて表題化合物を合成した。
融点 182−184℃
MS (ESI+): 358 (M+H)。
1H-NMR (DMSO-d6) δ: 1.31 (6H, s), 1.80-1.87 (2H, m), 3.15-3.24 (2H, m), 4.27 (1H, t, J = 5.1 Hz), 7.28 (1H, dd, J = 9.6, 2.1 Hz), 7.45-7.53 (3H, m), 8.02 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 8.86-8.89 (1H, m), 11.19 (1H, s)。
融点 182−184℃
MS (ESI+): 358 (M+H)。
1H-NMR (DMSO-d6) δ: 1.31 (6H, s), 1.80-1.87 (2H, m), 3.15-3.24 (2H, m), 4.27 (1H, t, J = 5.1 Hz), 7.28 (1H, dd, J = 9.6, 2.1 Hz), 7.45-7.53 (3H, m), 8.02 (2H, d, J = 8.5 Hz), 8.33 (1H, s), 8.86-8.89 (1H, m), 11.19 (1H, s)。
実施例468
4−(3−ヒドロキシ−1,1−ジメチルプロピル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−(3−ヒドロキシ−1,1−ジメチルプロピル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例103に準じ、参考例52で得られた4−(3−{[tert−ブチル(ジメチル)シリル]オキシ}−1,1−ジメチルプロピル)安息香酸を用いて表題化合物を合成した。
融点 225−227℃
MS (ESI+): 390 (M+H)。
1H-NMR (DMSO-d6) δ: 1.31 (6H, s), 1.81-1.88 (2H, m), 3.17-3.25 (2H, m), 4.26 (1H, t, J = 4.9 Hz), 7.49 (2H, d, J = 8.7 Hz), 7.57 (1H, dd, J = 9.5, 1.9 Hz), 7.62 (1H, d, J = 9.5 Hz), 7.69-7.70 (1H, m), 8.04 (2H, d, J = 8.3 Hz), 8.19 (2H, s), 8.34 (1H, s), 9.06 (1H, s), 11.21 (1H, s)。
元素分析値:C22H23N5O2として
計算値:C, 67.85; H, 5.95; N, 17.98。
実測値:C, 67.77; H, 5.90; N, 18.03。
融点 225−227℃
MS (ESI+): 390 (M+H)。
1H-NMR (DMSO-d6) δ: 1.31 (6H, s), 1.81-1.88 (2H, m), 3.17-3.25 (2H, m), 4.26 (1H, t, J = 4.9 Hz), 7.49 (2H, d, J = 8.7 Hz), 7.57 (1H, dd, J = 9.5, 1.9 Hz), 7.62 (1H, d, J = 9.5 Hz), 7.69-7.70 (1H, m), 8.04 (2H, d, J = 8.3 Hz), 8.19 (2H, s), 8.34 (1H, s), 9.06 (1H, s), 11.21 (1H, s)。
元素分析値:C22H23N5O2として
計算値:C, 67.85; H, 5.95; N, 17.98。
実測値:C, 67.77; H, 5.90; N, 18.03。
実施例469
4−tert−ブチル−N−[6−(1H−1,2,4−トリアゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
4−tert−ブチル−N−[6−(1H−1,2,4−トリアゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド
実施例51に準じ、1,2,4−トリアゾールを用いて表題化合物を合成した。
融点 274−276℃
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.54 (2H, d, J = 8.3 Hz), 7.66 (1H, d, J = 9.5 Hz), 7.73-7.78 (1H, m), 8.03 (2H, d, J = 8.3 Hz), 8.29 (1H, s), 8.43 (1H, s), 9.21-9.25 (2H, m), 11.21 (1H, s)。
融点 274−276℃
MS (ESI+): 361 (M+H)。
1H-NMR (DMSO-d6) δ: 1.33 (9H, s), 7.54 (2H, d, J = 8.3 Hz), 7.66 (1H, d, J = 9.5 Hz), 7.73-7.78 (1H, m), 8.03 (2H, d, J = 8.3 Hz), 8.29 (1H, s), 8.43 (1H, s), 9.21-9.25 (2H, m), 11.21 (1H, s)。
実施例470
N−[6−(3−アミノフェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]−4−(トリフルオロメチル)ベンズアミド
N−[6−(3−アミノフェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]−4−(トリフルオロメチル)ベンズアミド
実施例138に準じ、表題化合物を合成した。
MS (m/Z) 414
MS (m/Z) 414
実施例471
N−{3−[(2−{[(1,3−ジメチル−1H−ピラゾール−5−イル)カルボニル]アミノ}イミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}−1,3−ジメチル−1H−ピラゾール−5−カルボキサミド
N−{3−[(2−{[(1,3−ジメチル−1H−ピラゾール−5−イル)カルボニル]アミノ}イミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}−1,3−ジメチル−1H−ピラゾール−5−カルボキサミド
6−(3−アミノフェノキシ)イミダゾ[1,2−b]ピリダジン−2−アミン(100mg,0.41mmol)のN−メチルピロリドン(2mL)溶液に1,3−ジメチル−1H−ピラゾール−5−カルボニル クロリド(163mg,1.03mmol)を加え、室温で4時間撹拌した。反応混合物に酢酸エチルを加え、沈殿物をろ取、エタノールより再結晶化させて、表題化合物(131mg,収率65%)を白色固体として得た。
1H-NMR (DMSO-d6, 300 MHz) δ 2.18 (3H, s), 2.19 (3H, s), 3.98 (3H, s), 4.03 (3H, s), 6.85 (1H, s), 7.00-7.07 (1H, m), 7.03 (1H, s), 7.13 (1H, d, J = 9.6 Hz), 7.44 (1H, t, J = 8.2 Hz), 7.60-7.66 (1H, m), 7.71 (1H, t, J = 2.2 Hz), 8.11 (1H, dd, J = 9.6, 0.6 Hz), 8.17 (1H, s), 10.28 (1H, s), 11.28 (1H, s)。
1H-NMR (DMSO-d6, 300 MHz) δ 2.18 (3H, s), 2.19 (3H, s), 3.98 (3H, s), 4.03 (3H, s), 6.85 (1H, s), 7.00-7.07 (1H, m), 7.03 (1H, s), 7.13 (1H, d, J = 9.6 Hz), 7.44 (1H, t, J = 8.2 Hz), 7.60-7.66 (1H, m), 7.71 (1H, t, J = 2.2 Hz), 8.11 (1H, dd, J = 9.6, 0.6 Hz), 8.17 (1H, s), 10.28 (1H, s), 11.28 (1H, s)。
実施例472
N−[6−(3−{[3−(トリフルオロメチル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]ピロリジン−3−カルボキサミド
N−[6−(3−{[3−(トリフルオロメチル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]ピロリジン−3−カルボキサミド
N−{3−[(2−アミノイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}−3−(トリフルオロメチル)ベンズアミド(150mg,0.363mmol)のN,N−ジメチルホルムアミド(5mL)溶液に1−(tert−ブトキシカルボニル)ピロリジン−3−カルボン酸(117mg,0.544mmol)、N−[3−(ジメチルアミノ)プロピル]−N’−エチルカルボジイミド 塩酸塩(104mg,0.544mmol)、1−ヒドロキシベンゾトリアゾール(74mg,0.544mmol)を加え、室温で15時間攪拌した。反応混合物に飽和塩化アンモニウム水を加え、酢酸エチルを用いて抽出後、抽出液を飽和食塩水で洗浄、無水硫酸マグネシウムで乾燥、ろ過した。減圧下溶媒を留去、残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル/ヘキサン=30/70→100/0)で精製し淡黄色油状物を得た。この油状物とトリフルオロ酢酸(5mL)の混合物を室温で1.5時間攪拌した。反応混合物に飽和重曹水を加え、酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄、無水硫酸マグネシウムで乾燥、ろ過した。残渣をエタノールで洗浄し、表題化合物(134mg,72%)を白色粉末として得た。
1H-NMR (DMSO-d6, 300 MHz) δ 1.95-2.10 (1H, m), 2.16-2.31 (1H, m), 3.13-3.26 (2H, m), 3.34-3.43 (3H, m), 7.01-7.07 (1H, m), 7.12 (1H, d, J = 9.6 Hz), 7.47 (1H, t, J = 8.3 Hz), 7.66 (1H, d, J = 8.3 Hz), 7.74-7.83 (2H, m), 7.94-8.13 (3H, m), 8.22-8.31 (2H, m), 8.84 (1H, brs), 10.62 (1H, s), 11.15 (1H, s)。
1H-NMR (DMSO-d6, 300 MHz) δ 1.95-2.10 (1H, m), 2.16-2.31 (1H, m), 3.13-3.26 (2H, m), 3.34-3.43 (3H, m), 7.01-7.07 (1H, m), 7.12 (1H, d, J = 9.6 Hz), 7.47 (1H, t, J = 8.3 Hz), 7.66 (1H, d, J = 8.3 Hz), 7.74-7.83 (2H, m), 7.94-8.13 (3H, m), 8.22-8.31 (2H, m), 8.84 (1H, brs), 10.62 (1H, s), 11.15 (1H, s)。
実施例473
1−メチル−N−[6−(3−{[3−(トリフルオロメチル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]ピロリジン−3−カルボキサミドの製造
1−メチル−N−[6−(3−{[3−(トリフルオロメチル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]ピロリジン−3−カルボキサミドの製造
N−[6−(3−{[3−(トリフルオロメチル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]ピロリジン−3−カルボキサミド(139mg,0.273mmol)、ホルムアルデヒド(228mg,2.73mmol)、酢酸(1mL)、メタノール(5mL)の混合物にシアノトリヒドロホウ酸ナトリウム(103mg,1.63mmol)を加え、室温で20時間攪拌した。反応混合物に飽和重曹水を加え、酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄、無水硫酸マグネシウムで乾燥、ろ過した。減圧下溶媒を留去、残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル/メタノール=100/0→90/10)で精製し淡黄色粉末(46mg,32%)として得た。
1H-NMR (DMSO-d6, 300 MHz) δ 1.92-2.03 (2H, m), 2.23 (3H, s), 2.32-2.47 (2H, m), 2.54-2.62 (1H, m), 2.74-2.82 (1H, m), 3.08-3.23 (1H, m), 7.00-7.11 (2H, m), 7.46 (1H, t, J = 8.2 Hz), 7.63-7.83 (3H, m), 7.94-8.08 (3H, m), 8.21-8.31 (2H, m), 10.59 (1H, s), 10.78 (1H, s)。
1H-NMR (DMSO-d6, 300 MHz) δ 1.92-2.03 (2H, m), 2.23 (3H, s), 2.32-2.47 (2H, m), 2.54-2.62 (1H, m), 2.74-2.82 (1H, m), 3.08-3.23 (1H, m), 7.00-7.11 (2H, m), 7.46 (1H, t, J = 8.2 Hz), 7.63-7.83 (3H, m), 7.94-8.08 (3H, m), 8.21-8.31 (2H, m), 10.59 (1H, s), 10.78 (1H, s)。
実施例474
3−({[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]アミノ}カルボニル)ピロリジン−1−カルボン酸tert−ブチル
3−({[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]アミノ}カルボニル)ピロリジン−1−カルボン酸tert−ブチル
N−{3−[(2−アミノイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}−3−(1−シアノシクロプロピル)ベンズアミド(300mg,0.731mmol)のN,N−ジメチルホルムアミド(10mL)溶液に1−(tert−ブトキシカルボニル)ピロリジン−3−カルボン酸(188mg,0.877mmol)、N−[3−(ジメチルアミノ)プロピル]−N’−エチルカルボジイミド 塩酸塩(210mg,1.09mmol)、1−ヒドロキシベンゾトリアゾール(148mg,1.09mmol)を加え室温で16時間攪拌した。反応混合物に飽和塩化アンモニウム水溶液を加え、酢酸エチルを用いて抽出後、抽出液を飽和食塩水で洗浄、無水硫酸マグネシウムで乾燥、ろ過した。減圧下溶媒を留去、残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル/ヘキサン=0/100→100/0)で精製し表題化合物(345mg,77%)を緑色粉末として得た。
1H-NMR (DMSO-d6、300 MHz) δ 1.40 (9H, s), 1.57-1.65 (2H, m), 1.77-1.85 (2H, m), 1.93-2.17 (2H, m), 3.16-3.28 (2H, m), 3.33-3.43 (2H, m), 3.46-3.57 (1H, m), 7.02 (1H, dd, J = 8.2, 2.0 Hz), 7.09 (1H, d, J = 9.6 Hz), 7.45 (1H, t, J = 8.2 Hz), 7.51-7.61 (2H, m), 7.65 (1H, d, J = 8.2 Hz), 7.72 (1H, t, J = 2.0 Hz), 7.82 (1H, s), 7.84-7.91 (1H, m), 8.01-8.11 (2H, m), 10.42 (1H, s), 10.97 (1H, brs)。
1H-NMR (DMSO-d6、300 MHz) δ 1.40 (9H, s), 1.57-1.65 (2H, m), 1.77-1.85 (2H, m), 1.93-2.17 (2H, m), 3.16-3.28 (2H, m), 3.33-3.43 (2H, m), 3.46-3.57 (1H, m), 7.02 (1H, dd, J = 8.2, 2.0 Hz), 7.09 (1H, d, J = 9.6 Hz), 7.45 (1H, t, J = 8.2 Hz), 7.51-7.61 (2H, m), 7.65 (1H, d, J = 8.2 Hz), 7.72 (1H, t, J = 2.0 Hz), 7.82 (1H, s), 7.84-7.91 (1H, m), 8.01-8.11 (2H, m), 10.42 (1H, s), 10.97 (1H, brs)。
実施例475
N−[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]ピロリジン−3−カルボキサミド
N−[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]ピロリジン−3−カルボキサミド
tert−ブチル 3−({[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]アミノ}カルボニル)ピロリジン−1−カルボキシラート(290mg,0.477mmol)とトリフルオロ酢酸(5mL)の混合物を室温で4時間攪拌した。反応混合物に飽和重曹水を加え、酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄、無水硫酸マグネシウムで乾燥、ろ過した。残渣をエタノールで洗浄し表題化合物(133mg,55%)を白色粉末として得た。
1H-NMR (DMSO-d6, 300 MHz) δ 1.57-1.64 (2H, m), 1.77-1.85 (2H, m), 1.96-2.14 (1H, m), 2.17-2.36 (1H, m), 3.15-3.27 (2H, m), 3.38 (3H, s), 7.02 (1H, dd, J = 8.0, 1.8 Hz), 7.11 (1H, d, J = 9.5 Hz), 7.45 (1H, t, J = 8.0 Hz), 7.53-7.59 (2H, m), 7.63 (1H, d, J = 8.0 Hz), 7.76 (1H, t, J = 1.8 Hz), 7.82 (1H, s), 7.84-7.89 (1H, m), 8.03 (1H, s), 8.09 (1H, d, J = 9.5 Hz), 8.78 (1H, brs), 10.44 (1H, s), 11.16 (1H, s)。
1H-NMR (DMSO-d6, 300 MHz) δ 1.57-1.64 (2H, m), 1.77-1.85 (2H, m), 1.96-2.14 (1H, m), 2.17-2.36 (1H, m), 3.15-3.27 (2H, m), 3.38 (3H, s), 7.02 (1H, dd, J = 8.0, 1.8 Hz), 7.11 (1H, d, J = 9.5 Hz), 7.45 (1H, t, J = 8.0 Hz), 7.53-7.59 (2H, m), 7.63 (1H, d, J = 8.0 Hz), 7.76 (1H, t, J = 1.8 Hz), 7.82 (1H, s), 7.84-7.89 (1H, m), 8.03 (1H, s), 8.09 (1H, d, J = 9.5 Hz), 8.78 (1H, brs), 10.44 (1H, s), 11.16 (1H, s)。
実施例476
N−[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]−1−メチルピロリジン−3−カルボキサミド
N−[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]−1−メチルピロリジン−3−カルボキサミド
N−[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]ピロリジン−3−カルボキサミド(140mg,2.75mmol)、ホルムアルデヒド(230mg,2.75mmol)、シアノトリヒドロホウ酸ナトリウム(104mg,1.65mmol)、酢酸(1.5mL)、メタノール(3.5mL)を原料として用い、実施例473と同様にして表題化合物(16mg,12%)を淡橙色粉末として得た。
1H-NMR (CDCl3, 300 MHz) δ 1.45-1.52 (2H, m), 1.75-1.83 (2H, m), 2.05-2.17 (1H, m), 2.22-2.43 (2H, m), 2.50 (3H, s), 2.96-3.15 (2H, m), 3.42-3.50 (1H, m), 3.59-3.70 (1H, m), 6.86 (1H, d, J = 9.6 Hz), 6.97-7.05 (1H, m), 7.37-7.63 (4H, m), 7.69 (1H, t, J = 1.9 Hz), 7.71-7.79 (3H, m), 7.95-8.02 (1H, m), 8.15 (1H, s), 9.87 (1H, brs)。
1H-NMR (CDCl3, 300 MHz) δ 1.45-1.52 (2H, m), 1.75-1.83 (2H, m), 2.05-2.17 (1H, m), 2.22-2.43 (2H, m), 2.50 (3H, s), 2.96-3.15 (2H, m), 3.42-3.50 (1H, m), 3.59-3.70 (1H, m), 6.86 (1H, d, J = 9.6 Hz), 6.97-7.05 (1H, m), 7.37-7.63 (4H, m), 7.69 (1H, t, J = 1.9 Hz), 7.71-7.79 (3H, m), 7.95-8.02 (1H, m), 8.15 (1H, s), 9.87 (1H, brs)。
実施例477
N−(3−{[2−(ベンゾイルアミノ)イミダゾ[1,2−b]ピリダジン−6−イル]オキシ}フェニル)−3−(1−シアノシクロプロピル)ベンズアミド
N−(3−{[2−(ベンゾイルアミノ)イミダゾ[1,2−b]ピリダジン−6−イル]オキシ}フェニル)−3−(1−シアノシクロプロピル)ベンズアミド
N−{3−[(2−アミノイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}−3−(1−シアノシクロプロピル)ベンズアミド(150mg,0.365mmol)のN,N−ジメチルアセトアミド(3mL)溶液に塩化ベンゾイル(51μL,0.438mmol)を加え、室温で3時間攪拌した。反応混合物に水を加え、析出した固体をろ過し、水で洗浄し、表題化合物(154mg,82%)を淡緑色粉末として得た。
1H-NMR (DMSO-d6, 300 MHz) δ 1.56-1.65 (2H, m), 1.77-1.85 (2H, m), 7.05 (1H, dd, J = 8.0, 1.8 Hz), 7.12 (1H, d, J = 9.6 Hz), 7.41-7.63 (6H, m), 7.67 (1H, d, J = 9.0 Hz), 7.75 (1H, t, J = 1.8 Hz), 7.83 (1H, s), 7.85-7.91 (1H, m), 8.03-8.15 (3H, m), 8.24 (1H, s), 10.44 (1H, s), 11.33 (1H, s)。
1H-NMR (DMSO-d6, 300 MHz) δ 1.56-1.65 (2H, m), 1.77-1.85 (2H, m), 7.05 (1H, dd, J = 8.0, 1.8 Hz), 7.12 (1H, d, J = 9.6 Hz), 7.41-7.63 (6H, m), 7.67 (1H, d, J = 9.0 Hz), 7.75 (1H, t, J = 1.8 Hz), 7.83 (1H, s), 7.85-7.91 (1H, m), 8.03-8.15 (3H, m), 8.24 (1H, s), 10.44 (1H, s), 11.33 (1H, s)。
実施例478
N−[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]−1,3−オキサゾール−4−カルボキサミド
N−[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]−1,3−オキサゾール−4−カルボキサミド
1,3−オキサゾール−4−カルボン酸(44mg,0.394mmol)のテトラヒドロフラン(3mL)溶液にN,N−ジメチルホルムアミド(1滴)、オキサリルクロライド(57μL,0.657mmol)を加え、室温で1.5時間攪拌した。減圧下溶媒を留去、残渣およびN−{3−[(2−アミノイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}−3−(1−シアノシクロプロピル)ベンズアミド(135mg,0.328mmol)をN−メチルピロリドン(3mL)に溶解させ、室温で18時間攪拌した。反応混合物に飽和重曹水を加え、酢酸エチルで抽出した。抽出液を飽和食塩水で洗浄、無水硫酸マグネシウムで乾燥、ろ過した。減圧下溶媒を留去後、残渣をシリカゲルカラムクロマトグラフィー(酢酸エチル/ヘキサン=30/70→100/0)で精製し、表題化合物(115mg,69%)を淡褐色粉末として得た。
1H-NMR (DMSO-d6, 300 MHz) δ 1.58-1.65 (2H, m), 1.77-1.84 (2H, m), 7.05 (1H, dd, J = 8.2, 2.0 Hz), 7.14 (1H, d, J = 9.6 Hz), 7.46 (1H, t, J = 8.2 Hz), 7.51-7.60 (2H, m), 7.64-7.70 (1H, m), 7.74 (1H, t, J = 2.0 Hz), 7.81-7.84 (1H, m), 7.85-7.90 (1H, m), 8.09-8.18 (2H, m), 8.59 (1H, d, J = 0.8 Hz), 8.89 (1H, d, J = 0.8 Hz), 10.44 (1H, s), 10.75 (1H, s)。
1H-NMR (DMSO-d6, 300 MHz) δ 1.58-1.65 (2H, m), 1.77-1.84 (2H, m), 7.05 (1H, dd, J = 8.2, 2.0 Hz), 7.14 (1H, d, J = 9.6 Hz), 7.46 (1H, t, J = 8.2 Hz), 7.51-7.60 (2H, m), 7.64-7.70 (1H, m), 7.74 (1H, t, J = 2.0 Hz), 7.81-7.84 (1H, m), 7.85-7.90 (1H, m), 8.09-8.18 (2H, m), 8.59 (1H, d, J = 0.8 Hz), 8.89 (1H, d, J = 0.8 Hz), 10.44 (1H, s), 10.75 (1H, s)。
実施例479
N−[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]−3−フルアミド
N−[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]−3−フルアミド
N−{3−[(2−アミノイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}−3−(1−シアノシクロプロピル)ベンズアミド(135mg,0.328mmol)、3−フロ酸(44mg,0.394mmol)、オキサリルクロライド(57μL,0.657mmol)、N,N−ジメチルホルムアミド(1滴)、テトラヒドロフラン(3mL)、N−メチルピロリドン(3mL)を原料として用い、実施例478と同様にして表題化合物(85mg,51%)を淡褐色粉末として得た。
1H-NMR (DMSO-d6, 300 MHz) δ 1.58-1.65 (2H, m), 1.78-1.84 (2H, m), 7.01-7.15 (3H, m), 7.46 (1H, t, J = 8.2 Hz), 7.52-7.61 (2H, m), 7.64-7.70 (1H, m), 7.73 (1H, t, J = 2.1 Hz), 7.78 (1H, t, J = 1.7 Hz), 7.81-7.84 (1H, m), 7.85-7.90 (1H, m), 8.09 (1H, d, J = 9.6 Hz), 8.15 (1H, s), 8.50 (1H, s), 10.43 (1H, s), 11.13 (1H, s)。
1H-NMR (DMSO-d6, 300 MHz) δ 1.58-1.65 (2H, m), 1.78-1.84 (2H, m), 7.01-7.15 (3H, m), 7.46 (1H, t, J = 8.2 Hz), 7.52-7.61 (2H, m), 7.64-7.70 (1H, m), 7.73 (1H, t, J = 2.1 Hz), 7.78 (1H, t, J = 1.7 Hz), 7.81-7.84 (1H, m), 7.85-7.90 (1H, m), 8.09 (1H, d, J = 9.6 Hz), 8.15 (1H, s), 8.50 (1H, s), 10.43 (1H, s), 11.13 (1H, s)。
実施例480
N−[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]チオフェン−3−カルボキサミド
N−[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]チオフェン−3−カルボキサミド
N−{3−[(2−アミノイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}−3−(1−シアノシクロプロピル)ベンズアミド(170mg,0.381mmol)、チオフェン−3−カルボン酸(58mg,0.457mmol)、オキサリルクロライド(66μL,0.762mmol)、N,N−ジメチルホルムアミド(1滴)、テトラヒドロフラン(3mL)、N,N−ジメチルアセトアミド(3mL)を原料として用い、実施例478と同様にして表題化合物(56mg,29%)を淡緑色粉末として得た。
1H-NMR (DMSO-d6, 300 MHz,) δ 1.58-1.65 (2H, m), 1.77-1.85 (2H, m), 7.04 (1H, dd, J = 8.0, 2.0 Hz), 7.12 (1H, d, J = 9.5 Hz), 7.46 (1H, t, J = 8.0 Hz), 7.52-7.60 (2H, m), 7.61-7.76 (4H, m), 7.80-7.84 (1H, m), 7.85-7.91 (1H, m), 8.10 (1H, d, J = 9.5 Hz), 8.18 (1H, s), 8.52 (1H, d, J = 2.0 Hz), 10.44 (1H, s), 11.20 (1H, s)。
1H-NMR (DMSO-d6, 300 MHz,) δ 1.58-1.65 (2H, m), 1.77-1.85 (2H, m), 7.04 (1H, dd, J = 8.0, 2.0 Hz), 7.12 (1H, d, J = 9.5 Hz), 7.46 (1H, t, J = 8.0 Hz), 7.52-7.60 (2H, m), 7.61-7.76 (4H, m), 7.80-7.84 (1H, m), 7.85-7.91 (1H, m), 8.10 (1H, d, J = 9.5 Hz), 8.18 (1H, s), 8.52 (1H, d, J = 2.0 Hz), 10.44 (1H, s), 11.20 (1H, s)。
実施例481
N−[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]−1,3−チアゾール−4−カルボキサミド
N−[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]−1,3−チアゾール−4−カルボキサミド
N−{3−[(2−アミノイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}−3−(1−シアノシクロプロピル)ベンズアミド(100mg,0.224mmol)、1,3−チアゾール−4−カルボン酸(37mg,0.291mmol)、オキサリルクロライド(39μL,0.448mmol)、N,N−ジメチルホルムアミド(1滴)、テトラヒドロフラン(3mL)、N,N−ジメチルアセトアミド(3mL)を原料として用い、実施例478と同様にして表題化合物(76mg,65%)を淡緑色粉末として得た。
1H-NMR (DMSO-d6, 300 MHz,) δ 1.59-1.65 (2H, m), 1.78-1.85 (2H, m), 7.02-7.08 (1H, m), 7.15 (1H, d, J = 9.6 Hz), 7.47 (1H, t, J = 8.2 Hz), 7.54-7.60 (2H, m), 7.65-7.70 (1H, m), 7.74 (1H, t, J = 2.0 Hz), 7.81-7.83 (1H, m), 7.85-7.91 (1H, m), 8.13 (1H, dd, J = 9.6, 0.6 Hz), 8.19 (1H, s), 8.60 (1H, d, J = 2.0 Hz), 9.27 (1H, d, J = 2.0 Hz), 10.45 (1H, s), 10.58 (1H, s).
1H-NMR (DMSO-d6, 300 MHz,) δ 1.59-1.65 (2H, m), 1.78-1.85 (2H, m), 7.02-7.08 (1H, m), 7.15 (1H, d, J = 9.6 Hz), 7.47 (1H, t, J = 8.2 Hz), 7.54-7.60 (2H, m), 7.65-7.70 (1H, m), 7.74 (1H, t, J = 2.0 Hz), 7.81-7.83 (1H, m), 7.85-7.91 (1H, m), 8.13 (1H, dd, J = 9.6, 0.6 Hz), 8.19 (1H, s), 8.60 (1H, d, J = 2.0 Hz), 9.27 (1H, d, J = 2.0 Hz), 10.45 (1H, s), 10.58 (1H, s).
実施例482
N−[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]−1−メチル−1H−ピラゾール−4−カルボキサミド
N−[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]−1−メチル−1H−ピラゾール−4−カルボキサミド
N−{3−[(2−アミノイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}−3−(1−シアノシクロプロピル)ベンズアミド(100mg,0.224mmol)、1−メチル−1H−ピラゾール−4−カルボン酸(36mg,0.291mmol)、オキサリルクロライド(39μL,0.448mmol)、N,N−ジメチルホルムアミド(1滴)、テトラヒドロフラン(3mL)、N,N−ジメチルアセトアミド(3mL)を原料として用い、実施例478と同様にして表題化合物(25mg,22%)を淡緑色粉末として得た。
1H-NMR (DMSO-d6, 300 MHz) δ 1.58-1.65 (2H, m), 1.77-1.85 (2H, m), 3.88 (3H, s), 7.04 (1H, dd, J = 7.8, 2.0 Hz), 7.10 (1H, d, J = 9.6 Hz), 7.46 (1H, t, J = 8.1 Hz), 7.51-7.61 (2H, m), 7.63-7.70 (1H, m), 7.71-7.75 (1H, m), 7.80-7.84 (1H, m), 7.85-7.91 (1H, m), 8.05-8.15 (3H, m), 8.39 (1H, s), 10.44 (1H, s), 11.00 (1H, s).
1H-NMR (DMSO-d6, 300 MHz) δ 1.58-1.65 (2H, m), 1.77-1.85 (2H, m), 3.88 (3H, s), 7.04 (1H, dd, J = 7.8, 2.0 Hz), 7.10 (1H, d, J = 9.6 Hz), 7.46 (1H, t, J = 8.1 Hz), 7.51-7.61 (2H, m), 7.63-7.70 (1H, m), 7.71-7.75 (1H, m), 7.80-7.84 (1H, m), 7.85-7.91 (1H, m), 8.05-8.15 (3H, m), 8.39 (1H, s), 10.44 (1H, s), 11.00 (1H, s).
実施例483
N−[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]−1−メチル−1H−イミダゾール−4−カルボキサミド
N−[6−(3−{[3−(1−シアノシクロプロピル)ベンゾイル]アミノ}フェノキシ)イミダゾ[1,2−b]ピリダジン−2−イル]−1−メチル−1H−イミダゾール−4−カルボキサミド
N−{3−[(2−アミノイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}−3−(1−シアノシクロプロピル)ベンズアミド(170mg,0.381mmol)、1−メチル−1H−イミダゾール−4−カルボン酸(62mg,0.496mmol)、オキサリルクロライド(66μL,0.762mmol)、N,N−ジメチルホルムアミド(1滴)、テトラヒドロフラン(3mL)、N,N−ジメチルアセトアミド(3mL)を原料として用い、実施例478と同様にして表題化合物(144mg,73%)を淡緑色粉末として得た。
1H-NMR (DMSO-d6, 300 MHz) δ 1.58-1.65 (2H, m), 1.78-1.85 (2H, m), 3.73 (3H, s), 7.01-7.07 (1H, m), 7.12 (1H, d, J = 9.6 Hz), 7.46 (1H, t, J = 8.2 Hz), 7.51-7.60 (2H, m), 7.64-7.70 (1H, m), 7.73 (1H, t, J = 2.1 Hz), 7.76-7.83 (2H, m), 7.85-7.91 (2H, m), 8.07-8.14 (2H, m), 9.84 (1H, s), 10.44 (1H, s)。
1H-NMR (DMSO-d6, 300 MHz) δ 1.58-1.65 (2H, m), 1.78-1.85 (2H, m), 3.73 (3H, s), 7.01-7.07 (1H, m), 7.12 (1H, d, J = 9.6 Hz), 7.46 (1H, t, J = 8.2 Hz), 7.51-7.60 (2H, m), 7.64-7.70 (1H, m), 7.73 (1H, t, J = 2.1 Hz), 7.76-7.83 (2H, m), 7.85-7.91 (2H, m), 8.07-8.14 (2H, m), 9.84 (1H, s), 10.44 (1H, s)。
実施例484
3−(1−シアノ−1−メチルエチル)−N−(6−{3−[(シクロプロピルカルボニル)アミノ]フェノキシ}イミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
3−(1−シアノ−1−メチルエチル)−N−(6−{3−[(シクロプロピルカルボニル)アミノ]フェノキシ}イミダゾ[1,2−b]ピリダジン−2−イル)ベンズアミド
3−(1−シアノ−1−メチルエチル)安息香酸(37mg,0.19mmol)、オキサリルクロライド(21μL,0.24mmol)、N,N−ジメチルホルムアミド(1滴)、テトラヒドロフラン(2.0mL)、N−{3−[(2−アミノイミダゾ[1,2−b]ピリダジン−6−イル)オキシ]フェニル}シクロプロパンカルボキサミド(50mg,0.16mmol)、N,N−ジメチルアセタミド(1.0mL)を原料として用い、実施例478と同様にして、表題化合物(55mg,71%)を白色粉末として得た。
1H-NMR (DMSO-d6, 300 MHz) δ 0.79 (4H, d, J = 6.3 Hz), 1.64-1.85 (7H, m), 6.94 (1H, dt, J = 6.6, 2.4 Hz), 7.10 (1H, d, J = 9.6 Hz), 7.29-7.47 (2H, m), 7.50-7.66 (2H, m), 7.70-7.82 (1H, m), 8.03 (1H, ddd, J= 7.8, 1.2, 0.9 Hz), 8.10 (1H, d, J = 9.6 Hz), 8.17-8.26 (2H, m), 10.38 (1H, s), 11.52 (1H, s)。
1H-NMR (DMSO-d6, 300 MHz) δ 0.79 (4H, d, J = 6.3 Hz), 1.64-1.85 (7H, m), 6.94 (1H, dt, J = 6.6, 2.4 Hz), 7.10 (1H, d, J = 9.6 Hz), 7.29-7.47 (2H, m), 7.50-7.66 (2H, m), 7.70-7.82 (1H, m), 8.03 (1H, ddd, J= 7.8, 1.2, 0.9 Hz), 8.10 (1H, d, J = 9.6 Hz), 8.17-8.26 (2H, m), 10.38 (1H, s), 11.52 (1H, s)。
参考例1A:ヒトASK1遺伝子のクローニングと組換えバキュロウイルスの調製
ヒトASK1遺伝子のクローニングは、ヒト心臓cDNA(ベクトンディッキンソン; 商品名:QUICK-Clone cDNA)を 鋳型とし、GenBank にアクセッション番号NM_005923 で登録されているASK1遺伝子の塩基配列を参考に作製したプライマーセット:
ASK1-U: 5’-aaaagtcgacatggactacaaggacgacgatgacaaggtgaacaccattaccgaagagaagggga - 3’(配列番号:1)および
ASK1-L: 5’- aaagcggccgctcaagtctgtttgtttcgaaagtcaatg-3’(配列番号:2)
を用いたPCR法により行った。
PCRはKOD plus DNAポリメラーゼ(東洋紡)添付のプロトコールに従って行った。得られたPCR産物をアガロースゲル(1%)で電気泳動し、ASK1遺伝子を含む2.2kbのDNA断片をゲルから回収した後、制限酵素Not IおよびSal Iで消化した。制限酵素処理したDNAをアガロースゲル(1%)で電気泳動し、得られたDNA断片を回収し、制限酵素Not IおよびSal Iで消化したプラスミドpFASTBAC1 (インビトロジェン)へライゲーションし、発現プラスミドpFB-ASK1を作製した。挿入断片の塩基配列を確認したところ、目的の配列と一致していた。さらに、BAC-TO-BAC Baculovirus Expression System (インビトロジェン)を用いて、組換えバキュロウイルスのウイルスストックBAC-ASK1を調製した。
ヒトASK1遺伝子のクローニングは、ヒト心臓cDNA(ベクトンディッキンソン; 商品名:QUICK-Clone cDNA)を 鋳型とし、GenBank にアクセッション番号NM_005923 で登録されているASK1遺伝子の塩基配列を参考に作製したプライマーセット:
ASK1-U: 5’-aaaagtcgacatggactacaaggacgacgatgacaaggtgaacaccattaccgaagagaagggga - 3’(配列番号:1)および
ASK1-L: 5’- aaagcggccgctcaagtctgtttgtttcgaaagtcaatg-3’(配列番号:2)
を用いたPCR法により行った。
PCRはKOD plus DNAポリメラーゼ(東洋紡)添付のプロトコールに従って行った。得られたPCR産物をアガロースゲル(1%)で電気泳動し、ASK1遺伝子を含む2.2kbのDNA断片をゲルから回収した後、制限酵素Not IおよびSal Iで消化した。制限酵素処理したDNAをアガロースゲル(1%)で電気泳動し、得られたDNA断片を回収し、制限酵素Not IおよびSal Iで消化したプラスミドpFASTBAC1 (インビトロジェン)へライゲーションし、発現プラスミドpFB-ASK1を作製した。挿入断片の塩基配列を確認したところ、目的の配列と一致していた。さらに、BAC-TO-BAC Baculovirus Expression System (インビトロジェン)を用いて、組換えバキュロウイルスのウイルスストックBAC-ASK1を調製した。
参考例2A:組換え型ASK1酵素の調製
Sf-21細胞(インビトロジェン)を10%牛胎児血清を含む150ml Sf-900 II SFM培地(インビトロジェン)に1x106 cells/mlとなるように播種した後、27℃で24時間培養した。得られる培養液に、参考例1Aで得られた組換えバキュロウイルスのウイルスストックBAC-ASK1をそれぞれ150μl添加した後、さらに60時間培養した。培養液を遠心分離(3000rpm、10min)して細胞を分離した後、PBSで細胞を1回洗浄した。細胞を10mlの細胞溶解緩衝液(25mM HEPES (pH 7.5), 1% TritonX, 130mM 塩化ナトリウム, 1mM EDTA, 1mM Dithiothreitol, 25mM β-glycerophosphate, Protease inhibitor Complete (ベーリンガー), 1mM Sodium orthovanadate)に懸濁した後、ホモジナイザー(POLYTRON)で20000rpm、30秒間処理を4回行い、細胞を破砕した。細胞の破砕液を遠心分離(40000rpm、45分間)し、得られる上清からAnti-FLAG M2 Affinity Gel (シグマ社)を用いて、ASK1を精製した。
Sf-21細胞(インビトロジェン)を10%牛胎児血清を含む150ml Sf-900 II SFM培地(インビトロジェン)に1x106 cells/mlとなるように播種した後、27℃で24時間培養した。得られる培養液に、参考例1Aで得られた組換えバキュロウイルスのウイルスストックBAC-ASK1をそれぞれ150μl添加した後、さらに60時間培養した。培養液を遠心分離(3000rpm、10min)して細胞を分離した後、PBSで細胞を1回洗浄した。細胞を10mlの細胞溶解緩衝液(25mM HEPES (pH 7.5), 1% TritonX, 130mM 塩化ナトリウム, 1mM EDTA, 1mM Dithiothreitol, 25mM β-glycerophosphate, Protease inhibitor Complete (ベーリンガー), 1mM Sodium orthovanadate)に懸濁した後、ホモジナイザー(POLYTRON)で20000rpm、30秒間処理を4回行い、細胞を破砕した。細胞の破砕液を遠心分離(40000rpm、45分間)し、得られる上清からAnti-FLAG M2 Affinity Gel (シグマ社)を用いて、ASK1を精製した。
実験例2:ASK1阻害活性の測定
参考例2Aで得られたASK1酵素30ngとミエリンベーシックプロテイン(和光純薬)1μgを含む37.5μl反応溶液(25mM HEPES (pH 7.5)、10 mM酢酸マグネシウム、1mM DTT)にDMSOに溶解した試験化合物を2.5 μl添加した後、室温で5分間保温した。得られる混合液にATP溶液(2.5μM ATP、0.1μCi [γ-32P]ATP)を10μl添加し、室温で30分間反応させた。反応溶液に氷冷した20%トリクロロ酢酸 (和光純薬)を50μl添加して反応を停止させた。4℃で30分間静置させた後、セルハーベスター(パッカード)を用いてGF/Cフィルタープレート(ミリポア)へ酸不溶画分をトランスファーさせた。プレートを45℃で60分間乾燥させ、マイクロシンチ0(パッカード)を40μL添加し、トップカウント(パッカード)を用いて放射活性を測定した。32P の酸不溶画分への取り込みを50%阻害するのに必要な試験化合物の濃度(IC50値)をPRISM3.0(グラフパッドソフトウェア)にて算出した結果を表26に示す。
参考例2Aで得られたASK1酵素30ngとミエリンベーシックプロテイン(和光純薬)1μgを含む37.5μl反応溶液(25mM HEPES (pH 7.5)、10 mM酢酸マグネシウム、1mM DTT)にDMSOに溶解した試験化合物を2.5 μl添加した後、室温で5分間保温した。得られる混合液にATP溶液(2.5μM ATP、0.1μCi [γ-32P]ATP)を10μl添加し、室温で30分間反応させた。反応溶液に氷冷した20%トリクロロ酢酸 (和光純薬)を50μl添加して反応を停止させた。4℃で30分間静置させた後、セルハーベスター(パッカード)を用いてGF/Cフィルタープレート(ミリポア)へ酸不溶画分をトランスファーさせた。プレートを45℃で60分間乾燥させ、マイクロシンチ0(パッカード)を40μL添加し、トップカウント(パッカード)を用いて放射活性を測定した。32P の酸不溶画分への取り込みを50%阻害するのに必要な試験化合物の濃度(IC50値)をPRISM3.0(グラフパッドソフトウェア)にて算出した結果を表26に示す。
製剤例1(カプセルの製造)
1)実施例1の化合物 30 mg
2)微粉末セルロース 10 mg
3)乳糖 19 mg
4)ステアリン酸マグネシウム 1mg
計 60 mg
1)、2)、3)および4)を混合して、ゼラチンカプセルに充填する。
1)実施例1の化合物 30 mg
2)微粉末セルロース 10 mg
3)乳糖 19 mg
4)ステアリン酸マグネシウム 1mg
計 60 mg
1)、2)、3)および4)を混合して、ゼラチンカプセルに充填する。
製剤例2(錠剤の製造)
1)実施例1の化合物 30 g
2)乳糖 50 g
3)トウモロコシデンプン 15 g
4)カルボキシメチルセルロースカルシウム 44 g
5)ステアリン酸マグネシウム 1g
1000錠 計 140 g
1)、2)、3)の全量および30gの4)を水で練合し、真空乾燥後、整粒を行う。この整粒末に14gの4)および1gの5)を混合し、打錠機により打錠する。このようにして、1錠あたり実施例1の化合物30mgを含有する錠剤1000錠を得る。
1)実施例1の化合物 30 g
2)乳糖 50 g
3)トウモロコシデンプン 15 g
4)カルボキシメチルセルロースカルシウム 44 g
5)ステアリン酸マグネシウム 1g
1000錠 計 140 g
1)、2)、3)の全量および30gの4)を水で練合し、真空乾燥後、整粒を行う。この整粒末に14gの4)および1gの5)を混合し、打錠機により打錠する。このようにして、1錠あたり実施例1の化合物30mgを含有する錠剤1000錠を得る。
本発明のASK1阻害剤は、優れた活性を有し、糖尿病、炎症性疾患等の予防・治療剤等の医薬として有用である。
本願は、日本で出願された特願2006−213960を基礎としており、その内容は本明細書にすべて包含されるものである。
Claims (18)
- 式(I):
[式中、
環Aは、さらに置換されていてもよい環を;
R1は、水素原子または置換基を;
R2は、水素原子または置換基を;
R3は、水素原子または置換基を;
R4は、水素原子または置換基を;
R5は、水素原子または置換基を;
R6は、水素原子または置換基を;
Xは、=N−または=C(Z)−(Zは、水素原子または置換基を示す)を示し;
Xが=C(Z)−である場合、ZとR6が結合して、それらが結合する炭素原子と共に、置換されていてもよい環を形成してもよい。
但し、Xが=CH−である場合、R6は置換されていてもよい2−ピペリジニルでない]で表される化合物(但し、N−イミダゾ[1,2−a]ピリジン−2−イル−4−メチル−ベンズアミド、N−イミダゾ[1,2−a]ピリジン−2−イル−ベンズアミドおよびN−(7−メチルイミダゾ[1,2−a]ピリジン−2−イル)−ベンズアミドを除く。)またはその塩。 - Xが=C(Z)−(Zは、水素原子または置換基を示す)である請求項1記載の化合物。
- Xが=N−であり、環Aがさらに置換基を有していてもよい芳香族炭化水素または置換基を有していてもよい5員の複素環である請求項1記載の化合物。
- R1が、
(1) 水素原子、
(2) (a) 芳香族複素環基、
(b) (i) C1−6アルキル、
(ii) ヒドロキシおよび芳香族複素環基から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル−カルボニル、
(iii) C6−14アリール−カルボニル、
(iv) C1−6アルキル−スルホニル、および
(v) 芳香族複素環−カルボニル、
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(c) シアノ、
(d) カルボキシル、
(e) C1−6アルコキシ−カルボニル、
(f) N−ヒドロキシカルバモイル、
(g) (i)シアノ、(ii)ヒドロキシ、(iii)芳香族複素環基、および(iv)C1−6アルキルを1ないし3個有していてもよい非芳香族複素環基から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキルでモノまたはジ置換されていてもよいカルバモイル、
(h) ハロゲン原子、
(i) ジC1−6アルキルホスホリル、
(j) ヒドロキシ、ならびに
(k) 非芳香族複素環基
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル;
(3) (a) C1−6アルコキシ−カルボニル、および
(b) カルボキシル
から選ばれる1ないし3個の置換基で置換されていてもよいC3−10シクロアルキル;
(4) 芳香族複素環基;
(5) C1−6アルキルで置換されていてもよいヒドロキシ;
(6) (a) C1−6アルキル、および
(b) C1−6アルキル−スルホニル
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(7) シアノ;
(8) カルボキシル;
(9) C1−6アルコキシ−カルボニル;
(10) C1−6アルキル−スルホニル;
(11) (a) C1−6アルキル、および
(b) C1−6アルキル−カルボニル
から選ばれる置換基でモノまたはジ置換されていてもよいスルファモイル;あるいは
(12) ハロゲン原子
である請求項2または3記載の化合物。 - R2が水素原子である請求項2または3記載の化合物。
- R3が水素原子、C1−6アルキルまたはハロゲン原子である請求項2または3記載の化合物。
- R4が水素原子である請求項2または3記載の化合物。
- R5が水素原子である請求項2または3記載の化合物。
- R6が、
(1) 水素原子;
(2) (a) ヒドロキシ、
(b) C1−6アルキルでモノまたはジ置換されていてもよいアミノ、および
(c) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル;
(3) (a) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(b) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルコキシ、
(c) C1−6アルコキシ−カルボニル、
(d) (i)C1−6アルキル、および
(ii) C1−6アルキル−カルボニル
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(e) C1−6アルキル−スルホニル、
(f) シアノ、ならびに
(g) C1−3アルキレンジオキシ
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール;
(4) (a) (i) 非芳香族複素環基で置換されていてもよいヒドロキシ、および
(ii) シアノ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、
(b) C6−14アリール、
(c) 芳香族複素環基、
(d) C1−6アルコキシ、ならびに
(e) ハロゲン原子
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基;
(5) (a) (i) C6−14アリール、
(ii) 芳香族複素環基、および
(iii) C1−6アルキルで置換されていてもよいヒドロキシ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、
(b) C1−6アルコキシ、およびハロゲン原子から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール、
(c) 芳香族複素環基、
(d) ヒドロキシ、
(e) C1−6アルキル−カルボニルでモノまたはジ置換されていてもよいアミノ、
(f) カルボキシル、
(g) C7−13アラルキルでモノまたはジ置換されていてもよいカルバモイル、
(h) C1−6アルキル−スルホニル、ならびに
(i) C6−14アリール−スルホニル
から選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基;
(6) (a) (i) (A) ハロゲン原子、
(B) C1−6アルキルでモノまたはジ置換されていてもよいアミノ、および
(C) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキルで1ないし3個置換されていてもよい芳香族複素環基
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、
(ii)1ないし3個のC1−6アルキルで置換されていてもよい芳香族複素環基、
(iii) 非芳香族複素環基、
(iv) (A)ハロゲン原子および(B)カルボキシルから選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルコキシ、
(v) (A) C1−6アルキル、
(B) C1−6アルキル−カルボニル、
(C) C3−10シクロアルキル−カルボニル、
(D) (1’)1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、(2’)ハロゲン原子、および(3’)1ないし3個のシアノで置換されていてもよいC3−10シクロアルキルから選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール−カルボニル、ならびに
(E) 1ないし3個のC1−6アルキルで置換されていてもよい芳香族複素環−カルボニル
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ、
(vi) カルボキシル、ならびに
(vii) C1−6アルキルおよびオキソから選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環−カルボニル
から選ばれる1ないし3個の置換基で置換されていてもよいC6−14アリール、
(b) (i) C1−6アルキル、
(ii) C1−6アルキル−カルボニル、および
(iii) カルボキシル
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基、ならびに
(c) C1−6アルキルおよびオキソから選ばれる1ないし3個の置換基で置換されていてもよい非芳香族複素環基
から選ばれる置換基で置換されていてもよいヒドロキシ;
(7) (a) (i) 1ないし3個のハロゲン原子で置換されていてもよいC1−6アルキル、
(ii) C6−14アリール、および
(iii) 芳香族複素環基
から選ばれる1ないし3個の置換基で置換されていてもよい芳香族複素環基、
で置換されていてもよいメルカプト;
(8) (a) (i) 芳香族複素環基、
(ii) ヒドロキシ、
(iii) C1−6アルコキシ、および
(iv) C1−6アルキルでモノまたはジ置換されていてもよいアミノ
から選ばれる1ないし3個の置換基で置換されていてもよいC1−6アルキル、
(b) C3−10シクロアルキル、
(c) C7−13アラルキル、ならびに
(d) 1ないし3個のC1−6アルキルで置換されていてもよい非芳香族複素環基
から選ばれる置換基でモノまたはジ置換されていてもよいアミノ;
(9) シアノ;
(10) 1ないし3個のヒドロキシで置換されていてもよいC1−6アルキル−カルボニル;
(11) ハロゲン原子;あるいは
(12) オキソで置換されていてもよいC3−10シクロアルカンと縮合したC6−14アリールで置換されたヒドロキシである請求項2または3記載の化合物。 - Zが、水素原子、または1ないし3個のヒドロキシで置換されていてもよいC1−6アルキルであるか、あるいは、ZとR6が結合して、それらが結合する炭素原子と共に、それぞれ1ないし3個のC1−6アルキルで置換されていてもよい、芳香族炭化水素または複素環を形成する請求項2記載の化合物。
- 下記化合物またはその塩。
4−tert−ブチル−N−(1,2−ジヒドロフロ[2,3−e]イミダゾ[1,2−a]ピリジン−7−イル)ベンズアミド、
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド、
6−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ニコチンアミド、
4−(2−ヒドロキシ−1,1−ジメチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド、
4−tert−ブチル−N−[6−(1H−ピラゾール−4−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド、
4−(1−シアノ−1−メチルエチル)−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−a]ピリジン−2−イル]ベンズアミド、
4−tert−ブチル−N−[6−(1H−イミダゾール−1−イル)イミダゾ[1,2−b]ピリダジン−2−イル]ベンズアミド。 - 請求項1記載の化合物のプロドラッグ。
- 請求項1記載の化合物またはそのプロドラッグを含有してなる、医薬。
- ASK1阻害剤である、請求項13記載の医薬。
- 糖尿病の予防または治療剤である、請求項13記載の医薬。
- 炎症性疾患の予防または治療剤である、請求項13記載の医薬。
- 哺乳動物に対し請求項1記載の化合物またはそのプロドラッグの有効量を投与することを特徴とする糖尿病および/または炎症性疾患の予防・治療方法。
- 糖尿病および/または炎症性疾患の予防・治療剤を製造するための請求項1記載の化合物またはそのプロドラッグの使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2006213960 | 2006-08-04 | ||
| JP2006213960 | 2006-08-04 | ||
| PCT/JP2007/065227 WO2008016131A1 (fr) | 2006-08-04 | 2007-08-03 | Composé hétérocyclique à cycles fusionnés |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JPWO2008016131A1 true JPWO2008016131A1 (ja) | 2009-12-24 |
Family
ID=38997304
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008527796A Abandoned JPWO2008016131A1 (ja) | 2006-08-04 | 2007-08-03 | 縮合複素環化合物 |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US20100029619A1 (ja) |
| EP (1) | EP2058309A4 (ja) |
| JP (1) | JPWO2008016131A1 (ja) |
| WO (1) | WO2008016131A1 (ja) |
Families Citing this family (77)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PT1976828T (pt) | 2005-12-29 | 2017-03-10 | Celtaxsys Inc | Derivados de diamina como inibidores de leucotrieno a4 hidrolase |
| PE20070978A1 (es) * | 2006-02-14 | 2007-11-15 | Novartis Ag | COMPUESTOS HETEROCICLICOS COMO INHIBIDORES DE FOSFATIDILINOSITOL 3-QUINASAS (PI3Ks) |
| PE20080538A1 (es) | 2006-08-04 | 2008-06-18 | Takeda Pharmaceutical | Derivado heterociclico fusionado y su uso |
| EP2162445B1 (en) | 2007-06-05 | 2013-11-27 | Takeda Pharmaceutical Company Limited | Heterobicyclic compounds as kinase inhibitors |
| JP5561702B2 (ja) | 2007-08-02 | 2014-07-30 | アムジエン・インコーポレーテツド | Pi3キナーゼ調節剤および使用方法 |
| EP2025674A1 (de) | 2007-08-15 | 2009-02-18 | sanofi-aventis | Substituierte Tetrahydronaphthaline, Verfahren zu ihrer Herstellung und ihre Verwendung als Arzneimittel |
| US8058274B2 (en) * | 2007-08-17 | 2011-11-15 | Icagen, Inc. | Heterocycles as potassium channel modulators |
| US8431608B2 (en) * | 2007-08-17 | 2013-04-30 | Icagen Inc. | Heterocycles as potassium channel modulators |
| US8324395B2 (en) | 2007-08-23 | 2012-12-04 | Takeda Pharmaceutical Company Limited | Heterocyclic compound and use thereof |
| AU2008343813B2 (en) * | 2007-12-19 | 2012-04-12 | Amgen Inc. | Inhibitors of PI3 kinase |
| US8461163B2 (en) | 2008-03-31 | 2013-06-11 | Takeda Pharmaceutical Company Limited | Substituted N-(pyrazolo[1,5-a]pyrimidin-5-yl)amides as inhibitors of apoptosis signal-regulating kinase 1 |
| EP2444403A1 (en) | 2008-04-18 | 2012-04-25 | Shionogi Co., Ltd. | Heterocyclic compound having inhibitory activity on PI3K |
| AR071523A1 (es) * | 2008-04-30 | 2010-06-23 | Merck Serono Sa | Compuestos biciclicos fusionados, un proceso para su preparacion, el compuesto para ser utilizado como medicamento en el tratamiento y profilaxis de enfermedades, una composicion farmaceutica y un conjunto que comprende paquetes separados del compuesto y de un ingrediente activo del medicamento |
| US8445509B2 (en) | 2008-05-08 | 2013-05-21 | Takeda Pharmaceutical Company Limited | Fused heterocyclic derivatives and use thereof |
| KR101324804B1 (ko) * | 2008-05-13 | 2013-11-01 | 아이알엠 엘엘씨 | 키나제 억제제로서의 질소 함유 융합 헤테로사이클 및 그의 조성물 |
| JP2011525183A (ja) | 2008-06-20 | 2011-09-15 | ブリストル−マイヤーズ スクイブ カンパニー | キナーゼ阻害剤として有用なイミダゾピリジンおよびイミダゾピラジン化合物 |
| WO2010007099A1 (en) * | 2008-07-15 | 2010-01-21 | Cellzome Limited | 2-aminoimidazo[1,2-b]pyridazine derivatives as pi3k inhibitors |
| CA2738026C (en) * | 2008-09-22 | 2017-01-24 | Array Biopharma Inc. | Substituted imidazo[1,2b]pyridazine compounds as trk kinase inhibitors |
| AU2009308465B2 (en) | 2008-10-22 | 2015-02-12 | Array Biopharma Inc. | Substituted pyrazolo[1,5-a]pyrimidine compounds as TRK kinase inhibitors |
| US8697874B2 (en) | 2008-12-01 | 2014-04-15 | Takeda Pharmaceutical Company Limited | Heterocyclic compound and use thereof |
| JO3101B1 (ar) | 2008-12-02 | 2017-09-20 | Takeda Pharmaceuticals Co | مشتقات بنزوثيازول كعوامل مضادة للسرطان |
| AR077468A1 (es) | 2009-07-09 | 2011-08-31 | Array Biopharma Inc | Compuestos de pirazolo (1,5 -a) pirimidina sustituidos como inhibidores de trk- quinasa |
| TWI491606B (zh) | 2009-07-13 | 2015-07-11 | Gilead Sciences Inc | 調節細胞凋亡信號之激酶的抑制劑 |
| WO2011041293A1 (en) * | 2009-09-30 | 2011-04-07 | Takeda Pharmaceutical Company Limited | Pyrazolo [1, 5-a] pyrimidine derivatives as apoptosis signal-regulating kinase 1 inhibitors |
| SI2531501T1 (sl) * | 2010-02-03 | 2014-04-30 | Takeda Pharmaceutical Company Limited | Inhibitorji kinaze-1, ki regulirajo signal apoptoze |
| WO2011107494A1 (de) | 2010-03-03 | 2011-09-09 | Sanofi | Neue aromatische glykosidderivate, diese verbindungen enthaltende arzneimittel und deren verwendung |
| DK2918588T3 (en) | 2010-05-20 | 2017-08-28 | Array Biopharma Inc | Macrocyclic compounds as TRK kinase inhibitors |
| US8933024B2 (en) | 2010-06-18 | 2015-01-13 | Sanofi | Azolopyridin-3-one derivatives as inhibitors of lipases and phospholipases |
| KR101759759B1 (ko) * | 2010-07-02 | 2017-07-19 | 길리애드 사이언시즈, 인코포레이티드 | 세포자멸사 신호-조절 키나아제 저해제 |
| WO2012011548A1 (ja) * | 2010-07-23 | 2012-01-26 | 国立大学法人 東京大学 | 含窒素複素環誘導体 |
| ES2617339T3 (es) * | 2010-12-16 | 2017-06-16 | Calchan Limited | Derivados de pirrolopirimidina inhibidores de ASK1 |
| EP2567959B1 (en) | 2011-09-12 | 2014-04-16 | Sanofi | 6-(4-hydroxy-phenyl)-3-styryl-1h-pyrazolo[3,4-b]pyridine-4-carboxylic acid amide derivatives as kinase inhibitors |
| CN102516244B (zh) * | 2011-12-02 | 2013-08-28 | 山东大学 | 六元芳杂环并咪唑巯乙酰胺类衍生物及其制备方法与应用 |
| UY34573A (es) | 2012-01-27 | 2013-06-28 | Gilead Sciences Inc | Inhibidor de la quinasa que regula la señal de la apoptosis |
| CN104837844B (zh) * | 2012-12-21 | 2017-08-29 | 百时美施贵宝公司 | 作为酪蛋白激酶1 d/e抑制剂的吡唑取代的咪唑并哌嗪 |
| EP2935271B1 (en) * | 2012-12-21 | 2017-10-25 | Bristol-Myers Squibb Company | Novel substituted imidazoles as casein kinase 1 / inhibitors |
| ES2864862T3 (es) | 2013-03-12 | 2021-10-14 | Celltaxis Llc | Métodos de inhibición de la leucotrieno A4 hidrolasa |
| JP2016513681A (ja) | 2013-03-14 | 2016-05-16 | セルタクシス,インコーポレイテッド | ロイコトリエンa4加水分解酵素の阻害剤 |
| RU2690489C2 (ru) | 2013-03-14 | 2019-06-04 | Селтакссис, Инк. | Ингибиторы лейкотриен а4-гидролазы |
| JP6534650B2 (ja) * | 2013-03-14 | 2019-06-26 | セルタクシス,インコーポレイテッド | ロイコトリエンa4加水分解酵素の阻害剤 |
| WO2014197313A2 (en) | 2013-05-30 | 2014-12-11 | Kala Pharmaceuticals, Inc. | Novel compounds and uses thereof |
| WO2015143652A1 (en) * | 2014-03-26 | 2015-10-01 | Merck Sharp & Dohme Corp. | TrkA KINASE INHIBITORS,COMPOSITIONS AND METHODS THEREOF |
| JP6564406B2 (ja) * | 2014-06-19 | 2019-08-21 | ブリストル−マイヤーズ スクイブ カンパニーBristol−Myers Squibb Company | カゼインキナーゼ1デルタ/イプシロン阻害剤としてのイミダゾ−ピリダジン誘導体 |
| EP3197448B1 (en) | 2014-09-24 | 2019-04-24 | Gilead Sciences, Inc. | Methods of treating liver disease |
| US10799505B2 (en) | 2014-11-16 | 2020-10-13 | Array Biopharma, Inc. | Crystalline form of (S)-N-(5-((R)-2-(2,5-difluorophenyl)-pyrrolidin-1-yl)-pyrazolo[1,5-A]pyrimidin-3-yl)-3-hydroxypyrrolidine-1-carboxamide hydrogen sulfate |
| WO2016086026A1 (en) | 2014-11-26 | 2016-06-02 | Kala Pharmaceuticals, Inc. | Crystalline forms of a therapeutic compound and uses thereof |
| MA41252A (fr) | 2014-12-23 | 2017-10-31 | Gilead Sciences Inc | Formes solides d'un inhibiteur d'ask 1 |
| EP3237404B1 (en) | 2014-12-23 | 2020-11-11 | Gilead Sciences, Inc. | Processes for preparing ask1 inhibitors |
| WO2016161572A1 (en) * | 2015-04-08 | 2016-10-13 | Merck Sharp & Dohme Corp. | TrkA KINASE INHIBITORS, COMPOSITIONS AND METHODS THEREOF |
| KR20180102544A (ko) | 2015-10-26 | 2018-09-17 | 더 리전츠 오브 더 유니버시티 오브 콜로라도, 어 바디 코퍼레이트 | Trk 억제제-내성 암에서의 점 돌연변이 및 이의 관련 방법 |
| CN105418615B (zh) * | 2015-12-09 | 2018-02-02 | 北京工业大学 | 苯甲酰胺衍生物及制备和应用 |
| US10045991B2 (en) | 2016-04-04 | 2018-08-14 | Loxo Oncology, Inc. | Methods of treating pediatric cancers |
| NZ747135A (en) | 2016-04-04 | 2025-05-02 | Loxo Oncology Inc | Liquid formulations of (s)-n-(5-((r)-2-(2,5-difluorophenyl)-pyrrolidin-1-yl)-pyrazolo[1,5-a]pyrimidin-3-yl)-3-hydroxypyrrolidine-1-carboxamide |
| RS61463B1 (sr) | 2016-05-18 | 2021-03-31 | Loxo Oncology Inc | Priprema (s)-n-(5-((r)-2-(2,5-difluorofenil)pirolidin-1-il)pirazolo[1,5-a]pirimidin-3-il) -3-hidroksipirolidin-1-karboksamida |
| CN107641118B (zh) * | 2016-07-22 | 2020-11-06 | 爱科诺生物医药股份有限公司 | 具有细胞坏死抑制活性的化合物及其组合物和应用 |
| JOP20190092A1 (ar) | 2016-10-26 | 2019-04-25 | Array Biopharma Inc | عملية لتحضير مركبات بيرازولو[1، 5-a]بيريميدين وأملاح منها |
| WO2018157857A1 (zh) | 2017-03-03 | 2018-09-07 | 江苏豪森药业集团有限公司 | 凋亡信号调节激酶抑制剂及其制备方法和应用 |
| JOP20190213A1 (ar) | 2017-03-16 | 2019-09-16 | Array Biopharma Inc | مركبات حلقية ضخمة كمثبطات لكيناز ros1 |
| PL3621615T3 (pl) | 2017-05-12 | 2024-03-25 | Enanta Pharmaceuticals, Inc. | Inhibitory regulujące sygnał apoptozy kinazy 1 i sposoby ich stosowania |
| WO2018218044A2 (en) | 2017-05-25 | 2018-11-29 | Enanta Pharmaceuticals Inc | Apoptosis signal-regulating kinase 1 inhibitors and methods of use thereof |
| WO2018218042A1 (en) | 2017-05-25 | 2018-11-29 | Enanta Pharmaceuticals, Inc. | Apoptosis signal-regulating kinase 1 inhibitors and methods of use thereof |
| WO2018218051A1 (en) | 2017-05-25 | 2018-11-29 | Enanta Pharmaceuticals, Inc. | Apoptosis signal-regulating kinase 1 inhibitors and methods of use thereof |
| CN110770233B (zh) * | 2017-06-19 | 2022-07-26 | 广东东阳光药业有限公司 | 稠合双环类化合物及其在药物中的应用 |
| GB201711234D0 (en) | 2017-07-12 | 2017-08-23 | Galapagos Nv | Pyrrolopyrimidine and pyrrolopyridine derivatives |
| WO2019046186A1 (en) | 2017-08-28 | 2019-03-07 | Enanta Pharmaceuticals, Inc. | INHIBITORS OF KINASE 1 REGULATING THE APOPTOTIC SIGNAL CONTAINING TETRAZOLES AND METHODS OF USE THEREOF |
| PL3692023T3 (pl) | 2017-10-02 | 2023-12-11 | 1ST Biotherapeutics, Inc. | Związki benzotiazolowe i sposoby ich stosowania w leczeniu zaburzeń neurodegeneracyjnych |
| US10683289B2 (en) | 2018-05-02 | 2020-06-16 | Enanta Pharmaceuticals, Inc. | Apoptosis signal-regulating kinase 1 inhibitors and methods of use thereof |
| BR112020022114A2 (pt) | 2018-05-02 | 2021-01-26 | Enanta Pharmaceuticals, Inc. | tetrazol contendo inibidores de quinase-1 reguladora de sinal de apoptose e métodos de uso do mesmo |
| AU2019278935B2 (en) | 2018-05-31 | 2025-02-13 | Celltaxis, Llc | Method of reducing pulmonary exacerbations in respiratory disease patients |
| WO2020041417A1 (en) | 2018-08-22 | 2020-02-27 | Enanta Pharmaceuticals, Inc. | Cycloalkyl-containing apoptosis signal-regulating kinase 1 inhibitors and methods of use thereof |
| US11345699B2 (en) | 2018-11-19 | 2022-05-31 | Enanta Pharmaceuticals, Inc. | Apoptosis signal-regulating kinase 1 inhibitors and methods of use thereof |
| WO2020120576A1 (en) * | 2018-12-11 | 2020-06-18 | Fundació Institut De Recerca Biomèdica (Irb Barcelona) | p38α AUTOPHOSPHORYLATION INHIBITORS |
| JP2022521537A (ja) | 2019-02-22 | 2022-04-08 | ファースト・バイオセラピューティクス・インコーポレイテッド | イミダゾピリジニル化合物及び増殖性障害の処置のためのその使用 |
| US11466033B2 (en) | 2019-03-25 | 2022-10-11 | Enanta Pharmaceuticals, Inc. | Substituted pyridines as apoptosis signal-regulating kinase 1 inhibitors |
| WO2020201773A1 (en) * | 2019-04-05 | 2020-10-08 | Storm Therapeutics Ltd | Mettl3 inhibitory compounds |
| US20230391770A1 (en) * | 2020-10-06 | 2023-12-07 | Storm Therapeutics Limited | Mettl3 inhibitory compounds |
| CN117285520A (zh) * | 2022-06-24 | 2023-12-26 | 上海科技大学 | 甲酰胺类衍生物的医药用途、甲酰胺类衍生物、包含其的药物组合物 |
Family Cites Families (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3701780A (en) * | 1970-09-18 | 1972-10-31 | Merck & Co Inc | Imidazo(1,2-a)pyridines |
| WO1997010224A1 (en) | 1995-09-13 | 1997-03-20 | Takeda Chemical Industries, Ltd. | Benzoxazepine compounds, their production and use as lipid lowering agents |
| US6025372A (en) | 1997-04-04 | 2000-02-15 | Merck & Co., Inc. | Somatostatin agonists |
| US6057338A (en) | 1997-04-04 | 2000-05-02 | Merck & Co., Inc. | Somatostatin agonists |
| AU751139B2 (en) * | 1997-10-13 | 2002-08-08 | Astellas Pharma Inc. | Amide derivative |
| AU1285499A (en) | 1997-10-30 | 1999-05-24 | Merck & Co., Inc. | Somatostatin agonists |
| AR035016A1 (es) | 1999-08-25 | 2004-04-14 | Takeda Chemical Industries Ltd | Composicion de azol promotor de produccion/secrecion de neurotrofina, compuesto prodroga del mismo, composicion farmaceutica que lo comprende y uso del mismo para preparar esta ultima. |
| WO2001025228A1 (fr) | 1999-10-07 | 2001-04-12 | Tadeka Chemical Industries, Ltd. | Derives d'amines |
| ES2225252T3 (es) | 1999-11-10 | 2005-03-16 | Takeda Chemical Industries, Ltd. | Compuestos n-heterociclicos de 5 miembros con actividad hipoglucemica e hipolipidemica. |
| AU2001252596A1 (en) | 2000-04-28 | 2001-11-12 | Takeda Chemical Industries Ltd. | Melanin concentrating hormone antagonists |
| WO2001087834A1 (fr) | 2000-05-16 | 2001-11-22 | Takeda Chemical Industries, Ltd. | Antagoniste de l'hormone de concentration de la melanine |
| JPWO2002038179A1 (ja) | 2000-11-10 | 2004-03-11 | キッセイ薬品工業株式会社 | 小胞体ストレス関連疾患の予防又は治療剤 |
| US20030083535A1 (en) | 2001-06-20 | 2003-05-01 | Conoco Inc. | Circulating Catalyst system and method for conversion of light hydrocarbons to aromatics |
| US20050245571A1 (en) | 2001-10-19 | 2005-11-03 | Hidenori Abe | Amine derivative |
| JP4488720B2 (ja) * | 2002-11-22 | 2010-06-23 | 武田薬品工業株式会社 | アポトーシス関連蛋白質およびその用途 |
| WO2004048565A1 (ja) * | 2002-11-22 | 2004-06-10 | Takeda Pharmaceutical Company Limited | アポトーシス関連蛋白質およびその用途 |
| WO2004103991A1 (fr) | 2003-05-20 | 2004-12-02 | 'chemical Diversity Research Institute', Ltd. | Piperidines 2-substituees, bibliotheque focalisee et composition pharmaceutique |
| DE10356579A1 (de) * | 2003-12-04 | 2005-07-07 | Merck Patent Gmbh | Aminderivate |
| JP4659736B2 (ja) | 2004-04-27 | 2011-03-30 | 武田薬品工業株式会社 | スクリーニング方法 |
| TW200633990A (en) * | 2004-11-18 | 2006-10-01 | Takeda Pharmaceuticals Co | Amide compound |
| PE20070978A1 (es) * | 2006-02-14 | 2007-11-15 | Novartis Ag | COMPUESTOS HETEROCICLICOS COMO INHIBIDORES DE FOSFATIDILINOSITOL 3-QUINASAS (PI3Ks) |
-
2007
- 2007-08-03 EP EP07791901A patent/EP2058309A4/en not_active Withdrawn
- 2007-08-03 JP JP2008527796A patent/JPWO2008016131A1/ja not_active Abandoned
- 2007-08-03 US US12/376,054 patent/US20100029619A1/en not_active Abandoned
- 2007-08-03 WO PCT/JP2007/065227 patent/WO2008016131A1/ja active Application Filing
Also Published As
| Publication number | Publication date |
|---|---|
| EP2058309A4 (en) | 2010-12-22 |
| US20100029619A1 (en) | 2010-02-04 |
| WO2008016131A1 (fr) | 2008-02-07 |
| EP2058309A1 (en) | 2009-05-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20100029619A1 (en) | Fused heterocyclic compound | |
| JP5260507B2 (ja) | インドール化合物 | |
| JP5306818B2 (ja) | 縮合複素環化合物 | |
| JP5094394B2 (ja) | 縮合複素環化合物 | |
| US20090286791A1 (en) | Amide Compounds | |
| KR101616140B1 (ko) | 복소환 화합물 | |
| US8124617B2 (en) | Imidazopyridine compounds | |
| CN104981457B (zh) | 杂环化合物 | |
| JP5657518B2 (ja) | 縮合複素環化合物 | |
| JPWO2007013691A1 (ja) | スピロ環化合物 | |
| JPWO2007119833A1 (ja) | 含窒素複素環化合物 | |
| JPWO2008090944A1 (ja) | スピロ環化合物 | |
| JP2009196966A (ja) | ピラゾリジンジオン誘導体 | |
| TW201536758A (zh) | 雜環化合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20100402 |
|
| A762 | Written abandonment of application |
Free format text: JAPANESE INTERMEDIATE CODE: A762 Effective date: 20111031 |