JP7222866B2 - Lithium metal composite oxide powder, positive electrode active material for lithium secondary battery, positive electrode, and lithium secondary battery - Google Patents
Lithium metal composite oxide powder, positive electrode active material for lithium secondary battery, positive electrode, and lithium secondary battery Download PDFInfo
- Publication number
- JP7222866B2 JP7222866B2 JP2019184759A JP2019184759A JP7222866B2 JP 7222866 B2 JP7222866 B2 JP 7222866B2 JP 2019184759 A JP2019184759 A JP 2019184759A JP 2019184759 A JP2019184759 A JP 2019184759A JP 7222866 B2 JP7222866 B2 JP 7222866B2
- Authority
- JP
- Japan
- Prior art keywords
- metal composite
- lithium
- positive electrode
- composite oxide
- oxide powder
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
Landscapes
- Inorganic Compounds Of Heavy Metals (AREA)
- Battery Electrode And Active Subsutance (AREA)
Description
本発明は、リチウム金属複合酸化物粉末、リチウム二次電池用正極活物質、正極、及びリチウム二次電池に関する。 TECHNICAL FIELD The present invention relates to a lithium metal composite oxide powder, a positive electrode active material for lithium secondary batteries, a positive electrode, and a lithium secondary battery.
リチウム二次電池用正極活物質には、リチウム金属複合酸化物粉末が用いられている。
リチウム二次電池は、既に携帯電話用途やノートパソコン用途などの小型電源だけでなく、自動車用途や電力貯蔵用途などの中型又は大型電源においても、実用化が進んでいる。
A lithium metal composite oxide powder is used as a positive electrode active material for lithium secondary batteries.
Lithium secondary batteries have already been put to practical use not only as small-sized power sources for mobile phones and notebook computers, but also as medium- or large-sized power sources for automobiles and power storage.
リチウム金属複合酸化物粉末の粒子形状は、正極活物質として用いた際のプレス時の充填性等に影響を及ぼす。 The particle shape of the lithium metal composite oxide powder affects the filling properties during pressing when used as a positive electrode active material.
例えば特許文献1には、平均円形度が0.05以上0.6以下の二次粒子を有するリチウム二次電池用正極活物質が記載されている。特許文献1には、二次粒子の円形度が上記の範囲であることにより、導電助剤との接触が向上し、高出力充放電が可能となったことが記載されている。特許文献1には、平均円形度が1の場合は、正極活物質が球体(真球)であることを意味し、平均円形度が小さくなるほど、正極活物質の形状が球状から遠ざかることを意味することが記載されている。
For example,
特許文献1に記載のようなリチウム二次電池用正極活物質においては、体積容量、及び体積容量維持率を向上させる観点から改良の余地があった。
本発明は、体積容量と体積容量維持率が高いリチウム金属複合酸化物粉末、リチウム二次電池用正極活物質、正極、及びリチウム二次電池を提供することを目的とする。
In the positive electrode active material for lithium secondary batteries as described in
An object of the present invention is to provide a lithium metal composite oxide powder, a positive electrode active material for a lithium secondary battery, a positive electrode, and a lithium secondary battery having high volume capacity and volume capacity retention rate.
すなわち、本発明は、下記[1]~[8]の発明を包含する。
[1]一次粒子が凝集して形成された二次粒子と、前記二次粒子とは独立して存在する単粒子と、から構成されたリチウム金属複合酸化物粉末であって、下記組成式(1)で表され、下記要件(A)、(B)及び(C)を満たすことを特徴とする、リチウム金属複合酸化物粉末。
Li[Lix(Ni(1-y-z-w)CoyMnzMw)1-x]O2 (1)
(ただし、MはFe、Cu、Ti、Mg、Al、W、B、Mo、Nb、Zn、Sn、Zr、Ga及びVからなる群より選択される1種以上の元素であり、-0.1≦x≦0.2、0<y≦0.4、0≦z≦0.4、0≦w≦0.1を満たす。)
(A)前記リチウム金属複合酸化物粉末のBET比表面積が2m2/g未満である。
(B)前記リチウム金属複合酸化物粉末は、下記式(2)により求められる円形度の個数基準の円形度分布において2つ以上のピークを有する。
円形度=4πS/L2 …(2)
(Sは前記粒子の投影画像の投影面積であり、Lは前記粒子の周囲長である。)
(C)前記リチウム金属複合酸化物粉末の平均粒子径D50が2μm以上20μm以下である。
[2]平均円形度が0.4以上0.8以下である、[1]に記載のリチウム金属複合酸化物粉末。
[3]前記円形度分布において、円形度が0.4以上0.7以下の円形度範囲に第1のピークを有し、円形度が0.75以上0.95以下の円形度範囲に第2のピークを有する、[1]又は[2]に記載のリチウム金属複合酸化物粉末。
[4]前記円形度分布において、円形度分布標準偏差が0.1以上0.4以下である[3]に記載のリチウム金属複合酸化物粉末。
[5]前記第1のピークが単粒子に由来するピークであり、前記第2のピークが二次粒子に由来するピークである、[3]または[4]に記載のリチウム金属複合酸化物粉末。
[6]平均粒子径が1.0μm以上5.0μm以下の単粒子を含む、[1]~[5]のいずれか1つに記載のリチウム金属複合酸化物粉末。
[7][1]~[6]のいずれか1つに記載のリチウム金属複合酸化物粉末を含有するリチウム二次電池用正極活物質。
[8][7]に記載のリチウム二次電池用正極活物質を有する正極。
[9][8]に記載の正極を有するリチウム二次電池。
That is, the present invention includes the following inventions [1] to [8].
[1] A lithium metal composite oxide powder composed of secondary particles formed by agglomeration of primary particles and single particles existing independently of the secondary particles, and having the following composition formula ( 1) and characterized by satisfying the following requirements (A), (B) and (C).
Li[Li x (Ni (1-yzw) Co y Mn z M w ) 1-x ]O 2 (1)
(where M is one or more elements selected from the group consisting of Fe, Cu, Ti, Mg, Al, W, B, Mo, Nb, Zn, Sn, Zr, Ga and V; -0. satisfy 1≦x≦0.2, 0<y≦0.4, 0≦z≦0.4, and 0≦w≦0.1.)
(A) The BET specific surface area of the lithium metal composite oxide powder is less than 2 m 2 /g.
(B) The lithium metal composite oxide powder has two or more peaks in the number-based circularity distribution of the circularity determined by the following formula (2).
Circularity=4πS/L 2 (2)
(S is the projected area of the projected image of the particle, and L is the perimeter of the particle.)
(C) The lithium metal composite oxide powder has an average particle diameter D50 of 2 μm or more and 20 μm or less.
[2] The lithium metal composite oxide powder according to [1], which has an average circularity of 0.4 or more and 0.8 or less.
[3] In the circularity distribution, the circularity has a first peak in the circularity range of 0.4 or more and 0.7 or less, and the circularity is 0.75 or more and 0.95 or less. The lithium metal composite oxide powder according to [1] or [2], which has 2 peaks.
[4] The lithium metal composite oxide powder according to [3], wherein the circularity distribution has a standard deviation of circularity distribution of 0.1 or more and 0.4 or less.
[5] The lithium metal composite oxide powder according to [3] or [4], wherein the first peak is a peak derived from single particles and the second peak is a peak derived from secondary particles. .
[6] The lithium metal composite oxide powder according to any one of [1] to [5], containing single particles having an average particle size of 1.0 μm or more and 5.0 μm or less.
[7] A positive electrode active material for a lithium secondary battery, containing the lithium metal composite oxide powder according to any one of [1] to [6].
[8] A positive electrode comprising the positive electrode active material for a lithium secondary battery according to [7].
[9] A lithium secondary battery having the positive electrode according to [8].
本発明によれば、体積容量と体積容量維持率が高いリチウム金属複合酸化物粉末、リチウム二次電池用正極活物質、正極、及びリチウム二次電池を提供することができる。 According to the present invention, it is possible to provide a lithium metal composite oxide powder, a positive electrode active material for a lithium secondary battery, a positive electrode, and a lithium secondary battery having high volume capacity and high volume capacity retention rate.
本発明において、「一次粒子」とは、走査型電子顕微鏡などを用いて5000倍~20000倍の視野にて観察した際に、外観上に粒界が存在しない粒子であって、二次粒子を構成する粒子を意味する。
本発明において、「二次粒子」とは、前記一次粒子が凝集することにより形成された粒子である。
本発明において、「単粒子」とは、前記二次粒子とは独立して存在し、外観上に粒界が存在しない粒子であって、例えば粒子径が0.5μm以上の粒子を意味する。
本発明において、「粒子」と記載する場合には、単粒子又は二次粒子のいずれか一方又は両方が含まれる意味とする。
In the present invention, the "primary particles" are particles that do not have grain boundaries in appearance when observed in a field of view of 5000 to 20000 times using a scanning electron microscope or the like, and are secondary particles. Constituent particles are meant.
In the present invention, "secondary particles" are particles formed by aggregation of the primary particles.
In the present invention, the term "single particle" means a particle that exists independently of the secondary particles, has no grain boundary in appearance, and has a particle diameter of, for example, 0.5 μm or more.
In the present invention, the term "particles" is meant to include either or both of single particles and secondary particles.
<リチウム金属複合酸化物粉末>
本実施形態は、一次粒子が凝集して形成された二次粒子と、前記二次粒子とは独立して存在する単粒子と、から構成されたリチウム金属複合酸化物粉末である。
本実施形態のリチウム金属複合酸化物粉末は、下記組成式(1)で表され、下記要件(A)、(B)及び(C)を満たす。
Li[Lix(Ni(1-y-z-w)CoyMnzMw)1-x]O2 (1)
(ただし、MはFe、Cu、Ti、Mg、Al、W、B、Mo、Nb、Zn、Sn、Zr、Ga及びVからなる群より選択される1種以上の元素であり、-0.1≦x≦0.2、0<y≦0.4、0≦z≦0.4、0≦w≦0.1を満たす。)
(A)前記リチウム金属複合酸化物粉末のBET比表面積が2m2/g未満である。
(B)前記リチウム金属複合酸化物粉末は、下記式(2)により求められる円形度の個数基準の円形度分布において2つ以上のピークを有する。
円形度=4πS/L2 …(2)
(Sは前記粒子の投影画像の投影面積であり、Lは前記粒子の周囲長である。)
(C)前記リチウム金属複合酸化物粉末の平均粒子径D50が2μm以上20μm以下である。
<Lithium metal composite oxide powder>
This embodiment is a lithium metal composite oxide powder composed of secondary particles formed by agglomeration of primary particles and single particles existing independently of the secondary particles.
The lithium metal composite oxide powder of this embodiment is represented by the following compositional formula (1) and satisfies the following requirements (A), (B) and (C).
Li[Li x (Ni (1-yzw) Co y Mn z M w ) 1-x ]O 2 (1)
(where M is one or more elements selected from the group consisting of Fe, Cu, Ti, Mg, Al, W, B, Mo, Nb, Zn, Sn, Zr, Ga and V; -0. satisfy 1≦x≦0.2, 0<y≦0.4, 0≦z≦0.4, and 0≦w≦0.1.)
(A) The BET specific surface area of the lithium metal composite oxide powder is less than 2 m 2 /g.
(B) The lithium metal composite oxide powder has two or more peaks in the number-based circularity distribution of the circularity determined by the following formula (2).
Circularity=4πS/L 2 (2)
(S is the projected area of the projected image of the particle, and L is the perimeter of the particle.)
(C) The lithium metal composite oxide powder has an average particle diameter D50 of 2 μm or more and 20 μm or less.
≪組成式(1)≫
本実施形態の正極活物質は、下記組成式(1)で表される。
Li[Lix(Ni(1-y-z-w)CoyMnzMw)1-x]O2 ・・・(1)
(ただし、MはFe、Cu、Ti、Mg、Al、W、B、Mo、Nb、Zn、Sn、Zr、Ga、La及びVからなる群より選択される1種以上の元素であり、-0.1≦x≦0.2、0≦y≦0.4、0≦z≦0.4、0≦w≦0.1を満たす。)
<<Composition formula (1)>>
The positive electrode active material of this embodiment is represented by the following compositional formula (1).
Li[Li x (Ni (1-yzw) Co y Mn z M w ) 1-x ]O 2 (1)
(where M is one or more elements selected from the group consisting of Fe, Cu, Ti, Mg, Al, W, B, Mo, Nb, Zn, Sn, Zr, Ga, La and V, - satisfy 0.1≦x≦0.2, 0≦y≦0.4, 0≦z≦0.4, and 0≦w≦0.1.)
サイクル特性がよいリチウム二次電池を得る観点から、前記組成式(1)におけるxは0を超えることが好ましく、0.01以上であることがより好ましく、0.02以上であることがさらに好ましい。また、初回クーロン効率がより高いリチウム二次電池を得る観点から、前記組成式(I)におけるxは0.1以下であることが好ましく、0.08以下であることがより好ましく、0.06以下であることがさらに好ましい。
xの上限値と下限値は任意に組み合わせることができる。
本実施形態においては、0<x≦0.1であることが好ましい。
本明細書において、「サイクル特性がよい」とは、充放電の繰り返しにより、電池容量の低下量が低い特性を意味し、初期容量に対する再測定時の容量比が低下しにくいことを意味する。
From the viewpoint of obtaining a lithium secondary battery with good cycle characteristics, x in the composition formula (1) is preferably greater than 0, more preferably 0.01 or more, and even more preferably 0.02 or more. . From the viewpoint of obtaining a lithium secondary battery with a higher initial coulombic efficiency, x in the composition formula (I) is preferably 0.1 or less, more preferably 0.08 or less, and 0.06. More preferably:
The upper limit and lower limit of x can be combined arbitrarily.
In this embodiment, it is preferable that 0<x≦0.1.
As used herein, “good cycle characteristics” means characteristics in which the amount of decrease in battery capacity is small due to repeated charging and discharging, and means that the ratio of capacity at remeasurement to initial capacity is less likely to decrease.
また、電池の内部抵抗が低いリチウム二次電池を得る観点から、前記組成式(1)におけるyは0を超えることが好ましく、0.005以上であることがより好ましく、0.01以上であることがさらに好ましく、0.05以上であることが特に好ましい。また、熱的安定性が高いリチウム二次電池を得る観点から、前記組成式(1)におけるyは0.35以下であることがより好ましく、0.33以下であることがさらに好ましい。
yの上限値と下限値は任意に組み合わせることができる。
本実施形態においては、0<y≦0.4であることが好ましい。
Further, from the viewpoint of obtaining a lithium secondary battery with low battery internal resistance, y in the composition formula (1) is preferably greater than 0, more preferably 0.005 or more, and 0.01 or more. is more preferable, and 0.05 or more is particularly preferable. Moreover, from the viewpoint of obtaining a lithium secondary battery with high thermal stability, y in the composition formula (1) is more preferably 0.35 or less, and even more preferably 0.33 or less.
The upper limit and lower limit of y can be combined arbitrarily.
In this embodiment, it is preferable that 0<y≦0.4.
本実施形態においては、組成式(1)において、0<x≦0.1であり、0<y≦0.4であることがより好ましい。 In the present embodiment, it is more preferable that 0<x≦0.1 and 0<y≦0.4 in the composition formula (1).
また、サイクル特性が高いリチウム二次電池を得る観点から、前記組成式(1)におけるzは0.01以上であることが好ましく、0.02以上であることがより好ましく、0.1以上であることがさらに好ましい。また、高温(例えば60℃環境下)での保存性が高いリチウム二次電池を得る観点から、前記組成式(1)におけるzは0.39以下であることが好ましく、0.38以下であることがより好ましく、0.35以下であることがさらに好ましい。
zの上限値と下限値は任意に組み合わせることができる。
Also, from the viewpoint of obtaining a lithium secondary battery with high cycle characteristics, z in the composition formula (1) is preferably 0.01 or more, more preferably 0.02 or more, and 0.1 or more. It is even more preferable to have In addition, from the viewpoint of obtaining a lithium secondary battery with high storage stability at high temperatures (for example, in an environment of 60° C.), z in the composition formula (1) is preferably 0.39 or less, and is 0.38 or less. is more preferable, and 0.35 or less is even more preferable.
The upper limit and lower limit of z can be combined arbitrarily.
また、電池の内部抵抗が低いリチウム二次電池を得る観点から、前記組成式(1)におけるwは0を超えることが好ましく、0.0005以上であることがより好ましく、0.001以上であることがさらに好ましい。また、高い電流レートにおいて放電容量が多いリチウム二次電池を得る観点から、前記組成式(1)におけるwは0.09以下であることが好ましく、0.08以下であることがより好ましく、0.07以下であることがさらに好ましい。
wの上限値と下限値は任意に組み合わせることができる。
In addition, from the viewpoint of obtaining a lithium secondary battery with low battery internal resistance, w in the composition formula (1) is preferably greater than 0, more preferably 0.0005 or more, and 0.001 or more. is more preferred. Also, from the viewpoint of obtaining a lithium secondary battery with a large discharge capacity at a high current rate, w in the composition formula (1) is preferably 0.09 or less, more preferably 0.08 or less, and 0 It is more preferably 0.07 or less.
The upper limit and lower limit of w can be combined arbitrarily.
また、電池容量が大きいリチウム二次電池を得る観点から、本実施形態においては、前記組成式(1)におけるy+z+wは0.5未満が好ましく、0.48以下がより好ましく、0.46以下がさらに好ましい。 Further, from the viewpoint of obtaining a lithium secondary battery with a large battery capacity, in the present embodiment, y + z + w in the composition formula (1) is preferably less than 0.5, more preferably 0.48 or less, and 0.46 or less. More preferred.
前記組成式(1)におけるMはFe、Cu、Ti、Mg、Al、W、B、Mo、Nb、Zn、Sn、Zr、Ga、La及びVからなる群より選択される1種以上の元素を表す。 M in the composition formula (1) is one or more elements selected from the group consisting of Fe, Cu, Ti, Mg, Al, W, B, Mo, Nb, Zn, Sn, Zr, Ga, La and V. represents
また、サイクル特性が高いリチウム二次電池を得る観点から、組成式(1)におけるMは、Ti、Mg、Al、W、B、Zrからなる群より選択される1種以上の元素であることが好ましく、Al、Zrからなる群より選択される1種以上の元素であることがより好ましい。また、熱的安定性が高いリチウム二次電池を得る観点から、Ti、Al、W、B、Zrからなる群より選択される1種以上の元素であることが好ましい。 Moreover, from the viewpoint of obtaining a lithium secondary battery with high cycle characteristics, M in the composition formula (1) is one or more elements selected from the group consisting of Ti, Mg, Al, W, B, and Zr. is preferred, and one or more elements selected from the group consisting of Al and Zr are more preferred. Moreover, from the viewpoint of obtaining a lithium secondary battery with high thermal stability, it is preferably one or more elements selected from the group consisting of Ti, Al, W, B, and Zr.
≪要件(A)≫
本実施形態のリチウム金属複合酸化物粉末は、BET比表面積が2m2/g未満であり、1.7m2/g以下が好ましく、1.5m2/g以下がより好ましく、1.4m2/g以下が特に好ましい。
本実施形態において、BET比表面積は、リチウム金属複合酸化物粉末1gを窒素雰囲気中、105℃で30分間乾燥させた後、マウンテック社製Macsorb(登録商標)を用いて測定した値とする(単位:m2/g)。
≪Requirements (A)≫
The lithium metal composite oxide powder of the present embodiment has a BET specific surface area of less than 2 m 2 /g, preferably 1.7 m 2 /g or less, more preferably 1.5 m 2 /g or less, and 1.4 m 2 /g. g or less is particularly preferred.
In the present embodiment, the BET specific surface area is a value obtained by drying 1 g of lithium metal composite oxide powder in a nitrogen atmosphere at 105° C. for 30 minutes and then measuring it using Macsorb (registered trademark) manufactured by Mountech (unit: : m 2 /g).
本実施形態のリチウム金属複合酸化物粉末は、BET比表面積を上記上限値以下とすることで体積容量と体積容量維持率を向上できると推察される。 It is presumed that the lithium metal composite oxide powder of the present embodiment can improve the volume capacity and the volume capacity retention rate by setting the BET specific surface area to the upper limit value or less.
≪要件(B)≫
本実施形態のリチウム金属複合酸化物粉末は、円形度分布において、2つ以上のピークを有する。
≪Requirement (B)≫
The lithium metal composite oxide powder of this embodiment has two or more peaks in the circularity distribution.
・円形度分布の測定
測定対象とするリチウム金属複合酸化物粉末の円形度分布を測定する。本実施形態における円形度分布は、下記式(2)により求められる円形度の個数基準の円形度分布である。
まず、リチウム金属複合酸化物粉末のSEM画像を撮影し、リチウム金属複合酸化物粉末粒子の投影像である粒子画像を得る。次に、リチウム金属複合酸化物粉末を構成する個々の粒子について、下記式(2)により算出される円形度を測定する。得られた円形度を横軸に、粒子個数を縦軸とし、リチウム金属複合酸化物粉末の円形度分布が得られる。下記式(2)に示す円形度は、数値が1に近づくほど真円であることを意味する。
円形度=4πS/L2 …(2)
(Sは前記粒子の投影画像の投影面積であり、Lは前記粒子の周囲長である。)
・Measurement of Circularity Distribution Circularity distribution of the lithium metal composite oxide powder to be measured is measured. The circularity distribution in the present embodiment is a circularity distribution based on the number of circularities obtained by the following equation (2).
First, an SEM image of the lithium metal composite oxide powder is taken to obtain a particle image which is a projected image of the lithium metal composite oxide powder particles. Next, the circularity calculated by the following formula (2) is measured for each particle that constitutes the lithium metal composite oxide powder. The obtained circularity is plotted on the horizontal axis and the number of particles is plotted on the vertical axis to obtain the circularity distribution of the lithium metal composite oxide powder. The degree of circularity shown in the following formula (2) means that the closer the numerical value is to 1, the better the circularity.
Circularity=4πS/L 2 (2)
(S is the projected area of the projected image of the particle, and L is the perimeter of the particle.)
円形度分布は、例えば、走査型電池顕微鏡(SEM)や透過型電子顕微鏡(TEM)などを用いて撮影した画像を用いて、画像解析を行う方法や、市販される粒子画像分析装置、特にフロー式の粒子像分析装置を用いる方法等が挙げられる。 The circularity distribution can be measured by, for example, using an image taken using a scanning cell microscope (SEM) or a transmission electron microscope (TEM), and a method of performing image analysis, a commercially available particle image analysis device, especially a flow and a method using a particle image analyzer of the formula.
本実施形態のリチウム金属複合酸化物粉末は、上記の方法により得られた円形度分布において、2つ以上のピークを有する。ここで「ピーク」とは、円形度を横軸、粒子個数を縦軸にした円形度分布において、円形度が0~1.0の間で0.05毎に等間隔となるように20分割のデータ範囲を設定した際に、円形度が低い側から高い側へ向かって、粒子個数が増加から減少に転ずる箇所をいう。
なお、円形度分布の評価において、円形度が0~1.0の間を20以上に分割したデータ範囲を設定してもよい。
The lithium metal composite oxide powder of this embodiment has two or more peaks in the circularity distribution obtained by the above method. Here, the “peak” is divided into 20 so that the circularity is evenly spaced every 0.05 between 0 and 1.0 in the circularity distribution in which the horizontal axis is the circularity and the vertical axis is the number of particles. When the data range of is set, the number of particles changes from an increase to a decrease from the low circularity side to the high circularity side.
In the evaluation of the circularity distribution, a data range obtained by dividing the circularity between 0 and 1.0 into 20 or more may be set.
本実施形態においては、円形度分布測定は複数回実施し、再現性の良くピークが現れることを確認することが好ましい。また、再現性がない箇所に関しては、ノイズに由来すると判断し、ピークとして取り扱わないこととする。 In this embodiment, it is preferable to measure the circularity distribution a plurality of times to confirm that peaks appear with good reproducibility. In addition, it is determined that a portion with no reproducibility is derived from noise and is not treated as a peak.
平均円形度が0.4以上0.8以下であることが好ましく、0.45以上0.75以下がより好ましく、0.48以上0.70以下が特に好ましい。平均円形度は、全粒子の円形度の総和を、全粒子個数で除することにより算出できる。 The average circularity is preferably 0.4 or more and 0.8 or less, more preferably 0.45 or more and 0.75 or less, and particularly preferably 0.48 or more and 0.70 or less. The average circularity can be calculated by dividing the sum of the circularities of all particles by the total number of particles.
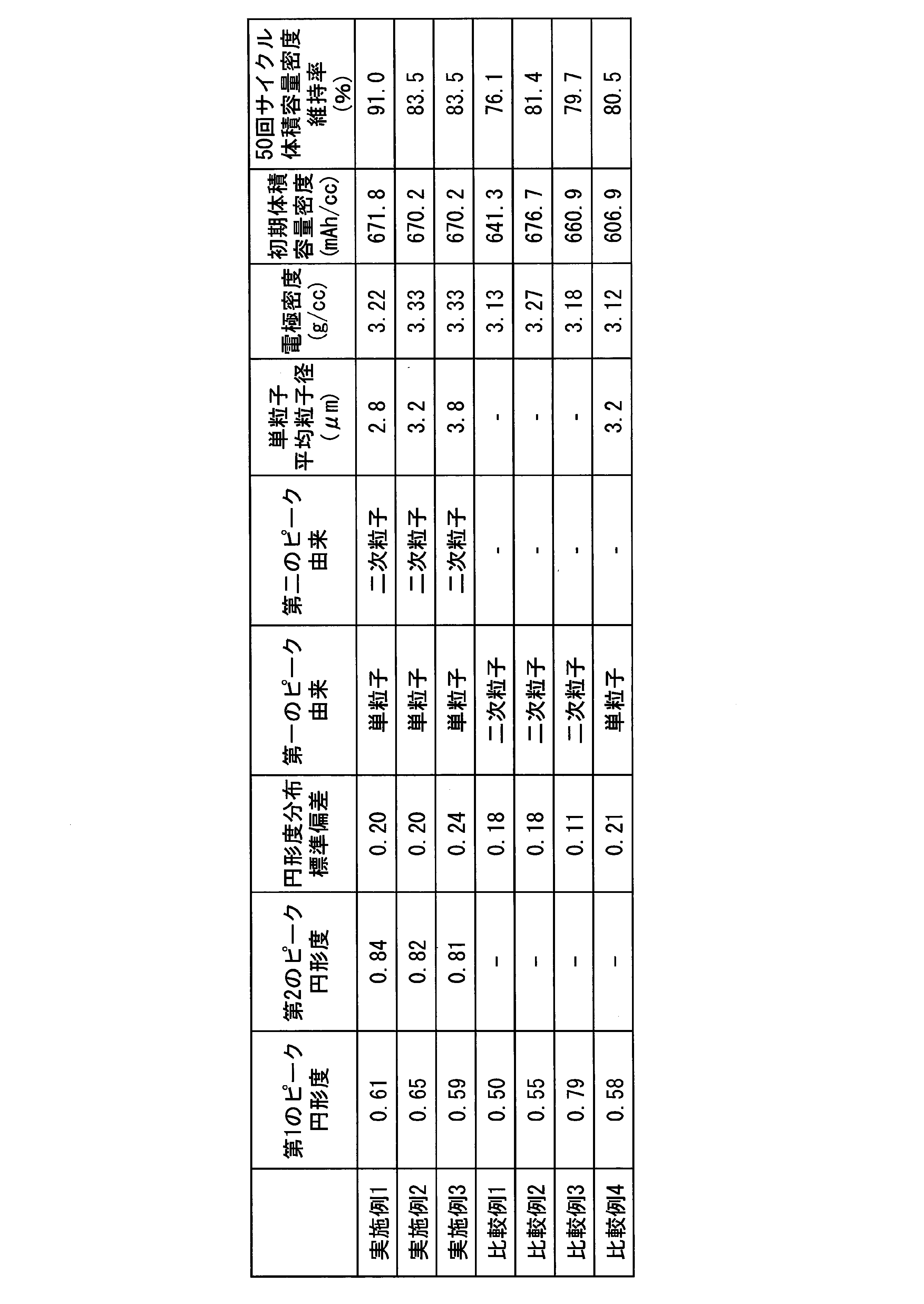
本実施形態においては、円形度を横軸に、粒子個数を縦軸とした円形度分布において、円形度が0.4以上0.7以下の円形度範囲に第1のピークを有し、円形度が0.75以上0.95以下の円形度範囲に第2のピークを有することが好ましい。 In the present embodiment, in the circularity distribution in which the horizontal axis is the circularity and the vertical axis is the number of particles, the circularity has a first peak in the circularity range of 0.4 or more and 0.7 or less. It is preferable to have the second peak in the circularity range of 0.75 or more and 0.95 or less.
本実施形態においては、リチウム金属複合酸化物粉末は、体積容量を高める観点から前記円形度分布において、円形度分布標準偏差が0.1以上であることが好ましく、0.15以上であることがより好ましく、0.18以上であることがさらに好ましい。また、リチウム金属複合酸化物粉末のハンドリング性を高める観点から0.4以下であることが好ましく、0.35以下がより好ましく、0.30以下がさらに好ましい。 In the present embodiment, the lithium metal composite oxide powder preferably has a circularity distribution standard deviation of 0.1 or more, more preferably 0.15 or more in the circularity distribution from the viewpoint of increasing the volumetric capacity. More preferably, it is 0.18 or more. In addition, from the viewpoint of enhancing the handleability of the lithium metal composite oxide powder, it is preferably 0.4 or less, more preferably 0.35 or less, and even more preferably 0.30 or less.
本実施形態においては、前記第1のピークが単粒子に由来するピークであり、前記第2のピークが二次粒子に由来するピークであることが好ましい。本実施形態のリチウム金属複合酸化物粉末は、二次粒子と単粒子とから構成されている。二次粒子は一次粒子が凝集して形成されているため、球状に近い粒子形状をしている。このため、円形度分布において観察されるピークのうち、前記第2のピークは二次粒子に由来するピークであることがある。また、第1のピークは他の構成成分である単粒子に由来するピークであることがある。第1のピークおよび第2のピークが由来する粒子は、各粒子の円形度を算出する際に撮影する画像から判断される。 In the present embodiment, it is preferable that the first peak is a peak derived from single particles, and the second peak is a peak derived from secondary particles. The lithium metal composite oxide powder of this embodiment is composed of secondary particles and single particles. Since the secondary particles are formed by agglomerating the primary particles, they have a nearly spherical particle shape. Therefore, among the peaks observed in the circularity distribution, the second peak may be a peak derived from secondary particles. Also, the first peak may be a peak derived from a single particle that is another component. The particles from which the first peak and the second peak are derived are determined from the images taken when calculating the circularity of each particle.
図2A~図2Cに、粒子の存在態様が異なるリチウム金属複合酸化物の円形度分布をそれぞれ示す。
図2Aは、二次粒子を単独で含むリチウム金属複合酸化物粉末の円形度分布の一例を示すグラフである。
図2Bは、単粒子を単独で含むリチウム金属複合酸化物粉末の円形度分布の一例を示すグラフである。
図2Cは、本実施形態のリチウム金属複合酸化物粉末の円形度分布の一例を示すグラフである。
2A to 2C show circularity distributions of lithium metal composite oxides having different particle existence modes.
FIG. 2A is a graph showing an example of a circularity distribution of a lithium metal composite oxide powder containing secondary particles alone.
FIG. 2B is a graph showing an example of a circularity distribution of a lithium metal composite oxide powder containing single particles alone.
FIG. 2C is a graph showing an example of the circularity distribution of the lithium metal composite oxide powder of this embodiment.
図2Aに示すように、二次粒子を単独で含むリチウム金属複合酸化物粉末は、円形度が0.8~0.9の範囲にピークを有することがある。二次粒子は一次粒子が凝集した粒子であり、二次粒子の多くは球状の粒子である。このため、二次粒子を単独で含むリチウム金属複合酸化物粉末は、図2Aに示すように円形度が大きい範囲に単一のピークが観察されることがある。
なお、二次粒子を単独で含むリチウム金属複合酸化物粉末には、二次粒子が割れたことにより発生した一次粒子がわずかに含まれる可能性もあるが一次粒子の存在量はごく微量であるため、一次粒子に由来するピークは観察されないと考えられる。
As shown in FIG. 2A, the lithium metal composite oxide powder containing secondary particles alone may have a circularity peak in the range of 0.8 to 0.9. Secondary particles are aggregates of primary particles, and most of the secondary particles are spherical particles. For this reason, in the lithium metal composite oxide powder containing only secondary particles, a single peak may be observed in the range of high circularity as shown in FIG. 2A.
In addition, the lithium metal composite oxide powder containing secondary particles alone may contain a small amount of primary particles generated by cracking of the secondary particles, but the amount of primary particles is very small. Therefore, it is considered that no peak derived from primary particles is observed.
図2Bに示すように、単粒子を単独で含むリチウム複合金属酸化物の円形度分布は、シャープなピークは観測されず、全体的にブロードなピークとなることがある。これは、単粒子は大きく発達した結晶面が粒子表面に表れやすいためと推察される。 As shown in FIG. 2B, in the circularity distribution of the lithium composite metal oxide containing single particles alone, no sharp peak is observed, and the overall peak may be broad. This is presumed to be due to the fact that in single grains, large and well-developed crystal planes tend to appear on the grain surface.
図2Cに、本実施形態のリチウム金属複合酸化物粉末の円形度分布の一例を示す。一次粒子が凝集して形成された二次粒子と、前記二次粒子とは独立して存在する単粒子と、から構成されている場合、単粒子に由来する第1のピークと、二次粒子に由来する第2のピークの少なくとも2つが観測されることがある。
本実施形態においては、円形度分布において2つ以上のピークを有していればよく、3つ以上のピークを有していてもよい。粒子形状が異なる粒子(例えば、楕円状粒子や板状粒子、繊維状粒子)を含む場合には、それぞれの粒子の円形度に由来する複数のピークが観測される場合がある。
FIG. 2C shows an example of the circularity distribution of the lithium metal composite oxide powder of this embodiment. When composed of secondary particles formed by aggregation of primary particles and single particles existing independently of the secondary particles, the first peak derived from the single particles and the secondary particles At least two of the second peaks from are sometimes observed.
In this embodiment, the circularity distribution may have two or more peaks, and may have three or more peaks. When particles with different particle shapes (eg, ellipsoidal particles, plate-like particles, fibrous particles) are contained, multiple peaks derived from the circularity of each particle may be observed.
本実施形態のリチウム金属複合酸化物粉末における、単粒子と二次粒子の存在比率としては、単粒子と二次粒子との混合比を1~60/99~40とすることが好ましい。混合比は、粒子の質量比とする。 In the lithium metal composite oxide powder of the present embodiment, the abundance ratio of the single particles and the secondary particles is preferably 1 to 60/99 to 40. The mixing ratio is the mass ratio of the particles.
≪要件(C)≫
本実施形態のリチウム金属複合酸化物粉末は、平均粒子径D50が2μm以上20μm以下であり、3μm以上18μm以下が好ましく、4μm以上15μm以下がより好ましい。
≪Requirement (C)≫
The lithium metal composite oxide powder of the present embodiment has an average particle diameter D50 of 2 μm or more and 20 μm or less, preferably 3 μm or more and 18 μm or less, more preferably 4 μm or more and 15 μm or less.
本実施形態のリチウム金属複合酸化物粉末は、単粒子の平均粒子径が1μm以上であることが好ましく、1.1μm以上がより好ましく、1.2μm以上がさらに好ましい。
また、単粒子の平均粒子径の上限値は特に限定されない。一例を挙げると、単粒子の平均粒子径は5.0μm以下であってもよく、4.0μm以下であってもよく、3.0μm以下であってもよい。
In the lithium metal composite oxide powder of the present embodiment, the average particle size of single particles is preferably 1 μm or more, more preferably 1.1 μm or more, and even more preferably 1.2 μm or more.
Moreover, the upper limit of the average particle size of the single particles is not particularly limited. For example, the average particle size of single particles may be 5.0 μm or less, 4.0 μm or less, or 3.0 μm or less.
・・単粒子及び二次粒子の平均粒子径
まず、リチウム金属複合酸化物粉末を、サンプルステージ上に貼った導電性シート上に載せ、日本電子株式会社製JSM-5510を用いて、加速電圧が20kVの電子線を照射してSEM観察を行う。SEM観察により得られた画像(SEM写真)から任意に50個の単粒子又は二次粒子を抽出し、それぞれの単粒子又は二次粒子について、単粒子又は二次粒子の投影像を一定方向から引いた平行線ではさんだ平行線間の距離(定方向径)を単粒子又は二次粒子の粒子径として測定する。得られた単粒子又は二次粒子の粒子径の算術平均値が、リチウム金属複合酸化物粉末の平均単粒子径又は平均二次粒子径である。平均粒子径を算出するためのn数は50以上とする。
.. Average particle size of single particles and secondary particles First, the lithium metal composite oxide powder is placed on a conductive sheet attached on a sample stage, and JSM-5510 manufactured by JEOL Ltd. is used to increase the accelerating voltage. A 20 kV electron beam is irradiated and SEM observation is performed. 50 single particles or secondary particles are arbitrarily extracted from the image (SEM photograph) obtained by SEM observation, and for each single particle or secondary particle, the projected image of the single particle or secondary particle is projected from a certain direction. The distance between the drawn parallel lines (unidirectional diameter) is measured as the particle size of the single particles or secondary particles. The arithmetic average value of the particle sizes of the obtained single particles or secondary particles is the average single particle size or average secondary particle size of the lithium metal composite oxide powder. The n number for calculating the average particle size is 50 or more.
・・平均粒子径D50
レーザー回折散乱法によって測定される。まず、リチウム金属複合酸化物粉末0.1gを、0.2質量%ヘキサメタりん酸ナトリウム水溶液50mlに投入し、該粉末を分散させた分散液を得る。
次に、得られた分散液についてマイクロトラック・ベル株式会社製マイクロトラックMT3300EXII(レーザー回折散乱粒度分布測定装置)を用いて、粒度分布を測定し、体積基準の累積粒度分布曲線を得る。
..Average particle size D50
Measured by laser diffraction scattering method. First, 0.1 g of lithium metal composite oxide powder is put into 50 ml of 0.2% by mass sodium hexametaphosphate aqueous solution to obtain a dispersion liquid in which the powder is dispersed.
Next, the particle size distribution of the resulting dispersion is measured using a Microtrac MT3300EXII (laser diffraction scattering particle size distribution analyzer) manufactured by Microtrac Bell Co., Ltd. to obtain a volume-based cumulative particle size distribution curve.
そして、得られた累積粒度分布曲線において、小粒子側からの累積体積が50%となる点の粒子径の値がD50(μm)である。 Then, in the obtained cumulative particle size distribution curve, the value of the particle diameter at the point where the cumulative volume from the small particle side reaches 50% is D50 (μm).
(層状構造)
本実施形態において、リチウム金属複合酸化物粉末の結晶構造は、層状構造であり、六方晶型の結晶構造又は単斜晶型の結晶構造であることがより好ましい。
(Layered structure)
In the present embodiment, the crystal structure of the lithium metal composite oxide powder is a layered structure, and more preferably a hexagonal crystal structure or a monoclinic crystal structure.
六方晶型の結晶構造は、P3、P31、P32、R3、P-3、R-3、P312、P321、P3112、P3121、P3212、P3221、R32、P3m1、P31m、P3c1、P31c、R3m、R3c、P-31m、P-31c、P-3m1、P-3c1、R-3m、R-3c、P6、P61、P65、P62、P64、P63、P-6、P6/m、P63/m、P622、P6122、P6522、P6222、P6422、P6322、P6mm、P6cc、P63cm、P63mc、P-6m2、P-6c2、P-62m、P-62c、P6/mmm、P6/mcc、P63/mcm、P63/mmcからなる群から選ばれるいずれか一つの空間群に帰属される。
The hexagonal crystal structure is composed of P3, P3 1 , P3 2 , R3, P-3, R-3, P312, P321, P3 1 12,
また、単斜晶型の結晶構造は、P2、P21、C2、Pm、Pc、Cm、Cc、P2/m、P21/m、C2/m、P2/c、P21/c、C2/cからなる群から選ばれるいずれか一つの空間群に帰属される。 The monoclinic crystal structure is P2, P2 1 , C2, Pm, Pc, Cm, Cc, P2/m, P2 1 /m, C2/m, P2/c, P2 1 /c, C2/ It belongs to any one space group selected from the group consisting of c.
これらのうち、放電容量が高いリチウム二次電池を得るため、結晶構造は、空間群R-3mに帰属される六方晶型の結晶構造、又はC2/mに帰属される単斜晶型の結晶構造であることが特に好ましい。 Among these, in order to obtain a lithium secondary battery with a high discharge capacity, the crystal structure is a hexagonal crystal structure assigned to the space group R-3m, or a monoclinic crystal assigned to C2 / m. A structure is particularly preferred.
本実施形態のリチウム金属複合酸化物粉末は、正極活物質として用い、電極を製造した場合に電極密度を向上させることができる。図3に、本実施形態のリチウム金属複合酸化物粉末をプレス充填した場合の模式図を示す。なお、図3および図4においては、円形度が高い粒子を二次粒子、円形度が低い粒子を単粒子として例示して説明する。図3において集電体55上に、二次粒子56、単粒子57、導電剤58及びバインダー59を含む正極合材が塗布された状態を示す。正極合剤をプレスして、集電体上に固着させる際に、加圧により二次粒子56と単粒子57との間で摩擦が生じ、二次粒子56が割れて、割れた二次粒子(符号56A)が生じる。割れた二次粒子56Aと単粒子57は、加圧により空隙を埋めるように移動し再配列する。換言すれば、割れた二次粒子56Aの隙間に単粒子57が入り込み、二次粒子(符号56及び56A)と単粒子57同士の接触面積が大きくなり、空隙が減少すると推察される。これにより、電極の密度が向上すると考えられる。
The lithium metal composite oxide powder of the present embodiment can be used as a positive electrode active material to improve the electrode density when an electrode is produced. FIG. 3 shows a schematic diagram when the lithium metal composite oxide powder of the present embodiment is press-filled. In FIGS. 3 and 4, particles with a high degree of circularity are exemplified as secondary particles, and particles with a low degree of circularity are exemplified as single particles. FIG. 3 shows a state in which a positive electrode mixture containing
また、単粒子57が存在することにより、二次粒子56との摩擦が大きくなり、粒子割れが促進されると推察される。加えて、単粒子57および二次粒子56が割れた粒子は円形度が低いため、加圧により粒子移動が起き、再配列しても一定以下の大きさの空隙は残存すると考えられる。このため、電池とし、充放電を繰りさえした際に電解液の枯渇などが起こりにくいと推察される。このような作用により、二次粒子と単粒子を含む本実施形態のリチウム金属複合酸化物粉末は、体積容量と体積容量維持率が高くなると推察される。
In addition, it is presumed that the presence of the
これに対し、単粒子を含まずに二次粒子を単独で有するリチウム複合金属酸化物粉末を正極活物質として用い、電極を製造した場合を図4に示す。集電体60の上に、二次粒子61、バインダー62、導電剤63を含む正極合材が塗布された状態を示す。正極合剤をプレスして、集電体上に固着させる際に、割れた二次粒子61Aと、割れていない二次粒子とが存在する場合、加圧による粒子の移動と再配列が十分に進まず、隙間が生じると考えられる。本実施形態を適用しない場合には、この隙間を埋めることができないため、電極の密度を向上させることができないと考えられる。
On the other hand, FIG. 4 shows a case where an electrode is manufactured using a lithium composite metal oxide powder that does not contain single particles but has secondary particles alone as a positive electrode active material. A positive electrode mixture containing
<リチウム金属複合酸化物粉末の製造方法>
本実施形態のリチウム金属複合酸化物粉末は、下記の製造方法1又は製造方法2によって製造できる。
<Method for Producing Lithium Metal Composite Oxide Powder>
The lithium metal composite oxide powder of the present embodiment can be produced by
≪製造方法1≫
本実施形態のリチウム金属複合酸化物粉末を製造するにあたって、まず、リチウム以外の金属、すなわち、少なくともNiを含み、Co、Mn、Fe、Cu、Ti、Mg、Al、W、B、Mo、Nb、Zn、Sn、Zr、Ga、La及びVのうちいずれか1種以上の任意元素を含む金属複合化合物を調製し、当該金属複合化合物を適当なリチウム塩と、不活性溶融剤と焼成することが好ましい。金属複合化合物としては、金属複合水酸化物又は金属複合酸化物が好ましい。以下に、リチウム金属複合酸化物粉末の製造方法の一例を、金属複合化合物の製造工程と、リチウム金属複合酸化物の製造工程とに分けて説明する。
In producing the lithium metal composite oxide powder of the present embodiment, first, metals other than lithium, that is, containing at least Ni, Co, Mn, Fe, Cu, Ti, Mg, Al, W, B, Mo, Nb , Zn, Sn, Zr, Ga, La and V, and sintering the metal composite compound with an appropriate lithium salt and an inert melting agent. is preferred. As the metal composite compound, a metal composite hydroxide or a metal composite oxide is preferable. An example of a method for producing a lithium metal composite oxide powder will be described below by dividing it into a metal composite compound production process and a lithium metal composite oxide production process.
(金属複合化合物の製造工程)
金属複合化合物は、通常公知のバッチ共沈殿法又は連続共沈殿法により製造することが可能である。以下、金属として、ニッケル、コバルト及びマンガンを含む金属複合水酸化物を例に、その製造方法を詳述する。
(Manufacturing process of metal composite compound)
A metal complex compound can be produced by a generally known batch coprecipitation method or continuous coprecipitation method. The method for producing the metal composite hydroxide containing nickel, cobalt and manganese as metals will be described in detail below.
製造方法1においては、金属複合化合物の製造工程において、最終的に単粒子を形成する金属複合化合物と、二次粒子を形成する金属複合化合物をそれぞれ製造する。以下において、最終的に単粒子を形成する金属複合化合物を「単粒子前駆体」と記載することがある。また、最終的に二次粒子を形成する金属複合化合物を「二次粒子前駆体」と記載することがある。
In
まず共沈殿法、特に特開2002-201028号公報に記載された連続法により、ニッケル塩溶液、コバルト塩溶液、マンガン塩溶液、及び錯化剤を反応させ、NiaCobMnc(OH)2(式中、a+b+c=1)で表される金属複合水酸化物を製造する。 First, a nickel salt solution, a cobalt salt solution, a manganese salt solution, and a complexing agent are reacted by a coprecipitation method, particularly a continuous method described in JP-A-2002-201028, to form Ni a Co b Mn c (OH). 2 A metal composite hydroxide represented by (a+b+c=1 in the formula) is produced.
上記ニッケル塩溶液の溶質であるニッケル塩としては、特に限定されないが、例えば硫酸ニッケル、硝酸ニッケル、塩化ニッケル及び酢酸ニッケルのうちの何れか1種又は2種以上を使用することができる。上記コバルト塩溶液の溶質であるコバルト塩としては、例えば硫酸コバルト、硝酸コバルト、塩化コバルト、及び酢酸コバルトのうちの何れか1種又は2種以上を使用することができる。上記マンガン塩溶液の溶質であるマンガン塩としては、例えば硫酸マンガン、硝酸マンガン、塩化マンガン、及び酢酸マンガンのうちの何れか1種又は2種以上を使用することができる。以上の金属塩は、上記NiaCobMnc(OH)2の組成比に対応する割合で用いられる。また、溶媒として水が使用される。 The nickel salt that is the solute of the nickel salt solution is not particularly limited, but for example, one or more of nickel sulfate, nickel nitrate, nickel chloride and nickel acetate can be used. As the cobalt salt that is the solute of the cobalt salt solution, for example, one or more of cobalt sulfate, cobalt nitrate, cobalt chloride, and cobalt acetate can be used. As the manganese salt that is the solute of the manganese salt solution, for example, one or more of manganese sulfate, manganese nitrate, manganese chloride, and manganese acetate can be used. The above metal salts are used in a proportion corresponding to the composition ratio of the above NiaCobMnc (OH) 2 . Also, water is used as a solvent.
錯化剤としては、水溶液中で、ニッケル、コバルト、及びマンガンのイオンと錯体を形成可能なものであり、例えばアンモニウムイオン供給体(水酸化アンモニウム、硫酸アンモニウム、塩化アンモニウム、炭酸アンモニウム、弗化アンモニウム等のアンモニウム塩)、ヒドラジン、エチレンジアミン四酢酸、ニトリロ三酢酸、ウラシル二酢酸、及びグリシンが挙げられる。 The complexing agent is one capable of forming a complex with ions of nickel, cobalt, and manganese in an aqueous solution. ammonium salt of ), hydrazine, ethylenediaminetetraacetic acid, nitrilotriacetic acid, uracildiacetic acid, and glycine.
沈殿に際しては、水溶液のpH値を調整するため、必要ならばアルカリ金属水酸化物(例えば水酸化ナトリウム、水酸化カリウム)を添加する。 During precipitation, alkali metal hydroxides (eg sodium hydroxide, potassium hydroxide) are added, if necessary, to adjust the pH value of the aqueous solution.
上記ニッケル塩溶液、コバルト塩溶液、及びマンガン塩溶液のほか、錯化剤を反応槽に連続して供給させると、ニッケル、コバルト、及びマンガンが反応し、NiaCobMnc(OH)2が製造される。反応に際しては、反応槽の温度が例えば20℃以上80℃以下、好ましくは30~70℃の範囲内で制御され、反応槽内のpH値は例えばpH9以上pH13以下、好ましくはpH11以上pH13以下の範囲内で制御され、反応槽内の物質が適宜撹拌される。反応槽は、形成された反応沈殿物を分離のためオーバーフローさせるタイプのものである。 When the nickel salt solution, cobalt salt solution, and manganese salt solution as well as the complexing agent are continuously supplied to the reaction tank, nickel, cobalt, and manganese react to form NiaCobMnc (OH) 2. is manufactured. During the reaction, the temperature of the reaction vessel is controlled within the range of, for example, 20° C. or higher and 80° C. or lower, preferably 30 to 70° C., and the pH value in the reaction vessel is, for example, pH 9 or higher and pH 13 or lower, preferably pH 11 or higher and pH 13 or lower. Controlled within the range, the material in the reactor is appropriately agitated. The reactor is of the overflow type for separation of the reaction sediment formed.
製造方法1においては、単粒子前駆体を製造する第1の共沈槽と、二次粒子前駆体を形成する第2の共沈槽を用いる。
第1の共沈槽に供給する金属塩の濃度、攪拌速度、反応温度、反応pH、及び後述する焼成条件等を適宜制御することにより、単粒子前駆体を製造できる。
In
A single particle precursor can be produced by appropriately controlling the concentration of the metal salt supplied to the first coprecipitator, the stirring speed, the reaction temperature, the reaction pH, the firing conditions described later, and the like.
具体的には、反応槽の温度が例えば30℃以上80℃以下が好ましく、40~70℃の範囲内で制御されることがより好ましく、後述する第2の反応槽に対し±20℃の範囲であることがさらに好ましい。また、反応槽内のpH値は例えばpH10以上pH13以下が好ましく、pH11以上pH12.5以下の範囲内で制御されることがより好ましく、後述する第2の反応槽に対し±pH2以内の範囲であることがさらに好ましく、第2の反応槽よりも高いpHであることが特に好ましい。
Specifically, the temperature of the reaction tank is, for example, preferably 30° C. or higher and 80° C. or lower, more preferably controlled within the range of 40 to 70° C., and within the range of ±20° C. with respect to the second reaction tank described later. is more preferable. In addition, the pH value in the reaction tank is preferably controlled within the range of
また、第2の共沈槽に供給する金属塩の濃度、攪拌速度、反応温度、反応pH、及び後述する焼成条件等を適宜制御することにより、二次粒子前駆体を製造できる。
具体的には、反応槽の温度が例えば20℃以上80℃以下が好ましく、30~70℃の範囲内で制御されることがより好ましく、後述する第2の反応槽に対し±20℃の範囲であることがさらに好ましい。また、反応槽内のpH値は例えばpH10以上pH13以下が好ましく、pH11以上pH12.5以下の範囲内で制御されることがより好ましく、後述する第2の反応槽に対し±pH2以内の範囲であることがさらに好ましく、第2の反応槽よりも低いpHであることが特に好ましい。
In addition, the secondary particle precursor can be produced by appropriately controlling the concentration of the metal salt supplied to the second coprecipitation tank, the stirring speed, the reaction temperature, the reaction pH, and the calcination conditions described later.
Specifically, the temperature of the reaction vessel is, for example, preferably 20° C. or higher and 80° C. or lower, more preferably controlled within the range of 30 to 70° C., and the range of ±20° C. with respect to the second reaction vessel described later. is more preferable. In addition, the pH value in the reaction tank is preferably controlled within the range of
上記の条件の制御に加えて、各種気体、例えば、窒素、アルゴン、二酸化炭素等の不活性ガス、空気、酸素等の酸化性ガス、あるいはそれらの混合ガスを反応槽内に供給してもよい。気体以外に酸化状態を促すものとして、過酸化水素などの坂酸化物、過マンガン酸塩などの過酸化物塩、過塩素酸塩、次亜塩素酸塩、硝酸、ハロゲン、オゾンなどを使用することができる。気体以外に還元状態を促すものとして、シュウ酸、ギ酸などの有機酸、亜硫酸塩、ヒドラジンなどを使用する事ができる。 In addition to controlling the above conditions, various gases such as nitrogen, argon, inert gases such as carbon dioxide, air, oxidizing gases such as oxygen, or mixed gases thereof may be supplied into the reaction vessel. . In addition to gases, other substances that promote an oxidized state include oxides such as hydrogen peroxide, peroxide salts such as permanganate, perchlorates, hypochlorites, nitric acid, halogens, and ozone. be able to. In addition to gases, organic acids such as oxalic acid and formic acid, sulfites, hydrazine, and the like can be used as agents that promote a reduced state.
以上の反応後、得られた反応沈殿物をそれぞれ水で洗浄した後、乾燥し、ニッケルコバルトマンガン複合化合物としてのニッケルコバルトマンガン水酸化物(単粒子前駆体、二次粒子前駆体)を単離する。また、必要に応じて弱酸水や水酸化ナトリウムや水酸化カリウムを含むアルカリ溶液で洗浄しても良い。
なお、上記の例では、ニッケルコバルトマンガン複合水酸化物を製造しているが、ニッケルコバルトマンガン複合酸化物を調製してもよい。
After the above reaction, each of the reaction precipitates obtained is washed with water and then dried to isolate nickel-cobalt-manganese hydroxide (single particle precursor, secondary particle precursor) as a nickel-cobalt-manganese composite compound. do. Moreover, you may wash|clean with alkaline solution containing weak acid water, sodium hydroxide, or potassium hydroxide as needed.
In addition, in the above example, a nickel-cobalt-manganese composite hydroxide is produced, but a nickel-cobalt-manganese composite oxide may be prepared.
(リチウム金属複合酸化物の製造工程)
単粒子前駆体、二次粒子前駆体としての上記金属複合酸化物又は金属複合水酸化物を乾燥した後、リチウム塩と混合する。単粒子前駆体および二次粒子前駆体を混合時に所定の質量比で混合することで、得られる単粒子と二次粒子の存在比率をおおよそ制御できる。
なお、混合以降の工程において単粒子前駆体および二次粒子前駆体がそれぞれ凝集、あるいは分離し単粒子前駆体を基にした二次粒子あるいは、二次粒子前駆体を基にした単粒子も存在し得るが、単粒子前駆体と二次粒子前駆体との混合比率および混合以降の工程の条件を調整することで、最終的に得られるリチウム金属複合酸化物粉末における単粒子と二次粒子の存在比率は制御することができる。
(Manufacturing process of lithium metal composite oxide)
After drying the metal composite oxide or metal composite hydroxide as a single particle precursor or a secondary particle precursor, it is mixed with a lithium salt. By mixing the single particle precursors and the secondary particle precursors at a predetermined mass ratio during mixing, the existence ratio of the resulting single particles and secondary particles can be roughly controlled.
In the process after mixing, the single particle precursor and the secondary particle precursor are aggregated or separated, and there are also secondary particles based on the single particle precursor or single particles based on the secondary particle precursor. However, by adjusting the mixing ratio of the single particle precursor and the secondary particle precursor and the conditions of the steps after the mixing, the ratio of the single particles and the secondary particles in the finally obtained lithium metal composite oxide powder can be improved. The abundance ratio can be controlled.
本実施形態において、乾燥条件は特に制限されないが、例えば、金属複合酸化物又は金属複合水酸化物が酸化・還元されない条件(酸化物が酸化物のまま維持される、水酸化物が水酸化物のまま維持される)、金属複合水酸化物が酸化される条件(水酸化物が酸化物に酸化される)、金属複合酸化物が還元される条件(酸化物が水酸化物に還元される)のいずれの条件でもよい。酸化・還元がされない条件のためには、窒素、ヘリウム及びアルゴン等の不活性ガスを使用すればよく、水酸化物が酸化される条件では、酸素又は空気を使用すればよい。また、金属複合酸化物が還元される条件としては、不活性ガス雰囲気下、ヒドラジン、亜硫酸ナトリウム等の還元剤を使用すればよい。リチウム塩としては、炭酸リチウム、硝酸リチウム、酢酸リチウム、水酸化リチウム、水酸化リチウム水和物、酸化リチウムのうち何れか一つ、または、二つ以上を混合して使用することができる。 In the present embodiment, the drying conditions are not particularly limited. ), conditions under which metal composite hydroxides are oxidized (hydroxides are oxidized to oxides), conditions under which metal composite oxides are reduced (oxides are reduced to hydroxides ) may be used. Inert gases such as nitrogen, helium and argon may be used for non-oxidizing/reducing conditions, and oxygen or air may be used for hydroxide oxidizing conditions. As for the conditions for reducing the metal composite oxide, a reducing agent such as hydrazine or sodium sulfite may be used in an inert gas atmosphere. As the lithium salt, one or a mixture of two or more of lithium carbonate, lithium nitrate, lithium acetate, lithium hydroxide, lithium hydroxide hydrate, and lithium oxide may be used.
単粒子前駆体、二次粒子前駆体としての金属複合酸化物又は金属複合水酸化物の乾燥後に、適宜分級を行ってもよい。以上のリチウム塩と金属複合水酸化物とは、最終目的物の組成比を勘案して用いられる。例えば、ニッケルコバルトマンガン複合水酸化物を用いる場合、リチウム塩と当該金属複合水酸化物は、LiNiaCobMncO2(式中、a+b+c=1)の組成比に対応する割合で用いられる。ニッケルコバルトマンガン金属複合水酸化物及びリチウム塩の混合物を焼成することによって、リチウム-ニッケルコバルトマンガン複合酸化物が得られる。なお、焼成には、所望の組成に応じて乾燥空気、酸素雰囲気、不活性雰囲気等が用いられ、必要ならば複数の加熱工程が実施される。 After drying the metal composite oxide or metal composite hydroxide as the single particle precursor or the secondary particle precursor, classification may be carried out as appropriate. The above lithium salt and metal composite hydroxide are used in consideration of the composition ratio of the final product. For example, when nickel-cobalt-manganese composite hydroxide is used, the lithium salt and the metal composite hydroxide are used in a proportion corresponding to the composition ratio of LiNi a Co b Mn c O 2 (where a + b + c = 1). . A lithium-nickel-cobalt-manganese composite oxide is obtained by calcining a mixture of the nickel-cobalt-manganese metal composite hydroxide and the lithium salt. For firing, dry air, an oxygen atmosphere, an inert atmosphere, or the like is used depending on the desired composition, and if necessary, a plurality of heating steps are performed.
焼成における保持温度を調整することにより、得られるリチウム金属複合酸化物の単粒子の平均粒子径と二次粒子の平均粒子径を本実施形態の好ましい範囲に制御できる。
焼成における保持温度は、用いる遷移金属元素の種類、沈殿剤、に応じて適宜調整すればよい。
保持温度として、具体的には、200℃以上1150℃以下の範囲を挙げることができ、300℃以上1050℃以下が好ましく、500℃以上1000℃以下がより好ましい。
By adjusting the holding temperature in the firing, the average particle size of the single particles and the average particle size of the secondary particles of the obtained lithium metal composite oxide can be controlled within the preferred range of the present embodiment.
The holding temperature in firing may be appropriately adjusted according to the type of transition metal element and precipitant used.
Specifically, the holding temperature can be in the range of 200° C. or higher and 1150° C. or lower, preferably 300° C. or higher and 1050° C. or lower, and more preferably 500° C. or higher and 1000° C. or lower.
また、前記保持温度で保持する時間は、0.1時間以上20時間以下が挙げられ、0.5時間以上10時間以下が好ましい。前記保持温度までの昇温速度は、通常50℃/時間以上400℃/時間以下であり、前記保持温度から室温までの降温速度は、通常10℃/時間以上400℃/時間以下である。また、焼成の雰囲気としては、大気、酸素、窒素、アルゴンまたはこれらの混合ガスを用いることができる。 Moreover, the holding time at the holding temperature is preferably 0.1 hour or more and 20 hours or less, preferably 0.5 hour or more and 10 hours or less. The rate of temperature increase up to the holding temperature is usually 50° C./hour or more and 400° C./hour or less, and the temperature drop rate from the holding temperature to room temperature is usually 10° C./hour or more and 400° C./hour or less. As the firing atmosphere, air, oxygen, nitrogen, argon, or a mixed gas thereof can be used.
焼成によって得たリチウム金属複合酸化物は、粉砕後に適宜分級され、リチウム二次電池に適用可能な正極活物質とされる。 The lithium metal composite oxide obtained by sintering is pulverized and then appropriately classified to obtain a positive electrode active material that can be applied to lithium secondary batteries.
≪製造方法2≫
本実施形態のリチウム金属複合酸化物粉末は、単粒子から構成される第1のリチウム金属複合酸化物粉末と、二次粒子から構成される第2のリチウム金属複合酸化物粉末とを、それぞれ製造し、第1及び第2のリチウム金属複合酸化物粉末を混合することにより製造できる。
<<
For the lithium metal composite oxide powder of the present embodiment, a first lithium metal composite oxide powder composed of single particles and a second lithium metal composite oxide powder composed of secondary particles are produced. and mixing the first and second lithium metal composite oxide powders.
第1及び第2のリチウム金属複合酸化物粉末のいずれを製造する場合においても、まず、リチウム以外の金属、すなわち、少なくともNiを含み、Co、Mn、Fe、Cu、Ti、Mg、Al、W、B、Mo、Nb、Zn、Sn、Zr、Ga、La及びVのうちいずれか1種以上の任意元素を含む金属複合化合物を調製し、当該金属複合化合物を、第1のリチウム金属複合酸化物粉末には適当なリチウム塩と不活性溶剤と焼成することが好ましい。第2のリチウム金属複合酸化物粉末を製造する場合には、当該金属複合化合物に、適当なリチウム塩と焼成することが好ましい。 In the case of producing any of the first and second lithium metal composite oxide powders, first, metals other than lithium, that is, containing at least Ni, Co, Mn, Fe, Cu, Ti, Mg, Al, W , B, Mo, Nb, Zn, Sn, Zr, Ga, La, and V. A metal composite compound containing any one or more arbitrary elements is prepared, and the metal composite compound is subjected to a first lithium metal composite oxidation The powder is preferably calcined with a suitable lithium salt and an inert solvent. When producing the second lithium metal composite oxide powder, it is preferable to calcine the metal composite compound with an appropriate lithium salt.
金属複合化合物としては、金属複合水酸化物又は金属複合酸化物が好ましい。以下に、リチウム金属複合酸化物粉末の製造方法の一例を、金属複合化合物の製造工程と、リチウム金属複合酸化物の製造工程とに分けて説明する。 As the metal composite compound, a metal composite hydroxide or a metal composite oxide is preferable. An example of a method for producing a lithium metal composite oxide powder will be described below by dividing it into a metal composite compound production process and a lithium metal composite oxide production process.
(金属複合化合物の製造工程)
金属複合化合物は、通常公知のバッチ共沈殿法又は連続共沈殿法により製造することが可能である。以下、金属として、ニッケル、コバルト及びマンガンを含む金属複合水酸化物を例に、その製造方法を詳述する。
(Manufacturing process of metal composite compound)
A metal complex compound can be produced by a generally known batch coprecipitation method or continuous coprecipitation method. The method for producing the metal composite hydroxide containing nickel, cobalt and manganese as metals will be described in detail below.
まず共沈殿法、特に特開2002-201028号公報に記載された連続法により、ニッケル塩溶液、コバルト塩溶液、マンガン塩溶液、及び錯化剤を反応させ、NiaCobMnc(OH)2(式中、a+b+c=1)で表される金属複合水酸化物を製造する。 First, a nickel salt solution, a cobalt salt solution, a manganese salt solution, and a complexing agent are reacted by a coprecipitation method, particularly a continuous method described in JP-A-2002-201028, to form Ni a Co b Mn c (OH). 2 A metal composite hydroxide represented by (a+b+c=1 in the formula) is produced.
上記ニッケル塩溶液の溶質であるニッケル塩、上記コバルト塩溶液の溶質であるコバルト塩、上記マンガン塩溶液の溶質であるマンガン塩に関する説明は上記製造方法1における説明と同様である。また、溶媒として水が使用される。
The nickel salt, which is the solute of the nickel salt solution, the cobalt salt, which is the solute of the cobalt salt solution, and the manganese salt, which is the solute of the manganese salt solution, are the same as those in the
錯化剤、沈殿に関する説明は上記製造方法1における説明と同様である。
The explanation about the complexing agent and precipitation is the same as the explanation in the
以上の反応後、得られた反応沈殿物を水で洗浄した後、乾燥し、ニッケルコバルトマンガン複合化合物としてのニッケルコバルトマンガン水酸化物を単離する。また、必要に応じて弱酸水や水酸化ナトリウムや水酸化カリウムを含むアルカリ溶液で洗浄しても良い。
なお、上記の例では、ニッケルコバルトマンガン複合水酸化物を製造しているが、ニッケルコバルトマンガン複合酸化物を調製してもよい。
After the above reaction, the obtained reaction precipitate is washed with water and then dried to isolate nickel-cobalt-manganese hydroxide as a nickel-cobalt-manganese composite compound. Moreover, you may wash|clean with the alkaline solution containing weak acid water, sodium hydroxide, or potassium hydroxide as needed.
In addition, in the above example, a nickel-cobalt-manganese composite hydroxide is produced, but a nickel-cobalt-manganese composite oxide may be prepared.
(リチウム金属複合酸化物の製造工程)
上記金属複合酸化物又は金属複合水酸化物を乾燥した後、リチウム塩と混合する。また、第1のリチウム金属複合酸化物粉末を製造する場合には、この混合と同時に不活性溶融剤を混合することが好ましい。
金属複合酸化物若しくは金属複合水酸化物、リチウム塩及び不活性溶融剤を含む、不活性溶融剤含有混合物を焼成することにより、不活性溶融剤の存在下で、混合物を焼成することになる。不活性溶融剤の存在下で焼成することにより、一次粒子同士が焼結して二次粒子が生成することを抑制できる。また、単粒子の成長を促進できる。
(Manufacturing process of lithium metal composite oxide)
After drying the metal composite oxide or metal composite hydroxide, it is mixed with a lithium salt. Moreover, when manufacturing the first lithium metal composite oxide powder, it is preferable to mix an inert melting agent at the same time as this mixing.
Firing an inert melting agent-containing mixture comprising a metal complex oxide or metal hydroxide, a lithium salt and an inert melting agent results in firing the mixture in the presence of the inert melting agent. By firing in the presence of an inert melting agent, it is possible to suppress the formation of secondary particles due to sintering of primary particles. Also, the growth of single grains can be promoted.
本実施形態において、乾燥条件と分級に関する説明は製造方法1と同様である。
In the present embodiment, the explanations regarding the drying conditions and classification are the same as in the
第1のリチウム金属複合酸化物粉末を製造する場合には、不活性溶融剤の存在下で混合物の焼成を行うことで、混合物の反応を促進させることができる。不活性溶融剤は、焼成後のリチウム金属複合酸化物粉末に残留していてもよいし、焼成後に水などで洗浄すること等により除去されていてもよい。本実施形態においては、焼成後のリチウム複合金属酸化物は水などを用いて洗浄することが好ましい。 When producing the first lithium metal composite oxide powder, the reaction of the mixture can be promoted by firing the mixture in the presence of an inert melting agent. The inert melting agent may remain in the lithium metal composite oxide powder after firing, or may be removed by washing with water or the like after firing. In the present embodiment, it is preferable to wash the lithium composite metal oxide after firing with water or the like.
焼成における保持温度を調整することにより、得られるリチウム金属複合酸化物の単粒子の粒子径又は二次粒子の平均粒子径を本実施形態の好ましい範囲にそれぞれ制御できる。
焼成における保持温度は、用いる遷移金属元素の種類、沈殿剤、不活性溶融剤の種類、量に応じて適宜調整すればよい。
保持温度として、具体的には、200℃以上1150℃以下の範囲を挙げることができ、300℃以上1050℃以下が好ましく、500℃以上1000℃以下がより好ましい。
By adjusting the holding temperature in the sintering, the particle size of the single particles or the average particle size of the secondary particles of the resulting lithium metal composite oxide can be controlled within the preferred range of the present embodiment.
The holding temperature in the firing may be appropriately adjusted according to the type of transition metal element used and the type and amount of precipitant and inert melting agent.
Specifically, the holding temperature can be in the range of 200° C. or higher and 1150° C. or lower, preferably 300° C. or higher and 1050° C. or lower, and more preferably 500° C. or higher and 1000° C. or lower.
特に、第1のリチウム金属複合酸化物粉末を製造する場合には第2のリチウム金属複合酸化物粉末の保持温度よりも、30℃以上高いことが好ましく、50℃以上高いことがより好ましく、80℃以上高いことがさらに好ましい。 In particular, when the first lithium metal composite oxide powder is produced, the holding temperature of the second lithium metal composite oxide powder is preferably 30° C. or higher, more preferably 50° C. or higher. ° C. or more is more preferable.
また、前記保持温度で保持する時間は、0.1時間以上20時間以下が挙げられ、0.5時間以上10時間以下が好ましい。前記保持温度までの昇温速度は、通常50℃/時間以上400℃/時間以下であり、前記保持温度から室温までの降温速度は、通常10℃/時間以上400℃/時間以下である。また、焼成の雰囲気としては、大気、酸素、窒素、アルゴンまたはこれらの混合ガスを用いることができる。 Moreover, the holding time at the holding temperature is preferably 0.1 hour or more and 20 hours or less, preferably 0.5 hour or more and 10 hours or less. The rate of temperature increase up to the holding temperature is usually 50° C./hour or more and 400° C./hour or less, and the temperature drop rate from the holding temperature to room temperature is usually 10° C./hour or more and 400° C./hour or less. As the firing atmosphere, air, oxygen, nitrogen, argon, or a mixed gas thereof can be used.
得られた第1及び第2のリチウム金属複合酸化物粉末を所定の割合で混合することにより、本実施形態のリチウム金属複合酸化物粉末を得ることができる。 By mixing the obtained first and second lithium metal composite oxide powders in a predetermined ratio, the lithium metal composite oxide powder of the present embodiment can be obtained.
焼成によって得たリチウム金属複合酸化物は、粉砕後に適宜分級され、リチウム二次電池に適用可能な正極活物質とされる。 The lithium metal composite oxide obtained by sintering is pulverized and then appropriately classified to obtain a positive electrode active material that can be applied to lithium secondary batteries.
本実施形態に使用することができる不活性溶融剤は、焼成の際に混合物と反応し難いものであれば特に限定されない。本実施形態においては、Na、K、Rb、Cs、Ca、Mg、SrおよびBaからなる群より選ばれる1種以上の元素(以下、「A」と称する。)のフッ化物、Aの塩化物、Aの炭酸塩、Aの硫酸塩、Aの硝酸塩、Aのリン酸塩、Aの水酸化物、Aのモリブデン酸塩およびAのタングステン酸塩からなる群より選ばれる1種以上が挙げられる。 The inert melting agent that can be used in this embodiment is not particularly limited as long as it hardly reacts with the mixture during firing. In the present embodiment, one or more elements selected from the group consisting of Na, K, Rb, Cs, Ca, Mg, Sr and Ba (hereinafter referred to as "A") are fluorides and A chlorides. , A carbonate, A sulfate, A nitrate, A phosphate, A hydroxide, A molybdate and A tungstate. .
Aのフッ化物としては、NaF(融点:993℃)、KF(融点:858℃)、RbF(融点:795℃)、CsF(融点:682℃)、CaF2(融点:1402℃)、MgF2(融点:1263℃)、SrF2(融点:1473℃)およびBaF2(融点:1355℃)を挙げることができる。 Fluorides of A include NaF (melting point: 993° C.), KF (melting point: 858° C.), RbF (melting point: 795° C.), CsF (melting point: 682° C.), CaF 2 (melting point: 1402° C.), MgF 2 (melting point: 1263° C.), SrF 2 (melting point: 1473° C.) and BaF 2 (melting point: 1355° C.).
Aの塩化物としては、NaCl(融点:801℃)、KCl(融点:770℃)、RbCl(融点:718℃)、CsCl(融点:645℃)、CaCl2(融点:782℃)、MgCl2(融点:714℃)、SrCl2(融点:857℃)およびBaCl2(融点:963℃)を挙げることができる。 Chlorides of A include NaCl (melting point: 801°C), KCl (melting point: 770°C), RbCl (melting point: 718°C), CsCl (melting point: 645°C), CaCl 2 (melting point: 782°C), MgCl 2 (melting point: 714° C.), SrCl 2 (melting point: 857° C.) and BaCl 2 (melting point: 963° C.).
Aの炭酸塩としては、Na2CO3(融点:854℃)、K2CO3(融点:899℃)、Rb2CO3(融点:837℃)、Cs2CO3(融点:793℃)、CaCO3(融点:825℃)、MgCO3(融点:990℃)、SrCO3(融点:1497℃)およびBaCO3(融点:1380℃)を挙げることができる。 Carbonates of A include Na 2 CO 3 (melting point: 854° C.), K 2 CO 3 (melting point: 899° C.), Rb 2 CO 3 (melting point: 837° C.), Cs 2 CO 3 (melting point: 793° C.). , CaCO 3 (melting point: 825° C.), MgCO 3 (melting point: 990° C.), SrCO 3 (melting point: 1497° C.) and BaCO 3 (melting point: 1380° C.).
Aの硫酸塩としては、Na2SO4(融点:884℃)、K2SO4(融点:1069℃)、Rb2SO4(融点:1066℃)、Cs2SO4(融点:1005℃)、CaSO4(融点:1460℃)、MgSO4(融点:1137℃)、SrSO4(融点:1605℃)およびBaSO4(融点:1580℃)を挙げることができる。 Sulfates of A include Na 2 SO 4 (melting point: 884° C.), K 2 SO 4 (melting point: 1069° C.), Rb 2 SO 4 (melting point: 1066° C.), Cs 2 SO 4 (melting point: 1005° C.). , CaSO 4 (melting point: 1460° C.), MgSO 4 (melting point: 1137° C.), SrSO 4 (melting point: 1605° C.) and BaSO 4 (melting point: 1580° C.).
Aの硝酸塩としては、NaNO3(融点:310℃)、KNO3(融点:337℃)、RbNO3(融点:316℃)、CsNO3(融点:417℃)、Ca(NO3)2(融点:561℃)、Mg(NO3)2、Sr(NO3)2(融点:645℃)およびBa(NO3)2(融点:596℃)を挙げることができる。 Nitrates of A include NaNO 3 (melting point: 310° C.), KNO 3 (melting point: 337° C.), RbNO 3 (melting point: 316° C.), CsNO 3 (melting point: 417° C.), Ca(NO 3 ) 2 (melting point: 417° C.). : 561°C), Mg( NO3 ) 2 , Sr( NO3 ) 2 (melting point: 645°C) and Ba( NO3 ) 2 (melting point: 596°C).
Aのリン酸塩としては、Na3PO4、K3PO4(融点:1340℃)、Rb3PO4、Cs3PO4、Ca3(PO4)2、Mg3(PO4)2(融点:1184℃)、Sr3(PO4)2(融点:1727℃)およびBa3(PO4)2(融点:1767℃)を挙げることができる。 Phosphates of A include Na 3 PO 4 , K 3 PO 4 (melting point: 1340° C.), Rb 3 PO 4 , Cs 3 PO 4 , Ca 3 (PO 4 ) 2 , Mg 3 (PO 4 ) 2 ( 1184° C.), Sr 3 (PO 4 ) 2 (melting point: 1727° C.) and Ba 3 (PO 4 ) 2 (melting point: 1767° C.).
Aの水酸化物としては、NaOH(融点:318℃)、KOH(融点:360℃)、RbOH(融点:301℃)、CsOH(融点:272℃)、Ca(OH)2(融点:408℃)、Mg(OH)2(融点:350℃)、Sr(OH)2(融点:375℃)およびBa(OH)2(融点:853℃)を挙げることができる。 As the hydroxide of A, NaOH (melting point: 318°C), KOH (melting point: 360°C), RbOH (melting point: 301°C), CsOH (melting point: 272°C), Ca(OH) 2 (melting point: 408°C ), Mg(OH) 2 (melting point: 350° C.), Sr(OH) 2 (melting point: 375° C.) and Ba(OH) 2 (melting point: 853° C.).
Aのモリブデン酸塩としては、Na2MoO4(融点:698℃)、K2MoO4(融点:919℃)、Rb2MoO4(融点:958℃)、Cs2MoO4(融点:956℃)、CaMoO4(融点:1520℃)、MgMoO4(融点:1060℃)、SrMoO4(融点:1040℃)およびBaMoO4(融点:1460℃)を挙げることができる。 Molybdates of A include Na 2 MoO 4 (melting point: 698° C.), K 2 MoO 4 (melting point: 919° C.), Rb 2 MoO 4 (melting point: 958° C.), Cs 2 MoO 4 (melting point: 956° C.). ), CaMoO 4 (melting point: 1520° C.), MgMoO 4 (melting point: 1060° C.), SrMoO 4 (melting point: 1040° C.) and BaMoO 4 (melting point: 1460° C.).
Aのタングステン酸塩としては、Na2WO4(融点:687℃)、K2WO4、Rb2WO4、Cs2WO4、CaWO4、MgWO4、SrWO4およびBaWO4を挙げることができる。 Tungstates of A include Na2WO4 (melting point: 687°C), K2WO4 , Rb2WO4 , Cs2WO4 , CaWO4 , MgWO4 , SrWO4 and BaWO4 . .
本実施形態においては、これらの不活性溶融剤を2種以上用いることもできる。2種以上用いる場合は、融点が下がることもある。また、これらの不活性溶融剤の中でも、より結晶性が高いリチウム金属複合酸化物粉末を得るための不活性溶融剤としては、Aの炭酸塩および硫酸塩、Aの塩化物のいずれか又はその組み合わせであることが好ましい。また、Aとしては、ナトリウム(Na)およびカリウム(K)のいずれか一方又は両方であることが好ましい。すなわち、上記の中で、とりわけ好ましい不活性溶融剤は、NaCl、KCl、Na2CO3,K2CO3、Na2SO4、およびK2SO4からなる群より選ばれる1種以上である。 In this embodiment, two or more of these inert melting agents can be used. When two or more are used, the melting point may be lowered. Among these inert melting agents, as an inert melting agent for obtaining a lithium metal composite oxide powder with higher crystallinity, any one of carbonates and sulfates of A, chlorides of A, or A combination is preferred. Moreover, A is preferably either one or both of sodium (Na) and potassium (K). That is, among the above, particularly preferred inert melting agents are one or more selected from the group consisting of NaCl, KCl , Na2CO3 , K2CO3 , Na2SO4 , and K2SO4 . .
本実施形態において、焼成時の不活性溶融剤の存在量は適宜選択すればよい。一例を挙げると、焼成時の不活性溶融剤の存在量はリチウム化合物100質量部に対して0.1質量部以上であることが好ましく、1質量部以上であることがより好ましい。また、必要に応じて、上記に挙げた不活性溶融剤以外の不活性溶融剤を併せて用いてもよい。該溶融剤としては、NH4Cl、NH4Fなどのアンモニウム塩等を挙げることができる。 In this embodiment, the amount of the inert melting agent present during firing may be appropriately selected. For example, the amount of the inert melting agent present during firing is preferably 0.1 parts by mass or more, more preferably 1 part by mass or more, relative to 100 parts by mass of the lithium compound. Further, if necessary, an inert melting agent other than the inert melting agents listed above may be used together. Examples of the melting agent include ammonium salts such as NH4Cl and NH4F .
<リチウム二次電池>
次いで、リチウム二次電池の構成を説明しながら、本実施形態の正極活物質粉末を含有するリチウム二次電池用正極活物質を用いた正極、およびこの正極を有するリチウム二次電池について説明する。
<Lithium secondary battery>
Next, a positive electrode using the positive electrode active material for a lithium secondary battery containing the positive electrode active material powder of the present embodiment and a lithium secondary battery having this positive electrode will be described while describing the configuration of the lithium secondary battery.
本実施形態のリチウム二次電池の一例は、正極および負極、正極と負極との間に挟持されるセパレータ、正極と負極との間に配置される電解液を有する。 An example of the lithium secondary battery of the present embodiment has a positive electrode and a negative electrode, a separator sandwiched between the positive electrode and the negative electrode, and an electrolytic solution placed between the positive electrode and the negative electrode.
図1A及び図1Bは、本実施形態のリチウム二次電池の一例を示す模式図である。本実施形態の円筒型のリチウム二次電池10は、次のようにして製造する。
1A and 1B are schematic diagrams showing an example of the lithium secondary battery of this embodiment. The cylindrical lithium
まず、図1Aに示すように、帯状を呈する一対のセパレータ1、一端に正極リード21を有する帯状の正極2、および一端に負極リード31を有する帯状の負極3を、セパレータ1、正極2、セパレータ1、負極3の順に積層し、巻回することにより電極群4とする。
First, as shown in FIG. 1A, a pair of strip-shaped
次いで、図1Bに示すように、電池缶5に電極群4および不図示のインシュレーターを収容した後、缶底を封止し、電極群4に電解液6を含浸させ、正極2と負極3との間に電解質を配置する。さらに、電池缶5の上部をトップインシュレーター7および封口体8で封止することで、リチウム二次電池10を製造することができる。
Next, as shown in FIG. 1B, after housing the
電極群4の形状としては、例えば、電極群4を巻回の軸に対して垂直方向に切断したときの断面形状が、円、楕円、長方形、角を丸めた長方形となるような柱状の形状を挙げることができる。
As for the shape of the
また、このような電極群4を有するリチウム二次電池の形状としては、国際電気標準会議(IEC)が定めた電池に対する規格であるIEC60086、又はJIS C 8500で定められる形状を採用することができる。例えば、円筒型、角型などの形状を挙げることができる。
In addition, as the shape of the lithium secondary battery having such an
さらに、リチウム二次電池は、上記巻回型の構成に限らず、正極、セパレータ、負極、セパレータの積層構造を繰り返し重ねた積層型の構成であってもよい。積層型のリチウム二次電池としては、いわゆるコイン型電池、ボタン型電池、ペーパー型(又はシート型)電池を例示することができる。 Further, the lithium secondary battery is not limited to the wound type structure described above, and may have a layered structure in which a layered structure of a positive electrode, a separator, a negative electrode, and a separator is repeatedly stacked. Examples of laminated lithium secondary batteries include so-called coin-type batteries, button-type batteries, and paper-type (or sheet-type) batteries.
以下、各構成について順に説明する。
(正極)
本実施形態の正極は、まず正極活物質、導電材およびバインダーを含む正極合剤を調整し、正極合剤を正極集電体に担持させることで製造することができる。
Hereinafter, each configuration will be described in order.
(positive electrode)
The positive electrode of the present embodiment can be manufactured by first preparing a positive electrode mixture containing a positive electrode active material, a conductive material, and a binder, and supporting the positive electrode mixture on a positive electrode current collector.
(導電材)
本実施形態の正極が有する導電材としては、炭素材料を用いることができる。炭素材料として黒鉛粉末、カーボンブラック(例えばアセチレンブラック)、繊維状炭素材料などを挙げることができる。カーボンブラックは、微粒で表面積が大きいため、少量を正極合剤中に添加することにより正極内部の導電性を高め、充放電効率および出力特性を向上させることができるが、多く入れすぎるとバインダーによる正極合剤と正極集電体との結着力、および正極合剤内部の結着力がいずれも低下し、かえって内部抵抗を増加させる原因となる。
(Conductive material)
A carbon material can be used as the conductive material of the positive electrode of the present embodiment. Examples of carbon materials include graphite powder, carbon black (eg, acetylene black), and fibrous carbon materials. Since carbon black is fine particles and has a large surface area, adding a small amount of carbon black to the positive electrode mixture can increase the conductivity inside the positive electrode and improve the charge-discharge efficiency and output characteristics. Both the binding force between the positive electrode mixture and the positive electrode current collector and the binding force inside the positive electrode mixture are lowered, which rather causes an increase in internal resistance.
正極合剤中の導電材の割合は、正極活物質100質量部に対して5質量部以上20質量部以下であると好ましい。導電材として黒鉛化炭素繊維、カーボンナノチューブなどの繊維状炭素材料を用いる場合には、この割合を下げることも可能である。 The ratio of the conductive material in the positive electrode mixture is preferably 5 parts by mass or more and 20 parts by mass or less with respect to 100 parts by mass of the positive electrode active material. If a fibrous carbon material such as graphitized carbon fiber or carbon nanotube is used as the conductive material, this ratio can be lowered.
(バインダー)
本実施形態の正極が有するバインダーとしては、熱可塑性樹脂を用いることができる。
この熱可塑性樹脂としては、ポリフッ化ビニリデン(以下、PVdFということがある。
)、ポリテトラフルオロエチレン(以下、PTFEということがある。)、四フッ化エチレン・六フッ化プロピレン・フッ化ビニリデン系共重合体、六フッ化プロピレン・フッ化ビニリデン系共重合体、四フッ化エチレン・パーフルオロビニルエーテル系共重合体などのフッ素樹脂;ポリエチレン、ポリプロピレンなどのポリオレフィン樹脂;を挙げることができる。
(binder)
A thermoplastic resin can be used as the binder of the positive electrode of the present embodiment.
This thermoplastic resin is polyvinylidene fluoride (hereinafter sometimes referred to as PVdF).
), polytetrafluoroethylene (hereinafter sometimes referred to as PTFE), ethylene tetrafluoride/propylene hexafluoride/vinylidene fluoride copolymer, propylene hexafluoride/vinylidene fluoride copolymer, tetrafluoride fluororesins such as ethylene chloride/perfluorovinyl ether copolymers; polyolefin resins such as polyethylene and polypropylene;
これらの熱可塑性樹脂は、2種以上を混合して用いてもよい。バインダーとしてフッ素樹脂およびポリオレフィン樹脂を用い、正極合剤全体に対するフッ素樹脂の割合を1質量%以上10質量%以下、ポリオレフィン樹脂の割合を0.1質量%以上2質量%以下とすることによって、正極集電体との密着力および正極合剤内部の結合力がいずれも高い正極合剤を得ることができる。 These thermoplastic resins may be used in combination of two or more. A fluororesin and a polyolefin resin are used as a binder, and the ratio of the fluororesin to the entire positive electrode mixture is 1% by mass or more and 10% by mass or less, and the ratio of the polyolefin resin is 0.1% by mass or more and 2% by mass or less. It is possible to obtain a positive electrode mixture having both high adhesion to the current collector and high bonding strength inside the positive electrode mixture.
(正極集電体)
本実施形態の正極が有する正極集電体としては、Al、Ni、ステンレスなどの金属材料を形成材料とする帯状の部材を用いることができる。なかでも、加工しやすく、安価であるという点でAlを形成材料とし、薄膜状に加工したものが好ましい。
(Positive electrode current collector)
As the positive electrode current collector included in the positive electrode of the present embodiment, a strip-shaped member made of a metal material such as Al, Ni, or stainless steel can be used. Among them, it is preferable to use Al as a forming material and process it into a thin film because it is easy to process and inexpensive.
正極集電体に正極合剤を担持させる方法としては、正極合剤を正極集電体上で加圧成型する方法が挙げられる。また、有機溶媒を用いて正極合剤をペースト化し、得られる正極合剤のペーストを正極集電体の少なくとも一面側に塗布して乾燥させ、プレスし固着することで、正極集電体に正極合剤を担持させてもよい。 As a method for supporting the positive electrode mixture on the positive electrode current collector, there is a method of pressure-molding the positive electrode mixture on the positive electrode current collector. In addition, the positive electrode mixture is made into a paste using an organic solvent, and the obtained positive electrode mixture paste is applied to at least one side of a positive electrode current collector, dried, and pressed to adhere, thereby forming a positive electrode on the positive electrode current collector. A mixture may be supported.
正極合剤をペースト化する場合、用いることができる有機溶媒としては、N,N―ジメチルアミノプロピルアミン、ジエチレントリアミンなどのアミン系溶媒;テトラヒドロフランなどのエーテル系溶媒;メチルエチルケトンなどのケトン系溶媒;酢酸メチルなどのエステル系溶媒;ジメチルアセトアミド、N-メチル-2-ピロリドン(以下、NMPということがある。)などのアミド系溶媒;が挙げられる。 When the positive electrode mixture is made into a paste, organic solvents that can be used include amine-based solvents such as N,N-dimethylaminopropylamine and diethylenetriamine; ether-based solvents such as tetrahydrofuran; ketone-based solvents such as methyl ethyl ketone; ester solvents such as dimethylacetamide; amide solvents such as dimethylacetamide and N-methyl-2-pyrrolidone (hereinafter sometimes referred to as NMP);
正極合剤のペーストを正極集電体へ塗布する方法としては、例えば、スリットダイ塗工法、スクリーン塗工法、カーテン塗工法、ナイフ塗工法、グラビア塗工法および静電スプレー法が挙げられる。 Examples of methods for applying the positive electrode mixture paste to the positive electrode current collector include slit die coating, screen coating, curtain coating, knife coating, gravure coating, and electrostatic spraying.
以上に挙げられた方法により、正極を製造することができる。
(負極)
本実施形態のリチウム二次電池が有する負極は、正極よりも低い電位でリチウムイオンのドープかつ脱ドープが可能であればよく、負極活物質を含む負極合剤が負極集電体に担持されてなる電極、および負極活物質単独からなる電極を挙げることができる。
A positive electrode can be manufactured by the method mentioned above.
(negative electrode)
The negative electrode included in the lithium secondary battery of the present embodiment may be capable of doping and dedoping lithium ions at a potential lower than that of the positive electrode, and the negative electrode mixture containing the negative electrode active material is supported on the negative electrode current collector. and an electrode composed solely of the negative electrode active material.
(負極活物質)
負極が有する負極活物質としては、炭素材料、カルコゲン化合物(酸化物、硫化物など)、窒化物、金属又は合金で、正極よりも低い電位でリチウムイオンのドープかつ脱ドープが可能な材料が挙げられる。
(Negative electrode active material)
Examples of the negative electrode active material that the negative electrode has include carbon materials, chalcogen compounds (oxides, sulfides, etc.), nitrides, metals, or alloys that can be doped and undoped with lithium ions at a potential lower than that of the positive electrode. be done.
負極活物質として使用可能な炭素材料としては、天然黒鉛、人造黒鉛などの黒鉛、コークス類、カーボンブラック、熱分解炭素類、炭素繊維および有機高分子化合物焼成体を挙げることができる。 Examples of carbon materials that can be used as the negative electrode active material include graphite such as natural graphite and artificial graphite, cokes, carbon black, pyrolytic carbons, carbon fibers, and baked organic polymer compounds.
負極活物質として使用可能な酸化物としては、SiO2、SiOなど式SiOx(ここで、xは正の実数)で表されるケイ素の酸化物;TiO2、TiOなど式TiOx(ここで、xは正の実数)で表されるチタンの酸化物;V2O5、VO2など式VOx(ここで、xは正の実数)で表されるバナジウムの酸化物;Fe3O4、Fe2O3、FeOなど式FeOx(ここで、xは正の実数)で表される鉄の酸化物;SnO2、SnOなど式SnOx(ここで、xは正の実数)で表されるスズの酸化物;WO3、WO2など一般式WOx(ここで、xは正の実数)で表されるタングステンの酸化物;Li4Ti5O12、LiVO2などのリチウムとチタン又はバナジウムとを含有する複合金属酸化物;を挙げることができる。 Examples of oxides that can be used as the negative electrode active material include oxides of silicon represented by the formula SiO x (where x is a positive real number) such as SiO 2 and SiO ; , x is a positive real number); V 2 O 5 , VO 2, etc. Vanadium oxide represented by the formula VO x (where x is a positive real number); Fe 3 O 4 , Fe 2 O 3 , FeO, etc. Iron oxide represented by the formula FeO x (where x is a positive real number); SnO 2 , SnO, etc. represented by the formula SnO x (where x is a positive real number) oxides of tin such as WO 3 and WO 2 ; oxides of tungsten represented by the general formula WO x (where x is a positive real number); lithium and titanium such as Li 4 Ti 5 O 12 and LiVO 2 or a composite metal oxide containing vanadium;
負極活物質として使用可能な硫化物としては、Ti2S3、TiS2、TiSなど式TiSx(ここで、xは正の実数)で表されるチタンの硫化物;V3S4、VS2、VSなど式VSx(ここで、xは正の実数)で表されるバナジウムの硫化物;Fe3S4、FeS2、FeSなど式FeSx(ここで、xは正の実数)で表される鉄の硫化物;Mo2S3、MoS2など式MoSx(ここで、xは正の実数)で表されるモリブデンの硫化物;SnS2、SnSなど式SnSx(ここで、xは正の実数)で表されるスズの硫化物;WS2など式WSx(ここで、xは正の実数)で表されるタングステンの硫化物;Sb2S3など式SbSx(ここで、xは正の実数)で表されるアンチモンの硫化物;Se5S3、SeS2、SeSなど式SeSx(ここで、xは正の実数)で表されるセレンの硫化物;を挙げることができる。 Sulfides that can be used as negative electrode active materials include titanium sulfides represented by the formula TiS x (where x is a positive real number) such as Ti 2 S 3 , TiS 2 and TiS; V 3 S 4 and VS. 2, Vanadium sulfide represented by the formula VS x (where x is a positive real number) such as VS ; Molybdenum sulfide represented by the formula MoS x (where x is a positive real number) such as Mo 2 S 3 and MoS 2 ; SnS 2 and SnS etc. Formula SnS x (where, sulfides of tin represented by the formula WS x (where x is a positive real number); sulfides of tungsten represented by the formula WS x (where x is a positive real number) ; selenium sulfide represented by the formula SeS x (where x is a positive real number), such as Se5S3 , SeS2 , SeS, etc.; can be mentioned.
負極活物質として使用可能な窒化物としては、Li3N、Li3-xAxN(ここで、AはNiおよびCoのいずれか一方又は両方であり、0<x<3である。)などのリチウム含有窒化物を挙げることができる。 Nitrides that can be used as negative electrode active materials include Li 3 N and Li 3-x A x N (where A is either one or both of Ni and Co, and 0<x<3). Lithium-containing nitrides such as
これらの炭素材料、酸化物、硫化物、窒化物は、1種のみ用いてもよく2種以上を併用して用いてもよい。また、これらの炭素材料、酸化物、硫化物、窒化物は、結晶質又は非晶質のいずれでもよい。 These carbon materials, oxides, sulfides and nitrides may be used alone or in combination of two or more. Moreover, these carbon materials, oxides, sulfides and nitrides may be either crystalline or amorphous.
また、負極活物質として使用可能な金属としては、リチウム金属、シリコン金属およびスズ金属などを挙げることができる。 Metals that can be used as the negative electrode active material include lithium metal, silicon metal, and tin metal.
負極活物質として使用可能な合金としては、Li-Al、Li-Ni、Li-Si、Li-Sn、Li-Sn-Niなどのリチウム合金;Si-Znなどのシリコン合金;Sn-Mn、Sn-Co、Sn-Ni、Sn-Cu、Sn-Laなどのスズ合金;Cu2Sb、La3Ni2Sn7などの合金;を挙げることもできる。 Alloys that can be used as negative electrode active materials include lithium alloys such as Li—Al, Li—Ni, Li—Si, Li—Sn, and Li—Sn—Ni; silicon alloys such as Si—Zn; - tin alloys such as Co, Sn-Ni, Sn-Cu, Sn-La; alloys such as Cu 2 Sb, La 3 Ni 2 Sn 7 ;
これらの金属や合金は、例えば箔状に加工された後、主に単独で電極として用いられる。 These metals and alloys are mainly used alone as electrodes after being processed into a foil shape, for example.
上記負極活物質の中では、充電時に未充電状態から満充電状態にかけて負極の電位がほとんど変化しない(電位平坦性がよい)、平均放電電位が低い、繰り返し充放電させたときの容量維持率が高い(サイクル特性がよい)などの理由から、天然黒鉛、人造黒鉛などの黒鉛を主成分とする炭素材料が好ましく用いられる。炭素材料の形状としては、例えば天然黒鉛のような薄片状、メソカーボンマイクロビーズのような球状、黒鉛化炭素繊維のような繊維状、又は微粉末の凝集体などのいずれでもよい。 Among the above negative electrode active materials, the potential of the negative electrode hardly changes from the uncharged state to the fully charged state during charging (good potential flatness), the average discharge potential is low, and the capacity retention rate when repeatedly charged and discharged is low. A carbon material containing graphite as a main component, such as natural graphite or artificial graphite, is preferably used for reasons such as high (good cycle characteristics). The shape of the carbon material may be, for example, flaky such as natural graphite, spherical such as mesocarbon microbeads, fibrous such as graphitized carbon fiber, or aggregates of fine powder.
前記の負極合剤は、必要に応じて、バインダーを含有してもよい。バインダーとしては、熱可塑性樹脂を挙げることができ、具体的には、PVdF、熱可塑性ポリイミド、カルボキシメチルセルロース、ポリエチレンおよびポリプロピレンを挙げることができる。 The negative electrode mixture may contain a binder, if necessary. Binders may include thermoplastic resins, specifically PVdF, thermoplastic polyimides, carboxymethyl cellulose, polyethylene and polypropylene.
(負極集電体)
負極が有する負極集電体としては、Cu、Ni、ステンレスなどの金属材料を形成材料とする帯状の部材を挙げることができる。なかでも、リチウムと合金を作り難く、加工しやすいという点で、Cuを形成材料とし、薄膜状に加工したものが好ましい。
(Negative electrode current collector)
Examples of the negative electrode current collector of the negative electrode include a band-shaped member made of a metal material such as Cu, Ni, or stainless steel. Among them, it is preferable to use Cu as a forming material and process it into a thin film because it is difficult to form an alloy with lithium and is easy to process.
このような負極集電体に負極合剤を担持させる方法としては、正極の場合と同様に、加圧成型による方法、溶媒などを用いてペースト化し負極集電体上に塗布、乾燥後プレスし圧着する方法が挙げられる。 As a method for supporting the negative electrode mixture on such a negative electrode current collector, as in the case of the positive electrode, a method of pressure molding, a paste using a solvent or the like is applied to the negative electrode current collector, dried and then pressed. A method of crimping can be mentioned.
(セパレータ)
本実施形態のリチウム二次電池が有するセパレータとしては、例えば、ポリエチレン、ポリプロピレンなどのポリオレフィン樹脂、フッ素樹脂、含窒素芳香族重合体などの材質からなる、多孔質膜、不織布、織布などの形態を有する材料を用いることができる。また、これらの材質を2種以上用いてセパレータを形成してもよいし、これらの材料を積層してセパレータを形成してもよい。
(separator)
The separator of the lithium secondary battery of the present embodiment may be in the form of a porous film, nonwoven fabric, or woven fabric made of a material such as a polyolefin resin such as polyethylene or polypropylene, a fluororesin, or a nitrogen-containing aromatic polymer. can be used. Moreover, the separator may be formed using two or more of these materials, or the separator may be formed by laminating these materials.
本実施形態において、セパレータは、電池使用時(充放電時)に電解質を良好に透過させるため、JIS P 8117で定められるガーレー法による透気抵抗度が、50秒/100cc以上、300秒/100cc以下であることが好ましく、50秒/100cc以上、200秒/100cc以下であることがより好ましい。 In the present embodiment, the separator has a permeation resistance of 50 seconds/100 cc or more and 300 seconds/100 cc according to the Gurley method defined in JIS P 8117 in order to allow the electrolyte to pass through the separator well when the battery is used (during charging and discharging). It is preferably 50 seconds/100 cc or more and 200 seconds/100 cc or less.
また、セパレータの空孔率は、好ましくは30体積%以上80体積%以下、より好ましくは40体積%以上70体積%以下である。セパレータは空孔率の異なるセパレータを積層したものであってもよい。 The porosity of the separator is preferably 30% by volume or more and 80% by volume or less, more preferably 40% by volume or more and 70% by volume or less. The separator may be a laminate of separators with different porosities.
(電解液)
本実施形態のリチウム二次電池が有する電解液は、電解質および有機溶媒を含有する。
(Electrolyte)
The electrolytic solution of the lithium secondary battery of this embodiment contains an electrolyte and an organic solvent.
電解液に含まれる電解質としては、LiClO4、LiPF6、LiAsF6、LiSbF6、LiBF4、LiCF3SO3、LiN(SO2CF3)2、LiN(SO2C2F5)2、LiN(SO2CF3)(COCF3)、Li(C4F9SO3)、LiC(SO2CF3)3、Li2B10Cl10、LiBOB(ここで、BOBは、bis(oxalato)borateのことである。)、LiFSI(ここで、FSIはbis(fluorosulfonyl)imideのことである)、低級脂肪族カルボン酸リチウム塩、LiAlCl4などのリチウム塩が挙げられ、これらの2種以上の混合物を使用してもよい。なかでも電解質としては、フッ素を含むLiPF6、LiAsF6、LiSbF6、LiBF4、LiCF3SO3、LiN(SO2CF3)2およびLiC(SO2CF3)3からなる群より選ばれる少なくとも1種を含むものを用いることが好ましい。 Electrolytes contained in the electrolytic solution include LiClO 4 , LiPF 6 , LiAsF 6 , LiSbF 6 , LiBF 4 , LiCF 3 SO 3 , LiN(SO 2 CF 3 ) 2 , LiN(SO 2 C 2 F 5 ) 2 , LiN ( SO2CF3 ) ( COCF3 ) , Li( C4F9SO3 ), LiC ( SO2CF3 ) 3 , Li2B10Cl10 , LiBOB (where BOB is bis (oxalato)borate ), LiFSI (where FSI is bis(fluorosulfonyl)imide), lower aliphatic carboxylic acid lithium salts, LiAlCl4 and other lithium salts, and mixtures of two or more thereof may be used. Among them, the electrolyte is at least selected from the group consisting of LiPF 6 , LiAsF 6 , LiSbF 6 , LiBF 4 , LiCF 3 SO 3 , LiN(SO 2 CF 3 ) 2 and LiC(SO 2 CF 3 ) 3 containing fluorine. It is preferred to use one containing one.
また前記電解液に含まれる有機溶媒としては、例えばプロピレンカーボネート、エチレンカーボネート、ジメチルカーボネート、ジエチルカーボネート、エチルメチルカーボネート、4-トリフルオロメチル-1,3-ジオキソラン-2-オン、1,2-ジ(メトキシカルボニルオキシ)エタンなどのカーボネート類;1,2-ジメトキシエタン、1,3-ジメトキシプロパン、ペンタフルオロプロピルメチルエーテル、2,2,3,3-テトラフルオロプロピルジフルオロメチルエーテル、テトラヒドロフラン、2-メチルテトラヒドロフランなどのエーテル類;ギ酸メチル、酢酸メチル、γ-ブチロラクトンなどのエステル類;アセトニトリル、ブチロニトリルなどのニトリル類;N,N-ジメチルホルムアミド、N,N-ジメチルアセトアミドなどのアミド類;3-メチル-2-オキサゾリドンなどのカーバメート類;スルホラン、ジメチルスルホキシド、1,3-プロパンサルトンなどの含硫黄化合物、又はこれらの有機溶媒にさらにフルオロ基を導入したもの(有機溶媒が有する水素原子のうち1以上をフッ素原子で置換したもの)を用いることができる。 Examples of the organic solvent contained in the electrolytic solution include propylene carbonate, ethylene carbonate, dimethyl carbonate, diethyl carbonate, ethylmethyl carbonate, 4-trifluoromethyl-1,3-dioxolan-2-one, 1,2-di (Methoxycarbonyloxy) carbonates such as ethane; 1,2-dimethoxyethane, 1,3-dimethoxypropane, pentafluoropropylmethyl ether, 2,2,3,3-tetrafluoropropyldifluoromethyl ether, tetrahydrofuran, 2- ethers such as methyltetrahydrofuran; esters such as methyl formate, methyl acetate and γ-butyrolactone; nitriles such as acetonitrile and butyronitrile; amides such as N,N-dimethylformamide and N,N-dimethylacetamide; - Carbamates such as 2-oxazolidone; Sulfur-containing compounds such as sulfolane, dimethyl sulfoxide, 1,3-propanesultone, or those obtained by further introducing a fluoro group into these organic solvents (one of the hydrogen atoms of the organic solvent above substituted with a fluorine atom) can be used.
有機溶媒としては、これらのうちの2種以上を混合して用いることが好ましい。中でもカーボネート類を含む混合溶媒が好ましく、環状カーボネートと非環状カーボネートとの混合溶媒および環状カーボネートとエーテル類との混合溶媒がさらに好ましい。環状カーボネートと非環状カーボネートとの混合溶媒としては、エチレンカーボネート、ジメチルカーボネートおよびエチルメチルカーボネートを含む混合溶媒が好ましい。このような混合溶媒を用いた電解液は、動作温度範囲が広く、高い電流レートにおける充放電を行っても劣化し難く、長時間使用しても劣化し難く、かつ負極の活物質として天然黒鉛、人造黒鉛などの黒鉛材料を用いた場合でも難分解性であるという多くの特長を有する。 As the organic solvent, it is preferable to use a mixture of two or more of these. Among them, a mixed solvent containing carbonates is preferable, and a mixed solvent of a cyclic carbonate and a non-cyclic carbonate and a mixed solvent of a cyclic carbonate and an ether are more preferable. A mixed solvent containing ethylene carbonate, dimethyl carbonate and ethyl methyl carbonate is preferable as the mixed solvent of the cyclic carbonate and the non-cyclic carbonate. The electrolyte using such a mixed solvent has a wide operating temperature range, does not easily deteriorate even when charging and discharging at a high current rate, does not easily deteriorate even after long-term use, and uses natural graphite as an active material for the negative electrode. , and has many features of being resistant to decomposition even when graphite materials such as artificial graphite are used.
また、電解液としては、得られるリチウム二次電池の安全性が高まるため、LiPF6などのフッ素を含むリチウム塩およびフッ素置換基を有する有機溶媒を含む電解液を用いることが好ましい。ペンタフルオロプロピルメチルエーテル、2,2,3,3-テトラフルオロプロピルジフルオロメチルエーテルなどのフッ素置換基を有するエーテル類とジメチルカーボネートとを含む混合溶媒は、高い電流レートにおける充放電を行っても容量維持率が高いため、さらに好ましい。 Further, as the electrolytic solution, it is preferable to use an electrolytic solution containing a fluorine-containing lithium salt such as LiPF 6 and an organic solvent having a fluorine substituent, since the safety of the obtained lithium secondary battery is increased. Mixed solvents containing fluorine-substituted ethers such as pentafluoropropylmethyl ether and 2,2,3,3-tetrafluoropropyldifluoromethyl ether and dimethyl carbonate do not retain their capacity even when charged and discharged at a high current rate. It is more preferable because of its high retention rate.
上記の電解液の代わりに固体電解質を用いてもよい。固体電解質としては、例えばポリエチレンオキサイド系の高分子化合物、ポリオルガノシロキサン鎖又はポリオキシアルキレン鎖の少なくとも一種以上を含む高分子化合物などの有機系高分子電解質を用いることができる。また、高分子化合物に非水電解液を保持させた、いわゆるゲルタイプのものを用いることもできる。またLi2S-SiS2、Li2S-GeS2、Li2S-P2S5、Li2S-B2S3、Li2S-SiS2-Li3PO4、Li2S-SiS2-Li2SO4、Li2S-GeS2-P2S5などの硫化物を含む無機系固体電解質が挙げられ、これらの2種以上の混合物を用いてもよい。これら固体電解質を用いることで、リチウム二次電池の安全性をより高めることができることがある。 A solid electrolyte may be used in place of the above electrolytic solution. Examples of solid electrolytes that can be used include organic polymer electrolytes such as polyethylene oxide polymer compounds and polymer compounds containing at least one of polyorganosiloxane chains and polyoxyalkylene chains. In addition, a so-called gel type in which a non-aqueous electrolyte is held in a polymer compound can also be used. Li 2 S—SiS 2 , Li 2 S—GeS 2 , Li 2 SP 2 S 5 , Li 2 S—B 2 S 3 , Li 2 S—SiS 2 —Li 3 PO 4 , Li 2 S—SiS Inorganic solid electrolytes containing sulfides such as 2 - Li 2 SO 4 and Li 2 S--GeS 2 --P 2 S 5 may be mentioned, and mixtures of two or more of these may be used. By using these solid electrolytes, the safety of the lithium secondary battery can sometimes be improved.
また、本実施形態のリチウム二次電池において、固体電解質を用いる場合には、固体電解質がセパレータの役割を果たす場合もあり、その場合には、セパレータを必要としないこともある。 Moreover, in the lithium secondary battery of the present embodiment, when a solid electrolyte is used, the solid electrolyte may serve as a separator, in which case the separator may not be required.
次に、本発明を実施例によりさらに詳細に説明する。 EXAMPLES Next, the present invention will be described in more detail by way of examples.
<組成分析>
後述の方法で製造されるリチウム金属複合酸化物粉末の組成分析は、得られたリチウム複合金属化合物の粉末を塩酸に溶解させた後、誘導結合プラズマ発光分析装置(エスアイアイ・ナノテクノロジー株式会社製、SPS3000)を用いて行った。
<Composition analysis>
The composition analysis of the lithium metal composite oxide powder produced by the method described below was performed by dissolving the obtained lithium composite metal compound powder in hydrochloric acid and then using an inductively coupled plasma emission spectrometer (manufactured by SII Nanotechnology Co., Ltd. , SPS3000).
<BET比表面積測定>
リチウム金属複合酸化物粉末1gを窒素雰囲気中、105℃で30分間乾燥させた後、マウンテック社製Macsorb(登録商標)を用いて測定した(単位:m2/g)。
<BET specific surface area measurement>
After drying 1 g of the lithium metal composite oxide powder at 105° C. for 30 minutes in a nitrogen atmosphere, it was measured using Macsorb (registered trademark) manufactured by Mountech (unit: m 2 /g).
<平均粒子径D50の測定>
リチウム金属複合酸化物粉末0.1gを、0.2質量%ヘキサメタりん酸ナトリウム水溶液50mlに投入し、該粉末を分散させた分散液を得た。次に、得られた分散液についてマイクロトラック・ベル株式会社製マイクロトラックMT3300EXII(レーザー回折散乱粒度分布測定装置)を用いて、粒度分布を測定し、体積基準の累積粒度分布曲線を得た。そして、得られた累積粒度分布曲線において、全体を100%としたときに、微小粒子側からの累積体積が50%となる点の粒子径の値を50%累積体積粒度D50(μm)として求めた。
<Measurement of average particle diameter D50 >
0.1 g of lithium metal composite oxide powder was put into 50 ml of 0.2% by mass sodium hexametaphosphate aqueous solution to obtain a dispersion liquid in which the powder was dispersed. Next, the particle size distribution of the resulting dispersion was measured using a Microtrac MT3300EXII (laser diffraction scattering particle size distribution analyzer) manufactured by Microtrac Bell Co., Ltd. to obtain a volume-based cumulative particle size distribution curve. Then, in the obtained cumulative particle size distribution curve, when the whole is 100%, the value of the particle diameter at the point where the cumulative volume from the fine particle side becomes 50% is defined as the 50% cumulative volume particle size D 50 (μm). asked.
<単粒子及び二次粒子の平均粒子径の測定>
リチウム金属複合酸化物粉末を、サンプルステージ上に貼った導電性シート上に載せ、日本電子株式会社製JSM-5510を用いて、加速電圧が20kVの電子線を照射してSEM観察を行った。なお、導電性シートにリチウム複合金属酸化物粉末を載せる際には独立した粒子同士が重なって観察されないよう、導電性シートに載せる粉末量を調整した。SEM観察により得られた画像(SEM写真)から任意に50個の単粒子又は二次粒子を抽出し、それぞれの単粒子又は二次粒子について、投影像を一定方向から引いた平行線ではさんだ平行線間の距離(定方向径)を単粒子又は二次粒子の粒子径として測定した。
得られた単粒子又は二次粒子の粒子径の算術平均値を、リチウム金属複合酸化物粉末の平均単粒子径又は平均二次粒子径とした。
<Measurement of average particle size of single particles and secondary particles>
The lithium metal composite oxide powder was placed on a conductive sheet pasted on a sample stage, and an electron beam was irradiated at an acceleration voltage of 20 kV using JSM-5510 manufactured by JEOL Ltd. for SEM observation. When the lithium composite metal oxide powder was placed on the conductive sheet, the amount of powder placed on the conductive sheet was adjusted so that independent particles were not observed overlapping each other. 50 single particles or secondary particles are arbitrarily extracted from the image (SEM photograph) obtained by SEM observation, and for each single particle or secondary particle, a parallel line drawn from a certain direction sandwiches the projected image. The distance between lines (unidirectional diameter) was measured as the particle size of single particles or secondary particles.
The arithmetic average value of the particle sizes of the obtained single particles or secondary particles was taken as the average single particle size or average secondary particle size of the lithium metal composite oxide powder.
<円形度の測定>
前記SEM面像をコンピュータに取り込み、画像解析ソフトImage Jを用い、該SEM画像中における最大輝度及び最小輝度の中間値で二値化処理を行い、該リチウム複合金属酸化物粉末、すなわち単粒子又は二次粒子を黒色とし、該単粒子又は二次粒子以外の部分を白色として変換した二値化処理済み画像を得た。前記二値化処理済み画像について、該単粒子又は二次粒子に該当する黒色部分それぞれについて、円形度を測定した。
<Measurement of circularity>
The SEM surface image is taken into a computer, and using image analysis software Image J, binarization processing is performed at the intermediate value between the maximum luminance and the minimum luminance in the SEM image, and the lithium composite metal oxide powder, that is, single particles or A binarized image was obtained by converting the secondary particles to black and the portions other than the single particles or secondary particles to white. Circularity was measured for each of the black portions corresponding to the single particles or secondary particles in the binarized image.
[円形度分布のピーク数の測定方法]
上記の方法により得られたそれぞれの粒子における円形度を横軸、粒子個数を縦軸にした円形度分布において、円形度が0~1.0の間で0.05毎に等間隔となるように20分割のデータ範囲を設定した際に、円形度が低い側から高い側へ向かって、粒子個数が増加から減少に転ずる箇所(ピーク)の数を測定した。
[Method for measuring the number of peaks in circularity distribution]
In the circularity distribution with the circularity of each particle obtained by the above method on the horizontal axis and the number of particles on the vertical axis, the circularity is between 0 and 1.0 at equal intervals every 0.05. When the data range of 20 divisions was set to , the number of points (peaks) where the number of particles changed from an increase to a decrease was measured from the low circularity side to the high circularity side.
[平均円形度の算出]
平均円形度は、以下のようにして算出した。
リチウム複合金属酸化物粉末における平均円形度 = 観察した全粒子の円形度の和/観察した全粒子個数
[Calculation of average circularity]
The average circularity was calculated as follows.
Average circularity of lithium composite metal oxide powder = sum of observed circularity of all particles/number of all observed particles
[第1のピークおよび第2のピークにおける円形度の算出] 単粒子又は二次粒子における平均円形度を以下のように算出した。
単粒子における平均円形度 = 観察した単粒子の円形度の和/観察した単粒子個数 二次粒子における平均円形度 = 観察した二次粒子の円形度の和/観察した二次粒子個数
該単粒子又は二次粒子における平均円形度を算出し、平均円形度が低い粒子に由来するピークから第1のピーク、第2のピークと呼ぶ。2つ以上のピークがある場合には、さらに続けて、第3のピーク、第4のピークと呼ぶ。
[Calculation of Circularity of First and Second Peaks] The average circularity of single particles or secondary particles was calculated as follows.
Average Circularity of Single Particles = Sum of Observed Circularities of Single Particles/Number of Observed Single Particles Average Circularity of Secondary Particles = Sum of Observed Circularities of Secondary Particles/Number of Observed Secondary Particles Alternatively, the average circularity of the secondary particles is calculated, and the peaks derived from particles with a low average circularity are called the first peak and the second peak. When there are two or more peaks, they are called third and fourth peaks.
<円形度分布標準偏差の算出>
前記円形度分布より、円形度分布標準偏差を算出した。具体的には以下のようにして算出した。
<Calculation of circularity distribution standard deviation>
A circularity distribution standard deviation was calculated from the circularity distribution. Specifically, it was calculated as follows.
下記の数式中、nはデータ総数であり、粒子個数を意味する。平均値x-は、平均円形度を意味する。xiは、各粒子の円形度を意味する。 In the formula below, n is the total number of data and means the number of particles. The average value x − means the average circularity. x i means the circularity of each particle.
〔リチウム二次電池の作製〕
・リチウム二次電池用正極の作製
後述する製造方法で得られるリチウム二次電池用正極活物質と導電材(アセチレンブラック)とバインダー(PVdF)とを、リチウム二次電池用正極活物質:導電材:バインダー=92:5:3(質量比)の組成となるように加えて混練することにより、ペースト状の正極合剤を調製した。正極合剤の調製時には、N-メチル-2-ピロリドンを有機溶媒として用いた。
[Production of lithium secondary battery]
・Preparation of positive electrode for lithium secondary battery A positive electrode active material for a lithium secondary battery, a conductive material (acetylene black), and a binder (PVdF) obtained by the manufacturing method described later are combined into a positive electrode active material for a lithium secondary battery: conductive material. : Binder = 92:5:3 (mass ratio), and kneaded to prepare a pasty positive electrode mixture. N-methyl-2-pyrrolidone was used as an organic solvent when preparing the positive electrode mixture.
得られた正極合剤を、集電体となる厚さ40μmのAl箔に塗布して60℃で3時間乾燥し、線圧200kN/mでプレスを行い、150℃で8時間真空乾燥を行って、リチウム二次電池用正極を得た。このリチウム二次電池用正極の電極面積は1.65cm2とした。また、得られたリチウム二次電池用正極の質量測定を行い、正極合材層の密度(正極密度)を算出した。 The resulting positive electrode mixture was applied to an Al foil having a thickness of 40 μm as a current collector, dried at 60° C. for 3 hours, pressed at a linear pressure of 200 kN/m, and vacuum-dried at 150° C. for 8 hours. Thus, a positive electrode for a lithium secondary battery was obtained. The electrode area of this positive electrode for a lithium secondary battery was 1.65 cm 2 . Moreover, the mass of the obtained positive electrode for lithium secondary batteries was measured, and the density of the positive electrode mixture layer (positive electrode density) was calculated.
・リチウム二次電池(コイン型セル)の作製
以下の操作を、乾燥空気雰囲気のグローブボックス内で行った。
「リチウム二次電池用正極の作製」で作成した正極を、コイン型電池R2032用のコインセル(宝泉株式会社製)の下蓋にアルミ箔面を下に向けて置き、その上に積層フィルムセパレータ(ポリエチレン製多孔質フィルムの上に、耐熱多孔層を積層(厚み16μm))を置いた。ここに電解液を300μL注入した。用いた電解液は、エチレンカーボネートとジメチルカーボネートとエチルメチルカーボネートとの30:35:35(体積比)混合液に、LiPF6を1.0mol/Lとなるように溶解して調製した。
次に、負極として金属リチウムを用いて、前記負極を積層フィルムセパレータの上側に置き、ガスケットを介して上蓋をし、かしめ機でかしめてリチウム二次電池(コイン型電池R2032。以下、「コイン型電池」と称することがある。)を作製した。
- Production of lithium secondary battery (coin-shaped cell) The following operations were performed in a glove box in a dry air atmosphere.
Place the positive electrode prepared in "Preparation of positive electrode for lithium secondary battery" on the lower lid of coin cell (manufactured by Hosen Co., Ltd.) for coin battery R2032 with the aluminum foil side facing down, and then place the laminated film separator on top of it. (A heat-resistant porous layer was laminated (thickness: 16 µm) on a polyethylene porous film). 300 μL of electrolytic solution was injected here. The electrolytic solution used was prepared by dissolving LiPF 6 to 1.0 mol/L in a mixed solution of ethylene carbonate, dimethyl carbonate, and ethyl methyl carbonate at a volume ratio of 30:35:35.
Next, using metallic lithium as the negative electrode, the negative electrode is placed on the upper side of the laminated film separator, the top lid is placed through a gasket, and the lithium secondary battery (coin type battery R2032. (sometimes referred to as "battery").
・充放電試験[初期体積容量密度および50回サイクル体積容量密度維持率測定]
「リチウム二次電池(コイン型セル)の作製」で作製したコイン型電池を用い、以下に示す条件の50回サイクル試験にて、初期体積容量密度および50回サイクル体積容量密度維持率評価を実施し、50回後の体積容量密度維持率を以下の式にて算出した。なお、50回後の体積容量密度維持率が高いほど、電池としての寿命特性がよいことを示している。
初期体積容量密度(mAh/cc)=1回目の放電容量×正極密度
50回後の体積容量密度(mAh/cc)=50回目の放電容量×正極密度
50回後の体積容量密度維持率(%)=50回後の体積容量密度/初期体積容量密度×100
以下、50回後の体積容量密度維持率を『サイクル維持率』と記載することがある。
・Charging and discharging test [measurement of initial volume capacity density and 50 cycle volume capacity density retention rate]
Using the coin-shaped battery produced in "Production of lithium secondary battery (coin-shaped cell)", the initial volume capacity density and the 50-cycle volume capacity density retention rate were evaluated in a 50-cycle test under the conditions shown below. Then, the volume capacity density retention rate after 50 times was calculated by the following formula. It should be noted that the higher the volume capacity density retention ratio after 50 cycles, the better the life characteristics of the battery.
Initial volume capacity density (mAh/cc) = 1st discharge capacity x positive electrode density Volume capacity density after 50 times (mAh/cc) = 50th discharge capacity x positive electrode density Volume capacity density retention rate after 50 times (% ) = volumetric capacity density after 50 times/initial volumetric capacity density × 100
Hereinafter, the volume capacity density retention rate after 50 cycles may be referred to as "cycle retention rate".
[サイクル試験条件]
試験温度:25℃
充電時条件:充電時最大電圧4.3V、充電時間6.0時間、充電電流0.2CA充電後休止時間:10分
放電時条件:放電時最小電圧2.5V、放電時間6.0時間、放電電流0.2CA放電後休止時間:10分
本試験において、充電、充電休止、放電、放電休止を順に実施した工程を1回としている。
[Cycle test conditions]
Test temperature: 25°C
Charging conditions: maximum voltage during charging 4.3 V, charging time 6.0 hours, charging current 0.2 CA Pause time after charging: 10 minutes Discharging conditions: minimum voltage during discharging 2.5 V, discharging time 6.0 hours, Discharge current 0.2CA Post-discharge rest time: 10 minutes In this test, the step of sequentially performing charging, charging rest, discharging, and discharging rest was counted as one step.
≪初期体積容量密度の測定≫
初期体積容量密度は、以下の方法により測定した。
後述の方法により得られた正極活物質を用いてリチウム二次電池(コイン型セル)を作製した。正極は、後述の方法により得られた正極活物質と導電材(アセチレンブラック)とバインダー(PVdF)とを、リチウム二次電池用正極活物質:導電材:バインダー=92:5:3(質量比)の組成となるように加えて混練することにより、ペースト状の正極合剤を調製した。
≪Measurement of initial volume capacity density≫
The initial volume capacity density was measured by the following method.
A lithium secondary battery (coin-type cell) was produced using the positive electrode active material obtained by the method described below. For the positive electrode, a positive electrode active material, a conductive material (acetylene black), and a binder (PVdF) obtained by the method described later are combined into a positive electrode active material for a lithium secondary battery: conductive material: binder = 92: 5: 3 (mass ratio ) were added and kneaded to prepare a pasty positive electrode mixture.
≪実施例1≫
1.正極活物質A1の製造
攪拌器およびオーバーフローパイプを備えた反応槽内に水を入れた後、水酸化ナトリウム水溶液を添加し、液温を55℃に保持した。
<<Example 1>>
1. Production of Positive Electrode Active Material A1 After water was put into a reactor equipped with a stirrer and an overflow pipe, an aqueous sodium hydroxide solution was added and the liquid temperature was kept at 55°C.
硫酸ニッケル水溶液と硫酸コバルト水溶液と硫酸マンガン水溶液と硫酸アルミニウム水溶液とを、ニッケル原子とコバルト原子とマンガン原子とアルミニウム原子の原子比が0.90:0.07:0.02:0.01となるように混合して、混合原料液1を調製した。
An aqueous nickel sulfate solution, an aqueous cobalt sulfate solution, an aqueous manganese sulfate solution, and an aqueous aluminum sulfate solution were prepared so that the atomic ratio of nickel atoms, cobalt atoms, manganese atoms, and aluminum atoms was 0.90:0.07:0.02:0.01. Mixed
次に、反応槽内に、攪拌下、この混合原料溶液と硫酸アンモニウム水溶液を錯化剤として連続的に添加した。反応槽内の溶液のpHが12.4になるよう水酸化ナトリウム水溶液を適時滴下し、ニッケルコバルトマンガンアルミニウム複合水酸化物粒子を得て、洗浄した後、遠心分離機で脱水し、洗浄、脱水、単離して105℃で乾燥することにより、ニッケルコバルトマンガンアルミニウム複合水酸化物1を得た。
Next, this mixed raw material solution and an aqueous solution of ammonium sulfate were continuously added as a complexing agent into the reactor with stirring. An aqueous sodium hydroxide solution is added dropwise so that the pH of the solution in the reaction tank becomes 12.4 to obtain nickel-cobalt-manganese-aluminum composite hydroxide particles. , was isolated and dried at 105°C to obtain nickel-cobalt-manganese-
ニッケルコバルトマンガンアルミニウム複合水酸化物粒子1と水酸化リチウム一水和物粉末と硫酸カリウム粉末を、Li/(Ni+Co+Mn+Al)=1.10、K2SO4/(LiOH+K2SO4)=0.1(mol/mol)となるように秤量して混合した後、酸素雰囲気下840℃で10時間焼成して、リチウム金属複合酸化物粉末を得た。上記粉末と液温を5℃に調整した純水とを、全体量に対して上記粉末質量の割合が0.3になるように混合し作製したスラリーを20分間撹拌させた後、脱水し、さらに上記粉末の2倍の質量の液温を5℃に調整した純水でリンス後、単離し、150℃で乾燥することで正極活物質A1を得た。
Nickel-cobalt-manganese-aluminum
2.正極活物質B1の製造
攪拌器およびオーバーフローパイプを備えた反応槽内に水を入れた後、水酸化ナトリウム水溶液を添加し、液温を50℃に保持した。
2. Production of Positive Electrode Active Material B1 After water was put into a reactor equipped with a stirrer and an overflow pipe, an aqueous sodium hydroxide solution was added and the liquid temperature was kept at 50°C.
次に、反応槽内に、攪拌下、この混合原料溶液1と硫酸アンモニウム水溶液を錯化剤として連続的に添加した。反応槽内の溶液のpHが11.9になるよう水酸化ナトリウム水溶液を適時滴下し、ニッケルコバルトマンガンアルミニウム複合水酸化物粒子を得て、洗浄した後、遠心分離機で脱水し、洗浄、脱水、単離して105℃で乾燥することにより、ニッケルコバルトマンガンアルミニウム複合水酸化物2を得た。
Next, this mixed
ニッケルコバルトマンガンアルミニウム複合水酸化物粒子2と水酸化リチウム一水和物粉末とを、Li/(Ni+Co+Mn+Al)=1.03となるように秤量して混合した後、酸素雰囲気下760℃で10時間焼成し、正極活物質B1を得た。
Nickel-cobalt-manganese-aluminum
3.正極活物質C1の製造
正極活物質A1と正極活物質B1とを質量比で20:80となるように秤量し、混合して正極活物質C1を得た。
3. Production of Positive Electrode Active Material C1 The positive electrode active material A1 and the positive electrode active material B1 were weighed and mixed in a mass ratio of 20:80 to obtain a positive electrode active material C1.
4.正極活物質C1の評価
正極活物質C1の分析結果、体積容量密度および50回サイクル体積容量密度維持率の測定結果を表2に示す。
4. Evaluation of Positive Electrode Active Material C1 Table 2 shows the analysis results of the positive electrode active material C1, and the measurement results of the volume capacity density and the 50-cycle volume capacity density retention rate.
≪実施例2≫
1.正極活物質A2の製造
攪拌器およびオーバーフローパイプを備えた反応槽内に水を入れた後、水酸化ナトリウム水溶液を添加し、液温を55℃に保持した。
<<Example 2>>
1. Production of Positive Electrode Active Material A2 After water was put into a reactor equipped with a stirrer and an overflow pipe, an aqueous sodium hydroxide solution was added and the liquid temperature was kept at 55°C.
硫酸ニッケル水溶液と硫酸コバルト水溶液と硫酸マンガン水溶液とを、ニッケル原子とコバルト原子とマンガン原子の原子比が0.88:0.08:0.04となるように混合して、混合原料液2を調製した。
A nickel sulfate aqueous solution, a cobalt sulfate aqueous solution, and a manganese sulfate aqueous solution are mixed so that the atomic ratio of nickel atoms, cobalt atoms, and manganese atoms is 0.88:0.08:0.04, and a mixed
次に、反応槽内に、攪拌下、この混合原料溶液アンモニウム水溶液を錯化剤として連続的に添加した。反応槽内の溶液のpHが11.8になるよう水酸化ナトリウム水溶液を適時滴下し、ニッケルコバルトマンガンアルミニウム複合水酸化物粒子を得て、洗浄した後、遠心分離機で脱水し、洗浄、脱水、単離して105℃で乾燥することにより、ニッケルコバルトマンガン複合水酸化物1を得た。
Next, this mixed raw material solution ammonium aqueous solution was continuously added as a complexing agent into the reaction tank while stirring. An aqueous solution of sodium hydroxide is added dropwise at appropriate times so that the pH of the solution in the reaction tank becomes 11.8 to obtain nickel-cobalt-manganese-aluminum composite hydroxide particles. , was isolated and dried at 105° C. to obtain nickel-cobalt-
ニッケルコバルトマンガン複合水酸化物粒子1と水酸化リチウム一水和物粉末と硫酸カリウム粉末を、Li/(Ni+Co+Mn)=1.10、K2SO4/(LiOH+K2SO4)=0.1(mol/mol)となるように秤量して混合した後、酸素雰囲気下840℃で10時間焼成して、リチウム金属複合酸化物粉末を得た。上記粉末と液温を5℃に調整した純水とを、全体量に対して上記粉末質量の割合が0.3になるように混合し作製したスラリーを20分間撹拌させた後、脱水し、さらに上記粉末の2倍の質量の液温を5℃に調整した純水でリンス後、単離し、150℃で乾燥することで正極活物質A2を得た。
Nickel-cobalt-manganese
2.正極活物質B2の製造
攪拌器およびオーバーフローパイプを備えた反応槽内に水を入れた後、水酸化ナトリウム水溶液を添加し、液温を45℃に保持した。
2. Production of Positive Electrode Active Material B2 After water was put into a reactor equipped with a stirrer and an overflow pipe, an aqueous sodium hydroxide solution was added and the liquid temperature was maintained at 45°C.
次に、反応槽内に、攪拌下、この混合原料溶液2と硫酸アンモニウム水溶液を錯化剤として連続的に添加した。反応槽内の溶液のpHが11.5になるよう水酸化ナトリウム水溶液を適時滴下し、ニッケルコバルトマンガンアルミニウム複合水酸化物粒子を得て、洗浄した後、遠心分離機で脱水し、洗浄、脱水、単離して105℃で乾燥することにより、ニッケルコバルトマンガン複合水酸化物2を得た。
Next, this mixed
ニッケルコバルトマンガン複合水酸化物粒子2と水酸化リチウム一水和物粉末とを、Li/(Ni+Co+Mn)=1.03となるように秤量して混合した後、酸素雰囲気下790℃で10時間焼成し、正極活物質B2を得た。
Nickel-cobalt-manganese
3.正極活物質C2の製造
正極活物質A2と正極活物質B2とを質量比で20:80となるように秤量し、混合して正極活物質C2を得た。
3. Production of Positive Electrode Active Material C2 The positive electrode active material A2 and the positive electrode active material B2 were weighed and mixed so as to have a mass ratio of 20:80 to obtain a positive electrode active material C2.
4.正極活物質C2の評価
正極活物質C2の分析結果、体積容量密度および50回サイクル体積容量密度維持率の測定結果を表2に示す。
4. Evaluation of Positive Electrode Active Material C2 Table 2 shows the analysis results of the positive electrode active material C2, and the measurement results of the volume capacity density and the 50-cycle volume capacity density retention rate.
≪実施例3≫
1.正極活物質A3の製造
ニッケルコバルトマンガン複合水酸化物粒子1と水酸化リチウム一水和物粉末と硫酸カリウム粉末を、Li/(Ni+Co+Mn)=1.15、K2SO4/(LiOH+K2SO4)=0.1(mol/mol)となるように秤量して混合した後、酸素雰囲気下840℃で10時間焼成して、リチウム金属複合酸化物粉末を得た。上記粉末と液温を5℃に調整した純水とを、全体量に対して上記粉末質量の割合が0.3になるように混合し作製したスラリーを20分間撹拌させた後、脱水し、さらに上記粉末の2倍の質量の液温を5℃に調整した純水でリンス後、単離し、150℃で乾燥することで正極活物質A3を得た。
<<Example 3>>
1. Production of positive electrode active material A3 Nickel-cobalt-manganese
3.正極活物質C3の製造
正極活物質A3と正極活物質B2とを質量比で25:75となるように秤量し、混合して正極活物質C3を得た。
3. Production of Positive Electrode Active Material C3 The positive electrode active material A3 and the positive electrode active material B2 were weighed and mixed at a mass ratio of 25:75 to obtain a positive electrode active material C3.
4.正極活物質C3の評価
正極活物質C3の分析結果、体積容量密度および50回サイクル体積容量密度維持率の測定結果を表2に示す。
4. Evaluation of Positive Electrode Active Material C3 Table 2 shows the analysis results of the positive electrode active material C3, and the measurement results of the volume capacity density and the 50-cycle volume capacity density retention rate.
≪比較例1≫
1.正極活物質B3の製造
攪拌器およびオーバーフローパイプを備えた反応槽内に水を入れた後、水酸化ナトリウム水溶液を添加し、液温を50℃に保持した。
<<Comparative Example 1>>
1. Production of Positive Electrode Active Material B3 After water was put into a reactor equipped with a stirrer and an overflow pipe, an aqueous sodium hydroxide solution was added and the liquid temperature was maintained at 50°C.
次に、反応槽内に、攪拌下、この混合原料溶液2と硫酸アンモニウム水溶液を錯化剤として連続的に添加した。反応槽内の溶液のpHが12.5になるよう水酸化ナトリウム水溶液を適時滴下し、ニッケルコバルトマンガンアルミニウム複合水酸化物粒子を得て、洗浄した後、遠心分離機で脱水し、洗浄、脱水、単離して105℃で乾燥することにより、ニッケルコバルトマンガン複合水酸化物3を得た。
Next, this mixed
ニッケルコバルトマンガン複合水酸化物粒子3と水酸化リチウム一水和物粉末とを、Li/(Ni+Co+Mn)=1.05となるように秤量して混合した後、酸素雰囲気下760℃で10時間焼成し、正極活物質B3を得た。
Nickel-cobalt-manganese
2.正極活物質B3の評価
正極活物質B3の分析結果、体積容量密度および50回サイクル体積容量密度維持率の測定結果を表2に示す。
2. Evaluation of Positive Electrode Active Material B3 Table 2 shows the analysis results of the positive electrode active material B3, and the measurement results of the volume capacity density and the 50-cycle volume capacity density retention rate.
≪比較例2≫
1.正極活物質C4の製造
正極活物質B2と正極活物質B3とを質量比で80:20となるように秤量し、混合して正極活物質C4を得た。
2.正極活物質C4の評価
正極活物質C4の分析結果、体積容量密度および50回サイクル体積容量密度維持率の測定結果を表2に示す。
<<Comparative Example 2>>
1. Manufacture of Positive Electrode Active Material C4 The positive electrode active material B2 and the positive electrode active material B3 were weighed and mixed so as to have a mass ratio of 80:20 to obtain a positive electrode active material C4.
2. Evaluation of Positive Electrode Active Material C4 Table 2 shows the analysis results of the positive electrode active material C4, and the measurement results of the volume capacity density and the 50-cycle volume capacity density retention rate.
≪比較例3≫
1.正極活物質B2の評価
正極活物質B2の分析結果、体積容量密度および50回サイクル体積容量密度維持率の測定結果を表1に示す。
<<Comparative Example 3>>
1. Evaluation of Positive Electrode Active Material B2 Table 1 shows the analysis results of the positive electrode active material B2, and the measurement results of the volume capacity density and the 50-cycle volume capacity density retention rate.
≪比較例4≫
1.正極活物質A3の評価
正極活物質A3の分析結果、体積容量密度および50回サイクル体積容量密度維持率の測定結果を表2に示す。
<<Comparative Example 4>>
1. Evaluation of Positive Electrode Active Material A3 Table 2 shows the analysis results of the positive electrode active material A3, and the measurement results of the volume capacity density and the 50-cycle volume capacity density retention rate.
表1に、組成、BET比表面積、D50、円形度分布ピーク数、平均円形度をまとめて記載する。
表2に、第1のピーク円形度、第2のピーク円形度、円形度分布標準偏差、第1のピーク由来の粒子、第2のピーク由来の粒子、単粒子平均粒子径、電極密度、初期体積容量密度、50回サイクル体積容量密度維持率をまとめて記載する。
Table 1 summarizes the composition, BET specific surface area, D 50 , number of circularity distribution peaks, and average circularity.
Table 2 shows the first peak circularity, second peak circularity, circularity distribution standard deviation, particles derived from the first peak, particles derived from the second peak, single particle average particle size, electrode density, initial The volumetric capacity density and the 50-cycle volumetric capacity density retention ratio are described together.
上記結果に示した通り、本発明を適用した実施例1~3の正極活物質は、体積容量密度および50回サイクル体積容量密度維持率が高いことが確認できた。 As shown in the above results, it was confirmed that the positive electrode active materials of Examples 1 to 3 to which the present invention was applied had high volumetric capacity densities and high 50-cycle volumetric capacity density retention rates.
1…セパレータ、2…正極、3…負極、4…電極群、5…電池缶、6…電解液、7…トップインシュレーター、8…封口体、10…リチウム二次電池、21…正極リード、31…負極リード
DESCRIPTION OF
Claims (7)
第2のリチウム金属複合酸化物粉末を得る工程2と、
前記第1のリチウム金属複合酸化物粉末と前記第2のリチウム金属複合酸化物粉末とを、混合比(質量比)が1~60/99~40となるように混合する工程と、を備え、下記組成式(1)で表されるリチウム金属複合酸化物粉末の製造方法であって、
前記工程1は、
第1の金属複合化合物を得る工程と、得られた第1の金属複合化合物とリチウム化合物と不活性溶融剤とを混合し、200℃以上1150℃以下の保持温度Aで焼成する工程を有し、
前記第1の金属複合化合物を得る工程は、少なくともニッケルを含む金属塩の水溶液とアルカリ金属水酸化物と錯化剤とを、第1の共沈槽へ供給する工程と、第1の共沈槽の温度を30℃以上80℃以下に調整し、前記第1の共沈槽内のpH値を10以上13以下に調整する工程を含み、
前記工程2は、
第2の金属複合化合物を得る工程と、得られた第2の金属複合化合物とリチウム化合物とを混合し、200℃以上1150℃以下の保持温度Bで焼成する工程を有し、
前記第2の金属複合化合物を得る工程は、少なくともニッケルを含む金属塩の水溶液とアルカリ金属水酸化物と錯化剤とを、第2の共沈槽へ供給する工程と、第2の共沈槽の温度を30℃以上80℃以下に調整し、前記第2の共沈槽内のpH値を10以上13以下に調整する工程を含み、
前記第1の共沈槽のpHは、前記第2の共沈槽のpHよりも高く、
前記保持温度Aは、前記保持温度Bよりも30℃以上高いことを特徴とする、リチウム金属複合酸化物粉末の製造方法。
Li[Li x (Ni (1-y-z-w) Co y Mn z M w ) 1-x ]O 2 (1)
(ただし、MはFe、Cu、Ti、Mg、Al、W、B、Mo、Nb、Zn、Sn、Zr、Ga及びVからなる群より選択される1種以上の元素であり、-0.1≦x≦0.2、0<y≦0.4、0≦z≦0.4、0≦w≦0.1を満たす。) Step 1 of obtaining a first lithium metal composite oxide powder;
Step 2 of obtaining a second lithium metal composite oxide powder;
mixing the first lithium metal composite oxide powder and the second lithium metal composite oxide powder so that the mixing ratio (mass ratio) is 1 to 60/99 to 40; A method for producing a lithium metal composite oxide powder represented by the following compositional formula (1) ,
The step 1 is
A step of obtaining a first metal composite compound, and a step of mixing the obtained first metal composite compound, a lithium compound, and an inert melting agent , and firing at a holding temperature A of 200° C. or higher and 1150° C. or lower. ,
The step of obtaining the first metal complex compound includes the step of supplying an aqueous solution of a metal salt containing at least nickel, an alkali metal hydroxide, and a complexing agent to a first coprecipitation tank; Adjusting the temperature of the tank to 30 ° C. or higher and 80 ° C. or lower, and adjusting the pH value in the first coprecipitation tank to 10 or higher and 13 or lower,
The step 2 is
A step of obtaining a second metal composite compound, a step of mixing the obtained second metal composite compound and a lithium compound, and firing at a holding temperature B of 200 ° C. or higher and 1150 ° C. or lower,
The step of obtaining the second metal complex compound includes the step of supplying an aqueous solution of a metal salt containing at least nickel, an alkali metal hydroxide, and a complexing agent to a second coprecipitation tank; Adjusting the temperature of the tank to 30 ° C. or higher and 80 ° C. or lower and adjusting the pH value in the second coprecipitation tank to 10 or higher and 13 or lower,
The pH of the first co-precipitation tank is higher than the pH of the second co-precipitation tank,
A method for producing a lithium metal composite oxide powder, wherein the holding temperature A is higher than the holding temperature B by 30° C. or more.
Li[Li x (Ni (1-yzw) Co y Mn z M w ) 1-x ]O 2 (1)
(where M is one or more elements selected from the group consisting of Fe, Cu, Ti, Mg, Al, W, B, Mo, Nb, Zn, Sn, Zr, Ga and V; -0. satisfy 1≦x≦0.2, 0<y≦0.4, 0≦z≦0.4, and 0≦w≦0.1.)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2019184759A JP7222866B2 (en) | 2019-10-07 | 2019-10-07 | Lithium metal composite oxide powder, positive electrode active material for lithium secondary battery, positive electrode, and lithium secondary battery |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2019184759A JP7222866B2 (en) | 2019-10-07 | 2019-10-07 | Lithium metal composite oxide powder, positive electrode active material for lithium secondary battery, positive electrode, and lithium secondary battery |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018225443A Division JP6600734B1 (en) | 2018-11-30 | 2018-11-30 | Lithium metal composite oxide powder, positive electrode active material for lithium secondary battery, positive electrode, and lithium secondary battery |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2020083750A JP2020083750A (en) | 2020-06-04 |
| JP2020083750A5 JP2020083750A5 (en) | 2022-01-06 |
| JP7222866B2 true JP7222866B2 (en) | 2023-02-15 |
Family
ID=70906351
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019184759A Active JP7222866B2 (en) | 2019-10-07 | 2019-10-07 | Lithium metal composite oxide powder, positive electrode active material for lithium secondary battery, positive electrode, and lithium secondary battery |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP7222866B2 (en) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN117457880B (en) * | 2023-11-29 | 2024-08-02 | 贝特瑞新材料集团股份有限公司 | Negative electrode material and battery |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016006557A1 (en) | 2014-07-07 | 2016-01-14 | 日立金属株式会社 | Lithium ion secondary battery positive electrode material, lithium ion secondary battery positive electrode and lithium ion secondary battery that use same, and method for manufacturing lithium ion secondary battery positive electrode material |
| WO2016129361A1 (en) | 2015-02-12 | 2016-08-18 | Jx金属株式会社 | Positive-electrode active material for lithium-ion cell, positive electrode for lithium-ion cell, lithium-ion cell, and method for manufacturing positive-electrode active material for lithium-ion cell |
| JP2018063920A (en) | 2016-10-14 | 2018-04-19 | 日産自動車株式会社 | Negative electrode for nonaqueous electrolyte secondary battery, and nonaqueous electrolyte secondary battery arranged by use thereof |
-
2019
- 2019-10-07 JP JP2019184759A patent/JP7222866B2/en active Active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016006557A1 (en) | 2014-07-07 | 2016-01-14 | 日立金属株式会社 | Lithium ion secondary battery positive electrode material, lithium ion secondary battery positive electrode and lithium ion secondary battery that use same, and method for manufacturing lithium ion secondary battery positive electrode material |
| WO2016129361A1 (en) | 2015-02-12 | 2016-08-18 | Jx金属株式会社 | Positive-electrode active material for lithium-ion cell, positive electrode for lithium-ion cell, lithium-ion cell, and method for manufacturing positive-electrode active material for lithium-ion cell |
| JP2018063920A (en) | 2016-10-14 | 2018-04-19 | 日産自動車株式会社 | Negative electrode for nonaqueous electrolyte secondary battery, and nonaqueous electrolyte secondary battery arranged by use thereof |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2020083750A (en) | 2020-06-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6600734B1 (en) | Lithium metal composite oxide powder, positive electrode active material for lithium secondary battery, positive electrode, and lithium secondary battery | |
| JP6630863B1 (en) | Lithium metal composite oxide powder, positive electrode active material for lithium secondary batteries | |
| JP6962838B2 (en) | Lithium metal composite oxide powder, positive electrode active material for lithium secondary battery, positive electrode, and lithium secondary battery | |
| JP6726102B2 (en) | Positive electrode active material for lithium secondary battery, positive electrode for lithium secondary battery, and lithium secondary battery | |
| JP6836369B2 (en) | Method for manufacturing positive electrode active material precursor for lithium secondary battery and positive electrode active material for lithium secondary battery | |
| JP6871888B2 (en) | Positive electrode active material for lithium secondary battery, positive electrode for lithium secondary battery and lithium secondary battery | |
| JP6542421B1 (en) | Lithium metal composite oxide powder, positive electrode active material for lithium secondary battery, positive electrode for lithium secondary battery, and lithium secondary battery | |
| JP2019096406A (en) | Positive electrode active material for lithium secondary battery, positive electrode for lithium secondary battery, and lithium secondary battery | |
| CN111837268B (en) | Lithium metal composite oxide powder, positive electrode active material for lithium secondary battery, positive electrode and lithium secondary battery | |
| JP6994990B2 (en) | Lithium metal composite oxide powder, positive electrode active material for lithium secondary batteries, positive electrodes and lithium secondary batteries | |
| JP6630865B1 (en) | Lithium composite metal oxide powder and positive electrode active material for lithium secondary batteries | |
| WO2020130123A1 (en) | Lithium metal complex oxide powder, positive electrode active material for lithium secondary batteries, positive electrode for lithium secondary batteries, and lithium secondary battery | |
| JP6803451B1 (en) | Lithium metal composite oxide, positive electrode active material for lithium secondary battery, positive electrode for lithium secondary battery and lithium secondary battery | |
| JP6659894B1 (en) | Lithium metal composite oxide powder, positive electrode active material for lithium secondary battery, and method for producing lithium metal composite oxide powder | |
| JP2021177460A (en) | Lithium metal composite oxide, positive electrode active material for lithium secondary battery, positive electrode for lithium secondary battery, and lithium secondary battery | |
| JP2020011892A (en) | Lithium metal composite oxide powder, positive electrode active substance for lithium secondary battery, positive electrode, and lithium secondary battery | |
| JP7222866B2 (en) | Lithium metal composite oxide powder, positive electrode active material for lithium secondary battery, positive electrode, and lithium secondary battery | |
| JP6843732B2 (en) | Lithium metal composite oxide powder, positive electrode active material for lithium secondary battery, positive electrode for lithium secondary battery and lithium secondary battery | |
| JP7235650B2 (en) | Lithium transition metal composite oxide powder, nickel-containing transition metal composite hydroxide powder, positive electrode active material for lithium secondary battery, positive electrode for lithium secondary battery and lithium secondary battery | |
| JP7049284B2 (en) | Positive electrode active material for lithium secondary battery, positive electrode for lithium secondary battery and lithium secondary battery | |
| JP7227894B2 (en) | Lithium metal composite oxide, positive electrode active material for lithium secondary battery, positive electrode for lithium secondary battery and lithium secondary battery | |
| JP2019172573A (en) | Lithium metal composite oxide powder, cathode active material for lithium secondary battery, cathode for lithium secondary battery, and lithium secondary battery |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211122 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20211122 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220913 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20221031 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20230131 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20230203 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7222866 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |