JP4765402B2 - Method for producing poly (A) RNA by applying electric field - Google Patents
Method for producing poly (A) RNA by applying electric field Download PDFInfo
- Publication number
- JP4765402B2 JP4765402B2 JP2005149325A JP2005149325A JP4765402B2 JP 4765402 B2 JP4765402 B2 JP 4765402B2 JP 2005149325 A JP2005149325 A JP 2005149325A JP 2005149325 A JP2005149325 A JP 2005149325A JP 4765402 B2 JP4765402 B2 JP 4765402B2
- Authority
- JP
- Japan
- Prior art keywords
- poly
- rna
- electric field
- chain
- reaction
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Description
本発明は、ポリ(A)RNA作製に係る技術に関する。より詳しくは、ポリアデニン分子に電気力学的作用を与えることによって、ポリ(A)RNAを作製する技術に関する。 The present invention relates to a technique relating to the poly (A) RN A work made. More specifically, the present invention relates to a technique for producing poly (A) RNA by giving an electrodynamic action to a polyadenine molecule.
近年、遺伝子工学の発展により種々の生物の遺伝子配列が解明されつつある。例えば、ヒトに存在する遺伝子数は10万を越えるであろうといわれている。しかしながら、ゲノムDNA全てが生命現象を担っているわけではなく、生命現象の主たる担い手タンパク質のアミノ酸配列情報を含む領域である。言い換えればタンパク質の合成の前にまずRNAに転写されるが、この際その間に挟まれたアミノ酸配列情報を含まない領域(イントロン)も合わせて転写され、スプライシングと呼ばれる過程でこの領域が切除され、アミノ酸配列情報を含む領域が残ったメッセンジャーRNA(mRNA)が生成する。 In recent years, gene sequences of various organisms are being elucidated by the development of genetic engineering. For example, it is said that the number of genes present in humans will exceed 100,000. However, not all genomic DNAs carry a life phenomenon, but a region containing amino acid sequence information of the protein responsible for the life phenomenon. In other words, it is first transcribed into RNA before protein synthesis. At this time, a region (intron) sandwiched between them is also transcribed, and this region is excised in a process called splicing, Messenger RNA (mRNA) is generated in which a region containing amino acid sequence information remains.
また、真核生物などのmRNAにおいては、転写に続いてポリ(A)ポリメラーゼにより、その3’末端に100〜200bp程度のポリ(A)鎖(poly(A)tail)と呼ばれるAMP残基の連続体が付加されるポリアデニル化(polyadenylation)が行われ、ポリ(A)RNAが生成する。ポリ(A)鎖の機能は未だわかっていないが、mRNAを分解するような酵素群から保護し、mRNAの安定性を高めていると考えられている。 Moreover, in mRNAs such as eukaryotes, an AMP residue called poly (A) tail of about 100 to 200 bp is formed at the 3 ′ end by poly (A) polymerase following transcription. Polyadenylation to which a continuum is added is performed to produce poly (A) RNA. Although the function of the poly (A) chain is not yet known, it is thought that it protects from a group of enzymes that degrade mRNA and enhances the stability of mRNA.
遺伝子の機能解析においては、生物の各組織内でいかなる遺伝子が発現されているかを知ることは極めて重要である。ポリ(A)RNAの解析において、しばしばtRNA、rRNA、mRNA(ポリA+RNA)等の混合物であるTotal RNAを用いて行われる。しかし、このTotal RNAに占めるポリ(A)RNAは5%以下であり、特にコピー数の少ないポリ(A)RNAの解析は困難である。そのため、生体材料から効率的にポリ(A)RNAを単離することは、これらの解析において非常に有意義である。 In gene function analysis, it is extremely important to know what gene is expressed in each tissue of an organism. In the analysis of poly (A) RNA, it is often performed using Total RNA which is a mixture of tRNA, rRNA, mRNA (poly A + RNA) and the like. However, poly (A) RNA occupies 5% or less of the total RNA, and analysis of poly (A) RNA having a small copy number is particularly difficult. Therefore, isolating poly (A) RNA efficiently from biomaterials is very significant in these analyses.
現在、ポリ(A)RNAの精製やcDNA(相補的DNA)の作製にポリ(A)構造が利用されている。例えば、ポリ(A)と相補的に結合するdT鎖を担体に結合したカラムに細胞から抽出したTotal RNAを流すと、ポリ(A)構造を持たないtRNA、rRNAは通り抜け、タンパク質に翻訳されるmRNAだけが捕捉され、次いで、低塩濃度溶液でmRNAを溶出させて精製する(例えば、特許文献1参照)。また、mRNAを鋳型に逆転写酵素でcDNAを合成する際にも、dT鎖のプライマーをmRNAに付着し部分的に二重鎖にして、逆転写酵素によるDNA合成反応を開始することが行われている。
従来のポリ(A)RNAの精製技術においては、dT鎖に対するポリ(A)RNAの捕捉効率や精度に改良の余地があった。より具体的には、担体に固定等されたdT鎖に対して、回収目的とするポリ(A)RNA以外にも他の不要分子が非特異的に吸着するという問題が発生するため、ポリ(A)RNAの回収効率や純度が悪かった。 Conventional poly (A) RNA purification techniques have room for improvement in the capture efficiency and accuracy of poly (A) RNA for dT strands. More specifically, since a problem arises in that other unwanted molecules adsorb non-specifically to the dT chain immobilized on the carrier in addition to the poly (A) RNA to be recovered. A) RNA recovery efficiency and purity were poor.
そこで、本発明は、ポリアデニン分子に対する電界印加の効果に基づき、細胞等の核酸を含有する試料から、効率的に高純度のポリ(A)RNAを作製する方法を提供することを主な目的とする。 The present invention is based on the effect of the electric field application to the polyadenine molecules, primary purpose of the sample containing nucleic acids, such as cells, to provide a method of making an efficient high purity Po Li (A) RNA of And
核酸分子は、骨格をなすリン酸イオン(陰電荷)とその周辺にある水がイオン化した水素原子(陽電荷)とによってイオン曇を作っていると考えられ、これらの陰電荷及び陽電荷によって分極ベクトル(双極子:dipole)が生じる。この分極ベクトルは電界によりその方向が変化し、また、分子配向も変化する。 Nucleic acid molecules are thought to be ion clouded by phosphate ions (negative charges) that form the skeleton and hydrogen atoms (positive charges) formed by ionizing water around them, and are polarized by these negative and positive charges. A vector (dipole) is generated. The direction of the polarization vector is changed by an electric field, and the molecular orientation is also changed.
本願発明者らは、鋭意研究を行った結果、電界印加によって、他の核酸分子に比べて、アデニン分子が急激に双極子モーメント(dipole moment)と配向(transformation)が変化することを突き止め、この電界印加による電気力学的作用によって、dT鎖に対してRNAのポリ(A)鎖部分が高効率で相補結合し、また、ポリ(A)RNAが効率良く生成することを明らかにした。 As a result of intensive studies, the present inventors have found that the dipole moment and transformation of adenine molecules change abruptly by applying an electric field compared to other nucleic acid molecules. It has been clarified that the poly (A) chain portion of RNA is efficiently complementary-bonded to the dT chain by electrodynamic action by applying an electric field, and that poly (A) RNA is efficiently generated.
本発明では、反応場に電界を印加してポリアデニン分子の双極子モーメントの配向を変化させることによって、RNAの3'末端部位に対するポリA鎖の付加及び/又は伸長を促進させてポリ(A)RNAを作製する方法を提供する。 In the present invention, an electric field is applied to the reaction field to change the orientation of the dipole moment of the polyadenine molecule, thereby facilitating the addition and / or extension of the poly A strand to the 3 ′ end site of RNA to thereby poly (A). Methods for making RNA are provided.
本発明によれば、ポリアデニン分子を標的として電界印加を行って、ポリアデニン分子の双極子モーメントとその配向を急激に変化させることができる。この電気力学的効果によって、dT鎖とポリ(A)RNAのポリ(A)鎖との間の相補鎖結合効率を向上させたり、あるいは、dT鎖とポリ(A)鎖の相補結合の解離を促進させたりすることができる。 According to the present invention, an electric field can be applied to a polyadenine molecule as a target to rapidly change the dipole moment and the orientation of the polyadenine molecule. This electrodynamic effect improves the complementary strand binding efficiency between the dT strand and the poly (A) strand of the poly (A) RNA, or dissociates the complementary bond between the dT strand and the poly (A) strand. It can be promoted.
また、電界印加によって、dT鎖に対するミスマッチ結合の解離をA−Tフルマッチの解離よりも相対的に増やすことによって、相補結合中のA−Tフルマッチの割合を増加させることができる。このため、dT鎖に対してポリ(A)RNAのポリ(A)鎖部位を相補結合させるアッセイの精度を高めることができ、ひいては、回収されたポリ(A)RNAの純度を向上させることができる。 Moreover, the ratio of the AT full match in the complementary bond can be increased by increasing the dissociation of the mismatch bond to the dT chain relative to the dissociation of the AT full match by applying an electric field. For this reason, it is possible to increase the accuracy of the assay in which the poly (A) chain portion of the poly (A) RNA is complementarily bound to the dT chain, and thus improve the purity of the recovered poly (A) RNA. it can.
さらに、前記電気力学的効果によって、RNAの3'末端部位に対するポリA鎖の付加や伸長を促進させて、ポリ(A)RNAの人為的な作製を効率よく行うことができる。 Furthermore, artificial addition of poly (A) RNA can be efficiently carried out by promoting the addition and extension of poly A chain to the 3 ′ terminal site of RNA by the electrodynamic effect.
以下、本発明を実施するための好適な形態について、添付図面を参照しながら説明する。なお、添付図面に示された各実施形態は、本発明に係わる物や方法の代表的な実施形態の一例を示したものであり、これにより本発明の範囲が狭く解釈されることはない。 DESCRIPTION OF EXEMPLARY EMBODIMENTS Hereinafter, preferred embodiments for carrying out the invention will be described with reference to the accompanying drawings. Each embodiment shown in the attached drawings shows an example of a typical embodiment of the thing and method concerning the present invention, and, thereby, the scope of the present invention is not interpreted narrowly.
まず、図1は、本発明に係るポリ(A)RNA精製方法の工程手順の一例を示す図である。 First, FIG. 1 is a figure which shows an example of the process sequence of the poly (A) RNA purification method which concerns on this invention.
符号Rで示す反応場としては、例えば、カラム内に形成された反応場や基板上に形成された反応場を利用できる。このような反応場Rにおいて、担体(例えば、ビーズ)や基板の表面SにdT鎖(符号1)の一端を、例えば、カップリング反応やビオチン‐アビジン結合等を用いて固定しておく。 As the reaction field indicated by the symbol R, for example, a reaction field formed in a column or a reaction field formed on a substrate can be used. In such a reaction field R, one end of the dT chain (symbol 1) is fixed to the surface (S) of the carrier (for example, beads) or the substrate, for example, using a coupling reaction or a biotin-avidin bond.
このようなdT鎖(符号1)が固定されている環境の反応場Rに対して、細胞等から抽出されたTotalRNAを含有する試料を添加又は送液等して送り込む。図1中の(I)には、ポリ(A)鎖を有するRNA、即ちポリ(A)RNA(符号2)とポリ(A)鎖を持たないRNA(符号3)が反応場Rに混在している様子が模式的に示されている。 A sample containing Total RNA extracted from a cell or the like is added or sent to the reaction field R in the environment where the dT chain (symbol 1) is fixed. In (I) in FIG. 1, RNA having a poly (A) chain, that is, poly (A) RNA (symbol 2) and RNA having no poly (A) chain (symbol 3) are mixed in the reaction field R. This is shown schematically.
なお、ポリ(A)RNA含有する試料は、特に限定されないが、例えば、血清、血液、髄液、組織、尿、糞便、唾液、精液等の生体材料から分離した細胞及び培養細胞などの生体試料を挙げることができる。 The sample containing poly (A) RNA is not particularly limited. For example, biological samples such as cells and cultured cells separated from biological materials such as serum, blood, spinal fluid, tissue, urine, feces, saliva, semen, etc. Can be mentioned.
続いて、このような物質環境の反応場Rに対して、電界Eを印加することによって、ポリ(A)RNA2において、特にそのポリ(A)鎖部位21の双極子モーメントに対して、選択的に影響を与える。
Subsequently, by applying an electric field E to the reaction field R in such a material environment, the poly (A)
図2は、電界Eを印加することによって、ポリ(A)RNA2のポリ(A)鎖部位21の双極子モーメントの向きが急激に変化して配向が変化することによって、ランダムコイル形状などを形成して絡み合っているポリA鎖部位が反応場Rに露出し、表面Sに固定されているdT鎖(符号1)に引き寄せられている様子が模式的に示されている。
FIG. 2 shows that a random coil shape or the like is formed by applying an electric field E to abruptly change the orientation of the dipole moment of the poly (A)
図3は、さらに、図2の段階から進行し、ポリ(A)RNA2のポリ(A)鎖部位21と表面Sに固定されているdT鎖(符号1)とが相補結合することにより、相補鎖を形成している様子が模式的に示されている。
FIG. 3 further proceeds from the stage of FIG. 2, and complementation is achieved by the complementary binding between the poly (A)
このような電界印加による相補鎖形成工程に続いて、洗浄工程へ移行する。図1中の(III)は、この洗浄工程の概念を模式的に簡潔に示している。この洗浄工程では、反応場Rに対して所定の洗浄用のバッファー溶液(相補鎖に影響を与えないもの)を送り込み、反応場Rに遊離状態で存在しているポリ(A)鎖を持たないRNA3を、該反応場Rから除去する。 Subsequent to the complementary strand forming step by applying an electric field, the process proceeds to a cleaning step. (III) in FIG. 1 schematically shows the concept of this cleaning step in a concise manner. In this washing step, a predetermined washing buffer solution (that does not affect the complementary strand) is sent to the reaction field R, and the reaction field R does not have a poly (A) chain present in a free state. RNA3 is removed from the reaction field R.
この洗浄工程が完了したら、続いて解離工程に移行する。図1中の(VI)にはこの解離工程の概念が模式的に示されている。 When this washing process is completed, the process proceeds to the dissociation process. (VI) in FIG. 1 schematically shows the concept of this dissociation process.
この解離工程では、表面S近傍の反応場Rに形成されている相補鎖、即ち、ポリ(A)RNA2のポリ(A)鎖部位21と表面Sに固定されているdT鎖(符号1)との相補結合部位を、反応場Rの温度条件、塩濃度、pH条件などを操作することによって解離し、一本鎖のポリ(A)RNA2を反応場Rへ遊離させるようにする。なお、解離のための反応場の条件は、適宜選択すればよい。
In this dissociation step, the complementary strand formed in the reaction field R in the vicinity of the surface S, that is, the poly (A)
なお、この解離工程において、再び電界を印加することによって、ポリ(A)RNA2のポリ(A)鎖部位21の双極子モーメントやその配向を急激に変化させ、その効果により解離を促進させるようにしてもよい。
In this dissociation step, by applying an electric field again, the dipole moment of the poly (A)
即ち、電界印加による電気力学的効果によって、dT鎖に対するミスマッチ結合の解離をA−Tフルマッチの解離よりも相対的に増やすことによって、全相補結合中のA−Tフルマッチの割合を増加させることができる、これにより、dT鎖に対するポリ(A)RNAのポリ(A)鎖部位を相補結合させるアッセイの精度を高めることができ、ひいては、回収されたポリ(A)RNAの純度を向上させることができる。 That is, it is possible to increase the ratio of AT full match in all complementary bonds by increasing the dissociation of mismatch bond with respect to dT chain relative to the dissociation of AT full match by electrodynamic effect by applying electric field. This can increase the accuracy of the assay for complementary binding of the poly (A) chain site of the poly (A) RNA to the dT chain, and thus improve the purity of the recovered poly (A) RNA. it can.
最後に、反応場Rに存在する溶液を回収することによって、該溶液中に含まれているポリ(A)RNA2を回収することができる。図1の(V)には、この回収工程の概念が模式的に示されている。
Finally, by recovering the solution present in the reaction field R, the poly (A)
次に、図4は、本発明に係るポリ(A)RNA作製方法に係る工程手順の概念を示す図である。 Next, FIG. 4 is a figure which shows the concept of the process procedure which concerns on the poly (A) RNA preparation method based on this invention.
反応場Rに、符号4で示されたポリアデニン分子と、ポリ(A)鎖を持たないRNA5、ポリ(A)ポリメラーゼ(poly A polymerase)、酵素反応に必要な成分(例えば、Mg2+又はMn2+)などが存在している系を形成する。
In the reaction field R, the polyadenine molecule indicated by
このような反応場Rに電界Eを印加すると、ポリアデニン分子4の双極子モーメントやその配向が急激に変化することにより、ポリアデニン分子4がRNA5の3'末端に付加され易く、あるいは伸長され易い状態となるため、目的のポリ(A)RNA6の生成を効率よく進めることができる。
When an electric field E is applied to such a reaction field R, the dipole moment of the
より具体的には、前記電界Eの電気力学的効果によって、ポリアデニン分子4と同反応場Rに存在するポリ(A)ポリメラーゼ(図示ぜす)の複合体(中間体)の形成が促進され、これにより、RNA5の3'末端部位に対するポリA鎖の付加や伸長が促進されると考えられる。
More specifically, the electrodynamic effect of the electric field E promotes the formation of a poly (A) polymerase (shown) complex (intermediate) present in the reaction field R with the
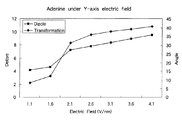
以下、本発明に係るポリ(A)RNA精製方法やポリ(A)RNA精製方法の有用性の根拠となる電界Eの電気力学的効果によるポリアデニン分子の双極子モーメントと配向(トランスフォーメーション)の変化に係る検証結果を、図5〜図8に基づいて説明する。なお、各図の左縦軸はベクトル(Debye)、右縦軸は配向の変化角度(Angle)、横軸は電圧(V/nm)をそれぞれ示している。 Hereinafter, poly (A) RNA purification method and poly (A) RNA purification method according to the present invention change in dipole moment and orientation (transformation) of polyadenine molecule due to electrodynamic effect of electric field E, which is the basis of usefulness of poly (A) RNA purification method The verification result which concerns on is demonstrated based on FIGS. In each figure, the left vertical axis represents a vector (Debye), the right vertical axis represents an orientation change angle (Angle), and the horizontal axis represents a voltage (V / nm).
図5は、ポリアデニン分子の双極子モーメントと配向が、電界強度(電圧)1.6〜2.1V/nmのときに急激に変化することが示されている。一方、図6はポリチアミン分子、図7はポリシトシン分子、図8はポリグアニン分子のついての双極子モーメントとトランスフォーメーションの変化をそれぞれ示している。 FIG. 5 shows that the dipole moment and orientation of the polyadenine molecule change rapidly when the electric field strength (voltage) is 1.6 to 2.1 V / nm. On the other hand, FIG. 6 shows polythiamine molecules, FIG. 7 shows polycytosine molecules, and FIG. 8 shows changes in dipole moment and transformation of polyguanine molecules.
図6から8の結果と図5の結果を比較すればわかるように、ポリチアミン分子、ポリシトシン分子、ポリグアニン分子では、ポリアデニン分子のような電界強度(電圧)1.6〜2.1V/nmにおける双極子モーメントと配向の急激な変化が見られないことが明らかである。 As can be seen by comparing the results of FIGS. 6 to 8 with the results of FIG. It is clear that there is no sudden change in the repulsive moment and orientation.
核酸分子は、骨格をなすリン酸イオン(陰電荷)とその周辺にある水がイオン化した水素原子(陽電荷)とによってイオン曇を作っていると考えられ、これらの陰電荷及び陽電荷によって分極ベクトル(双極子)が生じ、この分極ベクトルが電界の印加によりその方向が変化し、また、配向も変化する。 Nucleic acid molecules are thought to be ion clouded by phosphate ions (negative charges) that form the skeleton and hydrogen atoms (positive charges) formed by ionizing water around them, and are polarized by these negative and positive charges. A vector (dipole) is generated, and this polarization vector changes its direction by applying an electric field, and its orientation also changes.
本実施例1に係る実験で使用したElution Bufferの組成は、10mM Tris-HCL pH7.5, 1mM EDTA(エチレンジアミン四酢酸二ナトリウム),0.1%SDS(ポリアクリルアミド)であり、洗浄用のバッファー溶液(Washing Buffer)の組成は、10mMTris-HCL pH7.5, 1mM EDTA, 0.1% SDS, 0.5MNaClである。 The composition of the Elution Buffer used in the experiment according to Example 1 is 10 mM Tris-HCL pH 7.5, 1 mM EDTA (ethylenediaminetetraacetate disodium), 0.1% SDS (polyacrylamide). The composition of Washing Buffer is 10 mM Tris-HCL pH 7.5, 1 mM EDTA, 0.1% SDS, 0.5 M NaCl.
エタノール沈殿後のtotal RNA400mgに、前記Elution Buffer400mlを加え、更にoligotex-dT30 <super> 400mlを加えて、65度、5分インキュベートした。その後、3分間急冷し、電界(条件:1MHz,2V)を10分かけた。 400 ml of the above Elution Buffer was added to 400 mg of total RNA after ethanol precipitation, and 400 ml of oligotex-dT30 <super> was further added and incubated at 65 ° C. for 5 minutes. Thereafter, it was rapidly cooled for 3 minutes, and an electric field (conditions: 1 MHz, 2 V) was applied for 10 minutes.
続いて、5M NaCl 80mlを加え、37度10minインキュベートした後、15000rpm 3min 4度で遠心した。ペレットを上記Washing Buffer 1mlに懸濁し、15000rpm 3min 4℃で遠心し、上清を除去した。再び電界を10分かけてから、TE 400mlを加え、ピペッティングで懸濁し、65℃ 5分インキュベートし、その後、3分間急冷した後、15000rpm 3min 4℃で遠心し、その上清を新しいチューブに移し、15000rpm 3min 4℃遠心した。その上清を新しいチューブに移してエタノール沈殿(2M NaoAc1/10,100% Etoh 2.5倍)させた。その後、ペレットを少し乾かし、DEPC(diethylpyrocarbonete)処理したdH2OまたはTEに溶かして、ポリ(A)RNAの濃度を測定した。 Subsequently, 80 ml of 5M NaCl was added, incubated at 37 degrees for 10 minutes, and then centrifuged at 15000 rpm for 3 minutes at 4 degrees. The pellet was suspended in 1 ml of the above Washing Buffer, centrifuged at 15000 rpm for 3 min at 4 ° C., and the supernatant was removed. Apply electric field again for 10 minutes, add 400 ml of TE, suspend by pipetting, incubate at 65 ° C for 5 minutes, then rapidly cool for 3 minutes, and then centrifuge at 15000 rpm for 3 minutes at 4 ° C. Transfer the supernatant to a new tube. The sample was transferred and centrifuged at 15000 rpm for 3 minutes at 4 ° C. The supernatant was transferred to a new tube and ethanol precipitated (2M NaoAc1 / 10, 100% Etoh 2.5 times). Thereafter, the pellet was slightly dried, dissolved in dH2O or TE treated with DEPC (diethylpyrocarbonete), and the concentration of poly (A) RNA was measured.
この実験結果、電界を印加した場合は、電界をかけない場合に比べて、20%以上のポリ(A)RNAを生成できることを確認できた。 As a result of this experiment, it was confirmed that 20% or more of poly (A) RNA could be generated when an electric field was applied, compared to when no electric field was applied.
ストレス条件下で3h培養した枯草菌から抽出したtotal RNAを用いて、ポリ(A)ポリメラーゼ(poly A polymerase)によってpoly Aを付加させる実験を行った。 Using total RNA extracted from Bacillus subtilis cultured for 3 hours under stress conditions, an experiment was conducted in which poly A was added by poly (A) polymerase (poly A polymerase).
RNAは8.4μg使用し、poly A polymerase活性測定用反応液として、Takara社のプロトコルに沿って調製した。電界をかけない時に、酵素反応時間を37℃で60分、10mMのATP(アデノシン三リン酸)濃度がpoly A付加反応を、電界を印加した条件と、電界を印加しない条件でそれぞれ行った。 8.4 μg of RNA was used and prepared as a reaction solution for measuring poly A polymerase activity according to Takara's protocol. When no electric field was applied, the enzyme reaction time was 37 minutes at 60 ° C., and a 10 mM ATP (adenosine triphosphate) concentration poly A addition reaction was carried out under conditions where an electric field was applied and conditions where an electric field was not applied.
電界印加条件では、電界を印加しない条件よりも、短時間でpoly A付加反応が終わった。また、付加されたポリ(A)鎖(poly A tail)の長さを調べたところ、電場印加条件でポリ(A)鎖は、電界印加がない時より長いことが分かった。このような電界印加の効果は、ポリ(A)鎖の付加に加え、当該ポリ(A)鎖の伸長も促進させると考えられる。 Under the electric field application condition, the poly A addition reaction was completed in a shorter time than when no electric field was applied. Further, when the length of the added poly (A) chain (poly A tail) was examined, it was found that the poly (A) chain was longer under the electric field application condition than when no electric field was applied. Such an electric field application effect is considered to promote the extension of the poly (A) chain in addition to the addition of the poly (A) chain.
本発明は、様々な生体材料から効率的にポリ(A)RNAを精製したり、作製したりする技術として利用できる。本発明に係る方法により得られたポリ(A)RNAは、ノザンブロット解析、RT−PCR解析、cDNAライブラリーの調製、cDNAクローニングなどの鋳型として利用できる。 The present invention can be used as a technique for efficiently purifying or producing poly (A) RNA from various biomaterials. The poly (A) RNA obtained by the method according to the present invention can be used as a template for Northern blot analysis, RT-PCR analysis, cDNA library preparation, cDNA cloning and the like.
1 dT鎖
2 ポリ(A)RNA
3 ポリ(A)鎖を持たないRNA
E 電界
R 反応場
S 表面
1
3 RNA without poly (A) chain
E Electric field R Reaction field S Surface
Claims (1)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2005149325A JP4765402B2 (en) | 2005-05-23 | 2005-05-23 | Method for producing poly (A) RNA by applying electric field |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2005149325A JP4765402B2 (en) | 2005-05-23 | 2005-05-23 | Method for producing poly (A) RNA by applying electric field |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2006325409A JP2006325409A (en) | 2006-12-07 |
| JP4765402B2 true JP4765402B2 (en) | 2011-09-07 |
Family
ID=37547781
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2005149325A Expired - Fee Related JP4765402B2 (en) | 2005-05-23 | 2005-05-23 | Method for producing poly (A) RNA by applying electric field |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4765402B2 (en) |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5605662A (en) * | 1993-11-01 | 1997-02-25 | Nanogen, Inc. | Active programmable electronic devices for molecular biological analysis and diagnostics |
| AU746005B2 (en) * | 1998-05-04 | 2002-04-11 | Fraunhofer-Gesellschaft Zur Forderung Der Angewandten Forschung E.V. | Electrical integrated nucleic acid isolation, purification and detection |
| JP2003018985A (en) * | 2001-05-29 | 2003-01-21 | Japan Science & Technology Corp | Method for extending long chain DNA |
| JP4342890B2 (en) * | 2003-09-30 | 2009-10-14 | 富士フイルム株式会社 | Method for removing mismatch binding polynucleotides |
| JP4321854B2 (en) * | 2003-10-02 | 2009-08-26 | ソニー株式会社 | Hybridization and other interaction detection units and DNA chips and other bioassay substrates provided with the detection units |
| JP2005110503A (en) * | 2003-10-02 | 2005-04-28 | Arkray Inc | Method for purifying nucleic acid and device therefor |
| JP2005110539A (en) * | 2003-10-06 | 2005-04-28 | Sony Corp | Single-stranded nucleic acid extension method, single-stranded nucleic acid extension apparatus, and DNA chip |
-
2005
- 2005-05-23 JP JP2005149325A patent/JP4765402B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JP2006325409A (en) | 2006-12-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10858647B2 (en) | Removal of DNA fragments in mRNA production process | |
| CN102625838B (en) | For generating sample that rRNA eliminates or for from the method for sample separation rRNA, composition and test kit | |
| US11162139B2 (en) | Method for genomic profiling of DNA 5-methylcytosine and 5-hydroxymethylcytosine | |
| US20160032273A1 (en) | Characterization of mrna molecules | |
| CN111278550B (en) | Size Selective Purification Using Thermoplastic Silica Nanomaterials | |
| WO2007035742A9 (en) | Cdna library preparation | |
| CN115896047B (en) | Recombinant T4DNA ligase mutant, fusion protein and application thereof | |
| US10364455B2 (en) | Methods and compositions for improving removal of ribosomal RNA from biological samples | |
| EP4430206A1 (en) | Methods for barcoding macromolecules in individual cells | |
| WO2017147945A1 (en) | Sequencing method for genetic mapping of dna 5-methylcytosine and 5-hydroxymethylcytosine | |
| CN112779260B (en) | Aptamer of flavin mononucleotide, screening method and application thereof | |
| US20200340028A1 (en) | Novel enzymatic methods to generate high yields of sequence specific rna oligonucleotides with extreme precision | |
| JP2022547949A (en) | Methods and kits for preparing RNA samples for sequencing | |
| CN114395552A (en) | Method for isolating poly (A) nucleic acids | |
| CN108004246A (en) | The method that liquid phase target SELEX screenings are quickly carried out using the affine method of metal | |
| JP4765402B2 (en) | Method for producing poly (A) RNA by applying electric field | |
| WO2005093065A1 (en) | Improved method of isolating nucleic acids | |
| US10287625B2 (en) | Methods and kits for separating nucleic acids by size | |
| JP2006280277A (en) | Method for extracting nucleic acid | |
| JP2025535369A (en) | Methods and compositions for sequencing library normalization | |
| JP2009247220A (en) | Carrier for gene subtraction and use thereof | |
| JP5208477B2 (en) | Carrier for gene subtraction and use thereof | |
| WO2025226876A1 (en) | Sequencing library normalization methods | |
| CN121344150A (en) | Method for identifying glycosyltransferase or glycosidase specific enzymes involved in DNA/RNA glycosylation | |
| HK40112581A (en) | Nuclease-based rna depletion |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080327 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20101207 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110131 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20110517 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20110530 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140624 Year of fee payment: 3 |
|
| LAPS | Cancellation because of no payment of annual fees |