JP3872813B2 - ヘテロダイマーポリペプチド免疫原キャリア組成物および方法 - Google Patents
ヘテロダイマーポリペプチド免疫原キャリア組成物および方法 Download PDFInfo
- Publication number
- JP3872813B2 JP3872813B2 JP52926595A JP52926595A JP3872813B2 JP 3872813 B2 JP3872813 B2 JP 3872813B2 JP 52926595 A JP52926595 A JP 52926595A JP 52926595 A JP52926595 A JP 52926595A JP 3872813 B2 JP3872813 B2 JP 3872813B2
- Authority
- JP
- Japan
- Prior art keywords
- seq
- polypeptide
- amino acid
- peptide
- antigen
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title claims abstract description 414
- 102000004196 processed proteins & peptides Human genes 0.000 title claims abstract description 223
- 229920001184 polypeptide Polymers 0.000 title claims abstract description 160
- 239000000203 mixture Substances 0.000 title claims abstract description 72
- 230000002163 immunogen Effects 0.000 title claims description 45
- 238000000034 method Methods 0.000 title claims description 38
- 108091007433 antigens Proteins 0.000 claims abstract description 144
- 102000036639 antigens Human genes 0.000 claims abstract description 144
- 239000000427 antigen Substances 0.000 claims abstract description 143
- 210000001744 T-lymphocyte Anatomy 0.000 claims abstract description 39
- 210000003719 b-lymphocyte Anatomy 0.000 claims abstract description 34
- 235000001014 amino acid Nutrition 0.000 claims description 93
- 229940024606 amino acid Drugs 0.000 claims description 92
- 150000001413 amino acids Chemical class 0.000 claims description 84
- 239000000833 heterodimer Substances 0.000 claims description 51
- 230000015572 biosynthetic process Effects 0.000 claims description 42
- 238000005859 coupling reaction Methods 0.000 claims description 35
- 230000008878 coupling Effects 0.000 claims description 33
- 238000010168 coupling process Methods 0.000 claims description 33
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 31
- 230000003993 interaction Effects 0.000 claims description 27
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 23
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 claims description 18
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 claims description 15
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 claims description 14
- 239000004472 Lysine Substances 0.000 claims description 13
- 235000013922 glutamic acid Nutrition 0.000 claims description 12
- 239000004220 glutamic acid Substances 0.000 claims description 12
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 claims description 11
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 claims description 8
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 claims description 7
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 claims description 7
- 239000004475 Arginine Substances 0.000 claims description 6
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 claims description 6
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 claims description 6
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 claims description 6
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 claims description 6
- 229960000310 isoleucine Drugs 0.000 claims description 6
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 claims description 6
- 239000004474 valine Substances 0.000 claims description 6
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 claims description 5
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 claims description 5
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 claims description 5
- 235000003704 aspartic acid Nutrition 0.000 claims description 5
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 claims description 5
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 claims description 5
- 238000002156 mixing Methods 0.000 claims description 5
- 238000009472 formulation Methods 0.000 abstract description 33
- 230000000975 bioactive effect Effects 0.000 abstract description 12
- 150000001875 compounds Chemical class 0.000 abstract description 6
- 229940126577 synthetic vaccine Drugs 0.000 abstract description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 55
- 229960005486 vaccine Drugs 0.000 description 46
- 230000000890 antigenic effect Effects 0.000 description 29
- 230000000692 anti-sense effect Effects 0.000 description 24
- 235000018102 proteins Nutrition 0.000 description 24
- 102000004169 proteins and genes Human genes 0.000 description 24
- 108090000623 proteins and genes Proteins 0.000 description 24
- 241001465754 Metazoa Species 0.000 description 23
- 210000004027 cell Anatomy 0.000 description 22
- 230000027455 binding Effects 0.000 description 21
- 239000003814 drug Substances 0.000 description 21
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 18
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 18
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 18
- 239000000243 solution Substances 0.000 description 18
- 239000013612 plasmid Substances 0.000 description 16
- 229940079593 drug Drugs 0.000 description 15
- 239000011347 resin Substances 0.000 description 15
- 229920005989 resin Polymers 0.000 description 15
- 244000052769 pathogen Species 0.000 description 14
- 238000010586 diagram Methods 0.000 description 13
- 239000000710 homodimer Substances 0.000 description 13
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 12
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 12
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 12
- 239000012634 fragment Substances 0.000 description 12
- 125000000539 amino acid group Chemical group 0.000 description 11
- 238000006243 chemical reaction Methods 0.000 description 11
- 239000002609 medium Substances 0.000 description 11
- 229960000814 tetanus toxoid Drugs 0.000 description 11
- 108700018351 Major Histocompatibility Complex Proteins 0.000 description 10
- 230000001717 pathogenic effect Effects 0.000 description 10
- 150000003839 salts Chemical class 0.000 description 10
- 230000020382 suppression by virus of host antigen processing and presentation of peptide antigen via MHC class I Effects 0.000 description 10
- 239000000969 carrier Substances 0.000 description 9
- 125000006850 spacer group Chemical group 0.000 description 9
- 239000000126 substance Substances 0.000 description 9
- 238000003786 synthesis reaction Methods 0.000 description 9
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 8
- 241000699670 Mus sp. Species 0.000 description 8
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 8
- 241000589517 Pseudomonas aeruginosa Species 0.000 description 8
- 239000000539 dimer Substances 0.000 description 8
- 230000002209 hydrophobic effect Effects 0.000 description 8
- 208000015181 infectious disease Diseases 0.000 description 8
- 238000004519 manufacturing process Methods 0.000 description 8
- 238000000746 purification Methods 0.000 description 8
- 108020004414 DNA Proteins 0.000 description 7
- 239000000872 buffer Substances 0.000 description 7
- 230000004927 fusion Effects 0.000 description 7
- 230000028993 immune response Effects 0.000 description 7
- 108020004707 nucleic acids Proteins 0.000 description 7
- 102000039446 nucleic acids Human genes 0.000 description 7
- 150000007523 nucleic acids Chemical class 0.000 description 7
- 102000014914 Carrier Proteins Human genes 0.000 description 6
- 108010078791 Carrier Proteins Proteins 0.000 description 6
- 238000002965 ELISA Methods 0.000 description 6
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 6
- 210000004899 c-terminal region Anatomy 0.000 description 6
- 238000001142 circular dichroism spectrum Methods 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- 102000054766 genetic haplotypes Human genes 0.000 description 6
- 125000000291 glutamic acid group Chemical group N[C@@H](CCC(O)=O)C(=O)* 0.000 description 6
- -1 guanidinyl group Chemical group 0.000 description 6
- 238000002347 injection Methods 0.000 description 6
- 239000007924 injection Substances 0.000 description 6
- 238000012986 modification Methods 0.000 description 6
- 230000004048 modification Effects 0.000 description 6
- 239000002773 nucleotide Substances 0.000 description 6
- 125000003729 nucleotide group Chemical group 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 238000007363 ring formation reaction Methods 0.000 description 6
- 239000002904 solvent Substances 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- 229940124597 therapeutic agent Drugs 0.000 description 6
- 206010028980 Neoplasm Diseases 0.000 description 5
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 5
- 239000000853 adhesive Substances 0.000 description 5
- 230000001070 adhesive effect Effects 0.000 description 5
- 238000004458 analytical method Methods 0.000 description 5
- 238000013459 approach Methods 0.000 description 5
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 5
- 235000018417 cysteine Nutrition 0.000 description 5
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 5
- 239000013613 expression plasmid Substances 0.000 description 5
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 5
- 230000003053 immunization Effects 0.000 description 5
- 238000002649 immunization Methods 0.000 description 5
- 238000005259 measurement Methods 0.000 description 5
- 230000003472 neutralizing effect Effects 0.000 description 5
- 239000002953 phosphate buffered saline Substances 0.000 description 5
- 210000002966 serum Anatomy 0.000 description 5
- 230000001225 therapeutic effect Effects 0.000 description 5
- 210000001519 tissue Anatomy 0.000 description 5
- 239000011534 wash buffer Substances 0.000 description 5
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 4
- 108010000916 Fimbriae Proteins Proteins 0.000 description 4
- 239000004471 Glycine Substances 0.000 description 4
- 239000002671 adjuvant Substances 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 238000002983 circular dichroism Methods 0.000 description 4
- 230000000295 complement effect Effects 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 4
- 238000007912 intraperitoneal administration Methods 0.000 description 4
- 239000003446 ligand Substances 0.000 description 4
- 239000011541 reaction mixture Substances 0.000 description 4
- 230000000087 stabilizing effect Effects 0.000 description 4
- 230000001629 suppression Effects 0.000 description 4
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- 108010068327 4-hydroxyphenylpyruvate dioxygenase Proteins 0.000 description 3
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 3
- 108010025188 Alcohol oxidase Proteins 0.000 description 3
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 3
- 102100031675 DnaJ homolog subfamily C member 5 Human genes 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 101800000324 Immunoglobulin A1 protease translocator Proteins 0.000 description 3
- 241000235058 Komagataella pastoris Species 0.000 description 3
- 241000699666 Mus <mouse, genus> Species 0.000 description 3
- 241000283973 Oryctolagus cuniculus Species 0.000 description 3
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 3
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 3
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 3
- 101000874347 Streptococcus agalactiae IgA FC receptor Proteins 0.000 description 3
- 210000000612 antigen-presenting cell Anatomy 0.000 description 3
- 229940098773 bovine serum albumin Drugs 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- 239000000356 contaminant Substances 0.000 description 3
- 238000010511 deprotection reaction Methods 0.000 description 3
- 238000013461 design Methods 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N phenol group Chemical group C1(=CC=CC=C1)O ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 3
- 108010094020 polyglycine Proteins 0.000 description 3
- 229920000232 polyglycine polymer Polymers 0.000 description 3
- 108091033319 polynucleotide Proteins 0.000 description 3
- 102000040430 polynucleotide Human genes 0.000 description 3
- 239000002157 polynucleotide Substances 0.000 description 3
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 239000007790 solid phase Substances 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 230000008685 targeting Effects 0.000 description 3
- 125000003396 thiol group Chemical group [H]S* 0.000 description 3
- 239000013598 vector Substances 0.000 description 3
- DJQYYYCQOZMCRC-UHFFFAOYSA-N 2-aminopropane-1,3-dithiol Chemical group SCC(N)CS DJQYYYCQOZMCRC-UHFFFAOYSA-N 0.000 description 2
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 2
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- 102100021935 C-C motif chemokine 26 Human genes 0.000 description 2
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 2
- 238000012286 ELISA Assay Methods 0.000 description 2
- 241000588724 Escherichia coli Species 0.000 description 2
- KRHYYFGTRYWZRS-UHFFFAOYSA-N Fluorane Chemical compound F KRHYYFGTRYWZRS-UHFFFAOYSA-N 0.000 description 2
- 101000897493 Homo sapiens C-C motif chemokine 26 Proteins 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- 108060003951 Immunoglobulin Proteins 0.000 description 2
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 2
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 2
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 2
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 2
- 241000712079 Measles morbillivirus Species 0.000 description 2
- 108010052285 Membrane Proteins Proteins 0.000 description 2
- 239000004793 Polystyrene Substances 0.000 description 2
- 208000032536 Pseudomonas Infections Diseases 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- 108091008874 T cell receptors Proteins 0.000 description 2
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 2
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 235000004279 alanine Nutrition 0.000 description 2
- RDOXTESZEPMUJZ-UHFFFAOYSA-N anisole Chemical compound COC1=CC=CC=C1 RDOXTESZEPMUJZ-UHFFFAOYSA-N 0.000 description 2
- 230000005875 antibody response Effects 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 235000014633 carbohydrates Nutrition 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 238000010367 cloning Methods 0.000 description 2
- 230000021615 conjugation Effects 0.000 description 2
- 231100000433 cytotoxic Toxicity 0.000 description 2
- 230000001472 cytotoxic effect Effects 0.000 description 2
- 230000000368 destabilizing effect Effects 0.000 description 2
- 210000002919 epithelial cell Anatomy 0.000 description 2
- 108020001507 fusion proteins Proteins 0.000 description 2
- 102000037865 fusion proteins Human genes 0.000 description 2
- 210000002443 helper t lymphocyte Anatomy 0.000 description 2
- 210000004408 hybridoma Anatomy 0.000 description 2
- 125000001165 hydrophobic group Chemical group 0.000 description 2
- 230000005661 hydrophobic surface Effects 0.000 description 2
- 230000005965 immune activity Effects 0.000 description 2
- 230000009851 immunogenic response Effects 0.000 description 2
- 102000018358 immunoglobulin Human genes 0.000 description 2
- 230000016784 immunoglobulin production Effects 0.000 description 2
- 238000010348 incorporation Methods 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 229930182817 methionine Natural products 0.000 description 2
- 244000005700 microbiome Species 0.000 description 2
- 239000000178 monomer Substances 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 230000007918 pathogenicity Effects 0.000 description 2
- 238000010647 peptide synthesis reaction Methods 0.000 description 2
- 229920002223 polystyrene Polymers 0.000 description 2
- 229910000160 potassium phosphate Inorganic materials 0.000 description 2
- 235000011009 potassium phosphates Nutrition 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 239000011535 reaction buffer Substances 0.000 description 2
- 230000003252 repetitive effect Effects 0.000 description 2
- 238000004007 reversed phase HPLC Methods 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical group C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 210000000952 spleen Anatomy 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 150000008163 sugars Chemical class 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 2
- 238000011144 upstream manufacturing Methods 0.000 description 2
- 238000002255 vaccination Methods 0.000 description 2
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 1
- QJCNLJWUIOIMMF-YUMQZZPRSA-N (2s,3s)-3-methyl-2-[(2-methylpropan-2-yl)oxycarbonylamino]pentanoic acid Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)OC(C)(C)C QJCNLJWUIOIMMF-YUMQZZPRSA-N 0.000 description 1
- NKUHWWPUOXOIIR-CRCLSJGQSA-N (4r)-5-amino-4-[[(2s)-2-azaniumylpropanoyl]amino]-5-oxopentanoate Chemical compound C[C@H](N)C(=O)N[C@@H](C(N)=O)CCC(O)=O NKUHWWPUOXOIIR-CRCLSJGQSA-N 0.000 description 1
- BYEAHWXPCBROCE-UHFFFAOYSA-N 1,1,1,3,3,3-hexafluoropropan-2-ol Chemical compound FC(F)(F)C(O)C(F)(F)F BYEAHWXPCBROCE-UHFFFAOYSA-N 0.000 description 1
- VYMPLPIFKRHAAC-UHFFFAOYSA-N 1,2-ethanedithiol Chemical compound SCCS VYMPLPIFKRHAAC-UHFFFAOYSA-N 0.000 description 1
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 1
- GOJUJUVQIVIZAV-UHFFFAOYSA-N 2-amino-4,6-dichloropyrimidine-5-carbaldehyde Chemical group NC1=NC(Cl)=C(C=O)C(Cl)=N1 GOJUJUVQIVIZAV-UHFFFAOYSA-N 0.000 description 1
- BFSVOASYOCHEOV-UHFFFAOYSA-N 2-diethylaminoethanol Chemical compound CCN(CC)CCO BFSVOASYOCHEOV-UHFFFAOYSA-N 0.000 description 1
- YEDUAINPPJYDJZ-UHFFFAOYSA-N 2-hydroxybenzothiazole Chemical compound C1=CC=C2SC(O)=NC2=C1 YEDUAINPPJYDJZ-UHFFFAOYSA-N 0.000 description 1
- PQBZDGDVGDHNHR-UHFFFAOYSA-N 3-ethyl-2h-1,3-benzothiazole;sulfuric acid Chemical compound OS(O)(=O)=O.C1=CC=C2N(CC)CSC2=C1 PQBZDGDVGDHNHR-UHFFFAOYSA-N 0.000 description 1
- 108010049290 ADP Ribose Transferases Proteins 0.000 description 1
- 102000009062 ADP Ribose Transferases Human genes 0.000 description 1
- 101100295756 Acinetobacter baumannii (strain ATCC 19606 / DSM 30007 / JCM 6841 / CCUG 19606 / CIP 70.34 / NBRC 109757 / NCIMB 12457 / NCTC 12156 / 81) omp38 gene Proteins 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 101100064317 Arabidopsis thaliana DTX41 gene Proteins 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 231100000699 Bacterial toxin Toxicity 0.000 description 1
- OBMZMSLWNNWEJA-XNCRXQDQSA-N C1=CC=2C(C[C@@H]3NC(=O)[C@@H](NC(=O)[C@H](NC(=O)N(CC#CCN(CCCC[C@H](NC(=O)[C@@H](CC4=CC=CC=C4)NC3=O)C(=O)N)CC=C)NC(=O)[C@@H](N)C)CC3=CNC4=C3C=CC=C4)C)=CNC=2C=C1 Chemical compound C1=CC=2C(C[C@@H]3NC(=O)[C@@H](NC(=O)[C@H](NC(=O)N(CC#CCN(CCCC[C@H](NC(=O)[C@@H](CC4=CC=CC=C4)NC3=O)C(=O)N)CC=C)NC(=O)[C@@H](N)C)CC3=CNC4=C3C=CC=C4)C)=CNC=2C=C1 OBMZMSLWNNWEJA-XNCRXQDQSA-N 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 101710132601 Capsid protein Proteins 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 1
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 1
- LRQKBLKVPFOOQJ-YFKPBYRVSA-N L-norleucine Chemical compound CCCC[C@H]([NH3+])C([O-])=O LRQKBLKVPFOOQJ-YFKPBYRVSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 1
- 108090001030 Lipoproteins Proteins 0.000 description 1
- 102000004895 Lipoproteins Human genes 0.000 description 1
- 201000005505 Measles Diseases 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 101710176384 Peptide 1 Proteins 0.000 description 1
- 102000003992 Peroxidases Human genes 0.000 description 1
- 240000009188 Phyllostachys vivax Species 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 108010076504 Protein Sorting Signals Proteins 0.000 description 1
- 241000589516 Pseudomonas Species 0.000 description 1
- 206010037660 Pyrexia Diseases 0.000 description 1
- 108091081062 Repeated sequence (DNA) Proteins 0.000 description 1
- 229920005654 Sephadex Polymers 0.000 description 1
- 239000012507 Sephadex™ Substances 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 206010043376 Tetanus Diseases 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 230000003187 abdominal effect Effects 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 230000029936 alkylation Effects 0.000 description 1
- 238000005804 alkylation reaction Methods 0.000 description 1
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical compound [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 1
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical class N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 1
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 1
- 229960000723 ampicillin Drugs 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000012736 aqueous medium Substances 0.000 description 1
- 101150042295 arfA gene Proteins 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 230000006472 autoimmune response Effects 0.000 description 1
- 239000000688 bacterial toxin Substances 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- CIHWJRSPVJBHGT-UHFFFAOYSA-N benzhydrylazanium;chloride Chemical compound Cl.C=1C=CC=CC=1C(N)C1=CC=CC=C1 CIHWJRSPVJBHGT-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 102000005936 beta-Galactosidase Human genes 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 238000001311 chemical methods and process Methods 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 230000005595 deprotonation Effects 0.000 description 1
- 238000010537 deprotonation reaction Methods 0.000 description 1
- 238000003795 desorption Methods 0.000 description 1
- 230000001687 destabilization Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- MGHPNCMVUAKAIE-UHFFFAOYSA-N diphenylmethanamine Chemical compound C=1C=CC=CC=1C(N)C1=CC=CC=C1 MGHPNCMVUAKAIE-UHFFFAOYSA-N 0.000 description 1
- 230000009429 distress Effects 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 108010075387 exoenzyme S Proteins 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 238000013265 extended release Methods 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 238000011010 flushing procedure Methods 0.000 description 1
- 108010074605 gamma-Globulins Proteins 0.000 description 1
- 230000008570 general process Effects 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 235000004554 glutamine Nutrition 0.000 description 1
- 125000003630 glycyl group Chemical group [H]N([H])C([H])([H])C(*)=O 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 230000005660 hydrophilic surface Effects 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 229940127121 immunoconjugate Drugs 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 230000000415 inactivating effect Effects 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000003402 intramolecular cyclocondensation reaction Methods 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 108010045069 keyhole-limpet hemocyanin Proteins 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 210000001806 memory b lymphocyte Anatomy 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- UZKWTJUDCOPSNM-UHFFFAOYSA-N methoxybenzene Substances CCCCOC=C UZKWTJUDCOPSNM-UHFFFAOYSA-N 0.000 description 1
- 230000004001 molecular interaction Effects 0.000 description 1
- 238000013365 molecular weight analysis method Methods 0.000 description 1
- 229940031348 multivalent vaccine Drugs 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- FEMOMIGRRWSMCU-UHFFFAOYSA-N ninhydrin Chemical compound C1=CC=C2C(=O)C(O)(O)C(=O)C2=C1 FEMOMIGRRWSMCU-UHFFFAOYSA-N 0.000 description 1
- 230000009871 nonspecific binding Effects 0.000 description 1
- 101150087557 omcB gene Proteins 0.000 description 1
- 101150115693 ompA gene Proteins 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 229960005030 other vaccine in atc Drugs 0.000 description 1
- 239000006174 pH buffer Substances 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000007110 pathogen host interaction Effects 0.000 description 1
- 229940023041 peptide vaccine Drugs 0.000 description 1
- 108040007629 peroxidase activity proteins Proteins 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 230000000379 polymerizing effect Effects 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 238000001742 protein purification Methods 0.000 description 1
- 230000005588 protonation Effects 0.000 description 1
- 239000012264 purified product Substances 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 239000000941 radioactive substance Substances 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 229940081974 saccharin Drugs 0.000 description 1
- 235000019204 saccharin Nutrition 0.000 description 1
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 238000001338 self-assembly Methods 0.000 description 1
- 235000004400 serine Nutrition 0.000 description 1
- 238000007086 side reaction Methods 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 238000004611 spectroscopical analysis Methods 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 238000012799 strong cation exchange Methods 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 230000031068 symbiosis, encompassing mutualism through parasitism Effects 0.000 description 1
- 229920001059 synthetic polymer Polymers 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- WROMPOXWARCANT-UHFFFAOYSA-N tfa trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F.OC(=O)C(F)(F)F WROMPOXWARCANT-UHFFFAOYSA-N 0.000 description 1
- 150000007970 thio esters Chemical group 0.000 description 1
- 235000008521 threonine Nutrition 0.000 description 1
- 238000001269 time-of-flight mass spectrometry Methods 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 238000011282 treatment Methods 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/385—Haptens or antigens, bound to carriers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/001—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof by chemical synthesis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/60—Medicinal preparations containing antigens or antibodies characteristics by the carrier linked to the antigen
- A61K2039/6031—Proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/62—Medicinal preparations containing antigens or antibodies characterised by the link between antigen and carrier
- A61K2039/622—Medicinal preparations containing antigens or antibodies characterised by the link between antigen and carrier non-covalent binding
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/64—Medicinal preparations containing antigens or antibodies characterised by the architecture of the carrier-antigen complex, e.g. repetition of carrier-antigen units
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Gastroenterology & Hepatology (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Mycology (AREA)
- Epidemiology (AREA)
- Zoology (AREA)
- Cell Biology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Toxicology (AREA)
- Pharmacology & Pharmacy (AREA)
- Microbiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
Description
本発明は、一般的に、公知の化学量論および分子配向で結合した2つの異なる生物活性部分を有し得るポリペプチドキャリア複合体の組成物および使用方法に関する。より特定すると、予め定義された正確な化学量論および分子配向で2つの異なるタイプの抗原を提示し得る合成免疫抗原性ポリペプチド複合体に関する。
引用文献
発明の背景
ワクチンは、目的のエピトープを含有するほとんど完全な、天然の抗原性分子または抗原性分子の一部分のいずれかを用いて構築され得る。Tam(1988、1993)により議論されているように、最近の研究は、合成ペプチドが天然のタンパク質中のそれらの各自の配列と反応性である抗体を誘導し得ることを示している(Selaら;Lerner)。ペプチド抗原と免疫反応性である抗体は、有用な実験室試薬および診断試薬である。化学合成により都合良く入手可能な合成ペプチド抗原は、免疫原の生成および受動的免疫予防法のために使用され得る(Selaら;Lerner;Bittleら;DiMarchiら)。
ペプチド抗原と免疫反応性である抗体を調製するための従来のアプローチは、ペプチドの公知のタンパク質または合成ポリマーキャリアへの結合であり、免疫原性因子に高分子構造を与える(Selaら;Lerner;Bittleら)。合成ペプチド抗原を重合してペプチドポリマーを得ることによりキャリアの使用を回避するように設計された方法がまた、報告されている(DiMarchiら)。このような構築物は動物抗体の産生において有効であるが、それらは組成および構造が曖昧である。これは、抗体がヒトワクチンのために使用される場合に特に不利である。
ワクチンは、代表的には、天然キャリア上に抗原(例えば、タンパク質、炭水化物、脂質またはリポソーム)を含有する。このようなワクチンは有用であり、そして長年使用されている。しかし、このようなワクチンに伴う多くの認識された問題があり、それらのいくつかは、キャリアと関係する。キャリアは通常天然の供給源から単離されるので、それらはしばしば一定の品質ではない。さらに、高価でかつ骨の折れる精製努力にもかかわらず、天然の夾雑物を完全に含まない生成物を提供することは困難であり、そしてしばしば不可能である。このような夾雑物は、それ自体免疫原性であり得る。それらは、しばしばワクチンの使用と関連した望ましくない副反応(特に発熱および組織腫脹)を引き起こす。さらに、抗原の濃度は、バッチごとに変化し得る。なぜなら、キャリアと反応する抗原またはその表面で観察される抗原の量が一定でないからである。
発明の要旨
それ故、本発明の1つの目的は、相互作用して超らせんヘテロダイマーを形成する2つのサブユニットからなるポリペプチド化合物を提供することである。各サブユニットは、異なる機能部分または生物活性部分を含有するように誘導され、そしてこの部分は実質的に超らせんヘテロダイマーの形成を妨害しない。超らせんヘテロダイマーは、サブユニット間のイオン相互作用により安定化され得る。
種々の生物活性部分が、サブユニットに結合され得るか、または取り込まれ得る。この部分は、(抗体およびFAb断片を包含する)他のポリペプチド、薬剤、治療剤、放射性物質、核酸、糖タンパク質、リポタンパク質、炭水化物、脂肪酸、または他の生物学的に活性な物質であり得る。これらの物質は、キャリアポリペプチドのアミノ酸残基に直接結合され得るか、または2〜8アミノ酸(例えば、ポリグリシン)のようなスペーサー、炭素鎖などを介して結合され得る。
特に、この部分は抗原(例えば、1方のサブユニット上ではT細胞抗原および他方のサブユニット上ではB細胞抗原)であり得る。1つの実施態様において、一方のサブユニットは、配列番号10、配列番号11、配列番号12、配列番号13または配列番号14で表される配列を有するペプチドからなるT細胞抗原で誘導される。典型的なB細胞抗原は、配列番号18で表される配列を有する。
サブユニットおよびその生物活性部分は、ポリペプチド単鎖(例えば、スペーサーにより隔てられ得る2つのドメインを有する融合ポリペプチド)であり得る。1つの実施態様において、ポリペプチド単鎖は、配列番号28中に存在する配列を含有するアミノ酸配列を有する。別の実施態様において、ポリペプチド単鎖は、配列番号30中に存在する配列を含有するアミノ酸配列を有する。
本発明の関連する目的は、2つのサブユニットからなるへテロダイマーポリペプチド免疫原を提供することである。ここで、各サブユニットは、コアペプチドおよび抗原からなる。各コアペプチドは、gapcdefの形態を有する末端および内部のアミノ酸反復配列からなる。各末端および内部のアミノ酸反復配列のa位およびd位は、イソロイシン、ロイシンまたはバリンであり、そしてe位およびg位は、一方のコアペプチドにおいてはアスパラギン酸またはグルタミン酸、ならびに他方のコアペプチドにおいてはリジン、アルギニンまたはヒスチジンである。
ペプチド抗原は、内部反復のb位、c位またはf位でアミノ酸に共有結合することにより、コアペプチドに結合される。2つのサブユニットは、1:1の化学量論を有する安定なα-ヘリックス超らせんコンフィギュレーションに配列され、そしてペプチド抗原は、このコンフィギュレーションの外部表面に対して配置される。
各コアペプチドの末端反復配列は、b位にグルタミン酸、f位にリジンおよびb位とf位との間に形成されるラクタム架橋を含有し得る。内部反復配列は、f位にアミノ酸カップリング残基を含有し得、そしてこのカップリング残基はシステイン残基であり得る。
好適な実施態様において、コアペプチドは、配列番号1(EE)および配列番号2(KK)で表される配列を有し、そして抗原は、配列番号12(T細胞抗原)および配列番号18(B細胞抗原)で表される配列を有する。
本発明の別の目的は、α-ヘリックス超らせんヘテロダイマー抗原キャリアとして使用するための一対のサブユニットを提供することである。各サブユニットは、gabcdefの形態を有する2つの末端アミノ酸反復ペプチド配列を含有する。ここで、b位はグルタミン酸であり、f位はリジンであり、そしてbおよびfはラクタム架橋により結合され、そして少なくとも1つの内部アミノ酸反復配列はgabcdefの形態を有し、ここでb位、c位またはf位はシステイン残基である。システイン残基は、抗原に共有結合され得る。各末端および内部のアミノ酸反復配列のa位およびd位は、イソロイシン、ロイシンまたはバリンであり、一方のサブユニットのe位およびg位は、アスパラギン酸またはグルタミン酸であり、他方のサブユニットのe位およびg位は、リジン、アルギニンまたはヒスチジンである。
α-ヘリックス超らせんを形成し得る2つの典型的なサブユニットは、配列番号1(EE)および配列番号2(KK)で表される配列を有する。
本発明のさらに別の目的は、ポリペプチド化合物を調製する方法を提供することである。この方法は、相互作用して超らせんヘテロダイマーを形成する2つのペプチドサブユニットを形成する工程を包含する。各サブユニットは、生物活性部分を含有するように誘導され、各サブユニットは、異なる生物活性部分を有し、そして生物活性部分は実質的に超らせんヘテロダイマーの形成を妨害しない。ポリペプチドサブユニットは、上記超らせんヘテロダイマーも形成を促進する条件下で、約1:1の比で、温和培地(benign medium)中で混合される。超らせんヘテロダイマーは、イオン相互作用により安定化され得る。
生物活性部分は、上記の通り(例えば、抗原)であり得る。1つの実施態様において、一方のサブユニットは、T細胞抗原を含有し、そして他方のサブユニットは、B細胞抗原を含有する。T細胞抗原は、配列番号10、配列番号11、配列番号12、配列番号13または配列番号14で表される配列を有し得る。
本発明の関連する目的は、ポリペプチド免疫原組成物を調製する方法を提供することである。ここで、2つのコアペプチドが形成され、これらの各々は、gabcdefの形態を有する2つの末端アミノ酸反復配列およびgabcdefの形態を有するすくなくとも1つの内部アミノ酸反復配列を含有する。各末端および内部のアミノ酸反復配列のa位およびd位は、イソロイシン、ロイシンまたはバリンであり、各末端および内部のアミノ酸反復配列のe位およびg位は、一方のコアペプチドにおいてはアスパラギン酸またはグルタミン酸であり、そして他方のコアペプチドにおいてはリジン、アルギニンまたはヒスチジンである。
ペプチド抗原は、共有結合によりコアペプチドのb位、c位またはf位でアミノ酸に結合され、そして誘導された(derivatized)ペプチドは、超らせんヘテロダイマーの形成を促進する条件下で、約1:1の比で、温和培地中で混合される。
本発明のさらなる実施態様は、上記のように、α-ヘリックス超らせんヘテロダイマー組成物を形成し得る2つのサブユニットを包含する。ここで、第1のサブユニット上の抗原は、標的細胞(例えば、腫瘍細胞)に結合し得る部分により置き換えられ、そして第2のサブユニット上の抗原は、細胞傷害性部分(例えば、放射性化合物)により置き換えられる。
第1のサブユニットは、被験体に投与され、そして標的細胞に結合し得る。選択された時間間隔後、第2のサブユニットが投与され、そして第1のサブユニットとヘテロダイマーを形成し得る。このサブユニットは、好ましくは標的細胞を有意に阻害するかまたは死滅させるに効果的であるが、非標的細胞に対して最小の細胞傷害性効果を有しかつ被験体において最小の副作用を引き起こす用量で投与される。
本発明のこれらおよび他の目的および特徴は、以下の本発明の詳細な説明を添付の図面と共に読むと、より完全に認識される。
【図面の簡単な説明】
図1a〜cは、本明細書に開示される免疫原性処方物の合成およびアセンブリの模式図を示す。図1aは、2つのコアポリペプチドの模式図を示し、各々は5つのヘプタドからなる。図1bは、免疫原性ペプチドで誘導された後のコアポリペプチドを示す。図1cは、ヘテロダイマーコンフィギュレーションの2つの抗原デコレーションコアポリペプチドからなる本発明の免疫原性複合体の模式図を示す。
図2aは、平行α-ヘリックスヘテロダイマーコンフィギュレーションの2つの典型的なコアポリペプチドの末端ヘプタドのらせん状の輪の説明を示す。図2bは、逆平行α-ヘリックスヘテロダイマーコンフィギュレーションの2つの典型的なコアポリペプチドの末端ヘプタドのらせん状の輪の説明を示す。
図3a〜eは、平行コンフィギュレーションの2つのコアポリペプチドの隣接ヘプタドの模式図を示す。これは、ホモダイマー対ヘテロダイマーにおけるe位およびg位での荷電残基の安定化/不安定化効果を比較する。図3aは、ヘプタドのe位およびg位で逆の電荷を有する残基により安定化されたホモダイマーを示す。図3bは、ヘプタドのe位およびg位で逆の電荷を有する残基により不安定化されたヘテロダイマーを示す。図3cは、ヘプタドのe位およびg位で正の電荷を有する残基により不安定化されたホモダイマーを示す。図3dは、ヘプタドのe位およびg位で好適な電荷を有する残基により安定化されたヘテロダイマーを示す。図3eは、ヘプタドのe位およびg位で負の電荷を有する残基により不安定化されたホモダイマーを示す。
図4a〜cは、ヘプタドのいくつかの可能な配置の模式図を示す。このヘプタドは、超らせんヘテロダイマーを形成するように設計されたペプチド内で、それらのe位およびg位に正電荷または負電荷のいずれかを有する。図4aは、交互に正および負の電荷を有する連続ヘプタドを有するコアポリペプチドからなるヘテロダイマーの模式図を示す。図4bは、コアポリペプチドからなるヘテロダイマーの模式図を示す。このコアポリペプチドの一方は、主に正の電荷を有するヘプタドを有し、そして他方は主に負の電荷を有するヘプタドを有する。図4cは、コアポリペプチドからなるヘテロダイマーの模式図を示す。このコアポリペプチドの一方は、全て正の電荷を有するヘプタドを有し、そして他方は全て負の電荷を有するヘプタドを有する。
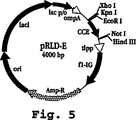
図5は、プラスミドpRLD-Eの地図を示す。
図6は、プラスミドpRLD-Eのポリリンカー領域(プロモーター、MCSおよび挿入)を示す。
図7は、プラスミドpRLD-Kの地図を示す。
図8は、pRLD-Kのポリリンカー領域を示す。
図9は、プラスミドpHIL-S1/Eの地図を示す。
図10は、プラスミドpHIL-S1/Eのポリリンカー領域を示す。
図11は、プラスミドpHIL-S1/Kの地図を示す。
図12は、プラスミドpHIL-S1/Kのポリリンカー領域を示す。
図13は、pHIL-S1/Eのポリリンカー領域中にクローン化されるPAK pili-Clをコードする配列を含有するフラグメントのヌクレオチドおよび翻訳されたアミノ酸配列を示す。
図14は、pHIL-S1/Eのポリリンカー領域中にクローン化されるMVF-Cl(はしかウイルスFタンパク質)をコードする配列を含有するフラグメントのヌクレオチドおよび翻訳されたアミノ酸配列を示す。
発明の詳細な説明
I.定義
交換可能に使用される、用語「ペプチド」および「ポリペプチド」は、アミノ酸に基づくポリアミドの鎖を示す。この鎖は、概して2個のアミノ酸から100個以上のアミノ酸まで長さが変化し得る。約100個のアミノ酸より長い鎖は、代表的には「タンパク質」と呼ばれる。さらに、用語「ヘテロダイマーポリペプチド」は、2つの会合した非同一ポリペプチド鎖をいう。
生物活性部分を含有するように「誘導された」ポリペプチドサブユニットの文脈において、用語「誘導された」は、サブユニットを形成する1つ以上のアミノ酸残基に共有結合された1つ以上の機能性部分または生物活性部分を有するポリペプチドサブユニットをいうと理解される。ここで、この部分は、(i)ポリペプチドサブユニット合成の前または後のいずれかでサブユニット中の1つ以上のアミノ酸残基にカップリングされ得るか、または(ii)(例えば、サブユニットのN-末端で)ペプチドサブユニットの伸長部を形成し得る。さらに、機能性部分または生物活性部分は、ポリペプチドサブユニットに直接、あるいはリンカーまたはスペーサー(例えば、ポリグリシンスペーサー)を介して結合され得る。
特に指示しない限り、ペプチドおよびポリペプチドに対する配列は、アミノ末端からカルボキシル末端の順序で与えられる。
本明細書中で使用される用語「エピトープ」は、同一または関連する抗原により誘起される対応する抗体(免疫グロブリン)分子との特異的相互作用を担う分子の構造成分を示す。より一般的には、この用語は、抗体を生成するために使用される抗原性タンパク質または抗原性ペプチドと同一かまたは類似の免疫反応特性(例えば、特異的抗体結合親和性)を有するペプチドという。従って、特異的ペプチド配列により形成されるエピトープは、一般的に特異的配列に対する抗体と反応性である任意のペプチドをいう。
本明細書中で使用される用語「抗原」は、抗体の産生を誘導するために使用される分子を意味する。あるいはこの用語は、特異的抗体と反応性である分子を示すために使用される。
本明細書中で使用される用語「B細胞抗原」は、抗体の産生を誘導するために使用される分子を意味する。あるいはこの用語は、特異的Bリンパ球クローンと反応性であるか、あるいは被験体または試験動物においてBリンパ球媒介免疫原性応答を誘起する分子を示すために使用される。
本明細書中で使用される用語「T細胞抗原」は、特異的Tリンパ球クローンと反応性である分子、あるいは被験体または試験動物においてTリンパ球媒介免疫原性応答を誘起する分子を示す。
本明細書中で使用される用語「免疫原」は、宿主動物において抗体産生を誘導する因子を記述する。いくつかの例では、抗原および免疫原は同一の因子であるが、他の例では2つの因子は異なる。
本明細書中で同定した全てのアミノ酸残基は、特に指示しない限り天然のコンフィギュレーションかまたはL-コンフィギュレーションである。標準的なペプチド命名法に一致して、アミノ酸残基の略語は、当該分野で通常使用される標準的な3文字コードおよび/または1文字コードである。
本明細書中で使用される用語「温和培地」は、代表的には約6と約8との間のpHおよび約50mMと約500mMとの間の塩濃度を有する生理学的に適合可能な水溶液を記述する。好ましくは、塩濃度は約100mMと約200mMとの間である。緩衝液Aとして示される典型的な温和培地は、以下の組成を有する:50mMリン酸カリウム、100mM KCl、pH7。同等に有効な温和培地は、例えば、リン酸カリウムをリン酸ナトリウムで、および/またはKClをNaClで置き換えることにより作製され得る。
II.発明の概要
1つの局面では、本発明は二つのサブユニットを有する合成ワクチン処方物であり、各々のサブユニットはコアポリペプチド(CP)および1つまたはそれ以上の抗原分子(Ag)を含有する。
コアポリペプチドは2つの同一でないポリペプチド鎖であり、代表的には約21〜約70残基の長さであり、温和培地における2本鎖のα−ヘリックスヘテロダイマー超らせんへの形成に適合したアミノ酸配列を有する。これらは、本明細書中でCP1(コアペプチド1)およびCP2(コアペプチド2)と示される。温和水性培地において、単離されたコアペプチドはランダムコイル(random coil)である。好ましくは等量で、CP1とCP2が混合される場合、これらは相互作用し、CP1-CP2と称される呼ばれる2本鎖のα−ヘリックスヘテロダイマー超らせんキャリアを形成する。
α−ヘリックス超らせん形態のペプチドは、それぞれのペプチドの一次配列により決定される特有の様式で、互いに相互作用する。α−ヘリックスの三次構造は、一次配列中の7個のアミノ酸残基が、約2巻きのα−ヘリックスに相当するようである。従って、α−ヘリックス高次構造を生じる一次アミノ酸配列は、ヘプタドと称される、各々7残基の単位に分解され得る。コアポリペプチドは、一列の一連のヘプタドを含有する。ヘプタドの配列が特定のコアポリペプチド中で繰り返される場合、ヘプタドは、「ヘプタド反復」または単に「反復」と呼ばれ得る。
以下で詳細に記載するように、それぞれのヘプタド中の規定された位置の特定の型のアミノ酸残基が、2本鎖α−ヘリックス超らせんヘテロダイマー構造を安定化するように作用する。
CP1およびCP2は、アミノ酸カップリング残基を通して異なる抗原(Ag1およびAg2)で個々に誘導またはデコレートされ得る。カップリング残基は、α−ヘリックス超らせん構造の外側、または親水性側面に位置されるような、CP1およびCP2の配列中の位置に置かれる。抗原誘導キャリアは[Ag1]i-CP1またはCP2-[Ag2]jとして設計されており、ここでiおよびjは単一コアペプチドに結合している抗原の数を示す。抗原は、コアポリペプチドに誘導される場合に、α−ヘリックスヘテロダイマー超らせん構造の形成をブロックしないように選択される。[Ag1]i-CP1およびCP2-[Ag2]jは、最終的な免疫原性構造へのアセンブリの前に精製され得る。
CP1およびCP2はまた、ポリペプチドのα−ヘリックスまたは超らせん特性を安定化するように(分子内(intra)または分子間(inter)らせんのどちらかで)反応し得る残基を含み得る。安定化する改変の1例は、コアペプチドの最初と最後(末端)の反復におけるラクタム架橋(brige)の結合である。
完全な免疫の構造は、[Ag1]i-CP1またはCP2-[Ag2]jの混合によって作成され得る。抗原誘導α−ヘリックス超らせん構造を形成するデコレートされたコアペプチド自己アセンブルは、[Ag1]i-CP1〜CP2-[Ag2]jと表示される。この構造は、抗体製造のために、またはワクチン処方物中に免疫原として使用され得る。
上記で概述した一般的な工程の説明図は、5個のヘプタド反復(段階が変化する影とともにボックスで示されている)を含むコアポリペプチド、1個のコアペプチドあたり1個の抗原結合残基、および末端反復上のラクタム架橋改変部位として図1に示される。図1の第A部は、ラクタム架橋の形成を誘導する反応条件(実施例4に詳述される)下でペプチドが合成された後のCP1およびCP2の図式を示している。第B部は、改変されたコアペプチドが抗原で誘導された(例えば実施例5に詳細に記載されるように)後のCP1およびCP2の図式を示している。第C部は、例えば実施例6で記述されるような、個々にデコレートされたペプチドを混合した後の、線状(超らせんと反対として)構造として簡単に示される、完全なヘテロダイマー免疫原複合体の図式である。
別の局面では、本発明は2個のコアポリペプチド(上述したような)からなるペプチド複合体を包含し、各々のペプチド複合体は、それに結合した生物活性部分を有する。コアペプチドに結合した生物活性部分は必ずしも抗原部分ではないが、代表的には治療または標的化機能を提供する。生物活性部分で誘導される個々のコアペプチドは、以下で述べる超らせんコンフィギュレーションで一緒に投与され得るか、または別々に投与されて、投与される動物または被験体の体内で超らせんのヘテロダイマーが形成され得る。
III.コアペプチドの特徴
二つのコアペプチド(CP1およびCP2)は類似しており、同一のサイズでなくとも、それぞれ代表的に長さが約21から約70の残基(3から10ヘプタド)の範囲である。
ペプチドは、当業者に公知の種々の方法で合成され得る。例えば、ABIモデル430Aペプチドシンセサイザーは、Hodgesら,(1988)によって以前に記載され、そして実施例1で述べられたように従来のt-Boc化学で用いられ得る。
合成に続いて、ペプチドは、当業者に公知の多くの方法のいずれか(例えば、実施例1に詳細に記載したような、逆相高速液体クロマトグラフィー(RPC)および「SYNCHROPAK」RP-Pカラムを用いて)により精製される。
ペプチドの組成および純度は、いくつかの方法で確認され得、それは、実施例1で詳述するような、Beckmanモデル6300アミノ酸分析器でのアミノ酸組成の質量分析および「BIOION-20」Nordicによる飛行時間型質量分析計を使用した分子量分析を包含する。
A.超らせん形成
CP1およびCP2のダイマー化は、保存されたアミノ酸残基の反復ヘプタドモチーフの存在に起因する。それぞれのヘプタド中の個々の位置は、図2aおよび2bに示したように、CP1に対して文字aからg、およびCP2に対して文字a'からg'により名付けられる。CP2の位置(例えば、a'位、g'位)は、以下のコアヘテロダイマー中のヘプタド位置についての一般的な考察では、(')記号なしで言及されることがある。
適切なヘプタドモチーフまたは反復は、下記のD部で示される許容条件下で、CP1およびCP2ペプチドがヘテロダイマーα−ヘリックス超らせん構造にアセンブルするように指示する。個々のα−ヘリックスペプチドは、それぞれの疎水面(各ヘプタドのa位およびd位で定義される)で互いに接触する。
CP1およびCP2は、平行または逆平行コンフィギュレーションのどちらかでヘテロダイマー超らせんヘリックス(超らせんヘテロダイマー)にアセンブルされ得る。平行コンフィギュレーションでは、2つのポリペプチドヘリックスは、同じ配向(アミノ末端からカルボキシ末端)になるように並ぶ。逆平行コンフィギュレーションでは、ヘリックスは逆に、一方のヘリックスのアミノ末端が他方のヘリックスのカルボキシ末端と並ぶように、整列される。
2つの相互作用するα−ヘリックスのa位−g位の相対的な配向の図式は、図2aおよび2bで示される。図2aは、平行コンフィギュレーションに整列される2つの典型的なコアペプチド、EEおよびKK(配列番号1および配列番号2)の最初の2巻き(1ヘプタド)のエンドオン(end-on)模式図を示している。図2bは、逆平行コンフィギュレーションで整列された同じコアポリペプチドのエンドオン模式図を示している。
本明細書で示されている指導に従って設計されたコアペプチドは、代表的に逆平行配向に対して平行配向においてわずかな優先を示す。しかし、一般に、2つのコアペプチドがα−ヘリックス超らせんを形成する配向(平行逆平行)は、コアペプチドに結合する部分と共に持ち込まれるキャリアとしての機能に、必ずしも関係しない。
図2aまたは2bでは、アミノ酸は丸で囲まれ、そして1文字コードによって示されている。そして連続したアミノ酸の位置は、数字が付され、そしてN-末端からC-末端方向を示す矢じりを有する線で結ばれている。2個のヘリックスの間の相互作用は、矢印で示されている。ヘリックス間を交差している太い矢印は、隣接するヘリックスのa位とd位との間の疎水性の相互作用を示している。
隣接するヘリックスのe位とg位との間のイオン相互作用は、ヘリックスの結合の上下の曲線矢印で示される。ペプチドEE(配列番号1)のe位は、最初および最後のヘプタドにおいてGluであり、そして内部のヘプタドにおいてGluである。この位置でのイオン相互作用を示す(下の)曲線矢印には、ダッシュラインを付し、最初のヘプタドと最後または末端のヘプタドとの間ではなく、ヘリックスの内部のヘプタド間でイオン相互作用が存在することを示す。
ラクタム架橋は、それぞれのヘリックス内のf位とb位との間の直角の線で示されている。
B. 疎水相互作用超らせん安定
ヘリックス間の疎水性相互作用はコアペプチドのa位およびd位にある疎水性残基による。ヘリックスの接触を維持するのに有効であるこの位置の残基としては、ロイシン、イソロイシン、バリン、フェニルアラニン、メチオニン、トリプトファン、チロシン、アラニンおよび上記のいずれかの誘導体が挙げられる。他が疎水性残基に占められない限り、アラニン、システイン、セリン、スレオニン、アスパラギンおよびグルタミンを含む他の残基もまた、いくつかのヘプタドのa位またはd位を占め得る。
a位およびd位を占める特定の残基の適切な選択は、本発明の重要な局面である。もし疎水性相互作用が強いと、同様に電荷を有する前記がホモダイマー生成を促進するe位およびg位に存在する場合であっても、例えば、一方の位置のIleと他方の位置のLeuとを含有するヘリックスの間の場合のように、ヘリックスの重要な画分はpH7でホモダイマーとして形成する(以下の第C部を参照のこと)。一方、a位およびd位の残基が、疎水性相互作用が非常に弱くなるように選択される(例えば両位置がAla)場合は、ヘリックスは全く超らせんダイマーを形成しなくてもよい。好ましくは、pH7で95%以上のヘテロダイマーの形成を促進する残基対が選択される。ホモダイマーに対するヘテロダイマーの形成の程度は、例えば、実施例3に述べられているように測定し得る。pH7で95%以上のヘテロダイマーの形成をもたらす疎水性相互作用を生じる、a位およびd位の残基の対の例は、一方の位置でLeuを、そして他方の位置でValを含有する。これらの残基は例示のコアポリペプチドEE(配列番号1)およびKK(配列番号2)のa位およびd位に存在する。
C.超らせんの安定性におけるイオン性相互作用
α-ヘリックスのダイマー超らせんコンフォメーションは、図3に示されるように隣接のヘリックスのe位およびg位の残基間のイオン相互作用により安定化され得る。ダイマーの各ヘリックスが、一方の位置、例えばe位に正の電荷を有する残基を有し、そして他方の位置、例えばg位に負の電荷を有する残基を有する場合、ホモダイマーの形成が優勢である(図3A;図3Bのヘテロダイマーと比較されたい)。しかし、各ヘリックスが両方の位置で同様に電荷を有する残基を有する場合、ホモダイマーの形成(図3C、3E)とは反対に、2つの反対の電荷を有するヘリックスが会合してヘテロダイマー(図3D)になる傾向がある。
溶液中のCP1およびCP2のようなポリペプチドのコンフォメーションは、溶液のCDスペクトルから決定され得る。これらのデータは、個々のペプチド自体のコンフォメーションに関する情報(ランダムコイルペプチド対α-ヘリックスペプチド)、ならびに例えば、CP1とCP2とのヘテロダイマー複合体対ホモダイマー複合体の相対的な量に関する情報を提供する。実施例2はCDスペクトルを測定する方法を詳述する。実施例3は、CDスペクトル測定がどのように溶液中のペプチドのコンフォメーションの評価に用いられるかを詳述する。
図2に示される図面において、CP1(EE;配列番号1)のe位およびg位の負の電荷を有する残基(Glu)と、CP2(KK;配列番号2)のe位およびg位の正の電荷を有する残基(Lys)から2つのヘリックス間のイオン性相互作用が生じる。しかし、ペプチドEE(配列番号1)の末端ヘプタドは、内部反復中のe位の電荷を有するGluと反対に、e位に非電荷残基(Gln)を有する。従って、EEのe位に関するイオン性相互作用は、内部反復で生じ、末端反復では生じない。
負の電荷を有する残基は、アスパラギン酸、グルタミン酸またはそれらの誘導体であり得る。正の電荷を有する残基は、リシン、アルギニン、ヒスチジン、またはそれらの誘導体であり得る。
ヘプタド中の他の位置の間でのイオン性相互作用もまたヘリックスの安定性に重要な影響を与え得る。例えば、EEキャリアペプチド(配列番号1)末端反復中のe位はGlnであり、Gluではない。なぜなら、両方の位置のGlu残基はイオン性斥力によりα-ヘリックスコンフォメーションを不安定にする傾向があるからである(図2aおよび2bを参照のこと)。しかし、ある程度の不安定化効果は、以下の第E節に記載されるラクタム架橋形成のような、安定化共有結合修飾の導入により克服され得る。
D.超らせん形成に好ましい条件
反復するヘプタドから構成され、そして上記第A節〜C節において示された教示に従って設計されたコアポリペプチドは、上記第I節において定義される温和培地中で容易に超らせんヘテロダイマーを形成する。α-ヘリックス超らせんヘテロダイマー形成の程度は、例えば実施例3に記載されるようにCDスペクトルから決定され得る。
超らせんヘテロダイマーは、温和培地について示されたpHおよび塩の範囲外の条件下において形成し得るが、ヘテロダイマー対ホモダイマーのいくつかの分子相互作用および相対的安定性は、上記で詳述した特徴と異なり得る。例えば、ヘテロダイマーを安定させる傾向を有するe位とg位の間のイオン性相互作用は、酸性のpHでは例えばGlu側鎖のプロトン化、または塩基性のpHでは例えばLys側鎖の脱プロトン化により、低pHまたは高pHで破壊され得る。
しかし、超らせんヘテロダイマーの形成に対する低pHおよび高pHの上記の効果は、塩濃度を上昇させることにより克服され得る。塩濃度を上昇させるより、安定化イオン性親和力を中和し得るかまたは不安定化イオン性斥力を抑制し得る。特定の塩は、イオン性相互作用の中和に、より優れた効力を有する。例えば、KKペプチド(配列番号2)の場合、最大のα-ヘリックス構造(実施例2に詳述されるように実施されるCD測定により決定される)を誘導するために1M以上のClO4 -陰イオンが必要とされるが、同じ効果にために3M以上のCl-イオンが必要とされる。低pHおよび高pHでの超らせん形成に対する高塩の効果はまた、ヘリックス内イオン性親和力はヘリックス形成に必須でなく、むしろ超らせんがヘテロダイマーとして形成されるかあるいはホモダイマーとして形成されるかどちらの傾向を有するかの制御に必須であること示す。
E.コアポリペプチドにおけるヘプタド変異
上記の第A節、第B節および第C節は、典型的に、温和培地でα-ヘリックス超らせん構造を形成するコアペプチドを生じるコアペプチドのヘプタド中の特異的位置において、包含され得るアミノ酸残基、および好ましいアミノ酸残基に関するガイドラインを表す。本節は、上記第A節〜第C節で表されるガイドラインの通りの配列を有するヘプタドをコアポリペプチド内に配置し得るいくつかの実施例を記載する。
本発明のコアポリペプチドはそれぞれ、3〜多数のヘプタドを含有し得る。それらのヘプタドのそれぞれの配列は、全て同じであり得るか、またはこれらは異なり得る。特に、最初および最後のヘプタドの配列、または末端反復は、内部または中間ヘプタドまたは反復の配列とは異なり得る。さらに、内部反復の配列は、例えば、この反復がアミノ酸カップリング残基を組み込むかどうかに依存して、互いに異なり得る。
例えば、ペプチドEE(配列番号1)は全体で5つのヘプタド反復を有する。この2つの末端反復は、配列番号3により表される配列を有し、そして3つの中間反復は、配列番号4および配列番号5により表される配列を有する。配列番号5により表される配列は、中央反復に存在し、システインカップリング残基の存在による内部反復配列(配列番号4)とは異なる。ペプチドKK(配列番号2)もまた、全体で5つのヘプタド反復を有し、そしてこの反復はペプチドEEの反復に相同な様式で配置される。KKの2つの末端反復は、配列番号6によって表される配列を有し、そしてこの3つの中間反復は、配列番号7および配列番号8によって表される配列を有し、配列番号8によって表される配列はシステインカップリング残基を含む。
EEおよびKKペプチドの両方の末端反復は、ラクタム架橋を形成するように設計した残基を組み込んで、α-ヘリックスコンフォメーションを安定化させる。両方のペプチドの中央内部反復は、アミノ酸カップリング残基(システイン)を含有し、そして「ペプチド連結内部反復」と名付けられる。
ヘプタド配置における多くの他の変異が可能である。例えば、1つのコアポリペプチドの規定された位置で異なる化合物をカップリングするために、異なるアミノ酸カップリング残基を有するコアポリペプチドを各中間反復に設計することが好適であり得る。このストラテージは、第G節でより詳細に議論されている。あるいは、独特なカップリング残基を1つまたは両方のコアペプチド上の反復の1つに配置して、これらを樹脂または別のポリペプチドに固定する(anchor)ことが可能である。
α-ヘリックス超らせんヘテロダイマーの対において2つのコアポリペプチド間の顕著な相互作用は、各ペプチド中の隣接の「コンプリメンタリー(complimentary)」ヘプタド間に存在するため、コアポリペプチド内のヘプタドの一次配列は、各ヘプタド内の残基が第2のポリペプチドのコンプリメンタリーヘプタド中の残基と都合よく相互作用する限り、変化し得る。
続いて、隣接のヘプタドは、配列内で変化し得、それにより、例えば、コアポリペプチド上の正味電荷は、α-ヘリックスヘテロダイマー超らせんを形成するポリペプチドの能力に影響を与えることなく、改変され得る。この関係は、図4に説明されている。この図はCPダイマー対の3つの例を示す。各コアポリペプチドは5つのヘプタドを有する。各ヘプタドにある+または−符号は、それぞれ、2つの電荷を代表する(1つはe位にあり、もう1つはg位にある)。隣接のコンプリメンタリーヘプタドは反対の電荷を有することに注目すべきである。この例のために、各ヘプタドのe位およびg位以外の位置で合計するとゼロの正味電荷となると仮定する。図4A中のダイマーを形成するCP1およびCP2は、それぞれ、+2および−2の正味電荷を有し、これらは、それぞれ、過剰の1つの正の電荷を有するヘプタドおよび過剰の1つの負の電荷を有するヘプタドに起因する。同様に、図4B中のCP1およびCP2は、それぞれ、+6および−6の正味電荷を有し、そして図4C中のCP1およびCP2は、それぞれ、+10および−10の正味電荷を有する。この課題に対する他の改変は、もちろん、本発明の精神を逸脱することなく、可能である。
ペプチドEE(配列番号1)およびKK(配列番号2)は、図4Cに概略されている状況に類似し、すなわち、ペプチドEEを含む全てのヘプタドのe位およびg位は正味負電荷を有するのに対して、ペプチドKKを含む全てのヘプタドのe位およびg位は正味電荷を有する。
F.コアポリペプチドの共有結合修飾
コアポリペプチド配列はまた、超らせん(coiled-coil)ダイマーにおいて各コアポリペプチドのα-ヘリックスコンフォメーションを安定化させるために設計された残基を含み得る。例えば、ペプチドEEおよびKKは、それぞれ末端反復のb位およびf位のグルタミン酸残基およびリジン残基を有する。これらの残基は、実施例4に詳述した適切な条件下で反応して、図1に概略したようなラクタム架橋を形成し得る。これらの位置のラクタム架橋は、α-ヘリックスコンフォメーションを安定化する。
G.コアポリペプチドにカップリングする生物活性部分
本発明の他の局面は、1つまたはそれより多いヘプタド(heptad)のb位、c位および/またはf位のアミノ酸カップリング残基の組み込みを包含する。これらの位置は、超らせんヘテロダイマーの外表面に沿って存在する。各ヘプタドは3つまでのカップリング残基を含み得る。
種々の実施態様が可能である。例えば、アミノ酸カップリング残基は、末端反復配列ではなく、内部反復配列中に組み込まれ得る。さらに、カップリング残基は、各ヘプタドにおける3つの全ての位置で、3つのうちの2つの位置で、または1つのみの位置(例えばf位)で、同時に組み込まれ得る。典型的実施態様(EE、KKペプチド;配列番号1および2)では、カップリング残基は、各コアポリペプチドの中央のヘプタドのf位に位置するシステインである。
好ましいカップリング基は、システイン残基のチオール基であり、これは標準的方法により容易に修飾される。実施例5は、ペプチドEE(配列番号1)およびKK(配列番号2)のペプチド結合内部反復中に存在するシステインのチオール基が、これらの位置の抗原性ペプチドを結合するためにどのように用いられ得るかを詳述する。他の有用なカップリング基としては、メチオニンのチオエステル基、ヒスチジンのイミダゾリル基、アルギニンのグアニジニル基、チロシンのフェノール基、およびトリプトファンのインドリル基が挙げられる。これらのカップリング基は、当業者に公知の反応条件を用いて、実施例5に詳述したと同様の方法で誘導され得る。
上記の第E部に記載したように、コアポリペプチドを含む種々のヘプタド中の種々のアミノ酸カップリング残基を組み込むことが所望であり得、所望の位置に単一のコアポリペプチド上の種々の抗原を結合させ得る。コアポリペプチドは、一連のカップリング反応を行うことにより、種々の抗原で連続的にデコレーションされ得る。単一の抗原は、所定の反応工程においてコアポリペプチドにカップリングされる。抗原が約40アミノ酸よりも少ないペプチドである場合、代表的には、抗原性ペプチドとコアポリペプチドとの間のスペーサーを加えることが望ましい。スペーサーは、例えば、2〜5のアミノ酸を含み得る。2つの典型的なスペーサーは(1つはTT2ペプチド、配列番号12、および他はPAKペプチド、配列番号18)は、実施例5に詳述されている。
本発明の好ましい実施態様では、生物活性部分は、アミノ酸スペーサーを介してカップリング残基に連結されたペプチド抗原である。
本発明の他の局面では、抗原のような生物活性部分は、b位、c位、および/またはf位でアミノ酸残基を介してコアポリペプチドにカップリングし得るのではなく、むしろコアポリペプチド中に直接またはコアポリペプチドのいずれかの末端で(例えば、N-末端またはC-末端で)カップリングし得る。このようなカップリングは、合成アプローチまたは組換えアプローチのいずれかを用いて行われ得る。組換えアプローチでは、コアポリペプチドおよび生物活性部分(例えば、抗原性ペプチド)をコードするポリヌクレオチド配列は、当業者に公知の方法(例えば、Maniatisら、Ausubelら)を用いて適切な発現プラスミド中に加工される。1つの実施態様では、次いで、コアポリペプチドまたは生物活性部分と縦に並ぶコアポリペプチドを含む融合ペプチドが、適切な発現系におけるプラスミドの発現を誘導し、そして発現された融合タンパク質を精製することによって生成され得る。
発現プラスミドは、代表的には、以下のエレメントを含む:複製起点(ori)、選択標識(例えば、アンピシリン;Amp-R)、プロモーター(例えば、lacプロモーター/オペレーター;lac p/o)、マルチクローニング部位(MCS)、および転写ターミネーター。プラスミドは、多くの他のエレメント、例えば、シグナルペプチド配列(例えば、ompA)、fl ori、組換えタンパク質の精製を容易にするためのフラッグまたはアフィニティ−配列(例えば、Hisテイル)などを含み得る。
図5〜12は、本発明の実施に有用な組換えポリペプチドを生成するに適切な4つの典型的なプラスミドのマップ(図5、7、9、および11)およびポリリンカー領域(図6、8、10、および12)を示す。図5は、プラスミドpRLD-Eのマップを示し、これはポリリンカー部位をpHIL-S1およびPIC9(pHIL-S1およびPIC9は両方ともInvirogen、San Diego、CAから市販されている)のポリリンカーに対応させるために変化させることによりpASK40(Skerraら)から修飾されたE.coli発現プラスミドである。図6は、pRLD-Eのポリリンカー領域(プロモーター、MCS、およびインサート)を示し、これは、pRLD-Eが、E-らせんペプチド(配列番号20)をコードするポリヌクレオチド配列(配列番号19)を含み、5-残基のHisテイルと縦に並ぶEE内部反復(配列番号3)の5つの反復を含むことを示す。
図7は、プラスミドpRLD-Kのマップを示し、これは、K-らせんペプチド(配列番号22)をコードするポリヌクレオチド配列(配列番号21)を含み、5-残基のHisテイルと縦に並ぶKK内部反復(配列番号7)の5つの反復を含むこと以外は、pRLD-Eと同一である(図8)。
図9は、プラスミドpHIL-S1/Eのマップを示し、これは、シグナル切断部位、ポリグリシンスペーサー(8グリシン)をコードする配列、E-らせんペプチド(配列番号20)をコードする配列(配列番号19)、他のポリGlyスペーサー、およびHisテイル(図10)をpHIL-S1(Invitrogen)のEcoRI/BglII部位に含むEcoRI/BamHIフラグメントをクローニングすることにより構築された酵母(例えば、Pichia pastoris)の発現プラスミドである。図11は、プラスミドpHIL-S1/Kのマップを示し、これは、インサートがE-らせんペプチドの代わりにK-らせんペプチド(配列番号22)をコードするヌクレオチド配列(配列番号21)を含むこと以外は、pHIL-S1/Eと同一である(図12)。
図13および14は、本発明のワクチン組成物および方法に使用するに適切な組換えポリペプチドを作成するための典型的な融合構築物インサートフラグメントのヌクレオチドおよび翻訳されたアミノ酸配列を示す。図13のフラグメント(配列番号23)は、pHIL-S1/Eのポリリンカー領域における8グリシンをコードする配列の上流にクローニングされたPAK抗原(PAK 128-144;配列番号18、配列番号26)をコードするヌクレオチド配列(配列番号25)を含む。このようなフラグメントから、対応するデコレーションされた(decorated)ペプチドと組み合わせて生成された融合ポリペプチドは、Pseudomonas aeruginosaに対するワクチン組成物として特に有用であり得、そして例えば、実施例8のプロトコルを用いてこのような使用のために評価され得る。
図14のフラグメント(配列番号27)は、pHIL-S1/Eのポリリンカー領域における8グリシンをコードする配列の上流にクローニングされたMVF T抗原(麻疹ウイルスFタンパク質;領域288-302;配列番号15、配列番号30)をコードするヌクレオチド配列(配列番号29)を含む。
上記のような発現プラスミドは、細菌または酵母のような適切な宿主細胞に形質転換され得、そして組換えポリペプチドを生成するように誘導され得、次いでこれは、当業者に公知の方法を用いて精製され得、そして本明細書に詳述されるような使用に用いられ得る。上記のようなポリHisテイルを含む融合ポリペプチドは、固定化金属イオンアフィニティークロマトグラフィー(IMAC;Hochuli;Porath)によって好都合に精製され得る。
pHILおよびpPIC由来のベクターは、組換えポリペプチドの高レベルの発現に特に適切である。これらは、Pichia pastoris宿主細胞に特に有用であるメタノール調節アルコールオキシダーゼ(AOX)プロモーターを用いる(例えば、AOXプロモーターは、Invirogen、San Diego、CAから入手可能なPachia発現キットに含まれるpHILおよびpPICベクターに用いられる)。プラスミドは、Pichia pastoris(GS115株;Invitrogen)のスフェロプラストを形質転換するために用いられ、そして形質転換された細胞は、製造者の指示に従って組み換えポリペプチドを生成するために用いられる。
pRLD由来ベクターはまた、本発明の組換えポリペプチドの発現に用いられ得る。プラスミドは、E.coli細胞(例えば、JM83細胞)を形質転換するために用いられ、細胞はイソプロピル-β-チオガラクトピラノシド(IPTG)を用いて誘導され、外膜は破壊され、そして周辺膜タンパク質は単離されて精製用のNi+ IMACカラム(Hochuli;Porath)を通過させる。
上記のように精製された組換えタンパク質は、本発明の実施のこのようなタンパク質を使用する前に、当業者に公知の方法を用いて(例えば、本明細書に記載の合成生成ペプチドについて用いられるように)、さらに精製および/または修飾され得る。
種々の生物活性部分がキャリアポリペプチドと縦に並んで発現され得、そのため、単一のポリペプチド鎖を形成してデコレーションされたペプチドを形成する。これらは、図13および14に示す構築物中に例示されるようなワクチン組成物としての使用のための抗原、ならびにクローン化された抗体のような他のポリペプチドを含む。抗体は、例えば、病原体(P. aeruginosa)に対するか、または特定の薬物(例えば、腫瘍組織)により標的される組織で発現される抗原に対するものであり得る。病原体に対するクローン化されたヒト抗体は、代表的にはヒトで用いられる場合に免疫応答を生じないので、特に有用であり得る。
選択された特異的部分は、その適用に依存し、そして本明細書のガイダンスに従って当業者により容易に決定され得る。本発明の適切な適用には、結合アッセイに使用するための送達システム(例えば、一方のサブユニットが抗体を含み、そして他方がアルカリホスファターゼ(AP)またはβ-ガラクトシダーゼのような検出部分を含む)、ワクチン組成物用の送達システム、およびアフィニティータンパク質精製システム(例えば、カラムに誘導された1つのサブユニットおよび所望のポリペプチドに対する抗体を含む他のサブユニットとともに)がある。
上記の組換え方法で用いられる典型的なキャリア分子CP1およびCP2は、E-らせんペプチド(配列番号20)およびK-らせんペプチド(配列番号22)である。これらは、E-らせんペプチドおよびK-らせんペプチドが、それらの末端に「末端」反復を含むよりも「内部」反復を独占的に含むが、EE(配列番号1)およびKK(配列番号2)ペプチドに匹敵する特徴(らせん-らせん形成に好都合な条件など)を有する点で、それぞれEEおよびKKペプチドとは異なる。
H.抗原デコレーションされたヘテロダイマーの生成
個々の抗原デコレーションされたコアペプチドは、実施例1に記載のように精製され、沈澱され、そして標準的方法により凍結乾燥され得る。抗原デコレーションされたヘテロダイマーは、[PAK]l-KK([PAK]-KK)およびEE-[TT2]l (EE-[TT2])でデコレーションされたコアポリペプチドについて実施例6に記載のように、精製[Ag1]i-CP1を精製CP2-[Ag2]jと混合することにより生成され得る。
ペプチドを、個別に温和培地(例えば、緩衝液A)に約0.25mMと0.5mMとの間の濃度で再懸濁する。溶液に懸濁されたほぼ等量の各ペプチドを合わせ、そして室温で5分間〜10分間反応させる。超らせん対ランダム配向におけるペプチドの画分を、実施例2に記載のようにCD測定を用いてアッセイする。代表的には、総タンパク質の90%以上がα-ヘリックスヘテロダイマーの超らせんコンフォメーションに存在する。
あるいは、ペプチドの凍結乾燥混合物の等部分が、混合され得、そして温和培地に再懸濁され得る。
IV.ワクチン開発の有利点
ワクチン開発に関する本発明の重要な特徴は、(i)多数の個々の抗原性ポリペプチドを含む2つまたはそれより多い種々のタイプの抗原が、十分に規定された構造の1つの免疫原性高分子に組み込まれ得ること、(ii)その成分が合成され、合成の各工程での組成物についてのコントロールを考慮して、それらのアセンブリの前に均一にまで精製され、そして純粋な十分に規定された産物の生成を可能にすること、および(iii)高濃度の抗原が比較的少ない容量で達成され得ることを包含する。
これらの特徴は、有効かつ再生可能なワクチンの設計に有利である。
有効なワクチンは、強い免疫応答を誘起しなければならない。強力かつ延長された保護を与える免疫応答を誘起するために、Bリンパ球およびTリンパ球(B細胞およびT細胞;Benjaminら)の両方を刺激することが望ましい。B細胞はその表面上の特異的免疫グロブリン(Ig)レセプターに結合する循環抗原に応答するが、T細胞は抗原提示細胞(APC)により内在化され、プロセシングされ、そして適切に提示される抗原に結合することによって刺激される。APCは、適切なT細胞レセプター複合体を有するT細胞による認識のため、主要組織適合性遺伝子複合体(MHC)に結合した抗原フラグメントとして、その表面上に外来抗原を提示する(Abbasら)。
B細胞およびT細胞エピトープは、たとえ両方とも同じ免疫原性分子に由来し得ても、代表的には、同一ではない(Benjaminら)。有効なT細胞抗原は、通常両親媒性ヘリックスであり、おそらく疎水性面がMHCタイプIIにおける溝と良好に相互作用し、そして親水性面がT細胞レセプターとの相互作用についての細胞外培地に曝されるためである(Berzofsky)。
最強の免疫応答は、B細胞がAPCとして機能する場合に上昇される。これは、極めて接近したB細胞およびT細胞をもたらし、両細胞タイプにより放出され、「記憶」細胞を増殖および生成するように細胞を刺激するサイトカインの有効性を増加させる。
適切なIg抗体を提示するB細胞は、外来抗原性分子上でB細胞抗原と結合し、この分子を内在化し、それをプロセシングし、そして適切なヘルパーT細胞による結合のためのMHCタイプIIと関連するT抗原フラグメントを提示する。
天然の抗原分子は、代表的には、B細胞抗原およびT細胞抗原を含み、したがって強い免疫応答を誘起し得る。しかし、特にヒトワクチンにおいて抗原として未処理のタンパク質を使用するにはいくつかの不利点がある。これらは、(i)密接に関連した株の病原体のうち変化しやすい(したがってワクチンの有効性を低下させる)抗原性分子の一部に対する抗体を生成する機会、および(ii)内因性タンパク質中の1つに類似し、したがって自己免疫応答を発生する危険性を上昇させるエピトープに対する抗体を生成する機会を包含する。さらに、大量かつヒトでの使用に十分な純度の未処理のタンパク質を得ることは困難である。病原性生物から単離された粗抗原の精製は、退屈で費用がかかり、そして精製に関連する個体の感染の危険性がある。多数の個体のワクチン接種に必要とされる量の組換えタンパク質を採取し、そして精製するための細菌または酵母の大規模培養は、実施不可能である(Good)。
本発明は、強い免疫応答を誘起するための未処理の抗原性分子の使用の代替を提供する。本発明の1つの方法によれば、例えば、B細胞エピトープを含む合成ポリペプチドは、CP1に誘導され、そして例えば、T細胞エピトープを有する合成ポリペプチドは、CP2に誘導される。デコレーションされたポリペプチドは精製され、そして混合されて目的のエピトープによりその外膜表面上にデコレーションされた安定なヘテロダイマー超らせん構造を形成する。
したがって、本発明により製造されたワクチン処方物は、十分に特徴付けされた有効なB細胞抗原ペプチドを、単一分子にカップリングした所定の有効なT細胞抗原ペプチドとともに組み込み得る。抗原が、予め規定された分子配向、およびバッチからバッチへ本質的に非変異である化学量論比で存在するので、このような処方物は、非常に再生可能である。
本発明の有利点には、正確な構造が公知であることがあり、それ自体が抗原性であり、組織刺激または他の望ましくない反応を生じ得る夾雑物がなく、抗原の正確な量および配向が公知であり、抗原がキャリア上に対称的に分布され、成分が最終のアセンブリの前に均一に独立して精製され得、そしてキャリアが1より多い抗原についてのベースとして利用され得、そのため多価ワクチンが生成され得る。キーホールリンペットヘモシアニン、破傷風菌トキソイド、およびウシ血清アルブミンのような天然のキャリアを用いる以前のシステムとは異なり、本発明のキャリアは、抗原が公知の配向および化学量論比で誘導される十分に規定された化学因子である。
本発明は、現在の免疫原性処方物およびワクチンの上記同定された欠点を示し、さらに十分に規定された空間的配向および化学量論比において2つの異なる生物活性部分をアセンブルしそして提示する一般的方法を提供する。
V.ペプチド抗原の選択
本発明の好適な実施態様では、コア分子に連結された物質は、抗体の産生またはワクチンの開発に用いられるべき抗原性処方物の構築について、抗原性ペプチドである。典型的な実施態様では、本発明は、1つのコアポリペプチドに連結されたB細胞抗原(例えば、CP1)、および他のコアポリペプチドに連結されたT細胞抗原(例えば、CP2)を包含する。
A.B細胞抗原
有効なワクチンは、ワクチン接種された個体におけるB細胞により病原体のエピトープに対する抗体の産生を生じる。いくつかのエピトープは、他よりも抗原性であり、そして病原体を不活性化するに有効な強力な抗体の産生を容易に刺激する。特定の抗原性B細胞エピトープ、および病原体を著しく阻害するエピトープの同定は、供給源の利用可能性に依存する。しかし、このような同定の技法は、当業者に周知である。いくつかの例を以下に列挙する。
病原体の特定の抗原性タンパク質をコードするDNAがクローニングされているる場合、タンパク質抗原性決定基をコードするようである単離された配列の領域を同定するための多くのコンピュータプログラムの1つを使用することが可能であり得る。(例えば、Hoppら;「ANTIGEN」、Intelligenetics、Mountain View CA)。
感染した個体からの血清が入手可能である場合、反応性のタンパク質またはペプチドを同定するために、本発明の材料および方法の項に記載のようなELISAアッセイを用いて、血清を別々にまたは混合してスクリーニングし得る。
疾患または苦痛についての動物モデルが存在する場合、モデル動物に投与された病原体の毒性混合物の感染性を中和する抗体の能力について、病原体の所定のタンパク質またはペプチドに対して生成された抗体をスクリーニングし得る。
有効な抗原はまた、疾患のサイクルにおける特定の宿主-病原体相互作用に関連する病原体タンパク質の領域として同定され得る。これは、特に、疾患または苦痛についての細胞モデルが存在する場合、例えば、Pseudomonas aeruginosa感染についての場合に当てはまる。Hodgesら(1993)により証明されるように、細胞外酵素(exoenzyme)S(Exo S)由来のペプチド、P. aeruginosa細胞の表面に存在するADPリボシルトランスフェラーザ活性を有する細菌トキシン、およびこれらのペプチドに対する抗体は、P. aeruginosaおよび他の微生物の気管上皮細胞(TEC)および頬上皮(BEC)への接着をブロックするに有効である。Exo Sペプチド抗原は、配列番号9により示される配列を含む。
有効なB細胞抗原であるペプチドおよびそれぞれの生物に対して防御するのに設計されたワクチン処方物に用いられ得るペプチドの他の例には、麻疹Fタンパク質由来のMVFペプチド(残基288-302;配列番号15;配列番号30)、HBVペプチド(肝炎T抗原;配列番号16)、P. vivax CSPタンパク質由来のCSPペプチド(残基317-336;配列番号17)、およびPAKペプチド(P. aeruginosa株 K pilin抗原、残基128-144;配列番号18、配列番号26)が挙げられる。
いくつかのBリンパ球が特定の抗原と直接相互作用しているが、B細胞の大部分、および全ての記憶B細胞は、それらが抗体分泌へ分化され得る前に、T細胞との協同を必要とすることが見出されている。本発明の局面に関連するので、得T細胞およびT細胞抗原の簡単な要約を以下に示す。
B.T細胞抗原
多くの場合、病原体エピトープは、その接近容易性、種々の病原性株間の構造の不変性、または病原体の生活環の独特の役割のための、ワクチンにより標的するに十分に適しており、特別に抗原性ではない。これらのエピトープの抗原性は、破傷風菌トキソイドのような非常に免疫原性のキャリアタンパク質にカップリングすることにより上昇され得る。不運にも、このストラテジーは、臨床治験において一様に成功していない(Etlingerら)。1つの理由は、キャリアタンパク質がそれ自体、他のワクチンのキャリアとしてまたはそれ自体ワクチンとして(例えば破傷風菌トキソイド)のいずれかで、個体の以前のワクチン接種に用いられ、そしてエピトープの抑制を生じたことであり得る。エピトープの抑制は、キャリアタンパク質での予備免疫がキャリアタンパク質に結合した新しいエピトープに対する続いての抗体応答を阻害し得る場合に生じる(Herzenbergら)。抗原性キャリアタンパク質由来のペプチドを用いることにより、未処理のキャリアタンパク質とは反対に、エピトープの抑制は好都合になり得る。「ヘルパー」ペプチド(Francisら)と命名されたこのような特定のペプチドは、既にプライムされたヘルパーT細胞により認識されるが、抑制の原因である細胞による認識されないようである(B細胞およびサプレッサーT細胞)。
いくつかのヘルパーペプチドは、B抗原と組み合わせて、クラスII MHCの1つのみまたは2〜3の対立遺伝子に遺伝学的に制限される免疫応答を誘起する。MHC「制限」のこの現象は、T細胞が天然のタンパク質を認識しないが、タンパク質抗原のプロセシングされた形態を認識するという事実から起こる。得られるフラグメントはT細胞自体と同じハプロタイプを有する細胞の表面上に存在しなければならないが、異なるハプロタイプを有する細胞上に存在しない。最近のデータは、いくつかのT抗原性ペプチドが広範囲のMHCハプロタイプとの相互作用を許容することを示す(Hoら)。特に、破傷風菌トキソイド由来のペプチドは、代表的にはT細胞の刺激に非常に有効である。
これらのペプチドには、TT0ペプチド(破傷風菌トキソイド残基88-99;配列番号10)、TTペプチド(TT12としても呼ばれる、破傷風菌トキソイド残基580-599;配列番号11)、TT2ペプチド(P2としても呼ばれる;破傷風菌トキソイド残基830-846;配列番号12)、TT1ペプチド(TT21としても呼ばれる;破傷風菌トキソイド残基916-932;配列番号13)、およびTT3ペプチド(P30としても呼ばれる;破傷風菌トキソイド残基947-967;配列番号14)が挙げられる。
本発明の方法によれば、適切なB細胞抗原を、広範囲のMHCハプロタイプと相互作用し得る抗原性T細胞抗原と組み合わせて利用することにより、有効なワクチン処方物が構築され得る。このような1つの典型的な処方物が以下のVI項で同定される。
VI.代表的なキャリア/抗原の組み合わせ
本発明の代表的なワクチン組成物は、KK(配列番号2)コアペプチドと結合したPAKペプチド(配列番号18;B細胞抗原)、およびEE(配列番号1)コアペプチドと結合した破傷風菌トキソイドペプチド(TT2、配列番号12;T細胞抗原)を含有する。
PAKペプチド(配列番号18)は、効果的なB細胞抗原として既に同定されている(Wongら、1992)。このペプチドにより形成されるエピトープは、Pseudomonas aeruginosa K株特異的モノクローナル抗体PK99Hにより認識される。この抗体は、頬および気管の上皮細胞に対するピリ線毛に媒介される接着をブロックする(Wongら、1992)。
TT2ペプチド(配列番号12)は、Panina-Bordignonら(1989)による研究に基づいてT細胞抗原として選択された。これらの著者らは、TT2ペプチドならびにTT3ペプチド(配列番号14)は、それらのMHCハプロタイプに関わりなく全ての感作された(primed)(ヒト)ドナーにより認識されるので、これらは、普遍的に免疫原性であることを示した。
EE(配列番号1)コアペプチドおよびKK(配列番号2)コアペプチドは、代表的なCP1コアポリペプチドおよびCP2コアポリペプチドである。両方のペプチドは、それらのa位にVal残基を、そしてそれらのd位にLeu残基を含有し、超らせんヘテロダイマーを安定化するのに効果的であるが、しかしホモダイマー間の静電斥力に打ち勝つほど強くない疎水性相互作用を確実にする。
EE内部反復(配列番号4、配列番号5)のe位およびg位は、Glu残基を含有し、それに対して、KKの末端(配列番号6)および内部反復(配列番号7、配列番号8)の両方のe位およびg位は、lys残基を含有する。EEおよびKKのコンプリメンタリーヘプタド内の対応位置での逆の電荷は、α−ヘリックス超らせんヘテロダイマーを安定化し、これは上記の第III節、第C部および第D部に記載されており、そして図3a〜3eおよび図4に示されている。
類似の方法で、e位およびg位の荷電基は、ホモダイマーの形成を防止し、ホモダイマーを不安定にする。本発明の1局面によれば、この不安定化は、a位およびd位の適切に選択された残基の間に存在する疎水的相互作用に打ち勝つのに十分に強い。これは、ヘテロダイマーおよびホモダイマーの両方の形成に有利である。
両方のペプチドの末端反復は、b位にGluを含有し、そしてf位にLysを含有し、これらは、ヘリックス内のラクタム架橋を形成し得る。ラクタム架橋は、例えば、実施例4に詳述した反応条件下で形成され得る。この架橋は、直角を形成し、そして各α−ヘリックス内のb位およびf位を連結する直線として図2aおよび図2bに図式化され、実施例4に詳述した適切な条件下で形成された場合、α−ヘリックスコンフォーメーションを安定化する。
両ペプチドのペプチド結合内部反復(配列番号5(EE)および配列番号8(KK))は、f位にCysを含有する。これらのシステインのチオール基は、例えば、実施例5に詳述したプロトコルを用いて、抗原性ペプチドをコアポリペプチドに結合するために用いられる。B細胞抗原性ペプチドであるPAK株線毛(pilin)抗原ペプチド(配列番号18)は、KKペプチド(配列番号2)の内部反復のCys残基に結合され、一方、破傷風菌トキソイド由来のTT2ペプチド(配列番号12)は、EEペプチド(配列番号1)の内部反復のCys残基に結合される。
代表的なワクチンの別のセットは、上記の組換えにより産生された融合ペプチドを含有する。例えば、図13に示されるようなコードされたポリペプチドは、Eらせんキャリアペプチドに結合されたPAK抗原を含有する。融合タンパク質は上記のように発現および精製され得、そして抗原デコレーションされたコアペプチド(上記のように)として、コンプリメンタリー(例えば、KらせんまたはKKに基づく)抗原デコレーションされた(例えば、T抗原)コアペプチドとともに用いられて、ワクチン組成物を製造し得る。デコレーションされたコアペプチドを混合するための条件は、上記で用いた通りである。
VII.抗体および免疫
A.抗体
別の局面では、本発明は、本発明のポリペプチド処方物に対する特異的抗体の産生を包含する。抗体を調製するために、宿主動物(例えば、ウサギ)を、本発明のポリペプチド処方物で免疫する。適切な時間をおいた後に宿主の血清または血漿を採集し、そしてこの血清を抗原に対して特異的な抗体について試験する。免疫した動物のIgG抗体のγグロブリン画分は、例えば、飽和硫酸アンモニウムまたはDEAE「SEPHADEX」、またはポリクローナル抗体を産生するために当該分野で公知の技術の使用により、得られ得る。
あるいは、本発明の抗原性処方物は、モノクローナル抗体を産生するために用いられ得る。ここで、免疫した動物由来の脾臓またはリンパ球を取り出し、そして不死化するか、または当該分野で公知の方法によりハイブリドーマを調製するために用いる。
実施例7は、[PAK]-KK〜EE-[TT2]合成ワクチン処方物中のPAK抗原性ペプチド(配列番号18)に対して特異的であるマウス抗体の産生を記載する。
B.ワクチンおよび中和抗体
ワクチンは、本発明の方法により合成した免疫原性ポリペプチドを用いて調製され得る。ワクチンとして有用であり得る潜在的な抗原を同定する1つの方法は、中和抗体をもたらす抗原をスクリーニングすることによる。これを達成するためのプロトコルは、当該分野で周知である。簡略に述べると、潜在的に抗原性の処方物を用いて適切な動物(例えば、ウサギ)において抗体を調製する。次いで、抗体または抗体含有血清を動物から単離し、そして抗体が設計された病原体の毒性の混合物とインキュベートする。次いで、混合物の病原性を適切なアッセイ系(例えば、モデル動物または感受性の細胞培養)において評価し、そしてアジュバントまたはキャリアのみとインキュベートした病原性混合物の(ポジティブコントロール)病原性と比較する。中和抗体は、病原性混合物の感染の可能性を著しく減少させる。良好な中和抗体を産生する抗原性ポリペプチドは、効果的な免疫原性ポリペプチドと考えられる。
活性成分として免疫原性ポリペプチドを含有するワクチンは、代表的には、溶液または懸濁液として注射可能なように調製される。さらに、免疫原性ポリペプチドは、注射前に水性の形態に再懸濁するのに適している固体または凍結乾燥の状態で調製され得る。免疫原性ポリペプチドはまた、リポソームに乳濁またはカプセル封入される。ポリペプチドは、しばしば、ポリペプチドと適合性である薬学的に受容可能な賦形剤と混合され得る。このような賦形剤は、以下のものおよび以下の組み合わせを包含するが、これらに限定されない:生理食塩水、水、糖(例えば、デキストロースおよびソルビトール)、グリセロール、アルコール(例えば、エタノール)、および当該分野で公知の他のもの。さらに、ワクチン調製物は、少量の他の補助物質(例えば、湿潤剤、懸濁剤(例えば、界面活性剤)、およびpH緩衝剤)を含有し得る。さらに、ワクチン調製物の有効性を増大し得る多くのアジュバントが利用可能である。このようなアジュバントの例は、以下を包含するが、これらに限定されない:N-アセチル-ムラミル(muranyl)-L-トレオニル-D-イソグルタミンおよびN-アセチル-ノル-ムラミル(muranyl)-L-アラニル-D-イソグルタミンを包含する関連化合物の群、ならびに水素化アルミニウム。
ポリペプチドは、通常、中性または塩の形態でワクチンに処方される。薬学的に受容可能な有機塩および無機塩が、当該分野で周知である。
他の可能な処方物は、経口処方物および坐薬処方物を包含する。経口処方物は、通常、賦形剤(例えば、調剤用糖、サッカリン、セルロースなど)を用い、そして通常、10〜98%の免疫原性ポリペプチドを含有する。経口組成物は、丸薬、カプセル、錠剤、溶液、懸濁液、粉剤などの形態をとり、そして持続放出または長期放出を可能にするように処方され得る。坐薬処方物は、従来の結合剤およびキャリアを用い、そして代表的には0.1〜10%の間の免疫原性ポリペプチドを含有する。
ワクチンの一例は、上記の第VI節に記載の[PAK]-KK〜EE-[TT2]ポリペプチド免疫原を含有する組成物である。この免疫原は、実施例8に記載のような配列番号18により形成されるエピトープに対して生成される抗体と抗原交差反応する表面タンパク質を有する微生物による感染に対するワクチンとして用いられる。
上記の情報を考慮して、種々の抗原に対する多価ワクチンが生成され得る。
本発明のワクチンは、処方方法に適合する投与量で投与され、そしてこのような量は、予防処置または治療処置に薬理学的に有効である。投与される免疫原の量は、処置される被験体、抗体合成のために被験体の免疫系を処置する能力、および予防の所望レベルに依存する。投与される量は、投薬管理者(administering health care professional)により規定的に決定される。
本発明のワクチンは、単回用量または多回用量で投与され得る。投薬計画はまた、処置被験体の必要性および耐性に関係して決定される。
VIII.有用性
本発明の方法に従って製造される組成物は、多くの用途に用いられ得る。いくつかを以下に記載する。
本発明の1局面によって設計されたポリペプチドは、抗原性物質または選り抜きのポリペプチドと共に誘導された一般免疫キャリアとして用いられ得る。一般免疫キャリアは、周知の方法論を用いてウサギまたはマウスにおいて抗体を産生させるために用いられ得る。さらに、免疫キャリアは、ワクチン処方物に用いられ得る。
1例として、一般免疫キャリアは、動物においてP.aeruginosaの感染を阻害するのに効果的な抗体と交差反応する抗原とともに合成され得る。本発明のこの実施態様において、1つのサブユニットはB細胞抗原(例えば、PAKペプチド(配列番号18)と共に誘導され、そして他のサブユニットは、T細胞抗原(例えば、破傷風菌トキソイドペプチドTT2(配列番号12)と共に誘導される。このようにして設計された免疫キャリアは、動物においてP.aeruginosaに対して防御するためのワクチン処方物の一部として用いられ得る。本発明の関連する実施態様においては、免疫キャリアは、ヒトにおいてP.aeruginosaの感染を阻害するのに効果的な抗体と交差反応する抗原を用いて設計され得、そしてヒトにおいてP.aeruginosaの感染に対して防御するため、または存在するP.aeruginosaの感染を改善するためのワクチン処方物の一部として用いられ得る。
本発明に従って合成された組成物はまた、ワクチンおよび/または抗体開発キットの一部として用いられ得る。このようなキットに含まれるコアポリペプチドは、既に活性化されたカップリング残基と一緒に販売され得、従って、[Ag1]i-CP1およびCP2-[Ag2]jを生成するためには、Ag1を含有する溶液に活性化CP1を添加すること、およびAg2を含有する溶液に活性化CP2を添加することだけが必要である。
あるいは、キットは、カップリング反応を実行するための適切な説明書とともに、不活性化コアペプチドと一緒に販売され得、そして(適宜)必要なカップリング試薬を含む。このようにして処方されたキットはまた、広範囲のMHCハプロタイプと相互作用し得る代表的なT細胞ヘルパーペプチドを含み得る。T細胞ヘルパーペプチドは、予めコアペプチドの1つに結合され得るか、または別個の試薬として含まれ得る。後者の場合、使用者自身の選択したT細胞抗原を用いる選択の余地が提供される。
本発明の1局面に従って製造された組成物は、潜在的に治療的な抗体を開発するために用いられ得る。抗体は、例えば、(i)本明細書に示す手引きに従って、または(ii)上記段落に記載のような、本発明に従って開発したキットを用いて開発され得る。治療的抗体は、当該分野で周知の技術(例えば、実施例7に詳述した方法)により、任意の適切な動物において産生され得る。このような抗体は、そのために開発された疾患または苦痛を処置するために、またはこのような疾患および苦痛を診断するために用いられ得る。
本発明の1局面に従って設計されたポリペプチドはまた、CP1およびCP2に結合した2つの異なる生物活性部分を合わせ得る「分子接着剤」として用いられ得る。このストラテジーは、細胞内および細胞外の両方でのインビボでの適用、ならびに無細胞抽出物、ホモジネート、または2つのポリペプチドまたは他の物質に近接並置させることが望ましい一般的な反応混合物におけるインビトロでの適用を見出し得る。
上記段落に示すような「分子接着剤」の適用は、ヘリックス間のカップリング残基を取り込むことにより、またはデコレーションされたコアポリペプチドがほとんど専らα-ヘリックスヘテロダイマー超らせんとして残存する条件を利用することにより、たいてい不可逆的になされ得る。
あるいは、「分子接着剤」は、可逆的になされ得る。例えば、コアポリペプチドは、あるセットの反応条件下におくことによりα-ヘリックス超らせんダイマーに会合するが、異なるセットの条件下におくことによりモノマーに解離するように設計され得る。異なる条件は、種々の変化(例えば、pHおよび塩濃度)を包含し、超らせん形成に対するこの効果は、第III節、第D部に概説されている。選択された適用において可逆的な超らせん形成を可能にする、選択された「分子接着剤」適用に適合した条件は、本明細書の手引きに基づいて決定され得る。
「分子接着剤」のアプローチは、2つの物質、または手元にはないが、リガンド、好ましくは高親和性のリガンドまたは抗体フラグメントが公知であるものを分子的に近接させるために利用され得る。本発明のこの局面によって、第1の物質に対するリガンド(生物活性部分)がCP1に結合され、そして第2の物質に対するリガンド(生物活性部分)がCP2に結合される。このような適用が、適切な標的に対する内因性の有益な分子を標的するために治療的に用いられ得る。
上記の適用の組み合わせおよび変型が、当業者には明らかである。例えば、薬物または治療剤が、あるキャリアポリペプチドに結合され得、そして細胞性標的に対する結合部位が、別のキャリアポリペプチドに結合され得る。組成物は、薬物または治療剤を身体内の適切な部位に送達するために投与され得る。
あるいは、誘導されたコアポリペプチドは、それだけで被験体に投与され得、それにより標的に結合し、そして治療的な生物活性部分と共に誘導された第2のポリペプチドが、後の時点で被験体に投与され得る。コアポリペプチドは、相互作用して超らせんヘテロダイマーを形成し、従って、標的に治療物質を送達するために効果的であるということが理解される。
このようなアプローチは、薬物を標的部位(例えば、化学療法を施す腫瘍)に特異的に送達するために用いられ得、非標的組織に薬物が蓄積することによる望ましくない副作用を軽減する。薬物を送達する前に、CP1を治療薬に結合させ、そしてCP2を標的認識ドメイン(例えば、ガン細胞を認識するモノクローナル抗体)に結合させる。抗体−CP2結合体を、まず第1に標的を探すために宿主細胞に送達する。薬物−CP1結合体をその後送達する。薬物は、CP1およびCP2の優先的なダイマー形成により超らせんヘテロダイマーを形成する結果、標的部位に局在化される。
送達ビヒクルとしての超らせんヘテロダイマーの使用は、直接標的化治療剤(例えば、抗体に直接的に結合された薬物)よりいくつかの利点を提供する。第1に、最適の結合化学は、独立して、個々のCP1ペプチドおよびCP2ペプチドのそれぞれの生物活性実体(抗体および薬物)への結合のために求められ得る。さらに、このような連結に用いられる化学はより単純である。なぜなら、抗体へのペプチドの連結、および薬物へのペプチドの連結は、基本的な有機化学技術のみを必要とするからである。対照的に、タンパク質(例えば、抗体)への薬物の結合は、連結のための条件がしばしばきびしく、そして抗体のようなより大きなタンパク質を損傷し得るために、著しくより複雑である。
第2に、本発明の方法は、各薬物のために異なる薬物/抗体結合体を設計および調製することを必要とせずに、同一の標的(例えば、器官または腫瘍)に対する複数の生物活性部分(例えば、異なる薬物)の標的化を可能にする。第3に、標的での薬物の有効用量は、CP2へのCP1の結合親和性に影響する因子を局所的に調節することにより調節し得る。
以下の実施例は本発明を具体的に示しているが、本発明を制限することを意図するものではない。
材料および方法
ELISAプロトコルの概要
精製された抗原ポリペプチド処方物を、マルチウェルポリスチレンプレートなどの固体支持体上に固定化する。試験する血清を希釈し、そしてウェルに添加する。固定化された抗原に抗体を結合させるために十分な時間が経った後、血清をウェルから洗い出す。標識化リポーター抗体を、適切な基質と共に各ウェルに添加する。固定化抗原ポリペプチドに結合した抗体を含むウェルは、陽性シグナルによって検出される。
ELISAプロトコル
(Worobec, E.A.ら、J. Biol. Chem. 260:938(1985)からの適用)
抗原ペプチド(0.01M炭酸塩緩衝液pH9.5中に10mg/Ml)を、NUNC 96ウェルポリスチレンプレートの各ウェル(100μl/ウェル)に添加して、室温で6時間静置する。0.02%(wt/vol)を捕捉したPBS pH7.4の250μlのBSA(洗浄緩衝液)で三回ウェルを洗浄し、そしてPBS pH7.4中に5%(wt/vol)BSAの250μlを各ウェルに添加する。プレートを4℃で一晩インキュベートし、ウェル中の非特異的結合部位を遮断する。次いで、ウェルを洗浄緩衝液で三回洗浄し、そして100μlの一次マウス抗体を添加し、そしてウェルを室温で二時間インキュベートする。ウェルを250μlの洗浄緩衝液で三回洗浄する。洗浄緩衝液中のヤギ抗マウスIgG(H+L)免疫グロブリン−西洋ワサビペルオキシダーゼ結合体(Jackson Laboratories、Bar Harbor, ME)を添加(100μl/ウェル)し、そして室温で二時間インキュベートする。ウェルを洗浄緩衝液で三回洗浄し、そして350μlの基質液を各ウェルに添加する。基質液は、pH4.2の10mMクエン酸ナトリウム緩衝液中の1mM 2,2'−アジノジ(3−エチルベンゾチアゾリン硫酸)、0.03%(vol/vol)過酸化水素からなる。4mMアジ化ナトリウムを250μl/ウェルで添加することによって反応を停止させる。EL-407プレート読み取り器を用いて、405nmでの吸光度が決定される。
実施例1
ペプチド合成、精製および分析
前記の従来のN-t-ブチルオキシカルボニル(t-Boc)化学(Hodgesら、1988)を用いて、Applied Biosystem(Foster City、CA)ペプチド合成器モデル430Aでベンズヒドリルアミン塩酸樹脂を用いる固相ペプチド合成によって、すべてのペプチドを合成した。10%アニソールおよび2%1,2−エタンジチオールを含むフッ酸(HF; 20ml/g樹脂)と−5℃〜0℃で一時間反応させることによって、ペプチドを樹脂から切断した。
逆相高速液体クロマトグラフィー(RPC)、および「SYNCHROPAK」RP-Pセミ調製C18カラム(250×10mmN内径、粒子サイズ6.5μm、孔サイズ300Å;SynChrom、Lafayette、IN)によって0.5%B/分および2ml/分の直線状AB勾配(溶媒Aは水中の0.05%トリフルオロ酢酸(TFA)であり、溶媒Bがアセトニトリル中の0.05%TFAである)により粗還元ペプチドを精製した。
アミノ酸組成および質量分析は、設計された配列と一致した。アミノ酸分析については、真空封管内で100℃で24時間あるいは160℃で1時間、0.1%フェノールを含む6N HCl中で精製ペプチドを加水分解した。アミノ酸分析は、Beckmanモデル6300アミノ酸分析器(Beckman、San Ramon, CA)で行った。還元ペプチドの正確な一次イオン分子量を、BIOION-20 Nordic(Uppsala、Sweden)でプラズマ脱離飛行時間質量分析法によって確認した。
実施例2
円偏光二色性測定
円偏光二色性(CD)スペクトルを、Jasco DP-500Nデータプロセッサおよびキュベット温度を制御するためのLauda(モデルRMS)水浴槽(Brinkmann Instruments、Rexdale、Ontario、Canada)を備えたJasco J-500C分光偏光器(Jasco、Easton MD)で、20℃で記録した。一定のN2フラッシングを用いた。再結晶したd-10-(+)-ショウノウ硫酸の水溶液を用いて290nmで、機器を定常的に較正した。
200nmでのモル楕円率を平均残基モル楕円率([θ]220、deg・cm2・dmol-1)として報告し、以下の式から計算する。
[θ]=[θ]obs×mrw/10×l×c
[θ]obsは測定された楕円率の度数であり、mrwは平均残基分子量(アミノ酸残基の数で除算したペプチドの分子量)であり、cはペプチド濃度をミリリットル当たりのグラム数で表したものであり、そして1はセルの光学経路長さをセンチメートルで表したものである。CDスペクトルは、250〜190nmの間を0.1nm間隔でデータを収集することによって得られる4回の走査の平均であった。
アミノ酸分析によってペプチド濃度を決定した。pHは室温で測定した。
実施例3
ヘテロダイマー対ホモダイマー形成
2つのペプチド、EE(配列番号1)およびKK(配列番号2)を、実施例1および4に記載するように合成した。第1のサブユニットペプチド(EE;配列番号1)および第2のサブユニットペプチド(KK;配列番号2)を異なる比率で混合したペプチド混合物のCDスペクトルを、実施例2に記載されるように測定し、ヘテロダイマー対ホモダイマー形成の程度を決定した。
0.1M KClおよび50mMリン酸カルシウム緩衝液(20℃でpH7)を含む溶液(反応緩衝液)に、ペプチドを懸濁した。すべての測定について、全体のペプチド濃度(EEおよびKK濃度の合計)は、196μMであった。
ペプチドの比率を0:100〜50:50に変化させると、ペプチド混合物のコンフォメーションがランダムコイル構造からα−ヘリックス構造に変化することを、データは示している。EEおよびKKペプチドの等モル混合物は、220nmでの平均残基楕円率が-31,000deg・cm2・dmol-1を伴う2つの最小点を220nmおよび208nmで示し、これは、約100%のα−ヘリックス構造(Hodgesら、1990)に対応し、ホモ鎖超らせんを不安定化するらせん間イオン反発によって、ヘテロ鎖超らせんの形成の原動力が与えられることを示唆している。
これらの結果は、ペプチドEEおよびKKの混合物がヘテロ鎖超らせんを形成することを示している。
実施例4
ラクタム架橋の生成
NおよびC末端ヘプタド(末端重複)を、Labortecペプチド合成器(Bubendorf、Switzerland)を用いて半自動的に合成した。N−メチルピロリドン(NMP)中の5当量の2-(1H−ベンゾトリアゾール−イル)-1,1,3,3-テトラメチルウロニウムヘキサフルオロリン酸塩(HBTU)、1-ヒドロキシベンゾトリアゾール(HOBt)およびBocアミノ酸ならびに7.5当量のN−メチルモルホリン(NMM)とのダブルカップリングを、各サイクルで用いた。各サイクル間に、Boc基を、塩化メチレン(DCM)中の50%トリフルオロ酢酸(TFA)を用いて除去した。
超らせん形成ペプチドのN末端およびC末端における、リジン残基およびグルタミン酸残基の側鎖を含む環化を、Felixおよび共同研究者の改変プロトコル(Felixら、1988)を用いて樹脂で行った。分子内環化反応を容易にし、望ましくない分子間反応を防止するために、低置換レベル(樹脂の1g当たり0.13mmol)を用いた。両ペプチドに対するリジン35およびリジン7のε−アミノ基およびグルタミン酸31およびグルタミン酸3のγ−カルボキシル基を、それぞれFmoc基とOFm基を用いて保護した。これによって、NMP中の3当量のHBTUおよびHOBtならびに4.5当量のNMMを用いた固相環化の前に、20%のピペリジンを用いるこれらの残基の選択的な脱保護が可能になった。図2に示されるペプチドEEのC末端ヘプタドの合成によって、環化手順の概要が示される。
介在するペプタド2〜4を、Applied Biosystems 430Aペプチド合成器で調製した。第1カップリング工程ではジメチルホルムアミド(DMF)中のジシクロヘキシルカルボジイミド(DCC)生成対称無水物(5当量)を用い、そして第2カップリング工程ではDCMを用いて、すべてのアミノ酸をダブルカップリングした。
A.BocLys(Fmoc)−ベンズヒドリルアミン樹脂の調製
(Labortec SP 640ペプチド合成器)
ベンズヒドリルアミン樹脂(3.0g、0.74meq/g樹脂、2.2meq)を、各30mlのDCM、メタノール(MeOH)、DCM、DCM(×2)DCM中の5%ジイソプロピルエチルアミン(DIEA)およびNMP(×2)で洗浄した。BocLys(Fmoc)(1.14g、2.4mmol)、HBTU(0.91g、2.4mmol)、HOBt(0.37g、2.4mmol)を、NMM(0.51mL、3.63mmol)を添加したNMP(15mL)中に溶解し、そして溶液を5分間予備活性化させた。この溶液を膨潤した樹脂に添加し、5分間撹拌(sir)した。得られたBocLys(Fmoc)樹脂を、NMP(2×1分)およびDCM(3×1分)で洗浄した。
B.CおよびN末端ヘプタドの調製
脱保護(DCM中の50%TFA、1×20分)および中和(DCM中の5%DIEA、2×2分)後、DCM(2×1分)およびNMP(3×1分)で樹脂を洗浄した。C末端ヘプタドについての次のアミノ酸およびその後に続くアミノ酸全てならびにN末端ヘプタドについてのそれに続くアミノ酸を、以下のプロトコルに従ってダブルカップリングさせた。
Bocアミノ酸(5当量)、HBTU(5当量)およびHOBt(5当量)を、NMM(7.5当量)を添加したNMP(15mL)に溶解し、そして溶液を5分間予備活性化させた。この溶液を反応容器に添加し、そして30分間穏やかに撹拌した。合成の1サイクルは以下の操作から成る(樹脂1グラムあたり溶媒10mL):1)DCM中の50%TFA(1×1分);2)DCM中の50%TFA(1×20分);3)DCM(3×1分);4)DCM中の5%DIEA(2×2分);5)DCM(1×1分);6)NMP(3×1分);7)結合(30分);8)NMP(3×1分);9)結合(30分);10)NMP(2×1分);11)DCM(3×1分)。
C.リジン−グルタミン酸側鎖環化
Boc-Ileの添加後、リジンのFmoc基およびグルタミン酸のOFm基の選択的な脱保護を、DCM中の20%ピペリジン(1×20分)を用いて行い、次いで、樹脂をDCM(2×1分)およびNMP(3×1分)で連続して洗浄した。以下のプロトコルを用いて、環化を行った。
HBTU(3当量)、HOBT(3当量)およびNMM(4.5当量)を、0.5mLのヘキサフルオロイソプロパノールを添加したNMPに溶解した。溶液を反応容器に添加して、8時間穏やかに撹拌した。定量的ニンヒドリン試験(Sarinら、1981)によって反応の進行をモニタした。代表的には、97%を超えるカップリング効率を達成するためには、3回のカップリングが必要であった。樹脂をDCM中の5%DIEAの25mL中の10当量の無水酢酸を用いて1時間アセチル化し、DCM、MeOH、DCMおよびNMP(×2)で洗浄した。各環化に以下の工程を用いた:1)DCM中の20%ピペリジン(1×1分);2)DCM中の20%ピペリジン(1×20分);3)DCM(2×1分);4)NMP(3×1分);5)結合(8時間);6)NMP(2×1分);7)DCM(1×1分);8)DCM中の5%DIEA(1×1分);9)DCM(1×1分);NMP(2×1分);11)結合(3時間);12)工程6〜10の繰り返し;13)結合(1時間)。
実施例5
チオール基のアルキル化によるペプチド抗原のヘテロダイマー骨格への結合
本実施例では、Nα末端ヨードアセチル化PAK株ピリン抗原(配列番号18)のKKキャリア配列(配列番号2)への結合を記載する。
結合の前に、ノルロイシン(内部マーカー)およびスペーサとして働く2つのグリシン残基を付加することによって、PAK抗原(配列番号18)のNα末端を伸長し、IAc-GG-Nle-PAKを形成した。同様に、3つのグリジンおよびブロムアセチル基を付加することによって、TT2ペプチド(配列番号12)のNα末端を伸長し、BrAc-GGG-TT2を形成した。これらの伸長は、キャリアポリペプチドから抗原を分離し、それらの抗原性を保持しようとするために役立つ。上記のような伸長は、一般に、本発明の免疫原性複合体の合成において推奨される。
キャリアペプチドのスルフヒドリル基への結合を、pH8の50mM NH4OAcおよび8M尿素中で周囲温度で行った。プロムアセチル化ペプチドあるいはヨードアセチル化ペプチドを、緩衝液(0.987μM、2ml)に溶解し、そして最終濃度0.165μM(2ml)までキャリアペプチドKK(配列番号2)を添加した。反応混合液は清澄なままであり、そして周囲温度で22時間反応させた。この時、TFA(pH2)を慎重に添加することによって、反応混合液を酸性化し、そして凍結乾燥した。
A.結合体の生成および同定
反応混合液(2ml)を、Synchropak RP-8セミ調製カラム(250mm×10mm I.D.:Synchrom Inc.、Lafayette、IN)に直接添加した。勾配溶出を用いて、未反応ペプチドから結合体を容易に分離した(30分にわたって2%B/分、溶媒A:0.05% TFA/H2O;溶媒B:0.05% TFA/アセトニトリル)。単離した結合体を凍結乾燥し、そしてHPLCグレードの水(200μl)中に再溶解し、次いで、さらに精製を行うためにMono-S強陽イオン交換カラム(Pharmacia、Uppsala、Sweden)に添加した。この精製工程の間に用いた勾配は1% B/分勾配(溶液A:5mM NaH2PO4/20%アセトニトリル、pH5、溶媒B:5mM NaH2PO4/20%アセトニトリル、1M NaCl、pH5)であった。次いで、逆相カラムおよび標準的な2%B勾配(上記参照)を用いて、単離した結合体を脱塩した。このように、質量分析法の分析によって所望の産物であることが示された純粋な結合体を得た(分子量計算値:7432.0、実測値7432.4)。
実施例6
結合体コア抗原モノマーの混合によるヘテロダイマーの生成
実施例1に記載したように、PAK(配列番号18)およびTT2(配列番号:12)ペプチドを調製し、そして精製した。実施例1および4に記載したように、EE(配列番号1)およびKK(配列番号2)ペプチドを調製し、精製し、そして修飾した。実施例5に記載したように[PAK]-KKおよびEE-[TT2]ペプチドキャリア複合体を調製し、そして実施例1に詳細に記載したように精製した。以下の条件下で[PAK]-KK複合体をEE-[TT2]複合体と組み合わせることによって、ヘテロダイマー複合体を生成した。
精製され、凍結乾燥され、デコレーションされた[PAK]-KKおよびEE-[TT2]ペプチドを、0.25〜0.5mM濃度で反応緩衝液中で個別に再懸濁した。各50μlのペプチド溶液を組み合わせ、そして室温で10分間反応させた。
実施例7
[PAK]-KK〜EE-[TT2]ヘテロダイマー複合体を用いるマウス抗体の調製
Balb Cマウス(10匹)を、Adjuvax ADJ-20(Alfa-Beta Technology, Worcester, MA)と10mMのリン酸緩衝化生理食塩水(PBS)との1:1の混合物100μlに溶解した5μgの結合体を含有する、[PAK]-KK-EE-[TT2]ヘテロダイマー結合体混合物を用いて腹膜内免疫化を行う。注入は、ある腹部部位に腹膜内で行う。同量の結合体を含むAdjuvax ADJ-20で、7日、14日および21日後にマウスを追加免疫する。
上記のように調製した5μgの結合体[PAK]-KKで免疫化した10匹の動物に対照実験を行う。免疫化は、上記の試験グループについて記載されたものと同じ方法で行う。
材料および方法に記載されているように、標準的ELISAプロトコルを用いて免疫活性について血清を試験する。(i)精製Pseudomonas aeruginosa K株ピリ、あるいは(ii)固相活性種としてウシ血清アルブミンと結合したN結合合成PAKペプチド(配列番号18)のいずれかを用いて反応性プレートELISAアッセイから力価を見積もる。
3匹の動物の脾臓をプールし、そしてHarlowらに記載されるように、骨髄腫細胞との融合を行うための細胞を生成するために処理を行う。免疫的に活性の抗体の存在について、抗原を用いるELISA試験によって、ハイブリドーマ上清を試験する。陽性クローンからの上清を、Pseudomonas由来の精製抗原を用いて、免疫活性について試験した。
実施例8
[PAK]-KK〜EE-[TT2]ヘテロダイマー複合体を用いるマウスワクチン注射およびそれに続くPseudomonas aeruginosaによる感染からの防御
A.研究1
(i)コントロール処方物([PAK]-KK)、あるいは(ii)抗原性の超らせんヘテロダイマー処方物([PAK]-KK〜EE-[TT2])のいずれかで、Balb/cマウスのグループ(1グループ当たり5〜10匹)を免疫化する。リン酸緩衝化生理食塩水中のAdjuvaxと混合した1、5あるいは10μgのペプチドの注入を、0、2、4および6週間で試験動物に腹膜内(IP)投与で行う。動物は採血を毎週行い、そして抗体応答について血清を試験する。(i)精製Pseudomonas aeruginosa K株ピリ、および(ii)ウシ血清アルブミンと結合したN結合合成ペプチドを用いる直接ELISAによって、抗体レベルを評価する。
上記に概要を示した手順に従って、コントロールペプチドで免疫化され、そしてペプチド-BSA抗原を用いて試験した動物について、<102の力価が可能である。PAKピリン抗原ELISAを用いて試験されるコントロール動物については、より低い力価が可能である。
反対に、超らせんヘテロダイマー処方物による免疫化の結果、ペプチド-BSA結合体および精製PAKピリの両方に対する抗体の高力価が得られ得る。5μg/注入用量を3〜4回注入すると、106〜108程度の力価(ペプチドおよび天然抗原の両方について)が可能である。
B.研究2
5〜10匹のAB.Y/SnJマウス(約4週齢)のグループに、緩衝液中のAdjuvax、コントロールペプチドおよび超らせん処方物(5μgのペプチドおよびアジュバントとしてAdjuvaxを含有する)を一週間おきに3回筋内(IM)注入して免疫化する。最終免疫化の2週間後、生存Pseudomonas aeruginosa K株を用いて用量2×106CFU(5×LD50と等しい抗原投与用量)で、マウス(約12週齢)をIPで抗原投与する。マウスをそれに続く60時間にわたってモニターし、ワクチン処方物によって与えられる、Pseudomonas aeruginosa感染に対する防御レベルを決定する。
コントロール動物(AdjuvaxあるいはAdjuvaxおよびコントロールペプチド処方物で免疫化されたマウス)は、16〜20時間以内にPseudomonas aeruginosaに感染し得、死亡率は100%であった。超らせんペプチドワクチン処方物で免疫化されたマウスは、Pseudomonas aeruginosa抗原投与に対して生存し得、死亡率は40%未満であった。
特定の方法および実施態様に関して本発明を説明したが、本発明から逸脱せずに様々な改変および変更を行い得ることが理解されるであろう。
配列表
(1)一般的情報:
(i)出願人:エス.ピー.アイ.シンセティック ペプチデス インコーポレイテッド
(ii)発明の名称:ヘテロダイマーポリペプチド免疫原キャリア組成物および方法
(iii)配列数:30
(iv)連絡住所:
(A)名称:デリンジャー アンド アソシエイツ
(B)番地:350ケンブリッジ アベニュー,スイート250
(C)市:パロ アルト
(D)州:カリフォルニア
(E)国:アメリカ合衆国
(F)郵便番号:94306
(v)コンピューター読み出し形態:
(A)媒体型:フロッピーディスク
(B)コンピューター:IBM PC互換用
(C)OS:PC-DOS/MS-DOS
(D)ソフトウェア:パテントイン リリース#1.0,バージョン#1.25
(vi)現在の出願データ:
(A)出願番号:
(B)出願日:1995年5月18日
(C)分類:
(vii)先願データ:
(A)出願番号:US 08/245,507
(B)出願日:1994年5月18日
(viii)代理人/事務所情報:
(A)氏名:ショルツ,チャールズ ケイ.
(B)登録番号:38,615
(C)照会/記録番号:8900-0009.41
(ix)電話回線情報:
(A)電話:(415)324-0880
(B)テレファックス:(415)324-0960
(2)配列番号1の情報:
(i)配列の特色:
(A)長さ:35アミノ酸
(B)型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:不明
(ii)配列の種類:ペプチド
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:EEペプチド
(xi)配列:配列番号1:
(2)配列番号2の情報:
(i)配列の特色:
(A)長さ:35アミノ酸
(B)型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:不明
(ii)配列の種類:ペプチド
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:KKペプチド
(xi)配列:配列番号2:
(2)配列番号3の情報:
(i)配列の特色:
(A)長さ:7アミノ酸
(B)型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:不明
(ii)配列の種類:ペプチド
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:EE末端反復
(xi)配列:配列番号3:
(2)配列番号4の情報:
(i)配列の特色:
(A)長さ:7アミノ酸
(B)型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:不明
(ii)配列の種類:ペプチド
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:EE内部反復
(xi)配列:配列番号4:
(2)配列番号5の情報:
(i)配列の特色:
(A)長さ:7アミノ酸
(B)型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:不明
(ii)配列の種類:ペプチド
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:EE結合内部反復
(xi)配列:配列番号5:
(2)配列番号6の情報:
(i)配列の特色:
(A)長さ:7アミノ酸
(B)型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:不明
(ii)配列の種類:ペプチド
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:EE末端反復
(xi)配列:配列番号6:
(2)配列番号7の情報:
(i)配列の特色:
(A)長さ:7アミノ酸
(B)型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:不明
(ii)配列の種類:ペプチド
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:KK内部反復
(xi)配列:配列番号7:
(2)配列番号8の情報:
(i)配列の特色:
(A)長さ:7アミノ酸
(B)型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:不明
(ii)配列の種類:ペプチド
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:KK結合内部反復
(xi)配列:配列番号8:
(2)配列番号9の情報:
(i)配列の特色:
(A)長さ:12アミノ酸
(B)型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:不明
(ii)配列の種類:ペプチド
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:B抗原;エキソSペプチド
(xi)配列:配列番号9:
(2)配列番号10の情報:
(i)配列の特色:
(A)長さ:12アミノ酸
(B)型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:不明
(ii)配列の種類:ペプチド
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:T抗原;TTOペプチド
(xi)配列:配列番号10:
(2)配列番号11の情報:
(i)配列の特色:
(A)長さ:20アミノ酸
(B)型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:不明
(ii)配列の種類:ペプチド
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:T抗原;TTペプチド
(xi)配列:配列番号11:
(2)配列番号12の情報:
(i)配列の特色:
(A)長さ:17アミノ酸
(B)型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:不明
(ii)配列の種類:ペプチド
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:T抗原;TT2ペプチド
(xi)配列:配列番号12:
(2)配列番号13の情報:
(i)配列の特色:
(A)長さ:17アミノ酸
(B)型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:不明
(ii)配列の種類:ペプチド
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:T抗原;TT1ペプチド
(xi)配列:配列番号13:
(2)配列番号14の情報:
(i)配列の特色:
(A)長さ:21アミノ酸
(B)型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:不明
(ii)配列の種類:ペプチド
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:T抗原;TT3ペプチド
(xi)配列:配列番号14:
(2)配列番号15の情報:
(i)配列の特色:
(A)長さ:15アミノ酸
(B)型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:不明
(ii)配列の種類:ペプチド
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:T抗原;MVFペプチド
(xi)配列:配列番号15:
(2)配列番号16の情報:
(i)配列の特色:
(A)長さ:15アミノ酸
(B)型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:不明
(ii)配列の種類:ペプチド
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:T抗原;HBVペプチド
(xi)配列:配列番号16:
(2)配列番号17の情報:
(i)配列の特色:
(A)長さ:20アミノ酸
(B)型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:不明
(ii)配列の種類:ペプチド
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:B抗原;CSPペプチド
(xi)配列:配列番号17:
(2)配列番号18の情報:
(i)配列の特色:
(A)長さ:17アミノ酸
(B)型:アミノ酸
(C)鎖の数:一本鎖
(D)トポロジー:不明
(ii)配列の種類:ペプチド
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:PAKペプチド
(xi)配列:配列番号18:
(2)配列番号19の情報:
(i)配列の特色:
(A)長さ:105塩基対
(B)型:核酸
(C)鎖の数:二本鎖
(D)トポロジー:両形態
(ii)配列の種類:DNA
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:E-らせん配列
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..105
(xi)配列:配列番号19:
(2)配列番号20の情報:
(i)配列の特色:
(A)長さ:35アミノ酸
(B)型:アミノ酸
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号20:
(2)配列番号21の情報:
(i)配列の特色:
(A)長さ:105塩基対
(B)型:核酸
(C)鎖の数:二本鎖
(D)トポロジー:両形態
(ii)配列の種類:DNA
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:K-らせん配列
(xi)配列の特徴:
(A)特徴を表わす記号:CDS
(B)存在位置:1..105
(xi)配列:配列番号21:
(2)配列番号22の情報:
(i)配列の特色:
(A)長さ:35アミノ酸
(B)型:アミノ酸
(C)鎖の数:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号22:
(2)配列番号23の情報:
(i)配列の特色:
(A)長さ:231塩基対
(B)型:核酸
(C)鎖の数:二本鎖
(D)トポロジー:両形態
(ii)配列の種類:DNA
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:Fig.13中のフラグメント
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..219
(xi)配列:配列番号23:
(2)配列番号24の情報:
(i)配列の特色:
(A)長さ:73アミノ酸
(B)型:アミノ酸
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号24:
(2)配列番号25の情報:
(i)配列の特色:
(A)長さ:51塩基対
(B)型:核酸
(C)鎖の数:二本鎖
(D)トポロジー:両形態
(ii)配列の種類:DNA
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:PAK抗原
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..51
(xi)配列:配列番号25:
(2)配列番号26の情報:
(i)配列の特色:
(A)長さ:17アミノ酸
(B)型:アミノ酸
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号26:
(2)配列番号27の情報:
(i)配列の特色:
(A)長さ:228塩基対
(B)型:核酸
(C)鎖の数:二本鎖
(D)トポロジー:両形態
(ii)配列の種類:DNA
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:Fig.14中のフラグメント
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..216
(xi)配列:配列番号27:
(2)配列番号28の情報:
(i)配列の特色:
(A)長さ:71アミノ酸
(B)型:アミノ酸
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号28:
(2)配列番号29の情報:
(i)配列の特色:
(A)長さ:45塩基対
(B)型:核酸
(C)鎖の数:二本鎖
(D)トポロジー:両形態
(ii)配列の種類:DNA
(iii)ハイポセティカル:NO
(iv)アンチセンス:NO
(vi)起源:
(C)個体・単離生物名:MVF抗原
(ix)配列の特徴:
(A)特徴を表す記号:CDS
(B)存在位置:1..45
(xi)配列:配列番号29:
(2)配列番号30の情報:
(i)配列の特色:
(A)長さ:15アミノ酸
(B)型:アミノ酸
(D)トポロジー:直鎖状
(ii)配列の種類:タンパク質
(xi)配列:配列番号30:
Claims (15)
- ヘテロダイマーポリペプチド免疫原であって、
相互に作用してコイルドコイル構造ヘテロダイマーを形成する第1および第2のサブユニットを有するキャリアを含み、ここで、(i)各サブユニットが抗原を含むように誘導され、(ii)一方のサブユニットがT細胞抗原を含み、そして他方のサブユニットがB細胞抗原を含み、そして(iii)該抗原が実質的にコイルドコイル構造ヘテロダイマーの形成を妨げない、ポリペプチド免疫原。 - 前記コイルドコイル構造ヘテロダイマーがイオン相互作用によって安定化される、請求項1に記載のポリペプチド免疫原。
- 少なくとも1つのサブユニットおよびその抗原が単一のポリペプチド鎖である、請求項1または2に記載のポリペプチド免疫原。
- 前記単一のポリペプチド鎖が、配列番号28に存在する配列を含むアミノ酸配列を有する、請求項3に記載のポリペプチド免疫原。
- 前記単一のポリペプチド鎖が、配列番号30に存在する配列を含むアミノ酸配列を有する、請求項3に記載のポリペプチド免疫原。
- 前記T細胞抗原が、配列番号10、配列番号11、配列番号12、配列番号13、および配列番号14からなる群より選択される配列を有するポリペプチドから構成される、請求項1〜5のいずれかに記載のポリペプチド免疫原。
- 前記T細胞抗原が配列番号12で表される配列を有し、そして前記B細胞抗原が配列番号18で表される配列を有する、請求項6に記載のポリペプチド免疫原。
- 前記第1のサブユニットが、
(A)(i)図2Aまたは図2Bに示すgabcdefの形態を有する2つの末端アミノ酸反復配列、および(ii)図2Aまたは図2Bに示すgabcdefの形態を有する少なくとも1つの内部アミノ酸反復配列(ここで、各末端および内部アミノ酸反復配列のa位およびd位が、イソロイシン、ロイシンおよびバリンからなる群より選択され、そして各末端および内部アミノ酸反復配列のe位およびg位がアスパラギン酸およびグルタミン酸からなる群より選択される)を含む第1のコアポリペプチド、および
(B)b位、c位またはf位でアミノ酸への共有結合を介して第1のコアポリペプチド内部アミノ酸反復配列に結合する、第1のポリペプチド抗原、を含み;そして第2のサブユニットが、
(A)(i)図2Aまたは図2Bに示すg’a’b’c’d’e’f’の形態を有する2つの末端アミノ酸反復配列、および(ii)図2Aまたは図2Bに示すg’a’b’c’d’e’f’の形態を有する少なくとも1つの内部アミノ酸反復配列(ここで、各末端および内部アミノ酸反復配列のa’位およびd’位がイソロイシン、ロイシンおよびバリンからなる群より選択され、各末端および内部アミノ酸反復配列のe’位およびg’位がリジン、アルギニンおよびヒスチジンからなる群より選択される)を含む第2のコアポリペプチド、および
(B)b’位、c’位またはf’位でアミノ酸への共有結合を介して第2のコアポリペプチド内部アミノ酸反復配列に結合する、第2のポリペプチド抗原、を含み;
ここで、該第1および第2のサブユニットが、1:1の化学量論を有する安定なα-ヘリックスコイルドコイル構造コンフィギュレーションに配列され、そして該ペプチド抗原がコンフィギュレーションの外表面に配置される、請求項1または2に記載のポリペプチド免疫原。 - (i)前記第1のコアポリペプチドの末端アミノ酸反復配列のそれぞれがb位でグルタミン酸を、f位でリジンを、および該b位と該f位との間で形成されるラクタム架橋を有し、そして
(ii)前記第2のコアペプチドの末端アミノ酸反復配列のそれぞれがb’位でグルタミン酸を、f’位でリジンを、および該b’位と該f’位との間で形成されるラクタム架橋を有する、
請求項8に記載のポリペプチド免疫原。 - 前記第1のコアポリペプチドが、その内部反復配列内の少なくとも1つにおいて、f位でアミノ酸カップリング残基を含み、そして
前記第2のコアポリペプチドが、その内部アミノ酸反復配列の少なくとも1つにおいて、f’位でアミノ酸カップリング残基を含む、請求項8に記載のポリペプチド免疫原。 - 前記アミノ酸カップリング残基がシステイン残基である、請求項10に記載のポリペプチド免疫原。
- 前記第1のコアポリペプチドか配列番号1の配列(EE)を有し、そして前記第2のコアポリペプチドが配列番号2の配列(KK)を有する、請求項11に記載のポリペプチド免疫原。
- 請求項1に記載のヘテロダイマーポリペプチド免疫原組成物を調製する方法であって、
相互に作用してコイルドコイル構造ヘテロダイマーを形成する2つのポリペプチドサブユニットを形成する工程(ここで、(i)各サブユニットが抗原を含むように誘導され、(ii)一方のサブユニットがT細胞抗原を含み、そして他方のサブユニットがB細胞抗原を含み、そして(iii)該抗原が実質的にコイルドコイル構造ヘテロダイマーの形成を妨げない)、および
該コイルドコイル構造ヘテロダイマーの形成を促進する条件下、温和培地中で該ポリペプチドサブユニットを、約1:1の割合で混合する工程、を包含する、方法。 - 前記コイルドコイル構造ヘテロダイマーがイオン相互作用によって安定化される、請求項13に記載の方法。
- 前記T細胞抗原が、配列番号10、配列番号11、配列番号12、配列番号13、および配列番号14からなる群より選択されるペプチドから構成される、請求項13または14に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US24550794A | 1994-05-18 | 1994-05-18 | |
| US08/245,507 | 1994-05-18 | ||
| PCT/CA1995/000293 WO1995031480A1 (en) | 1994-05-18 | 1995-05-18 | Heterodimer polypeptide immunogen carrier composition and method |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006132010A Division JP2006257095A (ja) | 1994-05-18 | 2006-05-10 | ヘテロダイマーポリペプチド免疫原キャリア組成物および方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPH10504018A JPH10504018A (ja) | 1998-04-14 |
| JP3872813B2 true JP3872813B2 (ja) | 2007-01-24 |
Family
ID=22926961
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP52926595A Expired - Fee Related JP3872813B2 (ja) | 1994-05-18 | 1995-05-18 | ヘテロダイマーポリペプチド免疫原キャリア組成物および方法 |
| JP2006132010A Withdrawn JP2006257095A (ja) | 1994-05-18 | 2006-05-10 | ヘテロダイマーポリペプチド免疫原キャリア組成物および方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006132010A Withdrawn JP2006257095A (ja) | 1994-05-18 | 2006-05-10 | ヘテロダイマーポリペプチド免疫原キャリア組成物および方法 |
Country Status (7)
| Country | Link |
|---|---|
| EP (1) | EP0759941B1 (ja) |
| JP (2) | JP3872813B2 (ja) |
| AT (1) | ATE196297T1 (ja) |
| AU (1) | AU708472B2 (ja) |
| CA (1) | CA2190494C (ja) |
| DE (1) | DE69518838T2 (ja) |
| WO (1) | WO1995031480A1 (ja) |
Families Citing this family (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1997012988A1 (en) * | 1995-10-06 | 1997-04-10 | Pence | Coiled-coil heterodimer methods and compositions for the detection and purification of expressed proteins |
| HUP9901254A3 (en) * | 1996-04-03 | 2001-10-29 | Perpres As | Non-dendritic backbone peptide carrier |
| US6165335A (en) * | 1996-04-25 | 2000-12-26 | Pence And Mcgill University | Biosensor device and method |
| US6130037A (en) * | 1996-04-25 | 2000-10-10 | Pence And Mcgill University | Biosensor device and method |
| US6271198B1 (en) | 1996-11-06 | 2001-08-07 | Genentech, Inc. | Constrained helical peptides and methods of making same |
| DE69906729T2 (de) | 1998-06-12 | 2004-02-05 | The Governors Of The University Of Alberta, Edmonton | Zusammensetzung und methode zur behandlung von pseudomonas aeruginosa infektionen |
| AR020102A1 (es) * | 1998-07-30 | 2002-04-10 | Ucb Sa | Compuesto para la prevencion y/o tratamiento de la alergia; composicion farmaceutica, composicion cosmetica, composicion en forma de bebida, alimento y/oalimento para animales domesticos que lo comprende y uso de dicho compuesto o dicha composicion farmaceutica para la fabricacion de un alimento |
| US6787368B1 (en) | 1999-03-02 | 2004-09-07 | Helix Biopharma Corporation | Biosensor method for detecting analytes in a liquid |
| CN1355846A (zh) * | 1999-04-23 | 2002-06-26 | 法麦克萨有限公司 | 用于下调节白细胞介素5活性的方法 |
| US6872806B1 (en) | 1999-06-25 | 2005-03-29 | The Governors Of The University Of Alberta | Polypeptide compositions formed using a coiled-coil template and methods of use |
| JP2004503565A (ja) * | 2000-06-14 | 2004-02-05 | サイトヴァックス・バイオテクノロジーズ・インコーポレーテッド | 構造特異的ペプチドを生産するためのコイルドコイル構造的骨格の使用 |
| US7264800B2 (en) | 2002-07-18 | 2007-09-04 | Helix Biopharma Corporation | Method and composition for inhibiting cancer cell growth |
| TR200500108T2 (tr) * | 2002-07-18 | 2005-04-21 | Helix Biopharma Corp. | Kanser Hücresi Gelişiminin İnhibe Edilmesinde Üreaz Kullanımı |
| CA2543200A1 (en) * | 2003-10-24 | 2005-05-06 | National Research Council Of Canada | Ligand-pseudoreceptor system for generation of adenoviral vectors with altered tropism |
| EP1737884B1 (en) | 2004-03-19 | 2016-10-19 | The University Of Queensland | Alpha helical mimics, their uses and methods for their production |
| CA2523032A1 (en) | 2005-10-07 | 2007-04-07 | Immunovaccine Technologies Inc. | Vaccines for cancer therapy |
| ES2588705T3 (es) | 2007-09-27 | 2016-11-04 | Immunovaccine Technologies Inc. | Uso de liposomas en un vehículo que comprende una fase hidrófoba continua para la entrega de polinucleótidos in vivo |
| WO2009146523A1 (en) | 2008-06-05 | 2009-12-10 | Immunovaccine Technologies Inc. | Compositions comprising liposomes, an antigen, a polynucleotide and a carrier comprising a continuous phase of a hydrophobic substance |
| CA2825861A1 (en) | 2010-01-26 | 2011-08-04 | Robert S. Hodges | Conjugates utilizing platform technology for stimulating immune response |
| CN107261154A (zh) * | 2011-04-29 | 2017-10-20 | 西莱克塔生物科技公司 | 致耐受性合成纳米载体 |
| CN103998058B (zh) | 2011-10-06 | 2021-11-05 | 免疫疫苗技术有限公司 | 包括激活或增加tlr2活性的佐剂的脂质体组合物及其应用 |
| EP2788021B1 (en) | 2011-12-09 | 2017-01-18 | Bavarian Nordic A/S | Poxvirus vector for the expression of bacterial antigens linked to tetanus toxin fragment c |
| ES2842206T3 (es) | 2013-05-03 | 2021-07-13 | Selecta Biosciences Inc | Métodos y composiciones para potenciar linfocitos T reguladores CD4+ |
| JP7242179B2 (ja) | 2014-09-07 | 2023-03-20 | セレクタ バイオサイエンシーズ インコーポレーテッド | 遺伝子治療用抗ウイルス導入ベクター免疫応答を減弱化するための方法および組成物 |
| US11426451B2 (en) | 2017-03-11 | 2022-08-30 | Selecta Biosciences, Inc. | Methods and compositions related to combined treatment with antiinflammatories and synthetic nanocarriers comprising an immunosuppressant |
| EP3810172A4 (en) | 2018-06-21 | 2022-04-20 | Shattuck Labs, Inc. | HETERODIMER PROTEINS AND THEIR USES |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1993015110A1 (en) * | 1992-01-31 | 1993-08-05 | Whitehead Institute For Biomedical Research | Amino acid sequences which pair specifically |
-
1995
- 1995-05-18 AT AT95918481T patent/ATE196297T1/de not_active IP Right Cessation
- 1995-05-18 AU AU24418/95A patent/AU708472B2/en not_active Ceased
- 1995-05-18 CA CA002190494A patent/CA2190494C/en not_active Expired - Fee Related
- 1995-05-18 DE DE69518838T patent/DE69518838T2/de not_active Expired - Fee Related
- 1995-05-18 JP JP52926595A patent/JP3872813B2/ja not_active Expired - Fee Related
- 1995-05-18 WO PCT/CA1995/000293 patent/WO1995031480A1/en active IP Right Grant
- 1995-05-18 EP EP95918481A patent/EP0759941B1/en not_active Expired - Lifetime
-
2006
- 2006-05-10 JP JP2006132010A patent/JP2006257095A/ja not_active Withdrawn
Also Published As
| Publication number | Publication date |
|---|---|
| CA2190494C (en) | 2002-05-07 |
| CA2190494A1 (en) | 1995-11-23 |
| JPH10504018A (ja) | 1998-04-14 |
| DE69518838T2 (de) | 2001-05-03 |
| DE69518838D1 (de) | 2000-10-19 |
| EP0759941B1 (en) | 2000-09-13 |
| AU2441895A (en) | 1995-12-05 |
| WO1995031480A1 (en) | 1995-11-23 |
| JP2006257095A (ja) | 2006-09-28 |
| ATE196297T1 (de) | 2000-09-15 |
| AU708472B2 (en) | 1999-08-05 |
| EP0759941A1 (en) | 1997-03-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP3872813B2 (ja) | ヘテロダイマーポリペプチド免疫原キャリア組成物および方法 | |
| Tam et al. | Vaccine engineering: enhancement of immunogenicity of synthetic peptide vaccines related to hepatitis in chemically defined models consisting of T-and B-cell epitopes. | |
| EP0652896B1 (en) | Peptide compounds | |
| AU640619B2 (en) | Hiv proteins and peptides useful in the diagnosis, prophylaxis or therapy of aids | |
| US6258599B1 (en) | Compositions and methods for treating viral infections | |
| US20040213801A1 (en) | Methods of eliciting broadly neutralizing antibodies targeting HIV-1 gp41 | |
| TW200533681A (en) | Immunogenic peptide carrier conjugates and methods of producing same | |
| JP2001502658A (ja) | 非樹状中心骨格ペプチド担体 | |
| JP4463877B2 (ja) | 合成ペプチドとそれを含むワクチン | |
| JP3060504B2 (ja) | ワクチン | |
| HUT63179A (en) | Process for producing synthetic polypeptides | |
| US7122193B1 (en) | Retro peptides, antibodies thereto and their uses for vaccination and in vitro diagnosis | |
| JPH0195773A (ja) | エイズの診断、予防、又は治療に有用な新規なhiv蛋白質及びペプチド類 | |
| Tam | Chemically defined synthetic immunogens and vaccines by the multiple antigen peptide approach | |
| Pardridge et al. | Enhanced endocytosis and anti-human immunodeficiency virus type 1 activity of anti-rev antibodies after cationization | |
| KR20220062080A (ko) | 전립선암 치료를 위한 면역요법 | |
| Mhidia et al. | Synthesis of Peptide− Protein Conjugates Using N-Succinimidyl Carbamate Chemistry | |
| JPH07505878A (ja) | Hivエンベロープ糖タンパク質から誘導された合成ポリペプチド | |
| JPH05501202A (ja) | インフルエンザ菌b型の外膜タンパク質p1およびペプチド類 | |
| HODGES et al. | Sommaire du brevet 2190494 | |
| AU2006200454B2 (en) | Compositions and methods for treating viral infections | |
| HODGES et al. | Patent 2190494 Summary | |
| CA2372569A1 (en) | Heterodimer polypeptide immunogen carrier composition and method | |
| JPH02502637A (ja) | 合成抗むしばワクチン | |
| CN100368436C (zh) | 人绒毛膜促性腺激素重组多表位嵌合肽cp22抗原的分子设计及其制备方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20060214 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060510 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20061003 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20061023 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20101027 Year of fee payment: 4 |
|
| LAPS | Cancellation because of no payment of annual fees |