JP2025504945A - アクチビン受容体iib型バリアント及びその使用 - Google Patents
アクチビン受容体iib型バリアント及びその使用 Download PDFInfo
- Publication number
- JP2025504945A JP2025504945A JP2024544859A JP2024544859A JP2025504945A JP 2025504945 A JP2025504945 A JP 2025504945A JP 2024544859 A JP2024544859 A JP 2024544859A JP 2024544859 A JP2024544859 A JP 2024544859A JP 2025504945 A JP2025504945 A JP 2025504945A
- Authority
- JP
- Japan
- Prior art keywords
- polypeptide
- amino acid
- seq
- acid sequence
- actriib
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 102100027647 Activin receptor type-2B Human genes 0.000 title claims abstract description 192
- 108010057453 activin receptor type II-B Proteins 0.000 title claims abstract description 192
- 108090000765 processed proteins & peptides Proteins 0.000 claims abstract description 682
- 102000004196 processed proteins & peptides Human genes 0.000 claims abstract description 569
- 229920001184 polypeptide Polymers 0.000 claims abstract description 563
- 239000003446 ligand Substances 0.000 claims abstract description 219
- 108090001012 Transforming Growth Factor beta Proteins 0.000 claims abstract description 181
- 208000002815 pulmonary hypertension Diseases 0.000 claims abstract description 39
- 230000011664 signaling Effects 0.000 claims abstract description 37
- 238000000034 method Methods 0.000 claims abstract description 35
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 29
- 210000003743 erythrocyte Anatomy 0.000 claims abstract description 28
- 201000010099 disease Diseases 0.000 claims abstract description 24
- 230000004761 fibrosis Effects 0.000 claims abstract description 23
- 206010016654 Fibrosis Diseases 0.000 claims abstract description 21
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 16
- 210000000988 bone and bone Anatomy 0.000 claims abstract description 11
- 208000030159 metabolic disease Diseases 0.000 claims abstract description 10
- 208000007502 anemia Diseases 0.000 claims abstract description 9
- 208000001145 Metabolic Syndrome Diseases 0.000 claims abstract description 7
- 208000010428 Muscle Weakness Diseases 0.000 claims abstract description 7
- 206010028372 Muscular weakness Diseases 0.000 claims abstract description 7
- 230000006378 damage Effects 0.000 claims abstract description 7
- 206010028289 Muscle atrophy Diseases 0.000 claims abstract description 4
- 230000037444 atrophy Effects 0.000 claims abstract description 4
- 201000000585 muscular atrophy Diseases 0.000 claims abstract description 4
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 353
- 239000011230 binding agent Substances 0.000 claims description 255
- 239000000178 monomer Substances 0.000 claims description 182
- 102000004887 Transforming Growth Factor beta Human genes 0.000 claims description 180
- 238000006467 substitution reaction Methods 0.000 claims description 123
- 150000001413 amino acids Chemical class 0.000 claims description 115
- 102100039939 Growth/differentiation factor 8 Human genes 0.000 claims description 85
- 108010056852 Myostatin Proteins 0.000 claims description 85
- 108010023082 activin A Proteins 0.000 claims description 79
- 230000014509 gene expression Effects 0.000 claims description 78
- 102100040898 Growth/differentiation factor 11 Human genes 0.000 claims description 76
- 101710194452 Growth/differentiation factor 11 Proteins 0.000 claims description 76
- 239000003795 chemical substances by application Substances 0.000 claims description 68
- 108010023079 activin B Proteins 0.000 claims description 66
- 210000004027 cell Anatomy 0.000 claims description 58
- 230000027455 binding Effects 0.000 claims description 57
- 102100028726 Bone morphogenetic protein 10 Human genes 0.000 claims description 51
- 101710118482 Bone morphogenetic protein 10 Proteins 0.000 claims description 49
- 239000000539 dimer Substances 0.000 claims description 46
- 230000002401 inhibitory effect Effects 0.000 claims description 45
- 239000003814 drug Substances 0.000 claims description 42
- 229940079593 drug Drugs 0.000 claims description 37
- 230000001965 increasing effect Effects 0.000 claims description 33
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Natural products NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 claims description 29
- 210000001519 tissue Anatomy 0.000 claims description 29
- 150000007523 nucleic acids Chemical class 0.000 claims description 24
- 206010064911 Pulmonary arterial hypertension Diseases 0.000 claims description 23
- 108010067306 Fibronectins Proteins 0.000 claims description 20
- 238000011282 treatment Methods 0.000 claims description 19
- 230000001225 therapeutic effect Effects 0.000 claims description 18
- 102000008100 Human Serum Albumin Human genes 0.000 claims description 17
- 108091006905 Human Serum Albumin Proteins 0.000 claims description 17
- 101000893585 Homo sapiens Growth/differentiation factor 2 Proteins 0.000 claims description 16
- 102000039446 nucleic acids Human genes 0.000 claims description 16
- 108020004707 nucleic acids Proteins 0.000 claims description 16
- 102000001554 Hemoglobins Human genes 0.000 claims description 15
- 108010054147 Hemoglobins Proteins 0.000 claims description 15
- 239000004471 Glycine Substances 0.000 claims description 14
- 230000002489 hematologic effect Effects 0.000 claims description 14
- 102000046041 human GDF2 Human genes 0.000 claims description 14
- 206010065687 Bone loss Diseases 0.000 claims description 13
- 102000007350 Bone Morphogenetic Proteins Human genes 0.000 claims description 12
- 108010007726 Bone Morphogenetic Proteins Proteins 0.000 claims description 12
- 229940112869 bone morphogenetic protein Drugs 0.000 claims description 12
- 230000002792 vascular Effects 0.000 claims description 12
- 102220504290 Meiotic recombination protein REC8 homolog_F58D_mutation Human genes 0.000 claims description 11
- 239000000203 mixture Substances 0.000 claims description 10
- 102220614024 Angiotensin-converting enzyme 2_K31Y_mutation Human genes 0.000 claims description 9
- 102200016899 rs1326930389 Human genes 0.000 claims description 9
- 238000002347 injection Methods 0.000 claims description 8
- 239000007924 injection Substances 0.000 claims description 8
- 239000013598 vector Substances 0.000 claims description 8
- 102000009027 Albumins Human genes 0.000 claims description 7
- 108010088751 Albumins Proteins 0.000 claims description 7
- 102220488099 Bone morphogenetic protein receptor type-1A_F58Y_mutation Human genes 0.000 claims description 7
- 102220487441 Electron transfer flavoprotein subunit alpha, mitochondrial_F58H_mutation Human genes 0.000 claims description 7
- 102200060276 rs137853102 Human genes 0.000 claims description 7
- 102220535568 tRNA wybutosine-synthesizing protein 5_F58W_mutation Human genes 0.000 claims description 7
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 6
- 239000012634 fragment Substances 0.000 claims description 6
- 230000002829 reductive effect Effects 0.000 claims description 6
- 241000124008 Mammalia Species 0.000 claims description 5
- 208000008589 Obesity Diseases 0.000 claims description 5
- 210000004369 blood Anatomy 0.000 claims description 5
- 239000008280 blood Substances 0.000 claims description 5
- 208000035475 disorder Diseases 0.000 claims description 5
- 125000003630 glycyl group Chemical group [H]N([H])C([H])([H])C(*)=O 0.000 claims description 5
- 235000020824 obesity Nutrition 0.000 claims description 5
- 102220082842 rs369277594 Human genes 0.000 claims description 5
- 230000008685 targeting Effects 0.000 claims description 5
- 206010043554 thrombocytopenia Diseases 0.000 claims description 5
- 230000008728 vascular permeability Effects 0.000 claims description 5
- 206010013801 Duchenne Muscular Dystrophy Diseases 0.000 claims description 4
- 208000037149 Facioscapulohumeral dystrophy Diseases 0.000 claims description 4
- 208000014777 Pulmonary venoocclusive disease Diseases 0.000 claims description 4
- 201000009594 Systemic Scleroderma Diseases 0.000 claims description 4
- 206010042953 Systemic sclerosis Diseases 0.000 claims description 4
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 claims description 4
- ZPUCINDJVBIVPJ-LJISPDSOSA-N cocaine Chemical compound O([C@H]1C[C@@H]2CC[C@@H](N2C)[C@H]1C(=O)OC)C(=O)C1=CC=CC=C1 ZPUCINDJVBIVPJ-LJISPDSOSA-N 0.000 claims description 4
- 208000018631 connective tissue disease Diseases 0.000 claims description 4
- 208000008570 facioscapulohumeral muscular dystrophy Diseases 0.000 claims description 4
- 208000038003 heart failure with preserved ejection fraction Diseases 0.000 claims description 4
- 208000038002 heart failure with reduced ejection fraction Diseases 0.000 claims description 4
- 239000012216 imaging agent Substances 0.000 claims description 4
- 201000008319 inclusion body myositis Diseases 0.000 claims description 4
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 claims description 4
- 206010028537 myelofibrosis Diseases 0.000 claims description 4
- 239000002539 nanocarrier Substances 0.000 claims description 4
- 208000005069 pulmonary fibrosis Diseases 0.000 claims description 4
- 208000001072 type 2 diabetes mellitus Diseases 0.000 claims description 4
- 206010018429 Glucose tolerance impaired Diseases 0.000 claims description 3
- 206010028980 Neoplasm Diseases 0.000 claims description 3
- 208000001280 Prediabetic State Diseases 0.000 claims description 3
- 206010039710 Scleroderma Diseases 0.000 claims description 3
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 claims description 3
- 230000002776 aggregation Effects 0.000 claims description 3
- 238000004220 aggregation Methods 0.000 claims description 3
- 230000009787 cardiac fibrosis Effects 0.000 claims description 3
- 230000001404 mediated effect Effects 0.000 claims description 3
- 229920000642 polymer Polymers 0.000 claims description 3
- 201000009104 prediabetes syndrome Diseases 0.000 claims description 3
- 206010058029 Arthrofibrosis Diseases 0.000 claims description 2
- 208000023275 Autoimmune disease Diseases 0.000 claims description 2
- 208000010392 Bone Fractures Diseases 0.000 claims description 2
- 206010005949 Bone cancer Diseases 0.000 claims description 2
- 208000018084 Bone neoplasm Diseases 0.000 claims description 2
- 206010006895 Cachexia Diseases 0.000 claims description 2
- 208000013725 Chronic Kidney Disease-Mineral and Bone disease Diseases 0.000 claims description 2
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 claims description 2
- 208000002330 Congenital Heart Defects Diseases 0.000 claims description 2
- 206010010356 Congenital anomaly Diseases 0.000 claims description 2
- 102100040892 Growth/differentiation factor 2 Human genes 0.000 claims description 2
- 206010019668 Hepatic fibrosis Diseases 0.000 claims description 2
- 101000695367 Homo sapiens Bone morphogenetic protein 10 Proteins 0.000 claims description 2
- 201000009794 Idiopathic Pulmonary Fibrosis Diseases 0.000 claims description 2
- 208000020875 Idiopathic pulmonary arterial hypertension Diseases 0.000 claims description 2
- 208000024934 IgG4-related mediastinitis Diseases 0.000 claims description 2
- 208000014919 IgG4-related retroperitoneal fibrosis Diseases 0.000 claims description 2
- 206010023421 Kidney fibrosis Diseases 0.000 claims description 2
- 208000002805 Mediastinal fibrosis Diseases 0.000 claims description 2
- 208000029725 Metabolic bone disease Diseases 0.000 claims description 2
- 206010027476 Metastases Diseases 0.000 claims description 2
- 208000010191 Osteitis Deformans Diseases 0.000 claims description 2
- 206010049088 Osteopenia Diseases 0.000 claims description 2
- 208000001132 Osteoporosis Diseases 0.000 claims description 2
- 208000027868 Paget disease Diseases 0.000 claims description 2
- 108010076504 Protein Sorting Signals Proteins 0.000 claims description 2
- 208000031467 Pulmonary capillary hemangiomatosis Diseases 0.000 claims description 2
- 206010038979 Retroperitoneal fibrosis Diseases 0.000 claims description 2
- 208000010399 Wasting Syndrome Diseases 0.000 claims description 2
- 230000002927 anti-mitotic effect Effects 0.000 claims description 2
- 239000000427 antigen Substances 0.000 claims description 2
- 108091007433 antigens Proteins 0.000 claims description 2
- 102000036639 antigens Human genes 0.000 claims description 2
- 210000000601 blood cell Anatomy 0.000 claims description 2
- 201000011510 cancer Diseases 0.000 claims description 2
- 229960003920 cocaine Drugs 0.000 claims description 2
- 238000012258 culturing Methods 0.000 claims description 2
- 239000002254 cytotoxic agent Substances 0.000 claims description 2
- 229940127089 cytotoxic agent Drugs 0.000 claims description 2
- 231100000599 cytotoxic agent Toxicity 0.000 claims description 2
- 238000005115 demineralization Methods 0.000 claims description 2
- 230000002328 demineralizing effect Effects 0.000 claims description 2
- 239000000412 dendrimer Substances 0.000 claims description 2
- 229920000736 dendritic polymer Polymers 0.000 claims description 2
- 235000005911 diet Nutrition 0.000 claims description 2
- 230000037213 diet Effects 0.000 claims description 2
- 239000003085 diluting agent Substances 0.000 claims description 2
- 239000003937 drug carrier Substances 0.000 claims description 2
- 230000002500 effect on skin Effects 0.000 claims description 2
- 230000005484 gravity Effects 0.000 claims description 2
- 230000005831 heart abnormality Effects 0.000 claims description 2
- 208000015181 infectious disease Diseases 0.000 claims description 2
- 238000001802 infusion Methods 0.000 claims description 2
- 208000036971 interstitial lung disease 2 Diseases 0.000 claims description 2
- 238000007918 intramuscular administration Methods 0.000 claims description 2
- 238000007912 intraperitoneal administration Methods 0.000 claims description 2
- 238000001990 intravenous administration Methods 0.000 claims description 2
- 206010025135 lupus erythematosus Diseases 0.000 claims description 2
- 208000027202 mammary Paget disease Diseases 0.000 claims description 2
- 230000009401 metastasis Effects 0.000 claims description 2
- 229960001252 methamphetamine Drugs 0.000 claims description 2
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 claims description 2
- 239000002105 nanoparticle Substances 0.000 claims description 2
- 208000002865 osteopetrosis Diseases 0.000 claims description 2
- 230000002018 overexpression Effects 0.000 claims description 2
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 2
- 208000007232 portal hypertension Diseases 0.000 claims description 2
- 230000002062 proliferating effect Effects 0.000 claims description 2
- 230000003439 radiotherapeutic effect Effects 0.000 claims description 2
- 201000002793 renal fibrosis Diseases 0.000 claims description 2
- 201000006409 renal osteodystrophy Diseases 0.000 claims description 2
- 208000001076 sarcopenia Diseases 0.000 claims description 2
- 239000003381 stabilizer Substances 0.000 claims description 2
- 238000007920 subcutaneous administration Methods 0.000 claims description 2
- 102100037362 Fibronectin Human genes 0.000 claims 1
- 230000002503 metabolic effect Effects 0.000 abstract description 2
- 102100030742 Transforming growth factor beta-1 proprotein Human genes 0.000 abstract 1
- 235000001014 amino acid Nutrition 0.000 description 203
- 108090000623 proteins and genes Proteins 0.000 description 147
- 102000004169 proteins and genes Human genes 0.000 description 132
- 235000018102 proteins Nutrition 0.000 description 131
- 206010063836 Atrioventricular septal defect Diseases 0.000 description 115
- 238000001211 electron capture detection Methods 0.000 description 114
- 229940024606 amino acid Drugs 0.000 description 105
- 230000005764 inhibitory process Effects 0.000 description 83
- 238000012360 testing method Methods 0.000 description 83
- 238000000423 cell based assay Methods 0.000 description 76
- 230000036515 potency Effects 0.000 description 65
- 238000001543 one-way ANOVA Methods 0.000 description 53
- 102000037280 Growth Differentiation Factor 2 Human genes 0.000 description 51
- 108010090290 Growth Differentiation Factor 2 Proteins 0.000 description 51
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 43
- 102000004127 Cytokines Human genes 0.000 description 40
- 108090000695 Cytokines Proteins 0.000 description 40
- 108700039887 Essential Genes Proteins 0.000 description 37
- 238000011529 RT qPCR Methods 0.000 description 37
- 230000035772 mutation Effects 0.000 description 37
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 36
- 238000004458 analytical method Methods 0.000 description 35
- 241001465754 Metazoa Species 0.000 description 29
- 210000001147 pulmonary artery Anatomy 0.000 description 28
- 239000003981 vehicle Substances 0.000 description 28
- 241000700159 Rattus Species 0.000 description 27
- 101000604905 Rattus norvegicus Phenylalanine-4-hydroxylase Proteins 0.000 description 27
- 102100027329 Malonyl-CoA-acyl carrier protein transacylase, mitochondrial Human genes 0.000 description 26
- 210000004072 lung Anatomy 0.000 description 26
- -1 P708 Chemical compound 0.000 description 24
- 230000002861 ventricular Effects 0.000 description 24
- 230000000694 effects Effects 0.000 description 23
- 230000006870 function Effects 0.000 description 22
- 238000007792 addition Methods 0.000 description 21
- 238000006386 neutralization reaction Methods 0.000 description 21
- 241000699670 Mus sp. Species 0.000 description 20
- 102000005962 receptors Human genes 0.000 description 20
- 108020003175 receptors Proteins 0.000 description 20
- 102000016359 Fibronectins Human genes 0.000 description 19
- 108020004999 messenger RNA Proteins 0.000 description 19
- 238000003762 quantitative reverse transcription PCR Methods 0.000 description 19
- 210000005241 right ventricle Anatomy 0.000 description 19
- 210000000329 smooth muscle myocyte Anatomy 0.000 description 19
- 230000007935 neutral effect Effects 0.000 description 18
- 230000002441 reversible effect Effects 0.000 description 18
- 108010059616 Activins Proteins 0.000 description 17
- 239000000488 activin Substances 0.000 description 17
- 238000001727 in vivo Methods 0.000 description 17
- 102100031168 CCN family member 2 Human genes 0.000 description 16
- 101100447432 Danio rerio gapdh-2 gene Proteins 0.000 description 16
- 101150112014 Gapdh gene Proteins 0.000 description 16
- 102100031181 Glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 description 16
- 101000777550 Homo sapiens CCN family member 2 Proteins 0.000 description 16
- 238000005516 engineering process Methods 0.000 description 16
- 108020004445 glyceraldehyde-3-phosphate dehydrogenase Proteins 0.000 description 16
- 239000001963 growth medium Substances 0.000 description 16
- 210000003205 muscle Anatomy 0.000 description 16
- 239000012679 serum free medium Substances 0.000 description 16
- 238000011740 C57BL/6 mouse Methods 0.000 description 15
- 102100026818 Inhibin beta E chain Human genes 0.000 description 15
- 239000012188 paraffin wax Substances 0.000 description 15
- 239000000126 substance Substances 0.000 description 15
- 230000003442 weekly effect Effects 0.000 description 15
- 210000002966 serum Anatomy 0.000 description 14
- 108010019691 inhibin beta A subunit Proteins 0.000 description 12
- 230000037361 pathway Effects 0.000 description 12
- 230000037396 body weight Effects 0.000 description 11
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 10
- 108010077593 ACE-011 Proteins 0.000 description 10
- 101150091877 Ccn2 gene Proteins 0.000 description 10
- 230000008859 change Effects 0.000 description 10
- 230000001817 pituitary effect Effects 0.000 description 10
- 241000699666 Mus <mouse, genus> Species 0.000 description 9
- 102000007562 Serum Albumin Human genes 0.000 description 9
- 108010071390 Serum Albumin Proteins 0.000 description 9
- 238000005534 hematocrit Methods 0.000 description 9
- 230000001976 improved effect Effects 0.000 description 9
- 229950002894 sotatercept Drugs 0.000 description 9
- HKZAAJSTFUZYTO-LURJTMIESA-N (2s)-2-[[2-[[2-[[2-[(2-aminoacetyl)amino]acetyl]amino]acetyl]amino]acetyl]amino]-3-hydroxypropanoic acid Chemical compound NCC(=O)NCC(=O)NCC(=O)NCC(=O)N[C@@H](CO)C(O)=O HKZAAJSTFUZYTO-LURJTMIESA-N 0.000 description 8
- 101150046085 INHBA gene Proteins 0.000 description 8
- 102100026120 IgG receptor FcRn large subunit p51 Human genes 0.000 description 8
- 101150002416 Igf2 gene Proteins 0.000 description 8
- 101150069061 Mss51 gene Proteins 0.000 description 8
- 101150014879 RpL13A gene Proteins 0.000 description 8
- 125000000539 amino acid group Chemical group 0.000 description 8
- 230000007423 decrease Effects 0.000 description 8
- 238000003306 harvesting Methods 0.000 description 8
- 108010087819 Fc receptors Proteins 0.000 description 7
- 102000009109 Fc receptors Human genes 0.000 description 7
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 7
- 230000009467 reduction Effects 0.000 description 7
- 101710177940 IgG receptor FcRn large subunit p51 Proteins 0.000 description 6
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 6
- 241000282567 Macaca fascicularis Species 0.000 description 6
- 239000004473 Threonine Substances 0.000 description 6
- 230000001133 acceleration Effects 0.000 description 6
- 230000004872 arterial blood pressure Effects 0.000 description 6
- 230000000052 comparative effect Effects 0.000 description 6
- QPNKYNYIKKVVQB-UHFFFAOYSA-N crotaleschenine Natural products O1C(=O)C(C)C(C)C(C)(O)C(=O)OCC2=CCN3C2C1CC3 QPNKYNYIKKVVQB-UHFFFAOYSA-N 0.000 description 6
- 239000003112 inhibitor Substances 0.000 description 6
- 108010091736 luspatercept Proteins 0.000 description 6
- 239000002609 medium Substances 0.000 description 6
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 6
- QVCMHGGNRFRMAD-XFGHUUIASA-N monocrotaline Chemical compound C1OC(=O)[C@](C)(O)[C@@](O)(C)[C@@H](C)C(=O)O[C@@H]2CCN3[C@@H]2C1=CC3 QVCMHGGNRFRMAD-XFGHUUIASA-N 0.000 description 6
- QVCMHGGNRFRMAD-UHFFFAOYSA-N monocrotaline Natural products C1OC(=O)C(C)(O)C(O)(C)C(C)C(=O)OC2CCN3C2C1=CC3 QVCMHGGNRFRMAD-UHFFFAOYSA-N 0.000 description 6
- 230000003472 neutralizing effect Effects 0.000 description 6
- 210000000056 organ Anatomy 0.000 description 6
- 230000019491 signal transduction Effects 0.000 description 6
- 238000000527 sonication Methods 0.000 description 6
- 230000035488 systolic blood pressure Effects 0.000 description 6
- 238000007492 two-way ANOVA Methods 0.000 description 6
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 5
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 5
- 101150030274 FSHB gene Proteins 0.000 description 5
- 102000009123 Fibrin Human genes 0.000 description 5
- 108010073385 Fibrin Proteins 0.000 description 5
- BWGVNKXGVNDBDI-UHFFFAOYSA-N Fibrin monomer Chemical compound CNC(=O)CNC(=O)CN BWGVNKXGVNDBDI-UHFFFAOYSA-N 0.000 description 5
- 102000012673 Follicle Stimulating Hormone Human genes 0.000 description 5
- 108010079345 Follicle Stimulating Hormone Proteins 0.000 description 5
- 206010019280 Heart failures Diseases 0.000 description 5
- 206010062767 Hypophysitis Diseases 0.000 description 5
- 101150050438 NPPA gene Proteins 0.000 description 5
- 101150114487 NPPB gene Proteins 0.000 description 5
- 230000003247 decreasing effect Effects 0.000 description 5
- 210000002744 extracellular matrix Anatomy 0.000 description 5
- 229950003499 fibrin Drugs 0.000 description 5
- 229940028334 follicle stimulating hormone Drugs 0.000 description 5
- 230000013632 homeostatic process Effects 0.000 description 5
- 230000004048 modification Effects 0.000 description 5
- 238000012986 modification Methods 0.000 description 5
- 102000004506 Blood Proteins Human genes 0.000 description 4
- 108010017384 Blood Proteins Proteins 0.000 description 4
- 208000020084 Bone disease Diseases 0.000 description 4
- 102000014015 Growth Differentiation Factors Human genes 0.000 description 4
- 108010050777 Growth Differentiation Factors Proteins 0.000 description 4
- 206010021143 Hypoxia Diseases 0.000 description 4
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 4
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 4
- 102100025751 Mothers against decapentaplegic homolog 2 Human genes 0.000 description 4
- 101710143123 Mothers against decapentaplegic homolog 2 Proteins 0.000 description 4
- 208000029578 Muscle disease Diseases 0.000 description 4
- 238000003559 RNA-seq method Methods 0.000 description 4
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 4
- 230000002411 adverse Effects 0.000 description 4
- 150000001875 compounds Chemical class 0.000 description 4
- 108020001507 fusion proteins Proteins 0.000 description 4
- 102000037865 fusion proteins Human genes 0.000 description 4
- 230000001146 hypoxic effect Effects 0.000 description 4
- 230000003993 interaction Effects 0.000 description 4
- 229950000151 luspatercept Drugs 0.000 description 4
- 230000007310 pathophysiology Effects 0.000 description 4
- 230000001105 regulatory effect Effects 0.000 description 4
- CCEKAJIANROZEO-UHFFFAOYSA-N sulfluramid Chemical group CCNS(=O)(=O)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)F CCEKAJIANROZEO-UHFFFAOYSA-N 0.000 description 4
- 230000009424 thromboembolic effect Effects 0.000 description 4
- 108010052946 Activin Receptors Proteins 0.000 description 3
- 102000018918 Activin Receptors Human genes 0.000 description 3
- 102000008186 Collagen Human genes 0.000 description 3
- 108010035532 Collagen Proteins 0.000 description 3
- 101150080985 GDF11 gene Proteins 0.000 description 3
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 3
- 101150001754 Gusb gene Proteins 0.000 description 3
- 208000032843 Hemorrhage Diseases 0.000 description 3
- 108060003951 Immunoglobulin Proteins 0.000 description 3
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 3
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 3
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 3
- 125000000174 L-prolyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])([H])[C@@]1([H])C(*)=O 0.000 description 3
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 3
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 3
- 101150035628 Serpine1 gene Proteins 0.000 description 3
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 3
- 235000004279 alanine Nutrition 0.000 description 3
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 3
- 230000004071 biological effect Effects 0.000 description 3
- 238000004820 blood count Methods 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 229920001436 collagen Polymers 0.000 description 3
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 3
- 238000009826 distribution Methods 0.000 description 3
- 210000002889 endothelial cell Anatomy 0.000 description 3
- 230000004927 fusion Effects 0.000 description 3
- 239000000833 heterodimer Substances 0.000 description 3
- 239000000710 homodimer Substances 0.000 description 3
- 102000018358 immunoglobulin Human genes 0.000 description 3
- 102000006495 integrins Human genes 0.000 description 3
- 108010044426 integrins Proteins 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 230000014759 maintenance of location Effects 0.000 description 3
- 239000012071 phase Substances 0.000 description 3
- 101150096543 rpl19 gene Proteins 0.000 description 3
- UBWXUGDQUBIEIZ-UHFFFAOYSA-N (13-methyl-3-oxo-2,6,7,8,9,10,11,12,14,15,16,17-dodecahydro-1h-cyclopenta[a]phenanthren-17-yl) 3-phenylpropanoate Chemical compound CC12CCC(C3CCC(=O)C=C3CC3)C3C1CCC2OC(=O)CCC1=CC=CC=C1 UBWXUGDQUBIEIZ-UHFFFAOYSA-N 0.000 description 2
- JARGNLJYKBUKSJ-KGZKBUQUSA-N (2r)-2-amino-5-[[(2r)-1-(carboxymethylamino)-3-hydroxy-1-oxopropan-2-yl]amino]-5-oxopentanoic acid;hydrobromide Chemical compound Br.OC(=O)[C@H](N)CCC(=O)N[C@H](CO)C(=O)NCC(O)=O JARGNLJYKBUKSJ-KGZKBUQUSA-N 0.000 description 2
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 2
- 101150087690 ACTB gene Proteins 0.000 description 2
- 102000005606 Activins Human genes 0.000 description 2
- 208000006386 Bone Resorption Diseases 0.000 description 2
- 102000002090 Fibronectin type III Human genes 0.000 description 2
- 108050009401 Fibronectin type III Proteins 0.000 description 2
- 102000003886 Glycoproteins Human genes 0.000 description 2
- 108090000288 Glycoproteins Proteins 0.000 description 2
- 125000000393 L-methionino group Chemical group [H]OC(=O)[C@@]([H])(N([H])[*])C([H])([H])C(SC([H])([H])[H])([H])[H] 0.000 description 2
- 206010048654 Muscle fibrosis Diseases 0.000 description 2
- 201000003793 Myelodysplastic syndrome Diseases 0.000 description 2
- 101150079964 RPL13 gene Proteins 0.000 description 2
- 230000003466 anti-cipated effect Effects 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 208000005980 beta thalassemia Diseases 0.000 description 2
- 230000008827 biological function Effects 0.000 description 2
- 230000024279 bone resorption Effects 0.000 description 2
- 210000004899 c-terminal region Anatomy 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 230000021615 conjugation Effects 0.000 description 2
- 235000018417 cysteine Nutrition 0.000 description 2
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 2
- 238000012217 deletion Methods 0.000 description 2
- 230000037430 deletion Effects 0.000 description 2
- 238000006471 dimerization reaction Methods 0.000 description 2
- 208000037765 diseases and disorders Diseases 0.000 description 2
- 239000012636 effector Substances 0.000 description 2
- 108010044804 gamma-glutamyl-seryl-glycine Proteins 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 238000010353 genetic engineering Methods 0.000 description 2
- 230000002440 hepatic effect Effects 0.000 description 2
- 230000008595 infiltration Effects 0.000 description 2
- 238000001764 infiltration Methods 0.000 description 2
- 229910052500 inorganic mineral Inorganic materials 0.000 description 2
- 238000002955 isolation Methods 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 210000004962 mammalian cell Anatomy 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 235000010755 mineral Nutrition 0.000 description 2
- 239000011707 mineral Substances 0.000 description 2
- 125000003729 nucleotide group Chemical group 0.000 description 2
- 230000011164 ossification Effects 0.000 description 2
- 210000002997 osteoclast Anatomy 0.000 description 2
- 238000012335 pathological evaluation Methods 0.000 description 2
- 230000006320 pegylation Effects 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 230000002685 pulmonary effect Effects 0.000 description 2
- 108700015048 receptor decoy activity proteins Proteins 0.000 description 2
- 102220080600 rs797046116 Human genes 0.000 description 2
- 125000006850 spacer group Chemical group 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 239000013638 trimer Substances 0.000 description 2
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- 102100021886 Activin receptor type-2A Human genes 0.000 description 1
- 101100133992 Amycolatopsis sp Aaar gene Proteins 0.000 description 1
- 241000024188 Andala Species 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 208000018240 Bone Marrow Failure disease Diseases 0.000 description 1
- 206010065553 Bone marrow failure Diseases 0.000 description 1
- 102000000844 Cell Surface Receptors Human genes 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 206010017076 Fracture Diseases 0.000 description 1
- 241001123946 Gaga Species 0.000 description 1
- 206010018276 Gingival bleeding Diseases 0.000 description 1
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101001128634 Homo sapiens NADH dehydrogenase [ubiquinone] 1 beta subcomplex subunit 2, mitochondrial Proteins 0.000 description 1
- 108010004250 Inhibins Proteins 0.000 description 1
- 102000002746 Inhibins Human genes 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- 125000000510 L-tryptophano group Chemical group [H]C1=C([H])C([H])=C2N([H])C([H])=C(C([H])([H])[C@@]([H])(C(O[H])=O)N([H])[*])C2=C1[H] 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 102100032194 NADH dehydrogenase [ubiquinone] 1 beta subcomplex subunit 2, mitochondrial Human genes 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 108091005735 TGF-beta receptors Proteins 0.000 description 1
- 206010043189 Telangiectasia Diseases 0.000 description 1
- 102000016715 Transforming Growth Factor beta Receptors Human genes 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 108010057429 activin receptor type II-A Proteins 0.000 description 1
- 230000001028 anti-proliverative effect Effects 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 230000001174 ascending effect Effects 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 208000034158 bleeding Diseases 0.000 description 1
- 230000000740 bleeding effect Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 230000014461 bone development Effects 0.000 description 1
- 230000003139 buffering effect Effects 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 208000020832 chronic kidney disease Diseases 0.000 description 1
- 230000024203 complement activation Effects 0.000 description 1
- 230000004540 complement-dependent cytotoxicity Effects 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 208000016097 disease of metabolism Diseases 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 208000028208 end stage renal disease Diseases 0.000 description 1
- 201000000523 end stage renal failure Diseases 0.000 description 1
- 239000006274 endogenous ligand Substances 0.000 description 1
- 210000003038 endothelium Anatomy 0.000 description 1
- 208000001780 epistaxis Diseases 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 210000001723 extracellular space Anatomy 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 238000010579 first pass effect Methods 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 102000034238 globular proteins Human genes 0.000 description 1
- 108091005896 globular proteins Proteins 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 208000014951 hematologic disease Diseases 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 230000003284 homeostatic effect Effects 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 239000000893 inhibin Substances 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 210000003093 intracellular space Anatomy 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- 108020001756 ligand binding domains Proteins 0.000 description 1
- 229940049593 luspatercept-aamt Drugs 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 108091005601 modified peptides Proteins 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 230000037257 muscle growth Effects 0.000 description 1
- 201000006938 muscular dystrophy Diseases 0.000 description 1
- 210000000822 natural killer cell Anatomy 0.000 description 1
- 108010068617 neonatal Fc receptor Proteins 0.000 description 1
- 238000006384 oligomerization reaction Methods 0.000 description 1
- 230000014207 opsonization Effects 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 230000008506 pathogenesis Effects 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 230000003651 pro-proliferative effect Effects 0.000 description 1
- 125000001500 prolyl group Chemical group [H]N1C([H])(C(=O)[*])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 108020001580 protein domains Proteins 0.000 description 1
- 230000012846 protein folding Effects 0.000 description 1
- 230000012743 protein tagging Effects 0.000 description 1
- 230000036593 pulmonary vascular resistance Effects 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 238000011552 rat model Methods 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 229940049592 reblozyl Drugs 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 208000009056 telangiectasis Diseases 0.000 description 1
- 125000000341 threoninyl group Chemical group [H]OC([H])(C([H])([H])[H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 210000002303 tibia Anatomy 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 108700012359 toxins Proteins 0.000 description 1
- 102000052185 transforming growth factor beta receptor activity proteins Human genes 0.000 description 1
- 108700015056 transforming growth factor beta receptor activity proteins Proteins 0.000 description 1
- 102000027257 transmembrane receptors Human genes 0.000 description 1
- 108091008578 transmembrane receptors Proteins 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 210000005166 vasculature Anatomy 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/71—Receptors; Cell surface antigens; Cell surface determinants for growth factors; for growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/62—DNA sequences coding for fusion proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/02—Fusion polypeptide containing a localisation/targetting motif containing a signal sequence
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/31—Fusion polypeptide fusions, other than Fc, for prolonged plasma life, e.g. albumin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/32—Fusion polypeptide fusions with soluble part of a cell surface receptor, "decoy receptors"
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Medicinal Chemistry (AREA)
- Genetics & Genomics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Zoology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biomedical Technology (AREA)
- Gastroenterology & Hepatology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Cell Biology (AREA)
- Diabetes (AREA)
- Toxicology (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Obesity (AREA)
- Hematology (AREA)
- Microbiology (AREA)
- Plant Pathology (AREA)
- Physics & Mathematics (AREA)
- Neurology (AREA)
- Emergency Medicine (AREA)
Abstract
Description
関連出願の相互参照
本出願は、2022年1月28日に出願された米国仮出願第63/304,478号、2022年8月12日に出願された米国仮出願第63/397,773号、2022年10月17日に出願された米国仮出願第63/416,852号、及び2022年10月31日に出願された米国仮出願第63/420,999号からの優先権の利益を主張する国際PCT出願であり、これらの各々の内容は、参照によりそれら全体が本明細書に組み込まれる。
本出願は、2022年1月28日に出願された米国仮出願第63/304,478号、2022年8月12日に出願された米国仮出願第63/397,773号、2022年10月17日に出願された米国仮出願第63/416,852号、及び2022年10月31日に出願された米国仮出願第63/420,999号からの優先権の利益を主張する国際PCT出願であり、これらの各々の内容は、参照によりそれら全体が本明細書に組み込まれる。
電子配列表の参照
電子配列表の内容(35PH_002_04WO_SeqList_ST26.xml、サイズ:417,164バイト、及び作成日:2023年1月27日)は、参照によりその全体が本明細書に組み込まれる。
電子配列表の内容(35PH_002_04WO_SeqList_ST26.xml、サイズ:417,164バイト、及び作成日:2023年1月27日)は、参照によりその全体が本明細書に組み込まれる。
本開示は、アクチビン受容体IIB型(ActRIIB)エクトドメイン(ECD)バリアントを含むポリペプチドと、TGFβスーパーファミリーリガンドを結合及び中和するための、特に、肺高血圧症、線維症、筋力低下及び萎縮、代謝障害及び心臓代謝性疾患、骨損傷、ならびに低い赤血球レベルなどのTGFβスーパーファミリーシグナル伝達と関連する疾患ならびに状態の治療のためのその使用と、に関する。
トランスフォーミング成長因子ベータ(TGFβ)スーパーファミリーは、細胞増殖、遊走及び分化、筋肉増殖、血管恒常性、ならびに骨発生を含む、いくつかの生理学的プロセスを調節する35個のリガンドを含む。それらのレベル及び/またはシグナル伝達経路の乱れは、顕著な病理学的効果を生じる。例えば、TGFβ及びアクチビンリガンドは、複数のヒト疾患の病因に関与しており、多くの疾患において重要な病原性の役割を果たす。TGFβスーパーファミリー関連障害の例としては、肺高血圧症(肺動脈高血圧症を含む)、血液悪性腫瘍、固形腫瘍、骨髄不全状態、筋力低下、ならびに肺線維症、肝線維症、腎線維症及び心線維症、ならびに全身性硬化症(SSc、強皮症とも呼ばれる)などの制御不能な線維症を特徴とする多種多様な障害が挙げられる(Nanthakumar,D.B.et al.,2015、Meng,X.-M.et al.,2016)。当該技術分野では、TGFβスーパーファミリー関連障害の治療に有効な治療薬の必要性が残っている。
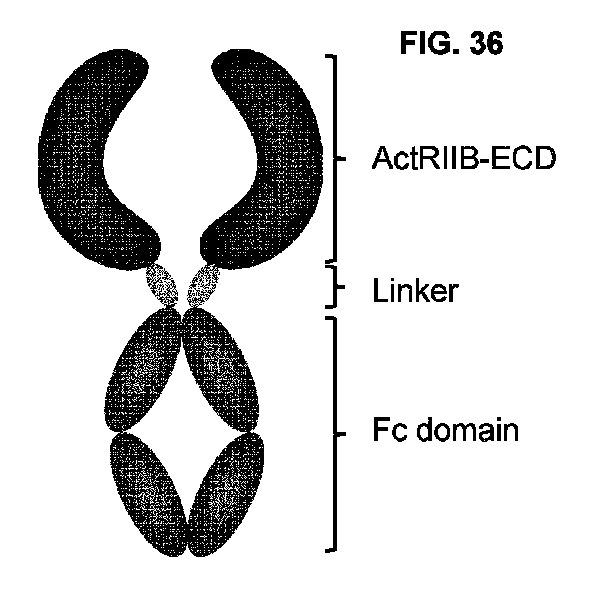
本明細書では、アクチビン受容体IIB型(ActRIIB)-エクトドメイン(ECD)ベースのトラップであって、TGFβスーパーファミリーリガンドの結合及び中和のために調整されたリガンド特異性プロファイルを有する、トラップ、ならびにTGFβスーパーファミリーシグナル伝達と関連するか、またはそれによって媒介された疾患及び状態の治療における薬学的組成物及びその使用方法が提供される。
本明細書で提供されるActRIIB-ECDトラップは、2つのポリペプチドを一緒に組み立てるように機能することができるFcドメイン単量体に融合したActRIIB-ECDバリアントを含む。本明細書で提供されるActRIIB-ECDバリアントは、有害作用を最小限に抑えながら、ある特定の疾患適応症における治療有効性を最大化するために、リガンド特異性を調整するように設計されている。本明細書で提供されるActRIIB-ECDバリアントは、アクチビンA、アクチビンB、GDF-8、及び/またはGDF-11などの他のTGFβスーパーファミリーリガンドの中和を維持及び/または増加させながら、内因性BMP-9シグナル伝達の中断を予防または低減することを目的として、ActRIIB-ECDに新規のアミノ酸置換を導入することによって構築される。理論に限定されることを望むものではないが、BMP-9シグナル伝達を回避する目的は、BMP-9が血管静止及び恒常性の維持に重要であるという発見に基づいている(Desroches-Castan,A.et al.,2022)。野生型ActRIIBは、BMP-9に結合し、したがって、ActRIIB-ECDベースのトラップは、出血の懸念をもたらし得る血管恒常性を破壊する可能性を有する。この概念を支持するために、毛細血管拡張症、鼻出血及び歯肉出血が、非変異ActRIIB-ECDトラップ(ACE-031と呼ばれる)の臨床研究において観察された(Campbell,C.et al.,2017)。これらの血管作用は、BMP-9経路の阻害に起因し得ることが示唆された。
本明細書で提供される好ましいActRIIB-ECDバリアントは、(1)野生型ActRIIBと比較して、アクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10と同様または改善された結合(リガンド結合について内因性アクチビン受容体と競合し、内因性リガンド刺激受容体シグナル伝達を低減または阻害することを可能にする)、(2)野生型ActRIIBと比較して、BMP-9との結合の低減または除去(恒常的BMP-9シグナル伝達を維持することを可能にする)を示す。これらのバリアントは、肺高血圧症(PH)(例えば、PAH、静脈PH、低酸素PH、血栓塞栓性PH、もしくは雑種PH)、代謝性疾患、骨疾患、筋疾患、線維症、及び/または低い赤血球レベル(例えば、貧血)などのアクチビン受容体シグナル伝達が上昇する疾患及び状態を治療するために使用することができる。バリアントは、例えば、PHの症状または進行の低減(例えば、PAH、静脈PH、低酸素PH、血栓塞栓性PH、もしくは雑種PH)、骨吸収または破骨細胞活性の低減、骨形成または骨ミネラル密度の増加、筋肉量または筋力の増加、線維症の低減(例えば、線維症の減少、または線維症の進行の遅延もしくは停止)、及び/または赤血球レベルの増加(例えば、ヘモグロビンレベル、ヘマトクリット、もしくは赤血球数の増加)をもたらし得る。
いくつかの実施形態では、本開示は、(a)アクチビン受容体IIB型(ActRIIB)エクトドメイン(ECD)バリアント、(b)少なくとも10個のアミノ酸を含むペプチドリンカー、及び(c)Fcドメイン単量体を含むポリペプチドを提供する。いくつかの実施形態では、ActRIIB ECDは、配列番号2のヒト野生型ActRIIB-ECDと比較して、G27、Q29、D30、K31、S38、D57、F58、V75、及びF77から選択される位置に1つ以上のアミノ酸置換を含む。
いくつかの実施形態では、ActRIIB ECDは、アミノ酸置換G27Dを含む。いくつかの実施形態では、ActRIIB ECDは、配列番号20と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。いくつかの実施形態では、ActRIIB ECDは、アミノ酸置換Q29Yを含む。いくつかの実施形態では、ActRIIB ECDは、配列番号14と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。いくつかの実施形態では、ActRIIB ECDは、アミノ酸置換D30Qを含む。いくつかの実施形態では、ActRIIB ECDは、配列番号15と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。いくつかの実施形態では、ActRIIB ECDは、アミノ酸置換K31Yを含む。いくつかの実施形態では、ActRIIB ECDは、配列番号16と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。いくつかの実施形態では、ActRIIB ECDは、アミノ酸置換S38Rを含む。いくつかの実施形態では、ActRIIB ECDは、配列番号17と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。いくつかの実施形態では、ActRIIB ECDは、アミノ酸置換D57Eを含む。いくつかの実施形態では、ActRIIB ECDは、配列番号4と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。
いくつかの実施形態では、ActRIIB ECDは、F58D、F58E、F58Y、F58K、F58Q、F58N、F58R、F58H、及びF58Wから選択される位置F58にアミノ酸置換を含む。いくつかの実施形態では、ActRIIB ECDは、アミノ酸置換F58Dを含む。いくつかの実施形態では、ActRIIB ECDは、配列番号6と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。いくつかの実施形態では、ActRIIB ECDバリアントは、アミノ酸置換F58Eを含む。いくつかの実施形態では、ActRIIB ECDは、配列番号5と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。いくつかの実施形態では、バリアントは、アミノ酸置換F58Yを含む。いくつかの実施形態では、ActRIIB ECDは、配列番号7と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。いくつかの実施形態では、ActRIIB ECDは、アミノ酸置換F58Kを含む。いくつかの実施形態では、ActRIIB ECDは、配列番号8と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。いくつかの実施形態では、バリアントは、アミノ酸置換F58Qを含む。いくつかの実施形態では、ActRIIB ECDは、配列番号9と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。いくつかの実施形態では、バリアントは、アミノ酸置換F58Wを含む。いくつかの実施形態では、ActRIIB ECDは、配列番号10と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。いくつかの実施形態では、バリアントは、アミノ酸置換F58Nを含む。いくつかの実施形態では、ActRIIB ECDは、配列番号11と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。いくつかの実施形態では、バリアントは、アミノ酸置換F58Hを含む。いくつかの実施形態では、ActRIIB ECDは、配列番号13と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。いくつかの実施形態では、バリアントは、アミノ酸置換F58Rを含む。いくつかの実施形態では、ActRIIB ECDは、配列番号12と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。
いくつかの実施形態では、ActRIIB ECDは、アミノ酸置換V75Qを含む。いくつかの実施形態では、ActRIIB ECDは、配列番号18と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。いくつかの実施形態では、ActRIIB ECDは、アミノ酸置換F77Dを含む。いくつかの実施形態では、ActRIIB ECDは、配列番号19と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。
いくつかの実施形態では、ActRIIB-ECDバリアントは、1つ以上の追加のアミノ酸置換を更に含む。いくつかの実施形態では、ActRIIB-ECDバリアントは、N末端に以下のアミノ酸:GRGEA(配列番号23)を更に含む。いくつかの実施形態では、ActRIIB-ECDバリアントは、C末端にアラニン-プロリン-トレオニン(APT)の3-アミノ酸伸長を更に含む。
いくつかの実施形態では、ポリペプチドは、N末端からC末端に、以下の構造:ActRIIB-ECD-ペプチドリンカー-Fcドメイン単量体を含む。
いくつかの実施形態では、Fcドメイン単量体は、IgG1、IgG2、IgG3、またはIgG4アイソタイプである。いくつかの実施形態では、Fcドメイン単量体は、ヒトFcドメイン単量体またはマウスFcドメイン単量体である。いくつかの実施形態では、Fcドメイン単量体は、ポリペプチドの二量体の凝集を低減するか、またはその安定性を調節するように操作される。いくつかの実施形態では、Fcドメイン単量体は、M252Y、S254T、及びT256E(YTE)のアミノ酸置換を含む。いくつかの実施形態では、Fcドメイン単量体は、M252Yアミノ酸置換を含む。いくつかの実施形態では、Fcドメイン単量体は、356位にD、及び358位にL(DL)を含む。いくつかの実施形態では、Fcドメイン単量体は、356位にE、及び358位にM(EM)を含む。いくつかの実施形態では、Fcドメイン単量体は、C末端にリジン残基(K)を更に含む。
いくつかの実施形態では、Fcドメイン単量体は、配列番号134~173及び338のうちのいずれか1つと少なくとも85%、少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%同一であるアミノ酸配列を含む。いくつかの実施形態では、Fcドメイン単量体は、配列番号134~173及び338のうちのいずれか1つから選択されるアミノ酸配列を含むか、またはそれからなる。いくつかの実施形態では、Fcドメイン単量体は、(a)IgG1アイソタイプであり、配列番号135または配列番号134に示されるアミノ酸配列を含むか、もしくはそれからなる、または(b)IgG2アイソタイプであり、配列番号157に示されるアミノ酸配列を含むか、もしくはそれからなる。いくつかの実施形態では、Fcドメイン単量体は、二量体を形成する。
いくつかの実施形態では、ペプチドリンカーは、グリシンリッチである。いくつかの実施形態では、ペプチドリンカーは、10~40アミノ酸長である。いくつかの実施形態では、リンカーは、少なくとも10アミノ酸長、少なくとも14アミノ酸長、少なくとも19アミノ酸長、または少なくとも39アミノ酸長である。いくつかの実施形態では、リンカーは、10アミノ酸長、14アミノ酸長、19アミノ酸長、または39アミノ酸長である。いくつかの実施形態では、リンカーは、14アミノ酸長である。いくつかの実施形態では、ペプチドリンカーは、配列番号34、54、59、または63のうちのいずれか1つに示されるアミノ酸配列を含む。
いくつかの実施形態では、ActRIIB-ECDは、配列番号4~22、331、332、及び24~33のうちのいずれか1つと少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。いくつかの実施形態では、ActRIIB-ECDは、配列番号4~22、331、332、及び24~33のうちのいずれか1つから選択されるアミノ酸配列を含むか、またはそれからなる。いくつかの実施形態では、ActRIIB-ECDは、配列番号5のアミノ酸配列、またはそれと少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を含むか、またはそれからなる。いくつかの実施形態では、ActRIIB-ECDは、配列番号8のアミノ酸配列、またはそれと少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を含むか、またはそれからなる。いくつかの実施形態では、ActRIIB-ECDは、配列番号9のアミノ酸配列、またはそれと少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を含むか、またはそれからなる。
いくつかの実施形態では、ポリペプチドは、配列番号174~254、333、及び339~341から選択されるアミノ酸配列と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。いくつかの実施形態では、ポリペプチドは、配列番号174~254、333、及び339~341から選択されるアミノ酸配列を含むか、またはそれからなる。いくつかの実施形態では、ポリペプチドは、配列番号186、190~194、232~233、及び247~248から選択されるアミノ酸配列と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。いくつかの実施形態では、ポリペプチドは、配列番号186、190~194、232~233、及び247~248から選択されるアミノ酸配列を含むか、またはそれからなる。いくつかの実施形態では、ポリペプチドは、配列番号186のアミノ酸配列、またはそれと少なくとも95%、96%、97%、98%、もしくは99%同一であるアミノ酸配列を含むか、またはそれからなる。いくつかの実施形態では、ポリペプチドは、配列番号213~216及び242~244から選択されるアミノ酸配列と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。いくつかの実施形態では、ポリペプチドは、配列番号213~216及び242~244から選択されるアミノ酸配列を含むか、またはそれからなる。いくつかの実施形態では、ポリペプチドは、配列番号220~223、253、及び254から選択されるアミノ酸配列と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む。いくつかの実施形態では、ポリペプチドは、配列番号220~223、253、及び254から選択されるアミノ酸配列を含むか、またはそれからなる。
いくつかの実施形態では、ポリペプチドは、リンカーを介して、ActRIIB-ECDのN末端またはC末端に融合したアルブミン結合ドメイン、フィブロネクチンドメイン、またはヒト血清アルブミンドメインを更に含む。いくつかの実施形態では、ポリペプチドは、ActRIIB-ECDのN末端に配列番号1のシグナルペプチドを更に含む。いくつかの実施形態では、ポリペプチドは、標的化剤、治療部分、検出可能部分、または診断部分とコンジュゲートされている。
いくつかの実施形態では、標的化剤、治療部分、検出可能部分、または診断部分は、抗体またはその抗原結合断片、TGFβスーパーファミリーの別のメンバーに対して、もしくは別の治療標的に対して親和性を有する結合剤、放射線療法剤、イメージング剤、蛍光部分、細胞傷害性剤、抗有糸分裂薬、ナノ粒子ベースの担体、ポリマーコンジュゲート薬、ナノ担体、イメージング剤、安定化剤、薬物、ナノ担体、またはデンドリマーを含む。
いくつかの実施形態では、ポリペプチドは、第1のポリペプチドのFcドメイン単量体と第2のポリペプチドのFcドメイン単量体との間の少なくとも1つのジスルフィド結合によって連結された第1のポリペプチド及び第2のポリペプチドを含む二量体を形成する。
いくつかの実施形態では、本開示は、本明細書に記載の第1のポリペプチド及び本明細書に記載の第2のポリペプチドを含むTGFβスーパーファミリーリガンド結合剤を提供し、第1のポリペプチド及び第2のポリペプチドは、第1のポリペプチドのFcドメイン単量体と第2のポリペプチドのFcドメイン単量体との間の少なくとも1つのジスルフィド結合によって連結される。いくつかの実施形態では、第1のポリペプチド及び第2のポリペプチドは、配列番号174~254、333、及び339~341から選択されるアミノ酸配列、またはそれと少なくとも95%、96%、97%、98%、もしくは99%同一であるアミノ酸配列を含むか、またはそれからなる。
いくつかの実施形態では、第1のポリペプチド及び第2のポリペプチドは、配列番号186、190~194、232~233、及び247~248から選択されるアミノ酸配列、またはそれと少なくとも95%、96%、97%、98%、もしくは99%同一であるアミノ酸配列を含むか、またはそれからなる。いくつかの実施形態では、第1のポリペプチド及び第2のポリペプチドは、配列番号186、またはそれと少なくとも95%、96%、97%、98%、もしくは99%同一であるアミノ酸配列を含むか、またはそれからなる。いくつかの実施形態では、第1のポリペプチド及び第2のポリペプチドは、配列番号213~216、及び242~244から選択されるアミノ酸配列、またはそれと少なくとも95%、96%、97%、98%、もしくは99%同一であるアミノ酸配列を含むか、またはそれからなる。いくつかの実施形態では、第1のポリペプチド及び第2のポリペプチドは、配列番号220~223、253、及び254から選択されるアミノ酸配列、またはそれと少なくとも95%、96%、97%、98%、もしくは99%同一であるアミノ酸配列を含むか、またはそれからなる。
いくつかの実施形態では、ポリペプチドまたは結合剤は、ヒトアクチビンA、アクチビンB、GDF-8、GDF-11、及び/または骨形態形成タンパク質(BMP)-10に結合し、ヒト野生型ActRIIB-ECDのヒトBMP-9への結合と比較して、ヒトBMP-9への結合が低減している。いくつかの実施形態では、ポリペプチドまたは結合剤は、ヒトBMP-9に実質的に結合しない。いくつかの実施形態では、ポリペプチドまたは結合剤は、ヒトアクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上のシグナル伝達を阻害する。いくつかの実施形態では、ポリペプチドまたは結合剤は、ヒトBMP-9シグナル伝達を阻害しない。
いくつかの実施形態では、ヒトBMP-9シグナル伝達に対するポリペプチドまたは結合剤の阻害効力は、ヒトBMP-9シグナル伝達に対するヒト野生型ActRIIB-ECDの阻害効力と比較して約100倍、約200倍、または約300倍低い。いくつかの実施形態では、ヒトアクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上に対するポリペプチドまたは結合剤の阻害効力は、同じそれぞれのリガンド(複数可)に対するヒト野生型ActRIIB-ECDの阻害効力と実質的に同じであるか、またはそれと比較して増加している。いくつかの実施形態では、ヒトアクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上に対するポリペプチドの阻害効力は、同じそれぞれのリガンド(複数可)に対するヒト野生型ActRIIB-ECDの阻害効力と比較して約2倍、約3倍、約4倍、または約5倍以上増加する。
いくつかの実施形態では、本開示は、本明細書に記載のポリペプチドをコードする核酸分子を提供する。いくつかの実施形態では、核酸配列は、配列番号256~330、334、または342~344のうちのいずれか1つと、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%同一である。いくつかの実施形態では、核酸配列は、配列番号256~330、334、または342~344のうちのいずれか1つの核酸配列を含むか、またはそれからなる。いくつかの実施形態では、核酸は、核酸分子の5’末端に配列番号255に示される配列を更に含む。
いくつかの実施形態では、本開示は、本明細書に記載の核酸を含むベクターを提供する。いくつかの実施形態では、本開示は、本明細書に記載の核酸分子またはベクターを含む宿主細胞を提供し、核酸分子またはベクターは、宿主細胞内で発現される。
いくつかの実施形態では、本開示は、(a)本明細書に記載の核酸分子またはベクターを含む宿主細胞を提供することと、(b)ポリペプチドの発現を可能にする条件下で宿主細胞を培養することと、(c)培養物から発現されたポリペプチドを回収することと、を含む、本明細書に記載のポリペプチドを調製する方法を提供する。
いくつかの実施形態では、本開示は、本明細書に記載のポリペプチドまたは結合剤と、薬学的に許容される担体、希釈剤、または賦形剤と、を含む、薬学的組成物を提供する。いくつかの実施形態では、組成物は、注射または注入による投与のために製剤化される。いくつかの実施形態では、組成物は、静脈内、皮下、腹腔内、または筋肉内投与用に製剤化される。
いくつかの実施形態では、ポリペプチドまたは結合剤は、対象において血管合併症を引き起こさず、及び/または対象において血管透過性もしくは漏出を増加させない。いくつかの実施形態では、ポリペプチドまたは結合剤は、赤血球質量を増加させず、ヘモグロビンを増加させず、血小板減少症を引き起こさず、及び/または対象において血液合併症を引き起こさない。
いくつかの実施形態では、本開示は、本明細書に記載のポリペプチドもしくは結合剤、または本明細書に記載の薬学的組成物、及び任意選択で、使用説明書を含むキットを提供する。
いくつかの実施形態では、本開示は、TGFβスーパーファミリーリガンドシグナル伝達と関連する疾患または状態の治療または予防を必要とする対象においてそれを行う方法を提供し、方法は、本明細書に記載のポリペプチド、結合剤、または薬学的組成物を対象に投与することを含む。いくつかの実施形態では、対象は、ヒトである。いくつかの実施形態では、TGFβスーパーファミリーリガンドは、アクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上である。
いくつかの実施形態では、本開示は、対象におけるアクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10と関連するか、またはそれによって媒介された疾患または状態を治療または予防する方法を提供し、方法は、本明細書に記載のポリペプチド、結合剤、または薬学的組成物を対象に投与することを含む。いくつかの実施形態では、疾患または状態は、アクチビンA及び/またはアクチビンB及び/またはGDF-8及び/またはGDF-11の過剰発現または過剰活性化を特徴とする。
いくつかの実施形態では、疾患または状態は、肺高血圧症(PH)、線維症、筋力低下または萎縮、代謝障害、心臓代謝性疾患、骨損傷、及び低い赤血球レベルから選択される。
いくつかの実施形態では、PHは、肺動脈高血圧症(PAH)である。いくつかの実施形態では、PAHは、感染症、先天性心臓異常、門脈高血圧症、肺静脈閉塞性疾患、肺毛細血管腫症、結合組織障害、慢性閉塞性肺疾患、自己免疫障害(例えば、強皮症もしくはループス)、または薬物使用(例えば、コカインもしくはメタンフェタミンの使用)と関連する特発性PAH、遺伝性PAH、またはPAHである。
いくつかの実施形態では、線維症は、肺線維症、特発性肺線維症、腎線維症(renal fibrosis)、肝線維症、肺線維症、腎線維症(kidney fibrosis)、骨髄線維症、全身性硬化症、皮膚線維症、心臓線維症、骨髄線維症、角膜線維症、縦隔線維症、後腹膜線維症、骨関節線維症、関節線維症、組織線維症、線維腫増殖性障害、または結合組織障害である。
いくつかの実施形態では、筋力低下または萎縮疾患もしくは状態は、デュシェンヌ型筋ジストロフィー(DMD)、顔面肩甲上腕型筋ジストロフィー(FSHD)、封入体筋炎(IBM)、筋萎縮性側索硬化症(ALS)、サルコペニア、またはがん悪液質である。
いくつかの実施形態では、代謝障害は、肥満、1型糖尿病、2型糖尿病、または前糖尿病である。
いくつかの実施形態では、心臓代謝性疾患または状態は、駆出率低下を伴う心不全(HFrEF)または駆出率維持を伴う心不全(HFpEF)である。
いくつかの実施形態では、骨損傷は、骨脱塩、骨粗しょう症(例えば、原発性もしくは二次性)、骨減少症、大理石骨病、骨折、骨癌もしくはがん転移関連の骨損失、パジェット病、腎性骨ジストロフィー、治療関連の骨損失、食事関連の骨損失、肥満の治療に関連する骨損失、低重力関連の骨損失、または不動性関連の骨損失を含む。
いくつかの実施形態では、低い血球レベルの疾患または状態は、貧血または失血である。
いくつかの実施形態では、本開示は、対象においてBMP9シグナル伝達を実質的に低減または阻害することなく、アクチビンA、アクチビンB、GDF-8、GDF-11及び/またはBMP10シグナル伝達を低減または阻害することを必要とする対象においてそれを行う方法を提供し、方法は、本明細書に記載のポリペプチド、結合剤、または薬学的組成物を対象に投与することを含む。いくつかの実施形態では、対象は、哺乳類である。いくつかの実施形態では、哺乳類は、ヒトである。
いくつかの実施形態では、方法は、対象において血管合併症を引き起こさず、対象において血管透過性もしくは漏出を増加させず、赤血球質量を増加させず、ヘモグロビンを増加させず、血小板減少を引き起こさず、及び/または対象において血液合併症を引き起こさない。
本技術の更なる範囲、適用可能性及び利点は、以下に与えられる非限定的な詳細な説明から明らかになるであろう。しかしながら、この詳細な説明は、本技術の例示的な実施形態を示すが、添付の図面を参照して、単なる例として提供されることを理解されるべきである。
本特許または出願書類は、カラーで作成された少なくとも1つの図面を含む。カラー図面(複数可)を含む本特許または特許出願公開の複写は、要請かつ必要な料金の支払により特許庁より提供される。
技術のより良い理解のために、及び技術がどのように実施され得るかをより明確に示すために、ここでは、本技術の非限定的な実施形態による態様及び特徴を図示する添付の図面を例として参照する。
概要
アクチビンII型受容体は、TGFβスーパーファミリーにおけるリガンドのシグナルを調節する単一の膜貫通ドメイン受容体である。アクチビンII型受容体には、2つのタイプ:ActRIIA及びActRIIBが存在する。TGFβスーパーファミリーのリガンドの例としては、アクチビン(例えば、アクチビンA及びアクチビンB)、インヒビン、成長分化因子(GDF)(例えば、GDF-8、ミオスタチン及びGDF-11としても知られる)、及び骨形態形成タンパク質(BMP)(BMP-9、BMP-10)が挙げられる。TGFβスーパーファミリーリガンドの活性は、肺高血圧症(PH)、線維症、筋疾患(筋ジストロフィーを含む)、代謝障害(II型糖尿病を含む)、骨疾患、及び貧血を含む様々な疾患及び障害に関与している。
アクチビンII型受容体は、TGFβスーパーファミリーにおけるリガンドのシグナルを調節する単一の膜貫通ドメイン受容体である。アクチビンII型受容体には、2つのタイプ:ActRIIA及びActRIIBが存在する。TGFβスーパーファミリーのリガンドの例としては、アクチビン(例えば、アクチビンA及びアクチビンB)、インヒビン、成長分化因子(GDF)(例えば、GDF-8、ミオスタチン及びGDF-11としても知られる)、及び骨形態形成タンパク質(BMP)(BMP-9、BMP-10)が挙げられる。TGFβスーパーファミリーリガンドの活性は、肺高血圧症(PH)、線維症、筋疾患(筋ジストロフィーを含む)、代謝障害(II型糖尿病を含む)、骨疾患、及び貧血を含む様々な疾患及び障害に関与している。
TGFβスーパーファミリーリガンド機能を阻害する治療薬を開発するための1つのアプローチは、可溶性デコイ受容体(受容体エクトドメイン(ECD)ベースのリガンドトラップとも呼ばれる)を使用してリガンドに結合及び隔離し、それによって細胞表面受容体へのアクセスを遮断することであった。一般に、受容体ECDベースのトラップは、リガンドを選択的に隔離することができ、タンパク質操作アプローチを使用して最適化することができる治療剤のクラスである。例えば、TGFβ1及び/またはTGFβ2及び/またはTGFβ3リガンドアイソフォームに結合または「トラップ」するTGFβ受容体エクトドメインに基づくポリペプチド融合物が、TGFβシグナル伝達を阻害するために使用されている(例えば、WO01/83525、WO2005/028517、WO2008/113185、WO2008/157367、WO2010/0031168、WO2010/099219、WO2012/071649、WO2012/142515、WO2013/000234、WO2018/158727、US5693607、US2005/0203022、US2007/0244042、US8318135、US8658135、US8815247、US2015/0225483、US2015/0056199、及びWO2017/037634を参照)。
肺の内皮及び血管系において、骨形態形成タンパク質(BMP)は、平滑筋細胞(SMC)及び内皮細胞(EC)の生存における抗増殖効果を誘導することができ、一方、アクチビン及び成長分化因子(GDF)は、相反する効果、すなわち、SMCにおける増殖促進効果及びECのアポトーシスを誘導することができる(Yung,L.M.et al.,2020、Ryanto,G.R.T.et al.,2021)。生理学的条件下では、これらのリガンドは、恒常性を維持するために協調して作用する。しかしながら、PAHなどのある特定の疾患状態では、これらの経路が不均衡になる。例えば、PAHの家族性症例の約80%及び特発性症例の約20%は、骨形態形成タンパク質(BMP)2型受容体(BMPR2)の変異によって引き起こされる(Austin,E.D.and Loyd,J.E.,2007、Quarck,R.and Perros,F.,2017)。これは、アクチビン/GDFとBMPシグナル伝達経路との間の不均衡をもたらす(Ryanto,G.R.T.et al.,2021)。したがって、経路を再バランスさせ、血管恒常性を再確立するために、ある特定のリガンドを中和することができ、他のリガンドを中和することができない受容体エクトドメインベースのトラップを提供することが望ましい。
いくつかのECDベースのトラップは、1つ以上のTGFβスーパーファミリーリガンドへの結合を改変するために、化合物のエクトドメイン部分にアミノ酸変異を含む。例えば、WO2021/158675、WO2022/150590、WO2021/158675、WO2022/072882、WO2021/189019、及びWO2021/189010を参照されたい。ActRIIB ECDにおける点変異は、他のトラップベースの薬剤の文脈で説明されているが、本開示は、長いペプチドリンカーと組み合わせた場合のこれらの変異の効果を強調する。具体的には、本出願のデータは、ActRIIB ECDのある特定の変異が、長いペプチドリンカー(すなわち、10以上のアミノ酸)と組み合わせた場合、TGFβスーパーファミリーリガンド結合に予測不可能な効果を有することを実証する。
したがって、本出願は、改善されたリガンド結合プロファイル及び治療有効性を示すTGFβスーパーファミリーリガンド結合剤を提供する。ActRIIB ECDにおける点変異と本明細書に記載の長いリンカーとの組み合わせは、これらの点変異の有益なリガンド結合プロファイルが特定の長さのリンカーとの組み合わせによって更に増強され得る、プラットフォームを提供する。これらのプラットフォーム化合物は、肺高血圧症、筋肉疾患、代謝障害、骨疾患、貧血、及び線維症を含む、TGFβスーパーファミリーリガンドによって駆動される様々な疾患及び障害の治療に有用である。
本技術は、以下でより詳細に説明される。この説明は、技術が実装され得る全ての異なる方法、または本技術に追加され得る全ての特徴の詳細なカタログであることを意図するものではない。例えば、一実施形態に関して示される特徴は、他の実施形態に組み込まれてもよく、特定の実施形態に関して示される特徴は、その実施形態から削除されてもよい。加えて、本明細書に示唆される様々な実施形態に対する多数の変形及び追加は、本開示に照らして当業者には明らかであり、その変形及び追加は、本技術から逸脱しない。したがって、以下の説明は、本技術のいくつかの特定の実施形態を例示することを意図しており、その全ての順列、組み合わせ、及び変形を網羅的に指定することを意図していない。
定義
本明細書で使用される用語の明確で一貫した理解を提供するために、いくつかの定義を以下に提供する。更に、別段定義されない限り、本明細書で使用される全ての技術用語及び科学用語は、本発明が属する当業者に一般に理解されるのと同じ意味を有する。
本明細書で使用される用語の明確で一貫した理解を提供するために、いくつかの定義を以下に提供する。更に、別段定義されない限り、本明細書で使用される全ての技術用語及び科学用語は、本発明が属する当業者に一般に理解されるのと同じ意味を有する。
特許請求の範囲及び/または明細書において「含む」という用語とともに使用されるときの「a」及び「an」及び「the」という用語の使用は、「1つ」を意味し得るが、「1つ以上」、「少なくとも1つ」及び「1つまたは2つ以上」の意味とも一致する。同様に、「別の」という用語は、少なくとも第2のまたはそれ以上を意味し得る。これらの用語は、本明細書で別段の指示がない限り、または文脈によって明らかに矛盾しない限り、単数形及び複数形の両方を網羅するように解釈されるべきである。
本明細書で使用される場合、「含む(comprising)」(ならびに「含む(comprise」及び「含む(comprises)」などの任意の形態の含む(comprising))、「有する(having)」(ならびに「有する(have)」及び「有する(has)」などの任意の形態の有する(having))、「含む(including)」(ならびに「含む(include)」及び「含む(includes)」などの任意の形態の含む(including))または「含有する(containing)」(ならびに「含有する(contain)」及び「含有する(contains)」などの任意の形態の含有する(containing))という用語は、包括的またはオープンエンドであり、追加の列挙されていない要素またはプロセスステップを除外しない。「からなる」という用語は、クローズエンドとして解釈されるべきである。
「約」という用語は、値または量が、実際の所与の値、及びそのような所与の値に対する実験及び/または測定条件による等価及び近似を含む、当該技術分野における一般的な技術に基づいて合理的に推測されるであろうそのような所与の値の近似を指すことを示すために使用される。例えば、所与の値または範囲の文脈における「約」という用語は、所与の値または範囲の20%以内、好ましくは15%以内、より好ましくは10%以内、より好ましくは9%以内、より好ましくは8%以内、より好ましくは7%以内、より好ましくは6%以内、及びより好ましくは5%以内の値または範囲を指す。
本明細書で使用される場合、「及び/または」という表現は、他のものの有無にかかわらず、指定された特徴または構成要素の各々の具体的な開示として解釈されるべきである。例えば、「A及び/またはB」は、(i)A、(ii)B、ならびに(iii)A及びBの各々の具体的な開示として、あたかも各々が本明細書に個々に記載されているかのように解釈されるべきである。「または」という用語は、本明細書で使用される場合、具体的に記載されていないか、または文脈から明らかでない限り、包含的であると理解され、「または」及び「及び」の両方を包含する。例えば、「AまたはBを含む組成物」の一実施形態は、典型的には、A及びBの両方を含む組成物を有する態様を提示するであろう。しかしながら、「または」は、矛盾なしに組み合わせることができないそれらの態様(例えば、9~10または7~8の組成物pH)を除外すると解釈されるべきである。
本明細書では、「1~20」などの用語が、1及び20を含めてこれらの中に含まれる任意の個々の値を含むことを理解されたい。したがって、「1~20」という用語は、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、及び/または20を含む。「1~20」などの用語はまた、1及び20を含めてこれらの中に含まれる任意の個々の部分範囲を含む。したがって、「1~20」という用語はまた、「1~9」、「2~9」、「3~5」、「5~9」、「5~20」、「8~20」などの部分範囲を含む。同じことが、「1~19」、「1~18」、「1~10」、「1~9」、「5~15」などの類似の表現にも当てはまるが、これらに限定されない。
本明細書では、「約15~約35」などの用語が、15及び35を含めてこれらの中に含まれる任意の個々の値を含むことを理解されたい。したがって、「約15~約35」などの用語は、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、及び/または35などの15及び35を含めてこれらの間の任意の数を含む。「約15~約35」などの用語はまた、15及び35を含めてこれらの中に含まれる任意の個々の部分範囲、「約16~約34」、「約16~約24」、「約24~約34」などを含む。アミノ酸の数の文脈における「約」という用語は、特定の数のアミノ酸が特異的に包含され、アミノ酸残基の数の+/-2の変動を可能にすることを意味する。したがって、「約15~約35」などの用語はまた、「13~37」、「13~35」、「17~37」、「17~35」などを含む。同じことは、「約16~約34」、「約16~約24」、約24~約34」などの同様の表現にも当てはまるが、これらに限定されない。
本明細書では、「少なくとも80%同一」などの用語は、80%及び100%を含めてこれらの中に含まれ、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%及び100%を含む任意の個々の値を含むことを理解されたい。「少なくとも80%同一」という用語はまた、例えば、「85%~99%」、「97%~100%」、「90%~100%」など、80%及び100%を含めてこれらの中に含まれる任意の個々の部分範囲を含む。同じことは、同様の表現、例えば、「少なくとも70%同一」、「少なくとも90%同一」などの表現にも当てはまるが、これらに限定されない。
本明細書で使用される場合、「IC50」という用語は、半最大阻害濃度(すなわち、インビトロで50%の阻害に必要な物質の濃度)を指す。それは、特定の生物学的または生化学的機能を阻害する物質の効力または有効性の尺度である。IC50値は、典型的には、モル濃度として表される。阻害剤のIC50は、用量反応曲線を構築し、問題の特定の生物学的または生化学的機能に対する異なる濃度の阻害剤の効果を調べることによって決定することができる。
本明細書で使用される場合、「阻害効力」という用語は、限定されないが、タンパク質受容体とそのリガンドとの間の結合、またはそのリガンドによる細胞受容体の活性化などの特定の生物学的または生化学的機能を阻害する物質の有効性を指す。いくつかの実施形態では、阻害の効力は、特定のリガンドまたは物質に対する阻害剤のIC50を測定することによって決定される。その場合、異なる阻害剤及び/またはリガンドに対する相対阻害効力は、IC50値を比較することによって評価され得る。例えば、3:1の相対阻害効力は、比較されている2つの物質のIC50値の比が3:1であることを意味し、第1の物質は、第2の物質よりも低い阻害効力(すなわち、より大きいIC50)を有する。1:3の相対阻害効力は、比較されている2つの物質のIC50値の比が1:3であることを意味し、第1の物質は、第2の物質よりも高い阻害効力(すなわち、より低いIC50)を有する。阻害剤のIC50は、アッセイ条件によって異なる可能性があるため、異なる阻害剤及び/またはリガンドに対する相対阻害効力は、一般に、同じアッセイ条件下で得られたIC50値を比較することによって決定される。「阻害効力(inhibition potency)」、「阻害効力(inhibitory potency)」、「阻害の効力」、及び「中和効力」という用語は、本明細書において互換的に使用される。
本明細書で使用される場合、相対阻害効力に関して「実質的に同じ」という用語は、2つのタンパク質が、同じ実験条件、例えば、2つのタンパク質のIC50値の比が約2:1、1:2、または1:1である条件下で、ほぼ同じ、例えば、約2倍以下の異なる(+/-2倍)相対阻害効力を有することを意味する。
本明細書で使用される場合、「機能的に同等の」という用語は、それが由来する元の配列と同じまたは実質的に同じ生物学的活性または機能、例えば、元の配列と比較して生理学的、化学的、理化学的または機能的特性に著しい変化がないバリアント配列を指す。「実質的に同一の」という用語は、元の配列または参照配列と機能的に等価であり、それに対して高度な配列同一性を有する配列を指す。一般に、実質的に同一の配列は、元の配列または参照配列と少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、または少なくとも約99%同一であり、同じ機能を有する。場合によっては、核酸配列を指すとき、実質的に同一の配列は、高いストリンジェンシー条件下、例えば、ハイブリダイゼーション及び洗浄の両方について、0.5X SSC~約5X SSC及び65℃に実質的に等しい塩及び温度条件下で、元の配列にハイブリダイズする。
「二量体」という用語は、TGFβスーパーファミリーリガンド結合剤(本明細書では「結合剤」とも称される)における本明細書に記載される2つのポリペプチドの存在を指す。「ホモ二量体」は、2つのポリペプチドが同じアミノ酸配列を有することを意味するが、「ヘテロ二量体」は、2つのポリペプチドが異なるアミノ酸配列を有することを意味する。
「二価」という用語は、TGFβスーパーファミリーリガンド結合剤における2つのTGFβRスーパーファミリーリガンド結合領域(例えば、エクトドメイン)の存在を指す。
本明細書で使用される場合、「組換えポリペプチド」は、組換えDNA技術または遺伝子操作の使用を通じて作製されたポリペプチドである。本開示の文脈において、組換えポリペプチドは、しばしば「ポリペプチド構築物」または単に「ポリペプチド」と称される。
タンパク質(その断片、好ましくは生物学的に活性な断片、及び通常30アミノ酸未満を有するペプチドを含む)は、共有結合ペプチド結合を介して互いにカップリングされた2つ以上のアミノ酸を含む(アミノ酸の鎖をもたらす)。本明細書で使用される「ポリペプチド」という用語は、通常10個より多くのアミノ酸からなる分子群を説明する。「ポリペプチド」、「ポリペプチド鎖」及び「鎖」という用語は、本明細書において互換的に使用される。ポリペプチドは、更に、二量体、三量体、及びより高いオリゴマーなどの多量体、すなわち、2つ以上のポリペプチド分子からなる多量体を形成し得る。そのような二量体、三量体などを形成するポリペプチド分子は、同一であっても非同一であってもよい。そのような多量体の対応する高次構造は、結果として、ホモまたはヘテロ二量体、ホモまたはヘテロ三量体などと呼ばれる。ヘテロ多量体の例は、天然に存在する形態では、2つの同一の軽ポリペプチド鎖及び2つの同一の重ポリペプチド鎖からなる抗体分子である。「ペプチド」、「ポリペプチド」及び「タンパク質」という用語はまた、例えば、グリコシル化、アセチル化、リン酸化などの翻訳後修飾によって、修飾が行われる天然に修飾されたペプチド/ポリペプチド/タンパク質を指す。本明細書で言及される場合、「ペプチド」、「ポリペプチド」または「タンパク質」もまた、ペグ化など化学修飾され得る。そのような修飾は、当該技術分野において周知であり、本明細書に記載される。
本明細書で使用される場合、「(特異的に)に結合する」、「(特異的に)認識する」、「に特異的」、「(特異的に)向けられる」、及び「(特異的に)反応する」という用語は、ポリペプチドが、リガンドのTGFβスーパーファミリーの特異的メンバー(複数可)などの所与の標的(複数可)と相互作用するか、または特異的に相互作用することを意味する。特異的結合は、ポリペプチドのアミノ酸配列における特異的モチーフによって影響を受けると考えられている。したがって、結合は、それらの一次、二次及び/または三次構造ならびに当該構造の二次修飾の結果として達成される。標的-相互作用部位とその特異的標的との特異的相互作用は、当該部位の標的への単純な結合をもたらし得る。更に、標的相互作用部位とその特異的標的との特異的相互作用は、代替的または追加的に、例えば、標的のコンフォメーションの変化の誘導、標的のオリゴマー化などに起因して、シグナルの開始をもたらし得るか、または内因性受容体への結合などの別の活性を標的が行うことを遮断し得る。
一般に、結合親和性が約10-12~10-9M、10-12~10-19M、10-11~10-9M、または約10-11~10-9Mである場合、結合は特異的であると考えられる。ポリペプチドまたは結合剤が標的と特異的に反応するか、または標的に結合するかどうかは、とりわけ、ポリペプチドまたは結合剤と標的との反応を、ポリペプチドまたは結合剤と他のタンパク質との反応と比較することによって容易に試験することができる。いくつかの実施形態では、本開示のポリペプチドまたは結合剤は、所望のリガンド以外に、TGFβスーパーファミリーリガンドに実質的に結合せず、例えば、BMP-9に実質的に結合しない。
本明細書で使用される場合、「実質的に結合しない」または「結合することができない」という用語は、本開示のポリペプチドまたは結合剤が所与の標的に対する検出可能な結合を示していないこと、例えば、所与の標的と30%以下、20%以下、10%以下、または9%、8%、7%、6%、5%、または3%以下の反応性を示していないことを意味する。
本明細書で使用される場合、「選択的に結合する」という用語は、ポリペプチドが他のタンパク質と共有されていない標的部位に結合することを意味するために使用される。一般に、選択的結合剤は、他のタンパク質と交差反応せず、指定された標的タンパク質(複数可)に排他的に結合する。本開示の文脈において、「アクチビンA及びGDF-8に対して選択的」とは、例えば、BMP-9などの他のTGFβスーパーファミリーリガンドに実質的に結合または中和することなく、ポリペプチドまたは結合剤がアクチビンA及びGDF-8リガンドに独占的に結合または中和することを意味する。
「半減期」は、投与される薬物の50%が、生物学的プロセス、例えば、代謝、排泄などを通じて排除される時間を意味する。
「肝臓ファーストパス代謝」とは、肝臓との最初の接触時、すなわち、肝臓を通過する最初のパス中に代謝される薬物の傾向を指す。
「分布体積」は、例えば、細胞内及び細胞外空間、組織及び臓器などの身体の様々な区画にわたる薬物の保持の程度、ならびにこれらの区画内の薬物の分布を指す。
「血清結合の程度」は、アルブミンなどの血清タンパク質と相互作用し、結合し、薬物の生物活性の低下または喪失をもたらす薬物の傾向を指す。
「アミノ酸」または「アミノ酸残基」という用語は、典型的には、アラニン(AlaまたはA)、アルギニン(ArgまたはR)、アスパラギン(AsnまたはN)、アスパラギン酸(AspまたはD)、システイン(CysまたはC)、グルタミン(GlnまたはQ)、グルタミン酸(GluまたはE)、グリシン(GlyまたはG)、ヒスチジン(HisまたはH)、イソロイシン(HeまたはI)、ロイシン(LeuまたはL)、リジン(LysまたはK)、メチオニン(MetまたはM)、フェニルアラニン(PheまたはF)、プロライン(ProまたはP)、セリン(SerまたはS)、トレオニン(ThrまたはT)、トリプトファン(TrpまたはW)、チロシン(TyrまたはY)、及びバリン(ValまたはV)からなる群から選択されるアミノ酸など、その当該技術分野で認識される定義を有するアミノ酸を指すが、修飾されたアミノ酸、合成アミノ酸、または希少アミノ酸が、所望に応じて使用されてもよい。一般に、アミノ酸は、非極性側鎖(例えば、Ala、Cys、He、Leu、Met、Phe、Pro、Val)、負荷電側鎖(例えば、Asp、Glu)、正荷電側鎖(例えば、Arg、His、Lys)、または非荷電極性側鎖(例えば、Asn、Cys、Gin、Gly、His、Met、Phe、Ser、Thr、Trp、及びTyr)を有するように分類することができる。
同様に、本明細書に特定されるポリペプチドまたは結合剤の核酸配列に対する「核酸配列同一性パーセント(%)」は、ポリペプチドまたは結合剤のコード配列中のヌクレオチド残基と同一の候補配列中のヌクレオチド残基のパーセンテージとして定義される。特定の方法は、デフォルトパラメータに設定されたWU-BLAST-2のBLASTNモジュールを利用し、オーバーラップスパン及びオーバーラップ分数は、それぞれ1及び0.125に設定される。
TGFβスーパーファミリーリガンド結合剤
いくつかの実施形態では、本開示は、ActRIIB-ECD領域、リンカー領域、及びFcドメイン(本明細書では「結合剤」または「TGFβリガンド結合剤」とも称される)を含むTGFβスーパーファミリーリガンド結合剤を提供する。本明細書に記載の結合剤の個々の構成要素については、以下の章に更に詳細に記載されている。しかしながら、一般に、本明細書に記載の結合剤は、各々がActRIIB-ECD、ペプチドリンカー、及びFcドメイン単量体を含む2つのポリペプチドを含む二量体タンパク質である。2つのポリペプチドは、Fcドメイン単量体を介して組み立てられて、本明細書に記載の二量体結合剤を形成する。図36の概略図を参照されたい。組み立てると、各ポリペプチドにおけるFcドメイン単量体は、一方の末端で二量体Fcドメインを形成し、他方の末端で二価のActRIIB-ECD領域を形成する。本開示の結合剤は、アクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10から選択される1つ以上のリガンドに結合し、BMP-9に実質的に結合することなく、及び/またはその受容体を通じたBMP-9シグナル伝達を阻害することなく、それぞれの受容体を通じた1つ以上のリガンドのシグナル伝達を阻害することができる。結合剤はまた、本明細書に更に記載されるように、他のリガンドまたは標的への結合などの更なる生物学的活性または機能を有し得る。
いくつかの実施形態では、本開示は、ActRIIB-ECD領域、リンカー領域、及びFcドメイン(本明細書では「結合剤」または「TGFβリガンド結合剤」とも称される)を含むTGFβスーパーファミリーリガンド結合剤を提供する。本明細書に記載の結合剤の個々の構成要素については、以下の章に更に詳細に記載されている。しかしながら、一般に、本明細書に記載の結合剤は、各々がActRIIB-ECD、ペプチドリンカー、及びFcドメイン単量体を含む2つのポリペプチドを含む二量体タンパク質である。2つのポリペプチドは、Fcドメイン単量体を介して組み立てられて、本明細書に記載の二量体結合剤を形成する。図36の概略図を参照されたい。組み立てると、各ポリペプチドにおけるFcドメイン単量体は、一方の末端で二量体Fcドメインを形成し、他方の末端で二価のActRIIB-ECD領域を形成する。本開示の結合剤は、アクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10から選択される1つ以上のリガンドに結合し、BMP-9に実質的に結合することなく、及び/またはその受容体を通じたBMP-9シグナル伝達を阻害することなく、それぞれの受容体を通じた1つ以上のリガンドのシグナル伝達を阻害することができる。結合剤はまた、本明細書に更に記載されるように、他のリガンドまたは標的への結合などの更なる生物学的活性または機能を有し得る。
いくつかの実施形態では、本開示の結合剤は、抗体のFcドメイン単量体を介して、または定常CH2ドメイン、定常CH3ドメイン、及び/またはCH2及びCH3の組み合わせを介して会合する2つのポリペプチド鎖を含む。抗体の定常領域は、ヒトIgG1、IgG2、IgG3またはIgG4抗体由来であり得るか、またはそれらと実質的に同一であり得る。両方のポリペプチド鎖の会合は、一般に、タンパク質の発現及び分泌中に、例えば、哺乳動物細胞において生じる。Fcドメイン単量体は、一般に、ヒト由来であり、典型的には一本鎖ポリペプチド間のジスルフィド架橋を提供する抗体重鎖由来のCH2、CH3、またはCH2及びCH3を含む。一実施形態では、Fcドメイン単量体は、一本鎖ポリペプチド間に少なくとも1つのジスルフィド結合を提供する。別の実施形態では、Fcドメイン単量体は、一本鎖ポリペプチド間に少なくとも2つのジスルフィド結合を提供する。場合によっては、抗体重鎖は、例えば、宿主細胞での産生後、二量体ポリペプチドのプロテインAベースの単離も提供する。
上述のように、ECDにおけるある特定のTGFβスーパーファミリーリガンド結合剤及び点変異は、当該技術分野において記載されている。例えば、WO2021/158675、WO2022/150590、WO2021/158675、WO2022/072882、WO2021/189019、及びWO2021/189010を参照されたい。ActRIIB ECDにおける点変異は、他のTGFβスーパーファミリーリガンド結合剤の文脈で説明されているが、これらの前述の薬剤の文脈でのこれらの変異の効果は、本明細書に記載の結合剤の文脈でのこれらの同じ変異の効果を予測しない。具体的には、本出願のデータは、ActRIIBにおけるある特定の変異が、可変長のペプチドリンカーと組み合わせた場合、TGFβスーパーファミリーリガンド結合に予測不可能な効果を有することを実証する。
例えば、P121、P622、P624、P666、及びP667は各々、ActRIIB-ECDにおけるF58E変異を有する。P121及びP624は、ActRIIB ECDとFcドメインとを接続する3aaリンカーを有し、P622は、ActRIIB ECDとFcドメインとを接続する14aaリンカーを有し、P666は、ActRIIB ECDとFcドメインとを接続する19aaリンカーを有し、P667は、ActRIIB ECDとFcドメインとを接続する39aaリンカーを有する。以下の表9に示されるように、F58E変異とより長いリンカー(14aa以上)との組み合わせは、短い(3aa)リンカーとの組み合わせにおける同じ変異と比較して、アクチビンA及びアクチビンBに対するP622、P666、及びP667結合剤の阻害効力を増加させた。GDF-8及びGDF-11に対する阻害効力は、F58E変異を含む短いリンカー結合剤と長いリンカー結合剤との間で類似したままであった。図10C及び10Dを参照されたい。より長いリンカー(14aa)と組み合わせたF58E変異はまた、PAHのラットモデルにおいて優れた治療効果を示した(実施例5を参照)。
同様に、ActRIIB-ECDへのD57E変異の導入は、長いリンカー(14aa)と組み合わせたときに融合タンパク質の阻害効力を増加させた。例えば、P759は、ActRIIB ECDとFcドメインとを接続する14aaリンカーを有し、P120は、ActRIIB ECDとFcドメインとを接続する3aaリンカーを有する。P759及びP120の各々は、ActRIIB-ECDにおけるD57E変異を含む。表9ならびに図10E及び図10Fに示されるように、P759は、短い(3aa)リンカーと組み合わせた同じ変異と比較して、アクチビンA、アクチビンB、GDF-8、及びGDF-11の各々について増加した阻害効力を示した(P120)。
対照的に、K31YまたはG27D変異の導入は、短いリンカー及び長いリンカーと組み合わせたときに全く異なる効果を有した。P124結合剤及びP761結合剤の各々は、K31Y変異を含む。P758結合剤及びP119結合剤の各々は、G27D変異を含む。より長いリンカー(14aa以上)とのK31YまたはG27D変異のいずれかの組み合わせは、短い(3aa)リンカーと組み合わせた同じ変異と比較して、アクチビンA、アクチビンB、GDF-8、及びGDF-11に対するP124結合剤及びP758結合剤の阻害効力を減少させた(P119及びP761)。図10G~10Jを参照されたい。
更に、V75Q変異の導入もまた、短いリンカー及び長いリンカーと組み合わせたときに予測不可能な効果を示した。P762結合剤及びP126結合剤の各々は、V75Q変異を含む。しかしながら、上述のF58E、K31Y、及びG27D変異とは対照的に、異なるリンカー長を有するV75Q変異の組み合わせは、アクチビンA、アクチビンB、GDF-8、GDF-11、またはBMP-9のいずれかに対する阻害効力に影響を及ぼさなかった。各リガンドの阻害効力は、V75Q変異を含む短いリンカー剤と長いリンカー剤との間で類似したままであった。図10K及び図10Lを参照されたい。
したがって、本明細書に記載の特定の結合剤の有効性は、細胞外リガンド結合ドメインに含まれる変異だけでなく、使用されるリンカーの長さによっても決定される。上述したように、ActRIIB ECDにおける点変異と、ActRIIB ECDをFcドメインに接続するリンカーの長さとの組み合わせは、TGFβスーパーファミリーリガンドへの結合及びその阻害に予測不可能な効果を有する。
追加のECDベースのトラップ、例えば、ルスパテルセプト(luspatercept)及びソタテルセプト(sotatercept)などが、臨床的に評価されている。ルスパテルセプト(ACE-536、REBLOZYL(登録商標)としても知られる)は、ヒトIgG1のFc部分に連結されたアクチビン受容体IIB型(ActRIIB)の細胞外ドメインの修飾形態で構成される可溶性融合タンパク質である。ルスパテルセプトは、いくつかの内因性TGFβスーパーファミリーリガンドを阻害し、それによってSmad2/3シグナル伝達を減少させる。ベータサラセミア及び骨髄異形成症候群における貧血の治療に使用される。ルスパテルセプト及び他の関連する融合タンパク質の説明については、例えば、米国特許第7,842,663号、同第8,058,229号、同第8,216,997号、同第8,252,900号、同第8,343,933号、同第8,361,957号、同第8,703,927号、同第9,138,459号、同第9,399,669号、同第9,439,945号、同第9,932,379号、同第10,131,700号、同第10,259,861号、同第10,689,427号、及び同第10,829,532号を参照されたい。
ソタテルセプト(ACE-011としても知られる)は、ヒトIgG1のFc部分に連結されたアクチビン受容体IIA型(ActRIIA)の細胞外ドメインで構成され、アクチビン及びGDFに結合し、中和することができる可溶性デコイ受容体である。ソタテルセプトは、健康なボランティア、及び血液障害、骨損失、化学療法誘発性貧血、多発性骨髄腫、骨髄異形成症候群、β-サラセミア、及び末期腎疾患を含む機能不全TGF-βスーパーファミリーシグナル伝達を特徴とする状態を有する患者において評価されている(Raftopoulos,H.et al.,2016、Abdulkadyrov,K.M.et al.,2014、Ruckle,J.et al.2009、Komrokji,R.et al.,2018、Cappellini,M.D.et al.,2019、Coyne,D.W.et al.,2019、Sherman,M.L.et al.,2013)。最近では、ソタテルセプトは肺動脈高血圧症(PAH)の治療のために評価されている。
アクチビン及びGDFのためのリガンドトラップとして作用することによって、ソタテルセプトは、成長促進アクチビン/成長分化因子経路と、PAHで生じる成長阻害BMP経路との間の不均衡を修正し得る。PAH患者における第2相治験では、ソタテルセプトは、肺血管抵抗を低減することが示された(Humbert,M.et al.,2021)。第3相治験を含む追加のPH治験は、進行中または計画中である。ソタテルセプト及び他の関連する融合タンパク質の説明については、例えば、米国特許第7,612,041号、同第7,709,605号、同第7,951,771号、同第7,988,973号、同第8,007,809号、同第8,629,109号、同第8,895,016号、及び9,163,075号を参照されたい。しかしながら、ソタテルセプトのいくつかの臨床研究では、血管及び血液学的副作用は、用量制限的であり、潜在的な治療有効性を制限することが見出されている。例えば、健康な閉経後女性を対象とした多重上昇用量研究では、0.1、0.3、1mg/kg、及び2mg/kgの4つの用量を評価する予定であったが、ヘモグロビン、ヘマトクリット、及び赤血球数の増加が用量制限であることが判明したため、1mg/kgレベルで早期に終了した(Sherman,M.L.et al.,2013)。PAH患者における第2相臨床治験では、血小板減少及びヘモグロビンレベルの増加が最も一般的な血液学的有害事象であり、0.7mg/kgの用量を受けた患者の17%がヘモグロビンの増加の有害事象を経験していた(Humbert,M.et al.,2021)。そのような血管及び血液学的副作用は、最大の有効性に必要な投与量の投与を可能にしない可能性があり、最大の治療効果を達成する可能性を制限するため、用量制限的である(Humbert,M.et al.,2021)。対照的に、本明細書で提供する結合剤(例えば、P622及びP624)は、非ヒト霊長類において血液学的効果を誘導せず、これらの薬剤がソタテルセプトよりも広い治療窓を有し得ることを示唆する。
いくつかの実施形態では、本開示の結合剤は、ホモ二量体、すなわち、配列番号174~254、333、もしくは339~341のうちのいずれか1つに示される配列、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列、またはその機能的に等価なバリアントを有するポリペプチドの二量体を含む。他の実施形態では、結合剤は、ヘテロ二量体、すなわち、2つの異なるポリペプチドの二量体、配列番号174~254、333、もしくは339~341のうちのいずれか1つに示される配列を有するポリペプチドのうちの少なくとも1つ、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列、もしくはその機能的に等価なバリアントを含む。
いくつかの実施形態では、本開示の結合剤は、F58E変異及び長いペプチドリンカーを含むActRIIB-ECDを含むポリペプチドの二量体を含む。いくつかの実施形態では、ペプチドリンカーは、10アミノ酸長であるか、または少なくとも10アミノ酸長である。いくつかの実施形態では、ペプチドリンカーは、14アミノ酸長であるか、または少なくとも14アミノ酸長である。いくつかの実施形態では、ペプチドリンカーは、19アミノ酸長であるか、または少なくとも19アミノ酸長である。いくつかの実施形態では、ペプチドリンカーは、39アミノ酸長であるか、または少なくとも39アミノ酸長である。いくつかの実施形態では、本開示の結合剤は、配列番号186、190~194、232~233、及び247~248から選択されるアミノ酸配列、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。
いくつかの実施形態では、本開示の結合剤は、配列番号186またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号190またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号191またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号192またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号193またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号194またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号232またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号233またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号247またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号248またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。
いくつかの実施形態では、本開示の結合剤は、F58K変異及び長いペプチドリンカーを含むActRIIB-ECDを含むポリペプチドの二量体を含む。いくつかの実施形態では、ペプチドリンカーは、10アミノ酸長であるか、または少なくとも10アミノ酸長である。いくつかの実施形態では、ペプチドリンカーは、14アミノ酸長であるか、または少なくとも14アミノ酸長である。いくつかの実施形態では、ペプチドリンカーは、19アミノ酸長であるか、または少なくとも19アミノ酸長である。いくつかの実施形態では、ペプチドリンカーは、39アミノ酸長であるか、または少なくとも39アミノ酸長である。いくつかの実施形態では、本開示の結合剤は、配列番号213~216もしくは242~244から選択されるアミノ酸配列、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。
いくつかの実施形態では、本開示の結合剤は、配列番号213、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号214またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号215またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号216またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号242またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号243またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号244またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。
いくつかの実施形態では、本開示の結合剤は、F58Q変異及び長いペプチドリンカーを含むActRIIB-ECDを含むポリペプチドの二量体を含む。いくつかの実施形態では、ペプチドリンカーは、10アミノ酸長であるか、または少なくとも10アミノ酸長である。いくつかの実施形態では、ペプチドリンカーは、14アミノ酸長であるか、または少なくとも14アミノ酸長である。いくつかの実施形態では、ペプチドリンカーは、19アミノ酸長であるか、または少なくとも19アミノ酸長である。いくつかの実施形態では、ペプチドリンカーは、39アミノ酸長であるか、または少なくとも39アミノ酸長である。いくつかの実施形態では、本開示の結合剤は、配列番号220~223、253、及び254から選択されるアミノ酸配列、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。
いくつかの実施形態では、本開示の結合剤は、配列番号220、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号221、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号222、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号223、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号253、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。いくつかの実施形態では、本開示の結合剤は、配列番号254、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一である配列、またはその機能的に等価なバリアントを含むか、またはそれからなるポリペプチドの二量体を含む。
アクチビン受容体IIB型エクトドメインバリアント
本明細書で使用される場合、「アクチビン受容体IIB型エクトドメインバリアント」または「ActRIIB-ECDバリアント」という用語は、野生型細胞外ActRIIBと少なくとも1つのアミノ酸置換を有する、単一の膜貫通受容体、ActRIIBの可溶性の細胞外部分を含むポリペプチドを指す。野生型ヒトActRIIB-ECDの配列を、配列番号2(表1)に示す。別段明記しない限り、アミノ酸置換について示される位置は、配列番号2のアミノ酸配列に従って付番される。本開示の目的のために、「ヒト野生型ActRIIB-ECD」は、配列番号2を参照する。
本明細書で使用される場合、「アクチビン受容体IIB型エクトドメインバリアント」または「ActRIIB-ECDバリアント」という用語は、野生型細胞外ActRIIBと少なくとも1つのアミノ酸置換を有する、単一の膜貫通受容体、ActRIIBの可溶性の細胞外部分を含むポリペプチドを指す。野生型ヒトActRIIB-ECDの配列を、配列番号2(表1)に示す。別段明記しない限り、アミノ酸置換について示される位置は、配列番号2のアミノ酸配列に従って付番される。本開示の目的のために、「ヒト野生型ActRIIB-ECD」は、配列番号2を参照する。
いくつかの実施形態では、ActRIIB-ECDバリアントは、G27、Q29、D30、K31、S38、D57、F58、V75、及びF77から選択される位置に1つ以上のアミノ酸置換を含む。いくつかの実施形態では、ActRIIB-ECDバリアントポリペプチドは、G27D、Q29Y、D30Q、K31Y、S38R、D57E、F58E、F58D、F58Y、F58K、F58Q、F58W、F58N、F58R、F58H、V75Q、及びF77Dから選択される1つ以上のアミノ酸置換を含む。いくつかの実施形態では、ActRIIB-ECDバリアントは、F58E、F58D、F58Y、F58K、F58Q、F58W、F58N、F58R、及びF58Hから選択される位置に1つ以上のアミノ酸置換を含む。いくつかの実施形態では、ActRIIB-ECDバリアントは、F58E、F58K、及びF58Qから選択された1つ以上のアミノ酸置換を含む。いくつかの実施形態では、ActRIIB ECDバリアントは、F58Eのアミノ酸置換を含む。いくつかの実施形態では、ActRIIB ECDバリアントは、F58Kのアミノ酸置換を含む。いくつかの実施形態では、ActRIIB ECDバリアントは、F58Qのアミノ酸置換を含む。ActRIIB-ECDにおける他のアミノ酸置換は、当該技術分野において既知である(例えば、WO2021/158675、WO2022/150590、WO2021/158675、WO2022/072882、WO2021/189019、及びWO2021/189010、これらの各々は、参照により本明細書に組み込まれる)。これらの追加の変異は、本明細書に記載のリンカーと併用され、本明細書に記載の結合剤に組み込まれて、ActRIIB-ECDのリガンド結合特性を変化させることができる。
いくつかの実施形態では、ActRIIB-ECDバリアントは、配列番号4~22、331、332、または24~33のうちのいずれか1つに示されるアミノ酸配列を含む。いくつかの実施形態では、ActRIIB-ECDバリアントは、野生型ヒトActRIIB-ECDの配列に対して、少なくとも85%(例えば、少なくとも85%、少なくとも87%、少なくとも90%、少なくとも92%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99%、またはそれ以上)のアミノ酸配列同一性を含む。いくつかの実施形態では、ActRIIB-ECDバリアントは、配列番号2に示される配列に対して、少なくとも85%(例えば、少なくとも85%、少なくとも87%、少なくとも90%、少なくとも92%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99%、またはそれ以上)のアミノ酸配列同一性を有し得る。
いくつかの実施形態では、ActRIIB-ECDバリアントのアミノ酸配列は、配列番号4~22、331、332、または24~33のうちのいずれか1つに対して、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を含む。いくつかの実施形態では、ActRIIB-ECDバリアントは、F58位にアミノ酸置換を含み、配列番号5~13のうちのいずれか1つと少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性であるアミノ酸配列を含む。いくつかの実施形態では、ActRIIB-ECDバリアントは、位置F58にアミノ酸置換を含み、配列番号5~13から選択されるアミノ酸配列を含むか、またはそれからなる。いくつかの実施形態では、ActRIIB-ECDバリアントは、F58位にアミノ酸置換を含み、配列番号5のアミノ酸配列を含むか、またはそれからなる。いくつかの実施形態では、ActRIIB-ECDバリアントは、F58位にアミノ酸置換を含み、配列番号6のアミノ酸配列を含むか、またはそれからなる。いくつかの実施形態では、ActRIIB-ECDバリアントは、F58位にアミノ酸置換を含み、配列番号7のアミノ酸配列を含むか、またはそれからなる。いくつかの実施形態では、ActRIIB-ECDバリアントは、F58位にアミノ酸置換を含み、配列番号8のアミノ酸配列を含むか、またはそれからなる。いくつかの実施形態では、ActRIIB-ECDバリアントは、F58位にアミノ酸置換を含み、配列番号9のアミノ酸配列を含むか、またはそれからなる。いくつかの実施形態では、ActRIIB-ECDバリアントは、F58位にアミノ酸置換を含み、配列番号10のアミノ酸配列を含むか、またはそれからなる。いくつかの実施形態では、ActRIIB-ECDバリアントは、F58位にアミノ酸置換を含み、配列番号11のアミノ酸配列を含むか、またはそれからなる。いくつかの実施形態では、ActRIIB-ECDバリアントは、F58位にアミノ酸置換を含み、配列番号12のアミノ酸配列を含むか、またはそれからなる。いくつかの実施形態では、ActRIIB-ECDバリアントは、F58位にアミノ酸置換を含み、配列番号13のアミノ酸配列を含むか、またはそれからなる。
いくつかの実施形態では、ActRIIB-ECDバリアントは、D57位にアミノ酸置換を含み、配列番号4に対して、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性であるアミノ酸配列を含む。いくつかの実施形態では、ActRIIB-ECDバリアントは、D57位にアミノ酸置換を含み、配列番号4のアミノ酸配列を含むか、またはそれからなる。
例示的なActRIIB ECDを表1に提供する。アミノ酸置換は、太字及び拡大テキストで示される。
いくつかの実施形態では、本開示のActRIIB-ECDバリアントは、N末端に最大5個のアミノ酸の伸長を更に含む。いくつかの実施形態では、本開示のActRIIB-ECDバリアントは、N末端、例えば、GRGEA(配列番号23)の5アミノ酸の伸長を更に含む。いくつかの実施形態では、本開示のActRIIB-ECDバリアントは、4アミノ酸、3アミノ酸、2アミノ酸、または1アミノ酸、例えば、限定されないが、RGEA、GEA、EA、またはAのN末端における伸長を更に含む。N末端伸長を有する例示的なActRIIB ECDは、表2に提供される。N末端伸長アミノ酸は、太字及び斜体のテキストで示される。アミノ酸置換は、太字及び拡大テキストで示される。
いくつかの実施形態では、本開示のActRIIB-ECDバリアントは、C末端にアラニン-プロリン-トレオニン(APT)の伸長を更に含む。図10O~10Pに示されるように、ActRIIB-ECDへのC末端伸長APTの付加は、阻害効力に影響を与えない。したがって、いくつかの実施形態では、配列番号2~22、331、332、及び24~33のうちのいずれか1つは、C末端でのAPTの伸長を更に含むことができる。
本開示のActRIIB-ECDバリアントは、ある特定の疾患適応症における治療有効性を最大化しつつ、有害作用を最小化するように、具体的には、内因性BMP-9シグナル伝達の阻害を防止または低減しつつ、アクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10などの他のTGFβスーパーファミリーリガンドに対する中和効力を維持及び/または増加させるように設計されている。本開示のActRIIB-ECDバリアントは、以下を示す:(1)野生型ActRIIB-ECDと比較して、アクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10への類似または改善された結合(リガンド結合について内因性受容体と競合し、内因性受容体シグナル伝達を低減または阻害することを可能にする)、ならびに(2)野生型ActRIIB-ECDと比較して、BMP-9への低減または除去された結合(BMP-9シグナル伝達の阻害と関連付けられた毒性を回避することを可能にする)。これらのバリアントは、本明細書に更に記載されるように、肺高血圧症(PH)(例えば、PAH、静脈PH、低酸素PH、血栓塞栓性PH、または雑種PH)、代謝障害及び心臓代謝性疾患(例えば、肥満、1型糖尿病、2型糖尿病、前糖尿病、心不全)、骨疾患(例えば、骨損傷を伴う疾患または状態)、筋肉疾患、線維症、及び低い赤血球レベル(例えば、貧血、失血)などのアクチビン受容体シグナル伝達が上昇する広範な疾患及び状態を治療するために使用することができる。バリアントは、本明細書に更に記載されるように、例えば、限定されないが、PHの症状または進行の低減(例えば、PAH、静脈PH、低酸素PH、血栓塞栓性PH、もしくは雑種PH)、骨吸収または破骨細胞活性の低減、骨形成または骨ミネラル密度の増加、筋肉量または筋力の増加、線維症の低減(例えば、線維症の減少、または線維症の進行の遅延もしくは停止)、及び/または赤血球レベルの増加(例えば、ヘモグロビンレベル、ヘマトクリット、もしくは赤血球数の増加、例えば、赤血球産生の増加)をもたらし得る。
いくつかの実施形態では、本開示のActRIIB-ECDバリアントは、アクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10から選択される1つ以上のリガンドに結合し、BMP-9に実質的に結合することなく、及び/またはその受容体を通じたBMP-9シグナル伝達を阻害することなく、1つ以上のリガンドのそれぞれの受容体を通じたシグナル伝達を阻害する。
いくつかの実施形態では、ヒトBMP-9シグナル伝達に対する本開示のActRIIB-ECDバリアントの阻害効力は、ヒトBMP-9シグナル伝達に対するヒト野生型ActRIIB-ECDの阻害効力と比較して約100倍低減する。
いくつかの実施形態では、アクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10から選択される1つ以上のリガンドに対する本開示のActRIIB-ECDバリアントの阻害効力は、同じ1つ以上のリガンドに対するヒト野生型ActRIIB-ECDの阻害効力よりも増加するか、または実質的に同じである。
いくつかの実施形態では、本開示のActRIIB-ECDバリアントは、ヒト野生型ActRIIB-ECDと比較して、アクチビンAに対するより高い阻害効力及びBMP-9に対するより低い阻害効力を有する。
いくつかの実施形態では、本開示のActRIIB-ECDバリアントは、対象において血管合併症を引き起こさない。
いくつかの実施形態では、本開示のActRIIB-ECDバリアントは、対象において血管透過性または漏出を増加させない。
結果として、本開示によれば、アクチビン受容体IIB型(ActRIIB)エクトドメイン(ECD)バリアントを含む新規のポリペプチドが本明細書に提供され、このバリアントは、ヒト野生型ActRIIB-ECDの配列と比較して1つ以上のアミノ酸置換を有し、治療有効性を最大化しながら有害作用を最小限に抑えるために、具体的には、アクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10などの他のTGFβスーパーファミリーリガンドの中和効力を維持及び/または増加させながら、内因性BMP-9シグナル伝達の破壊を予防または低減することを目的として、調整されたTGFβスーパーファミリーリガンド特異性を有する。
ActRIIB ECDバリアントを含むポリペプチド
いくつかの実施形態では、本開示は、リンカーを介して、Fcドメイン単量体に融合した、ActRIIB-ECDバリアントを含むポリペプチドを提供する。いくつかの実施形態では、ポリペプチドは、N末端からC末端に、ActRIIB ECDバリアント-ペプチドリンカー-Fcドメイン単量体を含む。ActRIIB ECDを含むポリペプチドは、Fcドメイン単量体間のシステイン結合を介して二量体化して、本明細書に記載のTGFβスーパーファミリーリガンド結合剤を形成することができる。
いくつかの実施形態では、本開示は、リンカーを介して、Fcドメイン単量体に融合した、ActRIIB-ECDバリアントを含むポリペプチドを提供する。いくつかの実施形態では、ポリペプチドは、N末端からC末端に、ActRIIB ECDバリアント-ペプチドリンカー-Fcドメイン単量体を含む。ActRIIB ECDを含むポリペプチドは、Fcドメイン単量体間のシステイン結合を介して二量体化して、本明細書に記載のTGFβスーパーファミリーリガンド結合剤を形成することができる。
リンカー
いくつかの実施形態では、本明細書に記載のActRIIB ECDバリアントは、リンカーを介して異種ドメインに融合される。いくつかの実施形態では、異種ドメインは、ポリペプチドの安定性を増加させる。いくつかの実施形態では、異種ドメインは、Fcドメイン単量体(例えば、野生型Fcドメイン単量体、1つ以上のアミノ酸置換を有するFcドメイン単量体)、アルブミン結合ペプチド、フィブロネクチンドメイン、またはヒト血清アルブミンドメインからなる群から選択される。
いくつかの実施形態では、本明細書に記載のActRIIB ECDバリアントは、リンカーを介して異種ドメインに融合される。いくつかの実施形態では、異種ドメインは、ポリペプチドの安定性を増加させる。いくつかの実施形態では、異種ドメインは、Fcドメイン単量体(例えば、野生型Fcドメイン単量体、1つ以上のアミノ酸置換を有するFcドメイン単量体)、アルブミン結合ペプチド、フィブロネクチンドメイン、またはヒト血清アルブミンドメインからなる群から選択される。
本明細書で使用される場合、「ペプチドリンカー」及び「リンカー」という用語は、ポリペプチド鎖内で2つの機能ドメインを一緒に接続するために使用されるアミノ酸の短いストレッチを指すために互換的に使用される。例えば、本開示のポリペプチドまたは結合剤のいくつかの実施形態では、ActRIIB-ECDバリアント及びFcドメイン単量体は、1つ以上のペプチドリンカーを介してポリペプチド鎖上で一緒に連結される。ペプチドリンカーを使用して、本開示のポリペプチドまたは結合剤に他のドメインまたはモジュールまたは領域(半減期延長ドメインなど)を結合することもできる。本明細書で使用される「ロングリンカー」という用語は、少なくとも10アミノ酸長(すなわち、10、11、12、13、14、15、16、17、18、19、20またはそれ以上のアミノ酸長)であるリンカーを指す。本明細書で使用される「短いリンカー」という用語は、10アミノ酸未満の長さ(すなわち、9、8、7、6、5、4、3、2、または1アミノ酸の長さ)のリンカーを指す。
好適なペプチドリンカーは、当該技術分野で既知であり、例えば、グリシン、アラニン、及びセリンなどの可撓性アミノ酸残基を含有するペプチドリンカーを含む。いくつかの実施形態では、リンカーは、GA、GS、GG、GGA、GGS、GGG、GGGA(配列番号92)、GGGS(配列番号91)、GGGG(配列番号69)、GGGGA(配列番号90)、GGGGS(配列番号68)、GGGGG(配列番号89)、GGAG(配列番号88)、GGSG(配列番号87)、AGGG(配列番号86)、またはSGGG(配列番号76)のモチーフ、例えば、複数のまたは繰り返しのモチーフを含有し得る。
いくつかの実施形態では、リンカーは、GAまたはGS、例えば、GA、GS、GAGA(配列番号103)、GSGS(配列番号95)、GAGAGA(配列番号96)、GSGSGS(配列番号97)、GAGAGAGA(配列番号98)、GSGSGSGS(配列番号99)、GAGAGAGAGA(配列番号100)、GSGSGSGSGS(配列番号101)、GAGAGAGAGAGA(配列番号102)、及びGSGSGSGSGSGS(配列番号104)のモチーフを含む、2~12アミノ酸を含有し得る。いくつかの実施形態では、リンカーは、GGAまたはGGS、例えば、GGA、GGS、GGAGGA(配列番号105)、GGSGGS(配列番号106)、GGAGGAGGA(配列番号107)、GGSGGSGGS(配列番号108)、GGAGGAGGAGGA(配列番号109)、及びGGSGGSGGSGGS(配列番号110)のモチーフを含む、3~12アミノ酸を含有し得る。いくつかの実施形態では、リンカーは、GGAG(配列番号111)、GGSG(配列番号112)、GGAGGGAG(配列番号113)、GGSGGGSG(配列番号114)、GGAGGGAGGGAG(配列番号115)、及びGGSGGGSGGGSG(配列番号116)のモチーフを含む、4~12アミノ酸を含有し得る。いくつかの実施形態では、リンカーは、GGGGA(配列番号90)またはGGGGS(配列番号68)、例えば、GGGGAGGGGAGGGGA(配列番号117)及びGGGGSGGGGSGGGGS(配列番号58)のモチーフを含有し得る。いくつかの実施形態では、ActRIIB-ECDバリアントと異種ドメイン(例えば、Fcドメイン単量体(例えば、野生型Fcドメイン単量体、1つ以上のアミノ酸置換を有するFcドメイン単量体)、アルブミン結合ペプチド、フィブロネクチンドメイン、またはヒト血清アルブミンドメイン)との間のアミノ酸リンカーは、GGG、GGGA(配列番号92)、GGGG(配列番号69)、GGGAG(配列番号335)、GGGAGG(配列番号336)、またはGGGAGGG(配列番号337)であり得る。
リンカーが使用される場合、リンカーは、一般に、ドメインの各々が、互いに独立して、それらの差次的結合特異性及び/または機能を保持することができることを確実にするのに十分な長さ及び配列である。いくつかの実施形態では、いかなる二次構造も更に促進しないペプチドリンカーが選択される。当該ドメインの互いへの連結は、例えば、本明細書に記載されるように、遺伝子操作によって提供することができる。融合及び作動可能に連結されたポリペプチド構築物を調製し、それらを哺乳動物細胞または細菌中で発現させるための方法は、当該技術分野で周知である(例えば、WO99/54440またはSambrook et al.,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.,2001)。
いくつかの実施形態では、リンカーは、Gly及びSerを含有するアミノ酸配列の様々な順列を含む。いくつかの実施形態では、リンカーは、グリシン及びセリンリッチリンカーである。いくつかの実施形態では、リンカーは、グリシン(例えば、2-10、2-5、2-4、2-3グリシン残基)またはグリシン及びプロリン残基が豊富であってもよく、例えば、トレオニン/セリン及びグリシンの単一配列、トレオニン/セリン及び/またはグリシンの反復配列、例えば、GGG、GGGG(配列番号69)、GGGS(配列番号91)、TGGGG(配列番号74)、SGGGG(配列番号75)、TGGG(配列番号73)、もしくはSGGG(配列番号76)の単一項または反復を含有してもよい。限定されないが、Thr、Asn、Pro及びAlaなどの他の近中性アミノ酸も、リンカー配列で使用してもよい。
いくつかの実施形態では、リンカーは、10アミノ酸長である。いくつかの実施形態では、リンカーは、10アミノ酸長を超える。いくつかの実施形態では、リンカーは、少なくとも10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、または50アミノ酸の長さを有する。いくつかの実施形態では、リンカーは、40、35、30、25、22、または20アミノ酸未満である。いくつかの実施形態では、リンカーは、10~50、10~40、10~30、10~25、10~21、10~15、10~14、12~14、15~25、17~22、20、または21アミノ酸長である。いくつかの実施形態では、リンカーは、14~40、14~39、14~35、14~30、14~25、または14~20アミノ酸長である。いくつかの実施形態では、リンカーは、少なくとも10アミノ酸長である。いくつかの実施形態では、リンカーは、少なくとも14アミノ酸長である。いくつかの実施形態では、リンカーは、少なくとも19アミノ酸長である。いくつかの実施形態では、リンカーは、少なくとも39アミノ酸長である。いくつかの実施形態では、リンカーは、14アミノ酸長である。いくつかの実施形態では、リンカーは、19アミノ酸長である。いくつかの実施形態では、リンカーは、39アミノ酸長である。いくつかの実施形態では、リンカーは、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、または50アミノ酸長である。更なる実施形態では、リンカーは、少なくとも12、14、15、20、21、25、30、35、40、45、または50アミノ酸の長さを有する。
いくつかの実施形態では、リンカーは、配列番号59を含む。いくつかの実施形態では、リンカーは、配列番号54を含む。いくつかの実施形態では、リンカーは、配列番号34を含む。いくつかの実施形態では、リンカーは、配列番号63を含む。
いくつかの実施形態では、リンカーは、配列番号59からなる。いくつかの実施形態では、リンカーは、配列番号54からなる。いくつかの実施形態では、リンカーは、配列番号34からなる。いくつかの実施形態では、リンカーは、配列番号63からなる。
いくつかの実施形態では、リンカーは、配列番号34~133及び335~337のうちのいずれか1つに示される配列を含むか、またはそれらからなる。
いくつかの実施形態では、リンカーは、グリシンリッチ、多くの場合グリシン/セリンリッチ、最大40アミノ酸、または1~40アミノ酸、2~39アミノ酸、3~39アミノ酸、3~14アミノ酸、3~19アミノ酸、5~25アミノ酸、5~20アミノ酸、5~15アミノ酸、または15~25アミノ酸のペプチドである。いくつかの実施形態では、ペプチドリンカーは、比較的少数のアミノ酸残基、例えば、39以下のアミノ酸、19以下のアミノ酸、14以下のアミノ酸、5以下のアミノ酸、または3以下のアミノ酸のみを含む。ある特定の実施形態では、Glyリッチリンカーが使用される。一実施形態では、ペプチドリンカーは、単一のアミノ酸グリシン(Gly)からなり得る。別の実施形態では、ペプチドリンカーは、アミノ酸配列Gly-Gly-Gly-Gly-Ser、すなわち、Gly4Ser、またはそのポリマー、すなわち(Gly4Ser)nを含むか、またはそれからなり、ここで、nは、1またはそれよりも大きい整数であるか、またはnは、1~8(例えば、1、2、3、4、5、6、7、または8)である。
いくつかの実施形態では、リンカーは、アミノ酸配列GlyGlyGlyGlySer(GGGGS)(配列番号68)、またはその反復(GGGGS)nを含み、n>2である。特定の実施形態では、n>3、またはn=3~10である。いくつかの実施形態では、n>4、またはn=4~10である。いくつかの実施形態では、nは、(GGGGS)nリンカーにおいて4以下である。いくつかの実施形態では、n=4~10、4~9、4~8、4~7、4~6、4~5、5~8、5~7、または5~6である。いくつかの実施形態では、n=3、4、5、6、または7である。いくつかの実施形態では、n=4である。いくつかの実施形態では、(GGGGS)n配列を含むリンカーは、N末端トレオニンも含む。
いくつかの実施形態では、リンカーは、グリシン、アラニン、及びセリン以外のアミノ酸、例えば、AAAL(配列番号118)、AAAK(配列番号119)、AAAR(配列番号120)、EGKSSGSGSESKST(配列番号121)、GSAGSAAGSGEF(配列番号122)、AEAAAKEAAAKA(配列番号123)、KESGSVSSEQLAQFRSLD(配列番号124)、GENLYFQSGG(配列番号125)、SACYCELS(配列番号126)、RSIAT(配列番号127)、RPACKIPNDLKQKVMNH(配列番号128)、GGSAGGSGSGSSGGSSGASGTGTAGGTGSGSGTGSG(配列番号129)、AAANSSIDLISVPVDSR(配列番号130)、またはGGSGGGSEGGGSEGGGSEGGGSEGGGSEGGGSGGGS(配列番号131)を含有し得る。いくつかの実施形態では、リンカーは、EAAAK(配列番号132)のモチーフ、例えば、複数のまたは反復するモチーフを含有し得る。いくつかの実施形態では、リンカーは、Xが任意のアミノ酸(例えば、A、K、またはE)であってもよく、nが1~5、及びPAPAP(配列番号133)である、(XP)nなどのプラリンリッチ配列のモチーフ、例えば、複数または反復モチーフを含有し得る。
ペプチドリンカー及び使用されるアミノ酸の長さは、関与する2つのタンパク質及び最終的なタンパク質融合ポリペプチドで所望される可撓性の程度に応じて調整することができる。リンカーの長さを調整して、適切なタンパク質の折り畳みを確実にし、凝集体の形成を回避することができる。
リンカーの非限定的な例を表3に示す。ポリペプチドまたは結合剤の所望の機能(結合、中和など)が提供される限り、リンカーは特に限定されることを意図するものではなく、任意の好適なリンカーが使用され得ることを理解されたい。
いくつかの実施形態では、本開示のActRIIB ECDバリアントポリペプチドまたは結合剤は、配列番号59、54、34、または63のうちのいずれか1つに示される配列を有する1つ以上のリンカーを含む。いくつかの実施形態では、ActRIIB ECDバリアントポリペプチドまたは結合剤は、ActRIIB ECDバリアントポリペプチドのC末端に、2、3、6、10、14、19、または39アミノ酸長のグリシンリッチリンカーを含む。いくつかの実施形態では、本開示のActRIIB ECDバリアントポリペプチドまたは結合剤は、ActRIIB ECDバリアントポリペプチドのC末端に配列番号59のリンカーを含む。いくつかの実施形態では、本開示のActRIIB ECDバリアントポリペプチドまたは結合剤は、ActRIIB ECDバリアントポリペプチドのC末端に配列番号54のリンカーを含む。いくつかの実施形態では、本開示のActRIIB ECDバリアントポリペプチドまたは結合剤は、ActRIIB ECDバリアントポリペプチドのC末端に配列番号34のリンカーを含む。いくつかの実施形態では、本開示のActRIIB ECDバリアントポリペプチドまたは結合剤は、ActRIIB ECDバリアントポリペプチドのC末端に配列番号63のリンカーを含む。
Fcドメイン単量体及びFcドメイン
いくつかの実施形態では、本開示は、リンカーを介して、Fcドメイン単量体に融合した、本明細書に記載のActRIIB-ECDバリアントを含むポリペプチドを提供する。いくつかの実施形態では、ActRIIB-ECDバリアントは、リンカーを介して、Fcドメイン単量体のN末端にC末端で融合している。
いくつかの実施形態では、本開示は、リンカーを介して、Fcドメイン単量体に融合した、本明細書に記載のActRIIB-ECDバリアントを含むポリペプチドを提供する。いくつかの実施形態では、ActRIIB-ECDバリアントは、リンカーを介して、Fcドメイン単量体のN末端にC末端で融合している。
本明細書で使用される場合、「Fcドメイン単量体」は、別のFcドメイン単量体と会合すると、機能的なFcドメインを形成する一本鎖タンパク質を説明する。2つのFcドメイン単量体の会合は、1つのFcドメインを作製する。本明細書で使用される場合、「Fcドメイン」は、Fc受容体(FcR)に結合することができるか、またはFc受容体(FcR)によって結合され得る最小領域(より大きなポリペプチドの文脈において)または最小のタンパク質折り畳み構造(単離されたタンパク質の文脈において)を説明する。2つのFcドメイン単量体が会合する場合、得られるFcドメインは、Fc受容体結合活性を有する。したがって、Fcドメインは、Fc受容体に結合することができる二量体構造である。別段明記しない限り、本明細書における「バリアントFcドメイン」への全ての言及は、二量体Fcドメインを指すと理解されるべきであり、各Fcドメイン単量体は、言及された変異を含む。
本明細書で使用されるFcドメインは、第1の定常領域免疫グロブリンドメインを除く抗体の定常領域を含むポリペプチドを含むことが理解されるであろう。したがって、Fcは、IgGの最後の2つの定常領域免疫グロブリンドメイン(CH2、CH3)、及び任意選択で、これらのドメインに対する可撓性ヒンジN末端を指す。Fcドメイン単量体の境界は異なり得るが、ヒトIgG重鎖Fcドメイン単量体は、通常、そのカルボキシ末端に残基C226またはP230を含むと定義される。別段明記しない限り、Fcドメイン及びFcドメイン単量体におけるアミノ酸位置への全ての言及は、Kabat(1991,NIH Publication 91-3242,National Technical Information Service,Springfield,Va.)に示されるようなEUインデックスに従う。Fcは、単離したこの領域、またはポリペプチド構築物の文脈におけるこの領域を指し得る。多形体は、限定されないが、Kabat 270、272、312、315、356、及び358を含む多くのFc位置で観察されており、したがって、本明細書で提供される配列と当該技術分野における配列との間にわずかな差異が存在し得ることに留意されたい。本開示のポリペプチドまたは結合剤に含まれるFcドメイン単量体は、IgG1、IgG2、IgG3、またはIgG4ドメインであり得る。
例示的な実施形態では、本開示のポリペプチドは、抗体の1つ以上の定常領域、例えば、抗体重鎖の第2の定常ドメイン(CH2)及び/または第3の定常ドメイン(CH3)、または抗体重鎖のFcドメイン単量体を含む。抗体は、例えば、限定されないが、IgG1、IgG2、IgG3またはIgG4抗体などのIgG抗体であり得る。特定の実施形態では、抗体は、ヒト抗体であり、例えば、Fcドメイン単量体は、ヒトIgG1、IgG2、IgG3、またはIgG4の重鎖の定常領域を含む。いくつかの実施形態では、Fcドメイン単量体は、ヒトIgG1、IgG2、IgG3またはIgG4定常領域との少なくとも85%、少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有する。特定の実施形態では、Fcドメイン単量体は、ヒトIgG1抗体のFcドメイン単量体を含むか、またはそれからなる。別の特定の実施形態では、Fcドメイン単量体は、ヒトIgG2抗体のFcドメイン単量体を含むか、またはそれからなる。別の特定の実施形態では、Fcドメイン単量体は、ヒトIgG4抗体のFcドメイン単量体を含むか、またはそれからなる。例示的なFcドメイン配列(野生型配列、その多形体、及びバリアント配列の両方を含む)を表4に提供する。
一般に、ActRIIB-ECDポリペプチドは、Fcドメイン単量体がそのN末端でActRIIB-ECDバリアントのC末端に連結され、各ActRIIB-ECDポリペプチドについて、構築物の配向が、N末端からC末端に、(ActRIIB-ECDバリアント)-(リンカー)-(Fcドメイン単量体)の一本鎖であるように構成される。しかしながら、構築物の配向は特に限定されず、他の配向が考えられる。例えば、いくつかの実施形態では、Fcドメイン単量体は、そのC末端で、ActRIIB-ECDバリアントのN末端に連結されてもよい。
例示的な実施形態では、Fcドメイン単量体は、例えば、システイン残基間のジスルフィド結合によって、共有結合で2つ以上のポリペプチド鎖のアセンブリを可能にする。このようにして、Fcドメイン単量体は二量体化ドメインとして作用し、2つのActRIIB-ECDポリペプチド鎖のアセンブリが二量体を形成することを可能にする。本開示によれば、そのような二量体は、一般に2つのポリペプチドを含み、各ポリペプチドは、本明細書に記載のFcドメイン単量体に連結されたActIIRB-ECDバリアントを含み、それによって二価TGFβスーパーファミリーリガンド結合剤を形成する。したがって、本明細書に記載の結合剤は、2つのActIIRB-ECDバリアント、リンカードメイン、及びFcドメインを含む。
Fcドメイン単量体は、一般に、ホモ二量体構築物における第1のポリペプチドと第2のポリペプチドとの架橋のための1つ以上のシステイン残基を含む。例えば、Fcドメイン単量体は、2つのポリペプチド間にジスルフィド架橋を形成し、それによって二量体を形成するための少なくとも2つのシステイン残基を含んでもよい。本技術のいくつかの実施形態では、Fcドメイン単量体は、配列番号134~173及び338のうちのいずれか1つに示される配列、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%同一の配列を含むか、またはそれからなる。特定の実施形態では、Fcドメイン単量体は、配列番号134に示されるアミノ酸配列を含むか、またはそれからなる。特定の実施形態では、Fcドメイン単量体は、配列番号135に示されるアミノ酸配列を含むか、またはそれからなる。特定の実施形態では、Fcドメイン単量体は、配列番号137に示されるアミノ酸配列を含むか、またはそれからなる。特定の実施形態では、Fcドメイン単量体は、配列番号138に示されるアミノ酸配列を含むか、またはそれからなる。特定の実施形態では、Fcドメイン単量体は、配列番号157に示されるアミノ酸配列を含むか、またはそれからなる。
いくつかの実施形態では、本開示は、バリアントFcドメイン、すなわち、非天然存在するにFcドメイン、例えば、1つ以上の非天然に存在するアミノ酸残基、置換、付加、欠失などを含むFcドメインを含む結合剤を提供する。
本技術のいくつかの実施形態では、Fcドメインは、天然に存在する(野生型)Fc配列と比較して、ポリペプチドまたは結合剤上に、半減期の増加などの望ましい特性を有するバリアントFcドメインを形成するバリアントFcドメインである。本明細書で使用される場合、「バリアントFcドメイン」は、非天然に存在するFcドメイン、例えば、1つ以上の非天然に存在するアミノ酸残基、野生型ヒト定常ドメインに対する1つ以上のアミノ酸置換、または1つ以上のアミノ酸欠失、付加及び/または修飾を含むFcドメインを指す。
「DEL」多形体及び「EEM」多形体を含む、IgG1 Fcドメインについて多くの既知の多形体が存在する。DEL多形体は、それぞれ、356位、357位、及び358位にアミノ酸D-E-Lを含む(本明細書では「Fc-DL」、例えば、配列番号135とも称される)。EEM多形体は、それぞれ、356位、357位、及び358位にアミノ酸E-E-Mを含む(本明細書では「Fc-EM」、例えば、配列番号134とも称される)。DEL FcドメインまたはEEM Fcドメインの存在を除いて、そうでなければ同一である2つの結合剤は、リガンド結合及び治療有効性の観点から同様の特性を示すことが予想される。本技術のいくつかの実施形態では、Fcドメインは、DEL Fcドメイン(「DL」)である。本技術のいくつかの実施形態では、Fcドメインは、EEM Fcドメイン(「EM」)である。他の多形体、例えば、配列番号134~135及び139~147のIgG1多形体、配列番号148~157のIgG2多形体、配列番号158~164のIgG3多形体、及び配列番号165~173のIgG4多形体も使用され得る。
いくつかの実施形態では、2つのバリアントFcドメイン単量体によって形成されたバリアントFcドメインは、同等の分子(例えば、野生型Fcドメイン単量体を有することを除いて同じアミノ酸配列を有するタンパク質)と比較して、FcRnなどのFc受容体に対する結合特性が変化している。Fcドメインを含むタンパク質の血清半減期は、FcRnに対するFcドメインの結合親和性を増加させることによって増加され得る。一実施形態では、Fcドメインバリアントは、同等の分子に対して増強された血清半減期を有する。特定の実施形態では、Fcドメインバリアントは、M252Y、S254T及びT256(本明細書では「YTE」と称される;例えば、配列番号137)からなる群から選択される1つ以上の位置に少なくとも1つのアミノ酸置換を含む。別の実施形態では、Fcドメインバリアントは、252位にY(例えば、本明細書で「Fc-Y」と称される配列番号138)を含む。別の実施形態では、Fcドメインバリアントは、254位にTを含む。別の実施形態では、Fcドメインバリアントは、256位にEを含む。
したがって、本技術のいくつかの実施形態では、ActRIIB-ECDポリペプチドは、同等の分子と比較して増加したインビボ半減期を有するFcドメインを形成するバリアントFcドメイン単量体を含む。いくつかのそのような実施形態では、ActRIIB-ECDポリペプチドのFcドメイン単量体は、残基252、254、及び256からなる群から選択されるアミノ酸残基の少なくとも1つの置換を含む。
いくつかの実施形態では、ActRIIB-ECDポリペプチドは、M252Y、S254T、及びT256Eからなる群から選択される少なくとも1つのアミノ酸置換を含むバリアントFcドメイン単量体を含む。そのような実施形態では、バリアントFcドメイン単量体は、限定されないが、E356D及びM358Lなどの1つ以上の追加のアミノ酸置換(複数可)を更に含み得る。
いくつかの実施形態では、ActRIIB-ECDポリペプチドは、以下のアミノ酸置換:M252Y、S254T、及びT256E(本明細書では「FcYTE」または「YTE」と称される)を含むバリアントFcドメイン単量体を含む。いくつかの実施形態では、FcYTEドメイン単量体は、DEL多形体(本明細書ではYTE-DL、例えば、配列番号137と称される)である。いくつかの実施形態では、FcYTEドメイン単量体は、EEM多形体(本明細書ではYTE-EM、例えば、配列番号136と称される)である。
いくつかの実施形態では、ActRIIB-ECDポリペプチドは、以下のアミノ酸置換:M252Y(本明細書では「FcY」と称される)を含むバリアントFcドメイン単量体を含む。いくつかの実施形態では、FcYドメイン単量体は、DEL多形体(本明細書ではY-DL、例えば、配列番号138と称される)である。いくつかの実施形態では、FcYドメイン単量体は、EEM多形体(本明細書ではY-EM、例えば、配列番号338と称される)である。
いくつかの実施形態では、ActRIIB-ECDポリペプチドは、C末端にリジン残基(K)を含むFcドメイン単量体を含む。
いくつかの実施形態では、本開示のActRIIB-ECDポリペプチドで使用するためのバリアントFcドメイン(例えば、2つのバリアントFcドメイン単量体によって形成されるFcドメイン)は、天然に存在するFc配列と比較して、ActRIIB-ECDポリペプチドの凝集を低減する、及び/または安定性を増加させる、及び/または半減期を増加させる1つ以上のアミノ酸置換を含む。いくつかの実施形態では、Fcドメインは、抗体依存性細胞傷害性(ADCC)、補体活性化(補体依存性細胞傷害性またはCDC)、オプソン化などの1つ以上のエフェクター機能を提供するように選択される。一実施形態では、バリアントFcドメインは、同等の分子と比較して、Fc受容体への結合が強化されている。特定の実施形態では、バリアントFcドメインは、新生児Fc受容体FcRnへの強化された結合を有する。別の実施形態では、バリアントFcドメイン及び/またはバリアントFcドメインを含有するポリペプチドもしくは結合剤は、FcRnに対する結合親和性が、同等の分子のそれよりも少なくとも2倍、または少なくとも3倍、または少なくとも5倍、または少なくとも7倍、または少なくとも10倍、または少なくとも20倍、または少なくとも30倍、または少なくとも40倍、または少なくとも50倍、または少なくとも60倍、または少なくとも70倍、または少なくとも80倍、または少なくとも90倍、または少なくとも100倍、または少なくとも200倍大きい。Fcドメインを含むタンパク質の血清半減期は、FcRnに対するFcドメイン単量体の結合親和性を増加させることによって増加され得る。したがって、一実施形態では、バリアントFcドメインを含むポリペプチドまたは結合剤は、同等の分子と比較して、強化された血清半減期を有する。
本開示のポリペプチド及び結合剤の血清半減期を延長する手段の例としては、ポリペプチド及び結合剤に融合されているか、または他の方法で結合されている、ペプチド、タンパク質、またはタンパク質のドメインが挙げられる。ペプチド、タンパク質、またはタンパク質ドメインの群には、血清アルブミンなどの人体における好ましい薬物動態プロファイルを有する他のタンパク質に結合するペプチドが含まれる(WO2009/127691を参照)。そのような半減期延長ペプチドの代替概念には、新生児Fc受容体(FcRn、WO2007/098420を参照)に結合するペプチドが含まれ、これはまた、本開示のポリペプチド及び結合剤に使用することができる。タンパク質または完全タンパク質のより大きなドメインを付着させるという概念は、例えば、本明細書に記載の、ヒト血清アルブミン、ヒト血清アルブミンのバリアントまたは変異体(WO2011/051489、WO2012/059486、WO2012/150319、WO2013/135896、WO2014/072481、WO2013/075066)またはそのドメインの融合、ならびに免疫グロブリンの定常領域(Fcドメイン)及びそのバリアントの融合を含む。Fcドメインのそのようなバリアントは、二量体または多量体の所望の対合を可能にするために、Fc受容体結合(例えば、Fcg受容体)を除去するために、FcRnへの結合を強化するために、または他の理由で最適化/修飾され得る。人体における小タンパク質化合物の半減期を延長するための当該技術分野で既知の更なる概念は、本開示のポリペプチドまたは結合剤などのそれらの化合物のペグ化である。
一実施形態では、本開示は、結合剤を提供し、Fcドメインは、Kabatに示されているEUインデックスによって付番された234、235、236、237、238、239、240、241、243、244、245、247、251、252、254、255、256、262、263、264、265、266、267、268、269、279、280、284、292、296、297、298、299、305、313、316、325、326、327、328、329、330、332、333、334、339、341、343、370、373、378、392、416、419、421、440及び443からなる群から選択される1つ以上の位置に非天然に存在するアミノ酸残基を含む。任意選択で、Fcドメインは、当業者に既知の追加の位置及び/または代替の位置に非天然に存在するアミノ酸残基を含んでよい(例えば、米国特許第5,624,821号、同第6,277,375号、同第6,737,056号、PCT特許公開第WO01/58957号、同第WO02/06919号、同第WO04/016750号、同第WO04/029207号、同第WO04/035752号、同第WO04/074455号、同第WO04/099249号、同第WO04/063351号、同第WO05/070963号、同第WO05/040217号、同第WO05/092925号、及び同第WO06/020114号を参照)。特定の実施形態では、本開示は、Fcバリアントタンパク質組成物を提供し、Fcドメインは、Kabatに示されているEUインデックスによって付番された234D、234E、234N、234Q、234T、234H、234Y、2341、234V、234F、235A、235D、235R、235W、235P、235S、235N、235Q、235T、235H、235Y、2351、235V、235F、236E、239D、239E、239N、239Q、239F、239T、239H、239Y、240I、240A、240T、240M、241W、241L、241Y、241E、241R、243W、243L、243Y、243R、243Q、244H、245A、247L、247V、247G、251F、252Y、254T、255L、256E、256M、262I、262A、262T、262E、2631、263A、263T、263M、264L、2641、264W、264T、264R、264F、264M、264Y、264E、265G、265N、265Q、265Y、265F、265V、265I、265L、265H、265T、266I、266A、266T、266M、267Q、267L、268E、269H、269Y、269F、269R、270E、280A、284M、292P、292L、296E、296Q、296D、296N、296S、296T、296L、296I、296H、269G、297S、297D、297E、298H、298I、298T、298F、299I、299L、299A、299S、299V、299H、299F、299E、305I、313F、316D、325Q、325L、325I、325D、325E、325A、325T、325V、325H、327G、327W、327N、327L、328S、328M、328D、328E、328N、328Q、328F、3281、328V、328T、328H、328A、329F、329H、329Q、330K、330G、330T、330C、330L、330Y、330V、330I、330F、330R、330H、332D、332S、332W、332F、332E、332N、332Q、332T、332H、332Y、332A、339T、370E、370N、378D、392T、396L、416G、419H、421K、440Y及び434Wからなる群から選択される少なくとも1つのアミノ酸置換を含む。任意選択で、Fcドメインは、当業者に既知の追加及び/または代替のアミノ酸置換を含んでよい(例えば、米国特許第5,624,821号、同第6,277,375号、同第6,737,056号、PCT特許公開第WO01/58957号、同第WO02/06919号、同第WO04/016750号、同第WO04/029207号、同第WO04/035752号、及び同第WO05/040217号を参照)。
追加のドメイン
本開示のActRIIB-ECDポリペプチド及び/または結合剤は、指定されたように標的TGFβスーパーファミリーリガンド(複数可)に結合するその機能に加えて、更なる結合特異性または更なる機能を有し得ることが想定される。本技術のいくつかの実施形態では、ActRIIB-ECDポリペプチドまたは結合剤は、標的化剤、治療部分、検出可能部分、及び/または診断部分とコンジュゲートされ得る。いくつかの実施形態では、ポリペプチドは、NK細胞のようなエフェクター細胞の動員を通じて、標識(蛍光など)を提供することによって、毒素または放射性核種などの治療剤を提供することによって、及び/または血清半減期を増強する手段を提供することなどによって、抗体依存性細胞傷害性を媒介する完全機能性Fc定常ドメインなどの更なる機能を有し得る。
本開示のActRIIB-ECDポリペプチド及び/または結合剤は、指定されたように標的TGFβスーパーファミリーリガンド(複数可)に結合するその機能に加えて、更なる結合特異性または更なる機能を有し得ることが想定される。本技術のいくつかの実施形態では、ActRIIB-ECDポリペプチドまたは結合剤は、標的化剤、治療部分、検出可能部分、及び/または診断部分とコンジュゲートされ得る。いくつかの実施形態では、ポリペプチドは、NK細胞のようなエフェクター細胞の動員を通じて、標識(蛍光など)を提供することによって、毒素または放射性核種などの治療剤を提供することによって、及び/または血清半減期を増強する手段を提供することなどによって、抗体依存性細胞傷害性を媒介する完全機能性Fc定常ドメインなどの更なる機能を有し得る。
いくつかの実施形態では、本明細書に記載のActRIIB-ECDポリペプチドは、ActRIIB-ECD、リンカー、Fcドメイン単量体、及び1つ以上の追加のドメインを含む。いくつかの実施形態では、1つ以上の追加のドメインは、フィブロネクチンドメイン、ヒト血清アルブミンドメインから選択される。本明細書で使用される場合、「フィブロネクチンドメイン」という用語は、例えば、インテグリンなどの膜スパニング受容体タンパク質、及びコラーゲン及びフィブリンなどの細胞外マトリックス構成要素に結合する、細胞外マトリックスの高分子量糖タンパク質、またはその断片を指す。いくつかの実施形態では、フィブロネクチンドメインは、UniProt ID番号P02751の配列のアミノ酸610~702を有するフィブロネクチンIII型ドメインである。他の実施形態では、フィブロネクチンドメインは、アドネクチンタンパク質である。
いくつかの実施形態では、本開示のポリペプチドまたは結合剤は、1つ以上のフィブロネクチンドメインに融合されたActRIIB-ECDバリアントを含む。フィブロネクチンドメインへの結合は、タンパク質医薬品の薬物動態を改善することができる。フィブロネクチンドメインは、例えば、インテグリンなどの膜スパニング受容体タンパク質、ならびにコラーゲン及びフィブリンなどの細胞外マトリックス構成要素に結合する、細胞外マトリックスの高分子量糖タンパク質、またはその断片である。本発明のいくつかの実施形態では、フィブロネクチンドメインは、本明細書に記載のActRIIB-ECDバリアント(例えば、配列番号4~22、331~332、及び24~33のうちのいずれか1つに示されるアミノ酸配列を有するActRIIB-ECDバリアント)のN末端またはC末端(例えば、C末端)に接合され、ActRIIB-ECDバリアントの血清半減期を増加させる。フィブロネクチンドメインは、直接的に、またはリンカーを通じて、ActRIIB-ECDバリアント、またはそのポリペプチド、またはその結合剤のN末端もしくはC末端に接合され得る。いくつかの実施形態では、本開示のポリペプチドまたは結合剤は、例えば、従来の遺伝的または化学的手段、例えば、化学的コンジュゲーションを通じて、フィブロネクチンドメインのN末端またはC末端に融合され得る。所望される場合、リンカー(例えば、スペーサー)は、ActRIIB-ECDバリアントとフィブロネクチンドメインとの間に挿入され得る。理論に縛られることなく、いくつかの実施形態では、本明細書に記載のActRIIB-ECDバリアントにフィブロネクチンドメインを含めることは、インテグリン、ならびにコラーゲン及びフィブリンなどの細胞外マトリックス構成要素への結合を通じて治療用タンパク質の長期保持をもたらし得ることが予想される。
一例として、本開示の方法及び組成物及びポリペプチドで使用され得るフィブロネクチンドメインは、一般に、当該技術分野で知られている。一実施形態では、フィブロネクチンドメインは、UniProt ID番号P02751の配列のアミノ酸610~702を有するフィブロネクチンIII型ドメインである。別の実施形態では、フィブロネクチンドメインは、アドネクチンタンパク質である。
本明細書で使用される場合、「ヒト血清アルブミン」という用語は、ヒト血漿中に存在するアルブミンタンパク質を指す。ヒト血清アルブミンは、血中で最も豊富なタンパク質である。これは、血清タンパク質の約半分を構成する。いくつかの実施形態では、ヒト血清アルブミンは、UniProt ID番号P02768の配列を有する。
いくつかの実施形態では、本明細書に記載のActRIIBバリアントまたはポリペプチドまたは結合剤は、血清アルブミンに融合され得る。血清アルブミンへの結合は、タンパク質医薬品の薬物動態を改善することができる。血清アルブミンは、哺乳類で最も豊富な血液タンパク質である球状タンパク質である。血清アルブミンは、肝臓で産生され、血清タンパク質の約半分を構成する。それは単量体であり、血液中に可溶性である。血清アルブミンの最も重要な機能のうちのいくつかは、体内のホルモン、脂肪酸、及び他のタンパク質を輸送すること、pHを緩衝すること、ならびに血管と体組織との間の体液の適切な分布に必要な浸透圧を維持することを含む。いくつかの実施形態では、血清アルブミンは、ヒト血清アルブミンである。いくつかの実施形態では、ヒト血清アルブミンは、本明細書に記載のActRIIB-ECDバリアント(例えば、配列番号4~22、331~332、及び24~33のうちのいずれか1つに示されるアミノ酸配列を有するActRIIB-ECDバリアント)のN末端またはC末端(例えば、C末端)に接合され、ActRIIB-ECDバリアントの血清半減期を増加させる。ヒト血清アルブミンは、直接的に、またはリンカーを通じて、ActRIIB-ECDバリアントのN末端またはC末端に接合され得る。
一例として、本明細書に記載のポリペプチド及び方法及び組成物に使用することができる血清アルブミンは、当該技術分野で一般に知られている。一実施形態では、血清アルブミンは、UniProt ID番号P02768の配列を含む。いくつかの実施形態では、本開示のポリペプチドまたは結合剤は、例えば、従来の遺伝的または化学的手段、例えば、化学的コンジュゲーションを通じて、ヒト血清アルブミンのN末端またはC末端に融合され得る。所望される場合、リンカー(例えば、スペーサー)は、ActRIIB-ECDバリアントとヒト血清アルブミンとの間に挿入され得る。理論に縛られることなく、いくつかの実施形態では、本明細書に記載のActRIIB-ECDバリアントにヒト血清アルブミンを含めることは、治療用タンパク質の長期保持をもたらし得ることが予想される。
いくつかの実施形態では、本開示のポリペプチドまたは結合剤は、部分(例えば、Fcドメイン単量体、野生型Fcドメイン、アミノ酸置換(例えば、二量体化を低減する1つ以上の置換、アルブミン結合ペプチド、フィブロネクチンドメイン、またはヒト血清アルブミン)を有するFcドメインを更に含み、これは、リンカーまたは他の共有結合を介して、ActRIIB-ECDバリアント、ポリペプチド、または結合剤のN末端またはC末端(例えば、C末端)に融合され得る。Fcドメイン単量体に融合されたActRIIB-ECDバリアントを含むポリペプチドは、2つのFcドメイン単量体間の相互作用を通じて二量体(例えば、ホモ二量体またはヘテロ二量体)を形成してもよく、これは、二量体においてFcドメインを形成するために結合する。更に、いくつかの実施形態では、本明細書に記載のポリペプチドまたは結合剤は、ヒトにおいて少なくとも7日間の血清半減期を有する。
例示的なTGFβスーパーファミリー結合剤
本明細書に記載の例示的な結合剤の全体的な構造を表5に提供する。各結合剤のアミノ酸配列を表6に提供する。
本明細書に記載の例示的な結合剤の全体的な構造を表5に提供する。各結合剤のアミノ酸配列を表6に提供する。
いくつかの実施形態では、結合剤は、N末端からC末端に、ActRIIB ECD、ペプチドリンカー、及びFcドメインを含む。いくつかの実施形態では、ActRIIB ECDは、1つ以上のアミノ酸置換を含む。いくつかの実施形態では、1つ以上のアミノ酸置換は、G27、Q29、D30、K31、S38、D57、F58、V75、及びF77から選択される位置での置換であり、ここで、アミノ酸の付番は、配列番号2に基づく。いくつかの実施形態では、G27位におけるアミノ酸置換は、G27Dである。いくつかの実施形態では、Q29位におけるアミノ酸置換は、Q29Yである。いくつかの実施形態では、D30位におけるアミノ酸置換は、D30Qである。いくつかの実施形態では、K31位におけるアミノ酸置換は、K31Yである。いくつかの実施形態では、S38位におけるアミノ酸置換は、S38Rである。いくつかの実施形態では、D57位におけるアミノ酸置換は、D57Eである。いくつかの実施形態では、F58位におけるアミノ酸置換は、F58D、F58E、F58K、F58Q、F58W、F58N、F58R、F58H、及びF58Yから選択される。いくつかの実施形態では、F58位におけるアミノ酸置換は、F58Eである。いくつかの実施形態では、F58位におけるアミノ酸置換は、F58Kである。いくつかの実施形態では、F58位におけるアミノ酸置換は、F58Qである。いくつかの実施形態では、V75位におけるアミノ酸置換は、V75Qである。いくつかの実施形態では、F77位におけるアミノ酸置換は、F77Dである。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、G27Dのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号20と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcEM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号20のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcEM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号177と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P119)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号177のアミノ酸配列を含むか、またはそれからなる(P119)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、D57Eのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号4と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcEM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号4のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcEM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号178と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P120)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号178のアミノ酸配列を含むか、またはそれからなる(P120)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Eのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcEM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcEM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号179と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P121)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号179のアミノ酸配列を含むか、またはそれからなる(P121)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、Q29Yのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号14と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcEM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号14のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcEM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号180と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P122)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号180のアミノ酸配列を含むか、またはそれからなる(P122)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、D30Qのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号15と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcEM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号15のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcEM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号181と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P123)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号181のアミノ酸配列を含むか、またはそれからなる(P123)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、K31Yのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号16と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcEM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号16のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcEM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号182と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P124)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号182のアミノ酸配列を含むか、またはそれからなる(P124)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、S38Rのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号17と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcEM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号17のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcEM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号183と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P125)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号183のアミノ酸配列を含むか、またはそれからなる(P125)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、V75Qのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号18と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcEM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号18のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcEM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号184と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P126)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号184のアミノ酸配列を含むか、またはそれからなる(P126)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F77Dのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号19のアミノ酸配列と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcEM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号19のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcEM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号185と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P127)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号185のアミノ酸配列を含むか、またはそれからなる(P127)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Eのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5のアミノ酸配列と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号186と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P622)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号186のアミノ酸配列を含むか、またはそれからなる(P622)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Eのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5のアミノ酸配列と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号187と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P624)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号187のアミノ酸配列を含むか、またはそれからなる(P624)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Eのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5のアミノ酸配列と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcY-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcY-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号188と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P625)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号188のアミノ酸配列を含むか、またはそれからなる(P625)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Eのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcYTE-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 FcYTE-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号189と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P626)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号189のアミノ酸配列を含むか、またはそれからなる(P626)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Eのアミノ酸置換を含むActRIIB ECD、19aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、19aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、19aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号190と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P666)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号190のアミノ酸配列を含むか、またはそれからなる(P666)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Eのアミノ酸置換を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号191と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P667)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号191のアミノ酸配列を含むか、またはそれからなる(P667)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Eのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号192と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P671)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号192のアミノ酸配列を含むか、またはそれからなる(P671)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Eのアミノ酸置換を含むActRIIB ECD、19aaの長さであるペプチドリンカー、及びIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、19aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、19aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号193と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P672)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号193のアミノ酸配列を含むか、またはそれからなる(P672)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Eのアミノ酸置換を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、39aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号194と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P673)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号194のアミノ酸配列を含むか、またはそれからなる(P673)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Eのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号195と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P674)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号195のアミノ酸配列を含むか、またはそれからなる(P674)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Dのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号6と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号6のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号196と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P683)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号196のアミノ酸配列を含むか、またはそれからなる(P683)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Dのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号6と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号6のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号197と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P684)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号197のアミノ酸配列を含むか、またはそれからなる(P684)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Dのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号6と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号6のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号198と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P685)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号198のアミノ酸配列を含むか、またはそれからなる(P685)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Dのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号6と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号6のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号199と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P686)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号199のアミノ酸配列を含むか、またはそれからなる(P686)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Dのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号6と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号6のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号200と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P687)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号200のアミノ酸配列を含むか、またはそれからなる(P687)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Dのアミノ酸置換を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号6と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号6のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号201と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P688)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号201のアミノ酸配列を含むか、またはそれからなる(P688)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Dのアミノ酸置換を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号6と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号6のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、39aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号202と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P689)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号202のアミノ酸配列を含むか、またはそれからなる(P689)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Yのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号7と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号7のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号203と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P690)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号203のアミノ酸配列を含むか、またはそれからなる(P690)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Yのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号7と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号7のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号204と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P691)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号204のアミノ酸配列を含むか、またはそれからなる(P691)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Yのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号7と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号7のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号205と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P692)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号205のアミノ酸配列を含むか、またはそれからなる(P692)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Yのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号7と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号7のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号206と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P693)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号206のアミノ酸配列を含むか、またはそれからなる(P693)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Yのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号7と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号7のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号207と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P694)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号207のアミノ酸配列を含むか、またはそれからなる(P694)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Yのアミノ酸置換を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号7と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号7のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号208と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P695)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号208のアミノ酸配列を含むか、またはそれからなる(P695)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Yのアミノ酸置換を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号7と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号7のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、39aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号209と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P696)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号209のアミノ酸配列を含むか、またはそれからなる(P696)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Kのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号210と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P697)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号210のアミノ酸配列を含むか、またはそれからなる(P697)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Kのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号211と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P698)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号211のアミノ酸配列を含むか、またはそれからなる(P698)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Kのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号212と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P699)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号212のアミノ酸配列を含むか、またはそれからなる(P699)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Kのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号213と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P700)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号213のアミノ酸配列を含むか、またはそれからなる(P700)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Kのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号214と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P701)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号214のアミノ酸配列を含むか、またはそれからなる(P701)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Kのアミノ酸置換を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号215と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P702)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号215のアミノ酸配列を含むか、またはそれからなる(P702)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Kのアミノ酸置換を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG2 Fcドメインを含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、39aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号216と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P703)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号216のアミノ酸配列を含むか、またはそれからなる(P703)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Qのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号217と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P704)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号217のアミノ酸配列を含むか、またはそれからなる(P704)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Qのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号218と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P705)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号218のアミノ酸配列を含むか、またはそれからなる(P705)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Qのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号219と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P706)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号219のアミノ酸配列を含むか、またはそれからなる(P706)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Qのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号220と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P707)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号220のアミノ酸配列を含むか、またはそれからなる(P707)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Qのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号221と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P708)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号221のアミノ酸配列を含むか、またはそれからなる(P708)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Qのアミノ酸置換を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号222と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P709)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号222のアミノ酸配列を含むか、またはそれからなる(P709)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Qのアミノ酸置換を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、39aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号223と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P710)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号223のアミノ酸配列を含むか、またはそれからなる(P710)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Wのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号10と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号10のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号224と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P711)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号224のアミノ酸配列を含むか、またはそれからなる(P711)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Wのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号10と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号10のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号225と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P712)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号225のアミノ酸配列を含むか、またはそれからなる(P712)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Wのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号10と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号10のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号226と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P713)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号226のアミノ酸配列を含むか、またはそれからなる(P713)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Wのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号10と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号10のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-EM Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号227と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P714)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号227のアミノ酸配列を含むか、またはそれからなる(P714)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Wのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号10と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号10のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号228と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P715)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号228のアミノ酸配列を含むか、またはそれからなる(P715)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Wのアミノ酸置換を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号10と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号10のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号229と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P716)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号229のアミノ酸配列を含むか、またはそれからなる(P716)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Wのアミノ酸置換を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号10と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号10のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、39aaの長さであるペプチドリンカー、及び配列番号157のIgG2 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号230と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P717)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号230のアミノ酸配列を含むか、またはそれからなる(P717)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、G27Dのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号20と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号10のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号240と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P758)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号240のアミノ酸配列を含むか、またはそれからなる(P758)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Kのアミノ酸置換を含むActRIIB ECD、6aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、6aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、6aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号241と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P1153)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号241のアミノ酸配列を含むか、またはそれからなる(P1153)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Kのアミノ酸置換を含むActRIIB ECD、10aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、10aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、10aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号242と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P1154)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号242のアミノ酸配列を含むか、またはそれからなる(P1154)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Kのアミノ酸置換を含むActRIIB ECD、19aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、19aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、19aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号243と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P1155)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号243のアミノ酸配列を含むか、またはそれからなる(P1155)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Kのアミノ酸置換を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号8のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、39aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号244と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P1156)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号244のアミノ酸配列を含むか、またはそれからなる(P1156)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Eのアミノ酸置換を含むActRIIB ECD、6aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、6aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、6aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号246と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P1163)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号246のアミノ酸配列を含むか、またはそれからなる(P1163)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Eのアミノ酸置換を含むActRIIB ECD、10aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、10aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、10aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号247と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P1164)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号247のアミノ酸配列を含むか、またはそれからなる(P1164)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Eのアミノ酸置換を含むActRIIB ECD及びC末端APT配列、14aaの長さであるペプチドリンカー、ならびにIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD及びC末端APT配列、14aaの長さであるペプチドリンカー、ならびにIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号5のアミノ酸配列を含むかまたはそれからなるActRIIB ECD及びC末端APT配列、14aaの長さであるペプチドリンカー、ならびにIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号248と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P1168)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号248のアミノ酸配列を含むか、またはそれからなる(P1168)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Nのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号11と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号11のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号249と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P1213)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号249のアミノ酸配列を含むか、またはそれからなる(P1213)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Rのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号12と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号12のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号250と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P1215)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号250のアミノ酸配列を含むか、またはそれからなる(P1215)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Hのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号13と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号13のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号251と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P1217)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号251のアミノ酸配列を含むか、またはそれからなる(P1217)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Qのアミノ酸置換を含むActRIIB ECD、6aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、6aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、6aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号252と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P1218)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号252のアミノ酸配列を含むか、またはそれからなる(P1218)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Qのアミノ酸置換を含むActRIIB ECD、10aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、10aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、10aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号253と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P1219)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号253のアミノ酸配列を含むか、またはそれからなる(P1219)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、F58Qのアミノ酸置換を含むActRIIB ECD、19aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、19aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号9のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、19aaの長さであるペプチドリンカー、及びIgG1 FcDL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号254と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P1220)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号254のアミノ酸配列を含むか、またはそれからなる(P1220)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、D57E及びF58Eのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号21と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号21のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号231と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P718)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号231のアミノ酸配列を含むか、またはそれからなる(P718)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、Q29Y及びF58Eのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号22と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号22のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号232と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P719)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号232のアミノ酸配列を含むか、またはそれからなる(P719)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、D30Q及びF58Eのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号331と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号331のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号233と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P720)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号233のアミノ酸配列を含むか、またはそれからなる(P720)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、G27D及びF58Eのアミノ酸置換を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号332と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号332のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、3aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号235と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P441)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号235のアミノ酸配列を含むか、またはそれからなる(P441)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、D57Eのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号4と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号4のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号333と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P759)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号333のアミノ酸配列を含むか、またはそれからなる(P759)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、K31Yのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号16と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号16のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号339と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P761)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号339のアミノ酸配列を含むか、またはそれからなる(P761)。
いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、V75Qのアミノ酸置換を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号18と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含むActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、N末端からC末端に、配列番号18のアミノ酸配列を含むかまたはそれからなるActRIIB ECD、14aaの長さであるペプチドリンカー、及びIgG1 Fc-DL Fcドメイン単量体を含む。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号340と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む(P762)。いくつかの実施形態では、TGFβスーパーファミリーリガンド結合剤は、ホモ二量体ポリペプチドであり、各ポリペプチド鎖は、配列番号340のアミノ酸配列を含むか、またはそれからなる(P762)。
いくつかの実施形態では、本開示のポリペプチドまたは結合剤は、「単離された」または「実質的に純粋」である。本明細書に開示されるポリペプチドまたは結合剤を説明するために使用される場合、「単離された」または「実質的に純粋」とは、その産生環境の構成要素から特定、分離及び/または回収されたポリペプチドまたは結合剤を意味する。好ましくは、ポリペプチドまたは結合剤は、その産生環境からの他の全ての構成要素と会合しないか、または実質的に会合しない。その産生環境の汚染構成要素、例えば、組換えトランスフェクトされた細胞から生じる汚染構成要素は、典型的には、ポリペプチドの診断または治療用途を妨げるであろう物質であり、酵素、ホルモン、及び他のタンパク質性または非タンパク質性溶質を含み得る。ポリペプチドまたは結合剤は、例えば、所与の試料中の総タンパク質の少なくとも約5重量%、または少なくとも約50重量%を構成し得る。単離されたタンパク質は、状況に応じて、総タンパク質含有量の5重量%~99.9%を構成し得ることが理解される。ポリペプチドまたは結合剤は、それが増加した濃度レベルで作製されるように、誘導的プロモーターまたは高発現プロモーターの使用を通じて、著しく高い濃度で作製され得る。この定義は、当該技術分野で既知の多種多様な生物及び/または宿主細胞におけるポリペプチドまたは結合剤の産生を含む。好ましい実施形態では、ポリペプチドまたは結合剤は、(1)スピニングカップ配列決定装置を使用して、N末端または内部アミノ酸配列の少なくとも15残基を取得するのに十分な程度まで、または(2)クマシーブルーもしくは好ましくは銀染色を使用した非還元もしくは還元条件下で、SDS-PAGEによって均一になるまで、精製されるであろう。しかしながら、通常、単離されたポリペプチドまたは結合剤は、少なくとも1つの精製ステップ、例えば、限定されないが、親和性及び/またはイオン交換クロマトグラフィー、例えば、プロテインAカラムへの結合によって調製されるであろう。
いくつかの実施形態では、本開示のポリペプチド及び結合剤は、例えば、アクチビンA、アクチビンB、GDF-8、GDF-11及びBMP-10のうちの1つ以上に対する特に高い親和性、アクチビンA、アクチビンB、GDF-8、GDF-11及びBMP-10のうちの1つ以上に対する高い中和効力(低IC50値)、BMP-9に対する特に低いまたは検出できない親和性、BMP-9に対する低いまたは検出できない中和効力(高いIC50値)、高い熱安定性、高い血漿安定性、長いまたは延長された半減期、低濁度、高いタンパク質均一性、及び/または高い製造性のうちの1つ以上を特徴とする。
本開示のポリペプチドもしくは結合剤、またはそれらの薬学的組成物の生物活性は、例えば、細胞中和アッセイ、結合アッセイ、競合アッセイなどによって決定することができる。本明細書で使用される「有効性」または「インビボ有効性」は、本開示のポリペプチドまたは結合剤または薬学的組成物を使用した療法に対する応答を指す。本開示のポリペプチドまたは結合剤または薬学的組成物を使用する療法の成功またはインビボでの有効性は、ポリペプチドまたは結合剤または組成物の、その意図された目的、例えば、ポリペプチドまたは結合剤または組成物が、所望の効果、すなわち、本明細書に定義されるTGFβスーパーファミリー関連疾患または障害の治療、改善、または予防を引き起こす能力に対する有効性を指す。インビボ有効性は、それぞれの疾患エンティティについて確立された標準的な方法によってモニタリングされてもよい。加えて、様々な疾患特異的臨床化学パラメータ及び他の確立された標準方法を使用してもよい。
本開示の薬学的組成物などの薬物の開発における別の主要な課題は、薬物動態特性の予測可能な調節である。この目的のために、薬物候補の薬物動態プロファイル、すなわち、所与の状態を治療する特定の薬物の能力に影響を与える薬物動態パラメータのプロファイルを確立することができる。ある特定の疾患エンティティを治療するための薬物の能力に影響を与える薬物の薬物動態パラメータとしては、半減期、分布体積、肝臓のファーストパス代謝、及び血清結合の程度が挙げられるが、これらに限定されない。所与の薬剤の有効性は、上述のパラメータの各々によって影響され得る。
薬物動態パラメータはまた、所与の量の投与される薬物についてのバイオアベイラビリティ、ラグタイム(Tlag)、Tmax、吸収速度、より多くの発症及び/またはCmaxを含む。「バイオアベイラビリティ」は、血液区画内の薬物の量を意味する。「ラグタイム」とは、薬物の投与と、血液または血漿中でのその検出及び測定可能性との間の時間遅延を意味する。「Tmax」は、薬物の最大血中濃度に達した後の時間であり、「Cmax」は、所与の薬物で最大限に得られる血中濃度である。その生物学的効果に必要な薬物の血中または組織濃度に達するまでの時間は、全てのパラメータによって影響される。
いくつかの実施形態では、本開示のポリペプチドまたは結合剤は、約3日以上、約5日以上、約1週間以上、約2週間以上、約3週間以上、約4週間以上、約5週間以上、約6週間以上、または約2ヶ月以上の半減期を有する。
いくつかの実施形態では、本開示のポリペプチドまたは結合剤は、約45℃以上、約45~約50℃、約52~約54℃、約56~約60℃、または約60℃以上の凝集温度で好ましい熱安定性を示し得る。熱安定性パラメータは、以下のようにポリペプチド凝集温度の観点から決定することができる。試験濃度(例えば、100μg/ml、250μg/ml)のタンパク質溶液を単回使用キュベットに移し、動的光散乱(DLS)デバイスに配置する。試料を40℃から70℃まで0.5℃/分の加熱速度で加熱し、測定された半径を一定に取得する。タンパク質の融解及び凝集を示す半径の増加を使用して、ポリペプチドの凝集温度を算出する。当該技術分野で既知の他の方法が使用され得る。
一実施形態では、本開示によるポリペプチドまたは結合剤は、少なくとも1ヶ月、2ヶ月、または3ヶ月間、2~8℃で安定である。一実施形態では、本開示によるポリペプチドまたは結合剤は、少なくとも4週間、25~40℃で安定である。一実施形態では、本開示によるポリペプチドまたは結合剤は、3回の凍結/解凍サイクルを受けた後で安定である。一実施形態では、本開示によるポリペプチドまたは結合剤は、-20℃で1ヶ月、2ヶ月、3ヶ月以上安定である。
あるいは、温度融解曲線は、ポリペプチドまたは結合剤の固有の生物物理学的タンパク質安定性を決定するために、示差走査熱量測定(DSC)によって決定することができる。これらの実験は、MicroCal LLC(Northampton,Mass.,U.S.A)VP-DSCデバイスを使用して行われ得る。ポリペプチドまたは結合剤を含む試料のエネルギー取り込みは、製剤緩衝液のみを含む試料と比較して、20℃~90℃で記録される。それぞれの融解曲線の記録のために、全体的な試料温度は段階的に増加する。各温度で、試料及び製剤緩衝液基準のTエネルギー取り込みが記録される。試料のエネルギー取り込みCp(kcal/モル/℃)の差から基準を引いたものを、それぞれの温度に対してプロットする。融解温度は、エネルギー取り込みの最初の最大値における温度として定義される。
更なる実施形態では、本開示によるポリペプチドまたは結合剤は、酸性pHで安定である。ポリペプチドまたは結合剤が、pH5.5(例えば、カチオン交換クロマトグラフィーを実行するために必要なpH)などの非生理学的pHでより寛容に振る舞うほど、充填されたタンパク質の総量に対して、イオン交換カラムから溶出されたポリペプチドまたは結合剤の回収率が高い。PH5.5のイオン(例えば、カチオン)交換カラムからのポリペプチドまたは結合剤の回収は、50%以上、60%以上、65%以上、70%以上、72%以上、74%以上、76%以上、78%以上、80%以上、90%以上、95%以上、または99%以上であり得る。
アミノ酸配列修飾
本明細書に記載のポリペプチド及び結合剤のアミノ酸配列修飾が企図される。例えば、ポリペプチドまたは結合剤の結合親和性、エフェクター機能、半減期、及び/または他の生物学的特性を改善することが望ましくあり得る。ポリペプチド及び結合剤のアミノ酸配列修飾/バリアントは、一般に、コード核酸に適切なヌクレオチド変化を導入することによって、またはペプチド合成によって調製される。以下に記載されるアミノ酸配列修飾の全ては、修飾されていない親分子の所望の生物学的活性(例えば、BMP-9への実質的な結合なしに、アクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上に結合する)を依然として保持するポリペプチドまたは結合剤をもたらすべきである。
本明細書に記載のポリペプチド及び結合剤のアミノ酸配列修飾が企図される。例えば、ポリペプチドまたは結合剤の結合親和性、エフェクター機能、半減期、及び/または他の生物学的特性を改善することが望ましくあり得る。ポリペプチド及び結合剤のアミノ酸配列修飾/バリアントは、一般に、コード核酸に適切なヌクレオチド変化を導入することによって、またはペプチド合成によって調製される。以下に記載されるアミノ酸配列修飾の全ては、修飾されていない親分子の所望の生物学的活性(例えば、BMP-9への実質的な結合なしに、アクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上に結合する)を依然として保持するポリペプチドまたは結合剤をもたらすべきである。
本明細書で使用される場合、「機能的に同等の」という用語は、それが由来する元の配列と同じまたは実質的に同じ生物学的活性または機能、例えば、元の配列と比較して生理学的、化学的、理化学的または機能的特性に著しい変化がない修飾された配列を指す。「実質的に同一の」という用語は、元の配列または参照配列と機能的に等価であり、それに対して高度な配列同一性を有する配列を指す。一般に、実質的に同一の配列は、元の配列または参照配列と少なくとも約90%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、または少なくとも約99%同一であり、同じ機能を有する。場合によっては、核酸配列を指すとき、実質的に同一の配列は、高いストリンジェンシー条件下、例えば、ハイブリダイゼーション及び洗浄の両方について、0.5X SSC~約5X SSC及び65℃に実質的に等しい塩及び温度条件下で、元の配列にハイブリダイズする。一般に、本開示に従って提供される配列と実質的に同一または機能的に同等である修飾配列は、包含されることになっている。
アミノ酸修飾には、例えば、ポリペプチドまたは結合剤のアミノ酸配列内の残基からの欠失、及び/または挿入、及び/または置換が含まれる。欠失、挿入、及び置換の任意の組み合わせが、最終構築物に到達するためになされるが、ただし、最終構築物が所望の特徴を有することを条件とする。アミノ酸の変化はまた、グリコシル化部位の数または位置を変化させるなど、ポリペプチドまたは結合剤の翻訳後プロセスを変化させ得る。特定の実施形態では、1つ以上のアミノ酸は、グリコシル化部位を改変するように変更される。
例えば、1、2、3、4、5、または6個のアミノ酸を、ポリペプチドまたは結合剤に挿入または欠失させてもよい。好ましくは、アミノ酸配列挿入は、1、2、3、4、5、6、7、8、9、または10個の残基から100個以上の残基を含むポリペプチドまでの長さのアミノ及び/またはカルボキシル末端融合、ならびに単一または複数のアミノ酸残基の配列内挿入を含む。本開示のポリペプチドまたは結合剤の挿入バリアントは、酵素のポリペプチドもしくは結合剤のN末端もしくはC末端への融合、ポリペプチドもしくは結合剤の血清半減期を増加させるポリペプチドへの融合を含む。
本明細書に記載のポリペプチドまたは結合剤の修飾も包含されることが想定される。本開示に包含される修飾としては、ポリペプチドまたは結合剤のアミノ酸配列における変形を有するものが挙げられる。ポリペプチドまたは結合剤の修飾には、例えば、本明細書に開示されるポリペプチドまたは結合剤と比較して、類似または改善された結合親和性、親和性、リガンド特異性、阻害効力、安定性、製造可能性、半減期、及び/または低減された凝集を有するものが含まれる。
置換変異誘発の目的の1つの部位には、本明細書で上述したFcドメイン単量体が含まれる。本開示の修飾ポリペプチドまたは結合剤の例示的な実施形態は、修飾IgG1、IgG2、IgG3、またはIgG4定常領域またはその一部を有するものを含み得る。一実施形態では、ポリペプチドまたは結合剤は、IgG1定常領域(修飾または非修飾)を含む。一実施形態では、ポリペプチドまたは結合剤は、IgG2定常領域(修飾または非修飾)を含む。一実施形態では、ポリペプチドまたは結合剤は、IgG3定常領域(修飾または非修飾)を含む。一実施形態では、ポリペプチドまたは結合剤は、IgG4定常領域(修飾または非修飾)を含む。
本開示に包含される修飾には、挿入、欠失、またはアミノ酸置換(保存的または非保存的)を含み得る修飾が含まれる。これらの修飾は、そのアミノ酸配列中の少なくとも1つのアミノ酸残基が除去され、異なる残基がその位置に挿入され得る。所望の結合または生物学的活性が維持される限り、変異がポリペプチドまたは結合剤の複数の領域に生じ得ることを理解されたい。
修飾及びバリアントは、置換変異誘発によって生成され得、本開示のポリペプチドの生物学的活性(すなわち、機能的等価性)を保持し得ることが当該技術分野で知られている。これらの修飾またはバリアントは、除去されたアミノ酸配列中の少なくとも1つのアミノ酸残基と、その代わりに挿入された異なる残基、例えば、1つ以上の保存的アミノ酸置換を有する。一般に、保存的アミノ酸置換は、類似の化学的特性(例えば、サイズ、電荷、または極性)を備えた別のアミノ酸残基に対するアミノ酸残基の置換である。
一般に、バリアントポリペプチド鎖間の類似性及び同一性の程度は、デフォルト設定、すなわち、blastpプログラム、BLOSUM62マトリックス(開放ギャップ11及び伸長ギャップペナルティ1;gapxドロップオフ50、期待10.0、ワードサイズ3)、及び活性化フィルターを使用して、Blast2配列プログラム(Tatusova,T.A.及びMadden,T.L.,1999)を使用して本明細書で決定される。
しかしながら、同一性のレベルは、所与の配列の全長にわたって決定されてもよい。したがって、パーセント同一性は、元のペプチドと比較して同一であり、同じまたは同様の位置を占め得るアミノ酸を示す。パーセント類似性は、同一であるアミノ酸と、同じまたは類似の位置にある元のペプチドと比較して、保存的アミノ酸置換で置換されているアミノ酸とを示す。
いくつかの実施形態では、したがって、本開示のポリペプチドまたは結合剤の修飾は、元の配列または元の配列の一部と少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有するアミノ酸配列を含む。
いくつかの実施形態では、置換は、保存的置換である。しかしながら、任意の置換(非保存的置換を含む)は、ポリペプチドまたは結合剤が、BMP-9に実質的に結合または阻害することなく、所望のTGFβスーパーファミリーリガンドに結合及び/または阻害する能力を保持する限り、想定される。
一般に、本開示のポリペプチドまたは結合剤をコードするヌクレオチド配列と本明細書に示されるヌクレオチド配列との間の核酸配列の相同性、類似性、または同一性は、少なくとも60%であり、より典型的には、少なくとも65%、70%、75%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、または99%、及びほぼ100%の漸増する相同性または同一性を有する。
核酸ならびにポリペプチド及び結合剤の産生
本開示は、本明細書で提供されるActRIIB-ECDポリペプチドをコードするポリヌクレオチドを更に提供する。いくつかの実施形態では、ポリヌクレオチドは、配列番号256~330、334、または342~344のうちの1つと少なくとも80%、85%、90%、95%、96%、97%、98%、または99%同一である核酸配列を含む。いくつかの実施形態では、ポリヌクレオチドは、配列番号256~330、334、または342~344のうちのいずれか1つを含むか、またはそれらからなる。
本開示は、本明細書で提供されるActRIIB-ECDポリペプチドをコードするポリヌクレオチドを更に提供する。いくつかの実施形態では、ポリヌクレオチドは、配列番号256~330、334、または342~344のうちの1つと少なくとも80%、85%、90%、95%、96%、97%、98%、または99%同一である核酸配列を含む。いくつかの実施形態では、ポリヌクレオチドは、配列番号256~330、334、または342~344のうちのいずれか1つを含むか、またはそれらからなる。
ポリヌクレオチドは、鎖に共有結合したヌクレオチド単量体からなるバイオポリマーである。DNA(cDNAなど)及びRNA(mRNAなど)は、異なる生物学的機能を有するポリヌクレオチドの例である。ヌクレオチドは、DNAまたはRNAのような核酸分子の単量体またはサブユニットとして機能する有機分子である。核酸分子またはポリヌクレオチドは、二本鎖または一本鎖、直鎖または環状であり得る。いくつかの実施形態では、核酸分子またはポリヌクレオチドは、ベクターに含まれる。いくつかの実施形態では、ベクターは宿主細胞に含まれる。宿主細胞は、例えば、本開示のベクターまたはポリヌクレオチドによる形質転換またはトランスフェクション後に、ポリペプチドまたは結合剤を発現することができる。その目的のために、ポリヌクレオチドまたは核酸分子は、通常、制御配列と作動可能に連結される。
更に、本開示は、本明細書に提供されるポリペプチドまたは結合剤をコードするポリヌクレオチド/核酸分子を含むベクターを提供する。
ベクターは、(外来)遺伝物質を細胞に導入するためのビヒクルとして使用される核酸分子である。「ベクター」という用語は、プラスミド、ウイルス、コスミド、及び人工染色体を包含するが、これらに限定されない。一般に、操作されたベクターは、複製起点、マルチクローニング部位、及び選択可能なマーカーを含む。ベクター自体は、一般に、インサート(導入遺伝子)及びベクターの「骨格」として機能するより大きな配列を含むヌクレオチド配列、一般的にDNA配列である。現代のベクターは、導入遺伝子インサート及び骨格以外の追加の特徴:プロモーター、遺伝子マーカー、抗生物質耐性、レポーター遺伝子、標的化配列、タンパク質精製タグを包含し得る。発現ベクター(発現コンストラクト)と呼ばれるベクターは、具体的には、標的細胞における導入遺伝子の発現のためのものであり、一般に、制御配列を有する。
「制御配列」という用語は、特定の宿主生物における作動可能に連結されたコード配列の発現に必要なDNA配列を指す。原核生物に好適な制御配列には、例えば、プロモーター、任意にオペレーター配列、及びリボソーム結合部位が挙げられる。真核細胞は、プロモーター、ポリアデニル化シグナル、及びエンハンサーを用いることで知られている。
核酸は、別の核酸配列と機能的関係に置かれるとき、「作動可能に連結される」。例えば、前配列または分泌リーダー(シグナル配列)のDNAは、ポリペプチドの分泌に関与する前タンパク質として発現される場合、ポリペプチドのDNAに作動可能に連結され、プロモーターまたはエンハンサーは、配列の転写に影響を及ぼす場合、コード配列に作動可能に連結されるか、またはリボソーム結合部位は、翻訳を容易にするように位置づけられる場合、コード配列に作動可能に連結される。一般に、「作動可能に連結される」は、連結されるDNA配列が連続的であり、分泌リーダーの場合には、連続的であり、かつリーディングフェーズにあることを意味する。しかしながら、エンハンサーは、連続していなくてもよい。連結は、好都合な制限部位でのライゲーションによって達成される。かかる部位が存在していない場合、合成オリゴヌクレオチドアダプターまたはリンカーが、従来の慣例に従って使用される。
「トランスフェクション」は、核酸分子またはポリヌクレオチド(ベクターを含む)を標的細胞に意図的に導入するプロセスである。この用語は、主に真核細胞における非ウイルス方法について使用される。形質導入は、核酸分子またはポリヌクレオチドのウイルス媒介性導入を説明するためにしばしば使用される。動物細胞のトランスフェクションは、典型的には、材料の取り込みを可能にするために、細胞膜内に一過性の孔または「穴」を開けることを伴う。トランスフェクションは、リン酸カルシウムを使用して、エレクトロポレーションによって、細胞絞りによって、またはカチオン性脂質を材料と混合してリポソームを生成することによって実行され得、リポソームは、細胞膜と融合し、内部に貨物を堆積させる。
「形質転換」という用語は、核酸分子またはポリヌクレオチド(ベクターを含む)の、細菌への、及びまた、植物細胞を含む非動物真核細胞への非ウイルス導入を記載するために使用される。したがって、形質転換は、その周囲から細胞膜(複数可)を通って直接取り込まれ、その後の外因性遺伝物質(核酸分子)の組み込みに起因する細菌または非動物真核細胞の遺伝的変化である。形質転換は、人工的な手段によってもたらされ得る。形質転換が起こるためには、細胞または細菌は能力状態になければならず、これは飢餓や細胞密度などの環境条件に対する時間制限された応答として起こり得る。
更に、本開示は、ポリヌクレオチド/核酸分子または技術のベクターで形質転換またはトランスフェクトされた宿主細胞を提供する。
本明細書で使用される場合、「宿主細胞」及び「レシピエント細胞」という用語は、本開示のポリペプチドまたは結合剤をコードするベクター、外因性核酸分子、及びポリヌクレオチドのレシピエント、及び/またはポリペプチドまたは結合剤自体のレシピエントであり得るか、またはこれらのレシピエントである任意の個々の細胞または細胞培養を含むことが意図される。細胞へのそれぞれの物質の導入は、形質転換、トランスフェクションなどによって実行される。「宿主細胞」という用語はまた、単一細胞の子孫または潜在的な子孫を含むことが意図される。ある特定の修飾は、自然、偶発的、もしくは意図的変異のいずれかにより、または環境影響により後の世代で生じ得るため、そのような子孫は実際には親細胞と完全に同一ではない場合があるが(形態学的に、またはゲノムもしくは全DNA補体において)、依然として本明細書で使用される本用語の範囲内に含まれる。好適な宿主細胞としては、原核細胞または真核細胞が挙げられ、細菌、酵母細胞、真菌細胞、植物細胞、ならびに昆虫細胞及び哺乳類細胞などの動物細胞、例えば、マウス細胞、ラット細胞、マカク細胞またはヒト細胞も挙げられるが、これらに限定されない。
本開示のポリペプチドまたは結合剤は、細菌中で産生され得る。発現後、ポリペプチドまたは結合剤は、可溶性画分で大腸菌細胞ペーストから単離され、例えば、親和性クロマトグラフィー及び/またはサイズ排除を通じて精製され得る。最終精製は、例えば、CHO細胞において発現されるタンパク質を精製するためのプロセスと同様に実行することができる。
原核生物に加えて、糸状菌または酵母などの真核微生物は、ポリペプチドまたは結合剤のための適切なクローニングまたは発現宿主である。Saccharomyces cerevisiae、または一般的なパン酵母が、下等真核生物宿主微生物の中で最も一般的に使用されているものである。しかしながら、Schizosaccharomyces pombe、Kluyveromyces宿主、例えば、K.lactis、K.fragilis(ATCC 12424)、K.bulgaricus(ATCC 16045)、K.wickeramii(ATCC 24178)、K.waltii(ATCC 56500)、K.drosophilarum(ATCC 36906)、K.thermotolerans、及びK.marxianus;yarrowia(EP 402 226);Pichia pastoris(EP 183070);Candida;Trichoderma reesia(EP 244234);Neurospora crassa;Schwanniomyces、例えば、Schwanniomyces occidentalis;ならびにfilamentous fungi、例えば、Neurospora、Penicillium、Tolypocladium、及びAspergillus宿主、例えば、A.nidulans及びA.nigerなどのいくつかの他の属、種、及び株は、一般的に利用可能であり、本明細書で有用である。
本開示のグリコシル化ポリペプチドまたは結合剤の発現に好適な宿主細胞は、多細胞生物に由来する。無脊椎動物細胞の例としては、植物及び昆虫細胞が挙げられる。多数のバキュロウイルス株及びバリアント、ならびにSpodoptera frugiperda(芋虫)、Aedes aegypti(カ)、Aedes albopictu(カ)、Drosophila melanogaster(ショウジョウバエ)、及びBombyx moriなどの宿主からの対応する許容昆虫宿主細胞が同定されている。トランスフェクションのための様々なウイルス株、例えば、Autographa californica NPVのL-1バリアント及びBombyx mori NPVのBm-5株は、公的に利用可能であり、そのようなウイルスは、特にSpodoptera frugiperda細胞のトランスフェクションのために、本開示による本明細書のウイルスとして使用され得る。
綿、トウモロコシ、ジャガイモ、大豆、ペチュニア、トマト、イソギンチャク、及びタバコの植物細胞培養物を、宿主として使用することもできる。植物細胞培養物におけるタンパク質の産生に有用なクローニング及び発現ベクターは、当業者に既知である。例えば、Hiatt et al.,Nature(1989)342:76-78、Owen et al.(1992)Bio/Technology 10:790-794、Artsaenko et al.(1995)The Plant J 8:745-750、及びFecker et al.(1996)Plant Mol Biol 32:979-986を参照されたい。
しかしながら、脊椎動物細胞が最も注目されており、培養下での脊椎動物細胞の増殖(組織培養)が日常的な手段となっている。有用な哺乳動物宿主細胞株の例は、SV40によって形質転換されたサル腎臓CV1株(COS-7、ATCC CRL 1651);ヒト胚腎臓株(浮遊培養での増殖のためにサブクローニングされた293または293細胞、Graham et al.,1977);ベビーハムスター腎臓細胞(BHK、ATCC CCL 10);チャイニーズハムスター卵巣細胞/-DHFR(CHO、Urlaub et al.,1980);マウスセルトリ細胞(TM4、Mather、1980);サル腎臓細胞(CVI ATCC CCL 70);アフリカ緑サル腎臓細胞(VERO-76、ATCC CRL 1587);ヒト子宮頸癌細胞(HELA、ATCC CCL2);イヌ腎臓細胞(MDCK、ATCC CCL 34);バッファローラット肝細胞(BRL 3A、ATCC CRL 1442);ヒト肺細胞(W138、ATCC CCL 75);ヒト肝臓細胞(Hep G2、1413 8065);マウス乳腺腫瘍細胞(MMT 060562、ATCC CCL5 1);TRI細胞(Mather et al.,Annals N.Y Acad.Sci.(1982)383:44~68);MRC5細胞;FS4細胞;及びヒト肝腫株(Hep G2)である。
更なる実施形態では、本開示は、ポリペプチドまたは結合剤の産生のためのプロセスを提供し、当該プロセスは、ポリペプチドまたは結合剤の発現を可能にする条件下で宿主細胞を培養することと、産生されたポリペプチドまたは結合剤を培養物から回収することと、を含む。
本明細書で使用される場合、「培養」という用語は、培地中での好適な条件下での細胞のインビトロ維持、分化、成長、増殖、及び/または伝播を指す。「発現」という用語は、転写、転写後修飾、翻訳、翻訳後修飾、及び分泌を含むが、これらに限定されない、本開示のポリペプチドまたは結合剤の産生に関与する任意のステップを含む。
組換え技法を使用する場合、ポリペプチドまたは結合剤は、細胞内で、膜周囲空間で、または培地に直接分泌されることができる。ポリペプチドまたは結合剤が細胞内で産生される場合、第1のステップとして、例えば、遠心分離または限外濾過によって、宿主細胞または溶解断片のいずれかの粒子デブリを除去する。Carter et al.,Bio/Technology 10:163-167(1992)は、大腸菌の細胞膜腔に分泌される抗体を単離するための手順を記載している。要するに、細胞ペーストを酢酸ナトリウム(pH3.5)、EDTA、及びフェニルメチルスルホニルフルオリド(PMSF)の存在下で約30分かけて解凍する。細胞片は遠心分離によって除去され得る。抗体が培地に分泌される場合、かかる発現系の上清は、一般に、市販のタンパク質濃縮フィルター、例えば、AmiconまたはMillipore Pellicon限外濾過ユニットを使用して最初に濃縮される。PMSFなどのプロテアーゼ阻害剤は、タンパク質分解を阻害するために前述のステップのうちのいずれかに含まれ得、抗生物質は、外来性混入物質の成長を阻止するために含まれ得る。
宿主細胞から調製された本開示のポリペプチドまたは結合剤は、例えば、ヒドロキシルアパタイトクロマトグラフィー、ゲル電気泳動、透析、及び親和性クロマトグラフィーを使用して回収または精製することができる。イオン交換カラム上の分画、エタノール沈殿、逆相HPLC、シリカ上のクロマトグラフィー、ヘパリンSEPHAROSE(商標)上のクロマトグラフィー、アニオンまたはカチオン交換樹脂(ポリアスパラギン酸カラムなど)上のクロマトグラフィー、クロマトフォーカシング、SDS-PAGE、及び硫酸アンモニウム沈殿などのタンパク質精製のための他の技法もまた、回収される抗体に応じて利用可能である。本開示のポリペプチドまたは結合剤がCH3ドメインを含む場合、Bakerbond ABX樹脂(J.T.Baker,Phillipsburg,N.J.)は、精製に有用であり得る。
親和性クロマトグラフィーは、一般的な精製技法である。親和性リガンドが結合するマトリックスは、ほとんどの場合アガロースであるが、他のマトリックスも利用可能である。制御された細孔ガラスまたはポリ(スチレンジビニル)ベンゼンなどの機械的に安定したマトリックスは、アガロースで達成することができるよりも速い流量及び短い処理時間を可能にする。
本明細書に開示されるポリペプチドまたは結合剤は、組換えDNA法を含む、当業者によく知られている様々な方法によって作製され得る。
ポリペプチドまたは結合剤を発現するために、本明細書に記載のポリペプチド鎖をコードすることができるヌクレオチド配列を、発現ベクター、すなわち、特定の宿主における挿入されたコード配列の転写及び翻訳制御のための要素を含むベクターに挿入し得る。これらの要素は、調節配列、例えば、エンハンサー、構成的及び誘導的プロモーター、ならびに5’及び3’非翻訳領域を含み得る。当業者に周知の方法を使用して、そのような発現ベクターを構築してもよい。これらの方法には、インビトロ組換えDNA技法、合成技法、インビボ遺伝子組換えなどが含まれる。
当業者に既知の様々な発現ベクター及び宿主細胞系を使用して、本明細書に記載のポリペプチド鎖を発現してもよい。これらには、組換えバクテリオファージ、プラスミド、またはコスミドDNA発現ベクターで形質転換された細菌;酵母発現ベクターで形質転換された酵母;バキュロウイルスベクターで感染された昆虫細胞系;ウイルスまたは細菌発現ベクターで形質転換された植物細胞系;及び動物細胞系などの微生物が含まれるが、これらに限定されない。哺乳類系における組換えタンパク質の長期産生のために、哺乳類細胞株における安定した発現が使用され得る。例えば、本明細書に記載のポリペプチド鎖のうちのいずれか1つをコードすることができるヌクレオチド配列は、ウイルス複製起点及び/または内因性発現エレメントと、同じまたは別個のベクター上の選択可能または可視マーカー遺伝子とを含み得る発現ベクターを使用して細胞株に変換され得る。本開示は、用いられるベクターまたは宿主細胞によって限定されるものではない。本明細書に開示されるある特定の実施形態では、本明細書に記載のポリペプチド鎖をコードすることができる核酸は、発現ベクターにライゲーションされ得る。結合剤が別個のポリペプチド鎖で構成される場合(すなわち、第1のポリペプチド及び第2のポリペプチドが同一でない場合)、そのようなポリペプチド鎖の各々は、別個のベクターに、または同じベクターにライゲーションされてもよい。本開示によれば、結合剤のポリペプチド鎖は、単一のベクターまたは別個のベクター(例えば、ベクターセット)によってコードされ得る。細胞は、所望のベクターまたはベクターセットで変換される。
あるいは、ポリペプチド鎖は、それぞれ、インビトロ転写系またはカップリングされたインビトロ転写/翻訳系、または任意のそのような無細胞系から発現され得る。
ヌクレオチド配列を含む宿主細胞は、対応するRNA(mRNAなど)の転写及び/または細胞培養物からのポリペプチド(複数可)の発現及び分泌のための条件下で培養され得る。例示的な実施形態では、本明細書に記載のポリペプチド鎖をコードすることができるヌクレオチド配列を含む発現ベクターは、原核または真核細胞膜を通じてポリペプチドの分泌を指示するシグナル配列を含むように設計され得る。
遺伝コードの固有の縮重性に起因して、同一の、実質的に同一の、または機能的に等価なアミノ酸配列をコードするDNA配列が、産生及び使用されてもよい。本開示のヌクレオチド配列は、遺伝子産物のクローニング、処理、及び/または発現の修飾を含むがこれらに限定されない様々な目的のためにヌクレオチド配列を変更するために、当該技術分野で一般に既知の方法を使用して操作され得る。遺伝子断片及び合成オリゴヌクレオチドのランダム断片化及びPCR再構成によるDNAシャッフリングを使用して、ヌクレオチド配列を操作することができる。例えば、オリゴヌクレオチド媒介部位特異的変異誘発を使用して、新しい制限部位を作製する変異、グリコシル化パターンを変化させる変異、コドン選好を変化させる変異、スプライスバリアントを産生する変異などを導入することができる。本明細書に記載のポリペプチド鎖をコードするコドン最適化された核酸は、本開示によって包含される。
加えて、宿主細胞株は、挿入された配列の発現を調節する能力、または発現されたポリペプチドを所望の様式で処理する能力のために選択されてもよい。翻訳後活性のための特定の細胞機構及び特徴的な機構を有する異なる宿主細胞(例えば、CHO、HeLa、MDCK、HEK293、及びW138)は、商業的に、及びAmerican Type Culture Collection(ATCC)から入手可能であり、発現したポリペプチドの正しい修飾及び処理を確実にするために選択することができる。
当業者はまた、核酸及びポリペプチド配列が、当該技術分野で周知の化学的または酵素的方法を使用して、全体的または部分的に合成され得ることを容易に認識するであろう。例えば、ペプチド合成は、様々な固相技法を使用して行われてもよく、ABI 431Aペプチドシンセサイザー(PE Biosystems)などの機械を使用して、合成を自動化してもよい。所望される場合、アミノ酸配列は、合成中に改変されてもよく、及び/または他のタンパク質由来の配列と組み合わされて、バリアントタンパク質を産生してもよい。
医薬組成物
本明細書に開示されるポリペプチドまたはTGFβスーパーファミリーリガンド結合剤を含む薬学的組成物が、本開示によって提供される。薬学的組成物は、一般に、本明細書に開示されるポリペプチドまたは結合剤と薬学的に許容される担体とを含む。
本明細書に開示されるポリペプチドまたはTGFβスーパーファミリーリガンド結合剤を含む薬学的組成物が、本開示によって提供される。薬学的組成物は、一般に、本明細書に開示されるポリペプチドまたは結合剤と薬学的に許容される担体とを含む。
薬学的組成物の調製は、当該技術分野で知られているように実行することができる(例えば、Remington:The Science and Practice of Pharmacy,20th Edition,2000を参照)。例えば、治療用化合物及び/または組成物は、1つ以上の固体または液体の薬学的担体物質及び/または添加物(もしくは補助物質)とともに、及び必要に応じて、治療または予防作用を有する他の薬学的に活性な化合物と組み合わせて、好適な投与形態または剤形にされ、その後、ヒトまたは獣医学において薬剤として使用され得る。薬学的製剤はまた、その多くが当該技術分野で既知である添加剤、例えば、充填剤、崩壊剤、結合剤、潤滑剤、湿潤剤、安定剤、乳化剤、分散剤、防腐剤、甘味料、着色剤、香料、芳香剤、増粘剤、希釈剤、緩衝物質、溶媒、可溶化剤、デポ効果を達成するための薬剤、浸透圧を変更するための塩、コーティング剤または酸化防止剤を含有することができる。
「薬学的組成物」という用語は、投与様式及び剤形の性質に応じて、本明細書に記載のポリペプチドまたは結合剤、ならびに薬学的に許容される担体、希釈剤、アジュバント、賦形剤、またはビヒクル、例えば、保存剤、充填剤、崩壊剤、湿潤剤、乳化剤、懸濁剤、甘味剤、香味剤、芳香剤、抗菌剤、抗真菌剤、潤滑剤、及び分注剤を含む少なくとも1つの構成要素を含む組成物を意味する。
「薬学的に許容される担体」という用語は、本明細書に記載されるか、または当該技術分野で既知である任意の担体、希釈剤、アジュバント、賦形剤、またはビヒクルを意味するために使用される。懸濁剤の例としては、エトキシル化イソステアリルアルコール、ポリオキシエチレンソルビトール及びソルビタンエステル、微結晶セルロース、メタ水酸化アルミニウム、ベントナイト、寒天及びトラガカント、またはこれらの物質の混合物が挙げられる。微生物の作用の予防は、種々の抗菌剤及び抗真菌剤、例えば、パラベン、クロロブタノール、フェノール、ソルビン酸などによって確実にすることができる。また、等張剤、例えば、糖、塩化ナトリウムなどを含むことも望ましい場合がある。注入可能な薬学的形態の長期吸収は、吸収遅延剤、例えば、モノステアリン酸アルミニウム及びゼラチンの使用によってもたらされ得る。好適な担体、希釈剤、溶媒、またはビヒクルの非限定的な例には、水、塩溶液、リン酸緩衝生理食塩水(PBS)、ゼラチン、油、アルコール、ポリオール、それらの好適な混合物、植物油(オリーブ油など)、及びオレイン酸エチルなどの注入可能な有機エステルが含まれる。賦形剤の非限定的な例としては、ラクトース、乳糖、クエン酸ナトリウム、炭酸カルシウム、及びリン酸二カルシウムが挙げられる。崩壊剤の非限定的な例としては、デンプン、アルギン酸、及びある特定の複合体ケイ酸塩が挙げられる。潤滑剤の非限定的な例としては、ステアリン酸マグネシウム、ラウリル硫酸ナトリウム、タルク、ならびに高分子量ポリエチレングリコールが挙げられる。
「薬学的に許容される」という用語は、妥当な医学的判断の範囲内で、過度の毒性、刺激、アレルギー応答などを伴わずに、対象、例えば、ヒト及び動物の細胞と接触する使用に好適であり、合理的な利益/リスク比に見合うものであることを意味する。
本明細書で使用される場合、「薬学的に許容される担体」または「薬学的担体」は、当該技術分野で既知であり、0.01~0.1Mまたは0.05Mのリン酸緩衝液または0.8%の生理食塩水を含むが、これらに限定されない。更に、そのような薬学的に許容される担体は、水性または非水性溶液、懸濁液、及び乳液であり得る。非水性溶液の例は、グリコール、ポリエチレングリコール、オリーブ油などの植物油、及びオレイン酸エチルなどの注入可能な有機エステルである。水性担体としては、水、アルコール/水性溶液、乳液または懸濁液が挙げられ、生理食塩水及び緩衝媒体を含む。非経口ビヒクルとしては、塩化ナトリウム溶液、リンゲルデキストロース、デキストロース及び塩化ナトリウム、乳酸リンガー油、または固定油が挙げられる。静脈内ビヒクルには、流体及び栄養補充剤、リンガーデキストロースに基づくものなどの電解質補充剤などが含まれる。保存剤及び他の添加剤、例えば、抗菌剤、抗酸化剤、照合剤、不活性ガスなども存在し得る。
薬学的に許容される担体は、生理学的に適合性のある、任意の及び全ての溶媒、分散媒、コーティング剤、抗細菌剤及び抗真菌剤、等張剤及び吸収遅延剤などを含み得る。一実施形態では、担体は、非経口投与に好適である。担体は、静脈内、腹腔内、皮下または筋肉内投与に好適であり得る。あるいは、担体は、舌下投与または経口投与に好適であり得る。他の実施形態では、担体は、局所投与または吸入による投与に好適である。薬学的に許容される担体には、注入可能な滅菌溶液または滅菌分散液を即時調製するための滅菌水溶液または滅菌分散液及び滅菌粉末が含まれる。薬学的に活性な物質のためのそのような媒体及び薬剤の使用は、当該技術分野において周知である。任意の従来の媒体または薬剤が活性化合物と不適合性である限りを除いて、本明細書に提供される薬学的組成物におけるそれらの使用が企図される。補助的活性化合物を組成物に組み込むこともできる。例えば、本明細書で提供される薬学的組成物は、以下で更に説明されるように、少なくとも1つの追加の治療剤を更に含み得る。
本明細書に記載の薬学的組成物は、経口、静脈内、筋肉内、動脈内、髄内、髄内、髄腔内、脳室内、経皮、皮下、腹腔内、鼻内、経腸、局所、舌下、または直腸手段を含むがこれらに限定されない任意の数の経路によって投与されてもよい。
いくつかの実施形態では、本明細書で提供される薬学的組成物は、例えば、丸薬、錠剤、ラッカー錠、糖衣錠、顆粒、硬質及び軟質ゼラチンカプセル、水性、アルコール性もしくは油性溶液、シロップ、乳液もしくは懸濁液の形態で経口投与され得るか、または例えば、坐剤の形態で直腸投与され得る。
他の実施形態では、本明細書で提供される薬学的組成物は、注射または注入のための溶液の形態で、非経口的に、例えば、皮下的に、筋肉内に、または静脈内に投与することができる。他の好適な投与形態は、例えば、軟膏、クリーム、チンキ剤、スプレーもしくは経皮治療系の形態での経皮もしくは局所投与、または鼻スプレーもしくはエアロゾル混合物の形態での吸入投与、または例えば、マイクロカプセル、インプラントもしくはウェハである。
薬学的組成物は、典型的に、製造及び保管の条件下で無菌及び安定でなければならない。組成物は、溶液、マイクロエマルジョン、リポソーム、または高薬物濃度に好適な他の規則構造として製剤化することができる。担体は、例えば、水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール、及び液体ポリエチレングリコールなど)、及びそれらの好適な混合物を含有する、溶媒または分散媒であることができる。適切な流動性は、例えば、レシチンなどのコーティングの使用によって、分散液の場合には必要とされる粒径の維持によって、及び界面活性剤の使用によって、維持することができる。多くの場合、等張剤、例えば、糖、多価アルコール(マンニトール、ソルビトールなど)、または塩化ナトリウムを組成物中に含むことが好ましい。注入可能な組成物の持続的吸収は、組成物中に吸収を遅延させる薬剤、例えば、モノステアレート塩及びゼラチンを含めることによってもたらすことができる。更に、化合物は、時間放出製剤、例えば、徐放性ポリマーを含む組成物中で投与することができる。化合物は、急速放出から保護する担体、例えば、インプラント及びマイクロカプセル化送達系を含む制御放出製剤とともに調製することができる。エチレン酢酸ビニル、ポリ無水物、ポリグリコール酸、コラーゲン、ポリオルトエステル、ポリ乳酸、及びポリ乳酸、ポリグリコールコポリマー(PLG)などの生分解性、生体適合性ポリマーを使用することができる。
そのような製剤を調製するための多くの方法は、当業者には一般に既知である。滅菌注入可能な溶液は、本明細書で提供されるポリペプチドまたは結合剤などの活性化合物を、必要に応じて、上に列挙される成分の1つまたはその組み合わせを含む適切な溶媒に、必要とされる量で組み込み、その後で濾過滅菌することによって調製することができる。一般に、分散液は、活性化合物を、基本的な分散媒及び上で列挙されたものからの必要とされる他の原料を含有する無菌ビヒクル中に組み込むことによって、調製される。滅菌注入可能な溶液を調製するための滅菌粉末の場合、一般的な調製方法は真空乾燥及び凍結乾燥であり、予め滅菌濾過したその溶液から活性成分及び任意の追加の所望の成分の粉末を得る。化合物はまた、それらの溶解性を向上させる1つ以上の追加の化合物と製剤化され得る。
いくつかの実施形態では、本開示の薬学的組成物は、滅菌注入可能な溶液を含む。いくつかの実施形態では、無菌注入可能な溶液は、許容される溶液(例えば、水)で再構成される無菌粉末を含む。
組成物(非経口組成物など)を、投与の容易さ及び投与量の均一性のために単位剤形に製剤化することがしばしば有利である。「単位剤形」という用語は、ヒト対象及び他の動物の単位投与量として好適な物理的に別個の単位を指し、各単位は、好適な薬学的担体と関連して、所望の治療効果がもたらされるように算出された所定の量の活性物質を含有する。本発明の単位剤形の仕様は、(a)治療用化合物の独特の特徴及び達成されるべき特定の治療効果、ならびに(b)TGFβスーパーファミリー関連疾患または状態の予防または治療のためにそのような治療用化合物を調合する技術分野に固有の制限によって異なり、左右され、かつそれらに直接依存し得る。投与量については、以下で更に論じられる。
投与量レジメンは、主治医及び臨床要因によって決定される。医学分野で周知であるように、任意の1人の患者の投与量は、患者のサイズ、体表面積、年齢、投与される特定の化合物、性別、投与の時間及び経路、一般的な健康状態、及び同時に投与される他の薬物を含む多くの要因に依存する。
任意の化合物について、治療上有効な用量は、細胞培養アッセイにおいて、またはマウス、ラット、ウサギ、イヌ、もしくはブタなどの動物モデルにおいて、最初に推定され得る。また、動物モデルを使用して、濃度範囲及び投与経路を決定し得る。次いで、そのような情報を使用して、ヒトにおける投与のための有用な用量及び経路を決定してもよい。これらの技法は、当業者に周知であり、治療上有効な用量は、症状または状態を改善する活性成分の量を指す。治療有効性及び毒性は、例えば、ED50(集団の50%に対して治療的に有効な用量)及びLD50(集団の50%に対して致死的な用量)を算出及び対照化することによって、細胞培養物中または実験動物の標準的な薬学的手順によって決定され得る。本明細書に記載される薬学的組成物のうちのいずれかは、治療を必要とする任意の対象、例えば、限定するものではないが、イヌ、ネコ、ウシ、ウマ、ウサギ、サル、及び特にヒトなどの哺乳類に適用され得る。
「有効用量」、「有効投与量」及び「有効量」という用語は、所望の効果を達成するか、または少なくとも部分的に達成するのに十分な量を指すために互換的に使用される。「治療上有効な」用量または量という用語は、すでに疾患に罹患している患者における疾患及びその合併症を治療するか、改善するか、または少なくとも部分的に停止させるのに十分な量として定義される。治療有効量の本開示のポリペプチドまたは結合剤または薬学的組成物は、概して、疾患症状の重症度の減少、無疾患症状期間の頻度または期間の増加、または疾患の苦痛に起因する機能障害もしくは身体障害の予防をもたらす。いくつかの実施形態では、治療有効量は、本明細書に記載されるように、対象におけるTGFβスーパーファミリー関連疾患または障害を予防または治療するポリペプチドまたは結合剤または組成物の量または用量である。いくつかの実施形態では、有効量は、本明細書に記載される、対象におけるアクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上を阻害するポリペプチドまたは結合剤または組成物の量または用量である。
この使用に有効な量または用量は、治療される障害(適応症)、送達されるポリペプチドまたは結合剤、治療文脈及び目的、疾患の重症度、以前の療法、患者の臨床歴及び治療剤に対する応答、投与経路、患者のサイズ(体重、体表面もしくは臓器サイズ)及び/または状態(年齢及び一般的な健康状態)、ならびに患者自身の免疫系の一般的な状態に依存する。適切な用量は、最適な治療効果を得るために、1回または一連の投与にわたって患者に投与することができるように、主治医の判断に従って調整することができる。
典型的な投与量は、上述の要因に応じて、約0.1μg/kg~最大約30mg/kg以上の範囲であってもよい。特定の実施形態では、投与量は、1.0μg/kg~約20mg/kg、任意選択で10μg/kg~約10mg/kg、または100μg/kg~約5mg/kgの範囲であり得る。投与量については、以下で更に論じられる。
使用方法
本明細書に記載される製剤は、疾患/障害の治療、緩和及び/または予防を必要とする対象においてそれを行うことにおいて薬学的組成物として有用である。用語「治療」は、治療的処置及び予防的もしくは予防性手段の両方を指す。治療には、疾患/障害、疾患/障害の症状、または疾患/障害に向かう素因を有する患者の身体、単離された組織、または細胞への本製剤の適用または投与が含まれ、その目的は、疾患、疾患の症状、または疾患に向かう素因を治癒する(cure)、治癒する(heal)、緩和する(alleviate)、緩和する(relieve)、改変する、修復する、寛解する、改善する(improve)、または影響を与えることである。
本明細書に記載される製剤は、疾患/障害の治療、緩和及び/または予防を必要とする対象においてそれを行うことにおいて薬学的組成物として有用である。用語「治療」は、治療的処置及び予防的もしくは予防性手段の両方を指す。治療には、疾患/障害、疾患/障害の症状、または疾患/障害に向かう素因を有する患者の身体、単離された組織、または細胞への本製剤の適用または投与が含まれ、その目的は、疾患、疾患の症状、または疾患に向かう素因を治癒する(cure)、治癒する(heal)、緩和する(alleviate)、緩和する(relieve)、改変する、修復する、寛解する、改善する(improve)、または影響を与えることである。
本明細書で使用される「寛解」という用語は、本明細書で以下に指定される疾患/障害を有する患者の疾患状態の、本開示によるポリペプチドもしくは結合剤または薬学的組成物の対象への投与による任意の改善を指す。例えば、「寛解」という用語は、疾患の発症または進行を、減少、抑制、減弱化、停止、または安定させることを意味する。そのような改善はまた、患者の疾患/障害の進行の遅延または停止として見られてもよい。本明細書で使用される「予防」という用語は、それを必要とする対象に、本開示によるポリペプチドまたは結合剤または薬学的組成物を投与することによって、本明細書で以下に指定される疾患/障害を有する患者の発生または再発を回避することを意味する。
「疾患または状態」(または「疾患/状態」)という用語は、本明細書に記載のポリペプチドまたは結合剤または薬学的組成物での治療から利益を受け得る任意の病理学的医学的状態を指す。これは、哺乳動物を問題の疾患/障害にかかりやすくする病理学的状態を含む、慢性及び急性の疾患または状態を含む。いくつかの実施形態では、本開示のポリペプチドまたは結合剤及びその組成物は、TGFβスーパーファミリー関連疾患または状態の予防、治療または寛解に有用である。したがって、対象におけるTGFβスーパーファミリー関連疾患または状態の予防または治療のための方法が提供され、方法は、治療有効量の本明細書に記載のポリペプチドまたは結合剤または薬学的組成物を投与することを含む。ポリペプチド及び結合剤は、一般に、薬学的組成物の形態で投与される。対象は、そのような治療を必要としていてもよく、すなわち、本明細書に記載されるように、TGFβスーパーファミリーシグナル伝達に関連する、またはTGFβスーパーファミリーの1つ以上のメンバーによって媒介された疾患または状態を有するか、有する疑いがあるか、または有するリスクがある。
「阻害」または「阻害すること」という用語は、本明細書では、一般に、疾患または状態の進行、成長、または拡大を低減または遅延させるなどのプロセスを低減、遅延、制限、遅延、抑制、遮断、中和、妨害、または予防することを指すために使用されるが、これらに限定されない。
本開示のいくつかの実施形態では、「治療すること」は、過剰なアクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10の生物学的活性を中和することを指す。それは、改善の好適な臨床変数、疾患または状態に対する効果の病理学的評価、アクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10シグナル伝達の直接阻害(BMP-9を実質的に阻害することなく)、または治療されている疾患または状態に好適な別の尺度によって決定され得る。
いくつかの実施形態では、改善は、臨床変数を治療前に行われた測定値と比較することによって、または代替的に健康な成人で測定された典型的な値と比較することによって決定される。いくつかの実施形態では、治療または予防は、本明細書に提供されるポリペプチド、結合剤、組成物、及び方法を使用して治療される対象のパフォーマンスが、プラセボ群のメンバーと比較して、過去の対照と比較して、または同じ対象に与えられる後続の試験との間に測定可能な差異がある場合、本開示の文脈内にある。
「対象」という用語は、TGFβスーパーファミリーに関連する疾患もしくは状態を有する、またはその影響を受けやすい、またはそのリスクがある生体生物を含む。対象の例には、哺乳動物、例えば、ヒト、サル、ウシ、ウサギ、ヒツジ、ヤギ、ブタ、イヌ、ネコ、ラット、マウス、及びそれらのトランスジェニック種が含まれる。「対象」という用語は、一般に、肺高血圧症、線維症、筋力低下及び萎縮、代謝障害及び/または心臓代謝性疾患、骨損傷、または低い赤血球レベルなどのTGFβスーパーファミリー関連疾患または状態を特徴とする状態に感受性のある動物、例えば、哺乳類、例えば、霊長類、例えば、ヒトを含む。動物はまた、障害、例えば、マウスモデル、異種移植片レシピエントなどの動物モデルであってもよい。ある特定の実施形態では、対象は、ヒトである。
本開示の組成物及び方法で使用するためのポリペプチドまたは結合剤の用量に特定の制限はない。例示的な用量には、対象または試料の重量1キログラム当たりのポリペプチドまたは結合剤のミリグラムまたはマイクログラム量(例えば、1キログラム当たり約50マイクログラム~約500ミリグラム、1キログラム当たり約1ミリグラム~約100ミリグラム、1キログラム当たり約1ミリグラム~約50ミリグラム、1キログラム当たり約1ミリグラム~約10ミリグラム、または1キログラム当たり約3ミリグラム~約5ミリグラム)が含まれる。追加の例示的な用量には、約5~約500mg、約25~約300mg、約25~約200mg、約50~約150mg、または約50、約100、約150mg、約200mgもしくは約250mg、及び例えば、1日1回もしくは1日2回、またはより低いもしくはより高い量が含まれる。
いくつかの実施形態では、成人ヒトの用量範囲は、概して、0.005mg~10g/日である。ポリペプチドまたは結合剤及びその組成物は、単位剤形で、例えば、そのような投与量で有効である単位で、または同じもの、例えば、5mg~500mg、通常は約10mg~200mgを含む単位の倍数として提供され得る。投与量単位は、例えば、1~30mg、1~40mg、1~100mg、1~300mg、1~500mg、2~500mg、3~100mg、5~20mg、5~100mg(例えば、1mg、2mg、3mg、4mg、5mg、6mg、7mg、8mg、9mg、10mg、11mg、12mg、13mg、14mg、15mg、16mg、17mg、18mg、19mg、20mg、25mg、30mg、35mg、40mg、45mg、50mg、55mg、60mg、65mg、70mg、75mg、80mg、85mg、90mg、95mg、100mg、150mg、200mg、250mg、300mg、350mg、400mg、450mg、または500mg)の本明細書に記載のポリペプチドまたは結合剤または組成物を含む。
疾患または状態の治療的処置のためのポリペプチドまたは結合剤の有効量は、投与様式、対象の年齢、体重、及び一般的な健康状態に応じて変化することを理解されたい。最終的には、担当医師または獣医が適切な量及び投与量レジメンを決定する。単独で、または投与される1つ以上の活性化合物と組み合わせて使用されるポリペプチドまたは結合剤の投与量または量は、個々の症例に依存し、慣習的に、最適な効果を達成するために個々の状況に適合されることが理解されるべきである。投薬及び投与レジメンは、当業者の範囲内であり、適切な用量は、通常、当業者の医師、獣医師、または研究者の知識内のいくつかの因子に依存する(例えば、Wells et al.eds.,Pharmacotherapy Handbook,2nd Edition,Appleton and Lange,Stamford,Conn.(2000)、PDR Pharmacopoeia,Tarascon Pocket Pharmacopoeia 2000,Deluxe Edition,Tarascon Publishing,Loma Linda,Calif.(2000)を参照)。例えば、投薬及び投与レジメンは、治療される疾患または状態の性質及び重症度、ならびに治療されるヒトまたは動物の性別、年齢、体重、及び個体応答性、使用される化合物の有効性及び作用期間、治療が急性であるか慢性であるか予防的であるか、及び/または治療分子(複数可)に加えて他の活性化合物が投与されるかどうかにも依存する。
本明細書で提供されるポリペプチドまたは結合剤または組成物の投与は、所望の目的を達成するのに有効な投与量及び期間で、既知の手順を使用して実行され得る。投与量レジメンは、最適な治療応答を提供するように調整することができる。例えば、いくつかの分割用量が、1日1回、週1回、2週間に1回、または月1回投与され得るか、または用量が、治療状況の緊急事態によって示されるように比例的に低減され得る。いくつかの実施形態では、ポリペプチドまたは結合剤または組成物は、対象において、TGFβスーパーファミリー関連疾患または状態、例えば、肺高血圧症、線維症、筋力低下及び萎縮、代謝障害及び/または心臓代謝性疾患、骨損傷、及び/または低い赤血球レベルを予防または治療するのに十分な治療上有効な投与量で投与される。
いくつかの実施形態では、本開示の方法によれば、TGFβスーパーファミリー関連疾患または状態の発症または進行の1つ以上の症状は、対象において、少なくとも5%、例えば、少なくとも10%、少なくとも15%、少なくとも20%、少なくとも25%、少なくとも30%、少なくとも35%、少なくとも40%、少なくとも45%、少なくとも50%、少なくとも55%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、または100%低減する。
本明細書で提供される方法のいくつかの実施形態では、ポリペプチドまたは結合剤は、1つ以上の追加の療法または治療剤と組み合わせて投与される。追加の療法または治療剤は、本明細書に記載のポリペプチドまたは結合剤または組成物の投与の前、後、または同時に投与することができる。いくつかの実施形態では、追加の療法または治療剤は、同じ組成物中のポリペプチドまたは結合剤とともに製剤化される。他の実施形態では、追加の療法または治療剤は、別々に投与される。追加の療法及び治療剤の例としては、限定されないが、抗線維化剤、抗がん剤、抗炎症剤、抗肥満剤、抗糖尿病剤、別のTGFβスーパーファミリーリガンド結合剤または阻害剤、例えば、抗体、抗体断片、抗原結合断片、可溶性TGFβスーパーファミリーリガンドトラップなど、1つ以上の追加の標的に結合または阻害する別の薬剤などが挙げられる。
あるいは、いくつかの実施形態では、ポリペプチドまたは結合剤は、TGFβスーパーファミリーリガンド及び/または別の標的を発現するポリペプチドまたは結合剤または細胞もしくは組織を追跡するのに有用な検出可能部分または診断部分とコンジュゲートされ得る。いくつかのそのような実施形態では、検出可能な部分または診断部分とコンジュゲートされた本開示のポリペプチドまたは結合剤を対象に投与することと、TGFβスーパーファミリーシグナル伝達と関連付けられた疾患または障害(例えば、アクチビンA、アクチビンB、GDF-8、GDF-11、またはBMP-10の過剰発現)が診断されるようにポリペプチドまたは結合剤を検出することと、を含む、TGFβスーパーファミリー関連疾患または状態の診断方法が提供される。
TGFβスーパーファミリー関連疾患及び状態
本明細書に記載のポリペプチドまたは結合剤、及びその薬学的組成物は、TGFβスーパーファミリー関連疾患及び状態の予防または治療に有用である。したがって、対象におけるTGFβスーパーファミリーリガンドシグナル伝達と関連付けられた疾患または状態の予防または治療のための方法であって、治療有効量の本明細書に記載のポリペプチド、結合剤、または薬学的組成物を投与することを含む、方法が提供される。ポリペプチド及び結合剤は、一般に、薬学的組成物の形態で投与される。対象は、そのような治療を必要としていてもよく、すなわち、本明細書に記載されるように、TGFβスーパーファミリーシグナル伝達と関連付けられた疾患または状態を有するか、または発症するリスクがある。
本明細書に記載のポリペプチドまたは結合剤、及びその薬学的組成物は、TGFβスーパーファミリー関連疾患及び状態の予防または治療に有用である。したがって、対象におけるTGFβスーパーファミリーリガンドシグナル伝達と関連付けられた疾患または状態の予防または治療のための方法であって、治療有効量の本明細書に記載のポリペプチド、結合剤、または薬学的組成物を投与することを含む、方法が提供される。ポリペプチド及び結合剤は、一般に、薬学的組成物の形態で投与される。対象は、そのような治療を必要としていてもよく、すなわち、本明細書に記載されるように、TGFβスーパーファミリーシグナル伝達と関連付けられた疾患または状態を有するか、または発症するリスクがある。
本明細書で使用される場合、「TGFβスーパーファミリーリガンドシグナル伝達関連疾患または状態」という用語は、1つ以上のTGFβスーパーファミリーリガンド、特にアクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10活性の阻害を通じて改善され得る疾患及び状態を指す。TGFβスーパーファミリー関連疾患または状態には、限定されないが、TGFβスーパーファミリーリガンド、特にアクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10の過剰発現または過剰活性化と関連付けられた疾患及び状態が含まれる。いくつかの実施形態では、TGFβスーパーファミリー関連疾患または状態は、アクチビンA及び/またはアクチビンBによって媒介される。一実施形態では、治療される疾患または状態は、アクチビンAによって媒介される。一実施形態では、治療される疾患または状態は、アクチビンBによって媒介される。一実施形態では、治療される疾患または状態は、GDF-8によって媒介される。一実施形態では、治療される疾患または状態は、GDF-11によって媒介される。一実施形態では、治療される疾患または状態は、BMP-10によって媒介される。別の実施形態では、治療される疾患または状態は、アクチビンA、アクチビンB、GDF-8、及びGDF-11の組み合わせによって媒介される。
本開示に従って予防または治療され得るTGFβスーパーファミリー関連疾患または状態の例としては、限定されないが、肺高血圧症、線維症、筋力低下及び萎縮、代謝障害及び/または心臓代謝性疾患、骨損傷、及び/または低い赤血球レベル、ならびに血管疾患及び血管障害が挙げられる。
肺高血圧症
いくつかの実施形態では、本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤は、肺高血圧症(PH)の治療または予防のために使用される。例えば、本明細書に記載のポリペプチドまたは結合剤は、限定されないが、肺血管リモデリング、肺線維症、及び右心室肥大を含む様々な状態、または1つ以上のPH関連合併症の進行速度及び/または重症度を治療、予防または低減するために、例えば、右心室収縮期圧を低減する必要がある対象においてそれを行うために使用され得る。
いくつかの実施形態では、本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤は、肺高血圧症(PH)の治療または予防のために使用される。例えば、本明細書に記載のポリペプチドまたは結合剤は、限定されないが、肺血管リモデリング、肺線維症、及び右心室肥大を含む様々な状態、または1つ以上のPH関連合併症の進行速度及び/または重症度を治療、予防または低減するために、例えば、右心室収縮期圧を低減する必要がある対象においてそれを行うために使用され得る。
肺高血圧症は、高い肺動脈圧をもたらす肺血管リモデリングを特徴とする疾患である。成長促進アクチビン/成長分化因子経路と成長阻害BMP経路との間の不均衡は、この疾患で観察される血管リモデリングを促進する。例えば、アクチビンAの上昇は、臨床的及び実験的肺高血圧で観察されている。ミオスタチン及びアクチビンは、骨格筋の成長の調節において役割を果たすことが知られている。例えば、ミオスタチンのないマウスは、骨格筋質量の大幅な増加を示す。ミオスタチンはまた、線維症の促進にも関与している。例えば、ミオスタチンのないマウスは、筋線維症の低減を示す。アクチビンAを過剰発現するマウスもまた、線維症の増加を示す。加えて、アクチビンは骨組織中で豊富に発現し、骨芽細胞及び破骨細胞機能の両方を制御することによって骨形成を調節する。アクチビンは、骨疾患において上方制御されることが報告されている。ミオスタチンはまた、骨発生を増加させ、骨芽細胞活性を阻害することを通じて、骨ホメオスタシスに関与している。したがって、アクチビン及び/またはGDFシグナル伝達を低減または阻害する方法は、肺高血圧症(例えば、PAH、静脈PH、低酸素PH、血栓塞栓性PH、または雑種PH)、筋萎縮もしくは衰弱、線維症、骨損傷、または低い赤血球レベル(例えば、貧血)などの疾患及び状態の治療に有用であり得る。
PHは、5つの主要なタイプ:動脈性(PAH)、静脈性(左側心疾患に続発するPH)、低酸素性(肺疾患によって引き起こされるPH)、血栓塞栓性(慢性動脈閉塞、例えば、血栓によって引き起こされるPH)、または雑種(不明瞭または多因子機構を伴うPH)に分類することができ、WHO群1-Vとしても知られている。PAHは、リモデリングによる小血管の閉塞または狭窄によって引き起こされる肺の血管内の圧力の増加を特徴とする。これにより、肺を通る血流に対する抵抗が増加し、心臓の右側がより懸命に働くようになり、心不全につながる可能性がある。PAHは、特発性、遺伝性であり得るか、または薬物使用、感染症、肝硬変、先天性心臓異常、または結合組織/自己免疫疾患(例えば、強皮症もしくは狼瘡)に関連し得る。PHの治療には、血管拡張剤、抗凝固剤、及び補助酸素が含まれるが、これらの治療は、疾患を引き起こす生物学的機構を標的とするのではなく、疾患の症状を管理する。
肺高血圧症(PH)は、肺動脈、肺静脈、及び肺毛細血管を含む肺血管系における高血圧を特徴とする疾患である。一般に、PHは、安静時の平均肺動脈圧(PA)≧25mmHgまたは運動による≧30mmHgとして定義される(Hill et al.,2009)。主なPH症状は、呼吸困難または息切れであり、他の症状には、疲労、めまい、失神、末梢浮腫(足、脚、または足首の腫れ)、青みがかった唇及び皮膚、胸痛、狭心症、運動中の立ちくらみ、非生産的な咳、脈拍異常及び動悸が含まれる。PHは、肺高血圧症を有する人々の最も一般的な死因のうちの1つである、心不全を引き起こす重篤な疾患であり得る。術後の肺高血圧症は、多くの種類の手術または処置を複雑にし、高死亡率に関連する課題を提示する可能性がある。
PHは、病態生理学的メカニズム、臨床的提示、及び治療アプローチにおける疾患共有の類似性の異なる症状に基づいてグループ化され得る(Simonneau et al.,2009)。PHの臨床分類は、1973年に最初に提案され、最近更新された臨床分類は、2008年に世界保健機関(WHO)によって承認された。更新されたPH臨床分類によれば、PHの5つの主要な群が存在する:PA楔入圧が≦15mmHgであることを特徴とする肺動脈高血圧症(PAH)、PA楔入圧が>15mmHgであることを特徴とする左心疾患(肺静脈高血圧症またはうっ血性心不全としても知られる)に起因するPH、肺疾患及び/または低酸素症に起因するPH、慢性血栓塞栓症PH、ならびに不明瞭または多因子病因を有するPH(Simonneau et al.,2009、Hill et al.,2009)。PAHは更に、PAHの家族歴も特定された危険因子もない散発性疾患である特発性PAH(IPAH)、遺伝性PAH、薬物及び毒素によって誘発されるPAH、結合組織疾患、HIV感染症、門脈高血圧症、先天性心疾患、血吸虫病、及び慢性溶血性貧血と関連付けられたPAH、ならびに新生児の持続性PHに分類される(Simonneau et al.,2009)。様々なタイプのPHの診断は、一連の検査を必要とする。
一般に、PHの治療は、PHの原因または分類に依存する。PHが既知の医薬品または医学的状態によって引き起こされる場合、それは二次PHとして知られており、その治療は通常、基礎疾患に向けられている。肺静脈高血圧症の治療は、一般に、利尿薬、ベータ遮断薬、及びACE阻害剤を投与すること、または僧帽弁もしくは大動脈弁を修復もしくは交換することによって左心室機能を最適化することを伴う。PAH療法には、肺血管拡張薬、ジゴキシン、利尿薬、抗凝固薬、及び酸素療法が含まれる。肺血管拡張薬は、プロスタシクリン経路(例えば、静脈内エポプロステノール、皮下もしくは静脈内トレプロスチニル、及び吸入イロプロストを含むプロスタシクリン)、一酸化窒素経路(例えば、シルデナフィル及びタダラフィルを含むホスホジエステラーゼ-5阻害剤)、ならびにエンドセリン-1経路(例えば、経口ボセンタン及び経口アンブリセンタンを含むエンドセリン受容体拮抗剤)を含む、異なる経路を標的とする(Humbert,M.,2009、Hill et al.,2009)。しかしながら、現在利用可能な療法は、PHの治療を提供せず、それらは、多くのPH患者において観察される血管の基礎となる血管リモデリング及び筋肉化を直接治療しない。
いくつかの実施形態では、本開示は、PHを治療する方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法に関する。いくつかの実施形態では、本開示は、PHを予防する方法であって、それを必要とする患者に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法に関する。いくつかの実施形態では、本開示は、PHの進行速度を低減する方法であって、それを必要とする患者に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法に関する。
いくつかの実施形態では、本開示は、間質性肺疾患を治療する方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含み、本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤は、アクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上を阻害する、方法を提供する。いくつかの実施形態では、限定されないが、GDF-3、BMP-6、BMP-15、ALK-4、ALK-5、及びALK-7などの1つ以上の追加のTGFβスーパーファミリーリガンドもまた、阻害され得る。
いくつかの実施形態では、本開示は、間質性肺疾患の1つ以上の合併症の進行率及び/または重症度を治療、予防、または低減する方法であって、それを必要とする患者に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含み、ポリペプチドまたは結合剤は、アクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上を阻害する、方法を提供する。いくつかの実施形態では、間質性肺疾患は、特発性肺線維症である。いくつかの実施形態では、本開示は、PHの重症度を低減する方法であって、それを必要とする患者に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法に関する。ある特定の態様では、本開示は、肺高血圧症の1つ以上の合併症(例えば、肺動脈における平滑筋及び/または内皮細胞増殖、肺動脈における血管新生、呼吸困難、胸痛、肺血管リモデリング、右心室肥大、及び肺線維症)を治療する方法であって、それを必要とする患者に、有効量の本明細書に記載のポリペプチドまたは結合剤を投与することを含む、方法に関する。
ある特定の実施形態では、本開示は、PH(例えば、肺動脈における平滑筋及び/または内皮細胞増殖、肺動脈における血管新生、呼吸困難、胸痛、肺血管リモデリング、右心室肥大、及び肺線維症)の1つ以上の合併症を予防する方法であって、それを必要とする患者に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法に関する。ある特定の実施形態では、本開示は、PH(例えば、肺動脈における平滑筋及び/または内皮細胞増殖、肺動脈における血管新生、呼吸困難、胸痛、肺血管リモデリング、右心室肥大、及び肺線維症)の1つ以上の合併症の進行速度を低減する方法であって、それを必要とする患者に、有効量の本明細書に記載のポリペプチドまたは結合剤を投与することを含む、方法に関する。ある特定の態様では、本開示は、肺高血圧症(例えば、肺動脈における平滑筋及び/または内皮細胞増殖、肺動脈における血管新生、呼吸困難、胸痛、肺血管リモデリング、右心室肥大、及び肺線維症)の1つ以上の合併症の重症度を低減する方法であって、それを必要としている患者に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法に関する。
ある特定の好ましい実施形態では、本明細書に記載の方法は、肺動脈高血圧症(PAH)を有する対象に関する。いくつかの実施形態では、本明細書に記載の方法は、少なくとも25mmHg(例えば、少なくとも25、少なくとも30、少なくとも35、少なくとも40、少なくとも45、または少なくとも50mmHg)の静止肺動脈圧(PAP)を有する対象に関する。いくつかの実施形態では、本明細書に記載の方法は、肺高血圧症を有する対象におけるPAPを低減する。例えば、方法は、肺高血圧症を有する対象において、PAPを少なくとも3mmHg(例えば、少なくとも3、少なくとも5、少なくとも7、少なくとも10、少なくとも12、少なくとも15、少なくとも20、または少なくとも25mmHg)低減し得る。いくつかの実施形態では、本明細書に記載の方法は、肺高血圧症を有する対象における肺血管抵抗性を低減する。
いくつかの実施形態では、本明細書に記載の方法は、肺高血圧症を有する対象における肺毛細血管楔入圧を増加させる。いくつかの実施形態では、本明細書に記載の方法は、肺高血圧症を有する対象における左心室拡張末期圧を増加させる。いくつかの実施形態では、本明細書に記載の方法は、肺高血圧症を有する対象における運動能力(能力、耐性)を増加させる(改善する)。例えば、方法は、肺高血圧症を有する対象において6分間の歩行距離を増加させ、任意選択で、6分間の歩行距離を少なくとも10メートル(例えば、少なくとも10、少なくとも20、少なくとも30、少なくとも40、少なくとも50、少なくとも60、少なくとも70、少なくとも80、少なくとも90、少なくとも100、またはそれ以上のメートル)増加させることができる。加えて、方法は、対象のBorg呼吸困難指数(BDI)を低減し得、これは、任意選択で、6分間の歩行試験の後に評価され得る。いくつかの実施形態では、方法は、対象のBorg呼吸困難指数(BDI)を少なくとも0.5指数ポイント(例えば、少なくとも0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5、または10指数ポイント)低減する。いくつかの実施形態では、本明細書に記載の方法は、世界保健機関によって認識されるクラスI、クラスII、クラスIII、またはクラスIVの肺高血圧症を有する対象に関する。いくつかの実施形態では、本明細書に記載の方法は、肺高血圧症の臨床的進行(悪化)の遅延(例えば、世界保健機関の標準によって測定される進行)に関する。いくつかの実施形態では、方法は、肺高血圧症のクラス進行を予防または遅延させる(例えば、世界保健機関によって認識されるように、クラスIからクラスII、クラスIIからクラスIII、またはクラスIIIからクラスIVへの進行を予防または遅延させる)。いくつかの実施形態では、方法は、肺高血圧クラスの退縮を促進または増加させる(例えば、世界保健機関によって認識されるように、クラスIVからクラスIII、クラスIIIからクラスII、またはクラスIIからクラスIの退縮を促進または増加させる)。
いくつかの実施形態では、対象は、開示の1つ以上のポリペプチドまたは結合剤に加えて、肺高血圧症を治療するための1つ以上の支持療法または活性剤を更に投与される。例えば、対象はまた、プロスタシクリン及びその誘導体(例えば、エポプロステノール、トレプロスチニル、及びイロプロスト);プロスタシクリン受容体アゴニスト(例えば、セレキシパグ);エンドセリン受容体アンタゴニスト(例えば、テリン、アンブリセンタン、マシテンタン、及びボセンタン);カルシウムチャネル遮断薬(例えば、アムロジピン、ジルチアゼム、及びニフェジピン);抗凝固剤(例えば、ワルファリン);利尿剤;酸素療法;心房隔離術;肺血栓形成術;ホスホジエステラーゼ5型阻害剤(例えば、シルデナフィル及びタダラフィル);可溶性グアニル酸シクラーゼの活性化剤(例えば、シナシグアト及びリオシグアト);ASK-1阻害剤(例えば、CIIA;SCH79797;GS-4997;MSC2032964A;3H-ナフト[1,2,3-de]キニリン-2,7-ジオン、NQDI-1;2-チオキソ-チアゾリジン、5-ブロモ-3-(4-オキソ-2-チオキソ-チアゾリジン-5-イリデン)-1,3-ジヒドロ-インドール-2-オン-);NF-κBアンタゴニスト(例えば、dh404、CDDO-エポキシド;2.2-ジフルオロプロピオンアミド;C28イミダゾール(CDDO-Im);2-シアノ-3,12-ジオキソオレアン-1,9-ジエン-28-オイ酸(CDDO);3-アセチルオレアノール酸;3-トリフルオロアセチルオレアノール酸;28-メチル-3-アセチルオレアナン;28-メチル-3-トリフルオロアセチルオレアナン;28-メチルオキシオレアノール酸;SZCO14;SCZ015;SZCO17;オレアノール酸のPEG化誘導体;3-O-(β-D-グルコピラノシル)オレアノール酸;3-O-[β-D-グルコピラノシル-(1→3)-β-D-グルコピラノシル]オレアノール酸;3-O-[β-D-グルコピラノシル-(1→2)-β-D-グルコピラノシル]オレアノール酸;3-O-[β-D-グルコピラノシル-(1→3)-β-D-グルコピラノシル]オレアノール酸28-O-β-D-グルコピラノシルエステル;3-O-[β-D-グルコピラノシル-(1→2)-β-D-グルコピラノシル]オレアノール酸28-O-β-D-グルコピラノシルエステル;3-O-[a-L-ラムノピラノシル-(1→3)-β-D-グルクロノピラノシル]オレアノール酸;3-O-[α-L-ラムノピラノシル-(1→3)-β-D-グルクロノピラノシル-]オレアノール酸28-O-β-D-グルコピラノシルエステル;28-O-β-D-グルコピラノシル-オレアノール酸;3-O-β-D-グルコピラノシル(1→3)-β-D-グルコピラノシズロン酸(CS1);オレアノール酸3-O-β-D-グルコピラノシル(1→3)-β-D-グルコピラノシズロン酸(CS2);メチル3,11-ジオキソオレアン-12-en-28-オラート(ジオキソール);ZCVI4-2;ベンジル3-デヒドロキシ-1,2,5-オキサジアゾロ[3’,4’,2,3]オレアノレート)肺移植及び/または心臓移植からなる群から選択される1つ以上の支持療法または活性剤を投与されてもよい。
いくつかの実施形態では、対象はまた、BMP-9ポリペプチドを投与され得る。いくつかの実施形態では、BMP-9ポリペプチドは、成熟BMP-9ポリペプチドである。いくつかの実施形態では、BMP-9ポリペプチドは、BMP-9プロドメインポリペプチドを含む。いくつかの実施形態では、BMP-9ポリペプチドは、薬学的調製物中で投与され、これは、任意選択でBMP-9プロドメインポリペプチドを含んでもよい。BMP-9プロドメインポリペプチドを含むそのようなBMP-9薬学的調製物において、BMP-9ポリペプチドは、BMP-9プロドメインポリペプチドと非共有結合的に会合してもよい。いくつかの実施形態では、BMP-9薬学的調製物は、BMP9プロドメインポリペプチドを実質的に含まないか、または含まない。いくつかの実施形態では、対象はまた、オレアノール酸またはその誘導体を投与され得る。
線維化
いくつかの実施形態では、本明細書に記載のポリペプチドまたは結合剤は、線維症の治療または予防のために使用される。例えば、本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤を使用して、組織及び/または臓器の線維性疾患、線維性瘢痕化、ならびに線維腫増殖性障害を含むがこれらに限定されない様々な状態の進行速度及び/または重症度を治療、予防、または低減する必要がある対象においてそれを行うことができる。線維性疾患または状態の非限定的な例としては、肺線維症(例えば、特発性肺線維症)、腎線維症、肝線維症(例えば、肝硬変)、全身性硬化症、強皮症、皮膚線維症、心臓線維症、骨髄線維症、眼線維症、及び骨髄線維症が挙げられる。1つの特定の実施形態では、全身性硬化症(SSc)が治療または予防される。別の特定の実施形態では、強皮症が治療または予防される。別の特定の実施形態では、骨髄線維症(MF)が治療または予防される。
いくつかの実施形態では、本明細書に記載のポリペプチドまたは結合剤は、線維症の治療または予防のために使用される。例えば、本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤を使用して、組織及び/または臓器の線維性疾患、線維性瘢痕化、ならびに線維腫増殖性障害を含むがこれらに限定されない様々な状態の進行速度及び/または重症度を治療、予防、または低減する必要がある対象においてそれを行うことができる。線維性疾患または状態の非限定的な例としては、肺線維症(例えば、特発性肺線維症)、腎線維症、肝線維症(例えば、肝硬変)、全身性硬化症、強皮症、皮膚線維症、心臓線維症、骨髄線維症、眼線維症、及び骨髄線維症が挙げられる。1つの特定の実施形態では、全身性硬化症(SSc)が治療または予防される。別の特定の実施形態では、強皮症が治療または予防される。別の特定の実施形態では、骨髄線維症(MF)が治療または予防される。
線維症は、臓器または組織における過剰な結合組織の形成である。損傷(例えば、傷害)に応答して、または免疫応答(例えば、炎症応答)の一部として形成され得る結合組織は、それが形成される臓器または組織の構造及び機能を破壊し、組織剛性の増加をもたらし得る。線維症は、とりわけ、肺(例えば、肺線維症、嚢胞性線維症)、肝臓(例えば、肝硬変)、心臓(例えば、心筋梗塞後の心内膜心筋線維症または線維症)、脳(例えば、グリア瘢痕形成)、皮膚(例えば、ケロイドの形成)、腎臓(例えば、腎線維症)、及び眼(例えば、角膜線維症)を含む、体内の多くの臓器及び組織で発生することができ、ある特定の医学的治療(例えば、化学療法、放射線療法、及び手術)と関連付けられていることが知られている。しかしながら、線維症の対象に現在利用可能な治療選択肢は限られており、利用可能なほとんどの治療は、生活の質の改善または疾患進行の一時的な遅延に焦点を当てている。
予防または治療され得る線維症の他の例示的な実施形態には、例えば、限定されないが、間質性肺疾患、ヒト線維性肺疾患(例えば、閉塞性細気管支炎、特発性肺線維症、既知の病因による肺線維症、肺疾患における腫瘍間質、肺に影響を及ぼす全身性硬化症、ヘルマンスキー・パドラク症候群、石炭労働者の塵肺症、アスベスト症、珪炭症、慢性肺高血圧症)、肺線維症、嚢胞性線維症、肝線維症、心線維症、縦隔線維症、後腹膜線維症、骨髄線維症、皮膚線維症を含むAIDS関連の治療可能な線維症;強皮症;及び全身性硬化症が含まれる。治療または予防することができる特定の形態の線維症としては、ヒトテノン線維芽細胞、腎臓、肺、腸、肝臓、心臓、骨髄、性器、皮膚、及び眼など、体の任意の臓器または組織または細胞に影響を及ぼすものが挙げられる。これらの疾患には、嚢胞性線維症、全身性硬化症、慢性閉塞性肺疾患(COPD)、デュピュイトラン拘縮、糸球体腎炎、肝線維症、梗塞後心線維症、再狭窄、眼手術誘発性線維症、及び瘢痕化が含まれるが、これらに限定されない。結合組織の遺伝的障害を治療することもでき、限定されないが、マルファン症候群(MFS)及び骨発生不全症が挙げられる。
いくつかの実施形態では、本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤は、線維芽細胞の筋線維芽細胞への分化を阻害するために使用される。
いくつかの実施形態では、本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤は、線維腫増殖性障害の治療または予防のために使用される。線維腫増殖性障害は、線維芽細胞の増殖に加えて、フィブロネクチン、ラミニン、及びコラーゲンなどの細胞外マトリックスの対応する過剰発現を特徴とする。
いくつかの実施形態では、本開示は、治療有効量の本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤、または本明細書に記載の薬学的組成物を対象に投与することによって、線維症を減少または予防する必要がある対象においてそれを行う方法を提供する。
いくつかの実施形態では、本開示は、治療有効量の本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤、または本明細書に記載の薬学的組成物を対象に投与することによって、線維症を遅らせるか、または阻害する必要がある対象においてそれを行う方法を提供する。
いくつかの実施形態では、本開示は、治療有効量の本明細書に記載のActRIIB-ECDポリペプチド、または本明細書に記載のそれを含むTGFβスーパーファミリーリガンド結合剤、または本明細書に記載の薬学的組成物を対象に投与することによって、線維症を発症するリスクを低減することを必要とする対象においてそれを行う方法を提供する。
いくつかの実施形態では、本明細書に記載のポリペプチドもしくは結合剤、または本明細書に記載の薬学的組成物を対象に投与することによって、線維症を有するか、または線維症を発症するリスクがある対象を治療する方法を提供する。
いくつかの実施形態では、線維症は、化学療法薬物誘発性線維症、放射線誘発性線維症、肺線維症、肝線維症、腎線維症(例えば、慢性腎疾患に関連する線維症)、角膜線維症、心臓線維症、骨髄線維症、縦隔線維症、後腹膜線維症、関節線維症、骨関節線維症、組織線維症、腫瘍間質、脱形成腫瘍、外科的接着、肥大性瘢痕、またはケロイドである。
いくつかの実施形態では、線維症は、創傷、火傷、B型またはC型肝炎感染症、脂肪性肝疾患、血吸虫感染症、腎疾患(例えば、慢性腎疾患)、心疾患、黄斑変性症、クローン病、網膜もしくは硝子体網膜症、全身性もしくは局所性強皮症、アテローム性動脈硬化症、または再狭窄と関連付けられた線維症である。いくつかの実施形態では、線維症は、慢性腎疾患に起因する。いくつかの実施形態では、疾患または状態は、化学療法薬物誘発性線維症、放射線誘発性線維症、肺線維症、肝線維症、腎線維症(例えば、慢性腎疾患に関連する線維症)、角膜線維症、心臓線維症、骨髄線維症、縦隔線維症、後腹膜線維症、関節線維症、骨関節線維症、組織線維症、腫瘍間質、脱形成腫瘍、外科的接着、肥大性瘢痕、またはケロイドである。いくつかの実施形態では、疾患または状態は、創傷、火傷、B型またはC型肝炎感染症、脂肪性肝疾患、血吸虫感染症、腎疾患(例えば、慢性腎疾患)、心疾患、黄斑変性症、クローン病、網膜もしくは硝子体網膜症、全身性もしくは局所性強皮症、アテローム性動脈硬化症、または再狭窄と関連付けられた線維症である。いくつかの実施形態では、線維症は、慢性腎疾患に起因する。
いくつかの実施形態では、組織線維症は、筋肉組織、皮膚表皮、皮膚真皮、腱、軟骨、膵臓組織、子宮組織、神経組織、心臓組織、精巣、卵巣、副腎、動脈、静脈、結腸、小腸、大腸、胆道、及び腸からなる群から選択される組織に影響を与える線維症である。
いくつかの実施形態では、本開示は、線維性組織または臓器の機能を改善する方法を提供する。いくつかの実施形態では、本開示は、線維症の進行を遅らせるか、または阻害する方法を提供する。いくつかの実施形態では、本開示は、線維症の1つ以上の症状を低減する、例えば、線維症の1つ以上の症状の頻度または重症度を低減する方法を提供する。
いくつかの実施形態では、本開示は、線維症疾患を有するか、または発症するリスクのある対象を治療する方法であって、それを必要とする対象に、有効量の本明細書に記載のポリペプチドまたは結合剤または薬学的組成物を投与することを含む、方法を提供する。いくつかのそのような実施形態では、アクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10シグナル伝達は、対象において阻害される。例えば、いくつかの実施形態では、本開示は、線維症を伴う疾患または状態を有するか、または発症するリスクがある対象における、それらの内因性受容体へのアクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10の結合を低減または阻害する方法に関し、方法は、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチド、または本明細書に記載のそれまたは薬学的組成物を含むTGFβスーパーファミリーリガンド結合剤を投与することを含む。
いくつかの実施形態では、本開示の方法に従って、線維症症状は、対象において低減される。例えば、ポリペプチドまたは結合剤または組成物は、対象における線維化、線維性瘢痕化、または皮膚肥厚を少なくとも5%、例えば、少なくとも10%、少なくとも15%、少なくとも20%、少なくとも25%、少なくとも30%、少なくとも35%、少なくとも40%、少なくとも45%、少なくとも50%、少なくとも55%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、または100%低減し得る。
いくつかの実施形態では、本開示の方法に従って、線維芽細胞の筋線維芽細胞への分化は、対象において、例えば、少なくとも5%、例えば、少なくとも10%、少なくとも15%、少なくとも20%、少なくとも25%、少なくとも30%、少なくとも35%、少なくとも40%、少なくとも45%、少なくとも50%、少なくとも55%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、または100%阻害される。
いくつかの実施形態では、本開示の方法に従って、腫瘍増殖及び/または転移は、対象において、例えば、少なくとも5%、例えば、少なくとも10%、少なくとも15%、少なくとも20%、少なくとも25%、少なくとも30%、少なくとも35%、少なくとも40%、少なくとも45%、少なくとも50%、少なくとも55%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、または100%阻害される。
いくつかの実施形態では、本開示の方法に従って、骨髄造血幹細胞または前駆細胞(HSPC)における造血コロニー形成及び/または造血は、対象の骨髄において、例えば、少なくとも5%、例えば、少なくとも10%、少なくとも15%、少なくとも20%、少なくとも25%、少なくとも30%、少なくとも35%、少なくとも40%、少なくとも45%、少なくとも50%、少なくとも55%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%または、100%増加する。
いくつかの実施形態では、本開示の方法に従って、肺線維症における陽性応答は、強制肺活量によって測定される肺機能の低下速度の一貫した減速として明らかにされる。
いくつかの実施形態では、本開示の方法に従って、全身性硬化症と関連付けられた皮膚線維症に対する陽性応答は、修正ロドナン皮膚スコア(MRSS)の改善によって決定される。例えば、MRSSは、対象において少なくとも5%、例えば、少なくとも10%、少なくとも15%、少なくとも20%、少なくとも25%、少なくとも30%、少なくとも35%、少なくとも40%、少なくとも45%、少なくとも50%、少なくとも55%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、または100%改善し得る。
筋力低下及び萎縮
いくつかの実施形態では、本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤は、限定されないが、筋力低下及び萎縮などの筋肉障害を伴う疾患及び状態の治療または予防のために使用される。例えば、本明細書に記載のActRIIB-ECDポリペプチドまたは本明細書に記載のそれを含むTGFβスーパーファミリーリガンド結合剤は、デュシェンヌ型筋ジストロフィー(DMD)、顔面肩甲上腕型筋ジストロフィー(FSHD)、封入体筋炎(IBM)、筋萎縮性側索硬化症(ALS)、サルコペニア、またはがん悪液質を含むがこれらに限定されない様々な状態の進行速度及び/または重症度を治療、予防または低減するために使用され得る。
いくつかの実施形態では、本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤は、限定されないが、筋力低下及び萎縮などの筋肉障害を伴う疾患及び状態の治療または予防のために使用される。例えば、本明細書に記載のActRIIB-ECDポリペプチドまたは本明細書に記載のそれを含むTGFβスーパーファミリーリガンド結合剤は、デュシェンヌ型筋ジストロフィー(DMD)、顔面肩甲上腕型筋ジストロフィー(FSHD)、封入体筋炎(IBM)、筋萎縮性側索硬化症(ALS)、サルコペニア、またはがん悪液質を含むがこれらに限定されない様々な状態の進行速度及び/または重症度を治療、予防または低減するために使用され得る。
デュシェンヌ型筋ジストロフィー(DMD)、顔面肩甲上腕型筋ジストロフィー(FSHD)、封入体筋炎(IBM)、及び筋萎縮性側索硬化症(ALS)は、任意の筋肉運動を制御する筋肉及び/または運動ニューロンの衰弱及び萎縮を伴う筋肉疾患の例である。DMDは、X連鎖ジストロフィン遺伝子の変異によって引き起こされ、進行性筋変性及び全ての骨格筋の衰弱を特徴とする。FSHDは、特に顔、肩、上腕、及び下肢の骨格筋に影響を与える。IBMは、主に太ももの筋肉及び指と手首の屈曲を制御する腕の筋肉に影響を与える炎症性筋肉疾患である。ALSは、筋肉の硬直、筋肉の痙攣、及び運動ニューロンの変性に起因する全身の筋萎縮を特徴とする運動ニューロン疾患である。しかしながら、これらの壊滅的な筋肉疾患に対して利用可能な治療選択肢はほとんどない。
いくつかの実施形態では、本開示は、DMDを治療する方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法に関する。いくつかの実施形態では、本開示は、FSHDを予防する方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法に関する。いくつかの実施形態では、本開示は、IBMを治療する方法であって、それを必要とする患者に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法に関する。いくつかの実施形態では、本開示は、ALSを治療する方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法に関する。いくつかの実施形態では、本開示は、サルコペニアを治療する方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法に関する。いくつかの実施形態では、本開示は、がん悪液質を治療する方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法に関する。
いくつかの実施形態では、本開示は、筋肉量及び/または筋力を増加させることを必要とする対象においてそれを行う方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、除脂肪量を増加させることを必要とする対象においてそれを行う方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、それを必要とする対象において筋肉量を増加させる方法であって、それを必要とする対象に、有効量の本明細書に記載の ActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、筋疾患を有するか、または発症するリスクのある対象を治療する方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法を提供する。いくつかの実施形態では、筋疾患は、DMD、FSHD、IBM、ALS、サルコペニア、またはがん悪液質である。いくつかのそのような実施形態では、アクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10シグナル伝達は、対象において阻害される。例えば、いくつかの実施形態では、本開示は、筋肉の衰弱及び萎縮を伴う疾患または状態を有するか、または発症するリスクがある対象における、それらの内因性受容体へのアクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10の結合を低減または阻害する方法に関し、方法は、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチド、または本明細書に記載のそれまたは薬学的組成物を含むTGFβスーパーファミリーリガンド結合剤を投与することを含む。
いくつかの実施形態では、本開示は、疾患または不使用に起因する筋肉消耗などの筋肉障害を治療する方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法に関する。筋肉障害は、筋肉萎縮などの筋骨格系疾患または障害であり得る。コルチゾール、デキサメタゾン、ベタメタゾン、プレドニゾン、メチルプレドニゾロン、またはプレドニゾロンなどのグルココルチコイドによる治療の結果を含む、筋肉萎縮の多くの原因がある。筋萎縮はまた、神経外傷による脱神経の結果、または変性、代謝性、もしくは炎症性ニューロパシー(例えば、ギリアンバレー症候群、末梢性ニューロパシー、または環境毒素もしくは薬物への曝露)の結果であり得る。
加えて、筋萎縮は、筋緊張症などのミオパチー;ネマレンミオパチー、マルチ/ミニコアミオパチー、及び筋細管(中心核)ミオパチーを含む先天性ミオパチー;ミトコンドリアミオパチー;家族性周期性麻痺;炎症性ミオパチー;グリコーゲンまたは脂質貯蔵疾患によって引き起こされるなどの代謝性ミオパチー;皮膚筋炎;多発性筋炎;封入体筋炎;骨化性筋炎;横紋筋溶解症及びミオグロビン尿症の結果であり得る。
ミオパチーは、デュシェンヌ症候群、ベッカー症候群、筋緊張症候群、筋膜肩甲上腕症候群、エメリー・ドライフス症候群、眼咽頭症候群、肩甲上腕症候群、四肢帯症候群、福山症候群、先天性筋ジストロフィー症候群、または遺伝性遠位性ミオパチーなどの筋ジストロフィー症候群によって引き起こされ得る。筋骨格系疾患は、骨粗しょう症、骨折、低身長、または小人症でもあり得る。
加えて、筋萎縮は、成人運動ニューロン疾患、乳児脊髄筋萎縮症、筋萎縮性側索硬化症、若年性脊髄筋萎縮症、多焦点導体ブロックを伴う自己免疫運動ニューロパシー、脳卒中もしくは脊髄損傷による麻痺、外傷による骨格固定、長時間のベッドレスト、自発的不活動、不随意的不活動、代謝ストレスもしくは栄養不足、がん、AIDS、断食、甲状腺障害、糖尿病、良性先天性低血圧症、中枢性コア疾患、火傷、慢性閉塞性肺疾患、肝疾患(線維症、肝硬変などの例)、敗血症、腎不全、うっ血性心不全、老化、宇宙旅行、または無重力環境で過ごした時間の結果であり得る。
加えて、筋肉萎縮は、限定されないが、II型糖尿病、メタボリックシンドローム、高血糖、及び肥満を含む代謝障害と関連付けられ得る。
代謝障害及び心臓代謝障害
いくつかの実施形態では、本明細書に記載のポリペプチドまたは結合剤は、代謝障害及び/または心臓代謝性疾患の治療または予防のために使用される。代謝障害の非限定的な例としては、1型糖尿病、2型糖尿病、糖尿病合併症(例えば、網膜症、腎障害または神経障害、糖尿病性足、潰瘍、大血管障害など)、代謝性アシドーシスまたはケトーシス、高血糖、反応性低血糖、高インスリン血症、グルコース代謝障害、インスリン抵抗性、代謝症候群、脂質異常血症、アテローム性動脈硬化症及び関連疾患、肥満、糖尿病前症、高血圧、慢性心不全、急性腎不全、浮腫、及び高尿酸血症が挙げられる。心臓代謝性疾患の非限定的な例としては、心臓発作、脳卒中、糖尿病、インスリン抵抗性、非アルコール性脂肪性肝疾患、慢性腎不全、心不全及び/または低駆出率が挙げられ、駆出率が低減した心不全(HFrEF)及び駆出率が維持された心不全(HFpEF)が挙げられる。
いくつかの実施形態では、本明細書に記載のポリペプチドまたは結合剤は、代謝障害及び/または心臓代謝性疾患の治療または予防のために使用される。代謝障害の非限定的な例としては、1型糖尿病、2型糖尿病、糖尿病合併症(例えば、網膜症、腎障害または神経障害、糖尿病性足、潰瘍、大血管障害など)、代謝性アシドーシスまたはケトーシス、高血糖、反応性低血糖、高インスリン血症、グルコース代謝障害、インスリン抵抗性、代謝症候群、脂質異常血症、アテローム性動脈硬化症及び関連疾患、肥満、糖尿病前症、高血圧、慢性心不全、急性腎不全、浮腫、及び高尿酸血症が挙げられる。心臓代謝性疾患の非限定的な例としては、心臓発作、脳卒中、糖尿病、インスリン抵抗性、非アルコール性脂肪性肝疾患、慢性腎不全、心不全及び/または低駆出率が挙げられ、駆出率が低減した心不全(HFrEF)及び駆出率が維持された心不全(HFpEF)が挙げられる。
肥満または過体重状態の治療、ならびにII型糖尿病、脂質異常、高血糖、心血管疾患、及び他の代謝障害などのそれらの関連する併存疾患は、実質的で満たされていない医療ニーズを表す。肥満は全死亡率の危険因子であり、2010年に世界中で340万人の死亡を引き起こしたと推定されている(Lim et al 2012)。肥満、糖尿病、高血糖及び関連する状態は、心疾患、脳卒中、腎臓の問題、神経損傷、及び眼障害などの重篤なまたは生命を脅かす合併症の危険因子である。特に、脳卒中、心臓発作、ならびに心臓及び血管疾患などの心臓代謝性疾患は、血糖レベルを低下させることによって、または2型糖尿病もしくは肥満を有する患者において体重減少を達成することによって改善され得る。除脂肪量対脂肪量の比を変化させることによって、体組成を改善し、それによって体重減少または中枢性肥満の減少を達成し、患者の血糖状態を改善することができる薬物療法が強く求められている。駆出率(HFpEF)を維持した心不全など、左心室機能不全と関連付けられた心不全に対処する治療法の必要性も存在する。HFpEFは、世界中の心不全症例の半分以上を表し、HFpEF及び肥満などの関連する危険因子に対処するための治療が非常に望ましい。
除脂肪量対脂肪量の比を変化させることによって、体組成を改善し、それによって体重減少または中枢性肥満の減少を達成し、患者の血糖状態を改善することができる薬物療法の必要性がある。ミオスタチンノックアウトマウス及びミオスタチンが可溶性のActRIIBによって隔離される野生型マウスにおける筋肉量の増加が報告されており、この増加は、全身のインスリン感受性の改善、ならびに食事誘発性及び遺伝的肥満に対する耐性と関連付けられる(Guo et al,2009、Akpan et al,2009)。抗体によるActRIIBの阻害は、骨格筋質量を増加させながら、正常または高脂肪食でマウスにおける白色脂肪組織を低減することが示されている(Fournier et al 2012)。
いくつかの実施形態では、本開示は、代謝障害を有する対象を治療する方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法を提供する。例えば、2型糖尿病、メタボリックシンドローム、高血糖症、及び肥満を治療する方法が提供される。したがって、いくつかの実施形態では、限定されないが、1型糖尿病、2型糖尿病、糖尿病合併症(例えば、網膜症、腎症もしくは神経障害、糖尿病性足、潰瘍、大血管症など)、代謝性アシドーシスもしくはケトーシス、反応性低血糖症、高インスリン血症、グルコース代謝障害、インスリン抵抗性、代謝症候群、脂質異常症、アテローム性動脈硬化症及び関連疾患、肥満、前糖尿病、高血圧症、慢性心不全、急性腎不全、浮腫、または高尿酸血症などの代謝障害または状態を予防または治療する方法が提供される。
いくつかの実施形態では、本開示は、代謝障害を有する対象において除脂肪量を増加させる方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、代謝障害を有する対象において筋肉量を増加させる方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、白色脂肪を減少させる及び/または褐色脂肪を増加させることを必要とする対象、例えば、代謝性障害を有する対象においてそれを行う方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、総体脂肪量(FM)を減少させることを必要とする対象、例えば、代謝性障害を有する対象においてそれを行う方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、総体脂肪量(FM)を減少させると同時に、筋肉量を増加させることを必要とする対象、例えば、代謝性障害、例えば、肥満を有する対象においてそれを行う方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、インスリン感受性を改善することを必要とする対象、例えば、代謝性障害を有する対象においてそれを行う方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、エネルギー消費を増加させることを必要とする対象、例えば、代謝性障害を有する対象においてそれを行う方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、心臓代謝性疾患を有する対象を治療する方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法を提供する。心臓代謝性疾患の非限定的な例としては、心臓発作、脳卒中、糖尿病、インスリン抵抗性、非アルコール性脂肪性肝疾患、及び慢性腎不全が挙げられる。いくつかのそのような実施形態では、本開示は、2型糖尿病及び確立された心血管疾患を有する対象における心血管死亡のリスクを低減する方法を提供する。いくつかのかかる実施形態では、本開示は、心不全及び/または低駆出率を有する人々の死亡及び/または入院のリスクを低減する方法を提供する。いくつかのかかる実施形態では、本開示は、駆出率(HFrEF)が低減した心不全を有する人々、または駆出率(HFpEF)が維持された心不全を有する人々の死亡及び/または入院のリスクを低減する方法を提供する。いくつかのかかる実施形態では、本開示は、成人における心不全の心血管死及び/または入院のリスクを低減する方法を提供する。いくつかのかかる実施形態では、本開示は、2型糖尿病を有する対象におけるグルコースレベルを低減する方法を提供する。いくつかのかかる実施形態では、本開示は、中等度の腎機能障害またはステージ3の慢性腎疾患を有する対象において、糖尿病などの代謝性障害を治療もしくは予防する方法、及び/または血糖制御を改善する方法を提供する。
いくつかの実施形態では、本開示は、体組成物を改善する方法、例えば、中枢性肥満、肥満または過体重状態、ならびに関連する併存症の治療のための方法であって、本明細書に記載の有効量のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を、それを必要とする対象に投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、例えば、血糖制御を改善することまたはインスリン感受性を増加させることによって、II型糖尿病を治療する方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、対象の体組成を改善する方法を提供し、改善は、除脂肪量の増加及び脂肪量の減少を含み、有効量の本明細書に記載のポリペプチドまたは結合剤を対象に投与することを含む。体組成は、例えば、体格指数(BMI)、体形指数(ABSI)、二重エネルギー吸収法(DXA)、磁気共鳴画像法(MM)、及び/または生体電気インピーダンス技法によって決定され得る。
いくつかの実施形態では、本開示は、例えば、除脂肪量が増加し、脂肪量が低減する体組成物を改善することによって、肥満または過体重障害を治療する方法であって、それを必要とする対象に、有効量の本明細書に記載のActRIIB-ECDポリペプチドまたはそれを含むTGFβスーパーファミリーリガンド結合剤を投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、肥満または過体重状態に関連する併存症を治療、予防、または低減する方法であって、それを必要とする対象に、有効量の本明細書に記載のポリペプチドまたは結合剤を投与することを含む、方法を提供する。「肥満または過体重状態に関連する併存疾患」とは、肥満と関連付けられた重篤な慢性疾患を指し、これらに限定されないが、2型糖尿病またはグルコース不耐症、前糖尿病、高トリグリセリド、身体障害、骨粗しょう症、腎臓病、閉塞性睡眠時無呼吸、性ホルモン障害、多嚢胞性卵巣症候群または男性性腺機能低下症などの内分泌生殖障害、変形性関節症、胃腸癌、脂質異常血症、高血圧症、心不全、冠動脈性心疾患及び脳卒中、胆石、高血圧、ならびに性腺ホルモンプロファイルの変化を含む。いくつかのかかる実施形態では、本開示は、例えば、インスリン感受性を増加させることによって、例えば、II型糖尿病に罹患している患者において、血糖制御を改善する方法を提供する。
骨の損傷
いくつかの実施形態では、本明細書に記載のポリペプチドまたは結合剤は、骨損傷及び関連する状態の治療または予防のために使用される。例えば、本明細書に記載のポリペプチドまたは結合剤を使用して、原発性骨粗しょう症、二次性骨粗しょう症、骨減少症、骨硬化症、骨折、骨癌またはがん転移関連の骨喪失、パジェット病、腎性骨ジストロフィー、治療関連の骨喪失、食事関連の骨喪失、肥満の治療と関連付けられた骨喪失、低重力関連の骨喪失、または不動性を含むがこれらに限定されない、骨損傷を伴う様々な疾患及び状態の進行率及び/または重症度を治療、予防、または低減することができる。
いくつかの実施形態では、本明細書に記載のポリペプチドまたは結合剤は、骨損傷及び関連する状態の治療または予防のために使用される。例えば、本明細書に記載のポリペプチドまたは結合剤を使用して、原発性骨粗しょう症、二次性骨粗しょう症、骨減少症、骨硬化症、骨折、骨癌またはがん転移関連の骨喪失、パジェット病、腎性骨ジストロフィー、治療関連の骨喪失、食事関連の骨喪失、肥満の治療と関連付けられた骨喪失、低重力関連の骨喪失、または不動性を含むがこれらに限定されない、骨損傷を伴う様々な疾患及び状態の進行率及び/または重症度を治療、予防、または低減することができる。
健康な骨は、骨破壊及び骨成長の両方を伴う絶え間ないリモデリングを受ける。骨成長は、骨芽細胞型によって媒介されるが、破骨細胞は、骨を再吸収する。病理学は、これらの系が、同化プログラムの下方制御、分解代謝系の上方制御、またはその両方の組み合わせのいずれかを通じてバランスが崩れ、正味の骨損失をもたらすときに起こり得る。したがって、骨リモデリングのバランスを制御することは、骨への損傷の治癒、ならびに骨量の喪失及び骨脱塩と関連付けられた骨粗しょう症などの障害の治療を促進するために有用であり得る。
骨の損傷は、加齢またはがんに関連する骨の喪失、遺伝的状態、または薬物治療の有害な副作用を含む、様々な根本原因から生じる可能性がある。世界保健機関は、骨粗しょう症だけで米国、欧州、及び日本で7500万人が罹患しており、骨損傷の重要な危険因子であると推定している。一般に、骨損失の全体は、効果的な治療法がほとんどない病理学的状態を表す。利用可能な治療法は、骨成長を直接促進し、骨密度を増加させる薬剤ではなく、固定化、運動、及び食事の変更に焦点を当てている。骨粗しょう症に関しては、エストロゲン、カルシトニン、ビタミンKを含むオステオカルシン、または高用量の食事性カルシウムが全て治療介入として使用される。骨粗しょう症に対する他の治療アプローチとしては、ビスホスホネート、副甲状腺ホルモン、副甲状腺ホルモン関連タンパク質(PTHrP)、カルシミメティクス、スタチン、アナボリックステロイド、ランタン及びストロンチウム塩、ならびにフッ化ナトリウムが挙げられるが、これらはしばしば望ましくない副作用と関連付けられる。
いくつかの実施形態では、本明細書に記載のポリペプチドまたは結合剤は、骨損傷を伴う疾患または状態を有するか、または発症するリスクがある対象の骨量または骨ミネラル密度を増加させるために使用される。
いくつかの実施形態では、本開示は、骨ミネラル密度を増加させることを必要とする対象においてそれを行う方法であって、治療有効量の本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤、または本明細書に記載の薬学的組成物を対象に投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、骨再吸収を低減することを必要とする対象においてそれを行う方法であって、治療有効量の本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤、または本明細書に記載の薬学的組成物を対象に投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、骨形成を増加させることを必要とする対象においてそれを行う方法であって、治療有効量の本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤、または本明細書に記載の薬学的組成物を対象に投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、骨強度を増加させることを必要とする対象においてそれを行う方法であって、治療有効量の本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤、または本明細書に記載の薬学的組成物を対象に投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、骨折を低減することを必要とする対象においてそれを行う方法であって、治療有効量の本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤、または本明細書に記載の薬学的組成物を対象に投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、骨疾患を有するか、または発症するリスクのある対象を治療する方法であって、本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤、または本明細書に記載の薬学的組成物を対象に投与することを含む、方法を提供する。本方法に従って治療され得る骨疾患の非限定的な例としては、原発性骨粗しょう症、二次性骨粗しょう症、骨減少症、骨粗しょう症、骨折、骨癌またはがん転移関連骨損失、パジェット病、腎性骨ジストロフィー、治療関連骨損失、食事関連骨損失、肥満の治療と関連付けられた骨損失、低重力関連骨損失、または不動性関連骨損失が挙げられる。いくつかの実施形態では、骨疾患は、骨粗しょう症である。いくつかの実施形態では、原発性骨粗しょう症は、加齢性骨粗しょう症またはホルモン関連骨粗しょう症である。上記の態様のうちのいずれかのいくつかの実施形態では、二次性骨粗しょう症は、固定化誘発性骨粗しょう症またはグルココルチコイド誘発性骨粗しょう症である。いくつかの実施形態では、がんは、多発性骨髄腫である。いくつかの実施形態では、治療関連の骨損失は、FGF-21による治療に起因して、GLP-1による治療に起因して、がん療法、例えば、化学療法もしくは放射線療法に起因して、または肥満もしくは2型糖尿病に対する治療に起因して生じる。いくつかの実施形態では、食事関連骨損失は、くる病、例えば、ビタミンD欠乏症である。いくつかの実施形態では、低重力関連骨損失は、負荷関連骨損失の欠如である。いくつかの実施形態では、対象は、骨折のリスクがある。いくつかの実施形態では、本明細書に記載のポリペプチドまたは結合剤は、対象におけるアクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上を、例えば、アクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10のそれらの受容体への結合を低減もしくは阻害するか、またはそれらの受容体を通じたシグナル伝達を阻害することによって阻害する。
本開示の方法のいくつかの実施形態では、方法は、対象における骨形成を増加させる。本開示の方法のいくつかの実施形態では、方法は、対象における骨吸収を減少させる。本開示の方法のいくつかの実施形態では、方法は、対象における骨損失を減少させる。本開示の方法のいくつかの実施形態では、方法は、対象における骨芽細胞活性または骨芽細胞発生を増加させる。本開示の方法のいくつかの実施形態では、方法は、対象における破骨細胞活性を減少させるか、または破骨細胞発生を減少させる。本開示の方法のいくつかの実施形態では、方法は、対象における骨折のリスクを減少させる。本開示の方法のいくつかの実施形態では、方法は、対象における骨強度を増加させる。本開示の方法のいくつかの実施形態では、骨は、皮質骨である。本開示の方法のいくつかの実施形態では、骨は、小梁骨である。
本明細書で使用される場合、「骨ミネラル密度(BMD)」、「骨密度」、及び「骨量」という用語は、骨組織中の骨ミネラル(例えば、カルシウム)の量の尺度を指す。BMDは、当業者に知られている十分に確立された臨床技法(例えば、単一または二重エネルギー光子またはX線吸収測定)によって測定され得る。BMDの概念は、骨の体積当たりのミネラルの質量に関連しているが、臨床的には、イメージング時の骨表面の平方センチメートル当たりの光学密度に従ってプロキシにより測定される。BMD測定は、骨粗しょう症及び骨折リスクの間接的な指標として臨床医学で使用されている。いくつかの実施形態では、BMD試験結果は、Tスコアとして提供され、Tスコアは、健康な30歳の成人の理想的またはピークの骨ミネラル密度と比較した、対象のBMDを表す。Oのスコアは、BMDが健康な若年成人の通常の基準値に等しいことを示す。対象の測定されたBMDと健康な若年成人の基準値との間の差は、標準偏差単位(SD)で測定される。したがって、+1SD~-1SDのTスコアは、正常なBMDを示し得、-1SD~-2.5SDのTスコアは、低い骨量(例えば、骨減少症)を示し得、-2.5SDよりも低いTスコアは、骨粗しょう症または重度の骨粗しょう症を示し得る。開示の方法のいくつかの実施形態では、対象は、低い骨量(例えば、-1SD~-2.5SDのTスコア)を有する。開示の方法のいくつかの実施形態では、対象は、骨粗しょう症(例えば、-2.5SD未満のTスコア)を有する。開示の方法のいくつかの実施形態では、対象のBMDは、本明細書に記載のポリペプチドまたは結合剤または薬学的組成物の投与によって増加する。例えば、本開示の方法による治療は、対象のTスコアを、例えば、0.1以上、0.2以上、0.3以上、0.4以上、0.5以上、1.0以上、または2.0以上増加させることができる。
いくつかの実施形態では、例えば、骨髄線維症を含む骨髄不全疾患では、陽性応答は、貧血の改善によって明らかにされる(例えば、ヘモグロビンレベルの増加を示す輸血非依存性患者、輸血依存性患者は、輸血非依存性になる)。
本明細書で使用される場合、「骨強度」という用語は、骨ミネラル密度に加えて骨の質によって決定される骨の測定値を指す。骨の質は、骨の形状、マイクロアーキテクチャ、及び構成組織の特性によって影響を受ける。骨強度は、骨折のリスクを評価するために使用することができる。
本明細書で使用される場合、「骨疾患」という用語は、骨損傷(例えば、骨ミネラル密度の減少、骨強度の減少、及び/または骨損失)を特徴とする状態を指す。かかる疾患または状態は、骨芽細胞及び/または破骨細胞活性の不均衡(例えば、骨吸収の増加または骨形成の低減)によって引き起こされ得る。骨疾患としては、限定されないが、原発性骨粗しょう症、二次性骨粗しょう症、骨減少症、骨形成症、骨折、骨癌またはがん転移関連骨損失(例えば、多発性骨髄腫と関連付けられた骨損失)、パジェット病、腎性骨ジストロフィー、治療関連骨損失、食事関連骨損失、肥満の治療に関連する骨損失、低重力関連骨損失、及び不動性関連骨損失が挙げられる。
本明細書で使用される場合、「骨リモデリング」または「骨代謝」という用語は、古い骨の別個の部分を新しく合成されたタンパク質性マトリックスのパケットに置き換えることによって、骨の強度及びイオン恒常性を維持するためのプロセスを指す。骨は破骨細胞によって再吸収され、骨化と呼ばれるプロセスで骨芽細胞によって沈着される。骨細胞の活性は、このプロセスにおいて重要な役割を果たしている。骨量の減少をもたらす状態は、吸収の増加または骨化の減少のいずれかによって引き起こされ得る。健康な個人では、小児期に骨形成が吸収を上回る。老化プロセスが発生するにつれて、再吸収が形成を上回る。骨吸収率はまた、典型的には、閉経後の高齢女性では、閉経に関連するエストロゲン欠乏症に起因してはるかに高い。
本明細書で使用される場合、「骨吸収」または「骨異化活性」という用語は、破骨細胞が骨内の組織を分解し、ミネラルを放出し、結果としてミネラル(例えば、カルシウム)を骨組織から血液に移すプロセスを指す。増加した骨吸収率は、閉経後の女性を含めて加齢と関連付けられる。高い骨吸収率、または骨化率を超える骨吸収率は、骨減少症及び骨粗しょう症を含む骨ミネラル密度の低下などの骨障害と関連付けられ、骨喪失をもたらす可能性がある。本開示の方法のいくつかの実施形態では、骨吸収は、本明細書に記載のポリペプチドまたは結合剤または薬学的組成物の投与によって、対象において減少し、例えば、骨損失は、対象において減少する。
本明細書で使用される場合、「骨形成」、「骨化」、「骨発生」、または「骨同化活性」という用語は、骨芽細胞によって新しい骨組織を形成するプロセスを指す。骨形成速度の低減、または骨吸収率によって超過される骨形成速度は、骨損失をもたらす可能性がある。本開示の方法のいくつかの実施形態では、本明細書に記載のポリペプチドまたは結合剤または薬学的組成物の投与によって、対象における骨形成が増加し、例えば、対象における骨形成または骨発生の量または速度が増加する。
本開示の方法のいくつかの実施形態では、本明細書に記載のポリペプチドまたは結合剤または薬学的組成物の投与は、治療前に得られた測定値と比較して、または未治療の対象で典型的に観察される測定値と比較して、対象における骨ミネラル密度の増加、骨形成の増加、骨強度の増加、骨折のリスクの低減、及び/または骨吸収の低減に作用する。
低い赤血球レベル
いくつかの実施形態では、本明細書に記載のポリペプチドまたは結合剤は、貧血または失血などの低い赤血球レベルと関連付けられた疾患または状態の治療または予防のために使用される。例えば、本明細書に記載のポリペプチドまたは結合剤は、例えば、赤血球レベルを増加させることによって(例えば、ヘモグロビンレベルを増加させることによって、赤血球数を増加させることによって、ヘマトクリットを増加させることによって、もしくは赤血球の形成もしくは産生を増加させることによって)、貧血または失血を含むがこれらに限定されない、低い赤血球レベルを伴う様々な疾患及び状態の進行速度及び/または重症度を治療、予防または低減するために使用され得る。
いくつかの実施形態では、本明細書に記載のポリペプチドまたは結合剤は、貧血または失血などの低い赤血球レベルと関連付けられた疾患または状態の治療または予防のために使用される。例えば、本明細書に記載のポリペプチドまたは結合剤は、例えば、赤血球レベルを増加させることによって(例えば、ヘモグロビンレベルを増加させることによって、赤血球数を増加させることによって、ヘマトクリットを増加させることによって、もしくは赤血球の形成もしくは産生を増加させることによって)、貧血または失血を含むがこれらに限定されない、低い赤血球レベルを伴う様々な疾患及び状態の進行速度及び/または重症度を治療、予防または低減するために使用され得る。
貧血は、罹患率と死亡率の両方に影響を与える健康への影響を伴う世界的な健康問題である。米国だけでも、貧血の罹患率は、2003年から2012年にかけてほぼ2倍になった。貧血の症状には、疲労、脱力感、息切れ、心臓動悸、及び認知能力の低減が含まれ、小児、妊婦、生殖年齢の女性、及び高齢者は、貧血を発症するリスクが最も高いことが見出されている。貧血の最も一般的な形態は、鉄欠乏性貧血であるが、貧血は、慢性疾患、失血、及び赤血球破壊によっても引き起こされる可能性がある。鉄欠乏性貧血は、鉄サプリメントで治療することができるが、再生不良性貧血、慢性疾患の貧血、及び溶血性貧血などの他の多くの形態の貧血は、輸血を必要とし得る。
いくつかの実施形態では、本開示は、低い赤血球レベルを治療することを必要とする対象においてそれを行う方法であって、本明細書に記載の有効量の本明細書に記載のActRIIB-ECDポリペプチドまたは本明細書に記載の同じ組成物または薬学的組成物を含むTGFβスーパーファミリーリガンド結合剤を対象に投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、貧血を治療することを必要とする対象においてそれを行う方法であって、有効量の本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤、または本明細書に記載の薬学的組成物を対象に投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、失血を治療することを必要とする対象においてそれを行う方法であって、有効量の本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤、または本明細書に記載の薬学的組成物を対象に投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、赤血球レベルを増加させることを必要とする対象においてそれを行う方法であって、本明細書に記載の有効量の本明細書に記載のActRIIB-ECDポリペプチドまたは本明細書に記載の同じ組成物または薬学的組成物を含むTGFβスーパーファミリーリガンド結合剤を対象に投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、ヘモグロビンレベルを増加させることを必要とする対象においてそれを行う方法であって、有効量の本明細書に記載のポリペプチドまたは結合剤または薬学的組成物を対象に投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、赤血球数を増加させることを必要とする対象においてそれを行う方法であって、本明細書に記載の有効量の本明細書に記載のActRIIB-ECDポリペプチドまたは本明細書に記載の同じ組成物または薬学的組成物を含むTGFβスーパーファミリーリガンド結合剤を対象に投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、ヘマトクリットを増加させることを必要とする対象においてそれを行う方法であって、有効量の本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤、または本明細書に記載の薬学的組成物を対象に投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、赤血球形成を増加させることを必要とする対象においてそれを行う方法であって、本明細書に記載の有効量の本明細書に記載のActRIIB-ECDポリペプチドまたは本明細書に記載の同じ組成物または薬学的組成物を含むTGFβスーパーファミリーリガンド結合剤を対象に投与することを含む、方法を提供する。
開示の方法のいくつかの実施形態では、対象は、貧血または失血を有するか、または発症するリスクがあり得る。いくつかの実施形態では、貧血は、慢性腎疾患、関節リウマチ、がん、または炎症性疾患(例えば、クローン病、SLE、もしくは潰瘍性大腸炎)などの他の疾患または状態、あるいは化学療法、放射線療法、または手術などの医学的治療に起因する。いくつかの実施形態では、本明細書に記載のポリペプチドまたは結合剤は、対象におけるアクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上を、例えば、アクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10のそれらの受容体への結合を低減もしくは阻害するか、またはそれらの受容体を通じたシグナル伝達を阻害することによって阻害する。
いくつかの実施形態では、本開示は、赤血球を増加させる(例えば、ヘモグロビンレベル、赤血球数、またはヘマトクリットを増加させる)ことを必要とする対象においてそれを行う方法であって、治療前に得られた測定値と比較して、赤血球が増加する(例えば、ヘモグロビンレベル、赤血球数、またはヘマトクリットが増加する)治療有効量の本明細書に記載のポリペプチドまたは結合剤または薬学的組成物を対象に投与することを含む、方法を提供する。
いくつかの実施形態では、本開示は、貧血または失血を有するか、または発症するリスクがある対象において赤血球レベルを増加させる方法を提供する。いくつかの実施形態では、貧血または失血は、がん、がん治療、腎疾患または腎不全(例えば、慢性腎疾患もしくは急性腎疾患もしくは不全)、骨髄異形成症候群、サラセミア、栄養不足、薬物に対する有害反応、炎症性または自己免疫疾患、脾腫、ポルフィリン症、血管炎、溶血、骨髄欠損、骨髄移植、糖尿病、肝疾患(例えば、急性肝疾患または慢性肝疾患)、出血(例えば、急性または慢性出血)、感染症、ヘモグロビン異常、薬物使用、アルコール乱用、高齢者、チャーグ・ストラウス症候群、フェルティ症候群、移植片対宿主病、造血幹細胞移植、骨髄線維症、汎血球減少症、純粋な赤血球再形成、紫斑病、シェーンライン・ヘノッホ症候群、シュワッハマン症候群(例えば、シュワッハマン・ダイアモンド症候群)、輸血の禁忌、手術、外傷、創傷、潰瘍、尿路出血、消化管出血、頻繁な献血、または大量の月経出血と関連付けられる。
本開示の方法のいくつかの実施形態では、貧血は、再生不良性貧血、鉄欠乏性貧血、ビタミン欠乏性貧血、慢性疾患の貧血、骨髄疾患と関連する貧血、溶血性貧血、鎌状赤血球貧血、小赤血球性貧血、低色素性貧血、鉄芽球性貧血、ダイアモンド・ブラックファン貧血、ファンコーニ貧血、または過剰な芽球を有する難治性貧血である。
本開示の方法のいくつかの実施形態では、治療を必要とする対象は、エリスロポエチン(EPO)による治療に十分に応答しないか、またはEPOの有害作用を受けやすい対象である。
本明細書で使用される場合、「赤血球レベルを増加させる」及び「赤血球形成を促進する」という用語は、ヘマトクリット、赤血球数、及びヘモグロビン測定などの臨床的に観察可能な測定基準を指し、かかる変化が生じる機構に関して中立であることが意図される。本明細書で使用される「低い赤血球レベル」という用語は、対象の年齢及び性別に対して正常とみなされる値の範囲を下回る赤血球数、ヘマトクリット、及びヘモグロビン測定値を指す。
本明細書で使用される場合、「赤血球形成」及び「赤血球産生」という用語は、赤血球が骨髄で産生される赤血球産生のプロセスなどの赤血球の生成を指す。
本明細書で使用される場合、「貧血」という用語は、血液中の酸素レベルの低減をもたらすヘモグロビンまたは赤血球における任意の異常を指す。貧血は、赤血球及び/またはヘモグロビンの異常な産生、処理、または性能と関連付けられ得る。貧血という用語は、正常な血液レベルと比較した、血液中の赤血球の数及び/またはヘモグロビンのレベルの任意の低減を指す。
本開示の方法のいくつかの実施形態では、本明細書に記載のポリペプチドまたは結合剤または薬学的組成物の投与は、例えば、治療前に得られた測定値と比較して、対象における赤血球形成、赤血球数、ヘモグロビンレベル、またはヘマトクリットを増加させるように作用する。本開示の方法のいくつかの実施形態では、本開示のポリペプチドまたは結合剤の投与は、対象の輸血の必要性を低減する。
いくつかの実施形態では、本開示は、血管疾患または血管障害を治療することを必要とする対象においてそれを行う方法であって、治療有効量の本明細書に記載のActRIIB-ECDポリペプチド、またはそれを含むTGFβスーパーファミリーリガンド結合剤、または本明細書に記載の薬学的組成物を対象に投与することを含む、方法を提供する。血管疾患または血管障害の非限定的な例としては、血管炎、動脈硬化症、大動脈瘤、及び血管石灰化が挙げられ、これらは、単独で、または例えば、限定されないが、慢性腎疾患(CKD)、糖尿病、または鎌状赤血球貧血及び川崎病などのまれな疾患などの他の疾患と関連して存在し得る。
キット
本開示によれば、本明細書に記載のポリペプチド、TGFβスーパーファミリーリガンド結合剤及び薬学的組成物は、TGFβスーパーファミリー関連疾患または状態の治療または予防に使用するためのキットまたは製剤系に組み立てられてもよい。キットまたは製剤系は、ポリペプチド、結合剤または薬学的組成物を含有するバイアル、チューブ、アンプル、ボトルなどの1つ以上の容器をその中に密閉する容器(例えば、包装、箱、カートン、バイアルなど)を含んでもよい。追加のキット構成要素は、酸、塩基、緩衝剤、無機塩、溶媒、抗酸化剤、防腐剤、または金属キレート剤を含み得る。追加のキット構成要素は、純粋な組成物として、または1つ以上の追加のキット構成要素を組み込む水性もしくは有機溶液として存在し得る。キット構成要素のうちのいずれかまたは全ては、任意選択で、緩衝液を更に含む。キットはまた、針、シリンジなどの投与用ツールを含み得る。キットは、本明細書に記載される方法に従って使用され得、かかる方法で使用するための指示書を含み得る。キットはまた、ポリペプチド、結合剤、または薬学的組成物の投与及び使用のための指示書を含み得る。
本開示によれば、本明細書に記載のポリペプチド、TGFβスーパーファミリーリガンド結合剤及び薬学的組成物は、TGFβスーパーファミリー関連疾患または状態の治療または予防に使用するためのキットまたは製剤系に組み立てられてもよい。キットまたは製剤系は、ポリペプチド、結合剤または薬学的組成物を含有するバイアル、チューブ、アンプル、ボトルなどの1つ以上の容器をその中に密閉する容器(例えば、包装、箱、カートン、バイアルなど)を含んでもよい。追加のキット構成要素は、酸、塩基、緩衝剤、無機塩、溶媒、抗酸化剤、防腐剤、または金属キレート剤を含み得る。追加のキット構成要素は、純粋な組成物として、または1つ以上の追加のキット構成要素を組み込む水性もしくは有機溶液として存在し得る。キット構成要素のうちのいずれかまたは全ては、任意選択で、緩衝液を更に含む。キットはまた、針、シリンジなどの投与用ツールを含み得る。キットは、本明細書に記載される方法に従って使用され得、かかる方法で使用するための指示書を含み得る。キットはまた、ポリペプチド、結合剤、または薬学的組成物の投与及び使用のための指示書を含み得る。
いくつかの実施形態では、キットは、(上述のように)投与のための適切な用量で、本開示のポリペプチドまたは結合剤または薬学的組成物を含む任意の適切な形状、サイズ及び材料(好ましくは防水、例えば、プラスチックまたはガラス)の1つ以上のレシピエント(バイアル、アンプル、容器、シリンジ、ボトル、バッグなど)を含む。キットは、(例えば、リーフレットまたは取扱説明書の形態で)使用説明書、シリンジ、ポンプ、注入器などの本開示のポリペプチドまたは結合剤を投与するための手段、本開示のポリペプチドまたは結合剤を再構成するための手段、及び/または本開示のポリペプチドまたは結合剤を希釈するための手段を更に含んでもよい。
本開示はまた、単回投与単位のためのキットを提供する。本開示のキットはまた、乾燥/凍結乾燥ポリペプチドまたは結合剤を含む第1のレシピエントと、水性製剤を含む第2のレシピエントとを含み得る。ある特定の実施形態では、単一チャンバ及び多チャンバのプレフィルドシリンジ(例えば、液体シリンジ及び凍結乾燥シリンジ)を含むキットが提供される。
更に付番した実施形態
本発明はまた、例えば、限定されないが、その範囲をいかなる方法でも限定するものとして解釈されるべきではない、以下の番号付けされた実施形態にも記載されている。
本発明はまた、例えば、限定されないが、その範囲をいかなる方法でも限定するものとして解釈されるべきではない、以下の番号付けされた実施形態にも記載されている。
実施形態1.アクチビン受容体IIB型(ActRIIB)エクトドメイン(ECD)バリアントを含むポリペプチドであって、前記バリアントが、ヒト野生型ActRIIB-ECDの配列に対して1つ以上のアミノ酸置換を有し、任意選択で、前記バリアントが、F58IではないF58の置換を含む、前記ポリペプチド。
実施形態2.前記バリアントが、ヒト野生型ActRIIB-ECDの配列に対して1つのアミノ酸置換を有し、1つのアミノ酸置換が、F58IではないF58の置換である、実施形態1に記載のポリペプチド。
実施形態3.前記バリアントが、アミノ酸置換F58D、F58E、F58Y、F58K、F58Q、F58N、F58R、F58H、またはF58Wを含む、実施形態1または2に記載のポリペプチド。
実施形態4.前記バリアントが、アミノ酸置換F58Dを含む、実施形態3に記載のポリペプチド。
実施形態5.前記バリアントが、アミノ酸置換F58Eを含む、実施形態3に記載のポリペプチド。
実施形態6.前記バリアントが、アミノ酸置換F58Yを含む、実施形態3に記載のポリペプチド。
実施形態7.前記バリアントが、アミノ酸置換F58Kを含む、実施形態3に記載のポリペプチド。
実施形態8.前記バリアントが、アミノ酸置換F58Qを含む、実施形態3に記載のポリペプチド。
実施形態9.前記バリアントが、アミノ酸置換F58Wを含むか、または前記バリアントが、アミノ酸置換F58Nを含むか、または前記バリアントが、アミノ酸置換F58Rを含むか、または前記バリアントが、アミノ酸置換F58Hを含む、実施形態3に記載のポリペプチド。
実施形態10.前記バリアントが、1つ以上の追加のアミノ酸置換を更に含む、実施形態1~9のいずれか1つに記載のポリペプチド。
実施形態11.前記ヒト野生型ActRIIB-ECDが、配列ETRECIYYNANWELERTNQSGLERCEGEQDKRLHCYASWRNSSGTIELVKKGCWLDDFNCYDRQECVATEENPQVYFCCCEGNFCNERFTHLPEAGGPEVTYEPPPT(配列番号2)を有する、実施形態1~10のいずれか1つに記載のポリペプチド。
実施形態12.前記ヒト野生型ActRIIB-ECDが、1つ以上の追加のアミノ酸を更に含む、実施形態11のポリペプチド。
実施形態13.前記ヒト野生型ActRIIB-ECDが、N末端に以下のアミノ酸:GRGEA(配列番号23)を更に含む、実施形態12に記載のポリペプチド。
実施形態14.前記バリアントが、配列番号5に示される配列を有する、実施形態1~11のいずれか1つに記載のポリペプチド。
実施形態15.前記バリアントが、配列番号6に示される配列を有する、実施形態1~11のいずれか1つに記載のポリペプチド。
実施形態16.前記バリアントが、配列番号7に示される配列を有する、実施形態1~11のいずれか1つに記載のポリペプチド。
実施形態17.前記バリアントが、配列番号8に示される配列を有する、実施形態1~11のいずれか1つに記載のポリペプチド。
実施形態18.前記バリアントが、配列番号9に示される配列を有する、実施形態1~11のいずれか1つに記載のポリペプチド。
実施形態19.前記バリアントが、配列番号10に示される配列を有する、実施形態1~11のいずれか1つに記載のポリペプチド。
実施形態19A.前記バリアントが、配列番号11に示される配列を有する、実施形態1~11のいずれか1つに記載のポリペプチド。
実施形態19B.前記バリアントが、配列番号12に示される配列を有する、実施形態1~11のいずれか1項に記載のポリペプチド。
実施形態19C.前記バリアントが、配列番号13に示される配列を有する、実施形態1~11のいずれか1項に記載のポリペプチド。
実施形態20.前記バリアントが、1つ以上の追加のアミノ酸置換を更に含む、実施形態14~19Cのいずれか1つに記載のポリペプチド。
実施形態21.前記バリアントが、N末端に以下のアミノ酸:GRGEA(配列番号23)を更に含み、任意選択で、前記バリアントが、C末端にアミノ酸APTを更に含む、実施形態20に記載のポリペプチド。
実施形態22.リンカーを介して前記バリアントの前記C末端に融合したFcドメイン単量体を更に含む、実施形態1~21のいずれか1つに記載のポリペプチド。
実施形態23.前記Fcドメイン単量体が、IgG1、IgG2、IgG3またはIgG4である、実施形態22に記載のポリペプチド。
実施形態24.前記Fcドメイン単量体が、ヒトFcドメイン単量体である、実施形態22または23に記載のポリペプチド。
実施形態25.前記Fcドメイン単量体が、マウスFcドメイン単量体である、実施形態22または23に記載のポリペプチド。
実施形態26.前記Fcドメイン単量体が、前記ポリペプチドの二量体の凝集を低減するか、またはその安定性を調節するように操作される、実施形態22~25のいずれか1つに記載のポリペプチド。
実施形態27.前記Fcドメイン単量体が、以下の3つの変異:M252Y/S254T/T256E(YTE)を有する、実施形態22~26のいずれか1つに記載のポリペプチド。
実施形態28.前記Fcドメイン単量体が、M252Y変異を有する、実施形態22~27のいずれか1つに記載のポリペプチド。
実施形態29.前記Fcドメイン単量体が、356位にD、及び358位にL(DL)を含む、実施形態22~28のいずれか1つに記載のポリペプチド。
実施形態30.前記Fcドメイン単量体が、356位にE、及び358位にM(EM)を含む、実施形態22~28のいずれか1つに記載のポリペプチド。
実施形態31.前記Fcドメイン単量体が、IgG1である、実施形態22~30のいずれか1つに記載のポリペプチド。
実施形態32.前記Fcドメイン単量体が、C末端にリジン残基(K)を含む、実施形態31に記載のポリペプチド。
実施形態33.前記Fcドメイン単量体が、配列番号134~147及び338のうちのいずれか1つに示されるアミノ酸配列、またはそれと少なくとも85%、少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を有する、実施形態31に記載のポリペプチド。
実施形態34.前記Fcドメイン単量体が、配列番号134~147及び338のうちのいずれか1つに示されるアミノ酸配列を含むか、またはそれからなる、実施形態31~33のいずれか1つに記載のポリペプチド。
実施形態35.前記Fcドメイン単量体が、配列番号134、135、137、138、及び157のうちのいずれか1つに示されるアミノ酸配列を含むか、またはそれからなる、実施形態31~33のいずれか1つに記載のポリペプチド。
実施形態36.前記Fcドメイン単量体が、配列番号135に示されるアミノ酸配列を含むか、またはそれからなる、実施形態31~33のいずれか1項に記載のポリペプチド。
実施形態37.前記Fcドメイン単量体が、前記C末端にリジン残基(K)を更に含む、実施形態33~36のいずれか1つに記載のポリペプチド。
実施形態38.前記Fcドメイン単量体が、IgG2である、実施形態22~30のいずれか1つに記載のポリペプチド。
実施形態39.前記Fcドメイン単量体が、配列番号148~157のうちのいずれか1つに示されるアミノ酸配列、またはそれと少なくとも85%、少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を有する、実施形態38に記載のポリペプチド。
実施形態40.前記Fcドメイン単量体が、配列番号148~157のうちのいずれか1つに示されるアミノ酸配列を含むか、またはそれからなる、実施形態10~17のいずれか1つに記載のポリペプチド。
実施形態41.前記Fcドメイン単量体が、配列番号157に示されるアミノ酸配列を含むか、またはそれからなる、実施形態38~40のいずれか1つに記載のポリペプチド。
実施形態42.前記Fcドメイン単量体が、配列番号134~173及び338のうちのいずれか1つに示されるアミノ酸配列、またはそれと少なくとも85%、少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を有する、実施形態22~30のいずれか1つに記載のポリペプチド。
実施形態43.前記Fcドメイン単量体が、配列番号134~173及び338のうちのいずれか1つに示されるアミノ酸配列を含むか、またはそれからなる、実施形態22~30及び42のいずれか1つに記載のポリペプチド。
実施形態44.前記Fcドメイン単量体が、C末端にリジン残基(K)を更に含む、実施形態42または43に記載のポリペプチド。
実施形態45.前記Fcドメイン単量体が、二量体を形成する、実施形態22~44のいずれか1つに記載のポリペプチド。
実施形態46.前記リンカーが、アミノ酸スペーサーである、実施形態22~45のいずれか1つに記載のポリペプチド。
実施形態47.前記リンカーが、グリシンリッチである、実施形態22~46のいずれか1つに記載のポリペプチド。
実施形態48.前記リンカーが、2~40アミノ酸長であるか、または前記リンカーが、10~40アミノ酸長である、実施形態22~47のいずれか1つに記載のポリペプチド。
実施形態49.前記リンカーが、3~39アミノ酸長であるか、または3~14アミノ酸長であるか、または10~39アミノ酸長であるか、または10~14アミノ酸長であるか、または3アミノ酸長、10アミノ酸長、14アミノ酸長、19アミノ酸長、もしくは39アミノ酸長である、実施形態48に記載のポリペプチド。
実施形態50.前記リンカーが、14アミノ酸長であるか、または前記リンカーが、少なくとも14アミノ酸長である、実施形態49に記載のポリペプチド。
実施形態51.前記リンカーが、10アミノ酸長であるか、または前記リンカーが、少なくとも10アミノ酸長である、実施形態46~51のいずれか1つに記載のポリペプチド。
実施形態52.前記リンカーが、配列番号59、54、34、または63に示されるアミノ酸配列を有する、実施形態46~51のいずれか1つに記載のポリペプチド。
実施形態53.前記リンカーが、アミノ酸配列(Gly4Ser)nを有し、ここで、nが、1~8の整数である、実施形態1~52のいずれか1つに記載のポリペプチド。
実施形態54.前記リンカーが、配列番号34~133及び335~337のうちのいずれか1つに示されるアミノ酸配列を有する、実施形態22~53のいずれか1つに記載のポリペプチド。
実施形態55.前記リンカーが、配列番号59に示されるアミノ酸配列を有する、実施形態22~54のいずれか1つに記載のポリペプチド。
実施形態56.前記ポリペプチドが、配列番号174~254、333、もしくは339~341のうちのいずれか1つに示されるアミノ酸配列を有するポリペプチド、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を含むか、またはそれからなる、実施形態1~55のいずれか1つに記載のポリペプチド。
実施形態57.前記ポリペプチドが、配列番号186に示されるアミノ酸配列を有するポリペプチド、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を含む、実施形態56に記載のポリペプチド。
実施形態58.前記ポリペプチドが、配列番号186に示されるアミノ酸配列を有するポリペプチド、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を含むか、またはそれからなる、実施形態56に記載のポリペプチド。
実施形態59.前記ポリペプチドが、配列番号186に示されるアミノ酸配列を有するポリペプチドを含む、実施形態57に記載のポリペプチド。
実施形態60.前記ポリペプチドが、配列番号186に示されるアミノ酸配列を有するポリペプチドからなる、実施形態58に記載のポリペプチド。
実施形態61.配列番号186に示されるアミノ酸配列を有する、ポリペプチド。
実施形態62.前記ポリペプチドが、配列番号174~254、333、または339~341のうちのいずれか1つに示されるアミノ酸配列を有するポリペプチドを含むか、またはそれからなる、実施形態56に記載のポリペプチド。
実施形態63.リンカーを介して前記ポリペプチドの前記N末端またはC末端に融合したアルブミン結合ドメインを更に含む、実施形態1~62のいずれか1つに記載のポリペプチド。
実施形態64.リンカーを介して前記ポリペプチドの前記N末端またはC末端に融合したフィブロネクチンドメインを更に含む、実施形態1~63のいずれか1つに記載のポリペプチド。
実施形態65.リンカーを介して前記ポリペプチドの前記N末端またはC末端に融合したヒト血清アルブミンを更に含む、実施形態1~64のいずれか1つに記載のポリペプチド。
実施形態66.前記ポリペプチドの発現、検出及び/または精製に好適なアミノ酸配列を更に含む、実施形態1~65のいずれか1つに記載のポリペプチド。
実施形態67.配列番号1に示される配列を有するシグナルペプチド、またはそれと実質的に同一の配列を更に含む、実施形態1~66のいずれか1つに記載のポリペプチド。
実施形態68.前記ポリペプチドが、標的化剤、治療部分、検出可能部分、または診断部分とコンジュゲートされている、実施形態1~67のいずれか1項に記載のポリペプチド。
実施形態69.前記標的化剤、前記治療部分、前記検出可能部分、または前記診断部分が、抗体またはその抗原結合断片、前記TGFβスーパーファミリーの別のメンバーに対して、もしくは別の治療標的に対して親和性を有する結合剤、放射線療法剤、イメージング剤、蛍光部分、細胞傷害性剤、抗有糸分裂薬、ナノ粒子ベースの担体、ポリマーコンジュゲート薬、ナノ担体、イメージング剤、安定化剤、薬物、ナノ担体、またはデンドリマーを含む、実施形態68に記載のポリペプチド。
実施形態70.2つ以上のポリペプチドが、それぞれのFcドメイン単量体間の少なくとも1つのジスルフィド架橋によって共有結合している、実施形態1~69のいずれか1つに記載のポリペプチド。
実施形態71.前記ポリペプチドが、ヒトアクチビンA、アクチビンB、GDF-8、GDF-11、及び/または骨形態形成タンパク質(BMP)-10に結合し、ヒトBMP-9への結合の低減または弱い結合を有する、実施形態1~70のいずれか1つに記載のポリペプチド。
実施形態72.前記ポリペプチドが、ヒトBMP-9に実質的に結合しない、実施形態71に記載のポリペプチド。
実施形態73.前記ポリペプチドが、それらの受容体を通じて、ヒトアクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上のシグナル伝達を阻害する、実施形態71または72に記載のポリペプチド。
実施形態74.前記ポリペプチドが、ヒトBMP-9シグナル伝達を実質的に阻害しない、実施形態71~73のいずれか1つに記載のポリペプチド。
実施形態75.ヒトBMP-9シグナル伝達に対する前記ポリペプチドの前記阻害効力が、ヒトBMP-9シグナル伝達に対するヒト野生型ActRIIB-ECDの前記阻害効力と比較して約100倍以上低減する、実施形態1~74のいずれか1つに記載のポリペプチド。
実施形態76.ヒトBMP-9シグナル伝達に対するポリペプチドの前記阻害効力が、ヒトBMP-9シグナル伝達に対するヒト野生型ActRIIB-ECDの前記阻害効力と比較して、約200倍、約300倍、またはそれ以上低減する、実施形態75に記載のポリペプチド。
実施形態77.ヒトBMP-9シグナル伝達に対する前記ポリペプチドの阻害効力が、ヒトBMP-9シグナル伝達に対する配列番号174に示されるアミノ酸配列を有する前記ポリペプチドの阻害効力と比較して約100倍以上低減する、実施形態1~74のいずれか1項に記載のポリペプチド。
実施形態78.ヒトBMP-9シグナル伝達に対する前記ポリペプチドの前記阻害効力が、配列番号174に示されるアミノ酸配列を有する前記ポリペプチドの阻害効力と比較して、約200倍、約300倍、またはそれ以上低減する、実施形態77に記載のポリペプチド。
実施形態79.ヒトアクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上に対する前記ポリペプチドの阻害効力が、同じそれぞれのリガンド(複数可)に対するヒト野生型ActRIIB-ECDの前記阻害効力と同じまたは実質的に同じである、実施形態1~78のいずれか1つに記載のポリペプチド。
実施形態80.ヒトアクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上に対する前記ポリペプチドの阻害効力が、同じそれぞれのリガンド(複数可)に対する配列番号174に示されるアミノ酸配列を有する前記ポリペプチドの前記阻害効力と同じまたは実質的に同じである、実施形態1~78のいずれか1項に記載のポリペプチド。
実施形態81.ヒトアクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上に対する相対阻害効力が、同じそれぞれのリガンド(複数可)に対するヒト野生型ActRIIB-ECDの前記阻害効力と比較して増加する、実施形態1~78のいずれか1つに記載のポリペプチド。
実施形態82.ヒトアクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上に対する前記相対阻害効力が、同じそれぞれのリガンド(複数可)に対する、配列番号174に示されるアミノ酸配列を有する前記ポリペプチドの前記阻害効力と比較して増加している、実施形態1~78のいずれか1つに記載のポリペプチド。
実施形態83.ヒトアクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上に対する前記相対阻害効力が、同じそれぞれのリガンド(複数可)に対する、ヒト野生型ActRIIB-ECDまたは配列番号174に示されるアミノ酸配列を有する前記ポリペプチドの前記阻害効力と比較して、約2倍以上、約3倍以上、約4倍以上、または約5倍以上増加する、実施形態81または82に記載のポリペプチド。
実施形態84.アクチビンAに対する前記ポリペプチドの阻害効力が、配列番号174に示されるアミノ酸配列を有する前記ポリペプチドの阻害効力よりも少なくとも約2倍高く、BMP-9に対する前記ポリペプチドの阻害効力が、配列番号174に示されるアミノ酸配列を有する前記ポリペプチドの阻害効力よりも少なくとも約100倍低い、実施形態1~78のいずれか1つに記載のポリペプチド。
実施形態85.アクチビンAに対する前記ポリペプチドの阻害効力が、配列番号174に示されるアミノ酸配列を有する前記ポリペプチドの阻害効力よりも少なくとも約5倍高く、BMP-9に対する前記ポリペプチドの阻害効力が、配列番号174に示されるアミノ酸配列を有する前記ポリペプチドの阻害効力よりも少なくとも約300倍低い、実施形態84に記載のポリペプチド。
実施形態86.実施形態1~85のいずれか1つに記載のポリペプチドをコードする、核酸分子。
実施形態87.前記核酸分子が、選択された発現宿主によって分泌可能な形態で前記ポリペプチドをコードする、実施形態86に記載の核酸分子。
実施形態88.配列番号174~254、333、もしくは339~341のうちのいずれか1つに示されるアミノ酸配列、またはそれと実質的に同一の配列を有する、少なくとも1つのポリペプチドをコードする核酸分子。
実施形態89.配列番号186に示されるアミノ酸配列、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を有するポリペプチドをコードする、核酸分子。
実施形態90.配列番号186に示されるアミノ酸配列を有するポリペプチドをコードする、核酸分子。
実施形態91.配列番号256~330、334、もしくは342~344のうちのいずれか1つに示される配列、またはそれと実質的に同一の配列を有する、核酸分子。
実施形態92.配列番号268に示される配列、またはそれと実質的に同一の配列、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を有する、核酸分子。
実施形態93.配列番号268に示される配列を有する、核酸分子。
実施形態94.配列番号268に示される配列、またはそれと実質的に同一の配列、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を含む、核酸分子。
実施形態95.配列番号268に示される配列を含む、核酸分子。
実施形態96.5’末端に、配列番号255に示される配列、またはそれと実質的に同一の配列を更に含む、実施形態86~95のいずれか1つに記載の核酸分子。
実施形態97.実施形態86~96のいずれか1つに記載の核酸分子を含む、ベクター。
実施形態98.配列番号268に示される配列、またはそれと実質的に同一の配列、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を含むか、またはそれからなる核酸分子を含む、ベクター。
実施形態99.配列番号268に示される配列を含む核酸分子を含む、ベクター。
実施形態100.配列番号268に示される配列からなる核酸分子を含む、ベクター。
実施形態101.実施形態86~96のいずれか1つに記載の核酸分子または実施形態97~100のいずれか1つに記載のベクターを含む、細胞宿主であって、前記核酸分子または前記ベクターが、前記細胞宿主内で発現される、前記細胞宿主。
実施形態102.実施形態1~85のいずれか1つに記載のポリペプチドを調製する方法であって、a)実施形態86~96のいずれか1つに記載の核酸分子または実施形態97~100のいずれか1つに記載のベクターを含む宿主細胞を提供することと、b)前記ポリペプチドの発現を可能にする条件下で前記宿主細胞を培養することと、c)発現されたポリペプチドを培養物から回収することと、を含む、前記方法。
実施形態103.実施形態1~85のいずれか1つに定義されるような第1のポリペプチドと、実施形態1~85のいずれか1つに定義されるような第2のポリペプチドと、を含む、TGFβスーパーファミリーリガンド結合剤であって、第1のポリペプチド及び第2のポリペプチドが、それぞれのFcドメイン単量体を通じて一緒に会合している、前記TGFβスーパーファミリーリガンド結合剤。
実施形態104.前記結合剤が、アクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10から選択される1つ以上のリガンドに結合し、それらのそれぞれの受容体を通じた1つ以上のリガンドのシグナル伝達を阻害し、前記結合剤が、BMP-9に実質的に結合しないか、またはその受容体を通じたBMP-9シグナル伝達を実質的に阻害する、実施形態103に記載の結合剤。
実施形態105.ヒトBMP-9シグナル伝達に対する前記結合剤の前記阻害効力が、ヒトBMP-9シグナル伝達に対するヒト野生型ActRIIB-ECDを含む第2の結合剤の阻害効力と比較して約100倍低減する、実施形態103~104に記載の結合剤。
実施形態106.アクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10から選択される1つ以上のリガンドに対する前記結合剤の前記阻害効力が、同じ1つ以上のリガンドに対する前記第2の結合剤の前記阻害効力と実質的に同じである、実施形態103~105のいずれか1つに記載の結合剤。
実施形態107.アクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10から選択される1つ以上のリガンドに対する前記結合剤の前記阻害効力が、同じ1つ以上のリガンドに対する前記第2の結合剤の前記阻害効力と比較して増加する、実施形態103~105のいずれか1つに記載の結合剤。
実施形態108.前記結合剤が、ヒト野生型ActRIIB-ECDを含む第2の結合剤と比較して、アクチビンAに対するより高い阻害効力及びBMP-9に対するより低い阻害効力を有する、実施形態103~105及び107のいずれか1つに記載の結合剤。
実施形態109.アクチビンAに対する前記結合剤の阻害効力が、それぞれ、アクチビンA及びBMP-9に対する前記第2の結合剤の前記阻害効力よりも少なくとも約2倍高く、BMP-9に対する前記結合剤の阻害効力が、少なくとも約100倍低い、実施形態108に記載の結合剤。
実施形態110.アクチビンAに対する前記結合剤の阻害効力が、それぞれ、アクチビンA及びBMP-9に対する前記第2の結合剤の前記阻害効力よりも少なくとも約5倍高く、BMP-9に対する前記結合剤の阻害効力が、少なくとも約300倍低い、実施形態109に記載の結合剤。
実施形態111.アクチビンAに対する前記結合剤の阻害効力が、それぞれ、アクチビンA及びBMP-9に対する前記第2の結合剤の前記阻害効力よりも少なくとも約2倍、少なくとも約3倍、少なくとも約4倍、または少なくとも約5倍高く、BMP-9に対する前記結合剤の阻害効力が、少なくとも約100倍、少なくとも約200倍、または少なくとも約300倍低い、実施形態109に記載の結合剤。
実施形態112.前記結合剤が、配列番号186、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列に示されるポリペプチドのホモ二量体である、実施形態103~111のいずれか1つに記載の結合剤。
実施形態113.前記結合剤が、配列番号186に示されるポリペプチドのホモ二量体である、実施形態112に記載の結合剤。
実施形態114.前記第2の結合剤が、配列番号186に示されるポリペプチドのホモ二量体である、実施形態105~113のいずれか1つに記載の結合剤。
実施形態115.前記結合剤が、対象において血管合併症を引き起こさず、及び/または対象において血管透過性もしくは漏出を増加させない、実施形態103~114のいずれか1つに記載の結合剤。
実施形態116.前記結合剤が、赤血球質量を増加させず、ヘモグロビンを増加させず、血小板減少症を引き起こさず、及び/または対象において血液合併症を引き起こさない、実施形態103~115のいずれか1つに記載の結合剤。
実施形態117.前記結合剤が、ホモ二量体であり、前記第1のポリペプチド及び前記第2のポリペプチドが、同じであるか、または実質的に同じである、実施形態103~116のいずれか1つに記載の結合剤。
実施形態118.前記第1のポリペプチド及び前記第2のポリペプチドが、配列番号174~254、333、もしくは339~341のうちのいずれか1つに示される配列、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を含むか、またはそれからなる、実施形態117に記載の結合剤。
実施形態119.前記第1のポリペプチド及び前記第2のポリペプチドが、配列番号174~254、333、または339~341のうちのいずれか1つに示される配列を含むか、またはそれらからなる、実施形態118に記載の結合剤。
実施形態120.前記第1のポリペプチド及び前記第2のポリペプチドが、配列番号186に示される配列、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を含む、実施形態117に記載の結合剤。
実施形態121.前記第1のポリペプチド及び前記第2のポリペプチドが、配列番号186に示される配列、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列からなる、実施形態117に記載の結合剤。
実施形態122.前記第1のポリペプチド及び前記第2のポリペプチドが、配列番号186に示される配列を含む、実施形態120に記載の結合剤。
実施形態123.前記第1のポリペプチド及び前記第2のポリペプチドが、配列番号186に示される配列からなる、実施形態121に記載の結合剤。
実施形態124.前記結合剤が、配列番号186に示される配列、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を有するポリペプチドのホモ二量体である、実施形態103~123のいずれか1つに記載の結合剤。
実施形態125.前記結合剤が、配列番号186に示される配列を有するポリペプチドのホモ二量体である、実施形態124に記載の結合剤。
実施形態126.前記結合剤が、ヘテロ二量体であり、前記第1のポリペプチド及び前記第2のポリペプチドが、異なるアミノ酸配列を含む、実施形態103~123のいずれか1つに記載の結合剤。
実施形態127.前記第1のポリペプチドが、配列番号186に示される配列、またはそれと少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を含むか、またはそれからなる、実施形態126に記載の結合剤。
実施形態128.前記第1のポリペプチドが、配列番号186に示される配列を含むか、またはそれからなる、実施形態127に記載の結合剤。
実施形態129.実施形態1~85のいずれか1つに記載のポリペプチド、または実施形態103~128のいずれか1つに記載の結合剤、及び薬学的に許容される担体、希釈剤、または賦形剤を含む、薬学的組成物。
実施形態130.前記組成物が、注射または注入による投与用に製剤化される、実施形態129に記載の薬学的組成物。
実施形態131.前記組成物が、静脈内、皮下、腹腔内、または筋肉内投与用に製剤化されている、実施形態130に記載の薬学的組成物。
実施形態132.実施形態1~85のいずれか1つに記載のポリペプチド及びレシピエントと、任意選択で使用説明書と、を含む、キット。
実施形態133.実施形態1~85のいずれか1つに記載のポリペプチドまたは実施形態103~128のいずれか1つに記載の結合剤を製造する方法であって、前記第1のポリペプチド及び/または前記第2のポリペプチドを細胞内で発現させることを含む、前記方法。
実施形態134.前記細胞を培養することと、前記細胞内で発現された前記ポリペプチドまたは前記結合剤を単離及び/または精製することと、を更に含む、実施形態133に記載の方法。
実施形態135.前記ポリペプチド及び/または前記結合剤が、前記細胞によって分泌され、前記ポリペプチド及び/または前記結合剤が、前記細胞が培養される培地から得られる、実施形態134に記載の方法。
実施形態136.TGFβスーパーファミリーリガンドのシグナル伝達と関連する疾患または状態を治療または予防することを必要とする対象においてそれを行う方法であって、前記方法が、実施形態1~85のいずれか1つに記載のポリペプチド、実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を前記対象に投与することを含み、その結果、前記疾患または状態が、前記対象において治療または予防される、前記方法。
実施形態137.前記対象が、哺乳類である、実施形態136に記載の方法。
実施形態138.前記哺乳類が、ヒトである、実施形態137に記載の方法。
実施形態139.前記対象が、1つ以上のTGFβスーパーファミリーリガンドによって媒介された疾患または状態を有するか、または有することが疑われる、実施形態136~138のいずれか1つに記載の方法。
実施形態140.前記対象が、アクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10によって媒介された疾患または状態を有するか、または有することが疑われる、実施形態136~139のいずれか1つに記載の方法。
実施形態141.前記TGFβスーパーファミリーリガンドが、アクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上である、実施形態136~140のいずれか1つに記載の方法。
実施形態142.対象においてアクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10によって媒介された疾患または状態を治療または予防する方法であって、実施形態1~85のいずれか1つに記載のポリペプチド、実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を前記対象に投与することを含み、その結果、アクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10によって媒介された前記疾患または状態が、前記対象において治療または予防される、前記方法。
実施形態143.前記疾患が、アクチビンAによって媒介される、実施形態142に記載の方法。
実施形態144.前記疾患が、アクチビンBによって媒介される、実施形態142または143に記載の方法。
実施形態145.前記疾患が、GDF-8によって媒介される、実施形態142~144のいずれか1つに記載の方法。
実施形態146.前記疾患が、GDF-11によって媒介される、実施形態142~145のいずれか1つに記載の方法。
実施形態147.前記疾患が、BMP-10によって媒介される、実施形態142~146のいずれか1つに記載の方法。
実施形態148.前記疾患または状態が、アクチビンA及び/またはアクチビンB及び/またはGDF-8及び/またはGDF-11の過剰発現または過剰活性化を特徴とする、実施形態142~147のいずれか1つに記載の方法。
実施形態149.前記疾患または状態が、肺高血圧症、線維症、筋力低下または萎縮、代謝障害、心臓代謝性疾患、骨損傷、及び低い赤血球レベルから選択される、実施形態136~148のいずれか1つに記載の方法。
実施形態150.前記疾患または状態が、肺高血圧症(PH)である、実施形態136~149のいずれか1つに記載の方法。
実施形態151.前記PHが、動脈PH、静脈PH、低酸素PH、血栓塞栓性PH、または雑種PH(WHO群1-Vとしても知られる)である、実施形態150に記載の方法。
実施形態152.前記PHが、肺動脈高血圧症(PAH)である、実施形態150または151に記載の方法。
実施形態153.前記PAHが、感染症、先天性心臓異常、門脈高血圧症、肺静脈閉塞性疾患、肺毛細血管腫症、結合組織障害、慢性閉塞性肺疾患、自己免疫障害(例えば、強皮症もしくはループス)、または薬物使用(例えば、コカインもしくはメタンフェタミンの使用)と関連する特発性PAH、遺伝性PAH、またはPAHである、実施形態152に記載の方法。
実施形態154.前記疾患または状態が、線維症である、実施形態136~149のいずれか1つに記載の方法。
実施形態155.前記線維症が、肺線維症、特発性肺線維症、腎線維症、肝線維症、肺線維症、腎線維症、骨髄線維症、全身性硬化症、皮膚線維症、心臓線維症、骨髄線維症、角膜線維症、縦隔線維症、後腹膜線維症、骨関節線維症、関節線維症、組織線維症、線維腫増殖性障害、または結合組織障害である、実施形態154に記載の方法。
実施形態156.前記疾患または状態が、筋力低下または萎縮である、実施形態136~149のいずれか1つに記載の方法。
実施形態157.前記疾患または状態が、デュシェンヌ型筋ジストロフィー(DMD)、顔面肩甲上腕型筋ジストロフィー(FSHD)、封入体筋炎(IBM)、筋萎縮性側索硬化症(ALS)、サルコペニア、またはがん悪液質である、実施形態156に記載の方法。
実施形態158.前記疾患または状態が、代謝障害である、実施形態136~149のいずれか1つに記載の方法。
実施形態159.前記代謝障害が、肥満、1型糖尿病、2型糖尿病、または前糖尿病である、実施形態158に記載の方法。
実施形態160.前記疾患または状態が、心臓代謝性疾患である、実施形態136~149のいずれか1つに記載の方法。
実施形態161.前記疾患または状態が、駆出率低下を伴う心不全(HFrEF)または駆出率維持を伴う心不全(HFpEF)である、実施形態160に記載の方法。
実施形態162.前記疾患または状態が、骨損傷である、実施形態136~149のいずれか1つに記載の方法。
実施形態163.前記骨損傷が、骨脱塩、骨粗しょう症(例えば、原発性もしくは二次性)、骨減少症、大理石骨病、骨折、骨癌もしくはがん転移関連の骨損失、パジェット病、腎性骨ジストロフィー、治療関連の骨損失、食事関連の骨損失、肥満の治療に関連する骨損失、低重力関連の骨損失、または不動性関連の骨損失を含む、実施形態162に記載の方法。
実施形態164.前記疾患または状態が、低い赤血球レベルである、実施形態136~149のいずれか1つに記載の方法。
実施形態165.前記疾患または状態が、貧血または失血である、実施形態164に記載の方法。
実施形態166.除脂肪量を増加させることを必要とする対象において除脂肪量を増加させる方法であって、前記対象に、治療有効量の実施形態1~85のうちのいずれか1つに記載のポリペプチド、実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含み、その結果、対象において除脂肪量が増加する、前記方法。
実施形態167.筋肉量を増加させることを必要とする対象において筋肉量を増加させる方法であって、前記対象に、治療有効量の実施形態1~85のいずれか1つに記載のポリペプチド、実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含み、その結果、前記対象において除脂肪量が増加する、前記方法。
実施形態168.前記対象が、デュシェンヌ型筋ジストロフィー、顔面肩甲上腕型筋ジストロフィー、封入体筋炎、筋萎縮性側索硬化症、サルコペニア、またはがん悪液質を有する、実施形態167に記載の方法。
実施形態169.デュシェンヌ型筋ジストロフィー、顔面肩甲上腕型筋ジストロフィー、封入体筋炎、筋萎縮性側索硬化症、サルコペニア、またはがん悪液質を有するか、または発症するリスクがある対象を治療する方法であって、前記対象に、治療有効量の実施形態1~85のいずれか1つに記載のポリペプチド、または実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含む、前記方法。
実施形態170.骨ミネラル密度を増加させることを必要とする対象において骨ミネラル密度を増加させる方法であって、前記対象に、治療有効量の実施形態1~85のいずれか1つに記載のポリペプチド、実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含み、その結果、前記対象において骨ミネラル密度が増加する、前記方法。
実施形態171.骨吸収を低減することを必要とする対象において骨吸収を低減する方法であって、前記対象に、治療有効量の実施形態1~85のうちのいずれか1つに記載のポリペプチド、実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含み、その結果、対象において骨吸収が低減する、前記方法。
実施形態172.骨形成を増加させることを必要とする対象において骨形成を増加させる方法であって、前記対象に、治療有効量の実施形態1~85のいずれか1つに記載のポリペプチド、実施形態103~128のいずれか1つに記載の結合剤、または実施形態88~90のいずれか1つに記載の薬学的組成物を投与することを含み、その結果、前記対象において骨形成が増加する、前記方法。
実施形態173.骨強度を増加させることを必要とする対象において骨強度を増加させる方法であって、前記対象に、治療有効量の実施形態1~85のうちのいずれか1つに記載のポリペプチド、実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含み、その結果、対象において骨強度が増加する、前記方法。
実施形態174.骨折のリスクを低減することを必要とする対象において骨折のリスクを低減する方法であって、前記対象に、治療有効量の実施形態1~85のうちのいずれか1つに記載のポリペプチド、実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含み、その結果、対象において骨折のリスクが低減する、前記方法。
実施形態175.前記対象が、原発性骨粗しょう症、二次性骨粗しょう症、骨減少症、大理石骨病、骨折、骨癌もしくはがん転移関連骨損失、多発性骨髄腫、パジェット病、腎性骨ジストロフィー、治療関連骨損失、食事関連骨損失、肥満の治療に関連する骨損失、低重力関連骨損失、または不動性関連骨損失を有する、実施形態170~174のいずれか1つに記載の方法。
実施形態176.骨疾患を有するか、または発症するリスクがある対象を治療する方法であって、前記対象に、治療有効量の実施形態1~85のいずれか1つに記載のポリペプチド、または実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含む、前記方法。
実施形態177.前記骨疾患が、原発性骨粗しょう症、二次性骨粗しょう症、骨減少症、大理石骨病、骨折、骨癌もしくはがん転移関連の骨損失、パジェット病、腎性骨ジストロフィー、治療関連の骨損失、食事関連の骨損失、肥満の治療に関連する骨損失、低重力関連の骨損失、または不動性関連の骨損失を含む、実施形態176に記載の方法。
実施形態178.原発性骨粗しょう症(例えば、加齢性骨粗しょう症、ホルモン関連骨粗しょう症)、二次性骨粗しょう症(例えば、固定化誘発性骨粗しょう症、グルココルチコイド誘発性骨粗しょう症)、骨減少症、パジェット病、腎性骨ジストロフィー、治療関連の骨損失(例えば、FGF-21治療、GLP-1治療、がん治療、肥満の治療、2型糖尿病の治療)、食事関連の骨損失(例えば、くる病)、低重力関連の骨損失、不動性関連の骨損失、または骨折を有するか、または発症するリスクがある対象を治療する方法であって、前記対象に、治療有効量の実施形態1~85のいずれか1つに記載のポリペプチド、または実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含む、前記方法。
実施形態179.前記骨が、皮質骨または小梁骨である、実施形態170~178のいずれか1つに記載の方法。
実施形態180.線維症を治療することを必要とする対象において線維症を治療する方法であって、前記対象に、治療有効量の実施形態1~85のいずれか1つに記載のポリペプチド、または実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含む、前記方法。
実施形態181.前記線維症が、肺線維症、特発性肺線維症、腎線維症、肝線維症、肺線維症、腎線維症、骨髄線維症、全身性硬化症、皮膚線維症、心臓線維症、骨髄線維症、角膜線維症、縦隔線維症、後腹膜線維症、骨関節線維症、関節線維症、組織線維症、線維腫増殖性障害、または結合組織障害である、実施形態180に記載の方法。
実施形態182.前記線維症が、化学療法薬物誘発性線維症、放射線誘発性線維症、腫瘍間質、デスモプラスチック腫瘍、外科的接着、肥大性瘢痕、またはケロイドである、実施形態180または181に記載の方法。
実施形態183.組織線維症が、筋肉組織、皮膚上皮、皮膚真皮、腱、軟骨、膵臓組織、子宮組織、神経組織、精巣、卵巣、副腎、動脈、静脈、結腸、小腸、大腸、胆道、及び腸からなる群から選択される組織に影響を与える線維症である、実施形態181に記載の方法。
実施形態184.前記線維症が、創傷、火傷、B型またはC型肝炎感染症、脂肪性肝疾患、血吸虫感染症、腎疾患、慢性腎疾患、心疾患、黄斑変性、網膜もしくは硝子体網膜症、クローン病、全身性もしくは局所性強皮症、アテローム性動脈硬化症、または再狭窄と関連する線維症である、実施形態149、154、155、及び180~183のいずれか1つに記載の方法。
実施形態185.前記方法が、対象において血管合併症を引き起こさず、対象において血管透過性もしくは漏出を増加させず、赤血球質量を増加させず、ヘモグロビンを増加させず、血小板減少を引き起こさず、及び/または対象において血液合併症を引き起こさない、実施形態136~184のいずれか1つに記載の方法。
実施形態186.赤血球レベルを増加させることを必要とする対象において赤血球レベルを増加させる方法であって、前記対象に、治療有効量の実施形態1~85のうちのいずれか1つに記載のポリペプチド、実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含み、その結果、対象において赤血球レベルが増加する、前記方法。
実施形態187.赤血球形成を促進または増加させることを必要とする対象において赤血球形成を促進または増加させる方法であって、前記対象に、治療有効量の実施形態1~85のいずれか1つに記載のポリペプチド、実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含み、その結果、前記対象において赤血球形成が増加する、前記方法。
実施形態188.貧血または失血を有するか、または発症するリスクがある対象を治療する方法であって、前記対象に、治療有効量の実施形態1~85のいずれか1つに記載のポリペプチド、実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含む、前記方法。
実施形態189.前記貧血または失血が、がん、がん治療、慢性腎疾患、急性腎疾患もしくは急性腎不全、慢性腎疾患もしくは慢性腎不全、骨髄異形成症候群、サラセミア、栄養不足、薬物に対する有害反応、炎症性疾患もしくは自己免疫疾患、脾腫大、ポルフィリン症、血管炎、溶血、骨髄欠損、骨髄移植、急性肝疾患、慢性肝疾患、急性出血、慢性出血、感染症、ヘモグロビン異常症、薬物使用、アルコール乱用、チャーグ・ストラウス症候群、フェルティ症候群、移植片対宿主病、造血幹細胞移植、骨髄線維症、汎血球減少症、純粋な赤血球再形成不全、ヘノッホ・シェーンライン紫斑病、シュワッハマン症候群、高齢、輸血の禁忌、手術、外傷、創傷、潰瘍、尿路出血、消化管出血、頻繁な献血、または激しい月経出血と関連する、実施形態188に記載の方法。
実施形態190.前記貧血が、再生不良性貧血、鉄欠乏性貧血、ビタミン欠乏性貧血、慢性疾患の貧血、骨髄疾患と関連する貧血、溶血性貧血、鎌状赤血球貧血、小赤血球性貧血、低色素性貧血、鉄芽球性貧血、ダイアモンド・ブラックファン貧血、ファンコーニ貧血、または過剰な芽球を有する難治性貧血である、実施形態188または189に記載の方法。
実施形態191.前記対象が、シュワッハマン・ボディアン・ダイアモンド症候群を有するか、または発症するリスクがある、実施形態186~190のいずれか1つに記載の方法。
実施形態192.前記対象が、エリスロポエチン(EPO)による治療に十分に応答しないか、またはEPOの有害作用を受けやすい、実施形態186~191のいずれか1つに記載の方法。
実施形態193.肺高血圧症(PH)を治療または予防することを必要とする対象において肺高血圧症を治療または予防する方法であって、前記対象に、治療有効量の実施形態1~85のいずれか1つに記載のポリペプチド、または実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含む、前記方法。
実施形態194.前記PHが、動脈PH、静脈PH、低酸素PH、血栓塞栓性PH、または雑種PHである、実施形態193に記載の方法。
実施形態195.前記PHが、突発性または遺伝性である、実施形態193または194に記載の方法。
実施形態196.前記PHが、肺動脈高血圧症(PAH)である、実施形態193または195に記載の方法。
実施形態197.前記PAHが、先天性心疾患、門脈高血圧症、肺静脈閉塞性疾患、肺毛細血管腫症、肝硬変、先天性心疾患、結合組織障害、慢性閉塞性肺疾患、自己免疫疾患(例えば、強皮症もしくはループス)、または薬物使用(例えば、コカインもしくはメタンフェタミンの使用)と関連する、特発性PAH、遺伝性PAH、感染症と関連するPAH、またはPAHである、実施形態196に記載の方法。
実施形態198.前記感染症が、HIV感染症または住血吸虫症である、実施形態197に記載の方法。
実施形態199.前記PHが、左心室収縮機能不全、左心室拡張機能不全、弁膜症、先天性心筋症、または先天性もしくは後天性肺静脈狭窄症と関連する静脈PHである、実施形態198に記載の方法。
実施形態200.前記PHが、慢性閉塞性肺疾患、間質性肺疾患、睡眠呼吸障害、肺線維症、肺胞低換気障害、高地への慢性曝露、または発達異常と関連する低酸素PHである、実施形態194に記載の方法。
実施形態201.前記PHが、慢性血栓塞栓性肺高血圧症、肺塞栓症、血管肉腫、動脈炎、先天性肺動脈狭窄症、または寄生虫感染症と関連する血栓塞栓性PHである、実施形態194に記載の方法。
実施形態202.前記PHが、血液疾患、全身疾患、代謝障害、肺腫瘍性血栓性微小血管症、線維性縦隔炎、慢性腎不全、または区分性肺高血圧症と関連する雑種PHである、実施形態194に記載の方法。
実施形態203.血管疾患または血管障害を治療または予防することを必要とする対象において血管疾患または血管障害を治療または予防する方法であって、前記対象に、治療有効量の実施形態1~85のいずれか1つに記載のポリペプチド、または実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含む、前記方法。
実施形態204.前記血管疾患または血管障害が、血管炎、動脈硬化、大動脈瘤もしくは血管石灰化である、及び/または前記対象が、慢性腎疾患(CKD)、糖尿病、鎌状赤血球貧血、もしくは川崎病を有する、実施形態203に記載の方法。
実施形態205.代謝障害を治療または予防することを必要とする対象において代謝障害を治療または予防する方法であって、前記対象に、治療有効量の実施形態1~85のいずれか1つに記載のポリペプチド、または実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含む、前記方法。
実施形態206.前記代謝障害が、年齢関連代謝障害である、実施形態205に記載の方法。
実施形態207.前記代謝障害が、治療関連代謝障害である、実施形態205に記載の方法。
実施形態208.前記治療が、グルココルチコイド(例えば、プレドニゾンなどのコルチコステロイド)、選択的セロトニン再取り込み阻害剤(SSRI、例えば、パロキセチン、ミルタザピン、フルオキセチン、エスシタロプラム、もしくはセルトラリン)、セロトニン-ノルエピネフリン再取り込み阻害剤(SNRI)、三環系抗うつ剤(例えば、アミトリプチリン)、気分安定剤(例えば、バルプロ酸もしくはリチウム)、抗精神病薬(例えば、オランザピン、クロルプロマジン、もしくはクロザピン)、または抗糖尿病薬(例えば、インスリン、クロルプロパミド)による治療である、実施形態207に記載の方法。
実施形態209.前記代謝障害が、肥満、1型糖尿病、2型糖尿病、または前糖尿病である、実施形態205~208のいずれか1つに記載の方法。
実施形態210.体脂肪を低減することを必要とする対象において体脂肪を低減する方法であって、前記対象に、治療有効量の実施形態1~85のいずれか1つに記載のポリペプチド、または実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含む、前記方法。
実施形態211.体重を低減することを必要とする対象において体重を低減する方法であって、前記対象に、治療有効量の実施形態1~85のいずれか1つに記載のポリペプチド、または実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含む、前記方法。
実施形態212.血糖を低減することを必要とする対象において血糖を低減する方法であって、前記対象に、治療有効量の実施形態1~85のいずれか1つに記載のポリペプチド、または実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含む、前記方法。
実施形態213.インスリン感受性を増加させることを必要とする対象においてインスリン感受性を増加させる方法であって、前記対象に、治療有効量の実施形態1~85のいずれか1つに記載のポリペプチド、または実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を投与することを含む、前記方法。
実施形態214.前記対象が、代謝性障害を有するか、または発症するリスクがある、実施形態205~213のいずれか1つに記載の方法。
実施形態215.前記代謝障害が、肥満、1型糖尿病、2型糖尿病、または前糖尿病である、実施形態214に記載の方法。
実施形態216.前記ポリペプチドまたは前記結合剤または前記薬学的組成物が、以下:前記対象の体重及び/または体重増加のパーセンテージを低減すること;前記対象の体脂肪の量及び/または体脂肪のパーセンテージを低減すること;前記対象の肥満度を低減すること;前記対象の附睾及び腎周脂肪パッドの重量を低減すること;前記対象の皮下、内臓、及び/または肝脂肪の量を低減すること;前記対象の空腹時インスリンのレベルを下げること;前記対象の血糖値を低減すること;前記対象のインスリン感受性を高めること;空腹時インスリンレベルを低減すること;前記対象のグルコースクリアランス率を上げること;前記対象の血清脂質プロファイルを改善すること;前記対象のインスリン治療の必要性を遅らせる、低減する、もしくは排除すること;前記対象の除脂肪量を増加させること;前記対象の体重増加のパーセンテージを低減すること;前記対象の脂肪細胞の増殖を低減すること;前記対象のLDLレベルを低減すること;前記対象におけるトリグリセリドレベルを低減すること;前記対象の血清脂質プロファイルを改善すること;前記対象における膵β細胞からのインスリン生合成及び/または分泌を調節すること;前記対象におけるグルコースクリアランスを増加させること;前記対象の筋肉量及び/または筋力を増加させること;及び/または前記対象の除脂肪量を増加させることのうちの1つ以上をもたらすのに十分な量で投与される、実施形態205~215のいずれか1つに記載の方法。
実施形態217.前記方法が、前記対象の食物摂取に対する食欲に影響を及ぼさない、実施形態193~216のいずれか1つに記載の方法。
実施形態218.前記方法が、前記対象において除脂肪量を低減しない、実施形態193~217のいずれか1つに記載の方法。
実施形態219.前記方法が、対象において血管合併症を引き起こさず、対象において血管透過性もしくは漏出を増加させず、赤血球質量を増加させず、ヘモグロビンを増加させず、血小板減少を引き起こさず、及び/または対象において血液合併症を引き起こさない、実施形態193~218のいずれか1つに記載の方法。
実施形態220.対象においてBMP9シグナル伝達を実質的に低減または阻害することなく、アクチビンA、アクチビンB、GDF-8、GDF-11及び/またはBMP10シグナル伝達を低減または阻害することを必要とする前記対象においてそれを行う方法であって、実施形態1~85のいずれか1つに記載のポリペプチド、実施形態103~128のいずれか1つに記載の結合剤、または実施形態129~131のいずれか1つに記載の薬学的組成物を前記対象に投与することを含む、前記方法。
実施形態221.アクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP10の、それぞれの内因性受容体への結合が、対象において低減または阻害される、実施形態220に記載の方法。
実施形態222.BMP9の、その内因性受容体への結合が、前記対象において実質的に低減または阻害されない、実施形態220または221に記載の方法。
実施形態223.前記対象が、哺乳類である、実施形態220~222に記載の方法。
実施形態224.前記哺乳類が、ヒトである、実施形態223に記載の方法。
実施形態225.前記対象が、アクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10によって媒介された疾患または状態を有するか、または発症するリスクがある、実施形態220~224のいずれか1つに記載の方法。
実施形態226.アクチビンAシグナル伝達が、前記対象において低減または阻害される、実施形態220~225のいずれか1つに記載の方法。
実施形態227.アクチビンBシグナル伝達が、前記対象において低減または阻害される、実施形態220~226のいずれか1つに記載の方法。
実施形態228.GDF-8シグナル伝達が、前記対象において低減または阻害される、実施形態220~227のいずれか1つに記載の方法。
実施形態229.GDF-11シグナル伝達が、前記対象において低減または阻害される、実施形態220~228のいずれか1つに記載の方法。
実施形態230.BMP10シグナル伝達が、前記対象において低減または阻害される、実施形態220~229のいずれか1つに記載の方法。
実施形態231.前記疾患または状態が、アクチビンA及び/またはアクチビンB及び/またはGDF-8及び/またはGDF-11の過剰発現または過剰活性化を特徴とする、実施形態220~230のいずれか1つに記載の方法。
実施形態232.前記疾患または状態が、肺高血圧症、線維症、筋力低下または萎縮、代謝障害、心臓代謝性疾患、骨損傷、及び低い赤血球レベルから選択される、実施形態220~230のいずれか1つに記載の方法。
実施形態233.前記疾患または状態が、肺高血圧症(PH)である、実施形態220~232のいずれか1つに記載の方法。
実施形態234.前記PHが、動脈PH、静脈PH、低酸素PH、血栓塞栓性PH、または雑種PH(WHO群1-Vとしても知られる)である、実施形態233に記載の方法。
実施形態235.前記PHが、肺動脈高血圧症(PAH)である、実施形態233または234に記載の方法。
実施形態236.前記PAHが、感染症、先天性心臓異常、門脈高血圧症、肺静脈閉塞性疾患、肺毛細血管腫症、結合組織障害、慢性閉塞性肺疾患、自己免疫障害(例えば、強皮症もしくはループス)、または薬物使用(例えば、コカインもしくはメタンフェタミンの使用)と関連する特発性PAH、遺伝性PAH、またはPAHである、実施形態235に記載の方法。
実施形態237.前記疾患または状態が、線維症である、実施形態220~232のいずれか1つに記載の方法。
実施形態238.前記線維症が、肺線維症、特発性肺線維症、腎線維症、肝線維症、肺線維症、腎線維症、骨髄線維症、全身性硬化症、皮膚線維症、心臓線維症、骨髄線維症、角膜線維症、縦隔線維症、後腹膜線維症、骨関節線維症、関節線維症、組織線維症、線維腫増殖性障害、または結合組織障害である、実施形態237に記載の方法。
実施形態239.前記疾患または状態が、筋力低下または萎縮である、実施形態220~232のいずれか1つに記載の方法。
実施形態240.前記疾患または状態が、デュシェンヌ型筋ジストロフィー(DMD)、顔面肩甲上腕型筋ジストロフィー(FSHD)、封入体筋炎(IBM)、筋萎縮性側索硬化症(ALS)、サルコペニア、またはがん悪液質である、実施形態239に記載の方法。
実施形態241.前記疾患または状態が、代謝障害である、実施形態220~232のいずれか1つに記載の方法。
実施形態242.前記代謝障害が、肥満、1型糖尿病、2型糖尿病、または前糖尿病である、実施形態241に記載の方法。
実施形態243.前記疾患または状態が、心臓代謝性疾患である、実施形態220~232のいずれか1つに記載の方法。
実施形態244.前記疾患または状態が、駆出率低下を伴う心不全(HFrEF)または駆出率維持を伴う心不全(HFpEF)である、実施形態243に記載の方法。
実施形態245.前記疾患または状態が、骨損傷である、実施形態220~232のいずれか1つに記載の方法。
実施形態246.前記骨損傷が、骨脱塩、骨粗しょう症(例えば、原発性もしくは二次性)、骨減少症、大理石骨病、骨折、骨癌もしくはがん転移関連の骨損失、パジェット病、腎性骨ジストロフィー、治療関連の骨損失、食事関連の骨損失、肥満の治療に関連する骨損失、低重力関連の骨損失、または不動性関連の骨損失を含む、実施形態245に記載の方法。
実施形態247.前記疾患または状態が、低い赤血球レベルである、実施形態220~232のいずれか1つに記載の方法。
実施形態248.前記疾患または状態が、貧血または失血である、実施形態247に記載の方法。
実施形態249.前記方法が、対象において血管合併症を引き起こさず、対象において血管透過性もしくは漏出を増加させず、赤血球質量を増加させず、ヘモグロビンを増加させず、血小板減少を引き起こさず、及び/または対象において血液合併症を引き起こさない、実施形態220~248のいずれか1つに記載の方法。
本発明は、本発明を例示するために提供される以下の実施例を参照することによってより容易に理解され、その範囲をいかなる方法でも限定するものとして解釈されるべきではない。
別段定義されない限り、または文脈が別段明確に指示しない限り、本明細書で使用される全ての技術用語及び科学用語は、本発明が属する当業者によって一般的に理解されるのと同じ意味を有する。本明細書に記載されるものと同様または同等の任意の方法及び材料を本発明の実施または試験において使用することができることを理解されたい。
実施例1.アクチビンA、アクチビンB、GDF-8、及びGDF-11を中和するが、BMP-9シグナル伝達を中和しないActRIIB-ECDポリペプチド構築物の設計及び特徴付け。
一連のTGFβスーパーファミリー結合剤を調査して、ホメオスタシスに必要なリガンドに低い効力を有しながら、疾患駆動リガンドに高い効力を示したものを同定した。異なる位置におけるActRIIB ECDにおけるアミノ酸置換、ならびにECDとFcドメインとの間の様々なリンカー長を含有するポリペプチドバリアントで構成された薬剤を調べた。これらのTGFβスーパーファミリー結合剤の試験の結果は、以下に記載され、所望のリガンド特異性プロファイルを有するものを強調する。
一連のTGFβスーパーファミリー結合剤を調査して、ホメオスタシスに必要なリガンドに低い効力を有しながら、疾患駆動リガンドに高い効力を示したものを同定した。異なる位置におけるActRIIB ECDにおけるアミノ酸置換、ならびにECDとFcドメインとの間の様々なリンカー長を含有するポリペプチドバリアントで構成された薬剤を調べた。これらのTGFβスーパーファミリー結合剤の試験の結果は、以下に記載され、所望のリガンド特異性プロファイルを有するものを強調する。
例示的な野生型ヒトアクチビン受容体エクトドメイン-Fc融合分子を産生し、特徴付け、ベンチマークタンパク質として使用した。ActRIIB-ECD-Fc(「ACVR2B-Fc」とも称される)及びActRIIA-ECD-Fc(「ACVR2A-Fc」とも称される)は、本明細書では、それぞれ、P75(配列番号174)及びP444(配列番号176)と称される。P75は、トリプルグリシンリンカーによってヒトIgG1 Fcドメインに連結されたヒト野生型ActRIIB ECD(ACVR2Bエクトドメインとも称される)(配列番号2)で構成される。P444も同様に組み立てられたが、エクトドメインは、ヒト野生型ActRIIA ECD(ACVR2Aエクトドメインとも称される)である(配列番号3)。P444(配列番号176)は、ヒトIgG1のFc部分に連結されたアクチビン受容体IIA(ActRIIA)受容体の細胞外ドメインで構成される治験薬候補であるソタテルセプトの配列に対応することに留意されたい(例えば、米国特許第7,612,041号を参照)。P75及びP444のSDS-PAGE分析を図1に示す。観察された分子量及び純度は、予想通りであり、タンパク質のジスルフィド結合ホモ二量体性質は、還元対非還元条件下でのサイズの差によって確認された。
ベンチマーク剤P75(野生型ActRIIB)及びP444(野生型ActRIIA(ソタテルセプト))のアクチビンA、アクチビンB、GDF-8、及びGDF-11阻害効力(IC50)を、以下に記載のTGFβ-レポーターHEK293細胞ベースのアッセイを使用して決定した。P75及びP444は、試験した4つ全てのサイトカイン(アクチビンA、アクチビンB、GDF-8、及びGDF-11)を用量依存的様態で効率的に中和した。IC50値は、平均値を表す。アクチビンA IC50値:P75及びP444については、それぞれ2.3nM及び2.7nM(図2A)。アクチビンB IC50値:P75及びP444については、それぞれ1.4nM及び0.95nM(図2B)。GDF-8 IC50値:P75及びP444については、それぞれ0.67nM及び3.06nM(図2C)。GDF-11 IC50値:P75及びP444については、それぞれ0.76nM及び1.6nM(図2D)。IC50値±SEMを表7に報告する。
ベンチマーク剤P75及びP444のBMP-9及びBMP-10阻害効力(IC50)を、以下に記載されるBMP-レポーターHepG2細胞ベースのアッセイを使用して決定した。P75は、平均IC50値が2.7nMで、用量依存的様態でBMP-9を中和したが、P444は、BMP-9に対してはるかに少ない中和活性を示し、IC50値は100nM超であった(図3A)。P75及びP444は、用量依存的様態でBMP-10を効率的に中和し、P75及びP444の平均IC50値はそれぞれ2.0及び3.7nMであった(図3B)。IC50値を表8に報告する。
疾患の駆動に重要であることが知られているTGFβスーパーファミリーリガンドの高い効力阻害を有する薬剤を生成するために、ActRIIB-ECDポリペプチドバリアントをTGFβ-レポーターHEK293細胞で試験した。ECD構築物の群全体についてのこのアッセイで得られたIC50値を表9に示し、例示的なECD構築物の代表的な結果を図4~7及び図11~14に示す。これらの実施例の中で、P122及びP123は、P75(野生型ActRIIB-ECD)と比較して同一またはわずかに低い効力を有し、すなわち、アクチビンA上のP122及びP123のIC50値は、それぞれ、2.4nM及び5.0nMであり(図4B)、アクチビンB上のIC50値は、2.5nM及び2.8nMであり(図5B)、GDF-8上のIC50値は、0.62及び1.1nMであり(図6B)、GDF-11上のIC50値は、0.71及び1.2nMであった(図7B)。P119、P121、及びP126などの他の例は、野生型ActRIIB-ECD(P75)と比較して、複数のリガンド上でわずかに増加した中和プロファイルを有し、例えば、P121の効力は、P75と比較して、アクチビンA、GDF-8、及びGDF-11でそれぞれ1.7倍、2.3倍、及び1.9倍向上したが(図4A、6A、7A、11C、13C、14C)、アクチビンBでは、P119及びP121の中和効力は、P75と比較してわずかに低かった(図5A及び12Cを参照)。P126の場合、野生型ActRIIB-ECD(P75)と比較して、4つ全てのリガンド上の中和効力が著しく減少した(図4~7、パネルCを参照)。アクチビンA上のP119、P121、及びP126のIC50値は、それぞれ、0.98、1.3、及び>1,000nMであり、アクチビンB上のIC50値は、1.8、2.5、及び>1,000nMであり、GDF-8上のIC50値は、0.64、0.29、及び65nMであり、GDF-11上のIC50値は、0.97、0.40、及び23nMであった。いくつかの試験構築物、特にP120、P125、及びP127は、4つ全てのリガンドを中和する能力を失った(図4~7)。
リンカー長の効果は、野生型ActRIIB ECDの文脈で、ならびにActRIIB ECDの一連の異なる変異の文脈で調べた。例示的なヒトアクチビン受容体エクトドメイン-Fc融合分子を産生し、以下に記載されるように特徴付けた。薬剤P75及びP757は、それぞれ3アミノ酸または14アミノ酸のリンカーを通じてFcに融合した野生型ActRIIB ECDを含有する。IC50値を表9に報告し、図10A~Bに示す。代表的な中和曲線を図11A、12A、13A、及び14Aに示す。P757の効力は、P75と比較して、アクチビンA、アクチビンB、GDF-8、及びGDF-11に対して著しく高く(表9及び図10A)、それぞれ389%、155%、116%、及び124%の増加であった(図10B)。
ActRIIB ECDにおける異なる変異の文脈におけるリンカー長の効果を調べるために、一連の比較を行った。1つの例示的な薬剤の対(P624及びP622)は、それぞれ、ActRIIB ECDの58位にF-E置換を含有し、3アミノ酸または14アミノ酸リンカーを含有する。これらの薬剤のアクチビンA、アクチビンB、GDF-8、及びGDF-11阻害効力(IC50)を、TGFβ-レポーター細胞ベースのアッセイを使用して決定した。IC50値を表9に報告し、図10C~Dに示す。代表的な中和曲線を図4D、5D、6D、及び7Dに示す。アクチビンA及びアクチビンBに対するP622の効力は、低いIC50値によって実証されるように、P624と比較して高いことが見出され(表9及び図10C)、すなわち、アクチビンA及びアクチビンBに対するP622の効力は、P624と比較してそれぞれ295%及び129%増加した(図10D)。興味深いことに、GDF-8及びGDF-11に対するP622及びP624のIC50値は同じであった(表9及び図10C~D)。同じ傾向が、P622(F58E+14aaリンカー+IgG1 DL Fc)及びP121(F58E+3aaリンカー+IgG1 EM Fc)のリガンド結合活性を比較したときに観察され、DL及びEM Fc多型が、本明細書に記載の融合タンパク質の活性に実質的に影響を及ぼさないことが実証された(表9を参照)。
異なるリンカー長を有する別の例示的な薬剤対は、P120(3アミノ酸リンカー)及びP759(14アミノ酸リンカー)であり、各々がActRIIB ECDの57位にD~E置換を有する。IC50値を表9に報告し、図10E~Fに示す。代表的な中和曲線を図4A、5A、6A、7A、11A、12A、13A、及び14Aに示す。P759は、P120と比較して、アクチビンA、アクチビンB、GDF-8及びGDF-11に対して増加した効力を有することが見出され(表9及び図10E)、すなわち、アクチビンA、アクチビンB、GDF-8、及びGDF-11に対するP759の効力は、P120と比較して、それぞれ73%、77%、60%、及び86%増加した(図10F)。
異なるリンカー長を有する別の例示的な薬剤対は、P124及びP761であり、各々がActRIIB ECDの31位にK-Y置換を有し、それぞれ、3アミノ酸または14アミノ酸リンカーを有する。IC50値を表9に報告し、図10G~Hに示す。代表的な中和曲線を図11A及びC、12A及びC、13A及びC、ならびに14A及びCに示す。驚くべきことに、上に提示されたリンカー長を増加させる効果とは対照的に、より長い14アミノ酸リンカーを有する例示的な薬剤P761は、両方のアクチビン及び両方のGDFに対して減少した効力を示し(より高いIC50値を示した)(表9及び図10G)、すなわち、アクチビンA、アクチビンB、GDF-8、及びGDF-11に対するP761の効力は、P124と比較して、それぞれ58%、88%、64%及び61%減少した(図10H)。
異なるリンカー長を有する別の例示的な薬剤対は、P119及びP758であり、各々がActRIIB ECDの27位にG-D置換を有し、それぞれ、3アミノ酸または14アミノ酸リンカーを有する。IC50値を表9に報告し、図10I~Jに示す。代表的な中和曲線を図11A及びC、12A及びC、13A及びC、ならびに14A及びCに示す。予想外に、アクチビンA、アクチビンB、GDF-8、及びGDF-11の効力は全て、より長い14アミノ酸リンカーを有する薬剤では低下し(表9及び図10G)、GDF-8の効力はより顕著に減少し(表9及び図10I)、すなわち、アクチビンA、アクチビンB、GDF-8、及びGDF-11に対するP758の効力は、P119(図10J)と比較して、それぞれ11%、35%、99%、及び44%減少した。
異なるリンカー長を有する別の例示的な薬剤対は、P126(3アミノ酸リンカー)及びP762(14アミノ酸リンカー)であり、各々がActRIIB ECDの75位にV-Q置換を有する。IC50値を表9に報告し、図10K~Lに示す。代表的な中和曲線を図4C、5C、6C、7C、11A、12A、13A、及び14Aに示す。予想外に、この変異の状況において、リンカー長の変化は、効力に影響を与えず、すなわち、P126及びP762は、アクチビンA、アクチビンB、GDF-8及びGDF-11に対して同じ効力を示した(表9及び図10K~L)。
要約すると、Fcドメインに融合したActRIIB ECDからなる例示的な薬剤は、ActRIIB ECDにおけるアミノ酸置換の組成及び位置、ならびにECDとFcドメインとの間のリンカーの長さに応じて異なる効力プロファイルを示した。いくつかの事例において、リンカー長が増加し、減少し、またはリンカー長が増加するにつれて変化しないままであったため、予想外に、リンカー長は、効力プロファイルに差異効果を有した。
中和効力に対するリンカーの延長の予測不可能な効果を更に実証するために、他のリンカー長を、ActRIIB ECDにおける異なるアミノ酸置換との関連で調べた。まず、58位におけるF-E置換を、3アミノ酸(P624)、14アミノ酸(P622及びP1168)、19アミノ酸(P666)、及び39アミノ酸(P667)のリンカー長で調べた。リンカー長を3アミノ酸から14、19、または39アミノ酸に増加させると、アクチビンAの効力が、それぞれ、1.7nM(P624)から0.43(P622)、0.35(P1168)、0.33(P666)、及び0.48(P667)nMに増加した(表9及び図10M)。リンカー長を3アミノ酸から14、19、または39アミノ酸に増加させると、アクチビンBの効力が、それぞれ、2.7(P624)から1.2(P622)、1.1(P666)及び1.7(P667)nMに増加した(表9及び図10N)。これらの結果は、この置換との関連で、リンカーを3から14アミノ酸に増加させたときに両方のアクチビンの効力が増加し、この効力の増加は、より長いリンカー長(19、39アミノ酸)でも維持されたことを示している。GDF-8及びGDF-11の効力を、14、19、及び39アミノ酸のリンカー長で維持した(表9及び図10O~P)。2つの例示的な薬剤P622とP1168との間の唯一の違いは、ActRIIB ECD配列のC末端における「APT」の存在または非存在であることに留意されたい。これらのデータは、効力がACTRIIB ECD配列のC末端におけるAPT配列の存在によって影響されなかったことを確認する。
58位におけるF-Q置換を、6アミノ酸(P1218)、10アミノ酸(P1219)、14アミノ酸(P708)、19アミノ酸(P1220)、及び39アミノ酸(P709)のリンカー長で調べた。この置換の文脈において、リンカー長を増加させることは、アクチビンAに対する効力を段階的に改善した(表9及び図10S)。驚くべきことに、58位のF-E置換とは対照的に、GDF-8に対する効力は、0.80nM(6アミノ酸)から0.72nM(10アミノ酸)、0.55nM(14アミノ酸)、0.55nM(19アミノ酸)、及び0.29nM(39アミノ酸)へのリンカー長の増加とともにも改善した(表9及び図10T)。
58位におけるF-K置換を、3アミノ酸(P698)、6アミノ酸(P1153)、10アミノ酸(P1154)、14アミノ酸(P701)、19アミノ酸(P1155)、及び39アミノ酸(P1156)のリンカー長で調べた。この置換の文脈において、Q置換に関しては、リンカー長を増加させることにより、アクチビンAに対する効力が、主に段階的に改善され(表9及び図10V)、GDF-8に関しては、リンカー長を増加させることにより、効力が、2.1nM(3アミノ酸)から1.5nM(6アミノ酸)及び1.0nM(10アミノ酸)に改善された(表9及び図10W)。興味深いことに、3アミノ酸リンカーによるF-K置換は、野生型と比較してアクチビンAに対して減少した効力を示したが、より長いリンカー長を有するF-K置換は、野生型と比較して増加した効力を示した。
これらの結果は、ActRIIB-ECDにおける単一点アミノ酸置換及びリンカー長の変化の両方が、リガンド阻害効力を調節することができることを実証する。特に、リンカー長の効果は予測不可能であり、ActRIIB-ECDにおけるアミノ酸変異の位置及び所与の位置における特定の置換に応じて、異なるリガンドに対して異なる効果を有した。
ActRIIB-ECDとFcドメインとの間の14アミノ酸リンカー配列に関連して、58位での追加のアミノ酸置換の効果も調査した。F-Y(P694)またはW(P715)の置換を含む例示的な薬剤は、両方とも、アクチビンB、GDF-8、及びGDF-11の効力を維持しながら、野生型(P75、2.3nM)と比較してアクチビンAの効力の向上(それぞれ、0.79及び0.90nMのIC50値)をもたらした(表9及び図11B、12B、13B、及び14B)。F-D(P687)、F-N(P1213)、F-R(P1215)及びF-H(P1217)の置換を含む例示的な薬剤もまた調査した。アクチビンA上のIC50値は、P687、P1213、P1215、及びP1217がそれぞれ2.0、1.5、0.58、及び0.59nMであった(表9及び図11D)。アクチビンB上のIC50値は、P687について8.8nMであった(表9及び図12D)。GDF-8上のIC50値は、P687、P1213、P1215、及びP1217についてそれぞれ1.4、1.1、0.99、0.56nMであった(表9及び図13D)。GDF-11上のIC50値は、P687について0.85nMであった(図14D)。これらの結果は、ActRIIB-ECDにおける変異の位置に加えて、特定の位置におけるアミノ酸置換の性質が、選択されたリガンドに対する効力を減少、増加させるか、または変化させないことを実証する。
次に、ActRIIB-ECDにおける異なる変異を組み合わせた効果を調査した。例示的な薬剤としては、P441(P121配列と組み合わせたP119からの点変異)、P718(P624配列と組み合わせたP120からの点変異)、P719(P622配列と組み合わせたP122からの点変異)、及びP720(P622配列と組み合わせたP123からの点変異)が挙げられる。アクチビンA上のIC50値は、P441、P718、P719、及びP720について、それぞれ0.67、>1,000、0.63、及び0.97nMであった(図11B~C)。アクチビンB上のIC50値は、P441、P718、P719、及びP720について、それぞれ28、>1,000、2.3、及び2.7nMであった(図12B~C)。GDF-8上のIC50値は、P441、P718、P719、及びP720について、それぞれ0.60、>1,000、0.61、及び0.77nMであった(図13B~C)。GDF-11上のIC50値は、P441、P718、P719、及びP720について、それぞれ0.73、>1,000、0.58、及び0.54nMであった(図14B~C)。これらの結果は、58位の変異によって得られたリガンド阻害効力の変化が、ActRIIB-ECDにおける他の変異に感受性であり得ることを実証する。
まとめると、これらの結果は、TGFβスーパーファミリーリガンドの阻害効力に対するECDとFcドメインとの間のリンカーの異なる長さと組み合わせたActRIIB-ECDにおける異なる点変異の異なる効果を示す。ActRIIB-ECDにおけるいくつかの点変異は、いずれのリガンドの阻害効力にも影響しなかったが、他の点変異は、選択されたリガンドにおける阻害効力を著しく変化させた。更に他の点変異は、試験した全てのリガンドについて、ActRIIB-ECDの中和活性を無効にした。注目すべきことに、P119、P121、及びP624は、試験した両方のベンチマークタンパク質(ActRIIB-Fc及びActRIIA-Fc)と比較して、アクチビンA、GDF-8、及びGDF-11について改善された中和(阻害効力)を示した。他の例示的な薬剤P622、P666、P667、P708、P709、P1168、及びP1220は、ベンチマークタンパク質と比較して、アクチビンA、アクチビンB、GDF-8、及び/またはGDF-11の優れたまたは等しい中和を示した。更に他の例示的な薬剤(P701、P1155、及びP1156)について、アクチビンA及びアクチビンBに対する効力は改善されたが、GDF-8及びGDF-11に対する効力は適度に影響された。アクチビンA、アクチビンB、GDF-8、及びGDF-11は、PAHの病態生理学において重要な役割を果たすと考えられているため、これらの結果は、P119、P121、P622、P624、P666、P667、P701、P708、P709、P1155、P1156、P1168、及びP1220によって例示されるようなかかる改善された薬剤が、PAH及び関連する状態の治療に特に有用であり得ることを示唆する。注目すべきことに、例えば、FからE、K、及びQに置換された58位を有するものなどのある特定の例示的な薬剤は、より長いリンカー長(例えば、10以上のアミノ酸)の文脈で、アクチビンA及びアクチビンBに対して高い中和効力を示し、かかる改善された薬剤は、PAH及び関連する状態の治療に特に有用であり得ることを強調する。
結果はまた、ActRIIB-ECDとFcドメインとの間のリンカー配列を延長することが、いくつかのリガンドでは選択的に効力を増加させたが、他のリガンドでは増加させなかったことを示す。例えば、P622、P1168、P666、及びP667(14アミノ酸~39アミノ酸のリンカーによるF58E置換)は、P624(3アミノ酸リンカーによるF58E置換)と比較して、アクチビンA及びアクチビンBに対する効力の増加を示したが、GDF-8及びGDF-11に対する効力の検出可能な差はなかった。特に、このシリーズでは、試験した任意のリガンドについて、リンカー長を14から39アミノ酸に増加させた場合、効力は更に増加しなかったが、P1156及びP709(それぞれ、F58K及びQ置換を有する39アミノ酸リンカー)については、アクチビンAに対する効力は、それぞれP701及びP708(14アミノ酸リンカー)と比較して増加した。これらの結果は、リンカー長の変化が、ActRIIB-ECDにおける特定の変異及び特定のリガンドに応じて、阻害効力に予測不可能な効果を有することを示す。
最後に、これらのデータはまた、ActRIIB-ECD内の他の変異をF58での置換と組み合わせる効果が予測不可能であることを示す。特に、P719及びP720は、対応する単一変異体のものに対して中間のアクチビンA、アクチビンB、GDF-8、及びGDF-11に対する効力を有した(対応する単一変異体は、P719についてP122及びP622、ならびにP720についてP123及びP622である)。しかしながら、P441は、対応する単一変異体(P119及びP121)のいずれかよりも、アクチビンBに対して低い効力を示し、その特定のサイトカインに対する両方の変異の複合効果を示した。また、P718(P120からの点変異を有するP622)は、試験したサイトカインのうちのいずれにも活性を示さず、F58E変異がP120で観察された効力の喪失を救うことができなかったことを示唆した。
薬剤のBMP-9及びBMP-10中和活性の特徴付け。アクチビンA、アクチビンB、GDF-8、及びGDF-11中和について評価した例示的な結合剤もまた、BMPレポーターアッセイで試験した。結合剤の群全体についてのこれらのアッセイで得られたIC50値を表10に提示し、結果を図8~9に示す。これらの実施例の中で、P122及びP123は、P75に対して効力の適度な変化を有した。BMP-9上のIC50値は、P122及びP123についてそれぞれ2.7nM及び8.4nMであった(図8B)。BMP-10上のIC50値は、P122及びP123についてそれぞれ2.7nM及び3.9nMであった(図9B)。例示的な薬剤P121は、BMP-9(図8A)上のP75と比較して、阻害効力を著しく低減したが、BMP-10(図9A)上の阻害効力は低減しなかった。別の薬剤、P119は、BMP-10(図16C)ではなく、BMP-9(図15C)に対する阻害を著しく増加させた。BMP-9上のIC50値は、P119及びP121についてそれぞれ1.3及び868であったが、BMP-10上のIC50値は、P119及びP121についてそれぞれ2.1及び1.0であった(表10)。P120、P125、P126、及びP127などの他の例示的な薬剤は、BMP-9及びBMP-10の両方を中和する能力を失った。
アクチビン及びGDFについて行われたように、BMP-9及びBMP-10の効力に対するリンカー長の効果を、ActRIIB ECDにおける一連の異なる変異について調べた。まず、野生型エクトドメインを、例示的な薬剤P75(3アミノ酸リンカー)及びP757(14アミノ酸リンカー)を使用して検査した。IC50値を表10に報告し、図10A~Bに示す。代表的な中和曲線を図15A及び16Aに示す。P757の効力は、BMP-9及びBMP-10に対してP75と比較してより高く(表9及び図10A)、それぞれ900%及び67%の増加であった(図10B)。BMP9阻害は患者における毒性と関連付けられるため、この結果は、野生型ActRIIB ECDの文脈におけるリンカー長の増加が望ましくない効果をもたらしたことを示す。
次の薬剤対(それぞれ、P624及びP622、3及び14アミノ酸リンカー)について、IC50値を表10に報告し、図10C~Dに示す。代表的な中和曲線を図8D及び9Dに示す。この場合、BMP-9及びBMP-10に対するP622の効力は、P624(図10C)と比較して高いことを見出した(それぞれ153%及び77%増加した;図10D)。特に、BMP-9に対する効力のこの増加パーセントは、野生型ActRIIB ECD(P757、上述)の文脈におけるよりもはるかに小さく、BMP-9に対する効力の増加の望ましくない効果が、P624/P622におけるActRIIB ECDの変異の文脈において低減されたことを示す。
次の例示的な薬剤対(P120及びP759、それぞれ3及び14アミノ酸リンカー)のIC50値を表10に報告し、図10E~Fに示す。代表的な中和曲線を図8A、9A、15A、及び16Aに示す。予想外に、この例では、P759は、BMP-9及びBMP-10において、P120と同じ効力を有することが見出された(図10E~F)。他の2つの例示的な3及び14アミノ酸リンカー対、すなわち、P119及びP758(表10、図10I~J、図15A及びC、ならびに16A及びC)、ならびにP126及びP762(表10、図10K~L、図8C及び9C、15A、ならびに16A)もまた、BMP-9及びBMP-10に対して同じ効力を示した。
次の対(それぞれ、P124及びP761、3及び14アミノ酸リンカー)について、IC50値を表10に報告し、図10G~Hに示す。代表的な中和曲線を図15A及びC、ならびに16A及びCに示す。驚くべきことに、この例では、例示的な薬剤P761(より長いリンカー)は、P124(短いリンカー)と比較してBMP-10に対して変化を示さず、P124と比較してBMP-9に対して83%の効力の増加を示す(図10G~H)。
要約すると、アクチビン及びGDFリガンドの場合と同様に、Fcドメインに融合したActRIIB ECDを含む例示的な薬剤は、ActRIIB ECDにおけるアミノ酸置換の位置及び性質に応じて、BMP-9及びBMP-10リガンドの効力プロファイルに対するリンカー長の異なる効果を示した。上記のように、いくつかの事例において、効力は影響を受けなかったが、他の場合では効力が増加した。
リンカーを延長する効果を更に調べるために、他のリンカー長をBMP-9及びBMP-10の効力に対するそれらの効果についても試験した。58位でのF-E置換の文脈において、リンカー長を3アミノ酸から14、19、または39アミノ酸に増加させることは、BMP-9及びBMP-10に対する効力の適度な増加を示した(表10及び図10Q~R)。上述のように、この増加は、野生型ActRIIB ECDの文脈で見られたものよりもかなり少なかった。58位におけるF-Q置換の文脈において、リンカー長を増加させることは、BMP-9効力に対する最小限の効果を有した(表10及び図10U)。58位におけるF-K置換の文脈において、リンカー長を増加させることは、BMP-9の効力が657nM(P698)から170nM(P1153)に増加した(表10及び図10X)。
ActRIIB-ECDの58位における追加のアミノ酸置換の効果もまた、BMP-レポーターアッセイで調査した。上記のF-E(P622)、K(P701)、及びQ(P708)からの置換に加えて、F-Y(P694)、W(P715)、D(P687)、N(P1213)、R(P1215)、及びH(P1217)からの置換を、14アミノ酸リンカーの文脈において調査した。これらの置換は全て、P622、P701、及びP708(それぞれ、F-E、K、またはQ)で観察されたように、野生型ActRIIB ECDと比較して、BMP-9(表10及び図15B、15D、及び16B)の効力の著しい減少を示した。これらの結果は、58位のアミノ酸置換に応じて変化するBMP-9及びBMP-10の効力を示すが、野生型と比較してBMP-9の効力の著しい低減は、全ての場合において維持された。
最後に、ActRIIB ECDにおける異なる変異を組み合わせる効果を調査した(例示的な薬剤P441、P718、P719、及びP720)。BMP-9上のIC50値は、P441、P718、P719、及びP720について、それぞれ362、>1,000、>100、及び914nMであった(図15B~C)。BMP-10上のIC50値は、P441、P718、P719、及びP720について、それぞれ1.0、>1,000、1.7、及び2.3nMであった(図16B~C)。これらの結果は、アクチビン及びGDFリガンドに関して、58位での変異によって得られたBMP-9及びBMP-10の阻害効力の変化が、ActRIIB ECDにおける他の変異に感受性があることを実証する。
総合すると、これらの結果は、ActRIIB ECDの効力プロファイルに対する様々な点変異の異なる効果を示す。いくつかの点変異は、試験したリガンドの阻害効力に影響を及ぼさなかった。いくつかの点変異は、いくつかのリガンドの阻害効力を変化させたが、他のリガンドは変化させなかった。またいくつかの点変異は、試験した全てのTGFβスーパーファミリーリガンドの阻害効力を変化させた。注目すべきことに、P121、P441、P622、P624、P666、P667、P687、P701、P708、P709、P719、P720、P1155、P1156、P1168、P1213、P1215、P1217、及びP1218は、P75(野生型ActRIIB ECD)と比較してBMP-9の著しく減少した中和を示した。BMP-9に対するこの減少した効力は、BMP-9阻害と関連付けられた毒性を回避するために望ましいため、結果は、かかる薬剤が治療上特に有用であり得ることを示唆する。
要約すると、我々の結果は、特定のリンカー長の文脈におけるActRIIB-ECDにおけるある特定の点変異が、ある特定のTGFβスーパーファミリーリガンド、特にPAH病態生理学に関与するもの、すなわち、アクチビンA、GDF-8、及びGDF-11の阻害効力の著しい増加をもたらしたことを示す。
結果はまた、P121、P698、及びP1218における単一点変異が、野生型ActRIIA(P444、ソタテルセプト)と比較して、アクチビンA、GDF-8、及びGDF-11に対してより高い中和効力もたらしたことを示す。具体的には、P121単一点変異は、P444と比較して、アクチビンA、GDF-8、及びGDF-11の2.1倍、11倍、及び4.0倍高い阻害効力をもたらした。P698単一点変異は、P444と比較して、GDF-8の1.5倍高い阻害効力をもたらした。P1218単一点変異は、P444と比較して、アクチビンA及びGDF-8の2.5倍及び1.5倍高い阻害効力をもたらした。重要なことに、P121、P687、P698、P1213、P1215、P1217、及びP1218における単一点変異はまた、非変異(野生型)ActRIIB ECDと比較して、BMP-9に対する阻害効力の著しい減少につながった。これにより、P444と比較して、BMP-9に対するP121及びP698の中和効力が低くなり、すなわち、BMP-9阻害効力は、P444と比較して、P121及びP698に対してそれぞれ3.5倍及び2.6倍低かった。まとめると、これらの結果は、P444(ソタテルセプト)と比較して、これらの例示的な薬剤のための潜在的により広い治療期間を示唆し、すなわち、それらは、アクチビンA、GDF-8及び/またはGDF-11に対するそれらのより高い効力に起因するある特定の疾患の治療のための優れた治療有効性を有する一方で、BMP-9に対するそれらのより低い効力に起因するより良い安全性プロファイルを有し得る。
更に、ActRIIB ECDとFcドメインとの間のリンカーの長さを増加させると、ある特定のリガンドに対する中和効力が増加した。驚くべきことに、P622及びP1168(14アミノ酸リンカー)は、P624(3アミノ酸リンカー)と比較して、アクチビンAではそれぞれ4.0倍及び4.9倍、アクチビンBでは2.3倍の阻害効力を示した(表9及び図10C)。別の例示的な薬剤であるP1156(39アミノ酸リンカー)は、P698(3アミノ酸リンカー)と比較して、アクチビンA及びGDF-8で13倍及び1.6倍増加した阻害効力を示した。最後に、P709(39アミノ酸リンカー)は、P1218(6アミノ酸リンカー)と比較して、アクチビンA及びGDF-8で2.6倍及び2.8倍増加した阻害効力を示した。これらの例示的な薬剤の対はリンカー長だけが異なるため、これらの結果は、ActRIIB ECDのある特定の変異の文脈における特定のリガンドの効力に対するリンカー長の驚くべき影響を強調する。
特に、効力の結果はまた、リンカーの長さを増加させることは、選択された病理学的リガンドの効力を増加させるのに有益であり得るが、このアプローチは、それ自体では、望ましい治療窓を有する薬剤、すなわち、BMP-9の効力が著しく低減した薬剤、及び病理学的リガンドの効力が高い薬剤を得るのに十分ではなかったことを実証する。これは、ActRIIB ECD(例えば、P622、P624、P666、P667、P1168のようなF58E;P698、P701、P1153、P1154、P1155、P1156のようなF58K;またはP708、P709、P1218、P1219、P1220のようなF58Q)における特定の変異を、より長いリンカー長(例えば、少なくとも10アミノ酸)と組み合わせることによってのみ達成された。この点は、P622、P701、及びP708をP757(野生型エクトドメイン)と比較することによって示され、これらは全て14アミノ酸リンカーを有する。P757は、病理学的リガンドに対して高い効力を有したが、試験した任意の構築物のBMP-9に対しても最も高い効力を有した。したがって、P757は、BMP-9阻害と関連付けられた毒性を促進すると予想される。
実施例1のための実験手順。
TGFβスーパーファミリーリガンドを中和するActRIIB-ECD融合タンパク質の産生、精製、及び特徴付け。
全ての構築物は、発現時にN末端に分泌シグナル配列(配列番号1)を含んだ。構築物をコードする相補的cDNAを合成的に調製した(Genscript,Piscataway,NJ)。cDNAを、pTT5哺乳動物発現プラスミドベクター(Durocher et al.,2002)のEcoR1(5’末端)及びBamH1(3’末端)にクローニングした。シグナルペプチドは、発現中に細胞内で切断され、精製された融合タンパク質に含まれなかった。融合タンパク質の発現に使用される代表的なcDNA配列を以下に要約する。
TGFβスーパーファミリーリガンドを中和するActRIIB-ECD融合タンパク質の産生、精製、及び特徴付け。
全ての構築物は、発現時にN末端に分泌シグナル配列(配列番号1)を含んだ。構築物をコードする相補的cDNAを合成的に調製した(Genscript,Piscataway,NJ)。cDNAを、pTT5哺乳動物発現プラスミドベクター(Durocher et al.,2002)のEcoR1(5’末端)及びBamH1(3’末端)にクローニングした。シグナルペプチドは、発現中に細胞内で切断され、精製された融合タンパク質に含まれなかった。融合タンパク質の発現に使用される代表的なcDNA配列を以下に要約する。
CHO及び/または29全て3細胞で効率的に発現されたのタンパク質、ならびにプロテインA親和性クロマトグラフィーを使用した各タンパク質の精製は類似していた。多くの特性は、バリアント間で非常に類似していたが、SEC-HPLCによって測定され、不適切な折り畳みを示す凝集の可能性は、いくつかの区別を明らかにした。ベンチマークタンパク質(すなわち、野生型ActRIIA-ECD-Fc(P444)及び野生型ActRIIB-ECD-Fc(P75))について、純度(すなわち、単量体含有率)は、それぞれ、P444及びP75について、99%及び85%の単量体含有率であった。いくつかの例示的な薬剤、すなわちP122、P125、P126、P127、及びP687は、それぞれ82、81、85、86、及び88%の単量体含有量を有するP75のものと同等の凝集レベルを有した。他の薬剤は、それぞれ78%及び73%の単量体含有量でP120及びP123に例示されるように、P75と比較してわずかに低い単量体含有量を示した。驚くべきことに、いくつかのバリアントP121、P622、P624、P666、P667、P694、P701、P708、P715、P718、P719、及びP720は、全てP75と比較してActRIIB-ECDの同じ位置に変異を含有し、それぞれ96、95、99、98、99、91、97、98、91、96、96、及び94%の単量体含有量で、著しく高い単量体含有量を示した。
図1A及び1Bは、非還元(図1A)及び還元(図1B)の両方の条件下での、例示的な精製タンパク質(P)120、121、123、及び125(それぞれ、P120、P121、P123、及びP125として示されるレーンを参照)のポリアクリルアミドゲル電気泳動分析を示す。観察された各タンパク質の分子量及び純度は、予想通りであり、タンパク質のジスルフィド結合ホモ二量体性質は、還元対非還元条件下でのサイズの差によって確認された。SEC-HPLC結果と一致して、いくつかの薬剤、例えば、P120及びP123は、凝集を表す可能性が高い高分子量バンドを示した。逆に、他の薬剤は、非常に低い高分子量バンドを有した。
これらの結果は、ActRIIBエクトドメインにおける点変異が、構築物の製造可能性プロファイルに予測不可能かつ予期せぬ結果をもたらしたことを実証する。特に、P121、P622、P624、P666、及びP667(配列番号5のActRIIB-ECDバリアントを含む)は、野生型受容体エクトドメインを含むFc融合体と比較して優れた単量体含有量を示した(P75)。
細胞ベースのアッセイにおけるTGFβスーパーファミリーリガンドを中和するActRIIB-ECD融合タンパク質の分析。
融合タンパク質のアクチビンA、アクチビンB、GDF-8、及びGDF-11阻害効力(IC50)の特徴付けを、細胞ベースのレポーターアッセイを使用して行った。TGFβレポーターHEK293細胞をInvivoGen(San Diego,CA、カタログ番号hkb-tgfb)から入手し、製造業者の指示に従って維持した。手短に言えば、細胞を、10%熱不活性化FBS、30μg/mLのブラスチシジン、250μg/mLのヒグロマイシンB、及び100μg/mLのゼオシン(以下、「成長培地」)を含有する高グルコースDMEMで成長させた。細胞が70~80%のコンフルエンスに達すると、フラスコを穏やかにタップすることによって、細胞を成長培地中で分離した。全てのアッセイについて、細胞を、成長培地中の1ウェル当たり20,000個の細胞の密度で96ウェルプレートに播種した。細胞を室温(RT)で10分間付着させた後、37℃のインキュベーター(5% CO2)に一晩移した。翌日、適切な濃度の薬剤とアクチビンA、アクチビンB、GDF-8、またはGDF-11を室温で30分間組み合わせることによって処理を調製した(150rpmで振盪)。処理は、高グルコースDMEM(無血清かつ選択剤なし)で実施し、サイトカイン(リガンド)の最終濃度は0.3nMであった。成長培地を培養プレートから除去し、細胞を、融合タンパク質及びサイトカインの適切な混合物で処理した。処理期間は、37℃で18~22時間であった(5% CO2)。全ての処理は、技術的に複製して行い、各サイトカインについて少なくとも2つの独立した実験を実施した。処理期間の終了時に、上清を新しいプレートに移し、300rpmで3分間遠心分離した。各条件からの40μLの上清を新しいプレートに移し、そこに180μLのQuanti-Blue試薬(InvivoGen、カタログ番号rep-qbs)を添加した。Quanti-Blue試薬を、製造業者の指示に従って調製した。試料を37℃で45分間インキュベートした。インキュベーションの終わりに、吸光度を650nmで読み取った。データをGraphPad Prismにおいてプロットし、これを使用して、非線形回帰としてIC50値を算出した。
融合タンパク質のアクチビンA、アクチビンB、GDF-8、及びGDF-11阻害効力(IC50)の特徴付けを、細胞ベースのレポーターアッセイを使用して行った。TGFβレポーターHEK293細胞をInvivoGen(San Diego,CA、カタログ番号hkb-tgfb)から入手し、製造業者の指示に従って維持した。手短に言えば、細胞を、10%熱不活性化FBS、30μg/mLのブラスチシジン、250μg/mLのヒグロマイシンB、及び100μg/mLのゼオシン(以下、「成長培地」)を含有する高グルコースDMEMで成長させた。細胞が70~80%のコンフルエンスに達すると、フラスコを穏やかにタップすることによって、細胞を成長培地中で分離した。全てのアッセイについて、細胞を、成長培地中の1ウェル当たり20,000個の細胞の密度で96ウェルプレートに播種した。細胞を室温(RT)で10分間付着させた後、37℃のインキュベーター(5% CO2)に一晩移した。翌日、適切な濃度の薬剤とアクチビンA、アクチビンB、GDF-8、またはGDF-11を室温で30分間組み合わせることによって処理を調製した(150rpmで振盪)。処理は、高グルコースDMEM(無血清かつ選択剤なし)で実施し、サイトカイン(リガンド)の最終濃度は0.3nMであった。成長培地を培養プレートから除去し、細胞を、融合タンパク質及びサイトカインの適切な混合物で処理した。処理期間は、37℃で18~22時間であった(5% CO2)。全ての処理は、技術的に複製して行い、各サイトカインについて少なくとも2つの独立した実験を実施した。処理期間の終了時に、上清を新しいプレートに移し、300rpmで3分間遠心分離した。各条件からの40μLの上清を新しいプレートに移し、そこに180μLのQuanti-Blue試薬(InvivoGen、カタログ番号rep-qbs)を添加した。Quanti-Blue試薬を、製造業者の指示に従って調製した。試料を37℃で45分間インキュベートした。インキュベーションの終わりに、吸光度を650nmで読み取った。データをGraphPad Prismにおいてプロットし、これを使用して、非線形回帰としてIC50値を算出した。
融合タンパク質のBMP-9及びBMP-10阻害効力(IC50)の特徴付けを、第2の細胞ベースのレポーターアッセイを使用して行った。ヒト肝臓HepG2細胞を、SEAPコードプラスミドでトランスフェクトし、ここで、SEAPの発現は、マウスId1プロモーターの制御下にある。このトランスフェクションから安定なプールを生成した。細胞を、10%熱不活性化FBS及び200μg/mLのゼオシン(以下、「HepG2成長培地」)を含有するEMEM中で成長させた。細胞が70%コンフルエンスに達すると、それらをPBSで洗浄し、0.25%トリプシンを使用して分離した。全てのアッセイについて、細胞を、HepG2成長培地中の1ウェル当たり100,000細胞のコンフルエンスで96ウェルプレートに播種した。細胞を室温で10分間付着させた後、37℃のインキュベーター(5% CO2)に一晩移した。翌日、適切な濃度の薬剤をBMP-9またはBMP-10と室温で30分間組み合わせることによって(150rpmで振盪)、EMEM(2.5%の熱不活化FBS及び選択剤なし)で処理を調製した。処理をEMEM(2.5%熱不活性化FBS及び選択剤なし)で実施し、BMP-9及びBMP-10の最終濃度は、それぞれ2ng/mL及び40ng/mLであった。HepG2成長培地を培養プレートから除去し、細胞を、融合タンパク質及びサイトカインの適切な混合物で処理した。処理期間は、37℃で22~24時間であった(5% CO2)。全ての処理は、技術的に複製して行い、各サイトカインについて少なくとも2つの独立した実験を実施した。処理期間の終了時に、上清を新しいプレートに移し、300rpmで3分間遠心分離した。各条件からの40μLの上清を新しいプレートに移し、そこに180μLのQuanti-Blue試薬を添加した。Quanti-Blue試薬を、製造業者の指示に従って調製した。試料を、Quanti-Blue試薬を用いて37℃で5時間インキュベートした。インキュベーションの終わりに、吸光度を650nmで読み取った。データをGraphPad Prismにおいてプロットし、これを使用して、非線形回帰としてIC50値を算出した。
実施例2:薬物動態(PK)特性が改善されたActRIIB-ECDポリペプチド構築物。
選択されたTGFβスーパーファミリーリガンド結合剤及び中和剤のPK特性を調べて、ActRIIB ECDの変異がインビボでの曝露に影響を及ぼし得るかを決定した。例示的な薬剤P121を10mg/kgまたは50mg/kgの用量で野生型(WT)マウスに腹腔内注射し、血清調製のために注射後3時間及び96時間に血液を採取した。比較のために、ベンチマーク剤野生型ActRIIB-ECD-Fc(P75)をWTマウスの第2の群に注入した。血清中の各タンパク質の濃度は、以下に記載のELISAベースの方法を使用して決定した。96ウェルプレートを、炭酸塩-重炭酸塩緩衝液中で1/6,000の希釈で、抗ヒトIgG抗体(Sigma #I2136)の100μL/ウェル溶液で4℃で一晩コーティングした。緩衝液で3回洗浄した後、300μLの遮断緩衝液(PBS中の1% BSA)を各ウェルに加え、プレートを室温で1時間インキュベートした。各薬剤の標準曲線を、12連続希釈液(3倍)を調製した薬剤の900ng/mlストックを調製することによって調製した。100μLの各希釈液を、96ウェルプレートに二重に添加した。血清試料について、これらを氷上で解凍し、アッセイ希釈液(PBS中0.5% BSA、0.05% Tween-20)で適切に希釈し、各希釈液100μLを、96ウェルプレートに二重に添加した。室温で1.5時間インキュベートした後、プレートをアッセイ希釈液で3回洗浄した。結合剤の検出のために、アッセイ希釈液中1/6,000の希釈でビオチンにコンジュゲートされた第2の抗ヒトIgG抗体(Thermo A18821)の100μL/ウェル溶液を各ウェルに添加し、室温で1時間インキュベートした。3回洗浄した後、標準熱量測定法を使用して、ストレプトアビジン-HRPを使用して結合を明らかにした。
選択されたTGFβスーパーファミリーリガンド結合剤及び中和剤のPK特性を調べて、ActRIIB ECDの変異がインビボでの曝露に影響を及ぼし得るかを決定した。例示的な薬剤P121を10mg/kgまたは50mg/kgの用量で野生型(WT)マウスに腹腔内注射し、血清調製のために注射後3時間及び96時間に血液を採取した。比較のために、ベンチマーク剤野生型ActRIIB-ECD-Fc(P75)をWTマウスの第2の群に注入した。血清中の各タンパク質の濃度は、以下に記載のELISAベースの方法を使用して決定した。96ウェルプレートを、炭酸塩-重炭酸塩緩衝液中で1/6,000の希釈で、抗ヒトIgG抗体(Sigma #I2136)の100μL/ウェル溶液で4℃で一晩コーティングした。緩衝液で3回洗浄した後、300μLの遮断緩衝液(PBS中の1% BSA)を各ウェルに加え、プレートを室温で1時間インキュベートした。各薬剤の標準曲線を、12連続希釈液(3倍)を調製した薬剤の900ng/mlストックを調製することによって調製した。100μLの各希釈液を、96ウェルプレートに二重に添加した。血清試料について、これらを氷上で解凍し、アッセイ希釈液(PBS中0.5% BSA、0.05% Tween-20)で適切に希釈し、各希釈液100μLを、96ウェルプレートに二重に添加した。室温で1.5時間インキュベートした後、プレートをアッセイ希釈液で3回洗浄した。結合剤の検出のために、アッセイ希釈液中1/6,000の希釈でビオチンにコンジュゲートされた第2の抗ヒトIgG抗体(Thermo A18821)の100μL/ウェル溶液を各ウェルに添加し、室温で1時間インキュベートした。3回洗浄した後、標準熱量測定法を使用して、ストレプトアビジン-HRPを使用して結合を明らかにした。
結果を図17Aに示し、10mg/kgの注射後のP75及びP121の両方の平均血清濃度が3時間時点で同等であったことを示す。同様に、50mg/kgの注射後の薬剤の濃度もまた、3時間後に同等であった。注射の96時間後に、薬剤間の血清濃度の顕著な差が観察された。例えば、3時間から96時間の時点までに10mg/kgで投与されたP75の濃度の減少は51.1%であったが、P121の濃度は39.9%のみ減少した。P75とP121との間の減少の同様の差は、50mg/kgの注射後にも見られ、P75は、P121の57.2%と比較して73.3%減少した。
別の研究では、8~10週齢の雄のC57BL/6 WTマウスを計量し、所与の用量レベル(1、3、10、25、または50mg/kg;n=試験薬剤当たりの用量当たり6)のビヒクル(n=6)または試験薬剤処置群(P622またはP75)のいずれかに無作為に割り当てた。次いで、マウスを、0、3、7、10、14、17、及び21日目に対応して、週2回、21日間、皮下的に処置した。各治療日に、体重を記録し、それに応じて用量を調整した。生存中の全血試料を、指定された時点で顔面静脈から収集し、血清に処理した。試験薬剤の血清濃度は、上で概説したように決定した。
P622及びP75の血清濃度を、3週間の過程にわたって(最初の注射の3時間後、その後の各注射の直前、及び寿命の終わりに)測定した。推定曝露は、研究の過程にわたって各試験薬剤及び用量レベルのPKプロファイルから算出した。薬剤濃度は、各投薬サイクルの終わりに、すなわち、次の注射の直前の最小試験薬剤濃度(トラフ濃度)で測定されたため、曝露推定値は、AUC(トラフ下)と称される。図17Bに示されるように、P622の曝露は、全ての用量レベルでP75の曝露よりも高く、すなわち、AUC(トラフ下)は、P75よりもP622について平均で2倍高かった。これらの結果は、野生型hActRIIB-ECD-Fc(P75)が、P622よりもマウスにおいて高いクリアランス及び/または低いバイオアベイラビリティを有することを示す。これらの結果は、野生型と比較して同じまたはより悪いPK特性を示す以前の変異したActRIIBエクトドメインとは対照的に(Attie et al.,2014、Tao et al.,2019を参照)、例示的な薬剤P622における変異したエクトドメインは、予想外に改善された曝露をもたらしたことを示す。
これらの結果は、改善された治療有効性プロファイル(上記の実施例を参照)を有することに加えて、ActRIIB ECDにおける単一のアミノ酸変異を有するP121及びP622によって例示されるような薬剤がインビボで改善されたPK特性を示したことを実証する。
実施例3:ActRIIB-ECDポリペプチド構築物は、体重及び筋肉量を増加させることができる。
選択された薬剤を試験して、体重及び筋肉量に対するそれらの効果を調べ、それらがインビボでActRIIB-Fc(P75)とどのように比較されたかを調べた。2つの例示的な薬剤、P622及びP624を、4mg/kgまたは16mg/kgの用量で、WT C57BL/6雌マウス(8~10週間)に2週間、週2回腹腔内に注射した。対照剤P75を、16mg/kgのみで同様に注射した。全ての動物の体重を週2回記録し、研究の終了時に5つの異なる筋肉群(骨格筋:腓腹筋、大腿四頭筋、胸筋、及び上腕三頭筋;ならびに心筋:心臓)を収集した。
選択された薬剤を試験して、体重及び筋肉量に対するそれらの効果を調べ、それらがインビボでActRIIB-Fc(P75)とどのように比較されたかを調べた。2つの例示的な薬剤、P622及びP624を、4mg/kgまたは16mg/kgの用量で、WT C57BL/6雌マウス(8~10週間)に2週間、週2回腹腔内に注射した。対照剤P75を、16mg/kgのみで同様に注射した。全ての動物の体重を週2回記録し、研究の終了時に5つの異なる筋肉群(骨格筋:腓腹筋、大腿四頭筋、胸筋、及び上腕三頭筋;ならびに心筋:心臓)を収集した。
4mg/kgで、P622及びP624は、ビヒクル処置マウスと比較して、全体重において同様の増加を示した(図18)。16mg/kgでは、P624は、(4mg/kgでのP624と比較して)全体重の更なる増加を引き起こし、この増加は、16mg/kgでのP75によって引き起こされるものと同様であった。対照的に、研究の全期間を通して16mg/kgのP622は、一貫して、他の全ての群と比較して体重のより大きな増加を誘導した。これらのデータは、P624(短いリンカー)と比較したP622(長いリンカー)の改善された効力プロファイルが、体重に関してより良いインビボの有効性に翻訳されたことを強調する。
本研究では、筋肉量に対する効果も検討した。4mg/kgで投与された場合、P622及びP624の両方が、分析された全ての骨格筋群において同様の増加を生じた(図19)。これらの増加は、16mg/kgで投与されたP75と比較してわずかに低く、野生型ActRIIB-Fcと比較して低用量レベルで投与された場合でも、P622及びP624が筋肉成長にほぼ同じ効果を有することを実証した(P75)。16mg/kgで、P624は、4mg/kgで注射されたときと比較して、骨格筋成長のわずかな追加の増加のみを引き起こした。対照的に、P622は、4mg/kgと比較して、16mg/kgで全ての筋肉群にわたって非常に高く著しい追加の増加を誘導し、P624に対してその優れた有効性を示した。これらのデータは、P622におけるP624と比較したリンカー長の増加の有益な影響を実証し、P624の効力プロファイルが筋肉肥大を最大限に誘導するのに十分ではないことを示す。これらの結果は、GDF-8がげっ歯類において筋肉量の主要な調節因子であると考えられ、GDF-8に対するP622及びP624の効力がほぼ同じであることを考慮すると、特に驚くべきものである。
筋肉遺伝子発現に対する例示的な薬剤の効果も調べた。大腿四頭筋において、全ての用量(4または16mg/kg)でP75、P622、及びP624は、Mss51 mRNAレベルを著しく減少させ(図19E)、Igf2遺伝子発現レベルを著しく増加させた(図19F)。Mss51は、GDF-8阻害によって下方制御され、Mss51の機能喪失は、マウスにおける骨格筋脂肪酸の酸化、解糖、及び酸化リン酸化の増加、ならびに食事誘導性体重増加に対する耐性をもたらす(Moyer and Wagner,2015、Yazmin,2019)。IGF-2及びそのシグナル伝達エフェクターは、骨格筋成長の正の調節因子である(Torrente et al.,2020)。
まとめると、筋肉量及び遺伝子発現に対するこれらの効果は、P75、P622、及びP624の体組成に対するプラスの効果を支持し、P622は、P75またはP624と比較して全体的により優れた有効性を示す。全体として、これらのデータは、1)P622及びP624で使用される変異が、筋肉肥大効果によって証明されるように、インビボでトラップの有効性を改善すること、ならびに2)P622で使用されるより長いリンカーが、筋肉同化効果を誘導する上でP624よりも有利であることを示している。
観察された同化効果は、試験した薬剤がどれもビヒクルに対する心臓重量の有意な変化を誘導しなかったため、骨格筋に特異的であった(図20)。
実施例4:例示的なActRIIB-ECDポリペプチド構築物は、血液学的効果を実証しなかった。
2つの例示的な薬剤、P622及びP624を試験して、血液学的パラメータに対するそれらの効果を調べた。P622及びP624を、雌カニクイザルに、3mg/kg及び30mg/kgの用量で皮下注射した(1群当たりn=3)。P622を1回注射し、血液学的パラメータをベースライン時及び注射の14日後の試験終了時に評価した。P624を2週間ごとに4週間(合計2回の注射)注射し、血液学的パラメータをベースライン時、2回目の注射前、及び研究終了時に評価した。
2つの例示的な薬剤、P622及びP624を試験して、血液学的パラメータに対するそれらの効果を調べた。P622及びP624を、雌カニクイザルに、3mg/kg及び30mg/kgの用量で皮下注射した(1群当たりn=3)。P622を1回注射し、血液学的パラメータをベースライン時及び注射の14日後の試験終了時に評価した。P624を2週間ごとに4週間(合計2回の注射)注射し、血液学的パラメータをベースライン時、2回目の注射前、及び研究終了時に評価した。
P622もP624も、研究を通して赤血球(RBC)数(図21A及び21D)、ヘモグロビン(図21B及び21E)、またはヘマトクリット(図21C及び21F)の著しい増加を誘導しなかった。各グラフの灰色の領域は、このタイプのカニクイザルの各パラメータの正常範囲を示す。結果は、P622及びP624で処置されたサルにおける血液学的パラメータが、投薬期間中、概して正常な範囲内に留まったことを示す。顕著な臨床徴候または有害事象は報告されなかった。これらの結果は、ActRIIB ECDに単一のアミノ酸変異を有するP622及びP624によって例示されるような薬剤が、インビボで赤血球量の増加を誘導しなかったことを実証する。結果は、薬剤が非ヒト霊長類において血液学的効果を誘導しなかったことを示し、これらの薬剤のためにヒトでの投薬が、ActRIIA-Fcポリペプチド(例えば、ソタテルセプト)で観察されたように、望ましくない血液学的効果によって制限されない場合があることを示唆する。
実施例5:例示的なActRIIB-ECDポリペプチド構築物は、ラットPAHモデルにおける有効性を示す。
ラットにおける3つの例示的な薬剤、P444、P622、及びP624の有効性を試験するために、それらの対応するヒトECD配列を(ヒトFcの代わりに)マウスFcに融合させて、P670、P671、及びP674を生成した(P670、P671、及びP674は、それぞれP444、P622、及びP624に対応する)。P670、P671、及びP674のリガンド阻害効力を、アクチビンA(図22A)、アクチビンB(図22B)、GDF-8(図22C)、GDF-11(図22D)、BMP-9(図22E)、及びBMP-10(図22F)に対する細胞ベースのアッセイを使用して試験した。結果は、P670、P671、及びP674の効力が、それぞれ、それらのヒトFc融合対応物、P444、P622、及びP624の効力と同等であることを確認した。
ラットにおける3つの例示的な薬剤、P444、P622、及びP624の有効性を試験するために、それらの対応するヒトECD配列を(ヒトFcの代わりに)マウスFcに融合させて、P670、P671、及びP674を生成した(P670、P671、及びP674は、それぞれP444、P622、及びP624に対応する)。P670、P671、及びP674のリガンド阻害効力を、アクチビンA(図22A)、アクチビンB(図22B)、GDF-8(図22C)、GDF-11(図22D)、BMP-9(図22E)、及びBMP-10(図22F)に対する細胞ベースのアッセイを使用して試験した。結果は、P670、P671、及びP674の効力が、それぞれ、それらのヒトFc融合対応物、P444、P622、及びP624の効力と同等であることを確認した。
次いで、P670、P671、及びP674を、ラットPAHモデルにおけるPAH様表現型の救出に対するそれらの効果について試験した。雄Sprague-Dawleyラット(7~9週齢、225~275g)に、0日目にモノクロタリン(MCT;60mg/kg)を注射した。翌日、動物を、P670、P671、及びP674(1、4、及び16mg/kg;1群当たりn=16)を用いて処置群間にランダムに分布させ、週2回腹腔内注射した。一部の動物には、MCT及びビヒクルが注入され、他の動物は、ナイーブのままであった(MCTなし)。研究の終了時(29日目、最初の注射の4週間後)に、全ての動物について心エコー及び血行動態評価を行った。フルトン指数(図23A~24A)、平均肺動脈圧(mPAP;図23B~24B)、右心室収縮期圧(RVSP;図23C~24C)、右心室自由壁厚さ(RVFWT;図23D~24D)、速度時間積分(図23E~24E)、及び肺動脈加速時間(図23F~24F)を評価した。
MCTは、このモデルにおけるPAHの予想される特徴:右心室肥大(フルトン指数[図23A~24A]及びRVFWT[図23D~24D]によって測定される)、ならびに増加したmPAP(図23B~24B)及びRVSP(図23C~24C)を誘導した。VTI(図23E~24E)及びPAAT(図23F~24F)によって評価したように、心臓収縮性も影響を受けた。P670は、1、4、及び16mg/kgでのフルトン指数、4及び16mg/kgでのmPAP、及びRVSP、4mg/kgでのRVFWTを著しく減少させた(図23A~D)。P670は、MCT単独に曝露した動物と比較してVTIに著しく影響を与えず(図23E)、4mg/kg及び16mg/kgでPAATを部分的に救出した(図23F)。P671(変異したActRIIB-Fc、長いリンカー)は、16mg/kgでフルトン指数、mPAP、RVSP、及びRVFWTを著しく減少させた(図23A~D)。P670とは対照的に、P671はまた、16mg/kgでVTIを著しく増加させた(図23E)。また、P671は、P670(図23F)よりも16mg/kgでPAATを著しく増加させた。驚くべきことに、P674(変異したActRIIB-Fc、短いリンカー)は、調査した血行動態または心エコー検査パラメータのうちのいずれにも著しい影響を及ぼさなかった(図23A~F)。
16mg/kgのP670、P671、またはP674を注射した動物を、試験薬剤への曝露に基づいて下位分類した。曝露を、7日目~29日目の各動物についてのPKプロファイルの曲線下面積(AUC)を算出することによって評価した。この曝露分析に基づいて、動物を三分位数に下位分類した。三分位数1(T1)は、曝露が最も低い動物を表し、三分位数2(T2)は、曝露が中程度の動物を表し、三分位数3(T3)は、曝露が最も高い動物を表した。動物が所与の試験薬剤に対して均等に分布するように、三分位を確立した。
この層別化に基づいて、P670及びP671は、いくつかの顕著な例外を除いて、2つの群にわたるT1、T2、及びT3の間で同等の応答を示した(図24A~F)。まず、P671-T3由来のラットにおけるフルトン指数は、ナイーブ動物と同等であった(図24A)。第二に、P670-T3ラットと比較して、PAATの増加は、P671-T3ラットにおいてより強力であった。両方の観察は、P671からの最大の可能な応答がP670からのものよりも大きいことを示唆している。驚くべきことに、P674に関しては、曝露三分位数間に明らかな有効性の差はなく、これらの下位群のいずれも、評価されたパラメータにおいて著しい改善を示さなかった(図24A~F)。
全体として、これらのデータは、例示的な薬剤P670及びP671が前臨床PAHラットモデルにおいて有効であり、P671はいくつかのパラメータをナイーブレベルに回復させることを示唆する。これは、全体として、例示的な薬剤P671がP670よりも有効であったことを示す。予想外に、P674は、調査したパラメータのいずれに対しても著しい影響を示さなかった。P671とP674との唯一の違いは、エクトドメインとFcとの間のリンカーの長さであることを考えると、これらの結果は、このリンカーの重要性を強調する。
PAHの特徴は肺血管の筋化であり、これは管腔のサイズを縮小する(平均内側壁厚さ(MTI)によって測定される)。MCTは、ラットにおいて血管筋化を著しく誘導し(図25A~B)、この効果は、16mg/kgでP670及びP671によって低減した(図25A)。曝露によって層別化した場合、P671は、最も高い曝露三分位においてP670よりも筋化レベルを低減するように思われたが、この差は統計的に有意ではなかった(図25B)。MTIもまた、MCTによって増加し(図25C~D)、この効果は、曝露によって動物を層別化した場合でさえ、P671によって著しく低減したが(図25D)、P670によっては著しく低減しなかった(図25C)。最後に、間質、肺胞出血、及び細胞浸潤におけるフィブリンレベルに基づいて、個々のラットに組織病理学的スコアを与えた。MCTは、このスコアを著しく増加させ(図25E~F)、この増加は、16mg/kgでP670またはP671のいずれによっても著しく変化しなかった(図25E)。層別化に基づいて、P670ではなくP671の最も高い曝露三分位数は、組織病理学的スコアを著しく低減した(図25F)。
PAH関連遺伝子発現変化に対するP670及びP671の効果も調べた。MCT誘導は、肺におけるInhba(アクチビンAをコードする)及びCtgf(CTGFをコードする)遺伝子発現(図25G~H)、ならびに右心室におけるNppb(BNPをコードする)及びCtgf遺伝子発現(図25I~J)を著しく増加させた。P670は、肺におけるInhba及びCtgfの発現には影響を及ぼさず、右心室におけるNppb及びCtgfの発現にはわずかな影響しか及ぼさなかった(図25G~J)。P671は、肺におけるCtgf発現レベルに著しい影響を与えなかった(図25H)が、肺におけるInhbaの発現レベル、及び右心室におけるNppb及びCtgfの発現レベルは著しく減少した(図25G~J)。右心室におけるNppbの場合、これらのレベルをP671でナイーブレベルに戻した(図25I)。Nppa発現も調査し、P670及びP671の両方が、MCT誘導Nppa発現を著しく比較可能に減少させたことが観察された(図25K)。P674に関しても、再び予期せぬことに、肺におけるInhbaまたはCtgfの発現(図25G~H)にも、右心室におけるCtgfまたはNppaの発現にも影響を及ぼさなかった(図25J~K)。P674は、右心室におけるNppb mRNAレベルを著しく減少させた(図25I)。
これらの結果は、より長いリンカー長に加えて、ActRIIB ECDに単一のアミノ酸変異を有する、P671によって例示されるものなどの薬剤が、動物モデルにおいてインビボでPAH様表現型を救助することができることを実証する。この結果は、肺高血圧症の治療におけるかかる薬剤の潜在的な治療的使用を強く支持する。
このげっ歯類PAHモデルにおける例示的な薬剤P670及びP671の効果を更に比較するために、右心室(RV)からの試料に対してRNAシーケンシングを行った。1群当たり3匹の動物(ナイーブ、MCT単独、MCT+P670[16mg/kg]、及びMCT+P671[16mg/kg])を選択した。MCT単独群では、最悪の疾患状態を有した動物(mPAP及びRVSPによって評価される)、ならびにP670及びP671群では、薬剤への曝露が最も高かった動物を選択した。RNAをRVから抽出し、Illumina NGSとのペアエンド150bp配列決定によって配列決定した。FastQC(v0.11.9)を使用して、生データの品質を検証した。全ての塩基は、少なくともQ34の品質スコアを有していた。リードを、HISAT2(v.2.2.1)(Kim et al.,2015)を使用して参照ゲノムrn6に整列させた後、featureCounts(v2.0.3)で要約した(Liao et al.,2014)。DESeq2(バージョン1.36.0)を使用して、差次的発現分析を行った(Love et al.,2014)。p値が0.05未満の調節された遺伝子(Benjamini-Hochberg法)を、差次的に発現された遺伝子(DEG)として分類した。
全てのDEG(ナイーブとMCTビヒクル群との間、図25L)を見ると、偏りのないクラスタリングは、P671処置群がナイーブ群に近いクラスタリングを示し、P670処置群はMCTビヒクル処置群に近いクラスタリングを示した。これらのデータにより、P671が、P670と比較して、遺伝子発現レベルでより顕著な逆リモデリング効果を有していたことが示唆される。更に、PAH病態生理学に関連する所与のKEGG経路(Kyoto Encyclopedia of Genes and Genomes、経路マッピングのための参照データベース)(図25M)を具体的に見ると、同様の観察がなされ得る。P671処置動物は、ナイーブ動物と同等のヒートマップ署名を有し、一方、P670処置動物は、よりMCTビヒクル動物に似ていた。
更に、ナイーブ動物を参照群として使用する場合、MCT処置動物は、RVにおいて2,068個の上方制御遺伝子及び1,687個の下方制御遺伝子を示した(図25N)。P670は、ナイーブ動物に対して1,720個の上方制御遺伝子及び1,103個の下方制御遺伝子を有する、このプロファイルに対して適度な効果を有した(図25N)。P671は、ナイーブ動物と比較してわずか58個の上方制御された遺伝子及び60個の下方制御された遺伝子を有する、MCT処置動物の遺伝子発現シグネチャのほぼ完全な救出を示した(図25N)。MCTビヒクル群を参照として使用する場合、同様の結論が得られ(図25O)、ナイーブ及びP671処置動物は、MCTビヒクル動物との最大の差を示した。
まとめると、これらの遺伝子発現結果は、ActRIIA-Fc(P670、P444のマウスバリアント)と比較した例示的な薬剤P671(P622のマウスバリアント)の優れたインビボ有効性を再び示す。結果は、かかる例示的な薬剤が、患者において増加した治療上の利益を提供し得ることを示唆する。
MCT表現型を駆動するシグナル伝達経路に対する例示的な薬剤P670、P671、及びP674の効果を更に理解するために、MCT処置動物において調節解除されることが知られている上位8つのKEGG用語と関連付けられた遺伝子を示す火山プロットを生成した(すなわち、ナイーブと比較して著しく上方制御または下方制御された)。図35に示されるように、P670及びP674は、MCT駆動遺伝子、特にTGF-β経路(例えば、TGF-β1、TGF-β2、Inhbb)に関連する遺伝子、及び心不全に関連する遺伝子経路(例えば、Nppa、Nppb、Spp1)にわずかな効果しか有しなかった。逆に、P671は、これらの経路の発現レベルをほぼナイーブレベルに正規化した。これらのデータは、P674と比較したP671の優れたインビトロ効力プロファイルが、驚くほど異なるインビボ薬理学的プロファイル、すなわち、P671及びP674が、TGF-βスーパーファミリーシグナル伝達及びPH及び心不全などの病理学的状態に関連する異なる影響を受けた経路に翻訳されたことを示す。これらの結果は、リガンドの改善された阻害及び増加したインビボの有効性の達成に関して、本開示の例示的な薬剤の潜在的な治療上の利益を更に強調する。
実施例6:例示的なActRIIB-ECDポリペプチド構築物は、PAH関連インビトロモデルにおけるサイトカイン誘導性の遺伝子発現の変化を効率的に防止する。
例示的な薬剤P444、P622、及びP624を、PAH関連細胞モデルの文脈で調べた。初代ヒト肺動脈平滑筋細胞(PASMC;Lonza CC-2581)を培養中に維持し、P444、P622、及びP624の存在下または非存在下でサイトカインで処理した。翌日、RNAを抽出してcDNAを生成した。ACTA2、CTGF、及びINHBA(二量体アクチビン及び阻害タンパク質複合体のアクチビンAサブユニットをコードする)のmRNA発現レベルを、GAPDH(ハウスキーピング遺伝子である)と比較して評価した。
例示的な薬剤P444、P622、及びP624を、PAH関連細胞モデルの文脈で調べた。初代ヒト肺動脈平滑筋細胞(PASMC;Lonza CC-2581)を培養中に維持し、P444、P622、及びP624の存在下または非存在下でサイトカインで処理した。翌日、RNAを抽出してcDNAを生成した。ACTA2、CTGF、及びINHBA(二量体アクチビン及び阻害タンパク質複合体のアクチビンAサブユニットをコードする)のmRNA発現レベルを、GAPDH(ハウスキーピング遺伝子である)と比較して評価した。
ACTA2及びCTGFは、インビトロでヒトPASMCにおいてアクチビン及びGDFによって高度に誘導されることが報告されている2つの重要な遺伝子である(Yung et al.,2020)。両方の遺伝子は、前臨床PAHモデル及びPAH患者において上方制御されるため、PAHに関連する(Calvier et al.,2019、Li et al.,2016、Pi et al.,2018、Sevilla-Perez et al.,2008、Tam et al.,2021)。
試験した全てのサイトカイン(アクチビンA、GDF-8、GDF-11、及びアクチビンAB)は、PASMCにおけるACTA2及びCTGFの発現を著しく誘導した(図26A~D)。(アクチビンABは、2つのインヒビンβAサブユニット[INHBA]のホモ二量体であるアクチビンA、及び2つのインヒビンβBサブユニット[INHBB]のホモ二量体であるアクチビンBと比較して、インヒビンβA及びインヒビンβBサブユニットで構成されるヘテロ二量体である)。INHBAの誘導は、観察された適度な誘導に起因して、これらの実験において一貫して評価されなかった(データは図示せず)。P444(3.7nM)は、GDF-8-、GDF-11、及びアクチビンAB誘導ACTA2及びCTGF mRNAレベルを著しく低減したが、それらは依然としてビヒクルと比較して高かった(図26B~D)。P444は、アクチビンA誘導遺伝子発現に著しく影響しなかった(図26A)。他方では、P622(3.7nM)は、アクチビンA-、GDF-8-、GDF-11-、及びアクチビンAB誘導ACTA2及びCTGF mRNAレベルを著しく阻害したが、これはビヒクル(図26A~D)(アクチビンA誘導CTGF発現、これはP622によって部分的にのみ阻害された)(図26A)とは著しく異なるものではなかった。P624は、P622と比較して、アクチビンA誘導遺伝子発現に対してそれほど有効ではなかったが(図26A)、GDF-8及びGDF-11誘導遺伝子発現に対して同等の効果を有した(図26B~C)。これらの結果は、細胞ベースのレポーターアッセイからのものと一致する(実施例1を参照)。これらのデータは、(P624と比較して)P622で使用されるより長いリンカーが、アクチビンAなどのある特定のリガンドに対する効力を最大化するために必要であることを更に示す。
同様の実験を、サイトカインの組み合わせ:a)アクチビンA+GDF-8(図27A~C)、b)アクチビンA+GDF-11(図27D~F)、c)GDF-8+GDF-11(図28A~C)、及びd)アクチビンB+GDF-8(図28D~F)を使用して実施した。これらの実験には、2つの異なる濃度のP444及びP622を使用した(3.7及び33.3nM)。平均して、3.7nMのP622は、試験したサイトカインの任意の組み合わせについて、同じ濃度のP444よりもACTA2、CTGF、及びINHBAの誘導を一貫して低減した(図27及び28)。33.3nMで、2つの薬剤は互いに同等であり、誘導を著しく低減し、ビヒクル処理条件と同様の発現レベルをもたらした。
これらの結果は、ActRIIB ECDに単一のアミノ酸変異を有するP622が、インビトロで、関連するPAH関連細胞系における疾患関連遺伝子標的の誘導を阻害するのに有効であったことを実証する。これらのデータはまた、サイトカインが単独で使用されたか、または併用で使用されたかにかかわらず、この文脈におけるP622のP444に対する優位性を示す。
実施例7:例示的なActRIIB-ECDポリペプチド構築物は、SMADリン酸化及びTGF-β関連遺伝子発現レベルを低下させる。
ActRIIB-ECDポリペプチド構築物が関連する組織(例えば、肺)にそれらの標的を係合させることができるかどうかを試験するために、例示的な薬剤P75、P121、P444、P622、及びP624を、30mg/kg及び/または50mg/kgの濃度でマウスに注射した。単回注射の4日後、リン酸化SMAD2(pSMAD2;図29A)及びSMAD3(pSMAD3;図29B-C)レベルの両方における用量依存的減少が、マウス肺において観察された。驚くべきことに、30mg/kgのpSMAD3上のP624を除いて、各々のそれぞれの用量で、全ての試験薬剤は同等であった(図29B)。これらのデータは、P624と比較してP622によって示される優れた効力プロファイルが、インビボで最大の標的関与を行うために必要であることを更に示す。
ActRIIB-ECDポリペプチド構築物が関連する組織(例えば、肺)にそれらの標的を係合させることができるかどうかを試験するために、例示的な薬剤P75、P121、P444、P622、及びP624を、30mg/kg及び/または50mg/kgの濃度でマウスに注射した。単回注射の4日後、リン酸化SMAD2(pSMAD2;図29A)及びSMAD3(pSMAD3;図29B-C)レベルの両方における用量依存的減少が、マウス肺において観察された。驚くべきことに、30mg/kgのpSMAD3上のP624を除いて、各々のそれぞれの用量で、全ての試験薬剤は同等であった(図29B)。これらのデータは、P624と比較してP622によって示される優れた効力プロファイルが、インビボで最大の標的関与を行うために必要であることを更に示す。
加えて、30mg/kgの例示的な薬剤P75、P444、P622、及びP624の注射の4日後に、マウス肺における遺伝子発現レベルを評価した(図30)。P622及びP624の両方が、P75もP444も、ビヒクルと比較してInhba遺伝子発現レベルを著しく低減した(図30A)。更に、P624は、ビヒクルと比較してGdf11遺伝子発現レベルを著しく減少させ(図30B)、P622は、同様の傾向を示した。例示的な薬剤のいずれも、ビヒクルと比較してSerpine1 mRNAレベルに著しい影響を及ぼさなかった(図30C)。
これらの結果は、変異したActRIIB ECDを含むP121、P622、及びP624が、疾患関連組織(肺)における標的関与の徴候を示したことを実証する。特に、P622及びP624は、Inhba遺伝子発現の阻害において、P75及びP444よりも優れていた。この結果は、アクチビンAリガンドをP75及びP44よりも強力に中和することに加えて、P622及びP624がインビボでの内因性アクチビンA遺伝子発現をP75及びP444よりもより効果的に低減することを示す。
実施例8:例示的なActRIIB-ECDポリペプチド構築物は、インビボでアクチビン及びGDFとの係合に成功し、優れた効力を示す。
野生型C57BL/6雄マウス(8~10週齢)に、1、3、10、25、または50mg/kgの用量で、例示的な試験薬剤P75、P444、P622、及びP624を週2回、3週間にわたって皮下的に注射した。全ての動物の体重を週2回記録し、研究の終了時に筋肉(腓腹筋及び前脛骨筋)、血漿、及び下垂体を収集した。
野生型C57BL/6雄マウス(8~10週齢)に、1、3、10、25、または50mg/kgの用量で、例示的な試験薬剤P75、P444、P622、及びP624を週2回、3週間にわたって皮下的に注射した。全ての動物の体重を週2回記録し、研究の終了時に筋肉(腓腹筋及び前脛骨筋)、血漿、及び下垂体を収集した。
P75は、3mg/kg以上の用量で、全体重の増加(図31A)及び誘導性筋肥大(図31B~C)を引き起こした。P444(ActRIIA-Fc)は、25及び50mg/kgの用量で筋肉肥大を著しく誘導したが(図31B~C)、最大50mg/kgの全体重には著しい影響をもたらさなかった(図31A)。P622及びP624の両方が、試験した最低用量(1mg/kg;図31A)を含む全身重量、ならびに3mg/kg以上の筋肉重量に著しい影響を有した(図31B~C)。他のインビボ有効性研究で観察されたように、P622は、P75及びP624と比較して、全身重量(図31A)及び腓腹筋肥大(図31B)に対して全体的により大きな有効性を示した。これらのデータは、例示的な薬剤P622のように、ActRIIB ECDとFcドメインとの間のより長いリンカー配列の利点を確認する。
アクチビンシグナル伝達の阻害に関連している、ヒトにおけるActRIIA-Fc、ActRIIB-Fc及びビマグルマブの投与後に、血漿卵胞刺激ホルモン(FSH)レベルの低減が観察されている(Garito et al.,2018、Ruckle et al.,2009、Attie et al.,2013)。血漿FSHレベルへの影響を、例示的な薬剤の投与後のマウスにおいて調べた。P75は、血漿FSHレベル(図31D)または下垂体Fshb(FSHβサブユニットをコードする)mRNAレベル(図31E)に著しい影響を有しなかった。P444は、50mg/kgで血漿FSHレベルを著しく減少させたが(約50%減少、図31D)、Fshb mRNAレベルに著しい影響はなかった(図31E)。P622は、3mg/kg以上の用量で血漿FSHレベルを有意に減少させ(図31D)、対照と比較して50mg/kgでFSHレベルを約93%低下させた。P622はまた、1mg/kgの用量で下垂体Fshb mRNAレベルを低下させた(図31E)。
P622、P75、及びP444の曝露-標的係合関係を、血漿FSH及び下垂体Fshb発現の低減を、対応する曝露(各動物におけるそれぞれの薬剤の曲線下面積(AUC))と相関させることによって更に調査した。曝露解析は、WinNonlinソフトウェア(Cetera,Princeton,NJ)を使用した非コンパートメント解析(NCA)によって行った。曝露は、研究の過程にわたる各被験試料及び用量レベルの完全なPKプロファイルから算出した。全ての動物をこの分析に含めた。
各例示的な薬剤について、赤池情報基準(AICc)を使用して、線形回帰と4パラメータ対数回帰との間のモデル比較分析(GraphPad Prism 9.0)を実施した。ビヒクル群を1(x=0で±SEM)に設定し、各回帰をその点を横切るように拘束した。データに最も適合するモデルを、所与の読み出しのために選択した。
P75及びP444への同様の曝露でのP622は、FSHレベル及びFshb mRNAレベルのより大きな減少を誘導し、血漿タンパク質及び遺伝子発現レベルの両方でのFSHのほぼ完全な抑制に対応する全体的な下部プラトーに達した(図32A~B)。
全体として、これらのデータは、P622がインビボで用量依存的な様式で関連するTGF-βスーパーファミリーメンバーとの係合に成功し、P75及びP444と比較して優れた効力を示したことを示す。
腓腹筋におけるMss51及びIgf2遺伝子発現に対する例示的な薬剤P444及びP622の効果について更に分析を実施した(図33)。P444は、Mss51(図33A)またはIgf2(図33B)のいずれにも影響を及ぼさなかった。一方、P622は、Mss51遺伝子発現レベルを著しく用量依存的に低下させ(図33A)、これは、以前に大腿四頭筋(図19E)で観察されたものと同等であった。腓腹筋において、P622は、Igf2 mRNAレベルに対して中程度の影響を及ぼした(図33B)。
P622及びP444の曝露-標的係合関係を、(上述のように)Mss51遺伝子発現の変化を各動物におけるそれぞれの薬剤の対応する曝露(AUC)と相関させることによって更に調査した。P444への同様の曝露でのP622は、Mss51の発現のほぼ完全な抑制に対応する全体的により低いプラトーに達するMss51 mRNAレベルのより大きな減少を誘導した(図34)。これらのMss51及びIgf2遺伝子発現データは、P444と比較して、P622の優れた効力を更に実証する。
本発明は、その実施形態を参照して詳細に説明されるが、これらの実施形態は、本発明を例示するために提供されるが、本発明を限定するものではない。本発明の原理を採用し、本明細書に添付の特許請求の範囲によって定義されるその趣旨及び範囲内に入る他の実施形態を作成することが可能である。
Claims (122)
- ポリペプチドであって、
a.アクチビン受容体IIB型(ActRIIB)エクトドメイン(ECD)バリアントと、
b.少なくとも10個のアミノ酸を含むペプチドリンカーと、
c.Fcドメイン単量体と、
を含む、前記ポリペプチド。 - 前記ActRIIB ECDが、配列番号2のヒト野生型ActRIIB-ECDと比較して、G27、Q29、D30、K31、S38、D57、F58、V75、及びF77から選択される位置に1つ以上のアミノ酸置換を含む、請求項1に記載のポリペプチド。
- 前記ActRIIB ECDが、アミノ酸置換G27Dを含む、請求項2に記載のポリペプチド。
- 前記ActRIIB ECDが、配列番号20と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項3に記載のポリペプチド。
- 前記ActRIIB ECDが、アミノ酸置換Q29Yを含む、請求項2に記載のポリペプチド。
- 前記ActRIIB ECDが、配列番号14と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項5に記載のポリペプチド。
- 前記ActRIIB ECDが、アミノ酸置換D30Qを含む、請求項2に記載のポリペプチド。
- 前記ActRIIB ECDが、配列番号15と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項7に記載のポリペプチド。
- 前記ActRIIB ECDが、アミノ酸置換K31Yを含む、請求項2に記載のポリペプチド。
- 前記ActRIIB ECDが、配列番号16と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項9に記載のポリペプチド。
- 前記ActRIIB ECDが、アミノ酸置換S38Rを含む、請求項2に記載のポリペプチド。
- 前記ActRIIB ECDが、配列番号17と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項11に記載のポリペプチド。
- 前記ActRIIB ECDが、アミノ酸置換D57Eを含む、請求項2に記載のポリペプチド。
- 前記ActRIIB ECDが、配列番号4と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項13に記載のポリペプチド。
- 前記ActRIIB ECDが、F58D、F58E、F58Y、F58K、F58Q、F58N、F58R、F58H、及びF58Wから選択される、位置F58のアミノ酸置換を含む、請求項2に記載のポリペプチド。
- 前記ActRIIB ECDが、アミノ酸置換F58Dを含む、請求項15に記載のポリペプチド。
- 前記ActRIIB ECDが、配列番号6と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項16に記載のポリペプチド。
- 前記ActRIIB-ECDバリアントが、アミノ酸置換F58Eを含む、請求項15に記載のポリペプチド。
- 前記ActRIIB ECDが、配列番号5と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項18に記載のポリペプチド。
- 前記バリアントが、アミノ酸置換F58Yを含む、請求項15に記載のポリペプチド。
- 前記ActRIIB ECDが、配列番号7と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項20に記載のポリペプチド。
- 前記バリアントが、アミノ酸置換F58Kを含む、請求項15に記載のポリペプチド。
- 前記ActRIIB ECDが、配列番号8と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項22に記載のポリペプチド。
- 前記バリアントが、アミノ酸置換F58Qを含む、請求項15に記載のポリペプチド。
- 前記ActRIIB ECDが、配列番号9と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項24に記載のポリペプチド。
- 前記バリアントが、アミノ酸置換F58Wを含む、請求項15に記載のポリペプチド。
- 前記ActRIIB ECDが、配列番号10と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項26に記載のポリペプチド。
- 前記バリアントが、アミノ酸置換F58Nを含む、請求項15に記載のポリペプチド。
- 前記ActRIIB ECDが、配列番号11と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項28に記載のポリペプチド。
- 前記バリアントが、アミノ酸置換F58Hを含む、請求項15に記載のポリペプチド。
- 前記ActRIIB ECDが、配列番号13と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項30に記載のポリペプチド。
- 前記バリアントが、アミノ酸置換F58Rを含む、請求項15に記載のポリペプチド。
- 前記ActRIIB ECDが、配列番号12と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項32に記載のポリペプチド。
- 前記ActRIIB ECDが、アミノ酸置換V75Qを含む、請求項2に記載のポリペプチド。
- 前記ActRIIB ECDが、配列番号18と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項34に記載のポリペプチド。
- 前記ActRIIB ECDが、アミノ酸置換F77Dを含む、請求項2に記載のポリペプチド。
- 前記ActRIIB ECDが、配列番号19と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項36に記載のポリペプチド。
- 前記ActRIIB-ECDバリアントが、1つ以上の追加のアミノ酸置換を更に含む、請求項1~37のいずれか1項に記載のポリペプチド。
- 前記ActRIIB-ECDバリアントが、N末端に以下のアミノ酸:GRGEA(配列番号23)を更に含む、請求項1~38のいずれか1項に記載のポリペプチド。
- N末端からC末端に、以下の構造:ActRIIB-ECD-ペプチドリンカー-Fcドメイン単量体を含む、請求項1~39のいずれか1項に記載のポリペプチド。
- 前記Fcドメイン単量体が、IgG1、IgG2、IgG3またはIgG4アイソタイプである、請求項1~40のいずれか1項に記載のポリペプチド。
- 前記Fcドメイン単量体が、ヒトFcドメイン単量体またはマウスFcドメイン単量体である、請求項1~41のいずれか1項に記載のポリペプチド。
- 前記Fcドメイン単量体が、前記ポリペプチドの二量体の凝集を低減するか、またはその安定性を調節するように操作される、請求項1~42のいずれか1項に記載のポリペプチド。
- 前記Fcドメイン単量体が、M252Y、S254T、及びT256E(YTE)のアミノ酸置換を含む、請求項43に記載のポリペプチド。
- 前記Fcドメイン単量体が、前記M252Yアミノ酸置換を含む、請求項43に記載のポリペプチド。
- 前記Fcドメイン単量体が、356位にD、及び358位にL(DL)を含む、請求項41~45のいずれか1項に記載のポリペプチド。
- 前記Fcドメイン単量体が、356位にE、及び358位にM(EM)を含む、請求項41~45のいずれか1項に記載のポリペプチド。
- 前記Fcドメイン単量体が、前記C末端にリジン残基(K)を更に含む、請求項41~47のいずれか1項に記載のポリペプチド。
- 前記Fcドメイン単量体が、配列番号134~173及び338のうちのいずれか1つと少なくとも85%、少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%同一であるアミノ酸配列を含む、請求項1~48のいずれか1項に記載のポリペプチド。
- 前記Fcドメイン単量体が、配列番号134~173及び338のうちのいずれか1つから選択されるアミノ酸配列を含むか、またはそれからなる、請求項49に記載のポリペプチド。
- 前記Fcドメイン単量体が、
a.IgG1アイソタイプであり、配列番号135もしくは配列番号134に示されるアミノ酸配列を含むか、もしくはそれからなる、または
b.IgG2アイソタイプであり、配列番号157に示されるアミノ酸配列を含むか、もしくはそれからなる、請求項49または50に記載のポリペプチド。 - 前記Fcドメイン単量体が、前記C末端にリジン残基(K)を更に含む、請求項49~51のいずれか1項に記載のポリペプチド。
- 前記Fcドメイン単量体が、二量体を形成する、請求項1~52のいずれか1項に記載のポリペプチド。
- 前記ペプチドリンカーが、グリシンリッチである、請求項1~53のいずれか1項に記載のポリペプチド。
- 前記ペプチドリンカーが、10~40アミノ酸長である、請求項1~54のいずれか1項に記載のポリペプチド。
- 前記リンカーが、少なくとも10アミノ酸長、少なくとも14アミノ酸長、少なくとも19アミノ酸長、または少なくとも39アミノ酸長である、請求項55に記載のポリペプチド。
- 前記リンカーが、10アミノ酸長、14アミノ酸長、19アミノ酸長、または39アミノ酸長である、請求項55に記載のポリペプチド。
- 前記リンカーが、14アミノ酸長である、請求項55に記載のポリペプチド。
- 前記ペプチドリンカーが、配列番号34、54、59、または63のうちのいずれか1つに示されるアミノ酸配列を含む、請求項54~58のいずれか1項に記載のポリペプチド。
- 前記ActRIIB-ECDが、配列番号4~22、331、332、及び24~33のうちのいずれか1つと少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項1~59のいずれか1項に記載のポリペプチド。
- 前記ActRIIB-ECDが、配列番号4~22、331、332、及び24~33のうちのいずれか1つから選択されるアミノ酸配列を含むか、またはそれからなる、請求項1~59のいずれか1項に記載のポリペプチド。
- 前記ActRIIB-ECDが、配列番号5のアミノ酸配列、またはそれと少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を含むか、またはそれからなる、請求項60に記載のポリペプチド。
- 前記ActRIIB-ECDが、配列番号8のアミノ酸配列、またはそれと少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を含むか、またはそれからなる、請求項60に記載のポリペプチド。
- 前記ActRIIB-ECDが、配列番号9のアミノ酸配列、またはそれと少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、もしくは少なくとも99%同一の配列を含むか、またはそれからなる、請求項60に記載のポリペプチド。
- 前記ポリペプチドが、配列番号174~254、333、及び339~341から選択されるアミノ酸配列と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項1~64のいずれか1項に記載のポリペプチド。
- 前記ポリペプチドが、配列番号174~254、333、及び339~341から選択されるアミノ酸配列を含むか、またはそれからなる、請求項1~64のいずれか1項に記載のポリペプチド。
- 前記ポリペプチドが、配列番号186、190~194、232~233、及び247~248から選択されるアミノ酸配列と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項1~64のいずれか1項に記載のポリペプチド。
- 前記ポリペプチドが、配列番号186、190~194、232~233、及び247~248から選択されるアミノ酸配列を含むか、またはそれからなる、請求項1~64のいずれか1項に記載のポリペプチド。
- 前記ポリペプチドが、配列番号186のアミノ酸配列、またはそれと少なくとも95%、96%、97%、98%、もしくは99%同一であるアミノ酸配列を含むか、またはそれからなる、請求項1~64のいずれか1項に記載のポリペプチド。
- 前記ポリペプチドが、配列番号213~216及び242~244から選択されるアミノ酸配列と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項1~64のいずれか1項に記載のポリペプチド。
- 前記ポリペプチドが、配列番号213~216及び242~244から選択されるアミノ酸配列を含むか、またはそれからなる、請求項1~64のいずれか1項に記載のポリペプチド。
- 前記ポリペプチドが、配列番号220~223、253、及び254から選択されるアミノ酸配列と少なくとも95%、96%、97%、98%、または99%同一であるアミノ酸配列を含む、請求項1~64のいずれか1項に記載のポリペプチド。
- 前記ポリペプチドが、配列番号220~223、253、及び254から選択されるアミノ酸配列を含むか、またはそれからなる、請求項1~64のいずれか1項に記載のポリペプチド。
- リンカーを介して、ActRIIB-ECDのN末端またはC末端に融合したアルブミン結合ドメイン、フィブロネクチンドメイン、またはヒト血清アルブミンドメインを更に含む、請求項1~73のいずれか1項に記載のポリペプチド。
- 前記ActRIIB-ECDの前記N末端に配列番号1のシグナルペプチドを更に含む、請求項1~74のいずれか1項に記載のポリペプチド。
- 前記ポリペプチドが、標的化剤、治療部分、検出可能部分、または診断部分とコンジュゲートされている、請求項1~75のいずれか1項に記載のポリペプチド。
- 前記標的化剤、前記治療部分、前記検出可能部分、または前記診断部分が、抗体またはその抗原結合断片、前記TGFβスーパーファミリーの別のメンバーに対して、もしくは別の治療標的に対して親和性を有する結合剤、放射線療法剤、イメージング剤、蛍光部分、細胞傷害性剤、抗有糸分裂薬、ナノ粒子ベースの担体、ポリマーコンジュゲート薬、ナノ担体、イメージング剤、安定化剤、薬物、ナノ担体、またはデンドリマーを含む、請求項76に記載のポリペプチド。
- 前記ポリペプチドが、前記第1のポリペプチドの前記Fcドメイン単量体と前記第2のポリペプチドの前記Fcドメイン単量体との間の少なくとも1つのジスルフィド結合によって連結された第1のポリペプチド及び第2のポリペプチドを含む二量体を形成する、請求項1~77のいずれか1項に記載のポリペプチド。
- 前記第1のポリペプチド及び前記第2のポリペプチドが、前記第1のポリペプチドの前記Fcドメイン単量体と前記第2のポリペプチドの前記Fcドメイン単量体との間の少なくとも1つのジスルフィド結合によって連結される、請求項1~77のいずれか1項に記載の第1のポリペプチド及び請求項1~77のいずれか1項に記載の第2のポリペプチドを含む、TGFβスーパーファミリーリガンド結合剤。
- 前記第1のポリペプチド及び前記第2のポリペプチドが、配列番号174~254、333、及び339~341から選択されるアミノ酸配列、またはそれと少なくとも95%、96%、97%、98%、もしくは99%同一であるアミノ酸配列を含むか、またはそれからなる、請求項79に記載の結合剤。
- 前記第1のポリペプチド及び前記第2のポリペプチドが、配列番号186、190~194、232~233、及び247~248から選択されるアミノ酸配列、またはそれと少なくとも95%、96%、97%、98%、もしくは99%同一であるアミノ酸配列を含むか、またはそれからなる、請求項79に記載の結合剤。
- 前記第1のポリペプチド及び前記第2のポリペプチドが、配列番号186、またはそれと少なくとも95%、96%、97%、98%、もしくは99%同一であるアミノ酸配列を含むか、またはそれからなる、請求項79に記載の結合剤。
- 前記第1のポリペプチド及び前記第2のポリペプチドが、配列番号213~216及び242~244から選択されるアミノ酸配列、またはそれと少なくとも95%、96%、97%、98%、もしくは99%同一であるアミノ酸配列を含むか、またはそれからなる、請求項79に記載の結合剤。
- 前記第1のポリペプチド及び前記第2のポリペプチドが、配列番号220~223、253、及び254から選択されるアミノ酸配列、またはそれと少なくとも95%、96%、97%、98%、もしくは99%同一であるアミノ酸配列を含むか、またはそれからなる、請求項79に記載の結合剤。
- 前記ポリペプチドが、ヒトアクチビンA、アクチビンB、GDF-8、GDF-11、及び/または骨形態形成タンパク質(BMP)-10に結合し、ヒト野生型ActRIIB-ECDのヒトBMP-9への結合と比較して、ヒトBMP-9への結合が低減している、請求項1~78のいずれか1項に記載のポリペプチド、または請求項79~84のいずれか1項に記載の結合剤。
- 前記ポリペプチドが、ヒトBMP-9に実質的に結合しない、請求項85に記載のポリペプチドまたは結合剤。
- 前記ポリペプチドが、ヒトアクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上のシグナル伝達を阻害する、請求項85または86に記載のポリペプチドまたは結合剤。
- 前記ポリペプチドが、ヒトBMP-9シグナル伝達を阻害しない、請求項85~87のいずれか1項に記載のポリペプチドまたは結合剤。
- ヒトBMP-9シグナル伝達に対する前記ポリペプチドの阻害効力が、ヒトBMP-9シグナル伝達に対するヒト野生型ActRIIB-ECDの阻害効力と比較して約100倍、約200倍、または約300倍低い、請求項85~88のいずれか1項に記載のポリペプチドまたは結合剤。
- ヒトアクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上に対する前記ポリペプチドの前記阻害効力が、同じそれぞれのリガンド(複数可)に対するヒト野生型ActRIIB-ECDの前記阻害効力と実質的に同じであるか、またはそれと比較して増加している、請求項85~89のいずれか1項に記載のポリペプチドまたは結合剤。
- ヒトアクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上に対する前記ポリペプチドの前記阻害効力が、同じそれぞれのリガンド(複数可)に対する前記ヒト野生型ActRIIB-ECDの前記阻害効力と比較して約2倍、約3倍、約4倍、または約5倍以上増加する、請求項90に記載のポリペプチドまたは結合剤。
- 請求項1~78のいずれか1項に記載のポリペプチドをコードする、核酸分子。
- 配列番号256~330、334、または342~344のうちのいずれか1つと少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%同一である核酸配列を含む、請求項92に記載の核酸分子。
- 配列番号256~330、334、または342~344のうちのいずれか1つの核酸配列を含むか、またはそれからなる、核酸分子。
- 配列番号255に示される配列を、前記核酸分子の5’末端に更に含む、請求項92~94のいずれか1項に記載の核酸分子。
- 請求項92~95のいずれか1項に記載の核酸分子を含む、ベクター。
- 前記核酸分子または前記ベクターが、前記宿主細胞内で発現される、請求項92~95のいずれか1項に記載の核酸分子または請求項96に記載のベクターを含む、宿主細胞。
- a.請求項92~95のいずれか1項に記載の核酸分子または請求項96に記載のベクターを含む、宿主細胞を提供することと、
b.前記ポリペプチドの発現を可能にする条件下で前記宿主細胞を培養することと、
c.発現されたポリペプチドを培養物から回収することと、を含む、請求項1~78のいずれか1項に記載のポリペプチドを調製する、方法。 - 請求項1~78のいずれか1項に記載のポリペプチド、または請求項79~91のいずれか1項に記載の結合剤、及び薬学的に許容される担体、希釈剤、または賦形剤を含む、薬学的組成物。
- 前記組成物が、注射または注入による投与用に製剤化される、請求項99に記載の薬学的組成物。
- 前記組成物が、静脈内、皮下、腹腔内、または筋肉内投与用に製剤化されている、請求項100に記載の薬学的組成物。
- 前記ポリペプチドまたは結合剤が、対象において血管合併症を引き起こさず、及び/または前記対象において血管透過性もしくは漏出を増加させない、請求項99~101のいずれか1項に記載の薬学的組成物。
- 前記ポリペプチドまたは結合剤が、赤血球質量を増加させず、ヘモグロビンを増加させず、血小板減少症を引き起こさず、及び/または対象において血液合併症を引き起こさない、請求項99~102のいずれか1項に記載の薬学的組成物。
- 請求項1~78のいずれか1項に記載のポリペプチド、請求項79~91のいずれか1項に記載の結合剤、または請求項99~103のいずれか1項に記載の薬学的組成物、及び任意選択で、使用説明書を含む、キット。
- TGFβスーパーファミリーリガンドのシグナル伝達と関連する疾患または状態を治療または予防することを必要とする対象においてそれを行う方法であって、請求項1~78のいずれか1項に記載のポリペプチド、請求項79~91のいずれか1項に記載の結合剤、または請求項99~103のいずれか1項に記載の薬学的組成物を前記対象に投与することを含む、前記方法。
- 前記対象が、ヒトである、請求項105に記載の方法。
- 前記TGFβスーパーファミリーリガンドが、アクチビンA、アクチビンB、GDF-8、GDF-11、及びBMP-10のうちの1つ以上である、請求項105または106に記載の方法。
- 対象においてアクチビンA、アクチビンB、GDF-8、GDF-11、及び/またはBMP-10によって媒介された疾患または状態を治療または予防する方法であって、請求項1~78のいずれか1項に記載のポリペプチド、請求項79~91のいずれか1項に記載の結合剤、または請求項99~103のいずれか1項に記載の薬学的組成物を前記対象に投与することを含む、前記方法。
- 前記疾患または前記状態が、アクチビンA及び/またはアクチビンB及び/またはGDF-8及び/またはGDF-11の過剰発現または過剰活性化を特徴とする、請求項108に記載の方法。
- 前記疾患または前記状態が、肺高血圧症(PH)、線維症、筋力低下または萎縮、代謝障害、心臓代謝性疾患、骨損傷、及び低い赤血球レベルから選択される、請求項105~109のいずれか1項に記載の方法。
- 前記PHが、肺動脈高血圧症(PAH)である、請求項110に記載の方法。
- 前記PAHが、感染症、先天性心臓異常、門脈高血圧症、肺静脈閉塞性疾患、肺毛細血管腫症、結合組織障害、慢性閉塞性肺疾患、自己免疫障害(例えば、強皮症もしくはループス)、または薬物使用(例えば、コカインもしくはメタンフェタミンの使用)と関連する特発性PAH、遺伝性PAH、またはPAHである、請求項111に記載の方法。
- 前記線維症が、肺線維症、特発性肺線維症、腎線維症(renal fibrosis)、肝線維症、肺線維症、腎線維症(kidney fibrosis)、骨髄線維症、全身性硬化症、皮膚線維症、心臓線維症、骨髄線維症、角膜線維症、縦隔線維症、後腹膜線維症、骨関節線維症、関節線維症、組織線維症、線維腫増殖性障害、または結合組織障害である、請求項110に記載の方法。
- 前記筋力低下または萎縮疾患もしくは状態が、デュシェンヌ型筋ジストロフィー(DMD)、顔面肩甲上腕型筋ジストロフィー(FSHD)、封入体筋炎(IBM)、筋萎縮性側索硬化症(ALS)、サルコペニア、またはがん悪液質である、請求項110に記載の方法。
- 前記代謝障害が、肥満、1型糖尿病、2型糖尿病、または前糖尿病である、請求項110に記載の方法。
- 前記心臓代謝性疾患または状態が、駆出率低下を伴う心不全(HFrEF)または駆出率維持を伴う心不全(HFpEF)である、請求項110に記載の方法。
- 前記骨損傷が、骨脱塩、骨粗しょう症(例えば、原発性もしくは二次性)、骨減少症、大理石骨病、骨折、骨癌もしくはがん転移関連の骨損失、パジェット病、腎性骨ジストロフィー、治療関連の骨損失、食事関連の骨損失、肥満の治療に関連する骨損失、低重力関連の骨損失、または不動性関連の骨損失を含む、請求項110に記載の方法。
- 低い血球レベルの疾患または状態が、貧血または失血である、請求項110に記載の方法。
- 対象においてBMP9シグナル伝達を実質的に低減または阻害することなく、アクチビンA、アクチビンB、GDF-8、GDF-11及び/またはBMP10シグナル伝達を低減または阻害することを必要とする前記対象においてそれを行う方法であって、請求項1~78のいずれか1項に記載のポリペプチド、請求項79~91のいずれか1項に記載の結合剤、または請求項99~103のいずれか1項に記載の薬学的組成物を前記対象に投与することを含む、前記方法。
- 前記対象が、哺乳類である、請求項119に記載の方法。
- 前記哺乳類が、ヒトである、請求項120に記載の方法。
- 前記方法が、対象において血管合併症を引き起こさず、対象において血管透過性もしくは漏出を増加させず、赤血球質量を増加させず、ヘモグロビンを増加させず、血小板減少を引き起こさず、及び/または対象において血液合併症を引き起こさない、請求項105~121のいずれか1項に記載の方法。
Applications Claiming Priority (9)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US202263304478P | 2022-01-28 | 2022-01-28 | |
| US63/304,478 | 2022-01-28 | ||
| US202263397773P | 2022-08-12 | 2022-08-12 | |
| US63/397,773 | 2022-08-12 | ||
| US202263416852P | 2022-10-17 | 2022-10-17 | |
| US63/416,852 | 2022-10-17 | ||
| US202263420999P | 2022-10-31 | 2022-10-31 | |
| US63/420,999 | 2022-10-31 | ||
| PCT/CA2023/050116 WO2023141724A1 (en) | 2022-01-28 | 2023-01-27 | Activin receptor type iib variants and uses thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2025504945A true JP2025504945A (ja) | 2025-02-19 |
Family
ID=87469979
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024544859A Pending JP2025504945A (ja) | 2022-01-28 | 2023-01-27 | アクチビン受容体iib型バリアント及びその使用 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US11945856B2 (ja) |
| EP (1) | EP4469489A1 (ja) |
| JP (1) | JP2025504945A (ja) |
| KR (1) | KR20240150761A (ja) |
| AU (1) | AU2023210700A1 (ja) |
| IL (1) | IL314280A (ja) |
| MX (1) | MX2024008800A (ja) |
| WO (1) | WO2023141724A1 (ja) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2025039072A1 (en) * | 2023-08-18 | 2025-02-27 | 35Pharma Inc. | Activin receptor type iib variants and uses thereof |
| WO2025050218A1 (en) * | 2023-09-08 | 2025-03-13 | 35Pharma Inc. | Combination therapy with actriib receptor variants and glp-1 agonists |
Family Cites Families (38)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2174868T3 (es) | 1992-10-29 | 2002-11-16 | Celtrix Pharma | Fragmento del receptor de fijacion a tgf-beta tipoii como agente terapeutico. |
| BR9808934A (pt) | 1997-04-18 | 2000-08-01 | Biogen Inc | Proteìnas de fusão de região constante de receptor/imunoglobulina tgf-beta do tipo ii |
| AU5943201A (en) | 2000-05-03 | 2001-11-12 | Amgen Inc | Modified peptides as therapeutic agents |
| WO2005028517A2 (en) | 2003-05-09 | 2005-03-31 | The General Hospital Corporation | SOLUBLE TGF-β TYPE III RECEPTOR FUSION PROTEINS |
| CA2574777C (en) | 2004-07-23 | 2015-09-01 | Acceleron Pharma Inc. | Actrii receptor polypeptides, methods and compositions |
| US7795389B2 (en) | 2004-09-28 | 2010-09-14 | The Board Of Regents Of The University Of Texas System | Antagonizing TGF-beta activity with various ectodomains TGF-beta receptors used in combination or as fusion proteins |
| EP3269381B1 (en) | 2005-11-23 | 2020-10-07 | Acceleron Pharma, Inc. | Activin-actriia antagonists in use for promoting bone growth |
| US8895016B2 (en) | 2006-12-18 | 2014-11-25 | Acceleron Pharma, Inc. | Antagonists of activin-actriia and uses for increasing red blood cell levels |
| DK2468290T3 (en) | 2006-12-18 | 2015-06-01 | Acceleron Pharma Inc | Activin-ActRII antagonists for use in the treatment of anemia |
| TW201803890A (zh) | 2007-02-02 | 2018-02-01 | 艾瑟勒朗法瑪公司 | 衍生自ActRIIB的變體與其用途 |
| US8318135B2 (en) | 2007-03-19 | 2012-11-27 | National Research Council Of Canada | Antagonist of ligands and uses thereof |
| EP2171062A1 (en) | 2007-06-15 | 2010-04-07 | Genzyme Corporation | Fusion proteins containing two tgf-beta binding domains of tgf-beta type ii receptor |
| TWI626945B (zh) | 2008-08-14 | 2018-06-21 | 艾瑟勒朗法瑪公司 | 使用gdf阱以增加紅血球水平 |
| US8216997B2 (en) | 2008-08-14 | 2012-07-10 | Acceleron Pharma, Inc. | Methods for increasing red blood cell levels and treating anemia using a combination of GDF traps and erythropoietin receptor activators |
| CA2737271C (en) | 2008-09-17 | 2020-06-23 | National Research Council Of Canada | Hetero-multivalent binding agents for members of the tgf.beta. superfamily |
| EP2401293B1 (en) | 2009-02-24 | 2016-02-10 | The Salk Institute For Biological Studies | Designer ligands of tgf-beta superfamily |
| US8987417B2 (en) | 2010-11-29 | 2015-03-24 | National Research Council Of Canada | Covalently dimerized bivalent binding agents |
| DK2697257T3 (en) | 2011-04-13 | 2017-01-30 | Bristol Myers Squibb Co | FC FUSION PROTEINS INCLUDING UNKNOWN LINKERS OR EVENTS |
| CN102850458B (zh) | 2011-06-28 | 2014-10-01 | 华博生物医药技术(上海)有限公司 | 新型重组双功能融合蛋白及其制法和用途 |
| CN110041431A (zh) | 2012-04-30 | 2019-07-23 | 比奥孔有限公司 | 靶向/免疫调节性融合蛋白及其制造方法 |
| WO2015027082A1 (en) | 2013-08-22 | 2015-02-26 | Acceleron Pharma, Inc. | Tgf-beta receptor type ii variants and uses thereof |
| PE20210168A1 (es) | 2014-02-10 | 2021-01-28 | Merck Patent Gmbh | INHIBICION DIRIGIDA DEL FACTOR DE CRECIMIENTO TRANSFORMADOR ß (TGFß) |
| MX2017013520A (es) * | 2015-04-22 | 2018-05-22 | Alivegen Usa Inc | Nuevas proteinas hibridas de bloqueo del ligando actriib para tratar enfermedades de atrofia muscular. |
| CA2996996A1 (en) | 2015-08-31 | 2017-03-09 | National Research Council Of Canada | Tgf-.beta.-receptor ectodomain fusion molecules and uses thereof |
| KR20180096645A (ko) | 2015-11-23 | 2018-08-29 | 악셀레론 파마 인코포레이티드 | 눈 질환의 치료 방법 |
| CN110036025B (zh) | 2016-10-05 | 2024-03-22 | 阿塞勒隆制药公司 | 变体ActRIIB蛋白及其用途 |
| WO2018158727A1 (en) | 2017-03-02 | 2018-09-07 | National Research Council Of Canada | Tgf-β-receptor ectodomain fusion molecules and uses thereof |
| KR20200109330A (ko) | 2018-01-12 | 2020-09-22 | 케로스 테라퓨틱스, 인크. | 액티빈 수용체 유형 iib 변이체 및 그의 사용 방법 |
| CN116134049A (zh) * | 2020-02-03 | 2023-05-16 | 阿塞勒隆制药公司 | 变体actriib蛋白及其用途 |
| US20230129812A1 (en) | 2020-02-03 | 2023-04-27 | Acceleron Pharma Inc. | Compositions and methods for treating pulmonary hypertension |
| IL296394A (en) | 2020-03-20 | 2022-11-01 | Keros Therapeutics Inc | Type ii activin receptor chimeras and methods of using them |
| WO2021189010A1 (en) | 2020-03-20 | 2021-09-23 | Keros Therapeutics, Inc. | Methods of using activin receptor type iib variants |
| JP2023544727A (ja) | 2020-10-02 | 2023-10-25 | ケロス セラピューティクス インコーポレイテッド | アクチビン受容体ii型バリアントの使用方法 |
| EP4274600A4 (en) | 2021-01-08 | 2024-11-20 | Acceleron Pharma Inc. | COMPOSITIONS AND METHODS FOR THE TREATMENT OF PULMONARY HYPERTENSION |
| EP4358991A4 (en) | 2021-06-21 | 2025-05-14 | Acceleron Pharma, Inc. | Compositions and methods for treating pulmonary hypertension |
| WO2022271716A2 (en) | 2021-06-21 | 2022-12-29 | Keros Therapeutics, Inc. | Methods of using activin receptor type ii signaling inhibitors |
| US20240366722A1 (en) | 2021-08-16 | 2024-11-07 | Acceleron Pharma Inc. | Compositions and methods for treating renal diseases or conditions |
| EP4387737A4 (en) | 2021-08-19 | 2025-06-18 | Keros Therapeutics, Inc. | METHODS OF USING INHIBITORS OF ACTIVIN RECEPTOR TYPE II SIGNALING |
-
2023
- 2023-01-27 KR KR1020247026819A patent/KR20240150761A/ko active Pending
- 2023-01-27 WO PCT/CA2023/050116 patent/WO2023141724A1/en active Application Filing
- 2023-01-27 JP JP2024544859A patent/JP2025504945A/ja active Pending
- 2023-01-27 MX MX2024008800A patent/MX2024008800A/es unknown
- 2023-01-27 AU AU2023210700A patent/AU2023210700A1/en active Pending
- 2023-01-27 US US18/160,787 patent/US11945856B2/en active Active
- 2023-01-27 EP EP23745779.1A patent/EP4469489A1/en active Pending
- 2023-01-27 IL IL314280A patent/IL314280A/en unknown
-
2024
- 2024-02-29 US US18/591,918 patent/US20240262886A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| KR20240150761A (ko) | 2024-10-16 |
| US11945856B2 (en) | 2024-04-02 |
| IL314280A (en) | 2024-09-01 |
| WO2023141724A1 (en) | 2023-08-03 |
| US20240262886A1 (en) | 2024-08-08 |
| AU2023210700A1 (en) | 2024-08-15 |
| MX2024008800A (es) | 2024-10-08 |
| EP4469489A1 (en) | 2024-12-04 |
| US20230287084A1 (en) | 2023-09-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102688969B1 (ko) | Bcma 및 cd3 이중특이성 t 세포 맞물림 항체 작제물 | |
| US20240262886A1 (en) | Activin receptor type iib variants and uses thereof | |
| AU2010246108B2 (en) | FGF21 mutants and uses thereof | |
| US10376581B2 (en) | Human endothelin receptor antibody and use thereof | |
| CN114127126B (zh) | ETA抗体与TGF-βTrap的融合蛋白质,以及其药物组合物和应用 | |
| WO2010019263A2 (en) | Soluble flt constructs for treating cancers | |
| TW201706306A (zh) | 以高親合性、結合性及特異性結合轉化生長因子-β1的經修飾IgG抗體 | |
| WO2021052349A1 (zh) | Gipr抗体及其与glp-1的融合蛋白质,以及其药物组合物和应用 | |
| WO2017206840A1 (zh) | Etar抗体,其药物组合物及其应用 | |
| US20210061904A1 (en) | Gipr antibody and glp-1 fusion protein thereof, and pharmaceutical composition and application thereof | |
| US20240254195A1 (en) | Activin receptor type iib variants and uses thereof | |
| JP2023528709A (ja) | バリアントactriibタンパク質およびその使用 | |
| KR20220103709A (ko) | 항-tigit 항체와의 병용물 형태로 항-ox40 항체를 사용하는 암 치료의 방법 | |
| WO2025039072A1 (en) | Activin receptor type iib variants and uses thereof | |
| CN118786152A (zh) | 激活素iib型受体变体及其用途 | |
| JP7674837B2 (ja) | Apj抗体及びelabelaとのその融合タンパク質並びにその医薬組成物及び用途 | |
| WO2025019954A1 (en) | Activin receptor type iib variants and uses thereof | |
| AU2021376241A1 (en) | Novel bifunctional multispecific antagonists capable of inhibiting multiple ligands of tgf-beta family and uses thereof | |
| WO2020248967A1 (zh) | Eta抗体与bnp的融合蛋白质,以及其药物组合物和应用 | |
| WO2025050218A1 (en) | Combination therapy with actriib receptor variants and glp-1 agonists | |
| WO2024107752A2 (en) | Compositions and methods for immunomodulatory bifunctional fusion molecules |