CN1972956A - 用作丙型肝炎病毒ns3丝氨酸蛋白酶抑制剂的新化合物 - Google Patents
用作丙型肝炎病毒ns3丝氨酸蛋白酶抑制剂的新化合物 Download PDFInfo
- Publication number
- CN1972956A CN1972956A CNA2005800126954A CN200580012695A CN1972956A CN 1972956 A CN1972956 A CN 1972956A CN A2005800126954 A CNA2005800126954 A CN A2005800126954A CN 200580012695 A CN200580012695 A CN 200580012695A CN 1972956 A CN1972956 A CN 1972956A
- Authority
- CN
- China
- Prior art keywords
- compound
- alkyl
- yuan
- aryl
- hcv
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
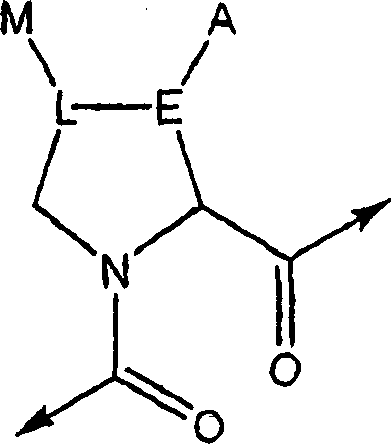
- 150000001875 compounds Chemical class 0.000 title claims abstract description 197
- 239000003112 inhibitor Substances 0.000 title description 13
- 108010022999 Serine Proteases Proteins 0.000 title description 11
- 102000012479 Serine Proteases Human genes 0.000 title description 11
- 108700012707 hepatitis C virus NS3 Proteins 0.000 title description 2
- 238000000034 method Methods 0.000 claims abstract description 95
- 108091005804 Peptidases Proteins 0.000 claims abstract description 25
- 239000004365 Protease Substances 0.000 claims abstract description 9
- 230000002401 inhibitory effect Effects 0.000 claims abstract description 3
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 claims abstract 4
- 239000000203 mixture Substances 0.000 claims description 102
- -1 heterocyclic radical Chemical class 0.000 claims description 78
- 125000000217 alkyl group Chemical group 0.000 claims description 76
- 238000002360 preparation method Methods 0.000 claims description 71
- 241000711549 Hepacivirus C Species 0.000 claims description 67
- 150000003839 salts Chemical class 0.000 claims description 54
- 125000003118 aryl group Chemical group 0.000 claims description 36
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 36
- 125000001072 heteroaryl group Chemical group 0.000 claims description 31
- 150000002148 esters Chemical class 0.000 claims description 26
- 125000000304 alkynyl group Chemical group 0.000 claims description 24
- 102000035195 Peptidases Human genes 0.000 claims description 21
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 21
- 229910052760 oxygen Inorganic materials 0.000 claims description 20
- 229910052799 carbon Inorganic materials 0.000 claims description 19
- 239000012453 solvate Substances 0.000 claims description 19
- 201000010099 disease Diseases 0.000 claims description 18
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 18
- 239000003814 drug Substances 0.000 claims description 18
- 125000002769 thiazolinyl group Chemical group 0.000 claims description 18
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 15
- 208000005176 Hepatitis C Diseases 0.000 claims description 14
- 229940079322 interferon Drugs 0.000 claims description 14
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 12
- 229910052736 halogen Inorganic materials 0.000 claims description 11
- 150000002367 halogens Chemical class 0.000 claims description 11
- 229920001184 polypeptide Polymers 0.000 claims description 11
- 108010050904 Interferons Proteins 0.000 claims description 10
- 102000014150 Interferons Human genes 0.000 claims description 10
- 241000283973 Oryctolagus cuniculus Species 0.000 claims description 9
- 125000003545 alkoxy group Chemical group 0.000 claims description 9
- 125000002877 alkyl aryl group Chemical group 0.000 claims description 8
- 125000004390 alkyl sulfonyl group Chemical group 0.000 claims description 8
- 125000004414 alkyl thio group Chemical group 0.000 claims description 8
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 8
- 230000000694 effects Effects 0.000 claims description 8
- 229910052739 hydrogen Inorganic materials 0.000 claims description 8
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 8
- 238000012545 processing Methods 0.000 claims description 8
- XSQUKJJJFZCRTK-UHFFFAOYSA-N urea group Chemical group NC(=O)N XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 claims description 8
- 230000000840 anti-viral effect Effects 0.000 claims description 7
- 125000005110 aryl thio group Chemical group 0.000 claims description 7
- 125000004104 aryloxy group Chemical group 0.000 claims description 7
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 7
- 125000004475 heteroaralkyl group Chemical group 0.000 claims description 7
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 7
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 7
- 108010047761 Interferon-alpha Proteins 0.000 claims description 6
- 125000004391 aryl sulfonyl group Chemical group 0.000 claims description 6
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 6
- 239000003937 drug carrier Substances 0.000 claims description 6
- 125000000623 heterocyclic group Chemical group 0.000 claims description 6
- 230000004048 modification Effects 0.000 claims description 6
- 238000012986 modification Methods 0.000 claims description 6
- 208000024891 symptom Diseases 0.000 claims description 6
- 230000015572 biosynthetic process Effects 0.000 claims description 5
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 5
- IWUCXVSUMQZMFG-AFCXAGJDSA-N Ribavirin Chemical compound N1=C(C(=O)N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 IWUCXVSUMQZMFG-AFCXAGJDSA-N 0.000 claims description 4
- 125000005194 alkoxycarbonyloxy group Chemical group 0.000 claims description 4
- 125000003282 alkyl amino group Chemical group 0.000 claims description 4
- 125000004656 alkyl sulfonylamino group Chemical group 0.000 claims description 4
- 125000003368 amide group Chemical group 0.000 claims description 4
- 125000001769 aryl amino group Chemical group 0.000 claims description 4
- 125000005518 carboxamido group Chemical group 0.000 claims description 4
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 4
- 229960000329 ribavirin Drugs 0.000 claims description 4
- HZCAHMRRMINHDJ-DBRKOABJSA-N ribavirin Natural products O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1N=CN=C1 HZCAHMRRMINHDJ-DBRKOABJSA-N 0.000 claims description 4
- 125000005420 sulfonamido group Chemical group S(=O)(=O)(N*)* 0.000 claims description 4
- 125000004149 thio group Chemical group *S* 0.000 claims description 4
- 125000004446 heteroarylalkyl group Chemical group 0.000 claims description 3
- 108010092851 peginterferon alfa-2b Proteins 0.000 claims description 3
- 229940106366 pegintron Drugs 0.000 claims description 3
- 230000001105 regulatory effect Effects 0.000 claims description 3
- 125000005213 alkyl heteroaryl group Chemical group 0.000 claims description 2
- 125000000468 ketone group Chemical group 0.000 claims description 2
- 238000007920 subcutaneous administration Methods 0.000 claims description 2
- 125000004213 tert-butoxy group Chemical group [H]C([H])([H])C(O*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 2
- 239000008194 pharmaceutical composition Substances 0.000 abstract 1
- 239000000243 solution Substances 0.000 description 123
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 95
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical class OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 84
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 63
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 51
- 239000011541 reaction mixture Substances 0.000 description 49
- 238000003756 stirring Methods 0.000 description 48
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 44
- 235000019439 ethyl acetate Nutrition 0.000 description 44
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 42
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 40
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 37
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 37
- 239000000460 chlorine Substances 0.000 description 36
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 32
- 238000005406 washing Methods 0.000 description 31
- 239000007864 aqueous solution Substances 0.000 description 30
- 238000001035 drying Methods 0.000 description 29
- 239000012044 organic layer Substances 0.000 description 29
- 239000007787 solid Substances 0.000 description 26
- 230000000670 limiting effect Effects 0.000 description 25
- 239000000047 product Substances 0.000 description 25
- 239000012141 concentrate Substances 0.000 description 23
- 235000008504 concentrate Nutrition 0.000 description 23
- 239000000463 material Substances 0.000 description 23
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 22
- 239000002253 acid Substances 0.000 description 20
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 18
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 18
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 18
- 238000000746 purification Methods 0.000 description 18
- 239000000758 substrate Substances 0.000 description 18
- 239000002585 base Substances 0.000 description 17
- 125000004432 carbon atom Chemical group C* 0.000 description 17
- 229920006395 saturated elastomer Polymers 0.000 description 17
- 238000010790 dilution Methods 0.000 description 16
- 239000012895 dilution Substances 0.000 description 16
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 15
- 239000003153 chemical reaction reagent Substances 0.000 description 15
- 239000003921 oil Substances 0.000 description 15
- 238000010898 silica gel chromatography Methods 0.000 description 15
- 239000011734 sodium Substances 0.000 description 15
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 14
- 238000000605 extraction Methods 0.000 description 14
- 239000000376 reactant Substances 0.000 description 14
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 13
- 125000004429 atom Chemical group 0.000 description 13
- 238000001914 filtration Methods 0.000 description 13
- 239000012299 nitrogen atmosphere Substances 0.000 description 13
- 239000001301 oxygen Substances 0.000 description 13
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 13
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 12
- 239000000651 prodrug Substances 0.000 description 12
- 229940002612 prodrug Drugs 0.000 description 12
- 238000010792 warming Methods 0.000 description 12
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 11
- 150000001412 amines Chemical class 0.000 description 11
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 11
- 239000010410 layer Substances 0.000 description 11
- 239000007788 liquid Substances 0.000 description 11
- 229910052757 nitrogen Inorganic materials 0.000 description 11
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 10
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 10
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 10
- 150000001335 aliphatic alkanes Chemical class 0.000 description 10
- 238000006243 chemical reaction Methods 0.000 description 10
- 230000006837 decompression Effects 0.000 description 10
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 10
- 239000003795 chemical substances by application Substances 0.000 description 9
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 9
- 239000000706 filtrate Substances 0.000 description 9
- 238000009472 formulation Methods 0.000 description 9
- 239000000725 suspension Substances 0.000 description 9
- 229920002472 Starch Polymers 0.000 description 8
- 239000005864 Sulphur Substances 0.000 description 8
- 150000001413 amino acids Chemical class 0.000 description 8
- 238000004440 column chromatography Methods 0.000 description 8
- 238000001816 cooling Methods 0.000 description 8
- 239000012043 crude product Substances 0.000 description 8
- 239000002245 particle Substances 0.000 description 8
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 8
- 239000002904 solvent Substances 0.000 description 8
- 239000008107 starch Substances 0.000 description 8
- 235000019698 starch Nutrition 0.000 description 8
- 229940032147 starch Drugs 0.000 description 8
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 7
- 102000004190 Enzymes Human genes 0.000 description 7
- 108090000790 Enzymes Proteins 0.000 description 7
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerol Natural products OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 7
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 7
- 229910004298 SiO 2 Inorganic materials 0.000 description 7
- 150000001408 amides Chemical class 0.000 description 7
- 238000010511 deprotection reaction Methods 0.000 description 7
- 229940088598 enzyme Drugs 0.000 description 7
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 7
- 238000001819 mass spectrum Methods 0.000 description 7
- 150000004702 methyl esters Chemical class 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- 208000030507 AIDS Diseases 0.000 description 6
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 6
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- 235000010443 alginic acid Nutrition 0.000 description 6
- 229920000615 alginic acid Polymers 0.000 description 6
- 239000002775 capsule Substances 0.000 description 6
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 6
- 238000004587 chromatography analysis Methods 0.000 description 6
- NKLCNNUWBJBICK-UHFFFAOYSA-N dess–martin periodinane Chemical compound C1=CC=C2I(OC(=O)C)(OC(C)=O)(OC(C)=O)OC(=O)C2=C1 NKLCNNUWBJBICK-UHFFFAOYSA-N 0.000 description 6
- 239000001257 hydrogen Substances 0.000 description 6
- 239000000314 lubricant Substances 0.000 description 6
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 6
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 6
- 239000003826 tablet Substances 0.000 description 6
- 150000001299 aldehydes Chemical class 0.000 description 5
- 238000001704 evaporation Methods 0.000 description 5
- 230000008020 evaporation Effects 0.000 description 5
- 229920000591 gum Polymers 0.000 description 5
- 230000007062 hydrolysis Effects 0.000 description 5
- 238000006460 hydrolysis reaction Methods 0.000 description 5
- AICOOMRHRUFYCM-ZRRPKQBOSA-N oxazine, 1 Chemical compound C([C@@H]1[C@H](C(C[C@]2(C)[C@@H]([C@H](C)N(C)C)[C@H](O)C[C@]21C)=O)CC1=CC2)C[C@H]1[C@@]1(C)[C@H]2N=C(C(C)C)OC1 AICOOMRHRUFYCM-ZRRPKQBOSA-N 0.000 description 5
- 239000000843 powder Substances 0.000 description 5
- 230000008569 process Effects 0.000 description 5
- 235000019419 proteases Nutrition 0.000 description 5
- 108090000623 proteins and genes Proteins 0.000 description 5
- 102000004169 proteins and genes Human genes 0.000 description 5
- 239000012266 salt solution Substances 0.000 description 5
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 4
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 4
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 4
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical class [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 4
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 4
- 239000007821 HATU Substances 0.000 description 4
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 4
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical class [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 4
- 125000002252 acyl group Chemical group 0.000 description 4
- 229940072056 alginate Drugs 0.000 description 4
- 125000005038 alkynylalkyl group Chemical group 0.000 description 4
- 239000011230 binding agent Substances 0.000 description 4
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 4
- 150000001721 carbon Chemical group 0.000 description 4
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 4
- 235000010980 cellulose Nutrition 0.000 description 4
- 229920002678 cellulose Polymers 0.000 description 4
- 239000001913 cellulose Substances 0.000 description 4
- 230000008859 change Effects 0.000 description 4
- 238000011097 chromatography purification Methods 0.000 description 4
- 238000013016 damping Methods 0.000 description 4
- JXTHNDFMNIQAHM-UHFFFAOYSA-N dichloroacetic acid Chemical compound OC(=O)C(Cl)Cl JXTHNDFMNIQAHM-UHFFFAOYSA-N 0.000 description 4
- 125000003438 dodecyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 239000000839 emulsion Substances 0.000 description 4
- 238000005516 engineering process Methods 0.000 description 4
- 239000012530 fluid Substances 0.000 description 4
- 125000000524 functional group Chemical group 0.000 description 4
- 235000011187 glycerol Nutrition 0.000 description 4
- 208000010710 hepatitis C virus infection Diseases 0.000 description 4
- KDCIHNCMPUBDKT-UHFFFAOYSA-N hexane;propan-2-one Chemical compound CC(C)=O.CCCCCC KDCIHNCMPUBDKT-UHFFFAOYSA-N 0.000 description 4
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- 229920000609 methyl cellulose Polymers 0.000 description 4
- 239000001923 methylcellulose Substances 0.000 description 4
- 238000012544 monitoring process Methods 0.000 description 4
- 238000005897 peptide coupling reaction Methods 0.000 description 4
- 229960001866 silicon dioxide Drugs 0.000 description 4
- 235000014347 soups Nutrition 0.000 description 4
- 238000003786 synthesis reaction Methods 0.000 description 4
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 4
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 4
- QDZOEBFLNHCSSF-PFFBOGFISA-N (2S)-2-[[(2R)-2-[[(2S)-1-[(2S)-6-amino-2-[[(2S)-1-[(2R)-2-amino-5-carbamimidamidopentanoyl]pyrrolidine-2-carbonyl]amino]hexanoyl]pyrrolidine-2-carbonyl]amino]-3-(1H-indol-3-yl)propanoyl]amino]-N-[(2R)-1-[[(2S)-1-[[(2R)-1-[[(2S)-1-[[(2S)-1-amino-4-methyl-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-3-(1H-indol-3-yl)-1-oxopropan-2-yl]amino]-1-oxo-3-phenylpropan-2-yl]amino]-3-(1H-indol-3-yl)-1-oxopropan-2-yl]pentanediamide Chemical compound C([C@@H](C(=O)N[C@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(N)=O)NC(=O)[C@@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCCN)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](N)CCCNC(N)=N)C1=CC=CC=C1 QDZOEBFLNHCSSF-PFFBOGFISA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 3
- 108010010803 Gelatin Proteins 0.000 description 3
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 3
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 3
- 241001597008 Nomeidae Species 0.000 description 3
- 102400000096 Substance P Human genes 0.000 description 3
- 101800003906 Substance P Proteins 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- 240000008042 Zea mays Species 0.000 description 3
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 3
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 3
- 230000002378 acidificating effect Effects 0.000 description 3
- 125000003342 alkenyl group Chemical group 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 125000005161 aryl oxy carbonyl group Chemical group 0.000 description 3
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 229910052801 chlorine Inorganic materials 0.000 description 3
- 239000012230 colorless oil Substances 0.000 description 3
- 235000005822 corn Nutrition 0.000 description 3
- 238000010168 coupling process Methods 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 230000032050 esterification Effects 0.000 description 3
- 238000005886 esterification reaction Methods 0.000 description 3
- OAYLNYINCPYISS-UHFFFAOYSA-N ethyl acetate;hexane Chemical compound CCCCCC.CCOC(C)=O OAYLNYINCPYISS-UHFFFAOYSA-N 0.000 description 3
- 239000000284 extract Substances 0.000 description 3
- 239000007789 gas Substances 0.000 description 3
- 239000008273 gelatin Substances 0.000 description 3
- 229920000159 gelatin Polymers 0.000 description 3
- 235000019322 gelatine Nutrition 0.000 description 3
- 235000011852 gelatine desserts Nutrition 0.000 description 3
- 239000003292 glue Substances 0.000 description 3
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 3
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 3
- 238000005984 hydrogenation reaction Methods 0.000 description 3
- 239000012948 isocyanate Substances 0.000 description 3
- 150000002513 isocyanates Chemical class 0.000 description 3
- KXKVLQRXCPHEJC-UHFFFAOYSA-N methyl acetate Chemical compound COC(C)=O KXKVLQRXCPHEJC-UHFFFAOYSA-N 0.000 description 3
- 229940016286 microcrystalline cellulose Drugs 0.000 description 3
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 3
- 239000008108 microcrystalline cellulose Substances 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 230000003287 optical effect Effects 0.000 description 3
- 230000003647 oxidation Effects 0.000 description 3
- 238000007254 oxidation reaction Methods 0.000 description 3
- 230000002265 prevention Effects 0.000 description 3
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 238000000926 separation method Methods 0.000 description 3
- 239000003001 serine protease inhibitor Substances 0.000 description 3
- 239000000741 silica gel Substances 0.000 description 3
- 229910002027 silica gel Inorganic materials 0.000 description 3
- 229910052708 sodium Inorganic materials 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 238000002798 spectrophotometry method Methods 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 229910052717 sulfur Inorganic materials 0.000 description 3
- 230000004083 survival effect Effects 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 3
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 3
- 239000003981 vehicle Substances 0.000 description 3
- NXLNNXIXOYSCMB-UHFFFAOYSA-N (4-nitrophenyl) carbonochloridate Chemical compound [O-][N+](=O)C1=CC=C(OC(Cl)=O)C=C1 NXLNNXIXOYSCMB-UHFFFAOYSA-N 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- QSSXJPIWXQTSIX-UHFFFAOYSA-N 1-bromo-2-methylbenzene Chemical compound CC1=CC=CC=C1Br QSSXJPIWXQTSIX-UHFFFAOYSA-N 0.000 description 2
- XNMQEEKYCVKGBD-UHFFFAOYSA-N 2-butyne Chemical compound CC#CC XNMQEEKYCVKGBD-UHFFFAOYSA-N 0.000 description 2
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 2
- 244000215068 Acacia senegal Species 0.000 description 2
- VVJKKWFAADXIJK-UHFFFAOYSA-N Allylamine Chemical compound NCC=C VVJKKWFAADXIJK-UHFFFAOYSA-N 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- 241000416162 Astragalus gummifer Species 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 2
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 2
- 102000053642 Catalytic RNA Human genes 0.000 description 2
- 108090000994 Catalytic RNA Proteins 0.000 description 2
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 108090000317 Chymotrypsin Proteins 0.000 description 2
- 241000701022 Cytomegalovirus Species 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- 238000006646 Dess-Martin oxidation reaction Methods 0.000 description 2
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 2
- 229920000084 Gum arabic Polymers 0.000 description 2
- 101150026303 HEX1 gene Proteins 0.000 description 2
- 208000037262 Hepatitis delta Diseases 0.000 description 2
- 241000724709 Hepatitis delta virus Species 0.000 description 2
- 241000709721 Hepatovirus A Species 0.000 description 2
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 2
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical group SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- 101800001020 Non-structural protein 4A Proteins 0.000 description 2
- 240000007594 Oryza sativa Species 0.000 description 2
- 235000007164 Oryza sativa Nutrition 0.000 description 2
- 108010033276 Peptide Fragments Proteins 0.000 description 2
- 102000007079 Peptide Fragments Human genes 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 2
- 108010076039 Polyproteins Proteins 0.000 description 2
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 2
- 108050000761 Serpin Proteins 0.000 description 2
- 102000008847 Serpin Human genes 0.000 description 2
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 2
- 244000061456 Solanum tuberosum Species 0.000 description 2
- 235000002595 Solanum tuberosum Nutrition 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 241000534944 Thia Species 0.000 description 2
- 229920001615 Tragacanth Polymers 0.000 description 2
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 2
- RHQDFWAXVIIEBN-UHFFFAOYSA-N Trifluoroethanol Chemical compound OCC(F)(F)F RHQDFWAXVIIEBN-UHFFFAOYSA-N 0.000 description 2
- 241000209140 Triticum Species 0.000 description 2
- 235000021307 Triticum Nutrition 0.000 description 2
- 235000010489 acacia gum Nutrition 0.000 description 2
- 239000000205 acacia gum Substances 0.000 description 2
- WETWJCDKMRHUPV-UHFFFAOYSA-N acetyl chloride Chemical compound CC(Cl)=O WETWJCDKMRHUPV-UHFFFAOYSA-N 0.000 description 2
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 2
- 239000008186 active pharmaceutical agent Substances 0.000 description 2
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 239000000783 alginic acid Substances 0.000 description 2
- 229960001126 alginic acid Drugs 0.000 description 2
- 150000004781 alginic acids Chemical class 0.000 description 2
- 239000003513 alkali Substances 0.000 description 2
- 150000001336 alkenes Chemical class 0.000 description 2
- 125000003435 aroyl group Chemical group 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- XYOVOXDWRFGKEX-UHFFFAOYSA-N azepine Chemical compound N1C=CC=CC=C1 XYOVOXDWRFGKEX-UHFFFAOYSA-N 0.000 description 2
- 150000003851 azoles Chemical class 0.000 description 2
- 230000000903 blocking effect Effects 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 210000004899 c-terminal region Anatomy 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- 229910052791 calcium Inorganic materials 0.000 description 2
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical compound [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 230000003197 catalytic effect Effects 0.000 description 2
- 239000007795 chemical reaction product Substances 0.000 description 2
- 229960002376 chymotrypsin Drugs 0.000 description 2
- 208000019425 cirrhosis of liver Diseases 0.000 description 2
- 239000004927 clay Substances 0.000 description 2
- 238000007906 compression Methods 0.000 description 2
- 230000006835 compression Effects 0.000 description 2
- 238000013270 controlled release Methods 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 238000011262 co‐therapy Methods 0.000 description 2
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- 229960005215 dichloroacetic acid Drugs 0.000 description 2
- FAMRKDQNMBBFBR-BQYQJAHWSA-N diethyl azodicarboxylate Substances CCOC(=O)\N=N\C(=O)OCC FAMRKDQNMBBFBR-BQYQJAHWSA-N 0.000 description 2
- FPAFDBFIGPHWGO-UHFFFAOYSA-N dioxosilane;oxomagnesium;hydrate Chemical compound O.[Mg]=O.[Mg]=O.[Mg]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O FPAFDBFIGPHWGO-UHFFFAOYSA-N 0.000 description 2
- 229960004756 ethanol Drugs 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 230000003203 everyday effect Effects 0.000 description 2
- 238000011049 filling Methods 0.000 description 2
- 239000011737 fluorine Substances 0.000 description 2
- 229910052731 fluorine Inorganic materials 0.000 description 2
- 235000013305 food Nutrition 0.000 description 2
- 125000005842 heteroatom Chemical group 0.000 description 2
- 239000000833 heterodimer Substances 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 2
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 2
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 2
- 239000002955 immunomodulating agent Substances 0.000 description 2
- 229940121354 immunomodulator Drugs 0.000 description 2
- 230000002584 immunomodulator Effects 0.000 description 2
- 125000005956 isoquinolyl group Chemical group 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 238000012417 linear regression Methods 0.000 description 2
- 208000019423 liver disease Diseases 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- LVWZTYCIRDMTEY-UHFFFAOYSA-N metamizole Chemical compound O=C1C(N(CS(O)(=O)=O)C)=C(C)N(C)N1C1=CC=CC=C1 LVWZTYCIRDMTEY-UHFFFAOYSA-N 0.000 description 2
- 238000005497 microtitration Methods 0.000 description 2
- OKDQKPLMQBXTNH-UHFFFAOYSA-N n,n-dimethyl-2h-pyridin-1-amine Chemical compound CN(C)N1CC=CC=C1 OKDQKPLMQBXTNH-UHFFFAOYSA-N 0.000 description 2
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 2
- 150000007530 organic bases Chemical group 0.000 description 2
- 239000012074 organic phase Substances 0.000 description 2
- 230000006320 pegylation Effects 0.000 description 2
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 description 2
- 125000003367 polycyclic group Chemical group 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 230000017854 proteolysis Effects 0.000 description 2
- 125000003373 pyrazinyl group Chemical group 0.000 description 2
- 125000003226 pyrazolyl group Chemical group 0.000 description 2
- LEHBURLTIWGHEM-UHFFFAOYSA-N pyridinium chlorochromate Chemical compound [O-][Cr](Cl)(=O)=O.C1=CC=[NH+]C=C1 LEHBURLTIWGHEM-UHFFFAOYSA-N 0.000 description 2
- 239000002994 raw material Substances 0.000 description 2
- 239000011347 resin Substances 0.000 description 2
- 229920005989 resin Polymers 0.000 description 2
- 108091092562 ribozyme Proteins 0.000 description 2
- 235000009566 rice Nutrition 0.000 description 2
- 229910000108 silver(I,III) oxide Inorganic materials 0.000 description 2
- 239000001632 sodium acetate Substances 0.000 description 2
- 235000017281 sodium acetate Nutrition 0.000 description 2
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 208000011580 syndromic disease Diseases 0.000 description 2
- MFPWEWYKQYMWRO-UHFFFAOYSA-N tert-butyl carboxy carbonate Chemical compound CC(C)(C)OC(=O)OC(O)=O MFPWEWYKQYMWRO-UHFFFAOYSA-N 0.000 description 2
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 125000001544 thienyl group Chemical group 0.000 description 2
- 235000010487 tragacanth Nutrition 0.000 description 2
- 239000000196 tragacanth Substances 0.000 description 2
- 229940116362 tragacanth Drugs 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- ONDSBJMLAHVLMI-UHFFFAOYSA-N trimethylsilyldiazomethane Chemical compound C[Si](C)(C)[CH-][N+]#N ONDSBJMLAHVLMI-UHFFFAOYSA-N 0.000 description 2
- 230000029812 viral genome replication Effects 0.000 description 2
- LSPHULWDVZXLIL-UHFFFAOYSA-N (+/-)-Camphoric acid Chemical compound CC1(C)C(C(O)=O)CCC1(C)C(O)=O LSPHULWDVZXLIL-UHFFFAOYSA-N 0.000 description 1
- MEIRRNXMZYDVDW-MQQKCMAXSA-N (2E,4E)-2,4-hexadien-1-ol Chemical compound C\C=C\C=C\CO MEIRRNXMZYDVDW-MQQKCMAXSA-N 0.000 description 1
- JBIJSEUVWWLFGV-SFHVURJKSA-N (2s)-2-(9h-fluoren-9-ylmethoxycarbonylamino)pentanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@@H](CCC)C(O)=O)C3=CC=CC=C3C2=C1 JBIJSEUVWWLFGV-SFHVURJKSA-N 0.000 description 1
- WAMWSIDTKSNDCU-ZETCQYMHSA-N (2s)-2-azaniumyl-2-cyclohexylacetate Chemical compound OC(=O)[C@@H](N)C1CCCCC1 WAMWSIDTKSNDCU-ZETCQYMHSA-N 0.000 description 1
- QSUXZIPXYDQFCX-JTQLQIEISA-N (2s)-2-cyclohexyl-2-[(2-methylpropan-2-yl)oxycarbonylamino]acetic acid Chemical compound CC(C)(C)OC(=O)N[C@H](C(O)=O)C1CCCCC1 QSUXZIPXYDQFCX-JTQLQIEISA-N 0.000 description 1
- JXDNUMOTWHZSCB-XMTZKCFKSA-N (3s)-3-acetamido-4-[[(2s)-3-carboxy-1-[[(2s,3s)-1-[[(2s)-1-[(2s)-2-[[(1r)-1-carboxy-2-sulfanylethyl]carbamoyl]pyrrolidin-1-yl]-3-methyl-1-oxobutan-2-yl]amino]-3-methyl-1-oxopentan-2-yl]amino]-1-oxopropan-2-yl]amino]-4-oxobutanoic acid Chemical compound OC(=O)C[C@H](NC(C)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CS)C(O)=O JXDNUMOTWHZSCB-XMTZKCFKSA-N 0.000 description 1
- DSSYKIVIOFKYAU-XCBNKYQSSA-N (R)-camphor Chemical compound C1C[C@@]2(C)C(=O)C[C@@H]1C2(C)C DSSYKIVIOFKYAU-XCBNKYQSSA-N 0.000 description 1
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 1
- LNDGACQEAYKNOI-UHFFFAOYSA-N 1,1,1-trifluoro-4-iodobutane Chemical compound FC(F)(F)CCCI LNDGACQEAYKNOI-UHFFFAOYSA-N 0.000 description 1
- VXNZUUAINFGPBY-UHFFFAOYSA-N 1-Butene Chemical compound CCC=C VXNZUUAINFGPBY-UHFFFAOYSA-N 0.000 description 1
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 1
- IWUCXVSUMQZMFG-RGDLXGNYSA-N 1-[(2s,3s,4r,5s)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-1,2,4-triazole-3-carboxamide Chemical compound N1=C(C(=O)N)N=CN1[C@@H]1[C@@H](O)[C@@H](O)[C@H](CO)O1 IWUCXVSUMQZMFG-RGDLXGNYSA-N 0.000 description 1
- 125000001088 1-naphthoyl group Chemical group C1(=CC=CC2=CC=CC=C12)C(=O)* 0.000 description 1
- NALZTFARIYUCBY-UHFFFAOYSA-N 1-nitrobutane Chemical compound CCCC[N+]([O-])=O NALZTFARIYUCBY-UHFFFAOYSA-N 0.000 description 1
- ABEXEQSGABRUHS-UHFFFAOYSA-N 16-methylheptadecyl 16-methylheptadecanoate Chemical compound CC(C)CCCCCCCCCCCCCCCOC(=O)CCCCCCCCCCCCCCC(C)C ABEXEQSGABRUHS-UHFFFAOYSA-N 0.000 description 1
- AWBOSXFRPFZLOP-UHFFFAOYSA-N 2,1,3-benzoxadiazole Chemical compound C1=CC=CC2=NON=C21 AWBOSXFRPFZLOP-UHFFFAOYSA-N 0.000 description 1
- OMGHIGVFLOPEHJ-UHFFFAOYSA-N 2,5-dihydro-1h-pyrrol-1-ium-2-carboxylate Chemical class OC(=O)C1NCC=C1 OMGHIGVFLOPEHJ-UHFFFAOYSA-N 0.000 description 1
- NGNBDVOYPDDBFK-UHFFFAOYSA-N 2-[2,4-di(pentan-2-yl)phenoxy]acetyl chloride Chemical compound CCCC(C)C1=CC=C(OCC(Cl)=O)C(C(C)CCC)=C1 NGNBDVOYPDDBFK-UHFFFAOYSA-N 0.000 description 1
- XNCSCQSQSGDGES-UHFFFAOYSA-N 2-[2-[bis(carboxymethyl)amino]propyl-(carboxymethyl)amino]acetic acid Chemical compound OC(=O)CN(CC(O)=O)C(C)CN(CC(O)=O)CC(O)=O XNCSCQSQSGDGES-UHFFFAOYSA-N 0.000 description 1
- MWFMGBPGAXYFAR-UHFFFAOYSA-N 2-hydroxy-2-methylpropanenitrile Chemical compound CC(C)(O)C#N MWFMGBPGAXYFAR-UHFFFAOYSA-N 0.000 description 1
- 125000000954 2-hydroxyethyl group Chemical group [H]C([*])([H])C([H])([H])O[H] 0.000 description 1
- BKOOMYPCSUNDGP-UHFFFAOYSA-N 2-methylbut-2-ene Chemical compound CC=C(C)C BKOOMYPCSUNDGP-UHFFFAOYSA-N 0.000 description 1
- WMPPDTMATNBGJN-UHFFFAOYSA-N 2-phenylethylbromide Chemical compound BrCCC1=CC=CC=C1 WMPPDTMATNBGJN-UHFFFAOYSA-N 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- OHXAOPZTJOUYKM-UHFFFAOYSA-N 3-Chloro-2-methylpropene Chemical compound CC(=C)CCl OHXAOPZTJOUYKM-UHFFFAOYSA-N 0.000 description 1
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 description 1
- BEYOBVMPDRKTNR-BUHFOSPRSA-N 4-Hydroxyazobenzene Chemical compound C1=CC(O)=CC=C1\N=N\C1=CC=CC=C1 BEYOBVMPDRKTNR-BUHFOSPRSA-N 0.000 description 1
- BTJIUGUIPKRLHP-UHFFFAOYSA-N 4-nitrophenol Chemical class OC1=CC=C([N+]([O-])=O)C=C1 BTJIUGUIPKRLHP-UHFFFAOYSA-N 0.000 description 1
- 125000000339 4-pyridyl group Chemical group N1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 1
- WDYVUKGVKRZQNM-UHFFFAOYSA-N 6-phosphonohexylphosphonic acid Chemical compound OP(O)(=O)CCCCCCP(O)(O)=O WDYVUKGVKRZQNM-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- 208000007848 Alcoholism Diseases 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 208000008439 Biliary Liver Cirrhosis Diseases 0.000 description 1
- 208000033222 Biliary cirrhosis primary Diseases 0.000 description 1
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 1
- 229910014033 C-OH Inorganic materials 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 229940122644 Chymotrypsin inhibitor Drugs 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 108091035707 Consensus sequence Proteins 0.000 description 1
- 229920002785 Croscarmellose sodium Polymers 0.000 description 1
- 244000241257 Cucumis melo Species 0.000 description 1
- 235000015510 Cucumis melo subsp melo Nutrition 0.000 description 1
- 229910014570 C—OH Inorganic materials 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- 108010016626 Dipeptides Proteins 0.000 description 1
- SNRUBQQJIBEYMU-UHFFFAOYSA-N Dodecane Natural products CCCCCCCCCCCC SNRUBQQJIBEYMU-UHFFFAOYSA-N 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 102100038132 Endogenous retrovirus group K member 6 Pro protein Human genes 0.000 description 1
- 101710091045 Envelope protein Proteins 0.000 description 1
- 206010015856 Extrasystoles Diseases 0.000 description 1
- 239000004606 Fillers/Extenders Substances 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 1
- 229920002907 Guar gum Polymers 0.000 description 1
- 229910004373 HOAc Inorganic materials 0.000 description 1
- 241000700721 Hepatitis B virus Species 0.000 description 1
- 101000959794 Homo sapiens Interferon alpha-2 Proteins 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102100040018 Interferon alpha-2 Human genes 0.000 description 1
- 241000764238 Isis Species 0.000 description 1
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 1
- 239000003810 Jones reagent Substances 0.000 description 1
- ZGUNAGUHMKGQNY-ZETCQYMHSA-N L-alpha-phenylglycine zwitterion Chemical compound OC(=O)[C@@H](N)C1=CC=CC=C1 ZGUNAGUHMKGQNY-ZETCQYMHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- 125000002061 L-isoleucyl group Chemical group [H]N([H])[C@]([H])(C(=O)[*])[C@](C([H])([H])[H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- 229910010082 LiAlH Inorganic materials 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- 239000007993 MOPS buffer Substances 0.000 description 1
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- 101100129514 Mus musculus Mbip gene Proteins 0.000 description 1
- MDXGYYOJGPFFJL-QMMMGPOBSA-N N(alpha)-t-butoxycarbonyl-L-leucine Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)OC(C)(C)C MDXGYYOJGPFFJL-QMMMGPOBSA-N 0.000 description 1
- XUYPXLNMDZIRQH-LURJTMIESA-N N-acetyl-L-methionine Chemical compound CSCC[C@@H](C(O)=O)NC(C)=O XUYPXLNMDZIRQH-LURJTMIESA-N 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 108090001074 Nucleocapsid Proteins Proteins 0.000 description 1
- PCKPVGOLPKLUHR-UHFFFAOYSA-N OH-Indolxyl Natural products C1=CC=C2C(O)=CNC2=C1 PCKPVGOLPKLUHR-UHFFFAOYSA-N 0.000 description 1
- 241001165050 Ocala Species 0.000 description 1
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- YGYAWVDWMABLBF-UHFFFAOYSA-N Phosgene Chemical compound ClC(Cl)=O YGYAWVDWMABLBF-UHFFFAOYSA-N 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 1
- 208000012654 Primary biliary cholangitis Diseases 0.000 description 1
- 101710188315 Protein X Proteins 0.000 description 1
- 241000219492 Quercus Species 0.000 description 1
- 101800001098 Serine protease NS3 Proteins 0.000 description 1
- 101800001838 Serine protease/helicase NS3 Proteins 0.000 description 1
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 1
- BCKXLBQYZLBQEK-KVVVOXFISA-M Sodium oleate Chemical compound [Na+].CCCCCCCC\C=C/CCCCCCCC([O-])=O BCKXLBQYZLBQEK-KVVVOXFISA-M 0.000 description 1
- 239000004902 Softening Agent Substances 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 240000006474 Theobroma bicolor Species 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 108010046075 Thymosin Proteins 0.000 description 1
- 102000007501 Thymosin Human genes 0.000 description 1
- 229940122618 Trypsin inhibitor Drugs 0.000 description 1
- 101710162629 Trypsin inhibitor Proteins 0.000 description 1
- 102000003990 Urokinase-type plasminogen activator Human genes 0.000 description 1
- 108090000435 Urokinase-type plasminogen activator Proteins 0.000 description 1
- 108010067390 Viral Proteins Proteins 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- FJJCIZWZNKZHII-UHFFFAOYSA-N [4,6-bis(cyanoamino)-1,3,5-triazin-2-yl]cyanamide Chemical compound N#CNC1=NC(NC#N)=NC(NC#N)=N1 FJJCIZWZNKZHII-UHFFFAOYSA-N 0.000 description 1
- DPDMMXDBJGCCQC-UHFFFAOYSA-N [Na].[Cl] Chemical compound [Na].[Cl] DPDMMXDBJGCCQC-UHFFFAOYSA-N 0.000 description 1
- SORGEQQSQGNZFI-UHFFFAOYSA-N [azido(phenoxy)phosphoryl]oxybenzene Chemical compound C=1C=CC=CC=1OP(=O)(N=[N+]=[N-])OC1=CC=CC=C1 SORGEQQSQGNZFI-UHFFFAOYSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- SPEUIVXLLWOEMJ-UHFFFAOYSA-N acetaldehyde dimethyl acetal Natural products COC(C)OC SPEUIVXLLWOEMJ-UHFFFAOYSA-N 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 239000012346 acetyl chloride Substances 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 239000003463 adsorbent Substances 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 235000010419 agar Nutrition 0.000 description 1
- 229940023476 agar Drugs 0.000 description 1
- 201000007930 alcohol dependence Diseases 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001447 alkali salts Chemical class 0.000 description 1
- 125000004450 alkenylene group Chemical group 0.000 description 1
- 125000004183 alkoxy alkyl group Chemical group 0.000 description 1
- 150000001350 alkyl halides Chemical class 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- 239000005030 aluminium foil Substances 0.000 description 1
- WMGSQTMJHBYJMQ-UHFFFAOYSA-N aluminum;magnesium;silicate Chemical compound [Mg+2].[Al+3].[O-][Si]([O-])([O-])[O-] WMGSQTMJHBYJMQ-UHFFFAOYSA-N 0.000 description 1
- 238000005576 amination reaction Methods 0.000 description 1
- 150000001414 amino alcohols Chemical class 0.000 description 1
- 235000010407 ammonium alginate Nutrition 0.000 description 1
- 239000000728 ammonium alginate Substances 0.000 description 1
- KPGABFJTMYCRHJ-YZOKENDUSA-N ammonium alginate Chemical compound [NH4+].[NH4+].O1[C@@H](C([O-])=O)[C@@H](OC)[C@H](O)[C@H](O)[C@@H]1O[C@@H]1[C@@H](C([O-])=O)O[C@@H](O)[C@@H](O)[C@H]1O KPGABFJTMYCRHJ-YZOKENDUSA-N 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 239000012736 aqueous medium Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 125000005160 aryl oxy alkyl group Chemical group 0.000 description 1
- 125000003289 ascorbyl group Chemical class [H]O[C@@]([H])(C([H])([H])O*)[C@@]1([H])OC(=O)C(O*)=C1O* 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 125000005334 azaindolyl group Chemical group N1N=C(C2=CC=CC=C12)* 0.000 description 1
- JXLHNMVSKXFWAO-UHFFFAOYSA-N azane;7-fluoro-2,1,3-benzoxadiazole-4-sulfonic acid Chemical compound N.OS(=O)(=O)C1=CC=C(F)C2=NON=C12 JXLHNMVSKXFWAO-UHFFFAOYSA-N 0.000 description 1
- SVPXDRXYRYOSEX-UHFFFAOYSA-N bentoquatam Chemical compound O.O=[Si]=O.O=[Al]O[Al]=O SVPXDRXYRYOSEX-UHFFFAOYSA-N 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 1
- PUJDIJCNWFYVJX-UHFFFAOYSA-N benzyl carbamate Chemical compound NC(=O)OCC1=CC=CC=C1 PUJDIJCNWFYVJX-UHFFFAOYSA-N 0.000 description 1
- 125000000051 benzyloxy group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])O* 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000008033 biological extinction Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- SIPUZPBQZHNSDW-UHFFFAOYSA-N bis(2-methylpropyl)aluminum Chemical compound CC(C)C[Al]CC(C)C SIPUZPBQZHNSDW-UHFFFAOYSA-N 0.000 description 1
- VQLYBLABXAHUDN-UHFFFAOYSA-N bis(4-fluorophenyl)-methyl-(1,2,4-triazol-1-ylmethyl)silane;methyl n-(1h-benzimidazol-2-yl)carbamate Chemical compound C1=CC=C2NC(NC(=O)OC)=NC2=C1.C=1C=C(F)C=CC=1[Si](C=1C=CC(F)=CC=1)(C)CN1C=NC=N1 VQLYBLABXAHUDN-UHFFFAOYSA-N 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 1
- 239000004327 boric acid Substances 0.000 description 1
- 235000010338 boric acid Nutrition 0.000 description 1
- 230000005587 bubbling Effects 0.000 description 1
- 150000004648 butanoic acid derivatives Chemical class 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 229960000846 camphor Drugs 0.000 description 1
- 229950005953 camsilate Drugs 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical compound OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 150000001733 carboxylic acid esters Chemical class 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 238000001311 chemical methods and process Methods 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- LADPCMZCENPFGV-UHFFFAOYSA-N chloromethoxymethylbenzene Chemical compound ClCOCC1=CC=CC=C1 LADPCMZCENPFGV-UHFFFAOYSA-N 0.000 description 1
- 239000003541 chymotrypsin inhibitor Substances 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 230000006957 competitive inhibition Effects 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 229960001681 croscarmellose sodium Drugs 0.000 description 1
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 230000002354 daily effect Effects 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 229960000935 dehydrated alcohol Drugs 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- JMVOCSLPMGHXPG-UHFFFAOYSA-N dipotassium;dioxido(dioxo)osmium Chemical compound [K+].[K+].[O-][Os]([O-])(=O)=O JMVOCSLPMGHXPG-UHFFFAOYSA-N 0.000 description 1
- 238000007598 dipping method Methods 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- FCNVPOALDDLXOR-UHFFFAOYSA-L disodium;benzoate;chloride Chemical compound [Na+].[Na+].[Cl-].[O-]C(=O)C1=CC=CC=C1 FCNVPOALDDLXOR-UHFFFAOYSA-L 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 238000001647 drug administration Methods 0.000 description 1
- 238000007908 dry granulation Methods 0.000 description 1
- 241001493065 dsRNA viruses Species 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 238000000119 electrospray ionisation mass spectrum Methods 0.000 description 1
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000012065 filter cake Substances 0.000 description 1
- 230000004907 flux Effects 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 238000013467 fragmentation Methods 0.000 description 1
- 238000006062 fragmentation reaction Methods 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 235000015203 fruit juice Nutrition 0.000 description 1
- JKFAIQOWCVVSKC-UHFFFAOYSA-N furazan Chemical compound C=1C=NON=1 JKFAIQOWCVVSKC-UHFFFAOYSA-N 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 235000010417 guar gum Nutrition 0.000 description 1
- 239000000665 guar gum Substances 0.000 description 1
- 229960002154 guar gum Drugs 0.000 description 1
- 239000007887 hard shell capsule Substances 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 208000002672 hepatitis B Diseases 0.000 description 1
- 125000005312 heteroarylalkynyl group Chemical group 0.000 description 1
- 125000005143 heteroarylsulfonyl group Chemical group 0.000 description 1
- 125000005368 heteroarylthio group Chemical group 0.000 description 1
- 125000004415 heterocyclylalkyl group Chemical group 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- 125000004356 hydroxy functional group Chemical group O* 0.000 description 1
- 238000005417 image-selected in vivo spectroscopy Methods 0.000 description 1
- 125000005946 imidazo[1,2-a]pyridyl group Chemical group 0.000 description 1
- 150000002460 imidazoles Chemical class 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 125000005945 imidazopyridyl group Chemical group 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 238000005470 impregnation Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 230000000937 inactivator Effects 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- JYGFTBXVXVMTGB-UHFFFAOYSA-N indolin-2-one Chemical compound C1=CC=C2NC(=O)CC2=C1 JYGFTBXVXVMTGB-UHFFFAOYSA-N 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 229940090438 infergen Drugs 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000012739 integrated shape imaging system Methods 0.000 description 1
- 108010010648 interferon alfacon-1 Proteins 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 125000005929 isobutyloxycarbonyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])OC(*)=O 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 229950003188 isovaleryl diethylamide Drugs 0.000 description 1
- 235000015110 jellies Nutrition 0.000 description 1
- 239000008274 jelly Substances 0.000 description 1
- 150000003951 lactams Chemical group 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical class CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 1
- 125000000686 lactone group Chemical group 0.000 description 1
- 230000002045 lasting effect Effects 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 239000012280 lithium aluminium hydride Substances 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- HRDXJKGNWSUIBT-UHFFFAOYSA-N methoxybenzene Chemical group [CH2]OC1=CC=CC=C1 HRDXJKGNWSUIBT-UHFFFAOYSA-N 0.000 description 1
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 1
- 125000004184 methoxymethyl group Chemical group [H]C([H])([H])OC([H])([H])* 0.000 description 1
- XMJHPCRAQCTCFT-UHFFFAOYSA-N methyl chloroformate Chemical compound COC(Cl)=O XMJHPCRAQCTCFT-UHFFFAOYSA-N 0.000 description 1
- JZMJDSHXVKJFKW-UHFFFAOYSA-M methyl sulfate(1-) Chemical compound COS([O-])(=O)=O JZMJDSHXVKJFKW-UHFFFAOYSA-M 0.000 description 1
- GDOPTJXRTPNYNR-UHFFFAOYSA-N methyl-cyclopentane Natural products CC1CCCC1 GDOPTJXRTPNYNR-UHFFFAOYSA-N 0.000 description 1
- 125000002816 methylsulfanyl group Chemical group [H]C([H])([H])S[*] 0.000 description 1
- IYSNYCQLARBERC-UHFFFAOYSA-N methylsulfinylmethane;toluene Chemical compound CS(C)=O.CC1=CC=CC=C1 IYSNYCQLARBERC-UHFFFAOYSA-N 0.000 description 1
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 1
- 239000002808 molecular sieve Substances 0.000 description 1
- 125000002911 monocyclic heterocycle group Chemical group 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- RTGDFNSFWBGLEC-SYZQJQIISA-N mycophenolate mofetil Chemical compound COC1=C(C)C=2COC(=O)C=2C(O)=C1C\C=C(/C)CCC(=O)OCCN1CCOCC1 RTGDFNSFWBGLEC-SYZQJQIISA-N 0.000 description 1
- 229960004866 mycophenolate mofetil Drugs 0.000 description 1
- 125000006606 n-butoxy group Chemical group 0.000 description 1
- AFFLGGQVNFXPEV-UHFFFAOYSA-N n-decene Natural products CCCCCCCCC=C AFFLGGQVNFXPEV-UHFFFAOYSA-N 0.000 description 1
- PSZYNBSKGUBXEH-UHFFFAOYSA-M naphthalene-1-sulfonate Chemical compound C1=CC=C2C(S(=O)(=O)[O-])=CC=CC2=C1 PSZYNBSKGUBXEH-UHFFFAOYSA-M 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 125000004923 naphthylmethyl group Chemical group C1(=CC=CC2=CC=CC=C12)C* 0.000 description 1
- 125000005186 naphthyloxy group Chemical group C1(=CC=CC2=CC=CC=C12)O* 0.000 description 1
- 229920001206 natural gum Polymers 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- ODUCDPQEXGNKDN-UHFFFAOYSA-N nitroxyl Chemical compound O=N ODUCDPQEXGNKDN-UHFFFAOYSA-N 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 125000004365 octenyl group Chemical group C(=CCCCCCC)* 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 229940041672 oral gel Drugs 0.000 description 1
- 239000007935 oral tablet Substances 0.000 description 1
- 229940096978 oral tablet Drugs 0.000 description 1
- 150000007524 organic acids Chemical group 0.000 description 1
- MOOYVEVEDVVKGD-UHFFFAOYSA-N oxaldehydic acid;hydrate Chemical compound O.OC(=O)C=O MOOYVEVEDVVKGD-UHFFFAOYSA-N 0.000 description 1
- TWNQGVIAIRXVLR-UHFFFAOYSA-N oxo(oxoalumanyloxy)alumane Chemical compound O=[Al]O[Al]=O TWNQGVIAIRXVLR-UHFFFAOYSA-N 0.000 description 1
- CFHIDWOYWUOIHU-UHFFFAOYSA-N oxomethyl Chemical compound O=[CH] CFHIDWOYWUOIHU-UHFFFAOYSA-N 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 229940002988 pegasys Drugs 0.000 description 1
- 108010092853 peginterferon alfa-2a Proteins 0.000 description 1
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 150000003008 phosphonic acid esters Chemical class 0.000 description 1
- 150000003014 phosphoric acid esters Chemical class 0.000 description 1
- 150000003016 phosphoric acids Chemical class 0.000 description 1
- 125000004437 phosphorous atom Chemical group 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 150000003053 piperidines Chemical class 0.000 description 1
- 125000005936 piperidyl group Chemical group 0.000 description 1
- 229940012957 plasmin Drugs 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 229940114930 potassium stearate Drugs 0.000 description 1
- ANBFRLKBEIFNQU-UHFFFAOYSA-M potassium;octadecanoate Chemical compound [K+].CCCCCCCCCCCCCCCCCC([O-])=O ANBFRLKBEIFNQU-UHFFFAOYSA-M 0.000 description 1
- 238000011533 pre-incubation Methods 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 238000003825 pressing Methods 0.000 description 1
- 150000003140 primary amides Chemical class 0.000 description 1
- 238000004393 prognosis Methods 0.000 description 1
- ALDITMKAAPLVJK-UHFFFAOYSA-N prop-1-ene;hydrate Chemical group O.CC=C ALDITMKAAPLVJK-UHFFFAOYSA-N 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 125000001501 propionyl group Chemical group O=C([*])C([H])([H])C([H])([H])[H] 0.000 description 1
- DNIAPMSPPWPWGF-UHFFFAOYSA-N propylene glycol Substances CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 1
- 125000006239 protecting group Chemical group 0.000 description 1
- 230000007065 protein hydrolysis Effects 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000005344 pyridylmethyl group Chemical group [H]C1=C([H])C([H])=C([H])C(=N1)C([H])([H])* 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000005493 quinolyl group Chemical group 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 239000013558 reference substance Substances 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 238000000611 regression analysis Methods 0.000 description 1
- 230000008521 reorganization Effects 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 239000011435 rock Substances 0.000 description 1
- YGSDEFSMJLZEOE-UHFFFAOYSA-M salicylate Chemical compound OC1=CC=CC=C1C([O-])=O YGSDEFSMJLZEOE-UHFFFAOYSA-M 0.000 description 1
- 229960001860 salicylate Drugs 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 150000003334 secondary amides Chemical class 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 238000007086 side reaction Methods 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 235000012239 silicon dioxide Nutrition 0.000 description 1
- KKKDGYXNGYJJRX-UHFFFAOYSA-M silver nitrite Chemical compound [Ag+].[O-]N=O KKKDGYXNGYJJRX-UHFFFAOYSA-M 0.000 description 1
- 238000009097 single-agent therapy Methods 0.000 description 1
- 108091069025 single-strand RNA Proteins 0.000 description 1
- URGAHOPLAPQHLN-UHFFFAOYSA-N sodium aluminosilicate Chemical compound [Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=O URGAHOPLAPQHLN-UHFFFAOYSA-N 0.000 description 1
- WXMKPNITSTVMEF-UHFFFAOYSA-M sodium benzoate Chemical compound [Na+].[O-]C(=O)C1=CC=CC=C1 WXMKPNITSTVMEF-UHFFFAOYSA-M 0.000 description 1
- 239000004299 sodium benzoate Substances 0.000 description 1
- 235000010234 sodium benzoate Nutrition 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- 239000008109 sodium starch glycolate Substances 0.000 description 1
- 229940079832 sodium starch glycolate Drugs 0.000 description 1
- 229920003109 sodium starch glycolate Polymers 0.000 description 1
- 229910052938 sodium sulfate Inorganic materials 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- 235000010265 sodium sulphite Nutrition 0.000 description 1
- HELHAJAZNSDZJO-UHFFFAOYSA-L sodium tartrate Chemical compound [Na+].[Na+].[O-]C(=O)C(O)C(O)C([O-])=O HELHAJAZNSDZJO-UHFFFAOYSA-L 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 229940114926 stearate Drugs 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 125000005017 substituted alkenyl group Chemical group 0.000 description 1
- 125000000547 substituted alkyl group Chemical group 0.000 description 1
- 125000004426 substituted alkynyl group Chemical group 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- RWSOTUBLDIXVET-UHFFFAOYSA-O sulfonium Chemical compound [SH3+] RWSOTUBLDIXVET-UHFFFAOYSA-O 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- YBRBMKDOPFTVDT-UHFFFAOYSA-N tert-butylamine Chemical compound CC(C)(C)N YBRBMKDOPFTVDT-UHFFFAOYSA-N 0.000 description 1
- 125000001712 tetrahydronaphthyl group Chemical group C1(CCCC2=CC=CC=C12)* 0.000 description 1
- 125000005958 tetrahydrothienyl group Chemical group 0.000 description 1
- 125000000383 tetramethylene group Chemical group [H]C([H])([*:1])C([H])([H])C([H])([H])C([H])([H])[*:2] 0.000 description 1
- WROMPOXWARCANT-UHFFFAOYSA-N tfa trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F.OC(=O)C(F)(F)F WROMPOXWARCANT-UHFFFAOYSA-N 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- DBDCNCCRPKTRSD-UHFFFAOYSA-N thieno[3,2-b]pyridine Chemical compound C1=CC=C2SC=CC2=N1 DBDCNCCRPKTRSD-UHFFFAOYSA-N 0.000 description 1
- RBNBDIMXFJYDLQ-UHFFFAOYSA-N thieno[3,2-d]pyrimidine Chemical compound C1=NC=C2SC=CC2=N1 RBNBDIMXFJYDLQ-UHFFFAOYSA-N 0.000 description 1
- 229940125670 thienopyridine Drugs 0.000 description 1
- 239000002175 thienopyridine Substances 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-N thiocyanic acid Chemical compound SC#N ZMZDMBWJUHKJPS-UHFFFAOYSA-N 0.000 description 1
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 1
- LCJVIYPJPCBWKS-NXPQJCNCSA-N thymosin Chemical compound SC[C@@H](N)C(=O)N[C@H](CO)C(=O)N[C@H](CC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(=O)N[C@H](C(C)C)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](C(C)C)C(=O)N[C@H](CO)C(=O)N[C@H](CO)C(=O)N[C@H](CCC(O)=O)C(=O)N[C@H]([C@@H](C)CC)C(=O)N[C@H]([C@H](C)O)C(=O)N[C@H](C(C)C)C(=O)N[C@H](CCCCN)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N[C@H](CCC(O)=O)C(=O)N[C@H](CCCCN)C(=O)N[C@H](CCCCN)C(=O)N[C@H](CCC(O)=O)C(=O)N[C@H](C(C)C)C(=O)N[C@H](C(C)C)C(=O)N[C@H](CCC(O)=O)C(=O)N[C@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@H](CCC(O)=O)C(O)=O LCJVIYPJPCBWKS-NXPQJCNCSA-N 0.000 description 1
- 125000003944 tolyl group Chemical group 0.000 description 1
- 229940125725 tranquilizer Drugs 0.000 description 1
- 239000003204 tranquilizing agent Substances 0.000 description 1
- 230000002936 tranquilizing effect Effects 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- JBWKIWSBJXDJDT-UHFFFAOYSA-N triphenylmethyl chloride Chemical compound C=1C=CC=CC=1C(C=1C=CC=CC=1)(Cl)C1=CC=CC=C1 JBWKIWSBJXDJDT-UHFFFAOYSA-N 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- 239000002753 trypsin inhibitor Substances 0.000 description 1
- 230000007306 turnover Effects 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 150000003672 ureas Chemical class 0.000 description 1
- 229960005356 urokinase Drugs 0.000 description 1
- 229960005486 vaccine Drugs 0.000 description 1
- 238000007738 vacuum evaporation Methods 0.000 description 1
- 125000002987 valine group Chemical group [H]N([H])C([H])(C(*)=O)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 238000009834 vaporization Methods 0.000 description 1
- 230000008016 vaporization Effects 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 238000005550 wet granulation Methods 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 150000004799 α-ketoamides Chemical class 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/02—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring
- C07D209/52—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring condensed with a ring other than six-membered
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/02—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing at least one abnormal peptide link
- C07K5/0202—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing at least one abnormal peptide link containing the structure -NH-X-X-C(=0)-, X being an optionally substituted carbon atom or a heteroatom, e.g. beta-amino acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/06—Dipeptides
- C07K5/06008—Dipeptides with the first amino acid being neutral
- C07K5/06017—Dipeptides with the first amino acid being neutral and aliphatic
- C07K5/06034—Dipeptides with the first amino acid being neutral and aliphatic the side chain containing 2 to 4 carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/06—Dipeptides
- C07K5/06008—Dipeptides with the first amino acid being neutral
- C07K5/06078—Dipeptides with the first amino acid being neutral and aromatic or cycloaliphatic
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/06—Dipeptides
- C07K5/06191—Dipeptides containing heteroatoms different from O, S, or N
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/08—Tripeptides
- C07K5/0802—Tripeptides with the first amino acid being neutral
- C07K5/0804—Tripeptides with the first amino acid being neutral and aliphatic
- C07K5/0808—Tripeptides with the first amino acid being neutral and aliphatic the side chain containing 2 to 4 carbon atoms, e.g. Val, Ile, Leu
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/08—Tripeptides
- C07K5/0827—Tripeptides containing heteroatoms different from O, S, or N
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Animal Behavior & Ethology (AREA)
- Virology (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Crystallography & Structural Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
本发明公开具有HCV蛋白酶抑制活性的新化合物和制备此类化合物的方法。在另一个实施方案中,本发明公开含此类化合物的药用组合物,和用它们治疗与HCV蛋白酶有关的疾病的方法。
Description
发明领域
本发明涉及新的丙型肝炎病毒(″HCV″)蛋白酶抑制剂;含一种或多种此类抑制剂的药用组合物;制备此类抑制剂的方法和用此类抑制剂治疗丙型肝炎及相关疾病的方法。本发明还公开用作HCVNS3/NS4a丝氨酸蛋白酶抑制剂的新化合物。本申请要求2004年2月27日提交的美国临时专利申请顺序号60/548,535的优先权。
发明背景
丙型肝炎病毒(HCV)是涉及非甲型、非乙型肝炎(NANBH),尤其与血液有关的NANBH(BB-NANBH)中主要病原体的(+)-义单链RNA病毒(参见,国际专利申请公布号WO 89/04669和欧洲专利申请公布号EP 381216)。NANBH与其它类型病毒引起的肝病不同,例如甲型肝炎病毒(HAV)、乙型肝炎病毒(HBV)、丁型肝炎病毒(HDV)、巨细胞病毒(CMV)和埃-巴二氏病毒(EBV),也不同于例如酒精中毒和原发性胆汁性肝硬变的其它形式肝病。
近来,已鉴定、克隆和表达出多肽加工和病毒复制必需的HCV蛋白酶。(参见例如美国专利号5,712,145)。从氨基末端到羧基末端,该约3000氨基酸多蛋白含核壳蛋白(C)、包膜蛋白(E1和E2)和一些非结构性蛋白(NS1、2、3、4a、5a和5b)。NS3是由HCV基因组的约1893个核苷酸编码的约68kda蛋白,具有两个特殊的域:(a)由约200个N-末端氨基酸组成的丝氨酸蛋白酶域;和(b)在蛋白C-末端的RNA依赖性ATP酶域。因为在蛋白序列、整体三维结构和催化机理中的相似性,NS3蛋白酶被认为是糜蛋白酶家族的成员。其它糜蛋白酶样酶是弹性蛋白酶、Xa因子、凝血酶、胰蛋白酶、纤溶酶、尿激酶、tPA和PSA。HCV NS3丝氨酸蛋白酶负责在NS3/NS4a、NS4a/NS4b、NS4b/NS5a和NS5a/NS5b接合处多肽(多蛋白)的蛋白水解,因此在病毒复制期间负责产生4种病毒蛋白。这使HCV NS3丝氨酸蛋白酶成为抗病毒化疗的有吸引力的靶。本发明化合物可抑制这种蛋白酶。它们还能调节丙型肝炎病毒(HCV)多肽的加工。
已测得约6kda多肽的NS4a蛋白是NS3丝氨酸蛋白酶活性的辅因子。由NS3/NS4a丝氨酸蛋白酶自动解离NS3/NS4a接合处发生在分子内(即顺式),而在其它解离部位为分子间进行(即反式)。
HCV蛋白酶的自然解离部位分析表明在P1存在半胱氨酸,和在P1′存在丝氨酸;这些残基严格保留在NS4a/NS4b、NS4b/NS5a和NS5a/NS5b接合处。NS3/NS4a接合处在P1含苏氨酸,在P1′含丝氨酸。假设NS3/NS4a中Cys→Thr取代解释在该接合处加工需要顺式而非反式。参见,例如Pizzi等(1994)Proc.Natl.Acad. Sci(USA)91:888-892,Failla等(1996)Folding & Design 1:35-42。NS3/NS4a解离部位还比其它部位更耐受诱变。参见,例如Kollykhalov等(1994)J.Virol.68:7525-7533。还发现在解离部位的区域上游中的酸性残基需要有效解离。参见,例如Komoda等(1994)J.Vrol.68:7351-7357。
已报道的HCV蛋白酶抑制剂包括抗氧化剂(参见国际专利申请公布号WO 98/14181)、某些肽和肽类似物(参见国际专利申请公布号WO 98/17679,Landro等(1997)Biochem.36:9340-9348,Ingallinella等(1998)Biochem.37:8906-8914,Llinàs-Brunet等(1998)Bioorg.Med.Chem.Lett.8:1713-1718)、基于70-氨基酸多肽水蛭抑制剂c的抑制剂(Martin等(1998)Biochem.37:11459-11468、选自人胰分泌胰蛋白酶抑制剂(hPSTI-C3)和小体所有组成成分(MBip)的抑制剂亲和力(Dimasi等(1997)J.Virol.71:7461-7469)、cVHE2(″camelized″可变域抗体片段)(Martin等(1997)Protein Eng.10:607-614)和α1-抗胰凝乳蛋白酶(ACT)(Elzouki等)(1997)J.Hepat.27:42-28)。最近公开了设计为选择性破坏丙型肝炎病毒RNA的核酶(参见BioWorld Today 9(217):4(1998年11月10日))。
还参考了1998年4月30日公布的PCT公布号WO 98/17679(Vertex Pharmaceuticals Incorporated);1998年5月28日公布的WO98/22496(F.Hoffmann-La Roche AG);和1999年2月18日公布的WO99/07734(Boehringer Ingelheim Canada Ltd.)。
HCV涉及肝硬变和诱发肝细胞癌。目前,感染HCV的患者预后很差。由于缺乏与HCV感染有关的免疫或缓解,HCV感染比其它形式的肝炎更难治疗。目前的数据表明肝硬化诊断后4年的存活率小于50%。诊断具有局部可切除的肝细胞癌患者5年存活率为10-30%,而具有局部不可切除的肝细胞癌患者5年存活率小于1%。
参考WO 00/59929(US 6,608,027,受让人:Boehringer Ingelheim(Canada)Ltd.;2000年10月12日公布),该专利公开下式肽衍生物:
参考A.Marchetti等,Synlett,S1,1000-1002(1999)所述合成HCVNS3蛋白酶抑制剂的双环类似物。其中公开的化合物具有下式:
还参考W.Han等,Bioorganic & Medicinal Chem.Lett,(2000)10,711-713,其中描述某些含烯丙基和乙基官能团的α-酮酰胺、α-酮酸酯和α-二酮的制备。
还参考WO 00/09558(受让人:Boehringer Ingelheim Limited;2000年2月24日公布),其中公开下式肽衍生物:
其中文中定义了各种要素。该系列化合物的示例性化合物是:
还参考WO 00/09543(受让人:Boehringer Ingelheim Limited;2000年2月24日公布),其中公开下式肽衍生物:
其中文中定义了各种要素。该系列化合物的示例性化合物是:
还参考US 6,608,027(Boehringer Ingelheim,Canada),其中公开以下类型NS3蛋白酶抑制剂:
其中文中定义了各个部分。
目前,治疗丙型肝炎的疗法包括α-干扰素(INFα)和利巴韦林与干扰素的联合疗法。参见,例如Beremguer等(1998)Proc.Assoc.Am.Physicians 110(2):98-112。这些疗法有持续响应率低和时常发生副作用的缺点。参见,例如Hoofnagle等(1997)N.Engl.J.Med.336:347。目前,没有可供使用的HCV感染疫苗。
进一步参考2001年10月11日公布的WO 01/74768(受让人:Vertex Pharmaceuticals Inc),其中公开用作丙型肝炎病毒NS3-丝氨酸蛋白酶抑制剂的某些以下通式化合物(R定义见文中):
在前述WO 01/74768中公开的具体化合物具有下式:
PCT公布号WO 01/77113;WO 01/081325;WO 02/08198;WO02/08256;WO 02/08187;WO 02/08244;WO 02/48172;WO 02/08251;和2002年1月18日提交的待审美国专利申请顺序号10/052,386中公开了作为丙型肝炎病毒NS-3丝氨酸蛋白酶抑制剂的各种类型的肽和/或其它化合物。这些申请的公开内容通过引用结合到本文中。
HCV感染需要新的治疗和疗法。需要可用于治疗或预防或缓解一种或多种丙型肝炎症状的化合物。
需要治疗或预防或缓解一种或多种丙型肝炎症状的方法。
需要用本文中提供的化合物调节丝氨酸蛋白酶,尤其HCVNS3/NS4a丝氨酸蛋白酶活性的方法。
需要用本文中提供的化合物调节HCV多肽加工的方法。
发明概述
在其许多实施方案中,本发明提供一类新的HCV蛋白酶抑制剂;含一种或多种此类化合物的药用组合物;制备含一种或多种此类化合物的药物制剂的方法;和用一种或多种此类化合物或一种或多种此类制剂,治疗或预防HCV或缓解一种或多种丙型肝炎症状的方法。还提供调节HCV多肽与HCV蛋白酶相互作用的方法。在本文提供的化合物中,优选抑制HCV NS3/NS4a丝氨酸蛋白酶活性的化合物。本发明公开化合物或所述化合物的对映体、立体异构体、旋转异构体、互变异构体、非对映体或外消旋体,或所述化合物药学上可接受的盐、溶剂化物或酯,所述化合物具有结构式I所示通用结构:
式I
其中:
R1为H、OR8、NR9R10或CHR9R10,其中R8、R9和R10可以相同或不同,各自独立选自H、烷基-、烯基-、炔基-、芳基-、杂烷基-、杂芳基-、环烷基-、杂环基-、芳烷基-和杂芳烷基;
A和M可以相同或不同,各自独立选自R、OR、NHR、NRR′、SR、SO2R和卤素;或A和M彼此连接,以使以上式I中所示部分:
形成3元、4元、6元、7元或8元环烷基、4元-8元杂环基、6元-10元芳基或5元-10元杂芳基;
E为C(H)或C(R);
L为C(H)、C(R)、CH2C(R)或C(R)CH2;
R、R1、R2和R3可以相同或不同,各自独立选自H、烷基-、烯基-、炔基-、环烷基-、杂烷基-、杂环基-、芳基-、杂芳基-、(环烷基)烷基-、(杂环基)烷基-、芳基-烷基-和杂芳基-烷基-;或者,NRR′中的R和R′彼此连接,以使NRR′形成4元-8元杂环基;
和Y选自以下部分:
或
其中G为NH或O;和R15、R16、R17、R18和R19可以相同或不同,各自独立选自H、烷基、杂烷基、烯基、杂烯基、炔基、杂炔基、环烷基、杂环基、芳基、芳烷基、杂芳基和杂芳烷基,或者,(i)R15和R16彼此连接形成4元-8元环结构,或R15和R19彼此连接形成4元-8元环结构,和(ii)同样,R17和R18独立地彼此连接形成3元-8元环烷基或杂环基;
其中所述烷基、芳基、杂芳基、环烷基或杂环基各自可未被取代,或任选独立被一个或多个选自以下的部分取代:羟基、烷氧基、芳氧基、硫代基、烷硫基、芳硫基、氨基、酰氨基、烷基氨基、芳基氨基、烷基磺酰基、芳基磺酰基、磺酰氨基、烷基磺酰氨基、芳基磺酰氨基、烷基、芳基、杂芳基、酮基、羧基、烷氧羰基、羧酰氨基、烷氧羰基氨基、烷氧羰基氧基、烷基脲基、芳基脲基、卤素、氰基和硝基。
上述陈述“A和M彼此连接,以使以上式I中所示部分:
形成3元、4元、6元、7元或8元环烷基、4元-8元杂环基、6元-10元芳基或5元-10元杂芳基”可按非限定性方式说明如下。因此,例如在当A和M连接,以使以上式I中所示部分:
形成6元环烷基(环己基)情况中,
式I可描述为:
本领域普通技术人员会认识到,当上述部分中所示的A和M:
连接形成3元、4元、7元或8元环烷基、4元-8元杂环基、6元-10元芳基或5元-10元杂芳基时,可以获得对式I的相似描述。
以上陈述:“或者,(i)R15和R16彼此连接形成4元-8元环结构,或R15和R19彼此连接形成4元-8元环结构,和(ii)同样,R17和R18独立地彼此连接形成3元-8元环烷基或杂环基”表示以下可能性:(i)R15和R16连接形成环结构,而R15和R19没有连接;(ii)R15和R19连接形成环结构,而R15和R16没有连接;和(iii)R17和R18独立地连接形成环结构,而无论(i)和(ii)中的可能性是否存在。
在上述R、R1、R2和R3的定义中,优选的烷基由1-10个碳原子组成,优选的烯基或炔基由2-10个碳原子组成,优选的环烷基由3-8个碳原子组成,以及优选的杂烷基、杂芳基或杂环烷基具有1-6个氧、氮、硫或磷原子。
式I代表的化合物本身或与本文中公开的一种或多种其它合适的药物组合可用于治疗疾病,例如HCV、HIV、AIDS(获得性免疫缺陷综合征)和相关疾病;以及用于调节丙型肝炎病毒(HCV)蛋白酶活性、预防HCV或缓解一种或多种丙型肝炎症状。可用本发明化合物和含此类化合物的药用组合物或制剂进行这种调节、治疗、预防或缓解。不受理论限制,认为HCV蛋白酶可能为NS3或NS4a蛋白酶。本发明化合物可抑制这种蛋白酶。它们还可调节丙型肝炎病毒(HCV)多肽的加工。
详述
在一个实施方案中,本发明公开由结构式I代表的化合物或其药学上可接受的盐、溶剂化物或酯,其中各个部分定义同上。
在另一个实施方案中,R1为NR9R10,R9为H,R10为H或R14,其中R14为H、烷基、芳基、杂烷基、杂芳基、环烷基、烷基-芳基、烷基-杂芳基、芳基-烷基、烯基、炔基或杂芳基-烷基。
在另一个实施方案中,R14选自:
在另一个实施方案中,R2选自以下部分:
在另一个实施方案中,R3选自:
其中R31为OH或O-烷基;和
R32为H、C(O)CH3、C(O)OtBu或C(O)N(H)tBu。
在又一个实施方案中,R3选自以下部分:
在另一个实施方案中,Y选自以下部分:
其中R15、R16、R17、R18和R19可以相同或不同,各自独立选自H、烷基、杂烷基、烯基、杂烯基、炔基、杂炔基、环烷基、杂环基、芳基和杂芳基,或者,(i)R15和R16连接形成4元-8元环结构,或R15和R19连接形成4元-8元环结构,和(ii)同样,R17和R18独立地连接形成3元-8元环烷基或杂环基;
其中所述烷基、芳基、杂芳基、环烷基或杂环基各自可未被取代,或任选独立被一个或多个选自以下的部分取代:羟基、烷氧基、芳氧基、硫代基、烷硫基、芳硫基、氨基、酰氨基、烷基氨基、芳基氨基、烷基磺酰基、芳基磺酰基、磺酰氨基、烷基磺酰氨基、芳基磺酰氨基、酮基、羧基、烷氧羰基、羧酰氨基、烷氧羰基氨基、烷氧羰基氧基、烷基脲基、芳基脲基、卤素、氰基和硝基。
在又一个实施方案中,部分:
选自:
其中Y32选自:
R16选自H、甲基、苯基、苄基;和
R15和R19可以相同或不同,各自独立选自以下基团:
或者,部分:
选自以下部分:
在又一个实施方案中,R16为H。
在另一个实施方案中,部分:
选自以下结构:
在又一个实施方案中,部分:
选自以下结构:
和
在还又一个实施方案中,部分:
选自以下结构:
在再又一个实施方案中,R1为NHR14,其中R14选自:
R2选自以下部分:
R3选自以下部分:
和
Y选自:
其中G=NH,和部分:
选自:
和
R16=H,和
R15和R19可以相同或不同,各自独立选自以下基团:
和
或者,部分:
由以下部分之一代表:
和部分:
为:
本发明的还另一个实施方案公开在本发明说明书后部分中表1、表1A、表2和表3所示化合物。表中也显示几个本发明化合物的生物活性(如Ki*值)。
在又一个实施方案中,本发明公开以下表4中化合物:
表4
在又一个实施方案中,本发明公开以下表5化合物:
表5
除非另外说明,否则在以上和本发明公开全文中使用的以下术语应理解为具有以下含义:
“患者”包括人和动物两者。
“哺乳动物”表示人和其它哺乳动物。
“烷基”表示可以为直链或支链且链中含约1至约20个碳原子的脂族烃基。优选的烷基链中含约1至约12个碳原子。更优选的烷基链中含约1至约6个碳原子。支链表示一个或多个低级烷基,例如甲基、乙基或丙基与直链烷基链连接。“低级烷基”表示链中具有约1至约6个碳原子的、可以为直链或支链的基团。术语“取代烷基”表示烷基可被一个或多个可相同或不同的取代基取代,各取代基独立选自卤素、烷基、芳基、环烷基、氰基、羟基、烷氧基、烷硫基、氨基、-NH(烷基)、-NH(环烷基)、-N(烷基)2、-N(烷基)2、羧基和-C(O)O-烷基。合适的烷基的非限定性实例包括甲基、乙基、正丙基、异丙基和叔丁基。
“烯基”表示含至少一个碳-碳双键的脂族烃基,其可以为直链或支链,且链中含约2至约15个碳原子。优选的烯基链中具有约2至约12个碳原子;更优选链中约2至约6个碳原子。支链表示一个或多个低级烷基,例如甲基、乙基或丙基与直链烯基链连接。“低级烯基”表示链中约2至约6个碳原子,其可以为直链或支链。术语“取代烯基”表示可被一个或多个可相同或不同的取代基取代的烯基,各取代基独立选自以下的基团:卤素、烷基、芳基、环烷基、氰基、烷氧基和-S(烷基)。合适的烯基的非限定性实例包括乙烯基、丙烯基、正丁烯基、3-甲基丁-2-烯基、正戊烯基、辛烯基和癸烯基。
“炔基”表示含至少一个碳-碳三键的脂族烃基,其可以为直链或支链,且链中含约2至约15个碳原子。优选的炔基链中具有约2至约12个碳原子;更优选链中约2至约4个碳原子。支链表示一个或多个低级烷基,例如甲基、乙基或丙基与直链炔基链连接。“低级炔基”表示链中约2至约6个碳原子,其可以为直链或支链。合适的炔基的非限定性实例包括乙炔基、丙炔基、2-丁炔基和3-甲基丁炔基。术语“取代炔基”表示可被一个或多个可相同或不同的取代基取代的炔基,各取代基独立选自以下的基团:烷基、芳基和环烷基。
“芳基”表示含约6至约14个碳原子,优选约6至约10个碳原子的芳族单环或多环环系统。芳基可任选被一个或多个本文中定义的、可相同或不同的“环系统取代基”取代。合适的芳基的非限定性实例包括苯基和萘基。
“杂芳基”表示含约5至约14个环原子,优选约5至约10个环原子的芳族单环或多环环系统,其中一个或多个环原子为非碳元素,例如单独的氮、氧或硫或氮、氧或硫的组合。优选的杂芳基含约5至约6个环原子。“杂芳基”可任选被一个或多个本文中定义的、可相同或不同的“环系统取代基”取代。杂芳基根名前的前缀氮杂、氧杂或硫杂分别表示存在至少一个氮、氧或硫原子环原子。杂芳基的氮原子可任选被氧化为相应的N-氧化物。合适的杂芳基的非限定性实例包括吡啶基、吡嗪基、呋喃基、噻吩基、嘧啶基、吡啶酮(包括N-取代的吡啶酮)基团、异唑基、异噻唑基、唑基、噻唑基、吡唑基、呋咱基、吡咯基、吡唑基、三唑基、1,2,4-噻二唑基、吡嗪基、哒嗪基、喹喔啉基、2,3-二氮杂萘基、羟吲哚基、咪唑并[1,2-a]吡啶基、咪唑并[2,1-b]噻唑基、苯并呋咱基、吲哚基、氮杂吲哚基、苯并咪唑基、苯并噻吩基、喹啉基、咪唑基、噻吩并吡啶基、喹唑啉基、噻吩并嘧啶基、吡咯并吡啶基、咪唑并吡啶基、异喹啉基、苯并氮杂吲哚基、1,2,4-三嗪基、苯并噻唑基等。术语“杂芳基”还指部分饱和的杂芳基部分,例如四氢异喹啉基、四氢喹啉基等。
“芳烷基”或“芳基烷基”表示芳基-烷基-,其中芳基和烷基同前述。优选的芳烷基包含低级烷基。合适的芳烷基的非限定性实例包括苄基、2-苯乙基和萘基甲基。通过烷基与母核部分连接。
“烷芳基”表示烷基-芳基-,其中烷基和芳基同前述。优选的烷芳基包含低级烷基。合适的烷芳基的非限定性实例有甲苯基。通过芳基与母核部分连接。
“环烷基”表示含约3至约10个碳原子的非芳族单环或多环环系统,优选约5至约10个碳原子。优选的环烷基环含约5至约7个环原子。环烷基可任选被一个或多个定义同上的、可相同或不同的“环系统取代基”取代。合适的单环环烷基的非限定性实例包括环丙基、环戊基、环己基、环庚基等。合适的多环环烷基的非限定性实例包括1-萘烷基、降冰片烷基(norbomyl)、金刚烷基(adamantyl)等,和部分饱和的多环环烷基,例如2,3二氢化茚基、四氢化萘基等。
“卤素”表示氟、氯、溴或碘。优选氟、氯和溴。
“环系统取代基”表示与芳族或非芳族环系统连接的取代基,它例如置换环系统上的可用氢。环系统取代基可以相同或不同,各自独立选自烷基、烯基、炔基、芳基、杂芳基、芳烷基、烷基芳基、杂芳烷基、杂芳基烯基、杂芳基炔基、烷基杂芳基、羟基、羟基烷基、烷氧基、芳氧基、芳烷氧基、酰基、芳酰基、卤素、硝基、氰基、羧基、烷氧羰基、芳氧基羰基、芳烷氧基羰基、烷基磺酰基、芳基磺酰基、杂芳基磺酰基、烷硫基、芳硫基、杂芳硫基、芳烷硫基、杂芳烷硫基、环烷基、杂环基、-C(=N-CN)-NH2、-C(=NH)-NH2、-C(=NH)-NH(烷基)、Y1Y2N-、Y1Y2N-烷基-、Y1Y2NC(O)-、Y1Y2NSO2-和-SO2NY1Y2,其中Y1和Y2可以相同或不同,且独立选自氢、烷基、芳基、环烷基和芳烷基。“环系统取代基”也可表示同时置换环系统中两相邻碳原子上两个可用氢(每个碳上1个H)的一个部分。这种部分的实例为亚甲二氧基、亚乙二氧基、-C(CH3)2-等,它形成部分,例如:
“杂环基”表示含约3至约10个环原子,优选约5至约10个环原子的非芳族饱和单环或多环环系统,其中环系统中的一个或多个原子为非碳元素,例如单独的氮、氧或硫或氮、氧或硫的组合。环系统中不存在相邻氧和/或硫原子。优选的杂环基含约5至约6个环原子。杂环基根名前的前缀氮杂、氧杂或硫杂分别表示存在至少一个氮、氧或硫原子环原子。杂环基环中的任何-NH可存在保护基团,例如-N(Boc)、-N(CBz)、-N(Tos)基团等;也可将此类保护视为本发明的一部分。杂环基可任选被一个或多个本文中定义的、可相同或不同的“环系统取代基”取代,可任选将杂环基的氮或硫原子氧化为相应的N-氧化物、S-氧化物或S,S-二氧化物。合适的单环杂环基环的非限定性实例包括哌啶基、吡咯烷基、哌嗪基、吗啉基、硫代吗啉基、噻唑烷基、1,4-二烷基、四氢呋喃基、四氢噻吩基、内酰胺基、内酯基等。
应注意,在含杂原子的本发明环系统中,与N、O或S相邻的碳原子上没有羟基,以及与另一个杂原子相邻的碳上没有N或S基。因此,例如在以下环上:
没有与标记2和5的碳直接连接的-OH。
还应注意,认为互变异构形式,例如以下部分:
和
在本发明的某些实施方案中是等同的。
“炔基烷基”表示炔基-烷基-,其中炔基和烷基同前述。优选的炔基烷基含低级炔基和低级烷基。通过烷基与母核部分连接。合适的炔基烷基的非限定性实例包括炔丙基甲基。
“杂芳烷基”表示杂芳基-烷基-,其中杂芳基和烷基同前述。优选的杂芳烷基含低级烷基。合适的芳烷基的非限定性实例包括吡啶基甲基和喹啉-3-基甲基。通过烷基与母核部分连接。
“羟烷基”表示HO-烷基-,其中烷基定义同前。优选的羟烷基含低级烷基。合适的羟烷基的非限定性实例包括羟甲基和2-羟基乙基。
“酰基”表示H-C(O)-、烷基-C(O)-或环烷基-C(O)-基团,其中各种基团同前述。通过羰基与母核部分连接。优选的酰基含低级烷基。合适的酰基的非限定性实例包括甲酰基、乙酰基和丙酰基。
“芳酰基”表示芳基-C(O)-基团,其中芳基同前述。通过羰基与母核部分连接。合适的基团的非限定性实例包括苯甲酰基和1-萘甲酰基。
“烷氧基”表示烷基-O-基团,其中烷基同前述。合适的烷氧基的非限定性实例包括甲氧基、乙氧基、正丙氧基、异丙氧基和正丁氧基。通过醚氧与母核部分连接。
“芳氧基”表示芳基-O-基团,其中芳基同前述。合适的芳氧基的非限定性实例包括苯氧基和萘氧基。通过醚氧与母核部分连接。
“芳烷氧基”表示芳烷基-O-基团,其中芳烷基同前述。合适的芳烷氧基的非限定性实例包括苄氧基和1-或2-萘甲氧基。通过醚氧与母核部分连接。
“烷硫基”表示烷基-S-基团,其中烷基同前述。合适的烷硫基的非限定性实例包括甲硫基和乙硫基。通过硫与母核部分连接。
“芳硫基”表示芳基-S-基团,其中芳基同前述。合适的芳硫基的非限定性实例包括苯硫基和萘硫基。通过硫与母核部分连接。
“芳烷硫基”表示芳烷基-S-基团,其中芳烷基同前述。合适的芳烷硫基的非限定性实例为苄硫基。通过硫与母核部分连接。
“烷氧羰基”表示烷基-O-CO-基团。合适的烷氧羰基的非限定性实例包括甲氧基羰基和乙氧基羰基。通过羰基与母核部分连接。
“芳氧基羰基”表示芳基-O-C(O)-基团。合适的芳氧基羰基的非限定性实例包括苯氧基羰基和萘氧基羰基。通过羰基与母核部分连接。
“芳烷氧基羰基”表示芳烷基-O-C(O)-基团。合适的芳烷氧基羰基的非限定性实例为苄氧基羰基。通过羰基与母核部分连接。
“烷基磺酰基”表示烷基-S(O2)-基团。优选的基团为其中烷基为低级烷基的那些基团。通过磺酰基与母核部分连接。
“芳基磺酰基”表示芳基-S(O2)-基团。通过磺酰基与母核部分连接。
术语“取代”表示在指定原子上的一个或多个氢被从指定基团中选择的基团置换,条件是在已有情况下,没有超出指定原子的正常化合价,且该取代导致稳定化合物。只要此类组合产生稳定化合物,就允许取代基和/或变量的组合。“稳定化合物”或“稳定结构”表示足够稳定,可从反应混合物分离有效纯度并配制成有效治疗药物的化合物。
当指明取代基、化合物、联合药物等的数目时,术语“一种(个)或多种(个)”或“至少一种(个)”指根据上下文,存在或加入至少一种(个)和最高达最大数目的化学和物理上允许的取代基、化合物、联合药物等,有关技术人员熟知此类技术和知识。
术语“任选取代”表示用特定基团、原子团或部分任选取代。
用于化合物的术语“分离”或“分离形式”指从合成过程或天然来源或其组合分离后,所述化合物的物理状态。用于化合物的术语“纯化”或“纯化形式”指由纯化处理方法或本文所述处理方法或熟练技术人员熟知的处理方法得到后,纯度足以通过本文中所述或熟练技术人员熟知的标准分析技术表征的所述化合物的物理状态。
还应注意,假定在本文正文、流程、实施例和表中具有不饱和价的任何杂原子,具有使化合价饱和的氢原子。
当化合物中的官能团称为“保护”时,这表示该基团为修饰形式,当化合物经历反应时,可在保护部位排除不需要的副反应。本领域普通技术人员和通过参考标准教材,例如T.W.Greene等,Protective Groups in organic Synthesis(1991),Wiley,New York可确定合适的保护基团。
当任何变量(例如芳基、杂环、R2等)在任何成分或在式I中出现大于一次时,其在每次出现时的定义独立于其在所有其他出现的定义。
本文中使用的术语“组合物”将包括含指定量的指定成分的产品,和由指定量的指定成分的组合直接或间接产生的任何产品。
本发明化合物的前药和溶剂化物也包括在本文中。本文中使用的术语“前药”表示为药物前体的化合物,当该前体给予患者后,通过代谢或化学过程进行化学转化,产生式I化合物或其盐和/或溶剂化物。在T.Higuchi and V.Stella,Pro-drugs as Novel Delivery Systems(1987)14,the A.C.S.Symposium Series和在Bioreversible Carriers inDrug Design,(1987)Edward B.Roche编辑,American PharmaceuticalAssociation and Pergamon Press中提供前药的论述,该两篇文献通过引用结合到本文中。
“溶剂化物”表示本发明化合物与一个多个溶剂分子的物理缔合物。该物理缔合涉及包括氢键键合在内的不同程度的离子和共价键键合。在某些情况中,例如当一个或多个溶剂分子结合至结晶固体的晶格中时,溶剂化物将能够被分离。“溶剂化物”包括溶液相和可分离的溶剂化物。合适的溶剂化物的非限定性实例包括乙醇化物、甲醇化物等。“水合物”为其中溶剂分子为H2O的溶剂化物。
“有效量”或“治疗有效量”用于描述有效抑制CDK(s),并因此产生需要的治疗、缓解、抑制或预防作用的本发明化合物或组合物的量。
式I化合物可形成也在本发明范围内的盐。应理解,除非另外说明,否则涉及到本文中式I化合物包括涉及其盐。本文中使用的术语“盐”表示由无机和/或有机酸形成的酸式盐,和由无机和/或有机碱形成的碱式盐。此外,当式I化合物既含例如但不限于吡啶或咪唑的碱性部分,又含例如但不限于羧酸的酸性部分时,两性离子(“内盐”)可形成,并包括在本文中使用的术语“盐”中。优选药学上可接受的(即无毒,生理上可接受的)盐,尽管其它盐也有效。例如,可通过使式I化合物在介质,例如在其中盐沉淀的介质或在水性介质中,与一定量例如一当量的酸或碱反应,随后冻干形成式I化合物的盐。
示例性酸加成盐包括乙酸盐、抗坏血酸盐、苯甲酸盐、苯磺酸盐、硫酸氢盐、硼酸盐、丁酸盐、柠檬酸盐、樟脑酸盐、樟脑磺酸盐、富马酸盐、盐酸盐、氢溴酸盐、氢碘酸盐、乳酸盐、马来酸盐、甲磺酸盐、萘磺酸盐、硝酸盐、草酸盐、磷酸盐、丙酸盐、水杨酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、甲苯磺酸盐(又称为甲苯磺酸盐)等。此外,例如P.Stahl等,Camille G.(编辑)Handbook ofPharmaceutical Salts.Properties,Selection and Use.(2002)Zurich:Wiley-VCH;S.Berge等,Journal of Pharmaceutical Sciences(1977)66(1)1-19;P.Gould,International J.of Pharmaceutics(1986)33 201-217;Anderson等,The Practice of Medicinal Chemistry(1996),AcademicPress,New York;和在The Orange Book(Food & Drug Administration,Washington,D.C.在其网站上)论述了通常认为适用于形成碱性药用化合物药用盐的酸。这些公开内容通过引用结合到本文中。
示例性碱式盐包括铵盐;碱金属盐,例如钠、锂和钾盐;碱土金属盐,例如钙和镁盐;有机碱(例如有机胺),例如二环己胺、叔丁胺的盐和氨基酸,例如精氨酸、赖氨酸等的盐。可用例如低级烷基卤化物(例如甲基、乙基和丁基的氯化物、溴化物和碘化物)、硫酸二烷基酯(例如硫酸二甲酯、二乙酯和二丁酯)、长链卤化物(例如癸基、十二烷基和硬酯酰基的氯化物、溴化物和碘化物)、芳烷基卤化物(例如苄基溴和苯乙基溴)和其它试剂,使碱性含氮基团季铵化。
所有此类酸式盐和碱式盐均应为本发明范围内的药学上可接受的盐,为本发明目的,所有酸式盐和碱式盐视为相应化合物游离形式的等同物。
本发明化合物的药学上可接受的酯包括以下酯类:(1)通过使羟基酯化得到的羧酸酯,其中酯的羧酸部分的非羰基部分选自直链或支链烷基(例如乙酰基、正丙基、叔丁基或正丁基)、烷氧基烷基(例如甲氧基甲基)、芳烷基(例如苄基)、芳氧基烷基(例如苯氧基甲基)、芳基(例如任选被例如卤素、C1-4烷基或C1-4烷氧基或氨基取代的苯基);(2)磺酸酯,例如烷基-或芳烷基磺酰基(例如甲磺酰基);(3)氨基酸酯(例如L-缬氨酰基或L-异亮氨酰基);(4)膦酸酯和(5)一-、二-或三磷酸酯。可通过例如C1-20醇或其活性衍生物,或通过2,3-二(C6-24)酰基甘油使磷酸酯进一步酯化。
式I化合物及其盐、溶剂化物、酯和前药可以它们的互变异构形式存在(例如酰胺或亚氨醚)。期望将所有此类互变异构形式作为本发明的一部分。
本发明化合物的所有立体异构体(例如几何异构体、旋光异构体等)(包括这些化合物的盐、溶剂化物和前药的那些立体异构体,以及前药的盐和溶剂化物的立体异构体),例如由于各取代基上的不对称碳而可能存在的那些立体异构体,包括对映体(甚至不存在不对称碳时,它也可能存在)、旋转异构体、阻转异构体和非对映体,作为位置异构体(例如4-吡啶基和3-吡啶基)包括在本发明范围内。本发明化合物的各立体异构体可以例如基本上不舍其它异构体,或可以与所有其它立体异构体或其它选择的立体异构体混合,例如外消旋体。本发明的手性中心可具有IUPAC 1974 Recommendations定义的S或R构型。术语“盐”、“溶剂化物”“前药”等的用途,将同样应用于本发明化合物的对映体、立体异构体、旋转异构体、互变异构体、位置异构体、外消旋体或前药的盐、溶剂化物和前药。
式I化合物的多晶型和式I化合物的盐、溶剂化物、酯和前药将包括在本发明中。
应理解,用于本文中论述的治疗应用的式I化合物的效用,可适用于每个化合物本身或一种或多种式I化合物的一种或多种组合,如在紧接下一段中阐述。同样理解也适用于含这样的一种或多种化合物的药用组合物和涉及这样的一种或多种化合物的治疗方法。
本发明化合物可具有药理性质;尤其式I化合物可以为HCV蛋白酶抑制剂,每个化合物本身或一种或多种式I化合物可与选自式I范围内的一种或多种化合物组合。这类化合物可用于治疗疾病,例如HCV、HIV、(AIDS,获得性免疫缺陷综合征)和相关疾病;以及调节丙型肝炎病毒(HCV)蛋白酶活性;预防HCV或缓解一种或多种丙型肝炎症状。
式I化合物可用于制备用于治疗与HCV蛋白酶有关疾病的药物,例如,包括使式I化合物与药学上可接受的载体充分接触的方法。
在另一个实施方案中,本发明提供含一种或多种本发明化合物作为活性成分的药用组合物。药用组合物通常还含至少一种药学上可接受的载体稀释剂、赋形剂或载体(本文中统称为载体物质)。由于它们的HCV抑制活性,此类药用组合物具有治疗丙型肝炎和相关疾病的效用。
在还另一个实施方案中,本发明公开制备含本发明化合物作为活性成分的药用组合物的方法。在本发明药用组合物和方法中,活性成分一般与合适的载体物质混合给予,这些载体物质根据以下的预定给药形式进行适当的选择:即口服片剂、胶囊剂(固体填充、半固体填充或液体填充)、溶解用粉末、口服凝胶、酏剂、可分散颗粒剂、糖浆、混悬液等,并符合常规药学实践。例如,对于片剂或胶囊剂给药形式,可使活性药物成分与任何口服、无毒药学上可接受的惰性载体,例如乳糖、淀粉、蔗糖、纤维素、硬脂酸镁、磷酸二钙、硫酸钙、滑石粉、甘露醇、乙醇(液体形式)等混合。此外,当需要或必要时,也可将合适的粘合剂、润滑剂、崩解剂和着色剂掺入该混合物中。散剂和片剂中本发明组合物占约5%至约95%。
合适的粘合剂包括淀粉、明胶、天然糖、玉米甜味剂、天然和合成胶例如阿拉伯胶、藻酸钠、羧甲基纤维素、聚乙二醇和蜡。在润滑剂中,可提及用于这些剂型的有硼酸、苯甲酸钠、乙酸钠、氯化钠等。崩解剂包括淀粉、甲基纤维素、瓜儿胶等。
适当时,也可包括甜味剂、矫味剂和防腐剂。以下更详细地论述以上提及的一些术语,即崩解剂、稀释剂、润滑剂、粘合剂等。
另外,本发明组合物可配制成缓释形式,以提供任何一种或多种组分或活性成分的控释速度,使治疗作用即HCV抑制活性等最佳化。合适的缓释剂型包括分层片,该分层片含不同崩解速度层或用活性组分浸渍的控释聚合物骨架,并成型为片剂;或胶囊剂,该胶囊剂含此类浸渍或封囊化的多孔聚合物骨架。
液体形式的制剂包括溶液剂、混悬剂和乳剂。作为实例,可提及的有用于肠胃外注射的水或水-丙二醇溶液,或加入甜味剂和镇静剂(pacifiers)的口服溶液、混悬液和乳液。液体形式制剂还可包括鼻内给药用的溶液。
适用于吸入的气雾剂制剂可包括溶液和粉末形式的固体,它可与药学上可接受的载体,例如惰性压缩气体例如氮气组合。
为制备栓剂,先将低熔点蜡,例如脂肪酸甘油酯的混合物例如可可脂熔化,将活性成分通过搅拌或类似的混合均匀分散其中。然后,将熔化的均匀混合物倾入适宜尺寸的模具中,使其冷却并因此固化。
还包括预定临用前转化为用于口服或肠胃外给药的液体形式制剂的固体形式制剂。此类液体形式包括溶液、混悬液和乳液。
本发明化合物还可透皮释放。透皮组合物可采用软膏剂、洗剂、气雾剂和/或乳剂的形式,并可包含在骨架或储库类型的透皮贴剂中,此为用于该目的的常规手段。
还可经口、静脉内、鼻内或皮下给予本发明化合物。
本发明化合物还可包含单位剂型的制剂。在这种形式中,可将制剂再分为含合适量,例如达到需要目的的有效量的活性组分的适当大小的单位剂量。
在单位剂量制剂中的本发明活性组合物的量通常可不同,或可根据具体应用,在约1.0mg至约1,000mg,优选约1.0至约950mg,更优选约1.0至约500mg,通常约1至约250mg范围调节。实际使用的剂量可根据患者的年龄、性别、体重和所治疗的病症严重程度而变化。本领域技术人员熟知此类技术。
通常,含活性成分的人口服剂型可每日给予1或2次。按主治医师的判断调节给药量和频率。通常推荐的口服给药日剂量方案可按单剂量或分剂量,每日约1.0mg至约1,000mg。
以下描述某些有用的术语:
胶囊-指由甲基纤维素、聚乙烯醇或变性明胶或淀粉制成的特殊容器或外壳,用于容纳或包含含活性成分的组合物。硬壳胶囊通常由相对高凝胶强度骨和猪皮明胶的混合物制成。胶囊本身可含少量染料、遮光剂、增塑剂和防腐剂。
片剂-指含活性成分和合适稀释剂的压制或模制固体剂型。可通过压制混合物或通过湿法制粒、干法制粒或通过压缩得到的颗粒来制备片剂。
口服凝胶-指分散在或溶于亲水性半固体基质中的活性成分。
溶解用粉末指可悬浮在水或果汁中的含活性成分和合适稀释剂的粉末混合物。
稀释剂-指通常构成组合物或剂型主要部分的物质。合适的稀释剂包括糖,例如乳糖、蔗糖、甘露醇和山梨醇;源自小麦、玉米、大米和马铃薯的淀粉;和纤维素,例如微晶纤维素。组合物中稀释剂的量可占组合物总重约10%至约90%(重量),优选约25%至约75%,更优选约30%至约60%(重量),甚至更优选约12%至约60%。
崩解剂-指加入组合物,帮助其破碎(崩解)和释放药物的物质。合适的崩解剂包括淀粉;“冷水可溶性”改性淀粉,例如羧甲基淀粉钠;天然和合成胶,例如槐树豆胶、刺梧桐树胶、瓜尔胶、黄芪胶和琼脂;纤维素衍生物,例如甲基纤维素和羧甲基纤维素钠;微晶纤维素和交联微晶纤维素,例如交联羧甲基纤维素钠;藻酸类,例如藻酸和藻酸钠;粘土,例如膨润土;和泡腾混合物。组合物中崩解剂量可占组合物约2%至约15%(重量),更优选约4%至约10%(重量)。
粘合剂-指通过形成颗粒,将粉末粘合或“胶合”在一起并使它们粘结在一起的物质,因此在制剂中用作“粘结剂”。粘合剂增加稀释剂或增量剂中已有的粘结强度。合适的粘合剂包括糖,例如蔗糖;源自小麦、玉米、大米和马铃薯的淀粉;天然胶,例如阿拉伯胶、明胶和黄芪胶;海藻衍生物,例如藻酸、藻酸钠和藻酸铵钙;纤维素类物质,例如甲基纤维素和羧甲基纤维素钠和羟丙基甲基纤维素;聚乙烯吡咯烷酮;和无机物,例如硅酸镁铝。组合物中粘合剂的量可占组合物约2%至约20%(重量),更优选约3%至约10%(重量),甚至更优选约3%至约6%(重量)。
润滑剂-指加入剂型中,通过减少摩擦或磨损,确保压制后的片剂、颗粒等从模具或冲模释放的物质。合适的润滑剂包括金属硬脂酸盐,例如硬脂酸镁、硬脂酸钙或硬脂酸钾;硬脂酸;高熔点蜡;和水溶性润滑剂,例如氯化钠、苯甲酸钠、乙酸钠、油酸钠、聚乙二醇和d′l-亮氨酸。润滑剂通常在压制前的非常后步骤加入,因为它们必须存在于颗粒表面、颗粒之间和部分压片机上。组合物中润滑剂的量可占组合物约0.2%至约5%(重量),优选约0.5%至约2%,更优选约0.3%至约1.5%(重量)。
助流剂-防止颗粒粘结和改善颗粒流动性,以便流动平滑和均匀的物质。合适的助流剂包括二氧化硅和滑石粉。组合物中助流剂的量可占组合物总量约0.1%至约5%(重量),优选约0.5%至约2%(重量)。
着色剂-给组合物或剂型提供颜色的赋形剂。此类赋形剂可包括吸附在合适吸附剂,例如粘土或氧化铝上的一种或多种食用级染料。着色剂的量可占组合物约0.1%至约5%(重量),优选约0.1%至约1%。
生物利用度-指与标准品或对照品相比,从给药剂型吸收到循环系统的活性药物成分或治疗部分的速度和程度。
已知制备片剂的常规方法。此类方法包括干法,例如直接压制和压制通过压缩制备的颗粒,或湿法或其它特殊方法。也熟知制备其它给药形式,例如胶囊剂、栓剂等的常规方法。
另一个本发明的实施方案公开以上公开的本发明化合物或药用组合物治疗疾病,例如丙型肝炎等的用途。该方法包括给予患有这种疾病或这类疾病和需要这种治疗的患者治疗有效量的本发明化合物或药用组合物。
在还另一个实施方案中,可按单一疗法模式或联合疗法(例如二联、三联等),例如与抗病毒和/或免疫调节剂联合的模式,用本发明化合物治疗人HCV。这类抗病毒和/或免疫调节剂的实例包括利巴韦林(出自Schering-Plough Corporation,Madison,New Jersey)和LevovirinTM(出自ICN Pharmaceuticals,Costa Mesa,California)、VP50406TM(出自Viropharma,Incorporated,Exton,Pennsylvania);ISIS14803TM(出自ISIS Pharmaceuticals,Carlsbad,California);HeptazymeTM(出自Ribozyme Pharmaceuticals,Boulder,Colorado);VX 497TM(出自Vertex Pharmaceuticals,Cambridge,Massachusetts);ThymosinTM(出自SciClone Pharmaceuticals,San Mateo,California);MaxamineTM(MaximPharmaceuticals,San Diego,California);麦考酚酸吗乙酯(出自Hoffman-LaRoche,Nutley,New Jersey);干扰素(例如α-干扰素、PEG-α-干扰素轭合物)等。“PEG-α-干扰素轭合物”为与PEG分子共价连接的α-干扰素分子。示例性的PEG-α-干扰素轭合物包括聚乙二醇化的α-2a干扰素形式(例如以商品名PegasysTM销售)的α-2a干扰素(RoferonTM,出自Hoffman La-Roche,Nutley,New Jersey)、聚乙二醇化的α-2b干扰素形式(例如以商品名PEG-IntronTM销售)的α-2b干扰素(IntronTM,出自Schering-Plough Corporation);α-2c干扰素(BeroforAlphaTM,出自Boehringer Ingelheim,Ingelheim,Germany)或通过测定天然存在的α-干扰素的共有序列定义的共有序列干扰素(InfergenTM,出自Amgen,Thousand Oaks,California)。
如前所述,本发明还包括本发明化合物的互变异构体、旋转异构体、对映体和其它立体异构体。因此,如本领域技术人员所认识到的那样,某些本发明化合物可能存在合适的异构形式。此类变化包括在本发明范围内。
另一个本发明实施方案公开制备本文公开化合物的方法。可通过本领域已知的一些技术制备这些化合物。在以下反应流程中说明示例性方法。不应将这些示例理解为对权利要求书定义的本发明范围的限制。替代的机制途径和相似结构对本领域技术人员而言是显而易见的。
应理解,虽然以下示例性流程描述一些代表性的本发明化合物的制备,但对任何天然和非天然氨基酸的合适取代将导致形成需要的基于这种取代的化合物。此类变化包括在本发明范围内。
在以下描述方法中,使用以下缩写:
缩写
用于描述以下流程、制备和实施例的缩写有:
THF:四氢呋喃
DMF:N,N-二甲基甲酰胺
EtOAc:乙酸乙酯
AcOH:乙酸
HOOBt:3-羟基-1,2,3-苯并三嗪-4(3H)-酮
EDCl:1-(3-二甲氢基丙基)-3-乙基碳二亚胺盐酸盐
NMM: N-甲基吗啉
ADDP:1,1′-(偶氮二羰基)联哌啶
DEAD:偶氮二甲酸二乙酯
MeOH:甲醇
EtOH:乙醇
Et2O:乙醚
DMSO:二甲亚砜
HOBt:N-羟基苯并三唑
PyBrOP:六氟磷酸溴-三-吡咯烷基
DCM:二氯甲烷
DCC:1,3-二环己基碳二亚胺
TEMPO:2,2,6,6-四甲基-1-哌啶基氧基
Phg:苯甘氨酸
Chg:环己基甘氨酸
Bn:苄基
Bzl:苄基
Et:乙基
Ph:苯基
iBoc:异丁氧基羰基
iPr:异丙基
tBu或But:叔丁基
Boc:叔丁氧基羰基
Cbz:苄氧基羰基
Cp:环戊基二烯基(cylcopentyldienyl)
Ts:对甲苯磺酰基
Me:甲基
HATU:六氟磷酸O-(7-氮杂苯并三唑-1-基)-1,1,3,3-四甲基脲
DMAP:4-N,N-二甲氨基吡啶
BOP:苯并三唑-1-基-氧基-三(二甲氨基)六氟磷酸盐
PCC:氯铬酸吡啶
制备目标化合物的通用流程
用下述通用流程(方法A-E)合成本发明化合物。
方法A:
在酸性条件下,将1.01的N-Boc官能团脱保护,得到盐酸盐1.02,随后用肽偶联方法,使它与N-Boc-叔-亮氨酸偶联,得到1.03。随后通过用适当的异氰酸盐(酯)处理,将N-Boc脱保护,得到脲1.05。将甲酯水解,得到酸1.06。使酸1.06与适当的P1-P′伯酰胺部分进行肽偶联,得到羟基酰胺1.07。氧化(Moffatt或有关方法-T.T.Tidwell,Synthesis,1990,857;或Dess-Martin-J.Org.Chem.,1983,48,4155),得到目标化合物1.08。
方法B
使酸1.06与适当的P1-P′仲酰胺部分进行肽偶联,得到羟基酰胺1.09。氧化(Moffatt或Dess-Martin),得到目标化合物1.10。
方法C
在另一种变化中,使N-Boc-P2-P3-酸1.17与适当的P1-P′酰胺部分进行肽偶联,得到羟基酰胺1.11。氧化(Moffatt或Dess-Martin),得到酮基酰胺1.12。使N-Boc官能团脱保护,得到盐酸盐1.13。用合适的异氰酸盐(酯)(或异氰酸盐(酯)等同物)处理,得到目标化合物1.14。
方法D
在还另一种变化中,通过与氯甲酸4-硝基苯酯反应,将盐酸盐1.13转化为氨基甲酸4-硝基苯酯1.15。随后选择用胺(或胺盐酸盐)处理,得到目标化合物1.14。
方法E
在还另一种变化中,如上述,将二肽盐酸盐1.03转化为氨基甲酸4-硝基苯酯。选择用胺(或胺盐酸盐)处理,得到脲衍生物1.05。按所述方法A/B,水解并进一步处理,得到目标化合物1.14。
制备中间体:
制备P1-P′部分:
制备中间体10.11和10.12:
步骤1:
在N2下,搅拌下,将酮亚胺10.01(50g,187.1mmol)的无水THF(400mL)溶液冷却至-78℃,用1MK-tBuO的THF溶液(220mL,1.15当量)处理。使反应混合物升温至0℃,搅拌1h,用溴甲基环丁烷(28mL,249mmol)处理。在室温下,将反应混合物搅拌48h,真空浓缩。将残渣溶于Et2O(300mL),用HCl水溶液(2M,300mL)处理。在室温下,将得到的溶液搅拌5h,用Et2O(1L)萃取。用NaOH(50%水溶液)将水层调至碱性pH~12-14,用CH2Cl2(3×300mL)萃取。将合并的有机层干燥(MgSO4),过滤,浓缩,得到纯胺(10.02,18g),为无色油状物。
步骤2
在0℃下,将胺10.02(18g,105.2mmol)的CH2Cl2(350mL)溶液用二碳酸二-叔丁酯(23g,105.4mmol)处理,在室温下搅拌12h。反应完全后(TLC),将反应混合物真空浓缩,将残渣溶于THF/H2O(200ml,1∶1),用LiOH·H2O(6.5g,158.5mmol)处理,在室温下搅拌3h。将反应混合物浓缩,将碱性水层用Et2O萃取。将水层用浓HCl酸化至pH~1-2,用CH2Cl2萃取。将合并的有机层干燥(MgSO4),过滤,真空浓缩,得到10.03,为无色粘性油状物,无需任何进一步纯化即可用于下一步骤。
步骤3
在室温下,将酸10.03(15.0g,62mmol)的CH2Cl2(250ml)溶液用BOP试剂(41.1g,93mmol)、N-甲基吗啉(27ml)、N,O-二甲基羟胺盐酸盐(9.07g,93mmol)处理,搅拌过夜。将反应混合物用1N HCl水溶液(250ml)稀释,将液层分离,将水层用CH2Cl2(3×300ml)萃取。将合并的有机层干燥(MgSO4),过滤,真空浓缩,通过层析(SiO2,EtOAc/Hex 2∶3)纯化,得到酰胺10.04(15.0g),为无色固体。
步骤4
在0℃下,滴加LiAlH4溶液(1M,93mL,93mmol)处理酰胺10.04(15g,52.1mmol)的无水THF(200mL)溶液。在室温下,将反应混合物搅拌1h,在0℃下,用KHSO4(10%水溶液)小心猝灭,搅拌0.5h。将反应混合物用HCl水溶液(1M,150mL)稀释,用CH2Cl2(3×200mL)萃取。将合并的有机层用HCl水溶液(1M)、饱和NaHCO3、盐水洗涤,干燥(MgSO4)。使混合物过滤,真空浓缩,得到10.05,为粘性无色油状物(14g)。
步骤5
将醛10.05(14g,61.6mmol)的CH2Cl2(50mL)溶液用Et3N(10.73mL,74.4mmol)和丙酮合氰化氢(10.86g,127.57mmol)处理,在室温下搅拌24h。将反应混合物真空浓缩,用HCI水溶液(1M,200mL)稀释,萃取到CH2Cl2(3×200mL)。将合并的有机层用H2O、盐水洗涤,干燥(MgSO4),过滤,真空浓缩,通过层析(SiO2,EtOAc/Hex 1∶4)纯化,得到10.06(10.3g),为无色液体。
步骤6
在0℃下,通过向CH3OH(700ml)中鼓泡通入HCl气体制备HCl*饱和的甲醇,将其用羟腈10.06处理,加热回流24h。将反应物真空浓缩,得到10.07,无需纯化即可用于下一步骤。
*或者,也可使用通过向无水甲醇加入AcCl制备的6M HCl。
步骤7
在-78℃下,将胺盐酸盐10.07的CH2Cl2(200ml)溶液用Et3N(45.0mL,315mmol)和Boc2O(45.7g,209mmol)处理。然后将反应混合物在室温下搅拌过夜,用HCl(2M,200mL)稀释,萃取到CH2Cl2。将合并的有机层干燥(MgSO4),过滤,真空浓缩,通过层析(EtOAc/Hex 1∶4)纯化,得到羟基酯10.08。
步骤8.
将甲酯10.08(3g,10.5mmol)的THF/H2O(1∶1)溶液用LiOH·H2O(645mg,15.75mmol)处理,在室温下搅拌2h。将反应混合物用HCl水溶液(1M,15ml)酸化,真空浓缩。将残渣真空干燥,定量收率得到10.09。
步骤9
将酸10.09(来自以上)的CH2Cl2(50mL)和DMF(25mL)溶液用NH4Cl(2.94g,55.5mmol)、EDCl(3.15g,16.5mmol)、HOOBt(2.69g,16.5mmol)和NMM(4.4g,44mmol)处理。将反应混合物在室温下搅拌3天。将溶剂真空除去,将残渣用HCl水溶液(250mL)稀释,用CH2Cl2萃取。将合并的有机层用饱和NaHCO3水溶液洗涤,干燥(MgSO4),过滤,真空浓缩,得到10.10,它在随后步骤中未处理直接使用。(或者,也可在0℃下,通过使10.06(4.5g,17.7mmol)与H2O2水溶液(10mL)、LiOH·H2O(820mg,20.8mmol)在50mL CH3OH中反应0.5h,直接得到10.10)
步骤10
将在上一步骤中得到的10.10的溶液溶于4N HCl的二烷溶液,在室温下搅拌2h。将反应混合物真空浓缩,得到中间体10.11,为固体,使用时无需进一步纯化。
步骤11
基本上用上述步骤9、10方法,用适当试剂由化合物10.09得到需要的中间体10.12。
制备中间体11.01
步骤1
向4-戊炔-1-醇11.02(4.15g;Aldrich)溶液中加入Dess-MartinPeriodinane(30.25g;Aldrich),将得到的混合物搅拌45min,然后加入(叔-丁氧基羰基亚甲基)三苯基正膦(26.75g;Aldrich)。将得到的深色反应物搅拌过夜,用EtOAc稀释,用亚硫酸钠水溶液、饱和NaHCO3水溶液、水、盐水洗涤,干燥。将挥发物减压除去,残渣经硅胶柱层析纯化,用1%EtOAc/己烷作洗脱液,得到需要的化合物11.03(3.92g)。还得到一些不纯的组分,但此时先搁置。
步骤2
用烯11.03(1.9g)的正丙醇(20ml;Aldrich))溶液、氨基甲酸苄酯(4.95g;Aldrich)的正丙醇(40ml)溶液、NaOH(1.29g)水(79ml)溶液、次氯酸叔丁酯(3.7ml)、(DHQ)2PHAL(0.423g;Aldrich))的正丙醇(37.5ml)溶液和锇酸钾:脱水物(0.1544g;Aldrich),和在Angew.Chem.Int.Ed.Engl(1998),35,(23/24),第2813-7页中描述的方法,得到粗产物,经硅胶柱层析纯化,用EtOAc∶己烷(1∶5)洗脱,得到需要的氨基醇11.04(1.37g,37%),为白色固体。
步骤3
向酯11.04(0.700g)中加入4M HCl的二烷(20ml;Aldrich)溶液,在室温下将得到的混合物放置过夜。将挥发物减压除去,得到酸11.05(0.621g),为白色固体。
步骤4
在室温下,依次将BOP试剂(3.65g;Sigma)、三乙胺(3.45ml)加入羧酸11.05(2.00g)和烯丙胺(0.616ml)的二氯甲烷(20ml)溶液中,将得到的混合物搅拌过夜。使反应混合物在EtOAc和10%HCl水溶液之间分配。将有机相分离,用饱和碳酸氢钠水溶液、水洗涤,干燥(硫酸镁)。粗反应产物经硅胶柱层析纯化,用(EtOAc∶己烷;70∶30)作洗脱液,得到需要的酰胺11.01(1.73g),为粘性黄色油状物。
制备中间体12.03和12.04
步骤1
基本上用中间体10.11步骤3-8描述的方法,将化合物12.01转化为需要的物质12.02。
步骤2
基本上用中间体10.11步骤9、10描述的方法,将化合物12.02转化为需要的中间体12.03。
步骤3
基本上用中间体10.12步骤11描述的方法,将化合物12.02转化为需要的中间体12.03。
制备中间体13.01
步骤1
在0℃-5℃下,搅拌下,在2h内,向1-硝基丁烷13.02(16.5g,0.16mol)和二羟乙酸H2O水溶液(28.1g,0.305mol)和MeOH(122ml)的溶液中滴加三乙胺(93mL,0.667mol)。使溶液升温至室温,搅拌过夜,浓缩至干,得到油状物。然后将油状物溶于H2O,用10%HCl酸化至pH=1,随后用EtOAc萃取。将合并的有机溶液用盐水洗涤,经Na2SO4干燥,过滤,浓缩至干,得到产物13.03(28.1g,99%收率)。
步骤2
搅拌下,向化合物13.03(240g,1.35mol)的乙酸(1.25L)溶液中加入10%Pd/C(37g)。在59psi下,将得到的溶液氢化3h,然后在60psi下氢化过夜。然后将乙酸蒸发,与甲苯共沸3次,然后用MeOH和乙醚研磨。然后将溶液过滤,与甲苯共沸两次,得到13.04,为灰白色固体(131g,0.891mol,66%)。
步骤3
在0℃,搅拌下,向氨基酸13.04(2.0g,13.6mmol)的二烷(10ml)和H2O(5ml)溶液中加入1N NaOH溶液(4.3ml,14.0mmol)。将得到的溶液搅拌10分钟,随后加入二碳酸二叔丁酯(0.110g,14.0mmol),在0℃下搅拌15分钟。然后将溶液升温至室温,搅拌45分钟,在冰箱中保存过夜,浓缩至干,得到粗物质。向该粗物质的EtOAc(100ml)溶液和冰中加入KHSO4(3.36g)和H2O(32ml),搅拌4-6分钟。然后将有机层分离,将水层用EtOAc萃取两次,将合并的有机层用水、盐水洗涤,经Na2SO4干燥,过滤,浓缩至干,得到产物13.05,为透明胶状物(3.0g,89%收率)。
步骤4
基本上用中间体10.12步骤11描述的方法,将化合物13.05转化为需要的中间体13.01。
制备中间体14.01
步骤1
基本上用中间体13.01步骤1-3描述的方法,将化合物14.02转化为需要的物质14.03。
步骤2
基本上用中间体10.12步骤11描述的方法,将化合物14.03转化为需要的中间体14.01。
制备中间体15.01
步骤1
在0℃下,通过加料漏斗向亚硝酸银(9g,58.5mmol)的乙醚(25mL)悬浮液中缓慢加入(约15min)4-碘-1,1,1-三氟丁烷15.02(10g,42.0mmol)的乙醚(25mL)溶液。在0℃下,将得到的混合物剧烈搅拌,升温至室温。50h后,将固体物质通过硅藻土垫滤除。将得到的乙醚溶液真空浓缩,得到15.03,为无色油状物,使用时无需进一步纯化。
步聚2
基本上用中间体13.01步骤1-3描述的方法,将化合物15.03转化为需要的物质15.04。
步骤3
基本上用中间体10.12步骤11描述的方法,将化合物15.04转化为需要的中间体15.01。
制备中间体16.01
按上述(制备中间体10.12)处理酸16.02(Winkler,D.;Burger,K.,Synthesis,1996,1419),得到期望的中间体16.01。
制备P2/P3-P2部分
制备中间体20.01
按R.Zhang和J.S.Madalengoitia(J.Org.Chem.1999,64,330)方法,制备氨基酯20.01,不同之处在于使Boc-保护的氨基酸与HCl的甲醇溶液反应,将Boc基团解离(还使用4M HCl的二烷溶液脱保护)。(注意:在报道的合成变化中,用相应的叶立德代替锍叶立德)
制备中间体20.04
步骤1
在0℃下,将市售氨基酸Boc-Chg-OH 20.02(Senn chemicals,6.64g,24.1mmol)和胺盐酸盐20.01(4.5g,22mmol)的CH2Cl2(100mL)溶液用BOP试剂处理,在室温下搅拌15h。将反应混合物真空浓缩,然后用1M HCl水溶液稀释,萃取到EtOAc(3×200mL)。将合并的有机层用饱和NaHCO3(200mL)洗涤,干燥(MgSO4),过滤,真空浓缩,层析(SiO2,EtOAc/Hex 3∶7),得到20.03(6.0g),外无色固体。
步骤2
将甲酯20.03(4.0g,9.79mmol)的THF/H2O(1∶1)溶液用LiOH·H2O(401mg,9.79mmol)处理,在室温下搅拌3h。用HCl水溶液将反应混合物酸化,真空浓缩,得到需要的中间体游离酸20.04。
制备中间体20.08
步骤1
将Boc-tert-Leu 20.05(Fluka,5.0g 21.6mmol)的无水CH2Cl2/DMF(50mL,1∶1)溶液冷却至0℃,用胺盐20.01(5.3g,25.7mmol)、NMM(6.5g,64.8mmol)和BOP试剂(11.6g,25.7mmol)处理。将反应物在室温下搅拌24h,用HCl水溶液(1M)稀释,用CH2Cl2萃取。将合并的有机层用HCl(水溶液,1M)、饱和NaHCO3、盐水洗涤,干燥(MgSO4),过滤,真空浓缩,经层析(SiO2,丙酮/己烷1∶5)纯化,得到20.06,为无色固体。
步骤2
将甲酯20.06(4.0g,10.46mmol)溶液溶于4M HCl的二烷溶液,在室温下搅拌3h。将反应混合物真空浓缩,得到胺盐酸盐20.07,使用时无需纯化。
步骤3
将胺盐20.07(840mg,2.64mmol)的THF(14ml)/乙腈(2mL)溶液冷却至0℃。依次加入氯甲酸4-硝基苯酯(800mg,3.96mmol)、吡啶(0.64mL,7.92mmol)。当TLC表明反应完成时,将反应物在3h内缓慢升温至室温。加入乙醚(50mL),将产生的沉淀滤除。将滤液用饱和氯化铵溶液(1×)、盐水(1×)洗涤,干燥(Na2SO4),浓缩。残渣经闪式层析纯化,用20/80 EtOAc/己烷洗脱,得到1.15g需要的中间体20.08。
制备中间体21.01
步骤1
在室温下,搅拌下,向N-Boc-3,4-脱氢脯氨酸21.02(5.0g,23.5mmol)、二碳酸二叔丁酯(7.5g,34.4mmol)和4-N,N-二甲氨基吡啶(0.40g,3.33mmol)的乙腈(100mL)溶液中加入三乙胺(5.0mL,35.6mmol)。在此温度下,将得到的溶液搅拌18h,然后将其真空浓缩。深棕色残渣经闪式柱层析纯化,用10-25% EtOAc/己烷洗脱,得到产物21.03,为浅黄色油状物(5.29g,84%)。
步骤2
在室温下,搅拌下,向脱氢脯氨酸衍生物21.03(10.1g,37.4mmol)、苄基三乙基氯化铵(1.60g,7.02mmol)的氯仿(120mL)溶液中加入50%氢氧化钠水溶液(120g)。在此温度下剧烈搅拌24h后,用CH2Cl2(200mL)和乙醚(600mL)将深色混合物稀释。将液层分离后,将水溶液用CH2Cl2/Et2O(1∶2,3×600mL)萃取。将有机溶液干燥(MgSO4),浓缩。残渣经闪式柱层析纯化,用5-20% EtOAc/己烷洗脱,得到9.34g(71%)21.04,为灰白色固体。
步骤3
在室温下,将21.04(9.34g,26.5mmol)的CH2Cl2(25ml)和CF3CO2H(50mL)溶液搅拌4.5h,然后将其真空浓缩,得到21.05的棕色残渣,它在步骤4使用时无需进一步纯化。
步骤4
将浓盐酸(4.5ml)加入步骤3残渣21.05的甲醇(70ml)溶液中,将得到的混合物在油浴中升温至65℃。18h后,将混合物真空浓缩,得到棕色油状物21.01,使用时无需进一步纯化。
制备中间体22.01
步骤1
搅拌下,将二(三甲基甲硅烷基)氨基化钾(158ml 0.5M的甲苯溶液;79mmol)加入溴化环丙基三苯基(33.12g;86.4mmol)的无水四氢呋喃(130ml)悬浮液中,在室温下,在氮气氛下,将得到的橙色混合物搅拌1h,然后加入醛22.02(9.68g;42.2mmol)的THF(8ml)溶液。然后在氮气氛下,使反应物回流2h。冷却后,加入甲醇、乙醚和Rochelles盐。使有机相分离,用盐水洗涤,干燥,减压浓缩。粗反应产物经硅胶柱层析纯化,用EtOAc-己烷(1∶99)-EtOAc-己烷(5∶95)洗脱,得到烯22.03(8.47g),为黄色油状物。
步骤2
在室温下,通过将14.2ml乙酰氯滴加到冷甲醇中,将得到的溶液稀释至200ml,制备1M HCl的MeOH/MeOAc溶液。
将氨基甲酸酯22.03(9.49g;37.5mmol)溶于甲醇(12ml),将其加入1M HCl的MeOH/MeOAc溶液(150ml)中,同时在冰浴中冷却。在此温度下,将得到的混合物保持1h,然后移去冰裕,在室温下继续搅拌过夜。将挥发物减压除去,得到黄色油状物,下一步使用时无需纯化。
将黄色油状物溶于THF(30ml)和MeOH(20ml)的混合物中,用三乙胺(15ml;108mmol)处理直至溶液pH=9-10。置入冰浴后,将混合物用N-Boc-Gly-OSu(11.22g;41mmol)处理。撤去冰浴,将反应物在室温下搅拌1h。将挥发物减压除去,残渣经硅胶柱层析纯化,用甲醇(1-3%)/二氯甲烷洗脱,得到需要的酰胺22.04(9.09g)。
步骤3
将醇22.04(9.09g;33.6mmol)溶于丙酮(118.5ml),用2,2-二甲氧基丙烷(37.4ml;304mmol)和BF3:Et2O(0.32ml;2.6mmol)处理,将得到的混合物在室温下搅拌5.5h。将反应溶液用几滴三乙胺处理,将挥发物减压除去。残渣经硅胶柱层析纯化,用5-25%EtOAc/己烷洗脱,得到N,O-缩醛22.05(8.85g)。
步骤4
在氮气氛下,将氨基甲酸酯22.05(8.81g;28.4mmol)溶于乙腈(45ml),将溶液冷却至-40℃。依次加入吡啶(6.9ml;85.3mmol)、四氟硼酸硝(nitrosium)(6.63g;56.8mmol),将得到的反应混合物保持在0℃以下,直至TLC表明无原料存在(约2.25h)。加入吡咯烷(20ml;240mmol),撤去冷却裕,在室温下继续搅拌1h,然后将挥发物减压除去。使残渣快速通过硅胶垫,得到黄色油状物。
将黄色油状物溶于无水苯(220ml),加入乙酸钯(0.317g;1.41mmol),然后在氮气氛下,将得到的混合物加热回流1.5h。冷却后,将挥发物减压除去,深色残渣经硅胶柱层析纯化,用EtOAc-己烷(1∶4)洗脱,得到i)反式-吡咯烷酮22.06(1.94g),随后得到ii)顺式-吡咯烷酮22.07(1.97g)。
步骤5
将新制备的1M HCl的MeOAc/MeOH溶液(10ml;同上述)加入N,O-缩醛22.06中,在室温下搅拌1h。将溶剂减压除去,残渣经硅胶柱层析纯化,用0-4%MeOH/二氯甲烷作洗脱液,得到需要的醇22.08(1.42g),为黄色油状物。
步骤6
向内酰胺22.08(1.29g;8.44mmol)的无水四氢呋喃(55ml)溶液中加入氢化铝锂(2.40g;63.2mmol),将得到的混合物回流8h。冷却后,依次加入水、15%NaOH水溶液,使得到的混合物通过硅藻土过滤,将固体用THF和MeOH充分洗涤,将溶剂减压除去,将残渣再溶于二氯甲烷,干燥,减压浓缩,得到吡咯烷,使用时无需纯化。
在-60℃下,在氮气氛下,将Hunigs碱(4.5ml;25.8mmol)加入N-Boc-L-tert-Leu-OH(1.76g;7.6mmol)、所述粗吡咯烷和HATU(2.89g;7.6mmol)在无水二氯甲烷(50ml)中的混合物中。让得到的反应物缓慢达到室温,过夜。加入EtOAc,将黄色溶液用稀HCl水溶液、饱和碳酸氢钠水溶液、水、盐水洗涤。将有机层干燥,减压浓缩。残渣经硅胶柱层析纯化,用EtOAc∶己烷(1∶3)洗脱,得到需要的酰胺22.09(2.00g)。
步骤7
将醇22.09(2.00g;5.67mmol)溶于丙酮(116ml),在冰浴中冷却10min。然后将该溶液加入冷Jones试剂(14.2ml;约2mmol/ml)中,将得到的混合物在5℃下搅拌0.5h,移去冷却浴。将反应物在室温下再搅拌2h,然后加入硫酸钠(28.54g)、硅藻土(15g)的EtOAc(100ml)溶液中。1min后,加入异丙醇(15ml),然后再搅拌10min,过滤。将滤液减压浓缩,得到棕色油状物,将其溶于EtOAc。将该溶液用水、3%柠檬酸水溶液、盐水洗涤,干燥,浓缩,得到需要的羧酸22.01(1.64g),为白色固体。
制备中间体23.01
步骤1
向酯23.02(6.0g)和分子筛(5.2g)在无水二氯甲烷(35ml)中的混合物中加入吡咯烷(5.7ml,66.36mmoL)。在N2下,在室温下,将得到的棕色浆状物搅拌24h,过滤,用无水CH3CN洗涤。将合并的滤液浓缩,得到需要的产物23.03。
步骤2
向前步产物23.03的CH3CN(35ml)溶液中加入无水K2CO3、甲代烯丙基氯(2.77g,30.5mmoL)、NaI(1.07g,6.7mmoL)。在N2下,将得到的浆状物在环境温度下搅拌24h。依次加入50ml冰-冷水、2NKHSO4溶液直至pH1。加入EtOAc(100ml),将混合物搅拌0.75h。收集合并有机层,用盐水洗涤,经MgSO4干燥,蒸发,得到需要的产物23.04。
步骤3
将前步产物23.04(2.7g,8.16mmoL)溶于二烷(20ml),用新制备的1N LiOH(9mL)处理。在N2下,将反应混合物在环境温度下搅拌20h。将反应混合物溶于EtOAc,用H2O洗涤。将合并的水相冷却至0℃,用1N HCl酸化至pH1.65。将混浊混合物用EtOAc(2×100mL)萃取。将合并的有机层用盐水洗涤,经MgSO4干燥,浓缩,得到需要的酸23.05(3.40g)。
步骤4
向NaBH(OAc)3(3.93g,18.5mmoL)的CH2Cl2(55mL)悬浮液中加入前步产物23.05的无水CH2Cl2(20mL)溶液和乙酸(2mL)。将浆状物在环境温度下搅拌20h。将冰冷水(100mL)加入浆状物,搅拌1/2h。将有机层分离,过滤,干燥,蒸发,得到需要的产物23.06。
步骤5
向前步产物23.06(1.9g)的MeOH(40mL)溶液中加入过量CH2N2/Et2O溶液处理,搅拌过夜。将反应混合物浓缩至干,得到粗残渣。残渣经硅胶层析,用EtOAc/己烷梯度洗脱,得到1.07g纯的需要产物23.07。
步骤6
向前步产物23.07(1.36g)的无水CH2Cl2(40mL)溶液中加入BF3·Me2O(0.7mL)处理。将反应混合物在环境温度下搅拌20h,用饱和NaHCO3(30ml)猝灭,搅拌1/2h。将有机层分离,将合并的有机层用盐水洗涤,经MgSO4干燥,浓缩,得到粗残渣。使残渣在硅胶上层析,用EtOAc/己烷梯度洗脱,得到0.88g需要的化合物23.08。
步骤7
在室温下,向前步产物23.08(0.92g)的MeOH(30mL)溶液中加入10%Pd/C(0.16g),在环境温度下,在1大气压下氢化。将反应混合物搅拌4h,浓缩至干,得到需要的化合物23.01。
制备P3部分
制备中间体50.01
步骤1
向50.02(15g)的MeOH(150mL)溶液中加入浓HCl(3-4mL),使混合物回流16h。将反应混合物冷却至室温,浓缩。将残渣溶于乙醚(250mL),用冷饱和碳酸氢钠溶液和盐水洗涤。将有机层干燥(Na2SO4),浓缩,得到甲酯50.03(12.98g),其无需进一步纯化即可进行下步反应。
步聚2
在氮气氛下,将以上甲酯50.03溶于二氯甲烷(100ml),冷却至-78℃。在2h内,滴加DIBAL(1.0M的二氯甲烷溶液,200ml)。在16h内,使反应混合物升温至室温。将反应混合物冷却至0℃,滴加入MeOH(5-8mL)。搅拌下,缓慢加入10%酒石酸钾钠水溶液(200mL)。用二氯甲烷(100mL)稀释,分离有机层(有一些白色沉淀)。将有机层用1N HCl(250mL)、盐水(200mL)洗涤,干燥(Na2SO4),浓缩,得到醇50.04(11.00g),为透明油状物。
步骤3
在氮气氛下,将以上醇50.04溶于二氯甲烷(400mL),冷却至0℃。分批加入PCC(22.2g),在16h内,将反应混合物缓慢升温至室温。将反应混合物用乙醚(500mL)稀释,通过硅藻土垫过滤。将滤液浓缩,将残渣溶于乙醚(500mL)。使其通过硅胶垫,将滤液浓缩,得到醛50.05,其无需进一步纯化即可进行下步反应。
步骤4
基本上用Chakraborty等(Tetrahedron,1995,51(33),9179-90)的方法,将以上醛50.05转化为需要的物质50.01。
制备中间体51.01
用文献所述方法,由醛51.02得到需要的中间体51.01(T.K.Chakraborty等,Tetrahedron,1995,51(33),9179-90)。
制备具体实施例
制备实施例1007
步骤1
按照文献方法(M.E.Duggan,J.S.Imagire Synthesis 1989,131-2),将市售化合物1007a(Aldrich Chemical Co.,Milwaukee,Wisconsin,USA)转化为1007b,收率90%。LC-MS:289(M+H)。
步骤2
室温下,用4M HCl的二烷溶液使1007b脱保护,保持3h,定量收率得到1007c。该物质使用时无需进一步纯化。
步骤3
用前述方法(参见制备中间体20.08),由适当的原料/试剂得到化合物1007d。
在氮气氛下,在0℃下,向1007d(200mg,0.394mmol)的二氯甲烷(10mL)溶液中依次加入1007c(115mg,0.512mmol)、DIPEA(0.22mL,1.182mmol)。在此温度下,将反应保持30min,在冰箱(-20℃)中保存48h。用饱和氯化铵溶液将反应混合物猝灭,将产物萃取到二氯甲烷(3×)中。将合并的有机层用盐水(1×)洗涤,干燥(Na2SO4),过滤,浓缩。粗残渣经闪式层析纯化,用30/70丙酮/己烷洗脱,得到需要的化合物1007e,收率69%。LC-MS:557(M+H)。
步骤4
按上述(参见制备中间体20.04,步骤2),并适当的改进,进行1007e的甲酯水解,得到需要的酸1007f。
步骤5
按前述(参见制备中间体20.08,步骤1),并改进(HATU代替BOP,DIPEA代替NMM;在0℃下反应15min,在24h内升温至10℃),以及适量的试剂,使酸1007f(0.125mmol)与胺盐10.11进行偶联。后处理后得到粗物质1007g,其无需纯化,即进行下步反应。LC-MS:697.2(M+H)。
步骤6
向以上物质1007g(0.125mmol)的DMSO/甲苯(各3mL)冷(0℃)溶液中依次加入EDCl(240mg,1.25mmol)、二氯乙酸(0.052mL,0.625mmol)。15min后,移除冷却浴,在16h内,使反应混合物升温至室温。将反应混合物用EtOAc(20mL)稀释,用1N NaHSO4水溶液(20mL)洗涤。将水层分离,用EtOAc(20mL)萃取。将合并的有机层用1N NaHSO4水溶液(20mL)、饱和NaHCO3(20mL)、盐水(20mL)洗涤,干燥(Na2SO4),过滤,真空浓缩。粗残渣经闪式柱层析纯化,用40/60丙酮/己烷洗脱,得到需要的目标化合物1007(57mg,0.082mmol,66%收率)。LC-MS:695.2(M+H)。
制备实施例1044
步骤1
按前述(参见制备实施例1007,步骤5),使按类似于1007f描述的方法(参见制备实施例1007)得到的酸1044a与胺盐14.01进行偶联反应。后处理后得到粗物质1044b,其无需纯化,即进行下步反应。
LC-MS:725.2(M+H)。
步骤2:
向以上物质1044b(0.054mmol)的二氯甲烷(5ml)溶液中加入Dess-Martin periodinane(68mg,0.16mmol)。在氮气氛下,将反应混合物在室温下搅拌4.5h。将反应混合物用二氯甲烷(10ml)稀释,用10%Na2S2O3水溶液(30mL)、饱和NaHCO3(30mL)、盐水(30mL)洗涤,干燥(Na2SO4),过滤,真空浓缩。粗残渣经闪式柱层析纯化,用35/65丙酮/己烷洗脱,得到需要的目标化合物1044(23mg,0.032mmol,59%收率)。LC-MS:723.2(M+H)。
主要用上述方法(制备实施例1007和1044)和适当试剂,以及制备目标化合物的通用流程,方法A-E中所述改进,制备下表1和表1A中化合物。
表1
表1A
Ki*范围:A=<75nM,B=75-250nM;C=>250nM
制备实施例1441:
步骤1
向冰冷却的1441a(4.28g,10.08mmol)的无水乙醚(100mL)溶液中加入LAH(1.53g,40.32mmol),让反应混合物升温至室温过夜。将反应混合物冷却至0℃,将EtOAc(3mL)加入其中,随后加入KHSO4水溶液(10g,25mL H2O)。将胶状残渣用乙醚(300mL)萃取,将有机层依次用饱和NaHCO3、10% KH2PO4水溶液、盐水洗涤,经MgSO4干燥,过滤,浓缩。粗残渣经闪式SiO2层析纯化,用乙酸乙酯/DCM(1∶4)洗脱,得到1441b(2.14g,92%)。
步骤2
向冰冷却的1441b(743mg,3.24mmol)的无水吡啶(10mL)溶液中依次加入氯甲酸甲酯(1mL,13mmol)、DMAP(1.6g,13mmol),在2天内,让反应混合物升温至室温。将反应混合物浓缩,向其中加入EtOAc(100mL),随后加入100mL冰冷却的(含0.05体积1M H3PO4的5%KH2PO4)。将有机层用盐水洗涤,经MgSO4干燥,过滤,浓缩。粗产物经闪式SiO2层析纯化,用乙酸乙酯/DCM(1∶4)洗脱,得到1441c(931mg,100%收率)。
步骤3
将1441c溶于4M HCl的二烷(10ml)溶液,30min后,浓缩。将饱和NaHCO3(25ml)加入冰冷却的该粗盐酸盐(194mg,1mmol)的CH2Cl2(25ml)溶液中。将反应混合物剧烈搅拌10min,将COCl2(1.85M的PhMe溶液,4ml)加入其中,在室温下,继续搅拌1h。将有机层分离,经MgSO4干燥,过滤,浓缩至一半体积,得到1441d,为0.05M的CH2Cl2溶液。
步骤4
向1.17(10.4g,28mmol;通过用中间体20.04,步骤2中所述方法水解20.06得到)的DCM(300ml)溶液(-20℃)中加入HATU(1.05当量,29.4mmol,11.2g)、胺盐、中间体12.03(1.0当量,28mmol,5.48g)。在-20℃下,10min后,加入DIPEA(3.6当量,100mmol,17.4mL)。将反应物在室温下搅拌16h。16h后,将反应物用EtOAc稀释,依次用NaHCO3、柠檬酸(10%w/w)和盐水洗涤。有机层经MgSO4干燥,过滤,真空浓缩,得到14g需要的中间体1441e。
步骤5
按实施例1007,步骤6中所述方法,将羟基酰胺1441e氧化为需要的酮基酰胺1441f。LC-MS=507(M+H)+
步骤6
按实施例1007,步骤2中所述,使1441f脱去t-Boc官能团,得到需要的物质1441g。
步骤7
向胺盐酸盐1441g(20mg,0.045mmol)的CH2Cl2(2.0ml)的冷(0℃)溶液中依次加入1441d(1.35mL,0.135mmol)、DIPEA(63μl,0.4mmol)。将反应混合物在室温下搅拌1.2h,用乙酸乙酯(20mL)稀释,用3%柠檬酸、盐水洗涤,经MgSO4干燥,过滤,浓缩,在SiO2上用EtOAc/DCM(1∶9-9∶1)纯化,得到1441(23mg)。LCMS=620.3(M+H)+。
主要用上述方法(制备实施例1441)和适当试剂,以及制备目标化合物通用流程,方法A-E中所述改进,制备下表(表2)中化合物。
表2
Ki*范围A=<75nM;B=75-250nM;C=>250nM
制备实施例1655
步骤1
在室温下,向市售化合物1655a(Aldrich Chemical Co.,Milwaukee,Wisconsin,USA,950mg,4.38mmol)的乙腈(40ml)溶液中加入碘代甲烷(4.63ml,74.42mmol)。然后在氮气氛下,加入氧化银(I)(1.62g,7.01mmol),使反应混合物回流约16h。(注意:用铝箔封住反应烧瓶)。此时,将反应混合物冷却至室温,通过硅藻土垫过滤。将滤饼用乙酸乙酯冲洗几次。将合并的滤液浓缩,经闪式柱层析纯化,用20/80-40/60的乙酸乙酯/己烷洗脱,得到720mg期望产物1655b。
步骤2
用前述方法(步骤2,实施例1007),将1655b转化为化合物1655c,定量收率。
步骤3
向化合物1655c(514mg,3.08mmol)的二氯甲烷(20ml)溶液中加入饱和碳酸氢钠溶液(20ml)。将该混合物剧烈搅拌并冷却至0℃。滴加光气(20%(重量)的甲苯溶液,6.5ml)。将反应混合物剧烈搅拌4.5h,同时将温度保持在5℃或低于5℃。此时,将反应混合物倾入分液漏斗中,将有机层分离。将有机层用饱和氯化铵溶液(1×)、水(1×)洗涤,干燥(Na2SO4),浓缩。将残渣1655d用二氯甲烷(10ml)稀释,下一步按0.308M溶液使用。
步骤4
向1655e(176mg,0.5mmol;按中间体20.08,步骤1和2中所述,用适当原料制备1655e)的二氯甲烷(4ml)的冷(0℃)溶液中依次加入1655d(0.308M溶液,4.87mL,1.5mmol)、DIPEA(0.276mL,1.5mmol)。将反应混合物在10℃下保持16h。将反应物用饱和氯化铵溶液猝灭,将水层用二氯甲烷(3×)萃取。将合并的有机层用盐水洗涤,干燥(Na2SO4),过滤,真空浓缩。粗残渣经闪式柱层析纯化,用20/80丙酮/己烷洗脱,得到需要的化合物1655f(240mg,100%收率)。LC-MS:480.1(M+H)。
步骤5
用中间体10.11和上述方法(步骤4-6,实施例1007),将以上化合物1655f转化为需要的目标化合物1655。1655的LC-MS=618.1(M+H)。
制备实施例1614
步骤1
在室温下,搅拌下,向N-Boc-叔-亮氨醇(leucinol)1655a(2.0g,9.22mmol)、苯酚(1.0g,10.6mmol)和ADDP(3.8g,15.1mmol)的CH2Cl2(80ml)溶液中鼓泡通入氩气15min。然后一次性加入三苯膦。将得到的溶液在室温下搅拌18h。将沉淀滤除,用乙醚(2×30ml)洗涤。将滤液真空浓缩。残渣经闪式柱层析纯化,用2-10%EtOAc/己烷洗脱,得到需要的产物1614a(0.33g,12%)。
步骤2
将化合物1614a(0.32g,1.13mmol)溶于4M氯化氢的对-二烷(20mL)溶液,在室温下搅拌3h。真空浓缩,得到化合物1614b,其使用时无需进一步纯化。
步骤3
按实施例1655,步骤3中所述方法,由1614b制备化合物1614c。
步骤4
按通用流程,方法C中所述,用适当试剂和中间体将异氰酸酯1614c转化为目标化合物1614。
制备实施例1610
步骤1
在室温下,搅拌下,向无水硫酸镁的无水CH2Cl2(40ml)悬浮液中加入浓硫酸(0.32ml,5.76mmol)。将混合物剧烈搅拌30min,然后加入1610a(2.0g,7.90mmol)的无水CH2Cl2(15ml)溶液。然后将混合物在室温下剧烈搅拌68h。小心加入饱和NaHCO3溶液(50ml)以及CH2Cl2(100mL)和水(50mL)。将两相分离,将水层用CH2Cl2(2×100mL)萃取。将合并的有机溶液干燥(MgSO4),过滤,真空浓缩,得到1610b。
步骤2
在氢气氛下,将化合物1610b和10%Pd-C的无水乙醇悬浮液剧烈搅拌4h。通过硅藻土垫将催化剂滤除。将滤液真空浓缩,得到1610c,其使用时无需进一步纯化。
步骤3
按实施例1655,步骤3中所述方法,由1610c制备化合物1610d。
步骤4
按通用流程,方法C中所述,用适当试剂和中间体将异氰酸酯1610d转化为目标化合物1610。
制备实施例1620
步骤1
在76℃下,在油浴中,将醇1655a(3.46g,12.8mmol)、苄基溴(10ml,84.2mmol)和氧化银(I)(5.0g,21.6mmol)的乙腈悬浮液剧烈搅拌过夜(18h)。将固体物质滤除,将溶液真空浓缩。产物经闪式柱层析纯化,用5-40% EtOAc/己烷洗脱,得到需要的产物1620a(0.78g,20%)。
步骤2
按实施例1614,步骤2中所述方法,由1620a制备化合物16120b。
步骤3
按实施例1655,步骤3中所述方法,由1620b制备化合物1620c。
步骤4
按通用流程,方法C中所述,用适当试剂和中间体将异氰酸酯1620c转化为目标化合物1620。
制备实施例1629
步骤1
向1441e(600mg)中加入4M HCl的二烷(25ml)溶液。将反应物在室温下搅拌30min,浓缩,得到白色固体1629a(490mg),其无需纯化即可进行下一步骤。
步骤2
按上述方法(实施例1655,步骤4),向化合物1629a(395mg)的CH2Cl2(25mL)冷(0℃)溶液中依次加入Et3N(0.57ml)、异氰酸酯1629b(Robinson,Ralph P.;Marfat,Anthony.Eur.Pat.Appl.(1991),EP 436333A2 19910710,第53页)。得到的粗羟基酰胺使用时无需纯化。
将粗羟基酰胺的甲苯-DMSO(各2.0mL)溶液冷却至0℃。向反应混合物中依次加入EDCl.HCl(410.0mg)、二氯乙酸(dichloroaceticacetic)(0.087mL),在室温下搅拌2h后,将它用EtOAc稀释,用1NHCl、饱和NaHCO3、盐水洗涤,经MgSO4干燥,过滤,浓缩,得到白色固体,将它经硅胶层析纯化,用丙酮-己烷(40∶60)洗脱,得到标题化合物1629(280.0mg),为白色固体:C33H49N5O6的质谱(611.77);实测值FAB(M+H)+=612.5
制备实施例1628
向化合物1629(37.0mg)的MeOH(2.0ml)溶液中加入Pd-C(10%w/v,5.0mg),在氢气氛下,将反应物搅拌1h,通过硅藻土垫过滤,浓缩,经硅胶层析纯化,用丙酮-己烷(4∶6)洗脱,得到需要的化合物1628(22.0mg),为白色固体。C26H43N5O6的质谱(521.65);实测值FAB(M+H)+=522.6。
制备实施例1633
用实施例1629描述的方法,由异氰酸酯1629b和化合物1633a(由1.17和10.11制备)得到需要的标题化合物1633。C34H51N5O6的质谱(625.80);实测值FAB(M+H)+=626.8。
制备实施例1632
向化合物1633(10.0mg)的MeOH(2.0ml)溶液中加入Pd-C(10%w/v,2.0mg),将反应物在氢气氛下搅拌1h,通过硅藻土垫过滤,浓缩,经硅胶层析纯化,用丙酮-己烷(4∶6)洗脱,得到标题化合物1632,为白色固体(4.2mg)。C27H45N5O6的质谱(535.68);实测值FAB(M+H)+=536.7。
制备实施例1647
步骤1
搅拌下,向市售化合物1647a(Aldrich Chemical Co.,Milwaukee,Wisconsin,USA,250.0mg)的MeOH溶液中加入三甲基甲硅烷基重氮甲烷(2.0ml,2M的PhMe溶液)。20min后,将溶剂除去,将粗产物再溶于CH2Cl2(2.0mL),加入苄氧基甲基氯(1.5当量)和Et3N(1.5当量)。将反应混合物搅拌过夜,用EtOAc稀释,依次用5% Na2S2O3、饱和NaHCO3、1N HCl、盐水洗涤,经MgSO4干燥,过滤,浓缩,得到白色固体,经硅胶层析纯化,用EtOAc-己烷(1∶3)洗脱,得到化合物1647b(413mg),为白色固体:C20H24O4的质谱(328.40);实测值FAB(M+H)+=329.4。
步骤2
向0.413g化合物1647b的MeOH/H2O(5.0/0.5ml)溶液中加入0.735g KOH。使反应混合物回流过夜,冷却至室温,浓缩。将粗产物再溶于H2O(10.0ml),用10%HCl水溶液酸化,用CH2Cl2萃取,经MgSO4干燥,过滤,浓缩,得到相应的羧酸1647c(392mg)。粗产物直接用于下一步骤。向123.2mg酸1647c的甲苯(5.0ml)溶液中加入DPPA(0.09ml)和Et3N(0.055ml)。将反应混合物在110℃下加热40min,冷却,用饱和NaHCO3洗涤,经MgSO4干燥,过滤,浓缩,得到异氰酸酯1647d。得到的粗产物使用时无需纯化。
步骤3
按实施例1629中所述方法,将异氰酸酯1647d用化合物1629a(90.0mg)处理,得到标题化合物1647。C40H55N5O7的质谱(717.89);实测值FAB(M+H)+=718.8。
制备实施例1648
向化合物1647的MeOH溶液中加入6N HCl,30min后,将MeOH除去,将粗产物再溶于乙酸乙酯,用饱和NaHCO3洗涤。粗产物经硅胶层析纯化,用丙酮-己烷(40∶60)洗脱,得到标题化合物1648(25.0mg),为白色固体:C32H47N5O6的质谱(597.75);实测值FAB(M+H)+=598.7。
主要用上述方法(制备实施例1610、1614、1620、1628、1629、1632、1633、1647、1648、1655)和适当试剂,以及制备目标化合物的通用流程,方法A-E中所述改进制备下表(表3)中化合物。
表3
Ki*范围A=<75nM;B=75-250nM;C=>250nM
本发明涉及新HCV蛋白酶抑制剂。可用它们抑制HCV NS2/NS4a丝氨酸蛋白酶的能力来证明该效用。通过以下体外测定来说明这种证明的通用方法。
测定HCV蛋白酶抑制活性:
分光光度测定:可通过以下R.Zhang等,Analytical Biochemistry,270(1999)268-275描述的方法,对本发明化合物进行HCV丝氨酸蛋白酶分光光度测定,该文献公开内容通过引用结合到本文中。基于生色酯底物蛋白水解的测定适用于连续监测HCV NS3蛋白酶活性。底物衍生自NS5A-NS5B连接序列(Ac-DTEDVVX(Nva),其中X=A或P)的P侧链,它的C-末端羧基被4个不同发色醇之一(3-或4-硝基苯酚、7-羟基-4-甲基-香豆素或4-苯基偶氮苯酚)酯化。以下举例说明合成、表征和应用这些新分光光度测定的酯底物进行高通量筛选和对HCV NS3蛋白酶抑制剂的详细动力学评价。
材料和方法:
材料:用于测定相关缓冲液的化学试剂得自Sigma ChemicalCompany(St.Louis,Missouri)。肽合成试剂出自Aldrich Chemicals,Novabiochem(San Diego,California),Applied Biosystems(Foster City,California)和Perseptive Biosystems(Framingham,Massachusetts)。人工或在431A型自动ABI合成仪(来自Applied Biosystems)上合成肽。LAMBDA 12型UV/VIS分光光度计出自Perkin Elmer(Norwalk,Connecticut),96孔UV板得自Corning(Corning,New York)。预热区段可从USA Scientific(Ocala,Florida)得到,96孔板涡旋搅拌器出自Labline Instruments(Melrose Park,Illinois)。带单色器的Spectramax Plus微量滴定板读出器得自Molecular Devices(Sunnyvale,California)。
酶制备:通过用先前公布的方法(D.L.Sali等,Biochemistry,37(1998)3392-3401),制备重组异源二聚体的HCV NS3/NS4A蛋白酶(1a系)。用通过氨基酸分析预先定量的重组HCV蛋白酶标准,通过Biorad染色法测定蛋白浓度。在测定开始前,用Biorad Bio-Spin P-6预填充柱,使酶储存缓冲液(50mM磷酸钠pH8.0,300mM NaCl,10%甘油,0.05%十二烷基麦芽糖苷和10mM DTT)与测定缓冲液(25mM MOPSpH6.5,300mM NaCl,10%甘油,0.05%十二烷基麦芽糖苷,5μMEDTA和5μM DTT)交换。
底物合成和纯化:按R.Zhang等(同上)报道方法合成底物,通过用标准方案(K.Barlos等,Int.J.Pept.Protein Res.,37(1991),513-520)将Fmoc-Nva-OH锚定到2-氯三苯甲基氯树脂上引发。随后用Fmoc化学,人工或在431型自动ABI肽合成仪上装配肽。用10%乙酸(HOAc)和10%三氟乙醇(TFE)的二氯甲烷(DCM)溶液,将N-乙酰化和全保护的肽片段与树脂解离30min,或用2%三氟乙酸(TFA)的DCM溶液解离10min。将合并的滤液和DCM洗涤液共沸蒸发(或用Na2CO3水溶液反复萃取),除去用于解离的酸。DCM相经Na2SO4干燥,蒸发。
用标准酸-醇偶联方法(K.Holmber等,Acta Chem.Scand.,B33(1979)410-412)装配酯底物。将肽片段溶于无水吡啶(30-60mg/ml),向其中加入10摩尔当量发色团和催化量(0.1当量)对甲苯磺酸(pTSA)。加入二环己基碳二亚胺(DCC,3当量),引发偶联反应。通过HPLC监控产物形成,在室温下,12-72小时后可发现反应完成。将吡啶溶剂真空蒸发,通过与甲苯共沸蒸发进一步除去。用95%TFA的DCM溶液使肽酯脱保护2小时,用无水乙醚萃取三次,除去过量发色团。使脱保护的底物通过反相HPLC,在C3或C8柱上纯化,用30%-60%乙腈梯度(用6柱体积)洗脱。HPLC纯化后的总收率可为约20-30%。分子量可通过电喷雾离子化质谱确证。在干燥条件下,底物以干粉形式储存。
底物和产物图谱:在pH6.5测定缓冲液中得到底物和相应的发色团产物图谱。在1-cm比色皿中(对于3-Np和HMC为340nm,对于PAP为370nm而对于4-Np为400nm),用多次稀释,测定在最佳非高峰波长处的消光系数。最佳非高峰波长定义为:在底物与产物之间吸收度产生最大分数差分的波长(产物OD-底物OD)/底物OD)。
蛋白酶测定:在30℃下,在96孔微量滴定板中,用200μl反应混合物进行HCV蛋白酶测定。对用于NS3/NS4A异源二聚体的测定缓冲液条件(25mM MOPS pH6.5,300mM NaCl,10%甘油,0.05%十二烷基麦芽糖苷,5μM EDTA和5μM DTT)进行优化(D.L.Sali等,同上))。通常,将150μl缓冲液、底物和抑制剂的混合物置入孔中(DMSO终浓度≤4%v/v),在30℃下,预温育约3分钟。然后用50μl预热蛋白酶(12nM,30℃)的测定缓冲液溶液引发反应(终体积200μl)。在测定期间(60分钟),在适当波长处(对于3-Np和HMC为340nm,对于PAP为370nm而对于4-Np为400nm),用配备单色器的SpectromaxPlus微量滴定板读出器监控板中吸收度变化(可用使用截止滤光器的板读出器得到可接受的结果)。在适当的波长处,监测Nva与发色团之间酯键的蛋白水解解离,用不含酶的空白作非酶水解对照。在30倍底物浓度范围(~6-200μM)中,评价底物动力学参数。用线性回归测定初始速度,通过将数据代入Michaelis-Menten方程,用非线性回归分析(Mac Curve Fit 1.1,K.Raner)得到动力学常数。假定酶全部具有活性,计算转换数(kcat)。
抑制剂和灭活剂评价:在酶和底物的固定浓度下,实验测定竞争性抑制剂Ac-D-(D-Gla)-L-1-(Cha)-C-OH(27)、Ac-DTEDVVA(Nva)-OH和Ac-DTEDVVP(Nva)-OH的抑制常数(Ki),按照重新排列的竞争性抑制动力学的Michaelis-Menten方程:vo/vi=1+[I]o/(Ki(1+[S]o/Km)),其中vo是未抑制的初始速度,vi是在任何给出抑制剂浓度([I]o)的抑制剂存在下的初始速度,[S]o是使用的底物浓度,绘制vo/vi对抑制剂浓度([I]o)的曲线。用线性回归拟合得到的数据,用得到的斜率,1/(Ki(1+[S]o/Km)计算Ki值。某些本发明化合物的Ki*值见下表6和表6A所示:
表6
表6A
虽然结合以上提出的具体实施方案描述了本发明,但其中的许多替代、改进和其它变化对本领域普通技术人员而言是显而易见的。所有此类替代、改进和变化均落入本发明宗旨和范围内。
Claims (37)
1.一种化合物,或所述化合物的对映体、立体异构体、旋转异构体、互变异构体或外消旋体,或所述化合物药学上可接受的盐、溶剂化物或酯,所述化合物具有式I所示通用结构:
式I
其中:
R1为H、OR8、NR9R10或CHR9R10,其中R8、R9和R10可以相同或不同,各自独立选自H、烷基-、烯基-、炔基-、芳基-、杂烷基-、杂芳基-、环烷基-、杂环基-、芳烷基-和杂芳烷基;
A和M可以相同或不同,各自独立选自R、OR、NHR、NRR′、SR、SO2R和卤素;或A和M彼此连接以使上述式I中所示部分:
形成3元、4元、6元、7元或8元环烷基、4元-8元杂环基、6元-10元芳基或5元-10元杂芳基;
E为C(H)或C(R);
L为C(H)、C(R)、CH2C(R)或C(R)CH2;
R、R′、R2和R3可以相同或不同,各自独立选自H、烷基-、烯基-、炔基-、环烷基-、杂烷基-、杂环基-、芳基-、杂芳基-、(环烷基)烷基-、(杂环基)烷基-、芳基-烷基-和杂芳基-烷基-;或者,NRR′中的R和R′彼此连接以使NRR′形成4元-8元杂环基;
和Y选自以下部分:
其中G为NH或O;且R15、R16、R17、R18和R19可以相同或不同,各自独立选自H、烷基、杂烷基、烯基、杂烯基、炔基、杂炔基、环烷基、杂环基、芳基、芳烷基、杂芳基和杂芳烷基,或者,(i)R15和R16彼此连接形成4元-8元环结构,或R15和R19彼此连接形成4元-8元环结构,和(ii)同样,R17和R18独立地彼此连接形成3元-8元环烷基或杂环基;
其中所述烷基、芳基、杂芳基、环烷基或杂环基各自可未被取代,或任选独立被一个或多个选自以下的部分取代:羟基、烷氧基、芳氧基、硫代基、烷硫基、芳硫基、氨基、酰氨基、烷基氨基、芳基氨基、烷基磺酰基、芳基磺酰基、磺酰氨基、烷基磺酰氨基、芳基磺酰氨基、烷基、芳基、杂芳基、酮基、羧基、烷氧羰基、羧酰氨基、烷氧羰基氨基、烷氧羰基氧基、烷基脲基、芳基脲基、卤素、氰基和硝基。
2.权利要求1的化合物,其中R1为NR9R10,且R9为H,R10为H或R14,其中R14为H、烷基、芳基、杂烷基、杂芳基、环烷基、烷基-芳基、烷基-杂芳基、芳基-烷基、烯基、炔基或杂芳基-烷基。
7.权利要求1的化合物,其中Y选自以下部分:
其中G=NH或O;和
R15、R16、R17、R18和R19可以相同或不同,各自独立选自H、烷基、杂烷基、烯基、杂烯基、炔基、杂炔基、环烷基、杂环基、芳基和杂芳基,或者,(i)R15和R16直接连接形成4元-8元环结构,或R15和R19直接连接形成4元-8元环结构,和(ii)同样,R17和R18独立地直接连接形成3元-8元环烷基或杂环基;
其中所述烷基、芳基、杂芳基、环烷基或杂环基各自可未被取代,或任选独立被一个或多个选自以下的部分取代:羟基、烷氧基、芳氧基、硫代基、烷硫基、芳硫基、氨基、酰氨基、烷基氨基、芳基氨基、烷基磺酰基、芳基磺酰基、磺酰氨基、烷基磺酰氨基、芳基磺酰氨基、酮基、羧基、烷氧羰基、羧酰氨基、烷氧羰基氨基、烷氧羰基氧基、烷基脲基、芳基脲基、卤素、氰基和硝基。
8.权利要求7的化合物,其中G为NH。
10.权利要求9的化合物,其中R16为H。
15.一种药用组合物,所述组合物包含至少一种权利要求1的化合物作为活性成分。
16.权利要求15的药用组合物,所述组合物用于治疗与HCV有关的疾病。
17.权利要求16的药用组合物,所述组合物还包含至少一种药学上可接受的载体。
18.权利要求17的药用组合物,所述组合物还含有至少一种抗病毒药物。
19.权利要求18的药用组合物,所述组合物还另外含有至少一种干扰素。
20.权利要求19的药用组合物,其中所述至少一种抗病毒药物为利巴韦林,且所述至少一种干扰素为α-干扰素或聚乙二醇化干扰素。
21.一种治疗与HCV有关的疾病的方法,所述方法包括给予需要这种治疗的患者药用组合物,该组合物包含治疗有效量的至少一种权利要求1的化合物。
22.权利要求21的方法,其中所述给予为口服或皮下给药。
23.权利要求1的化合物在制备药物中的用途,其中所述药物用于治疗与HCV有关的疾病。
24.一种制备用于治疗与HCV有关疾病的药用组合物的方法,所述方法包括使至少一种权利要求1的化合物与至少一种药学上可接受的载体物理性充分接触。
26.一种治疗与HCV有关疾病的药用组合物,所述组合物包含治疗有效量的一种或多种权利要求25的化合物和药学上可接受的载体。
27.权利要求26的药用组合物,所述组合物还含有至少一种抗病毒药物。
28.权利要求27的药用组合物,所述组合物还含有至少一种干扰素或PEG-α-干扰素轭合物。
29.权利要求28的药用组合物,其中所述至少一种抗病毒药物为利巴韦林,且所述至少一种干扰素为α-干扰素或聚乙二醇化干扰素。
30.一种治疗与丙型肝炎病毒有关的疾病的方法,所述方法包括给予有效量的一种或多种权利要求25的化合物。
31.一种调节丙型肝炎病毒(HCV)蛋白酶活性的方法,所述方法包括使HCV蛋白酶与一种或多种权利要求25的化合物接触。
32.一种治疗、预防或缓解一种或多种丙型肝炎症状的方法,所述方法包括给予治疗有效量的一种或多种权利要求25的化合物。
33.权利要求32的方法,其中所述HCV蛋白酶为NS3/NS4a蛋白酶。
34.权利要求33的方法,其中所述一种或多种化合物抑制HCVNS3/NS4a蛋白酶。
35.一种调节丙型肝炎病毒(HCV)多肽加工的方法,所述方法包括使含有HCV多肽的组合物在加工所述多肽的条件下,与一种或多种权利要求25的化合物接触。
37.权利要求1的化合物,所述化合物为纯化形式。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US54853504P | 2004-02-27 | 2004-02-27 | |
| US60/548,535 | 2004-02-27 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN1972956A true CN1972956A (zh) | 2007-05-30 |
Family
ID=34962125
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNA2005800126954A Pending CN1972956A (zh) | 2004-02-27 | 2005-02-24 | 用作丙型肝炎病毒ns3丝氨酸蛋白酶抑制剂的新化合物 |
Country Status (20)
| Country | Link |
|---|---|
| US (2) | US7186747B2 (zh) |
| EP (2) | EP1939213B1 (zh) |
| JP (1) | JP2007525511A (zh) |
| KR (1) | KR20060124729A (zh) |
| CN (1) | CN1972956A (zh) |
| AR (1) | AR047903A1 (zh) |
| AT (2) | ATE478889T1 (zh) |
| AU (1) | AU2005222056A1 (zh) |
| BR (1) | BRPI0508186A (zh) |
| CA (1) | CA2557249A1 (zh) |
| DE (2) | DE602005015093D1 (zh) |
| EC (1) | ECSP066794A (zh) |
| ES (2) | ES2327544T3 (zh) |
| HK (2) | HK1095837A1 (zh) |
| IL (1) | IL177627A0 (zh) |
| NO (1) | NO20064357L (zh) |
| RU (1) | RU2006134002A (zh) |
| TW (1) | TW200529823A (zh) |
| WO (1) | WO2005087725A2 (zh) |
| ZA (1) | ZA200607053B (zh) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN114133350A (zh) * | 2021-12-16 | 2022-03-04 | 浙江乐普药业股份有限公司 | 一种抗新冠药物Paxlovid中间体的制备方法 |
| WO2023151188A1 (zh) * | 2022-02-08 | 2023-08-17 | 上海皓元医药股份有限公司 | 一种抗病毒药物中间体的绿色合成方法 |
Families Citing this family (59)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7491794B2 (en) * | 2003-10-14 | 2009-02-17 | Intermune, Inc. | Macrocyclic compounds as inhibitors of viral replication |
| US20060275366A1 (en) * | 2005-06-02 | 2006-12-07 | Schering Corporation | Controlled-release formulation |
| US20060276404A1 (en) * | 2005-06-02 | 2006-12-07 | Anima Ghosal | Medicaments and methods combining a HCV protease inhibitor and an AKR competitor |
| US20070237818A1 (en) * | 2005-06-02 | 2007-10-11 | Malcolm Bruce A | Controlled-release formulation of HCV protease inhibitor and methods using the same |
| WO2006130552A2 (en) * | 2005-06-02 | 2006-12-07 | Schering Corporation | Methods of treating hepatitis c virus |
| PL1891089T3 (pl) | 2005-06-02 | 2015-05-29 | Merck Sharp & Dohme | Inhibitory proteazy HCV w połączeniu z pokarmem |
| WO2006130626A2 (en) * | 2005-06-02 | 2006-12-07 | Schering Corporation | Method for modulating activity of hcv protease through use of a novel hcv protease inhibitor to reduce duration of treatment period |
| CN101212970B (zh) * | 2005-06-02 | 2010-07-21 | 先灵公司 | Hcv蛋白酶抑制剂与表面活性剂的组合物 |
| WO2006130554A2 (en) * | 2005-06-02 | 2006-12-07 | Schering Corporation | Methods of treating hepatitis c virus |
| WO2006130687A2 (en) * | 2005-06-02 | 2006-12-07 | Schering Corporation | Liver/plasma concentration ratio for dosing hepatitis c virus protease inhibitor |
| CA2611145A1 (en) * | 2005-06-02 | 2006-12-07 | Schering Corporation | Controlled-release formulation useful for treating disorders associated with hepatitis c virus |
| MX2008001166A (es) * | 2005-07-25 | 2008-03-18 | Intermune Inc | Nuevos inhibidores macrociclicos de la replicacion del virus de hepatitis c. |
| AR055395A1 (es) | 2005-08-26 | 2007-08-22 | Vertex Pharma | Compuestos inhibidores de la actividad de la serina proteasa ns3-ns4a del virus de la hepatitis c |
| US8119592B2 (en) | 2005-10-11 | 2012-02-21 | Intermune, Inc. | Compounds and methods for inhibiting hepatitis C viral replication |
| KR20140098867A (ko) | 2005-11-11 | 2014-08-08 | 버텍스 파마슈티칼스 인코포레이티드 | C형 간염 바이러스 변이체 |
| US7705138B2 (en) | 2005-11-11 | 2010-04-27 | Vertex Pharmaceuticals Incorporated | Hepatitis C virus variants |
| US7816348B2 (en) | 2006-02-03 | 2010-10-19 | Boehringer Ingelheim International Gmbh | Viral polymerase inhibitors |
| US7990344B2 (en) | 2006-02-14 | 2011-08-02 | Panasonic Corporation | Plasma display panel driving method having a high temperature and low temperature driving mode and plasma display device thereof |
| RU2008152171A (ru) * | 2006-07-05 | 2010-08-10 | Интермьюн, Инк. (Us) | Новые ингибиторы вирусной репликации гепатита с |
| US20090098085A1 (en) * | 2006-08-11 | 2009-04-16 | Ying Sun | Tetrazolyl acyclic hepatitis c serine protease inhibitors |
| AU2007284027A1 (en) | 2006-08-17 | 2008-02-21 | Boehringer Ingelheim International Gmbh | Viral polymerase inhibitors |
| MX2009002688A (es) * | 2006-09-13 | 2009-03-26 | Novartis Ag | Inhibidores macrociclicos del virus de hepatitis c y sus usos. |
| US20100081672A1 (en) * | 2006-12-07 | 2010-04-01 | Schering Corporation | Ph sensitive matrix formulation |
| US7910587B2 (en) * | 2007-04-26 | 2011-03-22 | Enanta Pharmaceuticals, Inc. | Quinoxalinyl dipeptide hepatitis C virus inhibitors |
| WO2008137779A2 (en) * | 2007-05-03 | 2008-11-13 | Intermune, Inc. | Novel macrocyclic inhibitors of hepatitis c virus replication |
| KR20100027134A (ko) * | 2007-05-10 | 2010-03-10 | 인터뮨, 인크. | C형 간염 바이러스 복제의 신규 펩티드 억제제 |
| US8242140B2 (en) | 2007-08-03 | 2012-08-14 | Boehringer Ingelheim International Gmbh | Viral polymerase inhibitors |
| US8419332B2 (en) * | 2007-10-19 | 2013-04-16 | Atlas Bolt & Screw Company Llc | Non-dimpling fastener |
| EA201000948A1 (ru) | 2007-12-19 | 2011-02-28 | Бёрингер Ингельхайм Интернациональ Гмбх | Ингибиторы вирусной полимеразы |
| WO2009142842A2 (en) | 2008-04-15 | 2009-11-26 | Intermune, Inc. | Novel macrocyclic inhibitors of hepatitis c virus replication |
| US8188137B2 (en) | 2008-08-15 | 2012-05-29 | Avila Therapeutics, Inc. | HCV protease inhibitors and uses thereof |
| US20100173837A1 (en) | 2009-01-07 | 2010-07-08 | Scynexis, Inc. | Dosing forms and regimens comprising 3-[(r)-2-(n,n-dimethylamino)ethylthio-sar]-4-(gammahydroxymethylleucine)cyclosporine |
| AR075584A1 (es) | 2009-02-27 | 2011-04-20 | Intermune Inc | COMPOSICIONES TERAPEUTICAS QUE COMPRENDEN beta-D-2'-DESOXI-2'-FLUORO-2'-C-METILCITIDINA Y UN DERIVADO DE ACIDO ISOINDOL CARBOXILICO Y SUS USOS. COMPUESTO. |
| CA2763140A1 (en) | 2009-05-29 | 2010-12-02 | Schering Corporation | Antiviral compounds composed of three linked aryl moieties to treat diseases such as hepatitis c |
| EP2503881B1 (en) | 2009-11-25 | 2015-05-13 | Merck Sharp & Dohme Corp. | Fused tricyclic compounds and derivatives thereof useful for the treatment of viral diseases |
| JP2013515068A (ja) | 2009-12-22 | 2013-05-02 | メルク・シャープ・アンド・ドーム・コーポレーション | ウイルス性疾患の治療のための縮合三環式化合物およびその使用方法 |
| CA2792121A1 (en) | 2010-03-09 | 2011-09-15 | Merck Sharp & Dohme Corp. | Fused tricyclic silyl compounds and methods of use thereof for the treatment of viral diseases |
| EP2598149A4 (en) | 2010-07-26 | 2014-09-10 | Merck Sharp & Dohme | SUBSTITUTED BIPHENYLENE COMPOUNDS AND METHOD FOR USE THEREOF FOR THE TREATMENT OF VIRUS DISEASES |
| AU2011314168A1 (en) | 2010-09-29 | 2013-04-04 | Merck Sharp & Dohme Corp. | Fused tetracycle derivatives and methods of use thereof for the treatment of viral diseases |
| BR112013026345A2 (pt) | 2011-04-13 | 2019-04-24 | Merck Sharp & Dohe Corp. | composto, composição farmacêutica, uso de um composto, e, método para tratar um paciente infectado com hcv |
| WO2012142075A1 (en) | 2011-04-13 | 2012-10-18 | Merck Sharp & Dohme Corp. | 2'-azido substituted nucleoside derivatives and methods of use thereof for the treatment of viral diseases |
| ES2553449T3 (es) | 2011-07-06 | 2015-12-09 | Gilead Sciences, Inc. | Compuestos para el tratamiento de VIH |
| WO2013033901A1 (en) | 2011-09-08 | 2013-03-14 | Merck Sharp & Dohme Corp. | Heterocyclic-substituted benzofuran derivatives and methods of use thereof for the treatment of viral diseases |
| WO2013033899A1 (en) | 2011-09-08 | 2013-03-14 | Merck Sharp & Dohme Corp. | Substituted benzofuran compounds and methods of use thereof for the treatment of viral diseases |
| WO2013033900A1 (en) | 2011-09-08 | 2013-03-14 | Merck Sharp & Dohme Corp. | Tetracyclic heterocycle compounds and methods of use thereof for the treatment of viral diseases |
| EP2755981A4 (en) | 2011-09-14 | 2015-03-25 | Merck Sharp & Dohme | SILICULAR HETEROCYCLIC DERIVATIVES AND METHOD FOR THEIR USE FOR THE TREATMENT OF VIRUS DISEASES |
| WO2015065817A1 (en) | 2013-10-30 | 2015-05-07 | Merck Sharp & Dohme Corp. | Pseudopolymorphs of an hcv ns5a inhibitor and uses thereof |
| ES2954514T3 (es) | 2016-08-19 | 2023-11-22 | Gilead Sciences Inc | Compuestos terapéuticos útiles para el tratamiento profiláctico o terapéutico de una infección por el virus del VIH |
| JOP20180009A1 (ar) | 2017-02-06 | 2019-01-30 | Gilead Sciences Inc | مركبات مثبط فيروس hiv |
| TWI687415B (zh) | 2017-08-17 | 2020-03-11 | 美商基利科學股份有限公司 | Hiv蛋白質膜抑制劑之固體形式 |
| AR112412A1 (es) | 2017-08-17 | 2019-10-23 | Gilead Sciences Inc | Formas de sal de colina de un inhibidor de la cápside del vih |
| KR102587510B1 (ko) | 2018-02-15 | 2023-10-11 | 길리애드 사이언시즈, 인코포레이티드 | 피리딘 유도체 및 hiv 감염을 치료하기 위한 그의 용도 |
| EP4253366A3 (en) | 2018-02-16 | 2023-11-29 | Gilead Sciences, Inc. | Methods and intermediates for preparing a therapeutic compound useful in the treatment of retroviridae viral infection |
| TW202425967A (zh) | 2018-07-16 | 2024-07-01 | 美商基利科學股份有限公司 | 用於治療hiv之蛋白殼抑制劑 |
| EP4065116A1 (en) | 2019-11-26 | 2022-10-05 | Gilead Sciences, Inc. | Capsid inhibitors for the prevention of hiv |
| TWI858267B (zh) | 2020-06-25 | 2024-10-11 | 美商基利科學股份有限公司 | 用於治療hiv之蛋白殼抑制劑 |
| US11351149B2 (en) | 2020-09-03 | 2022-06-07 | Pfizer Inc. | Nitrile-containing antiviral compounds |
| AU2022399845A1 (en) | 2021-12-03 | 2024-05-23 | Gilead Sciences, Inc. | Therapeutic compounds for hiv virus infection |
| CA3235937A1 (en) | 2021-12-03 | 2023-06-08 | Gilead Sciences, Inc. | Therapeutic compounds for hiv virus infection |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2012739T5 (es) | 1987-11-18 | 2001-12-01 | Chiron Corp | Diagnosticos para nanbv. |
| DE69024378T2 (de) | 1989-02-01 | 1996-09-12 | Asahi Glass Co. Ltd., Tokio/Tokyo | Azeotrope oder azeotropähnliche Zusammensetzung auf der Basis von Chlorfluorkohlenwasserstoffen |
| AU7675491A (en) | 1990-04-04 | 1991-10-30 | Chiron Corporation | Hepatitis c virus protease |
| US5922757A (en) | 1996-09-30 | 1999-07-13 | The Regents Of The University Of California | Treatment and prevention of hepatic disorders |
| IN183120B (zh) | 1996-10-18 | 1999-09-11 | Vertex Pharma | |
| GB9623908D0 (en) | 1996-11-18 | 1997-01-08 | Hoffmann La Roche | Amino acid derivatives |
| HUP0100100A3 (en) | 1997-08-11 | 2001-12-28 | Boehringer Ingelheim Ca Ltd | Hepatitis c inhibitor peptide analogues, pharmaceutical compositions comprising thereof and their use |
| AR022061A1 (es) | 1998-08-10 | 2002-09-04 | Boehringer Ingelheim Ca Ltd | Peptidos inhibidores de la hepatitis c, una composicion farmaceutica que los contiene, el uso de los mismos para preparar una composicion farmaceutica, el uso de un producto intermedio para la preparacion de estos peptidos y un procedimiento para la preparacion de un peptido analogo de los mismos. |
| US6323180B1 (en) | 1998-08-10 | 2001-11-27 | Boehringer Ingelheim (Canada) Ltd | Hepatitis C inhibitor tri-peptides |
| US6608027B1 (en) | 1999-04-06 | 2003-08-19 | Boehringer Ingelheim (Canada) Ltd | Macrocyclic peptides active against the hepatitis C virus |
| UA74546C2 (en) | 1999-04-06 | 2006-01-16 | Boehringer Ingelheim Ca Ltd | Macrocyclic peptides having activity relative to hepatitis c virus, a pharmaceutical composition and use of the pharmaceutical composition |
| JP4806154B2 (ja) | 2000-04-03 | 2011-11-02 | バーテックス ファーマシューティカルズ インコーポレイテッド | セリンプロテアーゼ、特にc型肝炎ウイルスns3プロテアーゼのインヒビター |
| WO2001077113A2 (en) | 2000-04-05 | 2001-10-18 | Schering Corporation | Macrocyclic ns3-serine protease inhibitors of hepatitis c virus comprising n-cyclic p2 moieties |
| SK14952002A3 (sk) | 2000-04-19 | 2003-03-04 | Schering Corporation | Makrocyklické zlúčeniny, farmaceutický prostriedok s ich obsahom a ich použitie |
| DE60141608D1 (de) * | 2000-07-21 | 2010-04-29 | Dendreon Corp | Peptide als inhibitoren der ns3-serinprotease des hepatitis c virus |
| AR029851A1 (es) | 2000-07-21 | 2003-07-16 | Dendreon Corp | Nuevos peptidos como inhibidores de ns3-serina proteasa del virus de hepatitis c |
| US20020068702A1 (en) | 2000-07-21 | 2002-06-06 | Marguerita Lim-Wilby | Novel peptides as NS3-serine protease inhibitors of hepatitis C virus |
| JP4452441B2 (ja) | 2000-07-21 | 2010-04-21 | シェーリング コーポレイション | C型肝炎ウイルスのns3−セリンプロテアーゼ阻害剤としての新規ペプチド |
| AR034127A1 (es) | 2000-07-21 | 2004-02-04 | Schering Corp | Imidazolidinonas como inhibidores de ns3-serina proteasa del virus de hepatitis c, composicion farmaceutica, un metodo para su preparacion, y el uso de las mismas para la manufactura de un medicamento |
| US7244721B2 (en) * | 2000-07-21 | 2007-07-17 | Schering Corporation | Peptides as NS3-serine protease inhibitors of hepatitis C virus |
| EP1343807B1 (en) | 2000-12-12 | 2009-04-29 | Schering Corporation | Diaryl peptides as ns3-serine protease inhibitors of hepatits c virus |
| JP2002349498A (ja) * | 2001-05-24 | 2002-12-04 | Ishikawajima Harima Heavy Ind Co Ltd | 低騒音ファン静翼 |
-
2005
- 2005-02-24 CN CNA2005800126954A patent/CN1972956A/zh active Pending
- 2005-02-24 US US11/065,531 patent/US7186747B2/en not_active Expired - Lifetime
- 2005-02-24 AT AT08102711T patent/ATE478889T1/de not_active IP Right Cessation
- 2005-02-24 RU RU2006134002/04A patent/RU2006134002A/ru not_active Application Discontinuation
- 2005-02-24 EP EP08102711A patent/EP1939213B1/en not_active Expired - Lifetime
- 2005-02-24 WO PCT/US2005/005773 patent/WO2005087725A2/en active Application Filing
- 2005-02-24 ES ES05723590T patent/ES2327544T3/es not_active Expired - Lifetime
- 2005-02-24 KR KR1020067017296A patent/KR20060124729A/ko not_active Application Discontinuation
- 2005-02-24 CA CA002557249A patent/CA2557249A1/en not_active Abandoned
- 2005-02-24 DE DE602005015093T patent/DE602005015093D1/de not_active Expired - Lifetime
- 2005-02-24 ES ES08102711T patent/ES2349328T3/es not_active Expired - Lifetime
- 2005-02-24 EP EP05723590A patent/EP1737881B1/en not_active Expired - Lifetime
- 2005-02-24 JP JP2007500947A patent/JP2007525511A/ja not_active Ceased
- 2005-02-24 AT AT05723590T patent/ATE434621T1/de not_active IP Right Cessation
- 2005-02-24 TW TW094105642A patent/TW200529823A/zh unknown
- 2005-02-24 AU AU2005222056A patent/AU2005222056A1/en not_active Abandoned
- 2005-02-24 BR BRPI0508186-6A patent/BRPI0508186A/pt not_active IP Right Cessation
- 2005-02-24 DE DE602005023224T patent/DE602005023224D1/de not_active Expired - Lifetime
- 2005-02-25 AR ARP050100721A patent/AR047903A1/es unknown
-
2006
- 2006-08-22 IL IL177627A patent/IL177627A0/en unknown
- 2006-08-23 ZA ZA200606953A patent/ZA200607053B/xx unknown
- 2006-08-25 EC EC2006006794A patent/ECSP066794A/es unknown
- 2006-09-26 NO NO20064357A patent/NO20064357L/no not_active Application Discontinuation
- 2006-12-21 US US11/644,708 patent/US7425576B2/en not_active Expired - Lifetime
-
2007
- 2007-03-19 HK HK07102949.1A patent/HK1095837A1/xx not_active IP Right Cessation
-
2008
- 2008-08-19 HK HK08109243.8A patent/HK1118066A1/xx not_active IP Right Cessation
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN114133350A (zh) * | 2021-12-16 | 2022-03-04 | 浙江乐普药业股份有限公司 | 一种抗新冠药物Paxlovid中间体的制备方法 |
| WO2023151188A1 (zh) * | 2022-02-08 | 2023-08-17 | 上海皓元医药股份有限公司 | 一种抗病毒药物中间体的绿色合成方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| HK1118066A1 (en) | 2009-01-30 |
| JP2007525511A (ja) | 2007-09-06 |
| TW200529823A (en) | 2005-09-16 |
| WO2005087725A2 (en) | 2005-09-22 |
| AU2005222056A1 (en) | 2005-09-22 |
| DE602005015093D1 (de) | 2009-08-06 |
| KR20060124729A (ko) | 2006-12-05 |
| US7425576B2 (en) | 2008-09-16 |
| EP1939213A1 (en) | 2008-07-02 |
| EP1737881B1 (en) | 2009-06-24 |
| US20050245458A1 (en) | 2005-11-03 |
| ECSP066794A (es) | 2006-11-16 |
| EP1737881A2 (en) | 2007-01-03 |
| WO2005087725A3 (en) | 2005-10-27 |
| ZA200607053B (en) | 2009-02-25 |
| US7186747B2 (en) | 2007-03-06 |
| NO20064357L (no) | 2006-11-24 |
| EP1939213B1 (en) | 2010-08-25 |
| IL177627A0 (en) | 2006-12-31 |
| HK1095837A1 (en) | 2007-05-18 |
| ATE434621T1 (de) | 2009-07-15 |
| US20070142300A1 (en) | 2007-06-21 |
| BRPI0508186A (pt) | 2007-08-14 |
| ES2349328T3 (es) | 2010-12-30 |
| ES2327544T3 (es) | 2009-10-30 |
| RU2006134002A (ru) | 2008-04-10 |
| CA2557249A1 (en) | 2005-09-22 |
| AR047903A1 (es) | 2006-03-01 |
| DE602005023224D1 (de) | 2010-10-07 |
| ATE478889T1 (de) | 2010-09-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1972956A (zh) | 用作丙型肝炎病毒ns3丝氨酸蛋白酶抑制剂的新化合物 | |
| CN100509784C (zh) | 丙型肝炎病毒ns3/ns4a丝氨酸蛋白酶的抑制剂 | |
| CN100352819C (zh) | 作为ns3-丝氨酸蛋白酶抑制剂的脯氨酸化合物用于制备治疗丙型肝炎病毒感染的药物 | |
| US7253160B2 (en) | Depeptidized inhibitors of hepatitis C virus NS3 protease | |
| JP4745327B2 (ja) | C型肝炎ウイルスns3プロテアーゼのインヒビター | |
| EP1919478B1 (en) | Combination of hcv protease inhibitors with a surfactant | |
| CN1984922A (zh) | 用作丙型肝炎病毒ns3丝氨酸蛋白酶抑制剂的取代脯氨酸 | |
| CN103102389A (zh) | 作为丙型肝炎病毒ns3丝氨酸蛋白酶抑制剂的硫化合物 | |
| CN101679240A (zh) | Hcv ns3蛋白酶的p1-非可差向异构化酮酰胺抑制剂 | |
| CN101679483A (zh) | 作为hcv ns3-蛋白酶抑制剂的酰肼-肽 | |
| WO2005087721A2 (en) | Compounds as inhibitors of hepatitis c virus ns3 serine protease | |
| EP1797111A1 (en) | Acylsulfonamide compounds as inhibitors of hepatitis c virus ns3 serine protease | |
| AU2003207625A1 (en) | Proline compounds as NS3-serine protease inhibitors for use in treatment of hepatites C virus infection | |
| CA2701787A1 (en) | Macrocyclic inhibitors of hepatitis c virus ns3 serine protease | |
| MXPA06009812A (en) | Novel compounds as inhibitors of hepatitis c virus ns3 serine protease | |
| MXPA06009814A (en) | Inhibitors of hepatitis c virus ns3 protease |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C02 | Deemed withdrawal of patent application after publication (patent law 2001) | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Open date: 20070530 |