CN1246323C - 氮基喜树碱衍生物 - Google Patents
氮基喜树碱衍生物 Download PDFInfo
- Publication number
- CN1246323C CN1246323C CNB028090543A CN02809054A CN1246323C CN 1246323 C CN1246323 C CN 1246323C CN B028090543 A CNB028090543 A CN B028090543A CN 02809054 A CN02809054 A CN 02809054A CN 1246323 C CN1246323 C CN 1246323C
- Authority
- CN
- China
- Prior art keywords
- cpt
- compound
- amino
- hydroxy
- lower alkyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- VSJKWCGYPAHWDS-FQEVSTJZSA-N camptothecin Chemical class C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-FQEVSTJZSA-N 0.000 title abstract description 355
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 title description 10
- 229910052757 nitrogen Inorganic materials 0.000 title description 6
- 150000001875 compounds Chemical class 0.000 claims abstract description 158
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 44
- 201000011510 cancer Diseases 0.000 claims abstract description 25
- -1 cyano, nitro, amino Chemical group 0.000 claims description 150
- 125000000217 alkyl group Chemical group 0.000 claims description 108
- 125000003545 alkoxy group Chemical group 0.000 claims description 67
- 239000000203 mixture Substances 0.000 claims description 49
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 47
- 229910052736 halogen Inorganic materials 0.000 claims description 33
- 150000002367 halogens Chemical class 0.000 claims description 30
- 239000001257 hydrogen Substances 0.000 claims description 27
- 229910052739 hydrogen Inorganic materials 0.000 claims description 27
- 125000004453 alkoxycarbonyl group Chemical group 0.000 claims description 26
- 125000003806 alkyl carbonyl amino group Chemical group 0.000 claims description 26
- 125000005196 alkyl carbonyloxy group Chemical group 0.000 claims description 26
- ORTFAQDWJHRMNX-UHFFFAOYSA-N hydroxidooxidocarbon(.) Chemical group O[C]=O ORTFAQDWJHRMNX-UHFFFAOYSA-N 0.000 claims description 26
- 238000000034 method Methods 0.000 claims description 26
- 238000002360 preparation method Methods 0.000 claims description 25
- 125000001424 substituent group Chemical group 0.000 claims description 23
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 21
- 125000004432 carbon atom Chemical group C* 0.000 claims description 19
- 238000006243 chemical reaction Methods 0.000 claims description 19
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 claims description 18
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 14
- 241001465754 Metazoa Species 0.000 claims description 13
- 125000005843 halogen group Chemical group 0.000 claims description 12
- 125000003386 piperidinyl group Chemical group 0.000 claims description 12
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 claims description 10
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 10
- 125000003282 alkyl amino group Chemical group 0.000 claims description 9
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 9
- 229910052760 oxygen Inorganic materials 0.000 claims description 9
- 239000001301 oxygen Substances 0.000 claims description 9
- 125000004414 alkyl thio group Chemical group 0.000 claims description 8
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 8
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 8
- 125000001841 imino group Chemical group [H]N=* 0.000 claims description 8
- 239000008194 pharmaceutical composition Substances 0.000 claims description 8
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 7
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 7
- 150000001335 aliphatic alkanes Chemical class 0.000 claims description 6
- 125000004448 alkyl carbonyl group Chemical group 0.000 claims description 6
- 229920002554 vinyl polymer Polymers 0.000 claims description 6
- 230000008569 process Effects 0.000 claims description 5
- 125000004849 alkoxymethyl group Chemical group 0.000 claims description 4
- 125000000051 benzyloxy group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])O* 0.000 claims description 4
- 125000004122 cyclic group Chemical group 0.000 claims description 4
- 238000001990 intravenous administration Methods 0.000 claims description 4
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical group [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 claims description 3
- 125000005103 alkyl silyl group Chemical group 0.000 claims description 3
- 125000003277 amino group Chemical group 0.000 claims description 3
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 claims description 3
- 239000003054 catalyst Substances 0.000 claims description 3
- 125000004985 dialkyl amino alkyl group Chemical group 0.000 claims description 3
- 125000004663 dialkyl amino group Chemical group 0.000 claims description 3
- 238000007918 intramuscular administration Methods 0.000 claims description 3
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 claims description 3
- 239000007822 coupling agent Substances 0.000 claims description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 claims 2
- BQIKRTGTPBOIMK-UHFFFAOYSA-N [O]C[O] Chemical compound [O]C[O] BQIKRTGTPBOIMK-UHFFFAOYSA-N 0.000 claims 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 claims 1
- 229940127093 camptothecin Drugs 0.000 abstract description 420
- KLWPJMFMVPTNCC-UHFFFAOYSA-N Camptothecin Natural products CCC1(O)C(=O)OCC2=C1C=C3C4Nc5ccccc5C=C4CN3C2=O KLWPJMFMVPTNCC-UHFFFAOYSA-N 0.000 abstract description 404
- VSJKWCGYPAHWDS-UHFFFAOYSA-N dl-camptothecin Natural products C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-UHFFFAOYSA-N 0.000 abstract description 404
- 239000002253 acid Substances 0.000 abstract description 18
- 238000011282 treatment Methods 0.000 abstract description 17
- 150000002148 esters Chemical class 0.000 abstract description 12
- 150000007513 acids Chemical class 0.000 abstract description 2
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 96
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 54
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 48
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 43
- 239000007787 solid Substances 0.000 description 41
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 36
- 239000002904 solvent Substances 0.000 description 32
- 239000000126 substance Substances 0.000 description 31
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 30
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 30
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 28
- 230000015572 biosynthetic process Effects 0.000 description 28
- 229920006395 saturated elastomer Polymers 0.000 description 27
- 235000017557 sodium bicarbonate Nutrition 0.000 description 27
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 27
- 239000000243 solution Substances 0.000 description 27
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 26
- 238000004458 analytical method Methods 0.000 description 26
- 238000003786 synthesis reaction Methods 0.000 description 26
- 210000004027 cell Anatomy 0.000 description 25
- 235000019260 propionic acid Nutrition 0.000 description 25
- 241000699670 Mus sp. Species 0.000 description 22
- 150000003254 radicals Chemical class 0.000 description 22
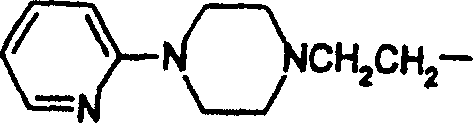
- PSHKMPUSSFXUIA-UHFFFAOYSA-N n,n-dimethylpyridin-2-amine Chemical compound CN(C)C1=CC=CC=N1 PSHKMPUSSFXUIA-UHFFFAOYSA-N 0.000 description 21
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 20
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 20
- DGHHQBMTXTWTJV-BQAIUKQQSA-N 119413-54-6 Chemical compound Cl.C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 DGHHQBMTXTWTJV-BQAIUKQQSA-N 0.000 description 17
- 125000005708 carbonyloxy group Chemical group [*:2]OC([*:1])=O 0.000 description 17
- 229960000303 topotecan Drugs 0.000 description 17
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 16
- XLHNAFUKOSPOAT-UHFFFAOYSA-N 4-ethyl-4-hydroxy-9-nitro-(+-)-1h-pyrano(3',4':6,7)indolizino(1,2-b)quinoline-3,14(4h,12h)-dione Chemical compound C1=C([N+]([O-])=O)C=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 XLHNAFUKOSPOAT-UHFFFAOYSA-N 0.000 description 15
- FUXVKZWTXQUGMW-FQEVSTJZSA-N 9-Aminocamptothecin Chemical compound C1=CC(N)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 FUXVKZWTXQUGMW-FQEVSTJZSA-N 0.000 description 15
- 239000012267 brine Substances 0.000 description 15
- 238000004440 column chromatography Methods 0.000 description 15
- 239000003480 eluent Substances 0.000 description 15
- 150000002431 hydrogen Chemical group 0.000 description 15
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 15
- 235000019341 magnesium sulphate Nutrition 0.000 description 15
- 239000012044 organic layer Substances 0.000 description 15
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 15
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 15
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 13
- 231100000419 toxicity Toxicity 0.000 description 13
- 230000001988 toxicity Effects 0.000 description 13
- 150000001412 amines Chemical class 0.000 description 12
- UCMIRNVEIXFBKS-UHFFFAOYSA-N beta-alanine Chemical compound NCCC(O)=O UCMIRNVEIXFBKS-UHFFFAOYSA-N 0.000 description 12
- 239000011541 reaction mixture Substances 0.000 description 12
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 11
- 239000003814 drug Substances 0.000 description 11
- FQTIYMRSUOADDK-UHFFFAOYSA-N ethyl 3-bromopropanoate Chemical compound CCOC(=O)CCBr FQTIYMRSUOADDK-UHFFFAOYSA-N 0.000 description 11
- 229940079593 drug Drugs 0.000 description 10
- 238000001914 filtration Methods 0.000 description 10
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 10
- DUWWHGPELOTTOE-UHFFFAOYSA-N n-(5-chloro-2,4-dimethoxyphenyl)-3-oxobutanamide Chemical compound COC1=CC(OC)=C(NC(=O)CC(C)=O)C=C1Cl DUWWHGPELOTTOE-UHFFFAOYSA-N 0.000 description 10
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Natural products C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 description 9
- 125000000623 heterocyclic group Chemical group 0.000 description 8
- 230000004083 survival effect Effects 0.000 description 8
- 125000006355 carbonyl methylene group Chemical group [H]C([H])([*:2])C([*:1])=O 0.000 description 7
- 125000005842 heteroatom Chemical group 0.000 description 7
- 230000002427 irreversible effect Effects 0.000 description 7
- OKMRLRFCLKDMTG-UHFFFAOYSA-N 3-(4-benzylpiperazin-1-ium-1-yl)propanoate Chemical compound C1CN(CCC(=O)O)CCN1CC1=CC=CC=C1 OKMRLRFCLKDMTG-UHFFFAOYSA-N 0.000 description 6
- JUXGOBSASOVDKO-UHFFFAOYSA-N 3-(4-phenylpiperazin-1-ium-1-yl)propanoate Chemical compound C1CN(CCC(=O)O)CCN1C1=CC=CC=C1 JUXGOBSASOVDKO-UHFFFAOYSA-N 0.000 description 6
- BHTCICYNHHCUFK-UHFFFAOYSA-N 3-[4-(2-chlorophenyl)piperazin-1-ium-1-yl]propanoate Chemical compound C1CN(CCC(=O)O)CCN1C1=CC=CC=C1Cl BHTCICYNHHCUFK-UHFFFAOYSA-N 0.000 description 6
- OJEVCLMHRBHIKC-UHFFFAOYSA-N 3-[4-(4-fluorophenyl)piperazin-1-ium-1-yl]propanoate Chemical compound C1CN(CCC(=O)O)CCN1C1=CC=C(F)C=C1 OJEVCLMHRBHIKC-UHFFFAOYSA-N 0.000 description 6
- FPEXVEVOZJTVAG-UHFFFAOYSA-N 3-[4-(4-nitrophenyl)piperazin-1-ium-1-yl]propanoate Chemical compound C1CN(CCC(=O)O)CCN1C1=CC=C([N+]([O-])=O)C=C1 FPEXVEVOZJTVAG-UHFFFAOYSA-N 0.000 description 6
- GDTCVEVTIDTQKL-UHFFFAOYSA-N 3-[4-[3-(trifluoromethyl)phenyl]piperazin-1-yl]propanoic acid Chemical compound C1CN(CCC(=O)O)CCN1C1=CC=CC(C(F)(F)F)=C1 GDTCVEVTIDTQKL-UHFFFAOYSA-N 0.000 description 6
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- 239000003795 chemical substances by application Substances 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- 238000009472 formulation Methods 0.000 description 6
- VJQUTRDUXKPESF-UHFFFAOYSA-N 3-[4-(3-methoxyphenyl)piperazin-1-ium-1-yl]propanoate Chemical compound COC1=CC=CC(N2CCN(CCC(O)=O)CC2)=C1 VJQUTRDUXKPESF-UHFFFAOYSA-N 0.000 description 5
- JHOUSXWICJCPBA-UHFFFAOYSA-N 3-[4-(4-acetylphenyl)piperazin-1-yl]propanoic acid Chemical compound C1=CC(C(=O)C)=CC=C1N1CCN(CCC(O)=O)CC1 JHOUSXWICJCPBA-UHFFFAOYSA-N 0.000 description 5
- 229910052799 carbon Inorganic materials 0.000 description 5
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 5
- 239000004615 ingredient Substances 0.000 description 5
- 239000002502 liposome Substances 0.000 description 5
- 239000003826 tablet Substances 0.000 description 5
- 210000001519 tissue Anatomy 0.000 description 5
- DXXHRZUOTPMGEH-UHFFFAOYSA-N 3-(1,3-dioxoisoindol-2-yl)propanoic acid Chemical compound C1=CC=C2C(=O)N(CCC(=O)O)C(=O)C2=C1 DXXHRZUOTPMGEH-UHFFFAOYSA-N 0.000 description 4
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 4
- 239000002246 antineoplastic agent Substances 0.000 description 4
- 229940041181 antineoplastic drug Drugs 0.000 description 4
- 238000003556 assay Methods 0.000 description 4
- 229940000635 beta-alanine Drugs 0.000 description 4
- 239000006185 dispersion Substances 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- 238000007912 intraperitoneal administration Methods 0.000 description 4
- 239000000693 micelle Substances 0.000 description 4
- FBDOJYYTMIHHDH-OZBJMMHXSA-N (19S)-19-ethyl-19-hydroxy-17-oxa-3,13-diazapentacyclo[11.8.0.02,11.04,9.015,20]henicosa-2,4,6,8,10,14,20-heptaen-18-one Chemical compound CC[C@@]1(O)C(=O)OCC2=CN3Cc4cc5ccccc5nc4C3C=C12 FBDOJYYTMIHHDH-OZBJMMHXSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical group C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- 102000003915 DNA Topoisomerases Human genes 0.000 description 3
- 108090000323 DNA Topoisomerases Proteins 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- 206010015548 Euthanasia Diseases 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 229930012538 Paclitaxel Natural products 0.000 description 3
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 3
- 208000009956 adenocarcinoma Diseases 0.000 description 3
- 150000008064 anhydrides Chemical class 0.000 description 3
- 239000004599 antimicrobial Substances 0.000 description 3
- 239000002585 base Substances 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- 150000001721 carbon Chemical group 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 210000000981 epithelium Anatomy 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 150000004820 halides Chemical class 0.000 description 3
- 238000006460 hydrolysis reaction Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 230000003211 malignant effect Effects 0.000 description 3
- 239000002609 medium Substances 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 229960001592 paclitaxel Drugs 0.000 description 3
- 229910052717 sulfur Inorganic materials 0.000 description 3
- 239000011593 sulfur Substances 0.000 description 3
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 3
- 239000003981 vehicle Substances 0.000 description 3
- KKIMDKMETPPURN-UHFFFAOYSA-N 1-(3-(trifluoromethyl)phenyl)piperazine Chemical compound FC(F)(F)C1=CC=CC(N2CCNCC2)=C1 KKIMDKMETPPURN-UHFFFAOYSA-N 0.000 description 2
- 125000004214 1-pyrrolidinyl group Chemical group [H]C1([H])N(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 2
- DUAWRLXHCUAWMK-UHFFFAOYSA-N 2-iminiopropionate Chemical compound CC(=[NH2+])C([O-])=O DUAWRLXHCUAWMK-UHFFFAOYSA-N 0.000 description 2
- LPDGWMLCUHULJF-UHFFFAOYSA-N 3-piperidin-1-ylpropanoic acid Chemical compound OC(=O)CCN1CCCCC1 LPDGWMLCUHULJF-UHFFFAOYSA-N 0.000 description 2
- ABGXADJDTPFFSZ-UHFFFAOYSA-N 4-benzylpiperidine Chemical compound C=1C=CC=CC=1CC1CCNCC1 ABGXADJDTPFFSZ-UHFFFAOYSA-N 0.000 description 2
- QNAYBMKLOCPYGJ-UHFFFAOYSA-N Alanine Chemical class CC([NH3+])C([O-])=O QNAYBMKLOCPYGJ-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- 229920002261 Corn starch Polymers 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- 239000012981 Hank's balanced salt solution Substances 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 230000000259 anti-tumor effect Effects 0.000 description 2
- 125000003118 aryl group Chemical group 0.000 description 2
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 244000309464 bull Species 0.000 description 2
- 230000005907 cancer growth Effects 0.000 description 2
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 239000008120 corn starch Substances 0.000 description 2
- 229940099112 cornstarch Drugs 0.000 description 2
- 239000002612 dispersion medium Substances 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 235000003599 food sweetener Nutrition 0.000 description 2
- 210000001654 germ layer Anatomy 0.000 description 2
- 230000002140 halogenating effect Effects 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 229940028435 intralipid Drugs 0.000 description 2
- 150000002596 lactones Chemical class 0.000 description 2
- 150000002632 lipids Chemical class 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 239000007937 lozenge Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 201000001441 melanoma Diseases 0.000 description 2
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 125000004433 nitrogen atom Chemical group N* 0.000 description 2
- 239000012454 non-polar solvent Substances 0.000 description 2
- 231100001160 nonlethal Toxicity 0.000 description 2
- 239000003921 oil Substances 0.000 description 2
- 235000019198 oils Nutrition 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- RLOWWWKZYUNIDI-UHFFFAOYSA-N phosphinic chloride Chemical compound ClP=O RLOWWWKZYUNIDI-UHFFFAOYSA-N 0.000 description 2
- 125000000587 piperidin-1-yl group Chemical group [H]C1([H])N(*)C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 2
- 239000002798 polar solvent Substances 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 235000018102 proteins Nutrition 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- 239000000376 reactant Substances 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 229930195734 saturated hydrocarbon Natural products 0.000 description 2
- 159000000000 sodium salts Chemical class 0.000 description 2
- 206010041823 squamous cell carcinoma Diseases 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 239000003765 sweetening agent Substances 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- 230000009466 transformation Effects 0.000 description 2
- 230000004614 tumor growth Effects 0.000 description 2
- 125000003837 (C1-C20) alkyl group Chemical group 0.000 description 1
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 description 1
- BDNKZNFMNDZQMI-UHFFFAOYSA-N 1,3-diisopropylcarbodiimide Chemical compound CC(C)N=C=NC(C)C BDNKZNFMNDZQMI-UHFFFAOYSA-N 0.000 description 1
- KPXVKKBJROCIJB-UHFFFAOYSA-N 1-(4-piperazin-1-ylphenyl)ethanone Chemical compound C1=CC(C(=O)C)=CC=C1N1CCNCC1 KPXVKKBJROCIJB-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- HAWSQZCWOQZXHI-FQEVSTJZSA-N 10-Hydroxycamptothecin Chemical compound C1=C(O)C=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 HAWSQZCWOQZXHI-FQEVSTJZSA-N 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- OZWUITKBAWTEAQ-UHFFFAOYSA-N 2-(1,3-dioxoisoindol-2-yl)propanoic acid Chemical compound C1=CC=C2C(=O)N(C(C)C(O)=O)C(=O)C2=C1 OZWUITKBAWTEAQ-UHFFFAOYSA-N 0.000 description 1
- XVUFGANHYPKKGB-UHFFFAOYSA-N 2-carbamoyliminoacetic acid Chemical compound NC(=O)N=CC(O)=O XVUFGANHYPKKGB-UHFFFAOYSA-N 0.000 description 1
- 125000002941 2-furyl group Chemical group O1C([*])=C([H])C([H])=C1[H] 0.000 description 1
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 125000004485 2-pyrrolidinyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])([H])C1([H])* 0.000 description 1
- 125000000389 2-pyrrolyl group Chemical group [H]N1C([*])=C([H])C([H])=C1[H] 0.000 description 1
- 125000000175 2-thienyl group Chemical group S1C([*])=C([H])C([H])=C1[H] 0.000 description 1
- 125000001698 2H-pyranyl group Chemical group O1C(C=CC=C1)* 0.000 description 1
- WAZSVCKLDOMJJX-UHFFFAOYSA-N 2h-pyrrolo[3,4-b]quinoline Chemical compound C1=CC=CC2=CC3=CNC=C3N=C21 WAZSVCKLDOMJJX-UHFFFAOYSA-N 0.000 description 1
- ZLUPHLAHUCATCA-UHFFFAOYSA-N 3-(3,4-dihydro-2h-pyrrol-5-yl)propanoic acid Chemical compound OC(=O)CCC1=NCCC1 ZLUPHLAHUCATCA-UHFFFAOYSA-N 0.000 description 1
- OJQZRZXMTDCLRM-UHFFFAOYSA-N 3-(4-cyano-4-phenylpiperidin-1-yl)propanoic acid Chemical compound C1CN(CCC(=O)O)CCC1(C#N)C1=CC=CC=C1 OJQZRZXMTDCLRM-UHFFFAOYSA-N 0.000 description 1
- YTWPPUYGIHSOJR-UHFFFAOYSA-N 3-(4-cyclohexylpiperazin-1-ium-1-yl)propanoate Chemical compound C1CN(CCC(=O)O)CCN1C1CCCCC1 YTWPPUYGIHSOJR-UHFFFAOYSA-N 0.000 description 1
- IIFIFJPUSDQJBR-UHFFFAOYSA-N 3-(4-ethylpiperazin-1-ium-1-yl)propanoate Chemical compound CCN1CCN(CCC(O)=O)CC1 IIFIFJPUSDQJBR-UHFFFAOYSA-N 0.000 description 1
- KYYVIALAPRVLCB-UHFFFAOYSA-N 3-(4-formylpiperazin-1-yl)propanoic acid Chemical compound OC(=O)CCN1CCN(C=O)CC1 KYYVIALAPRVLCB-UHFFFAOYSA-N 0.000 description 1
- YITKIMIVXHDPLW-UHFFFAOYSA-N 3-(4-pyrimidin-2-ylpiperazin-1-ium-1-yl)propanoate Chemical compound C1CN(CCC(=O)O)CCN1C1=NC=CC=N1 YITKIMIVXHDPLW-UHFFFAOYSA-N 0.000 description 1
- YQLXMZWDPOTWEC-UHFFFAOYSA-N 3-[2-[[4-(4-chlorophenyl)phenyl]methyl]piperazin-1-yl]propanoic acid Chemical compound OC(=O)CCN1CCNCC1CC1=CC=C(C=2C=CC(Cl)=CC=2)C=C1 YQLXMZWDPOTWEC-UHFFFAOYSA-N 0.000 description 1
- UFHSPKWAKVYQLP-UHFFFAOYSA-N 3-[4-(1,3-benzodioxol-5-yl)piperazin-1-yl]propanoic acid Chemical compound C1CN(CCC(=O)O)CCN1C1=CC=C(OCO2)C2=C1 UFHSPKWAKVYQLP-UHFFFAOYSA-N 0.000 description 1
- OAKAIJCQHPHQFV-UHFFFAOYSA-N 3-[4-(2,3-dimethylphenyl)piperazin-1-ium-1-yl]propanoate Chemical compound CC1=CC=CC(N2CCN(CCC(O)=O)CC2)=C1C OAKAIJCQHPHQFV-UHFFFAOYSA-N 0.000 description 1
- OSKJPAKEWVJCNA-UHFFFAOYSA-N 3-[4-(2-methylphenyl)piperazin-1-yl]propanoic acid Chemical compound CC1=CC=CC=C1N1CCN(CCC(O)=O)CC1 OSKJPAKEWVJCNA-UHFFFAOYSA-N 0.000 description 1
- NIYLVQSMGFJCMP-UHFFFAOYSA-N 3-[4-(3,4-dichlorophenyl)piperazin-1-yl]propanoic acid Chemical compound C1CN(CCC(=O)O)CCN1C1=CC=C(Cl)C(Cl)=C1 NIYLVQSMGFJCMP-UHFFFAOYSA-N 0.000 description 1
- DRUXIRJSPAZGFS-UHFFFAOYSA-N 3-[4-(4-chlorophenyl)piperidin-1-yl]propanoic acid Chemical compound C1CN(CCC(=O)O)CCC1C1=CC=C(Cl)C=C1 DRUXIRJSPAZGFS-UHFFFAOYSA-N 0.000 description 1
- DYWWDZQRZYAPHQ-UHFFFAOYSA-N 3-benzoyl-4-ethyl-4-methyl-2-phenyl-1,3-oxazolidin-5-one Chemical compound O1C(=O)C(CC)(C)N(C(=O)C=2C=CC=CC=2)C1C1=CC=CC=C1 DYWWDZQRZYAPHQ-UHFFFAOYSA-N 0.000 description 1
- 125000003682 3-furyl group Chemical group O1C([H])=C([*])C([H])=C1[H] 0.000 description 1
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 description 1
- 125000004575 3-pyrrolidinyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001397 3-pyrrolyl group Chemical group [H]N1C([H])=C([*])C([H])=C1[H] 0.000 description 1
- 125000001541 3-thienyl group Chemical group S1C([H])=C([*])C([H])=C1[H] 0.000 description 1
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 1
- KAGUYBPATATYOM-UHFFFAOYSA-N 4-[4-[3-(trifluoromethyl)phenyl]piperazin-1-yl]butanoic acid Chemical compound C1CN(CCCC(=O)O)CCN1C1=CC=CC(C(F)(F)F)=C1 KAGUYBPATATYOM-UHFFFAOYSA-N 0.000 description 1
- DTUOTSLAFJCQHN-UHFFFAOYSA-N 4-bromo-1,8-naphthalic anhydride Chemical compound O=C1OC(=O)C2=CC=CC3=C2C1=CC=C3Br DTUOTSLAFJCQHN-UHFFFAOYSA-N 0.000 description 1
- LKOZHLXUWUBRDK-UHFFFAOYSA-N 4-nitro-1,8-naphthalic anhydride Chemical compound O=C1OC(=O)C2=CC=CC3=C2C1=CC=C3[N+](=O)[O-] LKOZHLXUWUBRDK-UHFFFAOYSA-N 0.000 description 1
- 125000000339 4-pyridyl group Chemical group N1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 1
- 125000004487 4-tetrahydropyranyl group Chemical group [H]C1([H])OC([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001826 4H-pyranyl group Chemical group O1C(=CCC=C1)* 0.000 description 1
- 125000002373 5 membered heterocyclic group Chemical group 0.000 description 1
- LZJBNPBAFYYDIK-UHFFFAOYSA-N 5-[4-[3-(trifluoromethyl)phenyl]piperazin-1-yl]pentanoic acid Chemical compound C1CN(CCCCC(=O)O)CCN1C1=CC=CC(C(F)(F)F)=C1 LZJBNPBAFYYDIK-UHFFFAOYSA-N 0.000 description 1
- 125000004070 6 membered heterocyclic group Chemical group 0.000 description 1
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 201000003076 Angiosarcoma Diseases 0.000 description 1
- 241000208838 Asteraceae Species 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- 206010006417 Bronchial carcinoma Diseases 0.000 description 1
- HAWSQZCWOQZXHI-UHFFFAOYSA-N CPT-OH Natural products C1=C(O)C=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 HAWSQZCWOQZXHI-UHFFFAOYSA-N 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 208000005243 Chondrosarcoma Diseases 0.000 description 1
- 208000006332 Choriocarcinoma Diseases 0.000 description 1
- 230000007018 DNA scission Effects 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- 208000030453 Drug-Related Side Effects and Adverse reaction Diseases 0.000 description 1
- 244000286838 Eclipta prostrata Species 0.000 description 1
- 201000008808 Fibrosarcoma Diseases 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 208000012766 Growth delay Diseases 0.000 description 1
- 208000001258 Hemangiosarcoma Diseases 0.000 description 1
- OWYWGLHRNBIFJP-UHFFFAOYSA-N Ipazine Chemical compound CCN(CC)C1=NC(Cl)=NC(NC(C)C)=N1 OWYWGLHRNBIFJP-UHFFFAOYSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 208000018142 Leiomyosarcoma Diseases 0.000 description 1
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 1
- 240000007472 Leucaena leucocephala Species 0.000 description 1
- 208000007093 Leukemia L1210 Diseases 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 description 1
- 208000007369 Malignant Mixed Tumor Diseases 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 244000246386 Mentha pulegium Species 0.000 description 1
- 235000016257 Mentha pulegium Nutrition 0.000 description 1
- 235000004357 Mentha x piperita Nutrition 0.000 description 1
- 206010027406 Mesothelioma Diseases 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 208000006265 Renal cell carcinoma Diseases 0.000 description 1
- 206010039491 Sarcoma Diseases 0.000 description 1
- 201000010208 Seminoma Diseases 0.000 description 1
- 229920001800 Shellac Polymers 0.000 description 1
- 208000009574 Skin Appendage Carcinoma Diseases 0.000 description 1
- 206010043276 Teratoma Diseases 0.000 description 1
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 1
- 101710183280 Topoisomerase Proteins 0.000 description 1
- 206010070863 Toxicity to various agents Diseases 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 238000005411 Van der Waals force Methods 0.000 description 1
- 208000008383 Wilms tumor Diseases 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 125000000738 acetamido group Chemical group [H]C([H])([H])C(=O)N([H])[*] 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 230000007059 acute toxicity Effects 0.000 description 1
- 231100000403 acute toxicity Toxicity 0.000 description 1
- 208000036676 acute undifferentiated leukemia Diseases 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 150000001294 alanine derivatives Chemical class 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000008044 alkali metal hydroxides Chemical class 0.000 description 1
- 229930013930 alkaloid Natural products 0.000 description 1
- 150000003797 alkaloid derivatives Chemical class 0.000 description 1
- 125000005907 alkyl ester group Chemical group 0.000 description 1
- 150000001350 alkyl halides Chemical class 0.000 description 1
- 125000004202 aminomethyl group Chemical group [H]N([H])C([H])([H])* 0.000 description 1
- 230000002547 anomalous effect Effects 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- XJHABGPPCLHLLV-UHFFFAOYSA-N benzo[de]isoquinoline-1,3-dione Chemical compound C1=CC(C(=O)NC2=O)=C3C2=CC=CC3=C1 XJHABGPPCLHLLV-UHFFFAOYSA-N 0.000 description 1
- 235000013361 beverage Nutrition 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 210000000601 blood cell Anatomy 0.000 description 1
- 239000012503 blood component Substances 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- 208000003362 bronchogenic carcinoma Diseases 0.000 description 1
- 239000006189 buccal tablet Substances 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 239000003560 cancer drug Substances 0.000 description 1
- 239000007894 caplet Substances 0.000 description 1
- 125000002837 carbocyclic group Chemical group 0.000 description 1
- 150000007942 carboxylates Chemical class 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical class N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 230000009918 complex formation Effects 0.000 description 1
- 210000002808 connective tissue Anatomy 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 208000002445 cystadenocarcinoma Diseases 0.000 description 1
- 201000003146 cystitis Diseases 0.000 description 1
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 1
- 229960000975 daunorubicin Drugs 0.000 description 1
- 239000003405 delayed action preparation Substances 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- BGRWYRAHAFMIBJ-UHFFFAOYSA-N diisopropylcarbodiimide Natural products CC(C)NC(=O)NC(C)C BGRWYRAHAFMIBJ-UHFFFAOYSA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 125000000118 dimethyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 230000008034 disappearance Effects 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 230000002500 effect on skin Effects 0.000 description 1
- 125000006575 electron-withdrawing group Chemical group 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 210000003038 endothelium Anatomy 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- LIOVOGRQHDNEKX-UHFFFAOYSA-N ethyl 3-(4-benzylpiperazin-1-yl)propanoate Chemical compound C1CN(CCC(=O)OCC)CCN1CC1=CC=CC=C1 LIOVOGRQHDNEKX-UHFFFAOYSA-N 0.000 description 1
- HETBVARBVHYHHU-UHFFFAOYSA-N ethyl 3-(4-phenylpiperazin-1-yl)propanoate Chemical compound C1CN(CCC(=O)OCC)CCN1C1=CC=CC=C1 HETBVARBVHYHHU-UHFFFAOYSA-N 0.000 description 1
- JEOJUJQXHQVBRL-UHFFFAOYSA-N ethyl 3-[4-(2-chlorophenyl)piperazin-1-yl]propanoate Chemical compound C1CN(CCC(=O)OCC)CCN1C1=CC=CC=C1Cl JEOJUJQXHQVBRL-UHFFFAOYSA-N 0.000 description 1
- ZCWMMTIWADXVCT-UHFFFAOYSA-N ethyl 3-[4-(4-acetylphenyl)piperazin-1-yl]propanoate Chemical compound C1CN(CCC(=O)OCC)CCN1C1=CC=C(C(C)=O)C=C1 ZCWMMTIWADXVCT-UHFFFAOYSA-N 0.000 description 1
- KSDBXTOBCRVZTI-UHFFFAOYSA-N ethyl 3-[4-(4-fluorophenyl)piperazin-1-yl]propanoate Chemical compound C1CN(CCC(=O)OCC)CCN1C1=CC=C(F)C=C1 KSDBXTOBCRVZTI-UHFFFAOYSA-N 0.000 description 1
- OUGAANKZPLWQBW-UHFFFAOYSA-N ethyl 3-[4-(4-nitrophenyl)piperazin-1-yl]propanoate Chemical compound C1CN(CCC(=O)OCC)CCN1C1=CC=C([N+]([O-])=O)C=C1 OUGAANKZPLWQBW-UHFFFAOYSA-N 0.000 description 1
- MQOORNWHRVMLAW-UHFFFAOYSA-N ethyl 3-[4-[3-(trifluoromethyl)phenyl]piperazin-1-yl]propanoate Chemical compound C1CN(CCC(=O)OCC)CCN1C1=CC=CC(C(F)(F)F)=C1 MQOORNWHRVMLAW-UHFFFAOYSA-N 0.000 description 1
- KZTNQOAFISZIEI-UHFFFAOYSA-N ethyl 3-iodopropanoate Chemical compound CCOC(=O)CCI KZTNQOAFISZIEI-UHFFFAOYSA-N 0.000 description 1
- 125000000031 ethylamino group Chemical group [H]C([H])([H])C([H])([H])N([H])[*] 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 239000012737 fresh medium Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 210000004602 germ cell Anatomy 0.000 description 1
- 210000004907 gland Anatomy 0.000 description 1
- 210000002149 gonad Anatomy 0.000 description 1
- 239000007902 hard capsule Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 235000001050 hortel pimenta Nutrition 0.000 description 1
- 150000002430 hydrocarbons Chemical group 0.000 description 1
- 150000003840 hydrochlorides Chemical class 0.000 description 1
- 150000002483 hydrogen compounds Chemical class 0.000 description 1
- MSQACBWWAIBWIC-UHFFFAOYSA-N hydron;piperazine;chloride Chemical compound Cl.C1CNCCN1 MSQACBWWAIBWIC-UHFFFAOYSA-N 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 208000023525 immature teratoma Diseases 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000000099 in vitro assay Methods 0.000 description 1
- 238000005462 in vivo assay Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 231100000636 lethal dose Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 206010024627 liposarcoma Diseases 0.000 description 1
- 210000005229 liver cell Anatomy 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 210000001365 lymphatic vessel Anatomy 0.000 description 1
- 210000003563 lymphoid tissue Anatomy 0.000 description 1
- 208000025036 lymphosarcoma Diseases 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 208000021810 malignant mixed neoplasm Diseases 0.000 description 1
- 201000000289 malignant teratoma Diseases 0.000 description 1
- 235000012054 meals Nutrition 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 201000008806 mesenchymal cell neoplasm Diseases 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- OSWPMRLSEDHDFF-UHFFFAOYSA-N methyl salicylate Chemical compound COC(=O)C1=CC=CC=C1O OSWPMRLSEDHDFF-UHFFFAOYSA-N 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 201000010225 mixed cell type cancer Diseases 0.000 description 1
- 208000029638 mixed neoplasm Diseases 0.000 description 1
- 125000005322 morpholin-1-yl group Chemical group 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 201000008026 nephroblastoma Diseases 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 230000002611 ovarian Effects 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000001820 oxy group Chemical group [*:1]O[*:2] 0.000 description 1
- 238000002559 palpation Methods 0.000 description 1
- 201000010198 papillary carcinoma Diseases 0.000 description 1
- 210000004738 parenchymal cell Anatomy 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- XKJCHHZQLQNZHY-UHFFFAOYSA-N phthalimide Chemical compound C1=CC=C2C(=O)NC(=O)C2=C1 XKJCHHZQLQNZHY-UHFFFAOYSA-N 0.000 description 1
- 231100000208 phytotoxic Toxicity 0.000 description 1
- 230000000885 phytotoxic effect Effects 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000004483 piperidin-3-yl group Chemical group N1CC(CCC1)* 0.000 description 1
- 125000004482 piperidin-4-yl group Chemical group N1CCC(CC1)* 0.000 description 1
- 230000003169 placental effect Effects 0.000 description 1
- 239000003495 polar organic solvent Substances 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 125000004307 pyrazin-2-yl group Chemical group [H]C1=C([H])N=C(*)C([H])=N1 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000002206 pyridazin-3-yl group Chemical group [H]C1=C([H])C([H])=C(*)N=N1 0.000 description 1
- 125000004940 pyridazin-4-yl group Chemical group N1=NC=C(C=C1)* 0.000 description 1
- UBQKCCHYAOITMY-UHFFFAOYSA-N pyridin-2-ol Chemical group OC1=CC=CC=N1 UBQKCCHYAOITMY-UHFFFAOYSA-N 0.000 description 1
- 125000000246 pyrimidin-2-yl group Chemical group [H]C1=NC(*)=NC([H])=C1[H] 0.000 description 1
- 125000004527 pyrimidin-4-yl group Chemical group N1=CN=C(C=C1)* 0.000 description 1
- 125000004528 pyrimidin-5-yl group Chemical group N1=CN=CC(=C1)* 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 210000003079 salivary gland Anatomy 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 231100000004 severe toxicity Toxicity 0.000 description 1
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 1
- 239000004208 shellac Substances 0.000 description 1
- 229940113147 shellac Drugs 0.000 description 1
- 235000013874 shellac Nutrition 0.000 description 1
- 201000008261 skin carcinoma Diseases 0.000 description 1
- 210000002460 smooth muscle Anatomy 0.000 description 1
- 239000007901 soft capsule Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 230000000707 stereoselective effect Effects 0.000 description 1
- 239000008174 sterile solution Substances 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 239000011550 stock solution Substances 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 210000002536 stromal cell Anatomy 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 210000001258 synovial membrane Anatomy 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000002381 testicular Effects 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 231100000820 toxicity test Toxicity 0.000 description 1
- 231100000041 toxicology testing Toxicity 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 206010044412 transitional cell carcinoma Diseases 0.000 description 1
- 210000002993 trophoblast Anatomy 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 210000003741 urothelium Anatomy 0.000 description 1
- 238000001291 vacuum drying Methods 0.000 description 1
- 238000009777 vacuum freeze-drying Methods 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 230000004580 weight loss Effects 0.000 description 1
- 239000009637 wintergreen oil Substances 0.000 description 1
- 239000002023 wood Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/22—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains four or more hetero rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/08—Drugs for disorders of the urinary system of the prostate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
Landscapes
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Urology & Nephrology (AREA)
- Oncology (AREA)
- Dermatology (AREA)
- Hematology (AREA)
- Endocrinology (AREA)
- Reproductive Health (AREA)
- Pulmonology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
Abstract
本申请提供了喜树碱类似物的(20S)酯类。这些化合物是氨基链烷酸或亚氨基链烷酸与喜树碱的(20S)酯,它任选在喜树碱环的7、9、10、11和12位上取代。这些化合物可用于治疗癌症。
Description
引言
发明领域
本发明涉及可用于治疗各种癌症的新型喜树碱衍生物。
发明背景
喜树碱(经常缩写为“CPT”),一种具有植物毒性的生物碱,首先由Wall和同事于1966年从旱莲木(紫树科)的木材和树皮中分离出来,显示具有抗鼠白血病L1210体系的抗肿瘤活性。该化合物是在环E具有20S构型的具有不对称中心的五核环体系。该五核环体系包括吡咯并[3,4-b]喹啉(环A、B和C)、一共轭吡啶酮环D)、和具有20_-羟基的六元内酯(环E)。喜树碱本身基本上不溶于水。因此,早期在临床上以水溶性羧酸钠盐评价喜树碱。显然,该羧酸盐事实上是E环打开形成钠盐的化合物。该钠盐产生严重的毒性并且具有非常小的抗癌活性。因此早期对喜树碱的工作在开始第II阶段试验之后就终止了。然而,当发现它抑制拓扑异构酶(一种在分子事件如复制和转录期间DNA旋转和松弛所需的酶)时又恢复了对该化合物的兴趣。在文献中已报道了大量该分子的合成和改性,并且在几年内已制备了新的衍生物。例如,托泊替堪(9-二甲基氨基甲基-10-羟基CPT)和药薯(7-乙基-10[4-(1-哌啶基)-1-哌啶基]羰基氧基CPT)显示出临床有用的活性。本发明定义了一系列新的可用于治疗各种癌症的20S酯。这些新型化合物具有比CPT和其它CPT衍生物高的效力和低的毒性。
发明概述
本发明的一个方面是下式(I)的化合物,
其中R是RaRbN(CH2)m,m是1-10的整数(优选2),并且Ra和Rb各自独立地是
取代有1-5个取代基的低级烷基,所述1-5个取代基独立地选自卤素、低级烷氧基、羟基、氰基、硝基或氨基;
任选取代有1-5个取代基的苯基,所述1-5个取代基独立地选自卤素、低级烷基、低级烷氧基、羟基、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、甲酰基、低级烷基羰基、羟基羰基、低级烷基羰基氧基、苄氧基、任选取代的哌啶基、低级烷氧基羰基和低级烷基羰基氨基;
3-7个碳原子的环烷基,任选取代有1-5个独立地选自以下的取代基:卤素、低级烷基、低级烷氧基、羟基、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、羟基羰基、低级烷氧基羰基、低级烷基羰基氧基和低级烷基羰基氨基;
低级烷氧基;或
RaRb与N一起形成一环状胺或亚氨基环;
R2是氢、卤素、低级烷基、低级烷氧基、羟基、RC(O)O(R定义如本文前面的)、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、羟基羰基、-C(O)H、低级烷氧基羰基、三低级烷基甲硅烷基、低级烷基羰基氧基、低级烷基羰基氨基、低级烷基羰基氧基甲基、取代的乙烯基、1-羟基-2-硝基乙基、烷氧基羰基乙基、氨基羰基、烷基羰基、烷基羰基甲基、苄氧基甲基、苄基羰基氧基甲基或一-或二低级烷氧基甲基;
R3是氢、卤素、低级烷基、低级烷氧基、羟基、RC(O)O(R定义如本文前面的)、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、羟基羰基、低级烷氧基羰基、CH2NR7R8(其中R7和R8各自独立地是H-、1-6个碳原子的烷基、任选取代的苯基、羟基低级烷基、氨基低级烷基或一-或二烷基氨基低级烷基或者R7和R8与-N-一起代表一环状氨基-)、-C(O)H、CH2R9(其中R9是低级烷氧基、CN、氨基低级烷氧基、一-或二-低级烷基氨基低级烷氧基、低级烷硫基、氨基低级烷硫基或一-或二-低级烷基氨基低级烷硫基)或NR10R11(其中R10和R11各自独立地是氢、低级烷基、苯基、羟基低级烷基、氨基低级烷基或一-或二-低级烷基或者R10和R11与-N-一起代表一环状氨基)、二烷基氨基烷基、低级烷基羰基氧基或低级烷基羰基氨基;和
R4是氢、卤素、低级烷基、低级烷氧基、羟基、RC(O)O(R定义如本文前面的)、氰基、硝基、氨基、氨基低级烷基、卤代低级烷基、卤代低级烷氧基、羟基羰基、低级烷氧基羰基、氨基甲酰基氧基、低级烷基羰基氧基或低级烷基羰基氨基或者R4与R3一起是亚甲基二氧基;
R5是氢、卤素、低级烷基、低级烷氧基、羟基、RC(O)O(R定义如本文前面的)、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、羟基羰基、低级烷氧基羰基、低级烷基羰基氧基或低级烷基羰基氨基;和
R6是氢、卤素、低级烷基、低级烷氧基、羟基、RC(O)O(R定义如本文前面的)、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、羟基羰基、低级烷氧基羰基、低级烷基羰基氧基或低级烷基羰基氨基。
本发明的另一方面是一种可用于治疗温血动物的癌症的药物组合物,该组合物包括本文定义的本发明化合物和药用可接受的赋形剂。
本发明的另一方面是一种治疗温血动物的癌症的方法,该方法包括给予治疗有效量的本文定义的本发明化合物。该化合物通过适当给药,例如经口、局部或非肠道以治疗有效剂量给予。
本发明的另一方面是本发明化合物的制备方法,将喜树碱(CPT)或CPT类似物与式R-C(O)X的化合物反应,其中R是RaRbN(CH2)2,其中Ra和Rb如本文定义的,并且X是例如溴根、氯根、羟基、1-11个碳原子的烷氧基。
通过阅读接下来的说明书,本发明的其它方面对本领域技术人员将是显而易见的。
详述
概述
一般说来,本发明可以认为是CPT或CPT类似物的(20S)酯。正如本文前面所述的,CPT是在第20位具有一个羟基的(S)立体异构体。根据本发明的方法以立体专一转化且高产率地将该羟基酯化形成相应的(20S)酯。由于链中具有带负电个体,因此所得酯是唯一的,据信这有助于稳定喜树碱分子中的E环。本发明的新型化合物在小鼠中具有抗肿瘤活性并且通常能很好地耐受。它们可用于治疗各种类型的癌症,并且可以配制成药用制剂,例如经口、局部或非肠道给药。
尽管不希望受任何特定作用机理或这些化合物如何工作的理论解释所限制,但是据信这些20S酯部分通过稳定CPT分子的该E环产生其效果。这些酯可以通过以下实现这一点:通过位阻防止酶进入该E环、通过该酯链中存在的吸电子基团,即氮原子、和通过CPT分子的E环末端与该酶的氢键或范德华力抑制结合并由此抑制酶活性作用该E环。
定义
术语“CPT”是喜树碱的简称,还称作(S)-4-乙基-4-羟基-1H-吡喃并-[3’,4’:6,7]吲嗪醇[1,2-b]喹啉-3,14(4H,12H)-二酮。该化合物易于从许多源,例如Sigma Chemical Co.,St.Louis,Mo获得。喜树碱的化学式及其编号系统如下:
该化合物在第20位有一羟基,将其酯化制得本发明的化合物。
术语“烷基”是指具有指示碳原子数的一价饱和烃基。例如,“C1-6烷基”或“1-6个碳原子的烷基”或“Alk1-6”将是指在结构中含有1-6个碳原子的烷基。“C1-20烷基”是指具有1-20个碳原子的任何烷基。烷基可以是直链(即线性的)或支链。低级烷基是指1-6个碳原子的烷基。低级烷基的代表性实例包括甲基、乙基、正丙基、正丁基、正戊基、正己基、异丙基、异丁基、异戊基、戊基、仲丁基、叔丁基、叔戊基等。高级烷基是指7个或更多碳原子的烷基。这些包括正庚基、正辛基、正壬基、正癸基、正十二烷基、正十四烷基、正十六烷基、正十八烷基、正二十烷基等,及其支化变体。这些自由基可以任选在不显著干扰落入本发明范围的化合物的制备并且不显著降低这些化合物的功效的位置取代有取代基。烷基可以任选取代有1-5个取代基,这些取代基独立地选自卤素、低级烷氧基、羟基、氰基、硝基或氨基。
术语“烷氧基”是指式RO-的一价自由基,其中R是如本文定义的烷基。低级烷氧基是指1-6个碳原子的烷氧基,其中高级烷氧基是7个或更多碳原子的烷氧基。代表性的低级烷氧基包括甲氧基、甲氧基、乙氧基、正丙氧基、正丁氧基、正戊氧基、正己氧基、异丙氧基、异丁氧基、异戊氧基、戊氧基、仲丁氧基、叔丁氧基、叔戊氧基等。高级烷氧基包括相应于本文所述的高级烷基的那些。该自由基可以任选在不显著干扰落入本发明范围的化合物的制备并且不显著降低这些化合物的功效的位置取代有取代基。该自由基可以任选取代有1-5个取代基,这些取代基独立地选自卤素、低级烷基、低级烷氧基、羟基、氰基、硝基或氨基。
术语“环烷基”是指具有3个或更多成环碳原子的一价、脂环族、饱和烃基。尽管已知的环烷基化合物可以具有高达30个或更多碳原子,通常在环中有3-7个碳原子。后者例如包括环丙基、环丁基、环戊基、环己基和环庚基。该自由基可以任选在不显著干扰落入本发明范围的化合物的制备并且不显著降低这些化合物的功效的位置取代有取代基。该环烷基任选取代有1-5个取代基,这些取代基独立地选自卤素、低级烷基、低级烷氧基、羟基、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、羟基羰基、低级烷氧基羰基、低级烷基羰基氧基和低级烷基羰基氨基。
术语“羟基羰基”是具有式-C(O)OH的一价自由基。
术语“低级烷氧基羰基”是具有式-C(O)OAlk的一价自由基,其中Alk是低级烷基。
术语“低级烷基羰基氧基”是具有式-OC(O)Alk的一价自由基,其中Alk是低级烷基。
术语“低级烷基羰基氨基”是具有式-NHC(O)Alk的一价自由基,其中Alk是低级烷基。
“卤素”取代基是选自氯、溴、碘和氟的一价卤素自由基。“卤代化合物”是取代有1个或多个卤素取代基的那些。
“苯基”是通过从苯环除去一个氢原子形成的自由基。该苯基任选取代有1-5个取代基,这些取代基独立地选自卤素、低级烷基、低级烷氧基、羟基、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、羰基、羟基羰基、低级烷基羰基氧基、苄氧基、任选取代的哌啶基、低级烷氧基羰基和低级烷基羰基氨基。
氨基甲酰基氧基”是式R13R14NC(O)O-的一价自由基(即氨基羰基氧基),其中R13和R14一起与氮原子形成环氨基,或者R13和R14各自独立地是氢、低级烷基、羟基低级烷基、羟基低级烷基、氨基低级烷基、低级环烷基、苯基(取代或未取代的)或苄基(取代或未取代的)。实例包括氨基羰基氧基、甲基氨基羰基氧基、二甲基氨基羰基氧基、[4-(1-哌啶基)-1-哌啶基]羰基氧基、1-吗啉基羰基氧基、1-吡咯烷基、1-哌嗪羰基氧基和本文描述的其它的。
“5-元杂环”是含有碳和至少一个其它元素(通常是氮、氧或硫)并且可以完全饱和、部分饱和或不饱和(即性质上为芳族)的5-元闭环的一价自由基。通常该杂环将含有不超过2个杂原子。仅有一个杂原子的不饱和5-元杂环的代表性实例包括2-或3-吡咯基、2-或3-呋喃基和2-或3-噻吩基。相应的部分饱和或完全饱和的自由基包括3-吡咯啉-2-基、2-或3-吡咯烷基、2-或3-四氢呋喃基和2-或3-四氢噻吩基。代表性的具有2个杂原子的不饱和5-元杂环自由基包括咪唑基、噁唑基、噻唑基、吡唑基等。也包括相应的完全饱和和部分饱和的自由基。该杂环自由基通过杂环中可以利用的碳原子相连。该自由基可以任选在不显著干扰落入本发明范围的化合物的制备并且不显著降低这些化合物的功效的位置取代有取代基。该环任选取代有1或2个取代基,这些取代基选自卤素、低级烷基、低级烷氧基、羟基、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、羟基羰基、低级烷氧基羰基、低级烷基羰基氧基和低级烷基羰基氨基。
“6-元杂环”是含有碳和至少一个其它元素(通常是氮、氧或硫)并且可以完全饱和、部分饱和或不饱和(即性质上为芳族)的6-元闭环的一价自由基。通常该杂环将含有不超过2个杂原子。仅有一个杂原子的不饱和6-元杂环的代表性实例包括2-、3-或4-吡啶基、2H-吡喃基和4H-吡喃基。相应的部分饱和或完全饱和的自由基包括2-、3-或4-哌啶基、2-、3-或4-四氢吡喃基等。代表性的具有2个杂原子的不饱和6-元杂环包括3-或4-哒嗪基、2-、4-或5-嘧啶基、2-吡嗪基等。也包括相应的完全饱和和部分饱和的自由基,例如2-哌嗪。该杂环自由基通过杂环中可以利用的碳原子相连。该自由基可以任选在不显著干扰落入本发明范围的化合物的制备并且不显著降低这些化合物的功效的位置取代有取代基。该环任选取代有1或2个取代基,这些取代基选自卤素、低级烷基、低级烷氧基、羟基、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、羟基羰基、低级烷氧基羰基、低级烷基羰基氧基和低级烷基羰基氨基。
“环氨基”是具有不多于1个其它杂原子(如氮、氧或硫)的饱和5-、6-或7-元环胺环的一价自由基或者与另一个碳环或几个碳环稠合的5-、6-或7-元环胺的一价自由基。代表性实例包括例如1-吡咯烷基、1-哌啶基、吗啉基、哌嗪基、3-苯并哌啶基等。它们可以经过取代或未经过取代。如果经过取代,通常它们具有不多于2个选自以下的取代基:低级烷基、低级环烷基、羟基低级烷基、苯基(取代或未取代的)、苄基(取代或未取代的)、氨基羰基甲基、低级烷基氨基羰基甲基、氨基、一-或二-低级烷基氨基、环氨基或5-或6-元杂环。
“亚氨基环”是环酰亚胺,其中环状结构的氮在每一侧与羰基相连,这样依次与碳原子相连形成一环。亚氨基环将包括例如邻苯二甲酰亚胺(它可以在苯环上被取代)、马来酰亚胺、1,8-萘二甲酰亚胺(可以在萘环上取代,例如3-硝基-1,8-萘二甲酰亚胺、4-硝基萘二甲酰亚胺、4-溴-萘二甲酰亚胺等)。其它对本领域技术人员将是显而易见的。
其它化学术语是本领域技术人员借助标准教科书和词典所理解的标准含义给出的。
术语“MTD”是最大允许剂量的缩写。
术语“nM”是纳摩尔的缩写。
术语“ip”是腹膜内的缩写。
本发明的化合物
本发明的一个方面是下式的化合物
其中R是RaRbN-(CH2)m,m是1-10的整数(优选2),并且Ra和Rb各自独立地是
取代有1-5个取代基的低级烷基,所述1-5个取代基独立地选自卤素、低级烷氧基、羟基、氰基、硝基或氨基;
任选取代有1-5个取代基的苯基,所述1-5个取代基独立地选自卤素、低级烷基、低级烷氧基、羟基、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、甲酰基、低级烷基羰基、羟基羰基、低级烷基羰基氧基、苄氧基、任选取代的哌啶基、低级烷氧基羰基和低级烷基羰基氨基;
3-7个碳原子的环烷基,任选取代有1-5个独立地选自以下的取代基:卤素、低级烷基、低级烷氧基、羟基、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、羟基羰基、低级烷氧基羰基、低级烷基羰基氧基和低级烷基羰基氨基;
低级烷氧基;或
RaRb与N一起形成环状胺或亚氨基环;
R2是氢、卤素、低级烷基、低级烷氧基、羟基、RC(O)O(R定义如本文前面的)、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、羟基羰基、-C(O)H、低级烷氧基羰基、三低级烷基甲硅烷基、低级烷基羰基氧基、低级烷基羰基氨基、低级烷基羰基氧基甲基、取代的乙烯基、1-羟基-2-硝基乙基、烷氧基羰基乙基、氨基羰基、烷基羰基、烷基羰基氧基甲基、苄氧基甲基、苄基羰基氧基甲基或一-或二低级烷氧基甲基;
R3是氢、卤素、低级烷基、低级烷氧基、羟基、RC(O)O(R定义如本文前面的)、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、羟基羰基、低级烷氧基羰基、CH2NR7R8(其中R7和R8各自独立地是H-、1-6个碳原子的烷基、任选取代的苯基、羟基低级烷基、氨基低级烷基或一-或二烷基氨基低级烷基或者R7和R8与-N-在一起代表环氨基-)、-C(O)H、CH2R9(其中R9是低级烷氧基、CN、氨基低级烷氧基、一-或二-低级烷基氨基低级烷氧基、低级烷硫基、氨基低级烷硫基或一-或二-低级烷基氨基低级烷硫基)或NR10R11(其中R10和R11各自独立地是氢、低级烷基、苯基、羟基低级烷基、氨基低级烷基或一-或二-低级烷基或者R10和R11与-N-在一起代表环氨基)、二烷基氨基烷基、低级烷基羰基氧基或低级烷基羰基氨基;
R4是氢、卤素、低级烷基、低级烷氧基、羟基、RC(O)O(R定义如本文前面的)、氰基、硝基、氨基、氨基低级烷基、卤代低级烷基、卤代低级烷氧基、羟基羰基、低级烷氧基羰基、氨基甲酰基氧基、低级烷基羰基氧基或低级烷基羰基氨基或者R4与R3一起是亚甲基二氧基;
R5是氢、卤素、低级烷基、低级烷氧基、羟基、RC(O)O(R定义如本文前面的)、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、羟基羰基、低级烷氧基羰基、低级烷基羰基氧基或低级烷基羰基氨基;和
R6是氢、卤素、低级烷基、低级烷氧基、羟基、RC(O)O(R定义如本文前面的)、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、羟基羰基、低级烷氧基羰基、低级烷基羰基氧基或低级烷基羰基氨基。
一个优选方面是式(I)的化合物,其中R2-R6各自是H(或者优选本文后面给出的),m是2,并且RaRbN是环氨基或环亚氨基。
另一优选方面是式(I)的化合物,其中R2-R6各自是-H(或者优选本文后面给出的),m是2,并且RaRbNCH2-CH2是以下环氨基乙基或环亚氨基乙基之一:
本发明的其它方面包括本文前面所述的化合物,但是其中R2、R3、R4、R5和R6各自可以是除了氢之外的取代基。它们例如包括本文后面所述的优选小组:
R6是氢的式(I)的化合物,特别是R4和R5一起是亚甲基二氧基并且其中R2是氢的化合物。这些化合物中特别感兴趣的是R3是硝基、氨基、甲基、氯、氰基、乙酰氧基或乙酰基氨基的化合物。
R5和R6都是氢的式(I)的化合物,特别是R3是氢;R2是(3-氯-正丙基)二甲基甲硅烷基、叔丁基二甲基甲硅烷基、乙酰氧基甲基、氰基、乙酰基乙烯基、乙氧基羰基-乙烯基、氰基乙烯基、2,2-二氰基乙烯基、(2-氰基-2-乙氧基羰基)乙烯基、乙氧基羰基乙基、甲基、乙基或正丙基;和R4是羟基、乙酰氧基、氨基、硝基、氰基、氯、溴、氟、低级烷基、高级烷基、低级烷氧基、氨基甲酰基氧基或甲酰基的化合物。其中,更感兴趣的是R2是乙基且R4是氨基甲酰基氧基的化合物。优选的氨基甲酰基氧基取代基包括1-吡嗪基羰基氧基、4-(异丙基氨基羰基甲基)-1-吡嗪基-羰基氧基或[4-(1-哌啶基)-1-哌啶基羰基氧基。
R2、R5和R6各自是氢的式(I)的化合物,例如R3是氨基、硝基、氰基、卤素、OH、低级烷基氨基、二-低级烷基氨基、低级烷基、低级烷氧基、1-哌啶基、1-吗啉基、氨基甲基、低级烷基氨基甲基、环烷基氨基甲基、二-低级烷基氨基甲基、环氨基甲基、乙酰氧基、乙酰基氨基、低级烷氧基甲基、ω羟基低级烷基氨基甲基、氰基甲基和R4是羟基、乙酰氧基、氰基、硝基、氨基、卤素、甲酰基、低级烷氧基、氨基甲酰基氧基的化合物。
R2、R3、R5和R6各自都是氢并且R4是-OC(O)烷基1-20的化合物。
本发明的药物组合物
本发明的这一方面是一种可用于治疗温血动物的癌症的药物组合物,该组合物包括本文定义的本发明化合物以及一种药用可接受的赋形剂。该组合物按照已知的配制技术制备以提供适用于经口、局部、皮肤、直肠、经吸入、非肠道(静脉内、肌内或腹膜内)给药等的化合物。制备本发明组合物的详细指导通过参照the Mack PublishingCo.,Easton,Pa.18040出版的第18或19版的Remington’sPharmaceutical.Sciences找到。将这些相关部分加入本文作为参考。
包括单位剂量或多倍剂量形式,每种在某些临床设置方面具有益处。该单位剂量将含有在治疗癌症的方案中经计算产生所需效果的预定量的活性化合物。多倍剂量形式尤其可用于需要多份的单剂量或分剂量以获得所需结果的时候。这些剂量形式都可以具有该特定化合物的唯一特性所指或者直接依赖于该唯一特性的规格、待获得的特定治疗效果、以及制备治疗癌症用的特定化合物的领域中固有的任何限制。
单位剂量将含有足够治疗患者的癌症的治疗有效量,并且可以含有约1.0-1000mg的化合物,例如约50-500mg。
该化合物优选以例如可摄取的片剂、口腔片剂、胶囊、囊片、酏剂、悬剂、糖浆、糖锭、圆片、锭剂等的合适制剂经口给药。通常,最直接的制剂是片剂或胶囊(单独或者合称为“口服剂量单位”)。合适的制剂是按照可以获得的标准配制技术制备的,该技术可以将化合物的特性与可用于配制适宜组合物的赋形剂相匹配。片剂或胶囊将优选含有约50-约500mg的式(I)化合物。
该形式可以快速释放化合物,或者可以是缓释制品。该化合物可以包封在硬或软胶囊中,可以压制成片剂,或者可以与饮料、食品或其它物料一起加入到膳食中。最终组合物和制品的百分比当然可以变化,并且可以方便地占最终形式,例如片剂的重量的1-90%之间。这种治疗有用的组合物中的量使得将获得合适剂量。制备本发明的优选组合物,以便口服剂量单位形式在剂量单位称重为5-1000mg时含有约5.0-约50%重量(%w)。
口服剂量单位的合适制剂也可以含有:粘合剂,例如黄芪胶、金合欢胶、玉米淀粉、明胶;甜味剂,例如乳糖或蔗糖;崩解剂,例如玉米淀粉、海藻酸等;润滑剂,例如硬脂酸镁;或者风味剂,例如薄荷、冬绿油,等等。其它各种物质可以涂层存在,或者以其它方式改进口服剂量单元的物理形式。口服剂量单元可以涂布有虫胶、糖或二者。糖浆或酏剂可以含有该化合物,含有蔗糖作为甜味剂,含有对羟基苯甲酸甲酯和对羟基苯甲酸丙酯作为防腐剂,含有染料和风味剂。所用的任何物质应是药用上可接受的并且基本上无毒。有用的赋形剂类型的细节可以在第九版的“Remington:The Science andPractice of Pharmacy,”Mack Printing Company,Easton,PA中找到。特别是参见第91-93章有更完整的讨论。
化合物可以非肠道地给药,例如,静脉内、肌内、皮下或腹膜内。载体或赋形剂或者赋形剂混合物可以是溶剂或含有例如各种极性或非极性溶剂、其合适混合物或油的分散介质。本文所用的“载体”或“赋形剂”是指药学上可接受的载体或赋形剂并包括任何和所有的溶剂、分散剂或介质、涂层、抗微生物剂、等渗/低渗/高渗剂、吸收改进剂,等等。将这些物质和试剂用于药用活性物质在本领域为公知。除了任何常规介质或试剂不能与该活性成分相容的范围之外,还考虑了其在治疗组合物中的用途。而且,其它或补充的活性成分也可以加入到该最终组合物中。
可以在合适稀释剂如水、乙醇、甘油、液体聚乙二醇、各种油、和/或其混合物、以及本领域技术人员已知的其它物质中制备该化合物的溶液。
适合注射使用的药用形式包括无菌溶液、分散液、乳液和无菌粉末。最终形式必需在加工和贮藏条件下是稳定的。而且,最终药用形式必需防止污染,因此必需能够抑制微生物如细菌或真菌的生长。可以给予单一静脉内或腹膜内剂量。或者,可以使用缓慢长时间输注或多次短时间每日输注,典型地持续1-8天。也可以每隔一天或者每隔几天一次剂量。
通过将化合物以所需量加入到一种或多种溶剂中,并且上面所列或者本领域技术人员已知的其它组分可以根据需要加入,从而制得无菌的可注射溶液。无菌的可注射溶液是通过将该化合物以所需量加入到该合适溶剂以及根据需要的各种其它组分中制得的。然后进行杀菌步骤,例如过滤。典型地,通过将该化合物加入到无菌载体(也含有如上所述的分散介质和所需的其它组分)中制备分散液。在为无菌粉末的情况下,优选方法包括真空干燥或冷冻干燥,其中加入任何所需的组分。
在所有情况下,所述的最终形式必需无菌并且还必需能够容易地通过注射设备如中空针。通过适当选择溶剂或赋形剂可以获得并保持适当粘度。而且,可以使用分子或微粒涂层如卵磷脂,适当选择分散液的粒径,或者使用具有表面活性剂性能的物质。
通过加入一种或多种抗微生物剂如三氯叔丁醇、抗坏血酸、对羟基苯甲酸酯类、硫柳汞等可以实现防止或抑制微生物生长。也可以优选包括改变其张力的试剂如糖或盐。
尽管本发明的化合物易溶于水,但是在某些情况下,例如本发明的化合物不太易溶于水的情况下,可提供脂质体递送。通过将本发明的化合物加入、包封、包围或诱捕到脂质载体或脂质体中、上,或者被脂质囊泡或脂质体或胶束包封、包围或诱捕,该体系将本发明的化合物束缚。
已成功地使用脂质体将药物给予癌症患者,并且已显示临床上可用于递送抗癌药如阿霉素、柔红霉素和顺铂络合物。Forssen等人,Cancer Res.1992,52:3255-3261;Perex-Soler等人,CancerRes.1990,50:4260-4266;和Khokhar等人,J.Med.Chem.1991,34:325-329,将它们全文加入本文作为参考。
类似地,也已使用胶束将药物递送给患者,(Broden等人,ActaPharm Suec.19:267-284(1982))并且已使用胶束作为药物载体并用于递送靶药物(D.D.Lasic,Nature 335:279-280(1992);和Supersaxo等人,Pharm Res.8:1280-1291(1991)),包括癌症药物,(Fung等人,Biomater.Artif.Cells.Artif.Organs 16:439以及下列等等(1988);和Yokoyama等人,Cancer Res.51:3229-3236(1991)),将它们全文都加入本文作为参考。
可以将含有本发明化合物的脂质体和/或胶束给予癌症患者,典型地经静脉内给予。而且制备可用于本发明的脂质体组合物的指导可以在美国专利6,096,336中找到,将其加入本文作为参考。
本发明的治疗方法
本发明的另一方面是一种治疗温血动物的癌症的方法,该方法包括给予治疗有效量的本文定义的本发明化合物。通过药用上可接受的给药路径如口、非肠道(例如,肌内、静脉内、皮下、腹膜内)、透皮、直肠、通过吸入等将用于本发明的化合物以治疗有效剂量给予需要这些化合物的合适对象。
术语癌症应广义上认为是恶性新生物、异常组织块、超过正常组织的生长以及与正常组织的生长不协调,并且在引起该变化的刺激物停止之后保持相同过度方式的生长。异常组织块无目的,并且事实上是自主的在宿主身上滋生。癌症也可以认为是恶性肿瘤。新生物的进一步讨论在“Robbins Pathologic Basis of Disease,”第六版,R.S.Cotran、V.Kumar和T.Collins,第8章(W.B.SaundersCompany)中找到。将第8章的信息加入本文作为参考。下表A提供了癌症类型的实例,即可以通过给药本发明化合物治疗的恶性肿瘤或新生物。
表A
源组织 恶性
由实质细胞型组成
间充质肿瘤
结缔组织和和衍生物 纤维肉瘤
脂肉瘤
软骨肉瘤
成骨肉瘤
内皮和相关组织
血管 血管肉瘤
淋巴管 淋巴肉瘤
滑膜 滑膜瘤
间皮 间皮瘤
颅盖 侵入性脑瘤
血细胞和相关细胞
造血干细胞 白血病
淋巴组织 恶性淋巴瘤
肌肉
平滑肌 平滑肌肉瘤
横纹肌 横纹肌肉瘤
上皮瘤
复层扁平上皮 鳞状细胞或表皮样癌
皮肤或附件的基质细胞 基质细胞癌
上皮内层
腺或管 腺癌
乳头状癌
囊腺癌
呼吸道 支气管原癌
支气管腺癌(良性肿瘤)
神经外胚层 恶性黑素瘤
肾上皮细胞 肾细胞癌
肝细胞 肝细胞癌
尿道上皮细胞(过渡型) 过渡细胞癌
胎盘上皮细胞(滋养层) 绒膜癌
睾丸上皮细胞(生殖细胞) 精原细胞瘤
胚癌
多个新生细胞-混合瘤,经常
得自一个胚层
唾液腺 唾液腺源的恶性混合瘤
胸 叶状恶性囊性肉瘤
肾原基 Wilms瘤
多个新生细胞型
得自多个胚层-畸形的
性腺或胎性剩余部分中的全不成熟畸胎瘤,畸胎肉瘤能细胞
因此本发明的化合物可用于治疗白血病和实体肿瘤,例如结肠、结肠-直肠、卵巢、乳房、前列腺、肺、肾以及黑素瘤。采用的剂量范围将取决于给药路径以及治疗的患者的年龄、体重和健康状况。这些化合物可以通过例如非肠道路径,例如肌内、静脉内或通过大丸注入给药。
本文所用的本发明的CPT衍生物的“治疗有效量”打算指的是将抑制癌生长、或者延缓癌生长、或者杀死恶性细胞,并使恶性肿瘤消退和减轻,即减少这些肿瘤的体积或大小或者完全消除该肿瘤的量。
就哺乳动物,包括人而言,这些有效量可以体表面积为基础给药。剂量的相互关系随不同大小的动物和物种而变化,并且E.J.Freireich等人,Cancer Chemother.Rep.,50(4):219(1966)针对人(以mg/m2体表面积为基础)进行了描述。体表面积可以大致由个体的身高和体重确定(参见例如Scientific Tables,GeigyPharmaceuticals,Ardsley,N.Y.第537-538页(1970))。合适的剂量范围是每m2体表面积1-1000mg等价的本发明化合物,例如50-500mg/m2。
就所有的给药路径而言,可以改变这些剂量的精确给药时间以获得最佳结果。通常,如果使用英脱利匹特20作为这些CPT衍生物的载体时,到达患者的CPT衍生物的实际剂量将较少。这是由于CPT衍生物在注射器、针和制备容器的壁上有一些损失,这对于英脱利匹特20悬液是普遍的。当使用例如棉籽油的载体时,由于CPT衍生物没有这么大地粘附到注射器等的表面上,因此上述损失并不普遍。
本发明提供的该方法的另一重要特征涉及按照本文教导给药的CPT衍生物的相对低的表观总体毒性。可以使用各种标准判断总体毒性。例如,对象的体重损失超过最初记录的体重(即治疗之前)的10%可以认为是一个毒性信号。此外,对象的总体移动性和活性的损失以及腹泻或膀胱炎的信号也可以解释为毒性的证据。
本发明的方法
本发明的另一方面是本发明化合物的制备方法,包括将喜树碱(CPT)或CPT类似物与式R-C(O)X的化合物反应,其中R是RaRbN(CH2)m,Ra和Rb如本文定义的,并且X是例如溴根、氯根、羟基、1-11个碳原子的烷氧基(例如-O(CH2)nCH3,其中n是1-10的整数)或者R-C(O)O-(R是如本文前面定义的)。优选X是OH。以RaRbN(CH2)mC(O)X所示的化合物可以是指氨基链烷酸或氨基链烷酸衍生物,例如其中m是2时,它是“氨基丙酸″”或“氨基丙酸衍生物”。获得这种氨基链烷酸(例如氨基丙酸)的一种方法是通过将合适的氨基RaRbNH或亚氨基RaRbNH(或其酸加成盐)与ω-卤代链烷酸(例如3-卤代丙酸酯)反应,然后水解该酯形成酸。优选的卤代丙酸酯的实例包括3-溴丙酸乙酯、3-氯丙酸乙酯或3-碘丙酸乙酯。其它相应的烷基酯(例如,甲酯、丙酯等,可以使用,但是优选乙酯)。优选3-溴丙酸乙酯。在一些情况下,由相应的氨基丙酸制备酰基卤可能是有用的。这些酰基卤是通过将相应的氨基丙酸与卤化剂(例如SOCl2、PCl3、POCl3、PCl5、PBr3等)反应获得的。优选酰基氯。一旦制备该酸或其衍生物,将其与CPT反应形成CPT的(S)-20-酯,即本发明的化合物。该反应顺序可以概括如下:
(或
类似物)
(I)
在步骤1中,反应条件将随所用的准确反应物而变化。一般说来,用于该反应的溶剂可以是含水或非水的。优选,溶剂将是可与水混溶的极性有机溶剂,例如低级链烷醇(优选乙醇)。其它有用的极性溶剂的实例包括甲醇、丙醇、丙酮和二甲基聚酰胺(DMF)。该反应通常在有碱金属盐如碳酸氢钠的情况下进行。反应温度将随反应物和这些溶剂而变化,并且在约20℃-约180℃的范围内,优选在回流温度下,直到自由胺消失,即不再检测到。结束反应所需的时间通常不大于约20小时,优选不大于约6小时。
在步骤2中,通过水解反应将式(C)的化合物转变成式(D)的化合物,通常分两步进行。该步骤的反应条件将随反应的化合物而变化。一般说来,用于该转化的溶剂可以是含水的,优选溶剂是水,或者仅有水或者与水混性有机溶剂一起。特别有用的溶剂的实例是水和二噁烷的混合物。第一阶段反应的pH是碱性的,例如在10-14的范围内,优选约12-14。合适的无机碱如碱金属氢氧化物,例如氢氧化钠,是有用的。反应温度将在约0℃-约60℃的范围内,优选约20℃-约25℃。结束反应所需的时间通常不大于10小时,优选不大于约4小时。然后用合适酸如盐酸将该混合物酸化至pH小于4,例如3,并按照标准化学合成方法用合适溶剂如乙酸乙酯萃取(如果需要的话)。经常最终丙烯以固体沉淀并过滤出来。
在步骤2’中,在合适条件下通过与卤化剂如SOCl2、PCl3、POCl3、PCl5、PBr3等反应将式C的化合物(即氨基丙酸)转化成相应的酰基卤。
在本方法的步骤3中,式(D)或(D’)的化合物与CPT或CPT类似物以大致等摩尔量在适合形成本发明化合物20-(S)立体异构体的条件下反应。反应在有合适的偶合剂如碳二亚胺化合物,例如二异丙基碳二亚胺,但是优选1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI)和4-(二甲基氨基)吡啶(DMAP)的情况下在有合适溶剂,优选非水的非极性溶剂的情况下进行。该步骤中有用的溶剂的实例包括卤代链烷,例如二氯甲烷或三氯甲烷)和DMF。二氯甲烷是特别有用的。反应温度在约20℃-约40℃的范围内,优选约20℃-约25℃。结束反应所需的时间通常不大于约20小时。经常小于约10小时。应注意,R2-R6之一是RaRbN(CH2)-C(O)O-与R是RaRbN(CH2)2一起的式(I)的化合物是通过将R2-R6(特别是R4)是羟基的CPT类似物反应获得的。在这种情况下,该化合物(例如10羟基CPT),与2摩尔当量的氨基丙酸反应得到二取代的CPT衍生物。
制备本发明优选化合物的另一方法涉及用合适的酸酐开始,将其转化为亚氨基丙酸,依次按照上述3步反应顺序将其与CPT或CPT类似物反应得到本发明的化合物。该酸酐转化可以如下所示:
通常该酸酐与β-丙氨酸在有合适溶剂和催化剂的情况下反应。合适溶剂包括极性、水混性溶剂,例如醇类、丙酮、二噁烷等。优选乙醇。合适的催化剂是二甲基氨基吡啶(DMAP)。通常,该反应在回流温度下进行不到10小时,例如约3小时。加入水使得该化合物沉淀,然后干燥得到称作(D)的最终亚氨基丙酸。然后该化合物与CPT或CPT类似物反应得到本发明的化合物。
在上面的反应顺序的步骤1中,式(A)所代表的合适胺包括以下物质:
1-(3-三氟甲基)苯基哌嗪;
1-(4-苄基)哌嗪;
1-[4-(3-甲氧基苯基)]哌嗪;
1-[4-(4-硝基苯基)]哌嗪;
1-(4-苯基)哌嗪;
1-[4-(2-氯苯基)]哌嗪(以其HCl盐);
1-[4-(4-氟苯基)]哌嗪;
3-[4-(4-乙酰基苯基)哌嗪;
4-苄基哌啶;
哌啶;
哌嗪;
吗啉;等。
本领域技术人员根据本说明书的指导将想到其它代表性的胺。
在步骤2中,式(C)所代表的合适的3-环氨基丙酸酯包括以下物质:
3-[4-(3-三氟甲基苯基)-1-哌嗪基]丙酸乙酯;
3-(4-苄基-1-哌嗪基)丙酸乙酯;
3-[4-(4-硝基苯基)-1-哌嗪基]丙酸乙酯;
3-(4-苯基-1-哌嗪基)丙酸乙酯;
3-[4-(2-氯苯基)-1-哌嗪基]丙酸乙酯;
3-[4-(4-氟苯基)-1-哌嗪基]丙酸乙酯;
3-(4-苄基-1-哌啶基)丙酸乙酯;
3-[4-(4-乙酰基苯基)-1-哌嗪基]丙酸乙酯;等。
在步骤3中,合适的CPT类似物是如本文献中所述在7、9、10、11或12位取代的CPT的化合物。该CPT类似物可以取代有本领域已知的取代基或者可以由本领域技术人员通过本文给出的内容制备。教导这些类似物如何制备或者这些类似物可以购自哪里的代表性文章在以下杂志(将其加入本文作为参考)中找到:
1.J.Med.Chem.1998,41,31-37
2.J.Med Chem.2000,43,3970-3980
3.J.Med Chem.1993,36,2689-2700
4.J.Med.Chem.1991,34,98-107
5.J.Med.Chem.2000,43,3963-3969
6.Chem.Pharm.Bull.39(10)2574-2580(1991)
7.Chem.Pharm.Bull.39(6)1446-1454(1991)
8.ANTIMICROBIAL AGENTS AND CHEMOTHERAPY,1999年12月第2862-2868页
9.European Journal of Cancer,第34卷第10期第1500-1503页,1998
10.CANCER RESEARCH 55,753-760,1995年2月15日
11.Anti-Cancer Drug Design(1998),13,145-157
12.Bioorganic & Medicinal Chemistry Letters 8(1998)415-418
合适的CPT类似物包括如下,其中名称后面的圆括号中的数字是指上面所列的杂志文章:
喜树碱(CPT);
(20S)-7-乙基-10-[4-(1-哌啶基)-1-哌啶基]羰基氧基)-CPT(AKA-药薯);
(20S)-9-硝基CPT(1);
(20S)-7-氯-正丙基二甲基甲硅烷基CPT(2);
(20S)-10-羟基-7-氯-正丙基二甲基甲硅烷基CPT(2);
(20S)-10-乙酰氧基-7-氯-正丙基二甲基甲硅烷基CPT(2);
(20S)-7-叔丁基二甲基甲硅烷基CPT(2);
(20S)-10-羟基-7-叔丁基二甲基甲硅烷基CPT(2);
(20S)-10-乙酰氧基-7-叔丁基二甲基甲硅烷基CPT(2);
(20S)-9-羟基CPT(3);
(20S)-9-氨基CPT(3);
(20S)-10-氨基CPT(3);
(20S)-9-氨基-10-羟基CPT(3);
(20S)-9-氨基-10,11-亚甲基二氧基CPT(3);
(20S)-9-甲基氨基CPT;
(20S)-9-甲基CPT(3);
(20S)-9-二甲基氨基CPT;
(20S)-9-氯CPT(3);
(20S)-9-二甲基氨基-10-羟基CPT(AKA托泊替堪);
(20S)-9-氟CPT(3);
(20S)-9-哌啶基CPT;
(20S)-9-二甲基氨基甲基-10-羟基CPT(3);
(20S)-9-吗啉基甲基CPT(4);
(20S)-10-羟基CPT(3);
(20S)-9,10-二氯CPT(3);
(20S)-10-溴CPT(3);
(20S)-10-氯CPT(3);
(20S)-10-甲基CPT(3);
(20S)-10-氟CPT(3);
(20S)-10-硝基CPT(3);
(20S)-10,11-亚甲基二氧基CPT(3);
(20S)-10-甲酰基CPT(3);
(20S)-10-壬基羰基氧基CPT(12);
(20S)-10-十一基羰基氧基CPT(12);
(20S)-10-十五基羰基氧基CPT(12);
(20S)-10-十七基羰基氧基CPT(12);
(20S)-10-十九基羰基氧基CPT(12);
(20S)-9-硝基-10,11-亚甲基二氧基CPT(3);
(20S)-9-(4-甲基哌嗪基甲基)-10-羟基(CPT)(4);
(20S)-9-[4-(1-哌啶基)-1-哌啶基甲基]-10-羟基CPT(4);
(20S)-9-甲基-10,11-亚甲基二氧基CPT;
(20S)-9-氯-10,11-亚甲基二氧基CPT(3);
(20S)-9-氰基-10,11-亚甲基二氧基CPT;
(20S)-9-乙酰氧基-10,11-亚甲基二氧基CPT;
(20S)-9-乙酰基氨基-10,11-亚甲基二氧基CPT;
(20S)-9-氨基甲基-10-羟基CPT;
(20S)-9-乙氧基甲基-10-羟基CPT(4);
(20S)-9-甲基氨基甲基-10-羟基CPT;
(20S)-9-正丙基氨基甲基-10-羟基CPT(4);
(20S)-9-二甲基氨基甲基-10-羟基CPT(4);
(20S)-9-环己基氨基甲基-10-羟基CPT(4);
(20S)-9-(2-羟基乙基)氨基甲基-10-羟基CPT(4);
(20S)-9-(三甲基铵基)甲基-10-羟基CPT,甲磺酸盐(4);
(20S)-9-吗啉基甲基-10-羟基CPT(4);
(20S)-9-氰基甲基-10-羟基CPT(4);
(20S)-CPT-7-醛(5);
(20S)-10-甲氧基CPT-7-醛(5);
(20S)-7-乙酰氧基甲基CPT(5);
(20S)-7-乙酰氧基甲基-10-甲基CPT(5);
(20S)-7-氰基-10-甲氧基CPT(5);
(20S)-7-氰基CPT(5);
(20S)-7-甲酰基乙烯基CPT(5);
(20S)-7-乙氧基羰基乙烯基CPT(5);
(20S)-7-氰基乙烯基CPT(5);
(20S)-7-(2,2-二氰基乙烯基)CPT(5);
(20S)-7-(2-氰基-2-乙氧基羰基)乙烯基CPT(5);
(20S)-7-乙氧基羰基乙基CPT(5);
(20S)-7-乙基CPT(6);
(20S)-7-正丙基CPT(6);
(20S)-7-乙酰氧基甲基CPT(6);
(20S)-7-正丙基羰基氧基甲基CPT(6);
(20S)-7-乙氧基羰基CPT(6);
(20S)-7-乙基-10-羟基CPT;
(20S)-7-乙基-10-乙酰基氧基CPT;
(20S)-7-甲基-10-氨基羰基氧基CPT;
(20S)-7-正丙基-10-哌啶基羰基氧基CPT;
(20S)-7-乙基-10-(2-二甲基氨基)乙基CPT;和
CPT的(20S)-7-乙基-10-氨基甲酰基氧基衍生物,例如
(20S)-7-乙基-10-[4-(1-哌啶基)-哌啶基羰基氧基CPT(7);
(20S)-7-乙基-10-(1-哌嗪)羰基氧基CPT(7);
(20S)-7-乙基-10-(4-异丙基氨基羰基甲基哌嗪)羰基氧基CPT(7);
(20S)-7-乙基-10-[4(1-吡咯烷基)哌嗪]羰基氧基CPT(7);
(20S)-7-乙基-10-[(4-(二甲基氨基)-1-哌啶基]羰基氧基CPT(7);
(20S)-7-乙基-10-[4-(二-正丙基氨基)-1-哌啶基]羰基氧基CPT(7);
(20S)-7-乙基-10-[(4-(二-正丁基氨基)-1-哌啶基]羰基氧基CPT(7);
(20S)-7-乙基-10-[4-(1-吡咯烷基)-1-哌啶基)]羰基氧基CPT(7);
(20S)-7-乙基-10-[4-(1-哌啶基)-1-哌啶基]羰基氧基CPT(7);
(20S)-7-乙基-10-[N-甲基-N-2-(二甲基氨基)乙基氨基]羰基氧基CPT(7)等。
本领域技术人员将想到,按照上面文章中所述的教导并用本领域想到的适当步骤改变,可以制备其它类似的化合物。
在步骤3中,式(D)的合适的3-氨基丙酸包括如下:
3-苯二甲酰亚氨基丙酸;
3-马来酰亚氨基丙酸;
3-(3-硝基1,8-萘二甲酰亚胺)丙酸;
3-(4-硝基-1,8-萘二甲酰亚胺)丙酸;
3-(4-溴-1,8-萘二甲酰亚氨基)丙酸;
3-[4-(3-三氟甲基苯基)-1-哌嗪基]-丙酸;
3-[(4-苄基)-1-哌嗪基]丙酸;
3-[4-(3-甲氧基苯基)-1-哌嗪基]丙酸;
3-[4-(4-硝基苯基)-1-哌嗪基]丙酸;
3-(4-苯基-1-哌嗪基)丙酸;
3-[4-(2-氯苯基)-1-哌嗪基]丙酸;
3-[4-(4-氟苯基)-1-哌嗪基]丙酸;
3-(1-哌啶基)丙酸;
3-[1-(4-苄基)哌啶基]丙酸;
3-[4-(4-乙酰基苯基-1-哌嗪基]丙酸;
3-[4-(3,4-二氯苯基)-1-哌嗪基]丙酸;
3-[4-(3,4-亚甲基二氧基苯基)-1-哌嗪基]丙酸;
3-[4-(4-氯苯基)-1-哌啶基]丙酸;
3-(4-甲酰基-1-哌嗪基)丙酸;
3-(4-乙基-1-哌嗪基)丙酸;
3-[4-(4-氯苯基)苯基甲基-1-哌嗪基]丙酸;
3-(4-氰基-4-苯基-1-哌啶基)丙酸;
3-反式-4-肉桂酰基-1-哌嗪基)丙酸;
3-[4-(2-甲基苯基)-1-哌嗪基]丙酸;
3-[4-(2,3-二甲基苯基)-1-哌嗪基]丙酸;
3-[4-(1-哌啶基)-1-哌啶基]丙酸;
3-[4-(2-嘧啶基)-1-哌嗪基]丙酸;
3-(4-环己基-1-哌嗪基)丙酸;
3-[4-(-(2-吡啶基)苄基-1-哌嗪基]丙酸;
3-(4-吗啉基)丙酸;
3-(1-吡咯啉基)丙酸;
4-[4-(3-三氟甲基苯基)-1-哌嗪基]丁酸;
5-[4-(3-三氟甲基苯基)-1-哌嗪基]戊酸;等。
本领域技术人员将想到,其它类似的3-氨基丙酸可以从商业源获得或者通过用于步骤3的本领域想到的步骤制备,从而制备本发明的化合物。通过将CPT类似物表中所示的化合物与式(D)化合物表中所示的化合物按照反应条件的方案反应,将获得本发明的化合物。这些化合物将呈现或大或小程度的所需特性。本文提供的是这类化合物中优选小组的指导。
实施例
给出以下实施例提供代表性化合物,它们作为本发明的一部分包括在本发明内。这些实施例还描述了有助于确定这些化合物的效用的体外和体内试验。实施例1-15中的喜树碱酯是由相应的氨基丙酸和喜树碱制备的。所有这些实施例中将使用化学式命名适当化合物(例如NaHCO3是碳酸氢钠)。在命名这些化合物时,通常使用两种方案。每个实施例的篇头所用的一种方案是指该化合物为丙酸的喜树碱20S-酯。所用的另一方案是指该化合物为喜树碱-20-O-3-丙酸酯。每一方案意味着命名相同化合物。例如,在实施例1中,3-苯二甲酰亚氨基丙酸的喜树碱-20S-酯是与喜树碱-20-O-3-苯二甲酰亚氨基丙酸酯相同的化合物。
实施例1
本实施例解释如何制备未取代和取代的2-苯二甲酰亚氨基丙酸的喜树碱-20S-酯。
A.3-苯二甲酰亚氨基丙酸的喜树碱-20S-酯(000503)
将喜树碱(10mg,0.029mmol)、3-苯二甲酰亚氨基丙酸(12.7mg,0.058mmol)、EDCI(25mg,0.13mmol)、DMAP(2mg,0.02mmol)和二氯甲烷(3ml)的混合物于室温下搅拌20小时,然后向该溶液中加入二氯甲烷(20ml)。有机层用水(20ml)、饱和NaHCO3水溶液(10ml)和盐水(20ml)洗涤,然后在MgSO4上干燥。在减压下除去溶剂之后,通过柱色谱法(洗脱剂:CHCl3∶CH3OH 9∶1)分离所得固体,得到12mg喜树碱-20-O-3-苯二甲酰亚氨基丙酸酯,mp158-161℃。
通过1HNMR(CDCl3,600MHz)进行化学结构分析:δ8.39(s,1H,Ar-H)、8.23(d,1H,Ar-H)、7.95(d,1H,Ar-H)、7.84(t,1H,Ar-H)、7.80(s,2H,Ar-H)、7.69(t,1H,Ar-H)、7.63(s,2H,Ar-H)、7.24(s,1H,Ar-H)、5.67(d,1H,H17)、5.40(d,1H,H17)、5.28(s,2H,H5)、4.00(t,2H,NCH2)、2.98(m,2H,COCH2)、2.25(d,2H,CH2)、0.97(t,3H,CH3)。
B.通过用其它喜树碱类似物替换本实施例的A部分中的喜树碱制备本发明的其它化合物。在命名喜树碱类似物时,使用标准编号体系,同时使用“CPT”作为喜树碱的缩写。其它喜树碱类似物包括以下:
10,11-亚甲基二氧基CPT;
9-硝基CPT;
9-氨基CPT;
9-氨基-10-羟基CPT;
9-甲基氨基CPT;
9-二甲基氨基CPT;
9-二甲基氨基甲基-10-羟基CPT(AKA托泊替堪);
9-哌啶基CPT;
9-吗啉基CPT
7-乙基-10-[4-(1-哌啶基)-1-哌啶基]羰基氧基)-CPT(AKA药薯);
7-叔丁基二甲基甲硅烷基CPT;
7-叔丁基二甲基甲硅烷基-10-羟基CPT;
9-硝基-10,11-亚甲基二氧基CPT;
9-氨基-10,11-亚甲基二氧基CPT;
9-甲基-10,11-亚甲基二氧基CPT;
9-氯-10,11-亚甲基二氧基CPT;
9-氰基-10,11-亚甲基二氧基CPT;
9-乙酰基氧基-10,11-亚甲基二氧基CPT;
9-乙酰基氨基-10,11-亚甲基二氧基CPT;
9-氨基甲基-10-羟基CPT;
9-甲基氨基甲基-10-羟基CPT;
9-二甲基氨基甲基-10-羟基CPT;
9-(2-羟基乙基)氨基甲基-10-羟基CPT;
9-吗啉基甲基-10-羟基CPT;
7-乙基-10-羟基CPT;
7-乙基-10-乙酰基氧基CPT;
7-甲基-10-氨基羰基氧基CPT;
7-正丙基-10-哌啶基羰基氧基CPT;
7-乙基-10-(2-二甲基氨基)乙基CPT;等。
实施例2
本实施例解释如何制备未取代和取代的3-马来酰亚氨基丙酸的喜树碱-20S-酯。
A.3-马来酰亚氨基丙酸的喜树碱-20S-酯(010104)
将喜树碱(10mg,0.029mmol)、3-马来酰亚氨基丙酸(10mg,0.059mmol)、EDCI(25mg,0.13mmol)、DMAP(2mg,0.02mmol)和二氯甲烷(3ml)的混合物于室温下搅拌20小时,然后向该溶液中加入二氯甲烷(20ml)。有机层用水(20ml)、饱和NaHCO3水溶液(10ml)和盐水(20ml)洗涤,然后在MgSO4上干燥。在减压下除去溶剂之后,通过柱色谱法(洗脱剂:CHCl3∶CH3OH 9∶1)分离所得固体,得到6mg喜树碱-20-O-3-马来酰亚氨基丙酸酯,mp 243-245℃。
通过1HNMR(CDCl3,600MHz)进行化学结构分析:δ8.40(s,1H,Ar-H)、8.24(d,1H,Ar-H)、7.96(d,1H,Ar-H)、7.85(t,1H,Ar-H)、7.68(t,1H,Ar-H)、7.26(s,1H,Ar-H)、7.18(s,1H,Ar-H)、6.67(s,1H,Ar-H)、5.65(d,1H,H17)、5.41(d,1H,H17)、5.30(s,2H,H5)、3.84(t,2H,NCH2)、2.93(m,2H,COCH2)、2.25(d,2H,CH2)、0.97(t,3H,CH3)。
B.通过用其它喜树碱类似物替换本实施例的A部分中的喜树碱制备本发明的其它化合物。在命名喜树碱类似物时,使用标准编号体系,同时使用“CPT”作为喜树碱的缩写。其它喜树碱类似物包括以下:
10,11-亚甲基二氧基CPT;
9-硝基CPT;
9-氨基CPT;
9-氨基-10-羟基CPT;
9-甲基氨基CPT;
9-二甲基氨基CPT;
9-二甲基氨基甲基-10-羟基CPT(AKA托泊替堪);
9-哌啶基CPT;
9-吗啉基CPT
7-乙基-10-[4-(1-哌啶基)-1-哌啶基]羰基氧基)-CPT(AKA药薯);
7-叔丁基二甲基甲硅烷基CPT;
7-叔丁基二甲基甲硅烷基-10-羟基CPT;
9-硝基-10,11-亚甲基二氧基CPT;
9-氨基-10,11-亚甲基二氧基CPT;
9-甲基-10,11-亚甲基二氧基CPT;
9-氯-10,11-亚甲基二氧基CPT;
9-氰基-10,11-亚甲基二氧基CPT;
9-乙酰基氧基-10,11-亚甲基二氧基CPT;
9-乙酰基氨基-10,11-亚甲基二氧基CPT;
9-氨基甲基-10-羟基CPT;
9-甲基氨基甲基-10-羟基CPT;
9-二甲基氨基甲基-10-羟基CPT;
9-(2-羟基乙基)氨基甲基-10-羟基CPT;
9-吗啉基甲基-10-羟基CPT;
7-乙基-10-羟基CPT;
7-乙基-10-乙酰基氧基CPT;
7-甲基-10-氨基羰基氧基CPT;
7-正丙基-10-哌啶基羰基氧基CPT;
7-乙基-10-(2-二甲基氨基)乙基CPT;等。
实施例3
本实施例解释如何制备未取代和取代的3-(3-硝基-1,8-萘二甲酰亚胺)丙酸的喜树碱-20S-酯。
A.3-(3-硝基-1,8-萘二甲酰亚胺)丙酸的喜树碱-20S-酯(001117)
1.3-(3-硝基-1,8-萘二甲酰亚胺)丙酸的合成
将3-硝基-1,8-萘二甲酸酐(243mg,1.0mol)、β-丙氨酸(90mg,1.0mol)、DMAP(10mg,0.1mmol)和乙醇(15ml)的反应混合物回流3小时。然后加入15ml水。将该混合物过滤,固体用水洗涤,然后在炉中干燥,得到224mg 3-(3-硝基-1,8-萘二甲酰亚胺)丙酸灰色固体,mp 250-255℃。
通过1HNMR(DMSO-d6,600MHz)进行化学结构分析:δ9.39(d,1H,Ar-H)、8.85(d,1H,Ar-H)、8.70(d,1H,Ar-H)、8.61(d,1H,Ar-H)、8.00(t,1H,Ar-H)、4.25(t,2H,NCH2)、2.62(t,2H,COCH2)。
2.喜树碱-20-O-[3-(3-硝基-1,8-萘二甲酰亚胺)丙酸酯]的合成
将喜树碱(10mg,0.027mmol)、3-(3-硝基-1,8-萘二甲酰亚胺)-丙酸(18mg,0.058mmol)、EDCI(25mg,0.13mmol)、DMAP(2mg,0.02mmol)和二氯甲烷(3ml)的混合物于室温下搅拌20小时,然后向该溶液中加入二氯甲烷(20ml)。有机层用水(20ml)、饱和NaHCO3水溶液(10ml)和盐水(20ml)洗涤,然后在MgSO4上干燥。在减压下除去溶剂之后,通过柱色谱法(洗脱剂:CHCl3∶CH3OH9∶1)分离所得固体,得到12mg标题化合物,mp 225-227℃。
B.通过用其它喜树碱类似物替换本实施例的A部分中的喜树碱制备本发明的其它化合物。在命名喜树碱类似物时,使用标准编号体系,同时使用“CPT”作为喜树碱的缩写。其它喜树碱类似物包括以下:
10,11-亚甲基二氧基CPT;
9-硝基CPT;
9-氨基CPT;
9-氨基-10-羟基CPT;
9-甲基氨基CPT;
9-二甲基氨基CPT;
9-二甲基氨基甲基-10-羟基CPT(AKA托泊替堪);
9-哌啶基CPT;
9-吗啉基CPT
7-乙基-10-[4-(1-哌啶基)-1-哌啶基]羰基氧基)-CPT(AKA药薯);
7-叔丁基二甲基甲硅烷基CPT;
7-叔丁基二甲基甲硅烷基-10-羟基CPT;
9-硝基-10,11-亚甲基二氧基CPT;
9-氨基-10,11-亚甲基二氧基CPT;
9-甲基-10,11-亚甲基二氧基CPT;
9-氯-10,11-亚甲基二氧基CPT;
9-氰基-10,11-亚甲基二氧基CPT;
9-乙酰基氧基-10,11-亚甲基二氧基CPT;
9-乙酰基氨基-10,11-亚甲基二氧基CPT;
9-氨基甲基-10-羟基CPT;
9-甲基氨基甲基-10-羟基CPT;
9-二甲基氨基甲基-10-羟基CPT;
9-(2-羟基乙基)氨基甲基-10-羟基CPT;
9-吗啉基甲基-10-羟基CPT;
7-乙基-10-羟基CPT;
7-乙基-10-乙酰基氧基CPT;
7-甲基-10-氨基羰基氧基CPT;
7-正丙基-10-哌啶基羰基氧基CPT;
7-乙基-10-(2-二甲基氨基)乙基CPT;等。
实施例4
本实施例解释如何制备未取代和取代的3-(4-硝基-1,8-萘二甲酰亚胺)丙酸的喜树碱-20S-酯。
A.3-(4-硝基-1,8-萘二甲酰亚胺)丙酸的喜树碱-20S-酯(001128)
1.3-(4-硝基-1,8-萘二甲酰亚胺)丙酸的合成
将4-硝基-1,8-萘二甲酸酐(243mg,1.0mol)、β-丙氨酸(125mg,1.4mol)、DMAP(10mg,0.1mmol)和乙醇(15ml)的反应混合物回流3小时。然后加入15ml水。将该混合物过滤,固体用水洗涤,然后在炉中干燥,得到227mg 3-(4-硝基-1,8-萘二甲酰亚胺)丙酸灰色固体,mp 220-222℃。
通过1HNMR(DMSO-d6,600MHz)进行化学结构分析:δ8.69(t,1H,Ar-H)、8.60(m,2H,Ar-H)、8.54(d,1H,Ar-H)、8.08(t,1H,Ar-H)、4.25(t,2H,NCH2)、2.62(t,2H,COCH2)。
2.喜树碱-20-O-[3-(4-硝基-1,8-萘二甲酰亚胺)丙酸酯]的合成
将喜树碱(10mg,0.029mmol)、3-(4-硝基-1,8-萘二甲酰亚胺)-丙酸(13mg,0.041mmol)、EDCI(25mg,0.13mmol)、DMAP(2mg,0.02mmol)和二氯甲烷(3ml)的混合物于室温下搅拌20小时,然后向该溶液中加入二氯甲烷(20ml)。有机层用水(20ml)、饱和NaHCO3水溶液(10ml)和盐水(20ml)洗涤,然后在MgSO4上干燥。在减压下除去溶剂之后,通过柱色谱法(洗脱剂:CHCl3∶CH3OH9∶1)分离所得固体,得到10mg喜树碱-20-O-[3-(4-硝基-1,8-萘二甲酰亚胺)丙酸酯],mp 263-265℃。
通过1HNMR(CDCl3,600MHz)进行化学结构分析:δ8.76(d,1H,Ar-H)、8.69(d,1H,Ar-H)、8.63(d,1H,Ar-H)、8.40(s,1H,Ar-H)、8.24(d,1H,Ar-H)、8.18(d,1H,Ar-H)、7.96(d,1H,Ar-H)、7.89(t,1H,Ar-H)、7.84(t,1H,Ar-H)、7.69(t,1H,Ar-H)、7.27(d,1H,Ar-H)、5.65(d,1H,H17)、5.42(d,1H,H17)、5.28(s,2H,H5)、4.52(t,2H,NCH2)、2.96(dm,2H,COCH2)、2.25(d,2H,CH2)、0.93(t,3H,CH3)。
B.通过用其它喜树碱类似物替换本实施例的A部分中的喜树碱制备本发明的其它化合物。在命名喜树碱类似物时,使用标准编号体系,同时使用“CPT”作为喜树碱的缩写。其它喜树碱类似物包括以下:
10,11-亚甲基二氧基CPT;
9-硝基CPT;
9-氨基CPT;
9-氨基-10-羟基CPT;
9-甲基氨基CPT;
9-二甲基氨基CPT;
9-二甲基氨基甲基-10-羟基CPT(AKA托泊替堪);
9-哌啶基CPT;
9-吗啉基CPT
7-乙基-10-[4-(1-哌啶基)-1-哌啶基]羰基氧基)-CPT(AKA药薯);
7-叔丁基二甲基甲硅烷基CPT;
7-叔丁基二甲基甲硅烷基-10-羟基CPT;
9-硝基-10,11-亚甲基二氧基CPT;
9-氨基-10,11-亚甲基二氧基CPT;
9-甲基-10,11-亚甲基二氧基CPT;
9-氯-10,11-亚甲基二氧基CPT;
9-氰基-10,11-亚甲基二氧基CPT;
9-乙酰基氧基-10,11-亚甲基二氧基CPT;
9-乙酰基氨基-10,11-亚甲基二氧基CPT;
9-氨基甲基-10-羟基CPT;
9-甲基氨基甲基-10-羟基CPT;
9-二甲基氨基甲基-10-羟基CPT;
9-(2-羟基乙基)氨基甲基-10-羟基CPT;
9-吗啉基甲基-10-羟基CPT;
7-乙基-10-羟基CPT;
7-乙基-10-乙酰基氧基CPT;
7-甲基-10-氨基羰基氧基CPT;
7-正丙基-10-哌啶基羰基氧基CPT;
7-乙基-10-(2-二甲基氨基)乙基CPT;等。
实施例5
本实施例解释如何制备未取代和取代的3-(4-溴-1,8-萘二甲酰亚胺)丙酸的喜树碱-20S-酯。
A.3-(4-溴-1,8-萘二甲酰亚胺)丙酸的喜树碱-20S-酯(001220)
1.3-(4-溴-1,8-萘二甲酰亚胺)丙酸的合成
将4-溴-1,8-萘二甲酸酐(277mg,1.0mol)、β-丙氨酸(120mg,1.3mol)、DMAP(10mg,0.1mmol)和乙醇(15ml)的反应混合物回流3小时。将该混合物过滤,固体用乙醇洗涤,然后在炉中干燥,得到300mg 3-(4-溴-1,8-萘二甲酰亚胺)丙酸灰色固体,mp220-225℃。
通过1HNMR(DMSO-d6,600MHz)进行化学结构分析:δ8.58(t,2H,Ar-H)、8.35(d,1H,Ar-H)、8.24(d,1H,Ar-H)、8.01(t,1H,Ar-H)、4.25(t,2H,NCH2)、2.59(t,2H,COCH2)。
2.喜树碱-20-O-[3-(4-溴-1,8-萘二甲酰亚胺)丙酸酯]的合成
将喜树碱(10mg,0.029mmol)、3-(4-溴-1,8-萘二甲酰亚胺)-丙酸(19mg,0.056mmol)、EDCI(25mg,0.13mmol)、DMAP(2mg,0.02mmol)和二氯甲烷(3ml)的混合物于室温下搅拌20小时,然后向该溶液中加入二氯甲烷(20ml)。有机层用水(20ml)、饱和NaHCO3水溶液(10ml)和盐水(20ml)洗涤,然后在MgSO4上干燥。在减压下除去溶剂之后,通过柱色谱法(洗脱剂:CHCl3∶CH3OH9∶1)分离所得固体,得到12.3mg喜树碱-20-O-[3-(4-溴-1,8-萘二甲酰亚胺)丙酸酯],mp 250-252℃(度)。
通过1HNMR(CDCl3,600MHz)进行化学结构分析:δ8.61(d,1H,Ar-H)、8.49(d,1H,Ar-H)、8.38(s,1H,Ar-H)、8.36(d,1H,Ar-H)、8.19(d,1H,Ar-H)、7.94(m,2H,Ar-H)、7.84(t,1H,Ar-H)、7.75(t,1H,Ar-H)、7.68(t,1H,Ar-H)、7.29(s,1H,Ar-H)、5.65(d,1H,H17)、5.43(d,1H,H17)、5.28(s,2H,H5)、4.50(t,2H,NCH2)、3.00(dm,2H,COCH2)、2.25(d,2H,CH2)、0.94(t,3H,CH3)。
B.通过用其它喜树碱类似物替换本实施例的A部分中的喜树碱制备本发明的其它化合物。在命名喜树碱类似物时,使用标准编号体系,同时使用“CPT”作为喜树碱的缩写。其它喜树碱类似物包括以下:
10,11-亚甲基二氧基CPT;
9-硝基CPT;
9-氨基CPT;
9-氨基-10-羟基CPT;
9-甲基氨基CPT;
9-二甲基氨基CPT;
9-二甲基氨基甲基-10-羟基CPT(AKA托泊替堪);
9-哌啶基CPT;
9-吗啉基CPT
7-乙基-10-[4-(1-哌啶基)-1-哌啶基]羰基氧基)-CPT(AKA药薯);
7-叔丁基二甲基甲硅烷基CPT;
7-叔丁基二甲基甲硅烷基-10-羟基CPT;
9-硝基-10,11-亚甲基二氧基CPT;
9-氨基-10,11-亚甲基二氧基CPT;
9-甲基-10,11-亚甲基二氧基CPT;
9-氯-10,11-亚甲基二氧基CPT;
9-氰基-10,11-亚甲基二氧基CPT;
9-乙酰基氧基-10,11-亚甲基二氧基CPT;
9-乙酰基氨基-10,11-亚甲基二氧基CPT;
9-氨基甲基-10-羟基CPT;
9-甲基氨基甲基-10-羟基CPT;
9-二甲基氨基甲基-10-羟基CPT;
9-(2-羟基乙基)氨基甲基-10-羟基CPT;
9-吗啉基甲基-10-羟基CPT;
7-乙基-10-羟基CPT;
7-乙基-10-乙酰基氧基CPT;
7-甲基-10-氨基羰基氧基CPT;
7-正丙基-10-哌啶基羰基氧基CPT;
7-乙基-10-(2-二甲基氨基)乙基CPT;等。
实施例6
本实施例解释如何制备未取代和取代的3-[4-(3-三氟甲基苯基)-1-哌嗪基]丙酸的喜树碱-20S-酯。
A.3-[4-(3-三氟甲基苯基)-1-哌嗪基]-丙酸的喜树碱-20S-酯(001101)
1.3-[4-(3-三氟甲基苯基)-1-哌嗪基]丙酸的合成
将1-(3-三氟甲基苯基)哌嗪(510mg,2.2mmol)、3-溴丙酸乙酯(500mg,2.7mmol)、碳酸氢钠(300mg,3.5mmol)和乙醇(15ml)的反应混合物回流3小时,直到胺完全消失。将该混合物过滤之后,将所得固体溶解在5ml二噁烷和14ml 5%氢氧化钠溶液中。混合物在室温下搅拌过夜,然后用浓盐酸酸化。固体经过滤并用水洗涤,然后干燥,得到500mg 3-[4-(3-三氟甲基苯基)-1-哌嗪基]丙酸白色固体,mp 228-230℃。
通过1HNMR(DMSO-d6,600MHz)进行化学结构分析:δ7.47(t,1H,Ar-H)、7.29(t,2H,Ar-H)、7.15(d,1H,Ar-H)、3.36(m,10H,NCH2)、2.89(t,2H,COCH2)。
2.喜树碱-20-O-3-[4-(3-三氟甲基苯基)-1-哌嗪基]丙酸酯的合成
将喜树碱(10mg,0.029mmol)、3-[4-(3-三氟甲基苯基)-1-哌嗪基]丙酸(19mg,0.063mmol)、EDCI(25mg,0.13mmol)、DMAP(2mg,0.02mmol)和二氯甲烷(3ml)的混合物于室温下搅拌20小时,然后向该溶液中加入二氯甲烷(20ml)。有机层用水(20ml)、饱和NaHCO3水溶液(10ml)和盐水(20ml)洗涤,然后在MgSO4上干燥。在减压下除去溶剂之后,通过柱色谱法(洗脱剂:CHCl3∶CH3OH 9∶1)分离所得固体,得到11.4mg喜树碱-20-O-3-[4-(3-三氟甲基苯基)-1-哌嗪基]丙酸酯,mp 87-90℃。
通过1HNMR(CDCl3,600MHz)进行化学结构分析:δ8.35(s,1H,Ar-H)、7.99(d,1H,Ar-H)、7.89(d,1H,Ar-H)、7.64(dt,2H,Ar-H)、7.30(s,1H,Ar-H)、7.17(t,1H,Ar-H)、6.99(d,1H,Ar-H)、6.93(s,1H,Ar-H)、6.85(d,1H,Ar-H)、5.69(d,1H,H17)、5.42(d,1H,H17)、5.28(s,2H,H5)、3.22(m,6H,NCH2)、2.71(m,6H NCH2和COCH2)、2.25(d,2H,CH2)、0.99(t,3H,CH3)。
B.通过用其它喜树碱类似物替换本实施例的A部分中的喜树碱制备本发明的其它化合物。在命名喜树碱类似物时,使用标准编号体系,同时使用“CPT”作为喜树碱的缩写。其它喜树碱类似物包括以下:
10,11-亚甲基二氧基CPT;
9-硝基CPT;
9-氨基CPT;
9-氨基-10-羟基CPT;
9-甲基氨基CPT;
9-二甲基氨基CPT;
9-二甲基氨基甲基-10-羟基CPT(AKA托泊替堪);
9-哌啶基CPT;
9-吗啉基CPT
7-乙基-10-[4-(1-哌啶基)-1-哌啶基]羰基氧基)-CPT(AKA药薯);
7-叔丁基二甲基甲硅烷基CPT;
7-叔丁基二甲基甲硅烷基-10-羟基CPT;
9-硝基-10,11-亚甲基二氧基CPT;
9-氨基-10,11-亚甲基二氧基CPT;
9-甲基-10,11-亚甲基二氧基CPT;
9-氯-10,11-亚甲基二氧基CPT;
9-氰基-10,11-亚甲基二氧基CPT;
9-乙酰基氧基-10,11-亚甲基二氧基CPT;
9-乙酰基氨基-10,11-亚甲基二氧基CPT;
9-氨基甲基-10-羟基CPT;
9-甲基氨基甲基-10-羟基CPT;
9-二甲基氨基甲基-10-羟基CPT;
9-(2-羟基乙基)氨基甲基-10-羟基CPT;
9-吗啉基甲基-10-羟基CPT;
7-乙基-10-羟基CPT;
7-乙基-10-乙酰基氧基CPT;
7-甲基-10-氨基羰基氧基CPT;
7-正丙基-10-哌啶基羰基氧基CPT;
7-乙基-10-(2-二甲基氨基)乙基CPT;等。
实施例7
本实施例解释如何制备未取代和取代的3-[(4-苄基)哌嗪-1-基]丙酸的喜树碱-20S-酯。
A.3-[(4-苄基)-1-哌嗪基]丙酸的喜树碱-20S-酯(001204)
1.3-[(4-苄基)-1-哌嗪基]丙酸的合成
将1-(4-苄基)哌嗪(380mg,2.16mmol)、3-溴丙酸乙酯(500mg,2.7mmol)、碳酸氢钠(300mg,3.5mmol)和乙醇(15ml)的反应混合物回流6小时,直到胺完全消失。将该混合物过滤之后,将所得固体溶解在5ml二噁烷和14ml 5%氢氧化钠溶液中。混合物在室温下搅拌过夜,然后用浓盐酸酸化。固体经过滤并用水洗涤,然后干燥,得到265mg 3-[(4-苄基)-1-哌嗪基]丙酸,mp 165-166℃。
通过1HNMR(DMSO-d6,600MHz)进行化学结构分析:δ7.38(m,4H,Ar-H)、3.40-2.60(m,14H,NCH2和COCH2)。
2.喜树碱-20-O-3-[(4-苄基)-1-哌嗪基]丙酸酯的合成
将喜树碱(10mg,0.029mmol)、3-[(4-苄基)哌嗪-1-基]丙酸(14.3mg,0.058mmol)、EDCI(25mg,0.13mmol)、DMAP(2mg,0.02mmol)和二氯甲烷(3ml)的混合物于室温下搅拌20小时,然后向该溶液中加入二氯甲烷(20ml)。有机层用水(20ml)、饱和NaHCO3水溶液(10ml)和盐水(20ml)洗涤,然后在MgSO4上干燥。在减压下除去溶剂之后,通过柱色谱法(洗脱剂:CHCl3∶CH3OH 9∶1)分离所得固体,得到8mg喜树碱-20-O-3-[(4-苄基)-1-哌嗪基]丙酸酯,mp 206-208℃(度)。
通过1HNMR(CDCl3,600MHz)进行化学结构分析:δ8.40(s,1H,Ar-H)、8.20(d,1H,Ar-H)、7.95(d,1H,Ar-H)、7.83(t,1H,Ar-H)、7.68(t,1H,Ar-H)、7.23(m,6H,Ar-H)、5.67(d,1H,H17)、5.42(d,1H,H17)、5.29(q,2H,H5)、3.40(s,2H,NCH2Ar)、2.73(d,4H,NCH2CH2CO)、2.52(bs,8H,NCH2)、2.25(d,2H,CH2)、0.98(t,3H,CH3)。
B.通过用其它喜树碱类似物替换本实施例的A部分中的喜树碱制备本发明的其它化合物。在命名喜树碱类似物时,使用标准编号体系,同时使用“CPT”作为喜树碱的缩写。其它喜树碱类似物包括以下:
10,11-亚甲基二氧基CPT;
9-硝基CPT;
9-氨基CPT;
9-氨基-10-羟基CPT;
9-甲基氨基CPT;
9-二甲基氨基CPT;
9-二甲基氨基甲基-10-羟基CPT(AKA托泊替堪);
9-哌啶基CPT;
9-吗啉基CPT
7-乙基-10-[4-(1-哌啶基)-1-哌啶基]羰基氧基)-CPT(AKA药薯);
7-叔丁基二甲基甲硅烷基CPT;
7-叔丁基二甲基甲硅烷基-10-羟基CPT;
9-硝基-10,11-亚甲基二氧基CPT;
9-氨基-10,11-亚甲基二氧基CPT;
9-甲基-10,11-亚甲基二氧基CPT;
9-氯-10,11-亚甲基二氧基CPT;
9-氰基-10,11-亚甲基二氧基CPT;
9-乙酰基氧基-10,11-亚甲基二氧基CPT;
9-乙酰基氨基-10,11-亚甲基二氧基CPT;
9-氨基甲基-10-羟基CPT;
9-甲基氨基甲基-10-羟基CPT;
9-二甲基氨基甲基-10-羟基CPT;
9-(2-羟基乙基)氨基甲基-10-羟基CPT;
9-吗啉基甲基-10-羟基CPT;
7-乙基-10-羟基CPT;
7-乙基-10-乙酰基氧基CPT;
7-甲基-10-氨基羰基氧基CPT;
7-正丙基-10-哌啶基羰基氧基CPT;
7-乙基-10-(2-二甲基氨基)乙基CPT;等。
实施例8
本实施例解释如何制备未取代和取代的3-[4-(3-甲氧基苯基)-1-哌嗪基]丙酸的喜树碱-20S-酯。
A.3-[4-(3-甲氧基苯基)-1-哌嗪基]丙酸的喜树碱-20S-酯(001129)
1.3-[4-(3-甲氧基苯基)-1-哌嗪基]丙酸的合成
将1-(4-(3-甲氧基苯基))哌嗪(384mg,2mmol)、3-溴丙酸乙酯(500mg,2.7mmol)、碳酸氢钠(300mg,3.5mmol)和乙醇(15ml)的反应混合物回流6小时,直到胺完全消失。将该混合物过滤之后,将所得固体溶解在5ml二噁烷和14ml 5%氢氧化钠溶液中。混合物在室温下搅拌过夜,然后用浓盐酸酸化。固体经过滤并用水洗涤,然后干燥,得到191mg 3-[4-(3-甲氧基苯基)-1-哌嗪基]丙酸,mp 180-183℃。
通过1HNMR(DMSO-d6,600MHz)进行化学结构分析:δ10.75(bs,1H,COOH)、7.15(t,1H,Ar-H)、6.58(d,1H,Ar-H)、6.53(s,1H,Ar-H)、6.44(d,1H,Ar-H)、4.00-3.00(m,10H,NCH2)、2.88(t,2H,COCH2)。
2.喜树碱-20-O-3-[4-(3-甲氧基苯基)-1-哌嗪基]丙酸酯的合成
将喜树碱(10mg,0.029mmol)、3-[4-(3-甲氧基苯基)-1-哌嗪-1-基]丙酸(15.3mg,0.058mmol)、EDCI(25mg,0.13mmol)、DMAP(2mg,0.02mmol)和二氯甲烷(3ml)的混合物于室温下搅拌20小时,然后向该溶液中加入二氯甲烷(20ml)。有机层用水(20ml)、饱和NaHCO3水溶液(10ml)和盐水(20ml)洗涤,然后在MgSO4上干燥。在减压下除去溶剂之后,通过柱色谱法(洗脱剂:CHCl3∶CH3OH 9∶1)分离所得固体,得到16mg喜树碱-20-O-3-[4-(3-甲氧基苯基)-1-哌嗪-1-基]丙酸酯,mp 98-100℃。
通过1HNMR(CDCl3,600MHz)进行化学结构分析:δ8.35(s,1H,Ar-H)、8.06(d,1H,Ar-H)、7.91(d,1H,Ar-H)、7.71(t,1H,Ar-H)、7.64(t,1H,Ar-H)、7.31(s,1H,Ar-H)、7.05(t,1H,Ar-H)、6,60-6.30(m,3H,Ar-H)、5.68(d,1H,H17)、5.41(d,1H,H17)、5.28(q,2H,H5)、3.79(s,2H,NCH2)、3.73(s,3H,OCH3)、3.20(t,4H,NCH2)、2.80-2.60(m,6H,NCH2,CH2CO)、2.25(dm,2H,CH2)、1.00(t,3H,CH3)。
B.通过用其它喜树碱类似物替换本实施例的A部分中的喜树碱制备本发明的其它化合物。在命名喜树碱类似物时,使用标准编号体系,同时使用“CPT”作为喜树碱的缩写。其它喜树碱类似物包括以下:
10,11-亚甲基二氧基CPT;
9-硝基CPT;
9-氨基CPT;
9-氨基-10-羟基CPT;
9-甲基氨基CPT;
9-二甲基氨基CPT;
9-二甲基氨基甲基-10-羟基CPT(AKA托泊替堪);
9-哌啶基CPT;
9-吗啉基CPT
7-乙基-10-[4-(1-哌啶基)-1-哌啶基]羰基氧基)-CPT(AKA药薯);
7-叔丁基二甲基甲硅烷基CPT;
7-叔丁基二甲基甲硅烷基-10-羟基CPT;
9-硝基-10,11-亚甲基二氧基CPT;
9-氨基-10,11-亚甲基二氧基CPT;
9-甲基-10,11-亚甲基二氧基CPT;
9-氯-10,11-亚甲基二氧基CPT;
9-氰基-10,11-亚甲基二氧基CPT;
9-乙酰基氧基-10,11-亚甲基二氧基CPT;
9-乙酰基氨基-10,11-亚甲基二氧基CPT;
9-氨基甲基-10-羟基CPT;
9-甲基氨基甲基-10-羟基CPT;
9-二甲基氨基甲基-10-羟基CPT;
9-(2-羟基乙基)氨基甲基-10-羟基CPT;
9-吗啉基甲基-10-羟基CPT;
7-乙基-10-羟基CPT;
7-乙基-10-乙酰基氧基CPT;
7-甲基-10-氨基羰基氧基CPT;
7-正丙基-10-哌啶基羰基氧基CPT;
7-乙基-10-(2-二甲基氨基)乙基CPT;等。
实施例9
本实施例解释如何制备未取代和取代的3-[4-(4-硝基苯基)-1-哌嗪基]丙酸的喜树碱-20S-酯。
A.3-[4-(4-硝基苯基)-1-哌嗪基]丙酸的喜树碱-20S-酯(010105)
1.3-[4-(4-硝基苯基)-1-哌嗪基]丙酸的合成
将1-(4-(4-硝基苯基))哌嗪(414mg,2mmol)、3-溴丙酸乙酯(500mg,2.7mmol)、碳酸氢钠(300mg,3.5mmol)和乙醇(15ml)的反应混合物回流6小时,直到胺完全消失。将该混合物过滤之后,将所得固体溶解在5ml二噁烷和14ml 5%氢氧化钠溶液中。混合物在室温下搅拌过夜,然后用浓盐酸酸化。固体经过滤并用水洗涤,然后干燥,得到300mg 3-[4-(4-硝基苯基)-1-哌嗪基]丙酸,mp 250-252℃。
通过1HNMR(DMSO-d6,600MHz)进行化学结构分析:δ11.90(bs,1H,COOH)、8.11(d,2H,Ar-H)、7.14(d,2H,Ar-H)、3.34(t,10H,NCH2)、2.88(t,2H,COCH2)。
2.喜树碱-20-O-3-[4-(4-硝基苯基)-1-哌嗪基]丙酸酯的合成
将喜树碱(10mg,0.029mmol)、3-[4-(4-硝基苯基)-1-哌嗪基]丙酸(16mg,0.058mmol)、EDCI(25mg,0.13mmol)、DMAP(2mg,0.02mmol)和二氯甲烷(3ml)的混合物于室温下搅拌20小时,然后向该溶液中加入二氯甲烷(20ml)。有机层用水(20ml)、饱和NaHCO3水溶液(10ml)和盐水(20ml)洗涤,然后在MgSO4上干燥。在减压下除去溶剂之后,通过柱色谱法(洗脱剂:CHCl3∶CH3OH9∶1)分离所得固体,得到mg喜树碱-20-O-3-[4-(4-硝基苯基)-1-哌嗪基]丙酸酯,mp 255-257℃(度)。
通过1HNMR(CDCl3,600MHz)进行化学结构分析:δ8.34(s,1H,Ar-H)、7.98(d,1H,Ar-H)、7.91(d,2H,Ar-H)、7.88(d,1H,Ar-H)、7.63(m,2H,Ar-H)、7.30(s,1H,Ar-H)、6.56(d,2H,Ar-H)、5.69(d,1H,H17)、5.43(d,1H,H17)、5.28(q,2H,H5)、3.39,3.33(d,4H,NCH2)、2.76-2.56(t,8H,NCH2)、2.25(dm,2H,CH2)、100(t,3H CH3)。
B.通过用其它喜树碱类似物替换本实施例的A部分中的喜树碱制备本发明的其它化合物。在命名喜树碱类似物时,使用标准编号体系,同时使用“CPT”作为喜树碱的缩写。其它喜树碱类似物包括以下:
10,11-亚甲基二氧基CPT;
9-硝基CPT;
9-氨基CPT;
9-氨基-10-羟基CPT;
9-甲基氨基CPT;
9-二甲基氨基CPT;
9-二甲基氨基甲基-10-羟基CPT(AKA托泊替堪);
9-哌啶基CPT;
9-吗啉基CPT
7-乙基-10-[4-(1-哌啶基)-1-哌啶基]羰基氧基)-CPT(AKA药薯);
7-叔丁基二甲基甲硅烷基CPT;
7-叔丁基二甲基甲硅烷基-10-羟基CPT;
9-硝基-10,11-亚甲基二氧基CPT;
9-氨基-10,11-亚甲基二氧基CPT;
9-甲基-10,11-亚甲基二氧基CPT;
9-氯-10,11-亚甲基二氧基CPT;
9-氰基-10,11-亚甲基二氧基CPT;
9-乙酰基氧基-10,11-亚甲基二氧基CPT;
9-乙酰基氨基-10,11-亚甲基二氧基CPT;
9-氨基甲基-10-羟基CPT;
9-甲基氨基甲基-10-羟基CPT;
9-二甲基氨基甲基-10-羟基CPT;
9-(2-羟基乙基)氨基甲基-10-羟基CPT;
9-吗啉基甲基-10-羟基CPT;
7-乙基-10-羟基CPT;
7-乙基-10-乙酰基氧基CPT;
7-甲基-10-氨基羰基氧基CPT;
7-正丙基-10-哌啶基羰基氧基CPT;
7-乙基-10-(2-二甲基氨基)乙基CPT;等。
实施例10
本实施例解释如何制备未取代和取代的3-(4-苯基-1-哌嗪基)丙酸的喜树碱-20S-酯。
A.3-(4-苯基-1-哌嗪基)丙酸的喜树碱-20S-酯(010108)
1.3-(4-苯基-1-哌嗪基)丙酸的合成
将1-(4-苯基)哌嗪(324mg,2mmol)、3-溴丙酸乙酯(500mg,2.7mmol)、碳酸氢钠(300mg,3.5mmol)和乙醇(15ml)的反应混合物回流6小时,直到胺完全消失。将该混合物过滤之后,将所得固体溶解在5ml二噁烷和14ml 5%氢氧化钠溶液中。混合物在室温下搅拌过夜,然后用浓盐酸酸化。固体经过滤并用水洗涤,然后干燥,得到246mg 3-(4-苯基-1-哌嗪基)丙酸,mp 213-215℃。
通过1HNMR(DMSO-d6,600MHz)进行化学结构分析:δ7.26(t,2H,Ar-H)、7.00(d,2H,Ar-H)、6.87(t,1H,Ar-H)、3.37(t,10H,NCH2)、2.83(t,2H,COCH2)。
2.喜树碱-20-O-3-(4-苯基-1-哌嗪基)丙酸酯的合成
将喜树碱(10mg,0.029mmol)、3-(4-苯基哌嗪-1-基)丙酸(13.4mg,0.058mmol)、EDCI(25mg,0.13mmol)、DMAP(2mg,0.02mmol)和二氯甲烷(3ml)的混合物于室温下搅拌20小时,然后向该溶液中加入二氯甲烷(20ml)。有机层用水(20ml)、饱和NaHCO3水溶液(10ml)和盐水(20ml)洗涤,然后在MgSO4上干燥。在减压下除去溶剂之后,通过柱色谱法(洗脱剂:CHCl3∶CH3OH 9∶1)分离所得固体,得到mg喜树碱-20-O-3-(4-苯基-1-哌嗪基)丙酸酯,mp 200-202℃。
通过1HNMR(CDCl3,600MHz)进行化学结构分析:δ8.34(s,1H,Ar-H)、7.98(d,1H,Ar-H)、7.91(d,2H,Ar-H)、7.88(d,1H,Ar-H)、7.63(m,2H,Ar-H)、7.30(s,1H,Ar-H)、6.56(d,2H,Ar-H)、5.69(d,1H,H17)、5.43(d,1H,H17)、5.28(q,2H,H5)、3.39,3.33(d,4H,NCH2)、2.76-2.56(t,8H,NCH2)、2.25(dm,2H,CH2)、1.00(t,3H,CH3)。
B.通过用其它喜树碱类似物替换本实施例的A部分中的喜树碱制备本发明的其它化合物。在命名喜树碱类似物时,使用标准编号体系,同时使用“CPT”作为喜树碱的缩写。其它喜树碱类似物包括以下:
10,11-亚甲基二氧基CPT;
9-硝基CPT;
9-氨基CPT;
9-氨基-10-羟基CPT;
9-甲基氨基CPT;
9-二甲基氨基CPT;
9-二甲基氨基甲基-10-羟基CPT(AKA托泊替堪);
9-哌啶基CPT;
9-吗啉基CPT
7-乙基-10-[4-(1-哌啶基)-1-哌啶基]羰基氧基)-CPT(AKA药薯);
7-叔丁基二甲基甲硅烷基CPT;
7-叔丁基二甲基甲硅烷基-10-羟基CPT;
9-硝基-10,11-亚甲基二氧基CPT;
9-氨基-10,11-亚甲基二氧基CPT;
9-甲基-10,11-亚甲基二氧基CPT;
9-氯-10,11-亚甲基二氧基CPT;
9-氰基-10,11-亚甲基二氧基CPT;
9-乙酰基氧基-10,11-亚甲基二氧基CPT;
9-乙酰基氨基-10,11-亚甲基二氧基CPT;
9-氨基甲基-10-羟基CPT;
9-甲基氨基甲基-10-羟基CPT;
9-二甲基氨基甲基-10-羟基CPT;
9-(2-羟基乙基)氨基甲基-10-羟基CPT;
9-吗啉基甲基-10-羟基CPT;
7-乙基-10-羟基CPT;
7-乙基-10-乙酰基氧基CPT;
7-甲基-10-氨基羰基氧基CPT;
7-正丙基-10-哌啶基羰基氧基CPT;
7-乙基-10-(2-二甲基氨基)乙基CPT;等。
实施例11
本实施例解释如何制备未取代和取代的3-[4-(2-氯苯基)-1-哌嗪基]丙酸的喜树碱-20S-酯。
A.3-[4-(2-氯苯基)-1-哌嗪基]丙酸的喜树碱-20S-酯(010117)
1.3-[4-(2-氯苯基)-1-哌嗪基]丙酸的合成
将1-[4-(2-氯苯基)]哌嗪一盐酸盐(466mg,2mmol)、3-溴丙酸乙酯(500mg,2.7mmol)、碳酸氢钠(300mg,3.5mmol)和乙醇(15ml)的反应混合物回流6小时,直到胺完全消失。将该混合物过滤之后,将所得固体溶解在5ml二噁烷和14ml 5%氢氧化钠溶液中。混合物在室温下搅拌过夜,然后用浓盐酸酸化。固体经过滤并用水洗涤,然后干燥,得到246mg 3-[4-(2-氯苯基)-1-哌嗪基]丙酸,mp 210-213℃。
通过1HNMR(D2O,600MHz)进行化学结构分析:δ7.44(d,1H,Ar-H)、7.29(t,1H,Ar-H)、7.18(d,1H,Ar-H)、7.10(t,1H,Ar-H)、3.64-3.08(m,10H,NCH2)、2.85(t,2H,COCH2)。
2.喜树碱-20-O-3-[4-(2-氯苯基)-1-哌嗪基]丙酸酯的合成
将喜树碱(10mg,0.029mmol)、3-[4-(2-氯苯基)-1-哌嗪基]丙酸(15mg,0.056mmol)、EDCI(25mg,0.13mmol)、DMAP(2mg,0.02mmol)和二氯甲烷(3ml)的混合物于室温下搅拌20小时,然后向该溶液中加入二氯甲烷(20ml)。有机层用水(20ml)、饱和NaHCO3水溶液(10ml)和盐水(20ml)洗涤,然后在MgSO4上干燥。在减压下除去溶剂之后,通过柱色谱法(洗脱剂:CHCl3∶CH3OH9∶1)分离所得固体,得到mg喜树碱-20-O-3-[4-(2-氯苯基)-1-哌嗪基]丙酸酯,mp 190-192℃。
通过1HNMR(CDCl3,600MHz)进行化学结构分析:δ8.38(s,1H,Ar-H)、8.07(d,1H,Ar-H)、7.91(d,1H,Ar-H)、7.71(t,1H,Ar-H)、7.64(t,1H,Ar-H)、7.30(s,1H,Ar-H)、7.28(d,1H,Ar-H)、6.98(t,1H,Ar-H)、6.88(t,1H,Ar-H)、6.70(d,1H,Ar-H)、5.68(d,1H,H17)、5.42(d,1H,H17)、5.28(q,2H,H5)、3.06(s,4H,NCH2)、2.76-2.56(t,8H,NCH2)、2.25(dm,2H,CH2)、1.00(t,3H,CH3)。
B.通过用其它喜树碱类似物替换本实施例的A部分中的喜树碱制备本发明的其它化合物。在命名喜树碱类似物时,使用标准编号体系,同时使用“CPT”作为喜树碱的缩写。其它喜树碱类似物包括以下:
10,11-亚甲基二氧基CPT;
9-硝基CPT;
9-氨基CPT;
9-氨基-10-羟基CPT;
9-甲基氨基CPT;
9-二甲基氨基CPT;
9-二甲基氨基甲基-10-羟基CPT(AKA托泊替堪);
9-哌啶基CPT;
9-吗啉基CPT
7-乙基-10-[4-(1-哌啶基)-1-哌啶基]羰基氧基)-CPT(AKA药薯);
7-叔丁基二甲基甲硅烷基CPT;
7-叔丁基二甲基甲硅烷基-10-羟基CPT;
9-硝基-10,11-亚甲基二氧基CPT;
9-氨基-10,11-亚甲基二氧基CPT;
9-甲基-10,11-亚甲基二氧基CPT;
9-氯-10,11-亚甲基二氧基CPT;
9-氰基-10,11-亚甲基二氧基CPT;
9-乙酰基氧基-10,11-亚甲基二氧基CPT;
9-乙酰基氨基-10,11-亚甲基二氧基CPT;
9-氨基甲基-10-羟基CPT;
9-甲基氨基甲基-10-羟基CPT;
9-二甲基氨基甲基-10-羟基CPT;
9-(2-羟基乙基)氨基甲基-10-羟基CPT;
9-吗啉基甲基-10-羟基CPT;
7-乙基-10-羟基CPT;
7-乙基-10-乙酰基氧基CPT;
7-甲基-10-氨基羰基氧基CPT;
7-正丙基-10-哌啶基羰基氧基CPT;
7-乙基-10-(2-二甲基氨基)乙基CPT;等。
实施例12
本实施例解释如何制备未取代和取代的3-[4-(4-氟苯基)-1-哌嗪基]丙酸的喜树碱-20S-酯。
A.3-[4-(4-氟苯基)-1-哌嗪基]丙酸的喜树碱-20S-酯(010124)
1.3-[4-(4-氟苯基)-1-哌嗪基]丙酸的合成
将1-[4-(4-氟苯基)]哌嗪(360mg,2.0mmol)、3-溴丙酸乙酯(500mg,2.7mmol)、碳酸氢钠(300mg,3.5mmol)和乙醇(15ml)的反应混合物回流6小时,直到胺完全消失。将该混合物过滤之后,将所得固体溶解在5ml二噁烷和14ml 5%氢氧化钠溶液中。混合物在室温下搅拌过夜,然后用浓盐酸酸化。固体经过滤并用水洗涤,然后干燥,得到482mg 3-[4-(4-氟苯基)-1-哌嗪基]丙酸,mp178-180℃。
通过1HNMR(DMSO-d6,600MHz)进行化学结构分析:δ7.09(d,2H,Ar-H)、7.04(t,2H,Ar-H)、3.40-3.32(m,101H,NCH2)、2.91(t,2H,COCH2)。
2.喜树碱-20-O-3-[4-(4-氟苯基)-1-哌嗪基]-丙酸酯的合成
将喜树碱(10mg,0.029mmol)、3-[4-(4-氟苯基)-1-哌嗪基]丙酸(15mg,0.056mmol)、EDCI(25mg,0.13mmol)、DMAP(2mg,0.02mmol)和二氯甲烷(3ml)的混合物于室温下搅拌20小时,然后向该溶液中加入二氯甲烷(20ml)。有机层用水(20ml)、饱和NaHCO3水溶液(10ml)和盐水(20ml)洗涤,然后在MgSO4上干燥。在减压下除去溶剂之后,通过柱色谱法(洗脱剂:CHCl3∶CH3OH9∶1)分离所得固体,得到12mg喜树碱-20-O-3-[4-(氟苯基)-1-哌嗪基]丙酸酯,mp 162-165℃。
通过1HNMR(CDCl3,600MHz)进行化学结构分析:δ8.36(s,1H,Ar-H)、8.05(d,1H,Ar-H)、7.92(d,2H,Ar-H)、7.72(t,1H,Ar-H)、7.65(t,2H,Ar-H)、7.28(s,1H,Ar-H)、6.79(m,2H,Ar-H)、6.65(m,2H,Ar-H)、5.71(d,1H,H17)、5.43(d,1H H17)、5.27(q,2H,H5)、3.11(t,4H,NCH2)、2.83-2.50(m,8H,CH2)、2.25(dm,2H,CH2)、0.98(t,3H,CH3)。
B.通过用其它喜树碱类似物替换本实施例的A部分中的喜树碱制备本发明的其它化合物。在命名喜树碱类似物时,使用标准编号体系,同时使用“CPT”作为喜树碱的缩写。其它喜树碱类似物包括以下:
10,11-亚甲基二氧基CPT;
9-硝基CPT;
9-氨基CPT;
9-氨基-10-羟基CPT;
9-甲基氨基CPT;
9-二甲基氨基CPT;
9-二甲基氨基甲基-10-羟基CPT(AKA托泊替堪);
9-哌啶基CPT;
9-吗啉基CPT
7-乙基-10-[4-(1-哌啶基)-1-哌啶基]羰基氧基)-CPT(AKA药薯);
7-叔丁基二甲基甲硅烷基CPT;
7-叔丁基二甲基甲硅烷基-10-羟基CPT;
9-硝基-10,11-亚甲基二氧基CPT;
9-氨基-10,11-亚甲基二氧基CPT;
9-甲基-10,11-亚甲基二氧基CPT;
9-氯-10,11-亚甲基二氧基CPT;
9-氰基-10,11-亚甲基二氧基CPT;
9-乙酰基氧基-10,11-亚甲基二氧基CPT;
9-乙酰基氨基-10,11-亚甲基二氧基CPT;
9-氨基甲基-10-羟基CPT;
9-甲基氨基甲基-10-羟基CPT;
9-二甲基氨基甲基-10-羟基CPT;
9-(2-羟基乙基)氨基甲基-10-羟基CPT;
9-吗啉基甲基-10-羟基CPT;
7-乙基-10-羟基CPT;
7-乙基-10-乙酰基氧基CPT;
7-甲基-10-氨基羰基氧基CPT;
7-正丙基-10-哌啶基羰基氧基CPT;
7-乙基-10-(2-二甲基氨基)乙基CPT;等。
实施例13
本实施例解释如何制备未取代和取代的喜树碱-20-O-3-(1-哌啶基)丙酸酯。
A.喜树碱-20-O-3(1-哌啶基)丙酸酯(001124)
将喜树碱(10mg,0.029mmol)、3-(1-哌啶基)丙酸(10mg,0.063mmol)、EDCI(25mg,0.13mmol)、DMAP(2mg,0.02mmol)和二氯甲烷(3ml)的混合物于室温下搅拌20小时,然后向该溶液中加入二氯甲烷(20ml)。有机层用水(20ml)、饱和NaHCO3水溶液(10ml)和盐水(20ml)洗涤,然后在MgSO4上干燥。在减压下除去溶剂之后,通过柱色谱法(洗脱剂:CHCl3∶CH3OH 9∶1)分离所得固体,得到5mg喜树碱-20-O-3-(1-哌啶基)丙酸酯,mp 175-177℃。
通过1HNMR(CDCl3,600MHz)进行化学结构分析:δ8.39(s,1H,Ar-H)、8.20(d,1H,Ar-H)、7.94(d,1H,Ar-H)、7.83(t,1H,Ar-H)、7.67(t,1H,Ar-H)、7.26(s,1H,Ar-H)、5.70(d,1H,H17)、5.41(d,1H,H17)、5.29(s,2H,H5)、2,79(d,4H,NCH2)、2.52(bs,4H,NCH2CH2CO)、2.25(d,2H,H18)、1.62(6H,CH2)、1.00(s,3H,CH3)
B.通过用其它喜树碱类似物替换本实施例的A部分中的喜树碱制备本发明的其它化合物。在命名喜树碱类似物时,使用标准编号体系,同时使用“CPT”作为喜树碱的缩写。其它喜树碱类似物包括以下:
10,11-亚甲基二氧基CPT;
9-硝基CPT;
9-氨基CPT;
9-氨基-10-羟基CPT;
9-甲基氨基CPT;
9-二甲基氨基CPT;
9-二甲基氨基甲基-10-羟基CPT(AKA托泊替堪);
9-哌啶基CPT;
9-吗啉基CPT
7-乙基-10-[4-(1-哌啶基)-1-哌啶基]羰基氧基)-CPT(AKA药薯);
7-叔丁基二甲基甲硅烷基CPT;
7-叔丁基二甲基甲硅烷基-10-羟基CPT;
9-硝基-10,11-亚甲基二氧基CPT;
9-氨基-10,11-亚甲基二氧基CPT;
9-甲基-10,11-亚甲基二氧基CPT;
9-氯-10,11-亚甲基二氧基CPT;
9-氰基-10,11-亚甲基二氧基CPT;
9-乙酰基氧基-10,11-亚甲基二氧基CPT;
9-乙酰基氨基-10,11-亚甲基二氧基CPT;
9-氨基甲基-10-羟基CPT;
9-甲基氨基甲基-10-羟基CPT;
9-二甲基氨基甲基-10-羟基CPT;
9-(2-羟基乙基)氨基甲基-10-羟基CPT;
9-吗啉基甲基-10-羟基CPT;
7-乙基-10-羟基CPT;
7-乙基-10-乙酰基氧基CPT;
7-甲基-10-氨基羰基氧基CPT;
7-正丙基-10-哌啶基羰基氧基CPT;
7-乙基-10-(2-二甲基氨基)乙基CPT;等。
实施例14
本实施例解释如何制备未取代和取代的3-[1-(4-苄基)哌啶基]丙酸酯的喜树碱-20S-酯。
A.3-[1-(4-苄基)哌啶基]丙酸酯的喜树碱-20S-酯(010122)
1.3-[1-(4-苄基)哌啶基]丙酸的合成
将4-苄基哌啶(350mg,2.0mmol)、3-溴丙酸乙酯(500mg,2.7mmol)、碳酸氢钠(300mg,3.5mmol)和乙醇(15ml)的反应混合物回流6小时,直到胺完全消失。将该混合物过滤之后,将所得固体溶解在5ml二噁烷和14ml 5%氢氧化钠溶液中。混合物在室温下搅拌过夜,然后用浓盐酸酸化。固体经过滤并用水洗涤,然后干燥,得到346mg,3-[1-(4-苄基)哌啶基]丙酸,mp 214-215℃。
通过1HNMR(DMSO-d6,600MHz)进行化学结构分析:δ7.29(t,2H,Ar-H)、7.19(m,3H,Ar-H)、3.40(d,,2H,NCH2)、3.22(d,4H,CH2)、2.86(m,5H,CH2CH2CO和H4)、2.56(s,2H,Ar-CH2)、1.74(m,5H,CH2)。
2.喜树碱-20-O-3-[1-(4-苄基)哌啶基]丙酸酯的合成
将喜树碱(10mg,0.029mmol)、3-[1-(4-苄基)哌啶基]丙酸(14mg,0.056mmol)、EDCI(25mg,0.13mmol)、DMAP(2mg,0.02mmol)和二氯甲烷(3ml)的混合物于室温下搅拌20小时,然后向该溶液中加入二氯甲烷(20ml)。有机层用水(20ml)、饱和NaHCO3水溶液(10ml)和盐水(20ml)洗涤,然后在MgSO4上干燥。在减压下除去溶剂之后,通过柱色谱法(洗脱剂:CHCL3∶CH3OH 9∶1)分离所得固体,得到10mg喜树碱-20-O-3-[1-(4-苄基)哌啶基]丙酸酯,mp 195-197℃。
通过1HNMR(CDCl3,600MHz)进行化学结构分析:δ8.39(s,1H,Ar-H)、8.22(d,1H,Ar-H)、7.95(d,1H,Ar-H)、7.83(t,1H,Ar-H)、7.67(t,1H,Ar-H)、7.22(m,3H,Ar-H)、7.15(d,1H,Ar-H)、7.04(d,2H,Ar-H)、5.69(d,1H,H17)、5.42(d,1H,H17)、5.29(q,2H,H5)、2.90(d,2H,NCH2)、2.79(d,4H,NCH2)、2.42(d,2H,Ar-CH2)、2.25(dm,2H,CH2)、1.94-1.20(m,5H,CH2CHCH2)、1.00(t,3H,CH3)。
B.通过用其它喜树碱类似物替换本实施例的A部分中的喜树碱制备本发明的其它化合物。在命名喜树碱类似物时,使用标准编号体系,同时使用“CPT”作为喜树碱的缩写。其它喜树碱类似物包括以下:
10,11-亚甲基二氧基CPT;
9-硝基CPT;
9-氨基CPT;
9-氨基-10-羟基CPT;
9-甲基氨基CPT;
9-二甲基氨基CPT;
9-二甲基氨基甲基-10-羟基CPT(AKA托泊替堪);
9-哌啶基CPT;
9-吗啉基CPT
7-乙基-10-[4-(1-哌啶基)-1-哌啶基]羰基氧基)-CPT(AKA药薯);
7-叔丁基二甲基甲硅烷基CPT;
7-叔丁基二甲基甲硅烷基-10-羟基CPT;
9-硝基-10,11-亚甲基二氧基CPT;
9-氨基-10,11-亚甲基二氧基CPT;
9-甲基-10,11-亚甲基二氧基CPT;
9-氯-10,11-亚甲基二氧基CPT;
9-氰基-10,11-亚甲基二氧基CPT;
9-乙酰基氧基-10,11-亚甲基二氧基CPT;
9-乙酰基氨基-10,11-亚甲基二氧基CPT;
9-氨基甲基-10-羟基CPT;
9-甲基氨基甲基-10-羟基CPT;
9-二甲基氨基甲基-10-羟基CPT;
9-(2-羟基乙基)氨基甲基-10-羟基CPT;
9-吗啉基甲基-10-羟基CPT;
7-乙基-10-羟基CPT;
7-乙基-10-乙酰基氧基CPT;
7-甲基-10-氨基羰基氧基CPT;
7-正丙基-10-哌啶基羰基氧基CPT;
7-乙基-10-(2-二甲基氨基)乙基CPT;等。
实施例15
本实施例解释如何制备未取代和取代的3-[4-(4-乙酰基苯基)-1-哌嗪基]丙酸的喜树碱-20S-酯。
A.3-[4-(4-乙酰基苯基)-1-哌嗪基]丙酸的喜树碱-20S-酯(010201)
1.3-[4-(4-乙酰基苯基)-1-哌嗪基]丙酸的合成
将1-[4-(4-乙酰基苯基)]哌嗪(408mg,2.0mmol)、3-溴丙酸乙酯(500mg,2.7mmol)、碳酸氢钠(300mg,3.5mmol)和乙醇(15ml)的反应混合物回流6小时,直到胺完全消失。将该混合物过滤之后,将所得固体溶解在5ml二噁烷和14ml 5%氢氧化钠溶液中。混合物在室温下搅拌过夜,然后用浓盐酸酸化。固体经过滤并用水洗涤,然后干燥,得到330mg 3-[4-(4-乙酰基苯基)-1-哌嗪基]丙酸,mp 204-206℃。
通过1HNMR(DMSO-d6,600MHz)进行化学结构分析:δ7.86(d,2H,Ar-H)、7.07(d,2H,Ar-H)、3.40-3.32(m,10H,NCH2)、2.82(t,2H,COCH2)、2.48(s,3H,COCH3)。
2.喜树碱-20-O-3-[4-(4-乙酰基苯基)-1-哌嗪基]丙酸酯的合成
将喜树碱(10mg,0.029mmol)、3-[4-(4-乙酰基苯基)-1-哌嗪基]丙酸(16mg,0.058mmol)、EDCI(25mg,0.13mmol)、DMAP(2mg,0.02mmol)和二氯甲烷(3ml)的混合物于室温下搅拌20小时,然后向该溶液中加入二氯甲烷(20ml)。有机层用水(20ml)、饱和NaHCO3水溶液(10ml)和盐水(20ml)洗涤,然后在MgSO4上干燥。在减压下除去溶剂之后,通过柱色谱法(洗脱剂:CHCl3∶CH3OH9∶1)分离所得固体,得到8.7mg喜树碱-20-O-3-[4-(4-乙酰基苯基)-1-哌嗪基]丙酸酯,mp 218-220℃(度)。
通过1HNMR(CDCl3,600MHz)进行化学结构分析:δ8.34(s,1H,Ar-H)、8.02(d,1H,Ar-H)、7.88(d,1H,Ar-H)、7.72(d,2H,Ar-H)、7.62(m,2H,Ar-H)、7.31(s,1H,Ar-H)、6.66(d,2H,Ar-H)、5.69(d,1H,H17)、5.42(d,1H,H17)、5.28(q,2H,H5)、3.35(d,4H,NCH2)、2.79-2.60(t,8H,NCH2)、2.50(s,3H,COCH3)、2.25(dm,2H,CH2)、1.00(t,3H,CH3)。
B.通过用其它喜树碱类似物替换本实施例的A部分中的喜树碱制备本发明的其它化合物。在命名喜树碱类似物时,使用标准编号体系,同时使用“CPT”作为喜树碱的缩写。其它喜树碱类似物包括以下:
10,11-亚甲基二氧基CPT;
9-硝基CPT;
9-氨基CPT;
9-氨基-10-羟基CPT;
9-甲基氨基CPT;
9-二甲基氨基CPT;
9-二甲基氨基甲基-10-羟基CPT(AKA托泊替堪);
9-哌啶基CPT;
9-吗啉基CPT
7-乙基-10-[4-(1-哌啶基)-1-哌啶基]羰基氧基)-CPT(AKA药薯);
7-叔丁基二甲基甲硅烷基CPT;
7-叔丁基二甲基甲硅烷基-10-羟基CPT;
9-硝基-10,11-亚甲基二氧基CPT;
9-氨基-10,11-亚甲基二氧基CPT;
9-甲基-10,11-亚甲基二氧基CPT;
9-氯-10,1-亚甲基二氧基CPT;
9-氰基-10,11-亚甲基二氧基CPT;
9-乙酰基氧基-10,11-亚甲基二氧基CPT;
9-乙酰基氨基-10,11-亚甲基二氧基CPT;
9-氨基甲基-10-羟基CPT;
9-甲基氨基甲基-10-羟基CPT;
9-二甲基氨基甲基-10-羟基CPT;
9-(2-羟基乙基)氨基甲基-10-羟基CPT;
9-吗啉基甲基-10-羟基CPT;
7-乙基-10-羟基CPT;
7-乙基-10-乙酰基氧基CPT;
7-甲基-10-氨基羰基氧基CPT;
7-正丙基-10-哌啶基羰基氧基CPT;
7-乙基-10-(2-二甲基氨基)乙基CPT;等。
实施例16
本实施例提供细胞生长和测定本发明化合物对细胞生长的影响的指导。所有细胞购自DCTDC Tumor Repository,NCI,NIH。
细胞簇形成试验
将400个细胞(HCT 116,PC-3)或500个细胞(VM46)铺板在60mm含有2.7ml培养基(改进的McCoy’s 5a培养基)(含10%胎牛血清和100U/ml青霉素和100mg/ml链霉素)的陪替氏培养皿中。这些细胞在CO2恒温箱中于37℃下培养5小时,用于附着到陪替氏培养皿的底部。以10倍最终浓度在培养基中制备新鲜的药物,然后将0.3ml的该原液加入到该培养皿中的2.7ml培养基中。然后将这些细胞与药物一起于37℃下培养72小时。培养结束时,将含有药物的培养基倾析出,培养皿用4ml的Hank’s平衡盐溶液(HBSS)冲洗,加入5ml新鲜培养基,并将这些培养基返回到恒温箱中用于形成簇。使用簇计数器分别计数培养7天之后HCT116细胞和PC-3细胞的细胞簇以及培养8天之后VM46细胞的细胞簇。计算HCT 116细胞的细胞存活率(%/),如表I所示。
可以确定每一测定化合物的ID50值(产生50%簇形成抑制的药物浓度)。本实施例中所述的指导可用于其它细胞,例如DU-145。
表I
该表提供了对细胞系HCT116在实施例16中进行的体外功效试验的结果。
| 化合物(实施例#) | HCT116的存活率(%) | MTD(mg/kg) | ||
| 100nM | 10nM | 1nM | ||
| 喜树碱 | 0 | 73.72 | 70.82 | 12 |
| 药薯 | 90.52 | |||
| 000503(1) | 0 | 95.24 | 150 | |
| 001117(3) | 0 | 100 | ||
| 001128(4) | 0 | 100 | 150 | |
| 010104(2) | 0 | 95.54 | ||
| 001101(6) | 0 | 0 | 100 | 150 |
| 001129(8) | 0 | 0 | 73.26 | 150 |
| 001204(7) | 0 | 0 | 64.04 | |
| 001124(13) | 0 | 0 | 64.76 | |
| 010105(9) | 0 | 0 | 94.14 | |
| 010108(10) | 0 | 0 | 100 | |
| 010117(11) | 0 | 0 | 100 | |
| 010122(14) | 0 | 0 | 100 | |
| 010124(12) | 0 | 0 | ||
实施例17
本实施例提供了本发明化合物在C3H/HeJ小鼠上进行体内毒性试验的指导。
在C3H/HeJ小鼠(体重18-22g)上评价本发明化合物的急性毒性。通过Gad和Chengelis(参见例如“Acute ToxicologyTesting,”第2版,Shayne O.Gad和Christopher P.Chengelis,第186-195页(Academic Press))所述的标准步骤测定MTD40(40天的最大允许剂量)值。在这些连续型研究中,2只小鼠给予40和100mg/kg的低和适中剂量。如果以这些剂量没有发生严重且不可逆的毒性(需要安乐死),以180mg/kg开始一对新的动物,它比100mg/kg高1.8倍。以1.8的系数连续增加剂量(在3对动物上约3个剂量,即每一药物剂量给予2只小鼠),直到出现严重且不可逆的毒性(需要安乐死)。然后将另一对动物以最高非致死剂量开始,并以系数1.15连续增加剂量。这样进行的结果是两个剂量,如果出现严重且不可逆的毒性并且需要安乐死,那么一个显然是非致死的,另一个是致死的,它们以系数1.15间隔。以每一剂量给药6只小鼠。如果在较低剂量没有出现严重且不可逆的毒性,并且至少一个在较高剂量出现严重且不可逆的毒性,那么该较低剂量被认为是该MTD。本发明的化合物通过腹膜内注射给予C3H/HeJ小鼠。以每日检查小鼠持续45天评价药物毒性。报道的毒性参数是MTD40。该MTD定义为在一个处理组不引起严重不可逆毒性,但是至少一个动物出现严重且不可逆的毒性并且在接下来的较高剂量安乐死的最高剂量。
实施例18
本实施例提供了本发明化合物在患MTG-B瘤的C3H/HeJ小鼠上进行体内功效试验的指导。
在患MTG-B的C3H/HeJ小鼠上进行本发明化合物的研究。将这些肿瘤植入小鼠的胁腹中并在7-10天达到直径8mm(268.08mm3)之后,这些肿瘤以指数地生长。此时开始治疗,第一天的治疗指定为计算和绘图的第0天。使用一次注射和Q2D×3的方案(每2天总共3次以1/3MTD治疗)对小鼠以腹膜内注射3个药物剂量水平(1/3、1/2、1×MTD)。患8mm直径肿瘤的小鼠对照组仅用载体治疗。药物治疗之后,每天2次地观察动物。当一个肿瘤达到1.5g时,将患该肿瘤的小鼠安乐死。记录从第0天用抗癌药物治疗的小鼠的存活天数(T)以及从第0天对照小鼠的存活天数(C)。使用式T/C%=(用抗癌药物治疗的小鼠的存活天数T/对照小鼠的存活天数C)×100%计算肿瘤生长抑制值(T/C%)。
每天可以用测径规测定肿瘤大小。以可互换值1mm3=1mg为基础使用二维固体肿瘤(长L和宽W)的每日量度(mm)计算肿瘤重量[肿瘤重量=(长×宽2)/2]。通过计算治疗组和对照组肿瘤达到1,000mg所需的中时(以天计)确定肿瘤生长延迟(T-C值)。测定肿瘤加倍时间(Td),并通过式log细胞杀死=(T-C值)/(3.32×Td)计算肿瘤细胞杀死。可以观察并记录治疗之后的消退效果(完全消退:消退在触诊极限以下;部分消退:治疗块减少50%以上的消退)。
通常,对照小鼠的存活时间是6天。可以计算用本发明化合物治疗的小鼠超出的存活天数(与对照相比)与用紫杉酚治疗的小鼠超出的存活天数(与对照相比)的比例。例如,如果该小鼠存活18天,而相比较紫杉酚治疗的小鼠存活9天,那么CD/紫杉酚比将是18-6/9-6=12/3=4。
实施例19
本实施例提供在有不同血液组分的情况下测定喜树碱衍生物的内酯环(E)的水解动力学的指导。可以使用定量C18逆相高效液相色谱(HPLC)试验。有关描述可在以下参考文献中找到:
J.Med.Chem.2000,43,3970-3980;
Anal.Biochem.1993,212,285-287;和
Biochemistry 1994,33,10325-10336。
还参见J.Med.Chem.1998,41,31-37。
实施例20
本实施例提供了测定拓扑异构酶I的抑制的指导。该步骤是一个完整的细胞试验并且是一种在Cancer Res.1986,46,2021-2026中找到的公开步骤的改进。最接近的文献可以在J.Med.Chem.1993,36 2689-2700的2699中找到。本文使用前面步骤的改进定量拓扑异构酶I介导的DNA在完整细胞中的分裂量。在培养物中生长的HL-60细胞的DNA通过加入[3H]胸腺嘧啶核苷标记。将这些细胞与带测定和溶解的化合物接触,并且将蛋白质沉淀。与拓扑异构酶I以可分裂的复合物形成的放射性DNA与蛋白质一同沉淀。用液体闪烁计数器计数这些颗粒对可分裂的复合物形成量定量。
Claims (34)
1、下式的化合物
其中R是RaRbN-(CH2)m,m是1-10的整数,并且Ra和Rb各自独立地是
取代有1-5个取代基的低级烷基,所述1-5个取代基独立地选自卤素、低级烷氧基、羟基、氰基、硝基或氨基;
任选取代有1-5个取代基的苯基,所述1-5个取代基独立地选自卤素、低级烷基、低级烷氧基、羟基、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、甲酰基、低级烷基羰基、羟基羰基、低级烷基羰基氧基、苄氧基、任选取代的哌啶基、低级烷氧基羰基和低级烷基羰基氨基;
3-7个碳原子的环烷基,任选取代有1-5个独立地选自以下的取代基:卤素、低级烷基、低级烷氧基、羟基、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、羟基羰基、低级烷氧基羰基、低级烷基羰基氧基和低级烷基羰基氨基;
低级烷氧基;或
RaRb与N一起形成一环状胺或亚氨基环;
R2是氢、卤素、低级烷基、低级烷氧基、羟基、RC(O)O(R定义如本文前面的)、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、羟基羰基、甲酰基、低级烷氧基羰基、三低级烷基甲硅烷基、低级烷基羰基氧基、低级烷基羰基氨基、低级烷基羰基氧基甲基、取代的乙烯基、1-羟基-2-硝基乙基、烷氧基羰基乙基、氨基羰基、烷基羰基、烷基羰基甲基、苄氧基甲基、苄基羰基氧基甲基或一-或二低级烷氧基甲基;
R3是氢、卤素、低级烷基、低级烷氧基、羟基、RC(O)O(R定义如本文前面的)、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、羟基羰基、甲酰基、低级烷氧基羰基、CH2NR7R8(其中R7和R8各自独立地是H-、1-6个碳原子的烷基、任选取代的苯基、羟基低级烷基、氨基低级烷基或一-或二烷基氨基低级烷基或者R7和R8与-N-一起代表一环状氨基-)、CH2R9(其中R9是低级烷氧基、CN、氨基低级烷氧基、一-或二-低级烷基氨基低级烷氧基、低级烷硫基、氨基低级烷硫基或一-或二-低级烷基氨基低级烷硫基)或NR10R11(其中R10和R11各自独立地是氢、低级烷基、苯基、羟基低级烷基、氨基低级烷基或一-或二-低级烷基或者R10和R11与-N-一起代表一环状氨基)、二烷基氨基烷基、低级烷基羰基氧基或低级烷基羰基氨基;和
R4是氢、卤素、低级烷基、低级烷氧基、羟基、RC(O)O(R定义如本文前面的)、氰基、硝基、氨基、氨基低级烷基、卤代低级烷基、卤代低级烷氧基、羟基羰基、甲酰基、低级烷氧基羰基、氨基甲酰基氧基、低级烷基羰基氧基或低级烷基羰基氨基或者R4与R3一起是亚甲基二氧基;
R5是氢、卤素、低级烷基、低级烷氧基、羟基、RC(O)O(R定义如本文前面的)、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、羟基羰基、甲酰基、低级烷氧基羰基、低级烷基羰基氧基或低级烷基羰基氨基;和
R6是氢、卤素、低级烷基、低级烷氧基、羟基、RC(O)O(R定义如本文前面的)、氰基、硝基、氨基、卤代低级烷基、卤代低级烷氧基、羟基羰基、甲酰基、低级烷氧基羰基、低级烷基羰基氧基或低级烷基羰基氨基。
其中,当m=1时,Ra和Rb不是低级烷基,并且Ra和Rb与N一起不是
3、如权利要求1的化合物,其中R2-R6各自是H,并且RaRbN-(CH2)m是
7、如权利要求1的化合物,其中R2-R6各自是H,并且RaRbN-(CH2)m是
8、如权利要求1的化合物,其中R2-R6各自是H,并且RaRbN-(CH2)m是
14、如权利要求1的化合物,其中R2-R6各自是H,并且RaRbN-(CH2)m是
20、如权利要求1的化合物,其中R2-R6各自是H,并且RaRbN-(CH2)m是
21、如权利要求1的化合物,其中m是2,R2、R3、R4、R5和R6各自是氢,并且RaRbN是一环状氨基或一亚氨基环。
22、如权利要求21的化合物,其中RaRbN是一环状氨基。
23、如权利要求21的化合物,其中RaRbN是一亚氨基环。
24、一种可用于治疗温血动物的癌症的药物组合物,该组合物包括如权利要求1所述的化合物和药用可接受的赋形剂。
25、如权利要求24的药物组合物,适合口服。
26、如权利要求24的药物组合物,适合静脉注射给药。
27、如权利要求24的药物组合物,适合肌肉注射给药。
28、一种使用如权利要求1所述的化合物与一种药用可接受的赋形剂混合形成可用于治疗温血动物的癌症的药物组合物的方法。
29、如权利要求28的方法,其中该动物是人。
30、如权利要求28的方法,其中该化合物经口给药。
31、如权利要求28的方法,其中该化合物经静脉注射给药。
32、如权利要求28的方法,其中该化合物经非肠道给药。
33、一种如权利要求1的化合物的制备方法,该方法包括将(a)与(b)反应:
(a)式R-C(O)X的化合物,其中R是如权利要求1定义的RaRbN(CH2)2,并且X是羟基、氯根、或者R-C(O)-O(其中R是如本文前面定义的)
(b)下式的化合物
其中R2、R3、R4、R5和R6如权利要求1定义的。
34、如权利要求33的方法,其中反应是在有偶合剂1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐以及催化剂4-(二甲基氨基)吡啶的情况下进行。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US09/797,765 US6403604B1 (en) | 2001-03-01 | 2001-03-01 | Nitrogen-based camptothecin derivatives |
| US09/797,765 | 2001-03-01 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1511159A CN1511159A (zh) | 2004-07-07 |
| CN1246323C true CN1246323C (zh) | 2006-03-22 |
Family
ID=25171748
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB028090543A Expired - Fee Related CN1246323C (zh) | 2001-03-01 | 2002-02-06 | 氮基喜树碱衍生物 |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US6403604B1 (zh) |
| EP (1) | EP1383772B1 (zh) |
| JP (1) | JP4584538B2 (zh) |
| KR (1) | KR100853141B1 (zh) |
| CN (1) | CN1246323C (zh) |
| AT (1) | ATE338047T1 (zh) |
| CA (1) | CA2439787C (zh) |
| DE (1) | DE60214359T2 (zh) |
| ES (1) | ES2274020T3 (zh) |
| IL (2) | IL157669A0 (zh) |
| MX (1) | MXPA03007896A (zh) |
| NZ (1) | NZ528115A (zh) |
| WO (1) | WO2002070525A2 (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US12029736B2 (en) | 2020-02-25 | 2024-07-09 | Mediboston Limited | Camptothecin derivatives and conjugates thereof |
Families Citing this family (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6150343A (en) * | 1993-06-30 | 2000-11-21 | University Of Pittsburgh | Camptothecin analogs and methods of preparation thereof |
| US6492380B1 (en) * | 1999-05-17 | 2002-12-10 | Queen's University At Kingston | Method of inhibiting neurotrophin-receptor binding |
| US6350756B1 (en) | 2001-01-18 | 2002-02-26 | California Pacific Medical Center | Camptothecin derivatives |
| US6855720B2 (en) * | 2001-03-01 | 2005-02-15 | California Pacific Medical Center | Nitrogen-based camptothecin derivatives |
| US6403604B1 (en) * | 2001-03-01 | 2002-06-11 | California Pacific Medical Center | Nitrogen-based camptothecin derivatives |
| US20040034050A1 (en) * | 2002-06-03 | 2004-02-19 | Yang Li-Xi | Homo-camptothecin derivatives |
| AU2003243380A1 (en) * | 2002-06-03 | 2003-12-19 | California Pacific Medical Center | Nitrogen-based homo-camptothecin derivatives |
| FR2889527A1 (fr) * | 2005-08-05 | 2007-02-09 | Servier Lab | Nouveaux composes analogues de la camptothecine, leur procede de preparation et les compositions pharmaceutiques qui les contiennent |
| FR2889528B1 (fr) * | 2005-08-05 | 2007-09-07 | Servier Lab | Nouveaux composes analogues de la camptothecine, leur procede de preparation et les compositions pharmaceutiques qui les contiennent |
| JP2009507861A (ja) | 2005-09-15 | 2009-02-26 | ペインセプター ファーマ コーポレーション | ニューロトロフィン媒介性活性を調節する方法 |
| US7875602B2 (en) * | 2005-10-21 | 2011-01-25 | Sutter West Bay Hospitals | Camptothecin derivatives as chemoradiosensitizing agents |
| CN100586952C (zh) * | 2006-11-10 | 2010-02-03 | 中国药科大学 | 噁唑骈喜树碱酯衍生物及其制备方法和用途 |
| WO2009089537A2 (en) | 2008-01-11 | 2009-07-16 | Northwestern University | Anti-cancer compounds |
| KR20190049930A (ko) * | 2008-05-23 | 2019-05-09 | 더 유니버시티 오브 브리티쉬 콜롬비아 | 리포좀 나노입자에 사용하기 위한 변형된 약물 |
| EP2443125B1 (en) | 2009-06-17 | 2014-11-26 | Threshold Pharmaceuticals, Inc. | Camptothecin derivatives |
| US10391056B2 (en) | 2011-11-03 | 2019-08-27 | Taiwan Lipsome Company, LTD. | Pharmaceutical compositions of hydrophobic camptothecin derivatives |
| US10980798B2 (en) | 2011-11-03 | 2021-04-20 | Taiwan Liposome Company, Ltd. | Pharmaceutical compositions of hydrophobic camptothecin derivatives |
| CN109575044A (zh) * | 2018-12-21 | 2019-04-05 | 西安交通大学 | 2-(喜树碱-10-氧基)乙酰胺类化合物和应用 |
| CN118221763A (zh) * | 2019-03-29 | 2024-06-21 | 免疫医疗有限公司 | 化合物及其缀合物 |
Family Cites Families (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4943579A (en) | 1987-10-06 | 1990-07-24 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Water soluble prodrugs of camptothecin |
| GB9320781D0 (en) | 1993-10-08 | 1993-12-01 | Erba Carlo Spa | Polymer-bound camptothecin derivatives |
| US5965566A (en) | 1993-10-20 | 1999-10-12 | Enzon, Inc. | High molecular weight polymer-based prodrugs |
| US5919455A (en) | 1993-10-27 | 1999-07-06 | Enzon, Inc. | Non-antigenic branched polymer conjugates |
| US5646159A (en) | 1994-07-20 | 1997-07-08 | Research Triangle Institute | Water-soluble esters of camptothecin compounds |
| GB9504065D0 (en) | 1995-03-01 | 1995-04-19 | Pharmacia Spa | Poly-pyrrolecarboxamidonaphthalenic acid derivatives |
| JPH08333370A (ja) * | 1995-06-08 | 1996-12-17 | Kyorin Pharmaceut Co Ltd | 水に可溶な新規フルオロエチルカンプトテシン誘導体、及びその製造方法 |
| US6339091B1 (en) | 1995-06-21 | 2002-01-15 | Societe De Conseils De Recherches Et D'applications Scientifiques (S.C.R.A.S.) | Comptothecin analogues, preparation methods therefor, use thereof as drugs, and pharmaceutical compositions containing said analogues |
| WO1997019085A1 (en) | 1995-11-22 | 1997-05-29 | Research Triangle Institute | Camptothecin compounds with combined topoisomerase i inhibition and dna alkylation properties |
| US6096336A (en) | 1996-01-30 | 2000-08-01 | The Stehlin Foundation For Cancer Research | Liposomal prodrugs comprising derivatives of camptothecin and methods of treating cancer using these prodrugs |
| US5731316A (en) | 1996-01-30 | 1998-03-24 | The Stehlin Foundation For Cancer Research | Derivatives of camptothecin and methods of treating cancer using these derivatives |
| BR9711319B1 (pt) | 1996-08-19 | 2009-08-11 | derivados de camptotecina altamente lipofìlicos. | |
| CA2264227A1 (en) | 1996-09-27 | 1998-04-02 | Raymond A. Firestone | Hydrolyzable prodrugs for delivery of anticancer drugs to metastatic cells |
| WO1998014459A1 (de) | 1996-09-30 | 1998-04-09 | Bayer Aktiengesellschaft | Glycokonjugate von modifizierten camptothecin-derivaten (20-o-verknüpfung) |
| SG116433A1 (en) | 1996-10-30 | 2005-11-28 | Tanabe Seiyaku Co | S type 2-substituted hydroxy-2-indolidinylbutyric ester compounds and process for preparation thereof. |
| UA57757C2 (uk) | 1996-12-20 | 2003-07-15 | Сос'Єте Де Консей Де Решерш Е Даплікасьон С'Єнтіфік (С.К.Р.А.С.) | Аналоги камптотецину, спосіб їх отримання (варіанти) і фармацевтична композиція |
| ID23424A (id) | 1997-05-14 | 2000-04-20 | Bayer Ag | Glikokonjugat dari 20(s)-kamptotesin |
| GB9721070D0 (en) | 1997-10-03 | 1997-12-03 | Pharmacia & Upjohn Spa | Bioactive derivatives of camptothecin |
| US6153655A (en) | 1998-04-17 | 2000-11-28 | Enzon, Inc. | Terminally-branched polymeric linkers and polymeric conjugates containing the same |
| US6057303A (en) | 1998-10-20 | 2000-05-02 | Bionumerik Pharmaceuticals, Inc. | Highly lipophilic Camptothecin derivatives |
| US6207832B1 (en) | 1999-04-09 | 2001-03-27 | University Of Pittsburgh | Camptothecin analogs and methods of preparation thereof |
| AU4822500A (en) | 1999-05-04 | 2000-11-17 | Bionumerik Pharmaceuticals, Inc. | Novel highly lipophilic camptothecin analogs |
| US6765019B1 (en) | 1999-05-06 | 2004-07-20 | University Of Kentucky Research Foundation | Permeable, water soluble, non-irritating prodrugs of chemotherapeutic agents with oxaalkanoic acids |
| US6288072B1 (en) * | 1999-12-29 | 2001-09-11 | Monroe E. Wall | Camptothecin β-alanine esters with topoisomerase I inhibition |
| US6350756B1 (en) | 2001-01-18 | 2002-02-26 | California Pacific Medical Center | Camptothecin derivatives |
| US6403604B1 (en) | 2001-03-01 | 2002-06-11 | California Pacific Medical Center | Nitrogen-based camptothecin derivatives |
| GB0119578D0 (en) | 2001-08-10 | 2001-10-03 | Pharmacia & Upjohn Spa | Fluoro linkers |
-
2001
- 2001-03-01 US US09/797,765 patent/US6403604B1/en not_active Expired - Lifetime
-
2002
- 2002-02-06 DE DE60214359T patent/DE60214359T2/de not_active Expired - Lifetime
- 2002-02-06 WO PCT/US2002/003798 patent/WO2002070525A2/en active IP Right Grant
- 2002-02-06 JP JP2002569845A patent/JP4584538B2/ja not_active Expired - Fee Related
- 2002-02-06 KR KR1020037011466A patent/KR100853141B1/ko not_active IP Right Cessation
- 2002-02-06 MX MXPA03007896A patent/MXPA03007896A/es active IP Right Grant
- 2002-02-06 NZ NZ528115A patent/NZ528115A/en not_active IP Right Cessation
- 2002-02-06 IL IL15766902A patent/IL157669A0/xx unknown
- 2002-02-06 AT AT02718930T patent/ATE338047T1/de not_active IP Right Cessation
- 2002-02-06 CA CA2439787A patent/CA2439787C/en not_active Expired - Fee Related
- 2002-02-06 ES ES02718930T patent/ES2274020T3/es not_active Expired - Lifetime
- 2002-02-06 EP EP02718930A patent/EP1383772B1/en not_active Expired - Lifetime
- 2002-02-06 CN CNB028090543A patent/CN1246323C/zh not_active Expired - Fee Related
- 2002-05-23 US US10/154,768 patent/US6825207B2/en not_active Expired - Fee Related
-
2003
- 2003-08-31 IL IL157669A patent/IL157669A/en not_active IP Right Cessation
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US12029736B2 (en) | 2020-02-25 | 2024-07-09 | Mediboston Limited | Camptothecin derivatives and conjugates thereof |
Also Published As
| Publication number | Publication date |
|---|---|
| US6403604B1 (en) | 2002-06-11 |
| EP1383772B1 (en) | 2006-08-30 |
| EP1383772A2 (en) | 2004-01-28 |
| MXPA03007896A (es) | 2004-06-07 |
| DE60214359D1 (en) | 2006-10-12 |
| DE60214359T2 (de) | 2007-08-30 |
| NZ528115A (en) | 2006-04-28 |
| ATE338047T1 (de) | 2006-09-15 |
| CA2439787A1 (en) | 2002-09-12 |
| KR20040002872A (ko) | 2004-01-07 |
| IL157669A (en) | 2010-11-30 |
| ES2274020T3 (es) | 2007-05-16 |
| KR100853141B1 (ko) | 2008-08-20 |
| CN1511159A (zh) | 2004-07-07 |
| WO2002070525A3 (en) | 2003-02-20 |
| US6825207B2 (en) | 2004-11-30 |
| CA2439787C (en) | 2011-05-24 |
| IL157669A0 (en) | 2004-03-28 |
| WO2002070525A2 (en) | 2002-09-12 |
| JP4584538B2 (ja) | 2010-11-24 |
| US20030073698A1 (en) | 2003-04-17 |
| JP2004529114A (ja) | 2004-09-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1246323C (zh) | 氮基喜树碱衍生物 | |
| CN1255392C (zh) | 作为血管生成抑制剂的秋水仙醇衍生物 | |
| CN1122668C (zh) | 环氧噻酮衍生物,其制备方法及其药物组合物 | |
| CN1027265C (zh) | 水溶性喜树碱类似物的制备方法 | |
| CN1553802A (zh) | 喜树碱衍生物 | |
| CN1255391C (zh) | 作为血管破坏剂的colchinol衍生物 | |
| CN1139592C (zh) | 喜树碱衍生物,其制备用途以及中间体 | |
| CN86100090A (zh) | 萘衍生物的制备方法 | |
| CN1747948A (zh) | 新n-单乙酰代邻苯二胺类、其稠合杂环衍生物及其作为药剂的应用 | |
| CN1431997A (zh) | 2-酰基吲哚衍生物及它们作为抗肿瘤剂的用途 | |
| CN88101588A (zh) | 制备1,4-二取代的哌嗪类化合物的方法 | |
| CN1043766C (zh) | 吲哚衍生物及其制法和它们在制备药物中的应用 | |
| CN1741995A (zh) | 异吲哚啉衍生物 | |
| CN1646528A (zh) | 作为有效的α2-肾上腺素受体拮抗剂的多环化合物 | |
| CN1226893A (zh) | 精选的K-252a衍生物 | |
| CN1668583A (zh) | 视黄醇衍生物、它们在治疗癌症和增强其它细胞毒性剂功效中的应用 | |
| CN1926113A (zh) | 新的酰氨基取代的羟基-6-苯基菲啶化合物及其作为pde4抑制剂的应用 | |
| CN1807413A (zh) | 咔唑磺酰胺衍生物及其制备方法 | |
| CN1031941C (zh) | 氟代乙基喜树碱衍生物的制备方法 | |
| CN1100425A (zh) | 噻唑并嘧啶衍生物 | |
| CN1106405A (zh) | 用于调节多药抗性的三取代嘧啶并[5,4-d]嘧啶类,及含有该化合物的药物组合物及其制备方法 | |
| CN1039026A (zh) | 制备三环的3-氧代-丙腈衍生物的方法 | |
| CN1247589C (zh) | 具有抗血管生成活性的吲哚的三环衍生物 | |
| CN100338066C (zh) | 六环化合物 | |
| CN1195757C (zh) | 光学纯的喜树碱类似物及组合物和用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C17 | Cessation of patent right | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20060322 Termination date: 20130206 |