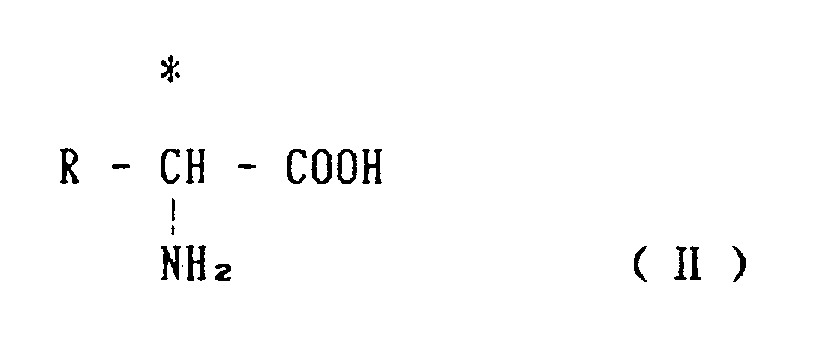CN1102672A - D-α氨基酸的制备方法 - Google Patents
D-α氨基酸的制备方法 Download PDFInfo
- Publication number
- CN1102672A CN1102672A CN93114421A CN93114421A CN1102672A CN 1102672 A CN1102672 A CN 1102672A CN 93114421 A CN93114421 A CN 93114421A CN 93114421 A CN93114421 A CN 93114421A CN 1102672 A CN1102672 A CN 1102672A
- Authority
- CN
- China
- Prior art keywords
- enzyme
- ala
- preparation
- arg
- deaminizating formyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P13/00—Preparation of nitrogen-containing organic compounds
- C12P13/04—Alpha- or beta- amino acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P41/00—Processes using enzymes or microorganisms to separate optical isomers from a racemic mixture
- C12P41/006—Processes using enzymes or microorganisms to separate optical isomers from a racemic mixture by reactions involving C-N bonds, e.g. nitriles, amides, hydantoins, carbamates, lactames, transamination reactions, or keto group formation from racemic mixtures
- C12P41/009—Processes using enzymes or microorganisms to separate optical isomers from a racemic mixture by reactions involving C-N bonds, e.g. nitriles, amides, hydantoins, carbamates, lactames, transamination reactions, or keto group formation from racemic mixtures by reactions involving hydantoins or carbamoylamino compounds
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S435/00—Chemistry: molecular biology and microbiology
- Y10S435/8215—Microorganisms
- Y10S435/822—Microorganisms using bacteria or actinomycetales
- Y10S435/874—Pseudomonas
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S435/00—Chemistry: molecular biology and microbiology
- Y10S435/8215—Microorganisms
- Y10S435/911—Microorganisms using fungi
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Health & Medical Sciences (AREA)
- General Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biotechnology (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Microbiology (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Analytical Chemistry (AREA)
- Enzymes And Modification Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
本发明涉及一种D-α-氨基酸的制备方法,该方
法是使用具有脱氨基甲酰基活性的酶作用于一种
N-氨基甲酰基-D-α-氨基酸,得到上述表示的
D-α-氨基酸。
Description
本发明涉及D-α-氨基酸的制备方法,该方法是使用具有脱氨基甲酰基活性的酶(以下称为“脱氨基甲酰基酶”)作用于用下述通式表示的D-N-氨基甲酰基-α-氨基酸,
[式中R是苯基,羟基取代的苯基,取代或未取代的最好是1-5个碳原子的烷基或亚硫酰基]得到用下述通式表示的D-α-氨基酸。
[式中的R定义同上]
这种旋光性的D-α-氨基酸类化合物是作为医药中间体,特别是半合成青霉素,半合成头孢菌素的中间体的重要化合物,例如可以举出其中的工业上极为有用的D-苯基甘氨酸和D-(4-羟苯基)甘氨酸(以下称为“D-PHG”)
从相应的D-N-氨基甲酰基-α-氨基酸类化合物通过脱氨基甲酰基得到D-α-氨基酸的制备方法是公知的,可用化学方法(特公昭58-4707)和利用微生物酶反应的方法(特公昭57-18793,63-20520,及特公平1-48758)来脱除上述氨基甲酰基。
但是,上述微生物酶,多数适用于PH为中性附近。将相应于D-α-氨基酸的DL-5取代海因,通过酶的作用将其D-异构体选择性地水解制得N-氨基甲酰基-D-α-氨基酸;继之通过脱氨基甲酰基酶的作用可得到D-α-氨基酸。因为在第一阶段对海因水解酶合适的PH值是8-9,因而第二阶段的脱氨基甲酰基酶的反应必须在不同的反应体系中进行。
在研究具有能够使D-N-氨基甲酰基类通过酶的作用脱除氨基甲酰基而转变为D-α-氨基酸的微生物方面,本发明人集中研究了各种原来不知道存在脱氨基甲酰基酶的菌属,结果发现属于Comamonas属,Blastobacter属,Alcaligenes属,Sporosarcina属,Rhizobium属,Bradyrhizobium属或Arthrobacter属的菌属具有脱除氨基甲酰基活性,从而完成了本发明。
也就是说,本发明是关于:以通式(Ⅰ)表示的N-氨基甲酰基-D-α-氨基酸
[式中R为苯基,被羟基取代的苯基,取代或末取代的最好是1-5个碳原子的烷基或亚硫酰基]在水溶性介质中,在微生物产生的酶的作用下,制备以通式(Ⅱ)表示的D-α-氨基酸的制备方法。
[式中R的定义同前]
本发明提供了用属于Comamonas属,Blastobacter属,Alcaligenes属,Sporosarcina属,Rhizobium属,Bradyrhizobium属或Arthrobacter属的微生物产生的酶,即将N-氨基甲酰基-D-α-氨基酸转变为D-α-氨基酸的脱氨基甲酰基酶为特征的D-α-氨基酸的制备方法。
虽然,在本发明中使用的脱氨基甲酰基酶对D-异构体有特异的作用,但也可使用对D-异构体或L-异构体均有作用的酶。另外,对D-N-氨基甲酰基-α-氨基酸有严格的立体选择性的酶被称为D-N-氨基甲酰基-α-氨基酸酰胺氢化酶。
在这些微生物中脱氨基甲酰基活性较高的菌株是Comamonas sp.E 222C(FERM BP 第13170号)、Comamonas sp.E 206a、Comamonas sp.E 217a、Blastobacter sp.NA 88-b Blastobacter sp. A17 p-4(FERM BP第13169号)、Alcaligenes sp.E 215(FERM BP 第13168号),Alcaligenes.xylosoxidans Subsp denitrificans CL66-2a,Sporosarcina sp.NCA 28-b(FERM BP第13174号)、Rhizobium sp. KNK 1415(FERM BP第_号)、Bradyrhizobium Japonicum IFO 14783、Bradyrhizobium sp.IFO 15003,Arthrobacter sp.CA 17-2(FERM BP 第_号)。
作为上述细菌的代表例,下面将Comamonas sp.E 222C、Blastobacter sp. A17 p-4、Alcaligenes sp.E 215、Sporosarcina sp.NCA 28-b、Rhizobium sp. KNK 1415和Arthrobacter sp.CA17-2的细菌学性质说明如下。
Comamonas sp.E222C
(a)形态特征
杆菌(弯曲的)
革兰氏染色性:可变的
有无孢子:无
菌落态:淡黄色,稍半透明,园形,规则的,正园形,有光泽,低的凸面,光滑,直径1mm(48 hr)
培养温度:37℃ +
(48 hr) 41℃ -
45℃ -
(b)生理学性质
放氧酶 +
氧化酶 -
葡糖发酵性 -
NO3还原性 -
生成吲哚 -
从葡糖生成酸 -
精氨酸脱氢酶 -
尿素酶 -
七叶灵(Aesculin)水分解 -
明胶水分解 -
β-半乳糖酶 -
细胞色素氧化酶 +(弱)
(c)同化能力
葡糖 -
阿拉伯糖 -
甘露糖 -
甘露糖醇 -
N-乙酰基葡糖胺 -
麦芽酚 -
葡糖酸 +
己酸 +
己二酸 -
苹果酸 +
柠檬酸 +
乙酸苯酯 +
Blastobacter sp. A 17 p-4
(a)形态特征
杆菌(卵型)
革兰氏染色性 阴性
有无孢子:无
菌落态:白色,稍半透明,园形,规则的,正园形,有光泽,低的凸面,平滑,生成类粘朊,直径1.0-1.5mm(48 hr)
培养温度:37℃ +
(48 hr) 41℃ -
45℃ -
(b)生理学性质
放氧酶 +
氧化酶 +(弱)
葡糖发酵性 -
NO3还原性 -
生成吲哚 -
从葡糖生成酸 -
精氨酸脱氢酶 -
尿素酶 +
七叶灵水分解 +
明胶水分解 -
β-半乳糖酶 +
细胞色素氧化酶 +(弱)
(c)同化能力
葡糖 +
阿拉伯糖 +
甘露糖 +
甘露糖醇 +
乙酰基葡糖胺 +
麦芽酚 +
葡糖酸 -
己酸 -
己二酸 -
苹果酸 -
柠檬酸 -
乙酸苯酯 -
Alcaligenes Sp.E215
(a)形态特征
杆菌
革兰氏染色性:可变
有无孢子:无
运动性:有
菌落态:淡黄色,稍半透明,园形,规则的,正园,低凸面,有光泽,光滑,直径1mm(48 hr)
培养温度:37℃ +
(48 hr) 41℃ -
45℃ -
(b)生理学性质
放氧酶 +
氧化酶 -
葡糖发酵性 -
Sporsarcina Sp.NCA 28-b
(a)形态特征
球菌
革兰氏染色性:可变
有无孢子:无
运动性:有
菌落态:园形,规则的,正园形,奶油色或白色,稍半透明,直径0.5mm以下(48 hr)
培养温度:37℃ -
45℃ -
(b)生理学性质
放氧酶 +
氧化酶 +
葡糖发酵性 -
Rhizobium Sp.KNK-1415(FERM BP-)
(a)形态特征
杆菌(稍呈棍棒状的短杆菌)
革兰氏染色性:阴性
有无孢子:无
边毛:极附近或周生
菌落态:稍黄色带白色,无光泽,真园形,大而光滑,稍凸
面,直径5mm(5天)生成类粘朊。
培养温度:30℃ +
37℃ ±
(b)生理学性质
放氧酶 +
氧化酶 +
葡糖发酵性 -
NO3还原性 +
生成吲哚 -
从葡糖生成酸 -
精氨酸脱氢酶 -
尿素酶 +
七叶灵水分解 +
明胶水分解 -
β-半乳糖酶 +
细胞色素氧化酶 +
生成3-羰基乳糖 -
生成H2S -
(c)同化能力
葡糖 +
阿拉伯糖 +
甘露糖 +
甘露糖醇 +
N-乙酰基葡糖胺 +
麦芽酚 +
葡糖酸 -
己酸 -
己二酸 -
苹果酸 -
柠檬酸 -
乙酸苯酯 -
GC含量 63.4%
醌分析 Q-10 95.7%
Q-9 3.3%
Q-11 0.6%
Q-8 0.4%
菌体脂肪酸分析
(全部菌体脂肪酸)
成分名 面积比(%)
3-OH C 14∶0 4.6
C 16∶1 5.9
C 16∶0 14.0
3-OH C 16∶0 0.1
C 18∶1 70.7
C 18∶0 3.3
未知物 1.4
(3-OH 脂肪酸)
成分名 面积比(%)
3-OH C 14∶0 88.8
3-OH C 16∶0 6.6
3-OH C 18∶0 4.6
(2-OH 脂肪酸)
未检出
Arthrobacter Sp.CA 17-2(FERM BP-4420)
(a)形态特征
杆菌或球菌
革兰氏染色性:阳性
有无孢子:无
运动性:有
菌落态:稍黄色带有白色,无光泽,园形,大小整齐,凸面,光滑,直径约0.5mm(2天)
培养温度:30℃ +
37℃ (+)
45℃ -
(b)生理学性质
放氧酶 +
氧化酶 -
葡糖发酵性 -
(c)化学分类学分析
肽聚糖氨基酸 L-赖氨酸
霉菌酸
脂肪酸组成:
反异C15∶0(12-甲基十四烷酸)58%
异C15∶0(13-甲基十四烷酸)5.5%
异C16∶0(14-甲基十五烷酸)8%
反异C17∶0(14-甲基十六烷酸)25%
用常规的方法培养微生物能够产生出上述脱氨基甲酰基活性的酶,虽然通常采用液体营养培养基进行培养,但也可以在固体表面进行培养。在培养其中通常含有同化的碳源、氮源各种微生物生长所必须的无机盐营养素。而且,加入少量D-对羟苯基甘氨酸,D-苯基甘氨酸等D-氨基酸;N-氨基甲酰基-DL-蛋氨酸,N-氨基甲酰基-D-苯基丙氨酸等N-氨基甲酰基-α-氨基酸类;DL-5-对羟苯基海因,DL-5-苯基海因等5取代海因类;尿嘧啶,二氢尿嘧啶,β-脲基丙酸等嘧啶代谢物;Fe2+,Fe3+,Be2+,Co2+,Al3+,Li+,Mn2+,Mg2+,Cs+等金属离子,尿素等对增强脱氨基甲酰基酶的能力是有宜的。这种脱氨基甲酰基酶增强培养基的浓度可选择金属离子0.1-10mM,其它基质0.01-1%重量范围。
培养温度为20-85%,PH值4-11,通气搅拌可促进微生物的生长。
对于D-N-氨基甲酰基-α-氨基酸的脱氨基甲酰基反应,可使用上述得到的微生物的培养液,菌体或菌体处理物作酶的来源。对于菌体当然可采用生菌体,但本发明可利用冻结的干燥菌体,以及菌体破碎物及菌体提取物,及用表面活性剂和超声波处理后的菌体作为酶源,进而可以从这些菌体的破碎物、提取物及处理所得到的精制的或部分精制的酶或粗酶的状态来使用,而且可将这种酶或粗酶固化作为固化酶使用。例如可使用WO PCT/JP 91/01696所述的固化方法。
而且从这些微生物通过基因得到的酶和直接从这些微生物得到的酶基本上是等效的。
脱氨基甲酰基反应在水溶性介质中进行,虽然可采用的PH值为6-11,但PH值为7-9.5特别好。而且具有PH值为8-9的酶更好。虽然脱氨基甲酰基反应的温度通常为20-85℃,但应根据使用的菌株采用对酶合适的温度。
对于本发明来说,作为脱氨基甲酰基酶基质的N-氨基甲酰基-D-α-氨基酸化合物的实例,可以举出:D-N-氨基甲酰基丙氨酸,D-N-氨基甲酰基蛋氨酸,D-N-氨基甲酰基缬氨酸,D-N-氨基甲酰基亮氨酸,D-N-氨基甲酰基甘氨酸,D-N-氨基甲酰基-(4-羟苯基)甘氨酸,D-N-氨基甲酰基-(2-亚硫酰基)甘氨酸,D-N-氨基甲酰基丙氨酸等。通式中的R是取代的烷基时,作为其取代基可以是苯基,吲哚基,烷硫基,羟基,氨基,羧基等。
上述通过微生物酶脱氨基甲酰基反应生成的D-α-氨基酸的分离,可采用浓缩,中和,离子交换法等公知技术。也就是说,对于D-苯基甘氨酸,D-(4-羟苯基)甘氨酸,D-亮氨酸和D-苯基丙氨酸等较疏水性的α-氨基酸,在除去酸性或碱性的不溶物以后,可以通过浓缩,中和等操作沉淀出所需的D-α-氨基酸;对于D-亚硫酰基甘氨酸、D-丝氨酸和D-丙氨酸等较亲水性的α-氨基酸,可通过同离子交换树脂吸附所需化合物,用氨水等洗脱,然后中和,浓缩等得到所需化合物。
作为上述脱氨基甲酰基基质的N-氨基甲酰基-D-氨基酸化合物,可以通过从各种属的微生物培养液,菌体,菌体处理物或菌体中提取出的酶与5-取代海因类化合物反应而制得。这种制备方法记载于特开昭53-44690,53-69884,53-91189,53-133688,54-84086及55-7001中。
用本发明的方法,可将上述D-氨基甲酰基-α-氨基酸类化合物转变成相应的旋光性的D-α-氨基酸类化合物。
用以下实施例具体地说明本发明
实施例1
将土酿试样(由日本各地采集)和2ml培养基A(1g/l KH2PO4,1g/l K2HPO4,0.3g/l MgSO47H20,0.1g.l酵母浸液,1g/l NH4Cl,1.5g/l下述记载的化合物作碳源,(PH0.7)或培养基B(1g/l KH2PO4,1g/l K2HPO4,0.3gl MgSO4·7H2O,0.5g/L葡糖,0.1g/L酸母浸液,1.5g/l下述记载的化合物作为氮源(ph 7.0)接种,于28℃及好氧条件下振荡培养,在同样的培养基中培养至微生物增殖。然后在平板培养基(含2%琼脂的和上述的培养基)扩展,于28℃培养2-6天,分离出微生物。
作为碳源或氮源的化合物:
N-氨基甲酰基-D-对羟苯基甘氨酸(C-D-HPG)
N-氨基甲酰基-D-苯基甘氨酸(C-D-PG)
N-氨基甲酰基-D-丙氨酸(C-D-Ala)
DL-5-甲基海因(DL-Ala-hyd)
DL-5-苯基海因(DL-PG-hyd)
DL-5-对羟苯基海因(DL-HPG-hyD)
瓜氨酸
苯基脲
氨基甲酸正丁酯
把各个平板培养基上的菌株悬浮于100ml反应液(35mM C-D-HPG,200mM磷酸钾缓冲液,PH7.0)里,于28℃反应1-3天后,用薄层色谱法分析氨基甲酰基D-HPG和D-HPG,使用默克公司制造的60F254板,用丁醇∶乙酸∶水=3∶3∶1(V/V/V)展开,用紫外线灯(254nm)或对(二甲氨基)肉桂醛和水合茚满三酮喷雾检出。其结果为,1868株能作为同化上述碳源或氮源的微生物被分离,其中37株产生D-HPG,其中16株显示出能良好地产生D-HPG(产生2mM以上的D-HPG)。
实施例2
对于实施例1得到的16株脱氨基甲酰基酶生产株,为了进行第2次筛选,用1ml培养基C(1.5g/l C-D-HPG,1g/l KH2PO4,1g/l K2HPO4,0.3g/l MgSO4·7H2O,3g/l酵母浸液,3g/l肉浸液,10g/l甘油,2g/l多胨(pH7.0)于28℃培养3天,将1ml培养液离心分离,将菌体悬浮和实施例1使用的同样的反应液100ml中,于30℃或50℃下反应24小时,再对生成的D-HPG进行定量。
对于D-HPG的定量,使用Cosmosil 5C18柱(φ4.6×250mm,纳拉第斯克(ナカラィテスク)公司制造),用水∶乙腈∶磷酸(95∶5∶0.01(V/V/V))作洗提液进行高速液体色谱(HPUC)分离,在254nm处测定吸光度,结果列于表1。
16株中的3株,E206a,E222c和E215,作为单一碳源培养C-D-Ala,在30℃下显出高的活性,E222C在30℃下生成30.8mM的D-HPG,于50℃下仅生3.5mM的D-HPG。另外三株即A17p-1,A17p-3和A17p-4,以单一碳源培养C-D-HPG,在50℃下显示出高的活性。A17p-4在50℃下生成28.8mM的D-HPG,在30℃下反生成2.5mM的D-HPG。
实施例3
得到的脱氨基甲酰酶的基质特异性
为了研究Comamonas sp.222和Blastobacter sp.A 17p-4脱氨基甲酰基酶的基质特异性,用实施例2所述的培养基C于28℃下将Comamonas sp.E222C基养一天,或者将Blastobacter sp.A17p-4振动培养7天,将3ml培养液离心分离,将该菌悬浮于300μl反应液(200mM磷取钾缓冲液,1%(W/V)的各种反应基质),Comamonas sp.E222C于30℃,Blastobacter sp.A 17p-4于50℃下分别反应24小时。
如表1所示,虽然两种菌体对于脂肪族和芳香族D-氨基酸的N-氨基甲酰基体均显示了很高的水解活性,但对于带极性基的氨基酸的N-氨基甲酰基体的活性低。另外Comamonas sp.E222C能水解尿基丙酸,Blastobacter sp.A 17p-4也具有海因酶活性。
表1新的脱氨基甲酰基酶的基质特性
氨基酸转化率
-:0%
+:<10%
++:<50%
+++:<80%
++++:100%
实施例4
Comamonas Sp.E222c株脱氨基甲酰基酶生产的增强物
在培养Comamonas Sp.E222c株时,研究增加脱氨基甲酰基酶产量的酶制备促进物。
在作为营养基的培养基D(1g/l KH2PO4,1g/l K2HPO4,0.3g/l MgSO·7H2O,3g/l肉浸液.10g/l甘油,2g/l多胨(PH 7.0))中以浓度为0.15%(W/V)加入图2所示化合物接种菌株后于28℃间歇振荡培养2天。
将1ml培养液离心分离,将菌体悬浮于100ml反应液(200mM)磷酸钾缓冲液(PH 7.0),35mM C-D-HPG),于30℃反应24小时,按照实施例2的方法用HPLC法定量生成的D-HPG。结果如图2所示,可以看出由于尿素,β-尿基丙酸,D-苯基甘氨酸,N-氨基甲酰基-DL-蛋氨酸而增加了活性。
实施例5
Comamonas sp.E222c生产的脱氨基甲酰基酶的精制
于28℃下将Comamonas sp.E222c用添加了β-脲基丙酸(0.15% W/V)的实施例4所述培养基D振荡培养3天,将共计3.61的培养基离心分离,分离出菌体,将该菌体悬浮于10mM磷酸钾缓冲液100ml中(PH 7.0),用超声波破碎,离心分离除去残渣,继续往该粗酶液中加硫酸铵,用离心分离得到从饱和浓度20%到40%碳酸铵的沉淀组分并溶于上述缓冲液中。
将177ml上述酶液用101上述缓冲液透析12小时,用DEAE-Sephacel柱(φ5×15cm)吸附,用0-1M的NaCl线性浓度梯度洗脱,收集活性组份,将该洗脱液的NaCl浓度调至4M,用PhenylSepharose CL-4B柱(φ1.5×15cm)吸附,用4-OM的NaCl线性浓度梯度洗脱,收集的活性组分用YM-10膜(阿密康社)进行超过滤浓缩。
将上述浓缩液(5ml)加到含0.2M NaCl的上述缓冲液中,用Sephacryl S-200 HR柱(φ1.8×80cm)进行凝胶过滤,活性成分经透析脱盐后,用羟磷灰石柱(φ1.2×10cm)吸附,用0-1M磷酸钾缓冲液(PH 7.0)线性浓度梯度洗脱、将活性组分(8.5ml)用10mM磷酸钾缓冲液(PH 7.0)500ml透析12小时,将其用Mono Q HR 5/5柱吸附,用0-1.0M NaCl线性浓度梯度洗脱,将此活性组分(1.2ml)作为精制酶液用于分析。
如表2所示,由于进行了精制,和细胞破碎上清液比较比活性提高了108倍,此时的酶活性回收率约为2%。另将10ml如此精制的酶按照King,J和Laemmli,U.K的方法(Journal of Molecular Biology 62,465-477(1971))用10%聚丙烯酰胺凝胶进行SDS-聚丙烯酰胺胶体电泳测定,如图3所示,在分子量38000处附近,得到单一的频带。
而且,用SephadexG-150柱(φ1.5×85cm),对含0.2M NaCl和0.1M二硫苏糖醇(DDT)的10ml磷酸钾缓冲液(PH 7.0)进行胶体过滤,如图4所示在分子量为111000附近被洗提出。
实施例6
Comamonas E222c脱氨基甲酰基酶的性质
用实施例5得到的酶,将Comamonas SP.E222c产生脱氨基甲酰基酶反应调制合适的PH值和适宜的温度。
用以下方法测定适宜反应的PH值。在PH 4.2-5.9时用醋酸一盐酸缓冲液,在PH 5.0-8.8时,用磷酸钾缓冲液,在PH 7.6-9.9时,用Tris-盐酸缓冲液在PH 8.9-11.1时用甘氨酸-NaOH缓冲液作为反应液(500μl)的缓冲液(浓度200mM),加10mM N-氨基甲酰基-D-苯基丙氨酸和酶液,将此反应液于30℃反应20分钟,加500μl乙醇使反应停止。
为了定量生成的D-苯基丙氨酸,往含有200mM磷酸钾缓冲液(PH 7.0),1.5mM 4-氨基安替比林,2.1mM 酚,2.25u 过氧化酶(由西洋芥茉得到,CALZ-YME Lab制造)及0.375单位的D-氨基酸氧化酶(西格马公司制造)的反应液中添加一份上述反应液(最终容量为500μl),于37℃反应60分钟,测定500nm处吸光度的增加。
反应的最佳温度,用以下方法确定:用磷酸钾缓冲液(PH 7.0)及和上述同样组成的反应液于10℃-80℃反应20分钟,用靛酚法[Bollter.W.T.等,Analytical Chimistry,33,592-594(1961)]测定生成的氨。
以上结果如图5和图6所示,Comamonas sp.E222c的脱氨基甲酰基酶适宜的PH值为8-9,适宜的反应温度为40℃。
实施例7
Comamonas SP.E222c株脱氨基甲酰基酶的氨基酸序列
用实施例5得到的酶液确定脱氨基甲酰基酶的氨基未端的氨基酸序列。将酶液用三得利康-10微型三得来仪(阿西康公司制造)脱盐,用脉冲式液相蛋白序列器进行解析其结果脱氨基甲酰基蛋白的氨基末端序列为:
1 5 10
Ser-Arg-lle-Val-Asn-Tyr-Ala-Ala-Ala-Gln-Leu-Gly-
15 20
Pro-lle-Gln-Arg-Ala-Asp-Ser-(Arg)-Ala-Asp-Val-Met
25 30
Glu-(Arg)-Leu-Leu-Ala-His
(第20号和第26号的Arg的峰不清楚,所以不能确定)
实施例8
Blastobacter SP.A17p-4株脱氨基甲酰基酶的增强物
在培养Blastobacter SP.A17p-4株时,研究了增加脱氨基甲酰基酶产量酶制备增强物。
向和实施例4用的相同的培养基D中添加0.15%(W/V),图7所示的化合物接种菌株,于28℃振荡培养3天。按照实施例4的方法,用HPLC定量反应温度仅40℃生成的D-HPG,发现如图7所示的那样,在添加尿嘧啶,二氢尿嘧啶或β-脲基丙酸的情况下,能够提高脱氨基甲酰基酶的产量。
进而,为了研究添加金属离子的效果,往培养基D里加0.15%(W/V)的尿嘧啶再加入2mM浓度的图8所示的金属离子。往培养基中接种菌种,于28℃下振荡培养4天,在定量生成的D-HPG时,发现如图8所示的那样,由于加入了Fe2+,Fe3+,Li+,Cs+,Be2+,Mg2+,Mn2+,Co2+,Al3+等离子,增加了脱氨基甲酰基酶的产量。
实施例9
Blastobacter SP.A17p-4脱氨基甲酰基酶的精制
往和实施例4用的同样的培养基中加0.15%(W/V)的尿嘧啶和2mM FeSO4·7H2O,往该培养基中接种Blastobacter SP.A17p-4,于28℃间歇振荡下培养7天。将合计4.8L培养液离心分离,菌体悬浮于120ml的10mM磷酸钾缓冲液中,用直径0.25mm的玻璃珠[Dyno-Mill KDL(瑞士)]于5℃下破碎20分钟,离心分离除去残渣,往粗酶液中加硫酸铵,用离心分离出饱和浓度为20%至40%沉淀出硫酸铵沉淀组分,并溶于上述缓冲液中。
将41ml上述酶液用5L上述缓冲液透析,按照实施例5的方法,用DEAE-Sephacel柱和Phenyl-Sepharose CL-6B柱精制,用超过滤浓缩,将该浓缩液(3mml)加到含0.2M的NaCl上述缓冲液中,用Sephadex G 150柱(φ1.5×80cm)进行凝胶过滤,用透析将活性组分脱盐后,按照实施例5的方法,用Mono QHR 5/5柱精制。将活性组分(2ml)作为精制酶液用于分析。如表3所示,精制的酶液和细胞破碎的上清液比较,比活性提高37倍,此时的酶活性回收率为2.3%。
将上述精制酶进行SDS-聚丙烯酰胺电泳,如图9所示,在分子量39000附近得到单一的频带,再者,按照实施例5的方法进行Sephadex G-150柱凝胶过滤时,如图10所示那样,在分子量为120000附近溶脱出。
实施例10
Blastobacter SP.A17p-4脱氨基甲酰基酶的性质
使用实施例9得到的酶液研究Blastobacter SP.A17p-4脱氨基甲酰基酶反应合适的PH值和合适的温度,无论那种场合均按实施例6的方法进行,其结果用图11和图12表示,Blastobacter SP.A17p-4脱氨基甲酰基酶反应的合适PH值为9,反应的合适温度为50℃。
实施例11
Blastobacter SP.A17p-4脱氨基甲酰基酶的氨基酸序列
用实施例9得到的酶液,用和实施例7相同的方法确定脱氨基甲酰基酶蛋白的氨基未端的氨基酸序列,该序列为:
1 5 10
Ala-Arg-Lys-Leu-Asn-Leu-Ala-Val-Ala-Gln-Leu-Gly-
15 20
Pro-Ile-Ala-Arg-Ala-Glu-Thr-Arg-Asp-Gln-Val-Val-
25 30 35
Ala-Arg-Leu-Met-Glu-Met-Met-Lys-Glu-Ala-Lys-Ser-
40
Ser-(Arg)-Gly-Thr
(38号的Arg峰不清楚,而不能确定)
实施例12
对于表4的Rhizobium属及Bradyrhizobium属的7株,向在1ml 805液体培养基(酵母浸液1g/l,甘露糖醇5g/l,K2HPO40.7g/l,KH2PO40.1g/l,MgSO4·7H2O 1g/l,C-D-HPG 1g/l(PH 7.0)中加C-D-HPG或C-D-Ala至浓度为1g/l的培养基中;接种,于30℃振荡培养24小时,离心分离收集菌体,并悬浮于0.5ml 1% C-D-HPG或C-D Ala,0.1M磷酸钾缓冲液(PH 7.0),0.1% TritonX-100中,于37℃边振荡边反应24小时后,按照实施例1方法用薄层色谱层析,如表4所示,可以看出Bradyrhizobium层菌株具有脱氨基甲酰基活性。
表4
菌株名称 脱氨基甲酰基酶活性
Rhizobium loti IFO 14779 ++
Rhizobium meliloti IFO 14782 ++
Rhizobium fredii IFO 14780 ++
Rhizobium galegae IFO 14965 ++
Rhizobium hualcuii IFO 15243 +
Bradyrhizobium Japonicum IFO 14783 +
Bradyrhizobium sp.IFO 15003 +
实施例13
按照实施例1的方法,进一步从土壤中进行筛选。把筛选物的N-氨基甲酰基-D-亮氨酸(C-D-Leu),N-氨基甲酰基-D-丙氨酸,(C-D-Ala),N-氨基甲酰基-D-苯基甘氨酸(C-D-PG)或DL-5-甲基海因(DL-Ala-byd)作碳源或氮源。在生长的菌体中,对9株使用C-D-Ala和C-D-HPG按照实施例12的同样方法研究脱氨基甲酰基活性,其结果如表5所示列出了对C-D-HPG活性高的菌株和对C-D-Ala活性高的菌株。
表5
菌株名 生长基质 活性
Rhizobium SP KNK1415 C-D-PG +++(C-D-HPG)
Alcaligenes.
Xylosoxidans Subsp
denitrificans CL66-2a C-D-Leu ++(C-D-HPG)
CL67-1 C-D-Leu ++(C-D-HPG)
CL85-1 C-D-Leu ++(C-D-HPG)
CA17-1 C-D-Ala +(C-D-Ala)
Arhrobacter
CA17-2 C-D-Ala ++(C-D-Ala)
CA77-2 C-D-Ala ++(C-D-Ala)
AH71-1 DL-Ala-hyd ++(C-D-Ala)
AH57-1 DL-Ala-hyd ++(C-D-Ala)
实施例14
将实施例3得到的Rhizobium SP KNK 1415接种于101 SE培养基中(蔗糖 23g/l),酵母浸液4g/l,尿素2g/l,KH2PO42g/l,Na2HPO42g/l,MgSO4·7H2O 1g/l,MnCl2·4H2O 0.01g/l(PH 6.5)),于30℃振荡培养40小时,离心分离收集菌体,用0.9%食盐水洗菌体后用超声波破碎菌体,离心分离除去残渣后,用硫酸精朊处理(0.1mg/mg蛋白)除去核酸,将离心后的上清液于50℃加热30分钟,离心除去变性蛋白,添加硫酸铵,使之成为30%饱和浓度,用离心分离收集沉淀,溶于500ml 20mM的Tris.HCl(PH 7.5),2mM的DTT,用同样的缓冲液透析后,用DEAE纤维素柱吸附,用10mM磷酸钠缓冲液(PH 7.2),0.15M NaCl,1mM DTT.洗提。将该洗提液用YM-10膜(阿密康公司制造)超过滤浓缩,将该酶液用SDS-聚丙烯酰胺凝胶电泳进行分析,在约35000附近该脱氨基甲酰基酶泳动。
实施例15
从分析实施例14得到的脱氨基甲酰基酶用的SDS-聚丙烯酰胺凝胶中切出脱氨基甲酰基酶带(band)的部分,在洗提缓冲液(50mM Tris.HCl(PH 7.5%),0.1% SDS,0.1mM EDTA,150mM NaCl,5mM DTT)均化在室温下洗提出。将该洗提液用超过滤浓缩,加在反相HPLC柱(AP-303;YMC公司制造)上,用乙腈浓度梯度洗提。将含脱氨基甲酰基酶的组分加在气相蛋白序列器上(阿布拉依特生物工程社制)解析后知道脱氨基甲酰基酶的具有(式5)的序列。
发现了用于制备抗菌素重要中间体的D-α-氨基酸的新的脱氨基甲酰基酶。和过去使用和条件不同,例如在PH 8-9及50℃下进行反应,能够有效地制备D-氨基酸。图的简要说明:
图1:表示根据筛选得到的菌株于50℃和30℃脱氨基甲酰基反应结果
图2:表示在培养Comamonas SP.E222c时,添加化合物对产生脱氨基甲酰基酶的影响
图3:表示在培养Comamonas SP.E222c精制脱氨基甲酰基酶用SDS-聚丙烯酰胺凝胶电泳分析的结果
图4:Comamonas SP.E222c精制脱氨基甲酰基酶用SepbadexG-150柱进行凝胶过滤的结果,
图5:表示用Comamonas SP.E222c精制脱氨基甲酰基酶对反应时的PH值的影响。
图6:表示用Comamonas SP.E222c精制脱氨基甲酰基酶,对反应时的温度的影响。
图7:表示Blastobacter SP.A17 P-4培养时,添加化合物对脱氨基甲酰基酶的影响
图8:表示Blastobacter SP.A17 P-4培养时,添加金属离子对脱氨基甲酰基酶的影响
图9:表示Blastobacter SP.A17 P-4精制脱氨基甲酰基酶用SDS-聚丙烯酰胺凝胶电泳分析的结果
图10:表示Blastobacter SP.A17 P-4精制脱氨基甲酰基酶,用Sepbadex G-150柱进行凝胶过滤的结果
图11:表示使用Blastobacter SP.A17 P-4精制脱氨基甲酰基酶对反应中PH值的影响。
图12:表示使用Blastobacter SP.A17 P-4精制脱氨基甲酰基酶对反应温度的影响。
图2,图7中纵坐标的说明:
1:无添加
2:尿素
3:苄基尿素
4:N-氨基甲酰肌氨酸
5:二氢尿嘧啶
6:尿嘧啶
7:β-脲基丙酸
8:D-丙氨酸
9:D-苯基甘氨酸
10:D-对羟苯基甘氨酸
11:N-氨基甲酰基丝氨酸
12:N-氨基甲酰基天冬氨酸
13:N-氨基甲酰基亮氨酸
14:N-氨基甲酰基蛋氨酸
15:N-氨基甲酰基历氨酸
16:N-氨基甲酰基-D-苯基丙氨酸
17:N-氨基甲酰基-D-苯基甘氨酸
18:N-氨基甲酰基-D-对羟苯基甘氨酸
19:L-5-羟甲基海因
20:L-5-羧甲基海因
21:DL-5-异丁基海因
22:DL-5-甲硫乙基海因
23:DL-5-甲基海因
24:DL-5-苄基海因
25:DL-5-苯基海因
26:DL-5-羟苯基海因
Claims (16)
2、权利要求1的制备方法,其中的微生物产生的脱氨基甲酰基酶以培养液,菌体,菌体破碎物,菌体提取物,菌体处理物,粗酶,精制酶固化菌体或固化酶形式作用。
3、权利要求1或2的制备方法,其中的微生物是Comamonas Sp.E222C(FERM BP 第13170号),Blastobacter Sp. A17 p-4(FERM BP 第13168号),Alcaligenes Sp.E215(FEMR BP 第13168号),Sporosarcina Sp.NCA 28-b(FERM BP第13174号),Rhizoblum Sp. KNK 1415(FERM BP第_号),Bradyrhi zobium japonicum IFO 14783,Bradyrhi zobium Sp.IFO 15003或Arthrobacter Sp.CA17-2(FERM BP 第_号)。
4、权利要求1或2的制备方法,其中使用的是在培养基中加入产生脱氨基甲酰基酶的增强物质培养微生物而产生脱氨基甲酰基酶。
5、权利要求4的制备方法,产生脱氨基甲酰基酶的增强物质为D-氨基酸,N-氨基甲酰基-α-氨基酸,5-取代海因类化合物,嘧啶代谢物或金属离子。
6、权利要求4的制备方法,其中的微生物是Comamonas属的微生物,产生增强物质为尿素,β-脲酰基丙酸,D-苯基甘氨酸,或N-氨基甲酰基DL-蛋氨酸。
7、权利要求4的制备方法,其中的微生物是Blastobacter属的微生物,产生增强物质为尿嘧啶,二氢尿嘧啶,β-脲基丙酸,Li+,Cs+,Be+,Mg2+,Mn2+,Fe2+,Fe3+,Co2+,或Al3+。
8、权利要求1的制备方法,其中保持水溶性质的PH为6-11。
9、权利要求1的制备方法,其中保持水溶性质的PH为7.5-9.5。
10、权利要求1的制备方法,其中是在40°-50℃下与脱氨基甲酰基酶作用。
11、适用于PH在8-9的脱氨基甲酰基酶。
12、适用于温度在40℃-50℃的脱氨基甲酰基酶。
13、Comamonas Sp.E222C,Blastobacter Sp.A17 p-4或Rhizobium Sp. KNK 1415产生的权利要求11或权利要求12记载的脱氨基甲酰基酶。
14、Comamonas Sp.E222C产生的权利要求13记载的脱氨基甲酰基酶,其中该酶的氨基末端的氨基酸序列用式3表示:
1 5 10
Ser-Arg-lle-Val-Asn-Tyr-Ala-Ala-Ala-Gln-Leu-Gly-
15 20
Pro-lle-Gln-Arg-Ala-Asp-Ser-(Arg)-Ala-Asp-Val-Met
25 30
Glu-(Arg)-Leu-Leu-Ala-His (3)
15、Blastobacter Sp.A17 p-4产生的权利要求13记载的脱氨基甲酰基酶,其中该酶的氨基末端的氨基酸序列为式4
1 5 10
Ala-Arg-Lys-Leu-Asn-Leu-Ala-Val-Ala-Gln-Leu-Gly-
15 20
Pro-Ile-Ala-Arg-Ala-Glu-Thr-Arg-Asp-Gln-Val-Val-
25 30 35
Ala-Arg-Leu-Met-Glu-Met-Met-Lys-Glu-Ala-Lys-Ser-
40
Ser-(Arg)-Gly-Thr (4)
16、Rhizobium Sp. KNK 1415产生的权利要求13记载的脱氨基甲酰基酶,其中该酶的氨基末端的氨基酸序列为式5
1 5
Thr-Arg-Gln-Met-Ile-Leu-Ala-Gly-Gln-(5)
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP26591492 | 1992-10-05 | ||
| JP265914/92 | 1992-10-05 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB981237320A Division CN1187444C (zh) | 1992-10-05 | 1993-10-05 | 具有脱氨基甲酰基活性的酶 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1102672A true CN1102672A (zh) | 1995-05-17 |
| CN1048524C CN1048524C (zh) | 2000-01-19 |
Family
ID=17423857
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB981237320A Expired - Fee Related CN1187444C (zh) | 1992-10-05 | 1993-10-05 | 具有脱氨基甲酰基活性的酶 |
| CN93114421A Expired - Fee Related CN1048524C (zh) | 1992-10-05 | 1993-10-05 | D-α氨基酸的制备方法 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB981237320A Expired - Fee Related CN1187444C (zh) | 1992-10-05 | 1993-10-05 | 具有脱氨基甲酰基活性的酶 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US5902736A (zh) |
| EP (1) | EP0628637B1 (zh) |
| KR (2) | KR100328111B1 (zh) |
| CN (2) | CN1187444C (zh) |
| DE (1) | DE69330343T2 (zh) |
| ES (1) | ES2159527T3 (zh) |
| SG (1) | SG55164A1 (zh) |
| WO (1) | WO1994008030A1 (zh) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5962279A (en) * | 1994-06-24 | 1999-10-05 | Kanegafuchi Kagaku Kogyo Kabushiki Kaisha | Process for producing D-amino acids with composite immobilized enzyme preparation |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4211840A (en) * | 1977-06-08 | 1980-07-08 | Ajinomoto Company, Incorporated | Method for producing D-α-amino acid |
| JPS557001A (en) * | 1978-03-15 | 1980-01-18 | Kanegafuchi Chem Ind Co Ltd | Preparation of n-carbamoyl-d-thienylglycine |
| IT1109506B (it) * | 1978-05-23 | 1985-12-16 | Snam Progetti | Processo enzimatico-microbiologico per la produzione di amminoacidi otticamente attivi a partire da idantoine e/o carbamil-derivati racemi |
| JPS5588697A (en) * | 1978-12-27 | 1980-07-04 | Ajinomoto Co Inc | Preparation of d-alpha-amino acid |
| JPS5718793A (en) * | 1980-07-08 | 1982-01-30 | Kao Corp | Granulation of coal-water slurry |
| DE3031151A1 (de) * | 1980-08-18 | 1982-04-15 | Basf Ag, 6700 Ludwigshafen | Verfahren zur herstellung von d-n-carbamoyl-(alpha)-aminosaeuren und mikroorganismen dafuer |
| JPS619292A (ja) * | 1984-06-25 | 1986-01-16 | Denki Kagaku Kogyo Kk | L−アミノ酸の製造方法 |
| JPS6225990A (ja) * | 1986-07-19 | 1987-02-03 | Kanegafuchi Chem Ind Co Ltd | D−α−アミノ酸類の製造方法 |
| JPS6448758A (en) * | 1987-08-20 | 1989-02-23 | Canon Kk | Recorder |
| JPS6471477A (en) * | 1987-09-11 | 1989-03-16 | Nippon Soda Co | Microbial strain capable of producing l-amino acid |
| ES2121001T3 (es) * | 1990-12-07 | 1998-11-16 | Kanegafuchi Chemical Ind | Procedimiento de produccion de d-alfa aminoacidos. |
| WO1994003613A1 (en) * | 1992-08-10 | 1994-02-17 | Kanegafuchi Kagaku Kogyo Kabushiki Kaisha | Dna coding for decarbamylase improved in thermostability and use thereof |
-
1993
- 1993-10-01 DE DE69330343T patent/DE69330343T2/de not_active Expired - Fee Related
- 1993-10-01 SG SG1996008489A patent/SG55164A1/en unknown
- 1993-10-01 WO PCT/JP1993/001408 patent/WO1994008030A1/ja active IP Right Grant
- 1993-10-01 ES ES93921099T patent/ES2159527T3/es not_active Expired - Lifetime
- 1993-10-01 US US08/244,657 patent/US5902736A/en not_active Expired - Fee Related
- 1993-10-01 EP EP93921099A patent/EP0628637B1/en not_active Expired - Lifetime
- 1993-10-01 KR KR1020007013779A patent/KR100328111B1/ko not_active IP Right Cessation
- 1993-10-01 KR KR1019940701912A patent/KR100293585B1/ko not_active IP Right Cessation
- 1993-10-05 CN CNB981237320A patent/CN1187444C/zh not_active Expired - Fee Related
- 1993-10-05 CN CN93114421A patent/CN1048524C/zh not_active Expired - Fee Related
-
1995
- 1995-06-07 US US08/479,639 patent/US5863785A/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| DE69330343T2 (de) | 2002-05-02 |
| EP0628637A1 (en) | 1994-12-14 |
| US5902736A (en) | 1999-05-11 |
| KR100293585B1 (ko) | 2001-09-17 |
| KR100328111B1 (ko) | 2002-03-09 |
| CN1187444C (zh) | 2005-02-02 |
| CN1221793A (zh) | 1999-07-07 |
| US5863785A (en) | 1999-01-26 |
| EP0628637B1 (en) | 2001-06-13 |
| SG55164A1 (en) | 1998-12-21 |
| EP0628637A4 (en) | 1997-03-05 |
| WO1994008030A1 (en) | 1994-04-14 |
| CN1048524C (zh) | 2000-01-19 |
| DE69330343D1 (de) | 2001-07-19 |
| ES2159527T3 (es) | 2001-10-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1057568C (zh) | D-α氨基酸的制备方法 | |
| CN1024022C (zh) | 一种生产2-酮基-l-古洛糖酸的方法 | |
| CN1032436A (zh) | 生物学生产酰胺的方法 | |
| CN87100031A (zh) | 2-芳基丙酸的制备方法 | |
| CN1366550A (zh) | (r)-2-辛醇脱氢酶,产生此酶的方法,编码此酶的dna,以及使用此酶生产醇类的方法 | |
| CN1054616A (zh) | 编码具有腈水化酶活性的多肽的dna片段、含该基因的转化株和用该转化株生产酰胺的方法 | |
| CN1172003C (zh) | N-乙酰神经氨酸的制造方法 | |
| CN1675371A (zh) | 具有α-H-α-氨基酸酰胺消旋酶活性的多肽和编码该多肽的核酸 | |
| CN1218040C (zh) | α-糖化氨基酸释放酶 | |
| CN1993464A (zh) | 新羰基还原酶、其基因及它们的使用方法 | |
| CN1171992C (zh) | L-脯氨酸4位羟基化酶的制备方法 | |
| CN1037617C (zh) | 酸性脲酶及其生产 | |
| CN1224697C (zh) | 氨基醇及其衍生物的制备方法 | |
| CN1209463C (zh) | 利用L-古洛糖酸-γ-内酯脱氢酶生产L-抗坏血酸的方法 | |
| CN1916164A (zh) | 生产D-N-氨基甲酰基-α-氨基酸的方法 | |
| CN1082108A (zh) | 微生物菌种w,含该微生物的酶组合物,该微生物的应用及尤其水解角蛋白的方法 | |
| CN1187444C (zh) | 具有脱氨基甲酰基活性的酶 | |
| CN1201794A (zh) | (1s,4r)-或(1r,4s)-4-(2-氨基-6-氯-9h-嘌呤-9-基)-2-环戊烯-1-甲醇或其盐的制备方法 | |
| CN1639328A (zh) | 新型脱氢酶和编码该脱氢酶的基因 | |
| CN1269950C (zh) | 酰胺的制备工艺 | |
| CN1517436A (zh) | 氧化还原酶 | |
| CN1829798A (zh) | 蛋白酶、编码该蛋白酶的dna、蛋白酶的制备方法 | |
| CN1213400A (zh) | N-保护d-脯氨酸衍生物的制备方法 | |
| CN1184311C (zh) | L-脯氨酸3位羟基化酶的制造方法 | |
| CN1254536C (zh) | 新型(r)-2-羟基-3-苯基丙酸(d-苯基乳酸)脱氢酶及其编码基因 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C19 | Lapse of patent right due to non-payment of the annual fee | ||
| CF01 | Termination of patent right due to non-payment of annual fee |