CN102134226B - 一类苯基c-葡萄糖苷衍生物、其制备方法和用途 - Google Patents
一类苯基c-葡萄糖苷衍生物、其制备方法和用途 Download PDFInfo
- Publication number
- CN102134226B CN102134226B CN2010105223370A CN201010522337A CN102134226B CN 102134226 B CN102134226 B CN 102134226B CN 2010105223370 A CN2010105223370 A CN 2010105223370A CN 201010522337 A CN201010522337 A CN 201010522337A CN 102134226 B CN102134226 B CN 102134226B
- Authority
- CN
- China
- Prior art keywords
- ring
- compound
- ethoxyphenyl
- phenyl
- stirred
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 title claims abstract description 50
- 238000002360 preparation method Methods 0.000 title claims abstract description 14
- 150000001875 compounds Chemical class 0.000 claims abstract description 74
- 239000000203 mixture Substances 0.000 claims abstract description 18
- 239000003814 drug Substances 0.000 claims abstract description 13
- 206010012601 diabetes mellitus Diseases 0.000 claims abstract description 12
- 239000007787 solid Substances 0.000 claims description 21
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 18
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical group C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 claims description 15
- 238000002347 injection Methods 0.000 claims description 11
- 239000007924 injection Substances 0.000 claims description 11
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 9
- CUFNKYGDVFVPHO-UHFFFAOYSA-N azulene Chemical compound C1=CC=CC2=CC=CC2=C1 CUFNKYGDVFVPHO-UHFFFAOYSA-N 0.000 claims description 8
- XKNAGLMNQADBQE-UHFFFAOYSA-N 1-(5-tert-butyl-1,2-oxazol-3-yl)-3-(4-pyridin-4-yloxyphenyl)urea Chemical compound O1C(C(C)(C)C)=CC(NC(=O)NC=2C=CC(OC=3C=CN=CC=3)=CC=2)=N1 XKNAGLMNQADBQE-UHFFFAOYSA-N 0.000 claims description 6
- JNCMHMUGTWEVOZ-UHFFFAOYSA-N F[CH]F Chemical compound F[CH]F JNCMHMUGTWEVOZ-UHFFFAOYSA-N 0.000 claims description 6
- 125000004432 carbon atom Chemical group C* 0.000 claims description 6
- VUWZPRWSIVNGKG-UHFFFAOYSA-N fluoromethane Chemical compound F[CH2] VUWZPRWSIVNGKG-UHFFFAOYSA-N 0.000 claims description 6
- 239000008194 pharmaceutical composition Substances 0.000 claims description 6
- 150000003839 salts Chemical class 0.000 claims description 6
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 claims description 6
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 claims description 6
- 125000003118 aryl group Chemical group 0.000 claims description 4
- 229910052739 hydrogen Inorganic materials 0.000 claims description 4
- 239000007788 liquid Substances 0.000 claims description 4
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 4
- 238000011282 treatment Methods 0.000 claims description 3
- IANQTJSKSUMEQM-UHFFFAOYSA-N 1-benzofuran Chemical group C1=CC=C2OC=CC2=C1 IANQTJSKSUMEQM-UHFFFAOYSA-N 0.000 claims description 2
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical group C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 claims description 2
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical group C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 claims description 2
- 238000009472 formulation Methods 0.000 claims description 2
- 239000000843 powder Substances 0.000 claims description 2
- 125000006273 (C1-C3) alkyl group Chemical group 0.000 claims 3
- 238000001802 infusion Methods 0.000 claims 2
- 125000004434 sulfur atom Chemical group 0.000 claims 2
- 238000004519 manufacturing process Methods 0.000 claims 1
- 229940079593 drug Drugs 0.000 abstract description 8
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 abstract description 3
- 229910052708 sodium Inorganic materials 0.000 abstract description 3
- 239000011734 sodium Substances 0.000 abstract description 3
- 239000003112 inhibitor Substances 0.000 abstract description 2
- 101710193897 Galactose transporter Proteins 0.000 abstract 1
- 101710103223 Galactose-proton symporter Proteins 0.000 abstract 1
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 135
- -1 alkyl lithium Chemical compound 0.000 description 53
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 45
- 238000002330 electrospray ionisation mass spectrometry Methods 0.000 description 39
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical class O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 38
- 239000000243 solution Substances 0.000 description 38
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 33
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 32
- 239000005457 ice water Substances 0.000 description 32
- 239000000284 extract Substances 0.000 description 31
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 24
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 24
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 24
- 238000006243 chemical reaction Methods 0.000 description 24
- 239000012230 colorless oil Substances 0.000 description 23
- AQRLNPVMDITEJU-UHFFFAOYSA-N triethylsilane Chemical compound CC[SiH](CC)CC AQRLNPVMDITEJU-UHFFFAOYSA-N 0.000 description 20
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 18
- HOVAGTYPODGVJG-UHFFFAOYSA-N methyl beta-galactoside Natural products COC1OC(CO)C(O)C(O)C1O HOVAGTYPODGVJG-UHFFFAOYSA-N 0.000 description 18
- 239000011541 reaction mixture Substances 0.000 description 18
- 238000003756 stirring Methods 0.000 description 18
- 238000001816 cooling Methods 0.000 description 17
- 238000000034 method Methods 0.000 description 17
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 16
- 230000002378 acidificating effect Effects 0.000 description 14
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 14
- 229960002246 beta-d-glucopyranose Drugs 0.000 description 13
- 238000007873 sieving Methods 0.000 description 12
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 11
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 11
- 229960001031 glucose Drugs 0.000 description 11
- 239000008103 glucose Substances 0.000 description 11
- KZMGYPLQYOPHEL-UHFFFAOYSA-N Boron trifluoride etherate Chemical compound FB(F)F.CCOCC KZMGYPLQYOPHEL-UHFFFAOYSA-N 0.000 description 10
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 10
- 238000001914 filtration Methods 0.000 description 10
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 10
- OBTZDIRUQWFRFZ-UHFFFAOYSA-N 2-(5-methylfuran-2-yl)-n-(4-methylphenyl)quinoline-4-carboxamide Chemical compound O1C(C)=CC=C1C1=CC(C(=O)NC=2C=CC(C)=CC=2)=C(C=CC=C2)C2=N1 OBTZDIRUQWFRFZ-UHFFFAOYSA-N 0.000 description 9
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 9
- CSJLBAMHHLJAAS-UHFFFAOYSA-N diethylaminosulfur trifluoride Chemical compound CCN(CC)S(F)(F)F CSJLBAMHHLJAAS-UHFFFAOYSA-N 0.000 description 9
- 238000001035 drying Methods 0.000 description 9
- 239000008187 granular material Substances 0.000 description 9
- DLEDOFVPSDKWEF-UHFFFAOYSA-N lithium butane Chemical compound [Li+].CCC[CH2-] DLEDOFVPSDKWEF-UHFFFAOYSA-N 0.000 description 9
- 229940098779 methanesulfonic acid Drugs 0.000 description 9
- HOVAGTYPODGVJG-XUUWZHRGSA-N methyl beta-D-glucopyranoside Chemical compound CO[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O HOVAGTYPODGVJG-XUUWZHRGSA-N 0.000 description 9
- 238000002156 mixing Methods 0.000 description 9
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 8
- 229940040526 anhydrous sodium acetate Drugs 0.000 description 8
- WTEOIRVLGSZEPR-UHFFFAOYSA-N boron trifluoride Chemical compound FB(F)F WTEOIRVLGSZEPR-UHFFFAOYSA-N 0.000 description 8
- 239000013078 crystal Substances 0.000 description 8
- 239000000706 filtrate Substances 0.000 description 8
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 8
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 8
- 238000010898 silica gel chromatography Methods 0.000 description 8
- NWUYHJFMYQTDRP-UHFFFAOYSA-N 1,2-bis(ethenyl)benzene;1-ethenyl-2-ethylbenzene;styrene Chemical compound C=CC1=CC=CC=C1.CCC1=CC=CC=C1C=C.C=CC1=CC=CC=C1C=C NWUYHJFMYQTDRP-UHFFFAOYSA-N 0.000 description 7
- 229910015900 BF3 Inorganic materials 0.000 description 7
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 7
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical class [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 7
- RBHJBMIOOPYDBQ-UHFFFAOYSA-N carbon dioxide;propan-2-one Chemical compound O=C=O.CC(C)=O RBHJBMIOOPYDBQ-UHFFFAOYSA-N 0.000 description 7
- 239000003729 cation exchange resin Substances 0.000 description 7
- 229920001971 elastomer Polymers 0.000 description 7
- 239000011347 resin Substances 0.000 description 7
- 229920005989 resin Polymers 0.000 description 7
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 6
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 6
- 229940123518 Sodium/glucose cotransporter 2 inhibitor Drugs 0.000 description 6
- 125000000217 alkyl group Chemical group 0.000 description 6
- 239000003795 chemical substances by application Substances 0.000 description 6
- 125000004216 fluoromethyl group Chemical group [H]C([H])(F)* 0.000 description 6
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 6
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 6
- 239000000126 substance Substances 0.000 description 6
- FMCAFXHLMUOIGG-JTJHWIPRSA-N (2s)-2-[[(2r)-2-[[(2s)-2-[[(2r)-2-formamido-3-sulfanylpropanoyl]amino]-3-methylbutanoyl]amino]-3-(4-hydroxy-2,5-dimethylphenyl)propanoyl]amino]-4-methylsulfanylbutanoic acid Chemical compound O=CN[C@@H](CS)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(=O)N[C@@H](CCSC)C(O)=O)CC1=CC(C)=C(O)C=C1C FMCAFXHLMUOIGG-JTJHWIPRSA-N 0.000 description 5
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 5
- 229920000881 Modified starch Polymers 0.000 description 5
- 229920002472 Starch Polymers 0.000 description 5
- 239000004480 active ingredient Substances 0.000 description 5
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 description 5
- 150000002148 esters Chemical class 0.000 description 5
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- 239000008108 microcrystalline cellulose Substances 0.000 description 5
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 5
- 229940016286 microcrystalline cellulose Drugs 0.000 description 5
- 239000008107 starch Substances 0.000 description 5
- 235000019698 starch Nutrition 0.000 description 5
- OEURLNJEQCLGPS-UHFFFAOYSA-N (5-bromo-2-chlorophenyl)-(4-ethoxyphenyl)methanone Chemical compound C1=CC(OCC)=CC=C1C(=O)C1=CC(Br)=CC=C1Cl OEURLNJEQCLGPS-UHFFFAOYSA-N 0.000 description 4
- LHABMHHRQYNLAN-UHFFFAOYSA-N 1-(5-bromo-2-chlorophenyl)-1-(4-ethoxyphenyl)ethanol Chemical compound BrC=1C=CC(=C(C1)C(C)(O)C1=CC=C(C=C1)OCC)Cl LHABMHHRQYNLAN-UHFFFAOYSA-N 0.000 description 4
- 238000005160 1H NMR spectroscopy Methods 0.000 description 4
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 4
- 239000002585 base Substances 0.000 description 4
- 210000004369 blood Anatomy 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- IJOOHPMOJXWVHK-UHFFFAOYSA-N chlorotrimethylsilane Chemical compound C[Si](C)(C)Cl IJOOHPMOJXWVHK-UHFFFAOYSA-N 0.000 description 4
- 125000000118 dimethyl group Chemical group [H]C([H])([H])* 0.000 description 4
- FPAFDBFIGPHWGO-UHFFFAOYSA-N dioxosilane;oxomagnesium;hydrate Chemical compound O.[Mg]=O.[Mg]=O.[Mg]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O FPAFDBFIGPHWGO-UHFFFAOYSA-N 0.000 description 4
- 239000012153 distilled water Substances 0.000 description 4
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 4
- 235000019359 magnesium stearate Nutrition 0.000 description 4
- VXWPONVCMVLXBW-UHFFFAOYSA-M magnesium;carbanide;iodide Chemical compound [CH3-].[Mg+2].[I-] VXWPONVCMVLXBW-UHFFFAOYSA-M 0.000 description 4
- 229910052760 oxygen Inorganic materials 0.000 description 4
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 4
- 239000000651 prodrug Chemical class 0.000 description 4
- 229940002612 prodrug Drugs 0.000 description 4
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 4
- AKMCSYFZZRJFBX-QYNCZWQASA-N (2s,3r,4r,5s,6r)-2-[4-chloro-3-[1-(4-ethoxyphenyl)-1-methoxyethyl]phenyl]-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound C1=CC(OCC)=CC=C1C(C)(OC)C1=CC([C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)=CC=C1Cl AKMCSYFZZRJFBX-QYNCZWQASA-N 0.000 description 3
- OUEAVRPYMJFFLT-KMOLRJMCSA-N (2s,3r,4r,5s,6r)-2-[4-chloro-3-[1-(4-ethoxyphenyl)ethyl]phenyl]-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound C1=CC(OCC)=CC=C1C(C)C1=CC([C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)=CC=C1Cl OUEAVRPYMJFFLT-KMOLRJMCSA-N 0.000 description 3
- KOJZDDZVYDZNEH-UHFFFAOYSA-N (5-bromo-2-chlorophenyl)-(4-ethoxyphenyl)methanol Chemical compound C1=CC(OCC)=CC=C1C(O)C1=CC(Br)=CC=C1Cl KOJZDDZVYDZNEH-UHFFFAOYSA-N 0.000 description 3
- HDUUESHOPCMWHX-UHFFFAOYSA-N 4-bromo-1-chloro-2-[(4-ethoxyphenyl)-fluoromethyl]benzene Chemical compound CCOC1=CC=C(C=C1)C(C2=C(C=CC(=C2)Br)Cl)F HDUUESHOPCMWHX-UHFFFAOYSA-N 0.000 description 3
- ZBAYJMYUYNGFGS-UHFFFAOYSA-N 4-bromo-1-chloro-2-[(4-ethoxyphenyl)-methoxymethyl]benzene Chemical compound BrC=1C=CC(=C(C1)C(OC)C1=CC=C(C=C1)OCC)Cl ZBAYJMYUYNGFGS-UHFFFAOYSA-N 0.000 description 3
- OWLLSLFMEQUBKD-UHFFFAOYSA-N 4-bromo-1-chloro-2-[1-(4-ethoxyphenyl)-1-fluoroethyl]benzene Chemical compound BrC=1C=CC(=C(C1)C(C)(F)C1=CC=C(C=C1)OCC)Cl OWLLSLFMEQUBKD-UHFFFAOYSA-N 0.000 description 3
- AUZVJEFNAUAFRQ-UHFFFAOYSA-N 4-bromo-1-chloro-2-[1-(4-ethoxyphenyl)-1-methoxyethyl]benzene Chemical compound BrC=1C=CC(=C(C1)C(C)(OC)C1=CC=C(C=C1)OCC)Cl AUZVJEFNAUAFRQ-UHFFFAOYSA-N 0.000 description 3
- AJBCFXLLZPEQRH-UHFFFAOYSA-N 4-bromo-1-chloro-2-[1-(4-ethoxyphenyl)ethyl]benzene Chemical compound BrC=1C=CC(=C(C1)C(C)C1=CC=C(C=C1)OCC)Cl AJBCFXLLZPEQRH-UHFFFAOYSA-N 0.000 description 3
- PCJSQQVMMYJSRQ-UHFFFAOYSA-N 4-bromo-1-chloro-2-[2-(4-ethoxyphenyl)propan-2-yl]benzene Chemical compound BrC=1C=CC(=C(C1)C(C)(C)C1=CC=C(C=C1)OCC)Cl PCJSQQVMMYJSRQ-UHFFFAOYSA-N 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- VSCWAEJMTAWNJL-UHFFFAOYSA-K aluminium trichloride Chemical compound Cl[Al](Cl)Cl VSCWAEJMTAWNJL-UHFFFAOYSA-K 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- 239000001768 carboxy methyl cellulose Substances 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- 239000003638 chemical reducing agent Substances 0.000 description 3
- 238000004440 column chromatography Methods 0.000 description 3
- 238000001704 evaporation Methods 0.000 description 3
- 239000012025 fluorinating agent Substances 0.000 description 3
- 235000012209 glucono delta-lactone Nutrition 0.000 description 3
- 229960003681 gluconolactone Drugs 0.000 description 3
- 238000004806 packaging method and process Methods 0.000 description 3
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 3
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 3
- 239000007779 soft material Substances 0.000 description 3
- 230000001954 sterilising effect Effects 0.000 description 3
- 229910052717 sulfur Inorganic materials 0.000 description 3
- ITMCEJHCFYSIIV-UHFFFAOYSA-N triflic acid Chemical compound OS(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-N 0.000 description 3
- ZSJDGWFSYYDXBV-KPMIJUJFSA-N (2s,3r,4r,5s,6r)-2-[4-chloro-3-[(4-ethoxyphenyl)-fluoromethyl]phenyl]-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound C1=CC(OCC)=CC=C1C(F)C1=CC([C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)=CC=C1Cl ZSJDGWFSYYDXBV-KPMIJUJFSA-N 0.000 description 2
- YJHNDVLNJRNPEO-PRYCNDIFSA-N (2s,3r,4r,5s,6r)-2-[4-chloro-3-[(4-ethoxyphenyl)-methoxymethyl]phenyl]-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound C1=CC(OCC)=CC=C1C(OC)C1=CC([C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)=CC=C1Cl YJHNDVLNJRNPEO-PRYCNDIFSA-N 0.000 description 2
- FFZFLRPRUGGPAD-QEXRHNKGSA-N (2s,3r,4r,5s,6r)-2-[4-chloro-3-[1-(4-ethoxyphenyl)-1-fluoroethyl]phenyl]-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound C1=CC(OCC)=CC=C1C(C)(F)C1=CC([C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)=CC=C1Cl FFZFLRPRUGGPAD-QEXRHNKGSA-N 0.000 description 2
- KJMSBEALEBZINR-BDHVOXNPSA-N (2s,3r,4r,5s,6r)-2-[4-chloro-3-[2-(4-ethoxyphenyl)propan-2-yl]phenyl]-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound C1=CC(OCC)=CC=C1C(C)(C)C1=CC([C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)=CC=C1Cl KJMSBEALEBZINR-BDHVOXNPSA-N 0.000 description 2
- 0 *C*c1ccccc1 Chemical compound *C*c1ccccc1 0.000 description 2
- HTSGKJQDMSTCGS-UHFFFAOYSA-N 1,4-bis(4-chlorophenyl)-2-(4-methylphenyl)sulfonylbutane-1,4-dione Chemical compound C1=CC(C)=CC=C1S(=O)(=O)C(C(=O)C=1C=CC(Cl)=CC=1)CC(=O)C1=CC=C(Cl)C=C1 HTSGKJQDMSTCGS-UHFFFAOYSA-N 0.000 description 2
- WPXONSYGPGWBPM-UHFFFAOYSA-N 2-(5-bromo-2-chlorophenyl)propan-2-ol Chemical compound CC(C)(O)C1=CC(Br)=CC=C1Cl WPXONSYGPGWBPM-UHFFFAOYSA-N 0.000 description 2
- 241000349731 Afzelia bipindensis Species 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- 102000004877 Insulin Human genes 0.000 description 2
- 108090001061 Insulin Proteins 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 239000002841 Lewis acid Substances 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- 241000699670 Mus sp. Species 0.000 description 2
- FIWILGQIZHDAQG-UHFFFAOYSA-N NC1=C(C(=O)NCC2=CC=C(C=C2)OCC(F)(F)F)C=C(C(=N1)N)N1N=C(N=C1)C1(CC1)C(F)(F)F Chemical compound NC1=C(C(=O)NCC2=CC=C(C=C2)OCC(F)(F)F)C=C(C(=N1)N)N1N=C(N=C1)C1(CC1)C(F)(F)F FIWILGQIZHDAQG-UHFFFAOYSA-N 0.000 description 2
- 229910018954 NaNH2 Inorganic materials 0.000 description 2
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical class [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- 102000003673 Symporters Human genes 0.000 description 2
- 108090000088 Symporters Proteins 0.000 description 2
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 2
- WGLPBDUCMAPZCE-UHFFFAOYSA-N Trioxochromium Chemical compound O=[Cr](=O)=O WGLPBDUCMAPZCE-UHFFFAOYSA-N 0.000 description 2
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 2
- 239000000853 adhesive Substances 0.000 description 2
- 230000001070 adhesive effect Effects 0.000 description 2
- 239000003708 ampul Substances 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical compound [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 2
- 125000002057 carboxymethyl group Chemical group [H]OC(=O)C([H])([H])[*] 0.000 description 2
- 125000001309 chloro group Chemical group Cl* 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 239000000945 filler Substances 0.000 description 2
- 238000007710 freezing Methods 0.000 description 2
- 230000008014 freezing Effects 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 125000005842 heteroatom Chemical group 0.000 description 2
- 229940125396 insulin Drugs 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 229960001375 lactose Drugs 0.000 description 2
- 150000007517 lewis acids Chemical class 0.000 description 2
- IHLVCKWPAMTVTG-UHFFFAOYSA-N lithium;carbanide Chemical compound [Li+].[CH3-] IHLVCKWPAMTVTG-UHFFFAOYSA-N 0.000 description 2
- 239000011777 magnesium Substances 0.000 description 2
- NXPHGHWWQRMDIA-UHFFFAOYSA-M magnesium;carbanide;bromide Chemical compound [CH3-].[Mg+2].[Br-] NXPHGHWWQRMDIA-UHFFFAOYSA-M 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- 229960001855 mannitol Drugs 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- AGJSNMGHAVDLRQ-HUUJSLGLSA-N methyl (2s)-2-[[(2r)-2-[[(2s)-2-[[(2r)-2-amino-3-sulfanylpropanoyl]amino]-3-methylbutanoyl]amino]-3-(4-hydroxy-2,3-dimethylphenyl)propanoyl]amino]-4-methylsulfanylbutanoate Chemical compound SC[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(=O)N[C@@H](CCSC)C(=O)OC)CC1=CC=C(O)C(C)=C1C AGJSNMGHAVDLRQ-HUUJSLGLSA-N 0.000 description 2
- AGJSNMGHAVDLRQ-IWFBPKFRSA-N methyl (2s)-2-[[(2s)-2-[[(2s)-2-[[(2r)-2-amino-3-sulfanylpropanoyl]amino]-3-methylbutanoyl]amino]-3-(4-hydroxy-2,3-dimethylphenyl)propanoyl]amino]-4-methylsulfanylbutanoate Chemical compound SC[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(=O)N[C@@H](CCSC)C(=O)OC)CC1=CC=C(O)C(C)=C1C AGJSNMGHAVDLRQ-IWFBPKFRSA-N 0.000 description 2
- 230000001035 methylating effect Effects 0.000 description 2
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 2
- DLRJIFUOBPOJNS-UHFFFAOYSA-N phenetole Chemical compound CCOC1=CC=CC=C1 DLRJIFUOBPOJNS-UHFFFAOYSA-N 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 159000000000 sodium salts Chemical class 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- ZGYICYBLPGRURT-UHFFFAOYSA-N tri(propan-2-yl)silicon Chemical compound CC(C)[Si](C(C)C)C(C)C ZGYICYBLPGRURT-UHFFFAOYSA-N 0.000 description 2
- 239000005051 trimethylchlorosilane Substances 0.000 description 2
- 210000002700 urine Anatomy 0.000 description 2
- ZOBPZXTWZATXDG-UHFFFAOYSA-N 1,3-thiazolidine-2,4-dione Chemical compound O=C1CSC(=O)N1 ZOBPZXTWZATXDG-UHFFFAOYSA-N 0.000 description 1
- YQTCQNIPQMJNTI-UHFFFAOYSA-N 2,2-dimethylpropan-1-one Chemical group CC(C)(C)[C]=O YQTCQNIPQMJNTI-UHFFFAOYSA-N 0.000 description 1
- FGERXQWKKIVFQG-UHFFFAOYSA-N 5-bromo-2-chlorobenzoic acid Chemical compound OC(=O)C1=CC(Br)=CC=C1Cl FGERXQWKKIVFQG-UHFFFAOYSA-N 0.000 description 1
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 1
- 229940077274 Alpha glucosidase inhibitor Drugs 0.000 description 1
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 1
- QBVUPCIRNXKYJR-HKNOCEQDSA-N CC(C)(c1ccc(-c(cc2)ccc2F)[s]1)c1cc([C@@H]([C@@H]([C@H]2O)O)O[C@H](CO)[C@H]2O)ccc1C Chemical compound CC(C)(c1ccc(-c(cc2)ccc2F)[s]1)c1cc([C@@H]([C@@H]([C@H]2O)O)O[C@H](CO)[C@H]2O)ccc1C QBVUPCIRNXKYJR-HKNOCEQDSA-N 0.000 description 1
- OUOLOWIIXXAMHW-MWFZDGHISA-N CC(C)(c1ccc(-c(cc2)ccc2F)[s]1)c1cc([C@@H]([C@@H]([C@H]2O)O)O[C@H](CO)[C@H]2O)ccc1Cl Chemical compound CC(C)(c1ccc(-c(cc2)ccc2F)[s]1)c1cc([C@@H]([C@@H]([C@H]2O)O)O[C@H](CO)[C@H]2O)ccc1Cl OUOLOWIIXXAMHW-MWFZDGHISA-N 0.000 description 1
- ZZKUQEASRNRLIQ-MWFZDGHISA-N CC(C)(c1ccc(-c(cc2)ccc2F)[s]1)c1cc([C@@H]([C@@H]([C@H]2O)O)O[C@H](CO)[C@H]2O)ccc1F Chemical compound CC(C)(c1ccc(-c(cc2)ccc2F)[s]1)c1cc([C@@H]([C@@H]([C@H]2O)O)O[C@H](CO)[C@H]2O)ccc1F ZZKUQEASRNRLIQ-MWFZDGHISA-N 0.000 description 1
- FYWRFIFWXCUMIN-WMYJMGEOSA-N CC(c1ccc(-c(cc2)ccc2F)[s]1)c1cc([C@@H]([C@@H]([C@H]2O)O)O[C@H](CO)[C@H]2O)ccc1C Chemical compound CC(c1ccc(-c(cc2)ccc2F)[s]1)c1cc([C@@H]([C@@H]([C@H]2O)O)O[C@H](CO)[C@H]2O)ccc1C FYWRFIFWXCUMIN-WMYJMGEOSA-N 0.000 description 1
- UJWNUFUBUSGRQD-LOZCZARCSA-N CC(c1ccc(-c(cc2)ccc2F)[s]1)c1cc([C@@H]([C@@H]([C@H]2O)O)O[C@H](CO)[C@H]2O)ccc1Cl Chemical compound CC(c1ccc(-c(cc2)ccc2F)[s]1)c1cc([C@@H]([C@@H]([C@H]2O)O)O[C@H](CO)[C@H]2O)ccc1Cl UJWNUFUBUSGRQD-LOZCZARCSA-N 0.000 description 1
- LJZCXIZCBLUXLT-LOZCZARCSA-N CC(c1ccc(-c(cc2)ccc2F)[s]1)c1cc([C@@H]([C@@H]([C@H]2O)O)O[C@H](CO)[C@H]2O)ccc1F Chemical compound CC(c1ccc(-c(cc2)ccc2F)[s]1)c1cc([C@@H]([C@@H]([C@H]2O)O)O[C@H](CO)[C@H]2O)ccc1F LJZCXIZCBLUXLT-LOZCZARCSA-N 0.000 description 1
- HUWMGYZLYHNQOC-RBHCUQLRSA-N C[C@@H]([C@@H]([C@@H](CO)O[C@H]1c2ccc(C)c(C(c3ccc(-c(cc4)ccc4F)[s]3)F)c2)O)[C@H]1O Chemical compound C[C@@H]([C@@H]([C@@H](CO)O[C@H]1c2ccc(C)c(C(c3ccc(-c(cc4)ccc4F)[s]3)F)c2)O)[C@H]1O HUWMGYZLYHNQOC-RBHCUQLRSA-N 0.000 description 1
- KWBCHIGTUTZZKH-PHNZBSFLSA-N Cc1ccc([C@@H]([C@@H]([C@H]2O)O)O[C@H](CO)[C@H]2O)cc1C(c1ccc(-c(cc2)ccc2F)[s]1)(F)F Chemical compound Cc1ccc([C@@H]([C@@H]([C@H]2O)O)O[C@H](CO)[C@H]2O)cc1C(c1ccc(-c(cc2)ccc2F)[s]1)(F)F KWBCHIGTUTZZKH-PHNZBSFLSA-N 0.000 description 1
- 229920002785 Croscarmellose sodium Polymers 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- PHOQVHQSTUBQQK-SQOUGZDYSA-N D-glucono-1,5-lactone Chemical compound OC[C@H]1OC(=O)[C@H](O)[C@@H](O)[C@@H]1O PHOQVHQSTUBQQK-SQOUGZDYSA-N 0.000 description 1
- JVHXJTBJCFBINQ-ADAARDCZSA-N Dapagliflozin Chemical compound C1=CC(OCC)=CC=C1CC1=CC([C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)=CC=C1Cl JVHXJTBJCFBINQ-ADAARDCZSA-N 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 229940124213 Dipeptidyl peptidase 4 (DPP IV) inhibitor Drugs 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 239000004366 Glucose oxidase Substances 0.000 description 1
- 108010015776 Glucose oxidase Proteins 0.000 description 1
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 1
- 229910010082 LiAlH Inorganic materials 0.000 description 1
- 229910010084 LiAlH4 Inorganic materials 0.000 description 1
- 239000012448 Lithium borohydride Substances 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- HSHXDCVZWHOWCS-UHFFFAOYSA-N N'-hexadecylthiophene-2-carbohydrazide Chemical compound CCCCCCCCCCCCCCCCNNC(=O)c1cccs1 HSHXDCVZWHOWCS-UHFFFAOYSA-N 0.000 description 1
- UWMQQVYKEDZZTF-OSKXVONFSA-N OC[C@H]([C@H]([C@@H]([C@H]1O)O)O)O[C@H]1c(cc1C(c2ccc(-c(cc3)ccc3F)[s]2)(F)F)ccc1Cl Chemical compound OC[C@H]([C@H]([C@@H]([C@H]1O)O)O)O[C@H]1c(cc1C(c2ccc(-c(cc3)ccc3F)[s]2)(F)F)ccc1Cl UWMQQVYKEDZZTF-OSKXVONFSA-N 0.000 description 1
- RMCJLNVUAHMSGG-OSKXVONFSA-N OC[C@H]([C@H]([C@@H]([C@H]1O)O)O)O[C@H]1c(cc1C(c2ccc(-c(cc3)ccc3F)[s]2)(F)F)ccc1F Chemical compound OC[C@H]([C@H]([C@@H]([C@H]1O)O)O)O[C@H]1c(cc1C(c2ccc(-c(cc3)ccc3F)[s]2)(F)F)ccc1F RMCJLNVUAHMSGG-OSKXVONFSA-N 0.000 description 1
- ZVNYDRMWDWZYIU-PBYBADFXSA-N OC[C@H]([C@H]([C@@H]([C@H]1O)O)O)O[C@H]1c(cc1C(c2ccc(-c(cc3)ccc3F)[s]2)F)ccc1Cl Chemical compound OC[C@H]([C@H]([C@@H]([C@H]1O)O)O)O[C@H]1c(cc1C(c2ccc(-c(cc3)ccc3F)[s]2)F)ccc1Cl ZVNYDRMWDWZYIU-PBYBADFXSA-N 0.000 description 1
- WGZOUDCPVOLHJF-PBYBADFXSA-N OC[C@H]([C@H]([C@@H]([C@H]1O)O)O)O[C@H]1c(cc1C(c2ccc(-c(cc3)ccc3F)[s]2)F)ccc1F Chemical compound OC[C@H]([C@H]([C@@H]([C@H]1O)O)O)O[C@H]1c(cc1C(c2ccc(-c(cc3)ccc3F)[s]2)F)ccc1F WGZOUDCPVOLHJF-PBYBADFXSA-N 0.000 description 1
- NOFZOJZALFHRLE-ZIQFBCGOSA-N OC[C@H]([C@H]([C@@H]([C@H]1O)O)O)O[C@H]1c1ccccc1 Chemical compound OC[C@H]([C@H]([C@@H]([C@H]1O)O)O)O[C@H]1c1ccccc1 NOFZOJZALFHRLE-ZIQFBCGOSA-N 0.000 description 1
- RVGRUAULSDPKGF-UHFFFAOYSA-N Poloxamer Chemical compound C1CO1.CC1CO1 RVGRUAULSDPKGF-UHFFFAOYSA-N 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 229940100389 Sulfonylurea Drugs 0.000 description 1
- 229940123464 Thiazolidinedione Drugs 0.000 description 1
- CEROKNRONBSQKV-ZFHCVQKHSA-N [(2R,3R,4R,5S,6S)-3,4,5-triacetyloxy-6-[4-chloro-3-[(4-ethoxyphenyl)-methoxymethyl]phenyl]oxan-2-yl]methyl acetate Chemical compound CCOC1=CC=C(C=C1)C(C2=C(C=CC(=C2)[C@H]3[C@@H]([C@H]([C@@H]([C@H](O3)COC(=O)C)OC(=O)C)OC(=O)C)OC(=O)C)Cl)OC CEROKNRONBSQKV-ZFHCVQKHSA-N 0.000 description 1
- VBVKOYFYDRGABJ-ATMIITHASA-N [(2R,3R,4R,5S,6S)-3,4,5-triacetyloxy-6-[4-chloro-3-[1-(4-ethoxyphenyl)-1-fluoroethyl]phenyl]oxan-2-yl]methyl acetate Chemical compound CCOc1ccc(cc1)C(C)(F)c1cc(ccc1Cl)[C@@H]1O[C@H](COC(C)=O)[C@@H](OC(C)=O)[C@H](OC(C)=O)[C@H]1OC(C)=O VBVKOYFYDRGABJ-ATMIITHASA-N 0.000 description 1
- WQCJOPCKGPAPSR-VHXOKDBGSA-N [(2R,3R,4R,5S,6S)-3,4,5-triacetyloxy-6-[4-chloro-3-[1-(4-ethoxyphenyl)ethyl]phenyl]oxan-2-yl]methyl acetate Chemical compound CCOC1=CC=C(C=C1)C(C)C2=C(C=CC(=C2)[C@H]3[C@@H]([C@H]([C@@H]([C@H](O3)COC(=O)C)OC(=O)C)OC(=O)C)OC(=O)C)Cl WQCJOPCKGPAPSR-VHXOKDBGSA-N 0.000 description 1
- SMZFMLJBJCXJLL-MYOTWTRRSA-N [(2R,3R,4R,5S,6S)-3,4,5-triacetyloxy-6-[4-chloro-3-[2-(4-ethoxyphenyl)propan-2-yl]phenyl]oxan-2-yl]methyl acetate Chemical compound C(C)(=O)O[C@H]1[C@@H](O[C@@H]([C@H]([C@@H]1OC(C)=O)OC(C)=O)COC(C)=O)C1=CC(=C(C=C1)Cl)C(C1=CC=C(C=C1)OCC)(C)C SMZFMLJBJCXJLL-MYOTWTRRSA-N 0.000 description 1
- 210000000683 abdominal cavity Anatomy 0.000 description 1
- WETWJCDKMRHUPV-UHFFFAOYSA-N acetyl chloride Chemical compound CC(Cl)=O WETWJCDKMRHUPV-UHFFFAOYSA-N 0.000 description 1
- 239000012346 acetyl chloride Substances 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 150000001263 acyl chlorides Chemical class 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 125000002947 alkylene group Chemical group 0.000 description 1
- 239000003888 alpha glucosidase inhibitor Substances 0.000 description 1
- PQLAYKMGZDUDLQ-UHFFFAOYSA-K aluminium bromide Chemical compound Br[Al](Br)Br PQLAYKMGZDUDLQ-UHFFFAOYSA-K 0.000 description 1
- 229940127003 anti-diabetic drug Drugs 0.000 description 1
- 239000003472 antidiabetic agent Substances 0.000 description 1
- 150000001491 aromatic compounds Chemical class 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- FUFJGUQYACFECW-UHFFFAOYSA-L calcium hydrogenphosphate Chemical compound [Ca+2].OP([O-])([O-])=O FUFJGUQYACFECW-UHFFFAOYSA-L 0.000 description 1
- 235000011132 calcium sulphate Nutrition 0.000 description 1
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 1
- 238000006555 catalytic reaction Methods 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 239000001767 crosslinked sodium carboxy methyl cellulose Substances 0.000 description 1
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 1
- 229960003834 dapagliflozin Drugs 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 235000019700 dicalcium phosphate Nutrition 0.000 description 1
- 229910001873 dinitrogen Inorganic materials 0.000 description 1
- 239000003603 dipeptidyl peptidase IV inhibitor Substances 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000007919 dispersible tablet Substances 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- NLFBCYMMUAKCPC-KQQUZDAGSA-N ethyl (e)-3-[3-amino-2-cyano-1-[(e)-3-ethoxy-3-oxoprop-1-enyl]sulfanyl-3-oxoprop-1-enyl]sulfanylprop-2-enoate Chemical compound CCOC(=O)\C=C\SC(=C(C#N)C(N)=O)S\C=C\C(=O)OCC NLFBCYMMUAKCPC-KQQUZDAGSA-N 0.000 description 1
- AMGWDYLEMSMUIO-UHFFFAOYSA-N ethyl 5-bromo-2-chlorobenzoate Chemical compound CCOC(=O)C1=CC(Br)=CC=C1Cl AMGWDYLEMSMUIO-UHFFFAOYSA-N 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 230000004153 glucose metabolism Effects 0.000 description 1
- 229940116332 glucose oxidase Drugs 0.000 description 1
- 235000019420 glucose oxidase Nutrition 0.000 description 1
- 230000002641 glycemic effect Effects 0.000 description 1
- 231100000304 hepatotoxicity Toxicity 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 1
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- 230000002218 hypoglycaemic effect Effects 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 239000012442 inert solvent Substances 0.000 description 1
- 239000003978 infusion fluid Substances 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 239000012280 lithium aluminium hydride Substances 0.000 description 1
- 230000007056 liver toxicity Effects 0.000 description 1
- 238000011866 long-term treatment Methods 0.000 description 1
- 229940031703 low substituted hydroxypropyl cellulose Drugs 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- XZWYZXLIPXDOLR-UHFFFAOYSA-N metformin Chemical compound CN(C)C(=N)NC(N)=N XZWYZXLIPXDOLR-UHFFFAOYSA-N 0.000 description 1
- 229960003105 metformin Drugs 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 229960000502 poloxamer Drugs 0.000 description 1
- 229920001983 poloxamer Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 210000000512 proximal kidney tubule Anatomy 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 238000007789 sealing Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000012279 sodium borohydride Substances 0.000 description 1
- 229910000033 sodium borohydride Inorganic materials 0.000 description 1
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical class [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- YROXIXLRRCOBKF-UHFFFAOYSA-N sulfonylurea Chemical class OC(=N)N=S(=O)=O YROXIXLRRCOBKF-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-N sulfuric acid Substances OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
- 230000004584 weight gain Effects 0.000 description 1
- 235000019786 weight gain Nutrition 0.000 description 1
- 239000011592 zinc chloride Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H7/00—Compounds containing non-saccharide radicals linked to saccharide radicals by a carbon-to-carbon bond
- C07H7/04—Carbocyclic radicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H7/00—Compounds containing non-saccharide radicals linked to saccharide radicals by a carbon-to-carbon bond
- C07H7/06—Heterocyclic radicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/351—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom not condensed with another ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D309/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings
- C07D309/02—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings having no double bonds between ring members or between ring members and non-ring members
- C07D309/08—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D309/10—Oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/10—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings linked by a carbon chain containing aromatic rings
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Diabetes (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biotechnology (AREA)
- Biochemistry (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Obesity (AREA)
- Hematology (AREA)
- Endocrinology (AREA)
- Emergency Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Saccharide Compounds (AREA)
- Medicinal Preparation (AREA)
- Pyrane Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
Description
技术领域
本发明涉及与糖尿病相关的药物领域。具体而言,本发明涉及对糖尿病有治疗作用的含苯基C-葡萄糖苷结构的2型钠葡萄糖共转运子(SGLT2)抑制剂及其制备方法,以及含有它们的药物组合物。
背景技术
全球糖尿病患者目前大约有1.7亿左右,其中约绝大多数为II型(即非胰岛素依赖型)糖尿病患者。目前在临床使用的抗糖尿病药物主要有二甲双胍类、磺酰脲类、胰岛素类、噻唑烷二酮类、α-葡糖苷酶抑制剂类和二肽基肽酶-IV抑制剂类药物,这些药物具有良好的治疗效果,但长期治疗存在安全性问题,如:肝毒性,部分药物尚有体重增加等诸多问题。
2型钠葡萄糖共转运子(SGLT2)是近年来发现的治疗糖尿病的新靶点。SGLT2主要分布在肾脏近端小管,其作用是吸收尿中的葡萄糖,并将其返回到血液中,因此抑制SGLT2的就能够降低血液中葡萄糖浓度,这个方法从以往不同的途径降低了血糖水平。当SGLT2功能受阻时,尿液中将分泌更多的葡萄糖,这将有助于糖尿病患者保持正确的血糖水平。由于SGLT2抑制剂不介入葡萄糖代谢,它可以作为血糖控制主流方法的补充手段。
中国专利CN200610093189.9公开了下列结构的化合物作为SGLT2抑制剂:
其中,A为O,S,NH,(CH2)n,n=0-3。
中国专利CN200380110040.1公开了下列结构的化合物作为SGLT2抑制剂:
其中,A为共价键,O,S,NH,(CH2)n,n=1-3。
中国专利CN200480006761.2公开了下列结构的化合物作为SGLT2抑制剂:
其中,X为共价键或低级亚烷基。
WO2005/012326公开了下列结构的化合物作为SGLT2抑制剂:
本发明提供了一类苯基C-葡萄糖苷类衍生物作为新型的SGLT2抑制剂,这些抑制剂为进一步可以用于治疗糖尿病,特别是非胰岛素依赖型糖尿病的药物打下了基础。
发明内容
本发明的一个目的是克服现有技术的缺点和不足,提供一种具有良好活性,具有通式I的化合物及其药学上可以接受的盐和前药酯。
本发明的另一个目的是提供制备具有通式I的化合物及其药学上可以接受的盐和前药酯的方法。
本发明的再一个目的是提供含有通式I的化合物及其药学上可以接受的盐和前药酯作为有效成分,以及一种或多种药学上可接受的载体、赋形剂或稀释剂的药用组合物,及其在治疗糖尿病方面的应用。
现结合本发明的目的对本发明内容进行具体描述。
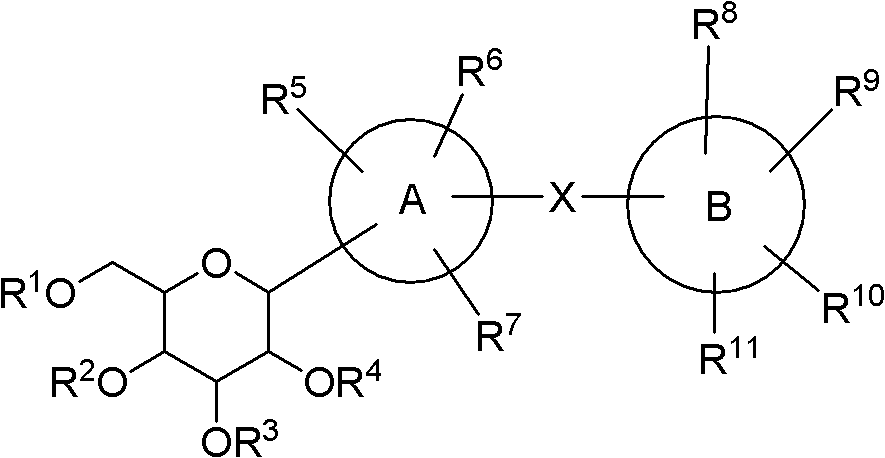
本发明具有通式I的化合物具有下述结构式:
其中,
R1、R2、R3、R4独立选自H,F,Cl,Br,I,OH,OR7,SR8,OCF3,CF3,CHF2,CH2F,C1-C3的烷基,含3-5个碳原子的环烷基,其中R7和R8独立选自C1-C3的烷基,上述烷基或者环烷基均可以被一个或多个F、Cl原子取代。
环A选自芳香性的单环和芳香性的二环,芳香性的二环中的两个环可以为并环也可以为两个独立芳香环通过共价键连接,上述所指的芳香性的单环和芳香性的二环为5-12元环并且可以被一到三个选自O、S、N的杂原子所取代。环A可以以任意可能的位置与化合物I的其它部分连接。
R5和R6的定义选自如下几种情况:
(1)R5=R6=F;
(2)R5=R6=Me;
(3)R5=Me,R6=OMe;
(4)R5=Me,R6=H;
(5)R5=Me,R6=F;
(6)R5=F,R6=H;
(7)R5=OMe,R6=H;
优选以下通式I化合物,
其中,
R1、R2、R3、R4独立选自H,F,Cl,OR7,SR8,OCF3,CF3,CHF2,CH2F,C1-C3的烷基,含3-5个碳原子的环烷基,其中R7和R8独立选自C1-C3的烷基,上述烷基或者环烷基均可以被一个或多个F、Cl原子取代。
环A选自芳香性的单环和芳香性的二环,芳香性的二环中的两个环可以为并环也可以为两个独立芳香环通过共价键连接,上述所指的芳香性的单环和芳香性的二环为5-12元环并且可以被一到两个选自O、S的杂原子所取代。环A可以以任意可能的位置与化合物I的其它部分连接。
R5和R6的定义优选自如下几种情况:
(1)R5=R6=F;
(2)R5=R6=Me;
(3)R5=Me,R6=H;
(4)R5=Me,R6=F;
(5)R5=F,R6=H;
更优选以下具有通式I的化合物,
其中,
R1、R2、R3、R4独立选自F,Cl,OR7,SR8,OCF3,CF3,CHF2,CH2F,C1-C3的烷基,含3-4个碳原子的环烷基,其中R7和R8独立选自C1-C3的烷基,上述烷基或者环烷基均可以被一个或多个F原子取代。
环A选自苯环,苯并噻吩环,苯并呋喃环,甘葡环烃(azulene),以任何可能的形式通过共价键连接的苯环和噻吩环,以任何可能的形式通过共价键连接的苯环和呋喃环,环A可以以任意可能的位置与化合物I的其它部分连接。
R5和R6的定义更优选自如下几种情况:
(1)R5=R6=F;
(2)R5=R6=Me;
(3)R5=Me,R6=H;
(4)R5=F,R6=H;
最优选通式I的化合物具有以下结构,
本发明所述通式I化合物通过以下步骤合成:
化合物II在碱存在下用三甲基硅基化试剂进行处理,得到化合物III,所用的碱如N-甲基吗啉、三乙胺、吡啶、4-二甲氨基吡啶等,三甲基硅基化试剂如三甲基氯硅烷等。
化合物IV用烷基锂试剂如正丁基锂处理,得到化合物V,化合物V不加分离在反应体系中直接与化合物II反应,得到化合物VI。化合物VI在酸如甲磺酸、三氟甲磺酸、对甲苯磺酸等催化下用甲醇处理,得到化合物VII。化合物VII在路易斯酸如BF3·Et2O、BF3·MeCN或者三氟乙酸等存在下用还原剂如三乙基硅烷、三异丙基硅烷等还原得到化合物VIII。化合物VIII用在碱如无水醋酸钠、吡啶、4-二甲氨基吡啶等存在下用醋酸酐、乙酰氯等试剂乙酰化得到IX。化合物IX用柱层析或者重结晶等方法处理,得到化合物X。化合物X用碱如甲醇钠、NaOH、KOH等处理,脱掉乙酰基得到化合物I。
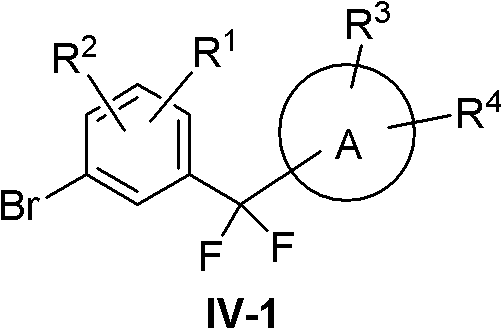
化合物IV因取代基R5和R6的不同可以采用下列方法制备。
(1)R5=R6=F
此时化合物IV变成IV-1:
化合物IV-1采用下列路线合成:
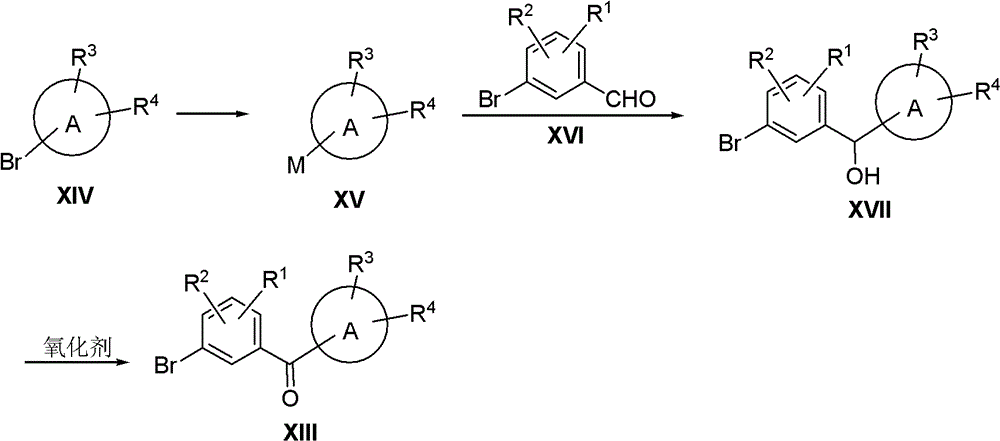
酰氯XI在Lewis酸如AlCl3、AlBr3、BF3或ZnCl2等存在下与芳香性化合物XII反应,得到化合物XIII。化合物XIII与氟化剂如SF4或Et2NSF3等反应得到化合物IV-1。
上述路线中的XIII也可以通过下列路线合成:
化合物XIV用n-BuLi或者金属Mg等处理后得到化合物XV,XV与化合物XVI反应,得到化合物XVII。化合物XVII使用氧化剂如CrO3/H2SO4等氧化,得到化合物XIII。
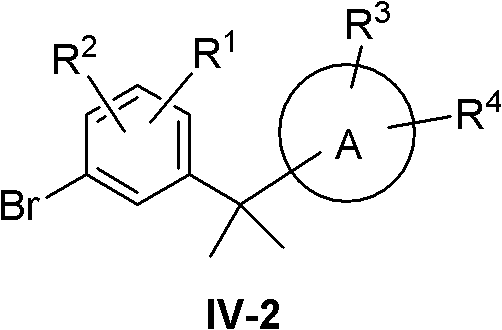
(2)R5=R6=Me
此时化合物IV变成IV-2:
化合物IV-2采用下列路线合成:
化合物XVIII用MeLi,MeMgI或MeMgBr等类似试剂处理,得到化合物XIX。化合物XIX在酸如甲磺酸,三氟甲磺酸,对甲苯磺酸或者浓硫酸等存在下与XII反应,得到化合物IV-2。
(3)R5=Me,R6=OMe
此时化合物IV变成IV-3:
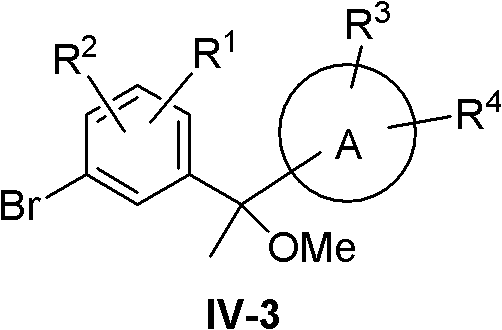
化合物IV-3采用下列路线合成:
化合物XIII用MeLi,MeMgI或MeMgBr等类似试剂处理,得到化合物XX,化合物XX在碱如NaH,KH或NaNH2等存在下用甲基化试剂如Me2SO4或MeI等处理,得到化合物IV-3。
上述路线中的化合物XX也可以通过下列方法合成:
化合物XIV用n-BuLi或者金属Mg等处理后得到化合物XV,XV与化合物XXI反应,得到化合物XX。
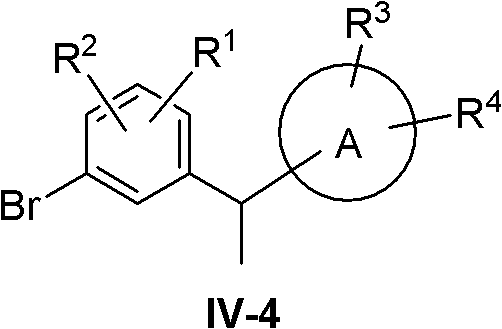
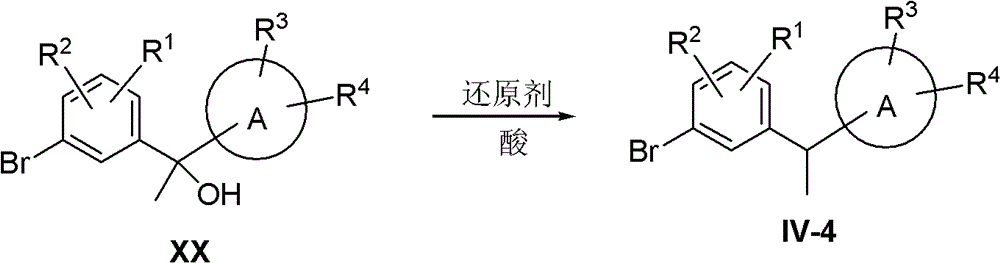
(4)R5=Me,R6=H
此时化合物IV变成IV-4:
化合物IV-4采用下列路线合成:
化合物XX在酸如BF3·Et2O或三氟乙酸等存在下用还原剂如三乙基硅烷或三异丙基硅烷等还原,得到化合物IV-4。
(5)R5=Me,R6=F
此时化合物IV变成IV-5:
化合物IV-5采用下列路线合成:
化合物XX与氟化剂如SF4或Et2NSF3等反应得到化合物IV-5。
(6)R5=F,R6=H
此时化合物IV变成IV-6:
化合物IV-6采用下列路线合成:
化合物XVII与氟化剂如SF4或Et2NSF3等反应得到化合物IV-6。
化合物XVII可以由化合物XIII还原得到,这些还原剂包括NaBH4、KBH4、LiAlH4、LiBH4等。
(7)R5=OMe,R6=H
此时化合物IV变成IV-7:
化合物IV-7采用下列路线合成:
化合物XVII在碱如NaH,KH或NaNH2等存在下用甲基化试剂如Me2SO4或MeI等处理,得到化合物IV-7。
本发明所述式I化合物的药学上可接受的前药酯,包括分子中的任意一个或多个羟基与乙酰基、特戊酰基、各种磷酰基、氨基甲酰基、烷氧甲酰基等形成的酯。
本发明所述式I化合物,可以与一种或多种药学上可接受的载体、赋形剂或稀释剂共同制成药物组合物。该药物组合物可以制成固体口服制剂、液体口服制剂、注射剂等剂型。所述固体及液体口服制剂包括:片剂、分散片、糖衣剂、颗粒剂、干粉剂、胶囊剂和溶液剂。所述的注射剂包括:小针、大输液、冻干粉针等。
本发明的组合物,所述的药学或食品学上可接受辅料选自:填充剂、崩解剂、润滑剂、助流剂、泡腾剂、矫味剂、防腐剂、包衣材料、或其它赋形剂。
本发明的组合物,所述的药学或食品学上可接受辅料。填充剂为填充剂包括乳糖、蔗糖、糊精、淀粉、预胶化淀粉、甘露醇、山梨醇、磷酸氢钙、硫酸钙、碳酸钙、微晶纤维素的一种或几种的组合物;所述的粘合剂包括蔗糖、淀粉、聚维酮、羧甲基纤维素钠、羟丙甲纤维素、羟丙纤维素、甲基纤维素、聚乙二醇、药用乙醇、水的一种或几种的组合物;所述的崩解剂包括淀粉、交联聚微酮、交联羧甲基纤维素钠、低取代羟丙基纤维素、羧甲纤维素钠、泡腾崩解剂的一种或几种的组合物。
本发明所述通式I化合物具有SGLT2酶的抑制作用,可作为有效成分用于制备糖尿病方面的治疗药物。本发明所述通式I化合物的活性是通过体内降糖模型验证的。
本发明的通式I化合物在相当宽的剂量范围内是有效的。例如每天服用的剂量约在1mg-1000mg/人范围内,分为一次或数次给药。实际服用本发明通式I化合物的剂量可由医生根据有关的情况来决定。这些情况包括:被治疗者的身体状态、给药途径、年龄、体重、对药物的个体反应,症状的严重程度等。
具体实施方式
下面结合实施例对本发明作进一步的说明。需要说明的是,下述实施例仅是用于说明,而并非用于限制本发明。本领域技术人员根据本发明的教导所做出的各种变化均应在本申请权利要求所要求的保护范围之内。
实施例1
1-{4-氯-3-[(4-乙氧基苯基)二氟甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖
A.(5-溴-2-氯苯基)(4-乙氧基苯基)二氟甲烷
一只100mL的圆底烧瓶中加入2.35g(10mmol)5-溴-2-氯苯甲酸、1.40g(11mmol)草酰氯和5mL干燥的二氯甲烷,室温下电磁搅拌,滴加一滴N,N-二甲基甲酰胺。反应化合物在室温下搅拌过夜,而后在旋转蒸发仪上蒸去溶剂,得到的残余物溶解到5mL干燥的二氯甲烷中,加入1.34g(11mmol)苯乙醚,所得混合物在冰水浴冷却下电磁搅拌,而后慢慢分批加入无水三氯化铝1.73g(13mmol),加完后体系在室温下继续搅拌两小时。反应体系小心倾倒到冰水中,搅拌,用二氯甲烷100mL分两次萃取,合并萃取液体用饱和食盐水洗涤一次,用无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到的残余物经过柱层析纯化得到一无色晶体,为(5-溴-2-氯苯基)(4-乙氧基苯基)甲酮,2.89g,产率85%,ESI-MS,m/z=339.3([M(79Br)+1]),341.2([M(81Br)+1])。
上述2.89g(8.5mmol)(5-溴-2-氯苯基)(4-乙氧基苯基)甲酮溶解到5mL二氯甲烷中,加入5mL二乙氨基三氟化硫(Et2NSF3),反应体系通氮气保护后密闭,在80-100℃加热反应过夜。反应混合物冷却,倾倒到水中,用100mL二氯甲烷分两次萃取,合并萃取液,饱和食盐水洗涤,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到的残余物经过柱层析纯化得到一无色油状物,即为(5-溴-2-氯苯基)(4-乙氧基苯基)二氟甲烷,2.49g,产率81%,ESI-MS,m/z=361.2([M(79Br)+1]),363.3([M(81Br)+1])。
B.2,3,4,6-四-O-三甲基硅基葡萄糖酸内酯
一只250mL的圆底烧瓶中加入1.78g(10mmol)葡萄糖酸内酯、8.09g(80mmol)N-甲基吗啉和干燥四氢呋喃20mL,体系在冰水浴冷却下电磁搅拌,慢慢滴加6.52g(60mmol)的三甲基氯硅烷溶解到10mL干燥THF中得到的溶液。滴加完毕后,体系在室温下搅拌过夜,用100mL甲苯稀释,冰水冷却下往其中慢慢滴加10mL水,而后把所得混合物转移到分液漏斗中,依次用100mL饱和磷酸二氢钠溶液和饱和食盐水洗涤,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,为2,3,4,6-四-O-三甲基硅基葡萄糖酸内酯,在真空油泵上室温下干燥两小时,备用。4.68g,产率100%。
C.1-{4-氯-3-[(4-乙氧基苯基)二氟甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖
一只100mL的圆底烧瓶中加入上述制备的2.49g(6.9mmol)(5-溴-2-氯苯基)(4-乙氧基苯基)二氟甲烷,10mL干燥的四氢呋喃和一个磁子,而后以薄橡胶塞封口,置于丙酮-干冰体系中冷却到-78℃。搅拌下,用注射器往此反应容器中慢慢加入8mL(8mmol;1.0M)n-BuLi的正己烷溶液,加完后体系在-78℃下再搅拌一小时,而后用注射器再往该反应容器中慢慢加入上述制备的2,3,4,6-四-O-三甲基硅基葡萄糖酸内酯溶解到10mL干燥甲苯中形成的溶液。加完后,体系再搅拌一小时,而后用注射器加入1.92g(20mmol)的甲磺酸溶解到10mL无水甲醇中形成的溶液,而后体系慢慢升温到室温,室温下搅拌过夜。反应混合物倾倒到饱和食盐水中,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,即为1-{4-氯-3-[(4-乙氧基苯基)二氟甲基]苯基}-α/β-D-甲基吡喃葡萄糖苷,2.95g,产率90%,ESI-MS,m/z=475.4([M+1])。
上述得到的1-{4-氯-3-[(4-乙氧基苯基)二氟甲基]苯基}-α/β-D-甲基吡喃葡萄糖苷油状物2.95g(6.2mmol)溶解到3mL干燥二氯甲烷中,冰水浴冷却下搅拌,先后加入三乙基硅烷2mL和三氟化硼乙醚1mL。所得反应体系在室温下搅拌过夜,小心倾倒到100mL冰水中,以饱和碳酸氢钠溶液调节到pH=8,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,即为1-{4-氯-3-[(4-乙氧基苯基)二氟甲基]苯基}-α/β-D-吡喃葡萄糖,2.46g,产率89%,ESI-MS,m/z=445.3([M+1])。
上述得到的1-{4-氯-3-[(4-乙氧基苯基)二氟甲基]苯基}-α/β-D-吡喃葡萄糖无色油状物2.46g(5.53mmol)溶解到20mL醋酸酐中,加入0.5g无水醋酸钠,电磁搅拌升温回流1小时。冷却后,体系倾倒到100mL水中,室温下搅拌过夜,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到类白色固体,经过硅胶柱层析纯化得到一无色晶体,2,3,4,6-四-O-乙酰基-1-{4-氯-3-[(4-乙氧基苯基)二氟甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖,2.78g,产率82%,ESI-MS,m/z=613.4([M+1])。
上述2,3,4,6-四-O-乙酰基-1-{4-氯-3-[(4-乙氧基苯基)二氟甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖2.78g(4.53mmol)溶解到含有0.11g(2mmol)甲醇钠的7mL无水甲醇中,室温下搅拌5小时,而后加入1g干燥的强酸性阳离子交换树脂,室温下搅拌过夜。过滤除去树脂,所得滤液在旋转蒸发仪上蒸干,得到一白色固体,即为1-{4-氯-3-[(4-乙氧基苯基)二氟甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖,2.02g,产率100%,ESI-MS,m/z=445.3([M+1])。
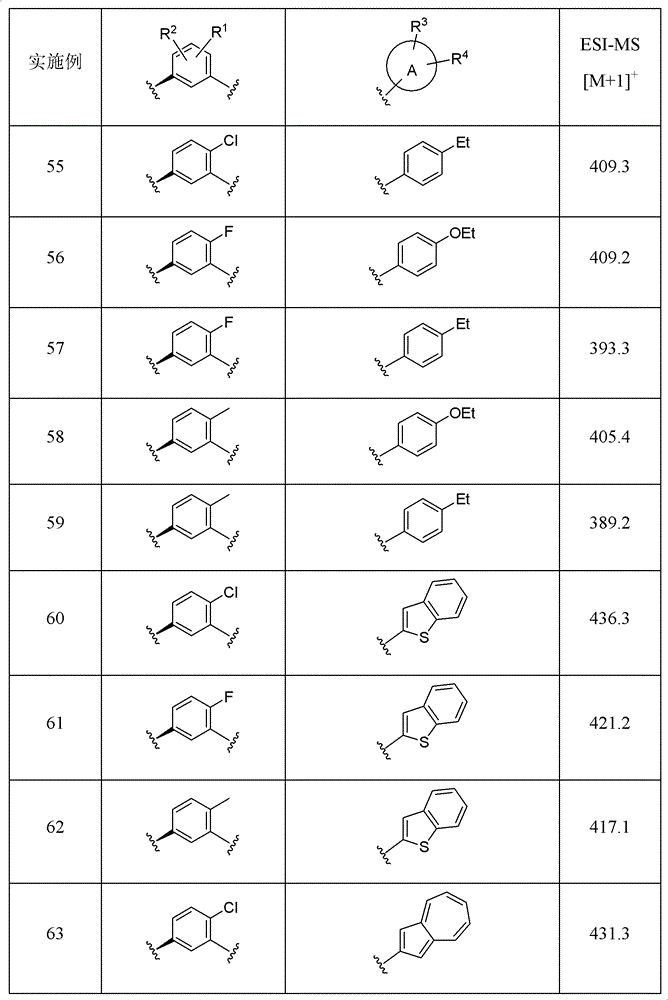
实施例2-10
可以理解的是,使用实施例1的方法和流程,改变R1、R2、R3、R4和环A,可以得到下表所列的化合物。
实施例19
1-{4-氯-3-[(4-乙氧基苯基)氟甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖
A.(5-溴-2-氯苯基)(4-乙氧基苯基)氟甲烷
一只100mL的圆底烧瓶中加入按照实施例1方法制备的3.40g(10mmol)(5-溴-2-氯苯基)(4-乙氧基苯基)甲酮,20mL干燥的四氢呋喃,冰水浴冷却下搅拌。分批加入0.38g(10mmol)LiAlH4,加完后,所得混合物室温下继续搅拌一小时后小心倾倒入200mL冰水中,用浓盐酸调节pH=2-3。所得酸性体系用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到类白色固体,为(5-溴-2-氯苯基)(4-乙氧基苯基)甲醇。3.07g,产率90%,ESI-MS,m/z=341.1([M(79Br)+1]),343.3([M(81Br)+1])。
上述3.07g(9mmol)(5-溴-2-氯苯基)(4-乙氧基苯基)甲醇溶解到10mL干燥的二氯甲烷中,再加入5mL二乙氨基三氟化硫(Et2NSF3),体系在室温下搅拌过夜后小心倾倒入200mL冰水中,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,得到无色油状物,经过硅胶柱层析纯化得到一无色油状物,即为(5-溴-2-氯苯基)(4-乙氧基苯基)氟甲烷,2.72g,产率88%,ESI-MS,m/z=343.2([M(79Br)+1]),345.3([M(81Br)+1])。
B.1-{4-氯-3-[(4-乙氧基苯基)氟甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖
一只100mL的圆底烧瓶中加入上述制备的2.72g(7.9mmol)(5-溴-2-氯苯基)(4-乙氧基苯基)氟甲烷,10mL干燥的四氢呋喃和一个磁子,而后以薄橡胶塞封口,置于丙酮-干冰体系中冷却到-78℃。搅拌下,用注射器往此反应容器中慢慢加入8mL(8mmol;1.0M)n-BuLi的正己烷溶液,加完后体系在-78℃下再搅拌一小时,而后用注射器再往该反应容器中慢慢加入按照实施例1中的方法制备的2,3,4,6-四-O-三甲基硅基葡萄糖酸内酯溶解到10mL干燥甲苯中形成的溶液。加完后,体系再搅拌一小时,而后用注射器加入1.92g(20mmol)的甲磺酸溶解到10mL无水甲醇中形成的溶液,而后体系慢慢升温到室温,室温下搅拌过夜。反应混合物倾倒到饱和食盐水中,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,即为1-{4-氯-3-[(4-乙氧基苯基)氟甲基]苯基}-α/β-D-甲基吡喃葡萄糖苷,3.07g,产率85%,ESI-MS,m/z=457.1([M+1])。
上述得到的1-{4-氯-3-[(4-乙氧基苯基)氟甲基]苯基}-α/β-D-甲基吡喃葡萄糖苷油状物3.07g(6.7mmol)溶解到3mL干燥二氯甲烷中,冰水浴冷却下搅拌,先后加入三乙基硅烷2mL和三氟化硼乙醚1mL。所得反应体系在室温下搅拌过夜,小心倾倒到100mL冰水中,以饱和碳酸氢钠溶液调节到pH=8,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,即为1-{4-氯-3-[(4-乙氧基苯基)氟甲基]苯基}-α/β-D-吡喃葡萄糖,2.57g,产率90%,ESI-MS,m/z=427.4([M+1])。
上述得到的1-{4-氯-3-[(4-乙氧基苯基)氟甲基]苯基}-α/β-D-吡喃葡萄糖无色油状物2.57g(6.0mmol)溶解到20mL醋酸酐中,加入0.5g无水醋酸钠,电磁搅拌升温回流1小时。冷却后,体系倾倒到100mL水中,室温下搅拌过夜,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到类白色固体,经过硅胶柱层析纯化得到一无色晶体,2,3,4,6-四-O-乙酰基-1-{4-氯-3-[(4-乙氧基苯基)氟甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖,2.86g,产率80%,ESI-MS,m/z=595.2([M+1])。
上述2,3,4,6-四-O-乙酰基-1-{4-氯-3-[(4-乙氧基苯基)氟甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖2.86g(4.8mmol)溶解到含有0.11g(2mmol)甲醇钠的7mL无水甲醇中,室温下搅拌5小时,而后加入1g干燥的强酸性阳离子交换树脂,室温下搅拌过夜。过滤除去树脂,所得滤液在旋转蒸发仪上蒸干,得到一白色固体,即为1-{4-氯-3-[(4-乙氧基苯基)氟甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖,2.05g,产率100%,ESI-MS,m/z=427.2([M+1])。
实施例20-33
可以理解的是,使用实施例19的方法和流程,改变R1、R2、R3、R4和环A,可以得到下表所列的化合物。
实施例34
1-{4-氯-3-[(二甲基)(4-乙氧基苯基)甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖
A.(5-溴-2-氯苯基)(4-乙氧基苯基)(二甲基)甲烷
一只100mL的圆底烧瓶中加入2.64g(10mmol)5-溴-2-氯苯甲酸乙酯和10mL无水四氢呋喃,所得溶液用冰水浴冷却电磁搅拌,用恒压滴液漏斗滴加25mL(25mmol;1.0M)甲基碘化镁的THF溶液,滴加完毕后,反应混合物在室温下搅拌一小时后小心倾倒入200mL冰水中,用浓盐酸调节pH=3-4。所得酸性体系用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,为(5-溴-2-氯苯基)二甲基甲醇。2.35g,产率94%;1H NMR(DMSO-d6,400MHz),δ7.95(d,1H,J=2.8Hz),7.44(dd,1H,J=2.6Hz and 8.6Hz),7.33(d,1H,J=8.0Hz),5.46(s,1H),1.56(s,6H);ESI-MS,m/z=249.2([M(79Br)+1]),251.3([M(81Br)+1])。
上述2.35g(9.4mmol)(5-溴-2-氯苯基)二甲基甲醇和2.44g(20mmol)苯乙醚加入到一25mL的圆底烧瓶中,电磁搅拌,加入三氟甲磺酸1mL,反应混合物在100℃下搅拌过夜后小心倾倒入200mL冰水中。所得酸性体系用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,为(5-溴-2-氯苯基)(4-乙氧基苯基)(二甲基)甲烷。2.69g,产率81%;1H NMR(DMSO-d6,400MHz),δ7.76(d,1H,J=2.4Hz),7.47(dd,1H,J=2.4Hz and 8.4Hz),7.25(d,1H,J=8.4Hz),6.96(d,2H,J=8.8Hz),6.78(d,2H,J=9.2Hz),3.96(q,2H,J=7.1Hz),1.64(s,6H),1.29(t,3H,J=7.0Hz);ESI-MS,m/z=353.4([M(79Br)+1]),355.2([M(81Br)+1])。
B.1-{4-氯-3-[(二甲基)(4-乙氧基苯基)甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖
一只100mL的圆底烧瓶中加入上述制备的2.69g(7.6mmol)(5-溴-2-氯苯基)(4-乙氧基苯基)二甲基甲烷,10mL干燥的四氢呋喃和一个磁子,而后以薄橡胶塞封口,置于丙酮-干冰体系中冷却到-78℃。搅拌下,用注射器往此反应容器中慢慢加入8mL(8mmol;1.0M)n-BuLi的正己烷溶液,加完后体系在-78℃下再搅拌一小时,而后用注射器再往该反应容器中慢慢加入按照实施例1中的方法制备的2,3,4,6-四-O-三甲基硅基葡萄糖酸内酯溶解到10mL干燥甲苯中形成的溶液。加完后,体系再搅拌一小时,而后用注射器加入1.92g(20mmol)的甲磺酸溶解到10mL无水甲醇中形成的溶液,而后体系慢慢升温到室温,室温下搅拌过夜。反应混合物倾倒到饱和食盐水中,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,即为1-{4-氯-3-[(二甲基)(4-乙氧基苯基)甲基]苯基}-α/β-D-甲基吡喃葡萄糖苷,3.09g,产率87%,ESI-MS,m/z=467.4([M+1])。
上述得到的1-{4-氯-3-[(二甲基)(4-乙氧基苯基)甲基]苯基}-α/β-D-甲基吡喃葡萄糖苷油状物3.09g(6.6mmol)溶解到3mL干燥二氯甲烷中,冰水浴冷却下搅拌,先后加入三乙基硅烷2mL和三氟化硼乙醚1mL。所得反应体系在室温下搅拌过夜,小心倾倒到100mL冰水中,以饱和碳酸氢钠溶液调节到pH=8,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,即为1-{4-氯-3-[(二甲基)(4-乙氧基苯基)甲基]苯基}-α/β-D-吡喃葡萄糖,2.62g,产率91%,ESI-MS,m/z=437.2([M+1])。
上述得到的1-{4-氯-3-[(二甲基)(4-乙氧基苯基)甲基]苯基}-α/β-D-吡喃葡萄糖无色油状物2.62g(6.0mmol)溶解到20mL醋酸酐中,加入0.5g无水醋酸钠,电磁搅拌升温回流1小时。冷却后,体系倾倒到100mL水中,室温下搅拌过夜,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到类白色固体,经过硅胶柱层析纯化得到一无色晶体,2,3,4,6-四-O-乙酰基-1-{4-氯-3-[(二甲基)(4-乙氧基苯基)甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖,3.27g,产率90%;1H NMR(DMSO-d6,400MHz),δ7.58(s,1H),7.27(s,2H),6.90(d,2H,J=8.8Hz),6.76(d,2H,J=8.8Hz),5.39(t,1H,J=9.6Hz),5.13(t,1H,J=9.6Hz),5.05(t,1H,J=9.6Hz),4.78(d,1H,J=9.6Hz),4.14-4.15(m,2H),4.06-4.11(m,1H),3.95(q,2H,J=6.9Hz),2.02(s,3H),2.01(s,3H),1.94(s,3H),1.82(s,3H),1.64(s,6H),1.28(t,3H,J=7.0Hz);ESI-MS,m/z=605.3([M+1])。
上述2,3,4,6-四-O-乙酰基-1-{4-氯-3-[(二甲基)(4-乙氧基苯基)甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖3.27g(5.4mmol)溶解到含有0.11g(2mmol)甲醇钠的7mL无水甲醇中,室温下搅拌5小时,而后加入1g干燥的强酸性阳离子交换树脂,室温下搅拌过夜。过滤除去树脂,所得滤液在旋转蒸发仪上蒸干,得到一白色固体,即为1-{4-氯-3-[(二甲基)(4-乙氧基苯基)甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖,2.36g,产率100%;1H NMR(DMSO-d6,400MHz),δ7.62(s,1H),7.23(s,2H),6.97(d,2H,J=8.8Hz),6.76(d,2H,J=8.8Hz),4.93-4.95(m,2H),4.87(d,1H,J=5.6Hz),4.46(t,1H,J=5.8Hz),4.09(d,1H,J=9.6Hz),3.95(q,2H,J=6.9Hz),3.71-3.75(m,1H),3.44-3.50(m,1H),3.24-3.30(m,2H),3.15-3.22(m,2H),1.653(s,3H),1.645(s,3H),1.29(t,3H,J=7.0Hz);ESI-MS,m/z=437.4([M+1])。
实施例35-48
可以理解的是,使用实施例34的方法和流程,改变R1、R2、R3、R4和环A,可以得到下表所列的化合物。
实施例54
1-{4-氯-3-[1-(4-乙氧基苯基)乙基]苯基}-1-脱氧-β-D-吡喃葡萄糖
A.1-(5-溴-2-氯苯基)-1-(4-乙氧基苯基)乙烷
一只100mL的圆底烧瓶中加入按照实施例1制备的3.40g(10mmol)(5-溴-2-氯苯基)(4-乙氧基苯基)甲酮和10mL无水四氢呋喃,所得溶液用冰水浴冷却电磁搅拌,用恒压滴液漏斗滴加10mL(10mmol;1.0M)甲基碘化镁的THF溶液,滴加完毕后,反应混合物在室温下搅拌一小时后小心倾倒入200mL冰水中,用浓盐酸调节pH=3-4。所得酸性体系用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,为1-(5-溴-2-氯苯基)-1-(4-乙氧基苯基)乙醇。3.20g,产率90%,ESI-MS,m/z=355.2([M(79Br)+1]),357.2([M(81Br)+1])。
上述3.20g(9.0mmol)1-(5-溴-2-氯苯基)-1-(4-乙氧基苯基)乙醇加入到一25mL的圆底烧瓶中,用3mL干燥二氯甲烷溶解,电磁搅拌,先后加入三乙基硅烷2mL和三氟化硼乙醚1mL,反应混合物在室温下搅拌过夜后小心倾倒入200mL冰水中。所得酸性体系用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,为1-(5-溴-2-氯苯基)-1-(4-乙氧基苯基)乙烷。2.45g,产率80%,ESI-MS,m/z=339.2([M(79Br)+1]),341.3([M(81Br)+1])。
B.1-{4-氯-3-[1-(4-乙氧基苯基)乙基]苯基}-1-脱氧-β-D-吡喃葡萄糖
一只100mL的圆底烧瓶中加入上述制备的2.45g(7.2mmol)1-(5-溴-2-氯苯基)-1-(4-乙氧基苯基)乙烷,10mL干燥的四氢呋喃和一个磁子,而后以薄橡胶塞封口,置于丙酮-干冰体系中冷却到-78℃。搅拌下,用注射器往此反应容器中慢慢加入8mL(8mmol;1.0M)n-BuLi的正己烷溶液,加完后体系在-78℃下再搅拌一小时,而后用注射器再往该反应容器中慢慢加入按照实施例1中的方法制备的2,3,4,6-四-O-三甲基硅基葡萄糖酸内酯溶解到10mL干燥甲苯中形成的溶液。加完后,体系再搅拌一小时,而后用注射器加入1.92g(20mmol)的甲磺酸溶解到10mL无水甲醇中形成的溶液,而后体系慢慢升温到室温,室温下搅拌过夜。反应混合物倾倒到饱和食盐水中,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,即为1-{4-氯-3-[1-(4-乙氧基苯基)乙基]苯基}-α/β-D-甲基吡喃葡萄糖苷,2.77g,产率85%,ESI-MS,m/z=453.4([M+1])。
上述得到的1-{4-氯-3-[1-(4-乙氧基苯基)乙基]苯基}-α/β-D-甲基吡喃葡萄糖苷油状物2.77g(6.1mmol)溶解到3mL干燥二氯甲烷中,冰水浴冷却下搅拌,先后加入三乙基硅烷2mL和三氟化硼乙醚1mL。所得反应体系在室温下搅拌过夜,小心倾倒到100mL冰水中,以饱和碳酸氢钠溶液调节到pH=8,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,即为1-{4-氯-3-[1-(4-乙氧基苯基)乙基]苯基}-α/β-D-吡喃葡萄糖,2.32g,产率90%,ESI-MS,m/z=423.2([M+1])。
上述得到的1-{4-氯-3-[1-(4-乙氧基苯基)乙基]苯基}-α/β-D-吡喃葡萄糖无色油状物2.32g(5.5mmol)溶解到20mL醋酸酐中,加入0.5g无水醋酸钠,电磁搅拌升温回流1小时。冷却后,体系倾倒到100mL水中,室温下搅拌过夜,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到类白色固体,经过硅胶柱层析纯化得到一无色晶体,2,3,4,6-四-O-乙酰基-1-{4-氯-3-[1-(4-乙氧基苯基)乙基]苯基}-1-脱氧-β-D-吡喃葡萄糖,3.12g,产率96%,ESI-MS,m/z=591.4([M+1])。
上述2,3,4,6-四-O-乙酰基-1-{4-氯-3-[1-(4-乙氧基苯基)乙基]苯基}-1-脱氧-β-D-吡喃葡萄糖3.12g(5.3mmol)溶解到含有0.11g(2mmol)甲醇钠的7mL无水甲醇中,室温下搅拌5小时,而后加入1g干燥的强酸性阳离子交换树脂,室温下搅拌过夜。过滤除去树脂,所得滤液在旋转蒸发仪上蒸干,得到一白色固体,即为1-{4-氯-3-[1-(4-乙氧基苯基)乙基]苯基}-1-脱氧-β-D-吡喃葡萄糖,2.24g,产率100%,ESI-MS,m/z=423.3([M+1])。
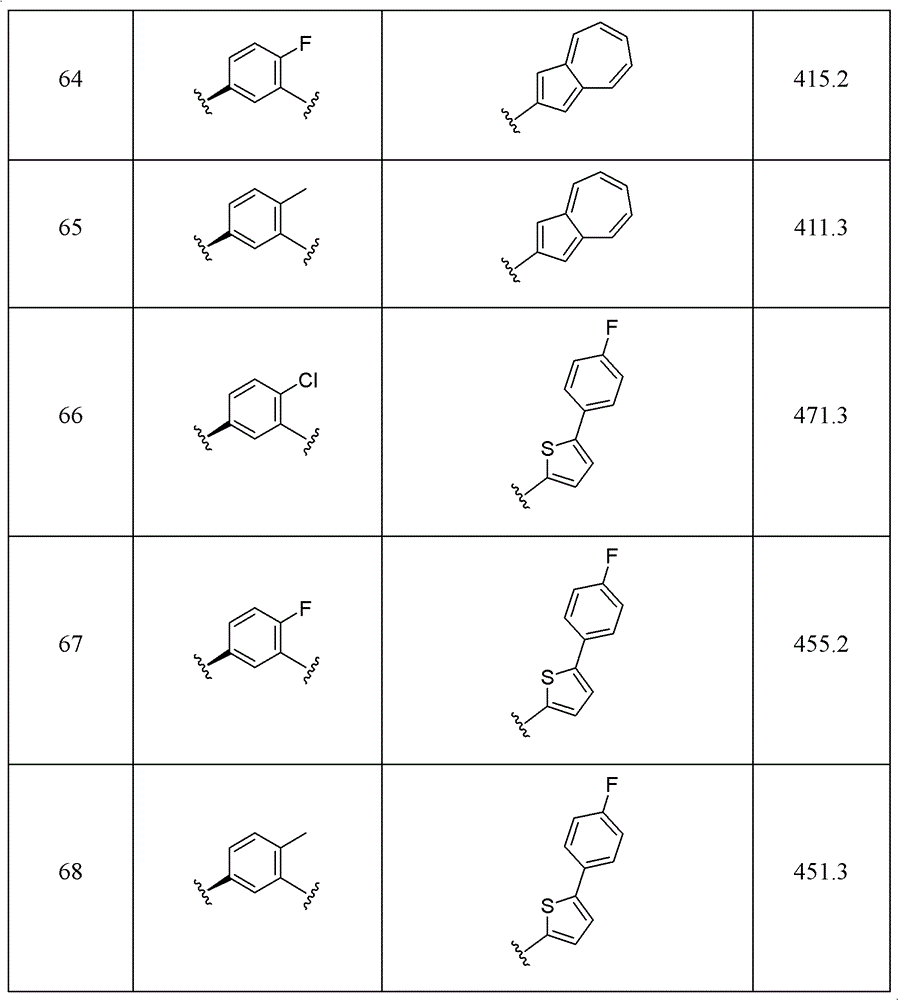
实施例55-68
可以理解的是,使用实施例54的方法和流程,改变R1、R2、R3、R4和环A,可以得到下表所列的化合物。
实施例69
1-{4-氯-3-[1-(4-乙氧基苯基)-1-甲氧基乙基]苯基}-1-脱氧-β-D-吡喃葡萄糖
A.1-(5-溴-2-氯苯基)-1-(4-乙氧基苯基)-1-甲氧基乙烷
一只100mL的圆底烧瓶中加入按照实施例54制备的3.56g(10mmol)(5-溴-2-氯苯基)(4-乙氧基苯基)(甲基)甲醇和10mL无水四氢呋喃,所得溶液用冰水浴冷却电磁搅拌,分批加入0.40g(12mmol;60%)固体NaH,加完后,反应混合物在室温下搅拌一小时后加入1.70g(12mmol)干燥的MeI,反应混合物在室温下搅拌过夜后小心倾倒入200mL冰水中,用浓盐酸调节pH=4-5。所得酸性体系用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,为1-(5-溴-2-氯苯基)-1-(4-乙氧基苯基)-1-甲氧基乙烷。3.40g,产率92%,ESI-MS,m/z=369.2([M(79Br)+1]),371.4([M(81Br)+1])。
B.1-{4-氯-3-[1-(4-乙氧基苯基)-1-甲氧基乙基]苯基}-1-脱氧-β-D-吡喃葡萄糖
一只100mL的圆底烧瓶中加入上述制备的3.40g(9.2mmol)1-(5-溴-2-氯苯基)-1-(4-乙氧基苯基)-1-甲氧基乙烷,10mL干燥的四氢呋喃和一个磁子,而后以薄橡胶塞封口,置于丙酮-干冰体系中冷却到-78℃。搅拌下,用注射器往此反应容器中慢慢加入10mL(10mmol;1.0M)n-BuLi的正己烷溶液,加完后体系在-78℃下再搅拌一小时,而后用注射器再往该反应容器中慢慢加入按照实施例1中的方法制备的2,3,4,6-四-O-三甲基硅基葡萄糖酸内酯溶解到10mL干燥甲苯中形成的溶液。加完后,体系再搅拌一小时,而后用注射器加入1.92g(20mmol)的甲磺酸溶解到10mL无水甲醇中形成的溶液,而后体系慢慢升温到室温,室温下搅拌过夜。反应混合物倾倒到饱和食盐水中,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,即为1-{4-氯-3-[1-(4-乙氧基苯基)-1-甲氧基乙基]苯基}-α/β-D-甲基吡喃葡萄糖苷,3.69g,产率83%,ESI-MS,m/z=483.4([M+1])。
上述得到的1-{4-氯-3-[1-(4-乙氧基苯基)-1-甲氧基乙基]苯基}-α/β-D-甲基吡喃葡萄糖苷油状物3.69g(7.6mmol)溶解到3mL干燥二氯甲烷中,冰水浴冷却下搅拌,先后加入三乙基硅烷2mL和三氟化硼乙醚1mL。所得反应体系在室温下搅拌过夜,小心倾倒到100mL冰水中,以饱和碳酸氢钠溶液调节到pH=8,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,即为1-{4-氯-3-[1-(4-乙氧基苯基)-1-甲氧基乙基]苯基}-α/β-D-吡喃葡萄糖,3.13g,产率91%,ESI-MS,m/z=453.4([M+1])。
上述得到的1-{4-氯-3-[1-(4-乙氧基苯基)-1-甲氧基乙基]苯基}-α/β-D-吡喃葡萄糖无色油状物3.13g(6.9mmol)溶解到20mL醋酸酐中,加入0.5g无水醋酸钠,电磁搅拌升温回流1小时。冷却后,体系倾倒到100mL水中,室温下搅拌过夜,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到类白色固体,经过硅胶柱层析纯化得到一无色晶体,2,3,4,6-四-O-乙酰基-1-{4-氯-3-[1-(4-乙氧基苯基)-1-甲氧基乙基]苯基}-1-脱氧-β-D-吡喃葡萄糖,4.07g,产率95%,ESI-MS,m/z=621.4([M+1])。
上述2,3,4,6-四-O-乙酰基-1-{4-氯-3-[1-(4-乙氧基苯基)-1-甲氧基乙基]苯基}-1-脱氧-β-D-吡喃葡萄糖4.07g(6.6mmol)溶解到含有0.11g(2mmol)甲醇钠的7mL无水甲醇中,室温下搅拌5小时,而后加入1g干燥的强酸性阳离子交换树脂,室温下搅拌过夜。过滤除去树脂,所得滤液在旋转蒸发仪上蒸干,得到一白色固体,即为1-{4-氯-3-[1-(4-乙氧基苯基)-1-甲氧基乙基]苯基}-1-脱氧-β-D-吡喃葡萄糖,2.98g,产率100%,ESI-MS,m/z=453.4([M+1])。
实施例70
1-{4-氯-3-[1-(4-乙氧基苯基)-1-氟乙基]苯基}-1-脱氧-β-D-吡喃葡萄糖
A.1-(5-溴-2-氯苯基)-1-(4-乙氧基苯基)-1-氟乙烷
一只100mL的圆底烧瓶中加入按照实施例54制备的3.56g(10mmol)(5-溴-2-氯苯基)(4-乙氧基苯基)(甲基)甲醇和10mL无水二氯甲烷,所得溶液用冰水浴冷却电磁搅拌,加入2mL二乙氨基三氟化硫(Et2NSF3),反应混合物在室温下搅拌过夜后小心倾倒入200mL冰水中。所得体系用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,为1-(5-溴-2-氯苯基)-1-(4-乙氧基苯基)-1-氟乙烷。3.40g,产率95%,ESI-MS,m/z=357.3([M(79Br)+1]),359.1([M(81Br)+1])。
B.1-{4-氯-3-[1-(4-乙氧基苯基)-1-氟乙基]苯基}-1-脱氧-β-D-吡喃葡萄糖
一只100mL的圆底烧瓶中加入上述制备的3.40g(9.5mmol)1-(5-溴-2-氯苯基)-1-(4-乙氧基苯基)-1-氟乙烷,10mL干燥的四氢呋喃和一个磁子,而后以薄橡胶塞封口,置于丙酮-干冰体系中冷却到-78℃。搅拌下,用注射器往此反应容器中慢慢加入10mL(10mmol;1.0M)n-BuLi的正己烷溶液,加完后体系在-78℃下再搅拌一小时,而后用注射器再往该反应容器中慢慢加入按照实施例1中的方法制备的2,3,4,6-四-O-三甲基硅基葡萄糖酸内酯溶解到10mL干燥甲苯中形成的溶液。加完后,体系再搅拌一小时,而后用注射器加入1.92g(20mmol)的甲磺酸溶解到10mL无水甲醇中形成的溶液,而后体系慢慢升温到室温,室温下搅拌过夜。反应混合物倾倒到饱和食盐水中,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,即为1-{4-氯-3-[1-(4-乙氧基苯基)-1-氟乙基]苯基}-α/β-D-甲基吡喃葡萄糖苷,3.58g,产率80%,ESI-MS,m/z=471.3([M+1])。
上述得到的1-{4-氯-3-[1-(4-乙氧基苯基)-1-氟乙基]苯基}-α/β-D-甲基吡喃葡萄糖苷油状物3.58g(7.6mmol)溶解到3mL干燥二氯甲烷中,冰水浴冷却下搅拌,先后加入三乙基硅烷2mL和三氟化硼乙醚1mL。所得反应体系在室温下搅拌过夜,小心倾倒到100mL冰水中,以饱和碳酸氢钠溶液调节到pH=8,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,即为1-{4-氯-3-[1-(4-乙氧基苯基)-1-氟乙基]苯基}-α/β-D-吡喃葡萄糖,3.02g,产率90%,ESI-MS,m/z=441.2([M+1])。
上述得到的1-{4-氯-3-[1-(4-乙氧基苯基)-1-氟乙基]苯基}-α/β-D-吡喃葡萄糖无色油状物3.02g(6.8mmol)溶解到20mL醋酸酐中,加入0.5g无水醋酸钠,电磁搅拌升温回流1小时。冷却后,体系倾倒到100mL水中,室温下搅拌过夜,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到类白色固体,经过硅胶柱层析纯化得到一无色晶体,2,3,4,6-四-O-乙酰基-1-{4-氯-3-[1-(4-乙氧基苯基)-1-氟乙基]苯基}-1-脱氧-β-D-吡喃葡萄糖,3.98g,产率96%,ESI-MS,m/z=609.2([M+1])。
上述2,3,4,6-四-O-乙酰基-1-{4-氯-3-[1-(4-乙氧基苯基)-1-氟乙基]苯基}-1-脱氧-β-D-吡喃葡萄糖3.98g(6.5mmol)溶解到含有0.11g(2mmol)甲醇钠的7mL无水甲醇中,室温下搅拌5小时,而后加入1g干燥的强酸性阳离子交换树脂,室温下搅拌过夜。过滤除去树脂,所得滤液在旋转蒸发仪上蒸干,得到一白色固体,即为1-{4-氯-3-[1-(4-乙氧基苯基)-1-氟乙基]苯基}-1-脱氧-β-D-吡喃葡萄糖,2.87g,产率100%,ESI-MS,m/z=441.2([M+1])。
实施例71
1-{4-氯-3-[(4-乙氧基苯基)(甲氧基)甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖
A.(5-溴-2-氯苯基)(4-乙氧基苯基)(甲氧基)甲烷
一只100mL的圆底烧瓶中加入按照实施例19制备的3.42g(10mmol)(5-溴-2-氯苯基)(4-乙氧基苯基)甲醇和10mL无水四氢呋喃,所得溶液用冰水浴冷却电磁搅拌,分批加入0.40g(12mmol;60%)固体NaH,加完后,反应混合物在室温下搅拌一小时后加入1.70g(12mmol)干燥的MeI,反应混合物在室温下搅拌过夜后小心倾倒入200mL冰水中,用浓盐酸调节pH=4-5。所得酸性体系用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,为(5-溴-2-氯苯基)(4-乙氧基苯基)(甲氧基)甲烷。3.20g,产率90%,ESI-MS,m/z=355.2([M(79Br)+1]),357.2([M(81Br)+1])。
B.1-{4-氯-3-[(4-乙氧基苯基)(甲氧基)甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖
一只100mL的圆底烧瓶中加入上述制备的3.20g(9.0mmol)(5-溴-2-氯苯基)(4-乙氧基苯基)(甲氧基)甲烷,10mL干燥的四氢呋喃和一个磁子,而后以薄橡胶塞封口,置于丙酮-干冰体系中冷却到-78℃。搅拌下,用注射器往此反应容器中慢慢加入10mL(10mmol;1.0M)n-BuLi的正己烷溶液,加完后体系在-78℃下再搅拌一小时,而后用注射器再往该反应容器中慢慢加入按照实施例1中的方法制备的2,3,4,6-四-O-三甲基硅基葡萄糖酸内酯溶解到10mL干燥甲苯中形成的溶液。加完后,体系再搅拌一小时,而后用注射器加入1.92g(20mmol)的甲磺酸溶解到10mL无水甲醇中形成的溶液,而后体系慢慢升温到室温,室温下搅拌过夜。反应混合物倾倒到饱和食盐水中,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,即为1-{4-氯-3-[(4-乙氧基苯基)(甲氧基)甲基]苯基}-α/β-D-甲基吡喃葡萄糖苷,3.63g,产率86%,ESI-MS,m/z=469.3([M+1])。
上述得到的1-{4-氯-3-[(4-乙氧基苯基)(甲氧基)甲基]苯基}-α/β-D-甲基吡喃葡萄糖苷油状物3.63g(7.7mmol)溶解到3mL干燥二氯甲烷中,冰水浴冷却下搅拌,先后加入三乙基硅烷2mL和三氟化硼乙醚1mL。所得反应体系在室温下搅拌过夜,小心倾倒到100mL冰水中,以饱和碳酸氢钠溶液调节到pH=8,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到一无色油状物,即为1-{4-氯-3-[(4-乙氧基苯基)(甲氧基)甲基]苯基}-α/β-D-吡喃葡萄糖,3.13g,产率90%,ESI-MS,m/z=439.1([M+1])。
上述得到的1-{4-氯-3-[(4-乙氧基苯基)(甲氧基)甲基]苯基}-α/β-D-吡喃葡萄糖无色油状物3.13g(6.9mmol)溶解到20mL醋酸酐中,加入0.5g无水醋酸钠,电磁搅拌升温回流1小时。冷却后,体系倾倒到100mL水中,室温下搅拌过夜,用100mL二氯甲烷分两次萃取,合并萃取液体用饱和食盐水洗涤一次,无水硫酸钠干燥,在旋转蒸发仪上蒸干,得到类白色固体,经过硅胶柱层析纯化得到一无色晶体,2,3,4,6-四-O-乙酰基-1-{4-氯-3-[(4-乙氧基苯基)(甲氧基)甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖,4.10g,产率98%,ESI-MS,m/z=607.3([M+1])。
上述2,3,4,6-四-O-乙酰基-1-{4-氯-3-[(4-乙氧基苯基)(甲氧基)甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖4.10g(6.8mmol)溶解到含有0.11g(2mmol)甲醇钠的7mL无水甲醇中,室温下搅拌5小时,而后加入1g干燥的强酸性阳离子交换树脂,室温下搅拌过夜。过滤除去树脂,所得滤液在旋转蒸发仪上蒸干,得到一白色固体,即为1-{4-氯-3-[(4-乙氧基苯基)(甲氧基)甲基]苯基}-1-脱氧-β-D-吡喃葡萄糖,2.98g,产率100%,ESI-MS,m/z=439.1([M+1])。
实施例72
将活性成分、预胶化淀粉和微晶纤维素过筛,充分混合,加入聚乙烯吡咯烷酮溶液,混合,制软材,过筛,制湿颗粒,于50-60℃干燥,将羧甲基淀粉钠盐,硬脂酸镁和滑石粉预先过筛,然后加入到上述的颗粒中压片。
实施例73
将活性成分、预胶化淀粉和微晶纤维素过筛,充分混合,加入聚乙烯吡咯烷酮溶液,混合,制软材,过筛,制湿颗粒,于50-60℃干燥,将羧甲基淀粉钠盐,硬脂酸镁和滑石粉预先过筛,然后加入到上述的颗粒中压片。
实施例74
将活性成分、预胶化淀粉和微晶纤维素过筛,充分混合,加入聚乙烯吡咯烷酮溶液,混合,制软材,过筛,制湿颗粒,于50-60℃干燥,将硬脂酸镁和滑石粉预先过筛,然后加入到上述的颗粒中,装胶囊,即得。
实施例75
将活性成分、预胶化淀粉和微晶纤维素过筛,充分混合,加入聚乙烯吡咯烷酮溶液,混合,制软材,过筛,制湿颗粒,于50-60℃干燥,将硬脂酸镁和滑石粉预先过筛,然后加入到上述的颗粒中,装胶囊,即得。
实施例76
在蒸馏水中,先加入蒸馏水和柠檬酸,搅拌溶解和后,再加入样品,微热使溶解,调pH值为4.0-5.0,加0.2克活性碳,室温下搅拌20分钟,过滤,滤液,中控测定溶液浓度,按每安瓶5毫升分装,高温灭菌30分钟,即得注射液。
实施例77
在蒸馏水中,先加入蒸馏水和柠檬酸,搅拌溶解和后,再加入样品,微热使溶解,调pH值为4.0-5.0,加0.2克活性碳,室温下搅拌20分钟,过滤,滤液,中控测定溶液浓度,按每安瓶5毫升分装,高温灭菌30分钟,即得注射液。
实施例78
制备工艺:取注射用水80ml,加主药、甘露醇、乳糖、泊洛沙姆搅拌使溶解后,加1mol/L的枸橼酸调节PH至7.0-9.0,补加水至100ml。加入0.5g活性炭,在30℃下搅拌20分钟,脱炭,采用微孔滤膜过滤除菌,滤液按每支1ml进行分装,预冻2小时后,冷冻下减压干燥12小时,至样品温度到室温后,再干燥5小时,制得白色疏松块状物,封口即得。
实施例79
制备工艺:将主药与辅料分别过100目筛,充分混合,然后称取处方量辅料与主药充分混合。再加入粘合剂制软材,14目筛制粒,55℃干燥,12目筛整粒,测定袋重包装。
实施例80
样品以1%羧甲基纤维素钠配制成5mg/mL浓度的混悬液,给药容量为0.2mL/20g体重,相当于10mg/kg剂量。
健康ICR小鼠,雌雄各半,体重20-24g,符合一级标准。动物禁食16小时,药后2h腹腔注射2g/kg的葡萄糖盐水溶液(Dapagliflozin药后1.5h注射葡萄糖),于造模后0.5h、1h、2h、3h和4h定时取用毛细管自小鼠球后静脉丛取血,离心分离血清,用葡萄糖氧化酶法测定各时间点血清葡萄糖含量。结果见下页的表格:
以上结果表明,各给药均能显著降低葡萄糖引起的小鼠血糖耐受量。
Claims (7)
1.具有通式I结构的化合物及其药学上可以接受的盐,
其中,
R1、R2、R3、R4独立选自H,F,Cl,Br,I,OH,OR7,SR8,OCF3,CF3,CHF2,CH2F,C1-C3的烷基,含3-5个碳原子的环烷基,其中R7和R8独立选自C1-C3的烷基;
环A选自芳香性的单环和芳香性的二环,芳香性的二环中的两个环可以为并环也可以为两个独立芳香环通过共价键连接,上述所指的芳香性的单环和芳香性的二环为5-12元环并且可以在环内含有一个S原子;环A可以以任意可能的位置与化合物I的其它部分连接;
R5和R6的定义选自如下几种情况:
(1)R5=R6=Me;
(2)R5=Me,R6=OMe;
(3)R5=Me,R6=H;
(4)R5=Me,R6=F;
(5)R5=F,R6=H;
(6)R5=OMe,R6=H。
2.权利要求1所定义的具有通式I的化合物及其药学上可以接受的盐,其中,
R1、R2、R3、R4独立选自H,F,Cl,OR7,SR8,OCF3,CF3,CHF2,CH2F,C1-C3的烷基,含3-5个碳原子的环烷基,其中R7和R8独立选自C1-C3的烷基;
环A选自芳香性的单环和芳香性的二环,芳香性的二环中的两个环可以为并环也可以为两个独立芳香环通过共价键连接,上述所指的芳香性的单环和芳香性的二环为5-12元环并且可以在环内含有一个S原子;环A可以以任意可能的位置与化合物I的其它部分连接;
R5和R6的定义优选自如下几种情况:
(1)R5=R6=Me;
(2)R5=Me,R6=H;
(3)R5=Me,R6=F;
(4)R5=F,R6=H。
3.权利要求2所定义的具有通式I的化合物及其药学上可以接受的盐,其中,
R1、R2、R3、R4独立选自F,Cl,OR7,SR8,OCF3,CF3,CHF2,CH2F,C1-C3的烷基,含3-4个碳原子的环烷基,其中R7和R8独立选自C1-C3的烷基;
环A选自苯环,苯并噻吩环,苯并呋喃环,甘葡环烃(azulene),以任何可能的形式通过共价键连接的苯环和噻吩环,以任何可能的形式通过共价键连接的苯环和呋喃环,环A可以以任意可能的位置与化合物I的其它部分连接;
R5和R6的定义更优选自如下几种情况:
(1)R5=R6=Me;
(2)R5=Me,R6=H;
(3)R5=F,R6=H。
4.权利要求1-3所定义的通式I化合物及其药学上可以接受的盐在制备治疗糖尿病药物方面的应用。
5.一种药物组合物,含有权利要求1-3之一的通式I化合物及其药学上可以接受的盐,以及适当的载体或赋形剂。
6.权利要求5所述的药物组合物,其中,所述的组合物为固体口服制剂、液体口服制剂或注射剂。
7.根据权利要求6所述固体及液体口服制剂包括:片剂、胶囊、颗粒剂、口服溶液剂,所述注射剂制剂包括注射用水针、注射用冻干粉针、大输液、小输液。
Priority Applications (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN2010105223370A CN102134226B (zh) | 2010-01-26 | 2010-10-27 | 一类苯基c-葡萄糖苷衍生物、其制备方法和用途 |
| US13/575,258 US9062087B2 (en) | 2010-01-26 | 2011-01-14 | Phenyl C-glucoside derivatives, preparation methods and uses thereof |
| AU2011209004A AU2011209004B2 (en) | 2010-01-26 | 2011-01-14 | Phenyl C-glucoside derivatives, preparation methods and uses thereof |
| EP11736592.4A EP2530079A4 (en) | 2010-01-26 | 2011-01-14 | PHENYL-C-GLUCOSIDE DERIVATIVES, PREPARATION METHODS AND USES THEREOF |
| JP2012550305A JP2013518065A (ja) | 2010-01-26 | 2011-01-14 | フェニルc−グルコシド誘導体並びにその調製方法及び使用 |
| PCT/CN2011/000061 WO2011091710A1 (zh) | 2010-01-26 | 2011-01-14 | 苯基c-葡萄糖苷衍生物、其制备方法和用途 |
| KR1020127022091A KR20120107526A (ko) | 2010-01-26 | 2011-01-14 | 페닐 c?글루코사이드 유도체 및 그의 제조 방법 및 용도 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201010101146.7 | 2010-01-26 | ||
| CN201010101146 | 2010-01-26 | ||
| CN2010105223370A CN102134226B (zh) | 2010-01-26 | 2010-10-27 | 一类苯基c-葡萄糖苷衍生物、其制备方法和用途 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN102134226A CN102134226A (zh) | 2011-07-27 |
| CN102134226B true CN102134226B (zh) | 2013-06-12 |
Family
ID=44294177
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2010105223370A Active CN102134226B (zh) | 2010-01-26 | 2010-10-27 | 一类苯基c-葡萄糖苷衍生物、其制备方法和用途 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US9062087B2 (zh) |
| EP (1) | EP2530079A4 (zh) |
| JP (1) | JP2013518065A (zh) |
| KR (1) | KR20120107526A (zh) |
| CN (1) | CN102134226B (zh) |
| AU (1) | AU2011209004B2 (zh) |
| WO (1) | WO2011091710A1 (zh) |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102675378A (zh) * | 2011-03-09 | 2012-09-19 | 天津药物研究院 | 一类含环丙烷结构的c-葡萄糖苷衍生物、其制备方法和用途 |
| KR101609859B1 (ko) * | 2011-04-25 | 2016-04-07 | 베이징 프릴루드 팜. 에스씨아이. & 테크. 씨오., 엘티디. | 소듐-의존적 포도당 운반 단백질의 억제제 및 이의 제조방법 및 용도 |
| CN102827122B (zh) * | 2011-06-17 | 2015-01-14 | 山东轩竹医药科技有限公司 | 糖苷衍生物 |
| CN102408459B (zh) * | 2011-09-29 | 2014-07-23 | 天津药物研究院 | 一类含异头位烷基的苯基c-葡萄糖苷衍生物、其制备方法和用途 |
| CN103058972B (zh) * | 2013-01-17 | 2014-12-10 | 天津药物研究院 | 一类含环己烷结构的苯基c-葡萄糖苷衍生物、其制备方法和用途 |
| WO2014164286A1 (en) * | 2013-03-11 | 2014-10-09 | Janssen Pharmaceutica Nv | Dual sglt1/sglt2 inhibitors |
| CN104418830A (zh) * | 2013-09-10 | 2015-03-18 | 天津药物研究院 | (1s)-1,6-二脱氧-1-[4-甲氧基-3-(反式-4-正丙基环己基)甲基苯基]-d-葡萄糖的制备工艺 |
| WO2015043511A1 (en) | 2013-09-27 | 2015-04-02 | Sunshine Lake Pharma Co., Ltd. | Glucopyranosyl derivatives and their uses in medicine |
| CN103739581B (zh) * | 2014-01-23 | 2016-11-23 | 中国药科大学 | C-芳基葡萄糖苷sglt2抑制剂 |
| CN104860793A (zh) * | 2014-02-20 | 2015-08-26 | 天津药物研究院 | 一类苯基c-葡萄糖苷衍生物中间体的制备方法 |
| CN105753910A (zh) * | 2014-12-16 | 2016-07-13 | 康普药业股份有限公司 | 一种卡格列净中间体的制备方法 |
| MY194941A (en) * | 2016-01-04 | 2022-12-27 | Je Il Pharmaceutical Co Ltd | C-glycoside derivatives having fused phenyl ring or pharmaceutically acceptable salts thereof, method for preparing the same and pharmaceutical composition comprising the same |
| EP3497090B1 (en) * | 2016-08-09 | 2022-08-03 | Laurus Labs Limited | Novel processes for preparation of dapagliflozin or its solvates or co-crystals thereof |
| US20180203457A1 (en) * | 2017-01-13 | 2018-07-19 | Ford Global Technologies, Llc | System and Method for Avoiding Interference with a Bus |
| EP3621977A4 (en) * | 2017-05-09 | 2021-04-07 | Piramal Pharma Limited | SGLT2 INHIBITOR PREPARATION PROCESS AND ITS INTERMEDIARIES |
| CN107163092B (zh) * | 2017-06-13 | 2020-05-19 | 杭州科巢生物科技有限公司 | Sglt-2糖尿病抑制剂及其中间体的制备方法 |
| CN110141566B (zh) * | 2018-02-11 | 2022-04-19 | 清华大学深圳研究生院 | Sglt2抑制剂在调控炎症中的应用 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004359630A (ja) * | 2003-06-06 | 2004-12-24 | Yamanouchi Pharmaceut Co Ltd | ジフルオロジフェニルメタン誘導体及びその塩 |
| CN1829729A (zh) * | 2003-08-01 | 2006-09-06 | 田边制药株式会社 | 新颖化合物 |
| CN101065391A (zh) * | 2004-09-23 | 2007-10-31 | 布里斯托尔-迈尔斯斯奎布公司 | C-芳基葡糖苷sglt2抑制剂和方法 |
| CN101503399A (zh) * | 2008-02-04 | 2009-08-12 | 白鹭医药技术(上海)有限公司 | C-芳基葡萄糖苷sglt2抑制剂 |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6515117B2 (en) * | 1999-10-12 | 2003-02-04 | Bristol-Myers Squibb Company | C-aryl glucoside SGLT2 inhibitors and method |
| TWI254635B (en) * | 2002-08-05 | 2006-05-11 | Yamanouchi Pharma Co Ltd | Azulene derivative and salt thereof |
| RU2317288C3 (ru) * | 2003-03-14 | 2021-03-10 | Астеллас Фарма Инк. | С-гликозидные производные и их соли |
| SG130189A1 (en) * | 2003-08-01 | 2007-03-20 | Janssen Pharmaceutica Nv | Substituted indole-o-glucosides |
| US20080139484A1 (en) * | 2004-09-29 | 2008-06-12 | Kissei Pharmaceutical Co., Ltd. | 1(Beta-D-Glycopyranosyl)-3-Substituted Nitrogenous Heterocyclic Compound, Medicinal Composition Containing the Same, and Medicinal Use Thereof |
| DE102004048388A1 (de) * | 2004-10-01 | 2006-04-06 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | D-Pyranosyl-substituierte Phenyle, diese Verbindungen enthaltende Arzneimittel, deren Verwendung und Verfahren zu ihrer Herstellung |
| CN101652377A (zh) * | 2007-04-02 | 2010-02-17 | 泰拉科斯有限公司 | 苄基化糖苷衍生物及其用法 |
| LT2187742T (lt) * | 2007-08-23 | 2018-01-10 | Theracos Sub, Llc | (2s,3r,4r,5s,6r)-2-(4-chlor-3-benzilfenil)-6-(hidroksimetil)tetrahidro-2h-piran-3,4,5-triolio dariniai, skirti panaudoti diabeto gydymui |
| AU2009270936B2 (en) * | 2008-07-15 | 2014-12-18 | Theracos, Inc. | Deuterated benzylbenzene derivatives and methods of use |
| US8163704B2 (en) * | 2009-10-20 | 2012-04-24 | Novartis Ag | Glycoside derivatives and uses thereof |
-
2010
- 2010-10-27 CN CN2010105223370A patent/CN102134226B/zh active Active
-
2011
- 2011-01-14 KR KR1020127022091A patent/KR20120107526A/ko not_active Ceased
- 2011-01-14 EP EP11736592.4A patent/EP2530079A4/en not_active Withdrawn
- 2011-01-14 WO PCT/CN2011/000061 patent/WO2011091710A1/zh active Application Filing
- 2011-01-14 AU AU2011209004A patent/AU2011209004B2/en not_active Ceased
- 2011-01-14 US US13/575,258 patent/US9062087B2/en not_active Expired - Fee Related
- 2011-01-14 JP JP2012550305A patent/JP2013518065A/ja active Pending
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004359630A (ja) * | 2003-06-06 | 2004-12-24 | Yamanouchi Pharmaceut Co Ltd | ジフルオロジフェニルメタン誘導体及びその塩 |
| CN1829729A (zh) * | 2003-08-01 | 2006-09-06 | 田边制药株式会社 | 新颖化合物 |
| CN101065391A (zh) * | 2004-09-23 | 2007-10-31 | 布里斯托尔-迈尔斯斯奎布公司 | C-芳基葡糖苷sglt2抑制剂和方法 |
| CN101503399A (zh) * | 2008-02-04 | 2009-08-12 | 白鹭医药技术(上海)有限公司 | C-芳基葡萄糖苷sglt2抑制剂 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20130023486A1 (en) | 2013-01-24 |
| AU2011209004A1 (en) | 2012-09-06 |
| EP2530079A4 (en) | 2013-06-19 |
| JP2013518065A (ja) | 2013-05-20 |
| KR20120107526A (ko) | 2012-10-02 |
| CN102134226A (zh) | 2011-07-27 |
| US9062087B2 (en) | 2015-06-23 |
| EP2530079A1 (en) | 2012-12-05 |
| WO2011091710A1 (zh) | 2011-08-04 |
| AU2011209004B2 (en) | 2015-04-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN102134226B (zh) | 一类苯基c-葡萄糖苷衍生物、其制备方法和用途 | |
| KR101837488B1 (ko) | 광학적으로 순수한 벤질-4-클로로페닐-c-글루코사이드 유도체 | |
| CN102146066A (zh) | 一类含饱和六元环的c-葡萄糖苷衍生物、其制备方法和用途 | |
| KR20140004783A (ko) | 소듐-의존적 포도당 운반 단백질의 억제제 및 이의 제조방법 및 용도 | |
| CN101508712A (zh) | 含四氮唑结构的葡萄糖苷、其制备方法和用途 | |
| CN113929698B (zh) | 二芳基庚烷二聚体及其药物组合物与其制备方法和应用 | |
| CN113214209B (zh) | 橙皮素与卡马西平共晶物及制备方法和其组合物与用途 | |
| CN103058972B (zh) | 一类含环己烷结构的苯基c-葡萄糖苷衍生物、其制备方法和用途 | |
| CN115894240A (zh) | 曲前列尼尔的前体药物及其应用 | |
| CN102675378A (zh) | 一类含环丙烷结构的c-葡萄糖苷衍生物、其制备方法和用途 | |
| CN104861002A (zh) | 含3,6-脱水葡萄糖结构的苯基c-葡萄糖苷衍生物及其制备方法和用途 | |
| CN103570657A (zh) | 一类含偕二甲基的苯基c-葡萄糖苷衍生物、其制备方法和用途 | |
| CN102408459B (zh) | 一类含异头位烷基的苯基c-葡萄糖苷衍生物、其制备方法和用途 | |
| CN115124419B (zh) | 大黄酸与金雀花碱共晶物及制备方法和其组合物与用途 | |
| CN115124420B (zh) | 大黄酸与苦参碱共晶物水合物及制备方法和其组合物与用途 | |
| CN101550112B (zh) | 4,5-二取代噻唑衍生物、其制备方法和用途 | |
| CN101463055B (zh) | 一类o-糖苷化合物、其制备方法和用途 | |
| JP7457033B2 (ja) | アルドース還元酵素阻害剤の塩、及びその製造方法と使用 | |
| CN101508713A (zh) | 含1,2,3-三氮唑结构的葡萄糖苷、其制备方法和用途 | |
| CN113214208A (zh) | 橙皮素与异烟酰胺共晶物及制备方法和其组合物与用途 | |
| CN115245487A (zh) | 美沙拉嗪与马来酸共晶物及制备方法和其组合物与用途 | |
| CN101684103B (zh) | 1,2,4-三唑结构的化合物、其制备方法和用途 | |
| CN101684088B (zh) | 氰甲基吡咯衍生物、其制备方法和用途 | |
| CN113214206B (zh) | 橙皮素与甜菜碱共晶物b及制备方法和其组合物与用途 | |
| CN104761523B (zh) | 含3‑氧代葡萄糖结构的苯基c‑葡萄糖苷衍生物、其制备方法和用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant |