Thiofeen
| Thiofeen | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
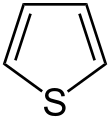
| |||||
Structuurformule van thiofeen
| |||||
| Algemeen | |||||
| Molecuulformule | C4H4S | ||||
| IUPAC-naam | thiofeen | ||||
| Andere namen | thiofuraan | ||||
| Molmassa | 84,13 g/mol | ||||
| SMILES | c1ccsc1
| ||||
| InChI | 1S/C4H4S/c1-2-4-5-3-1/h1-4H
| ||||
| CAS-nummer | 110-02-1 | ||||
| EG-nummer | 203-729-4 | ||||
| Wikidata | Q305364 | ||||
| Vergelijkbaar met | furaan | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H225 - H302 - H315 - H318 - H331 - H335 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P210 - P261 - P280 - P305+P351+P338 - P311 | ||||
| ADR-klasse | 3 | ||||
| LD50 (ratten) | (oraal) 1400 mg/kg | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vloeibaar | ||||
| Kleur | kleurloos | ||||
| Dichtheid | 1,051 g/cm³ | ||||
| Smeltpunt | −38 °C | ||||
| Kookpunt | 84 °C | ||||
| Vlampunt | -1 °C | ||||
| Goed oplosbaar in | benzeen, chloroform | ||||
| Onoplosbaar in | water | ||||
| Brekingsindex | 1,5287 | ||||
| Geometrie en kristalstructuur | |||||
| Dipoolmoment | 0,55 D | ||||
| Thermodynamische eigenschappen | |||||
| ΔfH |
80,2 kJ/mol | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Thiofeen is een heterocyclische aromatische verbinding met als brutoformule C4H4S. De stof komt voor als een kleurloze vloeistof, waarvan de geur lijkt op die van benzeen. Thiofeen kan opgevat worden als een onverzadigde versie van het verzadigde tetrahydrothiofeen, dat dienstdoet als aardgasadditief.
Voorkomen
[bewerken | brontekst bewerken]Thiofeen en derivaten ervan, zoals benzothiofeen, wordt aangetroffen in petroleum, vaak in relatief hoge concentraties (1 tot 3%). Het was de Duitse scheikundige Viktor Meyer die erin slaagde thiofeen te isoleren uit petroleum.[1]
Petroleum wordt ontzwaveld door een reeks chemische behandelingen, het hydro-ontzwavelen. Daarbij wordt ook thiofeen verwijderd. Bij dit proces wordt petroleum geleid over een katalystor, molybdeendisulfide, onder een waterstofgasatmosfeer. Daarbij wordt thiofeen omgezet tot koolwaterstoffen (onder andere butaan) en waterstofsulfide. Dit waterstofsulfide wordt vervolgens verwijderd via het Clausproces.
Synthese
[bewerken | brontekst bewerken]Thiofeen en derivaten ervan kunnen bereid worden door middel van de Paal-Knorr-synthese. Daarbij reageert een 1,4-diketon met fosforpentasulfide. Een variant op deze methode is de Volhard-Erdmann-cyclisatie. Alternatieve methoden maken gebruik van Lawesson-reagens. Met behulp van de Gewald-reactie kunnen aminothiofenen bereid worden.
Op industriële schaal wordt thiofeen bereid door een butaanderivaat (n-butaan, 1-buteen, 1,3-butadieen of 1-butanol) te laten reageren met zwaveldioxide of koolstofdisulfide over een oxide-katalysator bij 500-550 °C.
Eigenschappen
[bewerken | brontekst bewerken]Thiofeen is een bij kamertemperatuur kleurloze vloeistof met een karakteristieke geur, gelijkend op die van benzeen. Met benzeen deelt thiofeen een aantal eigenschappen. Zo verschillen de stoffen slechts 4 °C in hun kookpunten, hetgeen het lastig maakt beide te scheiden, zelfs met een gefractioneerde destillatie. Net zoals benzeen vormt ook thiofeen een azeotroop met ethanol.
De thiofeenmolecule is vlak en aromatisch. De bindingshoek rond zwavel bedraagt 93°.
Toepassingen
[bewerken | brontekst bewerken]Thiofeen is een bouwsteen in de organische synthese. Het ondergaat diverse reacties, waaronder oxidatie en elektrofiele aromatische substitutie.
Thiofeen kan gepolymeriseerd worden tot polythiofeen, waarbij de thiofeeneenheden met elkaar verbonden zijn aan de 2- en 5-posities. Polythiofeen kan door dotering met een elektronacceptor als jood of een sulfonzuur geleidend gemaakt worden, en gebruikt worden als een organische halfgeleider. Zuiver polythiofeen is echter onoplosbaar en moeilijk te verwerken, in tegenstelling tot polymeren van thiofeenderivaten met een functionele groep gesubstitueerd op de 3- en/of 4-positie, bijvoorbeeld poly(3-methylthiofeen), poly(3-butylthiofeen) of poly(3,4-ethyleendioxythiofeen).
Externe links
[bewerken | brontekst bewerken]- (en) Gegevens van thiofeen in de GESTIS-stoffendatabank van het IFA
- (en) MSDS van thiofeen
- ↑ (en) Ward C., Sumpter (1944). "The Chemistry of Isatin". Chemical Reviews. 34 (3): 393–434. doi:10.1021/cr60109a003


