Joodmonochloride
| Joodmonochloride | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
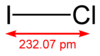
| ||||
Structuurformule van joodmonochloride
| ||||

| ||||
Molecuulmodel van joodmonochloride
met jood links en chloor rechts | ||||
| Algemeen | ||||
| Molecuulformule | ICl | |||
| IUPAC-naam | joodmonochloride | |||
| Molmassa | 162,35 g/mol | |||
| CAS-nummer | 7790-99-0 | |||
| Wikidata | Q414607 | |||
| Beschrijving | Roodbruine vloeistof | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H314 - H334 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P261 - P280 - P305+P351+P338 - P310 | |||
| Fysische eigenschappen | ||||
| Dichtheid | 3.10 g/cm³ | |||
| Smeltpunt | (α-form) 27 °C | |||
| Kookpunt | 97,4 °C | |||
| Goed oplosbaar in | koolstofdisulfide, azijnzuur, pyridine | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Joodmonochloride is een interhalogeenverbinding met als brutoformule ICl. Het is een rood-bruine corrosieve verbinding met een smeltpunt dicht tegen kamertemperatuur. Door het verschil in elektronegativiteit tussen jood en chloor is ICl een polaire verbinding die zich gedraagt als een bron van I+ (jodonium-ionen).
Synthese
[bewerken | brontekst bewerken]De bereiding van joodmonochloride verloopt door de twee halogenen met elkaar te mengen:
Als chloorgas over joodkristallen geleid wordt, is de vorming van de bruine joodmonochloride-damp duidelijk waarneembaar. Joodmonochloride kan vervolgens als vloeistof verzameld worden. Een overmaat chloor zet joodmonochloride in een reversibele reactie om in joodtrichloride volgens:
Polymorfie
[bewerken | brontekst bewerken]Van ICl zijn twee polymorfe vormen bekend. α-ICl vormt rood doorschijnende, zwarte naalden met een smeltpunt van 27,2 °C, β-ICl bestaat uit zwarte plaatvormige kristelen, roodbruin bij dioorvallend licht, met een smeltpunt van 13,9 °C.[1]
Toepassingen
[bewerken | brontekst bewerken]In de organische synthese is joodmonochloride een zeer bruikbaar reagens.[1] Het wordt gebruikt als een bron van elektrofiel jood (I+) in de synthese van een aantal aromatische joodverbindingen. Joodmonochloride is ook in staat om binding tussen koolstof en silicium te verbreken.
Joodmonochloride addeert aan dubbele bindingen in alkanen, waarbij chloor-joodalkanen worden gevormd:
Als deze reactie in aanwezigheid van natriumazide wordt uitgevoerd, ontstaat het joodazide.
In tegenstelling tot de algemene reactie van interhalogenen, reageert joodmonochloride met water onder ontleding naar de elementen.[2]
Met droog (= watervrij) HCl-gas reageert ICl onder vorming van waterstofdichloorjodaat:[2]
- ↑ a b R.G. Brisbois, R.A. Wanke, K.A. Stubbs & R.V. Stick - Iodine Monochloride, Encyclopedia of Reagents for Organic Synthesis, 2004, John Wiley & Sons
- ↑ a b joodmonochloride. Gearchiveerd op 24 november 2022.

