Ammoniumdichromaat
| Ammoniumdichromaat | |||||||
|---|---|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||||
| |||||||
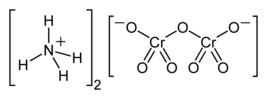
Structuurformule van ammoniumdichromaat
| |||||||

| |||||||
Ammoniumdichromaatpoeder
| |||||||
| Algemeen | |||||||
| Molecuulformule | (NH4)2Cr2O7 | ||||||
| IUPAC-naam | ammoniumdichromaat | ||||||
| Molmassa | 252,1 g/mol | ||||||
| CAS-nummer | 7789-09-5 | ||||||
| EG-nummer | 232-143-1 | ||||||
| Wikidata | Q422430 | ||||||
| Beschrijving | Oranje-rode kristallen | ||||||
| Waarschuwingen en veiligheidsmaatregelen | |||||||
| |||||||
| H-zinnen | H272 - H301 - H312 - H314 - H317 - H330 - H334 - H340 - H350 - H360 - H372 - H410[1] | ||||||
| EUH-zinnen | geen | ||||||
| P-zinnen | P201 - P220 - P260 - P273 - P280 - P284[1] | ||||||
| Carcinogeen | ja | ||||||
| EG-Index-nummer | 024-003-00-1 | ||||||
| VN-nummer | 1439 | ||||||
| ADR-klasse | Gevarenklasse 5.1 | ||||||
| Fysische eigenschappen | |||||||
| Aggregatietoestand | vast | ||||||
| Kleur | oranje-rood | ||||||
| Dichtheid | 2,15 g/cm³ | ||||||
| Smeltpunt | (ontleedt) 180 °C | ||||||
| Oplosbaarheid in water | 360 g/L | ||||||
| Goed oplosbaar in | water | ||||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||||
| |||||||
Ammoniumdichromaat (NH4)2Cr2O7 is het ammoniumzout van dichroomzuur (H2Cr2O7). Het is een oranje tot rood kristallijn poeder, dat goed oplosbaar is in water. Het is een zeer giftige, oxiderende, milieugevaarlijke en mogelijk explosieve stof.
Ontleding van ammoniumdichromaat
[bewerken | brontekst bewerken]Ammoniumdichromaat ontleedt bij verhitting boven 180°C, waarbij chroom(III)oxide, stikstofgas en waterdamp gevormd worden:
Deze reactie is exotherm en de vrijgekomen warmte zorgt dat de reactie zichzelf kan onderhouden bij een temperatuur boven 225°C.
De ontbinding is een populaire demonstratieproef in studentenlaboratoria. Wanneer men een hoopje ammoniumdichromaat verhit met de vlam van een bunsenbrander, ontstaat een reactie die op een vulkaanuitbarsting lijkt: het chroom(III)oxide (Cr2O3) vormt een groene kegel en de ontsnappende gassen (stikstof en waterdamp) blazen stofdeeltjes de lucht in.
Bij het uitvoeren van deze proef dient men wel een aantal veiligheidsvoorschriften te volgen, daar ammoniumdichromaat een giftige, kankerverwekkende stof is.

Toxicologie en veiligheid
[bewerken | brontekst bewerken]Ammoniumdichromaat is een sterk oxiderende stof, die reageert met brandbare en reducerende stoffen (bijvoorbeeld zwavel of fosfor); de reactie kan hevig of explosief zijn. De stof reageert heftig met organische oplosmiddelen. De oplossing in water is een zwak zuur. De ontleding ten gevolge van verhitting kan explosief zijn.
Het is een corrosieve stof, die de ogen, de huid en de ademhalingswegen aantast. De stof kan opgenomen worden door de huid. De stof kan effecten hebben op de nieren en de lever.
Langdurige of herhaalde blootstelling kan de huid gevoelig maken. Het kan leiden tot astma en schade aan de ademhalingswegen of de nieren.
Ammoniumdichromaat is een kankerverwekkende stof voor de mens. De stof wordt ook gerekend tot de mutagene stoffen en tot de stoffen die voor de voortplanting giftig zijn.
Ammoniumdichromaat is zeer toxisch voor waterorganismen. Het kan op lange termijn effecten veroorzaken in waterig milieu.
Toepassingen
[bewerken | brontekst bewerken]Ammoniumdichromaat wordt onder andere gebruikt in pyrotechnisch materiaal; in (analoge) fotografie, bepaalde drukprocedés en de productie van lcd-schermen (ammoniumdichromaat maakt een oplossing van gelatine of andere colloïden lichtgevoelig). Het wordt gebruikt in de synthese van andere stoffen zoals chroom(III)oxide (een groen pigment).
Externe links
[bewerken | brontekst bewerken] ammoniumdichromaat - International Chemical Safety Card
ammoniumdichromaat - International Chemical Safety Card- Experimenten online: ontleding ammoniumdichromaat
- ↑ a b c Productinformatie in de Online catalogus van Sigma Aldrich, geraadpleegd op 30 mars 2022.




