HIPK2
HIPK2(homeodomain-interacting protein kinase 2)は、ヒトではHIPK2遺伝子にコードされる酵素である[5]。HIPK2はセリン/スレオニンキナーゼに分類され、ホメオドメイン型転写因子と相互作用する[6]。DYRKキナーゼと呼ばれるプロテインキナーゼのファミリーに属する[7]。このファミリー内では、HIPK2はHIPK1やHIPK3とともにHIPK(homeodomain-interacting protein kinase)グループに属する[8]。HIPK2はさまざまな生物種に広く存在し、その遺伝子発現やアポトーシスにおける機能はいくつかの異なる機構によって調節されている。
発見
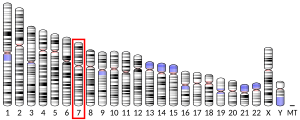
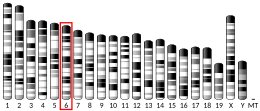
[編集]HIPK2はHIPK1、HIPK3とともに1998年に発見された。これらのHIPKは、NKホメオドメイン関連転写因子と相互作用する因子を産生する遺伝子の同定を目的としたツーハイブリッド法によるスクリーニングから発見された[8]。ツーハイブリッドスクリーニングはcDNAクローニングとともに行われ、ホメオドメイン型転写因子とマウス胚cDNAライブラリとマウスのホメオドメインタンパク質Nkx-1.2を用いて探索が行われた[8]。その結果、類似したタンパク質配列を持つ複数のクローンが発見され、それらがコードするタンパク質はホメオドメインタンパク質と強く相互作用し、プロテインキナーゼに特徴的な活性部位を持つことが示された[8]。こうした特徴からHIPKという名称が付けられた。2000年、HIPK2遺伝子はヒトゲノム中では7番染色体の長腕に位置することが発見された。マウスでは、対応する遺伝子は6番染色体上に位置する[7]。
相同性
[編集]HIPKが幅広い生物種間で進化的に保存されたタンパク質であることを示唆する証拠が存在する。ヒトのHIPKの配列は線虫Caenorhabditis elegansのゲノム中の配列と高い類似性がみられる[8]。HIPKは酵母のYAK1とも高い類似性がみられ、タマホコリカビ属Dictyosteliumのキナーゼも同じファミリーに属する[7][8]。さらに、HIPKは他の種のホメオタンパク質とも相互作用することが可能であり、上のスクリーニングから得られたHIPKはNkx-1.2だけでなくNkx-2.5やショウジョウバエのNK-1やNK-3とも相互作用した[8]。HIPK2はイヌ[9]、ネコ[10]、ヒツジ[11]、ゼブラフィッシュ[12]やその他多くの種でも発見されている。
局在
[編集]組織中の発現
[編集]HIPK2はほぼすべての組織で発現しているが、心臓、筋肉、腎臓で高度に発現しており[13]、脳と神経組織で最も高いレベルで発現していることが示されている[14]。ヒトでは成体組織に加えて胚発生の終盤でも発現しており、具体的には網膜、筋肉、神経組織で発現している。
細胞内局在
[編集]HIPK2は核内の核スペックルと呼ばれる構造体に存在している[7][15]。また、PMLボディと呼ばれる核内構造体とも結合している[16]。HIPK2は主に核内に存在するが、細胞質に存在することもある[17]。
構造
[編集]遺伝子
[編集]HIPK2遺伝子は13個のエクソンからなり、全長は59.1 kbである[18][19]。他のHIPKと同じく、プロテインキナーゼドメイン、ホメオドメイン相互作用ドメイン、PEST配列、YHドメインを含んでいる[8]。選択的スプライシングによって3つの異なるmRNAが産生され、3つの異なるタンパク質アイソフォームが産生される[20]。
タンパク質
[編集]HIPK2タンパク質の長さは1198アミノ酸で、130.97 kDaである[21][22]。タンパク質中に最も豊富に含まれるアミノ酸はセリン、スレオニン、アラニンであり、タンパク質の全アミノ酸の約30%を占める[21]。タンパク質はその機能、調節、局在と直接的に関係したいくつかの領域から構成されている。プロテインキナーゼドメインは約330アミノ酸長で、N末端付近に位置する[23][24]。キナーゼドメインに加えて、HIPK2は2つの核局在化シグナル[25]、SUMO相互作用モチーフ[25]、自己阻害ドメイン[23]、転写コリプレッサードメインを有する。いくつかの相互作用ドメインも存在し、そのうちの1つはp53と相互作用する[26]。HIPK2を核スペックルへ標的化するシグナルが存在し、HIPK2の核スペックルへの保持を引き起こすスペックル保持配列も存在する[17]。自己阻害ドメインはC末端に位置し、ユビキチン化部位K1182を含んでいる[24]。
機能
[編集]HIPK2には2つの主要な機能が存在する。1つはNKホメオドメイン転写因子のコリプレッサーとしての作用であり、転写因子のDNA結合親和性を高めて転写抑制効果を高める[8]。HIPK2はホメオボックス遺伝子の調節へ寄与することで遺伝子発現調節に関与する。これらの遺伝子は転写因子をコードしており、それぞれ標的遺伝子を調節する[8]。HIPK2のもう1つの機能はシグナル伝達における作用であり、具体的にはプログラム細胞死(アポトーシス)を導く経路に関与する。HIPK2はp53と関係した機構または異なる機構によってアポトーシスを促進する。HIPK2はp53のS46残基をリン酸化して活性化し、その結果アポトーシスを誘導する因子の転写が引き起こされる[27]。HIPK2によるp53のリン酸化は、p53の負の調節因子であるMdm2の結合を防ぎ、機能的に重要な修飾であるp53のK382のアセチル化にも必要である[27]。p53の機能には適切なフォールディングが必要不可欠であり、それは亜鉛の存在に依存している。HIPK2は亜鉛の調節に関与しているため[28]、HIPK2が存在しない場合p53は誤ったフォールディングを行う[27]。HIPK2はp53の負の調節因子であるCtBP1やMdm2をリン酸化し、プロテアソームによる分解を導くことでp53の活性を間接的に上昇させる[27][29]。また、HIPK2は酸化遺伝子と抗酸化遺伝子の双方の発現を調節することで活性酸素種に対する細胞応答を調節する能力を持つ[30]。
調節
[編集]HIPK2は他のタンパク質や細胞条件、翻訳後修飾によっても調節される[30][31][32][33]。
正の調節
[編集]DNA損傷条件下では、HIPK2は安定化されて正の調節を受ける。HIPK2の活性はカスパーゼ-6の作用によって増大する[17]。カスパーゼ-6はHIPK2をD916とD977残基で切断する[17]。その結果、自己阻害ドメインが除去されてHIPK2の活性は増大する。HIPK2の活性はチェックポイントキナーゼの作用によっても増大する。これらのキナーゼはHIPK2関連ユビキチンリガーゼをリン酸化し、HIPK2への結合を妨げる。その結果、ユビキチン-プロテアソーム経路によるHIPK2の分解が阻害される[17][31]。酸化ストレス条件下では、HIPK2のSUMO化が防がれてアセチル化が促進され、その結果アポトーシスを促進する機能が維持される[30]。HIPK2のアセチル化は、p300を介して行われる[32]。HIPK2のT880とS882のリン酸化は他のキナーゼまたは自己リン酸化によって行われ、PIN1のリクルートとHIPK2の安定化がもたらされ、その結果HIPK2のアポトーシス機能は増大する[33]。
負の調節
[編集]通常の条件下ではHIPK2は不安定であり、負の調節を受けている。HIPK2はユビキチン-プロテアソーム経路による調節を受ける。ユビキチンリガーゼがHIPK2に結合し、K1182残基のポリユビキチン化、プロテアソームへの局在、その後のタンパク質分解が引き起こされる[17][31]。HIPK2にみられるPEST配列もタンパク質分解と関係している[34]。HIPK2の活性はHMGA1によってもダウンレギュレーションされ、HMGA2はHIPK2を細胞質へ輸送する[17]。酸化ストレス条件下ではHIPK2のSUMO化が抑制されてアセチル化が促進され、HIPK2は安定化されてアポトーシスが促進される[30]。
p53
[編集]p53はHIPK2を正にも負にも調節する[17]。p53はカスパーゼ-6遺伝子の3番目のイントロンに結合し、遺伝子の活性化を促進する[35]。その後カスパーゼ-6はHIPK2を活性化する。逆に、p53はユビキチンリガーゼMdm2を活性化することでHIPK2をダウンレギュレーションする。Mdm2とHIPK2の相互作用はHIPK2のユビキチン化をもたらし、最終的にはHIPK2は分解される[17]。
変異
[編集]スペックル保持配列に2つの変異が発見されており、いずれもミスセンス変異である[36]。1つの変異はR868Wであり、野生型ではアルギニン(R)である868番残基がトリプトファン(W)へ置換されている。1つの変異はN958Iであり、野生型ではアスパラギン(N)である958番残基がイソロイシン(I)へ置換されている。R868W変異はシトシンからチミンへの点変異、N958I変異はアデニンからチミンへの点変異の結果生じたものである[36]。R868W変異はエクソン12に、N958Iはエクソン13にそれぞれ位置する[36]。これらの変異はHIPK2の活性を低下させ、核スペックルへの局在に異常が生じる[36]。スペックル保持配列はHIPK2の転写関連機能に必要であり、この配列の欠失によって機能は阻害される[36]。
臨床的意義
[編集]HIPK2の不適切な機能は、スペックル保持配列の変異によって急性骨髄性白血病と骨髄異形成症候群の[36]、HIPK2の過剰分解によってアルツハイマー病の[37]、それぞれ病理に関与していることが示唆されている。HIPK2の組織発現パターンと一致して、HIPK2の機能の喪失は腎線維化[38]や心血管疾患[39]への関与が示唆されている。
相互作用
[編集]HIPK2は次に挙げる因子と相互作用する。
- CREB結合タンパク質[40]
- p53[27]
- p300[32]
- SKI[41]
- TP53INP1[42]
- ATM[17]
- PIN1[33]
- HMGA1[17]
- SIAH1[17]
- WSB1[17]
- カスパーゼ-6[35]
- TACR3[8]
- Mdm2[34]
- CTBP1[29]
出典
[編集]- ^ a b c GRCh38: Ensembl release 89: ENSG00000064393 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000061436 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ “Isolation and characterization of cDNAs for the protein kinase HIPK2”. Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression 1518 (1–2): 168–72. (March 2001). doi:10.1016/S0167-4781(00)00308-0. PMID 11267674.
- ^ “Differential interactions of the homeodomain-interacting protein kinase 2 (HIPK2) by phosphorylation-dependent sumoylation”. FEBS Letters 579 (14): 3001–8. (June 2005). doi:10.1016/j.febslet.2005.04.053. PMID 15896780.
- ^ a b c d “Human homeodomain-interacting protein kinase-2 (HIPK2) is a member of the DYRK family of protein kinases and maps to chromosome 7q32-q34”. Biochimie 82 (12): 1123–7. (2000). doi:10.1016/S0300-9084(00)01196-2. PMID 11120354.
- ^ a b c d e f g h i j k “Homeodomain-interacting protein kinases, a novel family of co-repressors for homeodomain transcription factors”. The Journal of Biological Chemistry 273 (40): 25875–9. (October 1998). doi:10.1074/jbc.273.40.25875. PMID 9748262.
- ^ “HIPK2 homeodomain interacting protein kinase 2 [Canis lupus familiaris (dog) - Gene - NCBI]”. www.ncbi.nlm.nih.gov. 2017年11月29日閲覧。
- ^ “HIPK2 homeodomain interacting protein kinase 2 [Felis catus (domestic cat) - Gene - NCBI]”. www.ncbi.nlm.nih.gov. 2017年11月29日閲覧。
- ^ “HIPK2 homeodomain interacting protein kinase 2 [Ovis aries (sheep) - Gene - NCBI]”. www.ncbi.nlm.nih.gov. 2017年11月29日閲覧。
- ^ “hipk2 homeodomain interacting protein kinase 2 [Danio rerio (zebrafish) - Gene - NCBI]”. www.ncbi.nlm.nih.gov. 2017年11月29日閲覧。
- ^ “The homeodomain-interacting protein kinase 2 gene is expressed late in embryogenesis and preferentially in retina, muscle, and neural tissues”. Biochemical and Biophysical Research Communications 290 (3): 942–7. (January 2002). doi:10.1006/bbrc.2001.6310. PMID 11798164.
- ^ “Isolation and characterization of cDNAs for the protein kinase HIPK2”. Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression 1518 (1–2): 168–72. (2001). doi:10.1016/S0167-4781(00)00308-0. PMID 11267674. "The nucleotide sequence data have been deposited in GenBank under the accession numbers AF208291 and AF208292, respectively"
- ^ “Covalent modification of the homeodomain-interacting protein kinase 2 (HIPK2) by the ubiquitin-like protein SUMO-1”. Proceedings of the National Academy of Sciences of the United States of America 96 (22): 12350–5. (October 1999). doi:10.1073/pnas.96.22.12350. PMC 22920. PMID 10535925.
- ^ “Role of the SUMO-interacting motif in HIPK2 targeting to the PML nuclear bodies and regulation of p53”. Experimental Cell Research 317 (7): 1060–70. (April 2011). doi:10.1016/j.yexcr.2010.12.016. PMID 21192925.
- ^ a b c d e f g h i j k l m “How cells switch HIPK2 on and off”. Cell Death and Differentiation 16 (2): 187–94. (February 2009). doi:10.1038/cdd.2008.154. PMID 18974774.
- ^ “AceView: Gene:HIPK2, a comprehensive annotation of human, mouse and worm genes with mRNAs or ESTsAceView.”. www.ncbi.nlm.nih.gov. 2021年2月4日閲覧。
- ^ “DYRK gene structure and erythroid-restricted features of DYRK3 gene expression”. Genomics 85 (1): 117–30. (January 2005). doi:10.1016/j.ygeno.2004.08.021. PMID 15607427.
- ^ “HIPK2 - Homeodomain-interacting protein kinase 2 - Homo sapiens (Human) - HIPK2 gene & protein”. www.uniprot.org. 2017年11月28日閲覧。
- ^ a b “ExPASy - ProtParam”. web.expasy.org. 2017年11月28日閲覧。
- ^ “Characterization of Human Homeodomain-interacting Protein Kinase 4 (HIPK4) as a Unique Member of the HIPK Family”. Molecular and Cellular Pharmacology 2 (2): 61–68. (2010). PMC 2876313. PMID 20508833.
- ^ a b “Homeodomain-interacting protein kinase 2 (HIPK2): a promising target for anti-cancer therapies”. Oncotarget 8 (12): 20452–20461. (March 2017). doi:10.18632/oncotarget.14723. PMC 5386776. PMID 28107201.
- ^ a b “Homeodomain-Interacting Protein Kinase-2: A Critical Regulator of the DNA Damage Response and the Epigenome”. International Journal of Molecular Sciences 17 (10): 1638. (September 2016). doi:10.3390/ijms17101638. PMC 5085671. PMID 27689990.
- ^ a b “Control of nuclear HIPK2 localization and function by a SUMO interaction motif”. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research 1813 (2): 283–97. (February 2011). doi:10.1016/j.bbamcr.2010.11.022. PMID 21145359.
- ^ “Identification and characterization of HIPK2 interacting with p73 and modulating functions of the p53 family in vivo”. The Journal of Biological Chemistry 277 (35): 32020–8. (August 2002). doi:10.1074/jbc.M200153200. PMID 11925430.
- ^ a b c d e “Regulation of p53 activity by HIPK2: molecular mechanisms and therapeutical implications in human cancer cells”. Oncogene 29 (31): 4378–87. (August 2010). doi:10.1038/onc.2010.183. PMID 20514025.
- ^ “Restoring wtp53 activity in HIPK2 depleted MCF7 cells by modulating metallothionein and zinc”. Experimental Cell Research 315 (1): 67–75. (January 2009). doi:10.1016/j.yexcr.2008.10.018. PMID 18996371.
- ^ a b “Homeodomain interacting protein kinase 2 promotes apoptosis by downregulating the transcriptional corepressor CtBP”. Cell 115 (2): 177–86. (October 2003). doi:10.1016/S0092-8674(03)00802-X. PMID 14567915.
- ^ a b c d “A redox-regulated SUMO/acetylation switch of HIPK2 controls the survival threshold to oxidative stress”. Molecular Cell 46 (4): 472–83. (May 2012). doi:10.1016/j.molcel.2012.03.003. PMID 22503103.
- ^ a b c “Control of HIPK2 stability by ubiquitin ligase Siah-1 and checkpoint kinases ATM and ATR”. Nature Cell Biology 10 (7): 812–24. (July 2008). doi:10.1038/ncb1743. PMID 18536714.
- ^ a b c “p300-mediated acetylation increased the protein stability of HIPK2 and enhanced its tumor suppressor function”. Scientific Reports 7 (1): 16136. (November 2017). doi:10.1038/s41598-017-16489-w. PMC 5701035. PMID 29170424.
- ^ a b c “HIPK2 modification code for cell death and survival”. Molecular & Cellular Oncology 1 (2): e955999. (2014-10-29). doi:10.1080/23723548.2014.955999. PMC 4905192. PMID 27308327.
- ^ a b “MDM2-regulated degradation of HIPK2 prevents p53Ser46 phosphorylation and DNA damage-induced apoptosis”. Molecular Cell 25 (5): 739–50. (March 2007). doi:10.1016/j.molcel.2007.02.008. PMID 17349959.
- ^ a b “Apoptotic threshold is lowered by p53 transactivation of caspase-6”. Proceedings of the National Academy of Sciences of the United States of America 99 (14): 9492–7. (July 2002). doi:10.1073/pnas.132241599. PMC 123168. PMID 12089322.
- ^ a b c d e f “Mutations of the HIPK2 gene in acute myeloid leukemia and myelodysplastic syndrome impair AML1- and p53-mediated transcription”. Oncogene 26 (51): 7231–9. (November 2007). doi:10.1038/sj.onc.1210523. PMID 17533375.
- ^ “Homeodomain interacting protein kinase 2: a target for Alzheimer's beta amyloid leading to misfolded p53 and inappropriate cell survival”. PLOS ONE 5 (4): e10171. (April 2010). doi:10.1371/journal.pone.0010171. PMC 2854690. PMID 20418953.
- ^ “Role of HIPK2 in kidney fibrosis”. Kidney International Supplements 4 (1): 97–101. (November 2014). doi:10.1038/kisup.2014.18. PMC 4536960. PMID 26312158.
- ^ Guo, Yuanjun; Sui, Jennifer; Zhang, Qinkun; Barnett, Joey; Force, Thomas; Lal, Hind (2017-11-14). “Abstract 18728: Loss of Homeodomain-Interacting Protein Kinase 2 in Cardiomyocytes Leads to Cardiac Dysfunction”. Circulation 136 (Suppl 1): A18728. ISSN 0009-7322.
- ^ “Complex regulation of CREB-binding protein by homeodomain-interacting protein kinase 2”. Cellular Signalling 27 (11): 2252–60. (November 2015). doi:10.1016/j.cellsig.2015.08.001. PMID 26247811.
- ^ “Requirement of the co-repressor homeodomain-interacting protein kinase 2 for ski-mediated inhibition of bone morphogenetic protein-induced transcriptional activation”. The Journal of Biological Chemistry 278 (40): 38998–9005. (October 2003). doi:10.1074/jbc.M307112200. PMID 12874272.
- ^ “TP53INP1s and homeodomain-interacting protein kinase-2 (HIPK2) are partners in regulating p53 activity”. The Journal of Biological Chemistry 278 (39): 37722–9. (September 2003). doi:10.1074/jbc.M301979200. PMID 12851404.
関連文献
[編集]- “Viruses as hijackers of PML nuclear bodies”. Archivum Immunologiae et Therapiae Experimentalis 51 (5): 295–300. (2004). PMID 14626429.
- “HIPK2: a versatile switchboard regulating the transcription machinery and cell death”. Cell Cycle 6 (2): 139–43. (January 2007). doi:10.4161/cc.6.2.3788. PMID 17245128.
- “Homeodomain-interacting protein kinases, a novel family of co-repressors for homeodomain transcription factors”. The Journal of Biological Chemistry 273 (40): 25875–9. (October 1998). doi:10.1074/jbc.273.40.25875. PMID 9748262.
- “Covalent modification of the homeodomain-interacting protein kinase 2 (HIPK2) by the ubiquitin-like protein SUMO-1”. Proceedings of the National Academy of Sciences of the United States of America 96 (22): 12350–5. (October 1999). doi:10.1073/pnas.96.22.12350. PMC 22920. PMID 10535925.
- “The homeodomain protein NK-3 recruits Groucho and a histone deacetylase complex to repress transcription”. The Journal of Biological Chemistry 274 (47): 33194–7. (November 1999). doi:10.1074/jbc.274.47.33194. PMID 10559189.
- “The serine/threonine kinase HIPK2 interacts with TRADD, but not with CD95 or TNF-R1 in 293T cells”. Biochemical and Biophysical Research Communications 277 (2): 513–7. (October 2000). doi:10.1006/bbrc.2000.3700. PMID 11032752.
- “Isolation and characterization of cDNAs for the protein kinase HIPK2”. Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression 1518 (1–2): 168–72. (March 2001). doi:10.1016/S0167-4781(00)00308-0. PMID 11267674.
- “The DNA glycosylase T:G mismatch-specific thymine DNA glycosylase represses thyroid transcription factor-1-activated transcription”. The Journal of Biological Chemistry 276 (36): 33569–75. (September 2001). doi:10.1074/jbc.M104963200. PMID 11438542.
- “HIPK2 overexpression leads to stabilization of p53 protein and increased p53 transcriptional activity by decreasing Mdm2 protein levels”. BMC Molecular Biology 2: 8. (2003). doi:10.1186/1471-2199-2-8. PMC 48146. PMID 11532197.
- “High mobility group I (Y) proteins bind HIPK2, a serine-threonine kinase protein which inhibits cell growth”. Oncogene 20 (43): 6132–41. (September 2001). doi:10.1038/sj.onc.1204635. PMID 11593421.
- “Regulation of p53 activity by its interaction with homeodomain-interacting protein kinase-2”. Nature Cell Biology 4 (1): 1–10. (January 2002). doi:10.1038/ncb715. PMID 11740489.
- “Homeodomain-interacting protein kinase-2 phosphorylates p53 at Ser 46 and mediates apoptosis”. Nature Cell Biology 4 (1): 11–9. (January 2002). doi:10.1038/ncb714. PMID 11780126.
- “The homeodomain-interacting protein kinase 2 gene is expressed late in embryogenesis and preferentially in retina, muscle, and neural tissues”. Biochemical and Biophysical Research Communications 290 (3): 942–7. (January 2002). doi:10.1006/bbrc.2001.6310. PMID 11798164.
- “Identification and characterization of HIPK2 interacting with p73 and modulating functions of the p53 family in vivo”. The Journal of Biological Chemistry 277 (35): 32020–8. (August 2002). doi:10.1074/jbc.M200153200. PMID 11925430.
- “HIPK2 associates with RanBPM”. Biochemical and Biophysical Research Communications 297 (1): 148–53. (September 2002). doi:10.1016/S0006-291X(02)02020-X. PMID 12220523.
- “TP53INP1s and homeodomain-interacting protein kinase-2 (HIPK2) are partners in regulating p53 activity”. The Journal of Biological Chemistry 278 (39): 37722–9. (September 2003). doi:10.1074/jbc.M301979200. PMID 12851404.
- “Requirement of the co-repressor homeodomain-interacting protein kinase 2 for ski-mediated inhibition of bone morphogenetic protein-induced transcriptional activation”. The Journal of Biological Chemistry 278 (40): 38998–9005. (October 2003). doi:10.1074/jbc.M307112200. PMID 12874272.
外部リンク
[編集]- https://www.proteinatlas.org/ENSG00000064393-HIPK2/tissue#gene_information
- Overview of all the structural information available in the PDB for UniProt: Q9H2X6 (Homeodomain-interacting protein kinase 2) at the PDBe-KB.