c-Met
c-MetまたはMETは、ヒトではMET遺伝子によってコードされているタンパク質で、肝細胞増殖因子受容体(hepatocyte growth factor receptor、HGFR)としても知られる[5][6]。
このタンパク質はチロシンキナーゼ活性を有する[7]。一本鎖の前駆体タンパク質への翻訳後、αサブユニットとβサブユニットへ切断される。両者はジスルフィド結合で連結されて成熟型の受容体を形成する。
METは1回膜貫通型の受容体型チロシンキナーゼで、胚発生、器官形成、創傷治癒に必須である。MET受容体の既知のリガンドは、肝細胞増殖因子/細胞分散因子(HGF/SF)とそのスプライシングによるアイソフォーム(NK1、NK2)のみである。METは通常上皮由来の細胞で発現しており、一方HGFの発現は間葉由来の細胞に限定されている。HGFがMETに結合すると、METは二量体化し活性化されるが、その過程は完全には理解されていない。
がんでのMETの異常な活性化は予後の悪さと相関しており、異常な活性型のMETは腫瘍の成長や、腫瘍へ栄養を供給する血管の形成(血管新生)、他の器官へのがんの拡散(転移)を引き起こす。METは、腎臓、肝臓、胃、乳房、脳などの多くのタイプの悪性腫瘍で調節異常がみられる。通常、METを発現しているのは幹細胞と前駆細胞だけであり、胚で新たな組織を形成したり、成体で損傷組織を再生するための浸潤性増殖を可能にする。しかし、がん幹細胞では正常な幹細胞のMETの発現能力が乗っ取られており、がんの持続や他の部位への拡散の原因となっている。MET遺伝子のさまざまな変異が乳頭状腎細胞がんと関係しており[8]、METの過剰発現や、HGFとの共発現による自己分泌型の活性化の双方が、発がんへ関与していると示唆されている[9][10]。
遺伝子
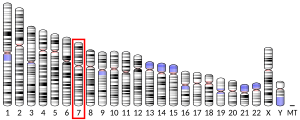
[編集]MET遺伝子(GeneID: 4233)は全長125,982bpで、7番染色体の7q31に位置している[11]。転写されて6,641塩基の成熟mRNAとなり、その後1,390アミノ酸のMETタンパク質へと翻訳される。
タンパク質
[編集]METは受容体型チロシンキナーゼであり、一本鎖の前駆体として産生される。前駆体はフーリン切断部位で切断され、高度にグリコシル化された細胞外のαサブユニットと、膜を貫通するβサブユニットとなる。両者はジスルフィド結合で連結されている[12]。
細胞外領域
[編集]細胞外領域には次の構造が含まれる。
- セマフォリン相同領域(Semaドメイン) - α鎖の全長とβ鎖のN末端部分からなる。
- システインに富むMET関連配列(MRSドメイン)
- グリシンとプロリンに富むリピート配列(GPリピート)
- 4つの免疫グロブリン様構造(Igドメイン) - 典型的なタンパク質間相互作用領域[12]
細胞内領域
[編集]膜近傍セグメントには次の要素が含まれている。
- リン酸化によって受容体キナーゼの活性化を阻害するセリン残基(Ser985)[13]
- ユビキチンリガーゼ CBLと相互作用し、METのポリユビキチン化、エンドサイトーシスと分解を担うチロシン残基(Tyr1003)[14]
- METの生物学的活性を媒介するチロシンキナーゼドメイン。METの活性化後、Tyr1244とTyr1235でトランスリン酸化が起こる。
- C末端領域には2つの重要なチロシン残基(Tyr1349とTy1356)が含まれている。これらの残基は、SH2ドメインを持つ下流のアダプタータンパク質をリクルートする、多基質ドッキング部位(multisubstrate docking site)に位置している[15]。2つのチロシン残基はin vitroでのシグナル伝達に必要かつ十分であることが報告されている[15][16]。
METシグナル伝達経路
[編集]HGFによるMETの活性化はMETのキナーゼ触媒活性を誘導し、Tyr1234とTyr1235のトランスリン酸化を開始する。これら2つのチロシン残基はさまざまなシグナル伝達因子と結合し[17]、METによって駆動されるさまざまな生物学的活性を開始する。METによって駆動される過程は、invasive growth program(浸潤性増殖プログラム)と総称されることもある。シグナル伝達因子はMETの多基質ドッキング部位と相互作用するが、GRB2、SH2[18]、SRC、PI3Kの調節サブユニットp85[18]のように直接相互作用するものと、足場タンパク質であるGAB1を介して間接的に相互作用するものがある[19]。
多基質ドッキング部位に位置するTyr1349とTyr1356はどちらもGAB1、SRC、SHCとの相互作用に関与しているが、GRB2、PLC-γ、p85、SHP2のリクルートにはTyr1356のみが関与する[20]。
GAB1はMETに対する細胞応答の重要な調節因子であり、METの細胞内領域に高いアビディティ、低いアフィニティで結合する[21]。METとの相互作用によってGAB1のいくつかのチロシン残基がリン酸化され、そこへPI3K、SHP2、PLC-γを含むシグナル伝達のエフェクター因子がリクルートされる。METによるGAB1のリン酸化によって、下流のシグナル伝達経路の大部分を媒介する持続的なシグナルがもたらされる[22]。
シグナル伝達の活性化
[編集]METとの結合によって複数のシグナル伝達経路が活性化される。
- RAS経路はHGFによって誘導される細胞の拡散と増殖のシグナルを媒介し、分枝形態形成(branching morphogenesis)を誘導する[23]。HGFは大部分の分裂促進因子とは異なり、持続的なRASの活性化、そして長期にわたるMAPK活性を誘導する[24]。
- PI3K経路は2つの方法で活性化される。PI3KはRASの下流因子であり、また多基質ドッキング部位にも直接リクルートされる[25]。PI3K経路の活性化は、細胞外マトリックスへの接着の再構成や、RAC1、PAKなど細胞骨格の再組織化に関与するシグナル伝達因子の局所的なリクルートを行い、これらを介して細胞の運動性と関係していると考えられている。また、PI3Kの活性化はAKT経路の活性化によって生存シグナルを開始する[26]。
- STAT経路は、持続的なMAPKの活性化とともに、HGFによって誘導される分枝形態形成に必要である。METは、SH2ドメインを介してSTAT3を直接的に活性化する[27]。
- β-カテニンはWntシグナル経路の重要な構成要素であり、METの活性化後に核へ移行し、多数の遺伝子の転写調節に関与する[28]。
- Notch経路に関しては、DLL3などのDeltaリガンドの転写が活性化される[29][30]。
発生における役割
[編集]METは浸潤性増殖(invasive growth)として知られる複雑な過程を媒介する[26]。METの活性化は有糸分裂の開始と形態形成を誘導する[31][32]。
胚発生において、扁平な2層の胚盤から3次元的な体構造への転換は、一部の上皮型細胞の紡錘形で運動性の高い間葉系細胞への転換に依存している。この過程は上皮間葉転換(epithelial to mesenchymal transition, EMT)と呼ばれている[33]。胚発生のより後の過程では、METは特に原腸形成、血管新生、筋芽細胞の移動、骨再構築、神経の発芽に重要である[34]。METは胚発生に必須であり、MET −/−マウスは胎盤発生の重篤な欠陥のため子宮内で死ぬ[35]。さらに、METは成体での肝臓の再生や創傷治癒などの重要な過程にも必要である[26]。
HGF/MET軸は心筋の発生にも関係している。HGFとMET受容体のmRNAは、心臓の運命決定直後のE7.5からE9.5まで心筋細胞で共発現している。HGFリガンドと受容体の転写産物は心臓の拍動とルーピングの出現以前から検出され、心臓の形態が複雑化しはじめるlooping stageを通じて持続する[36]。鳥類での研究では、心内膜床からのEMTが起こる発生段階では、HGFは房室管の心筋層に存在している[37]。しかしながら、METは心臓の発生には必須ではなく、心筋でMetがノックアウトされたコンディショナルノックアウトマウスの心臓発生は正常である[38]。
発現
[編集]組織分布
[編集]通常、METは上皮細胞で発現している[26]。しかし、METは内皮細胞、神経細胞、肝細胞、造血系細胞、メラニン細胞、新生児の心筋細胞にも存在している[32][39]。HGFの発現は、間葉由来の細胞に限定されている[33]。
転写制御
[編集]METの転写は、HGFといくつかの成長因子によって活性化される[40]。MET遺伝子のプロモーターには、浸潤性増殖に関するいくつかの遺伝子を制御するETS転写因子ファミリーの推定結合部位が4つ存在している[40]。ETS1はin vitroでMETの転写を活性化する[41]。METの転写は、細胞内の低酸素状態によって活性化されるHIF1によっても活性化される[42]。HIF1は、METのプロモーターの低酸素応答エレメント(HRE)の1つに結合する[33]。また、低酸素状態によって転写因子AP-1も活性化され、これもMETの転写に関係している[33]。
臨床的意義
[編集]がんにおける役割
[編集]MET経路はがんの発生に重要な役割を果たす。
- 重要な発がん性経路の活性化(RAS、PI3K、STAT3、β-カテニン)
- 血管新生(腫瘍へ栄養を供給するために、既存の血管から新たな血管が出芽する)
- 拡散(メタロプロテアーゼの産生による細胞の解離)によって、転移へとつながる[43]
miR-199a*によるMETとその下流のエフェクター因子ERK2の協調的なダウンレギュレーションは、細胞の増殖を阻害するだけでなく、腫瘍細胞の運動性や浸潤性も効果的に阻害する可能性がある[44]。
METの増幅は、明細胞腺がんのバイオマーカーとなる可能性がある[45]。
METの増幅は、大腸がんの抗EGFR療法に対する抵抗性をもたらすことが多い[46]。
自閉症における役割
[編集]自閉症のリスク遺伝子のデータベースであるSFARI gene databaseではMETの自閉症スコアは2.0であり、METが自閉症に関与する有力な候補遺伝子であることを意味している。データベースでは、少なくとも1つの研究において、METが統合失調症の症例に関係していることが示されている。MET遺伝子は、遺伝子のプロモーターの多型を同定した研究で初めて自閉症への関与が示唆された[47]。このプロモーターの多型はMETの転写を50%低下させる。さらに、自閉症リスク多型としてのMET遺伝子の変異は他の研究でも示されており、自閉症と消化管障害を抱える子供で多く見られることが示されている[48]。稀な変異が家族の2人で観察されており、1人は自閉症、もう1人は社会的コミュニケーション症の症状を示している[49]。脳の発達におけるMET受容体の役割は、他の発生過程におけるとは異なるものであり、MET受容体の活性化はシナプス形成を調節し[50][51][52][53][54]、社会的行動や情動的行動に関係する回路の機能の発達に影響を与えている[55]。
心臓機能における役割
[編集]成体のマウスでは、METは加齢と関連した酸化ストレス、アポトーシス、線維形成、心臓機能不全を防ぎ、心筋細胞を保護するために必要である[38]。さらに、クリゾチニブやPF-04254644などのMET阻害剤は細胞モデルや臨床前モデルでの短期投与試験が行われており、活性酸素種の産生、カスパーゼの活性化、代謝の変化、イオンチャネルの遮断によって心筋細胞の細胞死を誘導することが示されている[56][57]。
損傷した心臓では、HGF/MET軸は心筋細胞での生存効果(抗アポトーシス、抗オートファジー)の促進、血管新生、線維形成の阻害、抗炎症・免疫調節シグナル、心筋幹細胞の活性化による再生によって、心臓保護に重要な役割を果たす[58][59]。
がん抑制因子との相互作用
[編集]PTEN
[編集]PTEN(phosphatase and tensin homolog)は、脂質とプロテインホスファターゼに依存した活性と依存しない活性の双方を有するがん抑制因子である[60]。PTENはホスファターゼであり、PI3Kによって生成されたPIP3またはSHCのp52アイソフォームを脱リン酸化することでMETシグナル伝達に干渉する。SHCの脱リン酸化はGRB2アダプタータンパク質の活性化METへのリクルートを阻害する[29]。
VHL
[編集]腎細胞がんにおいて、がん抑制因子VHLの不活性化とMETシグナル伝達の増加が相関しているという証拠が存在する。心臓の悪性形質転換でも同様である[61][62]。
HGF/METを標的としたがん治療
[編集]腫瘍の浸潤と転移はがん患者の主な死因であり、METシグナル伝達の阻害は有望な治療アプローチとなると考えられる。ヒトで臨床試験が行われているHGFとMETを標的とした実験的治療薬のリストはこちらで見ることができる。
METのキナーゼ阻害剤
[編集]キナーゼ阻害剤は、ATPがMETに結合するのを防ぎ、受容体のトランスリン酸化と下流のエフェクター分子のリクルートを防ぐ低分子である。キナーゼ阻害剤の限界は、METのキナーゼ活性依存的な活性を阻害するだけであること、METに対する十分な特異性を示すものはまだ存在しないことである。
- K252a(Fermentek Biotechnology)は土壌菌Nocardiopsis sp.から単離されたスタウロスポリンアナログであり、すべての受容体型チロシンキナーゼの阻害剤である。K252aはnMレベルの濃度で野生型と変異型(M1268T)のMETの機能を阻害する[63]。
- SU11274(SUGEN)は、METのキナーゼ活性とその後のシグナル伝達を特異的に阻害する。また、SU11274はM1268T、H1112Y型MET変異体の効果的な阻害剤であるが、L1213V、Y1248H型変異体には効果がない[64]。SU11274はHGFによって誘導される上皮細胞とがん細胞の運動性と浸潤性を阻害することが示されている[65]。
- PHA-66572(ファイザー)はMETのキナーゼ活性を特異的に阻害し、METのHGF依存的なリン酸化と恒常的なリン酸化の双方を阻害することが示されている[66]。さらに、MET遺伝子が増幅している腫瘍の一部は、PHA-665752処理に対してきわめて高い感受性を示す[67]。
- チバンチニブ(ARQ197、ArQule)はMETの有望な選択的阻害剤で、2008年に第2相の臨床試験が行われたが、2017年に第3相試験は失敗に終わった[68]。
- フォレチニブ(XL880、Exelixis)は、増殖促進と血管新生作用を持つ複数の受容体型チロシンキナーゼを標的とする。フォレチニブの主要な標的はMETとKDR(VEGFR2)である。フォレチニブは、乳頭状腎細胞がん、胃がん、頭頸部がんに対する第2相試験が終了している。
- SGX523(SGX Pharmaceuticals)はnMレベルの低い濃度でMETを特異的に阻害する。
- MP470(SuperGen)はc-Kit 、MET、PDGFR、FLT3、AXLに対する新規阻害薬である。MP470の第1相臨床試験が2007年に発表されている。
HGF阻害剤
[編集]HGFはMETの既知の唯一のリガンドであるため、HGF:MET複合体の形成を防ぐことでMETの生物学的活性を防ぐことができる。こうした目的のために、切り詰められたMETや抗HGF中和抗体、非切断型HGFがこれまで利用されてきた。HGF阻害薬の大きな限界は、HGF依存的なMETの活性化しか防ぐことができない点である。
- NK4はHGFと競合し、METと結合しても受容体の活性化を引き起こさない。そのため、完全アンタゴニストとして機能する。NK4はHGFのN末端ヘアピンと4つのクリングルドメインを持つ分子である。さらに、NK4はアンジオスタチンと構造的に類似しており、そのため抗血管新生作用を持つ[69]。
- 抗HGF中和抗体は当初は複数種類の組み合わせで試験されており、HGFの異なるエピトープに作用する少なくとも3つの抗体がMETチロシンキナーゼの活性化を防ぐために必要であることが示された[70]。近年になって、完全ヒトモノクローナル抗体が個別にヒトのHGFに結合して中和し、マウスモデルで腫瘍の退縮を引き起こすことが示された[71]。ヒト化抗体AV299(AVEO)、完全ヒト抗体AMG102(アムジェン)の2つの抗HGF抗体が現在利用可能である。
- 非切断型HGFは1アミノ酸置換によって改変されたHGF前駆体であり、前駆体の切断による成熟が防がれる。非切断型HGFはMETに高い親和性で結合し、成熟HGFと置き換わることでMETによって誘導される生物学的反応をブロックすることができる。さらに非切断型HGFは、HGF前駆体の切断を担うプロテアーゼの触媒ドメインを内在性の野生型HGF前駆体と競合する。非切断型HGFの局所的または全身性の発現は腫瘍の成長を阻害し、転移も防ぐ[72]。
デコイMET
[編集]デコイMETは切り詰められた可溶性のMET受容体である。デコイはリガンドの結合とMET受容体のホモ二量体化の双方を防ぐため、HGF依存的なMETの活性化と非依存的な活性化の双方を阻害することができる。CGEN241(Compugen)は、腫瘍の成長と転移を高効率で防ぐことが動物モデルで示されている[73]。
METを標的とした免疫療法
[編集]免疫療法に用いられる薬剤は、MET発現細胞に対する免疫反応を強化するか、または免疫細胞を刺激し腫瘍細胞の分化・増殖に変化を与える[74]。
受動免疫療法
[編集]モノクローナル抗体の投与は、一種の受動免疫療法である。モノクローナル抗体は補体依存性細胞傷害(CDC)と抗体依存性細胞傷害(ADCC)によって腫瘍細胞の破壊を促進する。CDCにおいては、モノクローナル抗体は特定の抗原に結合して補体系の活性化を引き起こし、腫瘍細胞に孔の形成を引き起こす。ADCCにおいては、モノクローナル抗体のFabドメインが主要抗原に結合し、Fcドメインがエフェクター細胞(食細胞とNK細胞)に存在するFc受容体に結合することで、エフェクター細胞と標的細胞の間にブリッジを形成する。これによってエフェクター細胞の活性化が誘導され、好中球やマクロファージによる腫瘍細胞に対する食作用が引き起こされる。さらに、NK細胞は細胞傷害性分子を放出し、腫瘍細胞を溶解する[74]。
- DN30は抗METモノクローナル抗体で、METの細胞外部分を認識する。DN30はMETの細胞外ドメインのシェディングと細胞内ドメインの切断を誘導し、細胞内ドメインはプロテアソームによって分解される。その結果、細胞の内側ではMETは不活性化され、外側ではシェディングされたMETの細胞外ドメインがデコイとして他のMET受容体の活性化を妨げる。DN30は腫瘍の成長を阻害し転移を防ぐことが動物モデルで示されている[75]。
- OA-5D5はone-armed antibodyと呼ばれる一本腕の抗MET抗体であり、同所移植された膵臓腫瘍[76]と膠芽腫[77]において腫瘍成長を阻害すること、腫瘍異種移植モデルで生存率を改善することが示されている。OA-5D5は大腸菌Escherichia coliで組換えタンパク質として生産され、マウスの重鎖と軽鎖の可変領域とヒトのIgG1の定常領域から構成される。抗体はHGFのMETへの結合を競合的に阻害する。
能動免疫療法
[編集]MET発現細胞に対する能動免疫療法は、インターフェロンやインターロイキン(IL-2)などのサイトカインの投与によって行われ、多数の免疫細胞の非特異的な刺激を引き起こす。インターフェロンは多くの種類のがんに対する治療としての試験が行われており、治療効果が示されている。IL-2は、MET活性の調節異常が多く見られる腎細胞がんと転移性メラノーマに対する治療として、アメリカ食品医薬品局(FDA)に承認されている[74]。
相互作用
[編集]METは次に挙げる因子と相互作用することが示されている。
出典
[編集]- ^ a b c GRCh38: Ensembl release 89: ENSG00000105976 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000009376 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ “Identification of the hepatocyte growth factor receptor as the c-met proto-oncogene product”. Science 251 (4995): 802–4. (February 1991). doi:10.1126/science.1846706. PMID 1846706.
- ^ “Localization of the 5' end of the MCF2 oncogene to human chromosome 15q15----q23”. Cytogenet. Cell Genet. 60 (2): 114–6. (1992). doi:10.1159/000133316. PMID 1611909.
- ^ “The met oncogene: from detection by transfection to transmembrane receptor for hepatocyte growth factor”. Oncogene 7 (1): 3–7. (January 1992). PMID 1531516.
- ^ “Entrez Gene: MET met proto-oncogene (hepatocyte growth factor receptor)”. 2020年6月6日閲覧。
- ^ “Selective tumorigenesis in non-parenchymal liver epithelial cell lines by hepatocyte growth factor transfection”. Cancer Letters 96 (1): 37–48. (Sep 1995). doi:10.1016/0304-3835(95)03915-j. PMID 7553606.
- ^ “Evidence for autocrine basis of transformation in NIH-3T3 cells transfected with met/HGF receptor gene”. Growth Factors 12 (4): 303–13. (1995). doi:10.3109/08977199509028968. PMID 8930021.
- ^ “The human met oncogene is related to the tyrosine kinase oncogenes”. Nature 318 (6044): 385–8. (1985). doi:10.1038/318385a0. PMID 4069211.
- ^ a b “Met, metastasis, motility and more”. Nat. Rev. Mol. Cell Biol. 4 (12): 915–25. (December 2003). doi:10.1038/nrm1261. PMID 14685170.
- ^ “Phosphorylation of serine 985 negatively regulates the hepatocyte growth factor receptor kinase”. J. Biol. Chem. 269 (3): 1815–20. (January 1994). PMID 8294430.
- ^ “Mutation of the c-Cbl TKB domain binding site on the Met receptor tyrosine kinase converts it into a transforming protein”. Mol. Cell 8 (5): 995–1004. (November 2001). doi:10.1016/S1097-2765(01)00378-1. PMID 11741535.
- ^ a b “A multifunctional docking site mediates signaling and transformation by the hepatocyte growth factor/scatter factor receptor family”. Cell 77 (2): 261–71. (April 1994). doi:10.1016/0092-8674(94)90318-2. PMID 7513258.
- ^ “Uncoupling of Grb2 from the Met receptor in vivo reveals complex roles in muscle development”. Cell 87 (3): 531–42. (November 1996). doi:10.1016/S0092-8674(00)81372-0. PMID 8898205.
- ^ “Hepatocyte growth factor-induced signal transduction in two normal mouse epithelial cell lines”. Biochemistry and Molecular Biology International 36 (3): 465–74. (Jul 1995). PMID 7549943.
- ^ a b “The motogenic and mitogenic responses to HGF are amplified by the Shc adaptor protein”. Oncogene 10 (8): 1631–8. (April 1995). PMID 7731718.
- ^ “Interaction between Gab1 and the c-Met receptor tyrosine kinase is responsible for epithelial morphogenesis”. Nature 384 (6605): 173–6. (November 1996). doi:10.1038/384173a0. PMID 8906793.
- ^ “Met receptor tyrosine kinase: enhanced signaling through adapter proteins”. Oncogene 19 (49): 5582–9. (November 2000). doi:10.1038/sj.onc.1203859. PMID 11114738.
- ^ “Gab1 phosphorylation: a novel mechanism for negative regulation of HGF receptor signaling”. Oncogene 20 (2): 156–66. (January 2001). doi:10.1038/sj.onc.1204047. PMID 11313945.
- ^ “Sustained recruitment of phospholipase C-gamma to Gab1 is required for HGF-induced branching tubulogenesis”. Oncogene 19 (12): 1509–18. (March 2000). doi:10.1038/sj.onc.1203514. PMID 10734310.
- ^ “ERK and MMPs sequentially regulate distinct stages of epithelial tubule development”. Dev. Cell 7 (1): 21–32. (July 2004). doi:10.1016/j.devcel.2004.06.001. PMID 15239951.
- ^ “Specificity of receptor tyrosine kinase signaling: transient versus sustained extracellular signal-regulated kinase activation”. Cell 80 (2): 179–85. (January 1995). doi:10.1016/0092-8674(95)90401-8. PMID 7834738.
- ^ “The tyrosine-phosphorylated hepatocyte growth factor/scatter factor receptor associates with phosphatidylinositol 3-kinase”. J. Biol. Chem. 266 (33): 22087–90. (November 1991). PMID 1718989.
- ^ a b c d “The Met tyrosine kinase receptor in development and cancer”. Cancer Metastasis Rev. 27 (1): 85–94. (March 2008). doi:10.1007/s10555-007-9107-6. PMID 18175071.
- ^ “Induction of epithelial tubules by growth factor HGF depends on the STAT pathway”. Nature 391 (6664): 285–8. (January 1998). doi:10.1038/34657. PMID 9440692.
- ^ “Hepatocyte growth factor induces Wnt-independent nuclear translocation of beta-catenin after Met-beta-catenin dissociation in hepatocytes”. Cancer Res. 62 (7): 2064–71. (April 2002). PMID 11929826.
- ^ a b “Regulation of c-Met-dependent gene expression by PTEN”. Oncogene 23 (57): 9173–82. (December 2004). doi:10.1038/sj.onc.1208146. PMID 15516982.
- ^ “Activation of Notch-mediated protective signaling in the myocardium”. Circ. Res. 102 (9): 1025–35. (May 2008). doi:10.1161/CIRCRESAHA.107.164749. PMC 3760732. PMID 18369158.
- ^ “Hepatocyte growth factor induces proliferation and morphogenesis in nonparenchymal epithelial liver cells”. Hepatology 17 (6): 1052–61. (Jun 1993). doi:10.1016/0270-9139(93)90122-4. PMID 8514254.
- ^ a b “he fields of HGF/c-Met involvement”. HealthValue. 2007年9月27日時点のオリジナルよりアーカイブ。2009年6月13日閲覧。
- ^ a b c d “Invasive growth: a MET-driven genetic programme for cancer and stem cells”. Nat. Rev. Cancer 6 (8): 637–45. (August 2006). doi:10.1038/nrc1912. PMID 16862193.
- ^ “Developmental roles of HGF/SF and its receptor, the c-Met tyrosine kinase”. Trends Cell Biol. 8 (10): 404–10. (October 1998). doi:10.1016/S0962-8924(98)01359-2. PMID 9789329.
- ^ “Placental defect and embryonic lethality in mice lacking hepatocyte growth factor/scatter factor”. Nature 373 (6516): 702–5. (February 1995). doi:10.1038/373702a0. PMID 7854453.
- ^ “Hepatocyte growth factor and its receptor are expressed in cardiac myocytes during early cardiogenesis”. Circulation Research 78 (6): 1028–36. (Jun 1996). doi:10.1161/01.RES.78.6.1028. PMID 8635233.
- ^ “Hepatocyte growth factor expression in the developing myocardium: evidence for a role in the regulation of the mesenchymal cell phenotype and urokinase expression”. Developmental Dynamics 214 (1): 92–100. (1999). doi:10.1002/(SICI)1097-0177(199901)214:1<92::AID-DVDY9>3.0.CO;2-X. PMID 9915579.
- ^ a b “Met signaling in cardiomyocytes is required for normal cardiac function in adult mice”. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease 1832 (12): 2204–15. (Dec 2013). doi:10.1016/j.bbadis.2013.08.008. PMID 23994610.
- ^ “Activated Met signalling in the developing mouse heart leads to cardiac disease”. PLOS ONE 6 (2): e14675. (2011-02-09). doi:10.1371/journal.pone.0014675. PMC 3036588. PMID 21347410.
- ^ a b “Ets transcription factors cooperate with Sp1 to activate the human tenascin-C promoter”. Oncogene 18 (54): 7755–64. (December 1999). doi:10.1038/sj.onc.1203360. PMID 10618716.
- ^ “Ets up-regulates MET transcription”. Oncogene 13 (9): 1911–7. (November 1996). PMID 8934537.
- ^ “Hypoxia promotes invasive growth by transcriptional activation of the met protooncogene”. Cancer Cell 3 (4): 347–61. (April 2003). doi:10.1016/S1535-6108(03)00085-0. PMID 12726861.
- ^ “HGF/c-Met and cancer”. HealthValue. 2007年9月27日時点のオリジナルよりアーカイブ。2009年6月13日閲覧。
- ^ “MicroRNA miR-199a* regulates the MET proto-oncogene and the downstream extracellular signal-regulated kinase 2 (ERK2)”. J. Biol. Chem. 283 (26): 18158–66. (June 2008). doi:10.1074/jbc.M800186200. PMID 18456660.
- ^ “Clear cell carcinoma of the ovary: a review of the literature”. Gynecol. Oncol. 126 (3): 481–90. (September 2012). doi:10.1016/j.ygyno.2012.04.021. PMID 22525820.
- ^ “Amplification of the MET receptor drives resistance to anti-EGFR therapies in colorectal cancer”. Cancer Discov 3 (6): 658–73. (June 2013). doi:10.1158/2159-8290.CD-12-0558. PMC 4078408. PMID 23729478.
- ^ “A genetic variant that disrupts MET transcription is associated with autism”. Proc. Natl. Acad. Sci. U.S.A. 103 (45): 16834–9. (2006). doi:10.1073/pnas.0605296103. PMC 1838551. PMID 17053076.
- ^ “Distinct genetic risk based on association of MET in families with co-occurring autism and gastrointestinal conditions”. Pediatrics 123 (3): 1018–24. (2009). doi:10.1542/peds.2008-0819. PMID 19255034.
- ^ “A familial heterozygous null mutation of MET in autism spectrum disorder”. Autism Res 7 (5): 617–22. (2014). doi:10.1002/aur.1396. PMID 24909855.
- ^ “MET receptor tyrosine kinase controls dendritic complexity, spine morphogenesis, and glutamatergic synapse maturation in the hippocampus”. J. Neurosci. 34 (49): 16166–79. (2014). doi:10.1523/JNEUROSCI.2580-14.2014. PMC 4252539. PMID 25471559.
- ^ “Synaptic and extrasynaptic location of the receptor tyrosine kinase met during postnatal development in the mouse neocortex and hippocampus”. J. Comp. Neurol. 521 (14): 3241–59. (2013). doi:10.1002/cne.23343. PMC 3942873. PMID 23787772.
- ^ “A new synaptic player leading to autism risk: Met receptor tyrosine kinase”. J Neurodev Disord 3 (3): 282–92. (2011). doi:10.1007/s11689-011-9081-8. PMC 3261279. PMID 21509596.
- ^ “Circuit-specific intracortical hyperconnectivity in mice with deletion of the autism-associated Met receptor tyrosine kinase”. J. Neurosci. 31 (15): 5855–64. (2011). doi:10.1523/JNEUROSCI.6569-10.2011. PMC 3086026. PMID 21490227.
- ^ “Evidence of cell-nonautonomous changes in dendrite and dendritic spine morphology in the met-signaling-deficient mouse forebrain”. J. Comp. Neurol. 518 (21): 4463–78. (2010). doi:10.1002/cne.22467. PMC 2952412. PMID 20853516.
- ^ “Autism-associated promoter variant in MET impacts functional and structural brain networks”. Neuron 75 (5): 904–15. (2012). doi:10.1016/j.neuron.2012.07.010. PMC 3454529. PMID 22958829.
- ^ “Multi-parameter in vitro toxicity testing of crizotinib, sunitinib, erlotinib, and nilotinib in human cardiomyocytes”. Toxicology and Applied Pharmacology 272 (1): 245–55. (October 2013). doi:10.1016/j.taap.2013.04.027. PMID 23707608.
- ^ “Cardiovascular effects in rats following exposure to a receptor tyrosine kinase inhibitor”. Toxicologic Pathology 38 (3): 416–28. (April 2010). doi:10.1177/0192623310364027. PMID 20231546.
- ^ “Cellular and molecular toxicity of lead in bone”. Environmental Health Perspectives 91 (17): 17–32. (February 1991). doi:10.1289/ehp.919117. PMC 1519349. PMID 2040247.
- ^ “Novel therapy for myocardial infarction: can HGF/Met be beneficial?”. Cellular and Molecular Life Sciences 68 (10): 1703–17. (May 2011). doi:10.1007/s00018-011-0633-6. PMID 21327916.
- ^ “The tumor suppressor, PTEN/MMAC1, dephosphorylates the lipid second messenger, phosphatidylinositol 3,4,5-trisphosphate”. J. Biol. Chem. 273 (22): 13375–8. (May 1998). doi:10.1074/jbc.273.22.13375. PMID 9593664.
- ^ “Tumor suppressor activity and epigenetic inactivation of hepatocyte growth factor activator inhibitor type 2/SPINT2 in papillary and clear cell renal cell carcinoma”. Cancer Res. 65 (11): 4598–606. (June 2005). doi:10.1158/0008-5472.CAN-04-3371. PMID 15930277.
- ^ “Hypoxia-inducible factor-dependent degeneration, failure, and malignant transformation of the heart in the absence of the von Hippel-Lindau protein”. Molecular and Cellular Biology 28 (11): 3790–803. (June 2008). doi:10.1128/MCB.01580-07. PMC 2423296. PMID 18285456.
- ^ “K252a inhibits the oncogenic properties of Met, the HGF receptor”. Oncogene 21 (32): 4885–93. (July 2002). doi:10.1038/sj.onc.1205622. PMID 12118367.
- ^ “The Met kinase inhibitor SU11274 exhibits a selective inhibition pattern toward different receptor mutated variants”. Oncogene 23 (31): 5387–93. (July 2004). doi:10.1038/sj.onc.1207691. PMID 15064724.
- ^ “Potent and selective inhibitors of the Met [hepatocyte growth factor/scatter factor (HGF/SF) receptor] tyrosine kinase block HGF/SF-induced tumor cell growth and invasion”. Mol. Cancer Ther. 2 (11): 1085–92. (November 2003). PMID 14617781.
- ^ “A selective small molecule inhibitor of c-Met kinase inhibits c-Met-dependent phenotypes in vitro and exhibits cytoreductive antitumor activity in vivo”. Cancer Res. 63 (21): 7345–55. (November 2003). PMID 14612533.
- ^ “Amplification of MET may identify a subset of cancers with extreme sensitivity to the selective tyrosine kinase inhibitor PHA-665752”. Proc. Natl. Acad. Sci. U.S.A. 103 (7): 2316–21. (February 2006). doi:10.1073/pnas.0508776103. PMC 1413705. PMID 16461907.
- ^ “ArQule, Daiichi Sankyo Say Cancer Candidate Tivantinib Fails Phase III Trial”. Genetic Engineering & Biotechnology News (February 2017). 2020年6月28日閲覧。
- ^ “NK4 (HGF-antagonist/angiogenesis inhibitor) in cancer biology and therapeutics”. Cancer Sci. 94 (4): 321–7. (April 2003). doi:10.1111/j.1349-7006.2003.tb01440.x. PMID 12824898.
- ^ “Neutralizing monoclonal antibodies to hepatocyte growth factor/scatter factor (HGF/SF) display antitumor activity in animal models”. Proc. Natl. Acad. Sci. U.S.A. 98 (13): 7443–8. (June 2001). doi:10.1073/pnas.131200498. PMC 34688. PMID 11416216.
- ^ “Fully human monoclonal antibodies to hepatocyte growth factor with therapeutic potential against hepatocyte growth factor/c-Met-dependent human tumors”. Cancer Res. 66 (3): 1721–9. (February 2006). doi:10.1158/0008-5472.CAN-05-3329. PMID 16452232.
- ^ “An uncleavable form of pro-scatter factor suppresses tumor growth and dissemination in mice”. J. Clin. Invest. 114 (10): 1418–32. (November 2004). doi:10.1172/JCI22235. PMC 525743. PMID 15545993.
- ^ “Targeting the tumor and its microenvironment by a dual-function decoy Met receptor”. Cancer Cell 6 (1): 61–73. (July 2004). doi:10.1016/j.ccr.2004.05.032. PMID 15261142.
- ^ a b c “Biological response modifiers in cancer”. MedGenMed 8 (4): 33. (2006). PMC 1868326. PMID 17415315.
- ^ “Ab-induced ectodomain shedding mediates hepatocyte growth factor receptor down-regulation and hampers biological activity”. Proc. Natl. Acad. Sci. U.S.A. 103 (13): 5090–5. (March 2006). doi:10.1073/pnas.0508156103. PMC 1458799. PMID 16547140.
- ^ “MetMAb, the one-armed 5D5 anti-c-Met antibody, inhibits orthotopic pancreatic tumor growth and improves survival”. Cancer Res. 68 (11): 4360–8. (June 2008). doi:10.1158/0008-5472.CAN-07-5960. PMID 18519697.
- ^ “A novel one-armed anti-c-Met antibody inhibits glioblastoma growth in vivo”. Clin. Cancer Res. 12 (20 Pt 1): 6144–52. (October 2006). doi:10.1158/1078-0432.CCR-05-1418. PMID 17062691.
- ^ “HGF/SF modifies the interaction between its receptor c-Met, and the E-cadherin/catenin complex in prostate cancer cells”. Int. J. Mol. Med. 7 (4): 385–8. (2001). doi:10.3892/ijmm.7.4.385. PMID 11254878.
- ^ “The endophilin-CIN85-Cbl complex mediates ligand-dependent downregulation of c-Met”. Nature 416 (6877): 187–90. (2002). doi:10.1038/416187a. PMID 11894096.
- ^ “Structural basis for a novel intrapeptidyl H-bond and reverse binding of c-Cbl-TKB domain substrates”. EMBO J. 27 (5): 804–16. (2008). doi:10.1038/emboj.2008.18. PMC 2265755. PMID 18273061.
- ^ “Ligand-regulated binding of FAP68 to the hepatocyte growth factor receptor”. J. Biol. Chem. 276 (49): 46632–8. (2001). doi:10.1074/jbc.M104323200. PMID 11571281.
- ^ “Specific uncoupling of GRB2 from the Met receptor. Differential effects on transformation and motility”. J. Biol. Chem. 271 (24): 14119–23. (1996). doi:10.1074/jbc.271.24.14119. PMID 8662889.
- ^ “Signaling by HGF and KGF in corneal epithelial cells: Ras/MAP kinase and Jak-STAT pathways”. Invest. Ophthalmol. Vis. Sci. 39 (8): 1329–38. (1998). PMID 9660480.
- ^ “Structure, biosynthesis and biochemical properties of the HGF receptor in normal and malignant cells”. EXS 65: 131–65. (1993). PMID 8380735.
- ^ “Scatter factor and hepatocyte growth factor are indistinguishable ligands for the MET receptor”. EMBO J. 10 (10): 2867–78. (1991). doi:10.1002/j.1460-2075.1991.tb07836.x. PMC 452997. PMID 1655405.
- ^ “Association of the HGF/SF receptor, c-met, with the cell-surface adhesion molecule, E-cadherin, and catenins in human tumor cells”. Biochem. Biophys. Res. Commun. 261 (2): 406–11. (1999). doi:10.1006/bbrc.1999.1002. PMID 10425198.
- ^ “Activation of Ras/Erk pathway by a novel MET-interacting protein RanBPM”. J. Biol. Chem. 277 (39): 36216–22. (2002). doi:10.1074/jbc.M205111200. PMID 12147692.
関連文献
[編集]- “Targeting the c-Met signaling pathway in cancer”. Clin. Cancer Res. 12 (12): 3657–60. (2006). doi:10.1158/1078-0432.CCR-06-0818. PMID 16778093.
- “Met, metastasis, motility and more”. Nat. Rev. Mol. Cell Biol. 4 (12): 915–25. (December 2003). doi:10.1038/nrm1261. PMID 14685170.
- “HGF/SF-met signaling in the control of branching morphogenesis and invasion”. J. Cell. Biochem. 88 (2): 408–17. (February 2003). doi:10.1002/jcb.10358. PMID 12520544.
- “Hepatocyte growth factor/scatter factor activates the ETS1 transcription factor by a RAS-RAF-MEK-ERK signaling pathway”. Oncogene 21 (15): 2309–19. (April 2002). doi:10.1038/sj.onc.1205297. PMID 11948414.
- “Structure, biosynthesis and biochemical properties of the HGF receptor in normal and malignant cells”. EXS 65: 131–65. (1993). PMID 8380735.
- “Role of the hepatocyte growth factor receptor, c-Met, in oncogenesis and potential for therapeutic inhibition”. Cytokine Growth Factor Rev. 13 (1): 41–59. (2002). doi:10.1016/S1359-6101(01)00029-6. PMID 11750879.
- “c-Met: structure, functions and potential for therapeutic inhibition”. Cancer Metastasis Rev. 22 (4): 309–25. (2003). doi:10.1023/A:1023768811842. PMID 12884908.
- “Prostate cancer and the met hepatocyte growth factor receptor”. Adv. Cancer Res.. Advances in Cancer Research 91: 31–67. (2004). doi:10.1016/S0065-230X(04)91002-0. ISBN 978-0-12-006691-9. PMID 15327888.
- “Hereditary papillary renal carcinoma type I”. Curr. Mol. Med. 4 (8): 855–68. (2004). doi:10.2174/1566524043359674. PMID 15579033.
- “Signalling by HGF/SF and Met: the role of heparan sulphate co-receptors”. Biochem. Soc. Trans. 34 (Pt 3): 414–7. (2006). doi:10.1042/BST0340414. PMID 16709175.
関連項目
[編集]外部リンク
[編集]- Proto-Oncogene Proteins c-met - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス
- UniProtKB/Swiss-Prot entry P08581: MET_HUMAN, ExPASy (Expert Protein Analysis System) proteomics server of the Swiss Institute of Bioinformatics (SIB)
- A table with references to significant roles of MET in cancer
- Human MET genome location and MET gene details page in the UCSC Genome Browser.