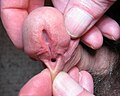
Ipospadia
| Ipospadia | |
|---|---|
 | |
| Specialità | genetica clinica e urologia |
| Classificazione e risorse esterne (EN) | |
| OMIM | 146450, 300633, 300758 e 300856 |
| MeSH | D007021 |
| MedlinePlus | 001286 |
| eMedicine | 1015227 |
L'ipospadia (dal latino "hypospadiasis", "hypospadia" e dal greco "υπό" = inferiore + "σπαδόν" = cava, la fessura; hypospadias in inglese) è una malformazione congenita dovuta ad un incompleto e anomalo sviluppo dell'uretra e del pene. Il difetto interessa l'apparato genito-urinario maschile e coinvolge la posizione del meato uretrale, di calibro spesso ridotto, sul lato ventrale mediano (rafe) dell'organo riproduttivo. Presenta tipicamente una mancata fusione cutanea prepuziale (il glande rimane scoperto) e spesso un incurvamento dell'asta[1]. In un approccio più ampio e moderno è definibile come "ipoplasia della parte addominale del pene, distale dal luogo di divisione del corpo spugnoso". A seconda della gravità l'ipospadia può essere considerata un leggero difetto estetico o un problema anatomo-fisiologico assai più grave, che rende difficile la minzione, aumenta il rischio di infezioni e contribuisce ad una generale disfunzione sessuale oltre che a importanti problemi psicologici. La branca specialistica medica che si occupa dello studio di questa malformazione è l'urologia pediatrica; in Italia i reparti ospedalieri responsabili del suo trattamento sono quelli di Chirurgia Pediatrica e, meno frequentemente, di Urologia. È strettamente correlata all'epispadia[2].
Storia
[modifica | modifica wikitesto]Il primo ad usare un termine arcaico per questa condizione fu Galeno nel II secolo d.C. Galeno non era estraneo alla corda del pene (chorda), un difetto fisico che impediva spesso ai pazienti ipospadici di concepire prole. I chirurghi medievali francesi Ambroise Paré e Pierre Dionis diedero in seguito il nome corrente ipospadia. Una delle prime descrizioni sul trattamento chirurgico del difetto proviene dal I secolo d.C.: Heliodor Antyl eseguì in quest’epoca un'amputazione della parte distale dei genitali su un paziente. Lo stesso metodo fu usato anche dal medico bizantino Paolo di Egina[3] (625-690). Questa pratica per il trattamento dell'ipospadia rimase in uso per quasi dieci secoli; le uniche eccezioni sono le menzioni di diverse procedure nel lavoro di Galeno e nel Talmud ebraico. La fase successiva nella storia della gestione della patologia fu l'introduzione di piccoli tunnel nel pene e della cannulazione per cercare di ricostruire la mancata continuità anatomica. Abulcasis (936-1013) e Şerafeddin Sabuncuoğlu utilizzarono nelle loro metodiche dei piccoli tubicini cavi di piombo, Guy de Chauliac di argento e Sir Astley Coopernel nel 1815 usò un catetere flessibile in gomma, così come Dupuytren e Mettauer nel 1842. Gli inizi della moderna chirurgia risalgono però al XIX secolo; le più importanti opere classiche sul trattamento di questa malformazione state scritte da Mettauer, Duplay, Lauenstein, Edmunds, Blair e Byers[4].
Epidemiologia
[modifica | modifica wikitesto]La presenza di ipospadia alla nascita è stimata in circa 2-4 x 1000 neonati maschi nati vivi[5] (epidemiologia rara). Un rischio più elevato è stato riscontrato nei bambini le cui famiglie avevano precedenti casi della patologia (incidenza 1:80-1:100[6]). Negli ultimi decenni questa malformazione è diventata sempre più comune nei paesi occidentali: negli anni 1970-1980 la frequenza è raddoppiata sulla base statistica storica[6] e dal 1980 ad oggi si è passati dallo 0,24% allo 0,52% di frequenza in Danimarca, dallo 0,2% allo 0,4% negli USA e dallo 0,28% allo 0,43% in Australia[7]. Le ragioni di questo fenomeno rimangono inspiegabili.
Nella letteratura medica classica è possibile trovare informazioni sulla maggior riscontrabilità del difetto nelle persone di etnia nera e di origine ebraica. Attualmente si ritiene che l'incidenza sia simile in tutte le popolazioni (anzi che sia più rara tra i bambini di discendenza sub-sahariana e più frequente fra quelli del bacino del Mediterraneo) e che le differenze descritte siano dovute ad errori nella metodologia di ricerca[8].
Eziologia
[modifica | modifica wikitesto]Fattori genetici, endocrini e ambientali sono postulati come cause multifattoriali dell'ipospadia (arresto dello sviluppo dei genitali esterni), anche se il meccanismo d'azione preciso non è ancora del tutto chiarito[9]. Il coinvolgimento della genetica è dimostrato dalla familiarità della condizione (manifestazione stimata attorno al 20% tra consanguinei e al 14% nei fratelli) e numerosi studi sono stati compiuti in tal senso. In passato si ipotizzava l'azione di un singolo gene a trasmissione autosomica dominante a bassa penetranza o autosomica recessiva con espressività incompleta nella comparsa della malformazione, mentre oggi le ultime ricerche indicano un modello ad eredità multifattoriale autosomica a penetranza variabile[9]. I presunti fattori ambientali comprendono invece l'esposizione della donna a composti chimici come estrogeni e fitoestrogeni da piante alimentari (ad es. semi e latte di soia), alcuni funghi, sostanze nocive come il DDT e prodotti come il Vinclozolin (classificato "endocrine disrupting chemical agent"). In uno studio pubblicato su Lancet nel 2002[10], è stato riscontrato un aumento di 20 volte del rischio di ipospadia nei bambini con madri che hanno ricevuto dietilstilbestrolo durante la gestazione (un antiabortivo), ma lavori successivi hanno suggerito una relazione meno chiara. È stata rilevata inoltre un'attinenza tra il verificarsi del difetto e l'adesione delle madri a una dieta vegetariana per i primi sei mesi di vita del feto, l'assunzione di vari farmaci per uso umano, di anticoncezionali ormonali nel primo trimestre di gravidanza (con incremento del rischio di sviluppare forme medie e anteriori della patologia), nell'uso di integratori di ferro e nell'azione del virus dell'influenza anch'esso durante il primo trimestre gravidico. Il maggior rischio statistico di sviluppare l'ipospadia riguarda i nati da genitrici molto giovani e anziane; l'insufficienza placentare (che può dare sofferenza fetale ipossica) è spiegata dall'occorrenza più frequente della malformazione nei neonati con basso peso al concepimento e nei gemelli (in questi ultimi aumenta il rischio di sviluppare forme posteriori). Altre cause eziologiche ipotizzate includono il deficit del fattore di crescita epiteliale (EGF), anomalie nei recettori EGF, l'esposizione a radiazioni ionizzanti, carenze vitaminiche, alto BMI della madre, ipertensione gravidica, disordini della biosintesi del testosterone e il difetto enzimatico della 5α-reduttasi; diversi studi e ricerche sono inoltre attualmente in corso[11][12]. Più il disturbo scatenante la condizione farà la sua comparsa precocemente durante la gravidanza e più grave sarà il manifestarsi dell'ipospadia. Questa è inoltre più comune nei bambini nati prematuramente e da fecondazione assistita[5].
Patogenesi
[modifica | modifica wikitesto]
La causa patologica dell'ipospadia - riscontrabile durante lo sviluppo del bambino nel grembo materno - è un disturbo del processo di fusione dei bordi delle pliche genito-urinarie embrionali costituenti l'uretra (plicae urogenitale) e della formazione della struttura interna del pene. Questo evento consiste nella rottura della chiusura della piastra tubolare (o piastra/piatto uretrale, ossia il canale in formazione) in un punto qualsiasi e/o nell'alterazione della ricanalizzazione del cordone ectodermico all'interno del glande. Il tubercolo genitale maschile si accresce infatti in senso prossimo-distale formando dall'endoderma dapprima l'uretra posteriore (prostatica e membranosa) e in seguito dall'ectoderma quella anteriore (porzioni bulbare e peniena) mentre l'uretra glandulare si sviluppa successivamente in maniera autonoma (anch'essa dall'ectoderma) per invaginazione, seguendo una direzione opposta e andando incontro alla seconda.
La parte del condotto urinario ubicata nel glande si genera quindi relativamente tardi, intorno ai 4 mesi di gestazione (quando il cordone cellulare ectodermico è libero), e si unisce alla fine del segmento dell'asta; il disordine di questo processo è la causa delle forme frontali (o anteriori) della malformazione.
Se i lembi genitali laterali del feto (tori genitales) non si fondono (come dovrebbe correttamente avvenire intorno alle 10 settimane di gravidanza), lo scroto si divide e il meato uretrale si posiziona tra le due parti dello scroto scisso (ipospadia scrotale). Quando l'apertura esterna dell'uretra è vicino all'ano (nel perineo), gli organi riproduttivi di solito non sono formati e hanno l’aspetto di una pseudovagina (sono questi i tipi più gravi di ipospadia).
Le forme intermedie della malformazione sono una via di mezzo tra i disturbi glandulari-frontali e quelli scroto-perineali.
Di seguito sono elencate le varie fasi embriologiche di sviluppo e differenziazione sessuale maschile:
- 6ª settimana di gravidanza: si forma il tubercolo genitale indifferenziato del feto. Fino alla 7ª-8ª settimana i genitali esterni del maschio e della femmina sono uguali. È solo a partire da questo momento che iniziano a diversificarsi i due sessi;
- Tra la 7ª e la 14ª settimana: inizio dello sviluppo del pene;
- 9ª-10ª (15ª) settimana: le pliche genitali interne si fondono per effetto del testosterone prodotto dal testicolo in accrescimento (controllato a sua volta dall'ipofisi fetale e dalla placenta materna) e formano l’uretra peniena. Il processo termina alla fine del 3º trimestre di gestazione. L'uretra glandulare è l’ultima a comparire (da un'introflessione nel tessuto del glande che si ricollega all’uretra dell'asta). Dorsalmente al canale urinario il mesenchima forma i corpi cavernosi (a funzione erettile), la fascia di Buck (che circonda i corpi cavernosi e riveste il corpo spugnoso), il corpo spugnoso (tessuto erettile di supporto) e il dartos (contenente i vasi linfatici e le vene superficiali). Varie cause di disturbo (genetica, fattori ambientali ecc...) interagenti con gli ormoni endogeni imputati allo sviluppo degli organi sessuali possono portare ad un'alterazione della produzione, della conversione periferica, dell'azione e del bilancio complessivo dei fattori endocrini, mentre altre possono interagire con la componente ormonale esogena inficiando così in entrambi i casi con il corretto sviluppo genitale e causando il verificarsi dell'ipospadia[5].
Riassumendo in parole semplici possiamo considerare le pliche genitali uretrali in formazione come una sottile lamina di carta i cui lembi si curvano su se stessi tubulizzandosi e fondendosi a partire dalla base del pene[7], che rimane curvo fino alla fine del processo. Un secondo processo di invaginazione a imbuto parte dal glande verso il basso e va incontro al precedente foglietto. Tutto questo è mediato dall'azione chimica degli ormoni. L'ipospadia è quindi sostanzialmente un'interruzione di questi due eventi (o solamente di uno, quando il meato è situato sopra la corona glandulare) ad una certa altezza rispetto all’asta del membro e in un certo momento temporale per interferenze con gli androgeni. Più questo avviene verso lo scroto e più grave sarà la manifestazione della malformazione. Dato che il pene, come detto, non si raddrizzerà fino a che la fusione del canale urinario non risulterà completa, questa condizione di incurvamento spesso permane.
Quadro clinico
[modifica | modifica wikitesto]
Nell'ipospadia l'uscita esterna dell'uretra (meato) si trova sulla superficie inferiore del pene invece che al suo apice. Molto spesso il difetto è piccolo e il meato risulta posizionato nella parte bassa del glande (ipospadie glandulari e coronali). Nei casi più gravi l'apertura uretrale è assai più distante dalla cima dell'organo e il difetto è di solito accompagnato da ipoplasia della parte inferiore del prepuzio (con schisi, che lo fa apparire aperto a forma di ventaglio) e del glande, da ipertrofia dorsale della cute peniena e da incurvamento e accorciamento dell'asta a causa della parziale agenesi del corpo spugnoso (maggiore è l'inclinazione e più lungo sarà il tratto di uretra da ricostruire). L'ipospadia è quindi essenzialmente una serie di anomalie più o meno importanti nell'anatomia ventrale del pene.
La curvatura dell'organo genitale si verifica in circa il 25-30% dei bambini con diagnosi del difetto ed è principalmente associata alle forme più gravi (distali e posteriori) della malformazione. La causa è riscontrabile in uno sviluppo anomalo della pelle sul lato inferiore e da aderenze con strati profondi[13], da corde fibrose, dalla fusione della piastra uretrale con il lato ventrale della tonaca albuginea, dal corpo spugnoso periferico ipoplastico a forma di ventaglio tra il meato e il glande o (in circa il 5% dei casi) da ipoplasia addominale di parti del corpo cavernoso[14]. Un corpo spugnoso degenerato è chiamato corda (o chorda) e può essere causa di infertilità indiretta. A volte lo sbocco urinario è posizionato correttamente ma l'asta risulta arcuata verso il basso ed è accompagnata da una parziale agenesia del corpo spugnoso. Questa condizione viene definita "ipospadia senza ipospadia" e necessita di correzione chirurgica.
La piastra uretrale non tubularizzata e rimasta aperta situata tra il meato ipospadico e la parte superiore del glande non scorre all'interno del corpo spugnoso penieno (che risulta malformato) e può spesso presentare alcuni abbozzi di meati secondari lungo tutto il suo percorso e solitamente uno di questi situato in posizione naturale all'apice del membro. Il difetto è sempre accompagnato dall'assenza del frenulo e della sua arteria. Un corpo spugnoso formato in modo anomalo può in alcuni casi essere suddiviso in più parti e i suoi contorni risultare visibili sotto pelle. Nel paziente ipospadico la fascia di Buck e la fascia contrattile sono inoltre spesso spostate lateralmente. L'asimmetria dei corpi cavernosi del pene è un'anomalia rara.
Nei casi di gravi forme posteriori (scrotali e perineali) con associati micropene, transposizione penoscrotale, scroto bifido e criptorchidia è raccomandata un'indagine di intersessualità per "Disturbi della Differenziazione Sessuale (Disorders of Sex development - DSD)", con tipizzazione del cariotipo e un esame endoscopico dell'uretra. Quando l’ipospadia non è associata a criptorchidismo o ad altre anomalie genitali si parla di “ipospadia isolata”. In questi casi è raro avere altre malformazioni dell'apparato urinario in quanto i momenti di formazione e i tessuti embrionali coinvolti sono diversi tra le due parti[7].
L'ipospadia viene solitamente diagnosticata alla nascita o durante le normali visite di controllo del bambino e nei casi più complicati necessita di apposite indagini strumentali con la consulenza di varie specialità mediche per la rilevazione di eventuali altri difetti e malformazioni fisiche.
Difetti di accompagnamento
[modifica | modifica wikitesto]I difetti più comuni alla nascita associati all'ipospadia comprendono criptorchidismo, malformazioni dell'apparato urinario come il megauretere, problemi cardiaci ed ernia inguinale obliqua. La loro incidenza è più elevata nei pazienti con forme posteriori ed è stimata complessivamente al 9,3-32%[15]. Spesso una stenosi dolorosa del meato (riscontrabile durante la minzione) è accompagnata alla manifestazione clinica del difetto; in questo caso il rischio è quello di avere una maggior predisposizione per infezioni, reflusso di urina e anche una possibile insufficienza renale cronica[9]. Il diverticolo prostatico persistente, a volte indicato come vagina maschile, viene raramente rilevato in pazienti con ipospadie anteriori, ma si ritrova nel 40% dei soggetti con forme scroto-perineali e perineali[16]. In questi bambini una diagnostica accurata per altre anomalie del tratto urinario è fortemente raccomandata[17].
Classificazione
[modifica | modifica wikitesto]Numerosi sono i sistemi ideati per la classificazione delle molteplici forme di ipospadia pubblicati da diversi autori nel corso del tempo, e molti di essi sono tuttora validi e utilizzati. Il meato (fattore principe per la suddivisione in tipi) può essere situato in varie posizioni lungo l'asta del pene, dalla sua abituale collocazione all'apice del glande sino al perineo, nei pressi dello scroto. A seconda della sua localizzazione si distinguono quindi ipospadie[2]:
- Distali o anteriori (oltre il 70-75% dei casi)
- glandulari
- coronali e subcoronali
- Intermedie o medie (circa il 10% dei casi)
- peniene anteriori senza incurvamento
- medio-peniene
- peniene posteriori senza incurvamento
- Prossimali o posteriori (circa il 20% dei casi)
- peniene posteriori con incurvamento
- peno-scrotali
- scrotali
- perineali

Trattamento
[modifica | modifica wikitesto]L'intervento chirurgico è l'unico trattamento efficace[2]. La chirurgia di riparazione dell'ipospadia corregge gravi problemi infantili e che potrebbero insorgere nell'età adolescenziale e adulta come difficoltà nella normale minzione (specie da in piedi), infezioni ricorrenti, disfunzioni sessuali (difficoltà di penetrazione ed eiaculazione, sterilità indiretta) e previene possibili gravi sofferenze psicologiche. L'operazione può svolgersi singola o in multi-stadio e di solito consiste in:
- Raddrizzamento del pene;
- Ricostruzione uretrale (uretroplastica) e correzione della posizione del meato;
- Chirurgia plastica glandulare (glanduloplastica);
- Ricostruzione degli strati addominali del pene;
- Ricostruzione del prepuzio (prepuzioplastica, non sempre);
- Ripristino estetico dei genitali e predisposizione al loro completo e corretto sviluppo futuro.
Indicazioni per il trattamento chirurgico
[modifica | modifica wikitesto]
Secondo le attuali linee guida mediche ogni forma di ipospadia diagnosticata va corretta, superando di fatto la vecchia consuetudine a operare solo le forme più gravi, sottovalutando così l'impatto psicologico sul paziente del problema estetico.
La necessità di un intervento chirurgico in caso di difetti minori (ipospadie glandulari) in cui il meato uretrale è in posizione vicina rispetto alla naturale ubicazione sul glande e il prepuzio è formato correttamente su un pene dritto, rimane incerta. Il flusso di urina in questi pazienti è di solito emesso normalmente e l'opinione medica prevalente è che si tratti di un piccolo difetto estetico che non richiede una correzione, anche se ogni caso è da valutare singolarmente[18]. Questa condizione è detta “megameato con prepuzio intatto”.
Tempi della procedura
[modifica | modifica wikitesto]Fino ai primi anni 2000 l'intervento chirurgico di riparazione dell'ipospadia veniva di norma eseguito su bambini di età superiore ai 3(5) anni per via delle maggiori dimensioni del pene che facilitavano la procedura di ricostruzione. Tale rinvio dell'operazione, tuttavia, spesso causava problemi psicologici a causa del marcato ricordo dell'evento (disturbi comportamentali, senso di colpa, compromissione dell'identificazione sessuale). Già nel 1975 l'American Pediatric Academy raccomandava l'esecuzione dell'intervento prima dei tre anni[8], ma talvolta non si disponeva ancora di adeguate tecniche operative e strumentali. Attualmente, i 6-18 mesi sono considerati i più convenienti per la correzione chirurgica del difetto[1], grazie anche alla possibilità di svolgere un trattamento ormonale pre-operatorio mediante applicazione locale o parenterale di testosterone, diidrotestosterone o beta-gonadotropina corionica per aumentare sufficientemente in modo artificiale le dimensioni dei genitali[19]. Quest'ultima procedura è di solito riservata ai pazienti con ipospadie gravi e scarso sviluppo tessutale.
Tecniche chirurgiche per raddrizzare il pene
[modifica | modifica wikitesto]In caso di sviluppo anomalo della cute del pene sul lato addominale e della presenza di aderenze e/o plicature di vario tipo, la tecnica di raddrizzamento chirurgico dell'asta consiste nell'incidere la pelle dalla base del glande lateralmente alla piastra uretrale che circonda l'uscita dislocata del meato. La dissezione profonda dovrebbe riuscire a tagliare le parti laterali del tessuto spugnoso ipoplastico e raggiungere la tonaca albuginea, permettendo così il raddrizzamento meccanico dell'organo. Nei casi in cui ciò non dia il risultato desiderato, il chirurgo seziona la piastra dai corpi cavernosi all'altezza della posizione corretta dello sbocco urinario, circondata dal corpo spugnoso. Lateralmente il tessuto viene liberato dalla fascia contrattile, dalla tonaca albuginea, dalla fascia di Buck e dalla cute. Il corpo spugnoso degenerato sotto forma di corda fibrosa viene rimosso. Se anche questa operazione non è efficace, probabilmente risiede un'altra ragione per la flessione del pene: una piastra tubolare uretrale troppo corta o un'ipoplasia della parte ventrale della tonaca albuginea. Un'uretra troppo corta può essere tagliata nella sua sezione inferiore e spostata in direzione prossimale; la seconda causa viene corretta mediante piegatura dorsale e accorciamento della plica della tonaca superiore[20]. Si verifica infine l'efficacia della procedura inducendo l'erezione artificiale farmacologica del pene[21]. L'intervento di correzione dell'incurvamento può svolgersi contemporaneamente all'uretroplastica, ottenendo così due risultati in un unico momento operatorio.
Tecniche chirurgiche per la ricostruzione uretrale
[modifica | modifica wikitesto]
La scelta della tecnica chirurgica dipende principalmente dal tipo di ipospadia, dalla sua gravità (posizione del meato, grado di incurvamento dell'asta e conformazione del glande) e a volte anche da altri fattori (ad esempio si può decidere di utilizzarne una che favorisce la ricostruzione del prepuzio o un'altra che invece prevede la circoncisione). Gli interventi a uno stadio sono più utilizzati di quelli a due stadi[8]. Le tecniche a due stadi sono utilizzate principalmente nel trattamento dell'ipospadia posteriore, nonché dei casi più severi e complessi che richiedono un nuovo intervento[22]. Nelle forme anteriori (circa il 70-75% dei casi) è possibile procedere mediante avanzamento uretrale distale glandulare, mentre in quelle medie e prossimali si procederà con un'uretroplastica completa. L'intervento non è in grado in nessun caso di ricostruire il corpo spugnoso che funge da guaina protettiva e contrattile al canale urinario. È norma, indipendentemente dal tipo di chirurgia impiegata, lasciare un catetere vescicale sovrapubico, uno stent o un catetere Foley[19] a protezione della neouretra per circa 3-6 giorni (in particolar modo nelle ipospadie gravi).
Di seguito è riportata una lista dei metodi più utilizzati in Europa e Nord America tra gli oltre 300 conosciuti[23]:
- Chirurgia plastica con metodo MAGPI (Meatal Advancement and Glanuloplasty Procedure Incorporated)
Il metodo viene utilizzato nei casi di ipospadia anteriore quando uno spostamento lieve del meato dalla sua sede naturale dirige il deflusso di urina verso il basso. In questa tecnica, dopo la spoliazione cutanea della parte superiore del pene (dissezione della pelle insieme alla fascia di Buck al di sotto del livello del meato anomalo e del glande), l'uretra naturale viene portata verso l'alto, fissata tramite sutura e si esegue una glanduloplastica per ridare forma corretta alla punta dell'asta. La tecnica prevede quindi un avanzamento del canale uretrale e ricostruzione della punta peniena[24]. Complicanze: discesa del meato e deiscenza dei tessuti trattati.
- Metodo Koff (Koff's Urethral Mobilization)
Nella metodica di Koff, dopo aver eseguito la spoliazione cutanea del pene, l'uretra viene scollata dai corpi cavernosi, il che consente di allungarla di qualche millimetro portando lo sbocco nella parte superiore del glande previa opportuna sutura[25].
- Metodo di Thiersch e Duplay (Thiersch-Duplay Principle)
Il metodo è utilizzato nei casi di ipospadia anteriore con la presenza di una porzione di piastra uretrale al disopra del meato anomalo sufficientemente ampia e sviluppata. Consiste nel tagliare i bordi di quest'ultima, tubulizzarla e successivamente suturarla al glande fino a raggiungere la posizione corretta dello sbocco urinario. Può anche essere usato nel trattamento dell'ipospadia media, a condizione che sia presente una piastra ben formata e conservata[26].
- Metodo Mathieu (Mathieu Technique)
In questo metodo, i casi di ipospadia anteriore con uno sviluppo uretrale insoddisfacente sono trattati come segue: si scolpisce un rettangolo di cute dalla faccia ventrale del pene che viene ribaltato sulla piastra previamente incisa ai lati in profondità nel glande; segue tubulizzazione del segmento e glanduloplastica. Il prepuzio viene quindi suturato ventralmente per ripristinare la continuità cutanea. Questo metodo è talvolta usato per trattare le forme medie meno gravi di ipospadia e produce nuovi meati dalla caratteristica forma a T[27]. Complicanze: necrosi del lembo cutaneo, stenosi.
- Tecnica di Asopa (Asopa Procedure)
Nella tecnica di Asopa la piastra uretrale viene dapprima aperta ventralmente; si esegue quindi una seconda incisione della sua parte dorsale a ridosso dei corpi cavernosi e si crea un'apertura ellittica da scollamento parziale. In questa apertura viene innestato un lembo ampliativo di mucosa buccale o di prepuzio formando così un canale urinario di dimensioni e larghezza adeguate. Si confeziona una tubularizzazione mediante sutura su catetere e viene riposizionata in sede la cute[28].
- Metodo Snodgrass (Tubularized Incised Plate Urethroplasty)
Nella tecnica di Snodgrass la neouretra viene ricostruita dopo aver inciso la piastra uretrale in tutta la sua lunghezza e averne tubulizzato i margini previo auto-ribaltamento. Il nuovo canale così formato verrà cucito sul lato addominale lasciando il lato dorsale non suturato. Sarà quindi apposto su di esso un lembo prepuziale vascolarizzato a protezione della struttura. Segue una glanduloplastica e il ripristino in sede della cute. La tecnica ha lo scopo di favorire l'epitelizzazione spontanea dei tessuti trattati. La parte dorsale del prepuzio si utilizza nella procedura, ma può anche essere conservata[29]. Complicanze: fistole e stenosi glandulari.
- Tecnica Onlay-Duckett (Island Onlay Hypospadias Repair - Transverse Preputial Island Flap)
In questa tecnica, dopo aver proceduto con l'incisione ai lati della piastra uretrale e la spoliazione cutanea completa del pene, si ritaglia un rettangolo di cute dal prepuzio dorsale e si trasferisce sulla faccia ventrale dell'organo genitale. Qui il peduncolo vascolarizzato viene tubulizzato e inserito centralmente, previa distruzione della piastra (Duckett)[30] o anastomizzato ad essa mediante apposita sutura ai lati (Onlay). Successivamente segue una glanduloplastica e il ripristino in sede del derma. In questo metodo, il lembo peduncolato ricavato dall'interno del prepuzio viene utilizzato per ricostruire la parte addominale della neouretra. La tecnica è utilizzata nel trattamento dell'ipospadia media e posteriore e consente la ricostruzione di un segmento di canale anche di sette centimetri[30]. Complicanze: fistole, stenosi, necrosi dei tessuti trattati.
- Chirurgia di Koyanagi (Koyanagi-Nonomura One-Stage Repair for Severe Perineal Hypospadias)
La tecnica della ricostruzione a uno stadio di Koyanagi è utilizzata nelle forme gravi di ipospadia e consiste nell'apporre un'uretra completamente artificiale ricavata mediante tubulizzazione di due lembi parameatali di tessuto (graft) sopra agli abbozzi non formati di quella naturale. Il tutto mediante doppia sutura cutanea. Vari tessuti possono essere impiegati nella formazione del nuovo canale: oltre alla pelle del prepuzio sono oggi impiegate la mucosa orale della guancia e quella vescicale[31].
- Tecnica di Bracka in due tempi (Two-Stage Urethroplasty)
Questa tecnica si esegue in due diversi momenti operatori e tratta le ipospadie posteriori e prossimali. Nel primo intervento la superficie ventrale del glande viene allargata tramite un innesto cutaneo prepuziale o di mucosa buccale (graft). Il tessuto impiantato dovrà attecchire e svilupparsi. Dopo circa 3 mesi dal primo intervento il lembo verrà tubulizzato e suturato per costruire la neouretra[32]. Segue una glanduloplastica. Complicanze: non attecchimento dei lembi innestati, fistole, stenosi.
Risultati del trattamento
[modifica | modifica wikitesto]Nella maggior parte delle forme di ipospadia trattata, l'effetto cosmetico ottenuto è almeno soddisfacente. Le possibilità di ricostruzione del prepuzio possono essere problematiche, il che è spesso importante per i genitori o i tutori del bambino operato[33], che potrebbero dover accettare giocoforza la proposta di un'estetica simile ad una circoncisione completa. A livello endoscopico la differenza del colore interno tra l'uretra naturale (rosso-rosata per la ricca vascolarizzazione) e quella ricostruita (biancastra), nonché le diverse proprietà di resistenza meccanica e biologica tissutali, sono una conseguenza del tutto normale e fisiologica.
Complicanze postoperatorie
[modifica | modifica wikitesto]Il follow-up per il paziente operato di ipospadia è necessario per un lungo periodo di tempo, solitamente fino all'adolescenza e/o al termine dello sviluppo degli organi genitali. Circa la metà dei problemi che richiedono un reintervento può presentarsi infatti nei primi 12 mesi dopo l'operazione[19], mentre un altro 50% più tardivamente.
La frequenza delle complicanze postoperatorie dipende dalla tecnica chirurgica utilizzata e dalla forma di ipospadia trattata. Quella più comune - oltre a dolore, spasmi vescicali, lieve incontinenza momentanea ed ematomi[9] - è la fistola, ossia la formazione di una seconda apertura per il deflusso urinario non voluta e in posizione errata. Nella chirurgia di Mathieu questa incidenza è stimata intorno al 4% mentre sale fino al 15-20% nella Onlay-Duckett[34]. La maggior parte delle complicazioni riguarda i bambini operati con forme posteriori, che richiedono spesso complesse ricostruzioni tessutali e colpiscono fino al 50% dei pazienti[35]. La fistola si chiude raramente in maniera spontanea e deve venire corretta chirurgicamente. La seconda complicanza per frequenza è la stenosi[9], ossia un anomalo restringimento del canale uretrale che compare nel punto di congiunzione tra il segmento ricostruito e l'uretra naturale (esiti cicatriziali) e/o nella parte superiore del tratto del glande. La stenosi coesiste frequentemente con una fistola. Il restringimento può causare un'irritazione della vescica, delle vie urinarie distali e la comparsa di infezioni lungo di esse. A volte, per ovviare a questo problema, è sufficiente ricalibrare la parte ristretta procedendo con dilatazioni per mezzo di Hegar, ma spesso è necessario un reintervento. Un terzo problema piuttosto frequente è l'ureterocele[9], un diverticolo che comporta l'allargamento di un segmento di uretra (prolasso uretrale) e il conseguente ristagno di liquidi che possono portare ad infiammazioni croniche ed infezioni. L'ureterocele può essere secondario al restringimento del meato (dilatazione da sforzo idraulico nella parte glandulare) o può verificarsi prossimalmente all'anastomosi tra uretra e neouretra (in questo caso si forma sempre per l'azione della pressione urinaria alterata, come nella fistola).
Altre possibili complicanze note includono: emorragie, infezioni generalizzate, cicatrici antiestetiche e retraenti, devitalizzazione dei lembi cutanei innestati o loro scarsa risposta agli androgeni durante la crescita genitale, stenosi serrata o chiusura completa del meato, presenza di peli prepuziali nel lume del canale ricostruito (su di essi si formano calcoli urinari ed è per questo motivo che la chirurgia sta volgendo verso l'utilizzo di parti anatomiche non cutanee come la mucosa orale), piega addominale persistente del pene, riduzione della sensibilità agli stimoli e balanite sclerotica obliterante (o Lichen Sclerosus, un'infiammazione cronica del glande con fibrosi e restringimento progressivo dello sbocco urinario)[36]. Le opzioni terapeutiche per quest'ultima condizione includono steroidi per unguento topici o una meatoplastica. Sono inoltre riportati casi di "locker-room syndrome" (riluttanza psicologica all'accoppiamento) e deterioramento dell'uretra ricostruita anche a distanza di anni specialmente in seguito all'inizio dei rapporti sessuali nell'età adolescenziale e adulta[37].
Curiosità
[modifica | modifica wikitesto]Oltre al re Enrico II di Francia, diverse figure storiche furono colpite da questa malformazione. Nel loro libro “Hitler's Last Day: Minute by Minute”, gli storici Jonathan Mayo ed Emma Craigie indicano che Adolf Hitler soffriva di ipospadia balanica dopo la visione di alcuni referti medici dell’epoca[38]. Anche il politico canadese Maurice Duplessis ne fu colpito, almeno secondo il suo biografo Conrad Black[39].
Note
[modifica | modifica wikitesto]- ^ a b Current concepts in hypospadiology. Mouriquand et Mure, British Journal of Urology, 2004. Da US National Library of Medicine National Institutes of Health PMID 15086439
- ^ a b c Domini, pp. 473-502, 1998.
- ^ Paulus Aegineta: The seven books of Paulus Aeginata. Sydenham Society, 1844
- ^ Etienne-Frédéric Bouisson (1813-1884): Et le Traitement Chirurgical de l'Hypospadias
- ^ a b c IPOSPADIA: 20 anni di sorveglianza in Emilia-Romagna
- ^ a b Hypospadias trends in two US surveillance systems.
- ^ a b c Ipospadia, da Dottoressa Arianna Lesma in Urologia Pediatrica
- ^ a b c Hypospadias Surgery: An Illustrated Guide
- ^ a b c d e f Ipospadia, Ospedale Pediatrico Bambino Gesù
- ^ Hypospadias in sons of women exposed to diethylstilbestrol in utero: a cohort study. Klip H. et al., 2002.
- ^ Hypospadias: the cause of penis malformation is still a matter of debate
- ^ European Journal of Pediatrics: Hypospadias, all there is to know.
- ^ The surgical treatment of coronal hypospadias and related problems.
- ^ Embryology of the male external genitalia.
- ^ Urologic anomalies associated with hypospadias.
- ^ Management of müllerian duct remnants in the male patient.
- ^ Linee Guida EAU di Urologia Pediatrica, da www.uroweb.org (PDF), su uroweb.org. URL consultato il 31 gennaio 2020 (archiviato dall'url originale il 31 gennaio 2020).
- ^ Wiesław Urbanowicz: Chirurgia dziecięca, 2005, pp. 725-742. ISBN 83-200-3066-8
- ^ a b c L'ipospadia. Da uroblog.it, consultazione delle patologie urologiche
- ^ Congenital curvature of the phallus: report of three cases with description of corrective operation.
- ^ Injection technique to induce penile erection.
- ^ The Two-Stage Repair for Severe Primary Hypospadias
- ^ Ipospadia: che cos’è e come si può curare
- ^ MAGPI (meatoplasty and glanuloplasty): a procedure for subcoronal hypospadias
- ^ Extensive mobilization of the urethral plate and urethra for repair of hypospadias: the modified Barcat technique.
- ^ Operative Therapie der Hypospadie
- ^ Traitement en un temps de l’hypospade balanique et juxta-balanique
- ^ La tecnica di Asopa nella correzione dei difetti uretrali, su stenosi-uretrale.it. URL consultato il 18 gennaio 2020 (archiviato dall'url originale il 20 giugno 2021).
- ^ Tubularized, incised plate urethroplasty for distal hypospadias
- ^ a b Transverse Preputial Island Flap Technique for Repair of Severe Hypospadias. Duckett JW, Urol. Clin. North Am. 1980 Jun; 7(2):423-30
- ^ Experience with one-stage repair of severe proximal hypospadias: operative technique and results.
- ^ Chirurgia dell'ipospadia
- ^ With penile appearance after hypospadias surgery: the patient and surgeon view.
- ^ Transverse preputial island flap neo-urethroplasty.
- ^ The modified Koyanagi repair for severe proximal hypospadias.
- ^ Hypospadias repair: current principles and procedures.
- ^ Ipospadia fallita, da Centro di chirurgia uretrale-genitale
- ^ Hitler's Last Day: Minute by Minute by Jonathan Mayo and Emma Craigie. Short Books Ltd editrice, collana Minute by Minute, 2016, 336 pp.
- ^ Conrad Black, Duplessis. Le pouvoir, Les éditions de l'homme, 1977, 623 pp.
Bibliografia
[modifica | modifica wikitesto]- Andrea Franchella, Manuale di chirurgia plastica pediatrica, CLEUP.
- Hypospadias Surgery: An Illustrated Guide, Springer, 2004.
- Hypospadias and Genital Development, Laurence S. Baskin, 2004.
- Nicola Olivieri, L'ipospadia. Masson ed., 1990.
- Remigio Dòmini, Roberto De Castro, Chirurgia delle malformazioni urinarie e genitali, Padova, Piccin, 1998.
- Enciclopedia medica italiana. Volume VII, Sansoni Edizioni Scientifiche, 1955, pp. 1239-1352.
- L'apparato genitale maschile, Collana della salute. Curcio.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «ipospadia»
Wikizionario contiene il lemma di dizionario «ipospadia» Wikimedia Commons contiene immagini o altri file su ipospadia
Wikimedia Commons contiene immagini o altri file su ipospadia
Collegamenti esterni
[modifica | modifica wikitesto]- Ipospadia - pagina descrittiva dell'Ospedale Bambino Gesù
- Ipospadia pagina informativa su Humanitas - clinicacellini.it
- Patologie: l’ipospadia, Urologia Pediatrica
- Ipospadia: 20 anni di sorveglianza. Descrizione della patologia e statistiche a cura della regione Emilia-Romagna
- L'ipospadia, un inquadramento generale. Da uroblog.it
- (EN) hypospadias, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Tecnica innesto ureterale (JPG), su img220.imageshack.us.
- Toronto Hospital for Sick Children’s Child Physiology, Animazione descrittiva delle classificazioni dell'ipospadia (illustrazione collegata ad altre schede su anatomia e sviluppo del pene), su aboutkidshealth.ca. URL consultato il 10 febbraio 2012 (archiviato dall'url originale il 2 aprile 2012).
- Hypospadias in eMedicine Pediatrics (sito web in lingua inglese)
- Hypospadias surgery (sito web in lingua inglese)
| Controllo di autorità | Thesaurus BNCF 45069 · LCCN (EN) sh85063812 · BNF (FR) cb12046922h (data) · J9U (EN, HE) 987007536177205171 |
|---|