Amminoacidi non proteinogenici
Gli amminoacidi non proteinogenici sono una vasta categoria di amminoacidi che non sono codificati dal codice genetico di alcun essere vivente. Questo non esclude la loro presenza nelle proteine, in quanto possono essere inclusi post-traduzionalmente lungo la catena peptidica o possono essere il risultato di modifiche di amminoacidi normalmente presenti.
Numericamente, gli amminoacidi non proteinogenici sono migliaia.[1]
Definizione per esclusione
[modifica | modifica wikitesto]
Qualsiasi molecola contenente un gruppo funzionale amminico () e uno carbossilico () è catalogabile come amminoacido. Le regole di nomenclatura degli amminoacidi approvate dalla IUPAC, assegnano a ciascun carbonio della molecola, escluso quello del gruppo carbossilico, una lettera greca che segue l'ordine alfabetico man mano che ci si allontana dal gruppo carbossilico. Il carbonio α è dunque quello che possiede il gruppo carbossilico.
Gli amminoacidi proteinogenici sono un piccolo sottogruppo di amminoacidi, in quanto soddisfano una serie di requisiti che li rendono tutti molto simili. Questi requisiti sono:
- Avere sul carbonio α sia il gruppo amminico, sia il gruppo carbossilico, sia una catena laterale, sia un atomo di idrogeno. A questa regola fa eccezione la glicina, che possiede due atomi di idrogeno e nessuna catena laterale.
- Il carbonio α a questo punto diventa uno stereocentro, il quale deve trovarsi in configurazione S. Tale configurazione rende la molecola un enantiomero levogiro (enantiomero L) quando colpita da luce polarizzata.
- Essere un'ammina primaria. A questa regola fa eccezione la prolina, che è un'ammina secondaria.
Tutti gli amminoacidi che non soddisfano questi requisiti, non sono inclusi nel codice genetico e di conseguenza vengono definiti non proteinogenici.
Amminoacidi α
[modifica | modifica wikitesto]Amminoacidi senza stereocentri
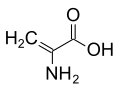
[modifica | modifica wikitesto]La presenza sul Cα di atomi più ingombranti dell'idrogeno distorce la struttura delle proteine ed è per questo motivo che gli amminoacidi che non hanno idrogeni sul Cα non sono proteinogenici.[2] Ad esempio, l'acido 2-amminoisobutirrico è prodotto da alcuni funghi come precursore di alcuni peptidi aventi attività antibiotica.[3]
-
Struttura dell'acido 2-amminoisobutirrico.
-
Struttura della deidroalanina.
Amminoacidi con uno stereocentro
[modifica | modifica wikitesto]L-α-amminoacidi
[modifica | modifica wikitesto]L-α-amminoacidi con catene laterali troppo ingombranti o troppo simili a quelle già esistenti, non sono inclusi nel codice genetico. Ad esempio, esiste un solo amminoacido proteinogenico con catena laterale lineare (alanina), ma ne esistono altri come l'omoalanina o la norvalina che non sono inclusi nel codice genetico. La mancanza di amminoacidi proteinogenici a catena laterale lineare potrebbe essere spiegata con la ridondanza di altri a catena laterale ramificata (valina, leucina, isoleucina).[2]
-
Struttura dell'omoalanina.
-
Struttura della norvalina.
-
Struttura della norleucina.
D-α-amminoacidi
[modifica | modifica wikitesto]Alcuni enantiomeri destrogiri degli amminoacidi sono usati in natura per la sopravvivenza. Ad esempio la D-alanina e l'acido D-glutammico sono usati dai procarioti per costruire il peptidoglicano, o ancora l'acido D-aspartico è usato dal nostro organismo come neurotrasmettitore.
-
Struttura della D-alanina.
-
Struttura dell'acido D-glutammico.
-
Struttura dell'acido D-aspartico
Amminoacidi con più stereocentri
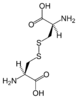
[modifica | modifica wikitesto]Nelle proteine, la cisteina generalmente forma ponti disolfuro con altri residui di cisteina, i quali servono a stabilizzare l'intera molecola. Quando però la cisteina non è inclusa in una proteina riesce comunque a legare un'altra cisteina, formando una molecola di cistina. A volte può capitare che per sintetizzare una metionina, la serina non reagisca come di consueto ma venga fusa con la cisteina, generando una nuova molecola chiamata cistationina.
-
Struttura della cistina.
-
Struttura della cistationina.
-
Struttura della lantionina.
Amminoacidi non-α
[modifica | modifica wikitesto]Vengono definiti amminoacidi non-α tutti quegli amminoacidi che hanno il sostituente amminico in posizioni più lontane rispetto alla posizione α. In natura e nel nostro organismo esistono alcuni amminoacidi non-α che vengono usati come neurotrasmettitori o precursori di altre molecole.
-
Struttura della β-alanina.
-
Struttura dell'acido γ-amminobutirrico (GABA).
-
Struttura dell'acido 4-amminobenzoico (PABA).
Amminoacidi che sono ammine secondarie
[modifica | modifica wikitesto]L'unico amminoacido incluso nel codice genetico che è anche un'ammina secondaria è la prolina, ma esistono altri amminoacidi non proteinogenici che sono ammine secondarie. Alcuni esempi sono l'idrossiprolina, l'acido pipecolico o la sarcosina, tutte molecole prodotte da trasformazioni chimiche delle rispettive ammine primarie.
-
Struttura dell'idrossiprolina.
-
Struttura dell'acido pipecolico.
-
Struttura della sarcosina.
Amminoacidi che sono ammine terziarie
[modifica | modifica wikitesto]Anche queste molecole sono prodotte dalle trasformazioni chimiche delle rispettive ammine primarie. Un esempio di amminoacido con ammina terziaria è l'N,N-dimeti-L-alanina o il relativo enantiomero.
Amminoacidi non naturali
[modifica | modifica wikitesto]Nei meteoriti e negli esperimenti prebiotici si trovano molti più amminoacidi dei venti amminoacidi standard, molti dei quali a concentrazioni superiori a quelli standard: è stato ipotizzato che se dovesse sorgere vita a base di amminoacidi parallelamente in altre parti dell'universo, non più del 75% degli amminoacidi sarebbe in comune.[2]
Note
[modifica | modifica wikitesto]- ^ (EN) Alexandre Ambrogelly, Sotiria Palioura e Dieter Söll, Natural expansion of the genetic code, in Nature Chemical Biology, vol. 3, n. 1, 2007-01, pp. 29–35, DOI:10.1038/nchembio847. URL consultato il 29 luglio 2021.
- ^ a b c (EN) Arthur L. Weber e Stanley L. Miller, Reasons for the occurrence of the twenty coded protein amino acids, in Journal of Molecular Evolution, vol. 17, n. 5, 1º settembre 1981, pp. 273–284, DOI:10.1007/BF01795749. URL consultato il 29 luglio 2021.
- ^ Xue Gao, Yit-Heng Chooi e Brian D. Ames, Fungal Indole Alkaloid Biosynthesis: Genetic and Biochemical Investigation of the Tryptoquialanine Pathway in Penicillium aethiopicum, in Journal of the American Chemical Society, vol. 133, n. 8, 2 marzo 2011, pp. 2729–2741, DOI:10.1021/ja1101085. URL consultato il 29 luglio 2021.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file sugli Amminoacidi non proteinogenici
Wikimedia Commons contiene immagini o altri file sugli Amminoacidi non proteinogenici