Ácido glicónico
| Ácido D-glicónico | |
|---|---|
 | |
 | |
D-Gluconic acid | |
Outros nomes Dextronic acid | |
| Identificadores | |
| Número CAS | 526-95-4, 133-42-6 (racemato) |
| PubChem | 10690 |
| ChemSpider | 10240 |
| Número CE | 208-401-4 |
| ChEBI | CHEBI:33198 |
| ChEMBL | CHEMBL464345 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C6H12O7 |
| Masa molecular | 196,16 g/mol |
| Aspecto | Cristais incoloros |
| Punto de fusión | 131 °C; 268 °F; 404 K |
| Solubilidade en auga | Boa |
| Acidez (pKa) | 3,86[1] |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
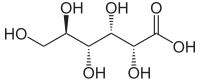
O ácido glicónico ou áido glucónico é un azucre ácido orgánico coa fórmula HOCH2(CHOH)4COOH [2][3]. É un dos 16 estereoisómeros do ácido 2,3,4,5,6-pentahidroxihexanoico.
En disolución acuosa a pHs lixeiramente ácidos, o ácido glicónico forma o ión gliconato. Os sales do ácido glicónico denomínanse "gliconatos". O ácido glicónico e os seus sales e ésteres aparecen amplamente na natureza porque ditas especies se orixinan pola oxidación da glicosa, unha substancia moi común. O grupo aldehido da glicosa oxídase orixinando este ácido aldónico, un tipo de azucre ácido. Algúns fármacos son inxectados en forma de gliconatos.
Estrutura química
[editar | editar a fonte]A estrutura química do ácido glicónico consiste nunha cadea de seis carbonos con cinco grupos hidroxilo e un grupo terminal carboxilo (COOH). En solución acuosa, o ácido glicónico existe en equilibrio co éster cíclico glicono delta-lactona.
Distribución e aplicacións
[editar | editar a fonte]O ácido glicónico aparece na natureza en froitas, mel, kombucha (té fermentado), e viño. Utilízase como aditivo alimentario co número E574[4], e funciona como regulador da acidez. Tamén se utiliza en produtos de limpeza, nos que disolve depósitos minerais especialmente en solución alcalina. O anión gliconato é un axente quelante, que quela o Ca2+, Fe2+, Al3+, e outros ións metálicos. En 1929 Horace Terhune Herrick desenvolveu un proceso para producir o sal por fermentación.[5]
O gliconato de calcio, en forma de xel, utilízase para tratar queimaduras producidas por ácido fluorhídrico;[6][7] as inxeccións de gliconato de calcio poden utilizarse en casos máis graves para evitar a necrose de tecidos profundos.[8] O gliconato de quinina é un sal do ácido glicónico e quinina, que se utiliza por inxección intramuscular no tratamento da malaria. As inxeccións de gliconato de cinc utilízanse para castrar cans machos.[9] No pasado propúxose o uso de inxeccións de gliconato de ferro para tratar a anemia.[10]
Notas
[editar | editar a fonte]- ↑ Bjerrum, J., et al. Stability Constants, Chemical Society, London, 1958.
- ↑ PubChem compound Gluconic acid
- ↑ ChemSpider Gluconic acid
- ↑ Current EU approved additives and their E Numbers. Food Standards Agency
- ↑ "All Chemistry". Time magazine. May 13, 1929. Arquivado dende o orixinal o 03 de xuño de 2011. Consultado o 2010-07-12.
O Dr. Horace T. Herrick (U. S. Department of Agriculture) relatou experimentos que tiñan como obxectivo producir ácido tartárico a partir de balores. Non conseguiron o seu obxectivo, pero se atopou un modo de producir ácido glicónico. Este ácido que antes costaba $100 a libra, podía agora producirse por menos de 35 centavos. Pode utilizarse na fabricación de colorantes con ese novo prezo; tamén, para fabricar gliconato de calcio, un valioso medicamento para o tratamento das hemorraxias.
Arquivado 03 de xuño de 2011 en Wayback Machine. - ↑ el Saadi MS, Hall AH, Hall PK, Riggs BS, Augenstein WL, Rumack BH (1989). "Hydrofluoric acid dermal exposure". Vet Hum Toxicol 31 (3): 243–7. PMID 2741315.
- ↑ Roblin I, Urban M, Flicoteau D, Martin C, Pradeau D (2006). "Topical treatment of experimental hydrofluoric acid skin burns by 2.5% calcium gluconate". J Burn Care Res 27 (6): 889–94. PMID 17091088. doi:10.1097/01.BCR.0000245767.54278.09.
- ↑ D. Thomas, U. Jaeger, I. Sagoschen, C. Lamberti and K. Wilhelm (2009), Intra-Arterial Calcium Gluconate Treatment After Hydrofluoric Acid Burn of the Hand. CardioVascular and Interventional Radiology, Volume 32, Number 1, pages 155-158, DOI 10.1007/s00270-008-9361-1
- ↑ Julie K. Levy, P. Cynda Crawford, Leslie D. Appel, Emma L. Clifford (2008), Comparison of intratesticular injection of zinc gluconate versus surgical castration to sterilize male dogs. American Journal of Veterinary Research Vol. 69, No. 1, Pages 140-143. doi: 10.2460/ajvr.69.1.140
- ↑ Paul Reznikoff and Walther F. Goebel (1937), The preparation of ferrous gluconate and its use in the treatment of hypochromic anelia in rats. Journal of Pharmacology and Experimental Thereapy, volume 59 issue 2, page 182.