Acétylacétonate de métal
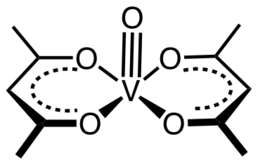
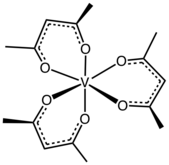
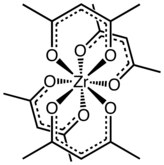
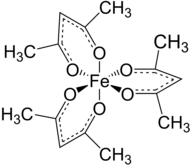
Un acétylacétonate de métal est un complexe formé d'anions acétylacétonate [CH3COCHCOCH3]−, un ligand bidentate, et d'ions métalliques, généralement de métaux de transition. Les deux atomes d'oxygène se lient généralement ensemble au cation métallique pour former un cycle de chélation à six atomes. Le ligand acétylacétonate est souvent noté acac. Les complexes les plus simples ont la formule générale M(acac)3 et M(acac)2, où M représente l'ion métallique. Il existe également de nombreux complexes à ligands mixtes, comme l'acétylacétonate de vanadyle (en) VO(acac)2. Il existe également de nombreux dérivés du ligand acac avec d'innombrables substituants à la place du méthyle, de la forme RCOCHCOR’ −[1].
De nombreux complexes de ce type sont solubles dans les solvants organiques, contrairement aux halogénures de métaux apparentés. Pour cette raison, les complexes d'acac sont parfois utilisés comme précurseurs de catalyseurs et de réactifs chimiques. Ils sont utilisés par exemple comme réactifs de déplacement en RMN, comme catalyseurs en synthèse organique, et comme précurseurs de catalyseurs d'hydroformylation industrielle. C5H7O2− se lie parfois également au métal depuis l'atome de carbone central, surtout avec les métaux de transition de la 6e période tels que Pt(II) et Ir(III).
Synthèse
[modifier | modifier le code]Une méthode générale de synthèse des acétylacétonates de métal consiste à traiter un sel de métal avec de l'acétylacétone, Hacac[2] :
- Mn+ + n Hacac M(acac)n + n H+.
L'addition d'une base favorise la déprotonation de l'acétylacétone et déplace l'équilibre vers la formation du complexe. Les deux atomes d'oxygène se lient au métal pour former un cycle de chélation à six atomes. Dans certains cas, la chélation est si forte qu'il n'est pas nécessaire d'ajouter de base pour former le complexe. Certains complexes sont produits par métathèse à partir de Tl(acac).
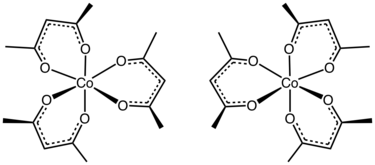
Structure et liaisons
[modifier | modifier le code]Dans la majorité de ses complexes, le ligand acac forme des cycles de chélation à six atomes C3O2M[3]. Le cycle Macacc a une géométrie planaire avec une symétrie plane traversant le cycle. Le cycle acacM est aromatique qui provient de la délocalisation des liaisons dans la section C3O2. Conformément à ce scénario, dans certains complexes, le ligand acac est sensible à la substitution électrophile, semblable à la substitution électrophile aromatique — Me = CH3 dans la réaction suivante :
Du point de vue du comptage des électrons (en), le ligand bidentate neutre acac lié par ses atomes d'oxygène est un « ligand L-X », c'est-à-dire la combinaison d'une base de Lewis L et d'un pseudohalogénure X.
La galerie ci-dessous présente quelques-unes de ces structures d'acétylacétonate de métal :
Notes et références
[modifier | modifier le code]- (en) Markus Albrecht, Sören Schmid, Marita deGroot, Patrick Weis et Roland Fröhlich, « Self-assembly of an unpolar enantiomerically pure helicate-type metalla-cryptand », Chemical Communications, no 20, , p. 2526-2527 (PMID 14594263, DOI 10.1039/b309026d, lire en ligne)
- (en) R. C. Mehrotra, R. Bohra et D. P. Gaur, Metal ß-Diketones and Allied Derivatives, Academic Press, 1978. (ISBN 0124881505)
- (en) Evrim Arslan, Roger A. Lalancette et Ivan Bernal, « An historic and scientific study of the properties of metal(III) tris-acetylacetonates », Structural Chemistry, vol. 28, , p. 201-212 (DOI 10.1007/s11224-016-0864-0, S2CID 99668641, lire en ligne)