P53
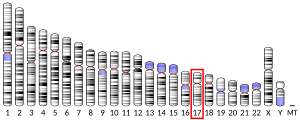
p53 tumore-proteina, gizakietan TP53 geneak kodeturiko proteina tumore-supresorea da, 17. giza kromosomaren beso laburrean kodetzen dena (17p13). [6]Proteina honi erreferentzia egitean, p53 tumore antigeno zelularra, p53 fosfoproteina, p53 tumore-supresorea, NY-CO-13 antigenoa edo transformazioarekin erlazionaturiko 53 proteina (TRP53) deritzo. p53 proteinaorganismo zelulaniztunetan ezinbestekoa da, non minbiziaren sorrera saihesten duen; hori dela eta, p53-a genomaren zaintzailetzat hartu da, genoman mutazioak gertatzea ekidin, eta egonkortasuna mantentzen duelako.[7] Ondorioz, proteina kodetzen duen TP53 genea, eta beste animaliatan aurki daitezkeen gene honen homologoak (Trp53 saguetan), antionkogene edo gene tumore-supresore bezala sailkatzen dira.[8][9][10][11][12]
p53 transkripzio-faktoreen familia baten parte da, zeinaren barne p63 eta p73 ere aurkitzen dira. Hiru proteina hauek oraindik osorik ezagutzen ez den elkarrekintza-sare konplexu batean laguntzen dute. Hala ere, p53 ubikuoa da, hau da, ehun guztietan adierazten da, eta p63 eta p73 ehun-espezifikotasuna dute. Gainera, proteina guztiek isoformak aurkezten dituzte, zeinetako batzuek aktibatzaile gisa funtzionatzen dute eta beste batzuk negatibo dominante gisa.
p53 izena 1979an eman zitzaion proteinari, horren masa molekularra deskribatu zelako; SDS-PAGE elektroforesi-analisiak erakusten du 53 kilo-daltoneko (kDa) proteina dela. Halaber, p53 proteina luzearen benetako masa, hondar aminoazidoen masen baturan oinarriturik, 43,7 kDa-ekoa da. Bi masen arteko desberdintasun hori proteinan dauden prolina-hondarrek eragiten dute, SDS-PAGE analisian proteinaren migrazioa moteldu, eta dena baino astunagoa dela dirudielako[13]. Proteina luzeaz gain, giza TP53 geneak gutxienez beste 15 proteina isomorfo kodetzen ditu, 3,5-43,7 kDa arteko tamainadunak. p53 proteina horiei guztiei p53 isomorfo deritze[6]. Giza minbizien artean TP53 da mutatuena (>%50), eta horrek agerian uzten du minbizaren sorrera ekiditeko eragin handia duela[6]. TP53 geneak DNAra lotzen den eta genomaren mutazioak ekiditeko gene-adierazpena erregulatzen duen proteina kodetzen du[14].
Genea
[aldatu | aldatu iturburu kodea]Gizakietan, TP53 genea 17. kromosomaren beso motzean kokaturik dago (17p13.1)[8][9][12][10]. Genea 20 kb-koa da, 1 exoi eta lehen introi luzeak (10 kb) osatua. Ornodunetan, genearen sekuentzia kodetzaileek 5 gune oso kontserbatu dituzte, nagusiki 2., 5., 6., 7. eta 8. exoietan; ornogabeetan aurkitutako sekuentziek, ordea, antzekotasun maila baxua dute ugaztunen TP53 genearekiko[15]. TP53-ren gene ortologoak ugaztun gehienetan identifikatu izanak ahalbidetu du, horien genomen datuak osorik azaltzea.
Gizakitan ohiko polimorfismo bat 72. posizioan dagoen arginina prolina batekin ordezkatzean datza. Ikerketa askok aztertu dute mutazio honen eta minbiziarekiko sentikortasunaren arteko harremana; nolanahi ere, emaitzak eztabaidagarriak izan dira. Esaterako, 2009an eginiko metaanalisi batek ezin izan zuen mutazio honen eta minbizi zerbikalaren arteko harremana frogatu[16]. 2011ko ikerlan batean, TP53-aren prolinaren mutazioak arren pankreako minbizian eragin sakona zuela aurkitu zen. [17]. Emakume arabiarretan egindako ikerkuntza batean, ordea, TP53 72. kodoiko prolina-homozigosia bularreko minbiziaren arrisku-gutxierarekin erlazionatuta zegoela ikusi zen[18]. Beste azterlan batean iradoki zen TP53 72. kodoiko MDM2 SNP309 eta A2164G polimorfismoak, elkarlanean, minbizi ez-orofaringeoekiko sentikortasunarekinlotuta egon zitezkeela. MDM2 zein SNP309 polimorfismoek TP53 72. kodoiarekin batera, emakumeen minbizi ez-orofaringeoen garapenabizkor lezakeela[19]. 2011. urteko beste ikerlan batek aurkitu zuen TP53 72. kodoiaren polimorfismoen eta biriketako minbizia pairatzeko arriskuaren handitzearen artean erlazioa zegoela[20]. 2011ko metaanalisi batek, aldiz, ez zituen nahikoa froga aurkitu TP53 72. kodoi polimorfismoen eta kolon minbizia[21] zein endometrio-minbizia[22] pairatzeko arriskuen artean harremanik ezartzeko. 2011ko Brasilgo jaiotza-kohorte baten ikerketan, TP53 arginina ez-mutatuen eta minbizi gabeko historial klinikodun banakoen artean harreman bat aurkitu zen[23]. Beste 2011ko ikerketa batean aurkitu zen p53 genotipo homozigotoak (Pro/Pro) giltzurruneko zelulen kartzinoma garatzeko arriskua izugarri handituko dezakeela.[24].
Egitura
[aldatu | aldatu iturburu kodea]p53 genearen zenbait homologo sekuentziatu dira osotasunez espezie desberdinetan. Haien antolaketa oso antzekoa da eta hurrengoko ezaugarriak dituzte:
- Introi oso luze bat genearen 5’ muturrean. Ugaztunen kasuan sekuentzia hau lehenengo eta bigarren exonen artean kokatuta dago, baina Xenophus-en kasuan bigarren eta hirugarren exonen artean kokatzen da. Introi honen helburu biologikoa oraindik ezezaguna da.
- Lehenengo exoia beti ez-kodetzailea da. exoi hau estruktura zehatz baten osaeran parte hartzen du parte, p53 alelo basatira lotuko dena baina ez p53 alelo mutantera. Lotura hau p53 mRNA-ren itzulpena inhibitzen du eta zelulan dagoen p53 kantitate erregulatzeko sistema bat izan daiteke,.
- Intronen antolaketa genean zehar antzekoa da. Hauen tamaina aldakorra da espeziearen arabera, baina haien kokapena antzekoa da. Hala ere, arratoian 6. introia ez da agertzen, eta Xenophus-ean 3. introia bitan banatzen da.
p53 proteina fosfoproteina bat da, 393 aminazidoz eta zenbait domeinuz osatua:
- N-talde (nitrogeno talde) azidikoko domeinu transkripzio-aktibatzaileak (DTA), 1 aktibazio-domeinua (1AD) deritzona, transkripzio faktoreak aktibatzen dituen p53 proteinaren domeinua da. N-taldeak beste bi domeinu transkripzio-aktibatzaile gehigarri ditu, handi bat 1-42 monomero artean eta txiki bat 55-75 monomeroetan, hainbat gene pro-apoptotikoren erregulazioarekin erlazionaturik daudenak[25].
- 2 aktibazio domeinua (2AD) 43-63 monomeroetan kokatua, garrantzitsua dena aktibitate apoptotikorako.
- Prolinan aberatsa den domeinua (PAD), 64 eta 92 aminoazidoen artean kokatua, p53-ren jarduera apoptotikorako garrantzitsua, MAPK bidezko garraio nuklearrean.
- Domeinu DNA lotzailea (DDL), 102 eta 292 monomeroen artean kokatua, zink atomo batek eta hainbat arginina aminoazidoek osatzen dute. Gune honen funtzioa p53-ren LMO3 proteina koinhibitzaileari atxikitzea da[26]. Proteinan ematen diren eta giza-minbizia kasuetan aurkitzen diren mutazio puntualen %80 deomeinu honetan ematen dira.
- Kokapen nuklear sekuentziaren (KNS) domeinua, 316 eta 325 aminoazidoen artean dago.
- Domeinu (homo) oligomerizatzailea (DO), 307 eta 355 monomeroen artean dagoena, proteinak in vivo funtzionatzeko funtsezkoa den tetramerizazioa erregulatzen duena.
- C-taldeak (karboxilo taldea), 356-393 monomero artean dagoena, domeinu DNA lotzailearen (DDL) inhibizioan parte hartzen du[27].
Minbizian, p53 inhibitzen duten mutazioak normalean DDLan gertatzen dira. Mutazio hauetako gehienek proteinak bere itu-DNA sekuentziei lotzeko duen ahalmena suntsitzen dute, sekuentzia horretako geneen transkripzio bidezko aktibazioa galaraziz. Hori dela eta, DDLan deraturiko mutazioak, errezesiboki haien funtzioa galdu duten alelo nuluak dira. DOan mutazioak dituzten p53-ko molekulak dimerizatzen dira p53 basatiarekin, haien transkripzioa aktibatzea ekidinez, horregatik DOko mutazioek izaera gainartzaile inhibitzailea dute p53-ren funtzioarekiko.
p53 basatia, proteina aldakorra da, gune tolestu eta intrintsekoki (hiru dimentsiotan) egituratu gabeko guneak (IEGG) izanik, sinergikoki (era bateratuan) funtzionatzen dutenak[28].
Isoformak
[aldatu | aldatu iturburu kodea]TP53 geneak proteina bat baino gehiago kodetzen du, giza geneen %95-aren antzera. Ekoiztutako proteina horiek p53 isoformak deritze eta haien tamainak desberdinak izaten dira, 3,5 eta 43,7 kDa-eko tartean egonik. 2005ean zenbait isoforma aurkitu ziren eta orain arte, giza p53-ren 12 isoforma ezagutzen dira (p53α, p53β, p53γ, ∆40p53α, ∆40p53β, ∆40p53γ, ∆133p53α, ∆133p53β, ∆133p53γ, ∆160p53α, ∆160p53β , ∆160p53γ ). Gainera, isoforma hauek ehunaren arabera desberdin adierazten dira eta p53α ez da bakarrik adierazten. [11]
Jakina, TP53 genetik eratortzen diren isoformak ez dira berdinak, horregatik funtzio desberdinak izango dituzte. Honen adibide Δ133p53β,γ eta Δ160p53α,β,γ isoformak dira, hau da, hauek ez dutenez prolina ugariko gunerik, ez dira gai izango apoptosia bideratzeko. Hala ere, nahiz eta isoforma guztiek ez izan domeinu guztiak, DNA ezagutzen duen domeinu oso kontserbatua dute amankomunean.
Isoformak mekanismo desberdinen bitartez eratzen dira. Beta eta gamma isoformak 9.introiaren ebaki eta lotura anizkoitzen bidez eratzen dira, ondorioz C mutur desberdin bat izaten dute. Aldiz, 4.introian ematen den barneko promotore baten erabileraren ondorioz, ∆133 eta ∆160 isoformak ekoizten dira. Azken hauek DTA domeinua eta DDL domeinuaren zati bat ez dute izango. Gainera, ∆40p53 eta ∆160p53 isoformak itzulpenean ematen den hasiera alternatiboaren ondorioz eratzen dira (40 edo 160. kodonean).
Funtzioak
[aldatu | aldatu iturburu kodea]DNA kalte eta konponketa
[aldatu | aldatu iturburu kodea]p53 proteinak ziklo zelularraren erregulazio zein jarraitzean, apoptosian eta egonkortasun genomikoan (mutazio maiztasun baxuak dituen genoma) hainbat mekanismo bidez parte hartzen du.
- DNA kaltetzen denean, hau konpon dezaketen proteinak aktibatu ditzake; garrantzitsua izan daitekeena zahartze prozesuan[29].
- Zelularen hazkunde prozesua eten dezake ziklo zelularra G1/S trantsizioan, DNAren akats ezagupenean. Denbora nahikoz mantentzen bada zelula kontrol-puntu honetan, DNA konpontze-proteinak kaltea erreparatu dezake eta ziklo zelularra jarraitu.
- DNA kaltea konponezina izatekotan, apoptosia (zelularen heriotza programatua) hasi dezake.
- Telomero motzen ondoriozko seneszentzia zelularrerako ezinbestekoa da.
WAF1/CIP1ak p21 eta beste hainbat ur-beheranzko geneak kodetzen ditu. p21 (WAF1) G1-S/CDK (CDK4/CDK6, CDK2 eta CDK1) konplexuetara lotu eta hauen aktibitatea inhibitzen duelarik.
p21-ak (WAF1) CDK2-rekin konplexua eratzen duenean, zelulak ezin du zatiketa zelularreko hurrengo fasera igaro. Baina p53 proteina mutatuak ezin badu DNArekin era eraginkorrean lotu, p21 proteinak ezingo du zatiketa prozesuaren geldiarazle bezala jokatu[30]. Gizakion ama-zelula enbrionarioetan (hESCs) egindako ikerketen arabera, G1/S kontrol-puntuko p53-p21 ardatz ez-funtzionalak zelulen bizi-zikloaren erregulazioan eta DNAren kalte erantzunean (DDR) garrantzi handia du; izan ere, p21 mRNA detektaezina den bitartean, DDR ostean hESCtan agertzen eta positiboki erregulatzen da. Bestalde, p53-ak zelula mota honetan aktibatzen dituen mikroRNA ezberdinek (miR-302a, miR-302b, miR-302c eta miR-302d) hESCtako p21-en adierazpena inhibitzen dute.
p21 proteina zuzenean lotzen da ziklo zelularrak aurrera egitea ahalbidetzen duten ziklina-CDK konplexuekin, hauen kinasa aktibitatea inhibituz eta ziklo zelularraren etenunea eratuz G1/S kontrol puntuan, konponketa ematea ahalbidetzeko. Horrez gain, p21ek desberdintzapenarekin erlazionaturiko hazkunde geldialdian bitartekaritzat jokatzen du, baita seneszentzia zelularrarekin erlazionaturiko hazkunde geldialdi iraunkorragoan. p21 geneak p53 genearen hainbat erantzun gune ditu, p53 proteinaren lotura zuzenetan eragiten dutenak, p21 proteina kodetzen duen genearen transkripzio-aktibazioa eraginez.
p53 eta erretinoblastoma proteinen (RB1) bidezidorrak, CDKN2A locusaren produktuaren irakurtze txandakatuaren markoaren (p14ARF) bidez erlazionatuta daude[31], bi bidezidorrek elkar erregulatzearen aukerak handiagotuz. p53 genearen adierazpena izpi ultramore (UV) bidez estimulatu daiteke, aldi berean DNAan kalteak eragiten dituena, beltzaranzteko gertaerak hasten dituelarik[32][33].
DNA kalte hauek proteina p53 estimulatzen dute DNA konponketarako entzimak aktibatzen dituztelako. p53R2 gene transkripzionalak adibidez, erribonukleotidoen erreduktasa bat kodetzen du, DNAren erreplikazioan eta konponketan garrantzitsua dena. Bestalde, AP endonukleasa eta konponketa DNA polimeasarekin ere interakzionatzen du. GADD45 bezala proteinak ere induzitzen ditu, baita ere konponketaz arduratzen direnak. Proteina eta entzima hauekin kaltea konpontzen badu, Mdm2 sintesia bultzatuko du eta proteinaren suntsiketa emango da, ziklo zelularra jarrai dezan, baina kaltea konponezina bada, p53-k zelula apoptosira bideratuko du.
Apoptosiaren sarerrari dagokionez, hau DNAren akatsa konponezina denean zelulak duen azken mekanismo babeslea da. p53-ak BAX eta PUMA gene aurre apoptotikoak aktibatzen ditu. Hala ere, aipatzekoa da proteina honek afinitate handiagoa duela konponketaz arduratzen diren promotoreei lotzeko apoptosiaz arduratzen direnekin konparatuta.
Ama-zelulak
[aldatu | aldatu iturburu kodea]p53 proteinaren mailak funtsezko lana betetzen du giza garapenaren zein giza bizitza osoan zeharreko ama-zelulen mantentzean.
Gizakion ama-zelula enbrionarioetan (hECSs), p53-a maila txikian mantentzen da, modu inaktiboan.[34] Hala izango ez balitz, p53-aren aktibazioak hESC-en desberdintzapen azkarra eragingo luke.[35] Knock out-organismoetan egindako ikerketen arabera, p53-aren faltak zelulen desberdintzapena atzeratzen du, p53-aren eranspen exogenoak berehalako desberdintzapen zelularra eraginez, p53-ak hESC-en desberdintzapenean zein ziklo zelularrean eraginez, desberdintzapen zelularraren erregulatzaile gisa, zeinetan funtsezko eginkizuna duen. hESC-etan p53 proteina aktibatzean, p21 proteinaren adierazpena emendatu egiten da, ziklo zelularreko G1-fasea luzatzen duena. Honek, orokorrean, S-faserako sarrera atzeratu egiten du, ziklo zelularra G1-fase horretan geldiaraziz eta, ondorioz, desberdintzapen zelularra bultzatuz. p53-ak, halaber, miR-34a eta miR-135 proteinak aktibatzen ditu ere, hESC-zelulen berezkoak diren pluripotentzia-faktoreak inhibituz, desberdintzapen zelularra are gehiago bultzatuz.[34]
Ama-zelula helduetan p53-aren erregulazioa oso garrantzitsua izango da, ama-zelulen poolak modu egokian mantentzeko, bereziki zelula-mota hauen pluripotentzialtasunari dagokionez. Seinale mekaniko jakinek, hipoxiaren kasu, p53-maila eraldatzen dute pool hauetan, hipoxiaren faktore induzigarriak diren HIF-1α and HIF-2α faktoreen bidez. Lehenengo faktoreak p53 proteina egonkortzen duen bitartean, bigarren faktorea proteinaren supresioarekin erlazionaturik dago.[36] p53-aren supresioak berebiziko eginkizuna du minbizidunak diren ama-zelulen fenotipoan, bai eta bestelako zelula pluripotenteen zein bestelako ama-zelulen etologian; esaterako, blastemen sorreran, urodeloen hanketan ematen den bezala.[37][38][39] p53 proteinaren maila baxuak agertzen dituzten zeluletan, halaber, berprogramazio-aukera handiago erakusten dute ere, ziklo zelularraren bahiketak berprogramatzeko aukera hau ematen duelako. Azkenik, aipagarria da ere p53 proteinaren erregulazioa oso garrantzitsua delarik ama-zelulen eta desberdintzaturiko zelulen arteko hesi modura, bai eta zelula osasuntsu eta minbizi-zelulen arteko hesi modura ere.[40]
Bestelako funtzioak
[aldatu | aldatu iturburu kodea]Aipaturiko eragin zelular zein molekularretatik at, p53 proteinak, angiogenesi-prozesuaren inhibitzaile den heinean ehun-mailako minbiziaren aurkako efektua izango du. Tumoreak handitu ahala, tumore-zelulek oxigenoz hornituko dituzten odol-baso berriak beharko dituzte. p53 proteinak angiogenesia prozesu hau inhibituko du, HIF1 eta HIF2 bezalako hipoxiaren faktore erregulatzaileekin elkarri eragiten, angiogenesiaren faktore bultzatzaileak inhibituz zein arresten proteina bezalako angiogenesiaren inhibitzaileen sintesia bultzatuz.[41][42]
p53 proteinak ere, Leuzemiaren Faktore Inhibitzailearen erregulazioaren bidez, obuluaren endometrioan txertatzea errazten du arratoietan, giza ugalketan ere parte hartu dezakeelarik.[43]
Erregulazioa
[aldatu | aldatu iturburu kodea]p53ren konzentrazio zelularra estuki erregukatuta egon behar da, izan ere, bere tumore supresore funtzioa alde batera utzita, proteina honen konzentrazioa altuak gehiegizko apoptosia eagin dezake zahartzaro prozesua azkartuz.
Ultramore, infragorri zein hidrogeno peroxidoa bezalako agente kimikoek eragindako DNA-kaltearen, estres oxidatibo[44] zein osmotikoaren, erribonukleotidoen faltaren zein onkogeneen adierazpen kontrolgabearen ondorioz, besteak beste, p53 proteina aktibatu egiten da. Estres anitzen aurreko espresio honen aktibazioan, halaber, bi dira funtsezko jazoera. Lehenik, p53 proteinaren erdi-bizitza modu gogorrean emendatuko da, estresa pairatzen duten zeluletan p53aren metatze azkar bat gertatuko delarik. Bigarrenik, konformazio-aldaketa batek, zelula hauetan p53a aktibatzera behartzen du, transkripzioaren erregulatzaile modura. p53an aktibazioan, halaber, N-domeinu terminalaren fosforilazioak funtsezko papera edukiko du. Fosforilazio hau burutzeko, proteinaren N-domeinu terminalak fosforilazio-gune anitz agertzen ditu, proteina kinasa askoren itu dena.
Aipaturiko proteina kinasa hauek, halaber, bi taldetan sailka daitezke. Lehenengo talde batean, MAPK familiako proteina kinasak ditugu (JNK1-3, ERK1-2 eta p38 MAPK), mintz-kaltearen, estres oxidatiboaren zein estres osmotiko eta bero-estresaren aurrean erantzuten duena, besteak beste. Bigarren taldean, ATR, ATM, CHK1 eta CHK2, DNA-PK, CAK eta TP53RK proteinak aurkituko ditugu, genomaren egokitasunaren kontrolean eta DNA-kaltearen aurreko erantzunean jarduten duena, bai eta genotoxinen aurreko erantzunean ere. Onkogeneek ere p53aren aktibazioa estimulatzen dute, p14ARF proteina kinasak mediaturiko prozesuaren bidez.

Estres gabeko zeluletan, p53aren maila maila baxu batean mantentzen da, p53aren degradazio konstantearen ondorioz. Mdm2 izeneko proteina, gizakiotan HDM2 modura ere ezaguna, p53ra lotu egiten da, p53aren eragina inhibituz eta proteina nukleotik zitosolera garraiatuz. Mdm2a ere ubikitina ligasa modura jarduten du, ubikitina molekula bat p53ra kobalenteki lotuz eta, ondorioz, proteolisirako markatuz, p53aren degradazioa proteasoma bidez emango delarik.[45] Halere, p53aren ubikitinazioa itzulgarria izan daiteke, adibidez MI63 proteina Mdm2ra lotzean.[46] Ubikitinarekiko espezifikoa den USP7 edo HAUSP proteasak, halaber, p53aren ubikitinazioa ezaba dezake, p53aren ubikitinazioa ekidinez. USP7 proteinaren funtzio antzekoa du, testuinguru honetan, USP42 proteasak ere, p53aren desubikitinazioan jardunez.[47]
USP10 estresik gabeko zelulen zitoplasman agertzen da eta zitoplasma-mailako p53a desubikitinatzen du, Mdm2ak eragindako ubikitinazioa bertan behera utziz. Kalte genetikoaren aurrean, USP10 nukleora garraiatua izango da eta p53aren estabilizazioan jardungo du. Aipagarria da, era berean, USP10ek ez duela Mdm2rekin elkarrekintzarik burutzen.[48]
Arestian aipaturiko N-terminalaren fosforilazioak Mdm2aren p53rako atxikipena inhibitzen du. Bestelako proteinek, Pin1-en kasu, Mdm2 proteinaren lotzea are gehiago zailagotzen dute, p53 proteinan konformazio-aldaketa bat eragitearen ondorioz. Sirt1 eta Sirt7 bezalako entzima deazetilasek, p53 desazetilatu dezakete, apoptosiaren inhibizioa eraginez.[49] Onkogene batzuk Mdm2 proteinaren aktibitatearen inhibizioa eragiten duten zenbait proteinen transkripzioa estimulatzen dute.
Gaixotasunen aurrean duen eginkizuna
[aldatu | aldatu iturburu kodea]
TP53 genea kaltetzeak tumore-supresore funtzioa arriskuan jartzen du. TP53 genearen kopia funtzional bakarra eskuratzen duten pertsonak sentikorragoak dira helduaro goiztiarrean tumoreak garatzeko, gaixotasun hau Li-Fraumeni sindromea bezala ezagutzen da.
TP53 genea mutagenoen (konposatu kimikoen, erradiazioen, edo birusen) bidez eraldatua izan daiteke, kontrolik gabeko zelulen gehiegizko proliferazio-probabilitatea emendatuz. Giza tumoreen %50ak baino gehiagok TP53 genearen mutazio edo delezio bat edukitzen du[50]. p53-ren galerak ezegonkortasun genomikoa sortzen du, gehienetan aneuploidia fenotipiko bat sortuz[51].

p53-ren kopuruaren emendio batek tumorearen aurrean tratamendu modura jokatu dezakeela edo tumorea zabaltzea ekiditeko balio duela pentsa dezakegu. Hori ordea, ez da tratamendu eraginkorra, zahartze goiztiar bat eragin dezakeelako[52]; p53-ren ohiko funtzio endogenoa berreskuratzeak ordea, lagundu lezake. Ikerketek erakutsi dute funtzioa berreskuratzeak minbizi zelula batzuen erregresioa eragiten duela, beste zelula batzuk bidean kaltetu gabe. Tumorearen erregresioa gertatzeko era tumore-motaren araberakoa da. Adibidez, linfometan p53 endogenoaren funtzioa berreskuratzeak apoptosia induzitu dezake, zelulen hazkundea maila normalera jaisten den bitartean. Hori dela eta, p53-ren berraktibazio farmakologikoa minbiziaren aurkako sendabide moduan erabil daiteke[53][54]. Txinan lehen terapia genetiko komertziala (Gendicine) 2003-an onartu zen, buru eta lepoko minbiziei aurre egiteko. Horretarako, diseinaturiko adenobirus batez baliatu ziren, p53 genearen kopia funtzional bat eratuz[55].
p53a ondorengo gaixotasunetan dago inplikatuta, besteak beste:
- Li-Fraumeno sindromea. Gaixotasun hau bereizgarria da sarkoma eta minbizi lehen graduak 45 urte baino beherakoetan ematen delako eta p53-ko 4-10 exoi bitarteetan ematen da gaixotasunaren eragile denmutazioa.
- Gaixotasun hematologikoa. CML, MDS, ANLL, LLA, LLC eta Hodgkin gaixotasunen eragileetako bat da besteak beste.
- Azaleko minbizia. TP53an mutazioak aurkitzen dira %40eko zelula basalen kartzinometan.
- Bular minbizia. Kasuen %25ak TP53an mutazioak erakusten dituzte.
- Buru eta lepo minbizia. Hauen kasuetako ehunekoa %40-60 inguru dabil
Patogeno batzuk, TP53 geneak adierazten duen p53 proteinan eragiten dute. Adibidez, giza papiloma birusak (GPB) E6 proteina kodetzen du eta proteina hau p53 proteinara atxikitzean, p53 inaktibaturik geldituko da. E6-aren mekanismoa sinergian GPB-aren E7 proteinak ziklo zelularreko pRb erregulatzailea inaktibatzearekin batera, fisiologikoki garatxo moduan agertuko den zelulen proliferazio ugaria ahalbidetzen du. Hainbat GPB motek, 16ak eta 18ak zehazki, garatxo onbera bat, gradu handiago edo txikiagoko displasia zerbikal (minbizi-aurreko lesio itzulkorra) bat bilakatzea eragin dezakete. Zerbixeko infekzio iraunkorrak aldaketa itzulezinak eman ditzake; in situ kartzinoma bat sor dezake, azkenean minbizi zerbikal inbasibo bat bilakatu daitekeelarik. Hau, E6 eta E7 proteinak kodetzen dituzten GPB geneen efektua da; DNA birala ostalariaren genoman txertatuz, adierazten dituzten onkoproteina biralak umetoki lepoaren minbizian mantentzea eta adieraztea lortzen dutelarik[56].
p53 proteina etengabe ekoizten eta degradatzen da pertsona osasuntsuen zeluletan, indargetze oszilatorio batean amaituz. p53 proteinaren degradazioa Mdm2aren lotzearekin erlazionatuta dago; atzera-elikatze (feedback loop) negatibo batean, p53 proteinak Mdm2 induzitzen duelarik. Aldiz, p53 proteina mutatuta dagoenean, ezin du Mdm2 induzitu eta p53 maila handietan metatzen da. Gainera, p53 mutanteak bere buruaren proteina-maila normala inhibitu dezake, kasu batzuetan ikusi da p53-ren ordezpen-mutazio (missense) bakarrak p53 proteinaren egonkortasuna eta funtzioa eteten dituela[57].
Giza bular-minbiziko zelulen p53-ren supresioak, CXCR5 kimiokina (kimiotaxia induzitzen duten zitokinak) hartzailearen gene adierazpena areagotzen du eta CXCL13 kimiokinari erantzuten dion zelula-migrazioa aktibatzen du[58].
Ikerketa batek erakutsi zuen p53 eta Myc proteinak funtsezkoak zirela Leuzemia mieloide kronikoko (CML) zelulen biziraupenerako. p53 eta Myc proteinak drogekin markatuz, emaitza positiboak lortu ziren CML zuten arratoietan[59][60].
p53ren mutazioak analisi esperimentaletan
[aldatu | aldatu iturburu kodea]p53 genearen mutazio gehienak DNA sekuentziazioarekin detektatzen dira. Hala ere, jakina da ordezpen-mutazio bakarrak eragin funtzional espektro handia eduki dezakeela, efektu arinetik larriraino[57].
TP53 genearen mutazioen ondorioz minbizi fenotipo desberdinak eratzearen ideia, p53 proteinaren isoforma ezberdinek minbiziaren aurkako mekanismo zelular desberdinak edukitzeak sostengatzen du. TP53-ko mutazioek isoforma desberdinen agerpenean lagundu dezakete funtzio orokorra eragotziz mekanismo zelular desberdinetan, eta honela, minbiziaren fenotipoa arina izatetik fenotipo larrira zabaltzea galaraziz. Azterketa berriek erakutsi dute p53 isoformek adierazpen ezberdina dutela giza-ehun desberdinetan. Gainera, isoformetako funtzio baten galerak edo lorpenak, ehun batekiko espezifikoa den minbizia eratu dezakete edo ehun desberdinei minbizi ama-zelula bilakatzeko potentzialtasuna eman[11][61][62][63]. TP53 mutazioak metabolismo energetikoa eta glikolisia emendatzen du bular-minbiziko zeluletan[64].
p53-ak duen dinamikak bere Mdm2 antagonistaren aurrean, erakusten du p53-ren kontzentrazio maila denborarekiko aldatzen dela. Aldaketa hau[65] klinikoki eta modelo matematikoak erabiliz adieraz daiteke[66][67]. Modelo matematikoek adierazten dute p53 kontzentrazioa azkarrago aldatzen dela konposatu teratogenikoen, harizpi bikoitzaren apurketa edo izpi ultramoreen (UV), presentzian; DNAaren kalteak p53-ren aktibazioa induzitzen duela sostengatuz. Modelo hauek ere lagungarriak izan daitezke p53-ren isomorfoen mutazioen modeloa eta p53-ren aurrean hauek duten efektuak ateratzeko orduan, horrela, de novo sortuko den ehun-espezifikoa sustatuko duen droga farmazeutiko berri baten aurkikuntzan ere lagun dezake.
Aurkikuntza
[aldatu | aldatu iturburu kodea]p53 1979-an aurkitu zen Lionel Crawford, David P. Lane, Arnold Levine, eta Lloyd Old-en eskutik Imperial Cancer Research Fund (UK) Princeton University/UMDNJ (Cancer Institute of New Jersey), eta Memorial Sloan-Kettering Cancer Center-en aldi berean, bertan lanean ari zirenean.
Datu interesgarriak
[aldatu | aldatu iturburu kodea]Argi dago p53 proteinak tumoreetan eragin handia duela, baina azken aurkikuntza batzuek, honen garrantzia azpimarratu du. Elefanteek tumore kopuru baxua dutela behatu da eta hau animali hauek ekoizten duten p53 proteina kantitate handiengatik izan daiteke. Ondorioz, hipotesi berri bat planteatu da non proteina honen kontzentrazio altuak, minbizitik babestu gaitzakela esaten den. Hipotesi hau frogatzeko, Ikerketa Onkologikoen Zentro Nazionaleko Manuel Serrano zientzialariak, arratoietan frogatu zuen, proteina honen genearen kopia ugari izatea eraginez eta arratoi super p53-ak lortzeko. Nahiz eta ikerketak emaitza positiboak izan zituen, hau terapia modura erabili ahal izateko ezinbestekoa da metodo bat garatzea proteinaren kantitatearen handipena kalterik gabe ahalbidetuko duena. Hau lortzeko hainbat metodo ikertzen ari dira, haien artean adenobirus modifikatuekin genearen expresioa handitzen saiatzea edo CRISPR teknikarekin edizio genetikoa burutzea. Hala ere bi teknikak ez dira guztiz bideragarriak oraindik. [68]
Erreferentziak
[aldatu | aldatu iturburu kodea]- ↑ Genetikoki lotutako gaixotasunak TP53ikusi/editatu erreferentziak Wikidatan. .
- ↑ a b c GRCh38: Ensembl release 89: ENSG00000141510 - Ensembl, May 2017
- ↑ a b c GRCm38: Ensembl release 89: ENSMUSG00000059552 – Ensembl, May 2017
- ↑ Human PubMed Reference:. National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ Mouse PubMed Reference:. National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ a b c (Ingelesez) «Uncovering the role of p53 splice variants in human malignancy: a clinical perspective.» OncoTargets and Therapy: 57–68. doi:. PMID 24379683..
- ↑ (Ingelesez) Read, A. P. eta Strachan, T.. (1999). Human molecular genetics 2.. New York: Wiley ISBN 978-0-471-33061-5..
- ↑ a b (Ingelesez) «Isolation and characterization of a human p53 cDNA clone: expression of the human p53 gene.» The EMBO Journal: 3257–62. doi:. PMID 6396087..
- ↑ a b (Ingelesez) «Localization of gene for human p53 tumour antigen to band 17p13.» Nature: 84–5. doi:. PMID 3456488. Bibcode: 1986Natur.320...84I..
- ↑ a b (Ingelesez) «The gene for human p53 cellular tumor antigen is located on chromosome 17 short arm (17p13).» Proceedings of the National Academy of Sciences of the United States of America: 130–4. doi:. PMID 3001719. Bibcode: 1986PNAS...83..130M..
- ↑ a b c (Ingelesez) «p53 isoforms can regulate p53 transcriptional activity.» Genes & Development: 2122–37. doi:. PMID 16131611..
- ↑ a b (Ingelesez) «Identification of p53 as a sequence-specific DNA-binding protein.» Science: 1708–11. doi:. PMID 2047879. Bibcode: 1991Sci...252.1708K..
- ↑ (Ingelesez) Ziemer, M. A., Mason, A. eta Carlson, D. M.. (1982). «Cell-free translations of proline-rich protein mRNAs.» The Journal of Biological Chemistry: 11176–80. PMID 7107651..
- ↑ (Ingelesez) Levine, A. J. eta Lane, D. P.. (2010). The p53 family. Cold Spring Harbor Perspectives in Biology.. Cold Spring Harbor, N.Y.: Cold Spring Harbor Laboratory Press ISBN 978-0-87969-830-0..
- ↑ (Ingelesez) May, Pierre; May, Evelyne. (1999-12). «Twenty years of p53 research: structural and functional aspects of the p53 protein» Oncogene 18 (53): 7621–7636. doi:. ISSN 0950-9232. (Noiz kontsultatua: 2019-11-28).
- ↑ (Ingelesez) Klug, Stefanie J; Ressing, Meike; Koenig, Jochem; Abba, Martin C; Agorastos, Theodoros; Brenna, Sylvia MF; Ciotti, Marco; Das, Br et al.. (2009-08). «TP53 codon 72 polymorphism and cervical cancer: a pooled analysis of individual data from 49 studies» The Lancet Oncology 10 (8): 772–784. doi:. (Noiz kontsultatua: 2019-11-28).
- ↑ Sonoyama, Takayuki. (2011-03-08). «TP53 codon 72 polymorphism is associated with pancreatic cancer risk in males, smokers and drinkers» Molecular Medicine Reports doi:. ISSN 1791-2997. (Noiz kontsultatua: 2019-11-28).
- ↑ (Ingelesez) Alawadi, Shafika; Ghabreau, Lina; Alsaleh, Mervat; Abdulaziz, Zainab; Rafeek, Mohamed; Akil, Nizar; Alkhalaf, Moussa. (2011-09). «P53 gene polymorphisms and breast cancer risk in Arab women» Medical Oncology 28 (3): 709–715. doi:. ISSN 1357-0560. (Noiz kontsultatua: 2019-11-28).
- ↑ (Ingelesez) Yu, Hongping; Huang, Yu-jing; Liu, Zhensheng; Wang, Li-E; Li, Guojun; Sturgis, Erich M.; Johnson, David G.; Wei, Qingyi. (2011-09). «Effects of MDM2 promoter polymorphisms and p53 codon 72 polymorphism on risk and age at onset of squamous cell carcinoma of the head and neck» Molecular Carcinogenesis 50 (9): 697–706. doi:. PMID 21656578. PMC PMC3142329. (Noiz kontsultatua: 2019-11-28).
- ↑ (Ingelesez) Piao, Jin-Mei; Kim, Hee Nam; Song, Hye-Rim; Kweon, Sun-Seog; Choi, Jin-Su; Yun, Woo-Jun; Kim, Young-Chul; Oh, In-Jae et al.. (2011-09). «p53 codon 72 polymorphism and the risk of lung cancer in a Korean population» Lung Cancer 73 (3): 264–267. doi:. (Noiz kontsultatua: 2019-11-28).
- ↑ (Ingelesez) Wang, Jing-Jun; Zheng, Yuan; Sun, Liang; Wang, Li; Yu, Peng-Bo; Dong, Jian-Hua; Zhang, Lei; Xu, Jing et al.. (2011-11). «TP53 codon 72 polymorphism and colorectal cancer susceptibility: a meta-analysis» Molecular Biology Reports 38 (8): 4847–4853. doi:. ISSN 0301-4851. (Noiz kontsultatua: 2019-11-28).
- ↑ (Ingelesez) Jiang, De-Ke; Yao, Lei; Ren, Wei-Hua; Wang, Wen-Zhang; Peng, Bo; Yu, Long. (2011-12). «TP53 Arg72Pro polymorphism and endometrial cancer risk: a meta-analysis» Medical Oncology 28 (4): 1129–1135. doi:. ISSN 1357-0560. (Noiz kontsultatua: 2019-11-28).
- ↑ (Ingelesez) Thurow, Helena S; Haack, Ricardo; Hartwig, Fernando P; de Oliveira, Isabel O; Dellagostin, Odir A; Gigante, Denise P; Horta, Bernardo L; Collares, Tiago et al.. (2011-12). «TP53 gene polymorphism: Importance to cancer, ethnicity and birth weight in a Brazilian cohort» Journal of Biosciences 36 (5): 823–831. doi:. ISSN 0250-5991. (Noiz kontsultatua: 2019-11-28).
- ↑ (Ingelesez) Huang, Chao-Yuan; Su, Chien-Tien; Chu, Jan-Show; Huang, Shu-Pin; Pu, Yeong-Shiau; Yang, Hsiu-Yuan; Chung, Chi-Jung; Wu, Chia-Chang et al.. (2011-12). «The polymorphisms of P53 codon 72 and MDM2 SNP309 and renal cell carcinoma risk in a low arsenic exposure area» Toxicology and Applied Pharmacology 257 (3): 349–355. doi:. (Noiz kontsultatua: 2019-11-28).
- ↑ Venot, C.. (1998-08-17). «The requirement for the p53 proline-rich functional domain for mediation of apoptosis is correlated with specific PIG3 gene transactivation and with transcriptional repression» The EMBO Journal 17 (16): 4668–4679. doi:. PMID 9707426. PMC PMC1170796. (Noiz kontsultatua: 2019-11-28).
- ↑ (Ingelesez) Larsen, Steven; Yokochi, Tomoki; Isogai, Eriko; Nakamura, Yohko; Ozaki, Toshinori; Nakagawara, Akira. (2010-02). «LMO3 interacts with p53 and inhibits its transcriptional activity» Biochemical and Biophysical Research Communications 392 (3): 252–257. doi:. (Noiz kontsultatua: 2019-11-28).
- ↑ (Ingelesez) Harms, K. L.; Chen, X.. (2005-03-01). «The C Terminus of p53 Family Proteins Is a Cell Fate Determinant» Molecular and Cellular Biology 25 (5): 2014–2030. doi:. ISSN 0270-7306. PMID 15713654. PMC PMC549381. (Noiz kontsultatua: 2019-11-28).
- ↑ (Ingelesez) Bell, Stefan; Klein, Christian; Müller, Lin; Hansen, Silke; Buchner, Johannes. (2002-10). «p53 Contains Large Unstructured Regions in its Native State» Journal of Molecular Biology 322 (5): 917–927. doi:. (Noiz kontsultatua: 2019-11-28).
- ↑ (Ingelesez) Gilbert,, S. F.. (2013). Developmental Biology. (10. argitaraldia) Sunderland, MA USA: Sinauer Associates, Inc. Publishers., 588 or. ISBN 13: 978-0878939787..
- ↑ (Ingelesez) National Center for Biotechnology Information.. (1998). The p53 tumor suppressor protein. Genes and Disease.. United States National Institutes of Health.
- ↑ (Ingelesez) Bates, Stewart; Phillips, Andrew C.; Clark, Paula A.; Stott, Francesca; Peters, Gordon; Ludwig, Robert L.; Vousden, Karen H.. (1998-09). «p14ARF links the tumour suppressors RB and p53» Nature 395 (6698): 124–125. doi:. ISSN 0028-0836. (Noiz kontsultatua: 2019-11-28).
- ↑ (Ingelesez) Cui, Rutao; Widlund, Hans R.; Feige, Erez; Lin, Jennifer Y.; Wilensky, Dara L.; Igras, Viven E.; D'Orazio, John; Fung, Claire Y. et al.. (2007-03). «Central Role of p53 in the Suntan Response and Pathologic Hyperpigmentation» Cell 128 (5): 853–864. doi:. (Noiz kontsultatua: 2019-11-28).
- ↑ (Ingelesez) «Genome's guardian gets a tan started» New Scientist (Noiz kontsultatua: 2019-11-28).
- ↑ a b (Ingelesez) Jain, Abhinav K.; Allton, Kendra; Iacovino, Michelina; Mahen, Elisabeth; Milczarek, Robert J.; Zwaka, Thomas P.; Kyba, Michael; Barton, Michelle Craig. (2012-02-28). Eaves, Connie J. ed. «p53 Regulates Cell Cycle and MicroRNAs to Promote Differentiation of Human Embryonic Stem Cells» PLoS Biology 10 (2): e1001268. doi:. ISSN 1545-7885. PMID 22389628. PMC PMC3289600. (Noiz kontsultatua: 2019-11-21).
- ↑ (Ingelesez) Maimets, T; Neganova, I; Armstrong, L; Lako, M. (2008-09). «Activation of p53 by nutlin leads to rapid differentiation of human embryonic stem cells» Oncogene 27 (40): 5277–5287. doi:. ISSN 0950-9232. (Noiz kontsultatua: 2019-11-21).
- ↑ (Ingelesez) Das, Bikul; Bayat-Mokhtari, Reza; Tsui, Micky; Lotfi, Shamim; Tsuchida, Rika; Felsher, Dean W.; Yeger, Herman. (2012-08). «HIF-2α Suppresses p53 to Enhance the Stemness and Regenerative Potential of Human Embryonic Stem Cells» STEM CELLS 30 (8): 1685–1695. doi:. (Noiz kontsultatua: 2019-11-21).
- ↑ (Ingelesez) Lake, Blue B.; Fink, Jürgen; Klemetsaune, Liv; Fu, Xuemei; Jeffers, John R.; Zambetti, Gerard P.; Xu, Yang. (2012-05). «Context-Dependent Enhancement of Induced Pluripotent Stem Cell Reprogramming by Silencing Puma: Puma Suppresses Induced Pluripotency» STEM CELLS 30 (5): 888–897. doi:. PMID 22311782. PMC PMC3531606. (Noiz kontsultatua: 2019-11-21).
- ↑ (Ingelesez) Marión, Rosa M.; Strati, Katerina; Li, Han; Murga, Matilde; Blanco, Raquel; Ortega, Sagrario; Fernandez-Capetillo, Oscar; Serrano, Manuel et al.. (2009-08). «A p53-mediated DNA damage response limits reprogramming to ensure iPS cell genomic integrity» Nature 460 (7259): 1149–1153. doi:. ISSN 0028-0836. PMID 19668189. PMC PMC3624089. (Noiz kontsultatua: 2019-11-21).
- ↑ (Ingelesez) Yun, M. H.; Gates, P. B.; Brockes, J. P.. (2013-10-22). «Regulation of p53 is critical for vertebrate limb regeneration» Proceedings of the National Academy of Sciences 110 (43): 17392–17397. doi:. ISSN 0027-8424. PMID 24101460. PMC PMC3808590. (Noiz kontsultatua: 2019-11-21).
- ↑ (Ingelesez) Aloni-Grinstein, Ronit; Shetzer, Yoav; Kaufman, Tom; Rotter, Varda. (2014-08-19). «p53: The barrier to cancer stem cell formation» FEBS Letters 588 (16): 2580–2589. doi:. (Noiz kontsultatua: 2019-11-21).
- ↑ (Ingelesez) Teodoro, Jose G.; Evans, Sara K.; Green, Michael R.. (2007-10-18). «Inhibition of tumor angiogenesis by p53: a new role for the guardian of the genome» Journal of Molecular Medicine 85 (11): 1175–1186. doi:. ISSN 0946-2716. (Noiz kontsultatua: 2019-11-21).
- ↑ (Ingelesez) Assadian, S.; El-Assaad, W.; Wang, X. Q. D.; Gannon, P. O.; Barres, V.; Latour, M.; Mes-Masson, A.-M.; Saad, F. et al.. (2012-03-01). «p53 Inhibits Angiogenesis by Inducing the Production of Arresten» Cancer Research 72 (5): 1270–1279. doi:. ISSN 0008-5472. (Noiz kontsultatua: 2019-11-21).
- ↑ (Ingelesez) Hu, Wenwei; Feng, Zhaohui; Teresky, Angelika K.; Levine, Arnold J.. (2007-11). «p53 regulates maternal reproduction through LIF» Nature 450 (7170): 721–724. doi:. ISSN 0028-0836. (Noiz kontsultatua: 2019-11-21).
- ↑ (Ingelesez) Han, Eun-Soo; Muller, Florian L.; Pérez, Viviana I.; Qi, Wenbo; Liang, Huiyun; Xi, Liang; Fu, Chunxiao; Doyle, Erin et al.. (2008-06). «The in vivo gene expression signature of oxidative stress» Physiological Genomics 34 (1): 112–126. doi:. ISSN 1094-8341. PMID 18445702. PMC PMC2532791. (Noiz kontsultatua: 2019-12-12).
- ↑ (Ingelesez) Purvis, J. E.; Karhohs, K. W.; Mock, C.; Batchelor, E.; Loewer, A.; Lahav, G.. (2012-06-15). «p53 Dynamics Control Cell Fate» Science 336 (6087): 1440–1444. doi:. ISSN 0036-8075. PMID 22700930. PMC PMC4162876. (Noiz kontsultatua: 2019-12-12).
- ↑ (Ingelesez) Canner, J A; Sobo, M; Ball, S; Hutzen, B; DeAngelis, S; Willis, W; Studebaker, A W; Ding, K et al.. (2009-09). «MI-63: A novel small-molecule inhibitor targets MDM2 and induces apoptosis in embryonal and alveolar rhabdomyosarcoma cells with wild-type p53» British Journal of Cancer 101 (5): 774–781. doi:. ISSN 0007-0920. PMID 19707204. PMC PMC2736841. (Noiz kontsultatua: 2019-12-12).
- ↑ (Ingelesez) Hock, Andreas K; Vigneron, Arnaud M; Carter, Stephanie; Ludwig, Robert L; Vousden, Karen H. (2011-12-14). «Regulation of p53 stability and function by the deubiquitinating enzyme USP42: USP42 targets p53» The EMBO Journal 30 (24): 4921–4930. doi:. PMID 22085928. PMC PMC3243628. (Noiz kontsultatua: 2019-12-12).
- ↑ (Ingelesez) Yuan, Jian; Luo, Kuntian; Zhang, Lizhi; Cheville, John C.; Lou, Zhenkun. (2010-02). «USP10 Regulates p53 Localization and Stability by Deubiquitinating p53» Cell 140 (3): 384–396. doi:. PMID 20096447. PMC PMC2820153. (Noiz kontsultatua: 2019-12-12).
- ↑ (Ingelesez) Vakhrusheva, Olesya; Smolka, Christian; Gajawada, Praveen; Kostin, Sawa; Boettger, Thomas; Kubin, Thomas; Braun, Thomas; Bober, Eva. (2008-03-28). «Sirt7 Increases Stress Resistance of Cardiomyocytes and Prevents Apoptosis and Inflammatory Cardiomyopathy in Mice» Circulation Research 102 (6): 703–710. doi:. ISSN 0009-7330. (Noiz kontsultatua: 2019-12-12).
- ↑ (Ingelesez) Hollstein, M; Sidransky, D; Vogelstein, B; Harris, C.. (1991-07-05). «p53 mutations in human cancers» Science 253 (5015): 49–53. doi:. ISSN 0036-8075. (Noiz kontsultatua: 2019-11-29).
- ↑ (Ingelesez) Schmitt, Clemens A; Fridman, Jordan S; Yang, Meng; Baranov, Eugene; Hoffman, Robert M; Lowe, Scott W. (2002-04). «Dissecting p53 tumor suppressor functions in vivo» Cancer Cell 1 (3): 289–298. doi:. (Noiz kontsultatua: 2019-11-29).
- ↑ (Ingelesez) Tyner, Stuart D.; Venkatachalam, Sundaresan; Choi, Jene; Jones, Stephen; Ghebranious, Nader; Igelmann, Herbert; Lu, Xiongbin; Soron, Gabrielle et al.. (2002-01). «p53 mutant mice that display early ageing-associated phenotypes» Nature 415 (6867): 45–53. doi:. ISSN 0028-0836. (Noiz kontsultatua: 2019-11-29).
- ↑ (Ingelesez) Ventura, Andrea; Kirsch, David G.; McLaughlin, Margaret E.; Tuveson, David A.; Grimm, Jan; Lintault, Laura; Newman, Jamie; Reczek, Elizabeth E. et al.. (2007-02). «Restoration of p53 function leads to tumour regression in vivo» Nature 445 (7128): 661–665. doi:. ISSN 0028-0836. (Noiz kontsultatua: 2019-11-29).
- ↑ (Ingelesez) Herce, Henry D.; Deng, Wen; Helma, Jonas; Leonhardt, Heinrich; Cardoso, M. Cristina. (2013-12). «Visualization and targeted disruption of protein interactions in living cells» Nature Communications 4 (1): 2660. doi:. ISSN 2041-1723. PMID 24154492. PMC PMC3826628. (Noiz kontsultatua: 2019-11-29).
- ↑ (Ingelesez) Pearson, Sue; Jia, Hepeng; Kandachi, Keiko. (2004-01). «China approves first gene therapy» Nature Biotechnology 22 (1): 3–4. doi:. ISSN 1087-0156. (Noiz kontsultatua: 2019-11-29).
- ↑ (Ingelesez) Angeletti, Peter C.; Zhang, Luwen; Wood, Charles. (2008). «The Viral Etiology of AIDS‐Associated Malignancies» Advances in Pharmacology (Elsevier) 56: 509–557. doi:. ISBN 978-0-12-373601-7. PMID 18086422. PMC PMC2149907. (Noiz kontsultatua: 2019-11-29).
- ↑ a b (Ingelesez) Bullock, A. N.; Henckel, J.; DeDecker, B. S.; Johnson, C. M.; Nikolova, P. V.; Proctor, M. R.; Lane, D. P.; Fersht, A. R.. (1997-12-23). «Thermodynamic stability of wild-type and mutant p53 core domain» Proceedings of the National Academy of Sciences 94 (26): 14338–14342. doi:. ISSN 0027-8424. PMID 9405613. PMC PMC24967. (Noiz kontsultatua: 2019-11-29).
- ↑ (Ingelesez) Mitkin, Nikita A.; Hook, Christina D.; Schwartz, Anton M.; Biswas, Subir; Kochetkov, Dmitry V.; Muratova, Alisa M.; Afanasyeva, Marina A.; Kravchenko, Julia E. et al.. (2015-08). «p53-dependent expression of CXCR5 chemokine receptor in MCF-7 breast cancer cells» Scientific Reports 5 (1): 9330. doi:. ISSN 2045-2322. PMID 25786345. PMC PMC4365401. (Noiz kontsultatua: 2019-11-29).
- ↑ (Ingelesez) Abraham, Sheela A.; Hopcroft, Lisa E. M.; Carrick, Emma; Drotar, Mark E.; Dunn, Karen; Williamson, Andrew J. K.; Korfi, Koorosh; Baquero, Pablo et al.. (2016-06). «Dual targeting of p53 and c-MYC selectively eliminates leukaemic stem cells» Nature 534 (7607): 341–346. doi:. ISSN 0028-0836. PMID 27281222. PMC PMC4913876. (Noiz kontsultatua: 2019-11-29).
- ↑ (Ingelesez) «Cientists identify drugs to target ’Achilles heel’ of Chronic Myeloid Leukaemia cells» www.myscience.uk (Noiz kontsultatua: 2019-11-29).
- ↑ (Ingelesez) Khoury, M. P.; Bourdon, J.-C.. (2011-04-01). «p53 Isoforms: An Intracellular Microprocessor?» Genes & Cancer 2 (4): 453–465. doi:. ISSN 1947-6019. PMID 21779513. PMC PMC3135639. (Noiz kontsultatua: 2019-11-29).
- ↑ (Ingelesez) Avery-Kiejda, Kelly A.; Morten, Brianna; Wong-Brown, Michelle W.; Mathe, Andrea; Scott, Rodney J.. (2014-03). «The relative mRNA expression of p53 isoforms in breast cancer is associated with clinical features and outcome» Carcinogenesis 35 (3): 586–596. doi:. ISSN 1460-2180. (Noiz kontsultatua: 2019-11-29).
- ↑ (Ingelesez) Arsic, Nikola; Gadea, Gilles; Lagerqvist, E. Louise; Busson, Muriel; Cahuzac, Nathalie; Brock, Carsten; Hollande, Frederic; Gire, Veronique et al.. (2015-04). «The p53 Isoform Δ133p53β Promotes Cancer Stem Cell Potential» Stem Cell Reports 4 (4): 531–540. doi:. (Noiz kontsultatua: 2019-11-29).
- ↑ (Ingelesez) Harami-Papp, Hajnalka; Pongor, Lőrinc S.; Munkácsy, Gyöngyi; Horváth, Gergő; Nagy, Ádám M.; Ambrus, Attila; Hauser, Péter; Szabó, András et al.. (2016-10-11). «TP53 mutation hits energy metabolism and increases glycolysis in breast cancer» Oncotarget 7 (41) doi:. ISSN 1949-2553. PMID 27582538. PMC PMC5341867. (Noiz kontsultatua: 2019-11-29).
- ↑ (Ingelesez) Geva‐Zatorsky, Naama; Rosenfeld, Nitzan; Itzkovitz, Shalev; Milo, Ron; Sigal, Alex; Dekel, Erez; Yarnitzky, Talia; Liron, Yuvalal et al.. (2006-01). «Oscillations and variability in the p53 system» Molecular Systems Biology 2 (1) doi:. ISSN 1744-4292. PMID 16773083. PMC PMC1681500. (Noiz kontsultatua: 2019-11-29).
- ↑ (Ingelesez) Proctor, Carole J; Gray, Douglas A. (2008-12). «Explaining oscillations and variability in the p53-Mdm2 system» BMC Systems Biology 2 (1): 75. doi:. ISSN 1752-0509. PMID 18706112. PMC PMC2553322. (Noiz kontsultatua: 2019-11-29).
- ↑ (Ingelesez) Chong, Ket Hing; Samarasinghe, Sandhya; Kulasiri, Don. (2015-01). «Mathematical modelling of p53 basal dynamics and DNA damage response» Mathematical Biosciences 259: 27–42. doi:. (Noiz kontsultatua: 2019-11-29).
- ↑ Cano, Amparo. (2019). «¿Podría implantarse en humanos la proteína p53 que protege a los elefantes del cáncer?» El País.