Cloruro de níquel(II)
| Cloruro de níquel(II) | ||
|---|---|---|
 Hexahidrato de cloruro de níquel(II) | ||
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 7718-54-9[1] | |
| Número RTECS | QR6480000 | |
| ChEBI | 34887 | |
| ChemSpider | 22796 | |
| PubChem | 24385 | |
| UNII | 696BNE976J | |
| KEGG | C14711 | |
|
Cl[Ni]Cl
| ||
| Propiedades físicas | ||
| Densidad |
3.55 g/cm³ (anhidro) 1.92 g/cm³ (hexahidrato) kg/m³; Expresión errónea: palabra «g» desconocida g/cm³ | |
| Masa molar |
129.5994 (anhidro) 237.69 (hexahidrato) g/mol | |
| Propiedades químicas | ||
| Acidez | 4 (hexahydrate) pKa | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El cloruro de níquel(II) (o simplemente cloruro de níquel), es el compuesto químico NiCl2 . La sal anhidra es amarilla, pero el hidrato más conocido, NiCl2 · 6H2O, es verde. Muy raras veces se lo encuentra en la naturaleza como mineral niquelbischofita. Existe también un dihidrato. En general, el cloruro de níquel(II) es la fuente más importante de níquel para la síntesis química. Las sales de níquel son carcinógenicas. Las sales también son delicuescentes, en cuanto a que absorben humedad del aire para formar una solución.
Producción y síntesis
[editar]La producción a gran escala de cloruro de níquel implica la extracción con ácido clorhídrico de matte de níquel y los residuos obtenidos de tostación de mineral de refinación de níquel.
Rara vez se prepara NiCl2 · 6H2O en el laboratorio porque es barato y tiene una larga vida útil. El hidrato se puede convertir a la forma anhidra mediante calentamiento en cloruro de tionilo o por calentamiento en una corriente de HCl gaseoso. El calentamiento simple de los hidratos no produce el dicloruro anhidro.
- NiCl2 · 6H2 O + 6 SOCl2 → NiCl2 + 6 SO 2 + 12 HCl
La deshidratación es acompañada por un cambio de color del verde al amarillo.[2]
Estructura y propiedades
[editar]El NiCl2 adopta la estructura CdCl2.[3] En este arreglo, cada centro Ni2+ se encuentra coordinado con seis centros Cl– y cada cloro se encuentra conectado con tres centros Ni(II). En el NiCl2 las uniones Ni-Cl son de "caracter iónicas". El NiBr2 amarillo y el NiI2 negro adoptan estructuras similares, pero con un diferente empaquetamiento de los haluros, adoptando el esquema CdI2.
Por el contrario el NiCl2 · 6H2O se compone de moléculas trans separadas - [NiCl2(H2O)4] ligadas más débilmente a las moléculas de agua adyacentes. Es de notar que solo cuatro de las seis moléculas de agua en la fórmula están unidas al níquel, y los dos restantes son agua de cristalización.[3] El hexahidrato de cloruro de Cobalto(II) tiene una estructura similar.
Muchos compuestos de níquel(II) son paramagnéticos, debido a la presencia de dos electrones no apareados en cada centro metálico. Sin embargo, los complejos de níquel cuadrados planos son diamagnéticos.
Las soluciones de cloruro de níquel(II) son ácidas, con un pH cercano a 4 debido a la hidrólisis del ion del Ni+2.
Coordinación química
[editar]
La mayoría de las reacciones atribuidas al "cloruro de níquel" implican el hexahidrato, aunque las reacciones especializados requieren la forma anhidra.
Se pueden utilizar reacciones a partir de NiCl2 · 6H2O para formar una variedad de complejos de coordinación de níquel porque los ligandos de H2O son rápidamente desplazadas por amoníaco, aminas, tioéteres, tiolatos, y órgano fosfinas. En algunos derivados, el cloruro se mantiene dentro de la esfera de coordinación, mientras que el cloruro es desplazado por ligandos altamente básicos. Algunos ejemplos de complejos son:
| Complejo | Color | Magnetismo | Geometría |
|---|---|---|---|
| [Ni(NH3)6]Cl2 | Azul / violeta | Paramagnético | Octaédrico |
| [Ni(es)3]2+ | Violeta | Paramagnético | Octaédrico |
| NiCl2(dppe) | Naranja | Diamagnético | Plana cuadrada |
| [Ni(CN)4]2– | Incoloro | Diamagnético | Plana cuadrada |
| [NiCl4]2–[4][5] | Amarillento-verde | Paramagnética | Tetraédrica |
Algunos complejos de cloruro de níquel existen como una mezcla en equilibrio de dos geometrías; estos ejemplos son algunos de los ejemplos más dramáticos de isomería estructural para un determinado número de coordinación. Por ejemplo, el NiCl2(PPh3)2, que contiene cuatro coordenadas de Ni(II), existe en solución como una mezcla de los isómeros diamagnético cuadrado plano y paramagnéticos tetraédricos. Los complejos cuadrados planos de níquel a menudo pueden formar aductos de cinco coordenadas.
El NiCl2 es el precursor de los complejos acetilacetonato de Ni(acac)2(H2O)2 y el (Ni(acac)2)3 soluble en benceno, que es un precursor del Ni (1,5-ciclooctadieno)2, un reactivo importante en química orgánica del níquel.
En presencia de captadores de agua, el cloruro de níquel(II) hidratado reacciona con el dimetoxietano (DME) para formar el complejo molecular NiCl2 (DME)2. Los ligandos de DME en este complejo son lábiles. Por ejemplo, este complejo reacciona con el complejo ciclopentadienuro sódico para dar el compuesto sándwich niqueloceno.
Las aplicaciones en síntesis orgánica
[editar]El NiCl2 y su hidrato son en ocasiones útiles en síntesis orgánica.[6]
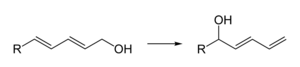
- Como un ácido de Lewis leve, por ejemplo, para la isomerización regioselectiva de dienoles:
- En combinación con CrCl2 para el acoplamiento de un aldehído y un yoduro vinílico para dar alcoholes alílicos.
- Para las reducciones selectivas en presencia de LiAlH4, por ejemplo, para la conversión de alquenos a alcanos.
- Como un precursor del boruro de níquel, preparado in situ a partir NiCl2 y NaBH4. Este reactivo se comporta como níquel Raney, que comprende un sistema eficiente para la hidrogenación de compuestos de carbonilo no saturados.
- Como precursor de Ni finamente dividido por reducción con Zn, para la reducción de aldehídos, alquenos y compuestos nitro aromáticos. Este reactivo también promueve reacciones de homo-acoplamiento, es decir, 2RX → R–R donde R = vinilo, arilo.
- Como un catalizador para hacer afosfonatos dialquilo de fosfitos y yoduros de arilo, ArI:
- ArI + P(OEt)3 → ARP(O)(OEt)2 + EtI
Otros usos
[editar]Las soluciones de cloruro de níquel se utilizan para galvanoplastia de níquel en productos metálicos.
Seguridad
[editar]El cloruro de níquel(II) es irritante tras la ingestión, inhalación, contacto con la piel y los ojos. Se ha demostrado que la exposición prolongada al níquel y sus derivados produce cáncer.
Referencias
[editar]- ↑ Número CAS
- ↑ Pray, A. P.; Tyree, S. Y.; Martin, Dean F.; Cook, James R. (1990). «Anhydrous Metal Chlorides». Inorganic Syntheses 28: 321-2. doi:10.1002/9780470132593.ch80.
- ↑ a b Wells, A. F. Structural Inorganic Chemistry, Oxford Press, Oxford, United Kingdom, 1984.
- ↑ Gill, N. S. y Taylor, F. B. (1967). «Tetrahalo Complexes of Dipositive Metals in the First Transition Series». Inorganic Syntheses 9: 136-142. doi:10.1002/9780470132401.ch37.
- ↑ G. D. Stucky, J. B.; Folkers; T. J. Kistenmacher (1967). «The Crystal and Molecular Structure of Tetraethylammonium Tetrachloronickelate(II)». Acta Crystallographica 23 (6): 1064-1070. doi:10.1107/S0365110X67004268.
- ↑ Tien-Yau Luh, Yu-Tsai Hsieh Nickel(II) Chloride". En Encyclopedia of Reagents for Organic Synthesis (L. A. Paquette, Ed.) 2001 J. Wiley & Sons, New York. doi 10.1002/047084289X.rn012. Article Online Posting Date: April 15, 2001.