Rubidiumbromid
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| _ Rb+ _ Br− | |||||||||||||||||||
| Kristallsystem |
kubisch | ||||||||||||||||||
| Raumgruppe |
Fm3m (Nr. 225) | ||||||||||||||||||
| Koordinationszahlen |
Rb[6], Br[6] | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Rubidiumbromid | ||||||||||||||||||
| Andere Namen |
Rubidium(I)-bromid | ||||||||||||||||||
| Verhältnisformel | RbBr | ||||||||||||||||||
| Kurzbeschreibung |
weißer, geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 165,37 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
3,35 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
1340 °C[1] | ||||||||||||||||||
| Löslichkeit |
gut in Wasser (980 g·l−1 bei 5 °C)[1] | ||||||||||||||||||
| Brechungsindex |
1,553[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Rubidiumbromid ist eine chemische Verbindung von Rubidium und Brom. Es ist ein farbloses Salz.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]| Löslichkeit von RbBr in Wasser[3] | ||||||
| Temperatur in °C | 0,5 | 5 | 16 | 39,7 | 57,5 | 113,5 |
| Löslichkeit in g/l | 896 | 980 | 1048 | 1318,5 | 1524,7 | 2052,1 |
Die Löslichkeit von Rubidiumbromid in Wasser ist in nebenstehender Tabelle angegeben. Die Löslichkeit in Aceton beträgt 0,0505 g/kg bei 18 °C, sowie 0,047 g/kg bei 37 °C.[3]
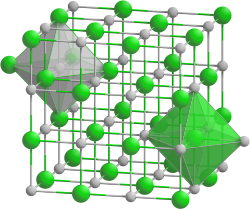
Rubidiumbromid kristallisiert in der Natriumchloridstruktur. Die Kristalle gehören der Raumgruppe Fm3m (Raumgruppen-Nr. 225) mit dem Gitterparameter a = 689 pm sowie vier Formeleinheiten pro Elementarzelle an.[4] Der Brechungsindex der Kristalle beträgt nD = 1,5528.[4]
Die Standardbildungsenthalpie von Rubidiumbromid beträgt ΔfH0298 = −389,50 kJ · mol−1,[5] die Freie Standardbildungsenthalpie ΔG0298 = −378,40 kJ · mol−1,[5] und die molare Standardentropie S0298 = 108,35 J · K−1 · mol−1.[5]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Rubidiumbromid kann durch Reaktion von Rubidiumhydroxid und Bromwasserstoff gewonnen werden:
weitere Reaktionsmöglichkeiten sind:
Verwendung
[Bearbeiten | Quelltext bearbeiten]Rubidiumhalogenide wie Rubidiumchlorid, Rubidiumbromid und Rubidiumiodid werden therapeutisch als Schmerz- und Beruhigungsmittel sowie als Antidepressivum eingesetzt.[6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Datenblatt Rubidium bromide, 99.8% (metals basis) bei Alfa Aesar, abgerufen am 7. Dezember 2019 (Seite nicht mehr abrufbar).
- ↑ a b David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Index of Refraction of Inorganic Crystals, S. 10-247.
- ↑ a b Aterton Seidell: "Solubilities Of Organic Compounds Vol - I", S. 1429. Volltext
- ↑ a b Jean D’Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-540-60035-0, S. 684 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c R. E. Dickerson, H. B. Gray, H.-W. Sichting, M. Y. Darensbourg: "Prinzipien der Chemie", Verlag Walter de Gruyter 1988, ISBN 978-3-11-009969-0, S. 976. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ H. Erdmann: Lehrbuch der anorganischen Chemie, S. 300, 1900, Verlag F. Vieweg und Sohn.