Bromchlorid
Bromchlorid ist eine gasförmige Interhalogenverbindung, die aus den Elementen Brom und Chlor besteht. Brom hat in dieser Verbindung formal die Oxidationsstufe +1. Es handelt sich um eine kovalente Verbindung.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
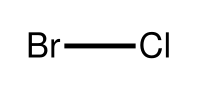
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bromchlorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | BrCl | |||||||||||||||
| Kurzbeschreibung |
rotbraunes Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 115,35 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
3,129 g·cm−3 (−140 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−5 °C (Zersetzung 10 °C)[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Dipolmoment | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Geschichte
BearbeitenErste Untersuchungen der Schmelz- und Siedekurven von Mischungen aus Chlor und Brom wurden schon am Anfang des 20. Jahrhunderts publiziert, wobei keine Verbindungsbildung nachweisbar war.[7][8] Später beschrieben einige Autoren Beobachtungen, die auf eine mögliche Existenz einer Brom-Chlor-Verbindung hinwiesen, wobei weder die Zusammensetzung geklärt noch eine Herstellung realisiert werden konnte.[9][10][11][12] Der erste Nachweis des Bromchlorids über den Vergleich von Dampfdruckkurven und die Isolierung der reinen Verbindung gelang Hermann Lux im Jahr 1930.[4]
Herstellung
BearbeitenDie erste Herstellung von Bromchlorid erfolgte durch Hermann Lux mittels langsamer Destillation eines Chlor-Brom-Gemischs bei −70 °C.[4] Die Verbindung lässt sich durch UV-Bestrahlung eines Chlor-Brom-Gemisches in Halogenkohlenwasserstoff (CFnCl4−n) herstellen.[1]
Eigenschaften
BearbeitenBromchlorid ist im festen Zustand eine ockergelbe Substanz, die bei −54 °C scharf schmilzt.[4] Im Vergleich dazu schmilzt ein 1:1-Gemisch aus Chlor und Brom im Bereich zwischen −66 °C und −52 °C.[4] Abweichende Schmelzpunktangaben für Bromchlorid anderer Autoren bei −66 °C[1] oder −75 °C[9] beruhen möglicherweise auf Messungen an Gemischen der Elemente. Die ockergelbe Schmelze siedet unter Normaldruck bei −5 °C, wobei schon ab 10 °C eine Zersetzung der Verbindung beobachtet wird.[3] Im Kristallgitter werden zickzackförmige BrCl-Ketten gebildet.[2] Die Verbindung kristallisiert in einem orthorhombischen Kristallgitter mit der Raumgruppe Cmc21 (Raumgruppen-Nr. 36).[2]
In Wasser hydrolysiert die Verbindung zu hypobromiger Säure und Salzsäure.[5]
In Gegenwart eines Überschusses an Chloridionen können Verbindungen mit dem Polyhalogenidion BrCl2− erhalten werden.[5]
Verwendung
BearbeitenBromchlorid wird bei der Herstellung von Lithium-Schwefeldioxid-Batterien[13] verwendet. Außerdem wird es als Wirkstoff in Desinfektionsmitteln, Fungiziden und Algiziden eingesetzt.[14]
Einzelnachweise
Bearbeiten- ↑ a b c A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 466.
- ↑ a b c T. Drews, K. Seppelt: Bromine Monofluoride. In: Z. Anorg. Allg. Chem. 638, 2012, S. 2106–2110, doi:10.1002/zaac.201200293.
- ↑ a b c d e f Eintrag zu Bromchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. September 2024. (JavaScript erforderlich)
- ↑ a b c d e H. Lux: Zur Kenntnis des Bromchlorids. In: Chem. Ber. 63, 1930, S. 1156–1158, doi:10.1002/cber.19300630525.
- ↑ a b c d L. Kolditz: Anorganische Chemie. Deutscher Verlag der Wissenschaften, Berlin 1983, S. 528.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dipole Moments, S. 9-51.
- ↑ P Lebeau: In: Compt. rend. Acad. Sciences. 143, 1906, S. 589.
- ↑ B. J. Karsten: Über das gegenseitige Verhalten der Halogene speziell der Systeme Chlor-Brom und Chlor-Jod. In: Z. anorg. Chem. 53, 1907, S. 365–392, doi:10.1002/zaac.19070530126.
- ↑ a b V. Thomas, P Dupuis: In: Comptes Rendus Hebdomadaires des Seances de l'Academie des Sciences. 143, 1906, S. 282.Volltext
- ↑ M. Delepine, L Ville: In: Compt. rend. Acad. Science. 170, 1920, S. 1390.
- ↑ G. S. Forbes, R. M. Fuoss: The Reaction Between Bromine and Chloride Ion in Hydrochloric Acid. Bromine Chloride. In: J. Am. Chem. Soc. 49, 1927, S. 142–156, doi:10.1021/ja01400a019.
- ↑ S Barratt: In: Proc. Roy. Soc. London. 122, 1929, S. 582.
- ↑ tayloredge.com: Lithium Battery Chemistry (PDF, engl.; 355 kB)
- ↑ cdpr.ca.gov (englisch) ( vom 1. Juni 2010 im Internet Archive).




