Guanidin
| Guanidin | |
|---|---|
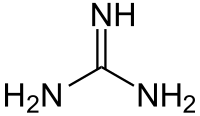 Strukturní vzorec guanidinu | |
 Model guanidinu | |
| Obecné | |
| Anglický název | Guanidin |
| Německý název | Guanidin |
| Sumární vzorec | CH5N3 |
| Vzhled | bezbarvá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 113-00-8 |
| PubChem | 3520 |
| SMILES | NC(N)=N |
| InChI | InChI=1S/CH5N3/c2-1(3)4/h(H5,2,3,4) |
| Vlastnosti | |
| Molární hmotnost | 59,072 g/mol |
| Teplota tání | 50 °C |
Některá data mohou pocházet z datové položky. | |
Guanidin je organická sloučenina, jejíž vzorec je HNC(NH2)2. Jedná se o bezbarvou pevnou látku rozpustnou v polárních rozpouštědlech. Guanidin je silná zásada používaná při výrobě plastů a výbušnin. Nachází se v moči jako produkt metabolismu bílkovin. Je součástí postranního řetězce argininu.
Výroba
[editovat | editovat zdroj]Poprvé jej izoloval Adolph Strecker rozkladem guaninu izolovaného z peruánského guána.[1][2]
Laboratorně jej lze připravit tepelným rozkladem thiokyanatanu amonného při 180–190 °C v bezvodém prostředí:
- 3 NH4SCN → 2 CH5N3 + H2S + CS2
Průmyslová výroba se skládá ze dvou kroků. Prvním je reakce dikyanamidu s amonnými solemi. Při této amonolýze vzniká biguanidin, z kterého vznikají soli s guanidiniovým kationtem. V druhém kroku reagují soli se zásadou, např. methoxidem sodným.[3]
Chemické vlastnosti
[editovat | editovat zdroj]Guanidiniový kation
[editovat | editovat zdroj]
S pKb = 0,4 je guanidin silná zásada. Většina guanidinových derivátů jsou ve skutečnosti soli obsahující jeho konjugovanou kyselinu, která se nazývá guanidinium a jejíž vzorec je C(NH2)3+. Je to planární souměrný stabilní ion s řádem vazby 4/3.
Využití
[editovat | editovat zdroj]Dusičnan guanidinu se používá jako plyn v airbazích. Guanidiniumchlorid se používá na denaturaci bílkovin. Guanidiniumhydroxid je aktivní látkou některých přípravků na vyrovnání vlasů.
Deriváty guanidinu
[editovat | editovat zdroj]
Mezi deriváty guanidinu patří například arginin, kreatin a saxitoxin.
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Guanidín na slovenské Wikipedii.
- ↑ Guanidine and Derivatives. [s.l.]: [s.n.] Dostupné online. ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a12_545.pub2. S. a12_545.pub2. (anglicky) DOI: 10.1002/14356007.a12_545.pub2.
- ↑ zenodo.org. Dostupné online. DOI 10.1002/jlac.18611180203.
- ↑ Guanidine and Derivatives. [s.l.]: [s.n.] Dostupné online. ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a12_545.pub2. S. a12_545.pub2. (anglicky) DOI: 10.1002/14356007.a12_545.pub2.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Guanidin na Wikimedia Commons
Obrázky, zvuky či videa k tématu Guanidin na Wikimedia Commons