Amida (compost químic)
| Substància química | classe estructural d'entitats químiques |
|---|
Una amida és un compost químic orgànic que presenta un grup funcional (grup carbamoïl) constituït per un carboni enllaçat a un oxigen per un doble enllaç (grup acil) i al nitrogen d'un grup amino mitjançant un enllaç simple. La fórmula general és on els grups són grups alquil o aril o àtoms d'hidrogen.
Una quarta part dels actuals fàrmacs contenen grups amida, com ara el paracetamol, un analgèsic i antipirètic molt emprat, o molts d'anestèsics locals (lidocaïna, bupivacaïna, ropivacaïna, dibucaïna…). També són importants les poliamaides ja que a la natura les trobam constituint les proteïnes i a la indústria fibres sintètiques com el niló. Les més simples s'empren com a dissolvents.
Història
[modifica]
El 1817 J.D.C. Bauhof sintetitzà al laboratori la primera amida, l'oxamida, fent reaccionar oxalat de dietil i amoníac, però no l'estudià.[1][2] El 1830 el químic francès Jean-Baptiste Dumas (1800–1884) la sintetitzà escalfant oxalat d'amoni (en francès «oxalate d'ammoniaque»). A aquesta nova substància l'anomenà «oxamide» (en català «oxamida») a partir dels mots francesos «(acide) oxa(lique)», «am(moniaque)»[3] i la terminació «–ide», emprada habitualment per formar noms de composts químics.[4]

La nomenclatura de Dumas fou utilitzada posteriorment per designar altres composts químics que s'obtenien en fer reaccionar un àcid carboxílic amb amoníac, com ara la benzamida sintetitzada el 1832 i anomenada així per Friedrich Whöler (1800–1882) i Justus von Liebig (1803–1873) i que deriva de l'àcid benzoic. Liebig anomenà «amide» al radical .[5] Dumas i el també químic francès Théophile-Jules Pelouze (1807–1867) feren ús per primera vegada el terme en francès «amide» («amida» en català), derivat d'«(ox)amide» el 1833 per designar un tipus de composts orgànics.[6][7]
El 1841 Antoine-Jérôme Balard (1802–1876) sintetitzà la monoamida de l'àcid oxàlic escalfant oxalat d'amoni. Dumas, l'italià Faustino J.M. Malaguti (1802–1878) i Leblanc sintetitzaren l'acetamida escalfant acetat d'amoni.[1] El 1846 Malaguti havia sintetitzat un bon grapat de noves amides a partir d'àcids passant pels èsters.[8] El 1853 el químic francès Charles Frédéric Gerhardt (1816–1856) amb el químic italià Luigi Chiozza (1828–1889) realitzaren un estudi exhaustiu de les amides i descobriren amides que tenien els hidrògens de l'amoníac substituïts per un o dos grups alquil.[9]
El 1933 el químic estatunidenc Wallace Carothers (1896–1937) sintetitzà la primera poliamida, el niló, que patenta el 1938.[10]
Nomenclatura
[modifica]Els composts que només tenen un grup acil unit a un nitrogen s'anomenen «amides primàries», si tenen dos grups acil, «amides secundàries» i si en tenen tres, «amines terciàries».[11]
Les amides primàries es poden considerar derivades dels àcids carboxílics per substitució del grup hidroxil de l'àcid per un grup amino , o . S'anomenen canviant en el nom de l'àcid el sufix -ic i -oic per amida o la terminació carboxílic per carboxamida. Per exemple, de l'àcid etanoic o acètic s'obté l'etanamida , de l'àcid benzoic , la benzamida .[11]
Les amides primàries N-substituïdes i s'anomenen com una amida N-substituïda citant els substituents i com a prefixos. Per exemple, la N-metiletanamida .[11]
En composts que tenen més d'un grup funcional les amides són les següents en la sèrie: àcids carboxílics, anhídrids d'àcids, èsters, halogenurs d'acil. En cas de no ser grup principal s'anomenen emprant el prefix «carbamoïl». Per exemple, àcid 3-carbamoïlbutanoic ; àcid 2-carbamoïlciclohexancarboxílic .
-
Propanamida.
-
3-metilbutanamida.
-
Benzamida.
-
N-metiletanamida
Estat natural
[modifica]
Les amides monomèriques són rares en la natura, amb poques excepcions, tals com la urea, present a l'orina dels mamífers com a producte de degradació de les proteïnes; o la niacinamida, una de les vitamines B3 present al fetge i ronyons dels animals. Cal notar, però, que els constituents principals de la trama estructural de la matèria viva, els pèptids i les proteïnes, són poliamides, en les quals es manifesta la solidesa de l'enllaç amídic.[12]
Propietats
[modifica]
Propietats físiques
[modifica]Exceptuant la formamida, les amides no substituïdes en el nitrogen són sòlides, i llurs punts de fusió i d'ebullició són superiors als dels àcids carboxílics corresponents. L'explicació d'aquest fet es troba en els enllaços per pont d'hidrogen que es formen entre els àtoms d'hidrogen enllaçats al nitrogen d'una molècula d'amida i els àtoms d'oxigen d'una altra molècula d'amida.[13] per la mateixa raó, molècules amb altres grups funcionals de masses moleculars semblants tenen punts d'ebullició inferiors. És el cas del 2-metilpropè i l'acetona que tenen punts d'ebullició de –7 °C i 56 °C, mentre que l'etanamida el té de 221 °C, molt més alt.[14]
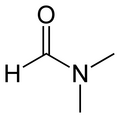
El nombre de substituents en el nitrogen determina el nombre de ponts d'hidrogen que es poden formar. La N,N-dimetiletanamida no té enllaços i no forma ponts d'hidrogen, i els seus punts de fusió i ebullició (–20 °C i 165 °C) són inferiors al de l'N-metiletanamida (31 °C i 206 °C). Aquesta, a la vegada, els té inferiors als de l'etanamida. (80 °C i 221 °C).[14]
En l'espectroscòpia infraroja absorbeixen a 3 500–3 400 cm−1 (vibració de tensió ) i a 1 690–1 680 cm−1 (banda I) i 1 640–1 630 cm−1 (banda II) (vibració de tensió ).[12]
Propietats químiques
[modifica]
El grup d'una amida és menys àcid que el grup d'un àcid carboxílic a causa de la menor electronegativitat del nitrogen respecte de l'oxigen. Les amides típiques tenen valors de pKa al voltant de 16, la qual cosa indica que tenen una acidesa semblant a la de l'aigua. La presència del grup carbonil fa que les amides siguin àcids més forts i bases més febles que les amines. Així l'etanamina té un pKa de 36 i l'etanamida de 15.[14]
Per altra banda, la deslocalització de la parella d'electrons no compartida del nitrogen disminueix el caràcter positiu del carboni carbonílic, la qual cosa fa que les amides siguin menys reactives als atacs nucleòfils que altres derivats dels àcids carboxílics.[14]
Síntesi
[modifica]
A partir d'èsters
[modifica]Les síntesis més emprades d'amides utilitzen com a reactius èsters i es fan reaccionar amb amoníac o amb amines primàries o secundàries (les terciàries no tenen l'hidrogen que se substitueix pel grup acil). Els èsters metílics i etílics són els més reactius.[14]
Els èsters també es poden fer reaccionar amb reactius de Grignard, reacció que es coneix com a síntesi de Bodroux, descoberta el 1904 per Fernand Bodroux (1873–1968).[15]

A partir de clorurs d'acil
[modifica]Els clorurs d'acil, o clorurs d'àcid, reaccionen amb amoníac i amb amines per formar amides. En general se n'afegeix una base, com a hidròxid de sodi, perquè reaccioneu amb el clorur d'hidrogen produït.[14]

A partir d'anhídrids d'àcids
[modifica]Els anhídrids d'àcid reaccionen amb amoníac i amines per formar amides. Es requereixen dos equivalents molars de l'amina. A l'exemple de la figura, només un grup acil de l'anhídrid acètic s'incorpora a l'amida; l'altre es torna el grup acil de la sal de l'amina amb l'àcid acètic.[14]

Reacció d'Schmidt
[modifica]A la reacció d'Schmidt, descoberta el 1924 pel químic alemany Karl Friedrich Schmidt (1887–1971), es fan reaccionar cetones o aldehids amb azida d'hidrogen o amb alquilazides , en medi àcid sulfúric, i s'obtenen amides. Si a la reacció s'empra un aldehid, s'obtenen metanamides N-substituïdes.[16]

A partir d'àcids carboxílics
[modifica]De vegades les amides es preparen en forma directa a partir dels àcids carboxílics i les amines, mitjançant un procés en dues etapes. El primer pas és una reacció àcid-base en la qual es combinen l'àcid i l'amina, per formar una sal de carboxilat d'amoni. En escalfar-la, aquesta sal de carboxilat d'amoni perd aigua i forma una amida. A la pràctica es poden combinar tots dos passos en una sola operació, amb només escalfar junts un àcid carboxílic i una amina. Tanmateix és un mètode limitat i no és habitual el seu ús.[14]
Aplicacions
[modifica]Indústria farmacèutica
[modifica]Les amides tenen una gran importància en la producció de fàrmacs essent les reaccions de formació d'amides les més comunes que es realitza a la indústria farmacèutica i, aproximadament una quarta part de tots els fàrmacs comercialitzats actualment (i dos terços de tots els candidats a fàrmacs) contenen almenys un enllaç amida.[17]
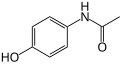
Una amida amb la qual molta gent està familiaritzada és l'acetaminofèn o paracetamol, un analgèsic i antipirètic que és l'ingredient actiu en molts de medicaments. Un altre analgèsic amida és la fenacetina. Un grup important de fàrmacs que són amides són els anestèsics locals lidocaïna, bupivacaïna, ropivacaïna, dibucaïna i d'altres. També és una amida el tranquil·litzant meprobromat.[18]
Indústria química
[modifica]Les amides d'àcid carboxílic alifàtic no substituïts tenen un ampli ús com a intermedis, estabilitzadors, agents d'alliberament per a plàstics, pel·lícules, tensioactius i fluxos de soldadura. Les amides substituïdes com la dimetilformamida i la dimetilacetamida són molt bons dissolvents.[19]
La dimetilformamida es fa servir principalment com a dissolvent en la síntesi orgànica. També s'utilitza en la preparació de fibres sintètiques. És un medi selectiu per a l'extracció d'hidrocarburs aromàtics del petroli i un dissolvent per a colorants. Tant la dimetilformamida com la dimetilacetamida són ingredients dels removedors de pintura. La dimetilacetamida també s'empra com a dissolvent per a plàstics, resines i gomes, i en moltes reaccions orgàniques.[19]
-
Dimetil-m-toluamida o DEET.
L'acetamida s'usa per desnaturalitzar l'etanol i com a dissolvent de molts compostos orgànics, com a plastificant i additiu en paper. També es troba en laques, explosius i flux de soldadura. La formamida és un suavitzant per a paper i coles, i un dissolvent en la indústria plàstica i farmacèutica.[19]
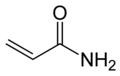
Algunes amides alifàtiques insaturades, com l'acrilamida s'utilitza en la síntesi de colorants, adhesius, encolat de paper i tèxtils, teixits de premsa permanent i tractament d'aigües residuals i residus. S'empra, també, a la indústria del metall per al processament del mineral, i en enginyeria civil per a la construcció de fonaments de preses i túnels. Les poliacrilamides es troben àmpliament usades com a agents de floculació en el tractament d'aigües i aigües residuals, i com a agents de reforç durant la fabricació de paper a la indústria del paper i de la pasta. Els compostos d'amides aromàtiques formen colorants importants i intermedis medicinals. Alguns tenen propietats repel·lents d'insectes,[19] com l'N,N-dimetil-m-toluamida (Off, DEET), i els insecticides Sevin i Mipcin.[18]
Indústria tèxtil
[modifica]
En la indústria tèxtil s'empren poliamides sintètiques i, potser la més coneguda de totes elles és el niló. El 1931, el químic nord-americà Wallace Hume Carothers descobrí un procés per fer una de les primeres fibres sintètiques. Trobà que l'addició d'àcid adípic a l'hexametilendiamina produïa un producte fort i semblant a la fibra al qual donà el nom de Nylon 66. (El 66 reflecteix el fet que l'àcid adípic i l'hexametilendiamina contenen cadascun sis àtoms de carboni a les seves molècules). La reacció entre aquestes dues substàncies forma un polímer llarg, una mica semblant a l'estructura de la proteïna natural. Igual que en les proteïnes, les subunitats del niló estan unides per enllaços amida. Per aquest motiu, tant la proteïna com el niló es poden considerar poliamides, compostos en què un gran nombre d'unitats d'amida s'uneixen entre si en una llarga cadena.[18]
Altres tipus de niló es desenvoluparen en dates posteriors. Una forma, coneguda com a niló 6, es produeix polimeritzant un sol tipus de molècula, l'àcid 6-aminohexanoic. L'enllaç entre subunitats en els enllaços de niló-6-amida és el mateix que en el niló 66. En tots els tipus de niló, la fibra obté la seva força de l'enllaç per pont d'hidrogen que es produeix entre els àtoms d'oxigen i d'hidrogen de les cadenes adjacents del material.[18]
Toxicologia
[modifica]La gran varietat d'estructures químiques possibles de les amides es reflecteix en la diversitat dels efectes biològics. Algunes són completament innòcues, per exemple, les amides dels àcids grassos simples de cadena llarga, com les amides dels àcids esteàric o oleic. D'altra banda, alguns membres d'aquesta família han estat classificats per l'Agència Internacional de Recerca sobre el Càncer (IARC) al Grup 2A (probable carcinogen humà) o al Grup 2B (possible carcinogen humà). Amb l'acrilamida s'han observat efectes neurològics a l'home i en animals d'experimentació. La dimetilformamida i la dimetilacetamida produeixen lesions hepàtiques en els animals i els efectes teratogènics de la formamida i la monometilformamida s'han demostrat experimentalment.[19]
Si bé hi ha una gran quantitat d'informació sobre el metabolisme d'algunes amides, la naturalesa dels seus efectes tòxics encara no s'han explicat a nivell molecular o cel·lular. Moltes amides simples són, probablement, hidrolitzades per la acció d'amidases inespecífiques al fetge i l'àcid produït s'excreta o es metabolitza a través dels mecanismes normals.[19]
Algunes amides aromàtiques, com la N-fenilacetamida (acetanilida), s'hidroxil·len a l'anell aromàtic i, seguidament, es conjuguen i s'excreten. La capacitat de certes amides de penetrar a l'organisme a través de la pell intacta és especialment important per a l'adopció de mesures preventives.[19]
Referències
[modifica]- ↑ 1,0 1,1 Partington, J. R.. History of Chemistry. Londres: Macmillan Education, Limited, 1964. ISBN 978-1-349-00554-3.
- ↑ Gerhardt, Charles. Traité de chimie organique.. 3a. París: Didot, 1853.
- ↑ Dumas, J. «Sur l'Oxamide, matière qui se rapproche de quelques substances animales». Annales de chimie et de physique, 44, 1830, pàg. 129-143.
- ↑ «-amide | Meaning of suffix -amide by etymonline» (en anglès). [Consulta: 16 novembre 2021].
- ↑ Webster, John White. A Manual of Chemistry: Containing the Principal Facts of the Science, in the Order in which They are Discussed, and Illustrated in the Lectures at Harvard University, N.E. (en anglès). 3a. Boston: Marsh, Capen, Lyon and Webb, 1839.
- ↑ Menten, Pierre de. Dictionnaire de chimie : une approche étymologique et historique. Bruxelles: De Boeck, 2013. ISBN 978-2-8041-8175-8.
- ↑ Dumas, J.; Pelouze, J. «Mémoire sur l'Huile essentielle de Moutarde noire». Annales de chimie et de physique, 53, 1983, pàg. 181-189.
- ↑ Wisniak, J. «FAUSTINO JOVITA MALAGUTI Sugar, substitution theory, and amides.». Revista CENIC. Ciencias Químicas, 50, 1, 2019, pàg. 075-089.
- ↑ Gerhardt, Ch.; Chiozza, L. «Recherches sur les amides». Comptes rendus hebdomadaires des séances de l'Académie des Sciences, 37, 1853, pàg. 86-90.
- ↑ «Es patenta el niló | enciclopèdia.cat». [Consulta: 17 novembre 2021].
- ↑ 11,0 11,1 11,2 Àngel Messeguer i Peypoch i Miquel A. Pericàs i Brondo. Nomenclatura de química orgànica: seccions A, B, C i H : regles definitives de 1979 / [Unió Internacional de Química Pura i Aplicada. IEC i Consell Superior d'Investigacions Científiques, 2013.
- ↑ 12,0 12,1 «Amida (compost químic)». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ Johansson, Allan; Kollman, Peter; Rothenberg, Steve; McKelvey, John «Hydrogen bonding ability of the amide group» (en anglès). Journal of the American Chemical Society, 96, 12, 6-1974, pàg. 3794–3800. DOI: 10.1021/ja00819a013. ISSN: 0002-7863.
- ↑ 14,0 14,1 14,2 14,3 14,4 14,5 14,6 14,7 Carey, Francis A. Química orgánica. 6a ed. México: McGraw Hill, 2006. ISBN 970-10-5610-8.
- ↑ Bodroux Amide Synthesis (en anglès). Hoboken, NJ, USA: John Wiley & Sons, Inc., 2010-09-15, p. conrr096. DOI 10.1002/9780470638859.conrr096. ISBN 978-0-470-63885-9.
- ↑ Aubé, J.; Fehl, C.; Liu, R.; McLeod, M.C.; Motiwala, H.F.. «6.15 Hofmann, Curtius, Schmidt, Lossen, and Related Reactions». A: Comprehensive Organic Synthesis (en anglès). 6. Elsevier, 2014, p. 598–635. DOI 10.1016/b978-0-08-097742-3.00623-6. ISBN 978-0-08-097743-0.
- ↑ Seavill, Peter W.; Wilden, Jonathan D. «The preparation and applications of amides using electrosynthesis» (en anglès). Green Chemistry, 22, 22, 16-11-2020, pàg. 7737–7759. DOI: 10.1039/D0GC02976A. ISSN: 1463-9270.
- ↑ 18,0 18,1 18,2 18,3 «Amides | Encyclopedia.com». [Consulta: 18 novembre 2021].
- ↑ 19,0 19,1 19,2 19,3 19,4 19,5 19,6 «Amidas». A: Enciclopedia de Salud y Seguridad en el Trabajo.. Tom IV. Organización Internacional del Trabajo. ISBN 978-84-7434-995-5.