Iridio
| Iste articlo ye en proceso de cambio enta la ortografía oficial de Biquipedia (la Ortografía de l'aragonés de l'Academia Aragonesa d'a Luenga). Puez aduyar a completar este proceso revisando l'articlo, fendo-ie los cambios ortograficos necesarios y sacando dimpués ista plantilla. |
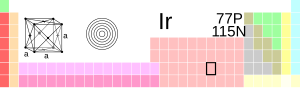
| Iridio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información cheneral | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, simbolo, numero | Iridio, Ir, 77 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie quimica | Metal de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, periodo, bloque | 9, 6, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Color | blanco archent
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atomico | 192.217 g·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electronica | [Xe] 4f14 5d7 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons por capa | 2, 8, 18, 32, 15, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedaz fisicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | solido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidat (a t.a.) | 22.56[1] g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidat en liquido en o p.f. | 19 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 2739 K (2466 °C, 4471 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto d'ebullición | 4701 K (4428 °C, 8002 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 41.12 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 563 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor especifica | (25 °C) 25.10 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedaz atomicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | cubica centrata en as caras | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estaus d'oxidación | −3,−1, 0, 1, 2, 3, 4, 5, 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividat | 2.20 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Enerchías d'ionización | 1ª: 880 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ª: 1600 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atomico | 136 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalent | 141±6 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atra información | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenación magnetica | paramagnetico[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistividat electrica | (20 °C) 47.1 nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividat termal | (300 K) 147 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatación | 6.4 µm/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidat d'o sonito | (20 °C) 4825 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modulo d'elasticidat | 528 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mod. elast. transversal | 210 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modulo de compresión | 320 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0.26 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Mohs | 6.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Vickers | 1760 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 1670 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numero CAS | 7439-88-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopos mas estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
O iridio ye un elemento quimico de numero atomico 77 que se sitúa en o grupo 9 d'a tabla periodica d'os elementos. O suyo simbolo ye Ir. Se tracta d'un metal de transición, d'o grupo d'o platín, duro, fráchil, pesato, de color blanca archent. S'emplega en aliacions d'alta resistencia que pueden soportar altas temperaturas. Ye un elemento poco abundant y se troba en a naturaleza en aliacions con platín y osmio. Ye o elemento mas resistent a la corrosión. S'emplega en contactos electricos, aparatos que treballan a altas temperaturas, y como achent endurecedor d'o platín.
Caracteristicas prencipals
[editar | modificar o codigo]Ye de color blanca, parellán a o platín, pero presenta una lichera coloración roya. Ye dificil treballar iste metal, porque ye muit duro y crebadizo. Ye o metal mas resistent a la corrosión. No ye atacato por os acidos, ni sisquiera por l'augua rechia. Ta disolver-lo s'emplega acido clorhidrico, HCl, concentrato con clorato de sodio, NaClO3 a temperaturas altas. Tien una densidat muit alta, parellana a la de l'osmio.
Os suyos estaus d'oxidación mas comuns son +1, +3 y +4.
Referencias
[editar | modificar o codigo]- ↑ J. W. Arblaster: Densities of Osmium and Iridium, in: Platinum Metals Review, 1989, 33, 1, S. 14–16; Volltext.
- ↑ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.