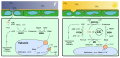
Photosynthes

Unter Photosynthes (altgriechisch φῶς phōs „Liecht“ un σύνθεσις sýnthesis „Zämmesetzig“) verstoht mer d Erzygig vu energyryche Stoff us energyermere Stoff mit Hilf vu Liechtenergy. Si wird vu Pflanze, Alge- un e Dail Bakteriegruppe bedribe. Bi däm biochemische Vorgang wird zerscht mit Hilf vu liechtabsorbierende Farbstoff, zmaischt Chlorophyll, Liechtenergy in chemischi Energy umgwandlet. Die wird derno unter anderem zum Ufböu vu energyryche organische Verbindige – Chohlehydrat - us energyaarme, anorganische Stoff, in dr Hauptsach us Chohledioxid CO2 (Chohlestoffdioxid-Assimilation) un Wasser H2O, brucht. Wel di energyryche organische Stoff zue Bstanddail vum Läbewäse wäre, nännt mer d Sintees vun ene Assimilation. Näbe Chohledioxid un Wasser wäre au Nitrat un Sulfat assimiliert.
Mer unterschaidet zwische oxygener un anoxygener Photosynthes. Bi dr oxygene wird molekulare Suurstoff (O2) erzygt, bi dr anoxygene nit. Bi dr anoxygene Photosynthes chenne statt em Suurstoff anderi anorganischi Stoff entstoo, zem Byschpel elementare Schwäfel S.
Di oxygen Photosynthes isch nit nume dr wichtigscht biogeocheemisch Prozäss vu dr Äärd, sunder au ain vu dr eltschte. Si drybt dur d Bildig vu organische Stoff dur Sunnenenergy diräkt un indiräkt fascht alli Ekosyschteem aa, wel si andere Läbewäse energyrychi Böustoff- un Energykwälle liiferet. Dr erzygt Suurstoff sälber dient zur Energygwinnig in dr aeroobe Ootmig as Oxidationsmittel, wäge däm hän sich hecher entwickleti aeroobi Läbesforme chenne bilde. Us em Suurstoff wird au d Ozonschicht ufböue, wu s Läbe uf em Land erscht megli gmacht ghaa het.
Iberblick
[ändere | Quälltäxt bearbeite]D Photosynthes cha in drei Schritt glideret wäre:
- Zerscht wird di elektromagnetisch Energy in Form vu Liecht vu gaignete Wällelengine unter Verwändig vu Farbstoff (Chlorophyll, Phycobilin, Carotinoid) absorbiert.
- Diräkt derno chunnt im zweete Schritt e Umwandlig vu dr elektromagnetischen Energy in chemischi Energy dur Iberdraagig vu Elektrone, wu dur d Liechtenergy in e energyryche Zuestand versetzt wore sin (Redoxreaktion).
- Im letschte Schritt wird die chemisch Energy fir Synthes vu energyryche organische Verbindige brucht, wu dr Läbewäse im Böustoffwächsel fir s Wachstum un au im Energystoffwächsel fir d Gwinnig vu Energy diene.
D Synthes vu däne Stoff goht zmaischt vu dr Chohlestoffverbindig Chohledioxid (CO2) uus. Fir d Verwärtig vu CO2 mueß es reduziert wäre. As Reduktionsmittel (Reduktans, Elektronedon(at)ore) diene d Elektrone vu oxidierbare Stoff: Wasser (H2O), elementare, molekulare Wasserstoff (H2), Schwäfelwasserstoff (H2S), zweewärtigi Yyseione (Fe2+) oder aifachi organischi Stoff (wie Syrine un Alkohol, z. B. Acetat bzw. Ethanol). Derzue chenne d Elektrone au us dr Oxidazion vu aifache Chohlehydrat gwunne wäre. Wel Reduktans brucht wird, hangt ab vum Organismus, vu syne Enzym, wun em fir d Nutzig vu dr Reduktanzie z Verfiegig stehn.
| Elektronedon(at)or | Photosynthes-Form | Vorchuu |
|---|---|---|
| Yyse-II-Ione (Fe2+) | anoxygeni Photosynthes | Purpurbakterie[1] |
| Nitrit (NO2−) | anoxygeni Photosynthes | Purpurbakterie[2] |
| elementare Schwäfel (S0) | anoxygeni Photosynthes | Purpurbakterie[3] |
| Schwäfelwasserstoff (H2S) | anoxygeni Photosynthes | grieni Nitschwäfelbakterie,[4] grieni Schwäfelbakteerie,[5] Purpurbakterie[6] |
| Thiosulfat (S2O32−) | anoxygeni Photosynthes | Purpurbakterie[7] |
| Wasser (H2O) | oxygeni Photosynthes | Cyanobakterie,[8] Prochlorophyta,[9] fascht alli phototrophe Eukaryote[10] |
| Wasserstoff (H2) | anoxygeni Photosynthes | grieni Nitschwäfelbakterie[11] |
Allgmaini Photosynthesglychig
[ändere | Quälltäxt bearbeite]D Gsamtreakzion vu dr Photosynthes losst sich im Fall vu CO2 as Uusgangsstoff allgmain un veraifacht mit däne Summeglychige formuliere, wu <CH2O> fir di bildete energyryche organische Stoff stoht.
Mit eme Reduktans, wu dur Abgab vu Wasserstoff (H) reduziert, wie Wasser (H2O), Schwäfelwasserstoff (H2S) un elementare, molekulare Wasserstoff (H2), (alli do mit em allgmainen Uusdruck <H> symbolisiert):
Mit eme Reduktans, wu dur Abgab vu Elektrone (e−) reduziert, wie zweewärtigi Yyseione (Fe2+) un Nitrit (NO2−):
E Dail Bakterie verwände Chohlehydraat as Reduktans, wie zem Byschpel Lactat, s Anion vu dr Milchsyri:[12]
D Gsamtreakzion vu dr Photosynthes mit Wasser oder Schwäfelwasserstoff as Reduktans cha au dur die allgmain, veraifacht Summeglychig formuliert wäre:
As allgmaini Formulierig stoht do H2A fir s Reduktans H2O bzw. H2S.
Alli Algen un griene Landpflanze bruuche uusschließli Wasser (H2O) as Reduktans H2A. Au Cyanobakterie bruche zmaischt Wasser as Reduktans. Dr Buechstab A stoht in däm Fall fir dr Suurstoff (O), wu im Wasser bunden isch. Är wird as Oxidazionsprodukt vum Wasser bi dr sognännte oxygene Photosynthes as elementare, molekulare Suurstoff (O2) freigsetzt. Dr gsamt Suurstoff, wu in dr Ärdatmosphäre un dr Hydrosphäre vorchunnt, wird dur oxygeni Photosynthes bildet.
Di photosythetische Bakterie (Chloroflexaceae, Chlorobiaceae, Chromatiaceae, Heliobacteria, Chloracidobacterium[13]) chenne ne vyl greßer Späktrum an Reduktanzie bruuche, in dr Hauptsach nutze si aber Schwäfelwasserstoff (H2S). Au ne Huffe Cyanobakterie chenne Schwäfelwasserstoff as Reduktans verwände. Wel in däm Fall A fir dr im Schwäfelwasserstoff bundene Schwäfel stoht, wird bi däre Art vu dr bakteriälle Photosynthes elementare Schwäfel (S) un kai Suurstoff freigsetzt. Die Foorm vu dr Photosynthes wird sällewääg anoxygeni Photosynthes gnännt.
E Dail Cyanobakterie chennen au zweewärtigi Yyseione as Reduktans nutze.
Au wänn bi dr oxygene un dr anoxygene Photosynthes unterschidligi Reduktanzie bruucht wäre, wäre doch in beede Prozäss dur d Oxidazion vun ene Elektrone gwunne. Mit däne Elektrone, wu mit Liechtenergy uf e hoch Energynivoo (niider Redoxpotenzial) broocht wore sin, wäre di energyryche Verbindige Adenosintriphosphat (ATP) un Nicotinamidadenindinukleotidphosphat (NADPH) bildet, un mit däne chenne us CO2 energyrychi organischi Stoff synthetisiert wäre.
Dr Chohlestoff, wu bi dr Synthes vu dr energyryche organische Verbindige bruucht wird, chaa us Chohledioxid (CO2) oder us aifache organische Verbindige (z. B. Acetat) gwunne wäre. Im erschte Fall spricht mer vu Photoautotrophy. Dr greescht Dail vu dr phototrophe Organisme isch photoautotroph. Zue dr photoautotrophe Organisme ghere z. B. alli griene Landpflanze un Alge. Bi iine isch e phosphorylierti Triose s primär Synthesprodukt un dient as Uusgangsmatrial fir dr Ufböu vu Böu- un Reservestoff (d. h. verschidene Chohlehydraat). Photoautotrophi dryybe mit ihrem Photosynthes-Stoffwächsel (diräkt un indiräkt) fascht alli Ekosyschtem aa, wu s git, wel si mit em Ufböu vu organische Verbindigen us anorganischem CO2 andere Läbewäse energyrychi Böustoff- un Energyquälle lifere. Wäre aifachi, organischi Verbindigen as Uusgangsstoff gnutzt, nännt mer dää Prozäss, wu nume bi Bakterie vorchunnt Photoheterotrophy.
Absorption vu Liechtenergy
[ändere | Quälltäxt bearbeite]
unte: Engelmannsche Bakterieversuech (nit maßstabsdreji Grafik). S Liechtspäktrum vun eme Prisma isch uf e Fadethallus vun ere Grienalge (Oedogonium) projiziert. Im roten un blaue Beraich sammle si doderby bsundersch vyl aerophili Bakterien aa, wu aktiv schwimme (roti Chugle). Wel d Carotinoid im blaue Beraich abschirme, isch s photosynthetisch Wirkspäktrum dert gringer wie im rote Beraich.[14]
D Energy vum Liecht wird bi phototrophen Organisme dur Farbstoff yygfange. In griene Pflanzen un in Cyanobakterie sin s Chlorophyll, in andere Bakterie Bakteriochlorophyll. Liecht vu unterschidlige Wällelengeberaich wird dur die Farbstoff absorbiert. Dr späktral Optimalberaich fir d Photosynthes isch dur dr Engelmannsche Bakterieversuech zum erschte Mol experimentäll bstimmt wore. D Farbstoff, wu s Liecht absorbiere, wären au Chromophor gnännt. Bilde die Kompläx mit Protein drumume, nännt mer si au Pigmänt.
Drifft Liecht uf e Pigmänt, no goht s Chromophor in e aagregte Zuestand iber. Je nodäm, wie di konjugierte Doppelbindige vum Chromophor ufböue sin, unterschaidet sich d Energy fir so ne Aaregig un dodermit s Absorpzionsspäktrum. Bi dr Chlorophyll a un b, wu s in Pflanze git, wird in dr Hauptsach blau un rot Liecht absorbiert, griens Liecht dergege gar nit, wäge däm ischs Chlorophyll grien. S dur Liecht aagregt Chlorophyll chaa sy aagregt Elektron jetz uf en andere Stoff, en Elektronenakzeptor iberdrage, derno blybt e positiv glade Chlorophyllradikal (Chl•+) ibrig. S iberdrait Elektron chaa iber e Elektronetransportchetti schließlig iber wyteri Elektroneniberdreger zum Chlorophyllradikal zruggchuu. Uf däm Wäg versetzt s Elektron Protone dur d Membran (Protonebumpi), dodermit wird d Liechtenergy in e eläktrisch un osmotisch Potenzial umgsetzt (chemiosmotischi Kupplig).
Liechtsammelkompläx
[ändere | Quälltäxt bearbeite]
E Photosynthes dur aifachi Pigmänt wär relativ ineffiziänt, wel die em Liecht nume ne gringi Flechi dete entgegestelle un derzue nume in eme änge Wällelengeberaich deten absorbiere. Dur d Anornig vu chlorophyllhaltige Liechtsammelkompläx zue Antänne um e gmainsam Reakzionszäntrum wird dr Querschnitt greßer un au s Absorpzionsspäktrum braiter gmacht. D Chromophor, wu ängi Nochbere sin, gän d Liechtenergy vu aim Pigmänt zum andere wyter. Die definiert Mängi (Quant) Aaregigsenergy nännt mer Exziton. D Exziton chemme schließlig in weenige Pikosekunden in s Reaktionszäntrum. Dr Exzitonetransfer gschiht allwäg innerhalb vun eme Liechtsammelkompläx dur delokalisierti Elektronen un zwische ainzelne Liechtsammelkompläx strahligslos dur dr Förster-Mechanismus.
In Pflanze bilde d Liechtsammelkompläx e Zäntralantänne (core) un e usseri Antänne un sin zämme mit em Reaktionszäntrum in d Thylakoidmembran yybettet. As Chromophor dienen aber nit nume Chlorophyll a un b, sunder au Carotinoid un Xanthophyll. Die schitze zum aine d Antänn, wänne e Chlorophyllmolekil imfall e schädlige Triplettzuestand uusbildet. Zum anderen mache die Chromophor dr Wällelengeberaich zum Yyfange vu Liecht hecher.
In Cyanobakterie sin d Antänne vu usse uf d Thylakoidmembran uufglageret. D Antännekompläx wäre Phycobilisome gnännt, d Phycobilinprotein vun ene absorbiere vor allem grien Liecht.
Grieni Schwäfelbakterien un Grieni Nitschwäfelbakterie bruuche fir iiri anoxygen Photosynthes sognännti Chlorosome. Des sin langlächti, lipidähnligi Partikel, wu uf dr cytoplasmatische Syte vu dr Membran liigen un in Verbindig mit em photosynthetische Reaktionszäntrum stehn.[15] Si sin bsundersch effäktivi Liechtsammler.
Oxigeni Photosynthes
[ändere | Quälltäxt bearbeite]
Di griene Pflanze, Algen un Cyanobakterie nutze d Energy vum Liecht go Energy in Form vu Adenosintriphosphat (ATP) spychere un as Reduktionsmittel Elektronen us Wasser gwinne. Wasser (H2O) wird oxidiert, indäm ihm Elektrone entzoge wäre, un doderby wäre molekularer Suurstoff O2 un Wasserstoffione H+ freigsetzt (Photolys vum Wasser). Die Form vu dr Photosynthes wird wäg dr Freisetzig vu Suurstoff oxygeni Photosynthes gnännt.
Di gwunnene Elektrone wären uf NADP+-Molekil iberdrait, wu im Stoffwächsel vum Organismus vor allem fir dr Ufböu vu Chohlehydrat („Dunkelreakzion“) notwändig sin. D Summeglychig lutet:
Go uf aire Syte Wasser oxidiere un uf dr andre Syte NADP+ reduziere z chenne, sin zwai verschideni Photosyschtem hinterenander gschaltet, d Redoxpotenzial vun ene wäre dur Adsorpzion vu Liecht gänderet. Photosyschtem II stellt e stark Oxidazionsmittel fir d Oxidazion vu Wasser z Verfiegig, derwylscht an Photosyschtem I e stark Reduktionsmittel fir d Reduktion vu NADP+ erzygt wird. Die Reakzion wird „Liechtreakzion“ gnännt, wel dää Dail vu dr Photosynthes diräkt vum Liecht abhängig isch.
- Dailglychig Liechtreakzion
Näb dr Gwinnig vu Elektrone wird bi dr Liechtreakzion Energy in Form vun eme Protone-Konzentrazionsunterschid gspycheret, wu brucht wird go ATP us ADP un Phosphat z erzyge (Photophosphorylierig):
In dr Gsamtbilanz wären in dr Liechtreakzion ai Molekil Suurstoff bildet, zwai Molekil NADP zue NADPH reduziert un rund drei Molekil ADP zue ATP phosphoryliert:
S Redukzionsmittel (NADPH) un d Energyquäll (ATP), wu bi dr Liechtreakzion gwunne wäre, wäre derno im sognännte Calvin-Zyklus („Dunkelreakzion“) verwändet, wu Chohlehydrat us Chohlestofdioxid ufböue wäre. S NADPH wird doderby fir d Redukzion vu 1,3-Bisphosphoglycerat zue Glycerinaldehyd-3-phosphat bruucht.
- Dailglyychig Dunkelreakzion
Dr freigsetzt Suurstoff stammt also us em Wasser, nit us em fixierte CO2. Wäge däm stehn in dr negschte Summeglyychig uf dr linke Syte 12 Wassermolekil, rächts 6 O2-Molekil. In dr Gsamtglychig vu dr oxygene Photosynthes dient Glucose (C6H12O6) as Byschpel, si stellt s primär Produkt dar:
- Brutto-Reakzionsglychig fir di oxygen Photosynthes
- Netto-Reakzionsglychig fir di oxygen Photosynthes
- Us Chohledioxid un Wasser entstehn – dur Energyzuefuer (Liecht) – Druubezucker (Glucose) un Suurstoff.
- Wortglychig fir di oxygen Photosynthes
Lineari (nit-zyklischi) Photophosphorylierig
[ändere | Quälltäxt bearbeite]
Bi Organisme mit oxygener Photosynthes sin di zwai membranintegrale Photosyschtem II un I in Serie gschaltet. Ähnli wie bi dr Otmigschette sin di baide Photosyschem dur e Elektronetransportchette verbunde, wu näb em chlaine Molekil Plastochinon au e wytere membranintegrale Proteinkompläx (Cytochrom-b6f-Kompläx) un s chlai Protein Plastocyanin umfasst. Wäre di Redoxpotenzial vu allne Redoxpartner ufdrait, wu an dr Reakzion bedailigt sin, git s e Art Zick-Zack-Verlauf, wu an e drillt „Z“ mahnt (Z-Schema, vgl. Abbildig).
D Aaregigsenergy, wu fir dr Elektronetransfer in dr Reakzionszäntre vu dr Photosyschtem brucht wird, wird in Form vu Strahlig vor allem dur d Liechtsammelkompläx ufgnuu, wu s näbe Chlorophyll-a au Chlorophyll-b un Carotinoid din het un wu in eme wyte Beraich vum sichtbare Wällelenginespäktrum absorbiere (vgl. s Späktrum obe). Bi Absorpzion vun eme rote Liechtquant wächslet s Molekil in dr aagregt Energyzuestand S1, bi Absorpzion vun eme blaue Liechtquant in dr Zuestand S2 mit hecherer Energy. Nume dr S1-Zuestand isch fir d Photochemy nutzbar. Unter Abgab vu dr iberschissigen Energy as Wermi (intärni Konversion) cha aber vum S2 uf s S1-Nivoo gwächslet wäre, was au hecherenergetischi Liechtquante nutzbar macht.[16]
Dur strahligslose Energytransfer cha d Energy vu dr Aaregigszueständ zwische äng benochberete Chlorophyll-Molekil bis zue dr Reakzionszäntre vu dr Photosyschtem iberdrait wäre. Bim Ruggfall uf s Uusgangsnivoo S0 wird Energy abgee, d Art vu dr Abgab isch doderby abhängig vu dr Effiziänz vum jewylige Prozäss.
Mit ere Quantenuusbyti vu rund 85 % vu dr Aaregigsenergy wird in dr uffige Reakzionszäntre vu Photosyschtem II e Ladigsdrännig durgfiert, doderby wird e Elektron vu dr baarige Chlorophyll-a-Molekil (special pair, P680) uf e primere Akzäptor, e Phäophytin (Phe) vu dr D1-Unterainhait, transferiert. Vu dert uus s iber s fescht bunde Plastochinon QA (D2-Unterainhait) uf e lugg bunde Plastochinon (QB) (D1-Unterainhait).[17] No Ufnahm vu zwai Elektronen un Protonierig dur H+ us em Stroma wird QB as Plastochinol (au Plastohydrochinol, PQH2) in d Membranmatrix entloo, wu si frei din cha diffundiere. E dritt Plastochinon (QC) vermittlet doderby dr Uusdusch vu QB mit dr Chinonpool vu dr Membran.[18]
S verblibe oxidiert P680•+-Radikal, wu mit eme Redoxpotenzial vu iber +1 V[19] e seli stark Oxidazionsmittel isch, wird dur e Tyrosinräscht (Tyrz) reduziert. Dää wird derno dr Mangan-Cluster vum Kompläx, wu Wasser spaltet regeneriert.[20][21]
PQH2 diffundiert in dr Thylakoidmembran zum Cytochrom-b6f-Kompläx. Dr Kompläx het e zäntrali Roll in dr Elektronetransportchette un vermittlet zwee Elektronenibergäng, wu nochenenander cheme. S erscht Elektron wird PQH2 dur s Rieske-Protein, e 2-Yyse-2-Schwäfel-Protein, entzoge. Des Protein verdankt sy Name em Entdecker John S. Rieske, wu anne 1964 s Protein mit Mitarbaiter het chennen isoliere.[22] In dr membranintegrale b-Unterainhait vum Cytochrom-b6-Kompläx het s zwai Cytochrom vum b-Typ. Die iberdrage s zwait Elektron vum Semichinon-Radikal PQH•- uf e Plastochinon, wu dur H+ us em Stroma protoniert wird (Q-Zyklus[23][24]). D PQH2-Reoxidazion am Cytochrom-b6f-Kompläx goht rund 5 ms un isch dodermit dr langsamscht Schritt, wu d Rot vu dr Elektronetransportchette limitiert.[25][24][26] Des lyt wahrschyns an dr notwändige Konformazionsänderig vum Rieske-Protein un dr yygschränkte Diffusion vum PQH2 zum aktiven Zäntrum vum Kompläx, wu in ere dief yygsänkte Däsche lyt.[24]
In Summa wird PQH2 zue PQ reoxidiert, ai Elektron wird im Q-Zyklus recyclet un ai Elektron wird schließlig uf s Protein Plastocyanin (PC), wu je ai Elektron cha ufnee, iberdrait. Bi däre Wytergab wird usserdäm pro Elektron ai Proton us em Stroma vu dr Chloroplaschte in s Thylakoidlume transloziert.
Plastocyanin isch e wasserlesli chupferhaltig Protein, wu s Chupferatom vun em zwische dr Oxidazionsstapfle CuI un CuII wächslet un dodermit e Elektron cha ufnee un wider abgee. S diffundiert derby im Lume vum Thylakoid. Vu syre Funkzion här isch s ähnli zum Cytochrom c vu dr Otmigschette. In e Dail Cyanobakterien un Alge wird Plastocyanin dur d Variant Cytochrom c6 ersetzt.
S reduziert Plastocyanin, wu vum Cyt-b6f-Kompläx freigsetzt wird, chunnt schließlig an dr Photosyschtemkompläx I (PS I). Im PS I het s au ne Chlorophyll-Molekilbaar, s het e Absorpzionsmaximum bi rund 700 nm un e Redoxpotenzial E'0=+0,45 V. Wie P680 im PS II wird s Chlorophyll-a-Baar im Reakzionszäntrum in e energetisch hechere Zuestand versetzt (E'0=−1,3 V) un git e Elektron ab. Doderby entstoht e positiv Chlorophyllradikal (Chl-a•+), wu ne Elektron us em aadockte Plastocyanin ufnimmt un doderdur zue Chl-a reduziert wird. PC cha no dr Abgab vum Elektrons wider dur dr Cyt-b6f-Kompläx reduziert wäre.
S Elektron, wu dur s Chlorophyll-a-Molekil abgee woren isch, drifft zerscht uf e erschten Akzeptor, A0. Mer goht dervu uus, ass es sich doderby um e bsunder Chlorophyll handlet.[27] Des isch e uugwehnli stark Redukzionsmittel un reduziert e feschtbunde Phyllochinon (Q, au A1). Vu dert uus wird s Elektron an e Yyse-Schwäfel-Zäntrum iberdrait (Fx) un chunnt iber wyteri Yyse-Schwäfel-Zäntre (FA, FB) schließlig uf Ferredoxin (Fd). Des lyt an dr Stromasyte vu dr Thylakoidmembran. S reduziert Fd bindet an ere Ferredoxin-NADP-Reduktas un reduziert NADP+ zue NADPH.
Dr Elektronetransport isch an e Protonetranslokazion vum Stroma in s Lume kupplet. Pro vollständig vu Wasser uf NADPH iberdrait Elektron wäre drei Protonen in s Lumen transloziert.[28] Dodermit entstoht e Protone-Konzentrazionsunterschid (ΔpH) un au ne eläktrisch Fäld iber dr Thylakoidmembran, wu zämme protonmotorischi Chraft ΔμH+ (engl. proton motive force) gnännt wird. Di protonmotorisch Chraft wird noch em Peter Mitchell syre chemiosmotische Theory dur d ATP-Synthas gnutzt go mit Hilf vu 14 Protone drei ATP us ADP un anorganischem Phosphat erzyge.[29][30][31] Dää Vorgang wird au Photophosphorylierig gnännt. In dr Bilanz wäre dur dr linear Elektronetransport unter Berucksichtigung vum Q-Zyklus je Elektron drei Protone transportiert. Wel fir d Erzygig vu drei ATP 14 Protone brucht wäre, wären ATP un NADPH nit in eme Verhältnis vu 9:7 erzygt.
Kompläx, wu Suurstoff produziert
[ändere | Quälltäxt bearbeite]

D Elektroneluck vum Chlorophyllradikal im Reakzionszäntrum vum PS II mueß no zuegmacht wäre. Doderby wäre d Elektronen us Wasser (E'0=+0,82 V) zoge. An däre „Wasserspaltig“ sin e Tyrosinräscht vu dr D1-Unterainhait (Tyr161 = TyrZ) un e Mangan-Cluster bedailigt. S Chl a-Radikal entziet däm reaktive Tyrosinräscht e Elektron, säll wird doderdur zuen eme Tyrosinradikal oxidiert. Ass s Tyrosinradikal wider reduziert wird, brucht s e Elektron us eme bsundere Metallkompläx, em Mangan-Calcium-Cluster.
Dr Mangan-Calcium-Cluster isch dr wichtigscht Bstanddail vum Kompläx, wu dr Suurstoff produziert („oxygen-evolving complex“, OEC). Dr Cluster isch in dr Hauptsach us vier Manganatom, eme Calciumatom un eme Chloratom ufböue. Die uugwehnli Zämmesetzig vu fimf Metallatom git s arg sälte. S isch nume ai Byschpel vun ere CO-Monohydrogenas bekannt, wu anderi Metallatom (Fe, Ni) iber Schwäfelbrucke ne ähnligi Zämemsetzig uswyse.[35] Funkzionäll cha s Calcium- dur e Strontium-, un s essenziäll Chlor- dur e Bromatom uusduscht wäre.[36][33]
Di gnau Geometry vu dr Metallatom isch nonig ganz gchlert, drotz ass es intänsivi Studie derzue git. Villicht lige d Metallatom mit Suurstoffatome wie in dr Abbildig rächts vor un wäre vu verschidene Aminosyrine vu dr D1- bzw. CP43-Unterainhait kompläxiert.[37][38] Doderby wäre zwai Molekil Wasser vu dr Manganatom bunde.[39]
Dr Mn4CaOx-Cluster funkzioniert wie ne Art Battery. Nodno gän drei Manganione je ai Elektron ab un wächsle zwischen dr Oxidazionsstapfle MnIII un MnIV (vgl. Abbildig). Doderdur cha s verschideni Oxidazionsstapfle vum Cluster (S0 bis S4) gee. Wel d Elektronen im Cluster stark delokalisiert sin, isch s Nänne vun ere gnauen Oxidazionsstapfle vu dr Manganatom aber schwär. S isch driber dischpetiert wore, eb s viert Manganatom im S4-Zuestand e formali Oxidazionsstapfle vu V het.[16] Wahrschynlige isch aber, ass sich e Oxoradikal bildet (vgl. Abbildig).[33][39]
Erscht wänn vier Elektronen an s TyrZ abgee wore sin (S4), wird Suurstoff bildet un freigsetzt un dr Cluster isch wider im reduzierte Zuestand (S0). Dää Zyklus wird au „Kok-Zyklus“ gnännt.[40] Fir s Freisetze vu aim Molekil Suurstoff brucht s insgsamt vier Exziton, des hän d Untersuechige vum Pierre Joliot un em Bessel Kok zaigt.
Vermuetli deet e schrittwys Oxidiere vum Wasser e Hufe reaktivi Suurstoffspezies (ROS) freisetze. Mit däm obe gschilderete Mechanismus wird des Risiko also minimiert. S Bsunder an däm Enzym isch aber nit, ass es Suurstoff freisetzt (Katalase chennte des au), sunder ass es zwische zwai Wassermolekil e O–O-Bindig uusbildet.[39]
Zyklischi Photophosphorylierig
[ändere | Quälltäxt bearbeite]E zyklische Elektronetransport in dr Liechtreakzion git s nume bim Photosyschtem I. Doderby wäre d Elektrone vum Ferredoxin (Fd) nit an d NADP+-Reduktas wytergee, sunder zruck zum Cytochromkompläx gfiert. Doderdur cheme si zruck zum Photosyschtem I un zum Reakzionszäntrum. Doderdur wird kai NADPH bildet, nume ATP. Wel s e Chraislauf isch, sait mer däm Vorgang au zyklischi Photophosphorylierig.
Pseudozyklische Elektronetransport
[ändere | Quälltäxt bearbeite]Im nit-zyklische Elektronetransport git Ferredoxin (Fd) sy Elektron uf NADP+ ab, so dass NADPH entstoht. Dur dr hoch Redukzionsgrad git s aber au d Megligkait, ass es Elektron an Suurstoff (O2) iberdrait wird. Doderby entstoht s Superoxidradikal in dr sognännte Mehler-Reakzion.[41] Si isch no dr Arbeite vum Alan H. Mehler gnännt wore:[42][43]
Des Radikal ghert zue dr hoch reaktive Suurstoffspezies (ROS) un cha Protein, Membranen un d DNA schedige. Wäge däm wird s zerscht mit ere Superoxiddismutas (EC 1.15.1.1) zue Suurstoff un Wasserstoffperoxid (H2O2) disproporzioniert. D Reakzion cha aber au spontan ablaufe:
Wasserstoffperoxid isch au ne ROS un wird dur e Ascorbat-Peroxidas (EC 1.11.1.11), wu in dr Thylakoidmembrane vorhanden isch, uuschedli gmacht. Bi däre Entgiftig wird Ascorbat zue Monodehydroascorbat oxidiert, derwylscht H2O2 zue Wasser reduziert wird. Dur s vorhande Ferredoxin wird Monodehydroascorbat wider zue Ascorbat regeneriert. In dr Bilanz ergit sich dodermit:
un insgsamt:
Us dr Wasserspaltig am PS II wäre normalerwys vier Elektrone freigsetzt un uf Ferredoxin iberdrait. Die wäre im Verlauf vu dr Mehler-Reakzion wider fir d Wasserbildig verwändet, des nännt mer wäge däm e pseudozyklische Elektronetransport. Wie im zyklische Elektronetransport wäre d Elektrone nit uf NADP+ iberdrait. Dää Zyklus wird in dr Literatur au Wasser-Wasser-Zyklus (water-water cycle) gnännt: E Molekil Wasser wird gspalten un speter e anders wider erzygt.[44] In dr Gsamtbilanz wird also formal d Wasserspaltig vum PS II umgchehrt un kai Redukzionsequivalänt ufböue.
D Mehler-Reakzion dritt vor allem uf, wänn vyl reduziert NADPH un dodermit au vyl reduziert Ferredoxin vorlyt. Bim pseudozyklischen Elektronetransport wird wie bim zyklische nume e Protonegradiänt im Q-Zyklus erzygt, so dass ATP generiert wird. Normalerwys fählt unter däne Bedingigen aber ADP zum Ufböu vu ATP, so dass nume ne hoche Protonegradiänt entstoht. Iberschissigi Aaregigsenergy cha dodermit lycht in Wermi umgwandlet wäre. Villicht dient des as „Iberlaufväntil“ unter hoche Liechtsterkine un schitzt doderby s Photosyschtem II nit numen in Pflanzen, sunder au in allne photosynthetisch aktiven Algen un Cyanobakterie.[45] Des setzt aber voruus, ass gnue Ascorbat vorlyt.[44]
Zwai Molekil Monodehydroascorbat chennen aber au zue Ascorbat un Dehydroascorbat disproporzioniere. Go Dehydroascorbat z regeneriere, wird Glutathion oxidiert, wu derno dur e Glutathion-Reduktas (EC 1.8.1.7) reduziert wird. Doderby wird NADPH verbruucht. Formal änderet des aber nyt an dr obe bschribene Gsamtbilanz.
Regulation vum Elektronetransport vu dr oxygene Photosynthes
[ändere | Quälltäxt bearbeite]Wäre Elektronen oder Aaregigszueständ uukontrolliert uf Suurstoff iberdrait, no cha s zue Schäden am Photosynthesapparat, an dr Membransyschtem oder dr Protein chuu. Wäge däm isch e Regulation vum Elektronetransport arg wichtig. Au uf dr Bedarf vu dr Pflanze an NADPH un ATP mueß er aabasst wäre.
Laterali Uuglychverdailig vu dr Photosyntheskompläx in dr Thylakoidmembran
[ändere | Quälltäxt bearbeite]
D Photosyntheskompläx PS II, Cytochrom-b6f un PS I sin in d Thylakoidmembran yybettet. D Photosyschtem sin aber nit glychmäßig lateral verdailt. PS II lyt wäge syre Interakzion mit dr Liechtsammelkompläx in dr bigene Beraich vum Thylakoid (Granalamelle), di stromal Syte vu PS I mueß fir d NADP+-Redukzion frei zuegängig syy un lyt wäge däm in Beraich, wu em Stroma zues exponiert sin. Doderzue ghere uubigeni Beraich (Stromalamelle, Nr. 8 in Abbildig rächts), un d Randberaich vu dr Granabygi (margins un end membranes). Au d ATP-Synthas brucht Blatz uf dr Stromasyte vu dr Membran un isch wäge däm nume in däne Beraich z finde.[46]
Di ryymli Drännig vu dr baide Photosyschtem soll au ne uukontrolliert Iberfließe (spillover) vu dr Exzitone vum PS-II- zum PS-I-Kompläx verhindere. Derwylscht nämli Exzitone hegscht effiziänt vu dr Antänne zum PS I abfließe (funnel trap), cha d Aaregigsenergy sogar us em PS II wider ussegumpe (shallow trap). Wäge däm deete bin ere diräkte Nochberschaft vu dr baide Photosyntheskompläx d Exzitonen uf Cheschte vum PS II hyfiger em PS I zuegschlaa wäre.
Umverdailig vu dr Liechtsammelkompläx LHC-II (state transitions)
[ändere | Quälltäxt bearbeite]Unter bstimmten Umständ chenne d Photosyschtem unterschidli stark aagregt wäre, wel si unterschidligi Absorpzionsspäktre hän. Im Schwachliecht, wänn di baide Photosyschtem nonig an ihre Kapazitetsgränz schaffe, wird PS I sterker aagregt wie PS II. Wäge däm chunnt s zuen ere Umverdailig vu dr Liechtsammelkompläx LHC-II vum PS II hii zum PS I, go dr uuglychmäßigen Aaregig entgegestyre. Perzipiert wird dää Zuestand vu dr Pflanze iber dr Redoxzuestand vum Plaschtochinon-Pool. Akkumuliert s reduziert Plaschtochinol in dr Thylakoidmembran, wird e Proteinkinas aktiviert, wu LHC-II-Kompläx phosphoryliert. Derno migriere die Kompläx zum PS I. Doderdur wird s PS I uf Cheschte vum PS II versterkt aagregt un s iberschissig Plaschtochinon wird prozessiert. Dr Plaschtochinon-Pool lyt derno nit vollständig reduziert vor.
D Umverdailig vu dr LHC wird state transitions (ängl. „Zuestandswächsel“) gnännt: Sin alli LHC-II mit PS II assoziiert, lyt dr Zuestand 1 (state 1) vor. Sin si aber mit PS I assoziiert, lyt dr Zuestand 2 vor (state 2).
Thermischi Dissipation vu iberschissiger Energy
[ändere | Quälltäxt bearbeite]Unter bstimmten Umständ wird meh NADPH un ATP erzygt, wie vu dr Dunkelreakzion cha verbrucht wäre. Des cha s zem Byschpel gee bin ere hoche Liechtintensitet oder au bi hoche Tämperaturen oder Druckesträss, wänn d Spalteffnige zue sin go dr Wasserverluscht verringere. Dodermit isch au d Ufnahm vu CO2 reduziert, so dass d Dunkelreakzion dur d CO2-Konzäntrazion limitiert un verlangsamt wird. Bi nidere Tämperaturen isch vor allem di enzymatisch Aktivitet vum Stoffwächsel verlangsamt, d Elektronetransfer in dr Liechtreakzion aber chuum, so dass ATP un NADPH im Iberschuss erzygt wäre. Wel dr Elektronetransportchette in däne Fäll kai Akzeptor fir di gwunnene Elektrone z Verfiegig stoht, isch d Wahrschynligkait fir d Bildig vu reaktive Suurstoffspezies (ROS) hecher, wu dr Photosynthesapparat un d Zälle chenne bschädige.
Go di iberschissig Energy abzlaite, dritt Zeaxanthin as Dail vum Xanthophyllzyklus in Akzion. Doderby bindet Zeaxanthin an e Unterainhait vum LHC-II-Kompläx un cha d Energy vu aagregte Chlorophyllmolekil ufnee un as Wermi abgee.[47] Eppe 50–70 % vu allne absorbierte Photone wäre uf die Art in Wermi iberfiert.[48] Bi Chiiselalge wird Diatoxanthin statt Zeaxanthin in eme ähnlige Zyklus brucht.
Zue dr Ablaitig vu iberschissiger Liechtenergy drait näbe dr obe gnännte Reakzione bsundersch bi Druckesträss au d Reassimilazion vum dur Photorespirazion freigsetzte CO2 by, dr Aadail vu dr ainzelne Prozäss am Verbruuch vu dr Liechtenergy variiert aber in Abhängigkait vum untersuechte Blattgwäb (Palisade- oder Schwammparenchym), vu dr untersuechte Pflanzenart un vum Stoffwächseltyp (C3- oder C4-Pflanze).[49]
Anoxygeni Photosynthes
[ändere | Quälltäxt bearbeite]


Vyl phototrophi Bakterie mache ne anoxygeni Photosynthes. Doderby isch ai ainzig Photosyschtem involviert, entwäder mit eme Reakzionszäntrum vum Typ I (PS I) oder vum Typ II (PS II). Im Gegesatz zue Cyanobakterie un phototrophe Eukaryote het s in däne Reakzionszäntre Bakteriochlorophyll. Wie bi dr oxygene Photosynthes wird des Chlorophyllbaar (special pair) dur Liechtenergy aagregt, syy Redoxpotential fallt doderdur stark ab. Dur des git s aagregt Bakteriochlorophyllbaar sy Elektron an e primäre Akzeptor ab. Je no Reakzionszäntrum isch dr erscht stabil Elektronenakzeptor entwäder en Yyse-Schwäfel-Protein (PS I) oder e Chinon (PS II). Von dert us wird s iber e Q-Zyklus schließli zruck zum Reakzionszäntrum glaitet (zyklische Elektronetransport). Bi däm Vorgang wird e Protonekonzäntrazionsunterschid ufböue, wu ne ATPas derdur bedribe wird. Wel ATP, derfir aber kai Redukzionsmittel ufböue wird, mueß des us extärnen Elektronedonatore (anorganischi oder organischi Verbindige) bildet wäre.
Näbe däm zyklischen Elektronetransport git s au ne nit-zyklische, wu Redukzionsmittel diräkt derdur bildet wäre. Go d Elektronelucke, wu doderdur etnstoht, z fille, wären extärni Elektronedonatore verwändet, zem Byschpel H2S, zweewärtigi Yyse-Ione (Fe2+) oder Nitrit (NO2−)[50] Doderby entstoht elemäntare Schwäfel (S), dreiwärtigi Yyseione (Fe3+) oder Nitrat (NO3−) as Reakzionsprodukt.
Dur s Fähle vun eme Kompläx, wu Wasser spaltet, cha Wasser bi dr anoxygene Photosynthes nit as Elektronequälle verwändet wäre, derzue längt s Redoxpotenzial vum Bakteriochlorophyll-Pigmänt nit fir e Wasserspaltig. Bi dr anoxygene Photosynthes cha dodermit nie Suurstoff entstoh.
Anoxygeni Photosynthes vum Typ II
[ändere | Quälltäxt bearbeite]Grieni Nitschwäfelbakterie (Chloroflexi) un Purpurbakterie (Schwäfelpurpurbakterien un schwäfelfreji Purpurbakterie) verwände bi dr anoxygene Photosynthes e Reakzionszäntrum vum Typ II. S Absorpzionsmaximum vum Bakteriochlorophylls a bzw. b im Zäntrum lyt bi 870 nm. Chunnt des dur Liechtenergy in e aagregte Zuestand, gheit sy Standardredoxpotänzial E'0 vu +0,6 V uf −0,8 V stark ab. S git syn Elektron uf e Bakteriophäophytin ab. Vu dert uus chunnt s iber e fescht bunde Menachinon (QA) schließlig uf e assoziiert Chinon (QB, E'0=+0,0 V). Wänn des imfall dur zwai Elektrone zum Chinol reduziert wird, verlosst s dr PS II-Kompläx un diffundiert in dr Membran zuen eme Cytochrom bc1-Kompläx. Im Q-Zyklus wäre d Elektronen uf dää Kompläx iberdrait, doderby wird e Protonegradiänt (ΔμH+) ufböue. Dää bedrybt e ATPas, wu ATP derdur generiert wird. S Elektron im Cytochrom bc1-Kompläx chunnt vu dert us uf e Cytochrom c (Cyt c2), wu membranassoziiert im Cytoplasma zum Reakzionszäntrum retuurdiffundiert. Dert wird d Elektronelucke dur Oxidazion vum Cyt c2 zuegmacht, e neie zyklische Elektronetransport cha aafange.[51]
Go Redukzionsmittel bilde, oxidiere schwäfelfreji Purpurbakterie (Rhodospirillum, Rhodobacter) un Grieni Nitschwäfelbakterie (z. B. Chloroflexus) organischi Verbindige; si wachse dodermit photoorganothroph. Grieni Nitschwäfelbakterie chenne derzue Wasserstoff (H2) as Elektronedonator bruche, si sin wäge däm au photolithotroph.
S Chinon cha syni Elektronen aber au in eme nit-zyklischen Elektronetransport uf NAD(P)+ iberdrage, was e NADH-Chinon-Oxidoreduktas katalysiert. S Redoxpotänzial vum Chinon isch aber z hoch, go NAD(P)+ (E'0=−0,32 V) diräkt reduziere. Wäge däm wird fir dää revertierte (rucklaifigen) Elektronetransport Energy in Form vu dr protonemotorische Chraft ΔμH+ aazapft. Wel s Elektron us em Chraislauf gnuu wird, verblybt s Bakteriochlorophyll a im Reakzionszäntrum zerscht as positiv glade Radikal. Go die Lucke zuemache, wären Elektronen us extärne Quälle brucht. Schwäfelpurpurbakterie (z. B. Chromatium, Ectothiorhodospira) oxidiere oderzue H2S zue Schwäfel, wu intra- oder extrazällulär abglageret wird.[52]
Bi Rhodopseudomonas viridis, eme Purpurbakterium, sin d Kinetike vu dr Elektroneniberdragig bekannt.[53] No Aaregig vum Bakteriochlorophyllenbaar chunnt s Elektron no 3 ps uf s Bakteriophäophytin. Vu dert uus wird s no 200 ps uf s Menachinon QA transferiert un chunnt vu dert uus relativ langsam (6 µs) zum Ubichinon QB. D Elektronelucke im Bakteriochlorophyllbaar vum Reakzionszäntrum wird dur Cytochrom c2 no 0,27 µs zuegmacht.
Anoxygeni Photosynthes vum Typ I
[ändere | Quälltäxt bearbeite]Grieni Schwäfelbakterie (z. B. Chlorobium) bzw. au Heliobacteriaceae (Heliobacterium) hän e Reakzionszäntrum vum Typ I. Bi dr erschtere lyt e Bakteriochlorophyll a mit eme Absorpzionsmaximum vu 840 nm, bi Heliobakterie ne Bakteriochlorophyll g mit 798 nm vor.[54][55] Im zyklischen Elektronetransport chunnt s Bakteriochlorophyll a (E'0=+0,3 V) no Aaregig dur Liecht in en energetisch hechere Zuestand (E'0=−1,2 V) un git sy Elektron an e wyter Bakteriochlorophyll ab. Vu dert uus chunnt s iber e fescht bunde Menachinon un verschideni Yyse-Schwäfel-Zäntre (Fx, FA/FB, E'0=−0,5 V) uf Ferredoxin (Fd). Fd git sy Elektron an in dr Membran lokalisiert Menachinon ab, wu in e Q-Zyklus yygspyst wird. Doderby wird e Protonekonzäntrazionsunterschid an dr Membran ufböue. Iber e Cyt bc1-Kompläx wird schließlig e Tetracytochromainhait (Cyt c553) reduziert, wu zue dr PS I retuurchunnt go d Elektronelucken im Reakzionszäntrum zuemache.[55]
Au do git s d Megligkait vun eme nit-zyklischen Elektronetransport: Wänn d Elektrone vum Yyse-Schwäfel-Zäntrum uf e Ferredoxin iberdrait wäre, chemme si vu dert uus uf NAD(P)+. S letschter katalysiert e Ferredoxin-NADP+-Oxidoreduktas. Wel s Redoxpotänzial vum Fd niderer isch wie des vu NAD(P)+, cha die Reakzion ohni Energyufwand ablaufe. Go di entstanden Elektronelucke bim Bakteriochlorophyll im nit-zyklischen Elektronetransport fille, oxidiere zem Byschpel Grieni Schwäfelbakterie H2S zue Schwäfel.
Bi Heliobakterie isch no kai Wäg fir s Fixiere vum CO2 idäntifiziert wore. Si hän kai RuBisCO bzw. kai ATP-Citrat-Lyas (fir dr reduktiv Citratzyklus), derfir verjääse si organischi Verbindige wie Pyruvat, Lactat, Butyrat un Acetat.[56] E Dail Stämm chennen au mit Zucker un mit Ethanol wachse. Dodermit wachse si heterotroph.
Anoxygeni Photosynthes in dr Diefsee
[ändere | Quälltäxt bearbeite]Di maischte photosynthetisch aktiven Organisme nutze d Sunnestrahlig as Liechtenergy, wäge däm findet d Photosynthes in dr Hauptsach an dr Ärdoberflechi statt. An eme rund 2.500 Meter diefe schwarze Raiger am oschtpazifische Ruggen isch mittlerwyli ne Grien Schwäfelbakterium entdeckt wore, wu ne anoxygeni Photosynthes mit Schwäfelwasserstoff oder Schwäfel bedrybt.[57] In däre Diefi chunnt kai Sunneliecht zue dr Bakterie. Syni usserscht liechtempfindlige Chlorosome chenne aber s schwach Liecht vu dr hydrothermale Quällen uffange un fir d Photosynthes nutze.[58]
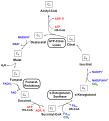
Chohlestoffdioxid-Assimilation
[ändere | Quälltäxt bearbeite]D Redukzionsäquivalänt un s ATP, wu in dr Liechtreakzion gwunne wäre, wäre brucht zum Ufböu vu Chohlehydrat. Doderfir git s verschideni Megligkaite:[59]
Calvin-Zyklus
[ändere | Quälltäxt bearbeite]Alli Organisme mit oxygener Photosynthes un au e Dail Mikroorganisme mit anoxygener Photosynthes (Purpurbakterie) chenne Chohlestoffdioxid im sognännte Calvin-Zyklus fixiere. Doderby kondensiert CO2 an Ribulose-1,5-bisphosphat (RubP), was dur s Enzym Ribulose-1,5-bisphosphat-Carboxylas/-Oxygenas (RuBisCO) katalysiert wird. Dur Redukzion wird Glycerinaldehyd-3-phosphat (G3P) unter Verbruch vu NADPH un ATP ufböue. D Reakzione finde bi Pflanzen in dr Stroma vu dr Chloroplaschte statt. D Enzym in däm Prozäss sin suurstoffunempfindli. D RuBisCO naigt aber derzue, Suurstoff statt em Chohlestoffdioxid z verwände (Photorespirazion), was d Effiziänz vu dr Chohlestoffdioxidfixierig verringeret. Us G3P wird Sterki un Fructos ufböue.
Di maischte Pflanze ghere zum Stoffwechseltyp vu dr C3-Pflanze, wu s im erschte noowysbare Zwischeprodukt im Stoffwächsel drei Chohlestoffatom (G3P) het. C4-Pflanze hän sich anatomisch un vum Stoffwächseltyp här an starki Sunnenyystrahlig aabasst. Doderby findet e rymli drännti CO2-Vorfixierig statt. CAM-Pflanze hän dergege d CO2-Fixierig vu dr Zyt här vorglageret un chenne znaacht in Regione mit ere große Drickini ihri Stomata ufmache.
Reduktive Citratzyklus
[ändere | Quälltäxt bearbeite]Im Zug vu dr anoxygene Photosynthes bi griene Schwäfelbakterie bzw. griene Nitschwäfelbakterie wird CO2 dur dr reduktiv Citratzyklus bzw. dr Hydroxypropionatzyklus assimiliert.
Heliobakterie
[ändere | Quälltäxt bearbeite]Heliobakterie gwinne Energy zwar in Form vu ATP dur ihri anoxygen Photosynthes, läben aber photoorganotroph. Si bruuchen organischi Verbindige (z. B. Verjäsigsprodukt) un böue dodrus Zällmatrial uf.
-
Calvin-Zyklus -
C4-Photosynthes vum Typ NADP-ME
-
Crassulaceae-Syyri-Stoffwächsel (CAM)
-
Reduktive Citrat-Zyklus
Energybilanz
[ändere | Quälltäxt bearbeite]Fir d Quantifizierig vum Effäkt vu dr Photosynthes im Verhältnis zue dr ufgwändeten Energy git s verschideni Greßine.
Dr Wirkigsgrad isch s Verhältnis vu dr Zuenahm vum Energyghalt bi dr Synthes vum Photosynthesprodukt zue dr fir d Photosynthes ufgwändete Liechtenergy, är isch also ne dimensionslose Quoziänt (0–1 oder 0–100 %). Au anderi Greßine fir s Photosynthesprodukt (z. B. Masse oder Stoffmängi) chenne zum Energyufwand ins Verhältnis gsetzt wäre. Die erhaltene Greßine nännt mer Effäktivitet, d Maßainhait vun ere entspricht dr gwehlte Greßi fir s Photosynthesprodukt (z. B. Gramm je Joule bzw. Mol je Joule).
Soll dr primer Effäkt vu dr Photosynthes vun eme Chloroplaschte oder eme Mikroorganismus dargstellt wäre, no wird dr Energyghalt (Maßainhait Joule), d Masse (Maßainhait Gramm) oder d Stoffmängi (Maßainhait Mol) vu aim vu dr erschte Synthesprodukt, in dr Regle Glucose, yygsetzt. Wänn e ganzi Pflanze bschaut wird, e Pflanzegsellschaft, e Mikroorganismepopulazion oder di global Photosynthes, no isch s ginschtig, wänn d Masse vu dr gsamte bildete Biodruckemasse (oder vum din enthaltene Chohlestoff) yygsetzt wird.
Bi dr Frog, wele Energyghalt s Liecht het, wu z Verfiegig stoht, git s verschideni Aasatzpinkt. Entwäder wird d Energy vum gsamte Späktrum vu dr Yystrahlig vu dr Sunne berucksichtigt. Oder s wird nume dää Dail vum Späktrum grächnet, wu prinzipiäll fir d Photosynthes nutzbar isch. Bi Pflanzen un Alge wird – je no Autor – zum Dail dr Wällelengineberaich vu 360 bis 720 nm aagnuu, zum Dail dää vu 360 bis 700 nm un zum Dail dää vu 400 bis 700 nm.[60] Dää Aadail vu dr Strahlig stellt di photosynthetisch nutzbar Strahlig dar (änglisch „photosynthetically active radiation“, Abchirzig „PAR“). Je no aagnummenem Wällelengineberaich lyt d Energy vu dr PAR bi 40 bis 50 Prozänt vu dr Energy vu dr gsamten Yystrahlig.
Wirkigsgrad
[ändere | Quälltäxt bearbeite]Dr theoretisch Wirkigsgrad vu dr Photosynthes git sich us em Verhältnis vu dr gwunnene chemische Energy zue dr absorbierte Energy vu dr elektromagnetische Strahlig :
Zum us 6 Mol CO2 im Calvin-Zyklus 1 Mol Chohlnhydrat D-Glucose ufböue, wäre Standardbedingige 2872 kJ brucht:[61]
Di brucht Energy wird dur NADPH + H+ un ATP z Verfiegig gstellt, wu bi dr Primärreakzion dur Liecht entstehn.
Dur Photolys vu Wasser wäre je Mol O2 2 Mol NADPH + H+ bildet. Di bildet Mängi ATP je Mol O2 hangt ab vom Q-Zyklus un lyt ohni Q-Zyklus bi 2 Mol un bi vollständigem Q-Zyklus bi 3 Mol. Bezogen uf d Bildig vu aim Molekil Glucose mien also 12 Mol NADPH un 12 Mol bzw. 18 Mol ATP in dr Sekundärreakzion z Verfiegig stoh.
Di molar frei Standardbildigsenthalpy fir NADPH + H+ lyt bi:
Di molar frei Standardbildigsenthalpy fir ATP us ADP + Pi lyt bi:
Wäge däm lyt dr Ertrag vu dr endergonische Liechtreakzion je Mol O2 zwische:
Sowohl wie au ligen iber dr molare freie Standardbildigsenthalpy fir d CO2-Fixierig vu 2872 kJ/mol.
In dr endergonische Liechtreakzion mien doderfir an baide Photosyschtem je 4 Exziton as Aaregigsenergy absorbiert wäre, also zmindescht 4 Mol Photone mit ere Wällelengi vu 680 nm am PS II un zmindescht glych vil mit ere Wällelengi vu 700 nm am PS I. D Energy vu dr Photone lyt bi:
Experimentäll isch an dr Quantenuusbyti aber e Bedarf vu 9 bis 10 Photonen ermittlet wore.[62] Wel 6 Mol Wasser gspalte woren isch go 1 Mol Glucose bilde, lyt di absorbiert elektromagnetisch Energy däge däm zwische:
Dodrus gän sich fir dr Wirkigsgrad Wärt zwische:
Wel in ere natyrligen Umgebig – also im Sunneliecht – nit nume Photone vum rote Dail vum Späktrum yystrahle, lyt d rächt (Brutto)-Wirkigsgrad bi maximal 20 %.[63]
Nettoprimärprodukzion
[ändere | Quälltäxt bearbeite]D Effektivitet vu dr Photosynthes bezogen uf s gsamt Sunneliecht, wu uf d Ärd yyfallt, losst sich eso aagee:[64]
| Gsamtyystrahlig | 100 % |
| dodervu d Helfti absorbiert, dr Räscht wird duregloo oder am Blatt reflektiert | 50 % |
| dodervu 3,2 % in d Bruttoprimärprodukzion, dr Räscht in Wermi umgwandlet | 1,6 % |
| dodervu schließli d Helfti as Nettoprimärprodukzion, di ander Helfti wird in dr Otmig verbruucht | 0,8 % |
Vu dr Pflanze wird also nume ne chlaine Dail vu dr Sunnenenergy, wu uf d Ärdoberflechi ufdrifft, gnutzt go Chohledioxid in dr Nettoprimärprodukzion zue Zällmatrial ufböue. Wel e Dail vu dr Energy brucht wird go dr Metabolismus ufrächthalte, wird dr oben abgschetzt (Brutto-)Wirkigsgrad vu 20 % no mee reduziert. Wäge däm sinkt dr (Netto)-Wirkigsgrad uf maximal 1 bis 2 %, abhängig vu dr Umwältbedingige, wu vorherrsche.[16]
Di gsamt Nettoprimärprodukzion im Johr wird uf 1,54•1011 Tonne pflanzligi Biomasse (Druckemasse) gschetzt.
E Hektar Laubwald böut im Johr rund 12 Tonne organischi Stoff in dr Nettoprimärprodukzion uf.[64] Die Biomasse entspricht eme Energyghalt vu 230•109 Joule.
Di ächt Effektivitet unter Fäldbedingige isch aber us verschidene Grind niderer, unter anderem wäge dr suboptimale Chohledioxidkonzäntrazion.
Abhängigkait vu abiotische Faktore
[ändere | Quälltäxt bearbeite]

D Photosynthes isch vu e baar abiotische Faktore abhängig, wu sich au gegesytig beyyflusse.[65] Doderby giltet s Gsetz vum Minimum: Wänn ain vu dr Faktore ne Gränz bildet, duet er s ganz Syschtem brämse. Go d Photosynthes quantifiziere cha mer di sognännt Photosynthesroot definiere. Si wird entwäder as Mängi vu produziertem Suurstoff oder as Glucose pro Zyt gmässe. Si chaan au as CO2-Ufnahm pro Zyt aagee wäre.
Chohledioxid
[ändere | Quälltäxt bearbeite]Wel in dr Photosynthes Chohledioxid fixiert wird, isch si abhängig vun ere gnuenig hoche Konzäntrazion. In dr hitigen Ärdatmosphäre lyt d CO2-Konzäntrazion bi 0,038 Volume-% (Vol.-%). In aim m3 Luft het s bi Ruumtämperatur dodermit 13 bis 18 mmol CO2. D CO2-Konzäntrazion in wässrige Lesige entspricht rund 10 µM, dää Wärt chaan au fir s Cytosol aagnuu wäre. Wel C3-Pflanze die Konzäntrazion nit aktiv chenne hecher mache, isch dert dr CO2-Level e Faktor, wu d Photosynthes begränzt. C4-Pflanze dien ATP-abhängig CO2 in dr Mesophyllzälle aahyfle (~ 70 µM). Dodermit sin si vu dr CO2-Mängi in dr Luft nit eso abhängig wie C3-Pflanze.
D Photosynthesroot vu C3-Pflanze stygt mit dr CO2-Konzäntrazion vu dr Luft (vgl. Abbildi rächts).[66] Erscht bi gnuenig hochem CO2-Ghalt iberdrifft si derno d Photosynthesroot vu dr C4-Pflanze. Unter atmosphärische Bedingige (0,03 Vol.-%) isch d Photosynthes bi C3-Pflanze däre vu C4-Pflanze alliwyl unterläge un suboptimal. Wänn d CO2-Konzäntrazion imfall z stark aabegoht, no iberstygt dr Chohlestoffverluscht vu dr Otmig dr Chohlestoffgwinn vu dr Photosynthes. Dr Punkt, wu sich d Otmig un d Photosynthes, also CO2-Fixierig un -Entstoh, in dr Woog sin, isch dr CO2-Kompänsazionspunkt Γ. Dää Punkt lyt bi C3-Pflanze bi ΓC3 = 0,005 bis 0,010 Vol.-% CO2- Konzäntrazion, e Settigung vu dr Photosynthesroot cha mer bi 0,05 bis 0,10 Vol.-% sää.[66] Bi C4-Pflanze lyt ΓC4 bi 0,001 Vol.-%. Dur ihri CO2-Bumbi chenne die Pflanze dodermit au bin eme arg nidere CO2-Level Photosynthes drybe.
In Gwägshyyser wird d CO2-Konzäntrazion dur Begasig hecher gmacht, des fiert iber e hecheri Photosynthesroot zuen ere greßere Biomasseuusbyti[67]. D Liechtintensitet derf doderby abner nit zuen eme begränzende Faktor wäre (vgl. dr negscht Abschnitt).[68]
E zue hochi CO2-Konzäntrazion (iber 0,1 Vol.%) cha dr Pflanze schade.
Liecht
[ändere | Quälltäxt bearbeite]As Prozäss, wu vu Liecht dribe wird, hangt d Photosynthes natyrlig in dr Hauptsach vu dr Liechtsterki ab. Je hecher die isch, umso hecher isch au d Photosynthesroot vun ere Pflanze. Wöäge däm gehen d Bletter vun ere Pflanze em Sunnestand noo un sin megligscht sänkrächt zum Liecht uusgrichtet. Au d Stellig vu dr Chloroplaschte wird fir e optimali Photosynthes uusglait. Bi Schwachliecht, zum Byschpel wänn s vil Wulke het, isch d Braitsyte vu dr Chlorplaschte em Liecht uusgsetzt, unter Starkliecht dergege d Schmalsyte. Die Reorientierig wird dur s Cytoskelett vermittlet.[69]
Wänn d Bstrahlig zuenimmt, zaige C3-Pflanze ne Settigung vu dr Photosynthesroot. Doderdur bringt e noo hecheri Liechtsterki kai zuesätzligi Staigerig vu dr Photosyntheeroot me. Dää Punkt isch dr Liechtsettigungspunkt.[70] Dr Grund doderfir isch di begränzt Mängi an CO2 in dr Atmosphäre. Die isch mit 0,03 Vol.-% bi C3-Pflanze suboptimal (vgl. Abschnitt obe). C4-Pflanze sin dergege im Verglych zue C3-Pflanze nit vu dr atmosphärische CO2-Konzäntrazion abhängig. Wäge däm chunnt s bi ihre Photosynthesroot nit zuene re Settigung bin ere hechere Liechtintensitet – sälbscht im vulle Sunneliecht – un si isch alliwyl liechtlimitiert.
An nidereri Liechtsterkine sin di sognännte „Schattepflanze“, an hecheri di sognännte „Sunnepflanzen“ aabasst. Au innerhalb vu dr nämlige Pflanze cha s zuen ere analoge Differenzierig vu dr Blattform chuu. Zem Byschpel git s bi dr Bueche dicki, chlaini Sunnebletter, derwylscht in Bodenechi dinni, großi Schattebletter uusbildet wäre.[71][72] Au s Palisadeparenchym isch bi dr Sunnebletter vilschichtiger, so dass di stark Sunnestrahlig cha uusgnutzt wäre.
Sunnepflanze (bzw. Sunnenbletter) hän erscht bi hoche Liechtsterkine ne hochi Photosynthesroot, d Liechtsettigung chunnt vil speter wie bi Schattepflanze (bzw. (Schattebletter). Die chenne dergege scho bi gringe Liechtsterkine Photosynthes bedrybe. Die isch aber nidererer wie bi Sunnepflanze, wel s schnäll zuen ere Liechtsettigung chunnt (vgl. au Abbildig).
Bi zue nidere Liechtsterkine lauft d Photosynthes mit ere arg gringen Effiziänz ab, so dass dr Chohlestoffgwinn (un d Produkzion vu Suurstoff) gringer isch wie dr Chohlestoffverluscht (un dr Suurstoffverbruuch) in dr Otmig. Dr Punkt, wu d Photosynthes un d Otmig im Glychgwicht sin, isch dr Liechtkompänsazionspunkt.[65] Dää isch bi C4-Pflanzen am hegschte. Schattepflanze hän dr gringscht Liechtkompänsazionspunkt un chenne wäge däm au bi seli nidere Liechtintänsitete no Netto-Photosynthes drybe.
E zue hochi Liechtmängi cha zue Schäde (Photodestrukzion) un dodermit zuen ere Verminderig vu dr Photosynthesroot fiere. Des git s zem Byschpel bi Schattepflanze, wu zmols em diräkte Sunneliecht uusgsetzt wäre. Au s Sunneliecht bi nidere Tämperature cha wäg dr vermindereten Enzymaktivitet zue Schäde fiere.
Wasserversorgig un Luftfychtigkait
[ändere | Quälltäxt bearbeite]Wasser goht zwar in d Photosynthesglychig yy, isch fir di biochemisch Reakzion aber alliwyl gnue vorhande. S wird gschetzt, ass 1875 km³ Wasser pro Johr in dr Photosynthes umgsetzt wäre.[73] Dr CO2-Yystrom in d Bletter goht aber dur d Spalteffnige, wu – je no Luftfychtigkait oder Wasserversorgig vum Blatt – uffe oder zue sin. Doderdur wirkt sich d Luftfychtigkait wie au d Wasserversorgig vu dr hechere Pflanzen iber d Wurzle (Wassersträss, Druckesträss)[74] uf d Photosyntheslaischtig uus: Bi Drickini sin d Spalteffnige dur d Schließzälle zuegmacht, go d Pflanze schitze vor em Uusdreckne. Doderdur chunnt aber chuum no CO2 in s Blatt, so dass des zum limitierte Faktor wird. C4-Pflanze sin dur ihri CO2-Aarycherig nit eso stark droffe wie C3-Pflanze (vgl. obe). E speziälli Aabassig an Wassermangel isch dr Crassulaceä-Syristoffwächsel bi dr sognännte CAM-Pflanze.
Tämperatur
[ändere | Quälltäxt bearbeite]| Pflanzetyp | Mindeschttämperatur | Tämperaturoptimum | Tämperaturmaximum |
| C4-Pflanze | 5 bis 7°C | 35 bis 45°C | 50 bis 60°C |
| C3-Pflanze | −2 bis 0°C | 20 bis 30°C | 40 bis 50°C |
| Sunnepflanze | −2 bis 0°C | 20 bis 30°C | 40 bis 50°C |
| Schattepflanze | −2 bis 0°C | 10 bis 20°C | 40 bis 50°C |
| Immergrieni tropischi Laubbaim | 0 bis 5°C | 25 bis 30°C | 45 bis 50°C |
| Laubbaium in dr gmäßigte Braitine | −3 bis −1°C | 15 bis 25°C | 40 bis 45°C |
| Nodelbaim | −5 bis −3°C | 10 bis 25°C | 35 bis 40°C |
| Flächte | −15 bis −10°C | 5 bis 15°C | 20 bis 30°C |
Bi dr Photosynthes handlet s si zum Dail um biochemischi Reakzione. Wie ne jedi (bio)chemischi Reakzion isch die au vu dr Tämperatur abhängig – im Gegesatz zue dr photochemische Prozäss. Erscht ab ere Mindeschttämperatur cha d Photosynthes ablaufe, si lyt bi froschtherte Pflanze zem Byschpel bi −1 °C.[76] (vgl. auch untenstehende Tabelle[66]). Je mee d Tämperatur aastygt, je mee nimmt d Photosynthesroot zue. No dr van ’t Hoff’sche RGT-Regle verdopplet sich doderby allgmain d Reakzionsgschwindigkait bine ere Tämperaturhecherig um 10 °C. D Photosynthes chunnt schließli zuen eme Tämperaturoptimum. Bi dr Pflanze in dr gmäßigte Braitine lige die Optima bi 20 bis 30 °C. Bi thermophile Cyanobakterie lyt s Tämperaturoptimum aber bi 70 °C.
Wänn d Tämperatur iber des Optimum stygt, goht d Photosyntheslaischtig wider aabe wäg dr allmeenige Denaturierig vu dr Enzym un hert schließli ganz uf.
Chlorophyllghalt
[ändere | Quälltäxt bearbeite]Dur dr hoch Chlorophyllghalt in dr Zälle wird dää nie zuen eme Gränzfaktor vu dr Photosynthes.[77] S git nume gwiisi Variazione im Chlorophyllghalt bi Sunne- un Schattenpflanze. Di letschtere hän e hechere Ghalt wie Sunnenpflanze un bsundersch großi Grana. Au di greßeren Antänne vu dr Schattenpflanze wyse ne hecher Chlorophyll a/b-Verhältnis uf wie d Sunnepflanze. Des macht d Grienlucke e weng besser zue.
Fueßnote
[ändere | Quälltäxt bearbeite]- ↑ Madigan MT, Martinko JM: Brock Mikrobiologie. München, 2006: 613-614 ISBN 3-8273-7187-2
- ↑ Griffin BM, Schott J, Schink B: Nitrite, an electron donor for anoxygenic photosynthesis. In: Science 316 (2007): 1870 doi:10.1126/science.1139478
- ↑ Madigan MT, Martinko JM: Brock Mikrobiologie. München, 2006: 613-614 ISBN 3-8273-7187-2
- ↑ Madigan MT, Martinko JM: Brock Mikrobiologie. München, 2006: 621 ISBN 3-8273-7187-2
- ↑ Madigan MT, Martinko JM: Brock Mikrobiologie. München, 2006: 613-614 ISBN 3-8273-7187-2
- ↑ Madigan MT, Martinko JM: Brock Mikrobiologie. München, 2006: 456 ISBN 3-8273-7187-2
- ↑ Madigan MT, Martinko JM: Brock Mikrobiologie. München, 2006: 613-614 ISBN 3-8273-7187-2
- ↑ Madigan MT, Martinko JM: Brock Mikrobiologie. München, 2006: 444-447 ISBN 3-8273-7187-2
- ↑ Madigan MT, Martinko JM: Brock Mikrobiologie. München, 2006: 447 ISBN 3-8273-7187-2
- ↑ Madigan MT, Martinko JM: Brock Mikrobiologie. München, 2006: 448-449 ISBN 3-8273-7187-2
- ↑ Madigan MT, Martinko JM: Brock Mikrobiologie. München, 2006: 621 ISBN 3-8273-7187-2
- ↑ David L. Nelson und Michael M. Cox: Lehninger Principles of Biochemistry. 5. Auflage. Freeman, New York, NY 2008, ISBN 978-0-7167-7108-1; S. 761
- ↑ Bryant, DA. et al. Candidatus Chloracidobacterium thermophilum: An aerobic phototrophic acidobacterium. In: Science, 317; 523–526 (2007).
- ↑ Elmar Weiler, Lutz Nover, Wilhelm Nultsch: Allgemeine und molekulare Botanik. Thieme Verlag, Stuttgart 2008. ISBN 978-3-13-147661-6; S. 261
- ↑ Georg Fuchs (Hrsg.), Thomas Eitinger, Erwin Schneider; Begründet von Hans. G. Schlegel: Allgemeine Mikrobiologie. 8. Auflage. Thieme Verlag, Stuttgart 2007, ISBN 3-13-444608-1; S. 425.
- ↑ 16,0 16,1 16,2 Barber, J. (2009): Photosynthetic energy conversion: natural and artificial. In: Chem Soc Rev. 38(1); 185–196; PMID 19088973; doi:10.1039/b802262n
- ↑ Hans W. Heldt, Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008; ISBN 978-3-8274-1961-3; S. 88
- ↑ Guskov, A. et al. (2009): Cyanobacterial photosystem II at 2.9-A resolution and the role of quinones, lipids, channels and chloride. In: Nat Struct Mol Biol. 16(3); 334-342; PMID 19219048; doi:10.1038/nsmb.1559
- ↑ Rappaport et al (2002): Kinetics and pathways of charge recombination in photosystem II. In: Biochemistry 41 (26); S. 8518–8527; PMID 12081503
- ↑ Dau et al. (2004): The structure of the manganese complex of Photosystem II in its dark-stable S 1-state—EXAFS results in relation to recent crystallographic data. In: Phys Chem Chem Phys 6 (20) pp. 4781–4792
- ↑ Ferreira et al. (2004): Architecture of the photosynthetic oxygen-evolving center. In: Science 303 (5665); S. 1831–1838; PMID 14764885
- ↑ Rieske, JS., Maclennan, DH. und Coleman, R. (1964): Isolation and properties of an iron-protein from the (reduced coenzyme Q)-cytochrome C reductase complex of the respiratory chain. In: Biochemical and Biophysical Research Communications 15(4); 338-344; doi:10.1016/0006-291X(64)90171-8
- ↑ Mitchell (1975): Protonmotive redox mechanism of Cytochrome-b-c1 complex in respiratory-chain - protonmotive ubiquinone cycle. In: FEBS Lett 56 (1) pp. 1-6
- ↑ 24,0 24,1 24,2 Baniulis et al (2008): Structure-function of the cytochrome b6f complex. In: Photochem Photobiol 84 (6) pp. 1349–1358, PMID 19067956
- ↑ Haehnel (1984): Photosynthetic Electron Transport in Higher Plants. In: Annu Rev Plant Biol 35 pp. 659-693
- ↑ Hope (2000): Electron transfers amongst cytochrome f, plastocyanin and photosystem I: kinetics and mechanisms. In: Biochim Biophys Acta 1456 (1) pp. 5-26; PMID 10611452
- ↑ David L. Nelson und Michael M. Cox: Lehninger Principles of Biochemistry. 5. Auflage. Freeman, New York, NY 2008, ISBN 978-0-7167-7108-1; S. 753
- ↑ Sacksteder et al (2000): The proton to electron stoichiometry of steady-state photosynthesis in living plants: A proton-pumping Q cycle is continuously engaged. In: Proc Natl Acad Sci U S A 97 (26) pp. 14283-14288; PMID 11121034
- ↑ Mitchell (1961): Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism. In: Nature 191 (4784) pp. 144–148
- ↑ Seelert et al: Structural biology. Proton-powered turbine of a plant motor. In: Nature 405 (6785) pp. 418–419; PMID 10839529
- ↑ Junge und Nelson (2005): Structural biology. Nature's rotary electromotors. In: Science 308 (5722) pp. 642–644; PMID 15860615
- ↑ Yano J, Kern J, Sauer K, Latimer MJ, Pushkar Y, Biesiadka J, Loll B, Saenger W, Messinger J, Zouni A, Yachandra VK (2006): Where water is oxidized to dioxygen: structure of the photosynthetic Mn4Ca cluster. In: Science 314(5800); 821–825; PMID 17082458; doi:10.1126/science.1128186.
- ↑ 33,0 33,1 33,2 Sauer K, Yano J, Yachandra VK (2008): X-Ray spectroscopy of the photosynthetic oxygen-evolving complex. In: Coord Chem Rev. 252(3–4); 318–335; PMID 19190720; PDF (freier Volltextzugriff, engl.)
- ↑ Sproviero EM, Gascón JA, McEvoy JP, Brudvig GW, Batista VS (2008): Quantum mechanics/molecular mechanics study of the catalytic cycle of water splitting in photosystem II. In: J Am Chem Soc. 130(11); 3428–3442; PMID 18290643; doi:10.1021/ja076130q.
- ↑ Dobbek H, Svetlitchnyi V, Gremer L, Huber R, Meyer O (2001): Crystal structure of a carbon monoxide dehydrogenase reveals a [Ni-4Fe-5S] cluster. In: Science 293(5533); 1281–1285; PMID 11509720; doi:10.1126/science.1061500.
- ↑ Pushkar Y, Yano J, Sauer K, Boussac A, Yachandra VK (2008): Structural changes in the Mn4Ca cluster and the mechanism of photosynthetic water splitting. In: Proc Natl Acad Sci USA 105(6); 1879–1884; PMID 18250316; PDF (freier Volltextzugriff, engl.)
- ↑ Barber, J. (2008): Photosynthetic generation of oxygen. In: Philos Trans R Soc Lond B Biol Sci. 363(1504); 2665–2674; PMID 18468983.
- ↑ Najafpour, MM. (2009): A Possible Evolutionary Origin for the Mn(4) Cluster in Photosystem II: From Manganese Superoxide Dismutase to Oxygen Evolving Complex. In: Orig Life Evol Biosph. 39(2); 151–163; PMID 1914877.
- ↑ 39,0 39,1 39,2 Conlan, B. (2008): Designing photosystem II: molecular engineering of photo-catalytic proteins. In: Photosynth Res. 98(1–3); 687–700; PMID 18777102; doi:10.1007/s11120-008-9355-5.
- ↑ Kok B, Forbush B, McGloin M (1970): Cooperation of charges in photosynthetic O2 evolution-I. A linear four step mechanism. In: Photochem Photobiol. 11(6); 457–475; PMID 5456273; doi:10.1111/j.1751-1097.1970.tb06017.x.
- ↑ Hans W. Heldt, Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008; ISBN 978-3-8274-1961-3; S. 103ff.
- ↑ Mehler, AH. (1951): Studies on reactions of illuminated chloroplasts: I. Mechanism of the reduction of oxygen and other hill reagents. In: Arch Biochem Biophys 33(1); 65–77; PMID 14857775; doi:10.1016/0003-9861(51)90082-3
- ↑ Mehler, AH. und Brown, AH. (1952): Studies on reactions of illuminated chloroplasts. III. Simultaneous photoproduction and consumpzion of oxygen studied with oxygen isotopes. In: Arch Biochem Biophys 38(1); 365–370; PMID 12997112; doi:10.1016/0003-9861(52)90042-8
- ↑ 44,0 44,1 Asada, K. (2000): The water-water cycle as alternative photon and electron sinks. In: Philos Trans R Soc Lond B Biol Sci. 355(1402); 1419–1431; PMID 11127996; PDF (freie Volltextzuegriff, ängl.)
- ↑ Hackenberg, C. et al. (2009): Photorespiratory 2-phosphoglycolate metabolism and photoreduction of O2 cooperate in high-light acclimation of Synechocystis sp. strain PCC 6803. In: Planta 230(4); 625–637; PMID 19578872; PDF (freie Volltextzuegriff, ängl.)
- ↑ Albertsson (2001): A quantitative model of the domain structure of the photosynthetic membrane. In: Trends Plant Sci 6(8) S. 349-58
- ↑ Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Plant Biochemistry. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5; S. 89.
- ↑ Hans W. Heldt, Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008; ISBN 978-3-8274-1961-3; S. 110
- ↑ R. Scheuermann, K. Biehler, T. Stuhlfauth & H. P. Fock (1991): Simultaneous gas exchange and fluorescence measurements indicate differences in the response of sunflower, bean and maize to water stress. In: Photosynthesis Research 27(3): 189-197.
- ↑ Griffin BM, Schott J, Schink B (2007): Nitrite, an electron donor for anoxygenic photosynthesis. In: Science 316(5833); S. 1870; PMID 17600210; doi:10.1126/science.1139478.
- ↑ Georg Fuchs (Hrsg.), Thomas Eitinger, Erwin Schneider; Begründet von Hans. G. Schlegel: Allgemeine Mikrobiologie. 8. Auflage. Thieme Verlag, Stuttgart 2007, ISBN 3-13-444608-1; S. 432.
- ↑ Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme Verlag, Stuttgart 2008, ISBN 978-3-13-144861-3; S. 341
- ↑ David L. Nelson und Michael M. Cox: Lehninger Principles of Biochemistry. 5. Auflage. Freeman, New York, NY 2008, ISBN 978-0-7167-7108-1; S. 751
- ↑ Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme Verlag, Stuttgart 2008, ISBN 978-3-13-144861-3; S. 343
- ↑ 55,0 55,1 Georg Fuchs (Hrsg.), Thomas Eitinger, Erwin Schneider; Begründet von Hans. G. Schlegel: Allgemeine Mikrobiologie. 8. Auflage. Thieme Verlag, Stuttgart 2007, ISBN 3-13-444608-1; S. 434
- ↑ Heinnickel, M. und Golbeck, JH. (2007): Heliobacterial photosynthesis. In: Photosynth Res. 92(1); 35–53; PMID 17457690; doi:10.1007/s11120-007-9162-4.
- ↑ Beatty, JT. et al. (2005): An obligately photosynthetic bacterial anaerobe from a deep-sea hydrothermal vent. In: Proc Natl Acad Sci USA 102(26); 9306–9310; PMID 15967984; PDF (Volltextzuegriff, ängl.)
- ↑ Photosynthese in der Tiefsee. Archiviert vom Original am 29. Januar 2012; abgruefen am 8. Januar 2011.
- ↑ Georg Fuchs (Hrsg.), Thomas Eitinger, Erwin Schneider; Begründet von Hans. G. Schlegel: Allgemeine Mikrobiologie. 8. Auflage. Thieme Verlag, Stuttgart 2007, ISBN 3-13-444608-1; S. 411
- ↑ Andreas Bresinsky et al. Strasburger - Lehrbuch der Botanik. A. a. O.; S. 317
- ↑ Elmar Weiler et al.: Allgemeine und molekulare Botanik. a. a. O. S. 279
- ↑ Katharina Munk (Hrsg.): Grundstudium Biologie. Botanik. Spektrum Akademischer Verlag, Heidelberg 2001, S. 6-6, ISBN 3-8274-0909-8
- ↑ Munk, Katharina (Hrsg.): Grundstudium Biologie. Botanik. Spektrum Akademischer Verlag, Heidelberg 2001, S. 5-27, ISBN 3-8274-0909-8.
- ↑ 64,0 64,1 Hermann Linder: Biologie. Schroedel; 21., neubearb. Auflage 1998; ISBN 3-507-10580-2; S. 43
- ↑ 65,0 65,1 Wilhelm Nultsch: Allgemeine Botanik. Georg Thieme Verlag; 10., neu bearbeitete Auflage 1996. ISBN 3-13-383310-3; S. 309-311
- ↑ 66,0 66,1 66,2 Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botanik. 5. vollst. überarb. Auflage. Wiley-VCH, Weinheim 2005; ISBN 978-3-527-31179-8; S. 472f.
- ↑ T. Stuhlfauth and H. P. Fock, Effect of whole season CO2 enrichment on the cultivation of a medicinal plant, Digitalis lanata, J. Agronomy & Science 164, 168-173 (1990) doi:10.1111/j.1439-037X.1990.tb00803.x
- ↑ Ulrich Lüttge, Manfred Kluge und Gabriela Bauer. Botanik. Wiley-VCH; 5. vollst. überarb. Auflage 2005; ISBN 978-3-527-31179-8
- ↑ Andreas Bresinsky, Christian Körner, Joachim W. Kadereit, G. Neuhaus und Uwe Sonnewald: Strasburger - Lehrbuch der Botanik. 36. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008, S. 315, ISBN 978-3-8274-1455-7.
- ↑ Hermann Linder: Biologie. 21., neubearb. Auflage. Schroedel Verlag, 1998, S. 45, ISBN 3-507-10580-2.
- ↑ Hermann Linder: Biologie. Schroedel; 21., neubearb. Auflage 1998; ISBN 3-507-10580-2; S. 48-49
- ↑ Turrell (1934): The area of the internal exposed surface of dicotyledon leaves. In: American Journal of Botany 23(4), 255-264
- ↑ Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botanik. 5. vollst. überarb. Auflage. Wiley-VCH, Weinheim 2005; ISBN 978-3-527-31179-8; S. 318
- ↑ B. Steuer, T. Stuhlfauth and H. P. Fock: The efficiency of water use in water stressed plants is increased due to ABA induced stomatal closure, Photosynthesis Research 18:327-336 (1988) doi:10.1007/BF00034837
- ↑ Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botanik. 5. vollst. überarb. Auflage. Wiley-VCH, Weinheim 2005; ISBN 978-3-527-31179-8; S. 472
- ↑ Hermann Linder: Biologie. 21., neubearb. Auflage. Schroedel Verlag, 1998; S. 48-49, ISBN 3-507-10580-2
- ↑ Andreas Bresinsky, Christian Körner, Joachim W. Kadereit, G. Neuhaus und Uwe Sonnewald: Strasburger - Lehrbuch der Botanik. 36. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008, S. 315, ISBN 978-3-8274-1455-7
Literatur
[ändere | Quälltäxt bearbeite]- Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme Verlag, Stuttgart 2008, ISBN 978-3-13-144861-3.
- Hans W. Heldt, Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008; ISBN 978-3-8274-1961-3.
- Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Plant Biochemistry. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5.
- David L. Nelson und Michael M. Cox: Lehninger Principles of Biochemistry. 5. Auflage. Freeman, New York, NY 2008, ISBN 978-0-7167-7108-1.
- Georg Fuchs (Hrsg.), Thomas Eitinger, Erwin Schneider; Begründet von Hans. G. Schlegel: Allgemeine Mikrobiologie. 8. Auflage. Thieme Verlag, Stuttgart 2007, ISBN 3-13-444608-1.
- Neil A. Campbell: Biologie. Spektrum Lehrbuch, 6. Auflage, Herausgegeben von J. Markl. Spektrum Verlag, Heidelberg, Berlin 2003, ISBN 3-8274-1352-4.
- Donat-Peter Häder (Hrsg.): Photosynthese. Georg Thieme Verlag, Stuttgart, New York 1999, ISBN 3-13-115021-1.
- Andreas Bresinsky, Christian Körner, Joachim W. Kadereit, G. Neuhaus, Uwe Sonnewald: Strasburger - Lehrbuch der Botanik. 36. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1455-7.
- Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botanik. 5. vollst. überarb. Auflage. Wiley-VCH, Weinheim 2005; ISBN 978-3-527-31179-8.
- Peter H. Raven, Ray F. Evert, Susan E. Eichhorn: Biologie der Pflanzen. 4. Auflage. Gruyter, Berlin, New York 2006; ISBN 978-3-11-018531-7.
- Elmar Weiler, Lutz Nover, Wilhelm Nultsch: Allgemeine und molekulare Botanik. Thieme Verlag, Stuttgart 2008. ISBN 978-3-13-147661-6.
- Hohmann-Marriott, MF. und Blankenship, RE. (2011): Evolution of photosynthesis. In: Annu Rev Plant Biol. 62; 515–548; PMID 21438681; doi:10.1146/annurev-arplant-042110-103811
Weblink
[ändere | Quälltäxt bearbeite]| Dä Artikel basiert uff ere fräie Übersetzig vu dere Version vum Artikel „Photosynthese“ vu de dütsche Wikipedia. E Liste vu de Autore un Versione isch do z finde. |