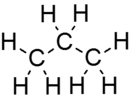
Propaan
|
Algemeen | |
|---|---|
| Naam | Propaan |
| IUSTC-naam | Propaan |
 |
 |
| Chemiese formule | C3H8 |
| Molêre massa | 44.097 g/mol |
| CAS-nommer | 74-98-6 |
| Voorkoms | kleurlose gas |
| Fasegedrag | |
| Smeltpunt | -187.7 °C |
| Kookpunt | -42.25 tot -42.04 °C |
| Digtheid | 2.00098 kg/cm3 (teen 0 °C en 101.3 kPa) |
| Oplosbaarheid | 47 g/L (teen 0 °C) |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | −104 °C |
| Selfontbrandingspunt | 470 °C |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Propaan is 'n drie-koolstofketting-alkaan met die molekulêre formule C3H8. Dit is 'n gas teen standaardtemperatuur en -druk, maar saampersbaar tot 'n vervoerbare vloeistof. Dit is 'n neweproduk van die verwerking van aardgas en raffinering van petroleum en word gewoonlik as brandstof gebruik. Dit is in 1857 deur die Franse chemikus Marcellin Berthelot ontdek. Propaan is een van 'n groep vloeibare petroleumgasse. Die ander bevat butaan, propileen, butadieen, butileen, isobutileen en mengsels daarvan. Propaan het 'n laer energiedigtheid, maar verbrand skoner as petrol en steenkool. Propaan word gebruik as brandstof in huishoudelike en industriële toepassings en in openbare vervoer met lae emissies.
Geskiedenis
[wysig | wysig bron]Propaan is in 1857 deur die Franse chemikus Marcellin Berthelot ontdek.[1] In 1864 is dit deur Edens Ronalds opgelos in Pennsylvaniese ligte ruolie gevind.[2][3] In 1910 het Walter O. Snelling, Frank P. Peterson, Chester Kerr en Arthur Kerr maniere geskep om die gasse vloeibaar te maak tydens die verfyning van petrol, wat in 1913 'n patent gekry het.[4] 'n Afsonderlike metode om die gas te produseer deur middel van kompressie is deur Frank Peterson geskep en die patent is in 1912 toegestaan.[5]
Die "prop-" wortel wat in "propaan" en name van ander verbindings met drie-koolstofkettings voorkom, is afgelei van "propionsuur",[6] wat weer vernoem is na die Griekse woorde protos (wat "eerste" beteken) en pion (wat "vet" beteken).
Bronne
[wysig | wysig bron]Propaan word geproduseer as 'n neweproduk van twee ander prosesse, natuurlike gasverwerking en petroleumraffinering. Die verwerking van natuurlike gas behels die verwydering van butaan, propaan en groot hoeveelhede etaan uit die rou gas om kondensasie van hierdie vlugtige stowwe in natuurlike gaspypleidings te voorkom. Daarbenewens vervaardig olieraffinaderye propaan as 'n neweproduk deur petroleum in petrol of verwarmingsolie te breek. Vanweë die neweproduk-aard van propaanproduksie kan die produksie van propaan nie maklik aangepas word om aan veranderende aanvraag te voldoen nie.[7]
Eienskappe en reaksies
[wysig | wysig bron]
Propaan is 'n kleurlose, reuklose gas. Teen normale druk vloei dit onder die kookpunt van -42 °C en stol dit onder die smeltpunt van -187,7 °C. Dit ondergaan verbrandingsreaksies op 'n soortgelyke manier as ander alkane. In die teenwoordigheid van oortollige suurstof brand propaan om water en koolstofdioksied te vorm:
Volledige verbranding van propaan lewer ongeveer 50 MJ/kg hitte.[8]
As daar onvoldoende suurstof is vir volledige verbranding, word koolstofmonoksied en / of roet (koolstof) ook gevorm:
Propaanverbranding is baie skoner as dié van steenkool of loodvrye petrol. Vir propaan is die produksie van CO2 per BTU byna net so laag as dié van natuurlike gas.[9] Propaan brand warmer as tuisverwarmingsolie of diesel weens die baie hoë waterstofinhoud. Die teenwoordigheid van C-C bindings, plus die meervoudige bindings van propileen en butileen, skep organiese uitlaatgasse sowel as koolstofdioksied en waterdamp tydens tipiese verbranding. Hierdie bindings laat ook propaan met 'n sigbare vlam brand.
Energie-inhoud
[wysig | wysig bron]Die entalpie van die verbranding van propaangas waar produkte nie na die standaardtoestand terugkeer nie, byvoorbeeld waar die warm gasse insluitend waterdamp 'n skoorsteen verlaat, is -2043.455 kJ/mol.[10]
Digtheid
[wysig | wysig bron]Die digtheid van propaangas teen 25 °C is 1,808 kg/m3. Die digtheid van vloeibare propaan teen 25 °C is 0,493 g/cm3.[11]
Gebruike
[wysig | wysig bron]
Propaangas word gebruik vir gasbraaiers en draagbare stowe, omdat die lae kookpunt dit laat verdamp sodra dit uit sy houer onder druk vrygestel word. Propaan dryf busse, vurkhysers, taxi's, buiteboordmotors en ys-oppervlakmasjiene aan en word gebruik vir hitte en kook in ontspannings- en kampvoertuie.
Ander gebruike
[wysig | wysig bron]- Propaan is die primêre vlambare gas wat gebruik word in soldeerwerk.
- Dit word gebruik as voermiddel vir die vervaardiging van basiese petrochemikalieë.
- Propaan is die primêre brandstof vir lugballonne.
- Dit word gebruik in die vervaardiging van halfgeleiers om silikonkarbied af te sit.
- Propaan word gebruik as 'n goedkoop brandstof met hoë energie vir ontploffings en ander spesiale effekte in temaparke en in die filmbedryf.
- Dit word as 'n dryfmiddel gebruik om projektiele af te vuur.
- Propaan word gebruik as dryfmiddel vir baie spuitkannetjies, insluitend skeerrome en lugverfrissers.
- Dit is 'n grondstof vir die produksie van propileen[12][13] en akrielsuur.[14][15][16]
Gevare
[wysig | wysig bron]Propaan is versmorend.[17] Anders as natuurlike gas, is propaan digter as lug en kan in lae ruimtes en naby die vloer ophoop. Wanneer dit misbruik word as 'n inasemmiddel, kan dit hipoksie (suurstoftekort), longontsteking, hartversaking of hartstilstand veroorsaak.[18][19] Propaan het lae toksisiteit omdat dit nie maklik opgeneem word nie en nie biologies aktief is nie. Propaan en die mengsels daarvan, wat gewoonlik onder kamertemperatuur gestoor word, verdamp by atmosferiese druk en koel tot onder die vriespunt van water. Die koue gas, wat wit lyk as gevolg van vog wat uit die lug kondenseer, kan vriesskade aan die vel veroorsaak.
Kyk ook
[wysig | wysig bron]Verwysings
[wysig | wysig bron]- ↑ "Comptes rendus hebdomadaires des séances de l'Académie des sciences (Weeklikse verslae van die Akademie vir Wetenskap-sessies)" (in Frans). 140. 1905.
{{cite journal}}: Cite journal requires|journal=(hulp) - ↑ Roscoe, H.E.; Schorlemmer, C. (1889). Treatise on Chemistry (in Engels). Vol. 3. Macmillan. pp. 144–145.
- ↑ Watts, H. (1918). Dictionary of Chemistry (in Engels). Vol. 4. p. 385.
- ↑ National Propane Gas Association. "The History of Propane". Geargiveer vanaf die oorspronklike op 11 Januarie 2011. Besoek op 8 Desember 2020.
- ↑ "The First Fifty Years of LP-Gas: An Industry Chronology" (PDF). LPGA Times (in Engels): 17. Januarie 1962. Geargiveer vanaf die oorspronklike (PDF) op 7 Oktober 2006.
- ↑ "Online Etymology Dictionary: Propane" (in Engels). Etymonline.com. Besoek op 8 Desember 2020.
- ↑ Hahn, Eric (2 April 2016). "LPG Gas Manufacturing Process: How is LPG Gas Made". LPG Plant (in Engels). Besoek op 8 Desember 2020.
- ↑ Propane. NIST Standard Reference Data verwys na Pittam, D. A.; Pilcher, G. (1972). "Measurements of heats of combustion by flame calorimetry. Part 8.—Methane, ethane, propane, n-butane and 2-methylpropane". Journal of the Chemical Society, Faraday Transactions 1: Physical Chemistry in Condensed Phases (in Engels). 68: 2224. doi:10.1039/f19726802224. en Rossini, F.D. (1934). "Calorimetric determination of the heats of combustion of ethane, propane, normal butane, and normal pentane". Bureau of Standards Journal of Research (in Engels). 12 (6): 735–750. doi:10.6028/jres.012.059.
- ↑ "How much carbon dioxide is produced when different fuels are burned". United States Energy Information Association (in Engels). Besoek op 8 Desember 2020.
- ↑ Cengel, Yunus A.; Boles, Michael A. (2006). Thermodynamics: An Engineering Approach (in Engels) (Vyfde uitg.). McGrawHill. p. 925. ISBN 978-0-07-288495-1.
- ↑ Razmi, Amir (Mei 2019). "Propylene Production by Propane Dehydrogenation (PDH)". Engineering (in Engels): 3.
- ↑ Hernández, Juan Pablo; Echavarría, Adriana; Palacio, Luz Amparo (2013). "Synthesis of two new Nickel and Copper- Nickel vanadates used for propane oxidative dehydrogenation". Revista Facultad de Ingeniería Universidad de Antioquia (in Spaans) (67): 137–145. ISSN 0120-6230.
- ↑ Zea, Hugo; Figueiredo, Jose L.; Carballo, Luis (2011). "Promoting effect of Mo on Pd / g-Al2O3 supported catalysts in the oxidative dehydrogenation of propane". DYNA (in Spaans). 78 (170): 159–166. ISSN 0012-7353.
- ↑ Naumann d'Alnoncourt, Raoul; Csepei, Lénárd-István; Hävecker, Michael; Girgsdies, Frank; Schuster, Manfred E; Schlögl, Robert; Trunschke, Annette (2014). "The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts" (PDF). Journal of Catalysis (in Engels). 311: 369–385. doi:10.1016/j.jcat.2013.12.008. hdl:11858/00-001M-0000-0014-F434-5. Geargiveer vanaf die oorspronklike (PDF) op 15 Februarie 2016. Besoek op 8 Desember 2020.
- ↑ Amakawa, Kazuhiko; Kolen’ko, Yury V.; Villa, Alberto; Schuster, Manfred E/; Csepei, Lénárd-István; Weinberg, Gisela; Wrabetz, Sabine; Naumann d’Alnoncourt, Raoul; Girgsdies, Frank; Prati, Laura; Schlögl, Robert; Trunschke, Annette (2013). "Multifunctionality of Crystalline MoV(TeNb) M1 Oxide Catalysts in Selective Oxidation of Propane and Benzyl Alcohol". ACS Catalysis (in Engels). 3 (6): 1103–1113. doi:10.1021/cs400010q.
- ↑ Hävecker, Michael; Wrabetz, Sabine; Kröhnert, Jutta; Csepei, Lenard-Istvan; Naumann d'Alnoncourt, Raoul; Kolen'Ko, Yury V; Girgsdies, Frank; Schlögl, Robert; Trunschke, Annette (2012). "Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid" (PDF). Journal of Catalysis (in Engels). 285: 48–60. doi:10.1016/j.jcat.2011.09.012. hdl:11858/00-001M-0000-0012-1BEB-F. Geargiveer vanaf die oorspronklike (PDF) op 30 Oktober 2016. Besoek op 8 Desember 2020.
- ↑ "Propane" (in Engels). The National Institute for Occupational Safety and Health (NIOSH). Besoek op 8 Desember 2020.
- ↑ "Inhalants – Facts and Statistics" (in Engels). Greater Dallas Council on Alcohol & Drug Abuse. 4 Maart 2006. Geargiveer vanaf die oorspronklike op 8 April 2009.
- ↑ "Inhalants" (in Engels). National Inhalant Prevention Coalition.