Benzen
| Benzen | |
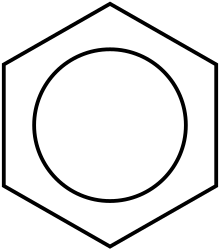 Structura | |
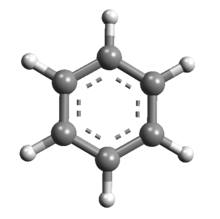 Structura în 3D | |
 | |
| Denumiri | |
|---|---|
| Alte denumiri | benzan, benzol |
| Identificare | |
| Număr CAS | 71-43-2 |
| ChEMBL | CHEMBL277500 |
| PubChem CID | 241 |
| Informații generale | |
| Formulă chimică | C6H6 |
| Aspect | lichid incolor cu miros caracteristic |
| Masă molară | 78,11 g/mol |
| Proprietăți | |
| Densitate | 0,8842 g/cm-3 |
| Starea de agregare | lichid |
| Punct de topire | 5,5°C |
| Punct de fierbere | 80,1°C |
| Solubilitate | în Benzină și Alcool |
| Anion | Carbon |
| Cation | Hidrogen |
| Duritate (Scara Mohs) | - |
| Presiune de vapori | 75 mm Hg |
| Indice de refracție(nD) | 1,501 |
| Viscozitate | dinamică 0,0652 poiseuille |
| Temperatură de aprindere | -11 °C |
| Pericol | |
| Fraze R | R11, R45, R46, R65, R36/38, R48/23/24/25 |
| Fraze S | S45, S53 |
| NFPA 704 | |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Benzenul (cunoscut și sub denumirea mai puțin frecventă de benzol) este o hidrocarbură cu un nucleu aromatic care are formula chimică C6H6. Este întâlnit în cărbuni, petrol și se obține în mod natural prin arderea incompletă a compușilor bogați în carbon. Are proprietăți de solvent pentru iod, sulf, fosfor,etc.
Până la Al Doilea Război Mondial, benzenul rezulta ca produs secundar al procedurii de formare a cocsului. După anii 1950, hidrocarbura a fost extrasă din petrol. Există patru metode de laborator din care se obține: reformare catalitică, hidrodezalchilarea toluenului, disproporționarea toluenului și cracare cu abur. Participă la reacții de substituție, oxidare și adiție. Etimologic, cuvântul provine de la rășina „benzoe” care prin sublimare formează acidul benzoic.
Au fost emise numeroase formule pentru benzen. Kekulé a propus în 1865 o aranjare ciclică a atomilor de carbon în care legăturile simple alternează cu cele duble, însă această structură nu explica în totalitate proprietățile hidrocarburii. Erich Hückel în 1931 a demonstrat prin teoria orbitalilor moleculari că benzenul este reprezentat de un ciclu de șase atomi de carbon, în interiorul lui fiind un cerc sau o linie circulară punctată pentru a sugera delocalizarea electronilor din legătura C-C.
Compusul organic este incolor, extrem de inflamabil și volatil, având un punct de solidificare de 5,5 °C și cel de fierbere fiind de 80,1 °C. La 20 °C are o densitate de 0,88 g·cm−3 și este mai solubil în solvenți organici decât în apă. Face parte din categoria substanțelor cancerigene, fiind evitat a fi folosit ca solvent industrial și înlocuit prin derivații metilați ai benzenului ca toluenul și xilenii. Este un solvent foarte utilizat în industria chimică și reprezintă un precursor important al sintezei chimice de medicamente, plastic, gumă sintetică sau coloranți.
Istoric
[modificare | modificare sursă]Descoperire
[modificare | modificare sursă]Cuvântul „benzen” provine de la numele rășinii arborelui Styrax benzoin, numită „benzoe”.[2] Aceasta a fost folosită în farmaciile europene începând cu secolul 15, fiind un produs originar din Asia de Sud-Est, denumirea ei fiind derivată de la expresia arabică „luban jawi”. Prin sublimarea acestei rășini se formează acidul benzoic, numit și „flori de benzoe”, iar hidrocarbura derivată din acesta a fost numită „benzin”, „benzol” sau „benzen”.[3][4][5]
Benzenul a fost izolat de Michael Faraday în anul 1825 dintr-o fracțiune de gaz depus în procesul de lichefiere a gazul de iluminat, numindu-l bicarburet of hydrogen.[6][7] El a observat că substanța este o hidrocarbură care avea o formulă moleculară ce putea fi scrisă ca un multiplu de CxHy.[8] Justus von Liebig a redenumit compusul, numindu-l „benzen” sau „benzol” în 1834.[9] În 1883, Eilhard Mitscherlich l-a obținut din decarboxilarea acidului benzoic și a oxidului de calciu, denumindu-l „benzin”.[10]
În 1836, chimistul francez Auguste Laurent a intitulat substanța „phène”, cuvântul devenind ulterior rădăcină pentru fenol și pentru radicalul fenil.[11] În 1845, August Wilhelm von Hofmann a izolat substanța din gudroanele rezultate din distilarea uscată a cărbunilor de pământ.[2] În 1855, acesta a folosit pentru prima dată termenul „aromatic” pentru a numi caracterul compușilor chimici înrudiți cu benzenul. În 1868, Marcellin Berthelot a sintetizat benzenul prin trimerizarea acetilenei.[12] În petrol, compusul a fost identificat ulterior, iar în cel din România a fost descoperit de Petru Poni în 1900 și de Lazăr Edeleanu în 1901.[2]
Formule propuse
[modificare | modificare sursă]
Modul de aranjare a atomilor din structura benzenului a fost îndelung disputată.[13] După ce Stanislao Cannizzaro a descoperit formula moleculară adevărată a compusului (C6H6),[8] multe teorii au fost emise fără explicația ulterioară a proprietăților chimice, cum ar fi cea prezentată de James Dewar (denumit benzen Dewar), 3-prismanul propus de Albert Ladenburg, benzvalenul, benzenul Claus, etc.[8] În cadrul teoriei valențelor parțiale au fost propuse pentru benzen formule cu valențe parțial centrice (E. Armstrong în 1887) și cu valențe parțiale compensate (J. Thiele în 1899).[14] Johann Josef Loschmidt a prezentat prima formulă corectă în 1861, aceasta reprezentând baza interpretării corecte a structurii benzenului de către Friedrich August Kekulé von Stradonitz în 1865.[15][16] Savantul german a declarat că i-a venit ideea reprezentării benzenului ca un cerc în care atomii de carbon sunt uniți prin legături duble alternate cu cele simple de la imaginea unui șarpe care-și urmărea propria coadă. Ulterior, el a modificat teoria sa, considerând benzenul un amestec de ciclohexatriene aflate în echilibru rapid.[17]

Kekulé a afirmat că benzenul este alcătuit dintr-un hexagon ciclic regulat plan, cu laturile având lungimea de 1,39Å și unghiurile având măsura de 120°. El a evidențiat faptul că majoritatea reprezentărilor sunt echivalente, mai exact, legăturile duble alternate cu cele simple pot fi așezate oriunde pe ciclu. De asemenea, utilizând teoria orbitalilor hibrizi, a afirmat că benzenul are în structura sa șase atomi de carbon (situați în vârfurile hexagonului și uniți între ei prin trei duble legături σ conjugate, fiecare atom având hibridizarea sp2) și din șase atomi de hidrogen, formându-se legături σ carbon-hidrogen. Orbitalul p nehibridizat al unui atom de carbon se întrepătrunde cu vecinii lui, formând orbitali moleculari extinși pe toți atomii ciclului. Datorită acestei întrepătrunderi, deasupra și dedesubtul planului se formează două domenii de densitate electronică mare. Atomul de carbon saturat al benzenului rezultă din această delocalizare a electronilor orbitalilor moleculari extinși.[18][19] Structura ciclică a benzenului a fost confirmată de cristalograful Kathleen Lonsdale.[20]
Structură
[modificare | modificare sursă]

Prin studiul spectrelor de difracție cu raze X pe ținte pure de benzen, s-a determinat echivalența tuturor legăturilor carbon-carbon din benzen, acestea având lungimea de 140 pm. Ele sunt mai mari decât una dublă (135 pm) și mai mici decât una simplă (147 pm). Această valoare este determinată de delocalizarea(dislocarea) electronilor legăturilor C-C, aceștia fiind distribuiți în mod egal pe fiecare dintre cei șase atomi de carbon, molecula putând fi reprezentată ca o suprapunere a două reprezentări mezomere).[18] Delocalizarea electronilor π este cunoscută sub numele de aromaticitate, aceasta conferind benzenului o mare stabilitate. Pentru a exprima acest lucru, se utilizează formule în care se scrie într-un hexagon regulat un cerc cu linie continuă sau punctată.[14]
Metoda orbitalilor moleculari permite descrierea mai exactă a structurii benzenului. Aceasta a fost elaborată de Erich Hückel în 1931 și necesită calculul unui determinant de șase linii și șase coloane pentru a putea obține diagrama energetică a benzenului.[21]

Proprietăți fizice și stare naturală
[modificare | modificare sursă]Benzenul se întâlnește în gazul de huilă, în petrol și în produsele lichide ale distilării uscate a numeroșilor compuși organici bogați în carbon (huilă, lignit etc.).[22] Este un lichid incolor, extrem de inflamabil și volatil, având un indice de refracție de 1,50.[23][24] Viscozitatea sa este mai slabă decât cea a apei.[25] Benzenul se solidifică la 5,5 °C, temperatura de fierbere fiind de 80,1 °C.[26][27] La 20 °C are o densitate de 0,88 kg/L și o presiune de vapori de 110 Pa.[27] Este foarte solubil în solvenți organici polari, iar în apă se solubilizează mai greu. Coeficientul de expansiune termică al benzenului la 20 °C este de 0,001187 K−1. Are un miros caracteristic, cu un prag de detectare de 1,5 la 900 mg/m3 în aer.[27] Amestecul format din vapori de benzen și aer este foarte inflamabil, compusul aprinzându-se la -11 °C.[28] Zona de sablare se situează între 1,2 procente de volum (39 g/m3) ca limita inferioară de explozie și 8,6 procente de volum (280 g/m3) ca limită superioară de explozie.[28] Energia minimă de aprindere este de 0,2 mJ,[29] iar temperatura de combustie este de 555 °C.[28] Benzenul arde cu o flacără galbenă, formând apă și dioxid de carbon, fumegând, indicând astfel conținutul ridicat de carbon. Puterea calorică a compusului este de 40580 kJ/kg, entalpia molară fiind de 3257,6 kJ/mol pentru starea lichidă și 3301 kJ/mol pentru cea gazoasă.[30]
La spectroscopia în infraroșu, benzenul prezintă trei benzi de absorbție ale vibrațiilor de valență la 3003, 3071 și 3091 cm−1. Vibrațiile de deformație provoacă absorbții intense între 860– 1000 cm−1.[31] Benzenul are în spectrul ultraviolet trei maxime de absorbție, acestea având valorile 184 nm, 203,5 nm și 256 nm.[32] Dezecranarea protonilor aromatici se datorează existenței norului de electroni π extins asupra ciclului.[33] Astfel, în spectrul RMN benzenul prezintă un singur semnal la δ 7,224 ppm.[34]
Obținere
[modificare | modificare sursă]Benzenul este obținut din compușii bogați în carbon care suferă o ardere incompletă. Se obține în mod natural din vulcani și din incendiile forestiere, fiind prezent și în multe alte produse de ardere inclusiv în fumul de țigară.[35] Până la Al Doilea Război Mondial, cantități însemnate de benzen rezultau ca produs secundar în procesul producerii cocsului utilizat în industria fierului.[36] În anii 1950, cererea de benzen a înregistrat o creștere substanțială, în special în industria maselor plastice, necesitând astfel extragerea mult mai productivă al acestuia din petrol. În prezent, benzenul se obține mai ales în industria petrochimică, producerea compusului din cărbune fiind foarte puțin utilizată.[37][38][39]
Producția industrială de benzen cuprinde patru procese chimice: reformare catalitică, hidrodezalchilare a toluenului, disproporționare a toluenului și cracare cu abur.[40] În 1996, aceasta era de 33 de milioane de tone, dintre care 7 milioane proveneau din Statele Unite, 6,5 milioane din Uniunea Europeană, 4,2 din Japonia, 1,4 milioane din Coreea de Sud și un milion din China.[41] România este o țară producătoare, consumatoare și exportatoare de benzen,[42] cele mai importante rafinării în care se fabrică benzen sunt Rafo Onești, Oltchim S.A și Rompetrol.[43][44][45]
Reformare catalitică
[modificare | modificare sursă]În procesul de reformare catalitică, un amestec de hidrocarburi cu punctele de fierbere situate în intervalul de temperatură 60-200 °C este pus în reacție cu hidrogenul gazos, utilizându-se catalizator de clorură de platină sau de reniu la 500-525 °C și la o presiune de 8–50 atm. În aceste condiții, hidrocarburile alifatice formează un ciclu și devin aromatice. Acestea sunt separate prin extracție cu diverși solvenți, cum ar fi sulfolanul sau dietilen glicolul. Benzenul rezultă din distilarea fracționară a amestecului de produși aromatici.[40][46]
Hidrodezalchilare a toluenului
[modificare | modificare sursă]Reacția de hidrodezalchilare a toluenului transformă toluenul în benzen. În acest proces, toluenul este amestecat cu hidrogen și apoi este trecut peste un catalizator de oxid de crom, molibden sau platină la o temperatură de 500-600 °C și la o presiune de 40–60 atm. Uneori sunt utilizate temperaturi mai ridicate pentru a înlocui catalizatorii. În aceste condiții, toluenul suferă o dezalchilare conform ecuației:
Randamentul acestei reacții este de peste 95%. Uneori, xilenii și compușii aromatici mai grei sunt utilizați în locul toluenului, având aceeași eficacitate.[40][47]
Disproporționare a toluenului
[modificare | modificare sursă]Disproporționarea toluenului poate fi o bună alternativă a reacției de hidrodezalchilare, cele două procese decurgând în condiții similare. Reacția constă în punerea a două molecule de toluen, rezultând o moleculă de benzen (din rearanjarea radicalilor metil) și una de xilen. Având în vedere cererea crescută de para-xilen (p-xilen) față de restul izomerilor, uneori se folosește metoda numită disproporționarea selectivă a toluenului, rezultând p-xilenul în procent de aproximativ 90%.[40][48]
Cracare cu abur
[modificare | modificare sursă]Cracarea cu abur este un proces utilizat pentru producerea etenei și a altor alchene din hidrocarburi alifatice. În funcție de produșii de reacție folosiți, poate rezulta un compus lichid bogat în benzen, numit pyrolysis gasoline.[49][50] Acesta poate fi amestecat cu alte hidrocarburi și folosit ca aditiv pentru benzină sau distilat pentru a separa substanțele componente.[40]
Utilizări
[modificare | modificare sursă]
Înainte de anii 1920, benzenul era utilizat frecvent ca solvent industrial, mai ales pentru degresarea metalelor, însă din cauza toxicității sale ridicate a fost înlocuit cu alți solvenți.[51]
Principala sa întrebuințare este cea de reactiv intermediar pentru sinteza altor compuși chimici. Derivații benzenului care se produc în cantități importante sunt stirenul (utilizat în fabricarea polimerilor și a materialelor plastice) fenolul (din care se prepară rășini și adezivi) sau ciclohexanul (folosit pentru prepararea nylonului). Cantități mai mici de benzen sunt utilizate la fabricarea pneurilor, lubrifianților, coloranților, detergenților, medicamentelor, explozibililor sau a pesticidelor. În anii 1980, principalii compuși obținuți din benzen erau etilbenzenul, în proces folosindu-se 48% benzen, cumenul 18%, ciclohexanul 15% și nitrobenzenul 7%.[52][53]
Ca aditiv al benzinei, benzenul mărește cifra octanică și reduce detonația. În consecință, aceasta conținea adesea benzen în cantități importante înainte de anii 1950, când s-a introdus tetraetilul de plumb ca antidetonator.[54] În ultimii ani, ca urmare a scăderii producției de benzină cu plumb, s-a reintrodus benzenul ca aditiv.[55] În Statele Unite, din cauza efectului negativ asupra sănătății și pentru diminuarea riscului poluării pânzei freatice cu această substanță, s-a impus o emisie maxim admisibilă de aproximativ 1% de benzen.[56] Aceaași cifră se întâlnește și în standardele Uniunii Europene.[57]
Se poate folosi ca lichid termometric în termometru manometric.
Reacții chimice
[modificare | modificare sursă]Oxidare
[modificare | modificare sursă]Oxidarea benzenului se poate realiza fie cu oxigen, fie cu aer, de obicei în cataliză eterogenă. Prin oxidare incompletă se poate obține, în funcție de condițiile de lucru, fenol (la 430 °C, 7 atm):[58]
sau anhidridă maleică (450 °C, 1,5 atm, catalizator de V2O5):[58]
În urma oxidării complete a benzenului rezultă dioxid de carbon și apă, reacția fiind însoțită de o degajare a unei cantități importante de căldură (cu entalpie de reacție: ΔH = - 78 kcal/mol):[18][58]
Nitrare
[modificare | modificare sursă]Prin nitrarea benzenului se obține nitrobenzen și apă:[18]
Pentru prepararea nitrobenzenului se folosește acid azotic fumans căruia i se adaugă acid sulfuric concentrat, amestecul numindu-se nitrant sau sulfonitric.[59]
Clorurare (Halogenare)
[modificare | modificare sursă]Prin clorurare în prezență de catalizatori (FeCl3, AlCl3, ZnCl3, etc.), benzenul formează clorobenzen:[18]
La fel se aplica și în cazul altor halogeni, de aici și numele reactiei de halogenare (Br2,Cl2).
În exces de clor, benzenul formează un amestec de o- și p-diclorbenzen și, în condiții mai energice, în hexaclorbenzen:[60]
Hidrogenare
[modificare | modificare sursă]Hidrogenarea benzenului are loc la 450 K și la 10 atm, în prezența unui catalizator (de nichel sau platină), formându-se ciclohexan:[18][58]
Sulfonare
[modificare | modificare sursă]Sulfonarea benzenului cu acid sulfuric concentrat sau fumans conduce la formarea acidului benzensulfonic:[61]
Substituție electrofilă aromatică
[modificare | modificare sursă]Substituirea electrofilă aromatică este o reacție în care un atom de hidrogen este substituit de o altă grupă funcțională. În cursul acestui proces, hidrocarbura joacă rolul de nucleofil ce reacționează cu un reactant electrofil (de exemplu, un carbocation). Mecanismul este următorul:
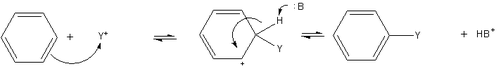
Sarcina pozitivă a intermediarului (numit intermediar de Wheland) provine în realitate de la o delocalizare pe ciclu realizată prin mezomerie, tendința fiind aceea de a stabiliza carbocationul benzenic. Pentru această reacție este nevoie de un catalizator de tip acid Lewis.[18]
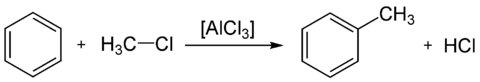
Reacția constă în alchilarea benzenului cu un compus halogenat al unui alcan. Uneori se utilizează un acid Lewis pe post de catalizator.[52]
Acilarea Friedel-Crafts este un caz particular al substituției electrofile aromatice. Reacția constă în acilarea unui compus aromatic, în acest caz a benzenului, cu o halogenură acidă. În proces se folosește drept catalizator un acid Lewis.[52]
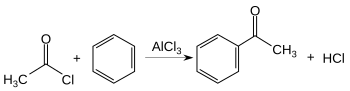
Substituenți
[modificare | modificare sursă]Un număr mare de compuși chimici de o importanță industrială ridicată sunt obținuți prin înlocuirea unuia sau mai multor atomi de hidrogen ai benzenului cu alte grupe funcționale.[18]
Compuși obținuți prin substituirea cu o grupă alchil
[modificare | modificare sursă]- toluen C6H5-CH3
- etilbenzen C6H5-CH2CH3
- xilen C6H4(-CH3)2
- mesitilen C6H3(-CH3)3
Compuși obținuți prin substituirea cu alte grupe
[modificare | modificare sursă]- fenol C6H5-OH
- anilină C6H5-NH2
- clorobenzen C6H5-Cl
- nitrobenzen C6H5-NO2
- acid picric C6H2(-OH)(-NO2)3
- trinitrotoluen C6H2(-CH3)(-NO2)3
- acid benzoic C6H5-COOH
- acid salicilic C6H4(-OH)(-COOH)
- acid acetilsalicilic C6H4(-O-C(=O)-CH3)(-COOH)
- paracetamol C6H4(-NH-C(=O)-CH3)-1-(-OH)-4
- fenacetină C6H4(-NH-C(=O)-CH3)(-O-CH2-CH3)
Compuși cu două sau mai multe inele benzenice
[modificare | modificare sursă]Aspecte de securitate și de sănătate
[modificare | modificare sursă]
Benzenul este o substanță foarte inflamabilă, amestecul vaporilor săi cu aerul fiind exploziv. Reacționează violent cu oxidanții, acidul azotic, acidul sulfuric și halogenii, cauzând incendii. Atacă plasticul și cauciucul. Poate fi inhalat, ingerat sau poate pătrunde prin piele.[62] Odată intrat în organism, se concentrează în grăsimi și în măduva osoasă, pentru care este toxic, blocând formarea globulelor sangvine în aceasta.[63] Benzenul irită ochii, pielea și căile respiratorii. Înghițirea lichidului poate cauza aspirarea sa în plămâni, acest lucru conducând la pneumonii chimice și la corodarea mucoasei digestive. Substanța poate afecta sistemul nervos central, provocând amețeli prin excitarea și apoi deprimarea lui.

Expunerea la un nivel mai ridicat decât cel admis poate duce la pierderea cunoștinței și la moarte.[62] Benzenul poate afecta sistemul imunitar, scăzând numărul de elemente figurate ale sângelui, urmat de trombocitopenie.[62][64] Este cancerigen pentru oameni, Centrul International de Cercetare a Cancerului incluzându-l pe lista substanțelor cancerigene de grupa 1 (rezervată pentru cel mai ridicat grad de risc), putând provoca leucemie.[65]
Valoarea limită conform legislației României este de 0% începând cu 2010.[66]
Fumul de țigară conține o cantitate mare de acest compus, fiind principalul responsabil pentru expunerea la această toxină. Un fumător inhalează de 10 ori mai mult benzen decât un nefumător, fumatul pasiv de-a lungul vieții crescând riscurile de apariție a cancerului.[67] Philip Landrigan, șeful medicinei preventive la Mount Sinai School of Medicine din New York a declarat că: „Studiile arată rate în exces de leucemie și alte forme apropiate de cancer al sângelui la oameni, îndeosebi la copiii care trăiesc în comunități adiacente rafinăriilor”.[68] În urma unui studiu australian, s-a descoperit că benzenul se află în concentrații prea mari în peste 230 de tipuri de băuturi răcoritoare. Astfel, specialiștii au cerut să se stabilească o anumită limită a compusului în sucuri și comercializarea lor într-o formulă îmbunătățită.[69]
Nicolae Rădulescu Dobrogea, președintele fundației Ecocivica, explică efectele benzenului pe timpul caniculei în București: „se știe că în București, benzenul din resturi de hidrocarburi nearse în motoare depășește de patru până la zece ori concentrația maxim admisă, după măsurătorile făcute de Registrul Auto Român. Benzenul are punctul de fierbere la 80 de grade. Astfel, cu cât temperatura este mai ridicată, cu atât benzenul se eliberează mai rapid și ajunge în cantități mai mari în organism. Intoxicarea cu benzen este dezastruoasă fiindcă este cancerigen și deteriorează ficatul. De asemenea, când temperatura crește foarte mult, mișcarea aerului este mai rapidă, iar praful stă suspendat și prin urmare inhalăm cantități mai mari”.[70]
Note
[modificare | modificare sursă]- ^ „benzen”, benzene (în engleză), PubChem, accesat în
- ^ a b c Avram, pg. 264
- ^ A. J. Rocke (). „Hypothesis and Experiment in the Early Development of Kekule's Benzene Theory”. Annals of Science. 42 (4): 355–81. doi:10.1080/00033798500200411.
- ^ en Pan's Directory of Incense Ingredients Arhivat în , la Wayback Machine.. panspantry.co.uk. Accesat la 7 noiembrie 2009.
- ^ en Acidum Benzoicum. henriettesherbal.com. Accesat la 7 noiembrie 2009.
- ^ en M. Faraday (). „On New Compounds of Carbon and Hydrogen, and on Certain Other Products Obtained during the Decomposition of Oil by Heat”. Philosophical Transactions of the Royal Society of London. 115: 440–466. doi:10.1098/rstl.1825.0022. ISSN 0261-0523.
- ^ en R. Kaiser (). „Bicarburet of Hydrogen. Reappraisal of the Discovery of Benzene in 1825 with the Analytical Methods of 1968”. Angewandte Chemie International Edition in English. 7 (5): 345–350. doi:10.1002/anie.196803451.
- ^ a b c K. C. Nicolaou, Tamsyn Montagnon, Molecules that changed the world, pg.2, Wiley-VCH. ISBN 978-3-527-30983-2.
- ^ William H. Brock, Justus Von Liebig: The Chemical Gatekeeper , Cambridge University Press, 1997. ISBN 0-521-56224-4
- ^ E. Mitscherlich (). „Ueber das Benzol und die Säuren der Oel- und Talgarten”. Annalen der Pharmacie. 9 (1): 39–48. doi:10.1002/jlac.18340090103.
- ^ Henry Marshall Leicester , The historical background of chemistry, Chapman & Hall, 1956, pg. 177. ASIN: B0000CJJFI
- ^ Russian Journal of Applied Chemistry, MAIK Nauka/Interperiodica, vol. 77, pg. 1909-1912. ISSN 1070-4272
- ^ „Le Benzène, de Faraday à Thiele”. Arhivat din original la . Accesat în .
- ^ a b Avram, pg. 265
- ^ F. A. Kekulé (). „Sur la constitution des substances aromatiques”. Bulletin de la Societe Chimique de Paris. 3: 98–110.
- ^ F. A. Kekulé (). „Untersuchungen uber aromatische Verbindungen”. Liebigs Annalen der Chemie. 137: 129–36.
- ^ en Benzene. ch.ic.ac.uk. Accesat la 4 noiembrie 2009.
- ^ a b c d e f g h Cuza Olga, Curs de bazele Chimiei Organice. Hidrocarburi. Universitatea din București, 2008-2009.
- ^ C.D. Nenițescu, Chimie Organică, vol 1. Editura Didactică și Pedagogică, București, 1980, pg 310
- ^ en Woman of substance. rsc.org. Accesat la 4 noiembrie 2009.
- ^ Avram, pg 267
- ^ Hidrocarburi
- ^ en Volatile Organic Compounds Arhivat în , la Wayback Machine.. ace.mmu.ac.uk. Accesat la 7 noiembrie 2009.
- ^ Jacques Denis,Jean Briant,Jean-Claude Hipeaux, Physico-chimie des lubrifiants: analyses et essais. Édition Technip., Paris. ISBN 2-7108-0726-2
- ^ en Process for the preparation of polyisocyanates with a biuret structure. FreePatentsOnline. Accesat la 7 noiembrie 2009.
- ^ en Benzene. accessscience.com. Accesat la 7 noiembrie 2009.
- ^ a b c en Benzene. National Toxicology Program. Accesat la 7 noiembrie 2009.
- ^ a b c E. Brandes, W. Möller, „Sicherheitstechnische Kenndaten - Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH”, Bremerhaven 2003.
- ^ de Benzol[nefuncțională]. biade.itrust.de. Accesat la 7 noiembrie 2009.
- ^ en Tabelas Termodinamica. slideshare.net. Accesat la 7 noiembrie 2009.
- ^ Avram, pg. 282
- ^ Avram, pg. 283
- ^ Avram, pg. 271
- ^ Avram,pg 281
- ^ en Benzene Arhivat în , la Wayback Machine.. toverdict.com. Accesat la 11 decembrie 2009.
- ^ UNESCO - CONVENTION DU PATRIMOINE MONDIAL BUREAU DU COMITÉ DU PATRIMOINE MONDIAL - ÉVALUATIONS DES BIENS CULTURELS (2001)
- ^ en Pittsburgh Post-Gazette - Jan 12, 1974. Google News. Accesat la 19 decembrie 2009
- ^ en Aromatics On-line: benzene. toluene, xylenes - Aromatic Industry Arhivat în , la Wayback Machine.. aromaticsonline.net. Accesat la 19 decembrie 2009.
- ^ Donald L. Burdick, William L. Leffler, „Petrochemicals in nontechnical language”, Ed. Pinwill, ediția a treia, p. 24.
- ^ a b c d e en Benzene Arhivat în , la Wayback Machine.. Yarns and Fibers Exchange. Accesat la 11 decembrie 2009.
- ^ fr Données industrielles, économiques, géographiques sur les principaux produits chimiques, métaux et matériaux Arhivat în , la Wayback Machine.. Société française de chimie. Accesat la 7 noiembrie 2009.
- ^ en Benzene - World Market Outlook And Forecast :: 13 January 2010[nefuncțională]. researchandmarkets.com. Accesat la 11 ianuarie 2009.
- ^ Rafinăria Rafo Onești va fi repornită în 2010. Wall-street.ro. Accesat la 11 ianuarie 2010.
- ^ Oltchim S.A. oltchim.ro. Accesat la 11 ianuarie 2010.
- ^ Produse - Rompetrol Arhivat în , la Wayback Machine.. rompetrol-rafinare.ro. Accesat la 11 ianuarie 2010.
- ^ en MANUFACTURING ARENES. chemguide.co.uk. Accesat la 5 decembrie 2009.
- ^ D. C. Grenoble, „The chemistry and catalysis of the toluene hydrodealkylation reaction”, Elsevier Science, doi:10.1016/0021-9517(79)90085-X.
- ^ en Disproportionation of toluene, benzene and xylenes[nefuncțională]. new.dli.ernet.in. Accesat la 5 decembrie 2009.
- ^ en pyrolysis gasoline Arhivat în , la Wayback Machine.. sabic.com. Accesat la 5 decembrie 2009.
- ^ en Process for converting pyrolysis gasoline to benzene and ethylbenzene-lean xylenes. GooglePantents. Accesat la 5 decembrie 2009.
- ^ fr PROGRAMME D'ACTIONS STRATEGIQUE VISANT A COMBATTRE LA POLLUTION DUE A DES ACTIVITES MENEES A TERRE. United Nations Environment Programme. Accesat la 11 decembrie 2009.
- ^ a b c en LOCATING AND ESTIMATING AIR EMISSIONS FROM SOURCES OF BENZENE. epa.gov. Accesat la 11 decembrie 2009.
- ^ en Benzene[nefuncțională]. waldis.lt. Accesat la 11 decembrie 2009.
- ^ en Additives Arhivat în , la Wayback Machine.. chemcases.com. Accesat la 11 decembrie 2009.
- ^ en The Criminalisation Of Ethyl Alcohol & The Enigma Of Viable Cottage Bio-Refineries In Rural Nigeria. nigerdeltacongress.com. Accesat la 11 decembrie 2009.
- ^ Kolmetz, Gentry, Guidelines for BTX Revamps, AIChE 2007 Spring Conference
- ^ en Commission proposes ambient air quality limit values for benzene and carbon monoxide. europa.eu. Accesat la 11 decembrie 2009
- ^ a b c d Beral, pg. 211
- ^ Beral, pg. 213
- ^ Beral, pg. 212
- ^ Beral, pg. 214
- ^ a b c en Benzene. International Labour Organization. Accesat la 29 noiembrie 2009.
- ^ Benzenul este toxic chiar și în doze foarte mici Arhivat în , la Wayback Machine.. Evenimentul Zilei. Accesat la 29 noiembrie 2009.
- ^ Benzen. sfatulmedicului.ro. Accesat la 29 noiembrie 2009.
- ^ În apărarea sănătății Arhivat în , la Wayback Machine.. profamilia.ro. Accesat la 29 noiembrie 2009.
- ^ ANEXA Nr.1 A.5. Benzen Arhivat în , la Wayback Machine.. ORDIN nr. 592 din 25 iunie 2002 legestart.ro. Accesat la 24 iulie 2011.
- ^ Fumul de țigară. romedic.ro. Accesat la 1 decembrie 2009.
- ^ Rafinăriile cauzează cancer Arhivat în , la Wayback Machine.. Jurnalul Național. Accesat la 1 decembrie 2009.
- ^ Băuturile răcoritoare pot fi cancerigene. ziare.com. Accesat la 1 decembrie 2009.
- ^ În București, canicula ne bagă gaze cancerigene pe gât. Gândul. Accesat la 1 decembrie 2009.
Bibliografie
[modificare | modificare sursă]- Margareta Avram, Chimie organică, vol.1, Editura Zecasin, București, 1994. ISBN 973-96241-3-8.
- Edith Beral, Mihai Zapan, Chimie organică, Editura Tehnică, ediția a cincea, București 1973.
- Constantin D. Albu, Maria Brezeanu, Mică enciclopedie de chimie, Editura Enciclopedică Română, 1974, p 96-97.
- Mircea Iovu, Chimie Organică, ediția a cincea, București 2005, ISBN 973-0-03688-8.
- Linus Pauling, Chimie generală, Editura Științifică, București, 1972 (traducere din limba engleză)
- en Thomas N. Sorrell, Organic chemistry, Editura University Science Books, Sausalito, California, 2005, ISBN 1-891389-38-6. On-line pe GoogleBooks.
- en Joseph M. Hornback, Organic chemistry, Editura Brooks Cole, 2005, ISBN 978-0-534-38951-2. On-line pe GoogleBooks.
- en Archibald Scott Couper, On a New Chemical Theory, în Philosophical Magazine, nr. 16, 1858, p. 104–116 ;
- Josef Loschmidt :
- de Chemische Studien I, Carl Gerold's Sohn, Vienne, 1861,
- de Chemische Studien I, Aldrich Chemical Co, Milwaukee, (catalogul nr. Z-18576-0, 1989 și catalogul nr. Z-18577-9, 1913) ;
- Kathleen Lonsdale :
- en The Structure of the Benzene Ring in Hexamethylbenzene, în Proceedings of the Royal Society, 123A : 494, 1929,
- en An X-Ray Analysis of the Structure of Hexachlorobenzene, Using the Fourier Method, în Proceedings of the Royal Society, 133A : 536, 1931.
Legături externe
[modificare | modificare sursă]| Scholia are un profil de chimicală pentru Benzen. |
- fr Benzenul și derivații săi pe site-ul Societății franceze de chimie
- en Benzen Arhivat în , la Wayback Machine.
- en Filmare a discursului lui John Cadogan despre benzen
- en Profilul substanței





