Amină
| Acest articol sau această secțiune are bibliografia incompletă sau inexistentă. Puteți contribui prin adăugarea de referințe în vederea susținerii bibliografice a afirmațiilor pe care le conține. |
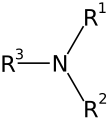
| Amină primară | Amină secundară | Amină terțiară |
|---|---|---|
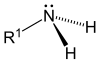
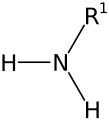
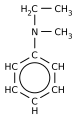
Aminele sunt compuși organici care conțin în molecula lor gruparea amino (-NH2) legată de un radical hidrocarbonat. Aminele sunt asemănătoare din punct de vedere structural cu amoniacul, fiind substanțe derivate formal de la amoniac unde unul sau mai mulți atomi de hidrogen sunt înlocuiți cu substituenți precum grupe alchil sau aril. Formula generală a aminelor primare este de forma , a aminelor secundare , iar a aminelor terțiare , .
Nu trebuie făcută confuzie între amine și amide. Acestea din urmă au formula chimică R-C(O)NH2, unde C(O) reprezintă o grupă carbonil. Aminele și amidele au structuri și deci proprietăți diferite, deci distincția este din punct de vedere chimic foarte importantă.
Aminele în care unul sau ambii atomi de hidrogen din grupa NH2 a aminelor primare sau unicul atom de hidrogen al aminelor secundare este sau sunt înlocuiți cu un atom M de metal,de obicei metal alcalin, se numesc amiduri și sunt săruri ale metalelor, îndeosebi ale metalelor alcaline. Astfel, (CH3)2N-Li+ se numește dimetilamidură de litiu. Acestea sunt combinații litice și sodice ale aminelor.
Clasificare
[modificare | modificare sursă]Amine primare, secundare și terțiare
[modificare | modificare sursă]Deoarece aminele pot fi considerate ca produși rezultați din înlocuirea atomilor de hidrogen din amoniac cu radicali alchil, ele pot fi:
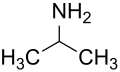
Amine primare - din molecula de amoniac se înlocuiește un singur atom de hidrogen.
-
Structura aminei primare
-
etil amină
-
2 propil amină
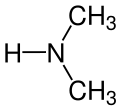
Amine secundare - Din molecula de amoniac se înlocuiesc doi atomi de hidrogen.
-
Structura aminei secundare
-
dimetil amină
-
etil metil amină
Amine terțiare - Din molecula de amoniac se înlocuiesc toți trei atomii de hidrogen.
-
Structura aminei terțiare
-
trimetil amină
-
dietil metil amină
Amine alifatice, aromatice și mixte
[modificare | modificare sursă]În locul hidrogenilor din molecula de amoniac se vor lega radicali. În funcție de tipul acestora, aminele pot fi:
Amine alifatice - Radicalul (sau radicalii) care se leagă de atomul de azot este unul alchil.
-
enamină
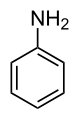
Amine aromatice - Radicalul (sau radicalii) care se leagă de atomul de azot este unul aril.
-
fenil amină (anilină)
-
α naftil amină
Amine mixte - Radicalii care se leagă de atomul de azot sunt o parte alchil și alta aril.
-
etil fenil metil amină
Monoamine și poliamine
[modificare | modificare sursă]Toate aminele prezentate anterior sunt monoamine, însemnând că în moleculă există doar o singură grupare -NH2. Poliaminele au două sau mai multe grupări în moleculă.
-
1,2 etilen diamină
-
1,4 butilen diamină
-
fucsină
Nomenclatură
[modificare | modificare sursă]Aminele se denumesc folosind denumirea radicalilor corespunzători urmați de cuvântul amină. Radicalii sunt denumiți în ordine alfabetică, iar numărul de grupe amino este evidențiat prin prefixele di, tri.
Proprietăți fizice
[modificare | modificare sursă]Legăturile de hidrogen influențează semnificativ proprietățile aminelor primare și secundare, ca și a derivaților lor. Prin urmare, punctele de fierbere ale aminelor sunt ridicate.
Aminele inferioare, precum metil-, dimetil-, etilamina sunt gaze cu un miros de amoniac și sunt solubile în apă. Aminele cu masă moleculară medie sunt lichide, parțial solubile în apă și au un miros de pește descompus (trimetilamina). Aminele superioare, similar alcanilor superiori, sunt solide, inodore și practic insolubile în apă. Cu cât numărul de carboni din catenă este mai mare, solubilitatea lor în apă scade[necesită citare].
Aminele alifatice sunt solubile în solvenți organici, în special în cei polari. Aminele primare reacționează cu cetonele, precum acetona, și majoritatea aminelor sunt incompatibile[formulare evazivă] cu cloroformul sau tetraclorura de carbon.
Aminele aromatice, precum anilina, au punctele de fierbere mai joase decât restul, datorită imposibilității de a crea legături de hidrogen puternice. Tot de aceea solubilitatea lor în apă este redusă, deși se dizolvă în solvenți organici. Aceste amine sunt toxice și sunt foarte ușor absorbite prin piele.
Obținere
[modificare | modificare sursă]Alchilarea amoniacului
[modificare | modificare sursă]Alchilarea amoniacului se face în mai multe etape, rezultând în final un amestec de amine primare, secundare, terțiare și o sare cuaternară de amoniu. Din acest amestec componenții se separă foarte greu, de aceea această metodă nu are un randament bun.
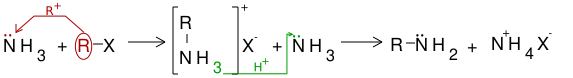
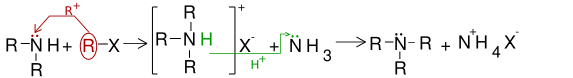

Cu sulfat acid de metil
[modificare | modificare sursă]Pentru a obține amine secundare sau terțiare mixte se folosește în mod special reacția anilinei cu sulfatul acid de metil (CH3OSO3H).
Reducerea nitroderivaților
[modificare | modificare sursă], în prezență de nichel
Reducerea amidelor
[modificare | modificare sursă]
Reducerea nitrililor
[modificare | modificare sursă]
Degradarea oxidativă Hoffman
[modificare | modificare sursă]
Proprietăți chimice
[modificare | modificare sursă]Bazicitatea
[modificare | modificare sursă]Aminele au un dublet electronic neparticipant la atomul de azot. Prezența acestor electroni neparticipanți conferă aminelor un caracter bazic, ei putând accepta un proton.
(hidroxid de alchilamoniu)
Cu apa reacționează mai ales aminele inferioare și cele medii, cele superioare sunt puțin solubile în apă cu urmarea gradului foarte scăzut de reacție corespunzător solubilității reduse[necesită citare].
Ionul hidroxid de alchilamoniu apare în compuși rezultați din reacția cu acizi îndeosebi hidracizi (exceptând acidul azotos HNO2, care are caracter oxidant și distruge grupa amino).
(clorhidratul aminei sau clorură de alchil-, arilamoniu)
Nu toate aminele sunt la fel de bazice. Aminele aromatice sunt mai puțin bazice chiar decât amoniacul. Aminele primare sunt mai bazice decât amoniacul, iar la cele secundare bazicitatea este și mai crescută.
Aminele se pot autoioniza, proces numit autoprotoliză, prin care apar ionii de alchil- sau arilamoniu și alchilamidură sau arilamidură. Se exemplifică pentru aminele primare:
- 2RNH
2 RNH−
RNH−
(ion alchil(aril)amidură) + RNH+
3 (ion alchil(aril)amoniu)
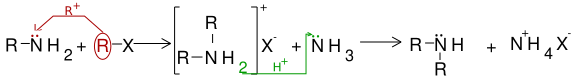
Alchilare
[modificare | modificare sursă]Alchilarea aminelor primare duce la apariția aminelor secundare. Alchilarea acestora produce amine terțiare, iar dacă alchilarea se continuă, apar săruri cuaternare de amoniu.

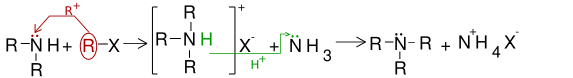

Acilare
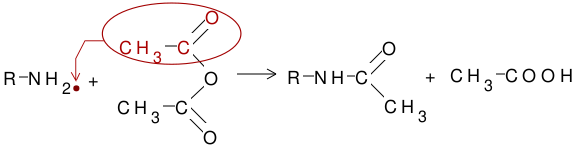
[modificare | modificare sursă]Acilarea aminelor înseamnă înlocuirea unuia sau a ambilor atomi de hidrogen de la gruparea amino. Deci pot fi acilate doar aminele primare și secundare, pentru că doar acestea dispun de atomi de hidrogen legați de azot. Reacția se produce tratând aminele cu acizi organici, cloruri acide sau anhidride acide.


Folosită industrial este reacția de obținere a vitaminei H.
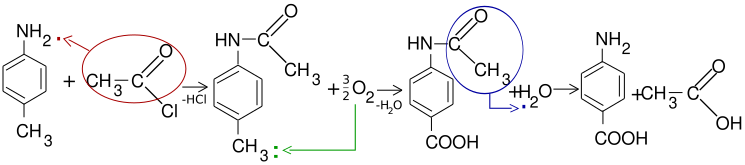
Protejarea grupei amino prin acilare se face față de următorii reactanți: permanganat de potasiu (KMnO4), bicromat de potasiu (K2Cr2O7), oxigen diatomic (O2), acid azotos (HNO2) și halogeni (X).
Diazotare
[modificare | modificare sursă]La această reacție participă doar aminele primare alifatice sau aromatice, reactantul folosit fiind acidul azotos (HNO2). Deoarece HONO este instabil, el se prepară chiar în mediul în care se dorește a fi folosit.
Din diazotarea aminelor alifatice rezultă alcooli și apă. Grupa amino din amină este înlocuită de hidroxilul din acoladă, rezultând astfel alcoolul. Grupa amino se desface și ea, atomii de azot unindu-se, iar cei doi atomi de hidrogen se leagă de oxigenul rămas din acid, formând apa.
Din diazotarea aminelor aromatice rezultă săruri de diazoniu.

Sărurile de diazoniu sunt foarte instabile, de aceea ele sunt supuse, imediat după obținere, altor reacții.



O altă reacție la care pot fi supuse sărurile de diazoniu este reacția de cuplare cu fenoli sau amine aromatice (care pot fi primare, secundare sau terțiare). Din această reacție rezultă azoderivați, care sunt folosiți drept coloranți în industria textilă.


Utilizări
[modificare | modificare sursă]Anilina este cel mai important termen al seriei. Ea se folosește ca materie primă pentru industria coloranților, a medicamentelor și a detergenților.
Aminele primare aromatice sunt materie primă pentru fabricarea coloranților. În reacție cu acidul azotos (HNO2), formează sări de diazoniu, care se supun imediat (datorită instabilității) unor reacții de cuplare, rezultând azoderivați. Aceștia sunt puternic colorați și deci folosiți în special în industria textilă.
Printre substanțele medicamentoase rezultate din amine se numără clorfeniramina, clorpromazina, efedrina, fenilefrina, amfetamina, metamfetamina, metcatinona.