Chlorek miedzi(II)
Chlorek miedzi(II), CuCl
2 – nieorganiczny związek chemiczny z grupy chlorków, sól kwasu solnego i miedzi na II stopniu utlenienia.
| |||||||||||||||||||||
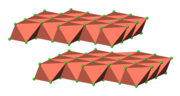 Budowa tolbachitu (bezwodnego CuCl 2) | |||||||||||||||||||||
| |||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||
| Wzór sumaryczny |
CuCl | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
134,45 g/mol | ||||||||||||||||||||
| Wygląd |
żółtobrązowe, higroskopijne kryształy[1] | ||||||||||||||||||||
| Minerały | |||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||
| PubChem | |||||||||||||||||||||
| DrugBank | |||||||||||||||||||||
| |||||||||||||||||||||
| |||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||
| Inne aniony | |||||||||||||||||||||
| Inne kationy | |||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||
Dihydrat chlorku miedzi(II) ma postać szmaragdowozielonych kryształów. W tej formie występuje jako rzadki minerał eriochalcyt. Otrzymać go można poprzez roztworzenie węglanu miedzi(II) w kwasie solnym.
Bezwodny chlorek miedzi występuje w postaci brązowego ciała stałego (minerał tolbachit). Można go otrzymać, spalając miedź w nadmiarze chloru lub poprzez odwodnienie dihydratu za pomocą stężonego kwasu siarkowego.
Wodne roztwory chlorku miedzi(II) są zielone, natomiast w dużym rozcieńczeniu mają barwę niebieską.
W obecności nadmiaru jonów chlorkowych tworzy związki kompleksowe: CuCl−
3 (czerwony) i CuCl2−
4 (żółty)[5].

Budowa
edytujBezwodny CuCl
2 przyjmuje zniekształconą strukturę jodku kadmu. Atomy miedzi są środkami ośmiościanów (oktaedrów) foremnych. Większość związków miedzi(II) wykazuje zniekształcenia względem idealnej ośmiościennej geometrii na skutek efektu Jahna-Tellera. W cząsteczce CuCl
2·2H
2O, miedź także przyjmuje mocno zniekształconą geometrię oktaedryczną, gdzie centra CuII
są otoczone przez dwa ligandy H
2O oraz cztery ligandy Cl−
[6].
Chlorek miedzi(II) jest paramagnetyczny. CuCl
2·2H
2O był użyty w pierwszym pomiarze elektronowego rezonansu paramagnetycznego dokonanym przez Jewgienija Zawojskiego w 1944 r.[7][8]
Przypisy
edytuj- ↑ a b c d e CRC Handbook of Chemistry and Physics, David R. Lide (red.), wyd. 88, Boca Raton: CRC Press, 2007, s. 4-61, ISBN 978-0-8493-0488-0 (ang.).
- ↑ Tolbachite, [w:] Mindat.org [online], Hudson Institute of Mineralogy [dostęp 2020-12-01] (ang.).
- ↑ Eriochalcite, [w:] Mindat.org [online], Hudson Institute of Mineralogy [dostęp 2020-12-01] (ang.).
- ↑ a b c Chlorek miedzi(II) [online], karta charakterystyki produktu Sigma-Aldrich, numer katalogowy: 203149 [dostęp 2020-12-01]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ N.S. Gill i inni, Tetrahalo Complexes of Dipositive Metals in the First Transition Series, „Inorganic Syntheses”, 9, 1967, s. 136–142, DOI: 10.1002/9780470132401.ch37 (ang.).
- ↑ A.F. Wells, Structural Inorganic Chemistry, Oxford: Clarendon Press, 1984, ISBN 0-19-855370-6 (ang.).
- ↑ Peter Baláž, Mechanochemistry in Nanoscience and Minerals Engineering, Springer, 2008, s. 167, DOI: 10.1007/978-3-540-74855-7, ISBN 3-540-74854-7 (ang.).
- ↑ Carlo Corvaja, Introduction to Electron Paramagnetic Resonance, [w:] Marina Brustolon, Elio Giamello (red.), Electron Paramagnetic Resonance: A Practitioner’s Toolkit, John Wiley and Sons, 2009, s. 3, DOI: 10.1002/9780470432235.ch1, ISBN 0-470-25882-9 (ang.).

