Ftaalzuur
Ftaalzuur, 1,2-benzeendicarbonzuur of orthoftaalzuur is een aromatische verbinding met twee carboxylgroepen, waardoor het behoort tot de stofklasse der dicarbonzuren. De stof komt voor als een kleurloos kristallijn poeder, dat goed oplosbaar is in basen.
| Ftaalzuur | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
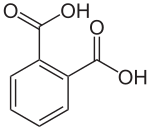
| ||||
Structuurformule van ftaalzuur
| ||||
| Algemeen | ||||
| Molecuulformule | C8H6O4 | |||
| IUPAC-naam | benzeen-1,2-dicarbonzuur | |||
| Andere namen | orthoftaalzuur | |||
| Molmassa | 166,14 g/mol | |||
| SMILES | C1=CC=C(C(=C1)C(=O)O)C(=O)O
| |||
| CAS-nummer | 88-99-3 | |||
| EG-nummer | 201-873-2 | |||
| Wikidata | Q423876 | |||
| Beschrijving | Kristallijne witte stof | |||
| Vergelijkbaar met | Benzoëzuur | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H315 - H319 - H335 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P261 - P305+P351+P338 | |||
| Omgang | Contact met de huid vermijden | |||
| Opslag | In een afgesloten recipiënt | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 1,59 g/cm³ | |||
| Smeltpunt | (ontleedt) 191 °C | |||
| Vlampunt | 168 °C | |||
| Oplosbaarheid in water | (bij 20 °C) 5,74 g/L | |||
| Goed oplosbaar in | basen | |||
| Slecht oplosbaar in | ethanol, koud water | |||
| Onoplosbaar in | chloroform, di-ethylether, azijnzuur | |||
| Evenwichtsconstante(n) | pKa1 = 2,89[1] pKa2 = 5,51 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Isomeren
bewerkenIn de klassieke organische chemie waren isomeren lang niet altijd eenvoudig van elkaar te onderscheiden. Om die reden zijn de isomeren van ftaalzuur als speciale gevallen van ftaalzuur benoemd:
- isoftaalzuur of 1,3-benzeendicarbonzuur
- tereftaalzuur of 1,4-benzeendicarbonzuur
Eigenschappen
bewerkenVoor ftaalzuur is de eerste ionisatiestap relatief sterk (pKa1 = 2,95). Dit heeft te maken met de interne waterstofbrugvorming die mogelijk is tussen de ontstane carboxylaatgroep en de nog niet gedeprotoneerde carboxylgroep. Het gevolg is dat de tweede stap relatief zwak is (pKa2 = 5,4).
Door ftaalzuur te verwarmen kan het corresponderende carbonzuuranhydride, ftaalzuuranhydride, verkregen worden.
Ftalaten
bewerkenZouten en esters van ftaalzuur worden ftalaten genoemd. Zij kennen verschillende toepassingen.
Esters van ftaalzuur
bewerkenDe esters worden gevormd door de reactie van alcoholen met ftaalzuur, gekatalyseerd door een sterk zuur (meestal zwavelzuur of p-tolueensulfonzuur). Ftalaten worden als weekmaker aangewend en gemengd met pvc om het flexibel te maken, onder meer voor gebruik in elektriciteitskabels en in babyspeelgoed.
Voor de verpakking van bloed- en plasmatransfusiemateriaal wordt pvc-gecoat met bis(2-ethylhexyl)ftalaat (DEHP). Ftalaten komen verder voor in drukinkten, rubber en lijmen.
De weekmakers lossen ook op in organische oplosmiddelen. Als deze bij een extractie gebruikt worden in de synthetisch organische chemie zijn de weekmakers berucht als verontreiniging van kleine hoeveelheden reactieproduct.
Zouten van ftaalzuur
bewerkenIn de analytische chemie speelt kaliumwaterstofftalaat (bij een van de twee zuurgroepen is het waterstofion vervangen door kalium) een belangrijke rol als oertiterstof bij zuur-basetitraties. Opgelost in water komt de zuurgroep H(C8H4O4)− vrij, die één op één kan reageren met natronloog. Kaliumwaterstofftalaat wordt ook vaak gebruikt als buffer voor het ijken van pH-meters.
Toxicologie en veiligheid
bewerkenFtaalzuur en de vele afgeleide ftalaten zijn giftig, en kunnen vrijkomen bij de verbranding van pvc. Er bestaat geen eensgezindheid over de vraag hoe groot het schadelijk effect is, zolang verbranding niet plaatsvindt.
De stof is erg schadelijk wanneer ze in contact komt met de ogen. Ook bij inslikken of inhalatie ontstaat irritatie, onder meer aan de keel, de slokdarm, de luchtpijp en het maag-darmstelsel. Ftaalzuur is corrosief voor de ogen en de huid. Het kan blindheid, blaarvorming, ontstekingen en zelfs lichte brandwonden veroorzaken. Langdurige of intense blootstelling kan longschade veroorzaken en leiden tot bewusteloosheid of zelfs de dood.
Externe links
bewerken- ↑ . (1983). GEEN TITEL OPGEGEVEN Handbook of Chemistry and Physics (64th ed.) – CRCpress
