Chloorbenzeen
Chloorbenzeen is een aromatische organische verbinding met als brutoformule C6H5Cl. Chloorbenzeen is een kleurloze, brandbare vloeistof die veel gebruikt wordt als oplosmiddel. Chloorbenzeen is ook tussenproduct in de bereiding van een groot aantal andere stoffen.
| Chloorbenzeen | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
| |||||
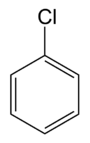
Structuurformule van chloorbenzeen
| |||||
| |||||
Molecuulmodel van chloorbenzeen
| |||||
| Algemeen | |||||
| Molecuulformule | C6H5Cl | ||||
| IUPAC-naam | chloorbenzeen | ||||
| Andere namen | fenylchloride | ||||
| Molmassa | 112,56 g/mol | ||||
| SMILES | ClC1=CC=CC=C1
| ||||
| CAS-nummer | 108-90-7 | ||||
| EG-nummer | 203-628-5 | ||||
| Wikidata | Q407768 | ||||
| Beschrijving | Kleurloze vloeistof | ||||
| Vergelijkbaar met | benzeen, fluorbenzeen | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H226 - H332 - H411 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P273 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vloeibaar | ||||
| Kleur | kleurloos | ||||
| Dichtheid | 1,1100 g/cm³ | ||||
| Smeltpunt | −45 °C | ||||
| Kookpunt | 130 °C | ||||
| Vlampunt | 29 °C | ||||
| Brekingsindex | 1,522 | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Synthese
bewerkenChloorbenzeen werd voor het eerst in 1851 beschreven. Het werd bereid uit fenol en fosforpentachloride. Tegenwoordig wordt de verbinding elektrolytisch bereid uit een anorganisch chloride en benzeen in aanwezigheid van een katalytische hoeveelheid lewiszuur zoals ijzer(III)chloride:
De katalysator verhoogt het elektrofiele karakter van chloor, waardoor de reactie tussen benzeen en chloor sneller verloopt. De chloorsubstituent heeft een desactiverende werking voor verdere reactie, zodat chloorbenzeen nauwelijks tot een van de dichloorbenzenen of hoger gechloreerde verbindingen wordt omgezet. Hierdoor ontstaan tijdens het chloreren slechts zeer kleine hoeveelheden van deze verbindingen.
Toepassingen
bewerkenChloorbenzeen werd gebruikt in de bereiding van pesticiden. Uit de reactie van chloorbenzeen met trichlooracteetaldehyde ontstaat DDT. Tegenwoordig is deze toepassing niet meer belangrijk door het wereldwijde verbod op gebruik van DDT. Ooit was chloorbenzeen de belangrijkste uitgangsstof in de bereiding van fenol:[1]
In 2005 is chloorbenzeen vooral een uitgangsstof in de bereiding van herbiciden, kleurstoffen en rubber. Chloorbenzeen wordt ook gebruikt als een hoog-kokend oplosmiddel, zowel in de chemische industrie als in het laboratorium. De eerste stap in veel syntheses is het nitreren van chloorbenzeen tot chloornitrobenzeen, dat op zijn beurt weer omgezet wordt in de overeenkomstige fenolen, anisolen en anilines.[2]
Toxicologie en veiligheid
bewerkenChloorbenzeen heeft een lage tot gemiddelde toxiciteit (LD50 van 2,9 g/kg).[2]
Zie ook
bewerken- ↑ Manfred Weber, Markus Weber, Michael Kleine-Boymann, Phenol in Ullmann’s Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2005. DOI:10.1002/14356007.a19 299.pub2
- ↑ a b Manfred Rossberg et al. Chlorinated Hydrocarbons in Ullmann’s Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2006. DOI:10.1002/14356007.a06 233.pub2


