Fosfina
La fosfina (fosfano secondo la nomenclatura IUPAC, idruro di fosforo o triidruro di fosforo) è il composto chimico di formula molecolare PH3. È un gas incolore e infiammabile con un punto di ebollizione di 185 K (-88 °C) a pressione atmosferica. Il fosfano puro è inodore, ma il fosfano "da laboratorio" ha un odore altamente sgradevole di aglio o pesce in decomposizione, dovuto alla presenza di fosfano sostituito e del difosfano P2H4.
| Fosfina | |
|---|---|
 | |
| Nome IUPAC | |
| Fosfano Triidruro di fosforo | |
| Nomi alternativi | |
| Idruro fosforoso Idruro di fosforo (III) Idrogeno fosforato | |
| Caratteristiche generali | |
| Formula bruta o molecolare | PH3 |
| Peso formula (u) | 34 g/mol |
| Aspetto | gas incolore |
| Numero CAS | |
| Numero EINECS | 232-260-8 |
| PubChem | 24404 |
| SMILES | P |
| Proprietà chimico-fisiche | |
| Densità (kg·m−3, in c.s.) | 1,37 |
| Solubilità in acqua | 31,1 g/L a 290 K |
| Temperatura di fusione | −134 °C (139 K) |
| Temperatura di ebollizione | −88 °C (185 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | 5,4 |
| ΔfG0 (kJ·mol−1) | 13,5 |
| S0m(J·K−1mol−1) | 210,2 |
| C0p,m(J·K−1mol−1) | 37,1 |
| Indicazioni di sicurezza | |
| Temperatura di autoignizione | 38 °C (311 K) |
| Simboli di rischio chimico | |
   
| |
| pericolo | |
| Frasi H | 330 - 220 - 314 - 280 - 400 |
| Consigli P | 260 - 280 - 210 - 273 - 304+340 - 303+361+353 - 305+351+338 - 315 - 377 - 381 - 405 - 403 [1] |
La fosfina è altamente tossica e può uccidere facilmente anche a concentrazioni relativamente basse. A causa di ciò, il gas è usato per il controllo dei parassiti tramite fumigazione. Nelle aziende agricole è usato spesso sotto forma di palline di fosfuro di alluminio, che producono la fosfina a contatto con l'acqua atmosferica. Queste palline inoltre contengono altri prodotti chimici che sviluppano ammoniaca contribuendo a ridurre il potenziale di autoignizione o esplosione del gas della fosfina. Inoltre contengono altri agenti (fondamentalmente mercaptani) per dare al gas un odore di aglio rivelandone la presenza nell'atmosfera. La fosfina è usata come drogante nell'industria dei semiconduttori. Si ritiene la presenza di questo composto alla base del fenomeno dei "fuochi fatui".
Struttura e proprietà
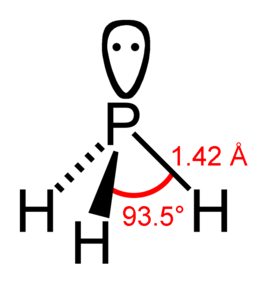
modificaLa molecola del PH3 è a forma di piramide trigonale, ossia ha simmetria C3v con lunghezza dei legami pari 1,42 Å (1,42×10−10 m) e gli angoli di legame con ampiezza pari a 93,5°. Il momento dipolare è 0,58 D, che aumenta con la sostituzione progressiva dei gruppi metilici: CH3PH2, 1,10 D; (CH3)2PH, 1,23 D; (CH3)3P, 1,19 D. Ciò contrappone con l'ammoniaca, che ha un momento dipolare di 1,47 D, che diminuisce con le sostituzioni metiliche successive. Il momento dipolare basso e gli angoli di legame quasi ortogonali portano alla conclusione che in PH3 i legami di P-H siano quasi interamente pσ(P)-sσ(H) e la coppia di elettroni contribuisca solo minimamente alla forma degli orbitali molecolari. Questa struttura elettronica conduce a una mancanza di basicità e alla incapacità di formare legami idrogeno.
La solubilità in acqua di PH3 è bassa; circa 0,22 mL di gas/mL di acqua a saturazione. La fosfina si scioglie più prontamente in solventi non polari che in acqua. In essa non funge né da acido né da base. Lo scambio protonico avviene via ione fosfonio (PH4+) nelle soluzioni acide e via PH2- nelle soluzioni alcaline, con costanti di dissociazione Ka = 4×10−28 M e Kb = 41,6×10−29 M.
Storia
modificaForse a causa della forte associazione con il fosforo elementare, il fosfano era ritenuta la forma gassosa dell'elemento finché Lavoisier (1789) la riconobbe come combinazione di fosforo con idrogeno additandola quale hydruyet di fosforo, o phosphuret di idrogeno.
Meyer (1891) descrisse così la storia sulla ricerca del fosfano: "La scoperta del fosfuro di idrogeno PH3 da parte di Gengembre nel 1783 e le analisi di Pelletier (che fu il primo a prepararlo puro), è divenuto fruttuoso solo dopo le indagini di Davy; costui ha delucidato la composizione di questo gas ed ha precisato la relativa analogia con l'ammoniaca, dato risaltato ancora più acutamente da H. Rose più tardi."
Thénard (1845) ha usato una presa fredda per separare il difosfano P2H4 dal fosfano a sua volta generata dal fosfuro di calcio, previa dimostrazione che P2H4 è responsabile di autoignizione se connessa con PH3. Egli considerava la formula del difosfano quale PH2, un intermediario fra fosforo elementare, i polimeri superiori e il fosfano. Il fosfuro di calcio (nominalmente Ca3P2) produce più difosfina di qualunque altro fosfuro a causa della preponderanza dei legami dei P-P nel prodotto base.
Sintesi
modificaIl fosfano può essere preparato in gran varietà di modi[2]. Può essere prodotto su scala industriale dalla reazione del fosforo bianco con l'idrossido di sodio, producendo ipofosfito di sodio come sottoprodotto. Può essere fatto (come descritto precedentemente) tramite l'idrolisi di un fosfuro di metallo quali il fosfuro di alluminio o il fosfuro di calcio. I campioni puri di fosfano, esenti da P2H4, possono essere preparati usando l'azione dell'idrossido di potassio sullo ioduro di fosfonio (PH4I).
Si associa al PH3 la categoria di composti comunemente denominati fosfine. Questi sono derivati alchilici o arilici del fosfano, così come le ammine possono essere considerate i derivati dell'ammoniaca. Esempi comuni includono il trifenilfosfano (C6H5)3P e il BINAP, entrambi usati come chelanti del fosfano in complessi metallici, quali il catalizzatore di Wilkinson. Tali fosfani sono spesso presenti come co-catalizzatori nelle reazioni come l'accoppiamento di Sonogashira.
Biosintesi
modificaLe fosfine possono essere prodotte per via enzimatica da microorganismi anaerobi. La funzione di questo prodotto è sconosciuta ma si ritiene possa trattarsi di un repellente per possibili competitori o di un prodotto di scarto. [3]
A settembre 2020 sono state rese pubbliche ricerche che hanno evidenziato la presenza di fosfina nell'atmosfera di Venere.[4][5]
Dato che sulla Terra la presenza di fosfina è legata esclusivamente all'attività antropica o alla presenza di forme di vita le fosfine sono considerate una possibile firma biologica (biosignature), [6] per quanto potrebbero essere il risultato di reazioni geochimiche o elettrochimiche ancora non osservate.[5]
Note
modifica- ^ scheda della fosfina su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ A.D.F. Toy, The Chemistry of Phosphorus, Pergamon Press, Oxford, UK, 1973.
- ^ https://www.wired.it/scienza/spazio/2020/09/15/fosfina-scoperta-venere/
- ^ https://www.focus.it/scienza/spazio/fosfina-nelle-nuvole-di-venere-una-firma-chimica-compatibile-con-la-vita
- ^ a b (EN) Jane S. Greaves, Anita M. S. Richards e William Bains, Phosphine gas in the cloud decks of Venus, in Nature Astronomy, 14 settembre 2020, pp. 1–10, DOI:10.1038/s41550-020-1174-4. URL consultato il 14 settembre 2020.
- ^ Sousa-Silva C, Seager S, Ranjan S, et al. Phosphine as a Biosignature Gas in Exoplanet Atmospheres. Astrobiology. 2020;20(2):235-268. doi: 10.1089/ast.2018.1954
Altri progetti
modifica- Wikiquote contiene citazioni di o su fosfina
- Wikimedia Commons contiene immagini o altri file su fosfina
Collegamenti esterni
modifica- Scheda di sicurezza della fosfina
| Controllo di autorità | J9U (EN, HE) 987007543512905171 · NDL (EN, JA) 00576134 |
|---|

