Diossido di piombo
Il diossido di piombo o ossido di piombo(IV) è un ossido del piombo con formula PbO2. In condizioni normali è un solido inodore di colore nero-marrone scuro, praticamente insolubile in acqua. È un ossido dove il piombo risulta essere nello stato di ossidazione +4. Il diossido di piombo è un forte ossidante utilizzato nella fabbricazione di fiammiferi, di materiali pirotecnici e di altri prodotti chimici. Su tutti gli autoveicoli sono diffusissimi gli accumulatori al piombo, contenenti elettrodi di diossido di piombo.[2][3]
| Diossido di piombo | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| diossido di piombo, ossido di piombo(IV) | |
| Nomi alternativi | |
| ossido piombico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | PbO2 |
| Massa molecolare (u) | 239,20 |
| Aspetto | solido nero-marrone scuro |
| Numero CAS | |
| Numero EINECS | 215-174-5 |
| PubChem | 14793 |
| SMILES | O=[Pb]=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 9,4[1] |
| Solubilità in acqua | 0,14 mg/l[1] |
| Temperatura di fusione | 290 °C (563 K) dec.[1] |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | –277,6[2] |
| ΔfG0 (kJ·mol−1) | –217,5[2] |
| S0m(J·K−1mol−1) | 68,7[2] |
| C0p,m(J·K−1mol−1) | 64,6[2] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
   
| |
| pericolo | |
| Frasi H | 272 - 360Df - 302+332 - 373 - 410 [1] |
| Consigli P | 201 - 210 - 261 - 273 - 280 - 308+313 [1] |
Struttura
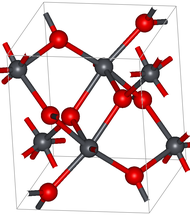
modificaIl diossido di piombo esiste in due polimorfi, denominati alfa e beta, che esistono in natura rispettivamente nei due minerali rari scrutinyite e plattnerite. La forma β-PbO2 era già stata identificata nel 1845,[4] mentre la forma α-PbO2 fu sintetizzata per la prima volta nel 1946 e trovata in natura come minerale nel 1981.[5]
La forma alfa ha struttura cristallina ortorombica, gruppo spaziale Pbcn (gruppo n° 60), con costanti di reticolo a = 497 pm, b = 596 pm e c = 544 pm, con quattro unità di formula per cella elementare. Gli atomi di piombo sono esacoordinati e la struttura consiste di ottaedri legati tramite lati adiacenti per formare catene a zig-zag.[5]
La forma beta ha struttura cristallina tetragonale, gruppo spaziale P42/mnm (gruppo n°136), con costanti di reticolo a = 496,1 pm e c = 338,5 pm, con due unità di formula per cella elementare. Questa struttura è tipo rutilo, ed è costituita da colonne di ottaedri che condividono lati opposti e sono unite ad altre catene tramite i vertici.[5][6]
Produzione
modificaIndustriale
modificaIl diossido di piombo viene prodotto commercialmente con diversi metodi, che includono l'ossidazione del piombo rosso (Pb3O4) in un impasto liquido alcalino in un'atmosfera di cloro[7], reazione del diacetato di piombo con cloruro di calce (ipoclorito di calcio)[8][9], La reazione di Pb3O4 con acido nitrico fornisce anche il diossido:[10][11]
Negli accumulatori a piombo il diossido di piombo viene depositato sull'anodo elettrolizzando una soluzione di sali di piombo in ambiente acido. Altri metodi di sintesi sono: l'ossidazione con cloro di una sospensione di solfato di piombo (PbSO4) e idrossido di magnesio (Mg(OH)2), l'ossidazione di Pb3O4 con acido nitrico, la fusione di PbO con una miscela di nitrato di sodio e clorato di sodio.[2] Come ossidante si può usare anche ipoclorito.[12]
Elettrolisi
modificaUn metodo di sintesi alternativo è elettrochimico: il diossido di piombo si forma sul piombo puro, in acido solforico diluito, quando polarizzato anodicamente al potenziale dell'elettrodo di circa +1,5 V a temperatura ambiente. Questa procedura viene utilizzata per la produzione industriale su larga scala di anodi di diossido di piombo. Gli elettrodi di piombo e rame sono immersi in acido solforico che scorre ad una velocità di 5-10 L/min. L'elettrodeposizione viene effettuata galvanostaticamente, applicando una corrente di circa 100 A/m2 per circa 30 minuti.
Lo svantaggio di questo metodo per la produzione di anodi di diossido di piombo è la sua morbidezza, soprattutto rispetto al diossido di piombo duro e fragile che ha una durezza su scala di Mohs pari a 5,5[13]. Questa discrepanza nelle proprietà meccaniche provoca il distacco del rivestimento che è preferito per la produzione di massa di diossido di piombo. Pertanto, un metodo alternativo consiste nell'utilizzare substrati più duri, come titanio, niobio, tantalio o grafite e depositare su di essi diossido di piombo dal nitrato di piombo(II) in acido nitrico statico o fluido. Il substrato viene solitamente sabbiato prima della deposizione per rimuovere l'ossido superficiale e la contaminazione e per aumentare la rugosità superficiale e l'adesione del rivestimento[14].
Reattività
modificaIl diossido di piombo è fortemente ossidante e mostra un comportamento anfotero (può reagire sia con acidi che con basi). Reagendo con acidi agisce anche da ossidante e forma in genere composti di Pb(II). Ad esempio in acido cloridrico concentrato a caldo forma cloruro di piombo(II) e libera cloro gassoso; con acido solforico o nitrico forma il sale di piombo(II) e libera ossigeno:[2][3]
In alcune condizioni si possono produrre anche sali di piombo(IV), ad esempio in acido cloridrico a freddo:
Per fusione con idrossido di sodio (NaOH) forma ortopiombati e metapiombati (Na4PbO4 e Na2PbO3), mentre sciogliendosi in presenza di basi forti si forma lo ione idrossipiombato, Pb(OH)62−:[2]
Per riscaldamento all'aria il diossido di piombo si decompone progressivamente a seconda della temperatura:[3]
La stechiometria del prodotto finale può essere controllata modificando la temperatura: ad esempio, nella reazione di cui sopra, la prima fase avviene a 290 °C, la seconda a 350 °C, la terza a 375 °C e la quarta a 600 °C. Inoltre, Pb2O3 può essere ottenuto decomponendo diossido di piombo a 580-620 °C sotto una pressione di ossigeno di 1400 atm (140 MPa). Pertanto, la decomposizione termica del diossido di piombo è un modo comune di produrre vari ossidi del piombo.[7]
Reagisce anche con gli ossidi basici producendo ortopiombati M4[PbO4].
A causa dell'instabilità del suo catione Pb4+, il diossido di piombo reagisce con gli acidi caldi, convertendosi allo stato più stabile Pb2+ e liberando ossigeno:[7]
Tuttavia queste reazioni sono lente.
Il diossido di piombo è ben noto per essere un buon agente ossidante, con un esempio di reazioni elencate di seguito:[15]
Usi
modificaIl diossido di piombo viene usato principalmente negli accumulatori a piombo. In altri utilizzi è sfruttato come ossidante nella preparazione di prodotti chimici, pigmenti, fiammiferi, fuochi d'artificio ed esplosivi.[3]
Tossicità / Indicazioni di sicurezza
modificaIl diossido di piombo è un forte ossidante, irritante per contatto con occhi e mucose. Risulta tossico se ingerito o inalato. I sintomi di avvelenamento cronico comprendono vertigini, insonnia, debolezza, dolori muscolari. A lungo andare si hanno danni al sistema nervoso centrale e ai reni. Avvelenamenti acuti provocano sapore metallico, vomito, costipazione, coliche addominali, disfunzioni renali, cali di pressione, collasso. Il diossido di piombo è un composto tossico per la riproduzione. Non risultano informazioni su eventuali effetti cancerogeni. Il diossido di piombo è inoltre pericoloso per gli organismi acquatici.[1]
Note
modifica- ^ a b c d e f GESTIS 2016
- ^ a b c d e f g h Patnaik 2003
- ^ a b c d Greenwood e Earnshaw 1997
- ^ Haidinger 1845
- ^ a b c Taggart et al. 1988
- ^ Harada et al. 1981
- ^ a b c (EN) Greenwood, N.N. e Earnshaw, A., Chemistry of the Elements, 2ª ed., Butterworth-Heinemann, 1997, ISBN 978-0-7506-3365-9.
- ^ (EN) M. Baulder, Lead(IV) Oxide, in Handbook of Preparative Inorganic Chemistry, vol. 1, 2ª ed., New York, Academic Press, 1963, p. 758.
- ^ (DE) Nils Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, de Gruyter, 2007, p. 919, ISBN 978-31-10-17770-1.
- ^ (EN) Mary Eagleson, Concise Encyclopedia of Chemistry, Walter de Gruyter, 1994, p. 590, ISBN 978-31-10-11451-5.
- ^ (EN) Arthur Sutcliffe, Practical Chemistry for Advanced Students, Londra, John Murray, 1930.
- ^ Holleman e Wiberg 2007
- ^ (EN) Plattnerite: Plattnerite mineral information and data, su mindat.org. URL consultato il 12 aprile 2018.
- ^ (EN) François Cardarelli, Materials Handbook: A Concise Desktop Reference, Springer, 2008, p. 574, ISBN 978-18-46-28668-1.
- ^ (EN) Anil Kumar De, A Textbook of Inorganic Chemistry, New Age International, 2007, p. 387, ISBN 978-81-22-41384-7.
Bibliografia
modifica- (EN) D. S. Carr, Lead compounds, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a15_249.
- GESTIS, Lead(IV) oxide, su gestis.dguv.de, 2016. URL consultato il 18 dicembre 2022. Pagina dell'ossido di piombo(IV) nel data base GESTIS.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (DE) W. Haidinger, Handbuch der Bestimmenden Mineralogie (PDF), Vienna, Braumüller & Seidel, 1845, p. 504.
- (EN) H. Harada, Y. Sasa e M. Uda, Crystal data for β-PbO2, in Journal of Applied Crystallography, vol. 14, 1981, pp. 141-142, DOI:10.1107/S0021889881008959.
- (DE) A. F. Holleman e N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1.
- (EN) P. Patnaik, Handbook of inorganic chemicals, New York, McGraw-Hill, 2003, ISBN 0-07-049439-8.
- (EN) J. E. Taggart Jr., E. E. Foord, A. Rosenzweig e T. Hanson, Scrutinyite, natural occurrence of α-PbO2 from Bingham, New Mexico, U.S.A., and Mapimi, Mexico (PDF), in Canadian Mineralogist, vol. 26, 1988, pp. 905-910.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Diossido di piombo