Dextropropoxyphène
| Dextropropoxyphène | |
| |
| Identification | |
|---|---|
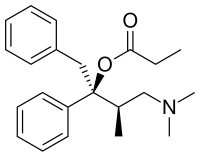
| Nom UICPA | propanoate de (2R,3R)-4-diméthylamino-3-méthyl-1,2-diphényl-butan-2-yle |
| No CAS | |
| No ECHA | 100.006.747 |
| Code ATC | N02 |
| PubChem | 10100 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C22H29NO2 [Isomères] |
| Masse molaire[1] | 339,471 2 ± 0,020 4 g/mol C 77,84 %, H 8,61 %, N 4,13 %, O 9,43 %, |
| Données pharmacocinétiques | |
| Biodisponibilité | 100 % (IV) |
| Métabolisme | Hépatique (nordextropropoxyphène) |
| Demi-vie d’élim. | 13 heures (2 - 26) |
| Excrétion | |
| Considérations thérapeutiques | |
| Classe thérapeutique | Antalgique opioïde faible |
| Voie d’administration | Orale |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|

Le dextropropoxyphène (DPX) est un analgésique opioïde synthétique. Agissant sur les récepteurs opioïdes, il est quinze fois moins puissant que la morphine. Il est commercialisé seul (Antalvic) ou en association avec des analgésiques de faible puissance comme le paracétamol (Di-Antalvic par exemple) et est indiqué dans les douleurs d'intensité modérée à forte. Comme la codéïne et le tramadol, il est classé comme antalgique de niveau 2 par l’OMS.
Retrait du marché
[modifier | modifier le code]Alors que la commercialisation du DPX datait d'environ 45 ans[2], l'Agence européenne des médicaments (AEM) a recommandé en 2009 le retrait progressif en Europe des médicaments contenant cette molécule du fait des risques, mortels en cas de surdosage, qu'ils présentaient[3]. Cela concernait une trentaine de médicaments[4]. L'AEM considérait que « les preuves d'efficacité thérapeutique (étaient) insuffisantes au regard du risque de mort, en cas de surdosage accidentel ou volontaire » et concluait « qu'aucune mesure complémentaire permettant de minimiser le risque ne pourrait être suffisante pour éviter les conséquences graves d'un surdosage »[5].
Cas de la France
[modifier | modifier le code]Les Français étaient de très loin les plus gros consommateurs européens de l'association dextropropoxyphène/paracétamol, représentant à eux seuls 95 % de la consommation européenne. En 2007, le Di-Antalvic constituait le 28e médicament le plus remboursé en France, avec 7,4 millions de boîtes prescrites[2].
Le Propofan (association de dextropropoxyphène, paracétamol et caféine), était aussi largement prescrit, notamment en cas de dorsopathie ou d'arthrose[6],[7],[8].
L'avis de l'AEM a été finalement suivi par l'Agence française de sécurité sanitaire des produits de santé (Afssaps), qui a décidé qu'à partir du , les médicaments contenant du dextropropoxyphène feraient l'objet d'un retrait d’autorisation de mise sur le marché. Initialement, elle estimait qu'ils présentaient « un profil de sécurité d'emploi satisfaisant dans des conditions normales d'utilisation », et soulignait que, même si ces médicaments étaient à l'origine de nombreux décès du fait d'intoxications volontaires ou accidentelles, ce n'était pas le cas en France, où d'autres médicaments étaient choisis pour les tentatives de suicide, et où le mode de conditionnement et les conditions de délivrance étaient différentes[5].
En effet, alors que l'AEM constatait entre 200 et 300 décès par an en Suède et en Angleterre, où le conditionnement en flacon favorisait le surdosage, l’Agence française ne relevait que 65 décès chaque année, alors que huit millions de Français prenaient des médicaments à base de dextropropoxyphène[9]. Une autre source rapportait sept décès par an en France après une enquête effectuée auprès des centres antipoison pour la période 1995-2003[2]. D’après l’Afssaps, le rapport bénéfices/risques plaidait en faveur du maintien de ce médicament en France[9]. Son avis était partagé par l’Académie nationale de médecine : « Cette association est utile, largement mise à profit en thérapeutique, en France, avec sécurité. Elle correspond au besoin d’antalgiques de puissance moyenne (palier II de l’OMS), supérieure à celle du paracétamol seul et inférieure à celle des opiacés/opioïdes de palier III. Le nombre restreint de médicaments de ce niveau II est à souligner. » De plus, l’Académie faisait observer que la recommandation européenne ne proposait pas de solution de remplacement[9].
L'Afssaps préconisait de remplacer le dextropropoxyphène soit par des antalgiques de palier I, « paracétamol à dose efficace, c'est-à-dire un gramme par prise, aspirine ou anti-inflammatoire non stéroïdien comme l'ibuprofène », soit par des antalgiques de palier II (codéine ou tramadol), et réfléchissait à une éventuelle procédure dérogatoire pour que les patients non soulagés par les antalgique de palier I et intolérants aux antalgiques de palier II puissent continuer à recevoir du dextropropoxyphène[10].
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Retrait progressif du Di-Antalvic en France », L'Express, publié le 26 juin 2009.
- [PDF] (en) « Press Release European Medicines Agency recommends withdrawal of dextropropoxyphene-containing medicines », publié le sur le site EMEA (consulté le ).
- « Le Di-Antalvic et ses génériques seront retirés des pharmacies d'ici à un an », Le Monde, 26 juin 2009.
- Retrait progressif du Di-Antalvic, jeudi 25 juin 2009, http://news.doctissimo.fr.
- « Médicaments. Di-Antalvic et Propofan, c'est fini », sur Le Telegramme, (consulté le )
- AFSSAPS 7/2/2001 réévaluation du service médical rendu
- « Dernier sursis pour le Diantalvic ! », sur VIDAL (consulté le )
- « Le retrait du Di-Antalvic pose problème », medecinews.com, 3 juillet 2009.
- Sandrine Cabut, « Di-Antalvic : un retrait qui inquiète », Le Figaro, 26 juin 2009.