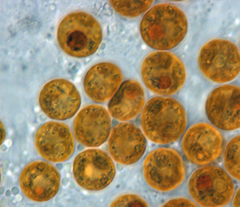
Zooxanthelle
Symbiodinium
| Empire | Eukaryota |
|---|---|
| Sous-règne | Biciliata |
| Infra-règne | Alveolata |
| Embranchement | Myzozoa |
| Classe | Dinophyceae |
| Ordre | Suessiales |
| Famille | Symbiodiniaceae |
- Zooxanthella Brandt, 1881
La zooxanthelle (« jaune des animaux » en grec), ou plus simplement xanthelle (« jaune » en grec, algue du genre Symbiodinium) est une algue unicellulaire, pouvant vivre en symbiose avec le corail, mais aussi avec les bénitiers, ainsi qu'avec de nombreuses espèces de méduses scyphozoaires, comme le genre Cassiopea ou Cotylorhiza par exemple, et chez d'autres animaux marins (Hydrozoaires, Limaces de mer, radiolaires, ciliées, démosponges, actinies…). Dans les couches superficielles des mers chaudes, dépourvues de la base de la chaîne alimentaire marine qu'est le plancton, les zooxanthelles se développent en absorbant le dioxyde de carbone libéré par les coraux (ou un autre animal hôte) et fournissent en retour divers nutriments à leur hôte[1],[2].
Chez les coraux durs bâtisseurs de récif (Scléractiniaires ou Madréporaires) et chez certains Actiniaires, Corallimorphaires, Zoanthaires et Octocoralliaires (Alcyonacea et Gorgonacea) l’endoderme des polypes renferme, sans exception, des algues unicellulaires.
Introduction
modifierCes algues sont des Dinoflagellés brun doré du genre Symbiodinium[3]. Elles sont généralement brunes[4], la couleur la plus adaptée à l’absorption de la lumière bleue. Les zooxanthelles, qui vivent en symbiose avec le corail (ainsi qu'avec d'autres invertébrés), jouent un rôle très important dans le métabolisme de l’animal. Cette association entre l’algue et le corail constitue une vraie symbiose car l’association profite aux deux partenaires. Ainsi les métabolismes de l’hôte (le corail) et du symbiote (l’algue) interfèrent fortement.
Chez le corail, les zooxanthelles sont localisées dans l’endoderme et sont intracellulaires[5]. Elles sont déjà présentes dans l’œuf juste après la fécondation, dans l’ectoderme de la planula qu’elles quittent pour gagner l’endoderme lorsque la larve s’est fixée. Elles se multiplient par scissiparité chez l’adulte et sont présentes dans toutes les couches cellulaires endodermiques mais plus abondantes dans le disque oral, les tentacules et le coenosarque (zones plus exposées à la lumière). Cette biomasse végétale stockée par les polypes varie selon les espèces et peut atteindre 45 à 60% de la biomasse en protéines du corail. La densité des zooxanthelles et leur répartition dans les tissus dépendent de la physiologie du polype, des conditions d’éclairement et de la température de l'eau. Un manque de lumière entraîne une plus forte dispersion des zooxanthelles et une diminution de leur nombre. À l’inverse, trop de lumière ou bien une augmentation de la température de l'eau peuvent conduire à une abondance élevée de zooxanthelles. Les coraux sont capables de s'acclimater à leur milieu en régulant génétiquement leur nombre de zooxanthelles[6]. Cette adaptation est contrôlée de manière génétique par des réponses moléculaires adaptatives. C'est la clé de leur résistance au réchauffement climatique et ce sujet fait l'objet de nombreuses recherches.
En cas de mauvaises conditions, les polypes sont stressés, ce qui déclenche leur système immunitaire. Si ce stress est trop important ou dure trop longtemps, les polypes rejettent les zooxanthelles dégénérées: les coraux blanchissent. Cette situation est réversible si les conditions redeviennent favorables suffisamment vite.
Les pigments
modifierComme tous les végétaux photosynthétiques, les zooxanthelles contiennent des pigments comme les chlorophylles a et c, des caroténoïdes. Ces pigments sont les molécules responsables de la photosynthèse[1],[2].
Le fait d’avoir plusieurs pigments différents permet aux zooxanthelles de s’adapter aux différentes conditions d’éclairement sur le plan de la qualité et de la quantité, et ce, quelle que soit la profondeur. Cette fameuse photosynthèse, qui peut être résumée simplement à la fabrication de composés carbonés complexes à partir d’eau et de dioxyde de carbone sous l’action énergétique de la lumière, n’est pas sans influence sur le métabolisme de l’hôte qui héberge les algues. Ainsi les échanges respiratoires, le métabolisme général ainsi que le processus de calcification sont étroitement liés au métabolisme des zooxanthelles.
Les coraux synthétisent aussi des substances toxiques. On suppose que ces substances les protègent des prédateurs, voire des infections bactériennes. Parmi ces substances on trouve des quinoneimines, vivement colorées, comme l'ascididemine, la calliactine, la kuanoniamine, actuellement objet de tests précliniques comme anti-cancéreux. On pense que les zooxanthelles participent partiellement voire totalement à la synthèse de ces substances.
Les échanges respiratoires
modifierUn des sous-produits de la photosynthèse est le dioxygène et celui-ci peut diffuser de l’algue vers le cytoplasme des cellules du polype, constituant ainsi un apport non négligeable pour la respiration du polype.
Le jour le polype absorbe du dioxygène de l’eau de mer et reçoit en plus celui produit par les zooxanthelles, alors que la nuit seul le dioxygène provenant de l’eau de mer peut être utilisé puisque la photosynthèse est stoppée. Ceci implique une diffusion des gaz à travers la membrane des zooxanthelles.
Globalement, il résulte pendant la journée un bilan respiratoire positif, c’est-à-dire que la production de dioxygène de l’association corail-zooxanthelle est supérieure à la consommation. En général la consommation de dioxygène est forte mais varie d’une espèce à l’autre. Par exemple, les Acropora sont de gros consommateurs, ce qui explique leur faible résistance à une élévation de température faisant chuter la concentration en dioxygène dissout.
Rôles métaboliques et dans la calcification du corail
modifierLes zooxanthelles pratiquent la photosynthèse et les zooxanthelles vivant en symbiose semblent avoir un rendement photosynthétique aussi bon que celles qui vivent libres. En plus de la production de dioxygène, les zooxanthelles fabriquent d’autres molécules qui vont être profitables aux polypes : glycérol, glucose, acides aminés, peptides, etc.
Ces molécules, pour être utilisées par les polypes, doivent impérativement traverser la membrane de l’algue pour se retrouver dans le cytoplasme des cellules du polype. Le transfert est favorisé par les enzymes digestives sécrétées par le corail, qui rendent les parois cellulaires des algues perméables aux métabolites. La présence de ces enzymes laisse penser qu’il serait possible pour les coraux de contrôler le flux de nutriments vers les zooxanthelles[7]. Les composés produits par les zooxanthelles sont largement utilisés par le polype pour son propre métabolisme des glucides, protides et lipides. Finalement les algues symbiotiques peuvent être considérées comme le réservoir de carbone organique du corail. De plus, les zooxanthelles sont capables d’assimiler les déchets issus du catabolisme des coraux[8] et vont ensuite pouvoir transformer ces déchets cataboliques en composés énergétiques comme des acides aminés et sucres (glucose, glycérol…)[9]. Ces composés vont ensuite être transloqués vers le polype où ils vont pouvoir être utilisés dans le catabolisme des Cnidaires[10]. Les zooxanthelles permettent un recyclage des déchets azotés des Cnidaires en composés énergétiques, ce qui permet aux coraux d’être efficaces dans des eaux oligotrophes.
Les zooxanthelles permettent également de stimuler la calcification des coraux. Au sein des récifs coralliens, les coraux scléractiniaires possèdent un squelette de carbonate de calcium cristallisé sous forme d’aragonite. La formation de carbonate de calcium est plus importante lorsqu’il y a de la lumière et une présence de zooxanthelles[11]. De plus, deux produits importants de la photosynthèse de ces microalgues, le glycérol et l’oxygène, permettent une forte augmentation de cette calcification pour des coraux blanchis (qui ont expulsé les zooxanthelles) montrant leur rôle important dans ce processus[11]. Il semblerait également que les zooxanthelles permettent de modifier la composition du milieu (pH et carbone inorganique) dans lequel se réalise la calcification, afin de la favoriser[12].
Apport du corail au métabolisme des zooxanthelles
modifierLes déchets azotés et phosphorés du corail sont utilisés en partie par l’algue. On pensait tout d’abord que le dioxyde de carbone produit par la respiration du polype était absorbé par l’algue pour la photosynthèse, mais en fait il semblerait plutôt que la source de CO2 utilisée par l’algue provienne des bicarbonates de l’eau de mer. Plusieurs travaux ont clairement montré que les phosphates (composés phosphorés) sont utilisés par les zooxanthelles pour leur métabolisme protidique. De même, chez certaines espèces de coraux l’ammoniaque (composé azoté) est excrétée à un taux dix fois moindre à la lumière qu’à l’obscurité, ce qui indique que la photosynthèse des zooxanthelles utilise l’ammoniaque. Les nitrites, nitrates et acides aminés peuvent également être utilisés dans une moindre mesure.
Des études récentes ont mis en évidence, outre la grande diversité des zooxanthelles (y compris au sein d'une même espèce et d'une même population de coraux), l'existence d'autres types de symbiontes au rôle encore mal compris, des sporozoaires (embranchement des Apicomplexa) appelés corallicolides[13].
Liste d'espèces
modifier|
Selon AlgaeBase (14 juin 2012)[14] :
|
Selon World Register of Marine Species (5 avril 2019)[15] :
|
Selon Catalogue of Life (14 juin 2012)[16] : |
Notes et références
modifier- Edward E. Ruppert et Richard S. Fox, Invertebrate zoology : a functional evolutionary approach, (ISBN 978-81-315-0104-7 et 81-315-0104-3, OCLC 970002268, lire en ligne)
- (en) Lohr, Jayme; Munn, Colin B.; Wilson1, William H., « "Characterization of a Latent Virus-Like Infection of Symbiotic Zooxanthellae" », Applied and Environmental Microbiology., , p. 73 (9): 2976–2981
- « Zooxanthelle », sur futura-sciences.com.
- Charles Birkeland, Life and death of coral reefs, Chapman & Hall, (ISBN 0-412-03541-3 et 978-0-412-03541-8, OCLC 32546999, lire en ligne)
- (en) Wakefield, Timothy; Farmer, Mark; Kempf, Stephen, « "Revised Description of the Fine Structure of in situ "Zooxanthellae" Genus Symbiodinium". », The Biological Bulletin, vol. 199, no 1, , p. 76–84 (PMID 10975645, DOI 10.2307/1542709, JSTOR 1542709)
- (en) Rosa Celia Poquita-Du, Danwei Huang, Loke Ming Chou, Mrinalini and Peter A. Todd, « Short Term Exposure to Heat and Sediment Triggers Changes in Coral Gene Expression and Photo-Physiological Performance », Frontiers, , p. 8 (lire en ligne)
- S. K. Davy, D. Allemand et V. M. Weis, « Cell Biology of Cnidarian-Dinoflagellate Symbiosis », Microbiology and Molecular Biology Reviews, vol. 76, no 2, , p. 229–261 (ISSN 1092-2172, DOI 10.1128/mmbr.05014-11, lire en ligne, consulté le )
- S. Karako, N. Stambler et Z. Dubinsky, « The Taxonomy and Evolution of the Zooxanthellae-Coral Symbiosis », dans Cellular Origin, Life in Extreme Habitats and Astrobiology, Kluwer Academic Publishers (ISBN 1402001894, lire en ligne), p. 539–557
- L. Muscatine et James W. Porter, « Reef Corals: Mutualistic Symbioses Adapted to Nutrient-Poor Environments », BioScience, vol. 27, no 7, , p. 454–460 (ISSN 0006-3568 et 1525-3244, DOI 10.2307/1297526, lire en ligne, consulté le )
- S Reynaud, P Martinez, F Houlbrèque et I Billy, « Effect of light and feeding on the nitrogen isotopic composition of a zooxanthellate coral: role of nitrogen recycling », Marine Ecology Progress Series, vol. 392, , p. 103–110 (ISSN 0171-8630 et 1616-1599, DOI 10.3354/meps08195, lire en ligne, consulté le )
- M. F. Colombo-Pallotta, A. Rodríguez-Román et R. Iglesias-Prieto, « Calcification in bleached and unbleached Montastraea faveolata: evaluating the role of oxygen and glycerol », Coral Reefs, vol. 29, no 4, , p. 899–907 (ISSN 0722-4028 et 1432-0975, DOI 10.1007/s00338-010-0638-x, lire en ligne, consulté le )
- Fuad A. Al-Horani, Salim M. Al-Moghrabi et Dirk de Beer, « Microsensor study of photosynthesis and calcification in the scleractinian coral, Galaxea fascicularis: active internal carbon cycle », Journal of Experimental Marine Biology and Ecology, vol. 288, no 1, , p. 1–15 (ISSN 0022-0981, DOI 10.1016/s0022-0981(02)00578-6, lire en ligne, consulté le )
- (en) Thomas A. Richards et John P. McCutcheon, « Coral symbiosis is a three-player game », Nature, vol. 568, (DOI 10.1038/d41586-019-00949-6, lire en ligne).
- Guiry, M.D. & Guiry, G.M. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. https://www.algaebase.org, consulté le 14 juin 2012
- World Register of Marine Species, consulté le 5 avril 2019
- Catalogue of Life Checklist, consulté le 14 juin 2012
- (en) Ken-ichi ONODERA, Takuya FUKATSU, Nozomi KAWAI, Yukio YOSHIOKA, Tetsuji OKAMOTO, Hideshi NAKAMURA, Makoto OJIKA, 2004. Zooxanthellactone, a Novel γ-Lactone-type Oxylipine from Dinoflagellates of Symbiodinium sp.: Structure, Distribution, and Biological Activity. Bioscience, Biotechnology, and Biochemistry, Volume 68, Issue 4, 1 January 2004, Pages 848–852, DOI 10.1271/bbb.68.848.
Voir aussi
modifierArticles connexes
modifierLiens externes
modifier- (en) Référence Tree of Life Web Project : Symbiodinium (consulté le )
- (en) Référence Catalogue of Life : Symbiodinium (consulté le )
- (en) Référence AlgaeBase : genre Symbiodinium Freudenthal, 1962 (consulté le )
- (en) Référence WoRMS : Symbiodinium (+ liste espèces) (consulté le )
- (en) Référence NCBI : Symbiodinium (taxons inclus) (consulté le )
- (fr + en) Référence ITIS : Symbiodinium Freudenthal, 1962 (consulté le )
- TechRécif - Les techniques du récifal pour tous