Bleb
En biologie cellulaire, un bleb ou bulle est une proéminence de la membrane plasmique d'une cellule, provoquée par le découplage délocalisé du cytosquelette de la membrane[1]. Le blebbing ou zeiosis est le processus de formation des blebs.
Origine
modifierLa croissance des blebs est déterminée par la pression intracellulaire générée dans le cytoplasme par le cortex cellulaire contractile et il peut s'en former en un point faible où s'est produit une rupture locale du cortex ou un détachement limité entre le cortex et la membrane plasmique[2]. Le flux de cytoplasme est déterminé par la pression hydrostatique dans la cellule[3],[4].
Fonctions physiologiques
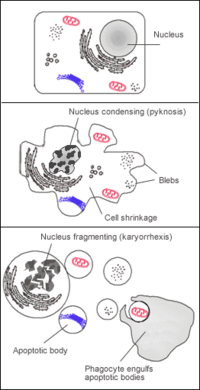
modifierLors de l'apoptose (mort cellulaire programmée), le cytosquelette se rompt et la membrane forme des blebs[5]. Ces blebs peuvent alors se séparer de la cellule, emmenant avec eux une portion du cytoplasme. Ils prennent alors le nom de corps apoptotiques. Les cellules phagocytaires capturent ces fragments et procèdent au recyclage de leurs composants.
La formation de blebs a aussi un rôle important dans d'autres phénomènes cellulaires, comme la locomotion, la division, et la réponse aux stress chimiques et physiques. Les types de blebs varient fortement en termes de vitesse de croissance, taille, contenu et quantité d'actine. Ils jouent aussi un rôle dans les cinq types de nécrose. Cependant, les organites cellulaires ne se dispersent pas dans les blebs en cas de nécrose.
Pharmacologie
modifierEn 2004, il a été montré qu'un composé connu sous le nom de blebistatine était capable d'inhiber la formation des blebs. Il a été mis en évidence lors d'un criblage à la recherche d'inhibiteurs de MYH9. Il agit en diminuant l'affinité de la myosine pour l'actine[6],[7],[8], diminuant ainsi les forces contractiles au niveau de l'interface cytosquelette-membrane.
Références
modifier- Charras GT, Coughlin M, Mitchison TJ, Mahadevan L, « Life and times of a cellular bleb », Biophys J., vol. 94, no 5, , p. 1836–53 (PMID 17921219, PMCID 2242777, DOI 10.1529/biophysj.107.113605, Bibcode 2008BpJ....94.1836C)
- Charras GT, Hu CK, Coughlin M, Mitchison TJ, « Reassembly of contractile actin cortex in cell blebs », J. Cell Biol., vol. 175, no 3, , p. 477–90 (PMID 17088428, PMCID 2064524, DOI 10.1083/jcb.200602085)
- Dai J, Sheetz MP, « Membrane tether formation from blebbing cells », Biophys. J., vol. 77, no 6, , p. 3363–70 (PMID 10585959, PMCID 1300608, DOI 10.1016/S0006-3495(99)77168-7, Bibcode 1999BpJ....77.3363D, lire en ligne)
- Drug Stops Motor Protein, Shines Light on Cell Division - FOCUS March 21, 2003. Retrieved April 8, 2008.
- Hagmann J, Burger MM, Dagan D, « Regulation of plasma membrane blebbing by the cytoskeleton », J. Cell. Biochem., vol. 73, no 4, , p. 488–99 (PMID 10733343, DOI 10.1002/(SICI)1097-4644(19990615)73:4<488::AID-JCB7>3.0.CO;2-P)
- Fackler OT, Grosse R, « Cell motility through plasma membrane blebbing », J Cell Biol., vol. 181, no 6, , p. 879–84 (PMID 18541702, PMCID 2426937, DOI 10.1083/jcb.200802081)
- G Charras et E Paluch, « Blebs lead the way: how to migrate without lamellipodia. », Nature reviews. Molecular cell biology, vol. 9, no 9, , p. 730–6 (PMID 18628785)
- GT Charras, JC Yarrow, MA Horton, L Mahadevan et TJ Mitchison, « Non-equilibration of hydrostatic pressure in blebbing cells. », Nature, vol. 435, no 7040, , p. 365–9 (PMID 15902261)
- JY Tinevez, U Schulze, G Salbreux, J Roensch, JF Joanny et E Paluch, « Role of cortical tension in bleb growth. », Proceedings of the National Academy of Sciences of the United States of America, vol. 106, no 44, , p. 18581–6 (PMID 19846787)
- Vermeulen K, Van Bockstaele DR, Berneman ZN, « Apoptosis: mechanisms and relevance in cancer », Ann Hematol., vol. 84, no 10, , p. 627–39 (PMID 16041532, DOI 10.1007/s00277-005-1065-x)
- Straight AF,Cheung A, Limouze J, Chen I, Westwood NJ, Sellers JR, and Mitchison TJ, « Dissecting temporal and Spatial control of cytokinesis with a myosin II inhibitor », Science, vol. 299, no 5613, , p. 1743–47 (PMID 12637748, DOI 10.1126/science.1081412, Bibcode 2003Sci...299.1743S, lire en ligne)
- Kovács M, Tóth J, Hetényi C, Málnási-Csizmadia A, Sellers JR, « Mechanism of blebbistatin inhibition of myosin II », J Biol Chem., vol. 279, no 34, , p. 35557–63 (PMID 15205456, DOI 10.1074/jbc.M405319200, lire en ligne)
- Limouze J, Straight AF, Mitchison T, Sellers JR, « Specificity of blebbistatin, an inhibitor of myosin II », J Muscle Res Cell Motil., vol. 25, nos 4–5, , p. 337–41 (PMID 15548862, DOI 10.1007/s10974-004-6060-7)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « bleb (cell biology) » (voir la liste des auteurs).