Silikoonid
See artikkel vajab toimetamist. (Jaanuar 2018) |
See artikkel ootab keeletoimetamist. (Jaanuar 2018) |
Silikooniks kutsutakse polümeriseerunud räniühendeid ehk polüsiloksaane. Need on sünteetilised inertsed ühendid, mille korduv osa koosneb siloksaanist, mis on vahelduv räni ja hapniku aatom. Silikoonid on tüüpiliselt kuumakindlad ja kummilaadsete omadustega, kasutatakse erinevates valdkondades. Erinevad silikooni variandid on näiteks silikoonõli, silikoonkumm, silikoonvaik.[1]
Keemia
[muuda | muuda lähteteksti]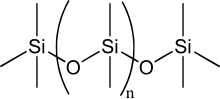
Polümeriseeritud siloksaanid ehk polüsiloksaanid koosnevad anorgaanilisest räni-hapnik peaahelast ja kõrvalahelaks on orgaanilised ühendid, mis on kinnitatud räni juures. Sel juhul on räni tetravalentses olekus ehk moodustab neli sidet. Üldiselt silikoonide keemiline valem on [R2SiO]n, kus R tähistab teatud orgaanilist rühma, näiteks polüdimetüülsiloksaani puhul metüülrühma.[2]
Osade orgaaniliste kõrvalahelate korral on võimalik ühendada räni-hapnik peaahelad omavahel ehk nad ristsidestada. Muutes peaahela pikkust, kõrvalahelaid ja ristsidestatust saab silikoone sünteesida erinevate omadustega ja koostistega. Omadused võivad olla vedeliku-, geeli-, kummi- või kõva plasti laadsed. Kõige rohkem kasutatav silikoon on polüdimetüülsiloksaan (PDMS), mis on silikoonõli.
Süntees
[muuda | muuda lähteteksti]Enamus silikoone baseeruvad polüdimetüülsiloksaanil, mis saadakse dimetüüldiklorosilaani hüdrolüüsil, kus n tähistab polümerisatsiooni astest ehk korduva monomeeri arvu.[2]
n Si(CH3)2Cl2 + (n+1) H2O → HO[-Si(CH3)2O-]nH + 2n HCl
Selle reaktsiooni käigus eraldub soolhapet, selle tõttu kasutatakse tihti algainena silaane, kus on kloori aatomi asemel atsetaatrühm. Sellisel juhul eraldub reaktsiooni käigus soolhappe asemel äädikhape, mis on vähem keemiliselt aktiivne. Selle tõttu on polümeeri tahkumise aeg pikem. Atsetaatreaktsiooni kasutatakse meditsiinis ja paljudes igapäevaelu valdkondades.[2]
Ristsidemete polümeeris saamiseks kasutatakse lähteainena räniühendeid, millel on vähem alküülrühmi, näiteks metüültriklorosilaan või metüültrimetoksüsilaan. Selle protsessiga saab sünteesida kõvasid silikoonvaike.
Polümeeri tahkestumise etapis lisades gaasilisi või aineid, millest eraldub kuumutamisel gaasi, saab tekitada ka silikoonvahtu.
Põlemine
[muuda | muuda lähteteksti]Kui silikoon põleb õhus või hapnikus, siis moodustub ränidioksiid (SiO2) valge pulbrina, süsinik ja erinevad gaasid.
Omadused
[muuda | muuda lähteteksti]Silikoonidel on mitmesuguseid kasulikke omadusi: [1]
- Madal soojusjuhtivus
- Madal keemiline reaktiivsus
- Vähene mürgisus
- Soojuslik stabiilsus, omadused püsivad samad temperatuurivahemikus −100 kuni 250°.
- Hüdrofoobsus, moodustab veekindlaid tihendeid.
- Hea adhesioon soovitud alustega. näiteks klaasiga.
- Ei soodusta mikrobioloogilist kasvu.
- Vähene lagunemine hapniku, osooni ja ultraviolett (UV) valguse mõjul. Selle omaduse tõttu kasutatakse silikoone laialdaselt ehitus- ja autotööstuses.
- Muudetav elektrijuhtivus, saab valmistada kui isolaatori või juhti. Laialdaselt kasutusel elektriisolaatorina.
- Suur gaasi läbitavus. Vajalik meditsiinilistel kasutusaladel. Halb, kui on vajalik gaasikindlaid tihendeid.
Kasutusalad
[muuda | muuda lähteteksti]Silikoone kasutatakse mitmetes toodetes. Aastal 2013 toodeti maailmas 2,1 miljonit tonni silikoontooteid, mille väärtus oli 11 miljardit USA dollarit.[3]
Autotööstus
[muuda | muuda lähteteksti]Autotööstuses kasutatakse silikoonmääret, mis on polüdimetüülsiloksaan, millesse on sisse segatud tihendavat ainet, tavaliselt ränidioksiidi. Seda kasutatakse määrdena pidurikomponentidel, kuna on stabiilne kõrgetel temperatuuridel ja pole vees lahustuv.
Auto süüteküünalde juhtmed isoleeritakse mitme silikoonikihiga, et ära hoida sädeme hüppamise kõrval olevatele juhtmetele.
Silikoonühendeid nagu silikoonkumm kasutatakse katete ja tihenditena turvapatjades. Suure tugevuse tõttu on silikoonkumm optimaalne tihend turvapatjades. Silikooni kasutamine koos termoplastidega suurendavad kriimustustaluvust ja vähendavad hõõrdumist.
Katted
[muuda | muuda lähteteksti]Silikoonkilesid saab kanda ränil põhinevatele alustele nagu klaas, et moodustada hüdrofoobseid katteid.
Mitmeid kangaid on võimalik katta silikooniga, et moodustada veekindel komposiit.
Kööginõud
[muuda | muuda lähteteksti]


- Silikoon on kasutusel, kui on vajalik kokkupuude toiduga, kuna see pole mürgine. Silikoonist on saamas üks olulisemaid kööginõude materjale, eriti küpsetamisel.
- Silikooni kasutatakse isolaatorina kuumakindlates potihoidikutes. Silikoonist ahjukindad kannatavad kuni 260 °C kuumust.
- Mittekleepuvad vormid erinevate toitude valmistamiseks.
Elektroonika
[muuda | muuda lähteteksti]Elektroonilised komponendid on tihti ümbritsetud silikooniga, et tõsta stabiilsust mehaanilise ja elektrilise šoki, radiatsiooni ja vibratsiooni vastu.
Silikoone kasutatakse, kui on vaja vastupidavust ekstreemsetes tingimustes, nagu näiteks kosmoses satelliitide juures. Neid eelistatakse polüuretaani või epoksüvaikude asemel, kui on vajalik suur temperatuuripiirkond, milles püsiks aine stabiilne. Silikoonide puhul on eeliseks ka vähene soojuseraldus tahkumise jooksul, vähene mürgisus ja suur puhtusaste.
Silikoonide probleemid elektroonikas on nende suur hind ja lahustuvus. Silikoon võib kergesti liikuda vedeliku või auruna teistesse komponentidesse.
Silikoon reostus elektrilistes lülitites võib viia hiljem riketeni.[4][5]
Meditsiin
[muuda | muuda lähteteksti]Silikooni kasutatakse mitmetes rakendustes, kus on vajalik suur bioühilduvus. Peale selle kasutatakse silikooni geelvormi plaastrites, muudes haava katetes ja erinevates implantaatides.
Armiravi lehti tehakse meditsiinilest ehk suure bioühildusega silikoonist. Kasutatakse tihti polüdimetüülsiloksaani, kuna selle ristsidestatud vormil on suur vastupidavus
Ohutus ja keskkonnasõbralikkus
[muuda | muuda lähteteksti]Pole täheldatud kahjulikku mõju organismidele keskkonnas. Laia kasutuse tõttu leiab silikoonil põhinevaid materjale kõikjalt.[6] Need lagunevad bioloogilistel mõjudel kiiresti, seda protsessi kiirendavad mitmed katalüsaatorid, milleks üks on savi.[1] Tsüklilised silikoonid on põhjustanud silanoolide ilmnemist biolagunemisel imetajates.[7] Sellest tulenevad silaaldioolid ja silaantrioolid võivad mõjuda inhibeerivalt teatud ensüümidele, aga selleks vajalikud kogused on kordades suuremad kui tarbijatoodetes sisalduvad.[8][9]
Polüdimetüülsiloksaanist eraldub 200 °C juures vähestes kogustes formaldehüüdi, aga see kogus on väiksem kui teistes levinud materjalides nagu polüetüleen.[10][11]
Viited
[muuda | muuda lähteteksti]- ↑ 1,0 1,1 1,2 Hans-Heinrich Moretto, Manfred Schulze, Gebhard Wagner (2005) "Silicones" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a24_057
- ↑ 2,0 2,1 2,2 James E. Mark; Harry R. Allcock; Robert West. Inorganic Polymers. Oxford University. ISBN 978-0-19-535131-6.
- ↑ Socio-economic evaluation of the globel silicones industry
- ↑ Paul G. Slade (1999). "16.4.1". Electrical Contacts: Principles and Applications. CRC Press. Lk 823. ISBN 0-8247-1934-4.
- ↑ W. Witter & R. Leiper (1979). "A Comparison for the Effects of Various Forms of Silicon Contamination on Contact Performance". IEEE Transactions on Components, Hybrids, and Manufacturing Technology. 2: 56. DOI:10.1109/TCHMT.1979.1135411.
- ↑ Bienkowski, Brian. "Chemicals from Personal Care Products Pervasive in Chicago Air". Scientific American.
- ↑ S. Varaprath, K. L. Salyers, K. P. Plotzke and S. Nanavati "Identification of Metabolites of Octamethylcyclotetrasiloxane (D4) in Rat Urine" Drug Metab Dispos 1999, 27, 1267–1273.
- ↑ S. M. Sieburth, T. Nittoli, A. M. Mutahi and L. Guo: Silanediols: a new class of potent protease inhibitors, Angew. Chem. Int. Ed. 1998, volume 37, 812–814.
- ↑ M. Blunder, N. Hurkes, M. List, S. Spirk and R. Pietschnig: Silanetriols as in vitro AChE Inhibitors, Bioorg. Med. Chem. Lett. 2011, volume 21, 363–365.
- ↑ Dave Hard. DIELECTRIC FLUIDS FOR TRANSFORMER COOLING History and Types. General Electric
- ↑ David C. Timpe Jr. Formaldehyde Generation from Silicone Rubber. Arlon