Inflamación
- Véase también antiinflamatorio o punto de inflamación, para el fuego.
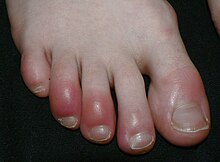
La inflamación (del latín inflammatio: encender, hacer fuego), es la forma de manifestarse de muchas enfermedades. Se trata de una respuesta inespecífica frente a las agresiones del medio, y está generada por los agentes inflamatorios. La respuesta inflamatoria ocurre solo en tejidos conectivos vascularizados y surge con el fin defensivo de aislar y destruir al agente dañino, así como reparar el tejido u órgano dañado. Se considera por tanto un mecanismo de inmunidad innata, estereotipado, en contraste con la reacción inmune adaptativa, específica para cada tipo de agente infeccioso.[1] La inflamación patológica se denomina flogosis.[2][3]
El sistema inmunitario innato está formado por defensas contra las infecciones que pueden activarse inmediatamente una vez que el agente patógeno ataca. Este sistema se compone esencialmente de barreras que tienen como objetivo eliminar los virus, bacterias, parásitos y otras partículas extrañas del cuerpo o limitar su capacidad de diseminarse y moverse por todo el cuerpo. La inflamación es un ejemplo de una respuesta inmunitaria innata.
El sistema inmunitario adaptativo, también llamado inmunidad adquirida, utiliza antígenos específicos para montar estratégicamente una respuesta inmunitaria. A diferencia del sistema inmunitario innato, que ataca solo sobre la base de la identificación de las amenazas generales, la inmunidad adaptativa se activa por la exposición a los patógenos, y utiliza una memoria inmunológica para aprender acerca de la amenaza y mejorar la respuesta inmunológica en consecuencia. La respuesta inmune adaptativa es mucho más lenta para responder a las amenazas e infecciones que la respuesta inmune innata, que está preparada y lista para luchar en todo momento.
La inflamación se identifica en medicina con el sufijo -itis. El mayor problema que surge de la inflamación es que la defensa se dirija tanto hacia agentes dañinos como a no dañinos, de manera que provoque lesión en tejidos u órganos sanos.
Agentes inflamatorios
[editar]- Agentes biológicos: bacterias, virus, parásitos, hongos; las células de mamíferos disponen de receptores que captan la presencia de microbios; entre los receptores más importantes están los receptores de tipo Toll, que detectan la presencia de bacterias, virus y hongos, y desencadenan vías de señalización que estimulan la producción de diferentes mediadores;
- Agentes o condiciones que producen necrosis de los tejidos afectados: las células necróticas liberan moléculas que activan la respuesta inflamatoria, como ácido úrico, ADP o incluso ADN; entre estos agentes tenemos:
- Agentes físicos: radiaciones (como los rayos UV), frío, calor.
- Agentes químicos: venenos, toxinas.
- Traumatismos y cuerpos extraños, que inducen inflamación porque dañan los tejidos (necrosis) o aportan microbios, los cuales están en el aire con los cuales pueden causar enfermedades.
- Alteraciones vasculares: como por ejemplo las que producen isquemia.
- Alteraciones inmunitarias: como por ejemplo las respuestas de hipersensibilidad o las autoinmunes; en estos casos es la propia respuesta inmunitaria la que induce la inflamación, que es la causa principal del daño tisular.
Evolución histórica
[editar]En las primeras civilizaciones existen testimonios de su conocimiento y su curación. Los primeros escritos aparecieron en papiros egipcios que datan del 3000 a. C.
En Grecia y Roma se conserva, de entre las numerosas obras escritas por el enciclopedista Aulo Cornelio Celso, el libro "De Medicinae", en donde se identifican cuatro signos cardinales de la inflamación. Posteriormente, Rudolf Virchow añadió el quinto signo.[4]
Los cinco signos cardinales son
- Tumor (tumefacción): aumento del líquido intersticial y formación de edema.
- Rubor: enrojecimiento, debido principalmente a los fenómenos de aumento de la vasodilatación.
- Calor: aumento de la temperatura de la zona inflamada, debido a la vasodilatación y al incremento del consumo local de oxígeno.
- Dolor: aparece como consecuencia de la liberación de sustancias capaces de provocar la activación de los nociceptores (receptores del dolor), como las prostaglandinas. Constituye el primer signo de la tétrada de Celsus. (Los cuatro signos → Tétrada de Celsus)
- Pérdida o disminución de la función: conocido como quinto signo de Virchow (función laesa).
En 1793, el cirujano escocés John Hunter destacó algo que en la actualidad es considerado obvio: "La inflamación no es una enfermedad, sino una respuesta inespecífica que produce un efecto saludable en el organismo en que tiene lugar".
El patólogo Julius Cohnheim fue el primer investigador que utilizó el microscopio para observar vasos sanguíneos inflamados en membranas finas y translúcidas, como el mesenterio y la lengua de la rana. Tras la observación de las alteraciones iniciales del flujo sanguíneo, observó el edema posterior al incremento de la permeabilidad vascular y la migración leucocitaria. En 1867 demostró que la emigración de los glóbulos blancos es el origen de la pus.[5] La contribución de Cohnheim fue fundamental para entender todo el proceso inflamatorio.
El biólogo ruso Elias Metchnikoff descubrió el proceso de la fagocitosis al observar la ingestión de espinas de rosal por los amebocitos de las larvas de estrellas de mar, y de bacterias por leucocitos de mamífero (1882). Llegó a la conclusión de que el objeto de la inflamación era hacer llegar las células con capacidad fagocitaria a la zona de lesión para eliminar a los agentes infecciosos. No obstante, al poco tiempo quedó claro que tanto los factores celulares (fagocitos) como los séricos (anticuerpos), eran imprescindibles para la defensa frente a microorganismos, y como reconocimiento por ello Metchnikoff y Paul Ehrlich (quien desarrolló la teoría humoral) recibieron el Premio Nobel de Medicina en 1908.
A estos nombres se debe añadir el del cardiólogo Thomas Lewis quien, mediante experimentos sencillos sobre la respuesta inflamatoria de la piel, estableció el concepto de que diversas substancias químicas inducidas localmente por el estímulo de una lesión, como la histamina, son factores mediadores de las alteraciones vasculares de la inflamación. Este concepto fundamental constituye la base de los importantes descubrimientos de los mediadores químicos de la inflamación y de la posibilidad de utilizar fármacos antiinflamatorios.
Lewis llamó a los mediadores químicos de la inflamación H1 (véase histamina ), y definió la triple respuesta ante la agresión.[6]
La respuesta consistía en:
Dependiendo de las características temporales de la inflamación, se definen dos tipos de respuesta:
- inflamación aguda
- inflamación crónica
Inflamación aguda
[editar]La fase aguda de la inflamación es sinónimo de reacción inmune innata. En la inflamación aguda distinguimos tres puntos clave: cambios hemodinámicos, alteración de la permeabilidad vascular y modificaciones leucocitarias.[9]
Cambios hemodinámicos
[editar]Después de un periodo inconstante y transitorio de vasoconstricción arteriolar, se produce vasodilatación e hiperemia activa (aumento de flujo sanguíneo en la zona de la lesión), que causa enrojecimiento y aumento de la temperatura. Después se produce un periodo de hiperemia pasiva en la que disminuye el flujo por un aumento de la permeabilidad microvascular con extravasación de líquido y aumento de la viscosidad sanguínea en los vasos de menor calibre, que es lo que se denomina estasis (parálisis total del flujo). A medida que evoluciona la estasis se produce la orientación periférica (marginación) de los leucocitos, que se adhieren al endotelio, atraviesan la pared vascular y se dirigen al intersticio.
Paso por paso (solo de manera didáctica, ya que estos eventos ocurren superponiéndose) se observa lo siguiente:
- Vasodilatacion arteriolar y capilar, que provoca la apertura de capilares y venulas; inducida por la acción de diferentes mediadores sobre el músculo liso vascular, principalmente histamina y óxido nítrico.
- Aumento de la velocidad del flujo sanguíneo (hiperemia) por las arteriolas, que es la causa de la aparición de eritema (rojez) en el sitio de la inflamación.
- Aumento de la permeabilidad de la microvasculatura: salida de un exudado inflamatorio hacia los tejidos extravasculares y aparición de edema inflamatorio.
- Acumulación anormal y excesiva de sangre: la salida de líquido provoca un aumento de la viscosidad de la sangre, lo cual aumenta la concentración de los glóbulos rojos (congestión venosa).
- Disminución de la velocidad de la sangre en pequeños vasos (estasis sanguínea).
- Acumulación periférica de los leucocitos: marginación y pavimentación leucocitaria.
- Al mismo tiempo, las células endoteliales son activadas por los mediadores de la inflamación, expresando moléculas en sus membranas que favorecen la adhesión de los leucocitos, fundamentalmente los polimorfonucleares neutrófilos (PMN).
- Paso de leucocitos (PMN en primer lugar, seguidos por los macrófagos) desde los vasos al intersticio: migración celular, con formación del infiltrado inflamatorio. Se denomina diapédesis.
Asimismo, durante la fase de reparación que sigue a la inflamación aguda y durante la inflamación crónica se produce un fenómeno de proliferación de vasos sanguíneos denominado angiogénesis.
Alteración de la permeabilidad vascular
[editar]En condiciones normales el endotelio no permite la salida de proteínas y el intercambio se produce por pinocitosis. Durante la inflamación, se alteran las bases morfológicas del endotelio por acción de los mediadores químicos, produciéndose una alteración de las uniones celulares y las cargas negativas de la membrana basal: Majno y Palade vieron aperturas entre las células que no se encontraban rotas. Generalmente, este efecto se produce en las vénulas, pero si es muy intenso se alcanza a los capilares y se produce extravasación por rotura.
La salida de líquidos, proteínas y células a partir de la sangre se denomina exudación. Es importante distinguir los siguientes conceptos:[9]
- Un exudado es un líquido extracelular que contiene alta concentración de proteínas y restos celulares, muy denso; su presencia implica una reacción inflamatoria;
- Un transudado, sin embargo, es un fluido con bajo contenido en proteínas (contiene sobre todo albúmina); es un ultrafiltrado del plasma debido a la existencia de una diferencia de presión osmótica o hidrostática a través de la pared de un vaso, sin aumento de la permeabilidad vascular ni proceso inflamatorio;
- Un edema es un exceso de líquido en el tejido intersticial, que puede ser un exudado o un transudado;
- El pus es un exudado purulento, un exudado inflamatorio rico en leucocitos (sobre todo PMN), restos de células muertas y, en muchos casos, microbios.
El aumento de la permeabilidad vascular se genera por varios mecanismos, que pueden producirse simultáneamente:[9]
Contracción de las células endoteliales
[editar]Es el mecanismo más común, desencadenado por diferentes mediadores, como la histamina, la bradiquinina, los leucotrienos y la sustancia P, entre otros. Estas sustancias provocan la contracción brusca, por fosforilacion oxidativa, de los filamentos de actina y miosina de las células endoteliales que se retraen, de forma que los espacios interendoteliales aumentan. Después el citoesqueleto se reorganiza para mantener la contracción durante más tiempo. Las sustancias inflamatorias deben disolver la membrana basal de estas aperturas.
Daño endotelial
[editar]La necrosis de las células endoteliales provoca su separación de la pared del vaso, creando de esta forma una apertura en el mismo. Puede producirse en heridas severas, como quemaduras, o por la acción tóxica de microbios que afectan directamente el endotelio. Los PMN que se adhieren a las células endoteliales también pueden dañarlas. En este caso, la pérdida de líquido continúa hasta que se forma un trombo o se repara el daño.
Aumento de la transcitosis
[editar]El transporte de fluidos y proteínas a través de las propias células endoteliales (y no entre ellas) puede realizarse mediante canales que se forman a partir de vacuolas y vesículas no recubiertas interconectadas (denominado orgánulo vesiculovacuolar). Parece que VEGF estimula el número y el tamaño de estos canales.
Respuestas de los vasos linfáticos
[editar]En condiciones normales, el sistema linfático filtra y controla las pequeñas cantidades de líquido extravascular que se ha perdido en los capilares. Durante la inflamación, la cantidad de líquido extracelular aumenta, y el sistema linfático participa en la eliminación del edema. Asimismo, en este caso una mayor cantidad de leucocitos, restos celulares y microbios pasa a la linfa. Como ocurre con los vasos sanguíneos, los linfáticos también proliferan en los procesos inflamatorios, para atender al incremento de la demanda. Puede ocurrir que los vasos linfáticos se inflamen de forma secundaria (linfangitis), o que se inflamen los ganglios (linfadenitis), a causa de la hiperplasia de los folículos linfoides y al mayor número de linfocitos y macrófagos.
Modificaciones leucocitarias
[editar]Los leucocitos fagocitan a los patógenos, destruyen a las bacterias y a los microorganismos, y degradan el tejido necrótico, pero también pueden prolongar la lesión tisular al liberar enzimas, mediadores químicos y especies reactivas del oxígeno (ERO, o también ROS, por sus siglas en inglés; también denominados radicales libres de oxígeno, RLO). Los dos grupos de leucocitos más importantes en un proceso de inflamación son los leucocitos polimorfonucleares neutrófilos (PMN) y los macrófagos.[9]
El tejido conjuntivo contiene macrófagos y mastocitos, que son células centinelas capaces de reconocer la presencia de microbios, células muertas o cuerpos extraños. Los macrófagos son los elementos principales en el inicio del proceso de inflamación, ya que poseen receptores específicos capaces de reconocer microbios y células muertas. Cuando reconocen estos elementos, los macrófagos producen las citoquinas IL-1 y TNF-α, que desencadenan la inflamación propiamente dicha actuando sobre las células endoteliales de los vasos sanguíneos cercanos (sobre todo las vénulas post-capilares), para permitir la migración transendotelial de los leucocitos.
Los mastocitos reaccionan al estrés físico que se detecta en los tejidos (calor, frío, presión) y producen los mediadores serotonina e histamina, que son potentes agentes vasoactivos que actúan sobre la contracción y la permeabilidad de los vasos, tanto arteriales como venosos.
Como consecuencia de la activación de macrófagos y mastocitos, se produce la liberación de los mediadores químicos de la inflamación. Estos mediadores inducen vasodilatación en la zona afectada, lo que provoca la salida de líquido de la sangre hacia los tejidos, generando un edema. Por esta razón, la viscosidad de la sangre aumenta, debido al aumento de concentración de los glóbulos rojos, lo que provoca un descenso en el flujo sanguíneo (estasis). En estas condiciones hemodinámicas, los leucocitos se redistribuyen en posición periférica, un fenómeno denominado marginación. A continuación, los leucocitos ruedan sobre la superficie del endotelio, estableciendo contactos transitorios con las células endoteliales, soltándose y volviéndose a unir. Finalmente, los leucocitos se adhieren firmemente al endotelio, antes de iniciar la migración a través de los capilares (ver el apartado "Diapédesis" de los neutrófilos para un detalle molecular completo).
Los leucocitos que han atravesado los capilares se dirigen hacia la zona afectada por un proceso de quimiotaxis. Una vez allí, fagocitan los microbios y los destruyen, generando la producción de pus. El pus será eliminado hacia el exterior si la lesión está en contacto con el exterior, o generará un absceso si la zona donde se ha formado el pus está en el interior de un órgano.
Una vez eliminado el pus (bien de manera natural o por intervención quirúrgica en caso de absceso), los macrófagos y los linfocitos proceden a la reparación del tejido dañado por la inflamación aguda. El daño tisular está producido generalmente por los PMN, que son muy numerosos y liberan enzimas hidrolíticas y radicales libres que dañan los tejidos. La reparación se produce gracias a los macrófagos, que estimulan a los fibroblastos a sintetizar colágeno y a las células endoteliales a generar nuevos vasos, mediante la secreción de factores de crecimiento. Sin embargo, la reparación es siempre incompleta, ya que no se recupera la estructura original: las glándulas y los pelos de la zona no se regeneran.
La naturaleza de los leucocitos infiltrados varía según el momento de la respuesta inflamatoria y el tipo de estímulo. En la mayor parte de los casos de inflamación aguda, los neutrófilos (PMN) predominan durante las primeras 6-24 h, y luego son reemplazados por monocitos en 24-48 h. La rápida aparición de los PMN se debe a que son más abundantes en la sangre, responden más rápido a las quimioquinas y se adhieren más fuertemente a las moléculas de adhesión que aparecen en las células endoteliales activadas, como las selectinas E y P. Sin embargo, después de entrar en los tejidos, los PMN tienen una vida media corta: sufren apoptosis y desaparecen después de 24-48 h. Los monocitos responden más despacio, pero no solo sobreviven en los tejidos, sino que además proliferan y dan lugar a los macrófagos, de manera que se convierten en la población dominante en las reacciones inflamatorias crónicas. Sin embargo, en algunos casos las poblaciones de leucocitos pueden variar: en infecciones por Pseudomonas, los neutrófilos se reclutan de forma continua durante varios días, y en infecciones virales, los linfocitos son los primeros en llegar, por ejemplo.
Mediadores de la inflamación
[editar]Estos mediadores son pequeñas moléculas que consisten en lípidos (prostaglandinas, leucotrienos y tromboxano), aminoácidos modificados (histamina, serotonina) y pequeñas proteínas (citoquinas, factores de crecimiento, interleuquinas...) que representan información específica destinada a las células capaces de utilizar esta información gracias a la presencia de receptores específicos en su membrana plasmática. Los mediadores de la inflamación son de origen plasmático (sintetizados por el hígado) o celular.[9]
Metabolitos del ácido araquidónico
[editar]El ácido araquidónico (AA) es un derivado del ácido graso esencial ácido linoleico, con muchos enlaces dobles, que se encuentra normalmente esterificado en forma de fosfolípido en las membranas celulares. El AA se libera por acción de las fosfolipasas celulares, a partir de cualquier célula activada (plaquetas), estresada o a punto de morir por necrosis. Una vez liberado, el AA puede metabolizarse por dos vías:
- las ciclooxigenasas (la forma constitutiva COX-1 y la inducible COX-2) generan intermediarios que, después de ser procesados por enzimas específicas, producen las prostaglandinas (PGD2 producido por mastocitos, PGE2 por macrófagos y células endoteliales, entre otros) y los tromboxanos (TXA2, el principal metabolito del AA generado por las plaquetas); el endotelio vascular carece de tromboxano sintetasa, pero posee una prostaciclina sintetasa, y por tanto genera prostaciclina (PGI2);
- las lipooxigenasas generan intermediarios de los leucotrienos y las lipoxinas.
Los derivados del ácido araquidónico (también denominados eicosanoides) sirven como señales intra o extracelulares en una gran variedad de procesos biológicos, entre ellos la inflamación y la hemostasis. Sus efectos principales son:
- prostaglandinas (PGD2, PGE2): vasodilatación, dolor y fiebre;
- prostaciclinas (PGI2): vasodilatación e inhibición de la agregación plaquetaria;
- tromboxanos (TXA2): vasoconstricción y activación de la agregación plaquetaria;
- leucotrienos: LTB4 es quimiotáctico y activador de los neutrófilos; los otros leucotrienos son vasoconstrictores, inducen el broncoespasmo y aumentan la permeabilidad vascular (mucho más potentes que la histamina);
- lipoxinas: vasodilatación, inhibición de la adhesión de los PMN; estos metabolitos del AA producen una disminución de la inflamación, por lo que intervienen en la detención de la inflamación; a diferencia del resto de los derivados del AA, necesitan de dos tipos celulares para ser sintetizados: los neutrófilos producen intermediarios de la síntesis, que son convertidos en lipoxinas por plaquetas al interaccionar con los neutrófilos.
Aminas vasoactivas: histamina y serotonina
[editar]Histamina y serotonina son las dos principales aminas vasoactivas, llamadas así por su importante acción sobre los vasos. Se almacenan ya preformados en gránulos, dentro de las células que los producen, por lo que son mediadores precoces de la inflamación. El principal productor de histamina son los mastocitos, aunque también se produce por los basófilos y las plaquetas. En el caso de los mastocitos, la histamina se libera cuando estas células producen desgranulación, en respuesta a diferentes tipos de estímulos:
- Daño físico, como traumatismo, frío o calor;
- Unión de anticuerpos a los mastocitos, que es la base de las reacciones alérgicas;
- Unión de elementos del sistema del complemento denominados anafilotoxinas (sobre todo C3a, C5a);
- Proteínas que inducen la liberación de histamina derivadas de leucocitos;
- Neuropéptidos (por ejemplo, la sustancia P);
- Citoquinas (IL-1, IL-8).
La histamina dilata las arteriolas y aumenta la permeabilidad de las vénulas. Es el principal mediador del aumento transitorio inmediato de la permeabilidad vascular, produciendo espacios interendoteliales en las vénulas que favorecen la salida del exudado plasmático. Este efecto se realiza a través de receptores H1 presentes en las células endoteliales.
La serotonina es otro mediador preformado que produce efectos similares. Está presente en las plaquetas y en ciertas células neuroendocrinas, por ejemplo en el tracto gastrointestinal. La liberación de serotonina (e histamina) se activa cuando las plaquetas se agregan en contacto con el colágeno, la trombina, ADP y complejos antígeno-anticuerpo (ver Hemostasis para un mayor detalle sobre este proceso).
Citoquinas
[editar]Las citoquinas son pequeñas proteínas (entre 5 y 20 kD) que permiten el intercambio de información entre las diferentes células durante el proceso de inflamación, la hematopoyesis y las respuestas inmunes. Los factores de crecimiento que utilizan las células epiteliales para estimular su renovación son asimismo citoquinas.
En general, las citoquinas se pueden considerar como hormonas con un radio de acción limitado, a excepción de IL-1 y TNF-α, que funcionan como verdaderas hormonas, transmitiendo información a través de todo el organismo.
Las citoquinas liberadas por los macrófagos durante la inflamación van a afectar a las células endoteliales, los PMN (durante la fase aguda) y después los fibroblastos y de nuevo las células endoteliales durante la fase de reparación. La información emitida por una citoquina solo será recibida por aquellas células que presenten receptores específicos para esa citoquina. Los mensajes de las citoquinas son múltiples; los principales son:
- La proliferación (factores de crecimiento);
- La diferenciación;
- La migración (quimioquinas);
- La apoptosis (familia TNF);
- Acción pro-inflamatoria (IL-1 y TNF-α);
Algunos mensajes muy importantes, como la estimulación de los linfocitos T, son emitidos por muchas citoquinas. Esta redundancia asegura la transmisión de la información.
Factor Activador de las Plaquetas
[editar]El factor activador de plaquetas (PAF) es otro mediador derivado de fosfolípidos. Se encuentra en plaquetas, mastocitos, basófilos, PMN, monocitos, macrófagos y células endoteliales. Sus acciones principales son:
- agregación de las plaquetas;
- vasoconstricción y broncoconstricción;
- adhesión leucocitaria al endotelio;
- quimiotaxis;
- degranulación y estallido oxidativo;
- activación de la síntesis de eicosanoides.
Óxido nítrico
[editar]El óxido nítrico (NO) es un gas producido en algunas neuronas del cerebro, macrófagos y células endoteliales. Actúa de forma paracrina (acción y local) sobre las células diana, a través de la inducción de GMPc, que inicia una serie de sucesos intracelulares que provocan la relajación del músculo liso (vasodilatación). La vida media in vivo del NO es muy corta, por lo que solo actúa sobre las células muy próximas al lugar de producción.
El NO se sintetiza a partir de L-arginina por la enzima NO-sintasa (NOS). Hay tres tipos de NOS: endotelial (eNOS), neuronal (nNOS) e inducible (iNOS). Las dos primeras son constitutivas, se expresan a niveles bajos y pueden activarse rápidamente aumentando los niveles de calcio intracelular. Sin embargo, la iNOS se activa solamente cuando los macrófagos y otras células son activados por citoquinas (como IFN-γ) o productos microbianos.
Radicales Libres de Oxígeno (RLO)
[editar]Los radicales libres de oxígeno son un tipo de especies reactivas del oxígeno (ERO, o también ROS, por sus siglas en inglés). Estos radicales pueden liberarse al medio extracelular por los leucocitos después de que hayan sido activados por la presencia de microbios, quimioquinas, complejos inmunes, o después de la fagocitosis. Su producción depende de la activación del sistema NADPH oxidasa. Las principales especies producidas intracelularmente son el anión superóxido (O2-), el peróxido de hidrógeno H2O2 y el radical hidroxilo (*OH). El anión superóxido puede combinarse con el óxido nítrico para formar especies reactivas del nitrógeno. Estas sustancias atacan todos los materiales biológicos (ADN, proteínas, lípidos...), bien arrancando electrones, arrancando átomos de hidrógeno o adicionándose sobre los enlaces dobles: reaccionan como potentes oxidantes. La consecuencia es, por tanto, la alteración y la posterior pérdida de función de las moléculas afectadas.
La liberación extracelular de estas potentes sustancias a bajas concentraciones activan quimiocinas, citoquinas y moléculas de adhesión leucocitaria endotelial, amplificando la respuesta inflamatoria. Están implicados en las siguientes respuestas inflamatorias:
- Daño de las células endoteliales, que consecuentemente produce un aumento de la permeabilidad vascular; cuando los PMN se adhieren al endotelio, si se activan, pueden no solo liberar estos productos, sino inducir la producción de ERO en el endotelio;
- Daño a otras células, como glóbulos rojos o células del parénquima;
- Inactivación de antiproteasas, como la α1-antitripsina, lo cual provoca un incremento de la destrucción tisular; esto ocurre, por ejemplo, en el enfisema pulmonar;
El plasma, los fluidos tisulares y las células poseen mecanismos antioxidantes para protegerse de los radicales libres de oxígeno. Entre estos se encuentran:
- La enzima superóxido dismutasa, que convierte el anión superóxido en peróxido de hidrógeno;
- La enzima catalasa, que detoxifica el peróxido de hidrógeno;
- La glutatión peroxidasa, otro potente detoxificador del H2O2;
- El ácido úrico,[10] un potente antioxidante presente en el plasma en una concentración mucho mayor que el ascorbato (vitamina C);
- La proteína ceruloplasmina, la principal transportadora de cobre en el suero;
- La fracción plasmática libre de hierro de la proteína transferrina.
Además existen compuestos de origen alimentario con capacidad antioxidante que también intervienen en la neutralización de ERO:
- El α-tocoferol (vitamina E), liposoluble, con capacidad de protección de las membranas celulares;
- Los carotenoides (como el β-caroteno) y los polifenoles (como el ácido cafeico y la quercetina);
- El ascorbato (vitamina C), hidrosoluble, capaz de regenerar los demás antioxidantes, como el glutatión o el α-tocoferol.
Por ello, el efecto negativo de los ERO se observa si se produce un desequilibrio debido a una producción exagerada de estas sustancias o por una disminución de los sistemas de defensa, enzimáticos y no enzimáticos.
Constituyentes de los lisosomas de los leucocitos
[editar]Los neutrófilos y los monocitos contienen gránulos lisosomales necesarios para la digestión de los materiales fagocitados. Si estos compuestos se vierten al exterior, pueden amplificar la respuesta inflamatoria, ya que tienen un efecto destructor sobre los tejidos (elastasas, colagenasas, proteasas...). Para contrarrestar su efecto, existen antiproteasas en el suero, fundamentalmente la α1-antitripsina, que es el principal inhibidor de la elastasa. Otra antiproteasa importante es la α2-macroglobulina.
Neuropéptidos
[editar]Los neuropéptidos son sustancias segregadas por los nervios sensoriales y varios tipos de leucocitos, y juegan un papel en la propagación de la respuesta inflamatoria. Entre ellos se encuentran la sustancia P y la neurocinina A, pertenecientes a la familia de los taquininos y producidos en el SNC y periférico. Los pulmones y el tracto gastrointestinal son ricos en fibras que contienen sustancia P. Esta tiene muchas funciones: transmisión de las señales dolorosas, regulación de la presión sanguínea, estimulación de la secreción de las células endocrinas y aumento de la permeabilidad vascular.
Mediadores derivados de proteínas plasmáticas
[editar]Una gran variedad de fenómenos en la respuesta inflamatoria están mediados por proteínas plasmáticas que pertenecen a tres sistemas interrelacionados:
- El sistema del complemento: las proteínas de este sistema están presentes en el plasma en forma inactiva, y cuando se activan se convierten en enzimas proteolíticas que degradan otras proteínas del complemento, formando una cascada; los elementos que participan en el proceso inflamatorio son C3a, C5a y en menor medida C4a, denominadas anafilotoxinas, que estimulan la liberación de histamina por los mastocitos, y por lo tanto producen vasodilatación; C5a además tiene capacidad quimiotáctica y activa la lipooxigenasa, generando leucotrienos;
- La coagulación; la inflamación aumenta la producción de algunos factores de la coagulación y convierte al endotelio en trombogénico; en contrapartida, la trombina promueve la inflamación mediante la activación de receptores denominados PAR (protease-activated receptors), que activan diferentes respuestas: movilización de selectina-P, producción de quimioquinas y citoquinas, expresión de receptores para integrinas en el endotelio, inducción de la COX-2 y producción de prostaglandinas, producción de NO y PAF, y cambios en la forma endotelial. Como la coagulación y la inflamación pueden iniciar un círculo vicioso de amplificación, la interferencia con la coagulación puede ser una estrategia terapéutica en algunas patologías para reducir la inflamación;
- Las quininas son péptidos vasoactivos derivados de proteínas plasmáticas, denominadas quininógenos, por la acción de enzimas específicas denominadas calicreínas; el sistema de quininas está íntimamente ligado a la coagulación: la forma activa del factor XII, FXIIa, convierte la precalicreína del plasma en calicreína, que corta una proteína del plasma de alto peso molecular para generar bradiquinina. La bradiquinina aumenta la permeabilidad vascular y causa contracción del músculo liso, dilatación de los vasos y dolor, efectos similares a los de la histamina. Por otro lado, la calicreína tiene efecto quimiotáctico, convierte C5 del sistema del complemento en C5a (también quimiotáctico) y convierte el plasminógeno en plasmina para degradar el coágulo secundario.
De estos tres sistemas, probablemente los mediadores de la inflamación más importantes in vivo son bradiquinina, C3a, C5a y trombina.
| Papel en la inflamación | Mediadores |
|---|---|
| Vasodilatación | |
| Aumento de la permeabilidad vascular |
|
| Quimiotaxis, reclutamiento de leucocitos y activación |
|
| Fiebre | |
| Dolor | |
| Daño tisular |
|
Efectos generales de la inflamación
[editar]Las citoquinas IL-1 y TNF-α producidas por los macrófagos funcionan como "hormonas" de la inflamación, y actúan sobre el conjunto del organismo para movilizar todos los recursos disponibles para luchar contra el agente infeccioso. En particular, su acción sobre el centro de la fiebre permite elevar la temperatura, lo que compromete la supervivencia bacteriana. Su acción sobre el hígado permite aumentar la síntesis de las proteínas de fase aguda, que son también antibacterianas (sistema del complemento, proteína C reactiva).
Detención de la respuesta inflamatoria aguda
[editar]Puesto que este potente proceso de defensa puede producir daños importantes en los tejidos del huésped, es importante mantenerlo bajo un estricto control. En parte, la inflamación desaparece simplemente porque los mediadores se producen en estallidos rápidos, solo mientras persiste el estímulo, tienen vidas medias cortas, y son degradados tras su liberación. Los neutrófilos también tienen una vida media corta y mueren por apoptosis unas pocas horas después de dejar la sangre. Además, durante el desarrollo del proceso inflamatorio se disparan unas serie de señales de STOP que sirven para terminar la reacción de forma activa:[9]
- Cambio en el tipo de metabolitos producidos a partir del ácido araquidónico, cambiando los leucotrienos pro-inflamatorios por las lipoxinas antiinflamatorias;
- Los macrófagos y otras células liberan citoquinas antiinflamatorias, como TGF-β e IL-10;
- Producción de mediadores lípidicos antiinflamatorios (como resolvinas y protectinas), derivados de ácidos grasos poliinsaturados;
- Generación de impulsos nerviosos (descargas colinérgicas) que inhiben la producción de TFN por los macrófagos.
Inflamación crónica
[editar]Cuando la inflamación se mantiene durante un tiempo prolongado (semanas o meses), se habla de inflamación crónica, en la que coexisten el daño tisular y los intentos de reparación, en diversas combinaciones.[9] Puede producirse por mantenimiento de la inflamación aguda (si no se resuelve la causa), o bien empezar de manera progresiva y poco evidente, sin las manifestaciones de la inflamación aguda. Este segundo caso es el responsable del daño tisular de algunas de las enfermedades humanas más invalidantes, como la artritis reumatoide, la aterosclerosis, la tuberculosis o la fibrosis pulmonar. Además, es importante en el desarrollo del cáncer y en enfermedades que anteriormente se consideraban exclusivamente degenerativas, como el Alzheimer.
En caso de no resolución se drenan también las bacterias y se extiende la infección por vía linfática: linfangitis (inflamación de los vasos linfáticos) y linfadenitis (inflamación de los ganglios linfáticos).
Causas
[editar]Entre las causas de la inflamación crónica se pueden distinguir:
Infecciones persistentes
[editar]En el caso de microbios difíciles de erradicar, como micobacterias, ciertos hongos, virus y parásitos. Pueden dar lugar a la formación de granulomas.
Enfermedades mediadas por el sistema inmune
[editar]En algunas enfermedades en las que la respuesta inmunitaria se produce de manera exagerada o inapropiada en relación con el agente desencadenante, la inflamación crónica juega un papel importante en el aspecto patológico de las mismas. En estos casos, como la respuesta inmune está sobredimensionada, no produce beneficio, sino daño. Por ejemplo:
- En las enfermedades autoinmunes, el sistema inmune de un individuo produce anticuerpos contra sus propios tejidos, provocando una reacción inmune continua que resulta en inflamación crónica y daño de los tejidos; es el caso de la artritis reumatoide y la esclerosis múltiple;
- En otros casos, se produce una respuesta inmune exagerada frente a microbios, como en la enfermedad de Crohn, en la que se produce una reacción frente a las bacterias intestinales;
- En las reacciones alérgicas, se produce una respuesta desproporcionada a agentes ambientales comunes, como en el asma bronquial.
En este tipo de enfermedades, se suelen producir brotes repetidos de inflamación, por lo que se pueden observar características mixtas de la inflamación aguda y crónica.
Exposición prolongada a agentes tóxicos
[editar]Dichos agentes pueden ser:
- Exógenos, como el polvo de sílice, un material inerte y no degradable, que inhalado por periodos prolongados puede producir la enfermedad inflamatoria de los pulmones conocida como silicosis;
- Endógenos: la acumulación de lípidos endógenos tóxicos (véase también LDL) en los vasos sanguíneos produce una inflamación crónica de los mismos, causando aterosclerosis.
Teorías nuevas: permeabilidad intestinal aumentada
[editar]
La alteración de la permeabilidad intestinal está implicada en el desarrollo de un creciente número de enfermedades, entre ellas ciertas enfermedades inflamatorias, en las que el aumento de la permeabilidad intestinal permite el paso de antígenos desde el intestino a la sangre, produciendo una respuesta inmune que puede dirigirse contra cualquier órgano o tejido.[11]
El epitelio intestinal es la superficie mucosa más grande del organismo e interactúa con el entorno. Cuando la mucosa intestinal está sana, con la permeabilidad intacta, constituye la principal barrera para evitar el paso de macromoléculas (nutrientes incompletamente digeridos, toxinas y ciertas bacterias intestinales). Cuando la permeabilidad intestinal está dañada (aumentada), la barrera intestinal pierde su función protectora y pasan al torrente sanguíneo moléculas que no deberían pasar, provocando la aparición de reacciones inmunitarias. En la mayoría de los casos, el aumento de la permeabilidad intestinal aparece antes que la enfermedad y provoca una anormalidad en la exposición al antígeno que desencadena el proceso inflamatorio. Esto implica que la respuesta inflamatoria puede ser en teoría detenida y posiblemente invertida, si se elimina el desencadenante o desencadenantes ambientales.[11]
Los dos factores más potentes que provocan aumento de la permeabilidad intestinal son ciertas bacterias intestinales y la gliadina (principal fracción tóxica del gluten),[11] independientemente de la predisposición genética, es decir, tanto en celíacos como en no celíacos.[12][13] Otras posibles causas son la prematuridad, la exposición a la radiación y la quimioterapia.[11]
Características
[editar]Mientras que la inflamación aguda se caracteriza por la aparición de cambios vasculares, edema e infiltración de neutrófilos, la inflamación crónica presenta las siguientes características distintivas:
- Infiltración con células mononucleares: macrófagos, linfocitos y células plasmáticas;
- Destrucción de tejidos, debido a la persistencia del agente o de las células inflamatorias;
- Intentos de reconstrucción, reemplazando el tejido dañado con tejido conectivo, con proliferación de vasos (angiogénesis) y, sobre todo, fibrosis.
Además de los infiltrados celulares, en la inflamación crónica es muy importante el crecimiento de vasos sanguíneos (angiogénesis) y linfáticos, estimulado por factores de crecimiento como VEGF, producidos por macrófagos y células endoteliales.
Células implicadas en la inflamación crónica
[editar]Macrófagos
[editar]Los macrófagos son el tipo celular dominante en la inflamación crónica. Son uno de los componentes del sistema fagocítico mononuclear, también denominado sistema retículo-endotelial, que está formado por células originadas en la médula ósea. Los macrófagos son células residentes en los tejidos, que se originan a partir de los monocitos del plasma. Sin embargo, mientras que los monocitos tienen una vida media corta (1 día), los macrófagos tisulares sobreviven durante meses o años. Según el tejido en el que se encuentran, los macrófagos tisulares reciben nombres diferentes: por ejemplo, los histiocitos del tejido conjuntivo, las células de Kupffer del hígado, las células de Langerhans de la epidermis, los osteoclastos del tejido óseo, la microglía del SNC o los macrófagos alveolares del pulmón. Los macrófagos tisulares son células centinela, conjuntamente con los mastocitos, ya que presentan receptores específicos capaces de detectar agentes infecciosos, como los receptores de tipo Toll. La unión de estos receptores a sus ligandos produce la activación de los macrófagos, proceso que puede inducirse además por la presencia de citoquinas como el interferón-γ (IFN-γ), una molécula segregada por los linfocitos T activados y por las células NK.
Los productos de los macrófagos activados eliminan microbios e inician el proceso de reparación tisular, y son los responsables de la mayor parte de los daños tisulares en la inflamación crónica. Entre estos productos, podemos destacar las especies reactivas del oxígeno (ERO) y del nitrógeno, así como las enzimas lisosomales, citoquinas, factores de crecimiento y otros mediadores de la inflamación. Algunos de estos productos, como los radicales libres, son tóxicos y destruyen tanto los microbios como los tejidos; otros atraen otros tipos celulares o inducen la producción de colágeno por parte de los fibroblastos o la angiogénesis. De hecho, podrían existir dos poblaciones diferentes de macrófagos activados, en función del tipo de activación que hayan sufrido:
- Activación por microbios o IFN-γ: producción de sustancias inflamatorias, dañinas para los tejidos (ROS y RNS, proteasas, citoquinas, factores de coagulación, metabolitos del ácido araquidónico);
- Activación por IL-4 y otras citoquinas: producción de sustancias mediadoras de la reparación tisular (factores de crecimiento, citoquinas fibrogénicas, factores angiogénicos como FGF...).
La artillería destructiva a disposición de los macrófagos les convierte en unos eficaces combatientes en la lucha contra la invasión por agentes patógenos, pero se convierte en un arma temible de doble filo cuando se dirige hacia los propios tejidos. Por ello, la destrucción de tejidos es un elemento característico de la inflamación crónica, ya que a diferencia de la inflamación aguda, en la que los macrófagos desaparecen cuando se elimina la causa (mueren o entran en las vías linfáticas), en la inflamación crónica los macrófagos se acumulan, aumentando los daños colaterales.
Linfocitos
[editar]Los linfocitos son células que se movilizan en la respuesta específica del sistema inmune, activándose con el objetivo de producir anticuerpos y células capaces de identificar y destruir el microbio patógeno. Los macrófagos segregan citoquinas (sobre todo TNF e IL-1) y quimioquinas capaces de reclutar leucocitos a partir de la sangre y movilizarlos hacia la zona afectada. Las interacciones entre linfocitos y macrófagos son bidireccionales, ya que los macrófagos reclutan y activan linfocitos, y estos a su vez segregan citoquinas (sobre todo IFN-γ) con una potente capacidad de activar macrófagos. De manera que una vez que los linfocitos entran en acción, la inflamación tiende a agravarse, convirtiéndose en crónica y severa.
Células plasmáticas
[editar]Las células plasmáticas se diferencian a partir de los linfocitos B activados. Su función consiste en la producción de grandes cantidades de anticuerpos dirigidos contra el microbio patógeno, o en ocasiones contra antígenos endógenos (en las enfermedades autoinmunes). En algunos pacientes con inflamación crónica (como la artritis reumatoide), las células plasmáticas, linfocitos y células presentadoras de antígenos se acumulan en nódulos similares a los ganglios linfáticos, que contienen incluso centros germinales bien definidos. Estos nódulos se denominan órganos linfoides terciarios.
Eosinófilos
[editar]Los eosinófilos son abundantes en reacciones inflamatorias mediadas por IgE y en infecciones por parásitos. Estos leucocitos tienen gránulos que contienen la proteína básica principal, una proteína catiónica muy básica que es tóxica tanto para los parásitos como para los tejidos. Tienen por ello un papel importante en la destrucción de tejidos en reacciones inmunes, como las alergias.
Mastocitos
[editar]Los mastocitos, como los macrófagos, son células centinelas ampliamente distribuidas por los tejidos, que reaccionan al estrés físico (calor, frío, presión), y participan tanto en la inflamación aguda como en la crónica. En sus membranas tienen receptores para IgE, que en reacciones de hipersensibilidad inmediata, estimulan la degranulación, liberando mediadores como histamina y prostaglandinas. Este tipo de reacción ocurre en las reacciones alérgicas, pudiendo llegar a producir un choque anafiláctico. En la inflamación crónica, como presentan una gran variedad de mediadores, pueden promover o limitar la inflamación, en función de las circunstancias.
Neutrófilos
[editar]Aunque los neutrófilos (PMN) son característicos de la inflamación aguda, en muchos casos de inflamación crónica puede detectarse la presencia de PMN durante meses, bien debido a la persistencia de la infección o de mediadores producidos por los linfocitos. Esto ocurre por ejemplo en la osteomielitis (infección bacteriana crónica del hueso) o en el daño crónico de los pulmones inducido por el humo del tabaco y otros irritantes.
Inflamación granulomatosa
[editar]Es un patrón característico de inflamación crónica que solo se encuentra en algunos casos bien definidos de inflamación crónica. Un granuloma es un intento celular de aislar un cuerpo extraño que no puede ser fagocitado. Normalmente se produce una fuerte activación de linfocitos T, que induce a su vez la activación intensa de los macrófagos. Como resultado de esta activación, se producen los granulomas, que son focos de inflamación crónica, en los que el agente patógeno está en el centro, rodeado por macrófagos transformados en células pseudo-epiteliales, rodeados por leucocitos mononucleares, sobre todo linfocitos y en ocasiones células plasmáticas. El prototipo de enfermedad granulomatosa es la tuberculosis, pero los granulomas pueden identificarse en otras enfermedades, como la sífilis, vasculitis, sarcoidosis, lepra o la enfermedad de Crohn. Se pueden detectar dos tipos fundamentales de granulomas:
- Por cuerpo extraño: generados por materiales externos relativamente inertes, como el talco (asociado con el abuso intravenoso de drogas), suturas u otros materiales que no se fagocitan fácilmente; frecuentemente debido al uso de prótesis, material quirúrgico, sílice, berilio...;
- Inmunitario: inducido por una variedad de agentes capaces de inducir una respuesta inmune mediada por células, cuando el agente patógeno es difícilmente degradable.
El granuloma puede ir asociado a:
- Necrosis.
- Caseosa: producida por micobacterias.
- Abscesificada: en la enfermedad por arañazo de gato, infecciones por bartonella...
- Fibrosis: que limita perfectamente el granuloma como ocurre en la sarcoidosis.
- Linfocitos y células plasmáticas: rodeándolo.
- Otros granulomas: no individuales, sino fusionados (tuberculosis o brucelosis).
Cuando existe mucha fibrosis se diferencia perfectamente el granuloma y se denomina sarcoidosis: enfermedad que afecta principalmente al pulmón, ganglios linfáticos, piel, conjuntiva, riñón... Otras veces se puede formar un espacio con gas; también pueden aparecer cristales de ácido úrico, que se depositan formando el granuloma (gota). Y en la tuberculosis el granuloma se caracteriza por necrosis caseosa central sin inclusiones y sin fibrosis, lo que lo diferencia de la sarcoidosis. Sin embargo, hay tantas presentaciones atípicas de granulomas que siempre es necesario identificar el agente patógeno por otros métodos: tinciones específicas, cultivos celulares, técnicas moleculares (como la técnica de Reacción en cadena de la polimerasa o PCR) o estudios serológicos.
Véase también
[editar]Referencias
[editar]- ↑ Abbas, A.B.; Lichtman A.H. (2009). «Ch.2 Innate Immunity». Basic Immunology. Functions and disorders of the immune system (3rd edición). Saunders (Elsevier). ISBN 978-1-4160-4688-2.
- ↑ Sobre la etimología de "flogisto" y los términos derivados (Consultado sábado, 13 de enero del 2024.)
- ↑ Definición de "flogosis" en el Diccionario de la lengua española, editado por la Real Academia Española (Consultado sábado, 14 de enero del 2024.)
- ↑ Goldsby, R., Inmunología, 5a. ed., McGraw Hill, cap. I, p. 7.
- ↑ Cohnheim, J. Ueber Entzündung und Eiterung. 1867.
- ↑ «Inflamación» (PDF). Gaceta Médica de México 97 (5): 535-538. 1967.
- ↑ León Regal M.L.; Alvarado Borges A.; de Armas García J.A.; Miranda Alvarado L.; Varens Cedeño J.A.; Cuesta del Sol J.A. (2015). «Respuesta inflamatoria aguda. Consideraciones bioquímicas y celulares». Rev. Finlay (REVISIÓN) (Cienfuegos, Cuba.: SciELO) 5 (1). Consultado el 13 de enero de 2024.
- ↑ López-Bagoa A. (2018). «Inmunidad e inflamación en el proceso quirúrgico». Rev. Fac. Med. (Méx.) (REVISIÓN) (México: SciELO) 61 (4).
- ↑ a b c d e f g Kumar, MBBS, MD, FRCPath, V.; Abul K. Abbas, MBBS, Nelson Fausto, MD and Jon Aster, MD (2009). «Ch.2 Acute and chronic inflammation». En Saunders (Elsevier), ed. Robbins & Cotran Pathologic Basis of Disease (8th edición). ISBN 978-1-4160-3121-5.
- ↑ Ames, B.N.; Cathcart, R.; Schwiers, E.; Hochstein, P. (1981), «Uric acid provides an antioxidant defense in humans against oxidant- and radical-caused aging and cancer: a hypothesis», Proc Natl Acad Sci USA 78: 6858-6862, archivado desde el original el 5 de febrero de 2015, consultado el 26 de enero de 2010.
- ↑ a b c d e f Fasano, A (2011 Jan). «Zonulin and its regulation of intestinal barrier function: the biological door to inflammation, autoimmunity, and cancer». Physiol Rev 91 (1): 151-75. PMID 21248165. doi:10.1152/physrev.00003.2008. Archivado desde el original el 26 de agosto de 2015.
- ↑ a b Hollon, J; Puppa, EL; Greenwald, B; Goldberg, E; Guerrerio, A; Fasano, A (2015 Feb 27). «Effect of gliadin on permeability of intestinal biopsy explants from celiac disease patients and patients with non-celiac gluten sensitivity». Nutrients 7 (3): 1565-76. PMID 25734566. doi:10.3390/nu7031565.
- ↑ a b Fasano, A (2012 Oct). «Intestinal permeability and its regulation by zonulin: diagnostic and therapeutic implications». Clin Gastroenterol Hepatol 10 (10): 1096-100. PMC 3458511. PMID 22902773. doi:10.1016/j.cgh.2012.08.012.