Amida
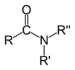
Una amida es un compuesto que se forma conceptual o químicamente por el reemplazo del hidroxilo de un oxácido por un sustituyente amino. En química orgánica, se le denomina por antonomasia como "amida" a las amidas de los ácidos carboxílicos (estrictamente, carboxamida). Se puede considerar como un derivado de un ácido carboxílico por sustitución del grupo —OH del ácido por un grupo —NH2, —NHR o —NRR' (llamado grupo amino).[1] Por esto su grupo funcional es del tipo RCONR'R'', siendo CO un carbonilo, N un átomo de nitrógeno, y R, R' y R'' radicales orgánicos o átomos de hidrógeno:

| Formamida (amida del ácido fórmico) |
Amida (carboxamida) (amida de ácido carboxílico) |
Urea o carbamida (amida del ácido carbónico) |
Cianimida (amida del ácido ciánico) |
Hexametilfosforamida (amida hexametilada del ácido fosfórico) |
Sulfamida (amida de ácido sulfúrico) |
Nitramida (amida de ácido nítrico) |
|---|---|---|---|---|---|---|

|
|

|

|
Cuando el grupo amida no es el principal, se nombra usando el prefijo carbamoil:[2]
CH3-CH2-CH(CONH2)-CH2-CH2-COOH → ácido 4-carbamoilhexanoico.
Todas las amidas, excepto la primera de la serie, son sólidas a temperatura ambiente[3] y sus puntos de ebullición son elevados, más altos que los de los ácidos correspondientes. Presentan excelentes propiedades disolventes y son bases muy débiles. Uno de los principales métodos de obtención de estos compuestos consiste en hacer reaccionar el amoníaco (o aminas primarias o secundarias) con ésteres. Las amidas son comunes en la naturaleza, y una de las más conocidas es la urea,[4] una diamida que no contiene hidrocarburos. Las proteínas y los péptidos están formados por amidas. Un ejemplo de poliamida de cadena larga es el nailon.[5] Las amidas también se utilizan mucho en la industria farmacéutica.
Poliamidas
editarLa amida del ácido carbónico es denominada urea y sus derivados son el grupo funcional ureido.
Las diacilaminas son denominadas como grupo funcional imida y son análogas a los anhídridos carboxílicos, por ejemplo el carboxilio
Las poliamidas son compuestos que contienen grupos amida.[6] Algunos son sintéticas, como el nailon, pero también se encuentran en la naturaleza, en las proteínas,[7] formadas a partir de los aminoácidos, por reacción de un grupo carboxilo de un aminoácido con un grupo amino de otro. En las proteínas al grupo amida se le llama enlace peptídico.[8]
El nailon es una poliamida debido a los característicos grupos amida en la cadena principal de su formulación. Por ejemplo, el nailon 6 se obtiene por polimerización de la ε-caprolactama.
Ciertas poliamidas del tipo nailon son la poliamida-6, la poliamida-11, la poliamida-12, la poliamida-9,6, la poliamida-6,9, la poliamida-6,10 y la poliamida-6,12. Se pueden citar como ejemplo de poliamidas no lineales los productos de condensación de ácidos dimerizados de aceites vegetales con aminas.
Los péptidos, incluyendo las proteínas como la seda, a la que el nailon reemplazó, también son poliamidas. Estos grupos amida son muy polares y pueden unirse entre sí mediante enlaces por puente de hidrógeno. Debido a esto y a que la cadena del nailon es tan regular y simétrica, los nailones son a menudo cristalinos, y forman excelentes fibras.
Síntesis de amidas
editarLa síntesis de amidas se puede llevar a cabo por diversos métodos.[9] El método más simple es la condensación de un ácido carboxílico con una amina. Esta reacción es termodinámicamente favorable en general, pero tiene una elevada energía de activación, debido principalmente a la primera desprotonación del ácido carboxílico y la protonación de la amina, lo cual forma un producto estable, el carboxilato de aminio. Esto reduce la reactividad. Además, se requieren altas temperaturas.[10]
- RCO2H + R′R″NH RCO−
2 + R′R″NH+
2 RC(O)NR′R″ + H2O
Se conocen muchos métodos para conducir el equilibrio hacia la derecha. En su mayor parte, estas reacciones implican "activar" el ácido carboxílico convirtiéndolo primero en un mejor electrófilo; tales como ésteres, cloruros de ácido (reacción de Schotten-Baumann) o anhídridos (método de Lumière-Barbier). Los métodos convencionales en la síntesis de péptidos usan agentes de acoplamiento tales como HATU, hidroxibenzotiazol (HOBt) o PyBOP.[11] Recientemente, han surgido reactivos novedosos a base de boro para la formación del enlace CO-N, incluyendo el uso de catalizadores de ácido 2-yodofenilborónico,[12] MIBA[13] y borato de tris(2,2,2-trifluoroetilo).[14][15]
| Nombre de la reacción | Sustrato | Detalles |
|---|---|---|
| Transposición de Beckmann | Cetona cíclica | Reactivo: hidroxilamina en medio ácido. Se forma una lactama. |
| Reacción de Schotten-Baumann | Halogenuro de acilo | Reactivo: amina con un halogenuro de acilo en medio básico
|
| Reacción de Schmidt | Cetonas | Reactivo: Ácido hidrazoico
|
| Hidrólisis de nitrilos[16] | Nitrilo | Reactivo: Agua en medio ácido
|
| Reacción de Willgerodt–Kindler | Aril alquil cetonas | Azufre y morfolina
|
| Reacción de Passerini | Ácido carboxílico, cetona o aldehído | Reacción de tres componentes entre un ácido carboxílico, un compuesto carbonílico, como una cetona o un aldehído, y un isocianuro, para formar α-hidroxicarboxamidas. |
| Reacción de Ugi | Isocianuro, ácido carboxílico, cetona, amina primaria | Condensación de cuatro componentes entre un aldehído, una amina, un ácido carboxílico y un isocianuro para preparar derivados de α-aminoacil amidas. |
| Reacción de Bodroux[17][18] | Ácido carboxílico, reactivo de Grignard con un derivado de anilina ArNHR′ | |
| Transposición de Chapman [19][20] | Arilo, imino éter | Para N,N-diaril amidas. El mecanismo de reacción está basado en una sustitución nucleofílica aromática.[21] |
| Síntesis de amidas de Leuckart[22] | Isocianato | Reacción de un areno con un isocianato catalizado por cloruro de aluminio. Se forma una benzamida. |
| Reacción de Ritter[23] | Alquenos, alcoholes, o cualquier otra fuente de carbocatiónes | Amidas con el nitrógeno enlazado a un carbono terciario por medio de una reacción de adición entre un nitrilo y un carbocatión terciario en presencia de ácidos concentrados.
|
| Adición fotolítica de una formamida a olefinas[24] | Alquenos terminales | Reacción de homologación radicalaria entre un alqueno termina y formamida. |
| Aminólisis de ésteres[25][26][27] | Ésteres | Reacción de aminólisis ácida de ésteres. |
Reacciones de amidas
editarLas principales reacciones de las amidas son:
- Hidrólisis ácida o básica: La amida se hidroliza en medio básico formando un carboxilato de metal o en medio ácido formando un ácido carboxílico.
- Deshidratación: En presencia de un deshidratante como cloruro de tionilo o pentóxido de fósforo se produce un nitrilo.
- Reducción: Las amidas pueden reducirse con hidruro de litio y aluminio a aminas.
- Transposición de Hofmann: En presencia de un halógeno en medio básico se produce una compleja reacción que permite la obtención de una amina con un carbono menos en su cadena principal.
Ejemplo de amida
editar- La acrilamida se emplea en distintas aplicaciones, aunque es más conocida por ser probablemente carcinógena y estar presente en bastantes alimentos al formarse por procesos naturales al cocinarlos.
- Son fuente de energía para el cuerpo humano.[28]
- Pueden ser vitaminas[29] en el cuerpo o analgésicos.[30]
Importancia y usos
editarLas amidas son comunes en la naturaleza y se encuentran en sustancias como los aminoácidos, las proteínas, el ADN y el ARN, hormonas y vitaminas.
La urea es utilizada para la excreción del amoníaco (NH3) en el ser humano y mamíferos. También es muy utilizada en la industria farmacéutica y en la industria del nailon.
Referencias
editar- ↑ Alejandrina, GALLEGO PICÓ; María, GARCINUÑO MARTÍNEZ Rosa; José, MORCILLO ORTEGA Mª; Ángel, VÁZQUEZ SEGURA Miguel (4 de diciembre de 2013). QUÍMICA BÁSICA. Editorial UNED. ISBN 9788436267846. Consultado el 18 de noviembre de 2017.
- ↑ Alejandrina, GALLEGO PICÓ; María, GARCINUÑO MARTÍNEZ Rosa; José, MORCILLO ORTEGA Mª; Ángel, VÁZQUEZ SEGURA Miguel (4 de diciembre de 2013). QUÍMICA BÁSICA. Editorial UNED. ISBN 9788436267846. Consultado el 18 de noviembre de 2017.
- ↑ Química para el Acceso a Ciclos Formativos de Grado Superior .e-book.. MAD-Eduforma. ISBN 9788466530453. Consultado el 18 de noviembre de 2017.
- ↑ Finck, Arnold (1988). Fertilizantes y fertilización: fundamentos y métodos para la fertilización de los cultivos. Reverte. ISBN 9788429110104. Consultado el 18 de noviembre de 2017.
- ↑ Society, American Chemical (2005). Química: un proyecto de la American Chemical Society. Reverte. ISBN 9788429170016. Consultado el 18 de noviembre de 2017.
- ↑ NEWELL, James (24 de agosto de 2016). Ciencia de materiales - aplicaciones en ingeniería. Alfaomega Grupo Editor. ISBN 9786077073116. Consultado el 18 de noviembre de 2017.
- ↑ Geissman, T. A. (1973). Principios de química orgánica. Reverte. ISBN 9788429171808. Consultado el 18 de noviembre de 2017.
- ↑ Química 2. Un enfoque constructivista. Pearson Educación. 2007. ISBN 9789702608448. Consultado el 18 de noviembre de 2017.
- ↑ Montalbetti, Christian A. G. N.; Falque, Virginie (14 de noviembre de 2005). «Amide bond formation and peptide coupling». Tetrahedron 61 (46): 10827-10852. doi:10.1016/j.tet.2005.08.031.
- ↑ Society, American Chemical (2005). Química: un proyecto de la American Chemical Society. Reverte. ISBN 9788429170016. Consultado el 18 de noviembre de 2017.
- ↑ Valeur, Eric; Bradley, Mark (2009). «Amide bond formation: beyond the myth of coupling reagents». Chem. Soc. Rev. 38: 606-631. doi:10.1039/B701677H.
- ↑ «Greener Methods: Catalytic Amide Bond Formation». Consultado el 22 de septiembre de 2016.
- ↑ «MIBA 96% | Sigma-Aldrich». www.sigmaaldrich.com. Consultado el 22 de septiembre de 2016.
- ↑ «Tris(2,2,2-trifluoroethyl) borate 97% | Sigma-Aldrich». www.sigmaaldrich.com. Consultado el 22 de septiembre de 2016.
- ↑ Sabatini, Marco T.; Boulton, Lee T.; Sheppard, Tom D. (1 de septiembre de 2017). «Borate esters: Simple catalysts for the sustainable synthesis of complex amides». Science Advances (en inglés) 3 (9): e1701028. Bibcode:2017SciA....3E1028S. ISSN 2375-2548. PMC 5609808. PMID 28948222. doi:10.1126/sciadv.1701028. Archivado desde el original el 18 de agosto de 2018. Consultado el 18 de agosto de 2018.
- ↑ Wenner, Wilhelm (1952). «Phenylacetamide». Organic Syntheses 32: 92. doi:10.15227/orgsyn.032.0092.
- ↑ Bodroux F. (1905). «none». Bull. Soc. Chim. France 33: 831.
- ↑ «Bodroux reaction». Institute of Chemistry, Skopje, Macedonia. Archivado desde el original el 24 de septiembre de 2015. Consultado el 18 de agosto de 2018.
- ↑ Schulenberg, J. W.; Archer, S. (1965). «The Chapman Rearrangement». Org. React. 14. doi:10.1002/0471264180.or014.01.
- ↑ Chapman, Arthur William (1925). «CCLXIX.—Imino-aryl ethers. Part III. The molecular rearrangement of N-phenylbenziminophenyl ether». Journal of the Chemical Society, Transactions 127: 1992. doi:10.1039/CT9252701992.
- ↑ March, Jerry. Advanced organic Chemistry, Reactions, mechanisms and structure (3rd edición). ISBN 0-471-85472-7.
- ↑ Leuckart, R. (1885). «Ueber einige Reaktionen der aromatischen Cyanate». Berichte der deutschen chemischen Gesellschaft 18: 873-877. doi:10.1002/cber.188501801182.
- ↑ Adams, Rodger; Krimen, L.I.; Cota, Donald J. (1969). Organic Reaction Volume 17. London: John Wiley & Sons, Inc. pp. 213-326. ISBN 9780471196150. doi:10.1002/0471264180.
- ↑ Monson, Richard (1971). Advanced Organic Synthesis: Methods and Techniques. Newyork: Academic Press. p. 141. ISBN 978-0124336803. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- ↑ Corson, B. B.; Scott, R. W.; Vose, C. E. (1941). «Cyanoacetamide». Organic Syntheses 1: 179. doi:10.15227/orgsyn.009.0036.
- ↑ Jacobs, W. A. (1941). «Chloroacetamide». Organic Syntheses 1: 153. doi:10.15227/orgsyn.007.0016.
- ↑ Kleinberg, J.; Audrieth, L. F. (1955). «Lactamide». Organic Syntheses 3: 516. doi:10.15227/orgsyn.021.0071.
- ↑ Nutrición y Alimentación de Bovinos en El Trópico Bajo Colombiano. Corpoica. Consultado el 18 de noviembre de 2017.
- ↑ Macarulla, José M.; Goñi, Félix M. (1993). Biomoléculas: lecciones de bioquímica estructural. Reverte. ISBN 9788429173383. Consultado el 18 de noviembre de 2017.
- ↑ Fernández, Pedro Lorenzo (2 de marzo de 2015). Velázquez. Farmacología Básica y Clínica (eBook online). Ed. Médica Panamericana. ISBN 9788498354812. Consultado el 18 de noviembre de 2017.
Enlaces externos
editar- Wikimedia Commons alberga una categoría multimedia sobre Amida.