Glycin
Glycin (Gly, G) je aminokyselina s nepolárním postranním řetězcem. Na rozdíl od ostatních nepolárních aminokyselin (Ala, Val, Leu, Ile, Pro, Met, Phe, Trp) však není jeho celkový charakter příliš nepolární. Jedná se o nejjednodušší z 23 proteinogenních aminokyselin: Glycin jako jediná biogenní aminokyselina není opticky aktivní, neboť kvůli přítomnosti dvou vodíků na α uhlíku má rovinu symetrie (nemůže se tedy rozlišit D- a L-glycin). Z důvodu krátkého postranního řetězce se může glycin vázat na místa, na která jiné aminokyseliny ze sterických důvodů nemohou. Například pouze glycin může být vnitřní aminokyselinou kolagenové šroubovice.
| Glycin | |
|---|---|
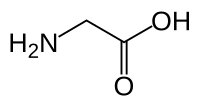 Strukturní vzorec | |
| Obecné | |
| Systematický název | Aminoethanová kyselina |
| Triviální název | Glycin |
| Sumární vzorec | C2H5NO2 |
| Identifikace | |
| Registrační číslo CAS | 56-40-6 |
| Vlastnosti | |
| Molární hmotnost | 75,07 g/mol |
| Teplota tání | 232–236 °C |
| Teplota varu | > 230 °C (rozklad) |
| Hustota | 1,595 g/cm3 |
| Disociační konstanta pKa | pKCOOH: 2,4 pKNH2: 9,8 |
| Izoelektrický bod | 5,97 |
| Průměrný výskyt | (v proteinech) 7,2 % |
Některá data mohou pocházet z datové položky. | |
Glycin je velmi evolučně stabilní na důležitých místech některých proteinů (například, v cytochromu c, myoglobinu, a hemoglobinu), neboť mutace měnící tuto aminokyselinu za jinou s větším postranním řetězcem výrazně pozměňují strukturu proteinu. Dalším příkladem je aktivní centrum proteázy chymotrypsinu, který štěpí enzymy za objemnými aminokyselinami typu fenylalanin, tryptofan, tyrosin, a proto i tady má záměna glycinu vážné důsledky. Enzym neschopný katalýzy je vyřazen z činnosti v proteazomu.
Glycin má stejný sumární vzorec jako nitroethan.
Většina proteinů obsahuje relativně malé množství glycinu. Důležitou výjimkou je kolagen, který se skládá z glycinu z jedné třetiny.[1] Důvod spočívá v tom, že další přibližně třetinu kolagenního vlákna zaujímá lysin a hydroxylysin. Obě tyto aminokyseliny mají omezené možnosti rotace a glycin tak vyrovnává deformační vliv těchto aminokyselin na strukturu kolagenního vlákna.
Ve velkém množství se glycin nachází také v elastinu.
Kódují ho kodóny GGU, GGC, GGA a GGG.
Fyziologické účinky
editovatGlycin je inhibiční neuropřenašeč v CNS, obzvláště v míše, mozkovém kmeni a v sítnici. V míše je většina inhibičních interneuronů glycinergních. Aktivací glycinových ionotropních receptorů na postsynaptické membráně se otevírají iontové kanály a chloridové ionty vstupují do neuronu, což působí hyperpolarizaci a takzvaný inhibiční postsynaptický potenciál (IPSP). Strychnin je antagonista ionotropních glycinových receptorů. Glycin je společně s glutamátem ligandem (konagonista) NMDA receptorů. Na rozdíl od inhibičních účinků v míše, např. inhibice antagonistických svalů v reflexních obloucích, na NMDA glutaminergních receptorech má glycin účinky excitační. LD50 glycinu je 7930 mg/kg pro potkana (orálně) a smrt je způsobena hyperexcitabilitou nervové soustavy.
Biosyntéza
editovatGlycin není esenciální aminokyselina, to znamená, že tělo si je schopné syntetizovat potřebné množství samo bez nutnosti jeho výskytu v potravě. Biosyntéza probíhá z aminokyseliny serin, který je vyráběn z 3-fosfoglycerátu. U většiny organismů tuto reakci katalyzuje enzym serin hydroxymethyltransferáza s pomocí kofaktoru pyridoxalfosfátu (pyridoxal je druh vitamínu B6).[2]
- serin + tetrahydrofolát → glycin + 5,10-methylentetrahydrofolát + H2O
V játrech obratlovců je syntéza glycinu katalyzována enzymem glycinsyntáza (neboli GDC – komplex glycin dekarboxylázy). Tato reakce je reverzibilní:[2]
- CO2 + NH4+ + 5,10-methylentetrahydrofolát + NADH + H+ → Glycine + tetrahydrofolát + NAD+
Degradace
editovatGlycin je degradován třemi různými cestami. V živočiších převažuje cesta skrze enzym glycindekaboxyláza (stejný enzym jako ten účastnící se biosyntézy). Tato cesta je zpětná reakce biosyntézy:[2]
- Glycine + tetrahydrofolát + NAD+ → CO2 + NH4+ + 5,10-methylentetrahydrofolát + NADH + H+
Druhá cesta je dvoukroková. První krok je zpětná reakce biosyntézy z serinu enzymem serinhydroxymethyltransferáza. Serin je pak přeměněn na pyruvát enzymem serin dehydratáza.[2]
Ve třetí cestě je glycin přeměněn na glyoxylát pomocí D-aminokyselina oxidázy. Glyoxylát je pak oxidován jaterní laktát dehydrogenázou na oxalát v NAD+-závislé reakci.[2]
Přítomnost v mezihvězdném prostoru
editovatV roce 1994 skupina astronomů z University of Illinois v Urbana-Champaign vedená Lewisem Snyderem ohlásila objev molekul glycinu ve vesmírném prostoru. Následujícími analýzami se ukázalo, že tento objev nemůže být potvrzen. O devět let později, v r. 2003, Yi-Jehng Kuan z National Taiwan Normal University a Steve Charnley detekovali mezihvězdný glycin ve třech zdrojích mezihvězdné hmoty. Ohlásili identifikaci 27 pásů glycinu pomocí radioteleskopu.[3] Podle počítačových simulací a laboratorních experimentů, vznikl glycin pravděpodobně tak, že ledové částice obsahující jednoduché organické molekuly byly vystaveny ultrafialovému záření. V říjnu 2004 Snyder a spolupracovníci znovu přezkoumali Kuanův objev glycinu. Snyder dokázal, že glycin nebyl ani v jednom ze tří zdrojů správně detekován.
Odkazy
editovatReference
editovat- ↑ Lodish H, Berk A, Zipursky SL, et al. Molecular Cell Biology. 4th edition. New York: W. H. Freeman; 2000. Section 22.3, Collagen: The Fibrous Proteins of the Matrix. Available from: http://www.ncbi.nlm.nih.gov/books/NBK21582/
- ↑ a b c d e NELSON, David L.; COX, Michael M. Principles of Biochemistry. New York: W. H. Freeman, 2005. Dostupné online. ISBN 0-7167-4339-6. S. 127, 675–77, 844, 854.
- ↑ KUAN, Yi‐Jehng; CHARNLEY, Steven B.; HUANG, Hui‐Chun. Interstellar Glycine. The Astrophysical Journal. 2003-08-20, roč. 593, čís. 2, s. 848–867. Dostupné online [cit. 2024-05-30]. ISSN 0004-637X. DOI 10.1086/375637. (anglicky)
Literatura
editovat- Snyder LE, Lovas FJ, Hollis JM, et al. (2005) A rigorous attempt to verify interstellar glycine. ASTROPHYS J 619 (2): 914-930
- https://web.archive.org/web/20071020054638/http://physchem.ox.ac.uk/MSDS/GL/glycine.html Safety (MSDS) data for glycine, 2005, The Physical and Theoretical Chemistry Laboratory Oxford University, datum přístupu: 2006-11-01.
- Dawson, R.M.C., Elliott, D.C., Elliott, W.H., and Jones, K.M., Data for Biochemical Research (3rd edition), pp. 1-31 (1986)
- http://www.newscientist.com/news/news.jsp?id=ns99992558 www.newscientist.com
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu glycin na Wikimedia Commons
- PDRHealth - Glycine
- Computational Chemistry Wiki
- Glycine cleavage system